Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и медицины, а именно к моноклональным антителам или их антигенсвязывающим фрагментам, которые специфически связываются с CSF-1R (рецептор колониестимулирующего фактора 1). Изобретение также относится к нуклеиновым кислотам, кодирующим указанные антитела, векторам экспрессии, клеткам-хозяевам и способам их получения, способам получения антител, фармацевтическим композициям, содержащим вышеуказанное антитело, фармацевтическим композициям, содержащим вышеуказанное антитело и другие терапевтически активные соединения, способам лечения заболеваний или нарушений, опосредованных CSF-1R, применениям антител или их фармацевтических композиций для лечения заболеваний или нарушений, опосредованных CSF-1R, и применениям антител и других терапевтически активных соединений для лечения заболеваний или нарушений, опосредованных CSF-1R.
Уровень техники
Рецептор колониестимулирующего фактора 1 (CSF-1R), также известный как рецептор макрофагального колониестимулирующего фактора (M-CSFR) или CD115 - мембранный протеин, контрольная точка дифференцировки макрофагов. Имеет 2 лиганда: CSF-1 и IL-34. Сигналинг его необходим для дифференцировки предшественников миелоидного ростка в макрофаги, которые в том числе, возможно, будут участниками опухолевого микроокружения (TAM, опухоль-ассоциированные макрофаги).
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток) как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2-макрофаги, в свою очередь, ускоряют регенерацию тканей и обеспечивают заживление ран.
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост, и наоборот: М2-макрофаги выделяют молекулы - факторы роста, которые стимулируют деление опухолевых клеток. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-макрофаги. Более того, под действием веществ, выделяемых опухолевыми клетками, в том числе и в условиях повышенной экспрессии CSF-1R, активные М1-макрофаги «перепрограммируются» в М2-макрофаги, перестают синтезировать противоопухолевые цитокины (например, IL-12, TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и ангиогенез (например, TGFb, VGF).
Опухоль превращает агрессивные М1-макрофаги в способствующий собственному развитию М2-макрофаги. Воспринимая опухоль как поврежденный участок ткани, М2-макрофаги включают программу восстановления, однако секретируемые ими факторы роста только увеличивают рост опухоли.
Таким образом, основной целью ингибирования сигналинга CSF-1R является перепрограммирование опухолевого микроокружения (в пользу предикторов активации противоопухолевого ответа).
Из уровня техники известны различные антитела, которые специфически связываются с CSF-1R (например, WO2011140249, WO2011070024, WO2011131407, WO2011123381, WO2009112245).
Известно антитело cabiralizumab, которое специфически связывается с CSF-1R, описанное в международной заявке WO2011140249 (FIVE PRIME THERAPEUTICS INC). Данное антитело находится на второй фазе клинических исследований.
Однако на данный момент нет ни одного антитела против CSF-1R, одобренного где-либо в мире к терапевтическому использованию. В связи с вышесказанным актуальным является создание новых антагонистических антител, которые ингибируют сигналинг CSF-1R, перепрограммируя за счет этого опухолевое микроокружение в пользу предикторов активации противоопухолевого ответа.
Краткое описание изобретения
В одном из аспектов настоящее изобретение относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, которое специфически связывается с CSF-1R, включающему:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 1, SEQ ID NO: 17,
(ii) CDR2 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 2, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO:29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36,
(iii) CDR3 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 3, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50; и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 12,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 13,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 14.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 2,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 3.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 5.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 6.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7;
(b) вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 5;
(b) вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 6;
(b) вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах выделенное моноклональное антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело, которое специфично связывается с CSF-1R, представляет собой полноразмерное антитело IgG.
В некоторых вариантах выделенное моноклональное антитело является полноразмерным антителом IgG и относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
В некоторых вариантах выделенное моноклональное антитело является полноразмерным антителом IgG и относится к изотипу IgG1 человека.
В одном из аспектов настоящее изобретение относится к выделенной нуклеиновой кислоте, которая кодирует любое описанное выше антитело или его антигенсвязывающий фрагмент.
В некоторых вариантах выделенная нуклеиновая кислота представляет собой ДНК.
В одном из аспектов настоящее изобретение относится к экспрессионному вектору, содержащему любую описанную выше нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения клетки-хозяина для получения любого описанного выше антитела или его антигенсвязывающего фрагмента, включающий трансформирование клетки вектором, описанным выше.
В одном из аспектов настоящее изобретение относится к клетке-хозяину для получения любого описанного выше антитела или его антигенсвязывающего фрагмента, содержащей описанную выше нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения описанного выше антитела или его антигенсвязывающего фрагмента, заключающемуся в культивировании клетки-хозяина в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции, которая содержит антитело по настоящему изобретению или его антигенсвязывающий фрагмент в терапевтически эффективном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для лечения заболевания или нарушения, опосредуемого CSF-1R, которая содержит описанное выше антитело или его антигенсвязывающий фрагмент в терапевтически эффективном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для лечения заболевания или нарушения, опосредуемого CSF-1R, содержащей описанное выше антитело или его антигенсвязывающий фрагмент и по меньшей мере одно другое терапевтически активное соединение.
В некоторых вариантах другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
В некоторых вариантах другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
В некоторых вариантах чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
В некоторых вариантах PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
В некоторых вариантах антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
В некоторых вариантах CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
В некоторых вариантах антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
В одном из аспектов настоящее изобретение относится к способу ингибирования биологической активности CSF-1R у субъекта, нуждающегося в таком ингибировании, включающему введение субъекту эффективного количества описанного выше антитела или его антигенсвязывающего фрагмента.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного CSF-1R, включающему введение субъекту, нуждающемуся в таком лечении, описанного выше антитела или его антигенсвязывающего фрагмента или описанной выше фармацевтической композиции в терапевтически эффективном количестве.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного CSF-1R, включающему введение субъекту, нуждающемуся в таком лечении, описанного выше антитела или его антигенсвязывающего фрагмента и меньшей мере одного другого терапевтически активного соединения.
В некоторых вариантах другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
В некоторых вариантах другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
В некоторых вариантах чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
В некоторых вариантах PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
В некоторых вариантах антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
В некоторых вариантах CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
В некоторых вариантах антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
В одном из аспектов настоящее изобретение относится к применению описанного выше антитела или его антигенсвязывающего фрагмента или описанной выше фармацевтической композиции для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого CSF-1R.
В одном из аспектов настоящее изобретение относится к применению описанного выше антитела или его антигенсвязывающего фрагмента и по меньшей мере одного другого терапевтически активного соединения для лечения заболевания или нарушения, опосредуемого CSF-1R.
В некоторых вариантах другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
В некоторых вариантах другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
В некоторых вариантах чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
В некоторых вариантах PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
В некоторых вариантах антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
В некоторых вариантах CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
В некоторых вариантах антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
В некоторых вариантах заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
Краткое описание чертежей
Фигура 1 представляет собой схему синтеза комбинаторной наивной библиотеки Fab-фрагментов антител человека.
Фигура 2 представляет собой схему синтеза комбинаторной наивной библиотеки scFv-фрагментов антител.
Фигура 3 представляет собой карту экспрессионной плазмиды для наработки Fab-фрагментов
AmpR - ген bla, обеспечивающий устойчивость к ампициллину,
PBR 322 ori - участка репликации,
LacI - лактозный оперон,
KmR - ген, обеспечивающий устойчивость к канамицину,
XhoI - сайт рестрикции XhoI,
NheI - сайт рестрикции NheI,
BamHI - сайт рестрикции BamHI,
NotI - сайт рестрикции NotI,
Lpelb - лидерный пептид легкой цепи,
Hpelb - лидерный пептид тяжелой цепи,
VK - вариабельный фрагмент легкой цепи,
CK - константный фрагмент легкой цепи,
VH - вариабельный фрагмент тяжелой цепи,
CH1 - константный фрагмент тяжелой цепи,
STOP CK - cтоп-кодон легкой цепи,
STOP CH1 - стоп-кодон тяжелой цепи,
His-tag - аминокислотная последовательность, которая состоит из шести гистидинов, часто на N- или С-конце белка,
Myc-tag - Myc-таг,
SeqH3b - обратный праймер.
Фигура 4 представляет собой карту экспрессионной плазмиды для наработки scFv-фрагментов
AmpR - Ген, обеспечивающий устойчивость к ампициллину,
PBR 322 ori - участка репликации,
LacI - лактозный оперон,
NcoI - сайт рестрикции NcoI,
NotI - сайт рестрикции NotI,
pelb - лидерный пептид,
His-tag - аминокислотная последовательность, которая состоит из шести гистидинов, часто на N- или С-конце белка,
Myc-tag - Myc-таг,
Linker - глицин-сериновый линкер (G4S)3,
T7 Promoter - Промотор РНК-полимеразы бактериофага Т7,
T7 Terminator - последовательность из бактериофага Т7, которая обеспечивает эффективную терминацию транскрипции,
T7 trans RBS - сайт посадки рибосомы.
Фигура 5 представляет собой электрофореграмму кандидатов 01-011 - 01-018 в денатурирующих нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Кандидат 01-011,
3. Кандидат 01-012,
4. Кандидат 01-013,
5. Кандидат 01-014,
6. Кандидат 01-015,
7. Кандидат 01-016,
8. Кандидат 01-017,
9. Кандидат 01-018.
Фигура 6 представляет собой электрофореграмму кандидата 01-019 в денатурирующих нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Кандидат 01-019.
Фигура 7 представляет собой график, где показана способность кандидата 01-016 ингибировать IL-34-зависимую пролиферацию
01-016 - кандидат 01-016.
Для кандидата 01-016: A (сигнал на нижнем плато (сигнал в точке, где концентрация антител равна 0)) = 52098, D (сигнал на верхнем плато) = 4861.5, B (наклон кривой) = 1.7644, С (EC50) = 0.36792, d (среднеквадратичное отклонение) = 332.87, r (коэффициент детерминации) = 0.99988.
Фигура 8 представляет собой график, где показано влияние anti-CSF-1R антитела 01-016 на пролиферативную активность моноцитов в присутствии M-CSF. CellTiter-Glo® Luminescent Cell Viability Assay Cell.
Для кандидата 01-016: A (сигнал на нижнем плато (сигнал в точке, где концентрация антител равна 0)) = 4.2326e+005, D (сигнал на верхнем плато) = 1.2845e+005, B (наклон кривой) = 0.77816, С (EC50) = 0.24761, d (среднеквадратичное отклонение) = 9305.7, r (коэффициент детерминации) = 0.99573.
Фигура 9 представляет собой график, где показано влияние anti-CSF-1R антитела 01-016 на пролиферативную активность моноцитов в присутствии M-CSF. Apo-ONE® Homogeneous Caspase-3/7 Assay.
Для кандидата 01-016: A (сигнал на нижнем плато (сигнал в точке, где концентрация антител равна 0)) = 26569, D (сигнал на верхнем плато) = 59046, B (наклон кривой) = 2.2794, С (EC50) = 0.36883, d (среднеквадратичное отклонение) = 1161.1, r (коэффициент детерминации) = 0.99674.
Фигура 10 представляет собой график, где показана оценка влияния anti-CSF-1R антитела 01-016 на пролиферативную активность моноцитов в присутствии M-CSF. Apo-ONE® Homogeneous Caspase-3/7 Assay
М1 - моноциты, дифференцированные по M1-пути,
М2 - моноциты, дифференцированные по M2-пути,
01-016 - моноциты, дифференцированные по M2-пути, в присутствии антитела 01-016.
Фигура 11 представляет собой электрофореграмму антитела 01-016 в нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело 01-016, 10 мкг,
3. Антитело 01-016, 40 мкг.
Фигура 12 представляет собой электрофореграмму антитела OPTIM-6_001-02 в нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-02, 10 мкг,
3. Антитело OPTIM-6_001-02, 40 мкг.
Фигура 13 представляет собой электрофореграмму антитела OPTIM-6_001-04 в нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-04, 10 мкг,
3. Антитело OPTIM-6_001-04, 40 мкг.
Фигура 14 представляет собой электрофореграмму антитела OPTIM-6_001-05 в нередуцирующих условиях 7.5% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-05, 10 мкг,
3. Антитело OPTIM-6_001-05, 40 мкг.
Фигура 15 представляет собой электрофореграмму антитела 01-016 в редуцирующих условиях 12% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело 01-016, 10 мкг,
3. Антитело 01-016, 40 мкг.
Фигура 16 представляет собой электрофореграмму антитела OPTIM-6_001-02 в редуцирующих условиях 12% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-02, 10 мкг,
3. Антитело OPTIM-6_001-02, 40 мкг.
Фигура 17 представляет собой электрофореграмму антитела OPTIM-6_001-04 в редуцирующих условиях 12% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-04, 10 мкг,
3. Антитело OPTIM-6_001-04, 40 мкг.
Фигура 18 представляет собой электрофореграмму антитела OPTIM-6_001-05 в редуцирующих условиях 12% SDS-PAGE
1. Маркер молекулярного веса,
2. Антитело OPTIM-6_001-05, 10 мкг,
3. Антитело OPTIM-6_001-05, 40 мкг.
Описание изобретения
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
Термин «Ka», как использовано в данном описании, относится к скорости ассоциации конкретного взаимодействия антитело-антиген, тогда как термин «KD» или «Kd» относится к скорости диссоциации конкретного взаимодействия антитело-антиген.
«Аффинность связывания» обычно относится к силе совокупных нековалентных взаимодействий между единичным сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иначе, «аффинность связывания» относится к внутренней (характерной, истинной) аффинности связывания, которая отражает 1:1 взаимодействие между членами пары связывания (например, антителом и антигеном). Аффинность молекулы Х к своему партнеру Y обычно можно представить константой диссоциации (Kd). Желательно, чтобы величина Kd составляла, примерно, 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или менее. Аффинность можно измерять обычными методами, известными в уровне техники, включая методы по данному описанию. Низкоаффинные антитела обычно медленно связываются с антигеном и имеют тенденцию легко диссоциировать, тогда как высокоаффинные антитела обычно быстрее связывают антиген и имеют тенденцию дольше оставаться в связанном состоянии. В уровне техники известны различные методы измерения аффинности связывания, любой из этих методов можно использовать для целей настоящего изобретения.
Термин «koff» или «kdis» относится к константе скорости диссоциации конкретного взаимодействия связывающей молекулы и антигена. Константу скорости диссоциации koff можно измерить посредством биослойной интерферометрии, например, с помощью системы Octet™.
Термин «kon» или «on-rate» относится к константе скорости ассоциации.
Термин «off-rate скрининг» относится к скринингу, в рамках которого кандидаты исследуются только на основании значений koff.
Термин «R2» относится к коэффициенту детерминации.
Термин «Response» относится к сигналу связывания антитела с антигеном.
Термин «in vitro» относится к биологическому объекту, биологическому процессу или биологической реакции вне организма, смоделированному в искусственных условиях. Например, рост клеток in vitro должен пониматься как рост клеток в среде вне организма, например, в пробирке, культуральном флаконе или микропланшете.
Термин «IC50» (50% ингибирующая концентрация) относится к концентрациям препарата, при которых измеряемая активность или отклик, например, рост или пролиферация клеток, таких как опухолевые клетки, ингибируется на 50%. Значение IC50 может оцениваться c помощью соответствующих кривых зависимости ответа от логарифма дозы, с использованием специальных статистических программ для обработки кривых.
Термин ED50 (EC50) (50% эффективная доза/концентрация) относится к концентрациям препарата, при которых измеряемый биологический эффект достигается на 50% (может включать цитотоксичность).
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Антитело
Настоящее изобретение относится к моноклональному антителу, которое специфически связывается с CSF-1R.
Термин «моноклональное антитело» или «mAb» относится к антителу, которое синтезировано и выделено отдельной клональной популяцией клеток.
Антитело по изобретению является рекомбинантным антителом.
Термин «рекомбинантное антитело» означает антитело, которое экспрессируется в клетке или клеточной линии, содержащей нуклеотидную последовательность (нуклеотидные последовательности), которая кодирует антитела, при этом указанная нуклеотидная последовательность (нуклеотидные последовательности) не ассоциирована с клеткой в природе.
В одном из аспектов настоящее изобретение относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, которое специфически связывается с CSF-1R, включающему:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью, которую выбирают из группы: DYAMS (SEQ ID NO: 1), DYAMT (SEQ ID NO: 17),
(ii) CDR2 с аминокислотной последовательностью, которую выбирают из группы: AISWNGGSTNYADSVKG (SEQ ID NO: 2), AISWRGGSTNYADSVKG (SEQ ID NO: 18), AISWIGGSTNYADSVKG (SEQ ID NO: 19), AISWLGGSTNYADSVKG (SEQ ID NO: 20), AISWFGGSTNYADSVKG (SEQ ID NO: 21), AISWNGGETNYADSVKG (SEQ ID NO: 22), AISWNGGITNYADSVKG (SEQ ID NO: 23), AISWNGGLTNYADSVKG (SEQ ID NO: 24), AISWNGGSTRYADSVKG (SEQ ID NO: 25), AISWNGGSTWYADSVKG (SEQ ID NO: 26), AISWNGGSTNYQDSVKG (SEQ ID NO: 27), AISWNGGSTNYHDSVKG (SEQ ID NO: 28), QISWNGGSTRYQDSVKG (SEQ ID NO: 29), QISWLGGSTNYQDSVKG (SEQ ID NO: 30), HISWNGGSTRYQDSVKG (SEQ ID NO: 31), QISWNGGSTRYHDSVKG (SEQ ID NO: 32), HISWNGGSTRYHDSVKG (SEQ ID NO: 33), HISWIGGSTNYQDSVKG (SEQ ID NO: 34), QISWIGGSTNYQDSVKG (SEQ ID NO: 35), HISWLGGSTNYQDSVKG (SEQ ID NO: 36),
(iii) CDR3 с аминокислотной последовательностью, которую выбирают из группы: TVEVAHRRLYKYLEV (SEQ ID NO: 3), IVEVAHRRLYKYLEV (SEQ ID NO: 37), YVEVAHRRLYKYLEV (SEQ ID NO: 38), TVEVAHRRLYRYLEV (SEQ ID NO: 39), TVEVAHRRLYNYLEV (SEQ ID NO: 40), TVEVAHRRLYQYLEV (SEQ ID NO: 41), TVEVAHRRLYLYLEV (SEQ ID NO: 42), TVEVAHRRLYFYLEV (SEQ ID NO: 43), TVEVAHRRLYYYLEV (SEQ ID NO: 44), TVEVAHRRLYKYLEI (SEQ ID NO: 45), TVELAHRRLYKYLEI (SEQ ID NO: 46), TVEFAHRRLYKYLEI (SEQ ID NO: 47), TVEQAHRRLYKYLEI (SEQ ID NO: 48), TVEFSHRRLYKYLEV (SEQ ID NO: 49), TVEFAHRRLYKYLEV (SEQ ID NO: 50); и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью GGNNIGSKSVH (SEQ ID NO: 12),
(ii) CDR2 с аминокислотной последовательностью GDSDRPS (SEQ ID NO: 13),
(iii) CDR3 с аминокислотной последовательностью QVWDISSDHVV (SEQ ID NO: 14).
Определение «выделенный» («изолированный»), применяемое для описания различных антител по данному описанию, означает антитело, идентифицированное и выделенное и/или регенерированное из клетки или клеточной культуры, в которой оно экспрессируется. Примеси (загрязняющие компоненты) из природной среды представляют собой материалы, которые, как правило, мешают диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. Обычно выделенный полипептид получают в результате по меньшей мере одной стадии очистки.
CSF-1R (рецептор колониестимулирующего фактора 1) - мембранный протеин, контрольная точка дифференцировки макрофагов. Имеет 2 лиганда: CSF-1 и IL-34. Сигналинг его необходим для дифференцировки предшественников миелоидного ростка в макрофаги, которые в том числе, возможно, будут участниками опухолевого микроокружения (TAM, опухоль-ассоциированные макрофаги).
Амплификация гена CSF-1R и/или сверхэкспрессия его белка были обнаружены при многих раковых заболеваниях, в том числе при РШМ (раке шейки матки), раке головы и шеи, раке желудка, РМЖ (раке молочной железы), почечно-клеточном раке, КРР (колоректальном раке), РЯ (раке яичника), НМРЛ (немелкоклеточном раке легкого).
Термин «антитело» или «иммуноглобулин» (Ig), как использовано в данном описании, включает целые антитела. Термин «антитело» относится к гликопротеину, содержащему по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями, или его антигенсвязывающей части. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в данном описании как VH) и константную область тяжелой цепи. Известно пять типов тяжелых цепей антител млекопитающих, которые обозначают греческими буквами: α, δ, ε, γ и μ. (Janeway C.A., Jr. и др., Immunobiology, 5-е изд., изд-во Garland Publishing, 2001). Присутствующий тип тяжелой цепи определяет класс антитела; указанные цепи обнаружены в антителах типа IgA, IgD, IgE, IgG и IgM соответственно (Rhoades R.A., Pflanzer R.G., Human Physiology, 4-е изд., изд-во Thomson Learning, 2002). Различные тяжелые цепи отличаются по размеру и составу; α и γ содержат примерно 450 аминокислот, а μ и ε состоят примерно из 550 аминокислот. Константная область является идентичной во всех антителах одного и того же изотипа, но отличается в антителах различного изотипа. Тяжелые цепи γ, α и δ содержат константную область, которая состоит из трех константных доменов CH1, СН2 и CH3 (выстроены в ряд) и шарнирной области, которая придает гибкость (Woof J., Burton D., Nat Rev Immunol 4, 2004, cc.89-99); тяжелые цепи μ и ε содержат константную область, которая состоит из четырех константных доменов CH1, СН2, CH3 и CH4 (Janeway C.A., Jr. и др., Immunobiology, 5-е изд., изд-во Garland Publishing, 2001). У млекопитающих известно только два типа легких цепей, которые обозначают как лямбда (λ) и каппа (κ). Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном описании как VL) и константной области легкой цепи. Примерная длина легкой цепи составляет 211-217 аминокислот. Предпочтительно легкая цепь представляет собой легкую каппа (κ)-цепь, а константный домен CL предпочтительно представляет собой С-каппа (κ).
«Антитела» согласно изобретению могут представлять собой антитела любого класса (например, IgA, IgD, IgE, IgG и IgM, предпочтительно IgG) или подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2, предпочтительно IgG1).
Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), разбросанные между областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями хозяина или факторами, включая различные клетки иммунной системы (например, эффекторными клетками), и первый компонент (Clq) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела или «антигенсвязывающий фрагмент» (или просто «часть антитела» или «фрагмент антитела»), как использовано в данном описании, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающая часть» антитела включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH 1; (ii) F(ab’)2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd- фрагмент, состоящий из доменов VH и CH 1; (iv) Fv-фрагмент, состоящий из доменов VL и VH в едином плече антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH/VHH; и (vi) выделенная определяющая комплементарность область (CDR). Кроме того, две области Fv-фрагмента, VL и VH, кодируются разными генами, они могут быть соединены при помощи рекомбинантных способов с использованием синтетического линкера, который дает возможность получать их в виде единой белковой цепи, в которой области VL и VH спариваются с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Предполагается, что такие одноцепочечные молекулы также включены в термин «антигенсвязывающая часть» антитела. Такие фрагменты антител получают с использованием общепринятых способов, известных специалистам в данной области, и эти фрагменты подвергают скринингу таким же образом, как и интактные антитела.
Термин «вариабельный» относится к тому факту, что определенные сегменты вариабельных доменов широко отличаются в последовательности среди антител. Домен V опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределяется на участке вариабельных доменов из 110 аминокислот. Напротив, V области состоят из инвариантных фрагментов, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими участками чрезвычайной вариабельности, называемых «гипервариабельными областями» или CDR. Каждый вариабельный домен нативных тяжелых и легких цепей содержит четыре FR, в основном принимающих конфигурацию бета-листов, связанных тремя гипервариабельными областями, которые образуют петли, связывающие, и в некоторых случаях являющиеся частью бета-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости с помощью FR и с гипервариабельными областями другой цепи вносят вклад в образование антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (АЗКЦ, ADCC).
Термин «гипервариабельная область» по данному описанию относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Обычно гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR», и/или такие остатки из «гипервариабельной петли».
Предпочтительно CDR антигенсвязывающего участка или весь антигенсвязывающий участок антител по изобретению имеет происхождение из ламы или донорской человеческой библиотеки или по существу человеческое происхождение с определенными аминокислотными остатками, измененными, например, замещенными разными аминокислотными остатками с тем, чтобы оптимизировать конкретные свойства антитела, например KD, koff, IC50, EC50, ED50. Предпочтительно каркасные участки антитела по изобретению имеют человеческое происхождение или по существу человеческое происхождение (по крайней мере на 80, 85, 90, 95, 96, 97, 98 или 99% человеческое происхождение).
В некоторых случаях может также быть предпочтительным изменение одного или более остатков аминокислот CDR-участков с целью повышения аффинности связывания с целевым эпитопом. Это известно как «созревание аффиности» и в некоторых случаях может выполняться в связи с гуманизацией, например, в ситуациях, когда гуманизация антитела приводит к снижению специфичности или аффинности связывания, и не представляется возможным в достаточной степени улучшить специфичность или аффинность связывания с помощью только обратных мутаций. Различные методы созревания аффинности известны в данной области техники, например, способ in vitro сканирующего насыщающего мутагенеза, описанный Burks et al., Proc Natl Acad Sci USA, 94:412-417 (1997), и способ пошагового in vitro созревания аффинности, предложенный Wu et al., Proc Natl Acad Sci USA 95:6037 6042 (1998).
«Kabat номенклатура» или «номенклатура по Kabat» применяются в данной заявке к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем остальные аминокислотные остатки в вариабельных участках тяжелой и легкой цепи антитела (Kabat et al. Ann. N.Y. Acad. Sci., 190:382-93 (1971); Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991)).
Антитело по данному изобретению, «которое связывает» целевой антиген, представляет собой антитело, которое связывает антиген с достаточной аффинностью так, что антитело можно применять в качестве диагностического и/или терапевтического агента при нацеливании на белок или клетку или ткань, экспрессирующую антиген, и в незначительной степени перекрестно реагирует с другими белками. По данным аналитических методов: сортинга флуоресцентно-активированных клеток (FACS), радиоиммунопреципитации (RIA) или ИФА (ELISA), в таких вариантах изобретения степень связывания антитела с белком, не являющимся «мишенью» (с «нецелевым белком»), составляет менее 10% от связывания антитела с конкретным белком-мишенью. По отношению к связыванию антитела с молекулой-мишенью термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени означает связывание, которое заметно (измеримо) отличается от неспецифического взаимодействия.
Специфическое связывание можно определять количественно, например, определяя связывание молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание можно определять конкурентной реакцией с другой молекулой, аналогичной мишени, например, с избытком немеченой мишени. В этом случае специфическое связывание указывается, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. В данном описании термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени можно характеризовать на примере молекулы, имеющей Kd к мишени по меньшей мере около 200 нМ, или же по меньшей мере около 150 нМ, или же по меньшей мере около 100 нМ, или же по меньшей мере около 60 нМ, или же по меньшей мере около 50 нМ, или же по меньшей мере около 40 нМ, или же по меньшей мере около 30 нМ, или же по меньшей мере около 20 нМ, или же по меньшей мере около 10 нМ, или же по меньшей мере около 8 нМ, или же по меньшей мере около 6 нМ, или же по меньшей мере около 4 нМ, или же по меньшей мере около 2 нМ, или же по меньшей мере около 1 нМ или выше. В одном варианте изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, практически не связываясь с каким-либо другим полипептидом или эпитопом на полипептиде.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 2,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 3.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, которую выбирают из группы: QVQLQQSGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLKSEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 4), QVQLVESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 5), QVQLVESGGGLVRPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTALYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 6), QVQLQESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 7).
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 5.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 6.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 7.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает вариабельный домен легкой цепи, который содержит аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVL (SEQ ID NO: 15).
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, выбранную из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7;
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 5;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 6;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело или его антигенсвязывающий фрагмент включает:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 7;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 8.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах выделенное моноклональное антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах выделенное моноклональное антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенное моноклональное антитело, которое специфично связывается с CSF-1R, представляет собой полноразмерное антитело IgG.
В некоторых вариантах выделенное моноклональное антитело является полноразмерным антителом IgG и относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
В некоторых вариантах выделенное моноклональное антитело является полноразмерным антителом IgG и относится к изотипу IgG1 человека.
В некоторых вариантах выделенное моноклональное антитело, которое специфично связывается с CSF-1R, представляет собой лидерный кандидат 01-016 (или антитело 01-016).
Лидерный кандидат 01-016 включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность QVQLQQSGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLKSEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 8); и
(b) легкую цепь, содержащую аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 16).
Лидерный кандидат 01-016 включает:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность QVQLQQSGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLKSEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 4);
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVL (SEQ ID NO: 15).
Лидерный кандидат 01-016 включает:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью DYAMS (SEQ ID NO: 1),
(ii) CDR2 с аминокислотной последовательностью AISWNGGSTNYADSVKG (SEQ ID NO: 2),
(iii) CDR3 с аминокислотной последовательностью TVEVAHRRLYKYLEV (SEQ ID NO: 3), и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью GGNNIGSKSVH (SEQ ID NO: 12),
(ii) CDR2 с аминокислотной последовательностью GDSDRPS (SEQ ID NO: 13),
(iii) CDR3 с аминокислотной последовательностью QVWDISSDHVV (SEQ ID NO: 14).
В рамках данного изобретения была проведена гуманизация лидерного кандидата 01-016.
Термин «гуманизация» относится к факту, что когда антитело имеет полностью или частично нечеловеческое происхождение, например, антитело мыши или ламы, полученное при иммунизации мышей или лам, соответственно, с представляющим интерес антигеном, или является химерным антителом на основе такого антитела мыши или ламы, можно заменить некоторые аминокислоты, в частности, в каркасных областях и константных доменах тяжелой и легкой цепей, с тем чтобы избежать или свести к минимуму иммунный ответ у человека. Специфичность взаимодействия антитела с антигеном-мишенью присуща главным образом аминокислотным остаткам, расположенных в шести CDR-участках тяжелой и легкой цепи. Поэтому аминокислотные последовательности внутри CDR-участков, являются гораздо более вариабельными между отдельными антителами, по сравнению с последовательностями вне CDR-участков. Поскольку последовательности CDR участков отвечают за большинство антитело-антиген взаимодействий, можно экспрессировать рекомбинантные антитела, которые имитируют свойства специфического природного антитела, или в более общем плане какого-либо специфического антитела с данной аминокислотной последовательностью, например, путем конструирования экспрессионных векторов, которые экспрессируют последовательности CDR-участков из специфического антитела и каркасные последовательности другого антитела. В результате, можно «гуманизировать» нечеловеческое антитело и в значительной степени сохранить специфичность связывания и аффинность исходного антитела. Несмотря на то, что невозможно точно предсказать иммуногенность и тем самым иммунный ответ, направленный против антитела у человека на конкретное антитело, нечеловеческие антитела, как правило, более иммуногенны, чем человеческие антитела. Химерные антитела, у которых инородные (например, грызуна или верблюда) константные участки были заменены последовательностями человеческого происхождения, показали в целом более низкую иммуногенность, чем антитела полностью инородного происхождения, и существует тенденция использовать в терапевтических антителах гуманизированные или полностью человеческие антитела. Химерные антитела или другие антитела нечеловеческого происхождения, таким образом, могут быть гуманизированы, чтобы снизить риск иммунного ответа, направленного против антитела, у человека.
Для гуманизации вариабельного домена тяжелой цепи лидерного кандидата 01-016 были отобраны позиции, содержащие наименее характерные для человеческих антител аминокислотные остатки. В схеме нумерации Kabat их значения: 1, 5, 6, 11, 26, 74, 77, 83, 84 и 89. От начала аминокислотной последовательности они имеют номера 1, 5, 6, 11, 26, 75, 78, 87, 88 и 93.
Все вышеуказанные позиции не затрагивают CDRs лидерного кандидата 01-016 (HCDR1 c аминокислотной последовательностью DYAMS (SEQ ID NO: 1), HCDR2 c аминокислотной последовательностью AISWNGGSTNYADSVKG (SEQ ID NO: 2), HCDR3 c аминокислотной последовательностью TVEVAHRRLYKYLEV (SEQ ID NO: 3)).
Гуманизация вариабельного домена легкой цепи лидерного кандидата 01-016 не проводилась.
В результате гуманизации лидерного кандидата 01-016 были получены кандидаты OPTIM-6_001-02, OPTIM-6_001-04 и OPTIM-6_001-05, у которых степень гуманизации вариабельного домена тяжелой цепи выше, чем у лидерного кандидата 01-016 (см. пример 21).
В некоторых вариантах выделенное моноклональное антитело является кандидатом OPTIM-6_001-02 и включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность QVQLVESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 9); и
(b) легкую цепь, содержащую аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 16).
Кандидат OPTIM-6_001-02 включает:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность QVQLVESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 5);
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVL (SEQ ID NO: 15).
В некоторых вариантах выделенное моноклональное антитело является кандидатом OPTIM-6_001-04 и включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность QVQLVESGGGLVRPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTALYYCASTVEVAHRRLYKYLEVWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 10); и
(b) легкую цепь, содержащую аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 16).
Кандидат OPTIM-6_001-04 включает:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность QVQLVESGGGLVRPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTALYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 6);
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVL (SEQ ID NO: 15).
В некоторых вариантах выделенное моноклональное антитело является кандидатом OPTIM-6_001-05 и включает:
(a) тяжелую цепь, содержащую аминокислотную последовательность QVQLQESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 11); и
(b) легкую цепь, содержащую аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 16).
Кандидат OPTIM-6_001-05 включает:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность QVQLQESGGGLVQPGGSLRLSCAASEFTFDDYAMSWVRQAPGKGLEWVSAISWNGGSTNYADSVKGRFTISRDNVKNTLYLQMNSLRAEDTAVYYCASTVEVAHRRLYKYLEVWGQGTLVTVSS (SEQ ID NO: 7);
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность QAGLTQPPSVSVAPGQTARITCGGNNIGSKSVHWYQQKPGQAPVLVVYGDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDISSDHVVFGGGTQLTVL (SEQ ID NO: 15).
Предлагается модификация(и) аминокислотных последовательностей антител. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или пептидным синтезом. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Изменения аминокислот также могут изменять посттрансляционные процессы в антителе, такие как изменение количества или положения сайтов гликозилирования.
Вариант модификации аминокислотных последовательностей антител с помощью аминокислотных замен. Такой вариант представляет собой замену, по меньшей мере, одного аминокислотного остатка в молекуле антитела на другой остаток. Места, представляющие наибольший интерес для мутагенеза путем замен, включают гипервариабельные области или CDR, но также предполагаются изменения и в области FR или Fc. Консервативные замены показаны в таблице 1 под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены дополнительные существенные изменения, названные «примерами замен» в таблице А, или изменения, дополнительно описанные ниже при описании классов аминокислот, и может быть проведен скрининг продуктов.
Фрагменты антител
В определенных обстоятельствах целесообразно применять фрагменты антител, а не полные антитела. Меньший размер фрагментов способствует их быстрому клиренсу и может способствовать лучшему проникновению в плотные опухоли.
Для получения фрагментов антител разработаны различные методы. Традиционно эти фрагменты получали путем протеолитического расщепления интактных антител (см., например, Morimoto и др., Journal of Biochemical and Biophysical Methods, 24, 1992, cc. 107-117, и Brennan и др., Science, 229, 1985, с. 81). Однако в настоящее время эти фрагменты можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Fab-, Fv- и scFv-фрагменты антител можно экспрессировать и секретировать из Е. coli, что позволяет облегчать производство больших количеств указанных фрагментов. Фрагменты антител можно выделять из описанных выше фаговых библиотек антител. Согласно другому варианту Fab'-SH-фрагменты можно непосредственно выделять из Е. coli и химически сшивать с получением F(аb')2-фрагментов (Carter и др., Bio/Technology, 10, 1992, сс. 163-167). Согласно другому подходу F(аb')2 - фрагменты можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Fab- и F(аb')2-фрагмент с повышенным временем полужизни in vivo, в которых сохранены остатки эпитопсвязывающего рецептора, описаны в US 5869046. Специалистам в данной области должны быть очевидны другие методики получения фрагментов антител. В других вариантах осуществления изобретения выбранное антитело представляет собой одноцепочечный Fv- фрагмент (scFv) (см. WO 93/16185; US 5571894 и US США 5587458). Fv и sсFv представляют собой единственные виды с интактными связывающими сайтами, лишенные константных областей; в результате их можно применять для пониженного неспецифического связывания при применении in vivo. Слитые белки, несущие sсFv, можно конструировать для получения слияния эффекторного белка либо на N-, либо на С-конце sсFv (см. Antibody Engineering, под ред. Borrebaeck, выше). Фрагмент антитела может представлять собой также «линейное антитело», например описанное в US 5641870. Такие фрагменты линейного антитела могут быть моноспецифическими или биспецифическими.
Молекула нуклеиновой кислоты
Настоящее изобретение также относится к выделенным молекулам нуклеиновых кислот, а именно к последовательностям, кодирующим выделенное моноклональное антитело, которое специфически связывается с CSF-1R, по данному изобретению, которые описаны в данном документе.
Термины «нуклеиновая кислота», «нуклеиновая последовательность» или «нуклеиновокислотная последовательность», «полинуклеотид», «олигонуклеотид», «полинуклеотидная последовательность» и «нуклеотидная последовательность», которые используются равнозначно в данном описании, обозначают четкую последовательность нуклеотидов, модифицированных или не модифицированных, определяющую фрагмент или участок нуклеиновой кислоты, содержащую или не содержащую неприродные нуклеотиды и являющуюся либо двухцепочечной ДНК или РНК, либо одноцепочечной ДНК или РНК, либо продуктами транскрипции указанных ДНК.
Здесь также следует упомянуть, что данное изобретение не относится к нуклеотидным последовательностям в их природной хромосомной среде, т.е. в природном состоянии. Последовательности данного изобретения были выделены и/или очищены, т.е. были взяты прямо или косвенно, например, путем копирования, при этом их среда была по меньшей мере частично модифицирована. Таким образом, также здесь следует подразумевать изолированные нуклеиновые кислоты, полученные путем генетической рекомбинации, например, с помощью принимающих клеток (клеток-хозяев), или полученные путем химического синтеза.
Ссылка на нуклеотидную последовательность охватывает его комплимент, если не указано иное. Таким образом, ссылка на нуклеиновую кислоту, имеющую определенную последовательность следует понимать как охватывающие ее комплементарную цепь с ее комплементарной последовательностью.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от по меньшей мере одной молекулы нуклеиновой кислоты-примеси, с которой она обычно связана в естественном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты отличается от той формы или набора, в которых она находится в естественных условиях. Таким образом, выделенная молекула нуклеиновой кислоты отличается от молекулы нуклеиновой кислоты, существующей в клетках в естественных условиях. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, находящуюся в клетках, в которых в норме происходит экспрессия антитела, например, в случае если молекула нуклеиновой кислоты имеет локализацию в хромосоме, отличную от ее локализации в клетках в естественных условиях.
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из SEQ ID NO: 1-50. Молекула нуклеиновой кислоты может также содержать любую комбинацию указанных нуклеотидных последовательностей.
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует выделенное моноклональное антитело или его антигенсвязывающий фрагмент, которое специфично связывается с CSF-1R, и включает:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 1, SEQ ID NO: 17,
(ii) CDR2 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 2, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO:29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36,
(iii) CDR3 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 3, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50; и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 12,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 13,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 14.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, которое включает вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 2,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 3.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, выбранную из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 5.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 6.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 7.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность, выбранную из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7;
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 4;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 5;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 6;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело или его антигенсвязывающий фрагмент, включающее:
(а) вариабельный домен тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 7;
(b) вариабельный домен легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 8.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 9.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 10.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее тяжелую цепь с аминокислотной последовательностью SEQ ID NO: 11.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее легкую цепь с аминокислотной последовательностью SEQ ID NO: 16.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 8; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая кодирует моноклональное антитело, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 11; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
В некоторых вариантах выделенная нуклеиновая кислота представляет собой ДНК.
В любом из указанных выше вариантах осуществления изобретения молекулы нуклеиновых кислот могут быть выделенными.
Молекула нуклеиновой кислоты по данному изобретению может быть выделена из любого источника, который продуцирует моноклональное антитело, которое специфически связывается с CSF-1R. В определенных вариантах осуществления изобретения молекула нуклеиновой кислоты по данному изобретению может быть синтезирована, а не выделена.
В одном варианте осуществления изобретения молекулы нуклеиновых кислот, кодирующие домены VH (SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 7) или VL (SEQ ID NO: 15) преобразуются в гены антитела по всей длине путем вставки в экспрессионный вектор, уже кодирующей константные домены тяжелой цепи (СН) или легкой цепи (CL), соответственно, так что VH сегмент функционально соединен с CH сегментом(-ами) в векторе и/или VL сегмент оперативно соединен с CL сегментом в векторе. В другом варианте осуществления изобретения молекулы нуклеиновых кислот, кодирующие VH и/или VL домены, преобразуются в гены по всей длине антитела путем соединения, например, лигирования, молекулы нуклеиновой кислоты, кодирующей VH и/или VL домены, к молекуле нуклеиновой кислоты, кодирующей CH и/или CL домены с использованием стандартных молекулярно-биологических методов. Молекулы нуклеиновых кислот, кодирующие по всей длине тяжелую и/или легкую цепи, могут затем экспрессироваться из клетки, в которую они были введены.
Молекулы нуклеиновой кислоты могут использоваться для экспрессии рекомбинантного моноклонального антитела, которое специфически связывается с CSF-1R.
Вектор
В одном из аспектов настоящее изобретение относится к экспрессионному вектору, содержащему вышеуказанную выделенную нуклеиновую кислоту. Настоящее изобретение относится к вектору, подходящему для экспрессии любой из нуклеотидных последовательностей, описанных в настоящем документе.
Термин «вектор» при использовании в настоящем документе означает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она соединена. В некоторых вариантах осуществления изобретения вектор представляет собой плазмиду, т.е. кольцевую двухцепочечную часть ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. В некоторых вариантах осуществления изобретения вектор представляет собой вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном. В некоторых вариантах осуществления изобретения векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации и эписомные векторы млекопитающих). В других вариантах осуществления изобретения векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и таким образом реплицируются вместе с геном хозяина. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально соединены. Такие векторы упоминаются в данном документе как «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы»).
Настоящее изобретение относится к векторам, содержащим молекулы нуклеиновых кислот, которые кодируют любую из аминокислотных последовательностей моноклонального антитела, которое специфически связывается с CSF-1R, или их частей (например, последовательностей тяжелой цепи первого и/или тяжелой и/или легкой цепи второго связывающих доменов) как описано в настоящем документе. Настоящее изобретение далее относится к векторам, содержащим молекулы нуклеиновых кислот, кодирующих слитые белки, модифицированные антитела, фрагменты антител.
Экспрессионные векторы включают плазмиды, ретровирусы, аденовирусы, аденоассоциированные вирусы (AAV), вирусы растений, такие как вирус мозаики цветной капусты, вирусы табачной мозаики, космиды, YAC, EBV полученные эписомы и тому подобное. Молекулы ДНК могут быть лигированы в вектор таким образом, что последовательности, контролирующие транскрипцию и трансляцию в векторе, выполняют предусмотренную функцию регуляции транскрипции и трансляции ДНК. Экспрессионный вектор и последовательности контроля экспрессии могут быть выбраны таким образом, чтобы быть совместимыми с используемой экспрессирующей клеткой-хозяином. Молекулы ДНК, кодирующие частично или по всей длине последовательности первого и второго связывающих доменов (например, последовательности тяжелой и легкой цепи, где связывающий домен содержит последовательность тяжелой и легкой цепи) могут быть введены в отдельные векторы. В одном варианте осуществления изобретения любая комбинация указанных выше молекул ДНК вводится в тот же экспрессионный вектор. Молекулы ДНК могут быть введены в экспрессионный вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и вектора или лигированием тупых концов, если сайты рестрикции отсутствуют).
Выражение «контролирующие последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Пригодные для прокариот контролирующие последовательности представляют собой, например, промотор, необязательно оператор и сайт связывания рибосомы. Как известно, в эукариотических клетках присутствуют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота «функционально связана», если она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связывают с ДНК полипептида, если он экспрессируется в виде предпротеина, который принимает участие в секреции полипептида; промотор или энхансер функционально связывают с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; сайт связывания рибосомы функционально связывают с кодирующей последовательностью, если он расположен так, что может облегчать трансляцию. Как правило, «функционально связан» обозначает, что связанные последовательности ДНК являются смежными, а в случае секреторной лидерной последовательности являются смежными и находятся в фазе считывания. Однако энхансеры не обязательно должны быть смежными.
Подходящим вектором является тот, который кодирует функционально законченные последовательности CH или CL человеческого иммуноглобулина с конструированием соответствующего места рестрикции так, что любая последовательность VH или VL может быть легко включена и экспрессирована, как описано выше. HC- и LC-кодирование генов в таких векторах может содержать интронные последовательности, что приводит к общему увеличению белковых продуктов антитела путем стабилизации соответствующей мРНК. Интронные последовательности находятся в окружении сплайс-донора и сплайс-акцептора сайтов, которые определяют, где будет происходить сплайсинг РНК. Расположение интронных последовательностей может быть либо в вариабельных или константных участках цепей антитела, или как в вариабельных, так и константных участках, когда используются несколько интронов. Прекращение полиаденилирования и транскрипции может произойти вниз по ходу сайта нативной хромосомы кодируемых участков. Рекомбинантный экспрессионный вектор также может кодировать сигнальный пептид, который облегчает выработку цепочки антитела клеткой-хозяином. Ген цепочки антитела может быть клонирован в вектор таким образом, что сигнальный пептид соединен с рамкой считывания аминоконца цепи иммуноглобулина. Сигнальным пептидом может быть сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (то есть, сигнальный пептид белка не иммуноглобулиновой природы).
Помимо цепочки генов антител, рекомбинантная экспрессия векторов по данному изобретению может нести регулирующие последовательности, которые контролируют экспрессию генов цепи антител в клетке-хозяине. Специалистам в этой области будет понятно, что дизайн экспрессионного вектора, включая выбор регулирующих последовательностей, может зависеть от таких факторов, как селекция клетки-хозяина для трансформации, уровень экспрессии желаемого белка, и т.д. Предпочтительные регулирующие последовательности для экспрессирующей клетки-хозяина млекопитающих включают вирусные элементы, обеспечивающие высокий уровень экспрессии белков в клетках млекопитающих, таких как промоторы и/или энхансеры, полученные из ретровирусной LTR, цитомегаловируса (CMV) (например, CMV промотора/энхансера), обезьяньего вируса 40 (SV40) (например, SV40 промотора/энхансера), аденовируса, (например, большого позднего промотора аденовируса (AdMLP)), вирус полиомы, а также сильных промоторов млекопитающих, таких как промотор нативных иммуноглобулинов или промотор актина. Методы экспрессии полипептидов в бактериальных клетках или клетках грибов, например, дрожжевых клетках, также хорошо известны в данной области техники.
В дополнение к генам цепи антитела и регулирующим последовательностям, рекомбинантные векторы экспрессии изобретения могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и гены селектируемого маркера. Ген селектируемого маркера облегчает селекцию клеток-хозяев, в которые был введен вектор.
Термин «последовательность контроля экспрессии», используемый в данном описании, означает полинуклеотидные последовательности, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, к которым они лигированы. Контролирующие экспрессию последовательности включают соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сплайсинг и сигналы полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Характер таких контролирующих последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контролирующие последовательности, как правило, включают промотор, сайт связывания рибосомы, а также последовательности терминации транскрипции; в эукариотах, как правило, такие контролирующие последовательности включают промоторы и последовательности терминации транскрипции. Термин «контролирующие последовательности» включает, как минимум, все компоненты, наличие которых имеет важное значение для экспрессии и процессинга, и может также включать дополнительные компоненты, чье присутствие является полезным, например, лидирующие последовательности и последовательности слившихся клеток.
Клетка-хозяин
В одном из аспектов настоящее изобретение относится к способу получения клетки-хозяина для получения антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, включающий трансформирование клетки описанным выше вектором.
В одном из аспектов настоящее изобретение относится к клетке-хозяину для получения антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, содержащей описанную выше нуклеиновую кислоту.
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») при использовании в данном документе означает клетку, в которую введен рекомбинантный экспрессионный вектор. Настоящее изобретение относится к клеткам-хозяевам, которые могут включать, например, вектор в соответствии с настоящим изобретением, описанным выше. Настоящее изобретение относится также к клеткам-хозяевам, которые включают, например, нуклеотидную последовательность, кодирующую тяжелую цепь или ее антигенсвязывающие части, нуклеотидную последовательность, кодирующую легкую цепь или ее антигенсвязывающие части, или обе из них, первого связывающего домена и/или второго связывающего домена связывающей молекулы по данному изобретению. Следует понимать, что «рекомбинантная клетка-хозяин» и «клетка-хозяин» означают не только конкретную заявленную клетку, но также и потомство такой клетки. Поскольку модификации могут проходить в последующих поколениях вследствие мутации или воздействий окружающей среды, такое потомство не может на самом деле быть идентичным родительской клетке, но такие клетки по-прежнему включены в объем термина «клетка-хозяин» при использовании в настоящем документе.
Молекулы нуклеиновой кислоты, кодирующие моноклональное антитело, которое специфически связывается с CSF-1R, по изобретению и векторы, содержащие эти молекулы нуклеиновой кислоты, могут быть использованы для трансфекции подходящего млекопитающего или его клетки, растения или его клетки, бактериальной или дрожжевой клетки-хозяина. Преобразование может происходить любым известным способом для введения полинуклеотидов в клетку хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области и включают декстран опосредованную трансфекцию, трансфекцию комплексом нуклеиновой кислоты и позитивно заряженного полимера, трансфекцию преципитатом нуклеиновой кислоты и фосфата кальция, полибрен опосредованную трансфекцию, слияние протопластов, трансфекцию инкапсулированными в липосомы полинуклеотидами и прямую микроинъекцию ДНК в ядра. В дополнение молекулы нуклеиновых кислот могут быть введены в клетки млекопитающих вирусными векторами.
Клеточные линии млекопитающих, используемые в качестве хозяев для трансформации, хорошо известны в данной области и включают множество иммортализованных доступных клеточных линий. К ним относятся, например, клетки яичников китайского хомячка (CHO), NS0 клетки, клетки SP2, HEK-293T клетки, 293 Фристайл клетки (Invitrogen), NIH-3T3 клетки, клетки HeLa, клетки почек хомячка (BHK), клетки почек африканских зеленых мартышек (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), A549 клетки и ряд других клеточных линий. Клеточные линии выбираются путем определения, какие клеточные линии имеют высокие уровни экспрессии и обеспечивают необходимые характеристики продуцируемого белка. Другими клеточными линиями, которые могут быть использованы, являются клеточные линии насекомых, такие как Sf9 или Sf21 клетки. Когда векторы рекомбинантной экспрессии, кодирующие моноклональное антитело, которое специфически связывается с CSF-1R, вводятся в клетки-хозяева млекопитающих, антитела продуцируются путем культивирования клеток-хозяев в течение времени, достаточного для экспрессии антител в клетках-хозяевах или, предпочтительнее, выделения антител в питательную среду, в которой выращиваются клетки-хозяева. Моноклональное антитело, которое специфически связывается с CSF-1R, может быть выделено из питательной среды с использованием стандартных методов очистки белка. Клетки-хозяева растений, например, включают Nicotiana, Arabidopsis, ряску, кукурузу, пшеницу, картофель и т.д. Клетки бактерий хозяина включают виды Escherichia и Streptomyces. Дрожжевые клетки-хозяева включают Schizosaccharomyces pombe, Saccharomyces cerevisiae и Pichia pastoris.
Кроме того, уровень продукции моноклонального антитела, которое специфически связывается с CSF-1R, по данному изобретению из продуцирующей клеточной линии можно усилить с помощью ряда известных методов. Например, система экспрессии гена глутамин синтетазы (система GS) является достаточно распространенной для усиления экспрессии при определенных условиях.
Вполне вероятно, что моноклональное антитело, которое специфически связывается c CSF-1R, различных клеточных линий или трансгенные животные будут отличаться друг от друга профилем гликозилирования. Однако моноклональное антитело, которое специфически связывается с CSF-1R, кодируемое молекулами нуклеиновой кислоты, описанными в данном документе, или содержащее аминокислотные последовательности, приведенные в настоящем документе, являются частью данного изобретения, независимо от состояния гликозилирования связывающих молекул и в целом, независимо от наличия или отсутствия пост-трансляционных модификаций.
Вышеуказанная клетка-хозяин не относится к клетке-хозяину, полученной с использованием человеческих эмбрионов.
Вышеуказанная клетка-хозяин не относится к клетке-хозяину, полученной с модификации генетической целостности клеток зародышевой линии человека.
Способ получения антитела
В одном из аспектов настоящее изобретение относится к способу получения антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, заключающемуся в культивировании описанной выше клетки-хозяина в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
Настоящего изобретения относится к способам получения моноклонального антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, по данному изобретению. Один вариант осуществления изобретения относится к способу получения моноклонального антитела, которое специфически связывается с CSF-1R, как определено в настоящем документе, содержащему получение рекомбинантной клетки-хозяина, способной экспрессировать моноклональное антитело, которое специфически связывается с CSF-1R, культивированию указанной клетки-хозяина в условиях, подходящих для экспрессии продукции моноклонального антитела, которое специфически связывается с CSF-1R, и выделение полученного моноклонального антитела, которое специфически связывается с CSF-1R. Моноклональное антитело, которое специфически связывается с CSF-1R, полученное такой экспрессией в таких рекомбинантных клетках-хозяевах упоминается в данном документе как «рекомбинантное моноклональное антитело, которое специфически связывается с CSF-1R». Изобретение также относится к потомству клеток таких клеток-хозяев и моноклональному антителу, которое специфически связывается с CSF-1R, полученному аналогично.
Фармацевтические композиции
Другим аспектом изобретения является фармацевтическая композиция, содержащая в качестве активного ингредиента (или в качестве единственного активного ингредиента) моноклональное антитело, которое специфически связывается с CSF-1R.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции, которая содержит антитело по настоящему изобретению или его антигенсвязывающий фрагмент в терапевтически эффективном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
«Фармацевтическая композиция» обозначает композицию, включающую в себя антитело согласно изобретению и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, полиолы, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутриглазного, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Фармацевтическая композиция может включать по меньшей мере одно моноклональное антитело, которое специфически связывается с CSF-1R и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых эксипиентов.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от соединения(-ий) по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Фармацевтическая композиция может включать по меньшей мере одно моноклональное антитело, которое специфически связывается с CSF-1R, и одну или более дополнительных связывающих молекул (например, антител), которые нацелены на один или более соответствующих поверхностных рецепторов.
В некоторых вариантах осуществления изобретения композиции предназначены для улучшения, профилактики или лечения нарушений, которые могут быть связаны с CSF-1R.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для лечения заболевания или нарушения, опосредуемого CSF-1R, содержащей антитело или его антигенсвязывающий фрагмент, которое специфически связывается с CSF-1R, в терапевтически эффективном количестве, в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
Термин «заболевание или нарушение, опосредованное CSF-1R» подразумевает все заболевания или нарушения, которые либо прямо, либо косвенно связаны с CSF-1R, включая этиологию, развитие, прогресс, персистентность или патологию заболевания или нарушения.
«Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Используемое в данном документе, чтобы «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включает ссылки на лечебную, паллиативную и профилактическую терапию.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Термин «нарушение» означает любое состояние, которое можно улучшить в результате лечения по настоящему изобретению. В определение данного термина входят хронические и острые нарушения или заболевания, включающие в себя патологические состояния, которые вызывают предрасположенность млекопитающего к возникновению данного нарушения.
«Терапевтически эффективным количеством» считается количество вводимого в процессе лечения терапевтического агента, которое избавит в определенной степени от одного или нескольких симптомов заболевания, по поводу которого проводится лечение.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
Фармацевтические композиции по настоящему изобретению и способы их изготовления будут бесспорно очевидными для специалистов в этой области. Производство фармацевтических композиций предпочтительно должно соответствовать требованиям GMP (надлежащей производственной практики). Композиция может включать буферную композицию, тонические агенты, стабилизаторы и солюбилизаторы. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного фармацевтического ингредиента, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, масла и инъекционные органические сложные эфиры.
Любой способ введения пептидов, белков или антител, принятый в данной области, может соответствующим образом использоваться для моноклонального антитела, которое специфически связывается с CSF-1R, по данному изобретению.
Термин «фармацевтически приемлемый» означает один или несколько совместимых жидких или твердых компонентов, которые подходят для введения млекопитающему, предпочтительно человеку.
Под термином «буфер», «буферная композиция», «буферный агент» понимается раствор, способный сохранять значение pH, благодаря взаимодействию кислотных и щелочных компонентов, входящих в его состав, который дает возможность препарату антитела, которое специфически связывается с CSF-1R, проявлять устойчивость к изменениям рН. В общем случае, преимущественными являются значения рН фармацевтической композиции от 4,0 до 8,0. В качестве буферных агентов могут быть использованы, например, ацетатный, фосфатный, цитратный, гистидиновый, сукцинатный и т.п. буферные растворы, но, не ограничиваясь ими.
Термины «тонический агент», «осмолитик» или «осмотический агент» в том виде, как они здесь использованы, относятся к эксципиенту, который может подводить осмотическое давление жидкого препарата антитела. «Изотоничный» препарат представляет собой препарат, который имеет осмотическое давление, эквивалентное давлению человеческой крови. Изотоничные препараты обычно имеют осмотическое давление от примерно 250 до 350 мОсм/кг. В качестве изотоноческих агентов могут быть использованы полиолы, моно- и дисахара, аминокислоты, соли металлов, например хлорид натрия, и т.п., но не ограничиваясь ими.
Под «стабилизатором» понимается вспомогательное вещество или смесь двух и более вспомогательных веществ, которые обеспечивают физическую и/или химическую стабильность активного агента. В качестве стабилизаторов могут быть использованы аминокислоты, например, аргинин, гистидин, глицин, лизин, глутамин, пролин, но, не ограничиваясь ими; поверхностно-активные вещества, например, полисорбат 20 (торговое наименование Tween 20), полисорбат 80 (торговое наименование Tween 80), полиэтилен-полипропилен гликоль и его кополимеры (торговые наименования Полоксамер (Poloxaner), Плуроник (Pluronic)), натрия додецилсульфат (SDS), но не ограничиваясь ими; антиоксиданты, например, метионин, ацетилцистеин, аскорбиновая кислота, монотиоглицерол, соли серистых кислот, и т.п., но не ограничиваясь ими; хелатирующие агенты, например, этилендиаминтетрауксусная кислота (ЭДТА), диэтилентриаминпентауксусная кислота (ДТПА), цитрат натрия и т.п., но не ограничиваясь ими.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8°С. Предпочтительно, чтобы активный агент сохранял и физическую, и химическую стабильность, а также биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
Фармацевтические композиции по настоящему изобретению, как правило, пригодны для парентерального введения в виде стерильных лекарственных средств, предназначенных для введения в организм человека с нарушением целостности кожных покровов или слизистых оболочек, минуя желудочно-кишечный тракт путем инъекций, инфузий или имплантации. В частности, предполагается, что парентеральное введение включает, помимо прочего, подкожную, внутрибрюшинную, внутримышечную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставнную, трансдермальную инъекцию или инфузию; и почечные диализные инфузионные методики. Внутриопухолевая доставка, например, внутриопухолевая инъекция, также может быть применима. Также предусмотрена региональная перфузия. Предпочтительные варианты осуществления изобретения включают внутривенный и подкожный пути. Любой способ введения пептидов или белков, принятый в данной области, может соответствующим образом использоваться для антитела, которое специфически связывается с CSF-1R, по данному изобретению.
Инъекционные лекарственные средства могут быть изготовлены, упакованы или проданы в стандартной лекарственной форме, например, в ампулах, флаконах, полимерных контейнерах, преднаполненных шприцах, устройствах для автоинжекции, но не ограничиваясь ими. Лекарственные средства для парентерального введения включают, помимо прочего, суспензии, растворы, эмульсии в масляных или водных основах, пасты и тому подобное.
Еще одним вариантом осуществления изобретения является лекарственное средство для парентерального введения, где фармацевтическая композиция предоставлена в сухой форме, то есть порошка или гранул для растворения в подходящем растворителе (например, стерильной апирогенной воде) перед введением. Такое лекарственное средство может быть получено, например, с помощью лиофилизации, т.е. процесса, известного в данной области техники как сушка из замороженного состояния, включающая в себя замораживание препарата и последующее удаление растворителя из замороженного содержимого.
Антитело, которое специфически связывается с CSF-1R, может также вводиться интраназально или ингаляционно, самостоятельно, в виде смеси с подходящим фармацевтически приемлемым наполнителем из ингалятора, такого как аэрозольный контейнер под давлением, помпа, спрей, распылитель или небулайзер, в котором используется или не используется подходящий пропеллент, или в виде назальных капель или спрея.
Лекарственное средство для парентерального введения может быть немедленного или модифицированного высвобождения. Лекарственные средства с модифицированным высвобождением включают отсроченное, замедленное, пульсирующее, контролируемое, нацеленное и программируемое высвобождение.
Терапевтическое применение моноклонального антитела, которое специфически связывается с CSF-1R
В одном аспекте антитело, которое специфически связывается с CSF-1R, применяется в лечении нарушений, которые опосредованы с активностью CSF-1R.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола и любого возраста.
В случае опухоли (например, раковой опухоли) терапевтически эффективное количество антитела или фрагмента антитела (например, антитела или фрагмента антитела, которое специфически связывает CSF-1R) может уменьшать число раковых клеток; уменьшать начальный размер опухоли; ингибировать (т.е. до некоторой степени замедлять и, предпочтительно, прекращать) инфильтрацию раковыми клетками периферических органов; ингибировать (т.е. до некоторой степени замедлять и, предпочтительно, прекращать) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или облегчать, до некоторой степени, один или более симптомов, обусловленных расстройством. Антитело или фрагмент антитела может, до некоторой степени, предупреждать рост и/или убивать имеющиеся раковые клетки, оно может вызывать цитостатический и/или цитотоксический эффект. При терапии рака эффективность in vivo можно определять, например, оценивая продолжительность жизни, время до прогрессирования заболевания (ТТР), частоту ответа опухоли на лечение (RR), продолжительность ответа и/или качество жизни.
Используемые в данном документе применения или способы, относящиеся к антителу, которое специфически связывается с CSF-1R, с одним или более другими терапевтическими агентами, как предполагают, означают, ссылаются или включают:
1) одновременное введение такой комбинации антитела, которое специфически связывается с CSF-1R, и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в одной лекарственной форме, из которой указанные компоненты высвобождаются практически одновременно указанному пациенту,
2) одновременное введение такой комбинации антитела, которое специфически связывается с CSF-1R, и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно в разных лекарственных формах, введение которых происходит практически в одно и то же время указанному пациенту, после чего указанные компоненты высвобождаются практически одновременно указанному пациенту,
3) последовательное введение такой комбинации антитела, которое специфически связывается с CSF-1R, и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно друг от друга в отдельных лекарственных формах, которые принимаются в последовательно по времени указанным пациентом со значимым временным интервалом между каждым введением, после чего указанные компоненты высвобождаются в практически разное время указанному пациенту; а также
4) последовательное введение такой комбинации антитела, которое специфически связывается с CSF-1R, и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в единый лекарственной форме, из которой высвобождение указанных компонентов происходит контролируемым образом, после чего они одновременно, последовательно или совместно высвобождаются в одно и то же время и/или разное время указанному пациенту, где каждая часть может быть введена одним или разными путями.
Антитело, которое специфически связывается с CSF-1R, могут назначаться без дополнительного терапевтического лечения, т.е. в качестве самостоятельной терапии. Кроме того, лечение антителом, которое специфически связывается с CSF-1R, может включать по меньшей мере одно дополнительное терапевтическое лечение (комбинированная терапия). В некоторых вариантах осуществления изобретения антитело, которое специфически связывается с CSF-1R, может вводиться совместно с другим медикаментом/препаратом для лечения рака.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для лечения заболевания или нарушения, опосредуемого CSF-1R, содержащей антитело или его антигенсвязывающий фрагмент, которое специфически связывается с CSF-1R, и по меньшей мере одно другое терапевтически активное соединение.
В некоторых вариантах заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
В некоторых вариантах другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
«Химиотерапевтическим средством» является химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохинон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (например, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (например, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин,например, калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMICIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, доксорубициноНСl в инъецируемых липосомах (DOXOL®), липосомный доксорубицин TLC D-99 (MYOCET®), пегилированный липосомный доксорубицин (CAELYX®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2»-трихлортриэтиламин; трихотецены (например, токсин T-2, верракурин A, роридин A и ангуидин); уретан; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («ara-C»); тиотепа; таксоид, например паклитаксел (TAXOL®), препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (ABRAXANETM) и доцетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; средства на основе платины, такие как цисплатин, оксалиплатин и карбоплатин; алкалоиды барвинка, которые предотвращают полимеризацию тубулина из образующихся микротрубочек, включая винбластин (VELBAN®), винкристин (ONCOVIN®), виндезин (ELDISINE®, FILDESIN®) и винорелбин (NAVELBINE®); этопозид (VP-16); ифосфамид; митоксантрон; лейковорин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, включая бексаротен (TARGRETIN®); бифосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризендронат (ACTONEL®); троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды,например олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в пролиферацию аберрантных клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептора эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); rmRH (например, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (Pfizer); перифосин, ингибитор ЦОГ-2 (например, целекоксиб или эторикоксиб), ингибитор протеосом (например, PS341); бортезомиб (VELCADE®); CCI-779; типифарниб (811577); орафениб, ABT510; ингибитор Bcl-2, такой как облимерсен натрия (GENASENSE®); пиксантрон; ингибиторы EGFR (см. определение ниже); ингибиторы тирозинкиназ (см. определение ниже); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств; а также сочетания двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены со смешанным профилем агонист/антагонист, включая тамоксифен (NOLVADEX®), 4-гидрокситамоксифен, триоксифен, торемифен (FARESTON®); идоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен и избирательные модуляторы рецепторов эстрогена (SERM), такие как SERM3; чистые антиэстрогены без агонистических свойств, такие как фулвестрант (FASLODEX®) и EM800 (такие средства могут блокировать димеризацию рецепторов эстрогена (ER), ингибировать связывание ДНК, усиливать метаболизм ER и/или снижать уровни ER); ингибиторы ароматазы, включая стероидные ингибиторы ароматазы, такие как форместан и эксеместан (AROMASIN®), и нестероидные ингибиторы ароматазы, такие как анастразол (ARIMIDEX®), летрозол (FEMARA®) и аминоглутетимид и другие ингибиторы ароматазы, включая ворозол (RIVISOR®), ацетат мегестрола (MEGASE®), фадрозол, имидазол; агонисты рилизинг-гормона лютеинизирующего гормона, включая лейпролид (LUPRON® и ELIGARD®), гозерелин, бузерелин и триптерелин; половые стероиды, включая прогестины, такие как ацетат мегестрола и ацетат медроксипрогестерона, эстрогены, такие как диэтилстилбестрол и премарин и андрогены/ретиноиды, такие как флуоксиместерон, полностью трансретиноевая кислота и фенретинид; онапристон; антипрогестероны; понижающие регуляторы рецепторов эстрогенов (ERD); антиандрогены, такие как флутамид, нилутамид и бикалутамид; тестолактон; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств; а также сочетания двух или более указанных выше средств.
В некоторых вариантах другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
Термин «чекпойнт-ингибитор» (или ингибитор контрольной точки) относится к соединениям, которые подавляют активность контрольных точек иммунитета. Ингибирование включает снижение функции или полную блокаду. Примеры ингибиторных молекул контрольных точек включают B7-H3, B7-H4, BTLA, CTLA-4, KIR, PD-1, PD-L1, PD-L2, LAG-3, TIM-3, TIGIT и VISTA. В некоторых вариантах осуществления ингибитор иммунных контрольных точек является антителом, специфически распознающим белок иммунных контрольных точек. Известен ряд ингибиторов иммунных контрольных точек, и в ближайшем будущем могут быть разработаны альтернативные ингибиторы иммунных контрольных точек по аналогии с этими известными ингибиторами белков иммунных контрольных точек. Ингибиторы иммунных контрольных точек включают, в качестве неограничивающих примеров, пептиды, антитела, молекулы нуклеиновой кислоты и низкомолекулярные соединения.
Было выявлено, что опухоль-ассоциированные макрофаги (ТАМ) экспрессируют высокие уровни PD1, PD-L1 и PD-L2. В ТАМ, полученных от мышей, пролеченных CSF-1R ингибиторами, значительно снижены уровни PD-L2 и PD1 экспрессии. 70% активированных CTLs имеют высокие уровни PD1 экспрессии и CSF-1R блокада влияния на это не оказывает. В свою очередь CTLA-4 экспрессия на CD8+ была значительно усилена на фоне CSF-1R ингибирования. Таким образом, при ингибировании CSF-1R необходимо учитывать возможность возникновения определенного парадокса. Несмотря на то, что CSF1/CSF-1R блокада репрограммирует микроокружение в сторону противоопухолевого ответа макрофагов и косвенно активирует CTL, это репрограммирование приводит к CTLA-4 на активированных цитотоксических T-клетках. Таким образом, очевидной является необходимость применения анти-CSF1R препаратов в комбинации с чекпойнт-ингибиторами (анти-CTLA4).
В некоторых вариантах чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
В некоторых вариантах PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1. Примеры антител, которые специфически связываются с PD-1, включают пембролизумаб (pembrolizumab), ниволумаб (nivolumab), пролголимаб (prolgolimab), торипалимаб (toripalimab), цемиплимаб (cemiplimab), синтилимаб (sintilimab) и другие. Наиболее предпочтительным является пролголимаб, пембролизумаб, ниволумаб.
В некоторых вариантах CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4. Примеры антител, которые специфически связываются с CTLA4, включают ипилимумаб (ipilimumab) и тремелимумаб (tremelimumab), залифрелимаб (zalifrelimab) и другие. Наиболее предпочтительным является ипилимумаб.
Подразумевается, что моноклональное антитело по данному изобретению могут использоваться в способах лечения, как описано выше, могут использоваться в лечении, как описано выше, и/или могут использоваться в производстве медикаментов для лечения, как описано выше.
В одном из аспектов настоящее изобретение относится к способу ингибирования биологической активности CSF-1R у субъекта, нуждающегося в таком ингибировании, включающему введение субъекту эффективного количества антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, по данному изобретению.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного CSF-1R, включающему введение субъекту, нуждающемуся в таком лечении, антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, по данному изобретению, или фармацевтической композиции, описанной выше, в терапевтически эффективном количестве.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного CSF-1R, включающий введение субъекту, нуждающемуся в таком лечении, описанного выше антитела или его антигенсвязывающего фрагмента и меньшей мере одного другого терапевтически активного соединения.
В одном из аспектов настоящее изобретение относится к применению описанного выше антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R, или описанной выше фармацевтической композиции для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого CSF-1R.
В одном из аспектов настоящее изобретение относится к применению описанного выше антитела или его антигенсвязывающего фрагмента, которое специфически связывается с CSF-1R и по меньшей мере одного другого терапевтически активного соединения для лечения заболевания или нарушения, опосредуемого CSF-1R.
В некоторых вариантах заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
Дозы и пути введения
Моноклональное антитело, которое специфически связывается с CSF-1R, по данному изобретению будет вводиться в количестве, эффективном для лечения состояния, о котором идет речь, т.е. в дозах и в течение периодов времени, необходимых для достижения желаемого результата. Терапевтически эффективное количество может изменяться в зависимости от таких факторов, как конкретное состояние, по поводу которого проводится лечение, возраста, пола и веса пациента, а также является ли введение моноклонального антитела, которое специфически связывается с CSF-1R, самостоятельным лечением или оно проводится в комбинации с одним или более дополнительных препаратов или методов лечения.
Схемы приема лекарственных средств можно регулировать, чтобы обеспечить оптимальный желаемый ответ. Например, может быть введен один болюс, несколько разделенных доз могут быть введены в течение некоторого времени, или доза могут быть пропорционально уменьшена или увеличена в зависимости от остроты терапевтической ситуации. Особенно полезным является изготовление парентеральных композиций в стандартной лекарственной форме для простоты введения и однородности дозирования. Стандартная лекарственная форма при использовании в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для пациентов/субъектов, подлежащих лечению; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Спецификация для стандартных лекарственных форм по настоящему изобретению, как правило, диктуется и непосредственно зависит от (a) уникальных характеристик терапевтического агента и конкретного терапевтического или профилактического эффекта, которые должны быть достигнуты, и (b) ограничений, присущих в технике компаундирования такого активного соединения для лечения чувствительности у субъектов.
Таким образом, квалифицированным специалистам понятно, исходя из раскрытия, представленного в данном документе, что дозы и режим дозирования корректируются в соответствии со способами, хорошо известными в терапевтической области. Это означает, что может быть легко установлена максимально переносимая доза и может быть также определено эффективное количество, обеспечивающее обнаруживаемый терапевтический эффект для пациента, так же, как и требования ко времени введения каждого агента для достижения видимого терапевтического эффекта для пациента. Таким образом, хотя некоторые дозы и схемы режима введения приведены в качестве примеров в данном документе, эти примеры никоим образом не ограничивают дозы и режимы введения, которые могут понадобиться для пациента в практике применения настоящего изобретения.
Следует отметить, что значения дозировки могут изменяться, в зависимости от типа и тяжести состояния, которое следует облегчить, и может включать одну или более доз. Кроме того, необходимо понимать, что для любого конкретного пациента, конкретные схемы введения должны быть скорректированы через некоторое время согласно индивидуальной потребности и на усмотрение медицинского работника, который осуществляет введение или контролирует введение композиций, и что диапазоны концентрации, приведенные в данном описании, приведены только в качестве примера и не предназначены для ограничения объема или практики заявленных композиций. Кроме того, режим дозирования с композициями по данному изобретению может быть основан на различных факторах, включая тип заболевания, возраст, вес, пол, состояния здоровья пациента, тяжесть состояния, путь введения и конкретное используемое моноклональное антитело, которое специфически связывается с CSF-1R. Таким образом, режим дозирования может широко варьироваться, но может определяться регулярно с помощью стандартных методов. Например, дозы могут быть скорректированы на основе фармакокинетических и фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты или лабораторные значения. Таким образом, настоящее изобретение охватывает индивидуальное повышение дозы, которое определяется квалифицированным специалистом. Определение необходимой дозы и режимы хорошо известны в соответствующей области техники и будут понятны специалисту в данной области после ознакомления с идеями, раскрытыми в данном документе.
Примеры подходящих способов введения предусмотрены выше.
Предполагается, что подходящая доза моноклонального антитела, которое специфически связывается с CSF-1R, по данному изобретению будет в диапазоне от 0,1-200 мг/кг, предпочтительно 0,1-100 мг/кг, в том числе около 0,5-50 мг/кг, например, около 1-20 мг/кг. Моноклональное антитело, которое специфически связывается с CSF-1R, может быть введено, например, в дозе по меньшей мере 0,25 мг/кг, например, по меньшей мере 0,5 мг/кг, в том числе не менее 1 мг/кг, например, по меньшей мере 1,5 мг/кг, например, также как не менее 2 мг/кг, например, по меньшей мере 3 мг/кг, в том числе по меньшей мере 4 мг/кг, например, по меньшей мере 5 мг/кг; и например вплоть до максимально 50 мг/кг, в том числе вплоть до максимально 30 мг/кг, например, вплоть до максимально 20 мг/кг, в том числе вплоть до максимально 15 мг/кг. Введение будет повторяться обычно в подходящие промежутки времени, например, раз в неделю, раз в две недели, один раз каждые три недели или один раз каждые четыре недели, и так долго, как будет сочтено целесообразным ответственным врачом, который может в некоторых случаях увеличить или уменьшить дозу при необходимости.
Диагностическое использование антитела, которое специфически связывается с CSF-1R
Моноклональное антитело, которое специфически связывается с CSF-1R, по настоящему изобретению также используются в диагностических целях (например, in vitro, ex vivo). Например, данное моноклональное антитело, которое специфически связывается с CSF-1R, по данному изобретению может использоваться для обнаружения или измерения уровня CSF-1R в образцах, полученных от пациента, например, образец ткани или образец жидкости тела, такой как воспалительный экссудат, кровь, сыворотка крови, жидкость кишечника, слюна или моча. Подходящие методы обнаружения и измерения включают иммунологические методы, такие как проточная цитометрия, твердофазный иммуноферментный анализ (ИФА), хемилюминесцентный анализ, радиоиммуноанализ и иммуногистология.
Выделенное моноклональное антитело или его антигенсвязывающий фрагмент, которое специфически связывается с CSF-1R, включающее:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 51: DYAMXaa1, где Xaa1 представляет собой аминокислоту T или S;
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 52: Xaa2ISWХaa3GGXaa4TXaa5YXaa6DSVKG, где
Xaa2 представляет собой аминокислоту А, Xaa3 представляет собой аминокислоту N, R, I, L или F, Xaa4 представляет собой аминокислоту S, X5 представляет собой аминокислоту N и Xaa6 представляет собой аминокислоту A;
или
Xaa2 представляет собой аминокислоту А, Xaa3 представляет собой аминокислоту N, Xaa4 представляет собой аминокислоту E, I или L, Xaa5 представляет собой аминокислоту N и Xaa6 представляет собой аминокислоту A;
или
Xaa2 представляет собой аминокислоту А, Xaa3 представляет собой аминокислоту N, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту R или W и Xaa6 представляет собой аминокислоту A;
или
Xaa2 представляет собой аминокислоту А, Xaa3 представляет собой аминокислоту N, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту N и Хaa6 представляет собой аминокислоту Q или H;
или
Хaa2 представляет собой аминокислоту Q или H, Xaa3 представляет собой аминокислоту N, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту R, и Хaa6 представляет собой аминокислоту Q; или где Хaa2 представляет собой аминокислоту Q или H, Xaa3 представляет собой аминокислоту N, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту R; и Хaa6 представляет собой аминокислоту H;
Хaa2 представляет собой аминокислоту Q или H, Хaa3 представляет собой аминокислоту L, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту N и Хaa6 представляет собой аминокислоту Q; или где Хaa2 представляет собой аминокислоту Q или H, Хaa3 представляет собой аминокислоту I, Xaa4 представляет собой аминокислоту S, Хaa5 представляет собой аминокислоту N и Хaa6 представляет собой аминокислоту Q;
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 53: Хaa7VEXaa8Xaa9HRRLYXaa10YLEХaa11, где
Хaa7 представляет собой аминокислоту T, I или Y, Хaa8 представляет собой аминокислоту V, Хaa9 представляет собой аминокислоту A, Хaa10 представляет собой аминокислоту K и Хaa11 представляет собой аминокислоту V;
или
Хaa7 представляет собой аминокислоту T, Хaa8 представляет собой аминокислоту V, Хaa9 представляет собой аминокислоту A, Хaa10 представляет собой аминокислоту R, N, Q, L, F или Y и Хaa11 представляет собой аминокислоту V;
или
Хaa7 представляет собой аминокислоту T, Хaa8 представляет собой аминокислоту V, Хaa9 представляет собой аминокислоту A, Хaa10 представляет собой аминокислоту K и Хaa11 представляет собой аминокислоту I;
или
Хaa7 представляет собой аминокислоту T, Хaa8 представляет собой аминокислоту Q, L или F, Хaa9 представляет собой аминокислоту A, Хaa10 представляет собой аминокислоту K и Хaa11 представляет собой аминокислоту I;
или
Хaa7 представляет собой аминокислоту T, Хaa8 представляет собой аминокислоту F, Хaa9 представляет собой аминокислоту S, Хaa10 представляет собой аминокислоту K и Хaa11 представляет собой аминокислоту V;
или
Хaa7 представляет собой аминокислоту T, Хaa8 представляет собой аминокислоту F, Хaa9 представляет собой аминокислоту A, Хaa10 представляет собой аминокислоту K и Хaa11 представляет собой аминокислоту V; и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью GGNNIGSKSVH (SEQ ID NO: 12),
(ii) CDR2 с аминокислотной последовательностью GDSDRPS (SEQ ID NO: 13),
(iii) CDR3 с аминокислотной последовательностью QVWDISSDHVV (SEQ ID NO: 14).
Выделенное моноклональное антитело или его антигенсвязывающий фрагмент, которое специфически связывается с CSF-1R, включающее:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 1: DYAMS или SEQ ID NO: 17: DYAMT;
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 2: AISWNGGSTNYADSVKG или
SEQ ID NO: 54: АISWXaa3GGSTNYADSVKG,
где Xaa3 представляет собой аминокислоту R, I, L или F;
или
SEQ ID NO: 55: AISWNGGXaa4TNYADSVKG,
где Xaa4 представляет собой аминокислоту E, I или L;
или
SEQ ID NO: 56: AISWNGGSTХaa5YADSVKG,
где Хaa5 представляет собой аминокислоту R или W;
или
SEQ ID NO: 57: AISWNGGSTNYXaa6DSVKG,
где Хaa6 представляет собой аминокислоту Q или H;
или
SEQ ID NO: 58: Xaa2ISWNGGSTXaa5YXaa6DSVKG,
где Хaa2 представляет собой аминокислоту Q или H, Хaa5 представляет собой аминокислоту R и Хaa6 представляет собой аминокислоту Q; или где Хaa2 представляет собой аминокислоту Q или H, Хaa5 представляет собой аминокислоту R и Хaa6 представляет собой аминокислоту H;
или
SEQ ID NO: 59: Xaa2ISWХaa3GGSTNYXaa6DSVKG,
где Хaa2 представляет собой аминокислоту Q или H, Хaa3 представляет собой аминокислоту L и Хaa6 представляет собой аминокислоту Q; или где Хaa2 представляет собой аминокислоту Q или H, Хaa3 представляет собой аминокислоту I и Хaa6 представляет собой аминокислоту Q;
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 3: TVEVAHRRLYKYLEV или
SEQ ID NO: 60: Хaa7VEVAHRRLYKYLEV,
где Хaa7 представляет собой аминокислоту I или Y;
или
SEQ ID NO: 61: TVEXaa10AHRRLYKYLEV,
где Хaa10 представляет собой аминокислоту R, N, Q, L, F или Y;
или
SEQ ID NO: 45: TVEVAHRRLYKYLEI,
или
SEQ ID NO: 62: TVEXaa8AHRRLYKYLEХaa11,
где Хaa8 представляет собой аминокислоту Q, L или F, и Хaa11 представляет собой аминокислоту I;
или
SEQ ID NO: 63: TVEXaa8Xaa9HRRLYKYLEV,
где Хaa8 представляет собой аминокислоту F, и Хaa9 представляет собой аминокислоту S;
или
SEQ ID NO: 50: TVEFAHRRLYKYLEV; и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью GGNNIGSKSVH (SEQ ID NO: 12),
(ii) CDR2 с аминокислотной последовательностью GDSDRPS (SEQ ID NO: 13),
(iii) CDR3 с аминокислотной последовательностью QVWDISSDHVV (SEQ ID NO: 14).
Осуществление изобретения
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Материалы и общие методы
Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей человеческого иммуноглобулина, представлена у: Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Аминокислоты цепей антител пронумерованы согласно нумерации EU (Edelman G.M. и др., Proc. Natl. Acad. Sci. USA 63, 1969, ее. 78- 85; Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии использовали согласно инструкциям производителей.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, созданных путем химического синтеза. Генные сегменты длиной от 300 до 4000 т.п.н., которые фланкированы уникальными сайтами рестрикции, собирали путем отжига и лигирования олигонуклеотидов, включая ПЦР-амплификацию и последующее клонирование через указанные сайты рестрикции. Последовательности ДНК субклонированных генных фрагментов подтверждали путем секвенирования ДНК.
Определение последовательностей ДНК
Последовательности ДНК определяли путем секвенирования по Сенгеру.
Анализ последовательностей ДНК и белков и обработка данных о последовательностях
Применяли пакет программ фирмы Infomax's Vector NT1 Advance suite, версия 8.0 для создания, картирования, анализа, аннотирования и иллюстрации последовательностей.
Экспрессионные векторы
Для экспрессии описанных антител и антигенов применяли варианты экспрессионных плазмид, предназначенных для экспрессии в клетках прокариот (E.coli) кратковременной экспрессии в клетках эукариот (например, в клетках CHO). Помимо кассеты экспрессии антитела векторы содержали: сайт инициации репликации, обеспечивающий репликацию указанной плазмиды в Е.coli, гены, придающие устойчивость в Е.coli к различным антибиотикам (например, к ампициллину и канамицину).
Слияние генов, содержащих описанные цепи антитела, как указано ниже, осуществляли с помощью ПЦР и/или синтеза и сборки генов с использованием известных методов и процедур рекомбинации путем соединения соответствующих сегментов нуклеиновых кислот, например, с использованием уникальных сайтов рестрикции в соответствующих векторах. Субклонированные нуклеотидные последовательности подтверждали секвенированием ДНК. Для кратковременных трансфекций создавали большие количества плазмид посредством получения плазмид из трансформированных культур E. coli.
Пример 1. Продукция рекомбинантных антигенов в суспензионной культуре клеток млекопитающих
Последовательности экстраклеточных доменов человека CSF-1R (SEQ https://www.uniprot.org/uniprot/P07333 (19-517 а.к)) клонировали в плазмиды для наработки белка в клетках млекопитающих с тагами FcLama, Avi, His по сайтам рестрикции SalI/NotI. Плазмиды нарабатывали в необходимых количествах в клетках E.Coli и очищали при помощи набора Qiagen.
Последовательность экстраклеточного домена макаки резус CSF-1R (SEQ https://www.ncbi.nlm.nih.gov/protein/XP_001107711.4) клонировали в плазмиду для наработки белка в клетках млекопитающих с His тагом по сайтам рестрикции SalI/NotI. Плазмиды нарабатывали в необходимых количествах в клетках E. coli и очищали при помощи набора Qiagen.
Пример 2. Продукция рекомбинантных антигенов и антител в суспензионной культуре клеток млекопитающих
Антигены и антитела продуцировали в клетках постоянной клеточной линии, полученной из клеток яичника китайского хомячка (линия CHO-T). Суспензионное культивирование осуществляли в колбах на орбитальном шейкере-инкубаторе, с использованием бессывороточных сред производства компании HyCell TransFx-C с добавлением 8 мМ L-глутамина и 1 г/л плюроника 68. Для транзиентной экспрессии клетки в концентрации 2-2,2×106 кл/мл трансфицировали с помощью линейного полиэтиленимина (ПЭИ «MAX», компания «Polysciences»). Соотношение ДНК/ПЭИ составляло 1:3/1:10. Через 9 дней после трансфекции культуральную жидкость отделяли от клеток фильтрацией через глубинный фильтр с размером пор 0,5/0,22 мкм.
Антиген hCSF1R-Fc_llama из культуральной жидкости выделяли и очищали, используя колонку с сорбентом для аффинной хроматографии с Protein A (ЗАО Биокад). Осветленную культуральную жидкость пропускали через колонку объемом 20 мл, уравновешенную фосфатно-солевым буфером (ФСБ, pH 7,4). Затем колонку промывали 5 колоночными объемами ФСБ, чтобы вымыть неспецифически связывающие компоненты. Связанный антиген элюировали, используя 0,1 М глициновый буфер рН 2.5. Главный протеиновый пик элюции собирали и доводили его рН до нейтральности с помощью 1 М буфера Tris (рН 7,5). Далее белок переводили в ФСБ (pH 7,4) с помощью диализа и добавляли 1мМ DTT, фильтровали через Millex GP 0,22 мкм, переносили в пробирки и хранили при -70°С.
В осветленную культуральную жидкость с антигенами CSF1R-Avi, hCSF1R_His и 00_RhAG_000_04_6His (Macaca mulatta CSF1R) добавляли 0,5 M Imidazole и 0,1 M NiCl2 до содержания 0,02 M Imidazole и 0,001 M NiCl2. Затем культуральную жидкость пропускали через колонку Ni Sepharose High Performance объемом 10 мл (GE Healthcare), уравновешенную фосфатно-солевым буфером с добавлением 10 мМ имидазола (ФСБ, pH 7,4). Затем колонку промывали 5 колоночными объемами ФСБ с добавлением 10 мМ имидазола, чтобы вымыть неспецифически связывающие компоненты. Связанный антиген элюировали, используя ФСБ с добавлением 500 мМ имидазола (pH 7,4). Далее белок переводили в ФСБ с помощью диализа и добавляли 1мМ DTT. После этого белок наносили на гель-фильтрационную колонку HiLoad 16/600 Superdex 75 pg (GE Healthcare), предварительно уравновешенную ФСБ с добавлением 1мМ DTT. Белок элюировали ФСБ с добавлением 1мМ DTT, фильтровали через Millex GP 0,22 мкм, переносили в пробирки и хранили при -70°С.
Электрофорез антигенов проводили в денатурирующем 10% полиакриламидном геле в нередуцирующих условиях без добавления меркаптоэтанола и в редуцирующих условиях c добавлением меркаптоэтанола.
Пример 3. Создание наивной фаговой Fab-библиотеки человеческих антител MeganLibTM
Суммарную РНК В-лимфоцитов из индивидуальных образцов крови более тысячи человеческих доноров выделяли с помощью набора RNeasy Mini Kit согласно предлагаемому протоколу (от QIAGEN). Концентрацию РНК определяли с помощью набора Nanovue (от GE Healthcare) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле.
Реакцию обратной транскрипции проводили с использованием набора MMLV RT kit (от Evrogen) согласно рекомендуемому протоколу с использованием обратной транскриптазы MMuLV и рандом-гексамерных олигонуклеотидов в качестве затравки.
Продукты обратной транскрипции использовали в качестве матрицы в двухступенчатой полимеразной цепной реакции для получения генов вариабельных доменов, фланкированных сайтами рестрикции, с использованием набора олигонуклеотидов по протоколам авторов [J Biol Chem. 1999 Jun 25; 274(26): 18218-30].
Полученный ДНК препарат VL-CK-VH (фиг. 1) обрабатывали эндонуклеазами рестрикции NheI/Eco91I и лигировали в оригинальную фагмиду pH5. Продукты лигирования трансформировали в электрокомпетентные клетки штамма SS320 E. сoli, приготовленные согласно протоколам [Methods Enzymol. 2000;328: 333-63.]. Репертуар комбинаторной фаговой Fab-дисплейной библиотеки MeganLibTM составлял 1011 трансформантов. Препараты фага Fab-библиотек готовили согласно процедуре, описанной ранее [J Mol Biol. 1991 Dec 5;222(3): 581-97].
Пример 4. Создание иммуных Fab, scFv, VHH-библиотек гибридных лама-человеческих антител (CHARM)
Суммарную РНК В-лимфоцитов из индивидуальных образцов крови иммунизированных рекомбинантными CSF-1R антигенами Lama Glama, которые продемонстрировали максимальный специфический титр сыворотки, выделяли с помощью набора KingFisher Pure RNA Tissue Kit, Cat. 98040196, согласно предлагаемому протоколу (от Thermo Scientific). Концентрацию РНК определяли с помощью спектрофотометра DropSence 96 (Trinean) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле.
Реакцию обратной транскрипции проводили с использованием набора GoScript Reverse Transcriptase, Promega, A5001 (от Promega) согласно рекомендуемому протоколу с использованием обратной транскриптазы и рандом-гексамерных олигонуклеотидов в качестве затравки.
Продукты обратной транскрипции использовали в качестве матрицы в двухступенчатой полимеразной цепной реакции для получения генов вариабельных доменов, фланкированных сайтами рестрикции, с использованием набора олигонуклеотидов по протоколам авторов [J Biol Chem. 1999 Jun 25; 274(26): 18218-30].
Полученный ДНК препарат VL-CK-VH (фиг. 1) или VH-(G4S)3-VL (фиг. 2) обрабатывали эндонуклеазами рестрикции NheI/SalI; NcoI/NotI и лигировали в оригинальную фагмиду pH6 или фагмиду pscK1. Продукты лигирования трансформировали в электрокомпетентные клетки штамма SS320, приготовленные согласно протоколам [Methods Enzymol. 2000;328: 333-63.]. Репертуар комбинаторных фаговых Fab, scFv, VHH-дисплейной библиотек составляли 109 трансформантов. Препараты фага Fab, scFv, VHH-библиотек готовили согласно процедуре, описанной ранее [J Mol Biol. 1991 Dec 5;222(3): 581-97]. Суммарная таблица препаратов иммунных библиотек приведена в таблице 1.
Таблица 1 - Комбинаторные библиотеки различных форматов антиген-связывающих участков после иммунизации
Пример 5. Селекция библиотек фаговых антител
Специфичные фаговые антитела человека против CSF-1R получали из комбинаторных фаговой Fab-дисплейной библиотеки MeganLibTM и иммунных CHARM библиотек, описанных в примерах 3 и 4. Селекцию проводили на CSF-1R человека методом фагового дисплея [Nat Biotechnol. 1996 Mar;14(3):309-14; J Mol Biol.1991 Dec 5;222(3): 581-97], но с использованием магнитных частиц и прибора KingFisher Flex, так как использование данной методики позволяет проводить параллельно до 96 различных схем и вариантов.
Человеческий биотинилированный антиген CSF-1R (Fc, Avi-His) направленно иммобилизовали на поверхность стрептавидиновых магнитных частиц (streptavidin magnetic beads, NEB) в концентрации для человеческой фаговой библиотеки: 10 мкг/мл для первого раунда, 5 мкг/мл для второго, 0,5 и 0,2 мкг/мл для третьего и четвертого, соответственно; для иммуных библиотек: 5 мкг/мл для первого раунда, 1 мкг/мл для второго, 0,2 для третьего раунда. Антиген инкубировали с частицами в течение 1 часа при комнатной температуре на ротаторе. Далее частицы отмывали ФСБ (pH 7,4) и блокировали поверхность частиц раствором 2% обезжиренного молока или 1% БСА на ФСБ (pH 7,4) в течение 1 часа. Человеческую фаговую библиотеку MeganLibTM разводили в концентрации 2*1013 фаговых частиц на мл, иммуные CHARM библиотеки разводили в концентрации 2*1012 фаговых частиц на мл в ФСБ (pH 7,4) с 2% обезжиренным молоком и нецелевым антигеном с тагом целевого антигена и преселектировали с магнитными частицами, не содержащими антиген на поверхности, для удаления неспецифически связывающихся фагов. CSF-1R-покрытые магнитные частицы затем были инкубированы с библиотеками в течение 1-2 часов при комнатной температуре.
Несвязавшиеся фаги удаляли в ходе нескольких отмывок магнитных частиц раствором ФСБ (pH 7,4) с 0,1% Твин 20. Количество отмывок увеличивали от раунда к раунду (на 1-м раунде 10 отмывки, на 2-м - 15 и на 3-м - 20, на 4-м - 25). Фаги, связавшиеся с антигеном на поверхности магнитных частиц, элюировали с частиц 100 мM раствором Gly-HCl (pH 2,2) в течение 15 мин при перемешивании, после элюции нейтрализовали раствор 1M Tris-HCl (pH 7,6). Бактерии штамма Е. coli TG1 инфицировали фагами, нарабатывали в культуре, и использовали их в следующем раунде селекции. После трех-четырех раундов из культуры Е. coli TG1 выделяли фагмидную ДНК согласно стандартному протоколу производителя (Qiagen). Обогащение библиотеки на целевые антигены и оценку присутствия неспецифически связывающихся фаговых частиц проводили при помощи иммуноферментного анализа поликлонального фага (ИФА).
Пример 6. Иммунноферментный анализ поликлонального фага на специфические и неспецифические антигены
Для проведения ИФА на высокосорбционные плашки (Greiner-Bio) иммобилизовали целевой антиген CSF-1R-Fc и нецелевой с Fc-фьюжн белком. Белок добавляли в концентрации 1 и 5 мкг/мл соответственно, в 0,1 M NaHCO3 (pH 9,0) и титровали с шагом 2 до 7 разведения, после чего, герметично закрытые плашки инкубировали в течение ночи при +4°С. Все последующие этапы проводили по стандартному ИФА протоколу с использованием высокопроизводительной автоматизированной платформы на базе роботизированной системы Tecan Freedom EVO 200 (от Tecan). Для блокирования неспецифического связывания в лунки планшетов добавляли блокирующий буфер 2% обезжиренное молоко или 1% БСА на ФСБ (pH 7,4). Планшеты инкубировали в течение часа при комнатной температуре. После отмывок фосфатно-солевым буфером, содержащим Твин-20 (ФСБТ), добавляли по 50 мкл на лунку тестируемого поликлонального фага. После промывания добавляли (50 мкл/лунку) анти-M13 HRP-конъюгированного вторичного антитела (от Pierce-Thermo Scientific) в соотношении 1:7500 в ФСТБ. После инкубации 50 минут при комнатной температуре планшеты отмывали ФСТБ три раза. Колориметрический сигнал развивали добавлением субстратного раствора (Н2О2-0,02% и ТМБ в CH3COONa рН5,5) на 10 минут, затем реакцию останавливали добавлением 1% серной кислоты (20 мкл). Цветовой сигнал измеряли при длине волны 450 нм, используя подходящий планшет-ридер Tecan-Sunrise (от Tecan).
После третьего и четвертого раунда селекции на целевом антигене проведенный ИФА анализ препарата поликлонального фага показал значительное обогащение. Для реклонирования и дальнейшего скрининга отобрали библиотеки, у которых наблюдали превышение сигнала более чем в 5 раз на минимальном разведении фаговых библиотек на негомологичные контрольные антигены.
Пример 7. Реклонирование генов вариабельных доменов антител в экспрессионную плазмиду
Реклонирование генов вариабельных доменов антител в экспрессионную плазмиду pLL (фиг. 3) или pET22 (фиг. 4) из фагмидного вектора после успешных раундов селекции осуществляли по стандартному протоколу с применением рестриктазно лигазного метода.
В последующем экспрессионные вектора содержащие фрагменты антител, трансформировали в штамм E. coli BL21-Gold для проведения сравнительного анализа аффинности вариабельных фрагментов антител из дисплейных библиотек к антигену методом ИФА с использованием технологической платформы Mabnext Flow Chart.
Пример 8. Отбор высокоаффинных клонов из постселекционных библиотек, специфически связывающих CSF-1R человека
Наработку Fab проводили по стандартной методике: бактериальные клетки E. coli BL21-Gold трансформировали экспрессионными векторами, содержащими гены Fab, а последующее добавление индуктора запускало транскрипцию lac-оперона, что при культивировании полученных трансформантов вызывало экспрессию Fab, которые экспортировались в периплазматическое пространство клеток. Далее проводили ИФА для проверки связывания Fab с иммобилизованным на подложке антигеном CSF-1R-Fc_lama в концентрации 0,2 мкг/мл на планшетах (medium binding от Greiner bio one) в 0,1 M NaHCO3 (pH 9,0) (антиген иммобилизовали в течение ночи при 4°С). Все последующие этапы проводили при комнатной температуре по стандартному протоколу ИФА с использованием высокопроизводительной автоматизированной платформы на базе роботизированных систем Genetix Qpix2xt (от Molecular Device) и Tecan Freedom EVO 200 (от Tecan). После каждого этапа проводили отмывку 300 мкл на лунку 1х ФСБТ в трех повторностях. Проводили блокирования неспецифических участков связывания на планшете 1% обезжиренным молоком в 1x ФСБТ, после отмывки добавляли аналит, в качестве которого выступали супернатанты клеток E. coli в обьеме 60 мкл на лунку. Детекция иммунных комплексов осуществляли при помощи козьих анти-Fab антител коньгированных с пероксидазой (от Pierce-ThermoScientific) в разведении 1:7500. Окрашивание субстрат-хромогенной смеси проводили добавлением субстратного раствора (Н2О2-0,02% и ТМБ в CH3COONa (рН5.5)) в объёме 50 мкл на 15 минут. Остановку реакции осуществляли 25 мкл H2SO4 1%. Цветовой сигнал измеряли при длине волны 450 нм, используя подходящий планшет-ридер Tecan-Sunrise (от Tecan). Степень связывания антитела была пропорциональна продуцированию цветового сигнала. Клоны, у которых цветовой сигнал превышал сигнал от контрольного антитела, проверяли в ИФА на неспецифическое связывание.
Пример 9. Анализ неспецифического связывания отобранных Fab с другими антигенами
ИФА использовали также для анализа неспецифического связывания исследуемых Fab-фрагментов с другими антигенами. Исследование проводили, как описано выше, но в качестве антигенов для иммобилизации использовали IL6R-Fc, PCSK9-VG-FE в 0,1 M NaHCO3 (pH 9,0) (антиген иммобилизовали в течение ночи при 4°С). В качестве контроля специфического связывания использовали CSF-1R-Fc_lama, CSF-1R-his (антиген иммобилизовали в течение ночи при 4°С). Все последующие этапы проводили по стандартному протоколу ИФА с использованием высокопроизводительной автоматизированной платформы на базе роботизированных систем Genetix Qpix2xt (от Molecular Device) и Tecan Freedom EVO 200 (от Tecan). Клоны, у которых цветовой сигнал неспецифического связывания не превышал сигнал контроля, проверяли в конкурентном ИФА анализе для выявления Fab, блокирующих взаимодействие лиганда и рецептора.
Пример 10. Отбор Fab фрагментов по скорости диссоциации на ForteBio
Off-rate скрининг проводили с использованием прибора Pall Forte Bio Octet Red 384. Анти-FABCH1-биосенсоры в течение 30 минут регидратировали в рабочем буфере, содержащем 10 мМ ФСБ (рH 7,2-7,4), 0,1% Твин-20, 0,1% БСА. В исследуемые образцы супернатантов E. coli добавляли рабочий буфер до конечной концентрации 10%. Затем анти-FABCH1-биосенсоры погружали в супернатанты E. coli, содержащие Fab-фрагменты кандидатов антител, на 12 часов при 4°С. Сенсоры с иммобилизованными на поверхности Fab - фрагментами переносили в лунки с рабочим буфером, где прописывали базовую линию (60 с). Далее сенсоры переносили в лунки с раствором аналита (CSF-1R-his, 30 мкг/мл) для ассоциации комплекса антиген-антитело (300 с). Затем сенсоры возвращали в лунки, содержащие рабочий буфер, для последующей стадии диссоциации (600 с). После каждого эксперимента использованные сенсоры регенерировали путем трехкратного помещения их в буфер для регенерации (10 мМ Gly-HCl, рH 1,7) после чего использовали в следующем эксперименте. Анализ полученных кривых проводили с помощью программного обеспечения Octet Data Analysis (версия 9.0) согласно стандартной процедуре по модели взаимодействия 1:1 Local.
В результате анализа были отобраны следующие Fab-фрагменты, которые в дальнейшем использовались для создания полноразмерных антител (таблица 2).
Таблица 2 - Константы скорости диссоциации Fab-фрагментов при взаимодействии с антигеном человека CSF-1R-his
Пример 11. Получение генетических конструкций для синтеза полноразмерных антител
Клонирование проводили по стандартной методике. Нарабатывали ПЦР-продукты, содержащие гены вариабельных доменов тяжелой и легкой цепей антител с праймерами, содержащими сайты рестрикции. Вариабельный домен тяжелой цепи клонировали в вектор pEE-HCLALA IgG1 по сайтам рестрикции Sal1/Nhe1. Вариабельный домен легкой цепи клонировали в вектор pEE-CK по сайтам рестрикции Sal1/BsiW1. Полученные генетические конструкции передали на транзиентную наработку белков в клеточной линии CHO-T.
Пример 12. Получение полноразмерных антител
Полноразмерные антитела продуцировали в клетках постоянной клеточной линии, полученной из клеток яичника китайского хомячка (линия CHO-T) с помощью транзиентной трансфекции на роботизированной станции Beckman NX в двух повторностях. Суспензионное культивирование осуществляли в биореакторах TubeSpin 50 на орбитальном шейкере, с использованием бессывороточных сред производства компании HyCell TransFx-C с добавлением 8 мМ L-Glutamine и 1 г/л Pluronic 68. Для транзиентной экспрессии клетки в концентрации 2-2,2×106 кл/мл трансфицировали с помощью линейного полиэтиленимина (например, ПЭИ «MAX», компания «Polysciences»). Соотношение ДНК/ПЭИ составляло 1:3/1:10. На 10 день культивирования клеточную суспензию центрифугировали при 2000g в течение 15 минут и фильтровали через фильтр с размером пор 0,22 мкм.
Антитела очищали путем аффинной хроматографии на колонках PreDictor RoboColumn MabSelect SuRe 200 (GE Healthcare) с помощью роботизированной станции Beckman FX. Колонку уравновешивали буфером 50 mM NaPB, 150 mM NaCl (рН 7,5), наносили фильтрованную культуральную жидкость с антителами, затем колонку промывали 8 объемами буфера 50 mM NaPB, 150 mM NaCl и 4 объемами 50 mM NaPB (рН 7,5). Элюцию белка проводили раствором 50 mM NaPB, 100 mM NaCl (pH 3) за 6 объемов колонок. Полученные образцы нейтрализовали 25 мкл 1M фосфатным буфером (pH 8).
Для контроля чистоты кандидатов использовали электрофорез в полиакриламидном геле и эксклюзионную ВЭЖХ. Электрофорез проводили в полиакриламидном геле 7,5% в денатурирующих нередуцирующих условиях. Определение чистоты белка проводили по интенсивности окрашивания бенда при нагрузке белка на дорожку 10 мкг. Электрофореграммы представлены на фиг. 5 и фиг. 6. Эксклюзионную ВЭЖХ проводили на колонке Tosoh TSK-Gel G3000SWXL в подвижной фазе 0,05M NaH2PO4, 0,3 M NaCl pH=7,0.
Пример 13. Определение аффинности полноразмерных кандидатов к CSF-1R человека на Forte Bio Octert RED 384
Эксперименты по исследованию аффинности связывания антител к антигену c Avi-hCSF1R человека проводили на приборе Forte Bio Octert RED 384. Антитела в концентрации 30 мкг/мл иммобилизуются на поверхности ProteinA-биосенсоров (ForteBio). Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры c иммобилизованными антителами погружали в лунки с раствором c Avi-hCSF1R в концентрации 10 мкг/мл, где происходит ассоциация комплекса в течение 300 секунд. Затем детектируется диссоциация комплекса в буферном растворе в течение 600 секунд.
Кривые связывания с вычетом референсного сигнала анализируется с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global.
Анализируемые анти-CSF-1R антитела специфически связываются с антигеном человека (таблица 3).
Таблица 3 - Кинетические константы кандидатов (01-011 - 01-019) при взаимодействии с антигеном avi-hCSF1R человека
Пример 14. Анализ взаимодействий полноразмерных кандидатов с CSF-1R макаки резус и мыши на приборе Forte Bio Octet RED 384
Эксперименты по исследованию аффинности связывания антител к антигену c 00_RhAG_000_04_6His (Macaca mulatta CSF-1R) проводили на приборе Forte Bio Octert RED 384. Антитела в концентрации 30 мкг/мл иммобилизуются на поверхности ProteinA-биосенсоров (ForteBio). Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры c иммобилизованными антителами погружали в лунки с раствором c 00_RhAG_000_04_6His (Macaca mulatta CSF-1R) в концентрации 10 мкг/мл, где происходит ассоциация комплекса в течение 300 секунд. Затем детектируется диссоциация комплекса в буферном растворе в течение 600 секунд.
Кривые связывания с вычетом референсного сигнала анализируется с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global.
Анти-CSF-1R антитела специфически связываются с антигеном макаки.
Таблица 4 - Кинетические константы кандидатов (01-011 - 01-019) при взаимодействии с антигеном 00_RhAG_000_04_6His (Macaca mulatta CSF-1R)
Аналогичным образом измерялась аффинность к антигену CSF-1R мыши. Было показано, что никто из кандидатов не взаимодействует с CSF-1R мыши.
Пример 15. Определение эпитопной специфичности антител к антигенам на приборе Forte Bio Octet RED 384
Антиген человека CSF-1R-his в концентрации 15 мкг/мл иммобилизуется на поверхности anti-penta-his-биосенсоров (ForteBio). Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры погружали в лунки с раствором антител Mab1 в концентрации 60 мкг/мл где происходит ассоциация комплекса. Затем, после насыщения антигена антителом Mab1 сенсоры погружали в раствор с конкурирующими образцами Mab2 в концентрации 15 мкг/мл для определения конкурентности с Mab1.
В случае если Mab2 взаимодействует с антигеном при полном насыщении антителами Mab 1, мы считаем, что антитело Mab2 не конкурирует с Mab1 за связывание с антигеном. В противном случае - если Mab2 не взаимодействует с антигеном при полном насыщении антителами Mab1, мы считаем, что Mab2 конкурирует с Mab1 за связывание с антигеном.
В ходе анализа выявлено, что кандидаты распределены в 5 групп по эпитопной специфичности, все из которых не конкурируют с контрольным антителом Cabiralizumab (таблица 5).
Таблица 5 - Распределение кандидатов по группам в ходе эпитопного бинннига
Пример 16. Пролиферативный тест на клеточной линии TF1-CSF-1R на фоне лиганда M-CSF
Анализ способности ингибировать CSF-зависимую пролиферацию для anti-CSF-1R антител проводили на клеточной линии TF1 (эритролейкемия костного мозга), стабильно экспрессирующей человеческий рецептор CSF-1R (TF1-human CSF-1R, ЗАО «Биокад).
В день анализа проводили подготовку anti-CSF-1R антител-кандидатов. Разводили указанные антитела до концентрации 100 мкг/мл в среде следующего состава: RPMI-1640, 2mM L-глутамина, 0.5% FBS. Вносили по 25 мкл/лунку подготовленных разведений в культуальные планшеты (Costar, 3599).
В среде того же состава проводили разведение M-CSF (Peprotech) до концентрации 50 нг/мл. Вносили 25 мкл подготовленного раствора в лунки культурального планшета. Подготавливали клеточную суспензию TF1-human CSF-1R с концентрацией 4×105 кл/мл, тщательно ресуспендировали и вносили по 50 мкл клеточной суспензии в культуральные планшеты. Планшеты перемешивали на орбитальном шейкере и инкубировали с СО2-инкубаторе 72 часа.
По истечении срока инкубации вносили витальный краситель Alamar blue (Invitrogen™) и дополнительно инкубировали в СО2-инкубаторе до развития градиентной окраски. Проводили измерение уровня флуоресценции с использованием Infinite M200Pro (Tecan).
Оценивали отношение уровня флуоресценции для анализируемых образцов (RFU AT) к уровню флуоресценции контроля действия M-CSF (M-CSFctrl). Результаты анализа кандидатов приведены в таблице 6.
Таблица 6 - Анализ способности anti-CSF-1R антител ингибировать СSF-зависимую пролиферацию
Пример 17. Анализ способности anti-CSF-1R антител ингибировать IL-34-зависимую пролиферацию
Анализ способности ингибировать IL-34-зависимую пролиферацию для anti-CSF-1R антител проводили на клеточной линии TF1 (эритролейкемия костного мозга), стабильно экспрессирующей человеческий рецептор CSF-1R (TF1-human CSF-1R, ЗАО «Биокад).
В день анализа проводили подготовку anti-CSF-1R антител-кандидатов. Подготавливали титровки указанных антител от концентрации 300 мкг/мл в среде следующего состава: RPMI-1640, 2mM L-глутамина, 0.5% FBS. Вносили по 25 мкл/лунку подготовленных разведений в культуральные планшеты (Costar, 3599).
В среде того же состава проводили разведение IL-34 (Peprotech) до концентрации 3 мкг/мл. Вносили 25 мкл подготовленного раствора в лунки культурального планшета. Подготавливали клеточную суспензию TF1-human CSF-1R с концентрацией 4×105 кл/мл, тщательно ресуспендировали и вносили по 50 мкл клеточной суспензии в культуральные планшеты. Планшеты перемешивали на орбитальном шейкере и инкубировали с СО2-инкубаторе 72 часа.
По истечении срока инкубации вносили витальный краситель Alamar blue (Invitrogen™) и дополнительной инкубировали в СО2-инкубаторе до развития градиентной окраски. Проводили измерение уровня флуоресценции с использованием Infinite M200Pro (Tecan), оценивали активность anti-CSF-1R антител.
Кандидат 01-016 проявляет способность ингибировать IL-34-зависимую пролиферацию клеточной линии TF1-human CSF-1R. Кривые доза-эффект представлены на фиг. 7.
Пример 18. Оценка влияния anti-CSF-1R антител на пролиферативную активность моноцитов в присутствии M-CSF
Оценку ингибирования M-CSF-зависимой пролиферации моноцитов проводили, с использованием выделенной из PBMC с помощью позитивной селекции на магнитных шариках CD14+ популяции (CD14 MicroBeads, human, 130-050-201 MACS). Выделение проводили согласно инструкции производителя.
После выделения CD14+ популяции проводили подсчет выделенных моноцитов в камере Горяева. Подготавливали клеточную суспензию 1×106 кл/мл в RPMI-1640, 25 mM HEPES, 2mM L-глутамина. Вносили по 50 мкл клеточной суспензии во внутренние лунки белых культуральных планшетов (Corning, 3610). Инкубировали 1,5-2 часа планшеты с клеточной суспензией в СО2-инкубаторе.
Подготавливали разведения кандидата 01-016 в RPMI-1640, 25 mM HEPES, 2mM L-глутамина, 5% FBS от концентрации 200 мкг/мл с шагом титровки 3.
По окончании времени инкубации аккуратно отбирали среду, и вносили раствор лиганда M-CSF 200 нг/мл (Peprotech), подготовленный в среде того же состава, что и растворы кандидата 01-016. Лиганд вносили из расчёта 50 мкл/лунку. В те же лунки культурального планшета вносили заранее подготовленные разведения кандидата 01-016 из расчёта 50 мкл/лунку. Планшеты перемешивали на орбитальном шейкере и инкубировали в СО2-инкубаторе в течение 6 дней.
По окончании времени инкубации проводили детекцию с помощью наборов CellTiter-Glo® Luminescent Cell Viability Assay (Promega, дозозависимые кривые представлены на фиг. 8) и Apo-ONE® Homogeneous Caspase-3/7 Assay (Promega, дозозависимые кривые представлены на фиг. 9) согласно инструкции производителя. Проводили измерение уровня люминесценции с использованием Infinite M200Pro (Tecan), оценивали активность anti-CSF-1R антител.
Полученные данные свидетельствуют о том, что кандидат 01-016 проявляет проапоптотическую активность.
Пример 19. Оценка влияния anti-CSF-1R антител на дифференцировку моноцитов по M2- пути
В эксперименте оценивали уровень экспрессии поверхностных маркеров CD80 и CD163 на моноцитах, дифференцированных с использованием факторов M-CSF и IL10 (дифференцировка по M2-типу). Выделение моноцитов проводили аналогично процедуре, описанной в Примере 18.
Подготавливали клеточную суспензию моноцитов 1×106 кл/лунку в RPMI-1640, 25 mM HEPES, 2mM L-глутамин, 5% FBS. Разносили клеточную суспензию в 24-луночный планшет (Corning, 3524) в объеме 1 мл/лунку. Инкубировали 1,5-2 часа планшеты с клеточной суспензией в СО2-инкубаторе.
После инкубации вносили раствор с лунки культурального планшета по 1 мл раствора M-CSF 200 нг/мл (Peprotech) и растворы 1 мкг/мл кандидата 01-016, подготовленные в среде того же состава, что и клеточная суспензия. В случае контроля дифференцировки моноцитов по M1-пути вместо M-CSF вносили раствор GM-CSF аналогичной концентрации. Планшет инкубировали СО2-инкубаторе в течение 6 дней.
По истечении времени инкубации отбирали супернатант из лунок и вносили раствор IL-10, 10 нг/мл (Peprotech). В лунки с контролями дифференцировки по типу M1 вносили раствор липополисахарида (LPS) и интерферона γ с концентрацией каждого из компонентов 40 нг/мл. Дополнительно инкубировали в течение 2-х дней планшеты в СО2-инкубаторе.
По окончании инкубации проводили цитометрический анализ с определением уровня экспрессии маркеров CD80 и СD163. Оценка уровня экспрессии CD163 в присутствии кандидата 01-016 приведена на фиг. 10.
Полученные данные свидетельствуют о том, кандидат 01-016 вызывает снижение экспрессии маркеров характерных для M2-макрофагов и появление выраженной CD163-негативной популяции.
Пример 20. Гуманизация лидерного кандидата, отобранного из иммунной библиотеки
Для гуманизации лидерного кандидата 01-016 были использованы алгоритмы программного комплекса YLab разработки компании BIOCAD. На первом этапе была оценена схожесть V-сегмента вариабельного домена тяжелой цепи с гермлайн-последовательностями human и исходного семейства камелидов - llama glama, vicugna pacos и camelus dromedarius (последовательности взяты из базы генов IMGT, imgt.org). Вариабельный домен легкой цепи не оценивался, поскольку в селекции участвовала библиотека байндеров, в состав которых входили полностью человеческие легкие цепи. Блажайшим VH-сегментом из vicugna pacos оказался IGHV3-1*01, схожесть составила 91,8%. Ближайшим VH-сегментом из human оказался IGHV3-23*01, схожесть составила 87,6%.
Для гуманизации вариабельного домена тяжелой цепи были отобраны позиции, содержащие наименее характерные для человеческих антител аминокислотные остатки. В схеме нумерации Kabat их значения: 1, 5, 6, 11, 26, 74, 77, 83, 84 и 89. От начала аминокислотной последовательности они имеют номера 1, 5, 6, 11, 26, 75, 78, 87, 88 и 93.
Все вышеуказанные позиции не затрагивают CDRs лидерного кандидата (HCDR1 c аминокислотной последовательностью DYAMS (SEQ ID NO: 1), HCDR2 c аминокислотной последовательностью AISWNGGSTNYADSVKG (SEQ ID NO: 2), HCDR3 c аминокислотной последовательностью TVEVAHRRLYKYLEV (SEQ ID NO: 3)). На основе наиболее часто встречающихся аминокислотных остатков в данных позициях в условиях окружающей их последовательности были предложены возможные мутации, повышающие как схожесть с VH-сегментами гермлайнов людей, так и матурированных человеческих антител. Оценка таких позиций делалась на основе данных NGS библиотеки здоровых доноров, полученной в BIOCAD в 2014 году (MegaNLib, секвенирование проведено с помощью Illumina MiSeq). Все варианты обладали схожестью с VH-сегментами гермлайн-последовательностей людей не менее 90,7%. Также во всех случаях схожесть с человеческими последовательностями была выше, чем с другими биологическими видами.
Пример 21. Получение гуманизированных антител
Гуманизированные нуклеотидные последовательности HCVR и LCVR были синтезированы de novo и клонированы в вектора pSXn-HCLALA-PR, pSXn-CK-BR, формат IgG1 по сайтам рестрикции SalI/NheI и SalI/BsiWI, соответственно.
Степени гуманизации вариабельных доменов тяжелых и легких цепей антител представлены в таблице 7.
Таблица 7 - Сравнение степени гуманизации вариабельных доменов
Векторы, содержащие нуклеиновые кислоты, кодирующие легкую и тяжелую цепи антитела, нарабатывали в клетках E.coli и очищали при помощи набора реактивов для очистки плазмидной ДНК производства фирмы Qiagen.
Пример 22. Создание стабильной клеточной линии, продукция и очистка анти-CSF-1R гуманизированных антител
Стабильные пулы продуцентов моноклональных антител 01-016, OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05 получали путем трансфекции методом электропорации с использованием прибора 4D Nucleofector (Lonza) согласно протоколу производителя. В качестве родительской линии использовалась суспензионная клеточная линия CHO-S. Трансфекция родительской линии осуществлялась генетическими конструкциями, которые содержат гены, кодирующие легкие и тяжелые цепи антитела и устойчивость к антибиотикам.
Протрансфицированную родительскую линию культивировали на среде S.3.87 MM (синтетическая среда, разработанная в ЗАО «БИОКАД» без содержания FBS) с добавлением 6 mM L-Glutamine. Через 48 часов после трансфекции и до закладки клеток в банк в среду добавлялись антибиотики Puromycin dihydrochloride (Sigma) с концентрацией 9,6 мкг/мл и Blasticidin S HCl (Gibco) с концентрацией 5,12 мкг/мл.
Полученные в результате селекции стабильные пулы заложены в банк для дальнейшего клонирования с целью получения моноклональной клеточной линии.
После разморозки стабильные пулы культивировали на среде S.3.87 MM (синтетическая среда, разработанная в ЗАО «БИОКАД» без содержания FBS) с добавлением 6 mM L-Glutamine и 12% Boost 4. На 11 день культивирования клеточную суспензию отделяли от клеток фильтрацией через глубинный фильтр с размером пор 0,5/0,22 мкм.
Антитела с Fc 01-016, OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05 выделяли и очищали путем аффинной хроматографии на бактериальном белке Protein A, вирусной инактивации и последующей очистки на сорбентах SP Sepharose HP и Capto Adhere. Далее 01-016, OPTIM-6_001-02, OPTIM-6_001-04 переводили в 20 мМ гистидиновый буфер с добавлением 100 мМ трегалозы (pH 5,5), OPTIM-6_001-05 в 20 мМ ацетатный буфер (pH 5,0) с добавлением 100 мМ трегалозы с помощью диализа, фильтровали (0,22 мкм), переносили в пробирки и хранили при -70°С.
Электрофорез проводили в денатурирующих нередуцирующих условиях в полиакриламидном геле 7,5% (фиг. 11-14) и в денатурирующих редуцирующих условиях в полиакриламидном геле 12% (фиг. 15-18). Определение чистоты белка проводили по интенсивности окрашивания бенда при нагрузке белка на дорожку 40 мкг. Эксклюзионную ВЭЖХ проводили на колонке Tosoh TSK-Gel G3000SWXL в подвижной фазе 0,05M NaH2PO4, 0,3 M NaCl pH=7,0.
Пример 23. Определение аффинности полноразмерных антител на Forte Bio Octert RED 384
Эксперименты по исследованию аффинности связывания антител к антигену c Avi-hCSF-1R человека проводили на приборе Forte Bio Octert RED 384. Антитела в концентрации 30 мкг/мл иммобилизуются на поверхности ProteinA-биосенсоров (ForteBio). Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры c иммобилизованными антителами погружали в лунки с растворами c Avi-hCSF-1R в разных концентрациях, где происходит ассоциация комплекса в течение 300 секунд. Затем детектируется диссоциация комплекса в буферном растворе в течение 600 секунд. Концентрация антигена варьировалась от 5 мкг/мл до 78 нг/мл.
Кривые связывания с вычетом референсного сигнала анализируется с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global.
Анти-CSF-1R антитела специфически связываются с антигеном человека.
Таблица 8 - Кинетические константы гуманизированных кандидатов при взаимодействии с антигеном avi-hCSF-1R человека
Пример 24. Анализ взаимодействий с рецепторами макаки резус на приборе Forte Bio Octet RED 384
Эксперименты по исследованию аффинности связывания антител к антигену c 00_RhAG_000_04_6His (Macaca mulatta CSF-1R) проводили на приборе Forte Bio Octert RED 384. Антитела в концентрации 30 мкг/мл иммобилизуются на поверхности ProteinA-биосенсоров (ForteBio). Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры c иммобилизованными антителами погружали в лунки с раствором c 00_RhAG_000_04_6His (Macaca mulatta CSF-1R) в разных концентрациях, где происходит ассоциация комплекса в течение 300 секунд. Затем детектируется диссоциация комплекса в буферном растворе в течение 600 секунд.
Концентрация антигена варьировалась от 5 мкг/мл до 78 нг/мл.
Кривые связывания с вычетом референсного сигнала анализируется с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global.
Анти-CSF-1R антитела специфически связываются с антигеном макаки.
Таблица 9 - Кинетические константы гуманизированных кандидатов при взаимодействии с антигеном 00_RhAG_000_04_6His (Macaca mulatta CSF-1R)
Аффинность данных кандидатов к антигену CSF-1R мыши измерялась аналогичным образом как в примере 14. Было подтверждено, что гуманизированные кандидаты не взаимодействуют с антигенами CSF-1R мыши.
Пример 25. Определение коллоидной и термической стабильности по точке агрегации белка методом динамического светорассеяния
Для определения температуры агрегации исследуемых образцов методом динамического светорассеяния (DLS) получали зависимость размера частиц в среде от температуры с помощью прибора DynaPro® Plate Reader II (Wyatt Technology Corp.) при постепенном нагревании от 25 до 80°С. Результаты представлены в таблице 10.
Таблица 10 - Точка агрегации 01-016, OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05
pH=5.5
Tre 100 мг/мл
pH=5.5
Tre 100 мг/мл
pH=5.5
Tre 100 мг/мл
pH=5.0
Tre 100 мг/мл
Можно заключить, что молекулы 01-016, OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05 имеют высокую термоколлоидную стабильность (точка агрегации в 20mM Acetate, pH=5,0 и 20мМ His, pH=5,5 буферных растворах составляет более 60,0°С).
Пример 26. Определение термической стабильности при термострессе 50°С
Исследуемые образцы устанавливали в воздушный термостат и термостатировали при 50°С в течение 72 часов. После окончания прогрева интактные и стрессировнные образцы передавали на анализ методом эксклюзионной ВЭЖХ (SEC HPLC) с УФ-детектором. Хроматографию проводили на системе ВЭЖХ Agilent 1100 на колонке Tosoh TSK-Gel G3000SWXL, детектирование проводили при длине волны 220 нм и 280 нм.
Результирующие данные стабильности для 01-016, OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05 при инкубировании при 50°С представлены в таблице 11.
Общий вывод: образцы обладают высокой коллоидной и термической стабильностью.
Таблица 11 - Зависимость содержания мономера по эксклюзивной ВЭЖХ для кандидатов
pH=5.5
Tre 100 мг/мл
pH=5.5
Tre 100 мг/мл
pH=5.5
Tre 100 мг/мл
pH=5.0
Tre 100 мг/мл
* Δ - разница чистоты стрессированного образца и чистоты интактного образца (входного контроля), %.
Пример 27. Пролиферативный тест на клеточной линии TF1-CSF-1R на фоне лиганда M-CSF
Полученные после гуманизации кандидата 01-016 антитела-кандидаты (OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05), наработанные в стабильном пуле, так же были проанализированы в тесте, описанном в примере 16, в сравнении с 01-016 до гуманизации. Результаты оценки приведены в таблице 12. Полученные данные свидетельствуют о том, что гуманизация значительно не повлияла на способности anti-CSF-1R антител ингибировать СSF-зависимую пролиферацию.
Таблица 12 - Оценка влияния гуманизации кандидата 01-016 на способность ингибировать CSF-зависимую пролиферацию
Пример 28. Пролиферативный тест на клеточной линии TF1-CSF-1R на фоне лиганда IL34
Полученные после гуманизации кандидата 01-016 антитела-кандидаты (OPTIM-6_001-02, OPTIM-6_001-04, OPTIM-6_001-05), наработанные в стабильном пуле, так же были проанализированы в тесте, описанном в примере 17, в сравнении с 01-016 до гуманизации. Результаты оценки приведены в таблице 13. Полученные данные свидетельствуют о том, что гуманизация значительно не повлияла на способности anti-CSF-1R антител ингибировать IL-34-зависимую пролиферацию активность.
Таблица 13 - Оценка влияние гуманизации кандидата 01-016 на способность ингибировать IL-34-зависимую пролиферацию
Пример 29. Конструирование библиотеки мутантных антител, специфичных к CSF-1R (человека)
Для создания мутантных антител, специфичных к CSF-1R (человека), был проведен структурный анализ на основе 3D моделирования с использованием программного пакета Schrödinger Suites 2020-2 компании Schrödinger и модели CSF-1R (PDB 4WRM с использованием 4DKD, 4LIQ, 4WRL). На основе 3D структуры смоделированного комплекса были проведены все возможные точечные замены аминокислот в зоне контакта с CSF-1R, за исключением цистеина, пролина и глицина в качестве исходных аминокислот и мутаций. Полученные мутанты с сохранением или повышением аффинности антитела и стабильности комплекса были ранжированы и на основе лучших замен сформированы мутанты, каждый из которых содержал не более 3 замен в каждом СDR. На следующем этапе из полученного набора структур была сформирована библиотека, включающая варианты, в которых замены привели к увеличению стабильности комплекса и к увеличению аффинности антитела.
Библиотека вариантов HCDR регионов (разметка Kabat), полученная по протоколу, описанному выше, включает 1, 19 и 14 вариантов для HCDR1 (SEQ ID NO: 17), HCDR2 (SEQ ID NO: 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36) и HCDR3 (SEQ ID NO: 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50) соответственно.
Библиотека CDR-регионов антител, полученная по протоколу, описанному выше, включает 34 последовательности. Замены представлены в 10 позициях. Количество уникальных замен составляет 26 штук. В таблице 13 представлены последовательности CDR петель тяжёлой цепи исходного кандидата, а также набор замен аминокислот, представленных в каждой из 34 мутантных последовательностей.
Таблица 14 - Последовательности вариантов HCDR регионов
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЗАО "БИОКАД"
<120> Моноклональное антитело, которое специфически связывается с CSF-1R
<160> 63
<170> BiSSAP 1.3.6
<210> 1
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR1_01
<400> 1
Asp Tyr Ala Met Ser
1 5
<210> 2
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_01
<400> 2
Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_01
<400> 3
Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 4
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> 01-016_VH
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 5
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-02_VH
<400> 5
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-04_VH
<400> 6
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-05_VH
<400> 7
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 454
<212> PRT
<213> Искусственная последовательность
<220>
<223> 01-016_HC
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 9
<211> 454
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-02_HC
<400> 9
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 10
<211> 454
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-04_HC
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 11
<211> 454
<212> PRT
<213> Искусственная последовательность
<220>
<223> OPTIM-6_001-05_HC
<400> 11
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu
100 105 110
Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 12
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_LCDR1
<400> 12
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 13
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_LCDR2
<400> 13
Gly Asp Ser Asp Arg Pro Ser
1 5
<210> 14
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_LCDR3
<400> 14
Gln Val Trp Asp Ile Ser Ser Asp His Val Val
1 5 10
<210> 15
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_VL
<400> 15
Gln Ala Gly Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Gly Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ile Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 16
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_LC
<400> 16
Gln Ala Gly Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Gly Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ile Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Gln Leu Thr Val Leu Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR1_02
<400> 17
Asp Tyr Ala Met Thr
1 5
<210> 18
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_02
<400> 18
Ala Ile Ser Trp Arg Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 19
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_03
<400> 19
Ala Ile Ser Trp Ile Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 20
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_04
<400> 20
Ala Ile Ser Trp Leu Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 21
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_05
<400> 21
Ala Ile Ser Trp Phe Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 22
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_06
<400> 22
Ala Ile Ser Trp Asn Gly Gly Glu Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 23
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_07
<400> 23
Ala Ile Ser Trp Asn Gly Gly Ile Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 24
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_08
<400> 24
Ala Ile Ser Trp Asn Gly Gly Leu Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 25
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_09
<400> 25
Ala Ile Ser Trp Asn Gly Gly Ser Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 26
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_10
<400> 26
Ala Ile Ser Trp Asn Gly Gly Ser Thr Trp Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 27
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_11
<400> 27
Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 28
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_12
<400> 28
Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr His Asp Ser Val Lys
1 5 10 15
Gly
<210> 29
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_13
<400> 29
Gln Ile Ser Trp Asn Gly Gly Ser Thr Arg Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 30
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_14
<400> 30
Gln Ile Ser Trp Leu Gly Gly Ser Thr Asn Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 31
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_15
<400> 31
His Ile Ser Trp Asn Gly Gly Ser Thr Arg Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 32
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_16
<400> 32
Gln Ile Ser Trp Asn Gly Gly Ser Thr Arg Tyr His Asp Ser Val Lys
1 5 10 15
Gly
<210> 33
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_17
<400> 33
His Ile Ser Trp Asn Gly Gly Ser Thr Arg Tyr His Asp Ser Val Lys
1 5 10 15
Gly
<210> 34
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_18
<400> 34
His Ile Ser Trp Ile Gly Gly Ser Thr Asn Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 35
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_19
<400> 35
Gln Ile Ser Trp Ile Gly Gly Ser Thr Asn Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 36
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_20
<400> 36
His Ile Ser Trp Leu Gly Gly Ser Thr Asn Tyr Gln Asp Ser Val Lys
1 5 10 15
Gly
<210> 37
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_02
<400> 37
Ile Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 38
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_03
<400> 38
Tyr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 39
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_04
<400> 39
Thr Val Glu Val Ala His Arg Arg Leu Tyr Arg Tyr Leu Glu Val
1 5 10 15
<210> 40
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_05
<400> 40
Thr Val Glu Val Ala His Arg Arg Leu Tyr Asn Tyr Leu Glu Val
1 5 10 15
<210> 41
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_06
<400> 41
Thr Val Glu Val Ala His Arg Arg Leu Tyr Gln Tyr Leu Glu Val
1 5 10 15
<210> 42
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_07
<400> 42
Thr Val Glu Val Ala His Arg Arg Leu Tyr Leu Tyr Leu Glu Val
1 5 10 15
<210> 43
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_08
<400> 43
Thr Val Glu Val Ala His Arg Arg Leu Tyr Phe Tyr Leu Glu Val
1 5 10 15
<210> 44
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_09
<400> 44
Thr Val Glu Val Ala His Arg Arg Leu Tyr Tyr Tyr Leu Glu Val
1 5 10 15
<210> 45
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_10
<400> 45
Thr Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Ile
1 5 10 15
<210> 46
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_11
<400> 46
Thr Val Glu Leu Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Ile
1 5 10 15
<210> 47
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_12
<400> 47
Thr Val Glu Phe Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Ile
1 5 10 15
<210> 48
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_13
<400> 48
Thr Val Glu Gln Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Ile
1 5 10 15
<210> 49
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_14
<400> 49
Thr Val Glu Phe Ser His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 50
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_15
<400> 50
Thr Val Glu Phe Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 51
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR1_common
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Thr или Ser
<400> 51
Asp Tyr Ala Met Xaa
1 5
<210> 52
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (1)..(1)
<223> Аминокислота в положении 1: Xaa = Ala или Gln или His
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Asn или Arg или Ile или Leu или Phe
<220>
<221> Xaa
<222> (8)..(8)
<223> Аминокислота в положении 8: Xaa = Ser или Gly или Ile или Leu
<220>
<221> Xaa
<222> (10)..(10)
<223> Аминокислота в положении 10: Xaa = Asn или Arg или Trp
<220>
<221> Xaa
<222> (12)..(12)
<223> Аминокислота в положении 12: Xaa = Ala или Gln или His
<400> 52
Xaa Ile Ser Trp Xaa Gly Gly Xaa Thr Xaa Tyr Xaa Asp Ser Val Lys
1 5 10 15
Gly
<210> 53
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_common
<220>
<221> Xaa
<222> (1)..(1)
<223> Аминокислота в положении 1: Xaa = Thr или Ile или Tyr
<220>
<221> Xaa
<222> (4)..(4)
<223> Аминокислота в положении 4: Xaa = Val или Phe
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Ala или Ser
<220>
<221> Xaa
<222> (11)..(11)
<223> Аминокислота в положении 11: Xaa = Lys или Arg или Asn или Gln или Leu или Phe или Tyr
<220>
<221> Xaa
<222> (15)..(15)
<223> Аминокислота в положении 15: Xaa = Val или Ile
<400> 53
Xaa Val Glu Xaa Xaa His Arg Arg Leu Tyr Xaa Tyr Leu Glu Xaa
1 5 10 15
<210> 54
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Arg или Ile или Leu или Phe
<400> 54
Ala Ile Ser Trp Xaa Gly Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 55
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (8)..(8)
<223> Аминокислота в положении 8: Xaa = Glu или Ile или Leu
<400> 55
Ala Ile Ser Trp Asn Gly Gly Xaa Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 56
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (10)..(10)
<223> Аминокислота в положении 10: Xaa = Arg или Trp
<400> 56
Ala Ile Ser Trp Asn Gly Gly Ser Thr Xaa Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 57
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (12)..(12)
<223> Аминокислота в положении 12: Xaa = Gln или His
<400> 57
Ala Ile Ser Trp Asn Gly Gly Ser Thr Asn Tyr Xaa Asp Ser Val Lys
1 5 10 15
Gly
<210> 58
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (1)..(1)
<223> Аминокислота в положении 1: Xaa = Gln или His
<220>
<221> Xaa
<222> (10)..(10)
<223> Аминокислота в положении 10: Xaa = Arg
<220>
<221> Xaa
<222> (12)..(12)
<223> Аминокислота в положении 12: Xaa = Gln или His
<400> 58
Xaa Ile Ser Trp Asn Gly Gly Ser Thr Xaa Tyr Xaa Asp Ser Val Lys
1 5 10 15
Gly
<210> 59
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR2_common
<220>
<221> Xaa
<222> (1)..(1)
<223> Аминокислота в положении 1: Xaa = Gln или His
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Leu или Ile
<220>
<221> Xaa
<222> (12)..(12)
<223> Аминокислота в положении 12: Xaa = Gln
<400> 59
Xaa Ile Ser Trp Xaa Gly Gly Ser Thr Asn Tyr Xaa Asp Ser Val Lys
1 5 10 15
Gly
<210> 60
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_common
<220>
<221> Xaa
<222> (1)..(1)
<223> Аминокислота в положении 1: Xaa = Ile или Tyr
<400> 60
Xaa Val Glu Val Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 61
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_common
<220>
<221> Xaa
<222> (4)..(4)
<223> Аминокислота в положении 4: Xaa = Arg или Asn или Gln или Leu или Phe или Tyr
<400> 61
Thr Val Glu Xaa Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<210> 62
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_common
<220>
<221> Xaa
<222> (4)..(4)
<223> Аминокислота в положении 4: Xaa = Gln или Leu или Phe
<220>
<221> Xaa
<222> (15)..(15)
<223> Аминокислота в положении 15: Xaa = Ile
<400> 62
Thr Val Glu Xaa Ala His Arg Arg Leu Tyr Lys Tyr Leu Glu Xaa
1 5 10 15
<210> 63
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-CSF-1R_HCDR3_common
<220>
<221> Xaa
<222> (4)..(4)
<223> Аминокислота в положении 4: Xaa = Phe
<220>
<221> Xaa
<222> (5)..(5)
<223> Аминокислота в положении 5: Xaa = Ser
<400> 63
Thr Val Glu Xaa Xaa His Arg Arg Leu Tyr Lys Tyr Leu Glu Val
1 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ GM-CSF, ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РЕВМАТОИДНОГО АРТРИТА ИЛИ В КАЧЕСТВЕ АНАЛЬГЕТИКОВ | 2014 |
|
RU2714919C2 |
| РЕЖИМ ВВЕДЕНИЯ ДОЗ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, МОДУЛИРУЕМОГО CSF-1R | 2021 |
|
RU2835316C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С IL-4Rα, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2808563C2 |
| НОВАЯ КОМБИНАЦИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2016 |
|
RU2742494C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К NAV1.7 | 2019 |
|
RU2776821C2 |
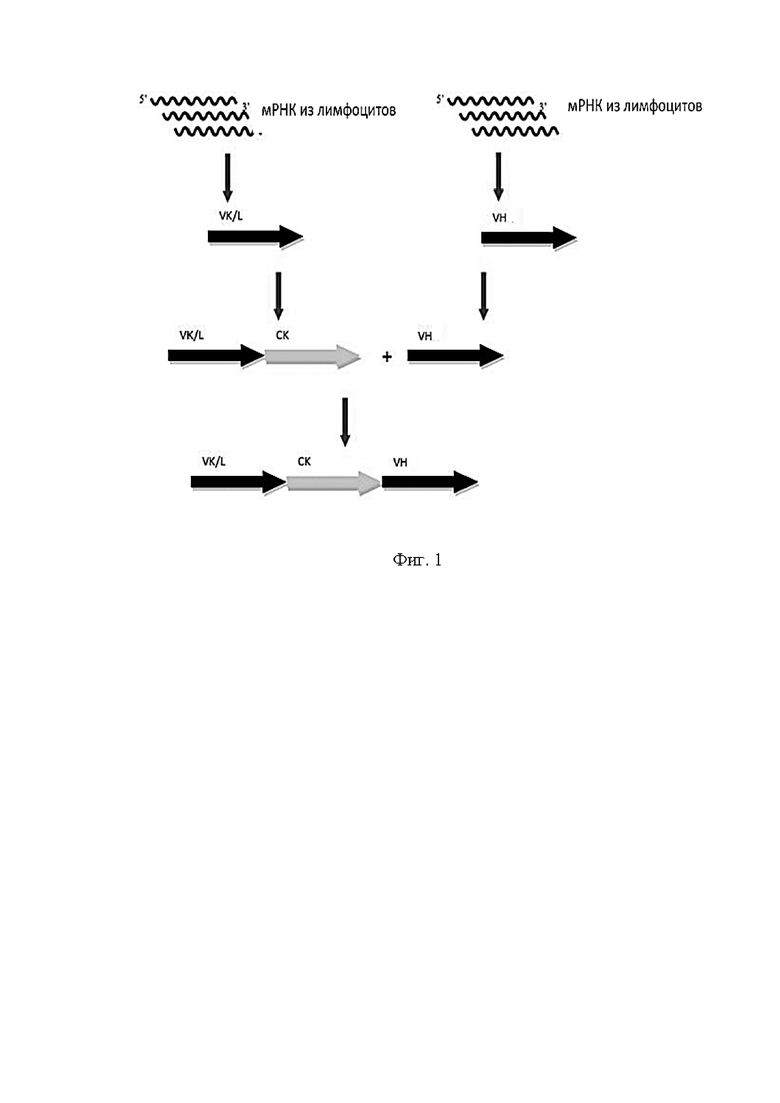
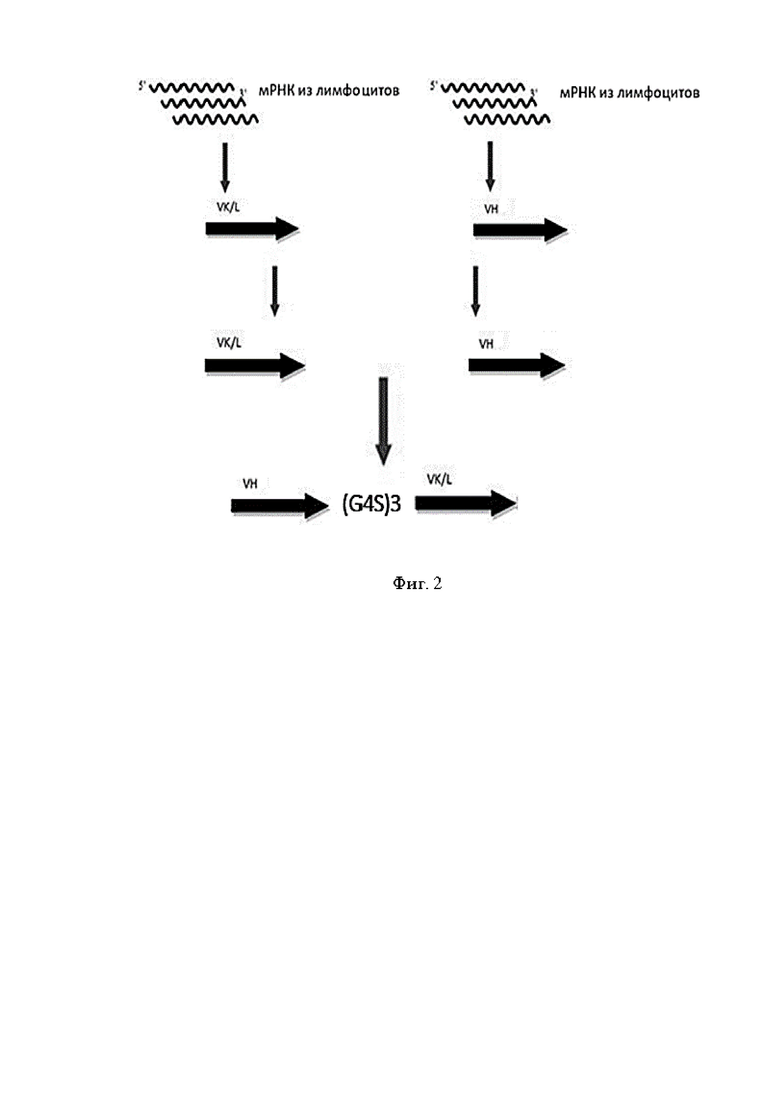
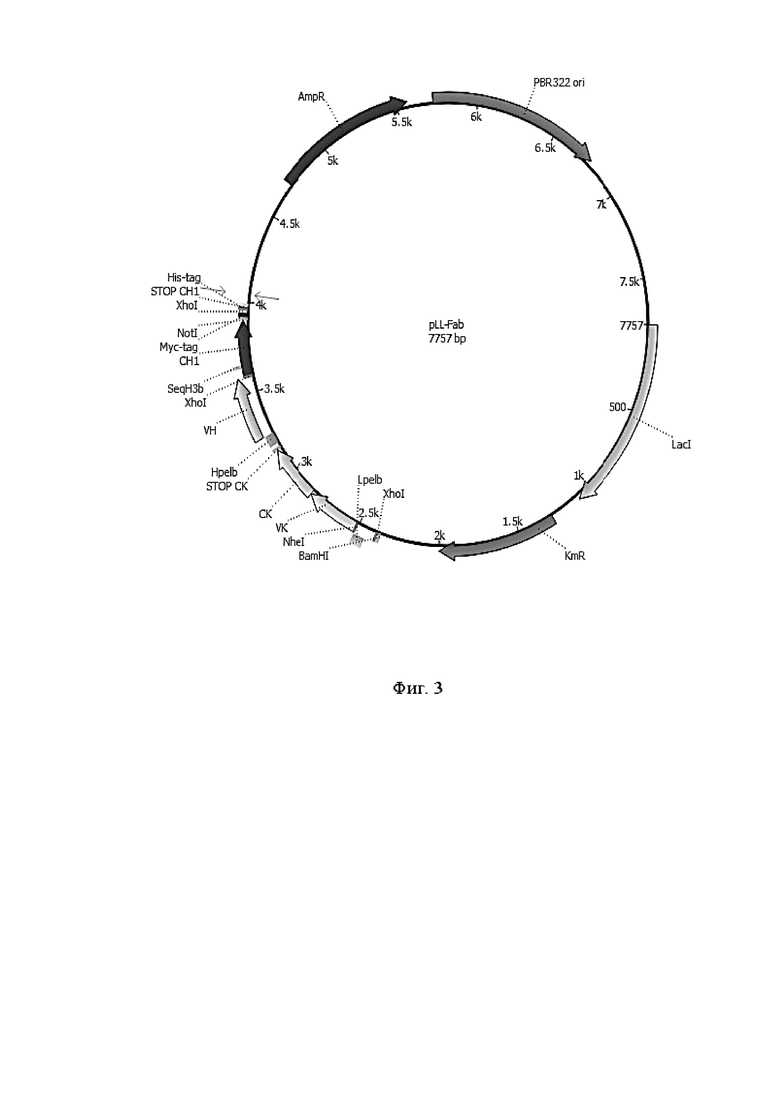
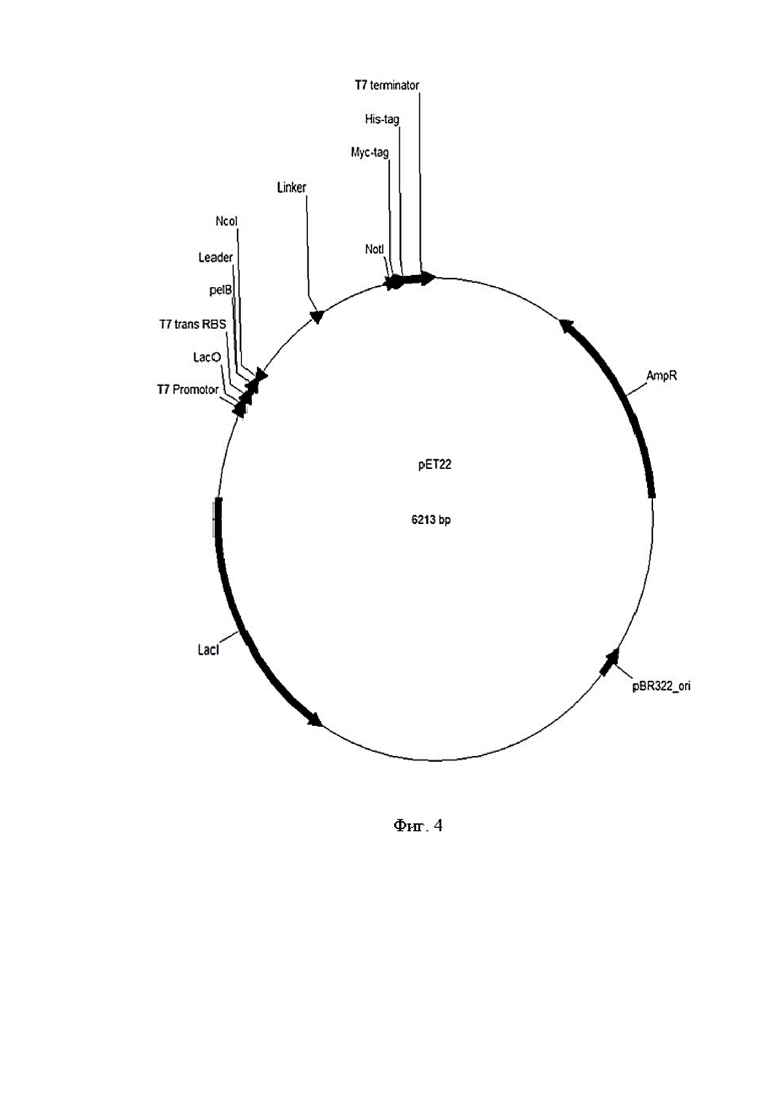
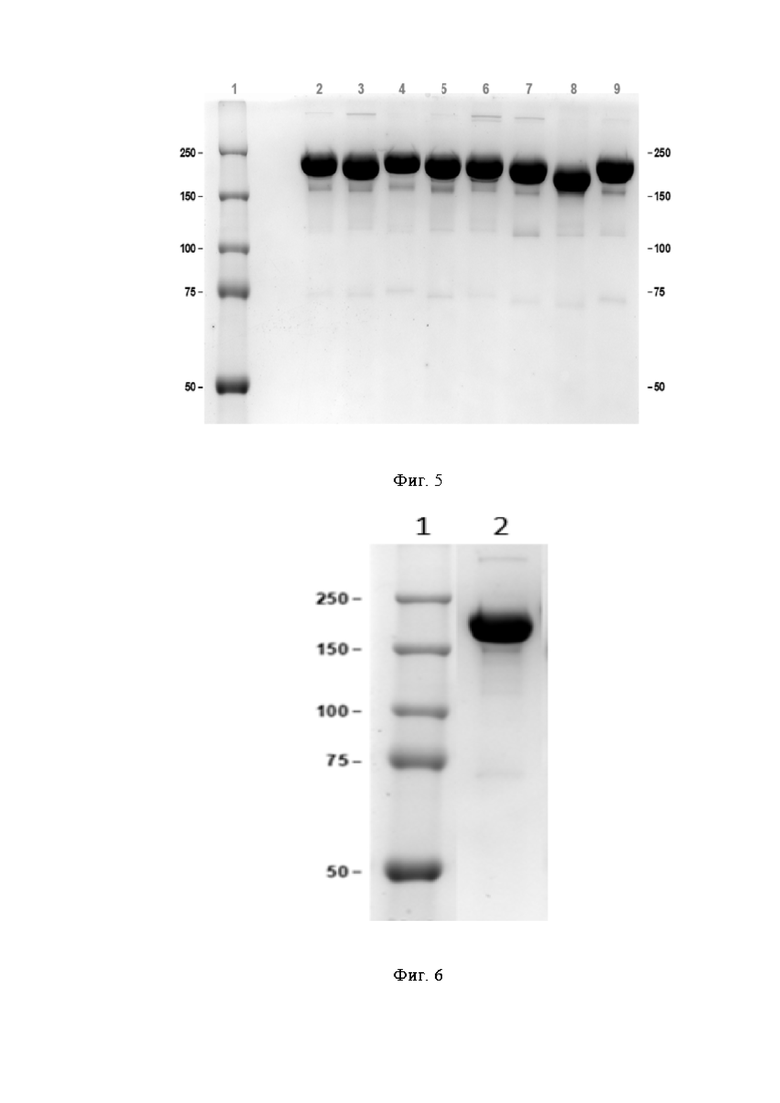
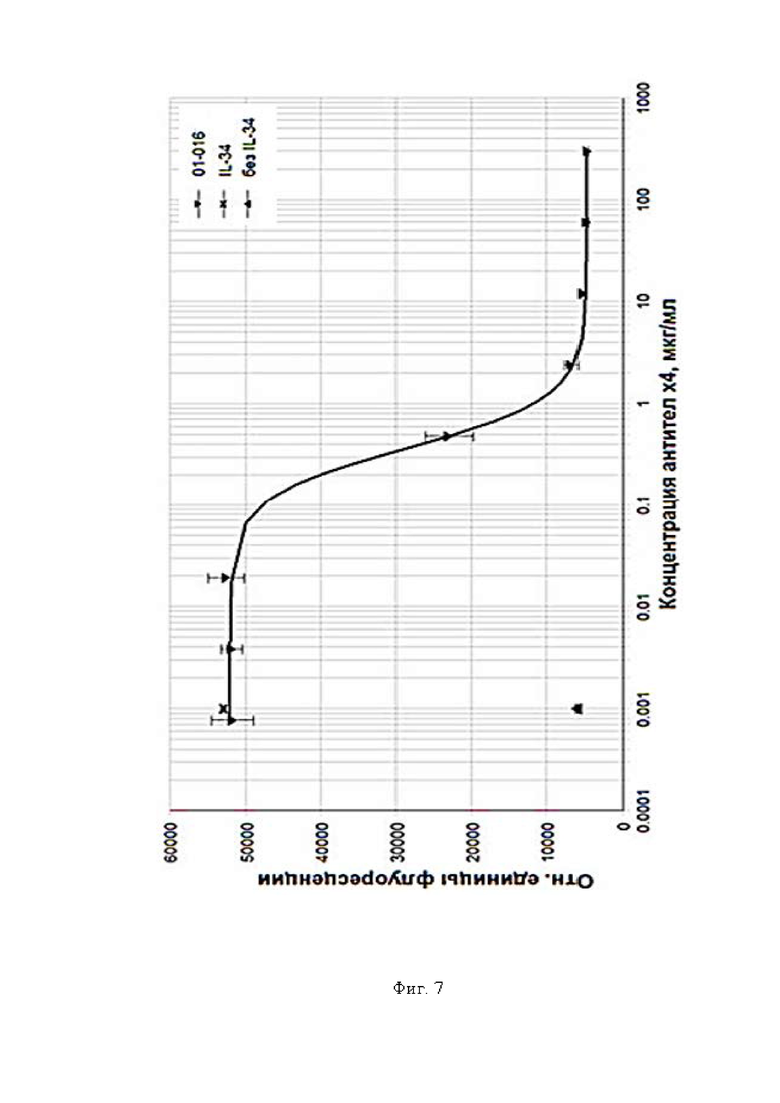
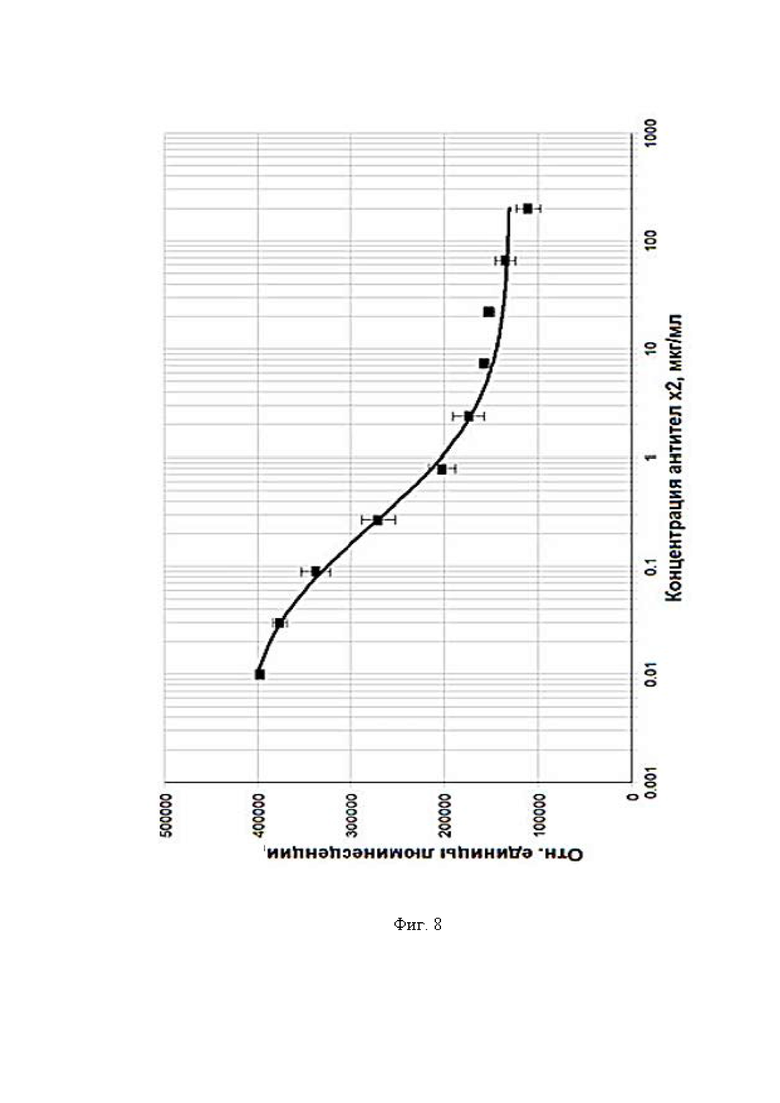
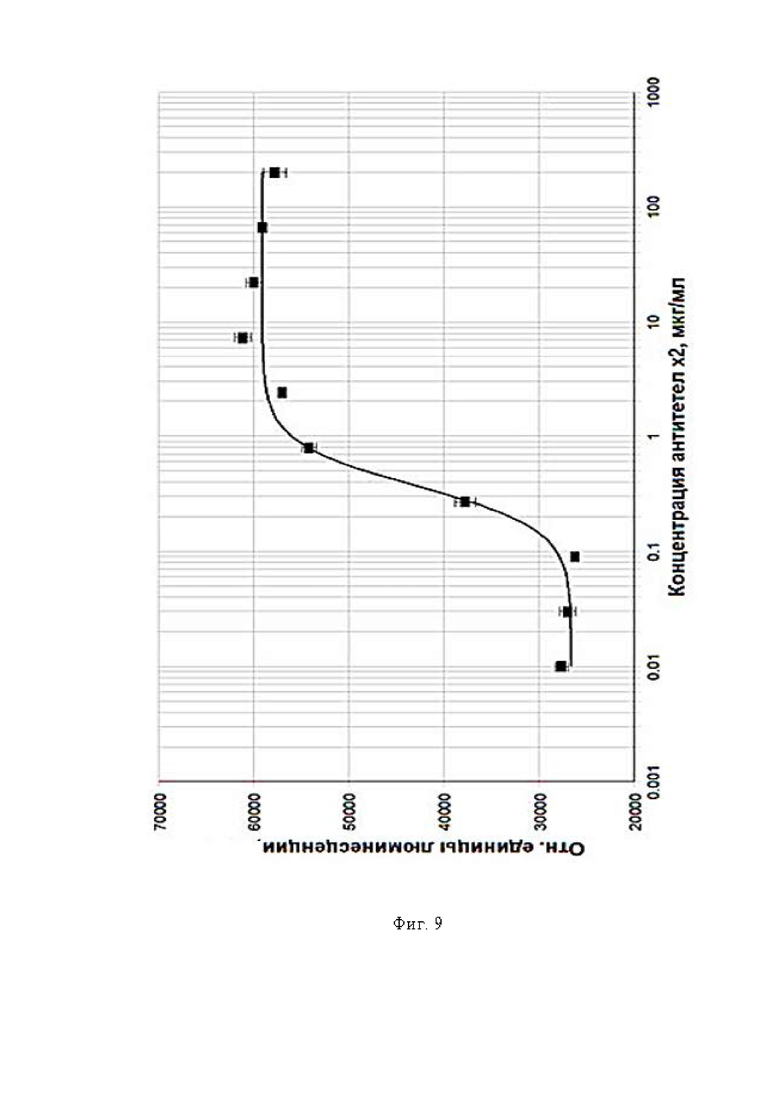
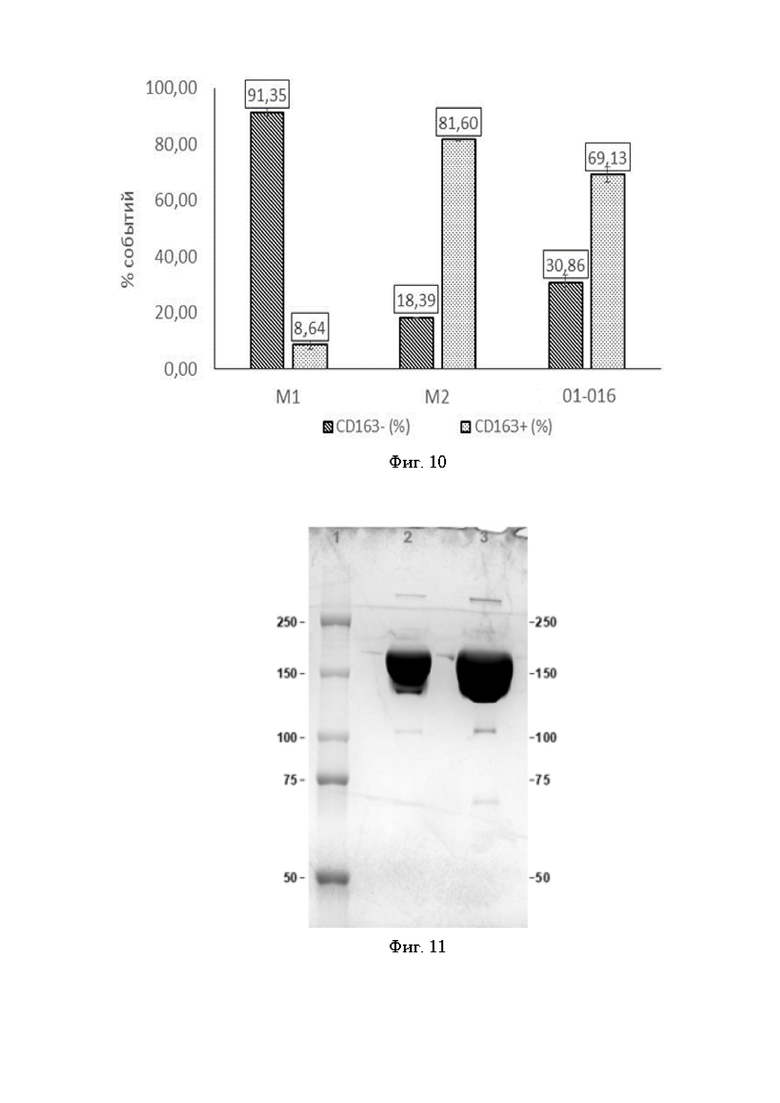
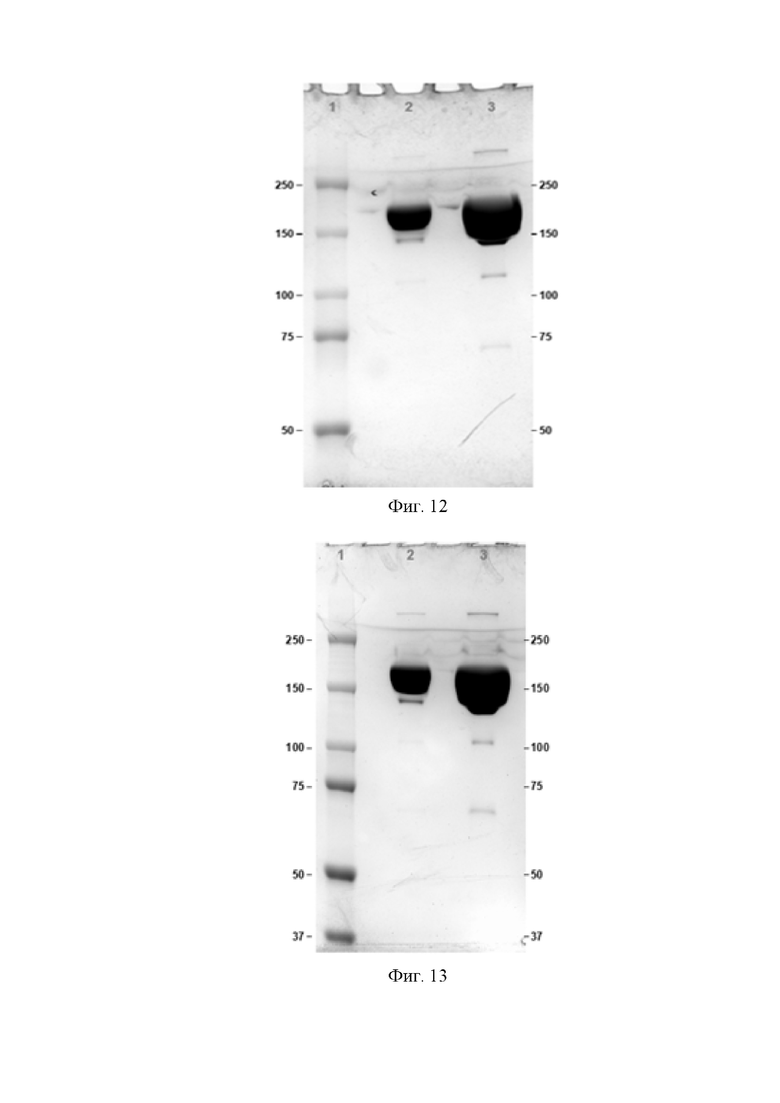
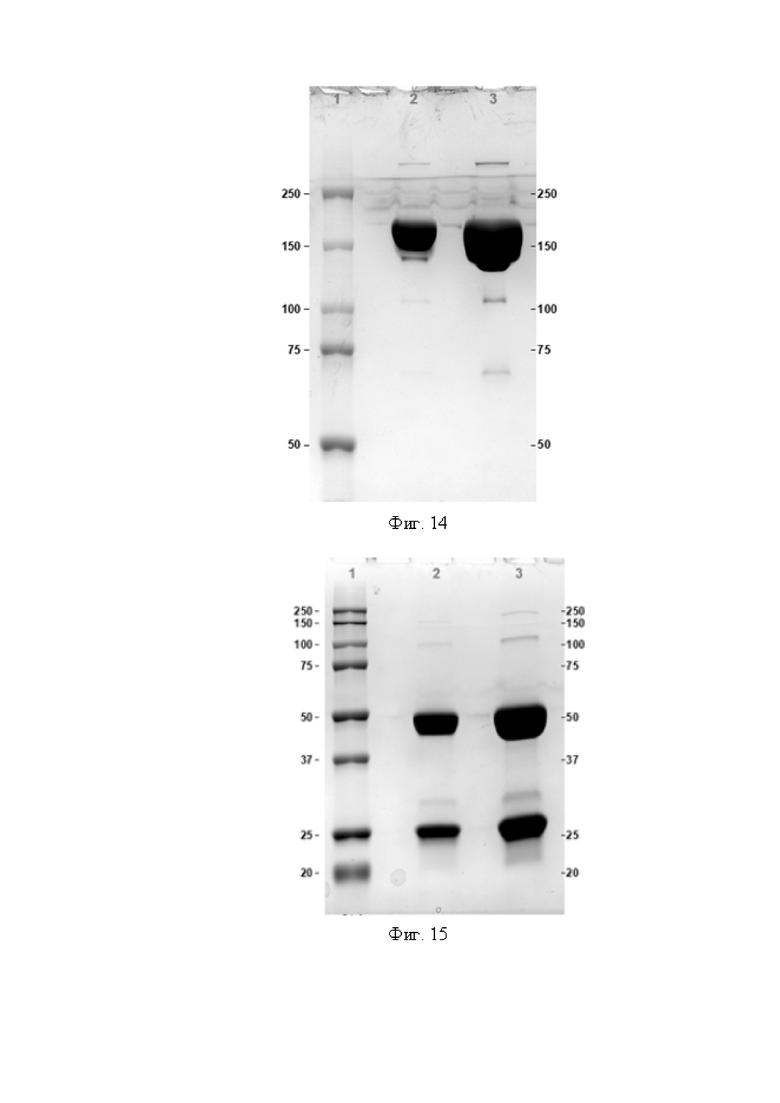
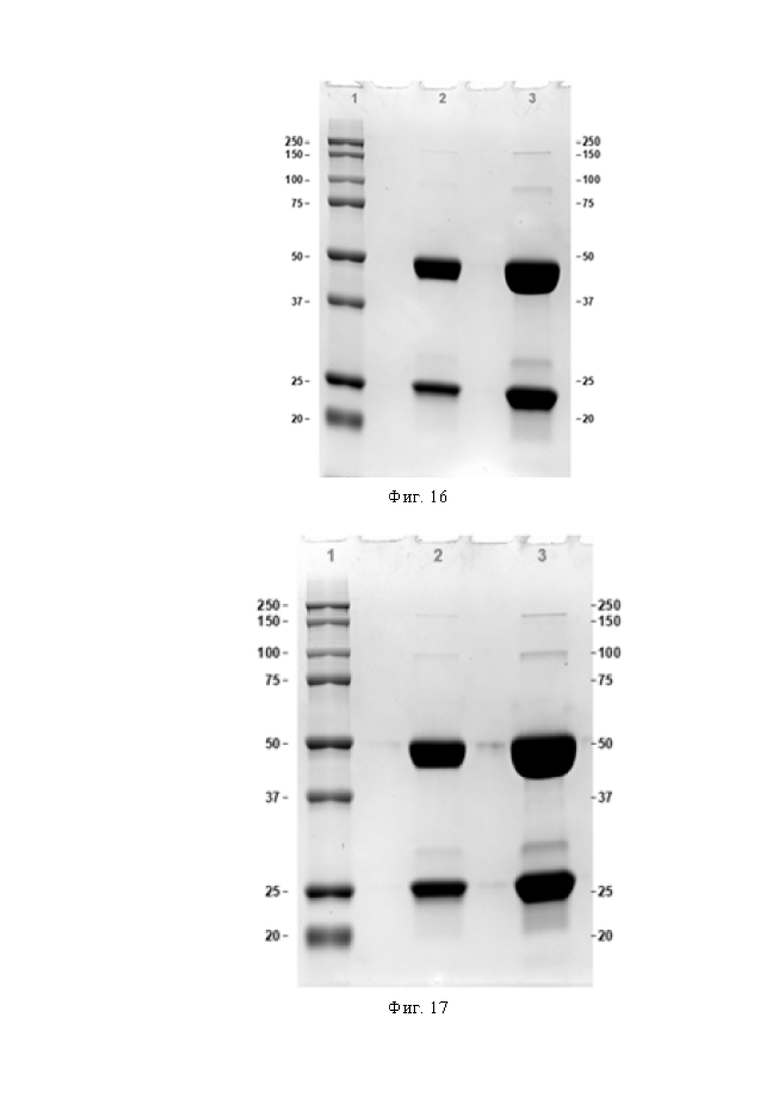
Настоящее изобретение относится к области биотехнологии и медицины, а именно к моноклональным антителам или их антигенсвязывающим фрагментам, которые специфически связываются с CSF-1R (рецептор колониестимулирующего фактора 1). Изобретение также относится к нуклеиновым кислотам, кодирующим указанные антитела, векторам экспрессии, клеткам-хозяевам и способам их получения, способам получения антител, фармацевтическим композициям, содержащим вышеуказанное антитело, фармацевтическим композициям, содержащим вышеуказанное антитело и другие терапевтически активные соединения, способам лечения заболеваний или нарушений, опосредованных CSF-1R, применениям антител или их фармацевтических композиций для лечения заболеваний или нарушений, опосредованных CSF-1R, и применениям антител и других терапевтически активных соединений для лечения заболеваний или нарушений, опосредованных CSF-1R. 13 н. и 46 з.п. ф-лы, 15 табл., 29 пр., 18 ил.
1. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент, которое специфически связывается с CSF-1R, включающее:
(a) вариабельный домен тяжелой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 1, SEQ ID NO: 17,
(ii) CDR2 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 2, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36,
(iii) CDR3 с аминокислотной последовательностью, которую выбирают из группы: SEQ ID NO: 3, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50; и
(b) вариабельный домен легкой цепи, содержащий:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 12,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 13,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 14.
2. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п.1, где вариабельный домен тяжелой цепи, содержит:
(i) CDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(ii) CDR2 с аминокислотной последовательностью SEQ ID NO: 2,
(iii) CDR3 с аминокислотной последовательностью SEQ ID NO: 3.
3. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7.
4. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 3, где вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 5.
5. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 3, где вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 6.
6. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
7. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7;
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
8. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 7, где:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 5;
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
9. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент по п. 7, где:
(а) вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 6;
(b) вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 15.
10. Выделенное моноклональное антитело по п. 1, включающее тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11.
11. Выделенное моноклональное антитело по п. 10, включающее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9.
12. Выделенное моноклональное антитело по п. 10, включающее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10.
13. Выделенное моноклональное антитело по п. 1, включающее легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
14. Выделенное моноклональное антитело по п. 1, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность, которую выбирают из группы: SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
15. Выделенное моноклональное антитело по п. 14, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
16. Выделенное моноклональное антитело по п. 14, включающее:
(a) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(b) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16.
17. Выделенное моноклональное антитело по любому из пп. 1-9, где антитело, которое специфично связывается с CSF-1R, представляет собой полноразмерное антитело IgG.
18. Выделенное моноклональное антитело по п. 17, где полноразмерное антитело IgG относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
19. Выделенное моноклональное антитело по п. 18, где полноразмерное антитело IgG относится к изотипу IgG1 человека.
20. Выделенная нуклеиновая кислота, которая кодирует антитело или его антигенсвязывающий фрагмент по любому из пп. 1-19.
21. Выделенная нуклеиновая кислота по п. 20, где нуклеиновая кислота представляет собой ДНК.
22. Экспрессионный вектор, содержащий нуклеиновую кислоту по любому из пп. 20-21.
23. Способ получения клетки-хозяина для получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19, включающий трансформирование клетки вектором по п. 22.
24. Клетка-хозяин для получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19, содержащая нуклеиновую кислоту по любому из пп. 20, 21.
25. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19, заключающийся в культивировании клетки-хозяина по п. 24 в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
26. Фармацевтическая композиция для лечения заболевания или нарушения, опосредуемого CSF-1R, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-19 в терапевтически эффективном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
27. Фармацевтическая композиция по п. 26, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
28. Фармацевтическая композиция для лечения заболевания или нарушения, опосредуемого CSF-1R, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-19 и по меньшей мере одно другое терапевтически активное соединение.
29. Фармацевтическая композиция по п. 28, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
30. Фармацевтическая композиция по любому из пп. 28, 29, где другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
31. Фармацевтическая композиция по любому из пп. 19, 20, где другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
32. Фармацевтическая композиция по п. 31, где чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
33. Фармацевтическая композиция по п. 32, где PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
34. Фармацевтическая композиция по п. 33, где антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
35. Фармацевтическая композиция по п. 32, где CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
36. Фармацевтическая композиция по п. 35, где антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
37. Способ ингибирования биологической активности CSF-1R у субъекта, нуждающегося в таком ингибировании, включающий введение субъекту эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19.
38. Способ лечения заболевания или нарушения, опосредованного CSF-1R, включающий введение субъекту, нуждающемуся в таком лечении, антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19 или фармацевтической композиции по любому из пп. 26-36 в терапевтически эффективном количестве.
39. Способ лечения заболевания или нарушения по п. 38, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
40. Способ лечения заболевания или нарушения, опосредованного CSF-1R, включающий введение субъекту, нуждающемуся в таком лечении, антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19 и меньшей мере одного другого терапевтически активного соединения.
41. Способ лечения заболевания или нарушения по п. 40, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
42. Способ лечения заболевания или нарушения по любому из пп. 40, 41, где другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
43. Способ лечения заболевания или нарушения по любому из пп. 40, 41, где другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
44. Способ лечения заболевания или нарушения по п. 43, где чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
45. Способ лечения заболевания или нарушения по п. 44, где PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
46. Способ лечения заболевания или нарушения по п. 45, где антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
47. Способ лечения заболевания или нарушения по п. 44, где CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
48. Способ лечения заболевания или нарушения по п. 47, где антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
49. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19 или фармацевтической композиции по любому из пп. 26-36 для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого CSF-1R.
50. Применение по п. 49, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
51. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-19 и по меньшей мере одного другого терапевтически активного соединения для лечения заболевания или нарушения, опосредуемого CSF-1R.
52. Применение по п. 51, где заболевание или нарушение, опосредуемое CSF-1R, выбрано из группы: метастатическая меланома, метастатический рак мочевого пузыря, метастатический немелкоклеточный рак легкого, метастатический почечно-клеточный рак (светло-клеточный тип), злокачественные новообразования с микросателлитной нестабильностью при неэффективности основной противоопухолевой терапии, местно-распространенный или метастатический плоскоклеточный рак головы и шеи, рак желудка (кардио-эзофагеальной зоны), рак яичника, рак молочной железы, трижды негативный рак молочной железы, опухоль костной ткани, лимфома Ходжкина, глиома, глиобластома, мезотелиома, миелома, рак предстательной железы, саркома мягких тканей.
53. Применение по любому из пп. 51, 52, где другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
54. Применение по любому из пп. 51, 52, где другое терапевтически активное соединение представляет собой чекпойнт-ингибитор.
55. Применение по п. 54, где чекпойнт-ингибитор выбран из PD-1-ингибитора или CTLA-4-ингибитора.
56. Применение по п. 55, где PD-1-ингибитор представляет собой антитело, которое специфически связывается с PD-1.
57. Применение по п. 56, где антитело, которое специфически связывается с PD-1, выбрано из группы: пролголимаб, пембролизумаб, ниволумаб.
58. Применение по п. 55, где CTLA-4-ингибитор представляет собой антитело, которое специфически связывается с CTLA-4.
59. Применение по п. 58, где антитело, которое специфически связывается с CTLA-4, представляет собой ипилимумаб.
| АНТИТЕЛА ПРОТИВ CSF-1R ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2617971C2 |
| WO 2020053321 A1, 19.03.2020 | |||
| US 9982055 B2, 29.05.2018 | |||
| WO 2011131407 A1, 27.10.2011 | |||
| BEIRAO B.C.B | |||
| et al., A blocking antibody against canine CSF-1R maturated by limited CDR mutagenesis, Antib Ther., 2020, Volume 3, Issue 3, pp | |||
| Приспособление для градации давления в воздухопроводе воздушных тормозов | 1921 |
|
SU193A1 |
Авторы
Даты
2021-07-12—Публикация
2020-10-28—Подача