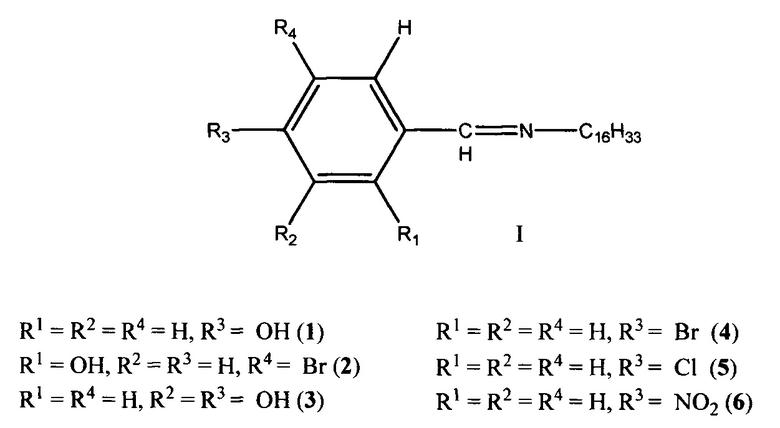
Изобретение относится к области органической химии, в частности к применению химических соединений, а именно длинноцепочечных ароматических азометинов общей формулы
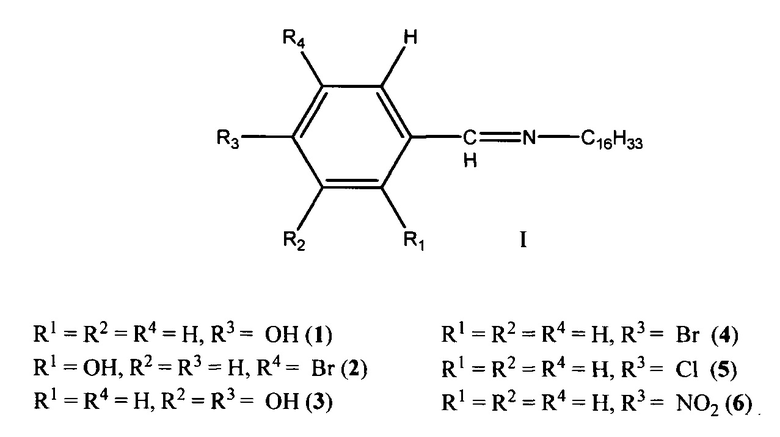
в качестве средства, обладающего одновременно высокой бактерицидной и фунгицидной активностью при низких лечебных дозах, низкой токсичностью, высокой термостойкостью, высокой проникающей способностью в ликворы организма человека и животных, которые могут найти применение в области ветеринарии, медицины и сельского хозяйства в качестве лекарственных и дезинфицирующих средств.
Известны структурные аналоги ароматических азометинов формулы I - антибактериальные нитрофурансодержащие азометины (фурациллин, фуразолидон, фурадонин, фурагин), которые эффективны в отношении грамположительных и грамотрицательных бактерий, крупных вирусов, трихомонад, лямблий и различаются по спектру лекарственного действия между собой ввиду различного химического строения [Машковский М.Д. Лекарственные средства. М., 2010, С. 849-853].
Однако все ароматические нитрофураны очень плохо растворимы в воде (например, соотношение фуразолидон:вода = 1:25000) [http://vetvrach.info/antibiotiki18.html], разрушаются при кипячении и под влиянием солнечных лучей, вследствие указанного применяются только в виде таблеток (перорально), что делает невозможным их инъекционное (парентеральное) применение при острых неотложных состояниях.
В силу изложенного, эти препараты не создают эффективных концентраций в тканях, хотя многие опасные микробы могут быть высокочувствительны к ним в эксперименте in vitro (антимикробная активность проявляется как в отношении грамположительных и грамотрицательных бактерий, так и бартонелл, кокцидий, гистомон, гексамитий, трипаносом, лептоспир, возбудителей грибковой инфекции и ряда крупных вирусов). Например, фурадонин в очень высоких концентрациях накапливается в моче, однако его концентрации в плазме крови и других ликворах невысоки, и он плохо проникает в различные ткани организма. Поэтому, например, фурадонин применяется только для лечения инфекций мочевого тракта в неосложненных случаях.
Фуразолидон эффективен по отношению к грамположительным, и особенно грамотрицательным бактериям. Препарат оказывает антимикробное действие при наличии антибиотико- и сульфаниламидо-резистентности микроорганизмов, замедляет развитие устойчивости к этим препаратам. Уже в дозе 1-5 мг на 1 кг массы животного проявляется выраженное антибактериальное действие, не уступающее действию левомицетина и хлортетрациклина. Фуразолидон активен в отношении трихомонад, трипаносом, лямблий, гистомон, кокцидий. Нейтрализует токсины сальмонелл и других возбудителей кишечных инфекций [http://vetvrach.info/antibiotiki18.html].
В настоящее время из-за длительного применения нитрофуранов, например фурациллина (синтезирован в 1847 году) в стационарах обитают штаммы бактерий, полностью устойчивые к этому препарату.
Важно отметить, что нитрофураны кумулируются (накапливаются) в органах и тканях организма и могут оказывать токсическое действие на организм в целом, поэтому они противопоказаны при почечной и печеночной недостаточности. Со стороны легких могут возникать бронхоспазмы и кашель в грудной клетке, также возможны аллергические реакции: сыпь, эозинофилия, лихорадка, артралгия, миалгия, волчаночноподобный синдром, редко - анафилактический шок.
Задачей заявленного технического решения является создание эффективных отечественных термически устойчивых до 200°С лекарственных препаратов нового поколения в ряду ароматических азометинов на основе замещенных бензальдегидов и гексадециламина, обладающих одновременно:
- широким спектром бактерицидного и одновременно фунгицидного действия на патогенную микрофлору человека и животных: Escherichia coli, Salmonella paratyphi В, Pseudomonas aeruginosa, Staphylococcus aureus, Candida Albicans;
- низкими лечебными дозами;
- относительно низкой токсичностью;
- высокой термостойкостью;
- высокой проникающей способностью в ликворы организма.
Известные на дату подачи заявленного технического решения аналоги заявленных соединений по назначению - это, например, вышеупомянутый фурациллин, к которому на сегодняшний день, ввиду длительного его применения, устойчивы большинство больничных штаммов патогенной микрофлоры человека.
Наиболее востребованными аналогами по назначению на сегодняшний день являются соли аммония - действующее вещество многих отечественных и зарубежных (Франция, Германия, Нидерланды) антимикробных препаратов, например, бензалконий хлорид (Benzalkonium chloride), представляющее собой хлорид алкилдиметил(фенилметил)аммония [Янгсон P.M. Медицинский энциклопедический словарь (Collins), М.: ACT Астрель, 2006, 1375 с.].
Бензалконий хлорид является одним из типичных представителей так называемых четвертичных аммониевых соединений. Известна [Domagk G. Eine neue Klasse von Desinfectionsmitteln // Deutsche Medizin Wissenschafter. 1935. Vol. 61. P. 829-832] антимикробная активность длинноцепочечных солей четвертичного аммония при их практическом применении в медицине: терапевтическая антисептика местных гнойно-воспалительных процессов, профилактическая антисептика неповрежденной кожи перед операциями, антисептика слизистых оболочек, консервирование глазных капель, инъекционных растворов.
Недостатком данного препарата является его низкая термическая устойчивость до 100°С, как и всех солей аммония, которые при нагревании распадаются на исходные амины и теряют свою терапевтическую активность. В связи с этим затруднена и стерилизация данных препаратов. Кроме того, все препараты, содержащие бензалконий хлорид, разрушаются мылом, о чем указано в инструкции по их применению [Бурбелло А.Т., Шабров А.В. Современные лекарственные средства. - М.: ОЛМА Медиа Групп, 2007, - С. 681].
Строение и состав полученных заявителем соединений подтверждены данными ИК-спектроскопии и элементного анализа, что отражено в примерах 1-6. Строение (молекулярная структура) одного из них (6) доказано методом рентгеноструктурного анализа (РСА) и представлено на Рис. 1. Следует обратить внимание на то, что заявленные соединения (1-6) синтезированы впервые.
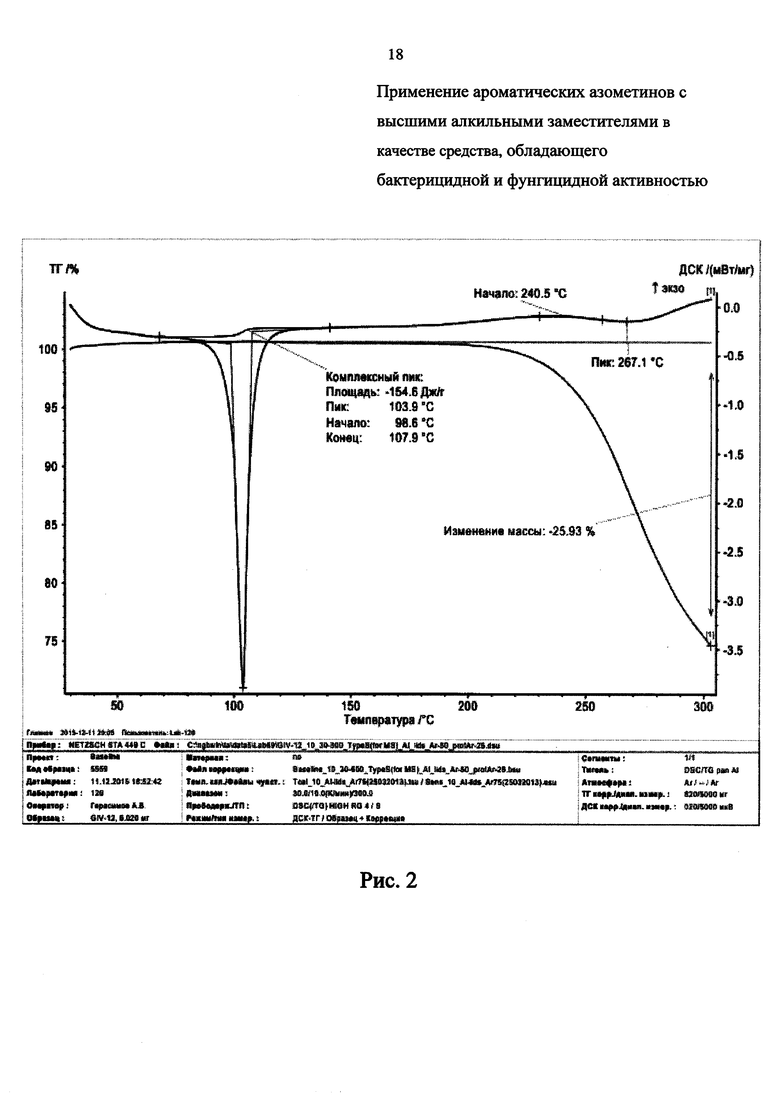
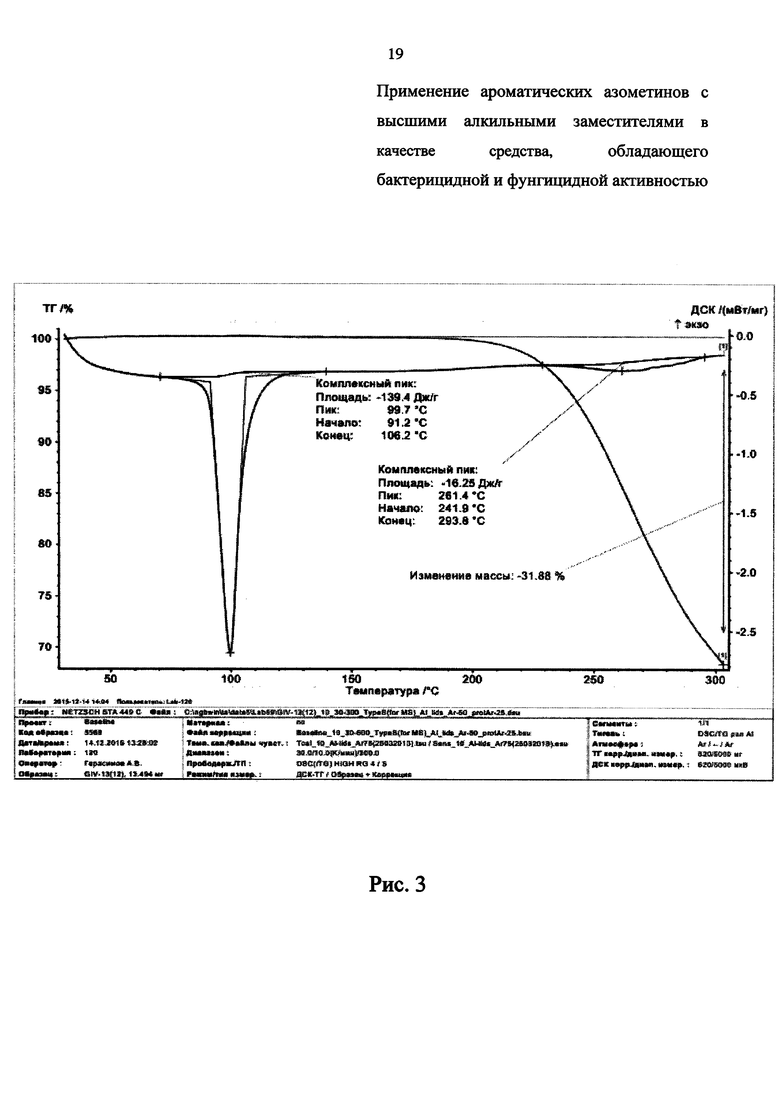
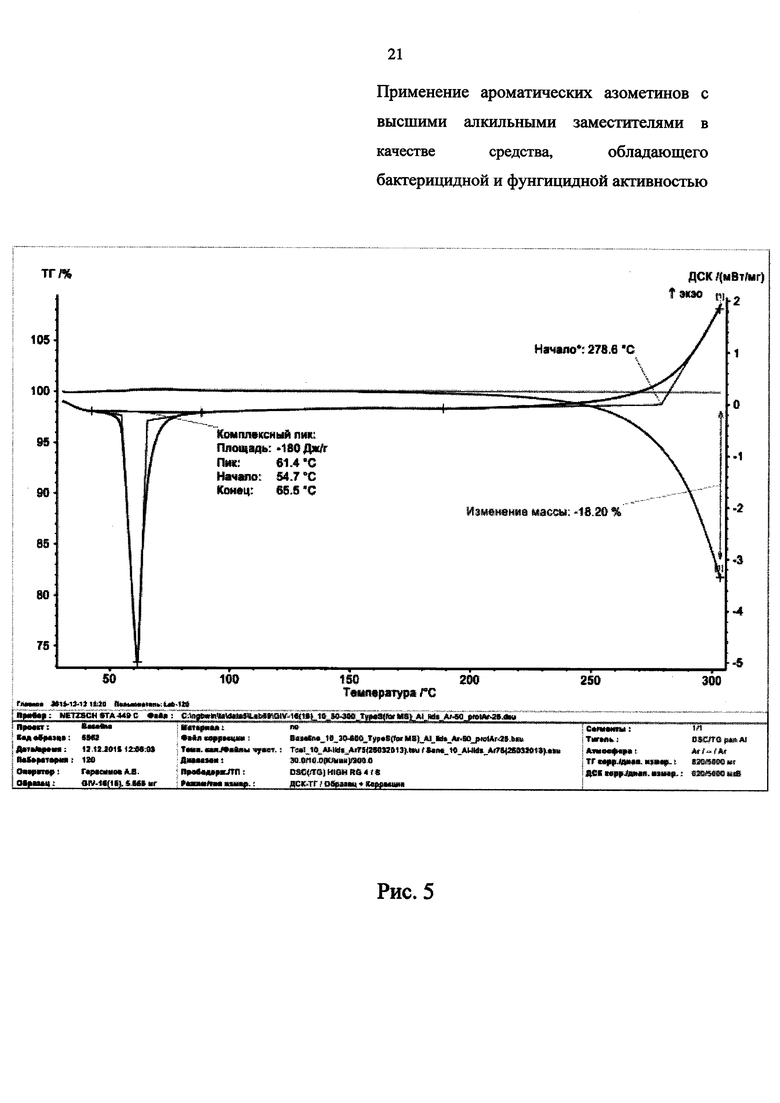
Термическая устойчивость соединений 1, 3, 4, и 6 представлена на дериватограммах ТГ-ДСК на Рис. 2-5 соответственно, из которых видно, что заявленные химические соединения имеют высокую термическую устойчивость, которая превосходит известные аналоги до 2-х и более раз:
- на Рис. 2 представлена дериватограмма соединения 1;
- на Рис. 3 представлена дериватограмма соединения 3;
- на Рис. 4 представлена дериватограмма соединения 4;
- на Рис. 5 представлена дериватограмма соединения 6.
Из данных ДГ-ДСК анализа синтезированных соединений (1-6) видно, что, несмотря на низкие температуры плавления от 50 до 103°С, стойкость к термическому разложению у этих соединений достаточно высокая и доходит до 200°С и выше. Разложение вещества и соответствующая потеря массы происходит при 240,5°С (1), 237,7°С (2), 241,9°С (3), 300°С (4), 261,9°С (5) и 278,6°С (6).
Исследованный заявителем уровень техники на дату подачи заявочных материалов не выявил наличие в уровне техники как аналогов по строению и по физиологическому действию, так и по достигаемому заявленным техническим решением техническому(им) результату(ам).
Сущностью заявленного технического решения является применение ароматических азометинов (1-6) на основе 4-((гексадецилимино)метил)фенола (1), 4-бром-2-((гексадецилимино)-метил)фенола (2), 4-((гексадецилимино)метил)бензол-1,2-диола (3), N-(4-бромбензелиден)гексадекан-1-амина (4), N-(4-хлорбензелиден)гексадекан-1-амина (5) и N-(4-нитробензелиден)гексадекан-1-амина (6) общей формулы I:
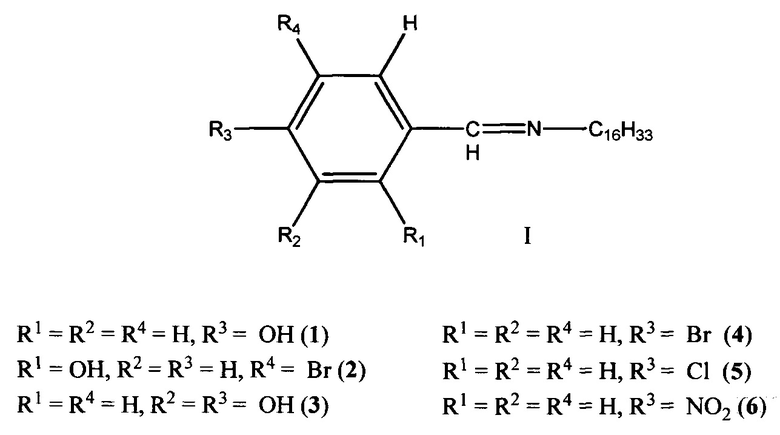
в качестве средства, обладающего бактерицидной и фунгицидной активностью.
Заявителем в заявленном техническом решении синтезированы новые стабильные активные фармацевтические субстанции ароматических азометинов (1-6) на основе ароматических бензальдегидов и н-гексадециламина для создания принципиально новых препаратов широкого спектра действия, проявляющие одновременно бактерицидную и фунгицидную активность при низких концентрациях (от 0,05% до 0,5%), что не является очевидным для специалиста в анализируемой области техники, таким образом, по мнению заявителей, заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям.
Соединения 1-6 получены взаимодействием н-гексадециламина с различными замещенными бензальдегидами (7-12) в спиртово-эфирной среде при мольном соотношении 1:1
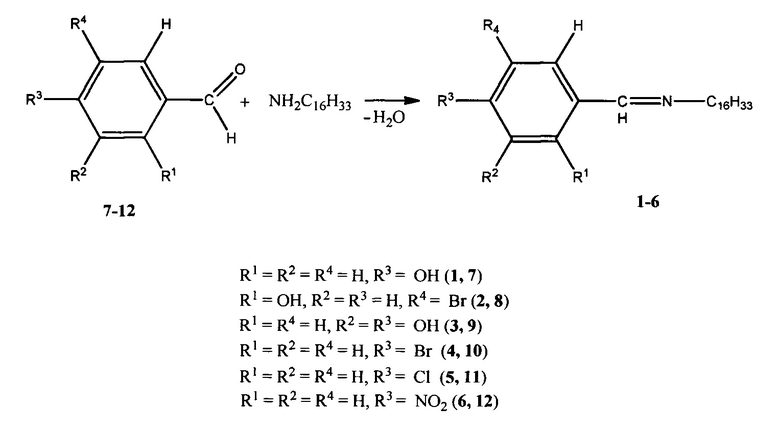
Структура полученных соединений доказана комплексом современных физических, химических и физико-химических методов исследования: ИК-спектроскопией, данными ТГ-ДСК, элементного и рентгеноструктурного анализа.
Исходные для синтеза замещенные ароматические бензальдегиды относительно дешевые отечественные препараты, используемые в органическом синтезе красителей, душистых веществ, в парфюмерно-косметических композициях, пищевых ароматизаторах. Гексадециамин вместе с октадециламином используется в промышленных масштабах как антиоксидантные противоизносные присадки к топливам и является легкодоступным дешевым отечественным реагентом.
Сущность изобретения иллюстрируется следующими примерами, но не исчерпывается ими.
Пример 1. Способ получения 4-((гексадецилимино)метил)фенола (1):
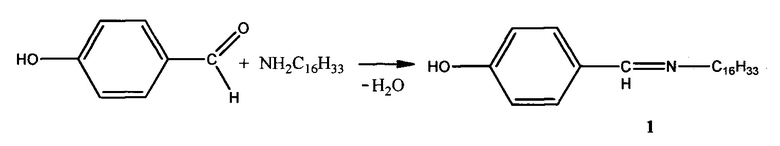
К раствору 1,00 г (0,0042 моль) гексадециламина в 5 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 0,52 г (0,0042 моль) 4-гидроксибензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы желтого цвета отделяют на воронке Шотта и трижды промывают этиловым спиртом и диэтиловым эфиром для удаления исходных соединений. Выход: 85%.
Элементный анализ C23H39NO.
Найдено, %: С 80,21; Н 11,53.
Вычислено, %: С 80,00; Н 11,30.
Тпл.=103,9°С.
ИК спектр, ν, см-1: 1680 (C=N) и 2800-3200 (ОН).
Пример 2. Способ получения 4-бром-2-((гексадецилимино)метил)фенола (2):
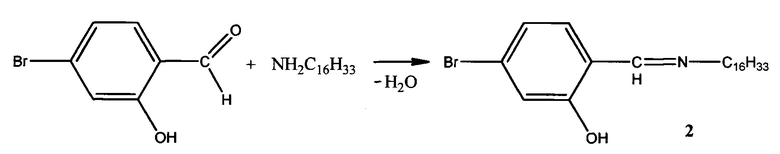
К раствору 1,30 г (0,0054 моль) гексадециламина в 5 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 1,09 г (0,0054 моль) 4-бром-2-гидроксибензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы желтого цвета отделяют на воронке Шотта и промывают этиловым спиртом и диэтиловым эфиром для удаления исходных соединений. Выход: 91%.
Элементный анализ C23H38BrNO.
Найдено, %: С 65,21; Н 9,13.
Вычислено, %: С 65,09; Н 8,96.
Тпл.=48,9°С.
ИК спектр, ν, см-1: 1675 (C=N) и 3100 (ОН).
Пример 3. Способ получения 4-((гексадецилимино)метил)бензол-1,2-диола (3):
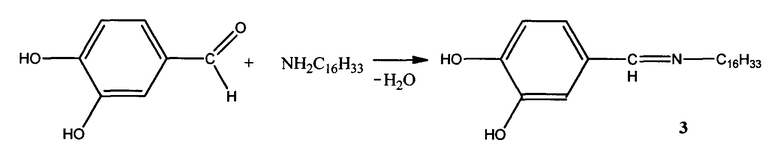
К раствору 1,00 г (0,0042 моль) гексадециламина в 5 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 1,64 г (0,0046 моль) 3,4-дигидроксибензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы светло-желтого цвета отделяют на воронке Шотта и промывают гексаном для удаления исходных соединений. Выход: 81%.
Элементный анализ C23H39BrNO2.
Найдено, %: С 76,40; Н 10,66.
Вычислено, %: С 76,45; Н 10,80.
Тпл.=99,7°С.
ИК спектр, ν, см-1: 1620 (C=N) и 3300 (ОН).
Пример 4. Способ получения N-(4-бромбензелиден)гексадекан-1-амина (4):
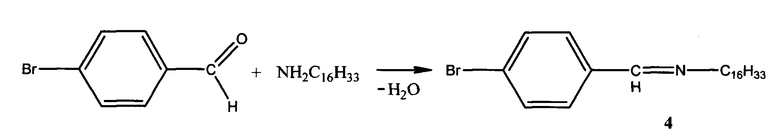
К раствору 1,03 г (0,0054 моль) гексадециламина в 6 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 1,03 г (0,0055 моль) 4-бромбензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы ярко-желтого цвета отделяют на воронке Шотта и промывают гексаном для удаления исходных соединений. Выход: 86%.
Элементный анализ C23H38BrN.
Найдено, %: С 67,97; Н 9,66.
Вычислено, %: С 67,65; Н 9,31.
Тпл.=56,8°С.
ИК спектр, ν, см-1: 1645 (C=N) и 3100 (ОН).
Пример 5. Способ получения N-(4-хлорбензелиден)гексадекан-1-амина (5):
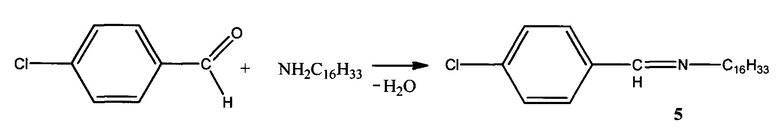
К раствору 1,50 г (0,0062 моль) гексадециламина в 6 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 0,93 г (0,0066 моль) 4-хлорбензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы желтого цвета отделяют на воронке Шотта и промывают гексаном для удаления исходных соединений. Выход: 83%.
Элементный анализ C23H38ClN.
Найдено, %: С 84,43; Н 11,65.
Вычислено, %: С 84,66; Н 11,66.
Тпл.=50,5°С.
ИК спектр, ν, см-1: 1650 (C=N) и 3300 (ОН).
Пример 6. Способ получения N-(4-нитробензелиден)гексадекан-1-амина (6):
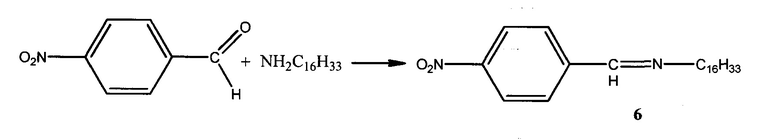
К раствору 1,30 г (0,0054 моль) гексадециламина в 6 мл смеси диэтилового эфира и этилового спирта (3:1) прибавляют по каплям раствор 1,82 г (0,0054 моль) 4-нитробензальдегида в 5 мл смеси выше обозначенных растворителей. Смесь нагревают на водяной бане с обратным холодильником при кипении диэтилового эфира в течение 2-х часов. После окончания реакции растворитель удаляют в вакууме. Выпавшие кристаллы ярко-желтого цвета отделяют на воронке Шотта и промывают гексаном для удаления исходных соединений. Выход: 81%.
Элементный анализ C23H38NO2.
Найдено, %: С 76,45; Н 10,64.
Вычислено, %: С 76,67; Н 10,56.
Тпл.=61,4°С.
ИК спектр, ν, см-1: 1680 (C=N) и 3000 (ОН).
Пример 7. Исследование биологической активности соединений 1-6.
Фунгицидную и бактерицидную активность ароматических азометинов формулы I исследовали на тест-культурах патогенной и условно-патогенной микрофлоры человека и животных. В работе использовали музейные штаммы кафедры микробиологии Казанской государственной медицинской академии: Escherichia coli, Salmonella paratyphi В., Pseudomonas aeruginoza, Staphylococcus aureus и Candida albicans. [Першин Г.Н. Методы эскпериментальной химиотерапии. - М.: Медицина, 1971, - 245 с]. Исследованы 6 химических соединений, которые испытаны на 5 музейных культурах.
Для оценки активности непосредственно перед исследованием готовят 0,05% растворы исследуемых соединений 1-6 в спирте. Суточную культуру стандартизуют до оптической плотности 0,5 по МакФарланду (108 КОЕ/мл). Чашку Петри с питательной средой Мюллера-Хинтона заражают культурой с использованием тампона. Через 5 минут на поверхность агара бактериологической петлей наносят каплю исследуемого вещества.
Результаты сравнительных исследований бактерицидной и фунгицидной активности заявленного технического решения (полученных соединений 1-6) представлены в Таблице.
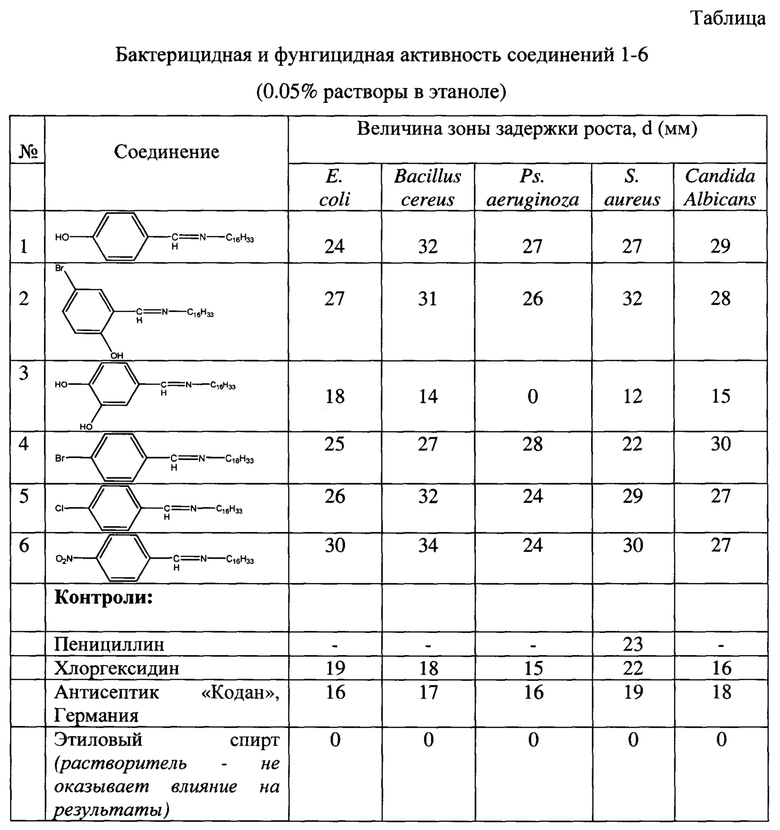
Преимуществами предлагаемых соединений 1-6 является то, что они обладают одновременно высокой бактерицидной и фунгицидной активностью при низких лечебных концентрациях и намного превосходят по своей активности как отечественные, так и зарубежные аналоги. Кроме того, они термически устойчивы (по данным метода термогравиметрии и скангирующей калориметрии) до 200°С, что и делает их перспективными лекарственными и дезинфицирующими средствами в медицине и ветеринарии.
Техническим результатом является применение эффективных отечественных термически устойчивых до 200°С лекарственных препаратов нового поколения из ряда ароматических азометинов на основе замещенных бензальдегидов и гексадециламина в качестве бактерицидного и одновременно фунгицидного средства по отношению к патогенной микрофлоре человека и животных: Escherichia coli, Salmonella paratyphi В, Pseudomonas aeruginosa, Staphylococcus aureus, Candida Albicans, обладающего:
- низкими лечебными дозами;
- относительно низкой токсичностью;
- высокой термостойкостью;
- высокой проникающей способностью в ликворы организма.
Другими словами, техническим результатом заявленного технического решения является комплексное применение отечественной (импортозамещающей) субстанции, ранее не известное в заявленном виде, так как она (субстанция) является термически устойчивой по данным ТГ-ДСК до 200°С и одновременно обладает высокой бактерицидной и фунгицидной активностью при низких (в пределах от 0,05% до 0,5% растворов) лечебных дозах. Вышеописанные преимущества заявленного технического решения позволяют решить одну из основных проблем - избавление от внутрибольничной инфекции, так как указанную температуру (до 200°С) не выдерживает ни одна из известных на дату подачи заявки больничных инфекций.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, характеризующиеся указанными признаками, приводящими к реализации заявленных технических результатов заявленного технического решения, которыми является применение термически стабильных ароматических азометинов формулы I в качестве средства, обладающего высокой одновременной бактерицидной и фунгицидной активностью, расширяющих ассортимент известных средств указанного назначения.
Таким образом, полученные ароматические азометины 1-6 общей формулы I, включающие алкильный заместитель в виде длинного гидрофобного радикала в 16 углеродных атомов для лучшей проницаемости в липидные мембраны патогенных микробов, обладают высокой бактерицидной активностью в низких лечебных дозах.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками заявленного технического решения, и не установлена известность влияния отличительных признаков на указанные технические результаты, кроме указанного, заявленное техническое решение обладает комплексом свойств, не присущих известным в мире антисептикам, такими как низкими лечебными дозами, относительно низкой токсичностью, высокой термостойкостью, высокой проникающей способностью в ликворы организма, что также является доказательством соответствия заявленного технического решения критерию «изобретательский уровень».
Заявленное техническое решение соответствует критерию «промышленная применимость» предъявляемому к изобретениям, т.к. заявленные соединения 1-7 могут быть получены посредством использования известных отечественных компонентов с применением стандартного оборудования и известных приемов и могут найти применение в области ветеринарии, медицины и сельского хозяйства в качестве отечественного лекарственного, антисептического и дезинфицирующего средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АММОНИЕВЫХ СОЛЕЙ ТРИФТОРБОРАНА В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНОГО И АНТИМИКОТИЧЕСКОГО СРЕДСТВА | 2014 |
|
RU2595037C2 |
| БИСФОСФОРИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 2,6-ДИ-ТРЕТ-БУТИЛ-4-МЕТИЛФЕНОЛА, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ, ФУНГИЦИДНОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2495879C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ДЕЗИНФЕКЦИИ НА ОСНОВЕ АЛКИЛ,АРИЛ-(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИБЕНЗИЛ)ФОСФОНИЙ БРОМИДОВ И НИТРАТОВ, ОБЛАДАЮЩЕЕ АКТИВНЫМИ БАКТЕРИЦИДНЫМ, ФУНГИЦИДНЫМ И АНТИОКСИДАНТНЫМ СВОЙСТВАМИ, А ТАКЖЕ ТЕРМОСТОЙКОСТЬЮ, СТОЙКОСТЬЮ К ВОЗДЕЙСТВИЮ ПАВ И НИЗКОЙ ТОКСИЧНОСТЬЮ | 2012 |
|
RU2486903C1 |
| КОМПЛЕКСЫ МЕЙЗЕНГЕЙМЕРА, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2452730C1 |
| СТАБИЛЬНЫЕ РАДИКАЛЫ, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2465279C1 |
| 2-(КАРБОКСИ-Н-АЛКИЛ)ЭТИЛТРИФЕНИЛФОСФОНИЙ БРОМИДЫ, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2423372C1 |
| СОЛИ БЕНЗОФУРОКСАНОВ С ЛОМЕФЛОКСАЦИНОМ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602804C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1995 |
|
RU2128996C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЗИНФИЦИРУЮЩЕГО ВЕЩЕСТВА КЛАТРАТА ДИДЕЦИЛДИМЕТИЛАММОННИЙБРОМИДА С МОЧЕВИНОЙ | 2001 |
|
RU2188667C1 |
| ПРОИЗВОДНЫЕ 2-АНИЛИНО-ПИРИМИДИНА ИЛИ ИХ СОЛИ, ПРОЯВЛЯЮЩИЕ ФУНГИЦИДНУЮ АКТИВНОСТЬ | 1992 |
|
RU2045520C1 |


Изобретение относится к области органической химии, в частности, к применению ароматических азометинов (1-6) на основе 4-((гексадецилимино)метил)фенола (1), 4-бром-2-((гексадецилимино)метил)фенола (2), 4-((гексадецилимино)метил)бензол-1,2-диола (3), N-(4-бромбензелиден)гексадекан-1-амина (4), N-(4-хлорбензелиден)гексадекан-1-амина (5) и N-(4-нитробензелиден)гексадекан-1-амина (6) общей формулы I, в качестве средства, обладающего бактерицидной и фунгицидной активностью. Изобретение может найти применение в ветеринарии, медицине и сельском хозяйстве. Указанные ароматические азометины проявляют высокую эффективность по отношению к патогенной микрофлоре при низких концентрациях. 5 ил., 1 табл., 7 пр.
Применение ароматических азометинов (1-6) на основе 4-((гексадецилимино)метил)фенола (1), 4-бром-2-((гексадецилимино)метил)фенола (2), 4-((гексадецилимино)метил)бензол-1,2-диола (3), N-(4-бромбензелиден)гексадекан-1-амина (4), N-(4-хлорбензелиден)гексадекан-1-амина (5) и N-(4-нитробензелиден)гексадекан-1-амина (6) общей формулы I

в качестве средства, обладающего бактерицидной и фунгицидной активностью.
| S.C.N | |||
| CHANDAR ET AL., Metallosurfactant Schiff base cobalt(III) coordination complexes | |||
| Synthesis, characterization, determination of CMC values and biological activities, TRANSITION MET | |||
| CHEM., 2009, 34, pp | |||
| Приспособление к паровозному реверсу | 1924 |
|
SU841A1 |
| А.Д | |||
| ГАРНОВСКИЙ И ДР., Трибохимически активные хелаты салицилидениминов, КООРДИНАЦИОННАЯ ХИМИЯ, 2009, 35(2), стр | |||
| Схема обмотки ротора для пуска в ход индукционного двигателя без помощи реостата, с применением принципа противосоединения обмоток при трогании двигателя с места | 1922 |
|
SU122A1 |
| N | |||
| ZHAO ET AL., Preparation, characterization and catalytic activity of amphiphilic cyclopalladated aryl imines and their Langmuir-Blodgett films, CHIN | |||
| J | |||
| CATAL., 2013, 34(8), pp | |||
| Устройство для радиоприема | 1924 |
|
SU1583A1 |
| M | |||
| LAKSHMANAN ET AL., Langmuir films of nitro substituted N-benzylidene hexadecylamine Schiff bases at air/water interface-Phase transitions and molecular dynamics simulation, APPLIED SURFACE SCIENCE, 2008, 255, pp | |||
| Способ выделения кодеина из опия | 1924 |
|
SU3381A1 |
| R | |||
| MAHESHWARI ET AL., Molecular dipoles at substrate/film interfaces influencing surface energy of Langmuir-Blodgett films, J | |||
| COLLOID INTERFACE SCI., 2004, 271, pp | |||
| Устройство для биологического очищения сточных вод | 1924 |
|
SU419A1 |
| База данных СА, RN 47462-15-7 (дата ввода 16.11.1984) [получено из STN]. | |||
Авторы
Даты
2018-01-18—Публикация
2016-06-02—Подача