Изобретение относится к фармакологии и медицине, преимущественно к аллергологии, дерматологии, и может быть использовано для лечения аллергодерматозов и других заболеваний, связанных с аллергической реакцией.
Лечение АД часто испытывает большие трудности и настоятельно нуждается в развитии новых подходов. Традиционной основой медикаментозного лечения атопического дерматита, особенно при обострениях, являются топические глюкокортикостероиды (ГКС) и, более редко, топические ингибиторы кальциневрина, нестероидные средства с противовоспалительным и иммуносупрессивным действием. Однако длительное применение топических ГКС может приводить к подавлению функции коры надпочечников и развитию атрофии кожи вследствие подавления синтеза коллагена и задержки пролиферации фибробластов. Наиболее известными ингибиторами кальциневрина являются такролимус и пимекролимус, блокирующие опосредовано, через сигнальные пути, продукцию провоспалительных цитокинов [Sidbury R, Hanifin JM. Systemic therapy of atopic dermatitis. Clin Exp Dermatol. 2000, 25: 559-66]. Однако, несмотря на высокую активность, всеобъемлющие данные по их долгосрочной клинической безопасности пока не представлены [Кутасевич Я.Ф., Уманец Т.Р. Эффективность и безопасность применения топических ингибиторов кальциневрина в педиатрии. http://www.umj.com.ua/wp/wp-content/uploads/2014/06/4255.pdf]. Терапия с использованием системных кортикостероидов показана только при тяжелых случаях (псориаз), но и в этом случае их использование должно быть ограничено во времени из-за возможных побочных эффектов. Кортикостероиды индуцируют лизис некоторых подтипов Т-клеток и блокируют также транскрипцию генов IL-1, IL-6 TNFα в макрофагах. Наиболее известные системные средства для подавления воспаления: преднизолон, метилпреднизолон, дексаметазон, метотрексат. Другие препараты из этого класса, особенно иммунодепрессанты (известны более 30 препаратов), имеют еще большие ограничения к регулярному использованию. К ним можно отнести циклоспорин (Сандимун), интерферон-гамма, Целлсепт, тазатиоприн (Имуран) и ряд других [J. Am. Acad. Dermatol., 2005; 52: 156; J Am Acad Dermatol. 2004; 50: 391-404]. Циклоспорин блокирует транскрипцию генов цитокинов IL-2, IL-4, IFN-α и IL-2R, тем самым ингибирует и продукцию самих цитокинов, которые вызывают индукцию, активацию и дифференцировку Т-клеток, элементов воспалительной реакции.
В последние годы стали также доступны в качестве лекарств моноклональные антитела против цитокина IL-4 и его рецепторов, иммуноглобулина Е (IgE), активированных Т и В-клеток [Yalcin A.D. An overview of the effects of anti-IgE therapies," Medical Science Monitor, 2014, 20: 1691-1699; Ganzetti G., Campanati A., Molinelli E., Offidani A. Biologic therapy in inflammatory and immunomediated skin diseases: safety profile. Current Drug Safety, 2015, 10 (999): 1-10]. Однако применение таких препаратов для многих групп больных ограничено из-за очень высокой их стоимости. Кроме того, ни один из этих препаратов пока не рекомендован для лечения АД, ввиду недостаточности данных об их эффективности и безопасности.
Пациентам с доказанной сенсибилизацией к определенным группам аллергена возможно проведение аллерген-специфической иммунотерапии (АСИТ). Эффективность имеющихся методов лечения доказана клиническими исследованиями, однако, в настоящее время отмечается тенденция к развитию тяжелых, непрерывно рецидивирующих форм АД, устойчивых к стандартной терапии.
С другой стороны, фуллерен С60 - многообещающая субстанция для высокотехнологичных материалов и новых лекарственных средств. После открытия простого способа его получения были синтезированы множественные производные фуллерена, многие из которых обладают явной биологической активностью [Kratschmer W., Lamb L.D., Fostiropoulos K., Huffman D.R. Solid C60: a new form of carbon. Nature; 1990, 347:354-356; Bosi, S., T. Da Ros, G. Spalluto, et al. Fullerene derivatives: an attractive tool for biological applications. Eur. J. Med. Chem., 2003, 38: 913-923; Пиотровский Л.Б. Фуллерены в биологии / Л.Б. Пиотровский, О.И. Киселев. СПб.: ООО «Издательство „Росток"», 2006. 336 с.]. С60 является единственной молекулярной формой чистого углерода, имеющей вид идеального сфероида с 60 атомами. Основой уникального действия фуллерена являются три его важных свойства: гидрофобность, электрон-акцепторная активность и легкая поляризуемость частиц, определяющая как его внутримолекулярные взаимодействия, так и облегченный перенос электронов от донорных молекул. Как сильнейший акцептор электронов, С60 проявляет высокую антиоксидантную активность и способен in vivo и in vitro эффективно инактивировать все формы АФК и свободные радикалы [Krustic P.J., Wasserman Е., Keizer P.N. Radical reactions of C60. Science, 1991, 254: 1183-1185; Gharbi N., Pressac M., Hadchouel M., Szwarc H., Wilson S.R., Moussa F. [60] Fullerene is a powerful antioxidant in vivo with no acute or subacute toxicity. Nano Letters, 2005, 5 (12): 2578-2585]. Такая активность предполагает, что фуллерен может являться перспективным терапевтическим средством для лечения заболеваний, связанных с окислительным стрессом. Важным свойством фуллерена является его низкая токсичность и возможность использовать разные пути его введения. Так, длительные (6 лет) эксперименты на крысах показали, что фуллерен, растворенный в оливковом масле, не проявляет хронической токсичности, более того, он значительно продлевает время жизни животных. Данные демонстрировали, что его эффект, по-видимому, связан с нивелированием окислительного стресса [Baati Т., Bourasset F., Gharbi N., Njim L. et al. The prolongation of the lifespan of rats by repeated oral administration of [60] fullerene. Biomaterials, 2012, 33: 4936-4946]. Также показана значительная противовоспалительная активность различных форм С60 (фуллеренола С60(ОН)24, катионных аминокислотных производных С60) на модели отека стопы крыс и мышей (модель реакции гиперчувствительности замедленного типа, ГЗТ), вызванной макромолекулярными агентами [Dragojevic-Simic V., Jacevic V., Dobric S. et al. Anti-inflammatory activity of fullerenol C60(OH)24 nanoparticles in a model of acute inflammation in rats. Digest J. Nanomater. Biostr., 2011, 6 (2): 819-827; Башкатова E.H., Андреев С.М., Шершакова Н.Н., Бабахин А.А., Шиловский И.П., Хаитов М.Р. Изучение модулирующей активности производных фуллерена С60 на реакцию гиперчувствительности замедленного типа. Физиология и патология иммунной системы, 2012, №2, 17-27].
В отношении противоаллергических эффектов фуллерена показано, что полигидроксифуллерен (С60(ОН)n и N-этилполиаминофуллерен (C60(NHCH2CH3)n ингибировали in vitro IgE-зависимую дегрануляцию тучных клеток, секрецию цитокинов и простагландинов в ответ на стимуляцию аллергеном. Авторы предположили, что этот эффект связан со снижением уровня АФК в клетках, т.е. блокированием окислительного стресса при аллергической реакции за счет антиоксидантной активности фуллерена [Magoulas G.Е., Garnelis Т., Athanassopoulos С.М et al. Synthesis and anti-oxidative/anti-inflammatory activity of novel fullerene-polyamine conjugates. Tetrahedron, 2012, 68 (35): 7041-7049]. При их инкубировании с тучными клетками и базофилами крови человека они подавляли их реакцию на аллерген, а в модели анафилаксии тормозили высвобождение гистамина. Отмечалось также, что такие производные ингибируют продукцию провоспалительных цитокинов, секреция которых опосредована фактором некроза опухоли (TNF-α) в синовиальных фибробластах, лимфоцитах и макрофагах, и он, очевидно, является перспективным препаратом для лечения артрита [Park E. - J., Kim Н., Kim Y., Yi J., Choi K., and Park K. Carbon fullerenes (C60s) can induce inflammatory responses in the lung of mice. Toxicology and Applied Pharmacology, 2010, 244 (2): 226-233].
Известно изобретение (US 7947262 B2), где водорастворимый С40, С50, С60 или С70 фуллерен, модифицированный ковалентным присоединением одного или более фрагментов, выбранных из группы, состоящей из пиридина, гидроксила, циклодекстрина, поливинилпирролидона, бис -(моносукцинимид-, р, р'-бис (2-амино-этил) дифенила, полиаминов и N-этилполиаминов, предполагают применять для лечения заболеваний, опосредованных реакцией тучных клеток и базофилов периферической крови в ответ на аллерген. Заявлен очень широкий спектр заболеваний от аллергии до сердечно-сосудистых. Однако немодифицированный фуллерен С60 не применяли для этих целей.
Известно изобретение (WO 2009145982), где для лечения поврежденной кожи заявлены соединения различных классов с антиоксидантными свойствами, включая липофильные катионы, нацеленные на транспорт в митохондрии, кератиноциты и фибробласты кожи. В качестве антиоксидантов также применяются витамин Е, аскорбиновая кислота, липоевые кислоты, ацетил-цистеин и другие классы веществ, включая химические производные фуллерена.
Известно изобретение (US 20110251158), где соединения фуллерена заявлены как противовоспалительные препараты для лечения атеросклероза сосудов. В патенте заявлен широкий ряд производных фуллерена С60 с формулой Zm-F-Yn, где F - фуллерен. Однако немодифицированный фуллерен С60 не заявлен для этих целей.
Описана композиция, предназначенная для сглаживания морщин и улучшения состояния кожи (WO 200913426 А1), представляющая собой раствор фуллеренов С32, С44, С60, С70, С76, С90, С96 и др. в масле. Однако представленные составы являются неводными, и их нельзя вводить парентерально.
Таким образом, экспериментальные данные свидетельствуют о явных противоаллергических свойствах фуллерена. Однако фуллерен пока не применяют в клинической практике. Одна из причин - коммерческая недоступность приемлемых по цене и нетоксичных водорастворимых форм фуллерена, химически немодифицированных. Другая причина - отсутствие результатов по долговременным всеобъемлющим клиническим испытаниям препаратов фуллерена, отсутствие знаний о возможных путях его метаболизма и выведения. Очень низкая растворимость фуллерена С60 в воде (<10-11 г/л) ограничивает возможность его непосредственного применения для биомедицинских исследований. При этом химическая модификация, введение заместителей в ядро фуллерена часто уменьшает его антиоксидантную активность из-за нарушения его электронной структуры (снижая уровень делокализации электронов).
Ранее мы описали простой способ получения стабильного водного раствора (коллоидный раствор или дисперсия) фуллерена С60 (ВРФ), пригодного по токсикологическим показателям для биомедицинского применения. Метод основан на проведении исчерпывающего диализа раствора С60 в смеси вода-N-метилпирролидон (МП) против воды [Андреев С.М., Пургина Д.Д., Башкатова Е.Н., Гаршев А.В., Маерле А.В., Хаитов М.Р. Эффективный способ получения водных нанодисперсий фуллерена. С. 60. Российские нанотехнологии, 2014, №7-8: 11-17; Патент RU 2548971 «Способ получения водных нанодисперсий фуллерена»]. ВРФ представляет собой опалесцирующий раствор желто-коричневого цвета с концентрацией частиц фуллерена 130-150 мг/л, имеет характерные максимумы поглощения при 220, 265 и 345 нм, размер частиц 60-80 нм, и поверхностный заряд (z-потенциал) - ξ=-25-30 mV. По этим параметрам дисперсия ВРФ имеет сходные характеристики с дисперсиями, получаемыми распространенным толуол-ультразвуковым методом [Andrievsky G.V., Kosevich M.V., Vovk О.М., Shelkovsky V.S., Vashcenko L.A. Chem. Soc. 1995, 12: 1281-1282], но с одним существенным отличием. В наночастицах ВРФ присутствуют молекулы МП, образующие с фуллереном донорно-акцепторный комплекс, что повышает их гидрофильность и стабильность в водной среде.
Показано, что ВРФ значительно снижает кожное воспаление, вызванное аллергенным белком овальбумином, обеспечивает снижение уровня специфического IgE и Th2-цитокинов (ИЛ-4, ИЛ-5) [Shershakova N, Baraboshkina Е, Andreev S, Purgina D, Struchkova I, Kamyshnikov O, Nikonova A, Khaitov M Anti-inflammatory effect of fullerene С60 in a mice model of atopic dermatitis. Journal of Nanobiotechnology, 2016, 14:8 doi: 10.1186/s12951-016-0159-z]. Однако частицы фуллерена в ВРФ диспергированы в деионизированной/дистиллированной воде, т.е. в среде, неизотоничной по отношению к биологической среде (кровь, ткани). Из литературы известно, что водные растворы (коллоидные дисперсии) немодифицированного фуллерена в присутствии солей неустойчивы. Таким образом, при прямом введении ВРФ в кровяное русло за счет присутствия солей фуллерен будет выпадать в осадок. Поэтому применять ВРФ как системное средство, например, для лечения аллергических дерматитов (АД), нельзя. Внутримышечное введение ВРФ чревато тяжелыми осложнениями (инфильтрат, абсцесс, флегмона и т.д.).
Суть настоящего изобретения состоит в использовании для противоаллергической терапии, включая АД, водно-солевого раствора фуллерена C60 (ВСРФ), устойчивого в условиях биологической среды, имеющего низкую гемолитическую активность, и пригодный для парентерального введения. Указанный способ основан на введении в ВРФ небольшой добавки биосовместимого неионного полимера плуроник F-127. В таком случае ВСРФ может быть использован в любой форме: либо путем накожной аппликации, например, с использованием лечебных повязок, заживляющих бинтов и салфеток, содержащих ВСФР, либо путем перорального приема, либо путем внутривенных и внутримышечных инъекций.
Техническим результатом настоящего изобретения является уменьшение аллергического воспаления, улучшение регенерации кожи.
In vivo исследования на мышах (BALB/c) показали наличие у ВСРФ заметного противовоспалительного действия. Визуальная оценка остаточного поражения кожного покрова показала, что процесс заживления раны при его участии идет примерно в два раза интенсивнее, чем при отсутствии терапии. По результатам анализа экспрессии таких факторов, как IgE (Рис. 3), IL-4, IL-5, IL-12 (Рис. 4), IFN-γ (Рис. 5), Foxp3, гена филаггрина и данных гистологии (Рис. 2) было установлено, что ВСРФ уменьшает аллергическое воспаление, стимулирует процесс эпителизации раны и способствует нормальной регенерации
Технический результат достигается применением водно-солевого раствора фуллерена С60, содержащего, кроме активного вещества - фуллерена С60, плуроник F-127, в качестве терапевтического средства для парентерального введения при заболеваниях атопическим дерматитом. При этом соотношение плуроника к фуллерену С60 1:1, или 1:2, раствор подвергается фильтрации через 0,45 мкм фильтр. Концентрация С60 в растворе находится в пределах 70-120 мкг/мл. Содержание в 1 мл раствора: фуллерен С60 - 120 мкг, F-127 - 120 мкг, остальное - физиологический раствор.
Ниже приводится подробное описание получения и использование водно-солевого раствора фуллерена С60.
Краткое описание чертежей.
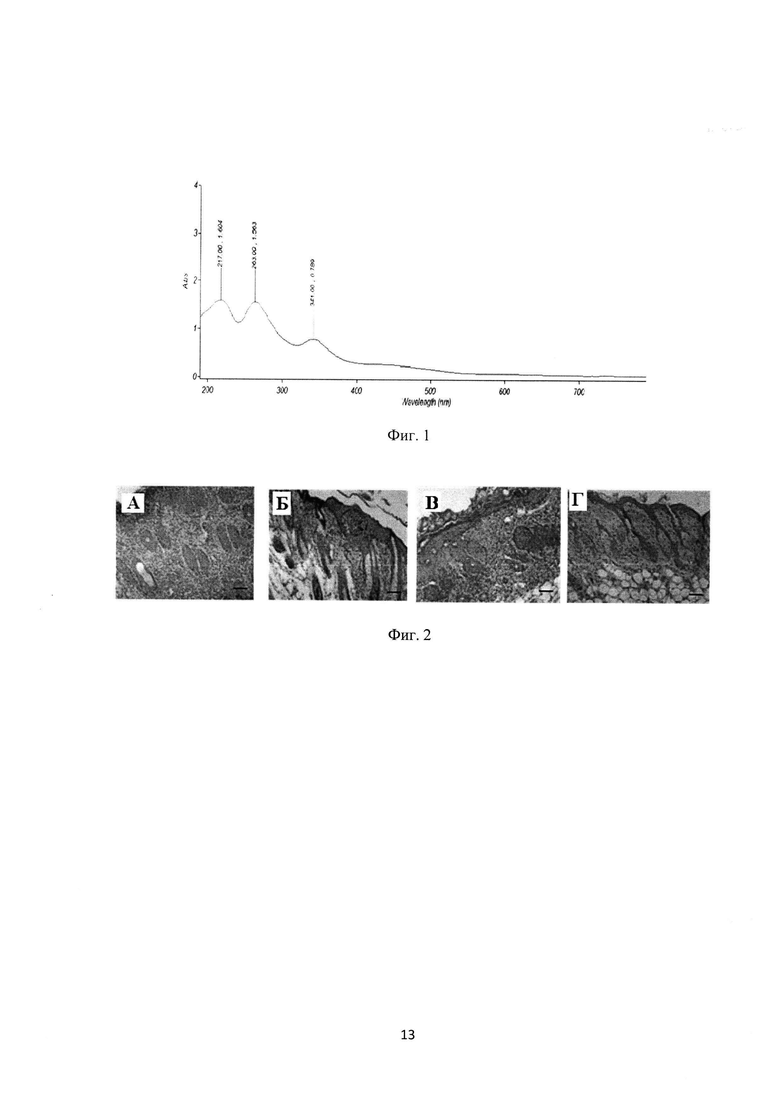
Фиг. 1 УФ-Вид спектр дисперсии фуллерена С60/плуроник F-127/вода. (С60:F-127=1:1) разбавлен в 10 раз.
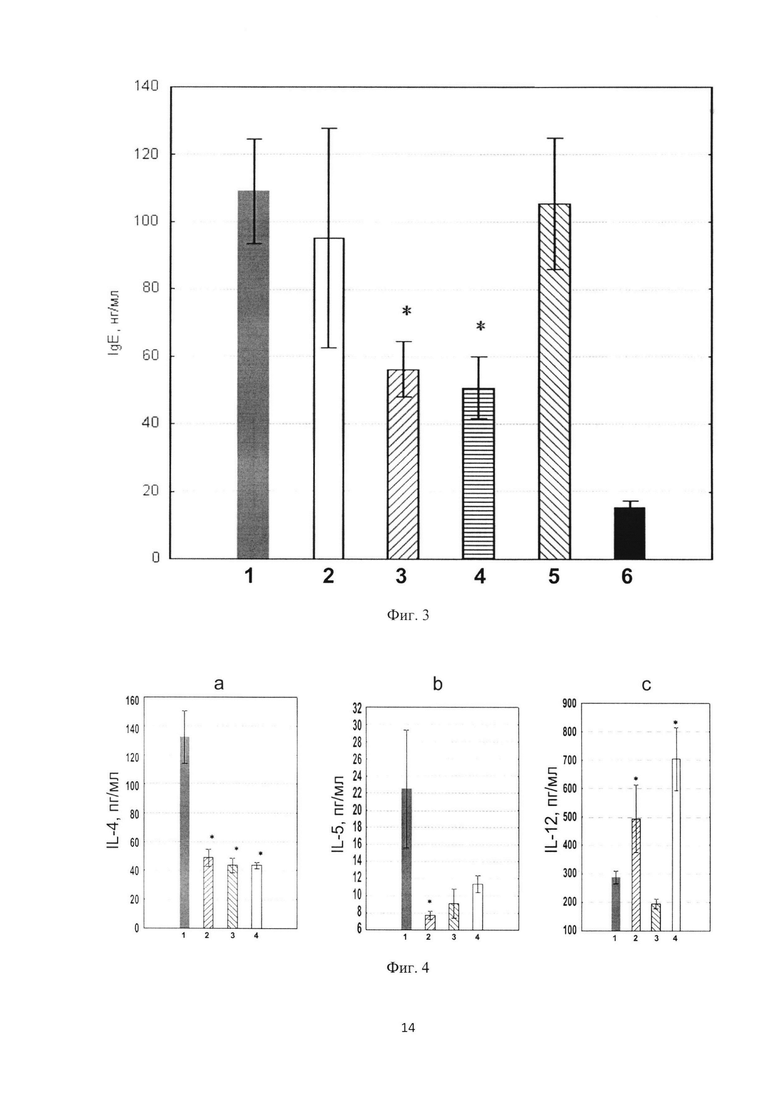
Фиг. 2. Гистологический анализ кожи: А - модель АД; Б - после внутривенного введения ВСРФ; В - после внутримышечного введения ВСРФ; Г - интактные мыши.
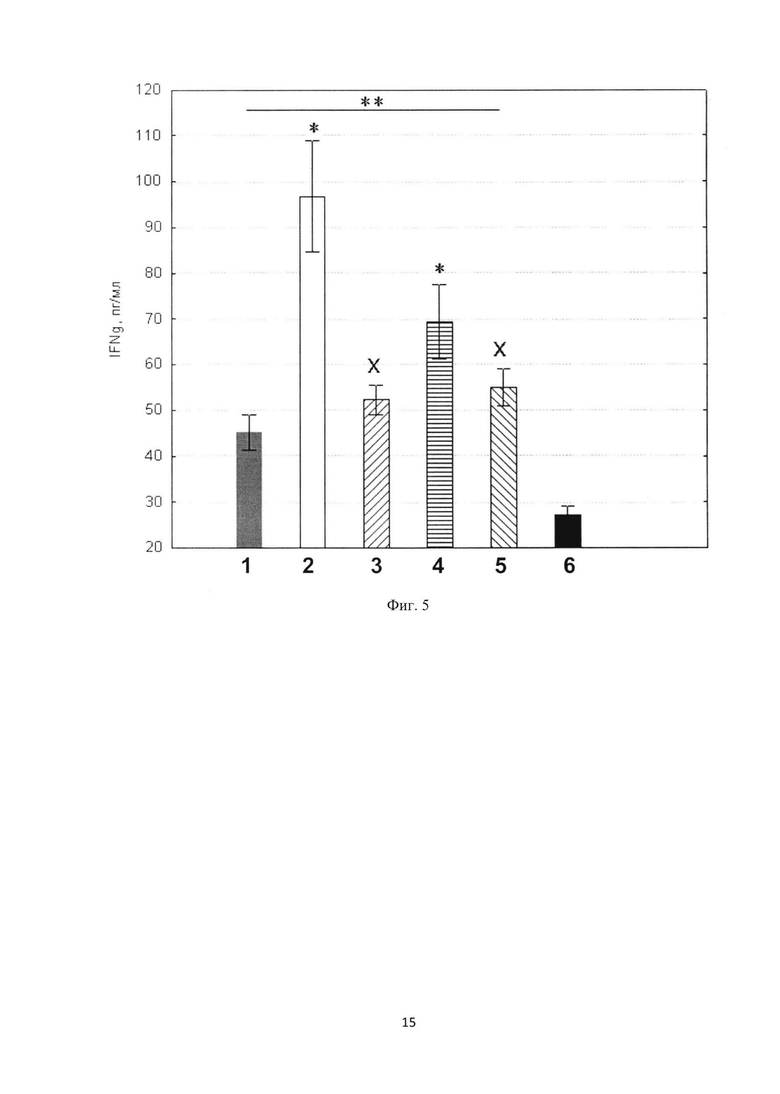
Фиг. 3. Изменение концентрации IgE-антител против овальбумина после введения ВСРФ. 1 - модель АД; 2 - С60 + ланолин; 3 - С60 в/м; 4 - С60 в/в; 5 - С60 и/г; 6 - PBS. * - достоверно отличается от группы «модель АД», р<0,05. Методы введения: в/м - внутримышечный, в/в - внутривенный, и/г - пероральный. Все группы достоверно отличаются от группы «интактные» (PBS).
Фиг. 4. Изменения концентраций а - ИЛ-4; b - ИЛ-5 и c - ИЛ-12 после введения ВСРФ. 1 - модель АД; 2 - С60 в/м; 3 - С60 в/в; 4 - интактные. * - достоверно отличается от группы «модель АД», р<0,05. Методы введения: в/м - внутримышечный, в/в - внутривенный.
Фиг. 5. Изменения концентрации интерферона-гамма (IFNg). 1 - модель АД; 2 - С60 + ланолин; 3 - С60 в/м; 4 - С60 в/в; 5 - С60 и/г; 6 - PBS. * - достоверно отличается от группы «модель АД», р<0,05; ** - достоверно отличается от группы «PBS», р<0,05; x - достоверно отличается от группы «С60 + ланолин», p<0,05.
1. Получение ВСРФ.
100 мг кристаллического фуллерена С60 (99.9%) растворяют в 125 мл N-метилпирролидона (МП), раствор перемешивают на магнитной мешалке до полного растворения фуллерена. Полученный раствор С60 в МП темно-фиолетового цвета фильтруют через 3-мкм стекловолоконный фильтр. Затем к фильтрату добавляют 250 мл 0.04% раствора плуроника F-127 в дистиллированной воде или в фосфатно-солевом буфере (ФСБ) при постоянном перемешивании. Цвет получаемых растворов меняется от темно-фиолетового до красно-оранжевого, также наблюдается легкая опалесценция. Раствор перемешивают на магнитной мешалке приблизительно час и затем подвергают исчерпывающему диализу против физиологического раствора с рН 7.4. Для диализа используют диализные мембраны SpectraPor с порами отсечки от 10 до 50 кДа. В результате получают желто-оранжевый раствор. Для расчета концентрации фуллерена в растворе используют УФ-Вид спектрофотометрию на основе молярной экстинкции фуллерена С60 при 340 нм, ε340=50200 (фиг. 1). Полученный раствор фильтруют для стерильности и разливают в ампулы из темного прозрачного стекла по 1 мл. Содержание в 1 мл раствора: фуллерен С60 - 120 мкг, F-127 - 120 мкг, остальное - физиологический раствор. Содержание фуллерена вместе с F-127 можно изменять (в меньшую сторону) путем разбавления полученного раствора физиологическим раствором для инъекций.
2. Моделирование АД и способ терапевтического введения препарата.
Моделирование АД осуществляли путем сенсибилизации мышей аллергеном овальбумином (OA) (Sigma). На предварительно выбритый участок спины мышей накладывали стерильную марлю размером 1×1 см, пропитанную 0,1% раствором OA, закрепляя ее специальным материалом (Bioclusive, Johnson), который предохраняет накладку от высыхания. Повязки с аллергеном выдерживали 7 дней, после чего повязки снимали. Через две недели 7 дневную аппликацию 0,1% OA повторяли еще два раза с двухнедельным интервалом (группа «модель»). Учет результатов проводили в конце периода третьей аппликации. Отрицательным контролем являлись мыши, эпидермально получавшие вместо OA ФСБ (группа «интактные»). Внутримышечные и внутривенные (хвостовая вена) введения осуществлялись между аппликациями OA через недельные интервалы (5 введений по 5 мкг С60/мышь, или 50 мкл р-ра ВСРФ). По окончании эксперимента проводили забор материала для ПЦР и гистологического анализа.
3. Гистологический анализ.
Образцы иссеченной кожи фиксировали в 10% растворе забуференного формалина (рН 6,8-7,2). Обезвоживание, проводку образцов и пропитывание парафином производили в гистопроцессоре автоматического типа SLEE MAINZ (Германия), заливку в парафин проводили с использованием заливочной станции SLEE MAINZ (Германия). Микротомирование парафиновых блоков для получения срезов толщиной 4 мкм осуществляли с помощью автоматизированного ротационного микротома Finesse Е+ (Финляндия), окрашенные по общепринятой методике гематоксилином и эозином гистологические срезы заключали в монтирующую среду под покровные стекла для получения постоянных микропрепаратов. Микроскопический анализ гистологических препаратов кожи мышей разных групп и фотографирование проводили на микроскопе Leica DM2000 с камерой DFC295 (Leica, Германия).
Патоморфологическое исследование кожи у группы мышей, в которой производилось моделирование атопического дерматита без специфического лечения, выявило следующие изменения, характеризующие данный патологический процесс развития дерматита: выраженная воспалительная лейкоцитарная инфильтрация эпидермиса и дермы кожи полинуклеарными лейкоцитами, в составе которой обнаруживалось большое количество эозинофилов - специфического компонента аллергического воспаления. Инфильтрация в дерме располагалась преимущественно диффузно или полосовидно, часто отмечалось вовлечение в патологический воспалительный процесс и подкожной жировой клетчатки. Эпидермис кожи в этой группе животных над областями дермального воспаления некротизировался вплоть до дермы, а в прилежащих областях был утолщен преимущественно за счет шиповатого слоя, в клетках базального слоя отмечалось увеличение числа фигур митоза, как признак процесса регенерации. Над эпидермисом образовывался струп из кератиновых масс и дегенеративно измененных лейкоцитов. В дерме кожи помимо лейкоцитарной инфильтрации происходила пролиферация соединительнотканных фибробластоподобных клеточных элементов, как реакция в ответ на раздражение с целью компенсации поврежденной соединительной ткани дермы. Также в дерме отмечалось развитие геморрагий деструктивного типа, которые выглядели как скопления ярко-красных эритроцитов, придатки кожи - волосяные фолликулы и сальные железы в дерме кожи часто редуцировались и исчезали. Микрокартина гистологического препарата кожи группы АД (модель АД) показана на Фиг. 2А. После внутримышечного введения ВСРФ у мышей по сравнению с группой АД отмечалось уменьшение выраженности полиморфноядерной лейкоцитарной инфильтрации эпидермиса и дермы, однако эозинофильный компонент инфильтрации был сохранен. Также наблюдалось уменьшение проявлений некроза эпидермиса и дермы кожи, утолщение эпидермиса за счет шиповатого слоя сохранялось, в клетках базального слоя эпидермиса наблюдалось увеличение числа фигур митоза, что свидетельствует о более выраженном развитии регенерации по сравнению с группой АД-модель. Деструктивные геморрагии в дерме кожи в этой группе обнаруживались реже. Отмечалось умеренное развитие гиперкератоза эпидермиса, как проявление компенсаторного механизма защиты от повреждения. Пролиферация фибробластоподобных клеток соединительной ткани дермы была умеренной (Фиг. 2Б). В группе, получавшей внутривенное введение ВСРФ, по сравнению с группой АД наблюдали более выраженный лечебный эффект, связанный с уменьшением выраженности воспалительной лейкоцитарной инфильтрации с уменьшением количества эозинофилов в составе инфильтрата. Наблюдали уменьшение некроза эпидермиса и дермы кожи, а в клетках базального слоя эпидермиса увеличение числа фигур митоза, что свидетельствует о более выраженной регенерации кожи (Фиг. 2В). Фиг. 2Г отражает нормальное строение кожи мышей в группе контроля - интактные животные. Эпидермис тонкий, в нем хорошо различим лишь базальный, шиповатый и роговой слой. Подкожная жировая клетчатка представлена жировыми клетками с расположенными между ними сосудами и нервными волокнами. В этой группе животных не отмечалось явных признаков воспаления и некроза, лишь у единичных животных встречались очаговые лимфоцитарные инфильтраты, являющиеся, по-видимому, условной физиологической нормой мышей линии BALB/c.
Важным аспектом, отражающим уменьшение воспалительной клеточной реакции, является снижение концентрации IgE-антител (Фиг. 3) и уровня инфильтрации эозинофилами дермы кожи, что наблюдалось в группах мышей, получавших инъекции ВСРФ, и это коррелировало с уменьшением экспрессии ИЛ-5 (Фиг. 4). Кроме того, анализ цитокинового профиля показал существенное изменение поляризации Т-хелперных клеток с фенотипа Th2 (падение ИЛ-4, ИЛ-5 (Фиг. 4)) на Th1 (рост ИФН-гамма (Фиг. 5), ИЛ-12 (Фиг. 4)) и стимуляцию экспрессии филагрина, важного барьерного фактора кожи, и маркера FoxP3 (таблица 1), играющего важную роль в поддержании иммунологической толерантности к аллергической атаке. Суммирование показателей гистологического анализа (используя бальную систему), выявило, что введение ВСРФ снижает проявление признаков воспаления примерно на 45% и 27%, в группах с внутривенным и внутримышечным введением, соответственно.

| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ АТОПИЧЕСКОГО ДЕРМАТИТА НА ОСНОВЕ ФУЛЛЕРЕНА | 2016 |
|
RU2641041C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНО-СОЛЕВЫХ ДИСПЕРСИЙ ФУЛЛЕРЕНА | 2015 |
|
RU2630561C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОКОНЦЕНТРИРОВАННОГО ВОДНОГО РАСТВОРА ФУЛЛЕРЕНА | 2018 |
|
RU2679257C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНЫХ НАНОДИСПЕРСИЙ ФУЛЛЕРЕНА | 2013 |
|
RU2548971C2 |
| Гепатопротекторный и антиоксидантный препарат для животных на основе водного раствора фуллерена C, ресвератрола и бетаина гидрохлорида | 2020 |
|
RU2770534C1 |
| Способ лечения аллергической бронхиальной астмы, основанный на подавлении экспрессии генов цитокинов IL-4 и IL-13 с использованием молекул миРНК | 2016 |
|
RU2615463C1 |
| Средство для лечения атопического дерматита | 2022 |
|
RU2794841C1 |
| КОМПОЗИЦИЯ ДЛЯ ПОДАВЛЕНИЯ ЭКСПРЕССИИ ГЕНА ЦИТОКИНА ИНТЕРЛЕЙКИНА-4 | 2014 |
|
RU2563989C1 |
| Композиция, подавляющая экспрессию генов интерлейкина-4 и интерлейкина-13, для терапии аллергического ринита | 2018 |
|
RU2710895C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДДУКТОВ ФУЛЛЕРЕНА | 2010 |
|
RU2462474C2 |
Изобретение относится к фармацевтической промышленности и медицине и представляет собой применение терапевтического средства для парентерального введения при атопическом дерматите, представляющего собой водно-солевой раствор, состоящий из фуллерена С60, плуроника F-127 и физиологического раствора, где компоненты в средстве находятся в определенном соотношении на 1 мл раствора. Изобретение обеспечивает уменьшение аллергического воспаления, улучшение регенерации кожи. 1 табл., 5 ил.
Применение терапевтического средства для парентерального введения при атопическом дерматите, представляющего собой водно-солевой раствор, состоящий из фуллерена С60, плуроника F-127 и физиологического раствора, где компоненты в средстве находятся в следующем соотношении на 1 мл раствора:
Фуллерен С60 120 мкг
Плуроник F-127 120 мкг
Физиологический раствор остальное
| Bashkatova E | |||
| Et | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ НАНОМИЦЕЛЛ, СОДЕРЖАЩИХ ЭПИГАЛЛОКАТЕХИНГАЛЛАТ, И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА, БОЛЕЗНИ КРОНА, АДЕНОМИОЗА И ГИПЕРПЛАСТИЧЕСКИХ ЗАБОЛЕВАНИЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2465912C9 |
| WO 2009114087 A2, 17.09.2009 | |||
| US 2008107618 A1, 08.05.2008. | |||
Авторы
Даты
2018-01-15—Публикация
2016-12-15—Подача