Область техники, к которой относится изобретение
Изобретение включает выделение редких клеток из биологических образцов фильтрацией и последующий анализ этих редких клеток и их компонентов. Редкие клетки имеют признаки или появляются в биологических образцах с частотами, которые отличают их от других типов клеток. Типы редких клеток включают редкие опухолевые или редкие злокачественные опухолевые клетки, редкие типы эндотелиальных клеток, редкие фетальные клетки и редкие инфицированные белые кровяные клетки (лейкоциты).
Уровень техники
Редкие клетки. Редкие клетки присутствуют в абсолютном и относительно низком количестве в биологических образцах, полученных из человека или животных. Наличие редких клеток часто коррелирует с конкретным заболеванием, расстройством или состоянием. Например, редкие опухолевые клетки могут быть обнаружены в крови объектов, с опухолями или злокачественными опухолями.
Типы редких клеток. Существует много различных типов редких клеток и редкие клетки неисключительно могут быть:
- эпителиальными клетками и их предшественниками, мезенхимальными клетками и их предшественниками, зрелыми и незрелыми эндотелиальными клетками и их предшественниками, фибробластами и их предшественниками, и меланоцитами и их предшественниками;
моноцитами и макрофагами и их предшественниками, активированными лимфоцитами и их предшественниками, клетками плазмы и их предшественниками, эозинофилами и их предшественниками, базофилами и их предшественниками и мегакариоцитами и их предшественниками;
- стволовыми клетками любого подтипа;
- фетальными клетками любого происхождения и типа, включая лимфоидные, эритроидные, миелоидные, стволовые фетальные клетки, трофобластные клетки, такие как цитотрофобласты и синцитиотрофобласты, и эмбриональные клетки; и
- опухолевые клетки любого происхождения и типа и любой степени дифференцировки, включая стволовые опухолевые клетки, опухолевые микроэмболы, агрегированные опухолевые клетки, коллективные опухолевые клетки любого типа, и атипичные клетки любого происхождения и типа.
Некоторые типы редких клеток являются патологическими клетками. Примеры таких патологических клеток включают опухолевые или злокачественные опухолевые клетки, такие как клетки, полученные или происходящие из рака легкого, рака простаты, рака толстой кишки, рака молочной железы, рака поджелудочной железы, рака почки, рака печени, рака желудка, рака пищевода, и любого типа карциномы, саркомы, миеломы, меланомы, остеосаркомы, нейробластомы, лейкоза и лимфомы.
Редкие клетки также ассоциированы с состояниями, в которых количество редких клеток в биологическом образце увеличивается или снижается при патологии. Они включают:
- эндотелиальные клетки, присутствующие в патологически более высоких количествах в крови пациентов со злокачественным новообразованием, или пациентов с сердечно-сосудистыми расстройствами, такими как приступ стенокардии;
- клетки, несущие внутриклеточные вирусы, бактерии или другие патогенные агенты, такие как HIV, HBV, HPV, шигелла, лейшмания, бацилла туберкулеза, инфицированные моноциты, инфицированные макрофаги, инфицированные лимфоциты, активированные лимфоциты; и
- клетки, несущие мутации, которые ассоциированы с генетическими заболеваниями, такие как фетальные клетки, пораженные генетическим расстройством, таким как анеуплоидия 21, 13, 18, XXY, ХО, талассемия, муковисцидоз, спинальная мышечная атрофия, Болезнь Дюшенна, болезнь Хантингтона, и т.д., и клетки, несущие генетические мутации или обладающие молекулярными характеристиками, связанными с восприимчивостью к определенным патологиям, таких как вирусные инфекции, воспаления, хронические дегенеративные заболевания, болезнь Альцгеймера, диабет, нарушения обмена веществ.
Редкие клетки также могут быть ассоциированы с непатологическими состояниями, такими как беременность.
Редкие клетки, как правило, могут представлять одну клетку из от около 103 до около 1010 клеток, от около 104 до около 1010 клеток, от около 105 до около 1010 клеток, от около 106 до 1010 клеток, от около 107 до около 1010 клеток, или даже от около 108 до около 1010 клеток клеточной популяции в биологической жидкости. Редкие клетки, как правило, могут представлять менее, чем 500 клеток в 1 мл биологической жидкости, менее, чем 200 клеток в 1 мл биологической жидкости, менее, чем 100 клеток в 1 мл биологической жидкости, менее, чем 50 клеток в 1 мл биологической жидкости, или даже менее, чем 10 клеток в 1 мл биологической жидкости. Например, известно, что циркулирующие опухолевые клетки (англ. circulating tumor cells, СТС), как правило, присутствуют в количестве 1-10 или 1-500 СТС на 6×106 лейкоцитов, около 2×108 тромбоцитов и около 4×109 эритроцитов на мл крови [75].
Существующие способы выделения редких клеток.
Редкие клетки могут быть экстрагированы или выделены из биологических образцов. Экстрагированные клетки являются клетками, экстрагированными из жидкого образца без отделения от других клеток. Выделенные клетки являются редкими клетками, выделенными из других типов клеток, присутствующих в жидком образце. Пропорция редких относительно нередких клеток, экстрагированных или выделенных из биологических образцов, варьирует таким образом, что степень чистоты выделенных или экстрагированных редких клеток может быть вариабельной.
Некоторые способы были предложены для экстракции или выделения редких клеток из биологических образцов; в частности, сообщалось о нескольких способах выделения опухолевых или фетальных клеток из крови. Однако эти способы не решали тройную проблему экстракции или выделения редких клеток с (i) минимальными или отсутствующими потерями, (ii) экстракции или выделения редких клеток с минимальной или отсутствующей ошибкой выборки, и (iii) экстракции или выделения редких клеток путем, который позволяет осуществить их гибкое или одновременное применение во множестве аналитических процедур.
Способы, которые только извлекают некоторые из редких клеток в образце, количественно ухудшают применение выделенных или экстрагированных клеток в последующих аналитических процедурах. Эти способы также могут внести ошибку выборки.
Ошибка выборки происходит, когда способ экстракции или выделения приводит к потере одного из нескольких типов выбранных редких клеток в образце. Например, способ, который выделяет опухолевые клетки из образца крови путем связывания редких опухолевых клеток с антителами против эпителиальных клеток приводит к потере редких опухолевых клеток, которые не экспрессируют антигены эпителиальных клеток, которые связываются с антителом.
Грубые процедуры экстракции или выделения или процедуры, которые в ином случае изменяют детектируемые признаки выделенных или экстрагированных редких клеток компрометируют их применение в последующих аналитических процедурах.
Диагностическая важность редких клеток. Обнаружение и описание редких клеток и их применение в диагностике и терапии, как ожидается, будет иметь возрастающую важность в медицине, ветеринарии и науке. Редкие клетки особенно ценны для применения в персонализированной медицине или тераностике, способе индивидуализированной диагностической терапии для пациента, основанной на его или ее конкретных генетических характеристиках и на характеристиках его или ее редких клеток. В данных условиях редкие клетки необходимо анализировать множественными подходами, обеспечивающими их диагностическую идентификацию и широкое описание. Как пример, редкие клетки, выделенные из крови пациентов, пораженных злокачественным новообразованием, могут быть охарактеризованы с помощью молекулярных анализов, целью которых является обнаружение генных мутаций с прогностическим и/или тераностическим значением. Однако если осуществляются только молекулярные анализы, нацеленные на генные мутации, без анализов, имеющих целью диагностику наличия или отсутствия опухолевых клеток в крови, результаты теста могут зависеть от ошибки. Фактически если редкие клетки, выделенные из крови данного пациента, не содержат опухолевых клеток, отсутствие генной мутации в выделенных редких клетках не будет служить указанием на отсутствие генной мутации в циркулирующих опухолевых клетках. Поэтому множественные анализы, осуществленные на редких клетках, экстрагированных или выделенных из биологических образцов, необходимы для того, чтобы получить надежную информацию, которая будет использоваться для выбора целевых методов лечения, следовать их эффективности и для детекции возможно лекарственной устойчивости.
Более того, редкие клетки, экстрагированные или выделенные из крови или других биологических образцов, могут быть использованы в качестве альтернативы образцам, полученных через инвазивные или полухирургические способы, включающие неисключительно хирургические или полухирургические вмешательства, биопсию, лапаратоцентез, парацентез, спинальную пункцию, амниоцентез, биопсию ворсин хориона и кордоцентез. В данных условиях редкие клетки представляют ценный материал, который необходим для детального исследования путем множественных анализов для диагностики и/или тераностического применения или для интенсивной молекулярной и/или генетической характеризации.
Редкие клетки, полученные из рака легкого. Рак легкого является наиболее распространенной неоплазией и основной причиной связанной с опухолями смертностью в мире [1-5]. Несмотря на недавние успехи в лечении резектированных раков легкого и более эффективном лечении метастатических опухолей, показатель эффективности лечения пациентов с раком легкого остается низким. Однако недавнее открытие ведущих онкогенных мутаций в карциномах легкого и растущая разработка таргетных терапий демонстрирует новые ободряющие результаты у пациентов с поздней стадией [6-8]. В числе таких терапий используются гефитиниб и эрлотиниб, тирозин-киназные ингибиторы, созданные против рецептора эпидермального фактора роста (EGFR), который обнаруживает активирующую тирозин мутацию в 10-20% аденокарцином [7, 9]. Совсем недавно была идентифицирована геномная перестройка, в которую вовлечены гены киназы анапластической лимфомы (ALK) (2р23) и белка-4, подобного белку, ассоциированному с микротрубочками эхинодерма (EML4) (2р21), в подмножестве пациентов с раком легкого, имеющих явный благоприятный ответ на низкомолекулярный ингибитор ALK (кризотиниб) [7, 10-13]. Реаранжировка гена ALK была обнаружена в 1-7% немелкоклеточного рака легкого (англ. non-small cell lung cancer, NSCLC) согласно большинству из серии без KRAS и EGFR ассоциированных мутаций в большинстве опухолей [10, 12-14]. Специфические гистологические признаки, характеризующие это подмножество ALK-положительных аденокарцином легкого, демонстрируют солидный или ацинарный паттерн роста, решетчатую структуру, наличие слизистых клеток (кольцевидные клетки или бокаловидные клетки), обильную внеклеточную слизь, утрату роста по стенкам альвеол, и утрату значимого ядерного плеоморфизма [14]. Более того, пациенты с опухолями с реаранжировкой ALK были моложе, чаще были мужчинами, в большинстве серий, и никогда не были курильщиками/бывшими незаядлыми курильщиками [12, 14].
Циркулирующие опухолевые клетки (СТС) могут быть выделены из более чем 40% пациентов с раком легкого в соответствии с сериями и способами [15-17]. Более того, прогноз пациентов с раком легкого, как в поздней, так и в ранней стадиях заболевания коррелирует с наличием и количеством СТС [15, 16]. СТС могут быть выделены различными прямыми и непрямыми способами [18, 19]. Геномные изменения, особенно мутации происходящие в гене EGFR, были продемонстрированы в СТС, выделенных у пациентов с NSCLC [20].
Авторы ранее продемонстрировали, что СТС могут быть выделены различными способами, даже в ранней стадии заболевания из пациентов, подвергнутых хирургии карциномы легкого [15, 21]. Более того, наличие и количество СТС было ассоциировано с плохим прогнозом [15]. Интересно, что при использовании прямого способа, в котором СТС выделяются согласно их размеру (англ. ISET, Isolation by Size of Epithelial Tumor cells, выделение клеток эпителиальной опухоли по размеру) авторы определили злокачественные цитопатологические критерии, которые позволяют осуществить хорошее описание СТС по злокачественным признакам [22, 23]. Кроме того, путем применения подхода иммуноцитохимии (англ. immunocytochemistry, ICC) к СТС, выделенным с помощью ISET из пациентов с NSCLC, наша группа и другая группа показали, что варьирующее количество СТС демонстрирует фенотип эпителиально-мезенхимального перехода (ЕМТ) [17, 21, 24, 25].
Об оценке реаранжировки гена ALK в СТС, выделенных из пациентов с раком легкого, не сообщалось. Такая оценка является уместной клинической целью для неинвазивного предварительного скрининга пациентов с раком легкого для того, чтобы избежать потенциальной смертности, связанной с биопсией легкого и удалением опухолевой ткани.
Трофобластные редкие клетки. Сообщалось о неинвазивных способах выделения трофобластных клеток из материнской крови, например, как описано в патенте США 7,651,838, выданном 26 января 2010 года. Однако существует потребность в способах получения трофобластных клеток из образцов шейки посредством полностью неинвазивного и безопасного (например, без риска индукции невынашивания) подхода. Такие способы должны сообразно выделять трофобластные клетки из беременных женщин, для того, чтобы данный подход был полезен для неинвазивного пренатального диагноза генетических дефектов, заболеваний или расстройств (Imudia AN, Kumar S, Diamond MP, DeChemey AH, Armant DR. Transcervical retrieval of fetal cells in the practice of modern medicine: a review of the current literature and future direction. Fertil Steril. 2010: 93:1725-30). Например, диагноз фетальной трисомии по 21 хромосоме у беременных женщин может быть достигнут путем экстракции чистой ДНК и анализа чистой фетальной ДНК секвенированием следующего поколения. Если количество свободной фетальной ДНК слишком низкое и для надежных результатов о наличии или отсутствии фетальной анеуплоидии не может быть получено достаточное количество, то, таким образом, для осуществления неинвазивного пренатального диагноза могут быть проанализированы фетальные клетки. В патенте США 7,651,838 описано выделение трофобластных клеток из крови с помощью неинвазивного способа. Трофобластные клетки могут быть выделены или экстрагированы из образцов шейки, но не было известно как сообразно и неинвазивно (без риска индукции невынашивания) получить трофобластные клетки из образцов шейки, из цервикальной слизи, из образцов, полученных из слизистой мембраны (Imudia AN, et al Fertil Steril. 2010: 93:1725-30).
Авторы искали решение проблемы, описанной выше, путем экстракции редких клеток из биологических образцов, таких как кровь и слизистые секреты, с использованием фильтрации и других процедур выделения и анализа, описанных в данном документе.
Раскрытие изобретения
Способы, описанные в данном документе, решают эти проблемы и задачи с помощью фильтрации в качестве наиболее подходящего пути экстракции или выделения редких клеток из биологических образцов. После экстракции или выделения фильтрацией, редкие клетки находятся в состоянии, подходящем для множественных или даже одновременных аналитических процедур. Этот способ эффективно выделяет или экстрагирует редкие клетки из биологического образца, идентифицирует редкие клетки, и затем молекулярно характеризует редкие клетки для диагностических целей, и для выбора, руководства, отслеживания лечения и в частности, для выбора целевых обработок и для отслеживания ответа и/или устойчивости к нему.
Изобретение включает различные режимы анализа или описания редких клеток. Они включают (i) применение количественного и качественного анализа редких клеток, выделенных фильтрацией для диагностических или тераностических целей и для последующего выбора терапии; (ii) «качественный анализ» включает множественные анализы, осуществленные на тех же самых редких клетках, выделенных фильтрацией. Множественные анализы на том же самом образце позволяют избежать проблем, связанных с условиями, в которых редкие клетки являются неизбыточными, или с биологическими образцами, которые содержат низкое количество редких клеток; (iii) «количественный анализ», включающий выделение нефиксированных (свежих) редких клеток фильтрацией позволяющей их культивирование и анализ РНК; (iv) использование циркулирующих опухолевых клеток, выделенных фильтрацией для ранней диагностики инвазивных злокачественных опухолей; и (v) использование трофобластных клеток, выделенных из образцов слизистой шейки матки, для неинвазивной пренатальной диагностики генетических расстройств.
В одном из этих аспектов, изобретение является способом для идентификации, диагностики или обеспечения прогноза состояния, расстройства или заболевания, ассоциированного с редкими клетками, включающего (а) выделение или экстракцию редких клеток путем проведения биологического образца через фильтр и извлечение выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые пропускают редкие клетки, но которые препятствуют прохождению других типов клеток; (b) определение цитоморфологии, и/или иммуномечения, и/или молекулярного анализа выделенных или экстрагированных редких клеток. Этот процесс может быть использован для выделения, экстракции, концентрирования или в ином случае очистки редких клеток в представляющем интерес биологическом образце. Биологический образец может быть любым, который содержит или который предположительно содержит редкие клетки. Биологический образец включает кровь и другие внеклеточные жидкости, биологические жидкости, отличные от крови, такие как амниотические жидкости, водянистая влага и стекловидное тело, желчь, сыворотка крови, плазма крови, грудное молоко, цереброспинальная жидкость, ушная сера, эндолимфа, перилимфа, женский эякулят, желудочный сок, слизь, включая отделяемое носа, флегма и другой материал, собранный из слизистой мембраны, перитонеальная жидкость, плевральная жидкость, слюна, кожное сало, сперма, пот, слезы, вагинальный секрет, рвотная масса и моча. Такие биологические образцы предпочтительно получают неинвазивно, однако образцы могут быть получены из биопсийных тканей или из клеточных суспензий, сделанных из твердых или полутвердых тканевых образцов.
Биологический образец может быть получен из представляющего интерес объекта, такого как объект, имеющий злокачественную опухоль или опухоль, предположительно имеющий злокачественную опухоль или опухоль, или имеющий риск развития злокачественной опухоли или опухоли. Образцы также могут быть получены из объекта, о котором известно, что он имеет, предположительно имеет или имеет риск развития любого другого состояния, расстройства или заболевания, ассоциированного с или вызванного редкими клетками, такого как незлокачественные пролиферативные состояния, расстройства или заболевания. Например, биологический образец может быть получен из объекта, у которого воспалительное и/или дегенеративное состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск воспалительного и/или дегенеративного состояния, расстройства или заболевания; из объекта, у которого имеется сердечнососудистое состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск сердечнососудистого состояния, расстройства или заболевания; или из объекта, у которого имеется инфекционное состояние, расстройство или заболевание, или которого подразумевается наличие или имеется риск инфекционного состояния, расстройства или заболевания.
В способе, описанном выше, в стадии (а) редкие клетки могут быть выделены, экстрагированы или сконцентрированы или, в ином случае, очищены путем проведения биологического образца через поликарбонатный фильтр, PET (полиэтилен терефталат), или другой подходящий пористый фильтр или материал и путем выделения клеток на поликарбонатной фильтре.
Биологический образец может быть свежим, таким как образец, недавно забранный из объекта, хранимым образцом, таким как законсервированный, охлажденный или замороженный образец, или образец, подвергнутый другой обработке, такой как фиксация. В зависимости от типа биологического образца, он может быть обработан муколитическим агентом, антикоагулятном, протеазой или обработкой с литическим агентом, который селективно удаляется определенные типы клеток в биологическом образце, в условиях сохранения редких клеток в образце.
Перед проведением через фильтр биологический образец может быть разведен или в ином случае обработан для облегчения выделения, экстракции, концентрации или очистки редких клеток.
Редкие клетки, которые выделены, экстрагированы, сконцентрированы или в ином случае очищены процессом фильтрации, описанным в данном документе, могут быть перенесены на подложку перед дальнейшими анализами как в (b) или для культивирования.
Редкие клетки могут быть собраны индивидуально для молекулярного анализа после их выделения или экстракции с помощью фильтрации, или множество или все редкие клетки, выделенные или экстрагированные из биологического образца фильтрацией, могут быть собраны для анализа в (b). Более того, выделенные или экстрагированные редкие клетки могут быть культивированы или размножены перед анализом в (Ъ). Например, редкие клетки могут быть культивированы в присутствии или отсутствии специфического лекарственного средства или агента, такого как биологический, химический или радиологический агент, для определения их ответа на лекарственное средство, или по сравнению с редкими клетками, которые не были обработаны. Этот способ может быть использован для селективных обработок, направленных на редкие клетки, выделенные из конкретного пациента или для отслеживания ответа пациента на обработку или отслеживания развития устойчивости к лечению конкретным лекарственным средством или агентом.
Перед анализом в (b) выделенные или экстрагированные редкие клетки могут быть зафиксированы или окрашены либо in situ на фильтре, используемом для их выделения, либо после удаления с фильтров. Например, выделенные или экстрагированные редкие клетки могут быть проанализированы в (b) молекулярным анализом in situ после или перед окрашиванием или иммуноокрашиванием, либо на фильтре, либо на другом субстрате; или (b) могут включать цитоморфологический анализ выделенных или экстрагированных редких клеток in situ на фильтре или другой подложке, на которую выделенные редкие клетки (или впоследствии культивируемые или размноженные редкие клетки) перенесены. Выделенные или экстрагированные редкие клетки могут быть проанализированы или оценены другими способами, которые не требуют их прикрепления к подложке.
В способах, описанных в данном документе, (b) может включать молекулярный анализ белков, нуклеиновых кислот или других компонентов выделенных или экстрагированных редких клеток in situ на фильтре или другом субстрате, на который редкие клетки, или культивируемые редкие клетки, нанесены. Например, молекулярный анализ в (b) может включать молекулярный анализ белков, пептидов или полипептидов, выделенных или экстрагированных редких клеток; ДНК, РНК или микроРНК выделенных или экстрагированных редких клеток; или других компонентов редких клеток, помимо полипептидов или нуклеиновых кислот.
Процессы, описанные в данном документе, могут также включать (b1) визуализацию изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или in situ молекулярного анализа и/или (Ь2) запись изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или in situ молекулярного анализа.
В другом воплощении изобретение направлено на способ обнаружение наличия или отсутствия редких клеток, включающий (а) выделение, экстракцию, концентрирование или в иному случае очистку редких клеток, путем проведения биологического образца через фильтр и извлечение редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые удерживают редкие клетки, но позволяют пройти другим типам клеток; (b) необязательно, культивирование выделенных или экстрагированых редких клеток; (с) необязательно, фиксирование или окрашивание выделенных или экстрагированных редких клеток или необязательно культивируемых редких клеток; и (d) анализ выделенных или экстрагированных редких клеток из (а), (b) или (с) с помощью иммуномечения, и/или in situ молекулярного анализа ДНК, РНК и/или микроРНК, и/или молекулярного анализа белковых молекул редких клеток. Этот способ может использовать те же типы биологических образцов, что и описанные выше, и может выделять или экстрагировать редкие клетки после разведения биологического образца или предварительной обработки биологического образца, как описано выше. Редкие клетки после фильтрации также могут быть зафиксированы или использованы свежими или подвергнуты другим обработкам или стадиям, описанным выше. В стадии (d) выделенные, сконцентрированные, экстрагированные или в ином случае очищенные редкие клетки могут быть лизированы или использованы в интактном виде.
При лизисе выделенных или экстрагированных редких клеток (d) возможна детекция мутантного(ых) белка(ов) и/или мутантной РНК и/или мутации(ий) ДНК, ассоциированных с состоянием, расстройством или заболеванием. Например, редкие клетки могут быть лизированы для выделения полипептидов или других иммунологических компонентов, содержащихся внутри редких клеток, лизированных для выделения, концентрирования или в ином случае очистки компонентов, которые должны быть обнаружены, или лизированы для выделения нуклеиновых кислот для молекулярного анализа.
Этот способ может дополнительно включать выбор таргетного лечения для персонализированной медицины, для оценки эффективности лечения, или для обнаружения возможной устойчивости к лечению, основанном на обнаружении мутантной ДНК, и/или мутантной РНК, и/или мутантного(ых) белка(ов) в лизированных редких клетках. Например, после лизиса редких клеток (d) может быть осуществлено обнаружение наличия или отсутствия мутаций ALK в лизированных редких клетках; обнаружение наличия или отсутствия мутаций ALK в лизированных редких клетках, где указанный процесс дополнительно включает выбор лечения для объекта, затем определение эффективности лечения или обнаружение устойчивости к лечению на основе наличия или отсутствия мутации ALK; обнаружение наличия или отсутствия мутации K-RAS и/или EGFR в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, затем определение эффективности лечения, или обнаружение устойчивости к лечению, основанном на наличии или отсутствии мутации K-RAS и/или EGFR; или обнаружение наличия или отсутствия мутации B-RAF и/или HER2 в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, затем определение эффективности лечения, или обнаружение устойчивости к лечению, основанном на наличии или отсутствии мутаций B-RAF и/или HER2.
Изобретение также относится к персонализированному лечению, включающему повторы способов, описанных выше, с использованием биологических образцов, полученных из одного и того же объекта в различные периоды времени. Например, образцы редких клеток могут быть выделены из объекта до обработки лекарственным средством или другим агентом, снова или несколько раз в течение курса лечения, или снова после окончания лечения. Это позволяет дать долгосрочную оценку эффективности лечения.
Таким образом биологические образцы, полученные из одного и того же пациента перед и после лечения, в различные временные точки в ходе лечения состояния, или в ходе различных режимов лечения состояния, расстройства или заболевания, ассоциированного с редкими клетками. Такое персонализированное лечение также может включать (е) и/или (f), которые включают дополнительно сравнение количества редких клеток между образцами, полученными в различные моменты времени для определения эффективности схемы лечения или для детекции устойчивости схемы лечения, где снижение относительного количества детектированных редких клеток указывает на относительную эффективность схемы лечения, и где увеличение относительного количества детектированных редких клеток указывает на устойчивость к или неэффективность схемы лечения; и необязательно, (f) выбор эффективного персонализированного таргетного лечения для объекта на основании (е).
Тип или идентичность или происхождение редких клеток могут быть определены, например, иммунологически, путем окрашивания, по внешнему виду, или молекулярным анализом их белков, нуклеиновых кислот или других компонентов. Например, (d) может включать анализ выделенных или экстрагированных редких клеток, включающий определение статуса эпителиально-мезенхимального перехода редких клеток; может включать анализ выделенных или экстрагированных редких клеток, включающий определение статуса стволовых редких клеток; или может включать анализ выделенных или экстрагированных редких клеток путем определения наличия у редких клеток сигнатуры генной экспрессии, ассоциированной с метастатическими или инвазивными клетками, или определения экспрессии у редких клеток детерминант, ассоциированных с метастазированием или инвазией.
Способ, описанный здесь, также дополнительно может включать постановку раннего диагноза состояния, расстройства или заболевания, ассоциированного с редкими клетками, на основании (d) или прогноз состояния. Например, способы, описанные выше, могут включать постановку раннего диагноза злокачественной опухоли и/или инвазивной злокачественной опухоли, ассоциированной с редкими клетками, на основании (d); могут включать постановку раннего диагноза органа, из которого произошла злокачественная опухоль и/или инвазивная злокачественная опухоль; или могут включать постановку раннего диагноза инфекционного состояния, расстройства или заболевания, ассоциированного с редкими клетками на основании (d).
Способы, описанные здесь, могут дополнительно включать оценку эффективности лекарственного средства-кандидата или кандидатного лечения на молекулярные характеристики редких клеток, и выбор лекарственного средства или лечения, которые уменьшают количество редких клеток в объекте по сравнению с контролем, не получавшим лекарственное средство или лечение, и выбор лекарственного средства или лечения, которое уменьшает относительное количество редких клеток или модифицирует молекулярные или иммунологические характеристики редких клеток по сравнению с контролем.
Способы, описанные здесь, также могут включать оценку склонности и/или риска развития у объекта состояния, расстройства или заболевания, ассоциированного с исходным уровнем, или контрольное значение, указывающее на склонность или повышенный риск развития указанного состояния, расстройства или заболевания, или где молекулярное или иммунологическое изменение в редких клетках по сравнению с исходным уровнем или контрольным значением указывает на склонность или повышенный риск развития указанного состояния, расстройства или заболевания. Например, они могут включать оценку склонности и/или риска развития у объекта генетического состояния, расстройства или заболевания; злокачественной опухоли, опухоли или неопластического состояния, расстройства или заболевания; или инфекционного состояния, расстройства или заболевания.
В дополнение к процессам и способам, описанным здесь, настоящее изобретение также относится к набору, содержащему, по меньшей мере, один из одного или нескольких фильтров для экстракции или выделения редких клеток из биологической жидкости, один или несколько буферов, разбавителей или других агентов для обработки биологической жидкости перед фильтрацией, один или несколько буферов для суспендирования, отмывки или иной обработки редких клеток после того, как они будут экстрагированы или выделены из биологической жидкости, один или несколько буферов для переноса выделенных или экстрагированных редких клеток с фильтра на другую подложку, один или несколько цитоморфологических и/или цитохимических реактивов или других клеточных красителей, или буферов к этому, одно или несколько антител или других реагентов для иммунномечения редких клеток или буферов к этому, один или несколько реактивов для in situ анализа редких клеток на фильтре или другой подложке, один или несколько литических агентов или лизирующих буферов для лизиса редких клеток, одно или несколько антител или других реактивов для молекулярного анализа белков редких клеток или буферов к этому, один или несколько зондов, праймеров, нуклеотидов, ферментов или других реактивов для молекулярного анализа нуклеиновых кислот редких клеток, в том числе с помощью ПНР.
Изобретение также направлено на композиции, включающие одну или несколько редких клеток, выделенных, сконцентрированных, эктрагированных или в ином случае очищенных путем проведения биологического образца через фильтр и извлечения выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые позволяют удержать редкие клетки, но которые позволяют проходить другим типам клеток, а также на фильтр, или другую подложку, содержащую редкие клетки.
Набор, содержащий инструменты, оборудование и/или реактивы, для окончания как стадии фильтрации, так и различных типов множественных анализов, осуществляемых после фильтрации, может быть собран для облегчения способов, описанных выше.
Краткое описание чертежей
Фигура 1А. А (Случай 1) и В (Случай 2). A1 и В1. Циркулирующие опухолевые клетки, демонстрирующие интенсивное и цитоплазматическое окрашивание (балл 3+) с некоторыми мембранными утолщениями (стрелки) (ALK-иммуноокрашивание с использованием мАт 5 A4, иммунопероксидазы, исходное увеличение × 1000; измерительная полоска: 16 μΜ). А2 и В2. Ядра циркулирующих клеток гибридизованные двхцветным 2р23 LSI ALK локус-специфичным сплит-зондом. Два зонда (3', красный; 5', зеленый) демонстрируют различное разделение красного и зеленого сигналов (стрелки-указатели), что указывает на реаранжировку в 2р23 локусе гена ALK. Зонды дают перекрывающиеся сигналы в ядрах без реаранжировки (стрелки). Выделенные 3' сигналы (красный) также наблюдаются (звездочки) (исходное увеличение × 1000; измерительная полоска: 16 μм). A3 и В3. Циркулирующие клетки, демонстрирующие цитоморфологические критерии, выделяли способом ISET (исходное увеличение × 1000; MGG окрашивание; измерительная полоска: 16 μм). С. Один пациент с отрицательным FISH ALK и отрицательным IHC ALK в тканевой опухоли. C1. Циркулирующие опухолевые клетки, не демонстрируют окрашивание (балл 0) (ALK-иммуноокрашивание с использованием мАт 5A4, иммунопероксидаза, исходное увеличение × 1000; измерительная полоска: 16 μм). С2. Ядра циркулирующих клеток, гибридизованные двухцветным 2р23 LSI ALK локус-специфичным сплит-зондом. Два зонда (3', красный; 5', зеленый) демонстрируют перекрывающиеся сигналы в ядре без реаранжировки (стрелки). Разделение сигналов не детектировалось в этих опухолевых клетках (исходное увеличение × 1000; измерительная полоска: 16 μм). С3. Циркулирующие клетки, демонстрирующие цитоморфологические критерии, выделяли способом ISET (исходное увеличение × 1000; MGG окрашивание; измерительная полоска: 16 μм). D. Клетки Н22213 выделяли способом ISET. DI ALK-иммуноокрашивание с использованием мАт 5A4 (иммунопероксидаза, исходное увеличение × 1000), демонстрирует интенсивное и цитоплазматическое окрашивание (балл 3+) с некоторыми мембранными утолщениями (стрелки). D2. FISH с использованием двухцветного 2р23 LSI ALK локус-специфичной сплит-зонда на опухолевой клеточной линии Н2228, внесенной в периферическую кровь и далее выделенной с помощью способа ISET. Два зонда (3', красный; 5', зеленый) демонстрируют различное разделение красного и зеленого сигналов (стрелки-указатели), что указывает на реаранжировку в локусе 2р23, в гене ALK. Зонды давали перекрытие сигналов в ядрах без реаранжировки (стрелки). Выделенные 3' сигналы (красный) также наблюдался (звездочки) (исходное увеличение × 1000; измерительная полоска: 16 μм). D3. Клетки Н2228, окрашенные с помощью MGG, после фильтрации крови (исходное увеличение × 1000; MGG-окрашивание; измерительная полоска: 16 μм).
Фигура 1В. А (Случай 3), В (Случай 4) и С (Случай 5). A1-C1. Циркулирующие опухолевые клетки, демонстрирующие интенсивное и цитоплазматическое окрашивание (балл 3+) с некоторыми мембранными утолщениями (стрелки) (ALK-иммуноокрашивание с использованием мАт 5A4, иммунопероксидазы, исходное увеличение × 1000; измерительная полоска: 16 μм). А2-С2. Ядра циркулирующих клеток гибридизованные двухцветным 2р23 LSI ALK локус-специфичным сплит-зондом. Два зонда (3', красный; 5', зеленый) демонстрируют различное разделение красного и зеленого сигналов (стрелки-указатели), что указывает на реаранжировку в 2р23 локусе гена ALK. Зонды дают перекрывающиеся сигналы в ядрах без реаранжировки (стрелки). Выделенные 3' сигналы (красный) также наблюдаются (звездочки) (исходное увеличение × 1000; измерительная полоска: 16 μм). А3-С3. Циркулирующие клетки, демонстрирующие цитоморфологические критерии, выделяли способом ISET (исходное увеличение × 1000; MGG-окрашивание; измерительная полоска: 16 μм).
Фигура 2. Цитоморфологический анализ циркулирующих негематологических клеток со злокачественными признаками - Циркулирующие Опухолевые Клетки (СТС), детектируемые способом ISET у пациентов с COPD.
(А) и (В) СТС, выделенные способом ISET, и идентифицированные окрашиванием по протоколу MGG из пациентов с COPD, имеющих сформировавшийся рак легкого. (А) Выделенные СТС со злокачественными цитоморфологическими признаками (двойные стрелки: поры фильтра). (В) Кластер (СТМ) состоящий из 9 СТС со злокачественными цитоморфологическими признаками (исходное увеличение × 1000; измерительные полоски: 8 μм; двойные стрелки: поры на фильтрах).
(С) и (D) Иммуноокрашенные СТС, наблюдавшиеся на фильтрованной крови с помощью способа ISET для пациентов с COPD. (С) СТС, сильно экспрессирующие антиген пан-цитокератин только в пациентах с COPD. (D) СТС, коэкспрессирующие антигены пан-цитокератина и виментина в пациентах с COPD (исходное увеличение × 400; измерительные полоски: 16 μм; иммунофосфатазное окрашивание антителами к пан-цитокератину (KL1) и окрашивание иммунопероксидазой антителами против виментина; двойные стрелки: поры на фильтрах).
Фигура 3. Обнаружение клеток цитотрофобластов (А) и синцитиотрофобластов (В) в образцах шейки матки с помощью ISET. Фетальную природу выделенных клеток подтверждали с помощью STR-генотипирования с помощью информативных маркеров D5S615 (A) и D21S11 (В).
Осуществление изобретения
Образцы. Биологические образцы включают неисключительно биологические жидкости, содержащие неисключительно венозную и артериальную кровь, лимфу, мочу, сперму, перитонеальный выпот, спинномозговую жидкость, плевральную жидкость, слюну, мокроту, носовую жидкость, суставную жидкость, слезную жидкость, жидкость из уретры и мочеточника, желчную жидкость, жидкость поджелудочной железы, жидкость желудка, кишечную жидкость, ректальную жидкость, вагинальные выделения, образцы, собранные неисключительно из слизистой оболочки и органов, таких как полости рта, гортань, глотка, матка, шейка матки, влагалище, пищевод, желудок, слизистая оболочка тонкого и толстого кишечника, образцы, собранные неисключительно с помощью биопсии или других хирургических вмешательств, включающие неисключительно образцы из молочной железы, простаты, печени, легких, костного мозга и любого другого органа.
Фильтры и фильтрация. Для выделения или экстракции редких клеток могут быть использованы фильтры, включающие неисключительно мембрану поликарбоната, PET (полиэтилен терефталата) или другого материала, имеющего толщину, размер и плотность пор, адаптированные к экстракции или выделению определенных редких клеток. Фильтры, фильтрационное устройство, способы фильтрации, буферы и другое оборудование и вспомогательные материалы описаны Paterlini-Brechot в опубликованной патентной заявке США 2009/0226957, включенной в данный документ ссылкой.
Это охватывает (i) способ, включающий применение фильтра, содержащего, по меньшей мере, одну первичную зону фильтрации, при этом каждая первичная зона фильтрации имеет ограниченную площадь поверхности; и (ii) площадь поверхности каждой первичной зоны фильтрации и количество первичных зон фильтрации выбирают как функцию типа фильтруемой жидкости, типа биологических частиц, которые должны быть разделены, и объема фильтруемой жидкости.
Соответственно, изобретение относится к способу разделения биологических частиц и жидкости, которая содержит их для целей очистки или анализа и, возможно, диагностики, содержащему, по меньшей мере, одну вертикальную стадию фильтрации через фильтр, пористость которого подходит природе биологических частиц, которые должны быть отделены так, что указанные биологические частицы, удерживаются фильтром, который отличается тем, что в нем используют фильтр, содержащий, по меньшей мере, одну элементарную зону фильтрации, где каждая элементарная зона фильтрации имеет ограниченную поверхность, и тем, что поверхность каждой элементарной зоны фильтрации и количество элементарных зон фильтрации выбирают согласно природе фильтруемой жидкости, природе отделяемых биологических частиц и объему фильтруемой жидкости.
Каждая элементарная область фильтрации указанного способа имеет поверхность, равную поверхности диска с диаметром от 0,6 см до 3 см, и количество элементарных областей фильтрации выбирают так, чтобы соотношение объема жидкости, фильтруемой через поверхность фильтрации, составляло меньше, чем 40 мл/см2, а предпочтительно, больше, чем 0,14 мл/см2.
Предпочтительно, каждая элементарная область фильтрации имеет поверхность, равную диску с диаметром больше, чем или равному 0,8 см.
Предпочтительно, фильтр имеет поры, калиброванные по размеру от 3 мкм до 100 мкм, и плотность пор от 3×103 и 5×106 пор/см2.
Предпочтительно, фильтрацию проводят путем снижения давления от 0,05 бар до 1 бар, возможно с увеличением давления меньше чем 1 бар.
Для проведения фильтрации предпочтительно использовать фильтр, образующий кассету, соотносимую со средствами анализа остатков фильтрации путем определения элементарных областей фильтрации.
Предпочтительно, если кассета, образующая фильтр, включена в одноразовый модуль фильтрации, содержащий, по меньшей мере, одну камеру, для содержания фильтруемой жидкости, и который может быть обработан перед применением для стерилизации его или для освобождения его от ферментов, которые расщепляют ДНК, РНК или белки.
Биологические частицы, которые должны быть отделены, являются, например, клетками. В данном случае перед фильтрацией жидкости, содержащей клетки, образец жидкости для фильтрации может быть приготовлен из образца жидкости, содержащей клетки, такой как биологическая жидкость или клеточная культура, предварительно обогащенная клетками, которые должны быть отделены, и/или разведением.
Жидкость, содержащая клетки, может быть кровью, и предпочтительно фильтр в данном случае имеет калиброванные поры от 5 мкм до 25 мкм.
Жидкость, содержащая биологические частицы, является мочой, а калиброванные поры фильтра составляют от 8 мкм до 100 мкм.
Способ может быть использован для обнаружения клеток для диагностических целей, таких как опухолевые, фетальные, эндотелиальные, фибробластные мышечные, нервные или моноцитные клетки, клеточные штаммы, органные клетки, предшественники или гематопоэтические клетки, в биологической жидкости, такой как кровь, моча, асциты, спинномозговая жидкость, молоко, плевральный экстравазат, жидкость для промывания шейки матки, жидкость клеточной суспензии, полученная биопсией, хирургическим способом, или промывкой рта, или для детекции животных или растительных клеток.
Изобретение также относится к модулю фильтрации для имплементации способа, где указанный модуль включает: блок камеры, содержащий, по меньшей мере, один компартмент, закрытый в своей нижней части основанием, содержащим, по меньшей мере, один вырез; выдвижной держатель фильтра, содержащий, по меньшей мере, одно отверстие, при этом каждое отверстие расположено напротив выреза в блоке камеры; фильтр зажат между нижней поверхностью блока камеры и выдвижным держателем.
В данном модуле размеры каждого выреза в основании блока камеры и размеры каждого отверстия в выдвижном держателе фильтра такие, что каждая пара, состоящая из выреза в основании блока камеры и ассоциированного отверстия в выдвижном держателе фильтра определяют элементарную область фильтрации ограниченной поверхности в том смысле, что полезный объем каждого компартмента пропорционален количеству элементарных областей фильтрации, расположенных в основании компартмента.
Предпочтительно, если поверхность элементарной области фильтрации равна диску с эквивалентным диаметром от 0,6 до 3 см, а соотношение полезного объема каждого компартмента к сумме поверхностей вырезов, содержащихся в основании компартмента, составляет меньше, чем 40 мл/см2, а предпочтительно больше, чем 0,14 мл/см2, а также все промежуточные значения и поддиапазоны вышеупомянутых диапазонов.
Предпочтительно, если размеры, по меньшей мере, одного выреза в основании блока камеры и соответствующего отверстия в выдвижном держателе фильтра таковы, что поверхность соответствующей элементарной области фильтрации больше чем или равна поверхности диска с диаметром 0,8 см.
Предпочтительно, если, по меньшей мере, один компартмент может быть разделен на частичные компартменты с помощью, по меньшей мере, одной удаляемой разделяющей стенки, так что, по меньшей мере, один частичный компартмент содержит в своем основании, по меньшей мере, один вырез, и что соотношение объема указанного частичного компартмента к сумме поверхностей люков в основании частичного компартмента составляет меньше чем 40 мл/см2, а предпочтительно больше, чем 0,14 мл/см2, а также все промежуточные значения и поддиапазоны вышеупомянутых диапазонов.
Предпочтительно, если модуль фильтрации содержит рифленое уплотнительное соединение, расположенное между основанием блока камеры и фильтром, содержащим по меньшей мере, одно отверстие, соответствующее отверстию в основании блока камеры, где отверстие окружено, по меньшей мере, одним выступающим бортиком.
Кроме того, модуль фильтрации предпочтительно также содержит пластинчатый разъем между фильтром и поддержкой фильтра, содержащий, по меньшей мере, один вырез напротив отверстия в опоре фильтра.
Фильтр может образовать кассету, центральная часть которой содержит, по меньшей мере, одну пористую площадь и ее периферию, которая формирует рамку, содержащую средства для соотнесения его положения в опоре фильтра.
Средствами соотнесения являются, например, по меньшей мере, два отверстия различного диаметра, разработанные для взаимодействия с выступами соответствующего диаметра, представленными на креплении фильтра.
Предпочтительно, если, по меньшей мере, центральная пористая часть фильтра содержит от 3×103 до 5×106 пор на см2 диаметром от 2 мкм до 100 мкм. Все промежуточные значения и поддиапазоны размера пор, предусматриваются в пределах данного диапазона, включая 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 27.5, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 87,5, 90, 92,5, 95, 97,5 и 100 μм. Все диапазоны и поддиапазоны плотности пор также предусматриваются 1, 2, 3, 4, 5, 6, 7, 8, или 9×103, 104, 1, 2, 3, 4, 5, 6, 7, 8, или 9×104, 105, 1, 2, 3, 4, 5, 6, 7, 8, или 9×105, 106 и 1, 2, 3, 4, 5, 6, 7, 8, или 9×106 пор/см2.
Предпочтительно, если модуль фильтрации также включает, по меньшей мере, один затвор для закрытия верхнего выреза компартмента.
Предпочтительно, если блок камеры включает, в его нижней части, обод, расширяющийся наружу и взаимодействующий, по меньшей мере, с одним сборочным штифтом, позволяющим зажать фильтр между креплением фильтра и блоком камеры, где сборочный штифт содержит разрушаемый конец, выходящий за обод блока камеры.
Предпочтительно, все его части сделаны из материалов, подходящих для стерилизующих манипуляций или разработаны как не содержащие РНКазы, ДНКазы и протеинкиназы.
И наконец, изобретение относится к опоре модуля фильтрации для удержания модуля фильтрации на фильтрационной машине, включающей, по меньшей мере, один кулачок, который может двигаться между открытым положением и положением захвата, предназначенным для оказания давления на фильтр между креплением фильтра блоком камеры.
Предпочтительно, если, по меньшей мере, один кулачок разработан для того, чтобы, если модуль фильтрации содержит, по меньшей мере, один фиксирующий штифт, один из концов которого является разрушаемым, где конец, по меньшей мере, одного фиксирующего штифта отрезается при подаче давления на фильтр, по меньшей мере, одним кулачком.
Блок опоры образует часть фильтрующей машины.
Предпочтительно, если модуль фильтрации также содержит средство, разработанное для взаимодействия с комплементарными средствами на блоке опоры, для того чтобы придать ориентацию модулю фильтрации относительно блока опоры, а блок опоры содержит средства, разработанные для взаимодействия со средствами на модуле фильтрации, для того, чтобы соотнести ориентацию модуля фильтрации относительно блока опоры.
Способ выделения биологических частиц содержащихся в жидкости, согласно изобретению, включает фильтрацию жидкости на фильтре с характеристиками, подходящими для природы выделяемых частиц. Биологическими частицами могут быть клетки, красные кровяные клетки, агрегаты тромбоцитов, фибрины или остатки тканей. Фильтрованная жидкость в частности является жидкостью, полученной из образца биологической жидкости, которая может быть подвергнута предварительной обработке для облегчения выделения с помощью фильтрации. Эта предварительная операция, которая будет более подробно описана ниже, включает, в общем, особенно когда выделяемыми частицами являются клетка, одну или множество следующих операций: химическая обработка, разработанная для предварительного обогащения выделяемых клеток, разведение, химическая обработка, разработанная для облечения разделения фильтрацией выделяемых клеток.
Также как и в случае условий подготовки образцов жидкости для фильтрации, авторы отмечают, что для достижения хорошей надежности в процессе выделения детектируемых клеток, было необходимо адаптировать определенные характеристики фильтра к объему фильтруемой жидкости. В частности, фильтр должен быть разделен на элементарные области фильтрации, каждая имеющая поверхность, равную поверхности диска с диаметром от 0,6 см до 3 см, и предпочтительно больше чем 0,8 см и даже еще больше от 0,8 до 1,5 см, а также все промежуточные значения и поддиапазон вышеуказанных диапазонов. Элементарные области фильтрации могут быть, например, в форме диска.
Кроме того, количество фильтруемой жидкости, которое должно пройти через каждую из элементарных областей фильтрации, должно составлять от 1 мл до 100 мл, а предпочтительно этот объем должен составлять от 8 мл до 15 мл. Эти диапазоны включают все промежуточные значения и поддиапазоны вышеупомянутых диапазонов.
Таким образом, для фильтрации конкретного образца должно быть использовано устройство для определения количества элементарных областей фильтрации на фильтре пропорционально объему фильтруемого образца.
В общем, объем фильтруемого образца зависит с одной стороны, от объема биологической жидкости, которая была взята изначально, а с другой стороны от возможного разведения, которое зависит, в частности, от природы разделяемых биологических частиц. Взятый объем зависит, в частности, от природы взятой жидкости, и возраста пациента, из которого взята жидкость. Специалистам в данной области известно, как определить какие объемы необходимо взять в зависимости от природы забираемой жидкости и в зависимости от пациента, из которого эта жидкость забирается.
Разведение зависит, в частности, от количества частиц на единицу объема, которое может быть обнаружено в забираемой жидкости. Действительно, если фильтрация подлежит проведению в удовлетворительных условиях, количество выделяемых частиц на единицу объема фильтруемой жидкости не должно быть слишком большим для того, чтобы избежать засорения фильтра. Более того, если процесс предназначен для обнаружения конкретных редких клеток, смешанных с намного большим количеством клеток, количество клеток на единицу объема не должно быть слишком маленьким, для того, чтобы достичь приемлемой вероятности обнаружения искомых клеток на фильтре. Специалистам в данной области известно как определить эти степени разведения в зависимости от природы рассматриваемой жидкости, и типа искомой клетки.
Биологические образцы, забранные из пациента, могут, например, быть кровью, мочой, перитонеальным выпотом, спинномозговой жидкостью, молоком или плевральным экстравазатом; также могут быть жидкостью после промывки шейки матки или любой жидкостью, которая может быть результатом забора биологического образца из пациента.
Способ анализа также может быть использован для поиска клеток в образцах, которые не были напрямую взяты из пациента, и например, в образцах, взятых из сред клеточных культур, полученных из мазков или биопсий или из образцов ткани человека или животного, или, кроме того, из сред клеточных линий человека или животного.
Если забранная биологическая жидкость является кровью, то забранное количество в общем составляет от 1 мл до 20 мл, и кровь разводят до соотношения, варьирующего от 1 в 5, до 1 в 20 для получения образца жидкости для фильтрации которого, в этих условиях, фильтрация производится через более чем от 1 до 20 элементарных областей фильтрации. Эти значения включают все промежуточные значения и поддиапазоны вышеупомянутых диапазонов.
Для всех других жидкостей образцы примерно составляют от 5 мл до 10 мл и разводятся в соотношении от 1 в 2 до 1 в 10, или они могут быть неразведенными. Эти образцы фильтруются через количество элементарных областей, которое может составлять вплоть до 5 или даже больше, особенно, если фильтруется 10 мл образец, который был разведен в соотношении 1 в 10. Эти значения включают все промежуточные значения и поддиапазон вышеупомянутых диапазонов.
Искомыми клетками являются, в частности, редкие клетки, такие как опухолевые клетки, фетальные клетки, эндотелиальные клетки, фибробластные клетки, мышечные клетки, нервные клетки, моноцитарные клетки, клеточные штаммы, органные клетки (печеночные, почечные и т.п.), предшественники и гематопоэтические клетки. Этот перечень, который дан в качестве примера, не является ограничительным.
Перед фильтрацией клетки могут быть предварительно обогащены обработкой по типу градиента плотности или лизисом клеток, которые не представляют интерес, или иммуноопосредующими способами, положительным или отрицательным скринингом, путем стимуляции пролиферации искомых клеток и т.п.
Этот перечень не является ограничительным, и специалисту в данной области известно как выбрать способ предварительного обогащения, подходящий для природы клеток, которые он или она хочет выделить.
Также как и в случае обработки для предварительного обогащения, жидкий образец, содержащий клетки, может быть обработан реактивом соответствующим природе искомых клеток, для облегчения разделения операцией фильтрации.
Цель обработки может заключаться в лизисе красных кровяных клеток и антикоагуляции крови, если биологический образец содержит кровь, и включает, например, добавление сапонина и EDTA.
Цель обработки также может заключаться в фиксации ядросодержащих клеток, например, путем добавления формальдегида, если фильтрация предназначена для выделения фиксированных клеток. В данном случае задача обработки заключается в осуществлении возможного обогащения.
Если фильтрация предназначена для выделения нефиксированных клеток, биологический образец может быть обработан реактивом в условиях, подходящих для временного придания жесткости биологическим мембранам (например, путем добавления полисахарида, DMSO, холодом, и т.п.).
Специалистам в данной области известно, как выбрать наиболее подходящий способ, согласно природе искомых клеток.
Биологический образец, который может быть разведен, предварительно обогащен, или обработан реактивом, позволяющим фильтрацию, подходящую для искомой цели, затем фильтруется через фильтр, изготовленный из поликарбоната или эквивалентного материала, который имеет калиброванные поры и размер от 1 мкм до 100 мкм и подходит к природе разделяемых частиц. Все промежуточные значения и поддиапазоны предполагаются в пределах диапазона, включая 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 27.5, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 87,5, 90, 92,5, 95, 97,5 и 100 μм. Размер предпочтительно составляет от 3 мкм до 25 мкм, и составляет, например, около 8 мкм, особенно если выделяются опухолевые клетки или эпителиальные клетки.
Плотность пор подходит для природы разделяемых частиц. Предпочтительно если плотность пор фильтра составляет от 5×103 до 5×106 пор/см2 и даже лучше от 5×104 до 5×105 пор/см2. Предполагаются все промежуточные значения и поддиапазоны в пределах этих диапазонов, а также следующие конкретные значения: 1, 2, 3, 4, 5, 6, 7, 8, или 9×103, 104, 1, 2, 3, 4, 5, 6, 7, 8, или 9×104, 105, 1, 2, 3, 4, 5, 6, 7, 8, или 9×105, 106 и 1, 2, 3, 4, 5, 6, 7, 8, или 9×106 пор/см2.
Фильтрацию осуществляют предпочтительно путем снижения давления от 0,05 бар до 1 бар, а предпочтительно примерно 0,1 бар. Предполагаются все значения и поддиапазоны данного диапазона, включая 0,05, 0,06, 0,07, 0,08, 0,09, 0,10, 0,20, 0,30, 0,40, 0,50, 0,60, 0,70, 0,80, 0,90 и 1,0 бар. Фильтрация может быть выполнена при незначительном повышении давления жидкости, находящейся над фильтром. Это повышение в давлении должно быть, однако, меньше чем 1 бар. Эти условия особенно подходят разделению.
Способ может быть использован для различных задач, например, для поиска редких клеток в суспензии в биологической жидкости, с тем, чтобы позволить диагностировать или очистить жидкость для проведения анализа элементов в растворе в хороших условиях.
Если способ используется для поиска клеток и их анализа, то после фильтрации фильтр, который использовался для фильтрации жидкости, извлекается, гарантируя тем самым, что области фильтрации ясно идентифицированы и что может быть проведена связь между этими областями фильтрации и отфильтрованным образцом. Фильтр затем используют для анализа клеток, которые возможно были извлечены в областях фильтрации.
Эти способы анализа, которые известны per se, принадлежат, например, к следующим типам: цитологическое окрашивание (гематоксилин, эозин и т.п.), иммуномаркировка (иммуногистохимия, иммунофлуоресценция), PNA, FISH, PRINS, ПЦР, in situ или другие молекулярные методы, спектрофотометрия, лазерная захватывающая микродиссекция с последующими таргетными молекулярными анализами на ДНК (экстракция ДНК, генотипирование, количественный ПЦР, анализ мутаций, CGH (сравнительная геномная гибридизация)), на РНК (экстракция и анализ с помощью ПЦР транскриптов, количественная GWH) и на белках (экстракция белков, микросеквенирование и т.п.).
Молекулярные анализы могут быть осуществлены на обогащенных клетках, удерживаемых на фильтрах, и перемещенных на предметное стекло методом, схожим с методом Саузерна, индивидуально подвергнутые микродиссекции с фильтра или со стекла согласно определенным критериям (морфологические характеристики клеток с или без маркировки различной природы) и подвергнутых индивидуальному или общему молекулярному анализу.
Клетки также могут быть отсоединены от фильтра промывкой соответствующим буфером для экстракции и анализ их ДНК, РНК и белков.
Элементы, выделенные фильтрацией, затем проверяются с помощью микроскопа и анализ изображений, полученных на фильтре, может быть проведен вручную или автоматическими средствами, в частности с помощью оборудования для анализа изображений.
Способ также может быть использован для очистки биологической жидкости, такой как моча, содержащей в растворе ДНК, РНК или белки, которые подлежат анализу. Цель очистки жидкости заключается в устранении всех биологических частиц, присутствующих в жидкости, которые могут мешать анализу. В данном случае, фильтры не сохраняются, и анализируется фильтрованная жидкость.
Такой способ фильтрации и получения образца и способы анализа могут быть использованы, как утверждалось ранее, в частности, для диагностических целей для обнаружения патологий, ассоциированных с присутствием конкретных клеток, возможно в экстремально малых количествах. В частности, способ может быть использован для детекции злокачественных клеток, которые могут высвобождаться в кровь пациента в ходе хирургической операции. Специалистам в данной области известно, что клетки можно искать для обнаружения конкретной патологии.
Подложка. Подложка может представлять собой твердую непористую подложку, такую как стекло или чашка Петри, или культуральная лунка, или любая другая подложка, сделанная из стекла или пластика, или любого твердого материала, который может быть использован в качестве подложки для культивируемых клеток, для обработки или анализа любого типа: цитоморфологического, иммуномечения, in situ молекулярных анализов, включая анализы белка, ДНК или РНК, и сбор клеток для молекулярных анализов, включая анализы белка, РНК или ДНК.
Фильтрация. Фильтрация биологического образца для экстракции, выделения, очистки или концентрирования редких клеток, проводится с использованием неисключительно мембраны из поликарбоната, PET (полиэтилен терефталата) или другого материала, имеющего размер и плотность пор, адаптированные для экстракции или выделения определенных редких клеток и путем использования понижения давления под фильтром для выделения или экстракции редких клеток.
Экстракция клеток вертикальной фильтрацией биологического образца позволяет наслоить его и сделать доступным для дальнейших анализов, таких как обнаружение, описание и диагностика редких клеток. Выделение клеток вертикальной фильтрацией биологического образца позволяет отделить редкие клетки от более мелких клеток для их обогащения и позволяет сделать их доступными для дальнейших анализов, таких как обнаружение, описание и/или диагностика редких клеток. Как правило, выделение редких клеток фильтрацией крови позволяет отделить основную часть нейтрофилов и зрелых лимфоцитов и эритроцитов (эритроциты не содержат ядра, поэтому они не рассматриваются истинными клетками и, как правило, лизируются перед фильтрацией), которые являются наиболее мелкими клетками в организме, поскольку их размер составляет от 6 до 9 микрон, и удержать на фильтре клетки, большие, чем нейтрофилы, и зрелые лимфоциты, включая активированные лимфоциты, моноциты, макрофаги, стволовые клетки, опухолевые клетки, злокачественные клетки, опухолевые микроэмболы, зрелые и незрелые эндотелиальные лимфоциты, меланоциты, миелобласты, промиелобласты, мегакариобласты, мегакариоциты и, как правило, все клетки организма, которые не являются нейтрофилами и зрелыми лимфоцитами. Более того, выделение редких клеток фильтрацией крови также позволяет собрать, на другой стороне фильтра, плазму и лейкоциты или другие компоненты биологического образца, отличные от редких клеток, выделенных фильтрацией. Плазма содержит свободную ДНК и РНК, и белки, включая свободную опухолевую ДНК и опухолевую РНК, и опухолевую микроРНК и белки у пациентов со злокачественным новообразованием, и включая свободную фетальную ДНК, фетальную РНК и фетальную микроРНК и белки у беременных женщин. Термин «свободный» означает «вне клеток», потому что нуклеиновые кислоты находятся в плазме. Свободная опухолевая ДНК используется для диагностики опухолевых мутаций в пациентах со злокачественной опухолью, а свободная фетальная ДНК используется для пренатальной диагностики анеуплоидий и других генетических расстройств, определения возраста плода, статуса RhD, и для проведения тестов на установление отцовства. Сбор лейкоцитов одновременно с редкими клетками и плазмой, может быть полезен для анализа и получения информации о генетическом фоне индивидуума. Свободную опухолевую ДНК и/или РНК и/или белок предполагается получать из лизированных, возможно апоптотических опухолевых клеток, из опухолевой массы и/или опухолевых метастазов и/или циркулирующего компартмента опухолевых клеток. Анализ свободной опухолевой ДНК и/или РНК и/или белков осуществляют экстракцией ДНК и/или РНК и/или белков из плазмы и поиском мутаций с помощью молекулярных анализов. Например, быстрый анализ наличия мутаций K-Ras в пациентах с раком легкого может быть осуществлен путем экстракции свободной ДНК из плазмы и поиском мутированных молекул K-Ras с помощью ПЦР, CAST-ПЦР, COLD-ПЦР, цифровой ПЦР и других таргетных молекулярных тестов. Таким образом, анализ мутаций K-Ras в циркулирующих опухолевых клетках может быть ассоциирован с анализом мутации KRas в ДНК из плазмы. Кроме того, исследование может начаться с поиска мутации KRas в плазме, которое менее дорого, и если мутации не обнаружены то, исследование может пойти по пути исследования мутации Kras в циркулирующих опухолевых клетках, что более дорого.
Диагностика пола плода легко проводится при низкой стоимости путем анализа ДНК плазмы. Однако, если количество свободной фетальной ДНК в плазме низкое, отрицательный сигнал с Y-специфичными молекулярными анализами не позволяют получить надежные результаты. В данном случае, можно добавить более дорогой анализ циркулирующих фетальных клеток, который позволить поставить надежный диагноз пола плода.
Обнаружение инфекционных заболеваний, таких как те, что вызваны HBV, HCV или HIV или бактериями или другими патогенами, может быть осуществлена экстракцией молекул, таких как ДНК, и/или РНК и/или микроРНК и/или белки, из плазмы и поиском наличия вирусной или бактериальной или другой патогенной ДНК, и/или РНК, и/или микроРНК, и/или белков с помощью молекулярных анализов. В качестве комплементарного теста, в циркулирующих редких клетках могут разыскиваться ДНК и/или РНК и/или микроРНК и/или белки, специфичные к патогенам.
В конкретных случаях также может быть полезным получить такую же информацию по мутированным или инфекционным молекулам в редких клетках, мутированным или инфекционным молекулам в плазме, и по геномным характеристикам индивидуума. В данном случае сбор плазмы и лейкоцитов после фильтрации для выделения циркулирующих редких клеток является особенно полезным. Например, у инфицированных пациентов может быть полезным искать инфекционные молекулы, такие как ДНК из ТВС-бациллы, в циркулирующих редких клетках, в плазме и для поиска признаков генетической восприимчивости в лейкоцитах. Например, в пациентах со злокачественной опухолью генетического происхождения, может быть полезным поискать мутацию, такую как BRCA1 или BRCA2, в циркулирующих опухолевых клетках, в плазме и в лейкоцитах. Например, в случае беременных женщин может быть полезным проанализировать редкие циркулирующие фетальные клетки на предмет наличия болезни Дюшенна, генетического заболевания, которое влияет только на плоды мужского пола, для поиска Y-последовательностей в свободной фетальной ДНК для того, чтобы узнать, что плод мужского пола, и для поиска статуса носительства в материнских лейкоцитах. Например, в случае беременных женщин может быть полезным проанализировать редкие циркулирующие фетальные клетки на предмет наличия болезни Хантингтона, доминантного генетического заболевания, которое может возникнуть поздно, для поиска мутантных последовательностей Хантингтона в свободной фетальной ДНК, и для поиска наличия мутации Хантингтона в материнских лейкоцитах. Фактически поскольку мутация является доминантной, наличие мутации в одном из двух родителей дает 50% риск поражения плода. Если генетический анализ открыл, что плод поражен, с помощью анализа материнских лейкоцитов может быть полезным проверить, является ли носителем мутации мать.
Эти примеры не являются исключительными. В общем, возможность выделения циркулирующих редких клеток и в то же время сбора плазмы и лейкоцитов для незамедлительного анализа или для хранения и анализа в дальнейшем, имеет высокий потенциал и значимость в неинвазивной персонализированной медицине.
Адаптация размера пор фильтра к фильтруемым биологическим образцам позволяет селективно выделить клетки дискриминатного размера, например, опухолевые микроэмболы и синцитиотрофобласты, группы клеток и мультиядерные клетки, и клеточные материалы, имеющие больший размер, чем индивидуальные клетки, таким образом эффективно выделяя такой материал из крови или других жидкостей с высокой чистотой (низкая или отсутствующая контаминация лейкоцитами и другими более мелкими клетками) путем фильтрации с использованием пор больше, чем 20-25 микрон в диаметре, таким образом устраняя фильтрацией все лейкоциты и эритроциты.
Аналогично путем изучения конкретного размера опухолевых клеток в данном типе опухоли и/или в данном пациенте, и/или путем изучения конкретного размера определенных выделяемых редких клеток, возможно адаптировать размер пор, плотность пор и другие химические и физические признаки фильтра для максимизации извлечения и чистоты выделенных опухолевых и/или редких клеток. Например, размер фетальных клеток может варьировать от 10 до 30 микрон. Размер синцитиотрофобластов, как правило, больше, чем 100 микрон. Размер зрелых эндотелиальных клеток, которые не являются круглыми или вытянутыми клетками, составляет около 40 или 50 микрон на 10-20 микрон. Таким образом, представляющий интерес размер пор составляет от 5 микрон до 30 микрон, а больший размер пор позволяет устранить все лейкоциты. Фактически лейкоциты больше, чем макрофаги и моноциты, и имеют размер, который в общем больше, чем 20 микрон. Размер пор должен быть адаптирован очень близко к плотности пор, и находится в диапазоне от 0,5 до 2,0 Е5 пор на см2, поскольку между порами должно быть достаточно материала фильтра для сбора редких клеток.
Размер опухолевых клеток. Опухолевые клетки по определению не являются «дремлющими клетками», поскольку они продуцируют белки и могут пролиферировать, таким образом, их хроматин открыт и никогда не компактизован подобно хроматину зрелых лейкоцитов, таких как зрелые лимфоциты и зрелые нейтрофилы, которые являются основной частью лейкоцитов (по количеству), и поэтому они меньше, чем опухолевые клетки. Размер индивидуальных опухолевых клеток может варьировать от 10 микрон до 50 микрон или больше, в зависимости от типа опухолевых клеток. Размер опухолевых клеток из мелкоклеточной карциномы легкого (SCLC): 1,5-3 размера лимфоцитов (12-24 микрона), размер опухолевых клеток немелкоклеточной карциномы легкого (NSCLC): больше 3 размеров лимфоцитов (24 микрона). Размер опухолевых микроэмбол в общем составлял больше, чем 100 микрон.
Преимущества фильтрации. Экстракция или выделение редких клеток фильтрацией имеет несколько преимуществ, по сравнению с другими способами экстракции/выделения:
Фильтрация позволяет выделить редкие клетки с очень высокой чувствительностью, включая сбор одной индивидуальной редкой клетки, которая может быть внесена перед фильтрацией в один мл крови, таким образом смешиваясь с несколькими миллионами лейкоцитов и несколькими миллиардами эритроцитов.
Фильтрация позволяет провести экстракцию или выделение редких клеток независимо от антигенов, экспрессирующих редкие клетки, например, избегая ошибки выделения, приводящей к потере редких клеток.
Фильтрация облегчает проведение мультианализов редких клеток, включая морфологические анализы, анализы иммуномечения, молекулярные анализы in situ и молекулярные анализы без интерференции с другими нередкими клетками.
Фильтрация позволяет специалисту модулировать чистоту выделенных редких клеток, что облегчает проведение мульти-анализов на них, включая морфологические анализы, анализы иммуномечения, молекулярные анализы in situ и молекулярные анализы без интерференции с другими нередкими клетками.
Фильтрация позволяет специалисту собрать редкие клетки индивидуально, в виде одиночных клеток или групп одиночных клеток, или в виде клеток, смешанных с остаточными нередкими клетками для дальнейшего молекулярного анализа.
Фильтрация ускоряет обнаружение и подсчет редких клеток путем избавления от миллионов малых лейкоцитов и миллиардов эритроцитов.
Фильтрация позволяет специалисту экстрагировать или выделять зафиксированные или свежие клетки для дальнейшего анализа.
Другие режимы фильтрации. Различные режимы фильтрации могут быть использованы при условии, что они позволяют отделить редкие клетки от других типов клеток и/или позволяют наслоить клетки на фильтр для дальнейшего анализа. Например, сила для отделения редких клеток от других типов клеток, которая проходит через фильтр, может быть гравитацией, положительным или отрицательным давлением, или центрифужной силой.
Предварительная обработка Образцов. Биологические образцы могут быть разведены и/или обработаны перед и/или после фильтрации агентами, используемыми для лизиса эритроцитов, таких как сапонин, хлорид аммония, литические антитела, гипотонические растворы, антикоагулянты, подобные EDTA, гепарин, кумадин, и другие антагонисты витамина К, антагонисты фактора Ха, ингибиторы тромбина; аспирин (салициловая кислота) и другие агенты, предотвращающие агрегацию тромбоцитов (http://en.wikipedia.org/wiki/Antiplatelet_drug, доступный с 21 мая 2013 года), муколитические лекарственные средства, и фиксирующие агенты (см. ниже).
Редкие клетки, экстрагированные или выделенные из биологических образцов фильтрацией, могут быть зафиксированными клетками или свежими клетками. Зафиксированные или свежие редкие клетки, экстрагированные или выделенные из биологических образцов фильтрацией, могут быть перенесены на подложку, включающую неисключительно предметное стекло, чашку Петри, лунку или микролунку, или тестовую пробирку или другую подложку для анализа, молекулярного анализа или культивирования. Перенос клеток из фильтра на подложку может быть осуществлен с применением средств сбора и/или отсоединения и/или буферов. Например, для переноса всех клеток с фильтра на предметное стекло или на твердую подложку и для того, чтобы избежать потерь редких клеток, возможно применение коммерчески доступных адгезивных предметных стекол, таких как SuperFrost Ultra Plus® slides или Clearcell™ и Adcell™ BioAdhesion Slides и/или для обработки фильтра до фильтрации с помощью агентов, которые предотвращают прилипание клеток к фильтру с помощью силиконизированных агентов, таких как Sigmacote™ или похожего. Для переноса всех клеток, собранных на фильтре, на предметное стекло, или на любую другую подложку и для того, чтобы избежать потерь редких клеток, также возможно оказать содействие переносу с помощью растворов, наносимых на заднюю сторону фильтра, то есть на сторону, которая не связывает клетки, и создать поток буфера через поры к твердой поверхности, который будет отделять клетки от фильтра, для того, чтобы они могли прикрепиться к предметному стеклу или другой твердой подложке. Этот процесс переноса клеток и редких клеток, собранных на фильтре, на предметное стекло или другую твердую подложку, также может быть улучшен с помощью положительно воздушного и/или жидкостного давления, применяемого к задней стороне фильтра: воздух и/или жидкость будут проходить через поры и помогать клеткам переноситься на предметное стекло или другую твердую подложку. Все эти протоколы для отсоединения клеток и редких клеток от фильтра и переноса их на предметное стекло или твердую подложку будут работать лучше, если клетки на фильтре не высушены, то есть если перенос осуществляется вскоре после фильтрации.
Экстракция или выделение зафиксированных клеток фильтрацией осуществляется путем фиксирования их до фильтрации с помощью фиксирующих агентов, включающих неисключительно формальдегид, параформальдегид, глутаральдегид, RCL2, ртутьсодержащие препараты, такие как В5 или фиксатор Зенкера, метиловый спирт и этиловый спирт, пикраты, такие как раствор Боуина, фиксатор Риго и т.п.
Свежие редкие клетки, экстрагированные или выделенные из биологических образцов фильтрацией могут быть зафиксированы после фильтрации с помощью фиксирующих агентов, содержащих неисключительно формальдегид, параформальдегид, глутаральдегид, RCL2, ртутьсодержащие препараты, такие как В5 или фиксатор Зенкера, метиловый спирт и этиловый спирт, пикраты, такие как раствор Боуина, фиксатор Риго и т.п.
Культивирование редких клеток. Редкие клетки, экстрагированные или выделенные из биологических образцов могут быть подвергнуты культивированию для увеличения их количества и для облегчения обнаружения и/или диагностики и/или описания. Протокол культивирования может включать средства для стимуляции предпочтительного роста редких клеток относительно роста нередких клеток для повышения чистоты редких клеток. Средства для стимуляции предпочтительного роста редких клеток относительно роста нередких клеток включают неисключительно специфические факторы роста и/или агенты, стимулирующие рост редких клеток, кокультивирование редких клеток с другими клеточными типами и/или применение фидерных слоев, помогающих росту редких клеток, и средства для блокирования роста и/или выживания нередких клеток, такие как ингибирующие антитела, блокаторы клеточного цикла, проапоптотические факторы, киРНК, и лекарственные средства, любого типа, в частности, нацеленные на нередкие клетки для достижения блокировки их роста и/или для их уничтожения.
Описание редких клеток. Обнаружение редких клеток и/или диагностика и/или описание могут быть получены с помощью цитоморфологического анализа и/или анализа иммуномечением и/или молекулярного анализа. Цитоморфологический анализ и анализ иммуномечения осуществляют in situ на интактньгх клетках, т.е. на клетках, плазматическая мембрана которых и/или границы цитоплазмы и/или границы ядра которых являются распознаваемыми.
Цитоморфологические анализы неисключительно включают окрашивание гематоксилином и/или эозином, окрашивание по Май-Грюнвальду и/или Гимзе, окрашивание по Папаниколау, окрашивание по Фельгену, и все типы окрашивания и стехиометрического окрашивания, целью которого является анализ клеточных морфологических деталей и анализ и/или количественная оценка клеточных компонентов. Цитоморфологические анализы неисключительно включают цитохимические анализы, которые неисключительно включают окрашивание PAS, Судан, альциановым синим, ферментативные и неферментативные способы, способные выявить клеточные компоненты, которые неисключительно включают кальций, липиды, полисахариды, ферменты и другие молекулы. Иммуномечение неисключительно включает мечение клеточных компонентов антителами, которые неисключительно включают антитела, нацеленные на эпителиальные антигены, мезенхимальные антигены, орган-специфические антигены, опухоль-специфические антигены, фетальные антигены, антигены, специфичные для стволовых клеток, факторы транскрипции, мутантные белки и любой белок и/или пептид и/или клеточный компонент, обнаружение которого может помочь с идентификцией клеток и/или диагнозом и/или описанием. Иммуномечение также неисключительно включает иммуноцитохимию, иммунофлуоресценцию, иммунную ПЦР, и все типы мечения клеточной структуры антителами, связанными со средством, используемым для выявления иммунологической связи и клеточной мишени.
Молекулярные анализы включают неисключительно FISH (флуоресцентную гибридизацию in situ), PRINS (праймированное мечение in situ), TUNEL (терминальное дезоксиуридиновое мечение концов), иммуноПЦР, ПНК (пептид-нуклеиновая кислота), in situ ПЦР и другие способы с использованием неисключительно молекулярных зондов, которые могут быть осуществлены in situ на интактных клетках.
Может быть осуществлен анализ изображений редких клеток после in situ окрашивания и/или иммуномечения и/или in situ молекулярных анализов и изображения могут быть сохранены и/или перенесены цифровым образом перед осуществлением дальнейших молекулярных анализов редких клеток, подразумевающих лизис клеток.
Молекулярные анализы, включающие неисключительно ПЦР, ПЦР с обратной транскриптазой, ПЦР в реальном времени, цифровой ПЦР, полногеномную амплификацию, секвенирование, высокопроизводительное секвенирование, CAST-ПЦР, COLD-ПЦР, Сравнительную геномную гибридизацию (CGH), CGH-эррей, микроэррейные анализы, анализы метилирования, анализы полиморфизмов, и т.п. могут быть осуществлены на клетках, структура которых была разрушена и/или лизированных для анализа молекулярных компонентов, включающих неисключительно молекулы ДНК, РНК, микроРНК и белка.
Молекулярные анализы, включающие неисключительно ПЦР, ПЦР с обратной транскрипцией, ПЦР в реальном времени, цифровой ПЦР, полногеномную амплификацию, секвенирование, высокопроизводительное секвенирование, CAST-ПЦР, COLD-ПЦР, Сравнительную геномную гибридизацию (CGH), CGH-эррей, микроэррейные анализы, анализы метилирования, анализы полиморфизмов, и т.п. могут быть нацелены на индивидуальные клетки, или группы индивидуальных клеток, или на все клетки, экстрагированные или выделенные фильтрацией из биологических образцов.
Целевые анализы индивидуальных клеток или групп клеток, идентифицированных согласно морфологическим критериям и/или иммуноменчению могут быть осуществлены с помощью лазерной захватывающей микродиссекции части фильтра, содержащей представляющие интерес клетки, или клетки после переноса на подложку, за которым следует лизис клеточных белков и молекулярный анализ молекул клеточной ДНК (геномной и/или митохондриальной ДНК), РНК, микроРНК и белков. В ином случае редкие клетки, экстрагированные или выделенные фильтрацией, могут быть откреплены от фильтра и индивидуальные клетки или группы клеток, идентифицированных согласно морфологическим критериям и/или иммуномечению могут быть выделены магнитным полем («Silicon biosystem» или другие способы, основанные на магнитном поле), или вручную или автоматическим капиллярным микропипетированием. В ином случае, все клетки экстрагированные или выделенные фильтрацией могут быть лизированы на фильтре, или после переноса на подложку, при использовании подходящего буфера для осуществления молекулярного анализа их ДНК (геномной и/или митохондриальной ДНК), РНК, микроРНК или белка, при использовании неисключительно ПНР, ПЦР с обратной транскрипцией, ПЦР в реальном времени, цифровой ПЦР, полногеномной амплификации, секвенирования, высокопроизводительного секвенирования, CAST-ПЦР, COLD-ПЦР, сравнительной геномной гибридизации (CGH), CGH-эррея, микроэррейных анализов, анализов метилирования, анализов полиморфизмов и т.п.
Неинвазивная тераностика. В числе других аспектов изобретение позволяет выделить циркулирующие опухолевые клетки из крови и использовать их для неинвазивной тераностики. Тераностика является применением диагностических результатов для предписания специфического «таргетного» лечения. Эти процедуры имеют преимущество конкретного молекулярного биомаркера, который может присутствовать в опухолевых клетках, для прогноза их восприимчивости на данную терапию. Поскольку терапии злокачественных опухолей является затратной и часто токсичной, тераностика, таким образом, является важной для минимизации затрат на здравоохранение и нагрузки вследствие побочных эффектов пациентов. Тераностические биомаркеры в настоящее время разыскиваются в первичных опухолевых и метастазных тканях. Однако было продемонстрировано, что опухолевые клетки в первичной опухоли являются более генетически гетерогенными и биопсии могут пропустить кластеры опухолевых клеток, несущих генетическую информацию, полезную для установки оптимального таргентного лечения. Метастазы считаются лучшим источником, но их биопсию трудно получить. Действительно, физические состояния пациентов со злокачественными новообразованиями часто препятствуют получению образцов из первичной опухоли или метастазов посредством инвазивного подхода (хирургии или биопсии) из-за высокого показателя осложнений, связанных с инвазивными процедурами. Более того, генетические характеристики опухолевых клеток могут измениться под давлением таргетного лечения, что делает важным отслеживание их в ходе лечения для детекции новых «мутантов опухолевых клеток», ускользнувших от таргетного лечения. Однако инвазивное последующее наблюдение генетических характеристик опухолевых клеток является неосуществимым в клинических условиях из-за связанных осложнений. И наконец, было полезно исследовать неинвазивно генетические характеристики опухолевых клеток в определенных пациентах для применения таргетных терапий до операций с целью снижения опухолевой нагрузки перед вмешательством и для лучшего удаления опухоли.
Таргетные терапии в настоящее время доступны для нескольких распространенных злокачественных новообразований (рак молочной железы, раки легкого, колоректальный рак и т.п.) и была показана их эффективность в части случаев. Однако в отсутствии продемонстрированных предиктивных факторов опухолевого ответа, этих таргетные дорогие терапии будут либо прописываться большей части пациентов, с огромным увеличением связанных затрат без пропорциональной пользы, или не будут прописываться, не давая пациентам получить пользу от них.
Имплементация тераностических биомаркеров, таким образом, как ожидается, приведет к впечатляющим терапевтическим улучшениям. Однако тераностические анализы, нацеленные на опухолевые ткани (первичная опухоль, метастазы) подразумевают инвазивные (хирургические или полухирургические) процедуры, которые не могут быть осуществлены на ослабленных пациентах, являются очень дорогими, и часто дают неполные данные. Следовательно, анализ опухолевых клеток и опухолевых микроэмбол, осуществленный неинвазивно, крайне важен в клинической онкологии.
Генетическое описание редких клеток. Информация о генетических характеристиках опухолевых клеток может быть получена неинвазивно из циркулирующих опухолевых клеток (СТС), циркулирующих опухолевых микроэмбол (СТМ), и опухолевых клеток, собранных из биологических жидкостей (мочи, перитонеального выпота, спермы, спинно-мозговой жидкости, слюны, мокроты и т.п.).
Способы исследования генетических характеристик опухолевых клеток варьируют согласно детектируемым генетическим аномалиям. Они могут опираться на цитологический, цитохимический иммуноцитохимический анализ, FISH, PRINS, иммуноПЦР, экстракцию ДНК и РНК и анализы, направленные на представляющие интерес гены или последовательности и/или полноэкзомные или полногеномные/транскриптомные последовательности.
Несколько тераностических биомеркеров были подтверждены, в частности для немелкоклеточного рака легкого (NSCLC) и рака толстой кишки. Рецептор эпидермального фактора роста (EGFR) является мембранной рецепторной тирозинкиназой. Сверхэкспрессия или сверхактивность EGFR обнаружена во множестве злокачественных опухолей. Мутации EGFR детектируются у 10%-15% всех пациентов с NSCLC и у 80% пациентов, которые клинически отвечают на ингибиторы EGFR тирозинкиназы, такие как гефитиниб (AstraZeneca) или эрлотиниб (Roche). Известные мутации EGFR включают мутации, расположенные в экзонах 18-21 тирозинкиназного домена EGFR. Эти мутации хорошо описаны в частности в случае рака легкого. Пациенты с первичной опухолью с мутацией L858R или мутацией в виде делеции экзона 19 имеют лучший ответ на ингибиторы EGFR, чем пациенты с опухолями с KRAS дикого типа [13]. Мутация L858R и мутация в виде делеции экзона 19 среди наиболее частых мутаций EGFR в опухолях легкого, с частотой примерно 43% и 48% от всех мутаций EGFR, соответственно (http://www.mycancergenome.org, доступно с 21 мая 2013 года).
KRAS (также известен как V-Ki-ras2 гомолог вирусного онкогена саркомы крыс Кирстен) кодирует 21 кДа ГТФазу, расположенную на внутренней мембране. Этот белок является ключевым компонентом пути передачи сигнала выше EGFR. Мутации KRAS происходят в 15-25% случаев аденокарциномы легкого (http://www.mycancergenome.org. доступ предоставлен 21 мая 2013 года). Наиболее частые мутации KRAS приводят к конститутивной активации киназной активности KRAS. Точечные мутации происходят в кодоне 12 (82% от всех мутаций KRAS) и 13 (17% от всех мутаций KRAS) в экзоне 2 гена KRAS. Стандартное секвенирование детектирует в одном тесте все мутации 12 и 13 кодонов (G12C: c34G>T, G12R : c34G>C, G12A : c35G>C, G12D : c35G>A, G12V : c35G>A, G12S : c34G>A, G13C : c37G>T, G13D : c38G>A).
KRAS дикого типа необходим для эффективного ингибирования EGFR у пациентов с NSCLC [13]. KRAS дикого типа также необходим для эффективного действия анти-EGFR терапевтических антител (Eli Lilly, Bristol-Myers Squibb, Merck Serono) у пациентов с метастатическим колоректальным раком [14, 15]. Мутации в кодонах 61 и 146 также сообщались, но они представляют незначительную долю мутаций KRAS (1-4%) и их клиническая значимость остается неясной [15].
В настоящее время NSCLC-пациенты с мутациями KRAS не имеют эффективной стратегии лечения. Ганетеспиб (Synta Pharmaceuticals) является низкомолекулярным ингибитором шаперона Hsp90, который в настоящее время проходит Фазу III клинического испытания. Испытание фазы II показало сокращение опухоли более чем у 60 процентов пациентов с мутантной по KRAS NSCLC в течение восьми недель после лечения ганетеспибом, вводимым еженедельно в виде монотерапии (Международная Ассоциация Исследования Рака Легкого, 14-я Всемирная Конференция по Раку Легкого).
Совсем недавно геномное изменение, в которое вовлечены гены киназы анапластической лимфомы (ALK) (2р23) и и белка-4, подобного белку, ассоциированному с микротрубочками эхинодерма (EML4), было обнаружено в подмножестве пациентов с раком легкого. Эти пациенты имели выдающийся положительный ответ на низкомолекулярный ингибитор ALK, кризотиниб (Pfizer) [16, 17, 18, 19]. Фактически кризотиниб в настоящее время тестируется в фазе III клинического исследования и предварительные результаты исследования фазы II свидетельствуют от внушительной 90% частоте контроля заболевания в опухолях легкого с реаранжировкой ALK [20]. Эта реаранжировка была обнаружена в 1-7% NSCLC согласно большинству серий, особенно в аденокарциномах поздних стадий, без ассоциированных мутаций EGFR и KRAS [21].
Два других особенных тераностических биомаркера были подтверждены в других типах злокачественных опухолей. Человеческий Рецептор Эпидермального Фактора Роста -2 (HER2) является связанной с поверхностью клеточной мембраны рецепторной тирозинкиназой и, как правило, вовлечен в пути передачи сигнала, приводящие к клеточному росту и дифференцировке. Локус HER2 амплифицирован в 20-30% опухолей молочной железы и наличие данной амплификации является показанием для таргетной терапии трастузумабом (анти-HER2, Roche) [22].
Зелбораф (Roche) является очень эффективным лекарственным средством, которое было недавно разрешено Управлением по контролю за продуктами и лекарствами (FDA) для лечения пациентов с меланомой, опухоли которой несут мутацию V600E гена гомолога В1 вирусного онкогена мышиной саркомы V-raf (BRAF). Поскольку данная мутация также присутствует у 1% пациентов с раком легкого, пациенты с раком легкого могут стать подходящими для данного лекарственного средства в будущем. Другие тераностические биомаркеры, подтвержденные или проходящие клинические испытания, включают:
Рак молочной железы и яичника: ER, PR, BRCA1, BRAC2
- Желудочно-кишечный рак: c-Kit, CDC4, р53
- Немелкоклеточный рак легкого: ROS1, HER2, FGFR, PDGFRA, VEGFR, PI3K
- MTOR, MEK, STAT3, AKT, RET химеры
- Рак предстательной железы: TMPRSS2/ERG.
Что касается неинвазивных тераностических анализов опухолевых клеток, то текущими нерешенными проблемами, решаемыми настоящим изобретением, являются следующие:
Опухолевые клетки экстрагировали или выделяли из биологических образцов весьма чувствительным способом, для того чтобы избежать их потери, и с максимальной чистотой, т.е. с минимумом загрязнения неопухолевыми клетками (для того чтобы избежать ложно-положительных результатов, полученных молекулярными анализами).
Кроме того, опухолевые клетки, полученные неинвазивно, являются очень редким, слабо представленным материалом; тем не менее, они должны быть объектом нескольких анализов и молекулярных анализов для того, чтобы применяться в качестве неинвазивного тераностического теста. Эти нерешенные проблемы мешают разработке и широкому применению неинвазивных тераностических тестов в клинической онкологии. В настоящем изобретении описывается решение проблем, упомянутых выше, с помощью способа, включающего следующие стадии:
(i) Фильтрация биологического образца при использовании мембраны, характеристики материала которой (поликарбонат, PET и т.п.), толщина, размер пор и плотность пор специально связаны с типом и количеством выделяемых опухолевых клеток и обрабатываемой биологической жидкостью, для выделения неинвазивно опухолевых клеток и опухолевых микроэмбол.
(ii) Окрашивание/мечение выделенных клеток цитологическим окрашиванием, иммуноокрашиванием, FISH, Tunel, PRINS, иммуноПЦР, и другими типами анализов, осуществляемых без лизиса клеток в качестве терраностического теста
(iii) Анализ изображений окрашенных/меченных клеток включая сканирование запись с высокой плотностью изображений клеток. Изображения могут быть проанализированы в диагностических целях, сохранены и/или перенесены электронным образом специалистам, помогающим в диагностическом процессе.
(iv) таргетный лизис опухолевых клеток, свежих или фиксированных клеток, собранных неинвазивно. Таргетный подход включает стадию лазерной захватывающей микродиссекции (англ. Laser Capture Microdissection, LCM). LCM позволяет выделить одиночные опухолевые клетки (или кластеры опухолевых клеток) после выделения фильтрацией. Этот способ позволяет провести генетический анализ на чистой опухолевой ДНК. Поскольку клетки являются гетерогенными и смешаны с нормальными клетками (в тканях, а также на фильтрах), LCM в настоящее время является способом оценки процента мутантных СТС среди популяции СТС. Альтернативой LCM являются системы микрокроманипуляций, «DEPArray» (Silicon Biosystem) или «CellCelector» (ALS). После лизиса клетки подвергаются анализу ДНК и/или РНК и/или белка.
(v) Нецелевой лизис всех фиксированных или свежих клеток, экстрагированных фильтрацией для их молекулярных (РНК, ДНК и/или белки) анализов, включая молекулярные анализы, нацеленные на мутированные последовательности, смешанные с немутантными последовательностями (COLD-ПЦР, CAST-ПЦР и т.п.)
(vi) Тераностические молекулярные анализы, направленные на РНК, ДНК и/или белки, нацеленные на один или несколько биомаркеров или примененные к полноэкзомной или геномной последовательности.
Преимуществами данной стратегии являются следующее:
(a) Оптимизированный подход для выделения редких клеток из биологических образцов с максимальной чувствительностью и чистотой и отсутствием ошибок выбора редких клеток, которые могут быть получены из систем захвата на основе иммуномечения и/или систем на основе маркеров.
(b) Возможность осуществить несколько диагностических и/или прогностических и/или тераностических анализов на одинаковых редких клетках, собранных неинвазивно. Например, у пациентов с раком легкого можно получить из одних и тех же опухолевых клеток, собранных неинвазивно, результаты анализа ALK (FISH) и KRAS и молекулярного анализа EGFR (ДНК-анализы после лизиса клеток). Например, у пациентов с инфекционными заболеваниями, можно получить из клеток иммунной системы, таких как активированные лимфоциты или моноциты и макрофаги, результаты анализов FISH, специфичные к внутриклеточным вирусам (ВИЧ и т.п.) или микробиологических агентов (Shigella, ТВС-бацилла, Leishmania, и т.п.) и результаты анализа ДНК и/или РНК и/или белка, специфичного к инфекционному агенту.
Например, у беременных женщин можно получить неинвазивно из выделенных редких фетальных клеток, результаты цитопатологического анализа и/или анализа иммуномечения и/или молекулярного анализа in situ (FISH или PRINS с Y-специфичными зондами) для диагностики наличия мужских фетальных клеток для осуществления анализа мутаций ДНК и/или РНК и/или белка, проведенного на лизированных клетках, которые демонстрируют наличие или отсутствие мутантных молекул, и, таким образом, наличие или отсутствие фетальных генетических расстройств.
(с) Возможность получения диагностической и/или прогностической и/или тераностической информации о наличии, или отсутствии, и количестве опухолевых клеток или других редких клеток, экстрагированных или выделенных фильтрацией и возможность сохранения изображений цитопатологического анализа и/или анализа иммуномечения и/или in situ молекулярного анализа перед переходом к лизису клеток, которые позволяют получить диагностическую и/или прогностическую и/или тераностическую информацию о наличии или отсутствии мутаций ДНК и/или РНК и/или белка и о наличии или отсутствии патологических молекул ДНК и/или РНК и/или белка в редких клетках анализируемого биологического образца.
Например, у пациентов со злокачественной опухолью можно получить из одних и тех же опухолевых клеток, собранных неинвазивно, сохраненные изображения результатов цитопатологического анализа и/или анализа иммуномечения и/или молекулярного анализа in situ для диагностики наличия опухолевых клеток и описания их in situ иммунологическим и in situ молекулярным анализом и для осуществления анализа мутаций ДНК и/или РНК и/или белка, проведенного на лизированных клетках.
Например, у пациентов с инфекционными заболеваниями можно получить неинвазивно, из выделенных редких клеток, сохраненные изображения результатов цитопатологического анализа и/или анализа иммуномечения и/или молекулярного анализа in situ для диагностики наличия инфицированных клеток и описания их in situ иммунологическим и in situ молекулярным анализом и для осуществления анализа ДНК и/или РНК и/или белка, проведенного на лизированных клетках, который продемонстрирует наличие или отсутствие молекул инфекционных агентов, и таким образом наличие или отсутствие и количество инфекционных агентов.
Например, у беременных женщин можно получить неинвазивно, из выделенных редких фетальных клеток, сохраненные изображения результатов цитопатологического анализа и/или анализа иммуномечения и/или молекулярного анализа in situ для диагностики наличия фетальных клеток и описания их in situ иммунологическим и in situ молекулярным анализом и для осуществления анализа мутаций ДНК и/или РНК и/или белка, проведенного на лизированных клетках, который продемонстрирует наличие или отсутствие мутантных молекул, и таким образом наличие или отсутствие фетальных генетических расстройств.
Эти преимущества не предоставляются в настоящее время любым из способов, нацеленных на редкие клетки, в том числе способами для неинвазивных тераностических анализов.
ПРИМЕРЫ
Пример 1: Мультианализ свежих, нефиксированных опухолевых клеток, обогащенных из крови фильтрацией
Фильтрация. Свежие опухолевые клетки экстрагировали и обогащали из крови фильтрацией как описано в опубликованной патентной заявке US-2009-0226957.
Экстрагированные нефиксированные клетки окрашивали для определения их морфологии, а их нуклеиновые кислоты экстрагировали и анализировали с помощью ОТ-ПЦР и ПЦР после полногеномной амплификации.
Для экстракции и обогащения редких опухолевых клеток из крови, образец крови разводили в 20 раз с помощью буфера для лизиса красных кровяных клеток. Давали пройти лизису в течение 5 минут при комнатной температуре при осторожном перемешивании.
Обработанный образец крови затем сразу же фильтровали при понижении давления - 6 мБар. Фильтрацию останавливали перед тем, как она полностью закончится, таким образом, чтобы в лунке осталось около 200 мкл.
Обогащенный свежий клеточный материал собирали осторожным 3-х кратным пипетированием 1 мл клеточной культуральной среды (DMEM HEPES 1% фетальная телячья сыворотка).
Собранный материал затем центрифугировали при 1000 об./мин. в течение 5 минут и осторожно удаляли надосадочную жидкость. Осадок ресуспендировали в среде для культивирования клеток.
Экстрагированные клетки затем могут культивироваться с использованием DMEM и 10% фетальной телячьей сыворотки. Экстрагированные или культивируемые клетки затем можно использовать для проведения функциональных тестов, таких как тест секретируемых белков, в тестах пролиферации или в тестах адгезии.
Индивидуальные опухолевые клетки могут быть выделены (i) с помощью (микро)пипетки под микроскопом, на основании простых критериев размера клетки или на основании иммуномечения; или (ii) с помощью клеточного сортера, такого как «DEParray» (Silicon Biosystems).
После выделения одиночной клетки, можно приступить к молекулярному анализу нуклеиновых кислот на уровне ДНК и/или РНК.
Анализ ДНК. Для анализа ДНК свежих одиночных клеток, клетки лизируют в течение 15 минут с помощью 3-10 мкл лизирующего буфера (100 ммоль /л Tris-HCl, pH 8; 400 μг/мл протеинкиназы K). Протеинкиназу К инактивировали при 94°С в течение 15 минут.
В ином случае клетку можно лизировать с помощью термостабильной протеиназы, такой как prepGem (ZyGem) и связанного с ней буфера (буфера «Gold buffer») в течение 5 мин. при 75°C с последующей инактивацией в течение 5 мин. при 95°С. Дальнейшее процессирование ДНК из свежей одиночной клетки идентично процессированию клеток, полученных микродиссекцией, описанному в примере X.
Анализ РНК. Для анализа РНК, свежие или фиксированные клетки или свежую или фиксированную клетку, лизировали в буфере, содержащем 400 мМ Tris-HCl pH 8, 1000 μг/мл протеинкиназы K и 2,5 Ед. ингибитора РНКазы. Для обратной транскрипции, РНК из лизированной клетки денатурировали в течение 10 минут при 70°C. Обратную транскрипцию осуществляли в общем объеме 40 мкл с использованием 10 единиц MMLV, 10 единиц ингибитора, рэндом-праймеров, dNTP и 1х буфера для обратной транскрипции, поставляемого с ферментом. Реакцию, как правило, инкубировали в течение 15 минут при комнатной температуре и 30 минут при 42°С. Фермент затем инактивировали в течение 10 минут при 70°С и охлаждали на льду перед транскрипт-специфичной амплификацией с помощью ПЦР или полной кДНК амплификацией с использованием коммерческого набора (Life Technologies, Illumina).
В конкретном примере, рекомбинация гена ALK может быть обнаружена с использованием тестов Taqman (hs03654556, Hs03654557, Hs03654558, Hs03654560, Hs03654559, Life technologies) или с помощью стандартного ПЦР. Для обнаружения транскриптных вариантов 3a и b рекомбинации EML4-ALK, могут быть использованы следующие праймеры:
Прямой праймер: 5'-GCATAAAGATGTCATCATCAACCAAG-31 (SEQ ID NO: 1)
Обратный праймер: 5'-TCTTGCCAGCAAAGCAGTAGTTGG-3' (SEQ ID NO: 2)
Опухолевые клетки, идентифицированные мультиплексным иммуномечением с использованием антител против эпителиального маркера и/или антител против белков, важны для тераностики (HER2, ALK и т.п.). Молекулярный анализ, нацеленный на циркулирующие опухолевые клетки, допустим после одноклеточной лазерной захватывающей микродиссекции (LCM) с использованием «Nikon ТЕ 2000 U» (Nikon Paris, Франция) оборудованном модулем вырезания клеток (MMI, Цюрих, Швейцария).
Каждая подвергнутая микродиссекции клетка может быть лизирована в 2-15 мкл лизирующего буфера (100 ммоль/л, Tris-HCl, pH 8; 400 μг/мл протеиназы K). Протеинкиназу К инактивировали при 94°С в течение 15 мин. В ином случае, клетки могут быть лизированы с помощью термостабильной протеинкиназы, такой как «prepGem» (ZyGem) и связанного с ним буфера (буфер «Gold buffer») в течение 15 мин. при 75°C с последующей инактивацией в течение 5 мин. при 95°С.
WGA могут быть осуществлены при использовании Преамплификации удлинения праймера (PEP) или коммерческих наборов (Rubicon Genomics, Sigma, Qiagen, Silicon Biosystems).
Для преамплификации удлинения праймера (PEP) к лизированным клеткам добавляли 5 мкл 400 мкМ раствора рэндом-праймеров (genPEP), 10 μл 10Х ПЦР-буфера, содержащего 15 мМ MgCl2, (Life technologies), 0,6 μл смеси четырех dNTP (каждый по 2 мМ) и 1 μл (5 Ед.) Taq-полимеразы (Life technologies) в конечном объеме 60 μл.
Для WGA с использованием «PicoPlex» из «Rubicon Genomics», к лизированной клетке вначале добавляли 5 мкл преамплификационного коктейля (общий объем 15 мкл) и преамплификацию осуществляли согласно инструкциям изготовителя.
Затем добавляли 60 мкл амплификационного коктейля и осуществляли амплификацию согласно инструкциям изготовителя. Продукты WGA могут быть очищены с помощью набора «Zymo Research D4014» согласно инструкции производителя.
Ген-специфичные амплификации осуществляются в 60 мкл, содержащих 6 мкл 10 мМ Tris-HCl, 50 мМ KCl, 1,5-2,5 мМ MgCl2, 200 μΜ каждого из деоксинуклеотидов, 0,5 μл праймера и 2 Ед. Taq Gold (Life technologies). Два микролитра продукта PCRouter реамплифицировали в 20 мкл с использованием «внутренних» ген-специфичных праймеров и того же самого протокола ПЦР.
При использовании продуктов WGA из «PicoPlex», «вложенная» ПЦР может не потребоваться для всех генов. Более того, эти продукты WGA совместимы с высокопроизводительным секвенированием и анализом CGH-микроэрреями.
Последовательности праймеров и условия цикла указаны в таблице 1 ниже:
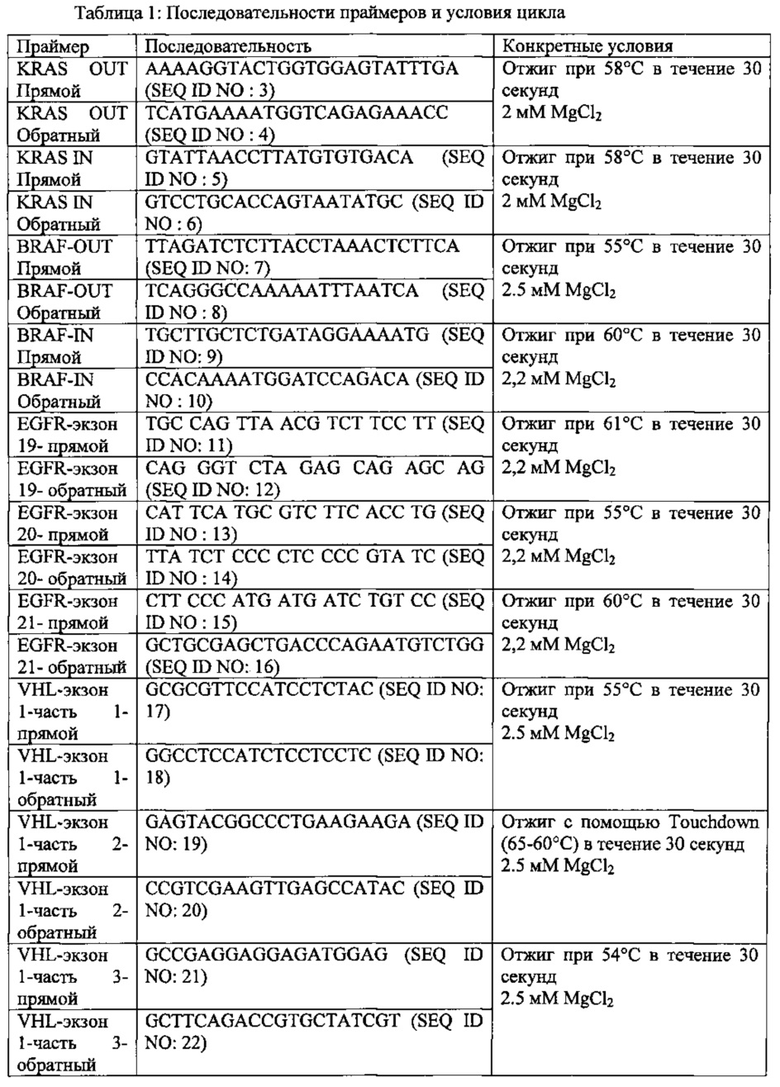

После ген-специфичного ПЦР, мутантный статус гена определяли с помощью традиционного секвенирования, фрагментного анализа, тестов SNP (тесты «Taqman»), COLD-PCR, CAST-PCR, или анализа HRM.
Молекулярный анализ также может быть осуществлен без лазерной захватывающей микродиссекции после лизиса все клеток, присутствующих в зоне фильтрации. Обогащение редких клеток и чистота могут быть улучшены при использовании фильтров с размером пор и плотностью пор, адаптированных для повышения чистоты определенных редких клеток.
ДНК опухолевых клеток, смешанная с ДНК дикого типа из лейкоцитов собирали после лизиса белков в объеме, по меньшей мере, 45 мкл. Экстрагированная ДНК может быть разделена на несколько реакций WGA или очищена и использована для одной реакции WGA.
Что касается одиночных клеток, то WGA может быть осуществлена помощью преамплификации удлинения праймера (PEP) или коммерческих наборов (Rubicon Genomics, Sigma, Qiagen, Silicon Biosystems).
После WGA тесты, чувствительные к генным мутациям могут быть использованы для оценки наличия мутантных ДНК среди немутантных ДНК. Это может быть достигнуто с помощью различных способов, таких как цифровой ПЦР, COLD-ПЦР или CAST-ПЦР.
В случае CAST-ПЦР, 2 мкл очищенной WGA ДНК (около 20 нг ДНК) могут быть использованы в типичной 20 мкл CAST-реакции.
Пример 2; Генетическая характеристика циркулирующих опухолевых клеток и детектирование тераностической мутации в циркулирующих опухолевых клетках:
Рак легких. Согласно предпочтительному способу воплощения редкие клетки могут быть выделены из крови пациентов со злокачественной опухолью легкого путем фильтрации, опухолевые клетки могут быть идентифицированы среди выделенных редких клеток с помощью цитоморфологических анализов и охарактеризованы с помощью ALK-специфичных антител и молекулярных зондов.
Реаранжировка гена ALK, сравнительный анализ на циркулирующих опухолевых клетках и опухолевых тканях из пациентов с аденокарциномой легкого
Целью данной работы, описанной ниже, является 1) оценка статуса ALK в СТС, имеющих злокачественные цитопатологические критерии, выделенных с помощью ISET у 87 пациентов с аденокарциномой легкого и, 2) сравнение статуса ALK, обнаруженного в СТС, и в соответствующей опухолевой ткани. Для этой цели использовали анализ на основе двойного способа с использованием иммунохимии и FISH для определения реаранжировки ALK-гена и применяли к обоим: к СТС и к соответствующим образцам опухолевой ткани.
Пациенты и образцы
В предыдущем исследовании с использованием метода ISET для пациентов, подвергнутых хирургической операции из-за NSCLC, СТС, имеющие цитоморфологические злокачественные признаки, были детектированы в 76/208 (37%) случаев [15].
Для настоящей работы авторы изобретения выбрали из данной последней популяции 40 случаев с первичной аденокарциномой. Кроме того, 47 пациентов с аденокарциномой легкого, включенные в исследование в промежутке между маем и декабрем 2011 года, имели СТС со злокачественными признаками. Среди этих 87 пациентов, 34 имели образцы крови (10 мл), собранные и обработанные с помощью ISET с использованием фиксирующего буфера (содержащего агент, фиксирующий клетки) и, как описано в опубликованной патентной заявке US 2009-0226957, в различные моменты времени: перед хирургической операцией, и через 7 и 15 дней после операции. Все пациенты дали информированное согласие на участие в данном исследовании. Основные клинико-патологические признаки выбранных 87 пациентов суммированы в таблице 2.

TNM: аббревиатура от tumor, nodus и metastasis
PY: Пачка-год
CNHC-MF: циркулирующие негематологические клетки со злокачественными признаками.
Опухоли классифицировали согласно 7-ой классификации pTNM и последней гистологической классификации аденокарциномы легкого [26, 27]. FISH-анализ осуществляли на опухолевых образцах с использованием отдаленного от разрыва зонда для гена ALK (Vysis LSI ALK Dual Color, Abbott Molecular, Abbott Park, IL) (Дополнительные Данные). Для адекватной интерпретации ядра опухолевых клеток должны иметь, по меньшей мере, один сигнал колокализации. Чтобы рассматриваться в качестве ALK-реаранжировки, по меньшей мере, 15% интерпретируемых ядер опухолевых клеток должны иметь аномальный профиль гибридизации зонда [28]. Иммуногистохимический анализ (IHC) проводили на депарафинизированных срезах с использованием первичного антитела против белка ALK (1:50, 5А4; Abeam, Кембридж, Великобритания), инкубированным в течение 45 минут при комнатной температуре (Дополнительные данные). Анализ направленной мутации для i) горячих точек мутаций EGFR ii) горячих точек мутаций KRAS и iii) горячих точек мутаций BRAF осуществляли на ДНК, экстрагированной из замороженных срезов опухолевых тканей с помощью пиросеквенирования, как описано ранее [29, 30] (Дополнительные данные).
Иммуноцитохимия (ICO и флуоресцентная гибридизация in situ (FISH) на фильтрах ISET.
ICC и FISH осуществляли на СТС, выделенных с помощью метода ISET на неокрашенных зонах соответствующих фильтров, содержащих СТС со злокачественными признаками, детектированными с помощью MGG-окрашивания на 6 зонах [15]. На фильтр две зоны использовали для ICC и две зоны использовали для FISH. Для ICC, пятна инкубировали с первичным антителом против белка ALK (1:50, 5А4; Abeam, Кембридж, Великобритания) в течение 30 минут при комнатной температуре. Реакции визуализировали с помощью 3,3'-диаминобензидина, с последующим контрастным окрашиванием гематоксилином. Цитоплазматическое окрашивание считали положительным для ALK [30] (Дополнительные данные). FISH-анализ осуществляли на двух или более пятнах с использованием отдаленного от разрыва зонда для гена ALK (Vysis LSI ALK Dual Color, Abbott Molecular, Abbott Park, IL) согласно инструкциям производителя. Клетки, демонстрирующие отдельные сигналы или индивидуальные 3'-сигналы, считали положительным ПО реаранжировке ALK [31]. Фильтры проверяли независимо и вслепую относительно клинических данных, данных IHC, данных ICC и генотипа ткани. Мы протестировали воспроизводимость результатов ICC и FISH при детекции ALK в СТС на 102 фильтрах из 34 пациентов, подвергнутых забору крови перед хирургической операцией и через 7 и 15 дней после хирургической операции.
Для каждого пациента анализировали 14-500 интерпретируемых ядер опухолевых клеток. Для корректной интерпретации ядра опухолевых клеток должны иметь, по меньшей мере, один сигнал колокализации. Чтобы рассматриваться в качестве ALK-реаранжировки, по меньшей мере, 15% интерпретируемых ядер опухолевых клеток должны иметь аномальный профиль гибридизации зонда.
Человеческую клеточную линию NSCLC Н2228, полученную из АТСС (Manassas, VA), использовали в качестве положительного контроля ALK--реаранжировки [32]. Клетки культивировали и поддерживали в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, как описано ранее [32]. Около 50 клеток смешивали в 10 мл образца крови, взятого у здоровых добровольцев. Образцы фильтровали с использованием метода ISET, как описано ранее [23]. Затем осуществляли FISH с использованием удаленного от разрыва зонда, а после этого проводили ICC с использованием анти-ALK антител, как описано выше.
ALK-положительное иммуноокрашивание было обнаружено в пяти опухолях, соответствующих солидной аденокарциноме с выработкой муцина. Эти пять случаев демонстрировали сильное цитоплазматическое окрашивание (бальная оценка 3+) для всех опухолевых клеток, как определено ранее, с мембранным усилением в паре клеток [31]. Анализ FISH, осуществленный на том же парафиновом блоке на серийных секциях, демонстрировал аденокарциному с ALK-реаранжировкой. Другие 82 опухоли были отрицательны по ALK-иммуноокрашиванию и по ALK-реаранжировке согласно анализу FISH. Десять опухолей (12%) были мутантыми по EGFR (1 экзон 18, 6 экзон 19, и 3 экзон 21 мутации) и 20 случаев (24%) были мутантыми по KRAS (18 ко дон 12 экзона 2 и 2 ко дон 13 экзона 2). Мутацию BRAF не обнаружили. Пять опухолей с ALK-реаранжировкой содержали EGFR, KRAS и BRAF дикого типа.
ALK-положительное иммуноокрашивание было обнаружено в выделенных СТС у пяти пациентов, соответствующих пациентам, имеющим ALK-реаранжировку в опухолях (фигура 1А, A1 и В1, и фигура 1В). Клинико-патологические данные по этим пяти пациентам подробно изложены в таблице 3.
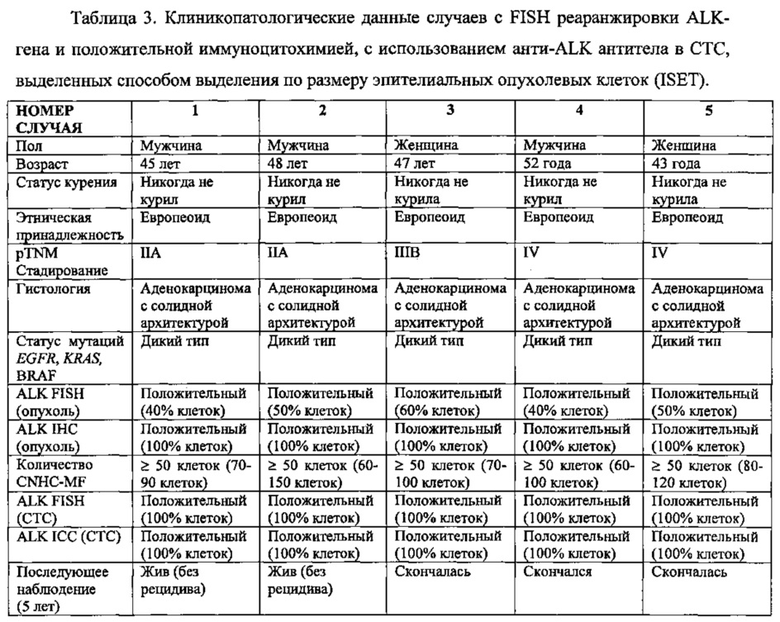
Сокращения: FNM = tumour node metastasis (опухоль, узел, метастаз); CNHC-MF: циркулирующие негематологические клетки со злокачественными признаками
Анти-ALK ICC при использовании клона 5А4 демонстрировала сильное цитоплазматическое окрашивание (балльная оценка 3+) 100% СТС с усилением окрашивания в мембране в большей части клеток (фигура 1, А1 и В1, и фигура 1B). ALK FISH был информативен для этих пяти случаев (фигура 1, А2 и В2, и фигура 1В). Все СТС имели аномальные сигнальные профили, содержащие, по меньшей мере, 3 сигнала, наблюдаемых на клетку в каждом случае, что согласуется с каждой генной амплификацией или с анеусомией (фигура 1, А2 и В2, и фигура 1В). Кроме того, FISH подтвердил присутствие ALK транслокации, все случаи содержали разрыв в отдалении от 5'- и 3'-зондов и множество сигналов на клетку (фигура 1, А2 и В2, и фигура 1В). Ни один из пяти случаев не соответствовал потере какой-либо части FISH-зонда. Наконец, СТС этих пяти пациентов, окрашенные с помощью MGG, демонстрировали наличие СТС со злокачественными признаками, как описано ранее (фигура 1, A3 и В3, и фигура 1В) [22]. Положительный сигнал ALK-ICC и ALK-FISH контролировали для каждого пациента с помощью CNHC-MF, выделенных с использованием ISET через 7 и 15 дней после первой детекции.
Демонстрировали отсутствие положительного иммуноокрашивания с использованием анти-ALK антитела и отсутствие ALK-реаранжировки с использованием FISH-анализа у 82 других отобранных пациентов со злокачественным заболеванием легкого, демонстрирующих СТС со злокачественными признаками при MGG-окрашивании (фигура 1, С1-С3). клетки Н2228 с реаранжировкой ALK, разведенные в образцах крови, затем отфильтрованные с помощью метода ISET, демонстрировали сильное ALK-положительное иммуноокрапшвание и ALK-транслокацию (фигура 1, D1-D3).
Воспроизводимость результатов детекции ALK с помощью ICC и FISH тестировали на СТС 102 фильтров образцов крови из 34 пациентов, подвергнутых забору крови перед хирургическим вмешательством и через 7 и 15 дней после хирургического вмешательства. Из 34 включенных в исследование пациентов 5 пациентов имели ALK-положительную опухолевую ткань, и 29 пациентов имели ALK-отрицательную опухолевую ткань. Положительные результаты были согласованно получены с помощью ICC и FISH для СТС из трех различных образцов крови, полученных от каждого из 5 пациентов с ALK-положительными опухолями. Отрицательные результаты для ALK были согласованно получены с помощью ICC и FISH для СТС из трех различных образцов крови, полученных от каждого из 29 пациентов с ALK-отрицательными опухолями.
Дополнительные данные: пациенты и образцы
FISH-анализ осуществляли на опухолевых образцах с использованием отдаленного от разрыва зонда для гена ALK (Vysis LSI ALK Dual Color, Abbott Molecular, Abbott Park, IL) (Дополнительные Данные). Стекла считывали (MI, EL, СВ) на эпифлуоресцентном микроскопе (ВХ51, Olympus, Токио, Япония) с использованием 63 x объектива, и анализировали изображения с помощью «Soft Imaging system» (Cell, Olympus). Результаты независимо оценивали вслепую относительно клинических и иммуногистохимических данных и генотипа. Когда отмечалось расхождение между тремя патологами, стекла анализировали для достижения консенсуса и, по меньшей мере, 50 интерпретируемых ядер опухолевых клеток анализировали для каждой опухоли. Для адекватной интерпретации ядра опухолевых клеток должны иметь, по меньшей мере, один сигнал колокализации.
Иммуногистохимический анализ (IHC) проводили на депарафинизированных секциях с использованием первичного антитела против белка ALK (1:50, 5А4; Abcam, Кембридж, Великобритания), инкубированным в течение 45 минут при комнатной температуре. Интенсивность окрашивания, а также процент положительных клеток оценивали полуколичественно следующим образом: 0 = нет окрашивания или слабое окрашивание <10% опухолевых клеток; 1+ = слабое окрашивание >10% опухолевых клеток; 2+ = среднее окрашивание; 3+ = сильное окрашивание. Положительную экспрессию ALK рассматривали между 1+ и 3+. Иммунгистохимическое окрашивание образцов независимо оценивали с помощью трех патологов (MI, VH и РН), у которых не было информации относительно клинических данных и генотипа. Когда отмечалось расхождение между тремя патологами, стекла анализировали для достижения консенсуса.
Анализ направленной мутации для i) горячих точек EGFR мутации в кодонах 719, 768, 790, и 858-861, а также делеций и комплексных мутаций в экзоне 19, ii) горячих точек KRAS мутации в кодонах 12, 13 и 61, и iii) горячих точек BRAF мутаций в кодонах 600 и 464-469, осуществляли на ДНК, экстрагированной из замороженных секций опухолевых тканей, как описано ранее [29, 30]. ПЦР-амплификацию осуществляли с использованием соответствующего наборов реагентов «Therascreen® Pyro» (Therascreen® EGFR Pyro® kit, CE-IVD, Ref. 971480; набор «Therascreen® KRAS Pyro®», CE-IVD, Ref. 971460; набор «Therascreen® BRAF Pyro®», CE-IVD, Ref. 971470; Qiagen, Hilden, Германия), следуя протоколам производителя. Продукты ПЦР (10 мкл) процессировали в 24-луночном формате для анализа пиросеквенированием с использованием вакуумной рабочей станции «PyroMark Q24 MDx» (Qiagen), следуя стандартному протоколу производителя. Планшет переносили прямо в систему «PyroMark Q24» (Qiagen) для определения последовательности. Данные автоматически анализировали с помощью программного обеспечения «PyroMark Q24» (Qiagen).
Дополнительные данные: Иммуноцитохимия (ICC) и флуоресцентная гибридизация in situ (PISH) на фильтрах ISET
Для ICC, осуществляли индуцированное нагреванием извлечение эпитопа с целевым раствором для извлечения (pH 9) (Dako, Carpinteria, СА) для ALK. Пятна обрабатывали 3% пероксидом водорода в течение 20 минут для блокировки эндогенной пероксидазной активности, с последующей отмывкой деионизованной водой в течение 2-4 минут. Пятна затем инкубировали с первичным антителом против белка ALK (1:50, 5А4; Abcam, Кэмбридж, Великобритания) в течение 30 минут при комнатной температуре. Реакции визуализировали с помощью 3,3'-диаминобензидина, с последующим контрастным окрашиванием гематоксилином. Цитоплазматическое окрашивание считали положительным для ALK [30]. Интенсивность окрашивания, а также проценты положительных клеток оценивали три патолога (MI, VH и РН) полуколичественно, как описано выше. Фильтры проверяли независимо и в слепую относительно клинических данных, данных IHC, и генотипа ткани и клеток. Когда отмечалось расхождение между тремя патологами, покровные стекла анализировали для того чтобы прийти к консенсусу.
Авторы показали, что с помощью двойного анализа ICC-FISH, статус ALK может быть обнаружен неинвазивно в СТС характеризуемых цитоморфологическим подходом в подмножестве пациентов с раком легкого. Более того, эти результаты демонстрируют строгую корреляцию между статусом ALK, определенным в СТС, и соответствующими образцами опухолевой ткани, в сериях из 87 пациентов легочной аденокарциномой. Пять из этих пациентов, имеющие клинико-патологические характеристики, о которых раннее сообщалось как об ассоциированных с реаранжировкой гена ALK в популяции жителей Запада, показали реаранжировку гена ALK как в СТС, так и в соответствующих образцах резектированной опухоли [28]. С другой стороны, СТС с реаранжировкой гена ALK никогда не находили у пациентов с опухолью без реаранжировки гена ALK, как продемонстрировано недавними исследованиями FISH, интерес которых был сфокусирован на релевантности прогноза ALK-положительных пациентов с раком легкого, независимо от таргетной терапии ALK [33-35]. Некоторые из этих исследований показали, что у пациентов, не подвергнутых лечению ингибиторами пре-ALK, ALK-положительные пациенты имели самое непродолжительное выживание, и были ассоциированы с более высоким риском метастазирования [33, 35]. Более того, ALK-положительные пациенты были более устойчивы к лечению ингибитором тирозинкиназы EGFR, чем ALK-положительные пациенты [33]. Наоборот, недавние исследования показали, что у пациентов с ALK-положительной аденокарциномой с EGFR дикого типа был лучший результат [34]. В настоящей работе 5 летнее последующее наблюдение пяти ALK-положительных пациентов с EGFR дикого типа показало отсутствие рецидива для двух пациентов со стадией II, перенесших хирургическое вмешательство, тогда как три пациента со стадией IIIb/IV умерли в течение 6 месяцев после постановки диагноза. Эти пациенты не подвергались никакой адъювантной терапии, в частности направленной против реаранжировки ALK.
Неинвазивный тест для детекции реаранжировки гена ALK посредством выделения и описания СТС основан на клинических соображениях. Лечение кризотинибом должно быть ограничено опухолями с доказанной реаранжировкой гена ALK, что предполагает систематический предварительный скрининг опухолевых образцов с помощью надежных технических подходов. Однако, опухолевая ткань из пациентов с раком легкого не всегда доступна или имеется в количестве, достаточном для осуществления как патологического исследования, так и увеличивающегося перечня иммуно/молекулярных анализов, целью которых является разделение пациентов для применения таргетных терапий. В отличие от свободной опухолевой ДНК/РНК в плазме, которая может быть получена из апоптирующих клеток и может утратить инвазивные свойства опухолевой клетки, СТС могут представлять собой «жидкую биопсию» и образовать идеальную мишень для неинвазивных тераностических тестов.
Авторы для выделения СТС использовали подход ISET, поскольку они и другие исследователи показали, что этот способ демонстрирует высокую чувствительность при выделении СТС из пациентов с NSCLC [15-17]. Как указывалось раннее, выделение СТС с помощью ISET зависит от размера клеток и не зависит от какого-либо клеточного маркера. Таким образом, опухолевые клетки, экспрессирующие эпителиальные маркеры, а также клетки, которые имеют потерянные эпителиальные антигены, из-за ЕМТ, эффективно выделяются с помощью ISET [17, 21, 24, 25]. Более того, ICC и молекулярные анализы, включая FISH, могут быть разработаны для СТС, выделенных и описанных с помощью ISET [17, 18, 21, 23-25]. Интересно отметить, что была показана воспроизводимость результатов при детекции ALK с помощью ICC и FISH на подгруппе из 34 пациентов, протестированных перед проведением хирургического вмешательства и через 7 и 15 дней после хирургического вмешательства, включая опухолевую ткань 5 положительных по ALK пациентов. Согласующиеся результаты были получены вслепую для трех образцов, полученных из каждого пациента. Эти результаты подтверждают техническую воспроизводимость ICC- и FISH-анализа для ALK на фильтрах и демонстрируют осуществимость кинетического последующего наблюдения в реальном времени за пациентами с помощью анализа СТС.
Надежная оценка реаранжировки гена ALK в тканях опухоли легкого признана в качестве диагностической и технической проблемы [31, 36]. Статус ALK в опухолевых образцах может быть оценен с помощью FISH, иммуноцитохимии и/или полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) [31, 35-39]. FISH является диагностическим способом, используемым в качестве правомочного критерия в текущих клинических испытаниях с кризотинибом [38]. Гистохимия с антителами, специфичными к белку ALK человека (антительный клон ALK1), является диагностической по отношению к реаранжировке ALK в подмножестве анапластических крупноклеточных лимфом, и обладает такой чувствительностью и специфичностью, что генетические тесты считаются ненужными [38]. При NSCLC экспрессия белка ALK из реаранжированного гена ALK ниже. Однако разработка и применение новых ALK-специфичных антител дает весьма интересные результаты.
Авторы использовали анти-ALK антитела, клон 5А4, который, как недавно было показано, точно типировал 20/20 опухолевых тканей NSCLC [36]. В пяти случаях реаранжировки ALK, было отмечено, что не более 50% опухолевых клеток в опухоли были положительны по ALK-FISH, тогда как при IHC положительными по ALK были 100% этих клеток. Однако IHC по ALK была гетергенной в определенных областях опухоли, и некоторые клетки были только бледно (1+) окрашены, тогда как другие были сильно окрашены (3+). Таким образом, как описано в недавнем исследовании, корреляция между IHC и FISH по реаранжировке гена ALK может наблюдаться только в некоторых областях опухолей [40], поднимая вопрос о лучшем и более подходящем сравнении между FISH-положительными и «только IHC 3+» положительными клетками. В качестве предварительных данных настоящее исследование показывает, что ICC осуществленное на СТС, может быть перспективным инструментом для детекции реаранжировки ALK, а также других геномных изменений, таких как мутации EGFR. В связи с этим некоторые мутации EGFR могут быть продемонстрированы с помощью IHC в подмножестве аденокарцином легкого с использованием специфических антител [31, 41]. Мы можем строить предположения о том, что такие мутации EGFR также могут быть продемонстрированы подходом ICC на СТС в данном подмножестве раков легкого. Примечательно, что все СТС, детектируемые в настоящем исследовании были положительными по ALK-FISH и сильно положительными по ICC при использовании специфических антител против ALK. СТС, накопившие такие специфические геномные изменения могут иметь свойство облегченной миграции и представляют собой агрессивное множество опухолевых клеток. Реаранжировка гена ALK также может детектироваться с помощью ОТ-ПЦР [30, 36]. ОТ-ПЦР является перспективным подходом, требующим высокого качества РНК для осуществления амплификации множественных транскриптов различных размеров [36]. И наконец, недавно был разработан подход количественного ПЦР в реальном времени, для количественной оценки ALK транскриптов, и были получены обнадеживающие результаты [36]. Автор не пытались искать реаранжировку ALK с помощью подхода ОТ-ПЦР, поскольку думали, что количество и качество РНК, которое потенциально может быть экстрагировано из СТС, выделенных с помощью ISET, может быть недостаточным для теста, поскольку коммерческий буфер, используемый для разведения крови перед фильтрацией, содержит формальдегид. Однако эта стратегия может быть протестирована с использованием нового буфера ISET разработанного для выделения свежих СТС с неизмененной чувствительностью по сравнению с фиксированными СТС.
Применение неинвазивных тестов на основе СТС может позволить имплиментировать молекулярное тераностическое последующее наблюдение пациентов для идентификации потенциальных новых геномных изменений, вовлеченных в устойчивость к таргетным терапиям [42]. В связи с этим, появление приобретенной устойчивости к кризотинибу является новой проблемой в лечебной работе с ALK-положительными пациентами с раком легкого [11, 43, 44]. Фактически новое геномное(ые) изменение(я) может произойти в ходе лечения кризотинибом и может сделать исходное таргетное лечение неэффективным. Таким образом, отслеживание в реальном времени может быть разработано с целью обнаружения потенциальных дополнительных геномных изменений, посредством молекулярных тестов на СТС, выделенных с помощью ISET и диагностически охарактеризованных с помощью морфологического подхода.
Авторы показали, что выполнимость обнаружения реаранжировки гена ALK в СТС, выделенных с помощью ISET и описанных как СТС со злокачественными признаками. Были получены непротиворечивые результаты при использовании молекулярных подходов ICC и FISH, и что важно, были получены непротиворечивые результаты в СТС по сравнению с опухолевыми тканями из 87 протестированных пациентов. Эти результаты обеспечивают тераностический подход на основе СТС для оценки неинвазивного статуса ALK при предварительном скрининге пациентов с раком легкого.
Пример 3: Применение настоящего изобретения при ранней диагностике инвазивных злокачественных опухолей
«Страж» циркулирующих опухолевых клеток позволяет осуществить раннюю диагностику легочной карциномы у пациентов с хроническим обструктивным заболеванием легких.
Циркулирующие опухолевые клетки (СТС), как полагают, начинают циркулировать на очень ранней стадии инвазивных злокачественных опухолей; однако о них никогда не сообщалось как о первом признаке инвазивных злокачественных опухолей. Мы сообщили о трех из 168 пациентов с Хроническим Обструктивным Заболеванием Легких (Chronic Obstructive Pulmonary Disease, COPD), предопухолевым состоянием для немелкоклеточного рака легкого (NSCLC), у которых СТС были обнаружены с помощью ISET (Isolation by Size of Tumor Cells - Выделение по Размеру Опухолевых Клеток), высокочувствительной СТС-платформы «основанной на цитопатологии». КТ-сканирование, осуществляемое ежегодно, детектирует узел только через 1-4 года после появления СТС в крови, приводя к хирургической резекции и патологическому диагнозу ранней стадии NSCLC. ISET затем повторяли через 9 или 12 месяцев после хирургического вмешательства и показали исчезновение СТС. Эти 3 случая демонстрируют, в качестве доказательства правильности концепции, потенциал использования СТС в качестве раннего индикатора инвазивного рака легкого у пациентов «с риском развития».
Циркулирующие опухолевые клетки (СТС) принадлежат к группе «циркулирующих редких клеток» (CRC) в крови, обнаружение которых может открыть новые пути в неинвазивной прогнозирующей медицине. CRC не детектируются существующими в настоящее время анализами крови, поскольку их уровень может быть настолько низким, как одна на мл крови (или ниже), то есть одна клетка, смешанная в среднем с 10 миллионами лейкоцитов и 5 миллиардами эритроцитов. Более того, CRC принадлежат к различным типам, включая как эпителиальные, так и мезенхимальные СТС, эпителиальные неопухолевые клетки, дессиминат, распространяемый воспалительными заболеваниями и ятрогенными вмешательствами, эндотелиальные клетки, стволовые клетки и опухолевые клетки (у беременных женщин). Таким образом, специфическое обнаружение СТС предполагает их дифференциальную диагностику от других CRC и двойную техническую проблему чувствительности и диагностической специфичности [45].
Из-за этих технических трудностей способы детекции циркулирующих эпителиальных клеток, но не диагностики СТС, были использованы для разработки прогностических/предиктивных маркеров главным образом у пациентов с метастазирующими злокачественными опухолями [46]. Однако сочетание данных из клинических, молекулярных исследований и исследований на животных недавно показало, что инвазивные злокачественные опухоли дессиминируют клетки на очень ранней стадии их развития, что подтверждает, что чувствительно и диагностический подход для детекции СТС может помочь при их ранней диагностике [47, 48].
Рак легкого является агрессивным и высоко инвазивным заболеванием. Его ранняя диагностика является критической проблемой, поскольку 94 миллиона курильщиков имеют повышенный риск заболевания, которое остается основной причиной смерти в США [49]. В Национальной программе по скринингу легких, в которой провели исследование 53 454 индивидуумов с высоким риском рака легкого, недавно показали, что малодозный КТ-скрининг ассоциирован со снижением смертности от рака легкого на 20% [49]. Однако этот результат был ассоциирован с впечатляющими 96,7% ложно-положительными результатами, поскольку из общего количества подвергнутых скринингу пациентов, 26 309, 7191 были выявлены как положительные, но только у 649 в дальнейшем было выявлено наличие рака легкого. Более того, общее количество пациентов с раком легкого составило 1060, включая 411 ложно-положительных, которые были пропущены КТ-скринингом.
В данных условиях авторы пришли к выводу, что высокоинвазивный характер рака легкого может быть использован в качестве его Ахиллесовой пяты, и позволит осуществить его раннюю диагностику с помощью чувствительного и диагностического обнаружения СТС. Поэтому был использован ISET (Выделение Опухолевых Клеток по Размеру), который является эффективным подходом для очень чувствительного выделения интактных СТС, что позволит осуществить их цитопатологическую диагностику [46, 50, 51].
Описаны три пациента, с хроническим обструктивным заболеванием легких (COPD), патологией, которая считается фактором риска для рака легкого, у которых были обнаружены СТС в крови за годы до обнаружения с помощью имиджинга опухоли в легком.
В этом сообщении впервые демонстрируется на людях, что чувствительная и диагностическая идентификация СТС обеспечивает многообещающий тест для ранней диагностики инвазивных злокачественных опухолей.
Клинические случаи
Случай 1
В 1995 году пациенту ХВ, мужчине, 49 лет, был поставлен диагноз умеренного (GOLD2) хронического обструктивного заболевания легких (COPD) на основании функциональных тестов легких, FEV1 (объем воздуха при форсированном выдохе в единицу времени перед занавесом секунда) от 50 до 79%, и рентгена грудной клетки. Он выкурил 45 ПГ (пачка-год: 1 пачка сигарет ежедневно в течение 45 лет). Четырнадцать лет спустя (в октябре 2009 года) он прошел тест ISET при котором у него было обнаружено 67 СТС и 3 СТМ (циркулирующих опухолевых микроэмбол) в 10 мл крови, идентифицированных цитопатологическим анализом. Низкодозное спиральное КТ-скнирование, осуществленное в то же время, подтвердило диагноз COPD, но не показало узлов в легких. КТ-сканирование затем было запланировано ежегодно, и годом спустя (в октябре 2010 года), показало впервые наличие узла в легком диаметром 1,5 см, в нижней доле правого легкого. Хирургическое вмешательство было осуществлено месяцем позднее. Патологический анализ и стадирование злокачественного заболевания выявили тубулопапиллярную аденокарциному стадии IA без диссеминации в лимфоузлы или без дистантных метастазов (pT1aN0M0). Генотипирование опухоли показало мутацию K-Ras в ко доне 12. Пациент не получал какого-либо дополнительного лечения. Его тестировали с помощью ISET через 9 месяцев после хирургического вмешательства и никаких СТС в его крови не было обнаружено.
Случай 2
Пациенту АС, мужчине, был поставлен диагноз тяжелого (GOLD 3) COPD в 1998 году, в возрасте 54 лет, на основании функциональных тестов легких, FEV1 от 30 до 49%, и рентгена грудной клетки. Он выкурил 60 ПГ. Одиннадцатью годами позже (в мае 2009 года), он прошел тест ISET, при котором у него было обнаружено 43 СТС и 1 СТМ в 10 мл крови, идентифицированных цитопатологическим анализом. Низкодозное спиральное КТ-сканирование, осуществленное в то же время, показало признаки COPD, но не показало каких-либо узлов в легких. КТ-сканирование, затем повторяли ежегодно и 3 года спустя, в сентябре 2012 года, оно впервые показало наличие узла в легком диаметром 2,4 см, в верхней доле левого легкого. Пациент повергся хирургическому вмешательству месяцем позднее. Патологический анализ и стадирование злокачественного заболевания выявили тубулопапиллярную аденокарциному стадии IA без диссеминации в лимфоузлы или без дистантных метастазов pT1bN0M0). Анализ опухолевой ДНК показал мутацию K-Ras в кодоне 12. Пациент не получал какого-либо дополнительного лечения. Его тестировали с помощью ISET через 12 месяцев после хирургического вмешательства и никаких СТС в его крови не было обнаружено.
Случай 3
Пациенту ВМ, мужчине, был поставлен диагноз умеренного (GOLD2) COPD в 1999 году, в возрасте 47 лет, на основании функциональных тестов легких, FEV1 от 50 до 79%, и рентгена грудной клетки. Он выкурил 35 ПГ. Девятью годами позже (в феврале 2008 года) его тестировали с помощью ISET и обнаружили 32 СТС и 1 СТМ в 10 мл крови. КТ-сканирование, проведенное в тот же период, подтвердило диагноз COPD, но не показало каких-либо легочных узлов. КТ-сканирование затем проводили каждый год и через 4 года, в августе 2012 года, оно показало узел диаметром 1,4 см в верхней доле правого легкого. Хирургическое вмешательство было осуществлено месяцем позднее. Патологический анализ и стадирование рака показали ацинарную аденокарциному стадии IA без какого-либо диссеминирования в лимфатические узлы или дистантных метастазов (pT1aN0M0). Генотипирование опухоли показало мутацию K-Ras в кодоне 12. Пациент не получал какого-либо дополнительного лечения. Его тестировали с помощью ISET через 12 месяцев после хирургического вмешательства и в его крови не было обнаружено никаких СТС.
Способы
Способ ISET является подходом на основе фильтрации крови с механическим приводом, который обогащает циркулирующие СТС и СТМ на поликарбонатной мембране с порами 8 микрон [50, 51]. Периферическую кровь (10 мл) собирали в забуференный EDTA, сохраняли при 4°С и обрабатывали в течение 1 часа после сбора. Несколько пятен на мембране обрабатывали для иммуноцитохимии, а 3 пятна для окрашивания по Май-Грюнвальду-Гимзе для цитологического анализа. Иммуноцитоцимию проводили, как описано ранее, с использованием двойного иммуномечения антителами к пант-цитокератину (мышь, клон KL-1, Immunotech, Марсель), и анти-виментин (мышь, клон V9, Dako, Париж) антитела, наносимых на фильтры в течение 45 минут при комнатной температуре.
При использовании ISET, пациенты считались положительными по СТС на основании цитопатологического анализа выделенных клеток при окрашивании MGG, а обнаружение клеток с характерными злокачественными признаками согласно ранее определенным критериям [51] (фигура 2).
Результаты
С помощью ISET 3 из 168 (1,8%) пациентов с COPD были выявлены как положительные по СТС на основании выделения с помощью ISET и цитопатологического анализа выделенных клеток с помощью окрашивания MGG, что позволяет осуществить обнаружение клеток с характерными злокачественными признаками, согласно ранее определенному критерию [51].
Три пациента с COPD, имевших СТС на исходом уровне, обнаруженных с помощью цитопатологического анализа на ISET, у которых развился рак легкого при их последующем наблюдении у них было обнаружено от 32 до 67 СТС, которые были выделены или сгруппированы на листах (Фигура 2). СТС демонстрировали большие ядра с рассеянными ядерными бороздками, гетерохроматиновыми сгустками и умеренным количеством цитоплазмы с высоким соотношением ядро/цитоплазма (фигура 2). Более того, у этих пациентов были продемонстрированы следующие случайные СТМ: пациент 1 имел 3 СТМ из 3, 9 и 15 СТС; пациент 2 имел 1 СТМ из 20 клеток, а пациент 3 имел 1 СТМ с 12 СТС. Случайные кластеры показали трехмерные сцепленные листы овальных или полигональных СТС, демонстрирующих ядерную атипию, умеренно выраженный анизонуклеоз, с частыми множественными ядрышками и перекрыванием ядер. Соответствующие иммуноокрашенные клетки в основном экспрессированили только панцитокератин (фигура 2). Однако, небольшое количество СТС сильно экспрессировали виментин со слабо ассоциированной экспрессией цитокератина (фигура 2).
Выделенные клетки с более доброкачественными цитоморфологическими признаками также детектировались с помощью ISET в 3 из 168 (1,8%) пациентов с COPD. Однако ни один из этих 3 пациентов или кто-либо другой из 162 пациентов с COPD не продемонстрировал развитие легочного узла в ходе последующего наблюдения (среднее время последующего наблюдения: 48 месяцев). СТС не детектировались у 42 контрольных курильщиков без детектируемой патологии и у 35 некурящих здоровых индивидуумов.
Обсуждение
Рак легкого известен как весьма инвазивное злокачественное новообразование, с более чем 75% пациентов, не отвечающих критериям для хирургического вмешательства при постановке диагноза [52]. Из-за высокого скорости и высоко инвазивного характера, он является ведущей причиной смертности, связанной с онкологическими заболеваниями, во всем мире [53]. В данной области открытие диагностического и неинвазивного биомаркера может быть критичным для разворачивания последующих стадий скрининга низкодозным спиральным КТ-сканированием и раннего хирургического вмешательства. Поскольку сильно злокачественное поведение рака легкого связано с его инвазивным потенциалом, считалось, что применение высокочувствительного и диагностического определения СТС может дополнить исследования КТ-сканированием и помочь снизить уровень ложно-положительных и отрицательных результатов, связанных со скринингом КТ-сканированием. Поэтому авторы сделали мишенью своих исследований популяцию из 168 пациентов с COPD. COPD является третьей ведущей причиной смерти в США и по прогнозам станет четвертой причиной, вызывающей смерть во всем мире к 2030 году, из-за увеличения числа курящих. COPD рассматривается как пренеопластическое состояние для рака легкого и было подсчитано, что, в целом, у 2,2% пациентов с COPD в течение года разовьется рак легкого. При этом прогрессия COPD увеличивает восприимчивость к канцерогенезу легкого вплоть до 4-6 раз, поскольку согласно наблюдениям COPD и рак легкого имеют общие механизмы. Таким образом, ранняя диагностика COPD является важной, поскольку отказ от курения вначале процесса развития COPD замедляет прогрессию заболевания и снижает заболеваемость и смертность [54].
Несколько способов было применено для выделения и обнаружения циркулирующих опухолевых клеток с вариабельной чувствительностью и специфичностью [45]. Однако авторы полагали, что в условиях ранней диагностики рака легкого только цитопатологический диагностический подход может подходить для выявления «индикатора СТС/СТМ» используемого в комбинированном подходе для ранней диагностики рака легкого, также включающем скрининг КТ-сканированием.
ISET направлен на быструю обработку образцов крови, при которой выделяются интактные СТС из крови высокочувствительным образом, что также позволяют провести их иммуноцитопатологический и молекулярный анализ.
Сообщалось о трех случаях, в которых выявлено релевантное количество СТС/СТМ за 1-4 года до обнаружения легочного узла с помощью КТ-сканирования. К сожалению, фильтры ISET не хранили при -20°С, что не позволило исследовать мутации ДНК в СТС/СТМ. Однако, впервые эти данные подтвердили правильность на людях результатов, полученных в животных моделях, демонстрируя, что СТС диссеминируют инвазивными злокачественными опухолями еще на стадии карциномы «in situ». В этих условиях также важно отметить, что ни СТС, ни СТМ, обнаруженные ISET у 42 курильщиков без детектируемой патологии и у 35 некурящих здоровых индивидуумов. В целом, 562 объекта без злокачественных новообразований были исследованы с помощью ISET различными группами, и было показано отсутствие СТС в их крови.
В этом документе впервые показано, что у трех пациентов с риском развития рака легкого, у которых с помощью ISET и цитопатологии было обнаружено наличие СТС за 1-4 года до идентификации с помощью имиджинга узла в легком. У этих трех пациентов рак легкого был диагностирован в ранней стадии (IA), что позволяло провести незамедлительную хирургическую резекцию; после этого в течение нескольких месяцев было показано отсутствие СТС у них. В настоящее время требуются большие исследования для оценки потенциала диагностической идентификации СТС в качестве надежного инструмента для раннего диагноза рака легкого у пациентов с риском его развития.
Пример 4; Применение настоящего изобретения для выделения и описания цервикальных трофобластов из трансцервикальных образцов
Трофобласты. Согласно предпочтительному режиму воплощения, трофобластные клетки могут быть экстрагированы фильтрацией из трансцервикальных образцов, идентифицированы цитоморфологическим анализом, и их геном может быть охарактеризован индивидуально с помощью ПЦР после лазерной микродиссекции и полногеномной амплификации.
Трансцервикальные образцы собирали из беременных женщин от 5 до 15 недели беременности с помощью цитощетки, вращаемой в центральном отверстии шейки матки. Трансцервикальные образцы переносили в раствор PBS, дополненный фиксирующим реактивом. Образец можно хранить при 4°С в течение месяцев перед фильтрацией.
Трансцервикальные образцы разводили стерильной дистиллированной водой согласно их насыщенности клетками перед фильтрацией и анализировали с помощью цитоморфологического окрашивания.
Одиночные трофобластные клетки затем собирали лазерной микродиссекцией и осуществляли молекулярный анализ для генотипирования и генетических анализов, как сообщалось в публикациях (Saker et al, Prenatal Diagnosis 2006).
Новый подход для неинвазивного выделения цервикальных трофобластов у беременных женщин в ранней стадии беременности.
Основная цель современного пренатального ухода заключается в замене инвазивной пренатальной диагностики, которая связана с риском потери плода 1-2% [55], на полностью безопасные «неинвазивные» способы тестирования. Фетальная ДНК может быть получена неинвазивно из трех источников: циркулирующих фетальных клеток в материнской крови, в частности, циркулирующих эритроидных и трофобластных клеток, которые не сохраняются в крови после рождения или выкидыша; трансцервикальные трофобласты, в переходе из полости матки в шейку матки, и свободная фетальная ДНК, которая является частью общей клеточной свободной ДНК, циркулирующей в материнской крови. Неинвазивное извлечение фетальных клеток как ожидается, даст чистую (несмешанную с материнской ДНК) фетальную ДНК, что позволит разработать неинвазивную и полностью надежную альтернативу амниоцентезу и CVS. Однако циркулирующие фетальные клетки, цервикальные трофобласты, очень редки и их выделение является технической проблемой. Высокоэффективные подходы секвенирования следующего поколения, нацеленные на свободную фетальную ДНК, в настоящее время доступны и хорошо зарекомендовали себя в качестве надежного и неинвазивного пренатального способа обнаружения анеуплоидии [56, 57, 58, 59, 60]. Однако эти способы не могут заменить аминоцентез и CVS, поскольку они не нацелены на чистую фетальную ДНК. Более того, эти подходы не могут быть применены в ранние периоды беременности и требуют сложной и дорогой технологии.
Наша команда продемонстрировала, что циркулирующие клетки-трофобласты, легко могут быть экстрагированы из материнской крови с помощью ISET (Выделения по Размеру Эпителиальных Опухолевых/Трофобластных Клеток), потому что трофобласты больше, чем лейкоциты периферической крови. Более того, выделенные клетки генетически анализировали и их полезность в неинвазивной пренатальной диагностике (NI-PND) была продемонстрирована для двух рецессивных расстройств, спинальной мышечной атрофии и муковисцидоза [61, 62].
Наличие фетальных клеток в эндоцервиксе впервые было продемонстрировано Shettles в 1971 году. Трофобластные клетки, как предполагается, слущиваются с регрессирующих хориальных ворсин в полость матки, и оттуда в шейку матки [63, 64]. Полость матки пропадает между 11 и 12 неделями беременности (WG), после слияния decidua basalis и decidua parietalis, поэтому возможность сбора этих редких клеток ожидаемо является временной и ограничена ранними сроками беременности. Сбор фетальных клеток из шейки матки и нижнего полюса полости матки, называемый сбором образцов трансцервикальных клеток (ТСС), является альтернативой выделению фетальных клеток из материнской крови и представляет собой дополнительных источник чистой фетальной ДНК для NI-PND. Большим преимуществом является факт того, что ТСС представляют собой исключительно трофобласты (цито- и синцитиотрофобласты), которые слущиваются и не сохраняются при текущей беременности. Были разработаны различные подходы сбора образцов ТСС, которые включают следующие: внутриматочный лаваж, эндоцервикальный лаваж, эндоцервикальную аспирацию слизи, а также эндоцервикальный сбор образцов с помощью цитощетки. Многочисленные исследования, целью которых являлось определение наилучшего способа сбора образцов ТСС, установили, что маточный и эндоцервикальный лаваж являются наиболее эффективными способами сообразного сбора фетальных клеток уже на 5 неделе беременности [65, 66, 67, 68, 69, 70]. Однако, хотя они были описаны как минимально или полуинвазивные, главная обеспокоенность относительно этих методов заключается в риске потери плода [71, 72]. В большинстве исследований образцы были собраны сразу перед прерыванием беременности.
Идеальный способ сбора образцов не должен вызывать осложнения, не должен оказывать отрицательное воздействие на текущую беременность, должен легко проводиться вне больничных условий и быть затратоэффективным. Безопасный способ был адаптирован, как описано в разделе Материалов и Методов (сбор образцов). Наиболее важным является то, что безопасность данного способа продемонстрирована тем фактом, что он рутинно осуществляется в ходе первого триместра беременности.
В данном исследовании подход безопасного сбора образцов для сбора цервикальных образцов, был объединен с ISET, весьма удобным способом исследования редких клеток, не только потому, что он устраняет элементы по размеру, такие как сперматозоиды и лейкоциты, но также и потому, что он образует оптимальный слой клеток для того, чтобы помочь при лазерной микродиссекции и любом другом типе анализа клеток. При использовании уникального способа окрашивания, который облегчает распознавание фетальных клеток, стало возможным подвергнуть микродиссекции отдельные цитотрофобласты и синцитиотрофобласты и продемонстрировать их фетальную природу с помощью генотипирования. Также в данном документе показано, что как и в случае трофобластов, выделенных из крови, клетки пригодны при использовании для NI-PND. Предлагается новый способ для того, чтобы стабильно и неинвазивно извлекать эмбриональные клетки, используемые как часть фактически неинвазивной альтернативы амниоцентезу и CVS для неинвазивной пренатальной диагностики генетических заболеваний.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор образцов:
Производили забор ТСС-образцов у беременных женщин с риском того, что они носят плод с моногенетическим заболеванием (Hôpital Necker-Enfants Malades) непосредственно перед забором образцов биопсии ворсин хориона, а также у женщин, подвергнутых элективному прерыванию беременности (ТОР) (Antoine Béclère). Все женщины были от 7 до 12 недели беременности. Клетки получали с помощью цитощетки, но в отличие от обычного способа сбора образцов ТСС, в нашем исследовании щетку не вставляли в эндоцервикальный канал, а скорее вращали его во внешнем устье. Цитощетки переносили в 10 мл метанол-содержащего консервирующего раствора.
Окрашивание и фиксация образцов с помощью альцианового синего:
1 мл каждого образца смешивали с 1 мл 1,1% Альцианового синего 8GX/3% раствора ледяной уксусной кислоты (Sigma-Aldrich, Сент-Луис, Миссури, США) и инкубировали в течение 30-50 минут. Образцы затем разводили в 25 раз в воде, оставляя конечный объем 50 мл. Каждый образец тщательно перемешивали и инкубировали в течение 5 минут.
Фильтрация образцов с помощью ISET:
ISET проводили, как описано ранее только с незначительными модификациями [61]. Вкратце, разведенные образцы (50 мл) фильтровали через поликарбонатные фильтры с калиброванным 8-μм-диаметром с цилиндрическими порами. Клетки из 1 мл образца концентрировали на фильтре на десяти спотах диаметром 0,6-см.
Окрашивание клеточных ядер с помощью Красного Красителя Ядер:
С целью окрашивания ядер концентрированных клеток на фильтре, на каждое пятно наносили 0,1% быстрого красного красителя для ядер/5% раствор сульфата алюминия (Sigma-Aldrich, Сент-Луис, Миссури, США), инкубировали в течение 2 минут и затем тщательно промывали водой. Фильтры сушили на воздухе.
Анализ фильтров и лазерная микродиссекция:
Как правило, делали 2 фильтра на образец и, таким образом, процессировали в среднем 2 мл каждого образца. Одиночные клетки, не окрашенные альциановым синим, и демонстрирующие морфологию типа цитотрофобластов или типа синцитиотрофобластов извлекали из фильтров с помощью лазерной захватывающей микродиссекции с использованием оборудованного лазерного микроскопа «Nikon ТЕ 2000-U» (Nikon Париж, Франция и MMI Цюрих, Швейцария). Каждую одиночную клетку захватывали на крышечку микроцентрифужной пробирки, подходящей для ПЦР.
Молекулярный анализ:
Каждую клетку полученную микродиссекцией лизировали в 15 μл лизирующего буфера (100 ммоль/л Tris-HCl, pH 8; 400 μг/мл протеиназы K) в течение 2 ч при 60°C, с последующей инактивацией протеиназы K при 94°С в течение 15 мин. Для предамплификационной протяжки праймера (PEP) [73], к лизированной клетке добавляли 5 μл 400 μΜ раствор случайных праймеров (набор реагентов genPEP 75 OD, Genetix, Бостон, США), 6 μл ПЦР-буфера (25 мМ MgCl2/желатин (1 мг/мл), 100 мМ Tris-HCl, pH 8.3, 500 мМ KCl), 3 μл смеси четырех dNTP (каждый 2 мМ) и 1 μл (5 Ед) Taq-полимеразы (Applied Biosystem, Фостер-Сити, Калифорния, США) до конечного объема 60 μл. Генотипирование одиночных клеток осуществляли для идентификации клеток, имеющих эмбриональный геном, с использованием STR-праймеров, которые, как было обнаружено, информативны для анализа отцовской и материнской геномной ДНК. Амплификацию осуществляли в 60 μл, содержащих 6 μл продукта PEP, 10 мМ Tris-HCl, 50 мМ KCl, 2,5 мМ MgCl2, 200 μΜ каждого дезоксинуклеотида, 0,5 μΜ каждого 'внешнего' STR-праймера и 2 Ед. Taq Gold (Applied Biosystems, Фостер-Сити, Калифорния, США). 2 μл разведенного 1:10 внешнего ПЦР-продукта реамплифицировали в 20 μл конечного объема с использованием 'внутренних' флуоресцирующих STR-праймеров и такого же ПЦР-протокола. Один μл разведенного 1:20 внутреннего ПЦР-продукта затем смешивали с 13,5 μл денонсированного Hi-Di формамида и 0,5 μл маркера «Genescan 400 HD» (ROX) (Applied Biosystems) и загружали в автоматический секвенатор «ABI Prism 3100» (Applied Biosystems). Профили анализировали с использованием пакета программ «Genescan» и «Genotyper» (Applied Biosystems).
Неинвазивную пренатальную диагностику SMA и костозного фиброза осуществляли, как описано ранее [62].
Инвазивную диагностику проводили в Hôpital Necker-Enfants Malades, Laboratoire de Génétique Médicale, Париж.
Результаты
Суммарно скринировали 21 цервикальный образец, в которых использовали цитощетку для извлечения клеток исключительно на уровне внешнего зева у беременных женщин на сроке 7-12 недель. Среди них было 14, для кого планировали забор биопсии ворсин хориона (CVS), так как у них был риск того, что они носят плод с моногенетическим расстройством, и было 7 женщин, кому рекомендовали прерывание беременности (ТОР).
Цервикальные образцы, как правило, содержат множество материнских клеток. Как представлено на Фигуре 3, экзоцервикальные плоские эпителиальные клетки легко распознаются на изображениях под микроскопом. Однако эндоцервикальные клетки и эмбриональные цитотрофобласты могут иметь сходную морфологию и, таким образом, их гораздо труднее различить. Альциановый синий реагирует со слизью, продуцирующей цилиндрические эпителиальные клетки, которые должны оставаться неокрашенными. Клетки, демонстрирующие морфологию типа цитотропобластов: искали круглые клетки с крупным, неправильным гиперхроматированным ядром (Фиг. 3). Таким образом, мы смогли выделить одиночные цитотрофобласты, чей эмбриональный генотип подтверждали с помощью флуоресцентного ПЦР-анализа информативных STR-маркеров (фиг. 3, таблица 4).
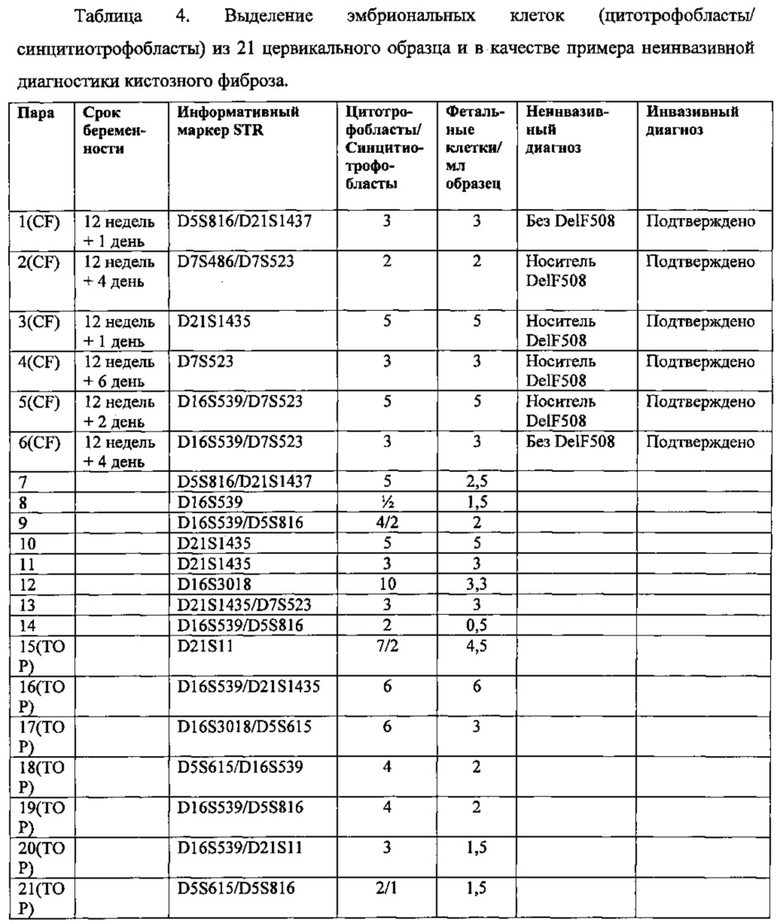
ТОР: Прерывание беременности, CF: Кистозный фиброз.
Синцитиотрофобласты имеют плотные ядра и являются многоядерными и, таким образом, как считается, хуже поддается молекулярному анализу. Кроме того, синцитиотрофобласты могут представлять собой скорее крупные фрагменты, поэтому должна повышаться вероятность появления смешанных клеточных популяций (эмбриональные и материнские). Однако с целью повышения количества извлекаемых эмбриональных клеток на образец, мы также начали микроразрезание полиядерных фрагментов, чей генотип снова определяли анализом STR (фиг. 3, таблица 4). В то время как мы смогли выделить синцитиотрофобласты, чья чистая эмбриональная природа была подтверждена (таблица 4), большинство фрагментов содержали эмбриональные, а также материнские элементы, как и ожидалось, и, таким образом, они были исключены из данного исследования.
Мы идентифицировали эмбриональные клетки (либо цитотрофобласты, либо цитотрофобласты и синцитиотрофобласты) во всех образцах в количестве 21, с частотой 0,5-6 эмбриональных клеток на 1 мл обработанного образца (таблица 4).
С целью демонстрации того, что наш ранее опубликованный протокол для неинвазивной диагностики кистозного фиброза (CF) может быть успешно применен к эмбриональным клеткам, выделенным из шейки матки, в качестве примера диагноз был поставлен для шести семейств CF (таблица 4). Неинвазивный диагноз CF был основан на наличии мутации De1F508 [62]. Мы определили, что все эмбрионы либо все вместе лишены мутации De1F508, либо были единичные носители (таблица 4). Наши результаты подтвердились биопсией ворсин хориона.
ОБСУЖДЕНИЕ
Путь разработки подходящих методов для выделения редких циркулирующих эмбриональных клеток не ограничен материнским кровотоком. В то время как следующее поколение методов секвенирования целых геномов, чьей мишенью является свободная эмбриональная ДНК в материнской сыворотке, кажется многообещающим, особенно по части детекции анеуплоидии, спектр наследственных расстройств, которые могут детектироваться, ограничен просто потому, что эмбриональная ДНК смешана с материнской ДНК. Получение эмбриональных клеток из шейки матки обеспечивает альтернативный источник и имеет преимущество, такое, что единственный тип клеток, обнаруженных в шейке матки, это трофобласты, которых как известно, нет при отсутствии беременности. Главной проблемой остается поиск и выделение этих редких клеток, или из материнского кровотока или из шейки матки. Забор трансцервикальных клеток (ТСС) объединяет различные методы, разработанные для извлечения эмбриональных клеток из эндоцервикса и нижнего отдела шейки матки. Однако главным недостатком является тот факт, что эти методы минимально инвазивны или полуинвазивны и сопряжены с риском потери плода. В наименее инвазивном способе забора ТСС используется цитощетка, которая, как правило, вставляется примерно на 2 см в эндоцевикальный канал для извлечения цервикальной слизи. Однако более крупные исследования нормально протекающей беременности, включая продолжительные плановые осмотры, должны проводиться до того, как этот способ будет признан безопасным. Также примечателен тот факт, что авторы идентифицировали эмбриональные клетки путем применения иммунофлуоресцентной микроскопии с использованием антигенных маркеров, но не подтвердили их эмбриональную природу генотипированием. Полностью неинвазиный и безопасный метод забора образцов, который обычно вводится в процессе первого триместра беременности, осуществляет забор клеток из эктоцервикса для извлечения клеток из зоны трансформации, где встречаются экто- и эндоцервикс. В нашем исследовании мы выбрали для адаптации данный способ выделения трофобластных клеток и объединили его с ISET, методом, разработанным в нашей лаборатории, который просто наслаивает клетки на мембрану и, таким образом, стабилизирует их для микродиссекции. Мы также способны обнаруживать эмбриональные клетки во всех тестируемых образцах и, таким образом, источник чистой эмбриональной ДНК для генетического тестирования. Мы показали, что также как в случае материнской крови, клетки поддаются генетическому анализу и диагностике и, таким образом, демонстрируют потенциал для разнообразных генетических тестов. Выделение эмбриональных клеток из двух источников полностью неинвазивно и с помощью клинически одобренных способов забора образцов (взятие крови и наш безопасный цервикальный тест), которые, как было доказано, безопасны во время беременности, может открыть дорогу к разработке раннего, безопасного и воспроизводимого диагностического теста генетических заболеваний.
Изобретение включает следующие конкретные воплощения:
1. Способ идентификации, диагностики или обеспечения прогноза состояния, расстройства или заболевания, ассоциированного с редкими клетками, включающий:
(a) выделение или экстракцию редких клеток путем проведения биологического образца через фильтр и извлечение выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор и другие физические характеристики, которые позволяют удерживать редкие клетки, но которые не мешают прохождению других типов клеток;
(b) определение цитоморфологии выделенных или экстрагированных редких клеток, и/или иммуномечение выделенных редких клеток, и/или осуществление молекулярного анализа на выделенных редких клетках;
(с) идентификацию, диагностику или обеспечение прогноза состояния, расстройства или заболевания и/или стадии состояния, расстройства или заболевания, ассоциированного с присутствием и/или количеством и/или характеристиками редких клеток на основании цитоморфологии, и/или иммуномечения и/или молекулярного анализа выделенных или экстрагированных редких клеток.
2. Способ воплощения 1, в котором биологический образец является кровью, которая необязательно может быть отфильтрована таким образом, что допускается разделение и выделение редких клеток, а также лейкоцитов, а плазма крови отделяется от редких клеток для молекулярного анализа.
3. Способ воплощения 1 или 2, в котором биологический образец является биологической жидкостью, отличной от крови.
4. Способ по любому из воплощений 1-3, в котором биологический образец является слизью или получен из слизистой оболочки.
5. Способ по любому из воплощений 1-4, в котором биологический образец получают из объекта, имеющего злокачественную опухоль или опухоль, или у которого подразумевается наличие или имеется риск развития опухоли или злокачественной опухоли.
6. Способ по любому из воплощений 1-5, в котором биологический образец получают из объекта, имеющего злокачественную опухоль или незлокачественное пролиферативное состояние, расстройство или заболевание, или у которого подразумевается наличие или который имеет риск наличия незлокачественного пролиферативного состояния, расстройства или заболевания.
7. Способ по любому из воплощений 1-6, в котором биологический образец получают из объекта, у которого имеется воспалительное и/или дегенеративное состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск воспалительного и/или дегенеративного состояния, расстройства или заболевания.
8. Способ по любому из воплощений 1-7, в котором биологический образец получают из объекта, который имеет сердечнососудистое состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск наличия сердечнососудистого состояния, расстройства или заболевания.
9. Способ по любому из воплощений 1-8, в котором биологический образец получают из объекта, который имеет инфекционное состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск наличия инфекционного состояния, расстройства или заболевания.
10. Способ по любому из воплощений 1-9, включающий (а) выделение или экстракцию редких клеток путем проведения биологического образца через поликарбонатный фильтр и извлечение выделенных или экстрагированных редких клеток на поликарбонатном фильтре.
11. Способ по любому из воплощений 1-10, включающий (а) выделение или экстракцию редких клеток путем проведения биологического образца через PET (полиэтилен терефталат) фильтр и извлечение экстрагированных или выделенных редких клеток на PET (полиэтилен терефталат) фильтре.
12. Способ по любому из воплощений 1-11, включающий (а) выделение или экстракцию редких клеток путем проведения биологического образца через фильтр, изготовленный из любого пористого материала и извлечение выделенных или экстрагированных редких клеток на указанном фильтре.
13. Способ по любому воплощений 1-12, в котором биологический образец разведен перед (а).
14. Способ по любому воплощений 1-13, в котором биологический образец является свежим перед (а).
15. Способ по любому воплощений 1-14, в котором биологический образец фиксирован перед (а).
16. Способ по воплощению 14 или 15, в котором биологический образец обработан лизирующим клетки агентом перед (а).
17. Способ по воплощению 14 или 15, в котором биологический образец обработан муколитическим агентом перед (а).
18. Способ по воплощению 14 или 15, в котором биологический образец обработан протеолитическим агентом перед (а).
19. Способ по воплощению 14 или 15, в котором биологический образец обработан антикоагулирующим агентом перед (а).
20. Способ по любому из воплощений 1-19, в котором редкие клетки, выделенные или экстрагированные фильтрацией, переносят на подложку перед дальнейшим анализом как в (b) или для культивирования.
21. Способ по любому из воплощений 1-20, в котором редкие клетки собирают индивидуально для молекулярных анализов после их экстракции или выделения фильтрацией.
22. Способ по любому из воплощений 1-21, в котором все клетки, экстрагированные или выделенные фильтрацией собирают для использования в (b).
23. Способ по любому из воплощений 1-22, в котором выделенные или экстрагированные редкие клетки культивируют перед (b).
24. Способ по любому из воплощений 1-23, в котором выделенные или экстрагированные клетки культивируют и используют для тестирования их чувствительности к конкретным лекарственным средствам и их различных доз.
25. Способ по любому из воплощений 1-23, в котором выделенные или экстрагированные клетки используют для выбора лечения или таргетного лечения, которое будет назначаться пациенту, и для отслеживания ответа и/или устойчивости к нему.
26. Способ по любому из воплощений 1-25, в котором выделенные или экстрагированные редкие клетки фиксируют перед (b).
27. Способ по любому из воплощений 1-26, в котором выделенные или экстрагированные редкие клетки окрашивают или иммуноокрашивают на фильтре перед (b).
28. Способ по любому из воплощений 1-27, в котором выделенные или экстрагированные редкие клетки анализируют в (b) с помощью in situ молекулярных анализов после или перед окрашиванием или иммуноокрашиванием.
29. Способ по любому из воплощений 1-27, в котором (b) включает цитоморфологический анализ выделенных или экстрагированных редких клеток in situ на фильтре или другой подложке.
30. Способ по любому из воплощений 1-29, в котором (b) включает иммуномечение выделенных или экстрагированных редких клеток in situ на фильтре или другой подложке.
31. Способ по любому из воплощений 1-30, в котором (b) включает молекулярный анализ белков, нуклеиновых кислот или других компонентов выделенных или экстрагированных редких клеток in situ на фильтре.
32. Способ по любому из воплощений 1-32, в котором (b) включает молекулярный анализ белков, пептидов или полипептидов выделенных или экстрагированных редких клеток.
33. Способ по любому из воплощений 1-32, в котором (b) включает молекулярный анализ ДНК, РНК или микроРНК, выделенных или экстрагированных редких клеток.
34. Способ любого из воплощений 1-33, дополнительно включающий (b1) визуализацию изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или молекулярного анализа in situ.
35. Способ любого из воплощений 1-34, дополнительно включающий (b2) запись изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или молекулярного анализа in situ.
36. Способ обнаружения наличия или отсутствия редких клеток, включающий:
(a) выделение или экстракцию редких клеток путем проведения биологического образца через фильтр и извлечение выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пори и другие физические характеристики, которые сохраняют редкие клетки, но которые позволяют прохождение других типов клеток;
(b) необязательно, культивирование выделенных или экстрагированных редких клеток;
(c) необязательно, фиксирование или окрашивание выделенных или экстрагированных редких клеток или необязательно культивированных редких клеток;
(d) анализ выделенных или экстрагированных редких клеток из (а), (b) или (с) путем иммуномечения, и/или in situ молекулярного анализа и/или молекулярного анализа ДНК, РНК и/или микроРНК редких клеток, и/или молекулярного анализа белковых молекул редких клеток.
37. Способ по воплощению 36, в котором выделенные или экстрагированные редкие лизируют для и в течение (d).
38. Способ воплощения 36 или 37, где выделенные или экстрагированные редкие клетки лизируют, и стадия (d) включает обнаружение мутантных белков и/или мутантной РНК и/или ДНК-мутаций, ассоциированных с патологическим состоянием, расстройством или заболеванием.
39. Способ воплощения 38, дополнительно включающий выбор таргентного лечения для персонализированной медицины, для оценки эффективности лечения, или для обнаружения возможной устойчивости к лечению, основанном на обнаружении мутантной ДНК, и/или мутантной РНК, и/или мутантного(ых) белка(ов) в лизированных редких клетках.
40. Способ любого из воплощений 36-39, где выделенные и экстрагированные редкие клетки лизируют, и стадия (d) включает обнаружение наличия или отсутствия ALK-мутаций в лизированных редких клетках.
41. Способ любого из воплощений 36-40, где выделенные или экстрагированные редкие клетки лизированы, и (d) включает обнаружение наличия или отсутствия мутаций ALK в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, после эффективности лечения, или детекции устойчивости к лечению, основанном на наличии или отсутствии мутации ALK;
42. Способ любого из воплощений 36-41, где выделенные или экстрагированные редкие клетки лизированы и (d) включает обнаружение наличия или отсутствия K-RAS и/или EGFR мутации в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, после эффективности лечения, или детекции устойчивости к лечению, основанном на наличии или отсутствии мутации IGRAS и/или EGFR;
43. Способ любого из воплощений 36-42, где выделенные или экстрагированные редкие клетки лизированы и (d) включает детекцию наличия или отсутствия мутации В-RAF и/или HER2 в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, после эффективности лечения, или детекции устойчивости к лечению, основанном на наличии или отсутствии мутаций B_RAF и/или HER2.
44. Лечение персонализированной терапией, включающее повторение способа любого из воплощений 36-43 с использованием биологических образцов, полученных из одного и того же объекта в различные моменты времени.
45. Лечение персонализированной терапией по п. 44, где биологические образцы полученных от одного и того же пациента перед и после лечения, в различные моменты времени в ходе лечения состояния, или в ходе различных схем лечения состояния, расстройства или заболевания, ассоциированного с редкими клетками.
46. Персонализированное лечение по воплощению 45,
(e), дополнительно включающее сравнение количества редких клеток между образцами, полученными в различные моменты времени для определения эффективности схемы лечения или для обнаружения устойчивости схемы лечения, где снижение относительного количества детектированных редких клеток указывает на относительную эффективность схемы лечения, и где увеличение относительного количества детектированных редких клеток указывает на устойчивость к или неэффективность схемы лечения; и необязательно,
(f) выбор эффективного персонализированного таргетного лечения объекта на основании (е).
47. Способ любого из воплощений 36-43, где стадия (d) анализа выделенных или экстрагированных редких клеток включает определение типа и/или происхождения редких клеток.
48. Способ любого из воплощений 36-43 и 47, где стадия (d) анализа выделенных или экстрагированных редких клеток включает определение статуса эпителиально-мезенхимального перехода редких клеток.
49. Способ любого из воплощений 36-43 и 47-48, где стадия (d) анализа выделенных или экстрагированных редких клеток включает определение статуса стволовых редких клеток.
50. Способ любого из воплощений 36-43 и 47-49, где стадия (d) анализа выделенных или экстрагированных редких клеток включает определение наличия у редких клеток сигнатуры генной экспрессии, ассоциированной с метастатическими или инвазивными клетками, или определение экспрессии редкими клетками детерминант, ассоциированных с метастазированием или инвазией.
51. Способ любого из воплощений 36-43 и 47-50, дополнительно включающий постановку раннего диагноза патологического состояния, расстройства или заболевания, ассоциированного с редкими клетками, на основании (d).
52. Способ любого из воплощений 36-43 и 47-51, дополнительно включающий постановку раннего диагноза злокачественного новообразования и/или инвазивного злокачественного новообразования, ассоциированного с редкими клетками, на основании (d).
53. Способ любого из воплощений 36-43 и 47-52, дополнительно включающий постановку раннего диагноза с определением органа, откуда происходит злокачественное новобразование и/или инвазивное злокачественное новообразование.
54. Способ любого из воплощений 36-43 и 47-53, дополнительно включающий постановку раннего диагноза инфекционного патологического состояния, расстройства или заболевания, ассоциированного с редкими клетками, на основании (d).
55. Способ любого из воплощений 36-43 и 47-54, дополнительно включающий оценку эффекта лекарственного средства - кандидата ил лечения-кандидата на молекулярные характеристики редких клеток, и выбор лекарственного средства или лечения, которое уменьшает количество редких клеток в объекте по сравнению с контролем, не получавшим лекарственного средства или лечения, и выбор лекарственного средства или лечения, которые уменьшают относительное количество редких клеток или модифицируют молекулярные или иммунологические характеристики редких клеток по сравнению с контролем.
56. Способ любого из воплощений 36-43 и 47-55, дополнительно включающий оценку склонности и/или риска развития у объекта состояния, расстройства или заболевания, ассоциированного с исходным уровнем, или контрольное значение, указывающее на склонность или повышенный риск развития указанного состояния, расстройства или заболевания, или где молекулярное или иммунологическое изменение в редких клетках по сравнению с исходным уровнем или контрольным значением указывает на склонность или повышенный риск развития указанного патологического состояния, расстройства или заболевания.
57. Способ по любому из воплощений 36-43 и 47-56, в котором состояние, расстройство или заболевание является генетическим расстройством.
58. Способ по любому из воплощений 36-43 и 47-57, в котором состояние, расстройство или заболевание является злокачественной опухолью или неопластическим заболеванием.
59. Способ по любому из воплощений 36-43 и 47-56, в котором состояние, расстройство или заболевание является инфекционным состоянием, расстройством или заболеванием.
60. Набор, содержащий, по меньшей мере, одно из:
один или несколько фильтров для экстракции или выделения редких клеток из биологической жидкости,
один или несколько буферов, разбавителей или других агентов для лечения биологической жидкости перед фильтрацией,
один или несколько буферов для суспендирования, отмывки или иной обработки редких клеток после того, как они были экстрагированы или выделены из биологической жидкости,
один или несколько трансферных буферов для переноса выделенных или экстрагированных редких клеток с фильтра на другую подложку,
один или несколько цитоморфологических и/или цитохимических окрашивающих реактивов или других клеточных красителей, или буферов для этого,
одно или несколько антител или других реактивов для иммуномечения редких клеток или буферов для этого,
один или несколько реактивов для in situ анализа редких клеток на фильтре или другой подложке,
один или несколько лизирующих агентов или лизирующих буферов для лизиса редких клеток,
один или несколько антител или других реактивов для молекулярного анализа белков редких клеток, или буферов для этого.
один или несколько зондов, праймеров, нуклеотидов, ферментов или других реактивово для молекулярного анализа нуклеиновых кислот редких клеток, включая ПЦР.
61. Сравнение, включающие одну или несколько редких клеток, выделенных или экстрагированных путем проведения биологического образца через фильтр и извлечение выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые удерживают редкие клетки, но которые не препятствуют прохождению других типов клеток.
62. Фильтр или любая другая подложка, включающая композицию воплощения 61.
63. Способ по любому из воплощений 36-43 и 47-59, дополнительно включающий постановку раннего диагноза рака легкого, ассоциированного с опухолевыми клетками на основании стадии d) воплощений 36-43 и 47-59.
64. Способ по любому из воплощений 36-43 и 47-59, дополнительно включающий постановку раннего диагноза наличия и/или тяжести сердечнососудистого заболевания, ассоциированного с эндотелиальными клетками на основании стадии d) воплощений 36-43 и 47-59.
Включение ссылкой
Каждый документ, патент, патентная заявка или патентная публикация, процитированная, или на которую ссылаются в данном описании, является включенной ссылкой во всей своей полноте, особенно по отношению к конкретному объекту изобретения, окружающему цитирование источника в данном тексте. Тем не менее, не признается, что любой такой источник составляет предшествующий уровень техники, и сохраняется право на обжалование точности и уместности цитируемых документов.
Список литературы
1. Goya Τ, Asamura H, Yoshimura Η et al., Prognosis of 6644 resected non-small cell lung cancers in Japan: a Japanese lung cancer registry study. Lung Cancer 2005; 50:227-34.
2. Jemal A, Siegel R, Ward E, et al., Cancer statistics, 2008. CA Cancer J Clin 2008; 58:71-96.
3. Naruke T, Tsuchiya R, Kondo H, Asamura, H. Prognosis and survival after resection for bronchogenic carcinoma based on the 1997 TNM-staging classification: the Japanese experience. Ann Thorac Surg 2001; 71:1759-64.
4. Pfannschmidt J, Muley T, Bulzebruck H, et al., Prognostic assessment after surgical resection for non-small cell lung cancer: experiences in 2083 patients. Lung Cancer 2007; 55:371-7.
5. van Rens MT, de la Riviere AB, Elbers HR, van Den Bosch JM. Prognostic assessment of 2,361 patients who underwent pulmonary resection for non-small cell lung cancer, stage I, II, and IIΙΑ. Chest 2000; 117:374-9.
6. Hirsch FR, Wynes MW, Gandara DR, Bunn PA Jr., The tissue is the issue: personalized medicine for non-small cell lung cancer. Clin Cancer Res 2010; 16:4909-11.
7. Mino-Kenudson M, Mark EJ., Reflex testing for epidermal growth factor receptor mutation and anaplastic lymphoma kinase fluorescence in situ hybridization in non-small cell lung cancer. Arch Pathol Lab Med 2011; 135:655-64.
8. Pao W, Girard Ν., New driver mutations in non-small-cell lung cancer. Lancet Oncol 2011; 12:175-80.
9. Bria E, Milella M, Cuppone F, et al., Outcome of advanced NSCLC patients harboring sensitizing EGFR mutations randomized to EGFR tyrosine kinase inhibitors or chemotherapy as first-line treatment: a meta-analysis. Ann Oncol. 2011; 22:2277-85.
10. Gerber DE, Minna JD., ALK inhibition for non-small cell lung cancer: from discovery to therapy in record time. Cancer Cell 2010; 18:548-51.
11. Sasaki T, Jänne PA., New strategies for treatment of ALK-rearranged non-small cell lung cancers. Clin Cancer Res 2011; 17:7213-8.
12. Shaw AT, Solomon В., Targeting anaplastic lymphoma kinase in lung cancer. Clin Cancer Res 2011; 17:2081-6.
13. Shaw AT, Yeap BY, Solomon BJ, et al., Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol 2011; 12:1004-12.
14. Yoshida A, Tsuta K, Nakamura H, et al., Comprehensive histologic analysis of ALK-rearranged lung carcinomas. Am J Surg Pathol 2011; 35:1226-34.
15. Hofman V, Bonnetaud C, Ilie MI, et al., Preoperative circulating tumor cell detection using the isolation by size of epithelial tumor cell method for patients with lung cancer is a new prognostic biomarker. Clin Cancer Res 2011; 17:827-35.
16. Krebs MG, Sloane R, Priest L, et al., Evaluation and prognostic significance of circulating tumor cells in patients with non-small-cell lung cancer. J Clin Oncol. 2011a; 29:1556-63.
17. Krebs MG, Hou JM, Sloane R, et al., Analysis of circulating tumor cells in patients with non-small cell lung cancer using epithelial marker-dependent and -independent approaches. J Thorac Oncol 2011b Dec 14.
18. Paterlini-Brechot P, Benali NL., Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer Lett 2007; 253:180-204.
19. Yu M, Stott S, Toner M, et al., Circulating tumor cells: approaches to isolation and characterization. J Cell Biol 2011; 192:373-82.
20. Maheswaran S, Sequist LV, Nagrath S, et al,. Detection of mutations in EGFR in circulating lung-cancer cells. N Engl J Med 2008; 359:366-77.
21. Hofman V, Ilie MI, Long E, et al., Detection of circulating tumor cells as a prognostic factor in patients undergoing radical surgery for non-small-cell lung carcinoma: comparison of the efficacy of the CellSearch Assay™ and the isolation by size of epithelial tumor cell method. Int J Cancer 2011; 129:1651-60.
22. Hofman V, Long E, Ilie M, et al., Morphological analysis of circulating tumor cells in patients undergoing surgery for non-small cell lung carcinoma using the isolation by size of epithelial tumor cell (ISET) method. Cytopathology 2012; 23:30-8.
23. Vona G, Sabile A, Louha M, et al., Isolation by size of epithelial tumor cells: a new method for the immunomorphological and molecular characterization of circulating tumor cells. Am J Pathol 2000; 156:57-63.
24. Hou JM, Krebs M, Ward T, et al., Circulating tumor cells as a window on metastasis biology in lung cancer. Am J Pathol 2011; 178:989-96.
25. Lecharpentier A, Vielh P, Perez-Moreno P, et al., Detection of circulating tumor cells with a hybrid (epithelial/mesenchymal) phenotype in patients with metastatic non-small cell lung cancer. Br J Cancer 2011; 105:1338-41.
26. Lababede O, Meziane M, Rice T., Seventh edition of the cancer staging manual and stage grouping of lung cancer: quick reference chart and diagrams. Chest 2011; 139:183-9.
27. Travis WD, Brambilla E, Noguchi M, et al., International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6:244-85.
28. Rodig SJ, Mino-Kenudson M, Dacic S, et al., Unique clinicopathologic features characterize ALK-rearranged lung carcinoma in the western population. Clin Cancer Res 2009; 15:5216-23.
29. Ogino S, Kawasaki T, Brahmandam M, et al., Sensitive sequencing method for KRAS mutation detection by pyrosequencing. J Mol Diagn 2005; 7:413-21.
30. Richman SD, Seymour MT, Chambers P, et al., KRAS and BRAF mutations in advanced colorectal cancer are associated with poor prognosis but do not preclude benefit from oxaliplatin or Irinotecan: Results From the MRC FOCUS Trial. J Clin Oncol 2009; 27:5931-7.
31. Hofman P, Ilie M, Hofman V, et al., Immunohistochemistry to identify EGFR mutations or ALK rearrangements in patients with lung adenocarcinoma. Ann Oncol 2011 Nov 18.
32. Koivunen JP, Mermel C, Zejnullahu K, et al., EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res2008; 14:4275-83.
33. Lee JK, Park HS, Kim DW, et al., Comparative analyses of overall survival in patients with anaplastic lymphoma kinase-positive and matched wild-type advanced nonsmall cell lung cancer. Cancer 2011 Nov 15.
34. Wu SG, Kuo YW, Chang YL, et al., EML4-ALK Translocation Predicts Better Outcome in Lung Adenocarcinoma Patients with Wild-Type EGFR. J Thorac Oncol 2012; 7:98-104.
35. Yang P, Kulig K, Boland JM, et al., Worse disease-free survival in never-smokers with ALK+ lung adenocarcinoma. J Thorac Oncol 2012; 7:90-7.
36. Just PA, Cazes A, Audebourg A, et al., Histologic subtypes, immunohistochemistry, FISH or molecular screening for the accurate diagnosis of ALK-rearrangement in lung cancer: A comprehensive study of Caucasian non-smokers. Lung Cancer. 2011 Dec 6.
37. Paik JH, Choi CM, Kim H, et al., Clinicopathologic implication of ALK rearrangement in surgically resected lung cancer A proposal of diagnostic algorithm for ALK-rearranged adenocarcinoma. Lung Cancer 2011 Nov 28.
38. Sasaki T, Rodig SJ, Chirieac LR, et al., The biology and treatment of EML4-ALK non-small cell lung cancer. Eur J Cancer 2010; 46:1773-80.
39. Popat S, Gonzalez D, Min T, et al., ALK translocation is associated with ALK immunoreactivity and extensive signet-ring morphology in primary lung adenocarcinoma. Lung Cancer 2011 Aug 18. [Epub ahead of print].
40. Yi ES, Boland JM, Maleszewski JJ, et al., Correlation of ICH and FISH for ALK gene rearrangement in non-small cell lung carcinoma: ICH score algorithm for FISH. J Thorac Oncol 2011; 6:459-65.
41. Kitamura A, Hosoda W, Sasaki E, et al., Immunohistochemical detection of EGFR mutation using mutation-specific antibodies in lung cancer. Clin Cancer Res 2010; 16:3349-55.
42. Krebs MG, Hou JM, Ward TH, et al., Circulating tumor cells: their utility in cancer management and predicting outcomes. Ther Adv Med Oncol 2010; 2:351-65.
43. Katayama R, Khan TM, Benes C, et al., Therapeutic strategies to overcome crizotinib resistance in non-small cell lung cancers harboring the fusion oncogene EML4-ALK. Proc Natl Acad Sci USA 2011; 108:7535-40.
44. Heuckmann JM, Hôlzel M, Sos ML, et al., ALK mutations conferring differential resistance to structurally diverse ALK inhibitors. Clin Cancer Res 2011; 17:7394-401.
45. Paterlini-Brechot P, Benali NL., Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer Lett. 2007; 253:180-204.
46. Krebs MG, Hou JM, Sloane R, Lancashire L, Priest L, Nonaka D, et al., Analysis of circulating tumor cells in patients with non-small cell lung cancer using epithelial marker-dependent and - independent approaches. J Thorac Oncol. 2012; 7:306-15.
47. Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, et al., EMT and dissemination precede pancreatic tumor formation. Cell. 2012; 148:349-61.
48. Klein C, Parallel progression of primary tumours and metastases. Nature Reviews Cancer, 2009 (9): 302-312.
49. National Lung Screening Trial Research Team: Aberle DR, Adams AM, Berg CD, Black WC, Clapp JD, Fagerstrom RM, Gareen IF, Gatsonis C, Marcus PM, Sicks JD. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011 4; 365:395-409.
50. Hofman V, Bonnetaud C, Hie MI, Vielh P, Vignaud JM, Flejou JF, et al., Preoperative Circulating Tumor Cell Detection Using the Isolation by Size of Epithelial Tumor Cell Method for Patients with Lung Cancer Is a New Prognostic Biomarker. Clin Cancer Res. 2011; 17:827-35.
51. Hofman V, Long E, Ilie M, Bonnetaud C, Vignaud JM, Flejou JF, et al., Morphological analysis of circulating tumour cells in patients undergoing surgery for non-small cell lung carcinoma using the isolation by size of epithelial tumour cell (ISET) method. Cytopathology. 2012; 23:30-8.
52. Mazzone P, Mekhail T., Current and emerging medical treatments for non-small cell lung cancer: a primer for pulmonologists. Respir Med. 2012; 106:473-92.
53. 2. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, et al., Cancer statistics, 2008. CA Cancer J Clin. 2008; 58:71-96.
54. Mets ОМ, Buckens CF, Zanen P, Isgum I, van Ginneken B, Prokop M, Gietema HA, Lammers JW, Vliegenthart R, Oudkerk M, van Klaveren RJ, de Koning HJ, Mali WP, de Jong PA., Identification of chronic obstructive pulmonary disease in lung cancer screening computed tomographic scans. JAMA. 2011; 306:1775-81.55. Mujezinovic F, Alfirevic Z. Procedure-related complications of amniocentesis and chorionic villous sampling: a systematic review. Obstet Gynecol 2007; 110:687-694.
56. Dan S, Wang W, Ren J, Li Y, Hu H, Xu Z, Lau TK, Xie J, Zhao W, Huang H et al., Clinical application of massively parallel sequencing-based prenatal noninvasive fetal trisomy test for trisomies 21 and 18 in 11105 pregnancies with mixed risk factors. Prenat Diagn 2012; 32:1-8.
57. Zimmermann B, Hill M, Gemelos G, Demko Z, Banjevic M, Baner J, Ryan A, Sigurjonsson S, Chopra N, Dodd M et al., Noninvasive prenatal aneuploidy testing of chromosomes 13, 18, 21, X, and Y, using targeted sequencing of polymorphic loci. Prenat Diagn 2012; 32:1233-1241.
58. Lo YM, Lun FM, Chan KC, Tsui NB, Chong KC, Lau TK, Leung TY, Zee ВС, Cantor CR, Chiu RW., Digital PCR for the molecular detection of fetal chromosomal aneuploidy. Proc Natl Acad Sci USA 2007; 104:13116-13121.
59. Chiu RW, Chan KC, Gao Y, Lau VY, Zheng W, Leung TY, Foo CH, Xie B, Tsui NB, Lun FM et al., Noninvasive prenatal diagnosis of fetal chromosomal aneuploidy by massively parallel genomic sequencing of DNA in maternal plasma. Proc Natl Acad Sci USA 2008; 105:20458-20463.
60. Fan HC, Blumenfeld YJ, Chitkara U, Hudgins L, Quake SR., Noninvasive diagnosis of fetal aneuploidy by shotgun sequencing DNA from maternal blood. Proc Natl Acad Sci USA 2008; 105:16266-16271.
61. Vona G, Beroud C, Benachi A, Quenette A, Bonnefont JP, Romana S, Munnich A, Vekemans M, Dumez Y, Lacour В et al., Enrichment, immunomorphological, and genetic characterization of fetal cells circulating in maternal blood. Am J Path 2002; 160:51-58.
62. Mouawia H, Saker A, Jais JP, Benachi A, Bussieres L, Lacour B, Bonnefont JP, Frydman R, Simpson JL, Paterlini-Brechot P., Circulating trophoblastic cells provide genetic diagnosis in 63 fetuses at risk for cystic fibrosis or spinal muscular atrophy. Reprod Biomed Online 2012; 25:508-520.
63. Shettles LB. Use of the Y chromosome in prenatal sex determination. Nature 1971; 230:52-53.
64. Rhine SA, Cain JL, Cleary RE, Palmer CG, Thompson JF. Prenatal sex detection with endocervical smears: successful results utilizing Y-bodyfluorescence. Am J Obstet Gynecol 1975; 122:155-160.
65. Ergin T, Baltaci V, Zeyneloglu HB, Duran EH, Ergenell MH, Batioglu S. Noninvasive early prenatal diagnosis using fluorescent in situ hybridization on transcervical cells: comparison of two different methods for retrieval. Eur J Obstet Gynecol Reprod Biol 2001; 95:37-41.
66. Cioni R, Bussani C, Bucciantini S, Scarselli G. Fetal cells in a transcervical cell sample collected at 5 weeks of gestation. J Mat-Fet Neonat Med 2005; 18:271-273.
67. Cioni R, Bussani C, Scarselli B, Bucciantini S, Marchionni M, Scarselli G. Comparison of two techniques for transcervical cell sampling performed in the same study population. Prenat Diagn 2005; 25:198-202.
68. Bussani C, Scarselli B, Cioni R, Bucciantini S, Scarselli G. Use of the quantitative fluorescent-PCR assay in the study of fetal DNA from micromanipulated transcervical samples. Mol Diagn 2004; 8:259-263.
69. Kingdom J, Sherlock J, Rodeck C, Adinolfi M. Detection of trophoblast cells in transcervical samples collected by lavage or cytobrush. Obstet Gynecol 1995; 86:283-288.
70. Massari A, Novelli G, Colosimo A, Sangiuolo F, Palka G, Calabrese G, Camurri L, Ghirardini G, Milani G, Giorlandino С et al. Non-invasive early prenatal molecular diagnosis using retrieved transcervical trophoblast cells. Hum Genet 1996; 97:150-155.
71. Chang SD, Lin SL, Chu KK, His BL. Minimally-invasive early prenatal diagnosis using fluorescence in situ hybridization on samples from uterine lavage. Prenat Diagn 1997; 17:1019-1025.
72. Chou MM, Lin SK, Ho ES. Severe limb reduction defects after uterine lavage at 7-8 weeks' gestation. Prenat Diagn 1997; 17:77-80.
73. Zhang L, Cui X, Schmitt K, Hubert R, Navidi W, Arnheim N. Whole genome amplification from a single cell: implications for genetic analysis. Proc Natl Acad Sci USA 1992; 89:5847-5851.
74. Imudia AN, Suzuki Y, Kilburn BA, Yelian FD, Diamond MP, Romero R, Armant DR. Retrieval of trophoblast cells from the cervical canal for prediction of abnormal pregnancy: a pilot study. Hum Reprod 2009; 24:2086-2092.
75. Coumans, F.A.W., et al., Filter Characteristics Influencing Circulating Tumor Cell Enrichment from Whole Blood, PLOS ONE 8(4): e61770 (April 2013).
76. Coumans, F.A.W., et al., Filtration Parameters Influencing Circulating Tumor Cell Enrichment from Whole Blood, PLOS ONE 8(4): e61774 (April 2013).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОВЕДЕНИЯ МУЛЬТИ-АНАЛИЗОВ РЕДКИХ КЛЕТОК, ЭКСТРАГИРОВАННЫХ ИЛИ ВЫДЕЛЕННЫХ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ ФИЛЬТРАЦИЕЙ | 2013 |
|
RU2765808C2 |
| СПОСОБЫ КЛАССИФИКАЦИИ ПАЦИЕНТОВ С СОЛИДНЫМ РАКОМ | 2017 |
|
RU2745730C2 |
| ИНДИВИДУАЛИЗИРОВАННЫЕ ПРОТИВООПУХОЛЕВЫЕ ВАКЦИНЫ | 2012 |
|
RU2670745C9 |
| Способы и композиции для лечения опухолей | 2017 |
|
RU2741786C2 |
| РЕПРЕЗЕНТАТИВНАЯ ДИАГНОСТИКА | 2016 |
|
RU2743169C2 |
| МУТАНТНЫЕ ЛЕНТИВИРУСНЫЕ БЕЛКИ ENV И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2012 |
|
RU2654673C2 |
| Способ оценки риска развития рака легкого на фоне хронической обструктивной болезни легких | 2022 |
|
RU2790302C1 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| Способ прогнозирования выживаемости у пациентов с аденокарциномой легкого, несущей мутации в гене KRAS | 2019 |
|
RU2702986C1 |
| ИНДИВИДУАЛИЗИРОВАННЫЕ ПРОТИВООПУХОЛЕВЫЕ ВАКЦИНЫ | 2012 |
|
RU2779946C2 |





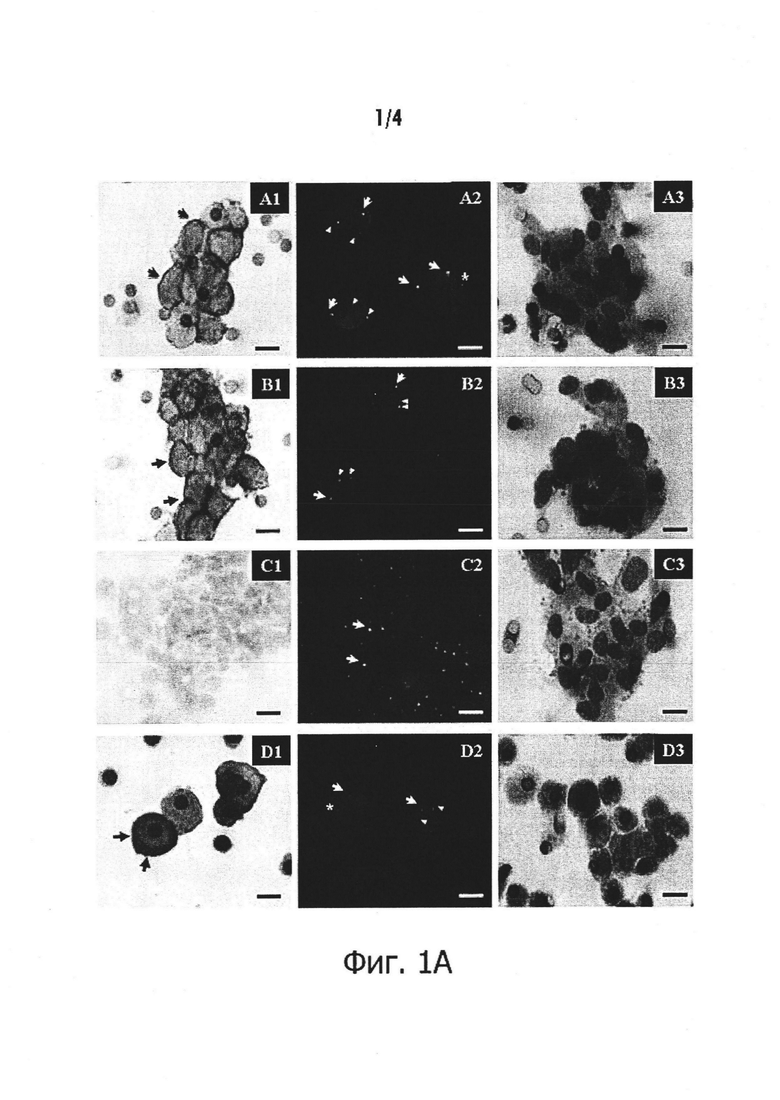

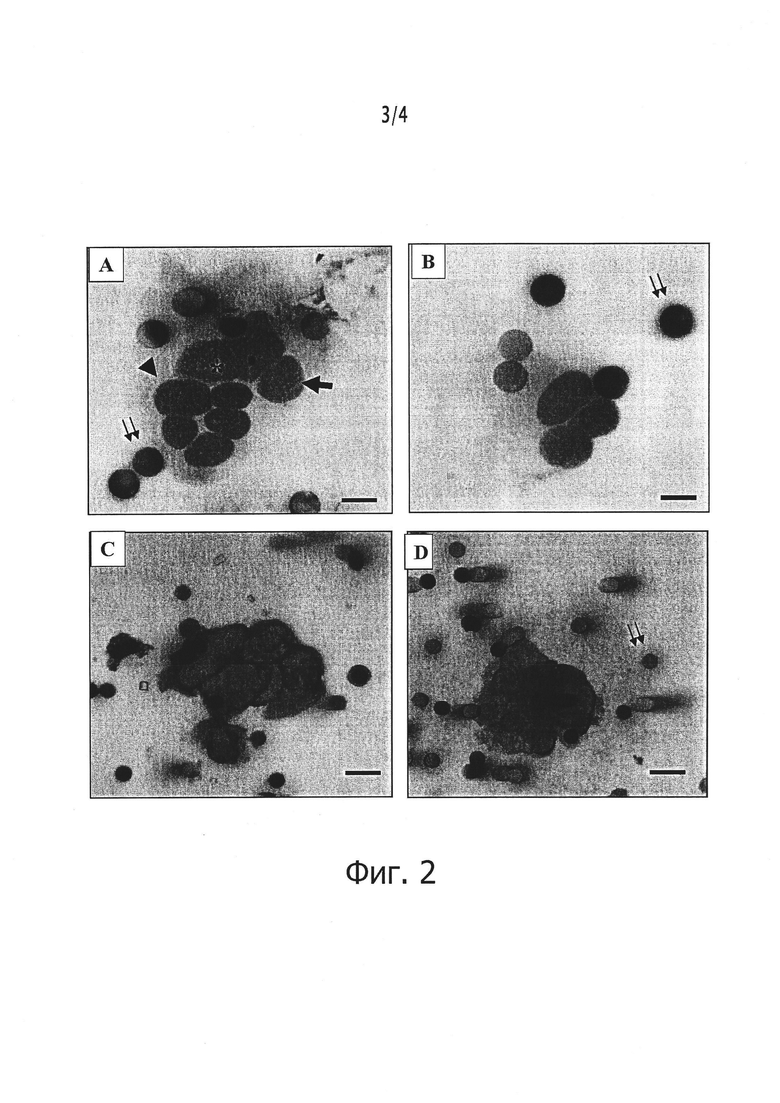

Изобретение относится к медицине, а именно к клинической онкологии для ранней диагностики инвазивного рака. Для этого выделяют или экстрагируют циркулирующие раковые клетки из биологического образца вертикальной фильтрацией через фильтр с размером пор между 3 и 100 мкм, который позволяет удерживать свободно циркулирующие опухолевые редкие клетки, но не препятствует прохождению через фильтр более мелких клеток. Выделенные клетки анализируют методом цитоморфологии, молекулярного анализа или анализа ДНК и/или РНК. Результаты определения используют для диагностики инвазивного рака, выбора таргетного лечения и мониторинга развития устойчивости к лекарственным средствам. Изобретение обеспечивает неинвазивный тест биологического образца для ранней диагностики инвазивного рака у пациентов с подозрением на наличие злокачественных опухолей. 17 з.п. ф-лы, 4 табл., 3 ил., 4 пр.
1. Способ ранней диагностики инвазивного рака, включающий:
(а) выделение или экстракцию циркулирующих раковых клеток путем проведения антикоагулированного образца крови или антикоагулированного разведенного образца крови, полученной от субъекта с риском развития рака, вертикальной фильтрацией через фильтр и извлечение выделенных или экстрагированных клеток, которые не проходят через фильтр; где фильтр имеет размер пор между 3 и 100 мкм, и плотность пор между 3×103 и 5×106 пор/см2, и где этот фильтр задерживает циркулирующие раковые клетки, но позволяет проход клеток крови более мелких, чем эти циркулирующие раковые клетки,
b) анализ этих клеток со стадии (а) путем цитоморфологического исследования, и/или иммуномечения, и/или молекулярного анализа in sity, и/или молекулярного анализа ДНК, и/или РНК, и/или микро-РНК, и/или молекулярного анализа белковых молекул для определения присутствуют ли циркулирующие раковые клетки, благодаря чему определяют, что субъект имеет риск ракового заболевания.
2. Способ по п. 1, в котором фильтр имеет размер пор между 5 и 25 мкм.
3. Способ по любому из пп. 1 или 2, дополнительно включающий лизирование клеток красной крови в образце антикоагулированной крови или в разведенном образце антикоагуолированной крови перед стадией (а).
4. Способ по любому из пп. 1-3, который (а) обеспечивает отделение большинства нейтрофилов и зрелых лимфоцитов и эритроцитов и сохранение на фильтре клеток, которые больше чем зрелые лимфоциты и нейтрофилы.
5. Способ по любому из пп. 1-4, в котором фильтр содержит поликарбонат или PET (полиэтилентерефталат).
6. Способ по любому из пп. 1-6, в котором фильтр содержит, по меньшей мере, одну элементарную область фильтрации, которая имеет поверхность, равную поверхности диска с диаметром от 0,6 см до 3 см, и количество элементарных областей фильтрации выбирают так, чтобы соотношение объема жидкости, фильтруемой через поверхность фильтрации, составляло меньше чем 40 мл/см2, предпочтительно больше чем 0,14 мл/см2.
7. Способ по любому из пп. 1-6, дополнительно включающий культивирование выделенных клеток, которые не проходят через фильтр перед стадией (b).
8. Способ по любому из пп. 1-7, дополнительно включающий фиксацию или окрашивание выделенных клеток, которые не проходят через фильтр до стадии (b).
9. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ выделенных клеток, которые не проходят через фильтр, на наличие или отсутствие мутации в K-RAS (гомолог вирусного онкогена саркомы Кирстена у крыс).
10. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ выделенных клеток, которые не проходят через фильтр на наличие мутации киназы анапластической лимфомы.
11. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ выделенных клеток, которые не проходят через фильтр на наличие мутации рецептора эпидермального фактора роста (EGFR).
12. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ выделенных клеток, которые не проходят через фильтр на наличие мутации протоонкогена B-Raf (B-Raf).
13. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ выделенных клеток, которые не проходят через фильтр на наличие мутации рецептора человеческого эпидермального фактора роста HER2 и/или амплификации.
14. Способ по любому из пп. 1-8, в котором стадия (b) включает анализ образца клеток, которые не проходят фильтр для определения статуса эпителиально-мезенхимального перехода клеток; определения наличия у клеток сигнатуры генной экспрессии, ассоциированной с метастатическими или инвазивными клетками; или определения экспрессии клетками детерминант, ассоциированных с метастазированием или инвазией.
15. Способ по любому из пп. 1-8, в котором, если циркулирующие раковые клетки детектированы на стадии (b), дополнительно определяют наличие циркулирующих клеток после лечения, в различные моменты времени в ходе лечения, или в ходе различных схем лечения.
16. Способ по п. 15, в котором определение циркулирующих раковых клеток используют для выбора таргетного лечения и мониторинга ответа пациента на лечение или мониторинга развития устойчивости к лечению конкретным лекарственным средством или агентом.
17. Способ по любому из пп. 1-16, который далее включает диагностирование органа, из которого происходит инвазивный рак.
18. Способ по п. 1 или 2, где раковые клетки представляют собой раковые клетки легких.
| US2009226957 A1, 10.09.2009 | |||
| WO2008008515 A2, 17.01.2008 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ РАКОВЫХ КЛЕТОК В ПЕРИФЕРИЧЕСКОЙ ВЕНОЗНОЙ КРОВИ У БОЛЬНЫХ С ПОДОЗРЕНИЕМ НА ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ | 2009 |
|
RU2425385C1 |
| US2005049793 A1, 03.03.2005 | |||
| ROSENBLATT J.I | |||
| et al., Theoretical Basis for Sampling Statistics Useful for Detecting and Isolating Rare Cells Using Flow Cytometry and Cell Sorting, Cytometry, 1997, 27, pp | |||
| Крутильный аппарат | 1922 |
|
SU233A1 |
| КВАЧЕВА З | |||
| Б | |||
| Разработка оптимальных условий культивирования и дифференцировки стволовых и прогениторных клеток ЦНС человека и животных, Гены и клетки, 2009, 4, стр | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
Авторы
Даты
2018-01-18—Публикация
2013-05-23—Подача