Область техники
Настоящее изобретение относится к неконкурентным в отношении нейрегулина (NRG) аллостерическим антителам против человеческого HER3 и их применениям в диагностических и терапевтических методах.
Предшествующий уровень техники
Семейство рецепторов человеческого эпидермального фактора роста ErbB/HER рецепторных тирозинкиназ (RTK) включает четыре члена: EGFR (ErbB1/HER1), HER2 (c-Neu, HER2), HER3 (HER3) и HER4 (HER4). Рецепторы HER содержат внеклеточный гликозилированный домен, состоящий из четырех структурных доменов, обозначаемых от 1 до 4, после которого следует трансмембранный домен и внутриклеточная С-концевая часть, содержащая киназный домен для взаимодействия с сигнальными путями. За исключением HER3, внутриклеточная область этих рецепторов обладает тирозинкиназной активностью. Сигнализация опосредована лиганд-индуцируемой димеризацией рецептора и последующим фосфорилированием, что приводит к активации цитоплазматических сигнальных путей. HER2 не имеет специфичного лиганда, поскольку в естественном состоянии он находится в «активной» конформации. Другие рецепторы HER существуют в виде неактивных мономеров, причем молекулы свернуты таким образом, чтобы предотвратить димеризацию. Связывание лиганда с доменами 1 и 3 индуцирует основные конформационные изменения, в конечном итоге, открывая димеризационную петлю в домене 2 рецептора. Данное открытие димеризационной петли делает возможным димеризацию рецептора.
Рецептор HER3, который впервые был описан в 1990 году, является единственным членом семейства HER, который не обладает внутренней киназной активностью, и сигнализация по направлению к внутриклеточной мишени достигается посредством гетеродимеризации. Таким образом, рецептор HER3 в виде мономера называют «не своим», и он не может образовывать гомодимеры. Связывание лиганда нейрегулина (NRG) с рецептором HER3 стимулирует гетеродимеризацию HER3 с другими рецепторами семейства HER (предпочтительно HER2). В пределах гетеродимера киназный домен HER3 действует в качестве аллостерического активатора своего партнера семейства HER.
HER3 вовлечен в онкогенез различных раковых заболеваний, включая рак молочной железы и яичника (Lee-Hoeflich ST, Cancer Res. 2008; Mclntyre E, Breast Cancer Res Treat. 2010; Tanner B, J Clin Oncol. 2006). Экспрессия HER3 коррелирует с развитием опухли и сниженной выживаемостью среди пациентов при злокачественной меланоме и метастазах и ассоциирована со снижением уровня выживаемости при раке яичника. Важно, что при раке молочной железы опухоли с низким уровнем экспрессии HER2, которые не поддаются лечению Герцептином, часто «запрограммированы» на сильную экспрессию HER3 (Smith et al. Br. J. Cancer 2004), и опухоли HER2+++, которые становятся устойчивыми к Герцептину после продолжительного лечения, «перепрограммированы» на сильную экспрессию HER3 (Narayan, Cancer Res. 2009). Устойчивость к Цетуксимабу также была ассоциирована со сверхэкспрессией HER3 при раке легкого (Wheeler, Oncogene 2008) и колоректальных карциномах (Lu Cancer Res 2007) наравне с дисрегуляцией интернализации/деградации EGFR. Согласно недавним исследованиям, сверхэкспрессия HER3 была в значительной степени ассоциирована с более низким уровнем выживаемости при колоректальной карциноме без метастазирования (Ho-Pun-Cheung, Int J Cancer 2010). Таким образом, сверхэкспрессия HER3 и компенсаторная сигнализация через активацию PI3K/AKT пути вовлечены в развитие устойчивости к лечению терапиями, нацеленными на HER (антитела и TKI (ингибитор тирозинкиназы)) (Wheeeler 2008, Lu 2007, Narayan, 2009, Sergina, 2007), но также к лечению терапиями, нацеленными на IGFR (рецептор инсулиноподобного фактора роста) (Desbois-Mouthon, Clin Cancer Res 2009), и лечению химиотерапевтическими агентами (Kruser, Exp Cell Res 2010).
Все эти результаты предполагают, что агенты, нацеленные на HER3, и в частности антитела, могут помочь дальнейшему пониманию роли HER3 сигнализации при раковых заболеваниях и в особенности быть использованы в качестве эффективных иммунотерапевтических средств.
В настоящее время, никакое терапевтическое антитело против HER3 не введено в коммерческое обращение, несмотря на то, что в научной литературе сделан сильный акцент на важности нацеливания на HER3 в терапевтической онкологии. В настоящее время Merrimack Pharmaceuticals/Sanofi Aventis разрабатывает два человеческих антитела (антитело ММ-121; РСТ WO 2008/100624) и U3 PharmaAG/Daiichi Sankyo/Amgen (U3-1287 или AMG-888; РСТ WO 2007/077028). Антитело ММ-121 участвует в фазе I клинического испытания при NSCLC (немелкоклеточный рак легкого) и в фазе I/II испытания при ER+ PR+ HER2- раке молочной железы. Антитело U3-1287 находится в фазе I при NSCLC в комбинации с Эрлотинибом. Одно биспецифичное в отношении EGFR/HER3 антитело MEHD7945A (Genentech; РСТ WO2010/108127) все еще находится в научной разработке. Одно биспецифичное в отношении HER2/HER3 антитело ММ-111 (Merrimack Pharmaceuticals; РСТ WO 2005/117973, WO 2006/091209) участвует в фазе I/II клинических испытаний, отдельно или в комбинации с трастузумабом или лапатинибом при раке молочной железы с усилением HER2.
Все упомянутые выше антитела блокируют сайт связывания херегулина рецептора HER3, таким образом, сводя данные терапии антителами к лиганд-зависимым опухолям. Нацеливание антител на HER3, которые не направлены на сайт связывания херегулина HER3, должно позволить обойти устойчивость к таргетным терапиям или химиотерапии при устойчивом раке молочной железы с усилением HER2, расширить область применения таргетных терапий до рака молочной железы с низким уровнем экспрессии HER2 (HER2low), который в настоящее время не поддается такому лечению, или лечить трижды негативные раковые заболевания молочной железы, при которых экспрессируется HER3 и для которых еще не доступна таргетная терапия.
Краткое описание изобретения
Настоящее изобретение относится к неконкурентным в отношении нейрегулина (NRG) аллостерическим антителам против человеческого HER3 и их применениям в диагностических и терапевтических методах.
Подробное описание изобретения
Авторы изобретения охарактеризовали мышиное антитело против человеческого HER3, называемое 9F7-F11, как имеющее уникальную специфичность в отношении HERS-положительных клеток в присутствии лиганда нейрегулина. Авторы изобретения, в частности, показали, что 9F7-F11/HER3 аффинность не ингибируется в присутствии нейрегулина (антитело 9F7-F11 является неконкурентным в отношении нейрегулина), и, кроме того, 9F7-F11/HER3 аффинность аллостерически возрастает в присутствии нейрегулина в среде HERS-положительных клеток (9F7-F11 представляет собой аллостерическое антитело против HER3). Неконкурентное в отношении NRG аллостерическое антитело 9F7-F11 ингибирует МАРК, АКТ и р53 пути, блокирует клеточный цикл в фазе G1, ингибирует пролиферацию клеток и восстанавливает апоптоз опухолевых клеток. Данное уникальное антитело 9F7-F11 уменьшает рост опухоли NRG-зависимых раковых заболеваний поджелудочной железы и раковых заболеваний молочной железы с усилением HER2 или трижды негативных раковых заболеваний молочной железы, и является более эффективным в комбинации с НЕР2-специфичным антителом пертузумабом, чем в комбинации с антителами специфичными в отношении HER2 трастузумабом/пертузумабом или чем отдельно используемые HER2 антитела.
Терапевтическое антитело 9F7-F11 клинически будет применимо к широкому спектру опухолей, по сравнению с конкурентным в отношении лиганда антителом или антителом, неконкурентным в отношении лиганда, лишенным аллостерического эффекта, которые были нацелены на более ограниченные механизмы активации HER3. Вследствие своего аллостерического эффекта неконкурентное в отношении NRG антитело 9F7-F11 будет более эффективно в лиганд-зависимых опухолях, чем другие антитела, при выделении нейрегулина опухолями (аутокринное выделение) или микроокружением (паракринное выделение). Благодаря своему аллостерическому эффекту, антитело 9F7-F11 будет более эффективно при возникновении устойчивости, опосредованной повышенной регуляцией нейрегулина (то есть устойчивость к цетуксимабу при колоректальной карциноме). Благодаря своему аллостерическому эффекту, связывание 9F7-F11 может быть улучшено при гетеродимеризации рецепторов после активации лигандами. В целом, неконкурентное в отношении NRG аллостерическое антитело против человеческого HER3 9F7-F11 можно использовать для лечения состояний, при которых существующие терапевтические антитела клинически неэффективны.
В заключение, антитела по изобретению обладают следующими преимуществами по сравнению с антителами против HER3, описанными в предшествующем уровне техники:
- они представляют собой аллостерические антитела,
- они являются неконкурентными в отношении нейрегулина,
- они обеспечивают более широкий спектр действия (как на лиганд-независимые, так и лиганд-зависимые раковые заболевания),
- они являются более эффективными в аутокринных и паракринных лиганд-зависимых опухолях (благодаря своему аллостерическому эффекту),
- они являются более эффективными при возникновении устойчивости, опосредованной повышенной регуляцией лигандов HER3 (например: устойчивость к антителам или TKI, к химиотерапии, к антигормону),
- они могут быть использованы для лечения состояний, при которых существующие терапевтические антитела клинически неэффективны, например, в случае трижды негативного рака молочной железы, рака поджелудочной железы, других ниш (почечно-клеточная карцинома).
Определения
Термин «нейрегулин» имеет общее значение в данной области и часто взаимозаменяем с термином «херегулин». Семейство херегулинов включает альфа, бета и гамма херегулины (Holmes et al., Science, 256: 1205-1210 (1992); Патент США 5641869; и Schaefer et al Oncogene 15: 1385-1394 (1997)); нейронные факторы дифференциации (NDF), глиальные факторы роста (GGF); фактор индукции синтеза ацетилхолинового рецептора (ARIA); и фактор, образуемый из сенсорных и двигательных нейронов (SMDF). Для обзора см. Groenen et al. Growth Factors 11:235-257 (1994); Lemke, G. Molec. & Cell. Neurosci. 7:247-262 (1996) и Lee et al. Pharm. Rev. 47:51-85 (1995); Falls and D. (2003). "Neuregulins: functions, forms, and signaling strategies." Experimental Cell Research 284(1): 14-30.
Термин «HER3» относится к человеческому рецептору HER3, как описано в Plowman et al., Proc. Natl. Acad. Sci. USA, 87:4905-4909 (1990); также см. Kani et al., Biochemistry 44: 15842-857 (2005), Cho and Leahy, Science 297: 1330- 1333 (2002)). HER3 также известен, как «HER3».
Термин «антитело против человеческого HER3» относится к антителу, направленному против человеческого HER3.
Согласно настоящему изобретению «антитело» или «иммуноглобулин» имеют одно и то же значение, и используются в настоящем изобретении наравне. Термин «антитело», используемый в данном документе, относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина, то есть молекулам, которые содержат антигенсвязывающий сайт, который иммуноспецифично связывается с антигеном. По существу, термин «антитело» охватывает не только молекулы полноразмерных антител, но также фрагменты антител, а также варианты (включая производные) антител и фрагментов антител. В природных антителах две тяжелые цепи связаны друг с другом посредством дисульфидных связей, и каждая тяжелая цепь связана с легкой цепью посредством дисульфидной связи. Существует два типа легкой цепи: лямбда (l) и каппа (k). Существует пять главных классов тяжелых цепей (или изотипов), которые определяют функциональную активность молекулы антитела: lgM, lgD, lgG, lgA и lgE. Каждая цепь содержит домены разных последовательностей. Легкая цепь включает два домена, вариабельный домен (VL) и константный домен (CL). Тяжелая цепь включает четыре домена, вариабельный домен (VH) и три константных домена (СН1, СН2 и СН3, в совокупности называемых СН). Вариабельные области как легких цепей (VL), так и тяжелых цепей (VH), определяют распознавание связывания и специфичность в отношении антигена. Домены константной области легких (CL) и тяжелых (СН) цепей придают важные биологические свойства, такие как ассоциация цепей антитела, секреция, трансплацентарная подвижность, связывание комплемента и связывание с рецепторами Fc (FcR). Фрагмент Fv представляет собой N-концевую часть Fab фрагмента иммуноглобулина и состоит из вариабельных областей одной легкой цепи и одной тяжелой цепи. Специфичность антитела заключается в структурной комплементарности между антигенсвязывающим центром антитела и антигенной детерминантой. Антигенсвязывающие центры антитела образованы остатками, которые по существу происходят из гипервариабельных областей или областей, определяющих комплементарность (CDR). Иногда, остатки из негипервариабельных или каркасных областей (FR) влияют на общую доменную структуру и, следовательно, антигенсвязывающий центр. Области, определяющие комплементарность, или CDR, относятся к аминокислотным последовательностям, которые вместе определяют аффинность связывания и специфичность природной области Fv сайта связывания нативного иммуноглобулина. Каждая из легких и тяжелых цепей иммуноглобулина имеет три CDR, обозначаемые L-CDR1, L-CDR2, L-CDR3 и H-CDR1, H-CDR2, H-CDR3, соответственно. Антигенсвязывающий сайт, таким образом, включает шесть CDR, включая набор CDR из каждой V области тяжелой и легкой цепи. Каркасные области (FR) относятся к аминокислотным последовательностям, расположенным между CDR.
Термин «химерное антитело» относится к антителу, которое содержит домен VH и домен VL антитела, происходящего от антитела 9F7-F11, и домен СН и домен CL человеческого антитела.
Согласно изобретению термин «гуманизированное антитело» относится к антителу, имеющему каркас вариабельных областей и константные области от человеческого антитела, но которое сохраняет CDR антитела 9F7-F11.
Термин «Fab» обозначает фрагмент антитела, имеющий молекулярную массу примерно 50000 и антигенсвязывающую активность, в котором примерно половина N-концевого сайта Н цепи и вся L цепь, среди фрагментов, полученных посредством обработки lgG протеазой папаином, связаны вместе дисульфидной связью.
Термин «F(ab')2» относится к фрагменту антитела, имеющему молекулярную массу примерно 100000 и обладающему антигенсвязывающей активностью, который немного больше, чем Fab, связанному дисульфидной связью шарнирной области, среди фрагментов, полученных посредством обработки lgG протеазой пепсином.
Термин «Fab'» относится к фрагменту антитела, имеющему молекулярную массу примерно 50000 и обладающему антигенсвязывающей активностью, который получают посредством разрывания дисульфидной связи шарнирной области F(ab')2.
Одноцепочечный Fv («scFv») полипептид представляет собой ковалентно связанный VH::VL гетеродимер, который обычно экспрессируется в результате слияния генов, включая VH и VL кодирующие гены, связанные посредством пептид-кодирующего линкера. «dsFv» представляет собой VH::VL гетеродимер, стабилизированный дисульфидной связью. Дивалентные и мультивалентные фрагменты антител могут образовываться либо самопроизвольно в результате ассоциации моновалентных scFv, либо могут быть созданы в результате связывания моновалентных scFv пептидным линкером, например, дивалентный sc(Fv)2.
Термин «диатела» относится к небольшим фрагментам антител с двумя антигенсвязывающими сайтами, фрагменты которых содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Посредством использования линкера, который является слишком коротким, чтобы допустить спаривание двух данных доменов на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта.
Под термином «очищенный» или «выделенный» подразумевают, что, при упоминании антитела по изобретению или нуклеотидной последовательности, указанная молекула представлена по существу в отсутствии других биологических макромолекул такого же типа. Термин «очищенный», используемый в данном документе, предпочтительно означает, что присутствует по меньшей мере 75 масс. %, более предпочтительно по меньшей мере 85 масс. %, еще более предпочтительно по меньшей мере 95 масс. % и наиболее предпочтительно по меньшей мере 98 масс. % биологических макромолекул одного и того же типа. «Выделенная» молекула нуклеиновой кислоты, которая кодирует определенный полипептид, относится к молекуле нуклеиновой кислоты, которая по существу не содержит других молекул нуклеиновых кислот, которые не кодируют данный полипептид; однако молекула может включать некоторые дополнительные основания или группировки, которые не оказывают негативного воздействия на основные характеристики композиции.
Антитела по изобретению
Согласно настоящему изобретению предложены выделенные неконкурентные в отношении нейрегулина (NRG) аллостерические антитела против HER3 или их фрагменты. В частности, авторы изобретения получили гибридому, продуцирующую мышиные антитела против HER3 (9F7-F11). Авторы изобретения клонировали и охарактеризовали вариабельный домен легких и тяжелых цепей указанного mAb (моноклональное антитело) 9F7-F11 и таким образом определили гипервариабельные области (CDR) домена указанного антитела, как описано в Таблице 1:

Вследствие этого, изобретение относится к моноклональному антителу, обладающему специфичностью по отношению к HER3, содержащему тяжелую цепь, где вариабельный домен содержит по меньшей мере одну CDR, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 2 для H-CDR1, SEQ ID NO: 3 для H-CDR2 и SEQ ID NO: 4 для H-CDR3.
Изобретение также относится к моноклональному антителу, обладающему специфичностью по отношению к HER3, содержащему легкую цепь, где вариабельный домен содержит по меньшей мере одну CDR, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 6 для L-CDR1, SEQ ID NO: 7 для L-CDR2 и SEQ ID NO: 8 для L-CDR3.
Моноклональное антитело по изобретению может содержать тяжелую цепь, где вариабельный домен содержит по меньшей мере одну CDR, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 2 для H-CDR1, SEQ ID NO: 3 для H-CDR2 и SEQ ID NO: 4 для H-CDR3, и легкую цепь, где вариабельный домен содержит по меньшей мере одну CDR, имеющую последовательность, выбранную из группы, состоящей из SEQ ID NO: 6 для L-CDR1, SEQ ID NO: 7 для L-CDR2 и SEQ ID NO: 8 для L-CDR3.
В частности, согласно изобретению предложено моноклональное антитело против HER3, содержащее вариабельную область тяжелой цепи, содержащую SEQ ID NO: 2 в области H-CDR1, SEQ ID NO: 3 в области H-CDR2 и SEQ ID NO: 4 в области H-CDR3; и вариабельную область легкой цепи, содержащую SEQ ID NO: 6 в области L-CDR1, SEQ ID NO: 7 в области L-CDR2 и SEQ ID NO: 8 в области L-CDR3.
В одном конкретном воплощении вариабельная область тяжелой цепи указанного антитела имеет аминокислотную последовательность, представленную как SEQ ID NO: 1, и/или вариабельная область легкой цепи имеет аминокислотную последовательность, представленную как SEQ ID NO: 5.
В другом воплощении моноклональное антитело по изобретению представляет собой химерное антитело, предпочтительно химерное мышиное/человеческое антитело. В частности, указанное химерное мышиное/человеческое антитело может содержать вариабельные домены антитела 9F7-F11, как определено выше.
В другом воплощении моноклональное антитело по изобретению представляет собой гуманизированное антитело. В частности, в указанном гуманизированном антителе вариабельный домен содержит человеческие акцепторные каркасные области и необязательно, при наличии, человеческий константный домен, и нечеловеческие донорные CDR, такие как мышиные CDR, как определено выше.
Согласно изобретению дополнительно предложены фрагменты против HER3, направленные против HER3, указанных антител, которые включают Fv, Fab, F(ab')2, Fab', dsFv, scFv, sc(Fv)2 и диатела, но не ограничиваются ими.
В другом аспекте изобретение относится к полипептиду, имеющему последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7 и SEQ ID NO: 8.
Способы получения антител по изобретению:
Антитела против человеческого HER3 по изобретению можно получить посредством любой методики, известной в данной области, такой как любая химическая, биологическая, генетическая или ферментативная методика, либо по отдельности, либо в их сочетании, но не ограничиваясь ими.
Зная аминокислотную последовательность желаемой последовательностью, специалист в данной области может легко получать указанные антитела с помощью стандартных методик получения полипептидов. Например, их можно синтезировать, используя хорошо известный твердофазный метод, предпочтительно с использованием коммерчески доступного оборудования для синтеза пептидов (такого как прибор, изготовленный Applied Biosystems, Foster City, California) и следуя инструкциям производителя. В качестве альтернативы, антитела по изобретению можно синтезировать посредством методов рекомбинантных ДНК, хорошо известных в данной области. Например, антитела можно получать в виде продуктов экспрессии ДНК после включения последовательностей ДНК, кодирующих антитела, в экспрессионные векторы и введения таких векторов подходящим эукариотическим или прокариотическим хозяевам, которые будут экспрессировать желаемые антитела, из которых они могут быть впоследствии выделены с использованием хорошо известных методик.
Соответственно, еще одна цель изобретения относится к нуклеотидной последовательности, кодирующей антитело согласно изобретению.
В одном конкретном воплощении изобретение относится к нуклеотидной последовательности, кодирующей домен VH антитела, получаемого из гибридомы 9F7-F11, или домен VL антитела, получаемого из гибридомы 9F7-F11.
В одном конкретном воплощении изобретение относится к нуклеотидной последовательности, содержащей последовательность SEQ ID NO: 9.
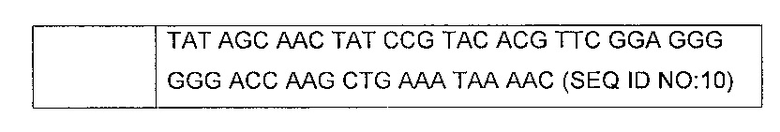
В одном конкретном воплощении изобретение относится к нуклеотидной последовательности, содержащей последовательность SEQ ID NO: 10.

Обычно указанная нуклеиновая кислота представляет собой молекулу ДНК или РНК, которая может быть включена в любой подходящий вектор, такой как плазмида, космида, эписома, искусственная хромосома, фаг или вирусный вектор.
Термины «вектор», «клонирующий вектор» и «экспрессионный вектор» означают носитель, посредством которого последовательность ДНК или РНК (например, чужеродный ген) можно вводить в клетку-хозяина, для того чтобы трансформировать хозяина и стимулировать экспрессию (например, транскрипцию и трансляцию) вводимой последовательности.
Так, дополнительная цель изобретения относится к вектору, содержащему нуклеиновую кислоту по изобретению.
Такие векторы могут содержать регуляторные элементы, такие как промотор, энхансер, терминатор и тому подобное, для того, чтобы вызывать или направлять экспрессию указанного антитела при введении субъекту. Примеры промоторов и энхансеров, используемых в экспрессионном векторе для животной клетки, включают ранний промотор и энхансер SV40 (Mizukami Т. et al. 1987), промотор длинного концевого повтора (LTE) и энхансер вируса лейкоза мышей Молони (Kuwana Y et al. 1987), промотор (Mason JO et al. 1985), и энхансер (Gillies SD et al. 1983) H цепи иммуноглобулина и тому подобное.
Экспрессионный вектор для животной клетки можно использовать, при условии, что ген, кодирующий С область человеческого антитела, может быть встроен и экспрессирован. Примеры подходящих векторов включают pAGE107 (Miyaji Н et al. 1990), pAGE103 (Mizukami T et al. 1987), pHSG274 (Brady G et al. 1984), pKCR (O'Hare К et al. 1981), pSG1 beta d2-4-(Miyaji H et al. 1990) и тому подобное. Другие примеры плазмид включают реплицирующиеся плазмиды, содержащие точку начала репликации, или интегративные плазмиды, такие как, например, pUC, pcDNA, pBR и тому подобное. Другие примеры вирусных векторов включают аденовирусные, ретровирусные векторы, векторы вируса герпеса и векторы аденоассоциированного вируса (AVV). Такие рекомбинантные векторы можно получать с помощью методик, известных в данной области, например, посредством трансфицирования упаковывающих клеток или посредством временной трансфекции хелперными плазмидами или векторами. Типичные примеры упаковывающих вирус клеток включают клетки РА317, клетки PsiCRIP, клетки GPenv+, клетки 293 и т.д. Подробные протоколы для получения таких рекомбинантных вирусов с дефектной репликацией можно найти, например, в WO 95/14785, WO 96/22378, US 5882877, US 6013516, US 4861719, US 5278056 и WO 94/19478.
Дополнительная цель настоящего изобретения относится к клетке-хозяину, которую трансфицировали, инфицировали или трансформировали нуклеиновой кислотой и/или вектором по изобретению.
Термин «трансформация» означает введение «чужеродного» (то есть внешнего или внеклеточного) гена, последовательности ДНК или РНК в клетку-хозяина, так чтобы клетка-хозяин экспрессировала введенный ген или последовательность с образованием желаемого вещества, обычно белка или фермента, кодируемого введенным геном или последовательностью. Клетку-хозяина, которая получает и экспрессирует введенную ДНК или РНК, «трансформировали».
Нуклеиновые кислоты по изобретению можно использовать для получения антитела по изобретению в подходящей экспрессионной системе. Под термином «экспрессионная система» подразумевается клетка-хозяин и совместимый вектор в подходящих условиях, например, для экспрессии белка, кодируемого чужеродной ДНК, которую несет вектор, и которую вводят в клетку-хозяина.
Обычные экспрессионные системы включают клетки-хозяева Е. coli и плазмидные векторы, клетки-хозяева насекомых и бакуловирусные векторы, и клетки-хозяева и векторы млекопитающих. Другие примеры клеток-хозяев включают прокариотические клетки (такие как бактерии) и эукариотические клетки (такие как дрожжевые клетки, клетки млекопитающих, клетки насекомых, растительные клетки и т.д.), но не ограничиваются ими. Конкретные примеры включают E.coli, дрожжи Kluyveromyces или Saccharomyces, линии клеток млекопитающих (например, клетки Vero, клетки СНО, клетки 3Т3, клетки COS и т.д.), а также первичные или стабильные культуры клеток млекопитающих (например, полученные из лимфобластов, фибробластов, эмбриональных клеток, эпителиальных клеток, нервных клеток, адипоцитов и т.д.). Примеры также включают мышиную клетку SP2/0-Ag14 (АТСС CRL1581), мышиную клетку P3X63-Ag8.653 (АТСС CRL1580), клетку СНО, в которой ген дигидрофолатредуктазы (далее «ген DHFR») является дефектным (Urlaub G et al; 1980), клетку крысы YB2/3HL.P2.G11.16Ag.20 (АТСС CRL1662, далее «клетка YB2/0») и тому подобное.
Настоящее изобретение также относится к способу получения рекомбинантной клетки-хозяина, экспрессирующей антитело по изобретению, причем указанный способ включает следующие стадии: (i) введение in vitro или ex vitro рекомбинантной нуклеиновой кислоты или вектора, как описано выше, в компетентную клетку-хозяина, (ii) культивирование полученной in vitro или ex vitro рекомбинантной клетки-хозяина и (iii) необязательный отбор клеток, которые экспрессируют и/или секретируют указанное антитело. Такие рекомбинантные клетки-хозяева можно использовать для получения антител по изобретению.
В другом конкретном воплощении способ включает следующие стадии:
(i) культивирование гибридомы 9F7-F11 в условиях, пригодных для экспрессию антитела 16D3-C1; и
(ii) выделение экспрессированного антитела.
Антитела по изобретению соответствующим образом отделяют от культуральной среды посредством общепринятых способов очистки иммуноглобулинов, таких как, например, белок А - Сефароза, хроматография на гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография.
В одном конкретном воплощении человеческое химерное антитело по настоящему изобретению можно получать посредством получения нуклеотидных последовательностей, кодирующих домены VL и VH, как описано ранее, конструирования вектора, экспрессирующего человеческое химерное антитело посредством их вставки в экспрессионный вектор для животной клетки, имеющий гены, кодирующие СН и CL человеческого антитела, и экспрессии кодирующей последовательности посредством включения экспрессионного вектора в клетку животного.
В качестве домена СН человеческого химерного антитела может служить любая область, которая принадлежит к человеческому иммуноглобулину, области класса lgG являются подходящими, и также можно использовать любую из подклассов, принадлежащих к классу lgG, таких как lgG1, lgG2, lgG3 и lgG4. Также, в качестве CL человеческого химерного антитела может служить любая область, которая принадлежит к lg, и можно использовать области класса каппа или лямбда.
Способы получения химерных антител включают традиционные методы рекомбинантных ДНК, и методы генной трансфекции хорошо известны в данной области (См. Morrison SL. et al. (1984) и патентные документы US 5202238; и US 5204244).
Гуманизированное антитело по настоящему изобретению можно получить посредством получения нуклеотидных последовательностей, кодирующих домены CDR, как описано ранее, конструирования вектора, экспрессирующего гуманизированное антитело, посредством их вставки в экспрессионный вектор для клетки животного, имеющий гены, кодирующие (i) константную область тяжелой цепи, идентичную константной области тяжелой цепи человеческого антитела, и (ii) константную область легкой цепи, идентичную константной области легкой цепи человеческого антитела, и экспрессии данных генов посредством введения экспрессионного вектора в клетку животного.
Вектор, экспрессирующий гуманизированные антитела, может относиться либо к типу, в котором ген, кодирующий тяжелую цепь антитела, и ген, кодирующий легкую цепь антитела, существуют на отдельных векторах, или к типу, в котором оба гена существуют на одном и том же векторе (тандемный тип). В отношении простоты конструкции вектора, экспрессирующего гуманизированные антитела, простоты введения в клетки животного и равновесия между уровнями экспрессии Н и L цепей антитела в клетках животного, вектор тандемного типа, экспрессирующий гуманизированные антитела, является предпочтительным (Shitara К et al. 1994). Примеры вектора тандемного типа, экспрессирующего гуманизированные антитела, включают pKANTEX93 (WO 97/10354), рЕЕ18 и тому подобное.
Способы получения гуманизированных антител на основе традиционных методик рекомбинантных ДНК и генной трансфекции хорошо известны в данной области (см., например, Riechmann L. et al. 1988; Neuberger MS. et al. 1985). Антитела могут быть гуманизированы множеством методик, известных в данной области, включая, например, CDR-прививку (ЕР 239,400; РСТ публикация WO 91/09967; Пат. США 5225539; 5530101; и 5585089), венирование или изменение поверхности (ЕР 592106; ЕР 519596; Padlan ЕА (1991); Studnicka GM et al. (1994); Roguska MA. et al. (1994)), и перетасовку цепей (Пат. США 5565332). Также известна общая технология рекомбинантных ДНК для получения таких антител (см. Европейскую патентную заявку ЕР 125023 и Международную патентную заявку WO 96/02576).
Fab по настоящему изобретению можно получить посредством обработки антитела, которое специфично взаимодействует с человеческим HER3, протеазой папаином. Кроме того, Fab можно получить путем вставки ДНК, кодирующей Fab антитела, в вектор для прокариотической экспрессионной системы или для эукариотической экспрессионной системы, и введения вектора в клетку прокариота или эукариота (в зависимости от обстоятельств) для экспрессии Fab.
F(ab')2 по настоящему изобретению можно получить посредством обработки антитела, которое специфично взаимодействует с человеческим HER3, протеазой пепсином. Кроме того, F(ab')2 можно получить посредством связывания Fab', описанного ниже, посредством тиоэфирной связи или дисульфидной связи.
Fab' по настоящему изобретению можно получить посредством обработки F(ab')2, который специфично взаимодействует с человеческим HER3, восстанавливающим агентом дитиотреитолом. Также Fab' можно получить посредством вставки ДНК, кодирующей Fab' фрагмент антитела, в экспрессионный вектор для прокариота или экспрессионный вектор для эукариота и введения вектора в клетку прокариота или эукариота (в зависимости от обстоятельств) для осуществления его экспрессии.
scFv по настоящему изобретению можно получить посредством получения кДНК, кодирующей домены VH и VL, как описано ранее, конструирования ДНК, кодирующей scFv, вставки ДНК в экспрессионный вектор для прокариот или экспрессионный вектор для эукариот и затем введения экспрессионного вектора в клетку прокариота или эукариота (в зависимости от обстоятельств) для экспрессии scFv. Для создания гуманизированного фрагмента scFv можно использовать хорошо известную методику, называемую CDR-прививкой, которая включает выбор гипервариабельных областей (CDR) из донорного фрагмента scFv и их встраивание в каркас человеческого фрагмента scFv известной трехмерной структуры (см., например, WO 98/45322; WO 87/02671; US 5859205; US 5585089; US 4816567; ЕР 0173494).
Рассмотрена(ы) модификация(и) аминокислотной последовательности антител, описанных в данном документе. Например, улучшение аффинности связывания и/или других биологических свойств антитела может быть желательным. Известно, что когда гуманизированное антитело получают просто посредством прививки только CDR в VH и VL антитела, полученного от животного, не являющегося человеком, в FR VH и VL человеческого антитела, антигенсвязывающая активность снижается, по сравнению с антигенсвязывающей активностью исходного антитела, полученного от животного, не являющегося человеком. Считается, что несколько аминокислотных остатков VH и VL нечеловеческого антитела, не только в CDR, но также в FR, непосредственно или косвенно ассоциированы с антигенсвязывающей активностью. Следовательно, замена данных аминокислотных остатков разными аминокислотными остатками, происходящими из FR VH и VL человеческого антитела снизит связывающую активность. Для решения данной проблемы в человеческих антителах, привитых CDR, должны быть сделаны попытки идентифицировать среди аминокислотных последовательностей FR VH и VL человеческих антител аминокислотный остаток, который непосредственно ассоциирован со связыванием с антителом или который взаимодействует с аминокислотным остатком CDR, или который поддерживает трехмерную структуру антитела и который непосредственно ассоциирован со связыванием с антигеном. Сниженная антигенсвязывающая активность может быть повышена в результате замены идентифицированных аминокислот аминокислотными остатками исходного антитела, полученного от животного, не являющегося человеком.
Структура антител по настоящему изобретению и кодирующие их последовательности ДНК могут быть модифицированы и изменены, и при этом функциональная молекула, которая кодирует антитело с желаемыми характеристиками, будет все еще получена.
При внесении изменений в аминокислотные последовательности можно учитывать индекс гидропатичности аминокислот. Важность индекса гидропатичности аминокислот в придании интерактивной биологической функции на белке, как правило, понятна в данной области. Считается, что относительный характер гидропатичности аминокислоты вносит вклад во вторичную структуру полученного в результате белка, которая, в свою очередь, определяет взаимодействие белка с другими молекулами, например, ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и тому подобное. Каждой аминокислоте приписан индекс гидропатичности на основе их гидрофобности и характеристик заряда, данные индексы представляют собой следующие: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серии (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9); и аргинин (-4,5).
Дополнительная цель настоящего изобретения также охватывает консервативные по функции варианты антител по настоящему изобретению.
«Консервативные по функции варианты» представляют собой варианты, в которых данный аминокислотный остаток в белке или ферменте был изменен без изменения общей структуры и функции полипептида, включая замену аминокислоты на имеющую похожие свойства (такие как, например, полярность, потенциал водородной связи, кислотные, основные, гидрофобные, ароматические свойства и тому подобное), но, не ограничиваясь ими. Аминокислоты, отличные от консервативных аминокислот, могут различаться в белке так, что процент сходства белковых или аминокислотных последовательностей у любых двух белков похожей функции может варьировать и может составлять, например, от 70% до 99%, как определено методом выравнивания, например, с помощью Cluster Method, где сходство основано на алгоритме MEGALIGN. «Консервативный по функции вариант» также включает полипептид, который обладает по меньшей мере 60% аминокислотной идентичностью, определенных с помощью алгоритмов BLAST или FASTA, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 85%, еще предпочтительно по меньшей мере 90% и даже более предпочтительно по меньшей мере 95%, и который имеет такие же или по существу похожие свойства или функции, как и нативный или родительский белок, с которым его сравнивают.
Две аминокислотные последовательности являются «по существу гомологичными» или «по существу аналогичными», когда больше чем 80%, предпочтительно больше чем 85%, предпочтительно больше чем 90% аминокислот являются идентичными или больше чем примерно 90%, предпочтительно больше чем 95%, являются аналогичными (функционально идентичными) по всей длине более короткой последовательности. Предпочтительно, аналогичные или гомологичные последовательности идентифицируют посредством выравнивания с использованием, например, программного обеспечения GCG (Genetics Computer Group, Руководство по работе с программой для пакета GCG, Версия 7, Мэдисон, Висконсин) или любого алгоритма сравнения последовательностей, такого как BLAST, FASTA и т.д.
Например, определенные аминокислоты можно замещать другими аминокислотами в белковой структуре без ощутимой потери активности. Так как способность взаимодействовать и природа белка определяют биологическую функциональную активность белка, определенные аминокислотные замены могут быть сделаны в последовательности белка и, безусловно, в его ДНК-кодирующей последовательности, с получением, при этом, белка с аналогичными свойствами. Таким образом, считается, что в последовательности антител по изобретению или соответствующие последовательности ДНК, которые кодируют указанные антитела, могут быть внесены разные изменения без ощутимой потери их биологической активности.
В данной области известно, что определенные аминокислоты могут быть замещены другими аминокислотами, имеющими аналогичный индекс или показатель гидропатичности, и, при этом, все еще способных к образованию белка с аналогичной биологической активностью, то есть биологический функционально эквивалентный белок все еще может быть получен.
Как указано выше, аминокислотные замены обычно, вследствие этого, основаны на относительном сходстве заместителей боковых цепей аминокислот, например, их гидрофобности, гидрофильности, заряда, размера и тому подобное. Типичные замены, при которых учитываются различные упомянутые выше характеристики, хорошо известны специалистам в данной области, и они включают: аргинин и лизин, глутамат и аспартат; серии и треонин; глутамин и аспарагин; и валин, лейцин и изолейцин.
Соответственно, согласно изобретению также предложено антитело, содержащее тяжелую цепь, где вариабельный домен содержит:
- H-CDR1, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 2,
- H-CDR2, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 3,
- H-CDR3, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 4,
- L-CDR1, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 6,
- L-CDR2, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 7,
- L-CDR3, обладающую по меньшей мере 90% или 95% идентичностью с последовательностью, представленной как SEQ ID NO: 8, и
которое специфично связывается с HER3, обладающим, по существу, такой же аффинностью, как и антитело, содержащее тяжелую цепь, где вариабельный домен содержит SEQ ID NO: 2 для H-CDR1, SEQ ID NO: 3 для H-CDR2 и SEQ ID NO: 4 для H-CDR3, и легкую цепь, где вариабельный домен содержит SEQ ID NO: 6 для L-CDR1, SEQ ID NO: 7 для L-CDR2 и SEQ ID NO: 8 для L-CDR3, и более предпочтительно обладающим, по существу, такой же аффинностью, как и мышиное антитело против HER3 9F7-F11.
Указанные антитела можно анализировать в отношении специфичного связывания любым способом, известным в данной области. Для эпитоп-специфической сортировки можно использовать много разных форматов анализа конкурентного связывания. Иммунологические анализы, которые можно использовать, включают системы конкурентного анализа с использованием методик, таких как вестерн-блоттинг, радиоиммунологические анализы, ELISA (твердофазный иммуноферментный анализ), иммунологические «сэндвич»-анализы, иммунопреципитационные анализы, преципитационные анализы, гельдиффузные преципитационные анализы, иммунорадиометрические анализы, флуоресцентные иммунологические анализы, иммунологические анализы на основе белка А и анализы на основе фиксации комплемента, но не ограничиваются указанными. Такие анализы являются стандартными и хорошо известны в данной области (см., например, Ausubel et al., eds, 1994 Current Protocols in Molecular Biology, Vol. 1, John Wiley & sons, Inc., New York). Например, BIACORE® (GE Healthcare, Piscaataway, NJ) представляет собой один из множества форматов анализа на основе поверхностного плазмонного резонанса, которые стандартно используются для панелей эпитоп-специфичной сортировки моноклональных антител. Кроме того, можно проводить стандартные эпитоп-перекрестные конкурентные анализы, например, анализы, описанные в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane, 1988.
Сконструированные антитела по изобретению включают антитела с модифицированными остатками каркасной области в пределах VH и/или VL, например, для улучшения свойств антитела. Обычно такие модификации каркасной области осуществляют для снижения иммуногенности антитела. Например, один подход заключается в «обратной мутации» одного или более чем одного остатка каркасной области до соответствующей зародышевой последовательности. Более конкретно, антитело, которое подвергалось соматической мутации, может содержать остатки каркасной области, которые отличаются от зародышевой последовательности, от которой происходит антитело. Такие остатки могут быть идентифицированы посредством сравнения последовательностей каркасных областей антитела с зародышевыми последовательностями, от которых происходит антитело. Для возвращения последовательностям каркасной области их зародышевой конфигурации соматические мутации можно подвергать «обратной мутации» до зародышевой последовательности, например, посредством сайт-направленного мутагенеза или ПЦР(полимеразная цепная реакция)-опосредованного мутагенеза. Также подразумевается, что такие «обратно мутировавшие» антитела охвачены данным изобретением. Другой тип модификации каркасной области включает мутации одного или более чем одного остатка в пределах каркасной области или даже в пределах одной или более чем одной CDR области с удалением эпитопов Т-клеток для снижения, таким образом, потенциальной иммуногенности антитела. Данный подход также называют «деиммунизацией», и он более подробно описан в публикации патента США 20030153043 Carr et al.
В качестве дополнения или альтернативы к модификациям в пределах каркасных областей или областей CDR, антитела по изобретению можно конструировать с включением модификаций в пределах Fc области, обычно с изменением одного или более чем одного функционального свойства антитела, такого как время полужизни в сыворотке, фиксация комплемента, связывание с рецептором Fc и/или антигензависимая клеточная цитотоксичность. Кроме того, антитело по изобретению может быть химически модифицировано (например, к антителу может быть присоединен один или более чем один химический фрагмент) или может быть модифицировано с изменением его гликозилирования, что опять же приводит к изменению одного или более чем одного функционального свойства антитела. Каждое из данных воплощений описано ниже более подробно. Нумерация остатков в области Fc соответствует EU-индексу (индекс европейской системы нумерации) по Kabat.
В одном воплощении шарнирную область СН1 модифицируют так, что число остатков цистеина в шарнирной области изменено, например, увеличено или уменьшено. Данный подход дополнительно описан в патенте США 5677425 Bodmer et al. Число остатков цистеина в шарнирной области СН1 изменяют, например, для облегчения объединения легкой и тяжелой цепей или для повышения или снижения стабильности антитела.
В другом воплощении шарнирная область Fc антитела подвергают мутации для уменьшения биологического времени полужизни антитела. Более конкретно, одну или более чем одну мутацию аминокислот вводят в область на границе доменов СН2-СН3 шарнирного фрагмента Fc, так чтобы связывание антитела с белком А стафилококка (SpA) относительно связывания нативного шарнирного домена Fc с SpA ослабилось. Данный подход описан более подробно в патенте США 6165745 Ward et al.
В другом воплощении антитело модифицируют таким образом, чтобы увеличить его биологическое время полужизни. Возможны разные подходы. Например, может быть введена одна или более чем одна из следующих мутаций: T252L, T254S, T256F, как описано в патенте США 6277375 Ward. В качестве альтернативы, для увеличения биологического времени полужизни антитело можно изменять в области СН1 или CL таким образом, чтобы ввести эпитоп связывания рецептора «реутилизации», образованный двумя петлями домена СН2 области Fc IgG, как описано в патенте США 5869046 и 6121022 Presta et al.
В других воплощениях область Fc изменяют путем замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком с изменением эффекторных функций антитела. Например, одну или более чем одну аминокислоту можно заменять на другой аминокислотный остаток, так чтобы антитело обладало измененной аффинностью в отношении эффекторного лиганда, но сохраняло антигенсвязывающую способность родительского антитела. Эффекторный лиганд, к которому изменяют аффинность, может представлять собой, например, рецептор Fc или компонент С1 комплемента. Данный подход более подробно описан в патенте США 5624821 и 5648260, оба принадлежат Winter et al.
В другом воплощении одну или более чем одну аминокислоту, выбранную из аминокислотных остатков, можно заменить другим аминокислотным остатком, так чтобы получить антитело с измененным связыванием C1q и/или сниженной комплемент-зависимой цитотоксичностью или не обладающее комплемент-зависимой цитотоксичностью (CDC). Данный подход более подробно описан в патенте США 6194551 Idusogie et al.
В другом воплощении один или более чем один аминокислотный остаток изменяют для изменения, таким образом, способности антитела фиксировать комплемент. Данный подход дополнительно описан в публикации РСТ WO 94/29351 Bodmer et al.
В еще одном воплощении область Fc модифицируют для повышения способности антитела опосредовать антителозависимую клеточную цитотоксичность (ADCC) и/или для повышения аффинности антитела в отношении рецептора Fc путем модификации одной или более чем одной аминокислоты. Данный подход дополнительно описан в публикации РСТ WO 00/42072 Presta. Кроме того, были картированы сайты связывания на человеческом IgGI для FcγRI, FcγRII, FcγRIII и FcRn и описаны варианты с улучшенным связыванием (см. Shields, R.L. et al., 2001 J. Biol. Chen. 276:6591-6604, WO 2010106180).
В еще одном воплощении модифицируют гликозилирование антитела. Например, можно получать агликозилированное антитело (то есть антитело без гликозилирования).
Гликозилирование можно изменять, например, для повышения аффинности антитела в отношении антигена. Такие углеводные модификации можно осуществлять, например, путем изменения одного или более чем одного сайта гликозилирования в пределах последовательности антитела. Например, можно осуществлять одну или более чем одну замену аминокислот, которая приводит к устранению одного или более чем одного сайта гликозилирования в каркасной области вариабельной области с устранением, таким образом, гликозилирования в том сайте. Такое агликозилирование может повышать аффинность антитела в отношении антигена. Такой подход описан более подробно в патенте США 5714350 и 6350861 Со et al.
В качестве дополнения или альтернативы, можно получать антитело, которое имеет измененный тип гликозилирования, например, гипофукозилированное или нефукозилированное антитело, имеющее уменьшенное количество фукозильных остатков или не имеющее фукозильных остатков, или антитело, имеющее увеличенное количество структур GlcNAc в точке ветвления. Было показано, что такие измененные профили гликозилирования увеличивают способность антител к ADCC. Такие модификации углеводов можно осуществлять, например, посредством экспрессии антитела в клетке-хозяине с измененным механизмом гликозилирования. Клетки с измененным механизмом гликозилирования были описаны в данной области и могут быть использованы в качестве клеток-хозяев для экспрессии в них рекомбинантных антител по изобретению с получением, таким образом, антитела с измененным гликозилированием. Например, в ЕР 1176195 Hang et al. описана линия клеток с геном FUT8 с нарушенной функцией, который кодирует фукозилтрансферазу, так что антитела, экспрессирующиеся в такой линии клеток, демонстрируют гипофукозилирование или лишены фукозильных остатков. Вследствие этого, в одном воплощении посредством рекомбинантной экспрессии в линии клеток можно получать антитела по изобретению, которые демонстрируют гипофукозилирование или лишены профиля фукозилирования, например, линия клеток млекопитающих с недостаточной экспрессией гена FUT8, кодирующего фукозилтрансферазу. В публикации РСТ WO 03/035835 Presta описан вариант линии клеток СНО, клетки Lecl3, со сниженной способностью присоединять фукозу к Asn(297)-связанным углеводам, что также приводит к гипофукозилированию антител, экспрессирующихся в данной клетке-хозяине (см. также Shields, R.L. et al., 2002 J. Biol. Chem. 277:26733-26740). В публикации РСТ WO 99/54342 Umana et al. описаны линии клеток, сконструированные таким образом, чтобы экспрессировать гликозилтрансферазы, модифицирующие гликопротеины (например, бета(1,4)-N-ацетилглюкозаминилтрансфераза III (GnTIII)), таким образом, что антитела, экспрессируемые в данных сконструированных линиях клеток, демонстрируют повышенное количество структур GlcNAc в точке ветвления, что приводит к повышенной активности ADCC данных антител (также см. Umana et al., 1999 Nat. Biotech. 17:176-180). Eureka Therapeutics дополнительно описывает генетически сконструированные клетки млекопитающих СНО, способные продуцировать антитела с измененным профилем гликозилирования млекопитающих, лишенные фукозильных остатков (http://www.eurekainc.com/a&boutus/companyoverview.html). В качестве альтернативы, антитела по изобретению можно получать в дрожжах или мицелиальных грибах, сконструированных для получения профиля гликозилирования подобного млекопитающим и способных продуцировать антитела, не имеющие фукозы в профиле гликозилирования (см., например, ЕР 1297172 В1).
Другой модификацией антител в данном документе, рассматриваемой данным изобретением, является пегилирование. Антитело может быть пегилировано, например, с увеличением биологического времени полужизни антитела (например, в сыворотке). Для пегилирования антитела антитело или его фрагмент обычно приводят во взаимодействие с производным полиэтиленгликоля (PEG), таким как реакционноспособный сложный эфир или альдегид PEG, в условиях, в которых одна или более чем одна PEG группа присоединяется к антителу или фрагменту антитела. Пегилирование можно осуществлять путем ацилирования или алкилирования с реакционноспособной молекулой PEG (или аналогичным реакционноспособным водорастворимым полимером). Используемый в данном документе термин «полиэтиленгликоль» охватывает любую из форм PEG, которую использовали для дериватизации других белков, такую как моно (С1- С10) алкокси-, или арилокси-полиэтиленгликоль, или полиэтиленгликоль малеимид. В конкретных воплощениях антитело, продлежащее пегилированию, представляет собой агликозилированное антитело. Способы пегилирования белков известны в данной области и могут применяться к антителам по изобретению. См., например, ЕР О 154316 Nishimura et al. и ЕР 0401384 Ishikawa et al.
Другая модификация антител, рассматриваемая данным изобретением, представляет собой конъюгат или слияние белков по меньшей мере антигенсвязывающей области антитела по изобретению с сывороточным белком, таким как человеческий сывороточный альбумин или его фрагмент, для увеличения времени полужизни образующейся молекулы. Такой подход, например, описан в Ballance et al. ЕР 0322094.
Другой возможностью является слияние по меньшей мере антигенсвязывающей области антитела по изобретению с белками, способными связываться с сывороточными белками, такими как человеческий сывороточный альбумин, для увеличения времени полужизни образующейся молекулы. Такой подход, например, описан в Nygren et al., ЕР 0486525.
Иммуноконъюгаты:
Антитело по изобретению может быть конъюгировано с детектируемой меткой с образованием иммуноконъюгата против HER3. Подходящие детектируемые метки включают, например, радиоизотоп, флуоресцентную метку, хемилюминесцентную метку, ферментную метку, биолюминесцентную метку или коллоидное золото. Способы получения и детектирования таких детектируемо-меченных иммуноконъюгатов хорошо известны рядовым специалистам в данной области и более подробно описаны ниже.
Детектируемая метка может представлять собой радиоизотоп, который детектируют посредством авторадиографии. Изотопы, которые особо применимы для целей настоящего изобретения, представляют собой 3Н, 125I, 131I, 35S и 14С.
Иммуноконъюгаты против HER3 могут также быть помечены флуоресцентным соединением. Наличие флуоресцентно-меченного антитела определяют, подвергая иммуноконъюгат воздействию света соответствующей длины волны и детектируя полученную в результате флуоресценцию. Флуоресцентные маркирующие соединения включают флуоресцеин изотиоцианат, родамин, фикоэритерин, фикоцианин, аллофикоцианин, о-фтальдегид и флуорескамин.
В качестве альтернативы, иммуноконъюгаты против HER3 могут быть детектируемо помечены посредством связывания антитела с хемилюминесцентным соединением. Наличие иммуноконъюгата, помеченного хемилюминесцентным соединением, определяют детектированием наличия люминесценции, которая возникает в ходе химической реакции. Примеры хемилюминесцентных маркирующих соединений включают люминол, изолюминол, ароматический сложный эфир акридиния, имидазол, соль акридиния и сложный эфир-оксалат.
Аналогично, для маркирования иммуноконъюгатов против HER3 по настоящему изобретению можно использовать биолюминесцентное соединение. Биолюминесценция относится к типу хемилюминесценции, обнаруженному в биологических системах, где каталитический белок повышает эффективность хемилюминесцентной реакции. Наличие биолюминесцентного белка определяют посредством детектирования наличия люминесценции. Биолюминесцентные соединения, используемые для макркирования, включают люциферин, люциферазу и экворин.
В качестве альтернативы, иммуноконъюгаты против HER3 могут быть детектируемо помечены посредством связывания моноклонального антитела против человеческого HER3 с ферментом. Когда конъюгат антитела против HER3 и фермента инкубируют в присутствии соответствующего субстрата, фрагмент фермента взаимодействует с субстратом с образованием химического фрагмента, который можно детектировать, например, посредством спектрометрических, флуориметрических или визуальных способов. Примеры ферментов, которые можно использовать для детектируемого маркирования полиспецифичных иммуноконъюгатов, включают β-галактозидазу, глюкозооксидазу, пероксидазу и щелочную фосфатазу.
Специалистам в данной области будут известны другие подходящие метки, которые можно использовать согласно настоящему изобретению. Связывание маркерных фрагментов с моноклональными антителами против человеческого HER3 можно осуществлять, используя стандартные методики, известные в данной области. Типичная методология в данном отношении описана Kennedy et al., Clin. Chim. Acta 70:1, 1976; Schurs et al., Clin. Chim. Acta 81:1, 1977; Shih et al., Int'l J. Cancer 46:1101, 1990; Stein et al., Cancer Res. 50:1330, 1990; и Coligan, supra.
Кроме того, удобство и универсальность иммунохимической детекции могут быть усилены использованием моноклональных антител против человеческого HER3, которые были конъюгированы с авидином, стрептавидином и биотином (См., например., Wilchek et al. (eds.), "Avidin-Biotin Technology," Methods In Enzymology (Vol. 184) (Academic Press 1990); Bayer et al., "Immunochemical Applications of Avidin-Biotin Technology," in Methods In Molecular Biology (Vol. 10) 149-162 (Manson, ed., The Humana Press, Inc. 1992).)
Способы проведения иммунологических анализов хорошо отработаны (См., например, Cook and Self, "Monoclonal Antibodies in Diagnostic Immunoassays," in Monoclonal Antibodies: Production, Engineering, and Clinical Application 180-208 (Ritter and Ladyman, eds., Cambridge University Press 1995); Perry, "The Role of Monoclonal Antibodies in the Advancement of Immunoassay Technology," in Monoclonal Antibodies: Principles and Applications 107-120 (Birch and Lennox, eds., Wiley-Liss, Inc. 1995); Diamandis, Immunoassay (Academic Press, Inc. 1996).)
В другом аспекте согласно настоящему изобретению предложен конъюгат моноклонального антитела против человеческого HER3 и лекарственного средства. Термин «конъюгат моноклонального антитела против человеческого HER3 и лекарственного средства», используемый в данном документе, относится к моноклональному антителу против человеческого HER3 согласно изобретению, конъюгированному с терапевтическим агентом. Такие конъюгаты моноклонального антитела против человеческого HER3 и лекарственного средства оказывают клинически полезное действие на HER3-экспрессирующие клетки при введении субъекту, такому как, например, субъект с НЕР3-экспрессирующим раковым заболеванием, обычно при введении отдельно, а также в комбинации с другими терапевтическими агентами.
В типичных воплощениях моноклональное антитело против человеческого HER3 конъюгировано с цитотоксическим агентом, так что полученный конъюгат антитела и лекарственного средства оказывает цитотоксическое или цитостатическое действие на НЕР3-экспрессирующую клетку (например, HERS-экспрессирующая раковая клетка) при поглощении или усвоении клеткой. Особенно подходящими фрагментами для конъюгирования с антителами являются химиотерапевтические средства, ферменты, преобразующие пролекарства, радиоактивные изотопы или соединения, или токсины. Например, моноклональное антитело против человеческого HER3 может быть конъюгировано с цитотоксическим агентом, таким как химиотерапевтический агент или токсин (например, цитостатический агент или агент, разрушающий клетки, такой как, например, абрин, рицин А, экзотоксин синегнойной палочки или дифтерийный токсин).
Полезные классы цитотоксических агентов включают, например, антитубулиновые агенты, ауристатины, агенты, связывающиеся с малой бороздкой ДНК, ингибиторы репликации ДНК, алкилирующие агенты (например, платиновые комплексы, такие как цисплатин, моно(платина), бис(платина) и трехядерные платиновые комплексы и карбоплатин), антрациклины, антибиотики, антифолаты, антиметаболиты, химиотерапевтические сенсибилизирующие агенты, дуокармицины, этопозиды, фторированные пиримидины, ионофоры, лекситропсины, нитрозомочевины, платинолы, соединения для предварительного формования, пуриновые антиметаболиты, пуромицины, радиосенсибилизаторы, стероиды, таксаны, ингибиторы топоизомеразы, алкалоиды барвинка или тому подобное.
Отдельные цитотоксические агенты включают, например, андроген, антрамицин (АМС), аспарагиназу, 5-азацитидин, азатиоприн, блеомицин, бусульфан, бутионин сульфоксимин, камптотецин, карбоплатин, кармустин (BSNU), СС-1065 (Li et al., Cancer Res. 42:999-1004, 1982), хлорамбуцил, цисплатин, колхицин, циклофосфамид, цитарабин, цитидин арабинозид, цитохалазин В, дакарбазин, дактиномицин (ранее актиномицин), даунорубицин, декарбазин, доцетаксел, доксорубицин, эстроген, 5-фтордезоксиуридин, этопсида фосфат (VP-16), 5-фторурацил, грамицидин D, гидроксимочевину, идарубицин, ифосфамид, иринотекан, ломустин (CCNU), мехлоретамин, мелфалан, 6-меркаптопурин, метотрексат, митрамицин, митомицин С, митоксантрон, нитроимидазол, паклитаксел, пликамицин, прокарбизин, стрептозотоцин, тенопозид (VM-26), 6-тиогуанин, тиотепа, топотекан, винбластин, винкристин и винорелбин.
Особенно подходящие цитотоксические агенты включают, например, доластатины (например, ауристатин Е, AFP, MMAF, ММАЕ), агенты, связывающиеся с малой бороздкой ДНК (например, энедиины и лекситропсины), дуокармицины, таксаны (например, паклитаксел и доцетаксел), пуромицины, алкалоиды барвинка, СС-1065, SN-38 (7-этил-10-гидрокси-камптотеин), топотекан, морфолино-доксорубицин, ризоксин, цианоморфолино-доксорубицин, эхиномицин, комбретастатин, нетропсин, эпотилон А и В, эстрамустин, криптофизины, цемадотин, маитансиноиды, дискодермолид, элеутеробин и митоксантрон.
В конкретных воплощениях цитотоксический агент представляет собой традиционное химиотерапевтическое средство, такое как, например, доксорубицин, паклитаксел, мелфалан, алкалоиды барвинка, метотрексат, митомицин С или этопозид. Кроме того, сильные агенты, такие как аналоги СС-1065, калихеамцин, маитанзин, аналоги доластатина 10, ризоксин и палитоксин, могут быть связаны с антителом против HER3.
В конкретных вариантах цитотоксический или цитостатический агент представляет собой ауристатин Е (также известный в данной области, как доластатин-10) или его производное. Обычно производное ауристатина Е представляет собой, например, сложный эфир, образованный ауристатином Е и кетокислотой. Например, ауристатин Е могут приводить во взаимодействие с пара-ацетилбензойной кислотой или бензоилвалериановой кислотой с образованием АЕВ и AEVB, соответственно. Другие типичные производные ауристатина включают AFP (диметилвалин-валин-долаизолейин-долапроин-фенилаланин-п-фенилендиамин), MMAF (довалин-валин-долаизолейин-долапроин-фенилаланин) и МАЕ (монометилауристатин Е). Синтез и структура ауристатина Е и его производных описаны в публикации патентной заявки США 20030083263; публикации международного патента WO 2002/088172 и WO 2004/010957; и патентах США 6884869; 6323315; 6239104; 6034065; 5780588; 5665860; 5663149; 5635483; 5599902; 5554725; 5530097; 5521284; 5504191; 5410024; 5138036; 5076973; 4986988; 4978744; 4879278; 4816444 и 4486414.
В других вариантах цитотоксический агент представляет собой агент, связывающийся с малой бороздкой ДНК (См., например, Патент США 6130237). Например, в конкретных воплощениях агент, связывающийся с малой бороздкой ДНК, представляет собой CBI соединение (1,2,9,9а-тетрагидроцикло-пропа[с]бенз[е]индол-4-он). В других воплощениях агент, связывающийся с малой бороздкой ДНК, представляет собой энедиин (например, калихеамицин).
В конкретных воплощениях конъюгат антитела и лекарственного средства содержит антитубулиновый агент. Примеры антитубулиновых агентов включают, например, таксаны (например, Taxol® (паклитаксел), Taxotere® (доцетаксел)), Т67 (Туларик), алкалоиды (например, винкристин, винбластин, виндезин и винорелбин) и доластатины (например, ауристатин Е, AFP, MMAF, ММАЕ, АЕВ, AEVB). Другие агенты против тубулина включают, например, производные баккатина, аналоги таксана (например, эпотилон А и В), нокодазол, колхицин и колцимид, эстрамустин, криптофизины, цемадотин, маитанзиноиды, комбретастатины, дискодермолид и элеутеробин. В некоторых воплощениях цитотоксический агент представляет собой маитанзиноид, другую группу агентов против тубулина. Например, в конкретных воплощениях маитанзиноид представляет собой маитанзин или DM-1 (ImmunoGen, Inc.; см. также Chari et al., Cancer Res. 52:127-131, 1992).
В других воплощениях цитотоксический агент представляет собой антиметаболит. Антиметаболит может представлять собой, например, антагонист пуринов (например, азотиоприн или микофенолата мофетил), ингибитор дигидрофолатрезуктазы (например, метотрексат), ацикловир, гангцикловир, зидовудин, видарабин, рибаварин, азидотимидин, цитидин арабинозид, амантадин, дидезоксиуридин, йоддезоксиуридин, поскарнет или трифлуридин.
В других воплощениях моноклональное антитело против человеческого HER3 конъюгировано с ферментом, преобразующим пролекарство. Фермент, преобразующий пролекарство, может быть рекомбинантно слит с антителом или химически конъюгирован с ним с использованием известных способов. Типичные ферменты, преобразующие пролекарства, представляют собой карбоксипептидазу G2, β-глюкуронидазу, пенициллин-V-амидазу, пенициллин-G-амидазу, β-лактамазу, β-глюкозидазу, нитроредуктазу и карбоксипептидазу А.
Методики конъюгирования терапевтических агентов с белками, и, в частности, с антителами, хорошо известны (см., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy," в Monoclonal Antibodies And Cancer Therapy (Reisfeld et al. eds., Alan R. Liss, Inc., 1985); Hellstrom et al., "Antibodies For Drug Delivery," в Controlled Drug Delivery (Robinson et al. eds., Marcel Deiker, Inc., 2nd ed. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," в Monoclonal Antibodies '84: Biological And Clinical Applications (Pinchera et al. eds., 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy," в Monoclonal Antibodies For Cancer Detection And Therapy (Baldwin et al. eds., Academic Press, 1985); и Thorpe et al., 1982, Immunol. Rev. 62:119-58. Также см., например, РСТ публикацию WO 89/12624).
Применения в диагностике:
Другая цель изобретения относится к антителу против человеческого HER3 по изобретению для диагностики и/или наблюдения за раковым заболеванием, ассоциированным с экспрессией HER3. Раковые заболевания, ассоциированные с экспрессией HER3, обычно включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак желудка, рак поджелудочной железы, глиальные опухоли, такие как глиобластома и нейрофиброматоз, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, меланому, колоректальный рак, карциному эндометрия, карциному слюнной железы, рак почки, почечно-клеточный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному и разные типы рака головы и шеи, но не ограничиваются указанным. В одном конкретном воплощении рак, который диагностируют с использованием способов по настоящему изобретению, представляет собой рак молочной железы или рак яичника. В одном конкретном воплощении антитела по изобретению являются полезными в диагностике рака молочной железы и яичника.
В одном конкретном воплощении антитела по изобретению могут быть помечены детектируемой молекулой или веществом, таким как флуоресцентная молекула, радиоактивная молекула или любые другие метки, известные в данной области, как описано выше. Например, антитело по изобретению можно пометить радиоактивной молекулой любым способом, известным в данной области. Например, радиоактивные молекулы включают радиоактивный атом для сцинтиграфических исследований, такой как I123, I124, In111, Re186, Re188, но не ограничиваются указанным. Антитела по изобретению можно также метить спиновой меткой для визуализации ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная томография, мрт), такой как йод-123, йод-131, индий-I11, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо. После введения антитела детектируют его распространение в организме пациента. Способы детектирования распространения любой специфичной метки известны специалистам в данной области, и любой соответствующий способ может быть использован. Некоторые примеры, не ограничивающиеся указанными, включают компьютерную томографию (КТ), позитронно-эмиссионную томографию (ПЭТ), магнитно-резонансную томографию (МРТ), флуоресценцию, хемилюминесценцию и сонографию.
Антитела по изобретению могут быть полезны в определении стадии раковых заболеваний, ассоциированных с экспрессией HER3 (например, в радиовизуализации). Например, антитела по изобретению могут быть полезны для определения стадии рака молочной железы или яичника. Их можно использовать по отдельности или в комбинации с другими маркерами рака молочной железы или яичника, включая HER2, CAI 25, НЕ4 и мезотелин, но, не ограничиваясь указанными.
Как правило, указанные способы диагностики включают применение биологического образца, полученного от пациента. Термин «биологический образец», используемый в данном документе, охватывает множество типов образцов, полученных от субъекта, и может использоваться в диагностике и наблюдении. Биологические образцы включают образцы крови и другой жидкости биологического происхождения, твердые образцы тканей, такие как биоптат, или культуры тканей или клетки, полученные из них, и их потомство, но не ограничиваются указанным. Например, биологические образцы включают клетки, полученные из образца ткани, отобранного у индивидуума с подозрением на раковое заболевание, ассоциированное с экспрессией HER3, и в одном конкретном воплощении из молочной железы или яичника. Таким образом, биологические образцы охватывают клинические образцы, клетки в культуре, клеточные супернатанты, лизаты клеток, сыворотку, плазму, биологическую жидкость и образцы тканей.
В одном конкретном воплощении изобретение представляет собой способ диагностики ракового заболевания, ассоциированного с экспрессией HER3, у субъекта посредством детектирования HER3 в клетках субъекта с использованием антитела по изобретению. В частности, указанный способ диагностики может включать стадии, заключающиеся в:
(а) приведении биологического образца субъекта, который вероятно страдает от ракового заболевания, ассоциированного с экспрессией HER3, в контакт с антителом согласно изобретению в условиях, достаточных для образования комплексов антитела с клетками биологического образца, которые экспрессируют HER3;
(б) детектировании и/или количественном определении указанных комплексов, на основании чего выявление указанных комплексов свидетельствует о раковом заболевании, ассоциированном с экспрессией HER3.
Для наблюдения за раковым заболеванием диагностику по изобретению можно повторять с разными временными интервалами для определения того, увеличивается ли или уменьшается связывание антитела с образцами, на основании чего определяют прогрессирует ли раковое заболевание или регрессирует.
Терапевтические применения:
Антитела, фрагменты или иммуноконъюгаты по изобретению могут быть полезны в лечении любого рака с экспрессией HER3. Антитела по изобретению можно использовать отдельно или в комбинации с любым подходящим агентом.
Примеры рака с экспрессией HER3 включают карциному, лимфому, бластому, саркому и лейкоз, но не ограничиваются ими. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак желудка, рак поджелудочной железы, глиальные опухоли, такие как глиобластома и нейрофиброматоз, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, меланому, колоректальный рак, карциному эндометрия, карциному слюнной железы, рак почки, почечно-клеточный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному и разные типы рака головы и шеи, но не ограничиваются ими. В одном конкретном воплощении рак, который лечат с использованием способов по настоящему изобретению, представляет собой рак молочной железы или рак яичника.
Таким образом, цель изобретения относится к способу лечения рака, ассоциированного с экспрессией HER3, включающему введение нуждающемуся в этом субъекту терапевтически эффективного количества антитела, фрагмента или иммуноконъюгата по изобретению.
В некоторых воплощениях антитела по изобретению являются особенно подходящими для лечения лиганд (то есть NRG)-независимых раковых заболеваний и лиганд-зависимых раковых заболеваний.
В некоторых воплощениях антитела по изобретению являются особенно подходящими для лечения аутокринных или паракринных лиганд-зависимых опухолей (вследствие их аллостерического эффекта).
В некоторых воплощениях антитела по изобретению являются особенно подходящими для лечения раковых заболеваний, устойчивых к лечению антителами, ингибиторами тирозинкиназ (TKI), химиотерапевтическими агентами или антигормональными агентами.
В некоторых воплощениях антитела по изобретению являются особенно подходящими для лечения раковых заболеваний, выбранных из группы, состоящей из трижды негативного рака молочной железы, рака поджелудочной железы и почечно-клеточных карцином.
В контексте изобретения термин «процесс лечения» или «лечение», используемый в данном документе, означает вызов регресса, облегчение, подавление развития или предупреждение расстройства или состояния, к которому такой термин относится, или одного или более чем одного симптома такого расстройства или состояния.
Согласно изобретению термин «пациент» или «нуждающийся в этом пациент» относится к человеку или млекопитающему, не являющемуся человеком, находящемуся под воздействием или вероятно находящемуся под воздействием рака, ассоциированного с экспрессией человеческого HER3.
Под термином «терапевтически эффективное количество» антитела по изобретению подразумевается количество антитела, достаточное для лечения указанного рака при разумном соотношении польза/риск, применимое для любого медицинского лечения. Понятно, однако, что общее суточное применение антител и композиций по настоящему изобретению определяет лечащий врач по результатам тщательной медицинской оценки. Конкретный уровень терапевтически эффективной дозы для какого-либо конкретного пациента зависит от множества факторов, включая расстройство, которое подлежит лечению, и тяжесть расстройства; активность конкретного используемого антитела; конкретную используемую композицию, возраст, массу тела, общий уровень здоровья, пол и диету пациента; время введения, путь введения и скорость выведения используемого конкретного антитела; продолжительность лечения; лекарственные средства, используемые в комбинации или по случайному совпадению с конкретным используемым антителом; и подобные факторы, хорошо известные в данной области медицины. Например, в данной области хорошо известно, что нужно начинать с более низких доз соединения, по сравнению с требуемыми для достижения желаемого терапевтического эффекта, и постепенно повышать дозировку до тех пор, пока желаемый эффект не будет достигнут.
В конкретных воплощениях моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства используют в комбинации со вторым агентом для лечения заболевания или расстройства. При использовании в лечении рака моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства по настоящему изобретению можно использовать в комбинации с традиционными противораковыми терапиями, такими как, например, хирургическое вмешательство, радиотерапия, химиотерапия или их комбинации. В конкретных аспектах другие терапевтические агенты, полезные в комбинировании противораковой терапии с антителом против HER3 или конъюгатом антитела и лекарственного средства согласно настоящему изобретению, включают антиангиогенные средства. В некоторых аспектах антитело или конъюгат антитела и лекарственного средства согласно настоящему изобретению совместно вводят с цитокином (например, цитокином, который стимулирует иммунный ответ в отношении опухоли).
В некоторых других аспектах другие терапевтические агенты, полезные для комбинированной терапии, включают антагонист определенных факторов, которые участвуют в росте опухоли, например, EGFR, HER2 или HER4.
В одном конкретном воплощении моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства по настоящему изобретению используют в комбинации с моноклональным антителом против человеческого HER2, таким как Трастузумаб или Пертузумаб.
В некоторых воплощениях моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства, как описано в данном документе, используют в комбинации с ингибитором тирозинкиназ (TKI). BAY 43-9006 (сорафениб, Nexavar®) и SU11248 (сунитиниб, Sutent®) являются двумя такими TKI, которые были одобрены. Другие TKI включают иматиниба мезилат (Gleevec®, Novartis); Гефитиниб (Iressa®, AstraZeneca); Эрлотиниба гидрохлорид (Tarceva®, Genentech); Вандетаниб (Zactima®, AstraZeneca), Типифарниб (Zarnestra®, Janssen-Cilag); Дазатиниб (Sprycel®, Bristol Myers Squibb); Лонафарниб (Sarasar®, Schering Plough); Ваталаниб сукцинат (Novartis, Schering AG); Лапатиниб (Tykerb®, GlaxoSmithKline); Нилотиниб (Novartis); Лестауртиниб (Cephalon); Пазопаниба гидрохлорид (GlaxoSmithKline); Акситиниб (Pfizer); Канертиниба дигидрохлорид (Pfizer); Пелитиниб (Национальный институт рака, Wyeth); Тандутиниб (Millennium); Босутиниб (Wyeth); Семаксаниб (Sugen, Taiho); AZD-2171 (AstraZeneca); VX-680 (Merck, Vertex); EXEL-0999 (Exelixis); ARRY-142886 (Array BioPharma, AstraZeneca); PD-0325901 (Pfizer); AMG-706 (Amgen); BIBF-1120 (Boehringer Ingelheim); SU-6668 (Taiho); CP-547632 (OSI); (AEE-788 (Novartis); BMS-582664 (Bristol-Myers Squibb); JNK-401 (Celgene); R-788 (Rigel); AZD-1152 HQPA (AstraZeneca); NM-3 (Genzyme Oncology); CP-868596 (Pfizer); BMS-599626 (Bristol-Myers Squibb); PTC-299 (PTC Therapeutics); ABT-869 (Abbott); EXEL-2880 (Exelixis); AG-024322 (Pfizer); XL-820 (Exelixis); OSI-930 (OSI); XL-184 (Exelixis); KRN-951 (Kirin Brewery); CP-724714 (OSI); E-7080 (Eisai); HKI-272 (Wyeth); CHIR-258 (Chiron); ZK-304709 (Schering AG); EXEL-7647 (Exelixis); BAY-57-9352 (Bayer); BIBW-2992 (Boehringer Ingelheim); AV-412 (AVEO); YN-968D1 (Advenchen Laboratories); Midostaurin (Novartis); Perifosine (AEterna Zentaris, Keryx, Национальный институт рака); AG-024322 (Pfizer); AZD-1152 (AstraZeneca); ON-01910Na (Onconova); и AZD-0530 (AstraZeneca), но не ограничиваются ими.
Фармацевтические композиции:
Для введения моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства готовят в виде фармацевтической композиции. Фармацевтическую композицию, содержащую моноклональное антитело против человеческого HER3 или конъюгат антитела и лекарственного средства, можно приготовить согласно известным способам получения фармацевтически полезных композиций, где терапевтическую молекулу объединяют в смеси с фармацевтически приемлемым носителем. Композицию называют «фармацевтически приемлемым носителем», если пациент-реципиент проявляет толерантность к ее введению. Стерильный фосфатно-солевой буферный раствор является одним примером фармацевтически приемлемого носителя. Другие подходящие носители хорошо известны специалистам в данной области (См., например, Gennaro (ed.), Remington's Pharmaceutical Sciences (Mack Publishing Company, 19th ed. 1995).) Композиции могут дополнительно включать один или более чем один эксципиент, консервант, солюбилизатор, буферный агент, альбумин для предотвращения потери белка на поверхностях флаконов и т.д.
Форма фармацевтических композиций, путь введения, дозировка и режим естественно зависят от состояния, подлежащего лечению, тяжести заболевания, возраста, массы и пола пациента и т.д.
Фармацевтические композиции по изобретению могут быть приготовлены для местного, перорального, парентерального, интраназального, внутривенного, внутримышечного, подкожного или внутриглазного введения и тому подобное.
Предпочтительно, фармацевтические композиции содержат несущие среды, которые являются фармацевтически приемлемыми для композиции, пригодной для инъецирования. Данные композиции могут находиться в конкретном изотоническом, стерильном, солевом растворах (мононатрий или динатрий фосфат, хлорид натрия, калия, кальция или магния и тому подобное или смеси таких солей) или быть сухими, особенно лиофилизированными композициями, которые при добавлении, в зависимости от случая, стерильной воды или физиологического раствора обеспечивают разбавление инъецируемых растворов.
Дозы, используемые для введения, могут быть адаптированы в зависимости от разных параметров, и в частности в зависимости от используемого способа введения, соответствующей патологии или в качестве альтернативы - желаемой продолжительности лечения.
Для получения фармацевтических композиций эффективное количество антитела может быть растворено или диспергировано в фармацевтически приемлемом носителе или водной среде.
Фармацевтические формы, подходящие для инъецирования, включают стерильные водные растворы или дисперсии; композиции, включающие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные парашки для получения стерильных инъецируемых растворов или дисперсий для немедленного приема. Во всех случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы обеспечивалась легкая проходимость через иглу. Она должна быть стабильной в условиях изготовления и хранения и должна быть защищена от загрязняющего воздействия микроорганизмов, таких как бактерии и грибы.
Растворы активных соединений в виде свободного основания или фармацевтически приемлемых солей, подходящим образом смешанных с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза, могут быть получены в воде. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В обычных условиях хранения и применения данные препараты содержат консервант для предотвращения роста микроорганизмов.
Антитело по изобретению может быть приготовлено в виде композиции в нейтральной форме или форме соли. Фармацевтически приемлемые соли включают соли присоединения кислоты (образованные свободными аминогруппами белка), и которые образованы неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и тому подобное. Соли, образованные свободными карбоксильными группами, могут быть также получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органический оснований, как изопропиламин, триметиламин, гистидин, прокаин и тому подобное.
Носитель также может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), их подходящие смеси и растительные масла. Соответствующую текучесть можно поддерживать, например, посредством применения покрытия, такого как лецитин, посредством поддержания желаемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Предупреждение воздействия микроорганизмов можно осуществлять посредством разных противобактериальных и противогрибковых средств, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тимерозалом и тому подобное. Во многих случаях предпочтительно включать изотонические агенты, например, сахара или хлорид натрия. Пролонгированную абсорбцию инъецируемых композиций можно осуществлять посредством применения в композициях агентов, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
Стерильные инъецируемые растворы получают посредством добавления активных соединений в необходимом количестве в соответствующем растворителе с целым рядом других ингредиентов, перечисленных выше, при необходимости, с последующим стерилизацией фильтрованием. Обычно дисперсии получают путем добавления разных стерилизованных активных ингредиентов в стерильную несущую среду, которая содержит основную дисперсионную среду и другие требуемые ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов предпочтительные способы получения представляют собой методики вакуумной сушки и сублимационной сушки, которые дают порошок активного ингредиента и любого дополнительного желаемого ингредиента из его предварительно стерильно отфильтрованного раствора.
Также предполагается получение более или высоко концентрированных растворов для прямой инъекции, где предусмотрено применение ДМСО в качестве растворителя для чрезвычайно быстрого проникания с доставкой высоких концентраций активных агентов к небольшой области опухоли.
После приготовления растворы вводят способом, соответствующим дозируемой лекарственной форме, и в таком количестве, которое является терапевтически эффективным. Препараты легко вводят в разных лекарственных формах, таких как тип инъецируемых растворов, описанных выше, но также могут быть использованы капсулы с высвобождением лекарственного средства и тому подобное.
Для парентерального введения в водном растворе, например, раствор должен быть при необходимости подходящим образом буферизирован, и жидкий разбавитель вначале приведен в изотоническое состояние достаточным количеством солевого раствора или глюкозы. Данные конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В этой связи, применимые стерильные водные среды известны специалистам в данной области в свете настоящего изобретения. Например, одна дозировка может быть растворена в 1 мл изотонического раствора NaCl и либо добавлена к 1000 мл жидкости гиподермоклизиса или инъецирована в предполагаемое место инфузии (см., например, "Remington's Pharmaceutical Sciences" 15ое издание, страницы 1035-1038 и 1570-1580). Некоторые вариации в дозировке обязательно имеют место в зависимости от состояния подлежащего лечению субъекта. Ответственный за введение в любом случае определяет соответствующую дозу для каждого отдельного субъекта.
Антитела по изобретению могут быть приготовлены в терапевтической смеси с содержанием примерно от 0,0001 до 1,0 миллиграмма или примерно от 0,001 до 0,1 миллиграмма, или примерно от 0,1 до 1,0 или даже примерно 10 миллиграмм на дозу или около того. Также могут быть введены многократные дозы.
Помимо соединений, приготовленных для парентерального введения, такого как внутривенная или внутримышечная инъекция, другие фармацевтически приемлемые формы включают, например, таблетки или другие твердые формы для перорального введения; капсулы с высвобождением с течением времени; или любую другую форму, используемую в настоящее время.
В конкретных воплощениях для введения антител в клетки-хозяев предполагают применение липосом и/или наночастиц. Образование и применение липосом и/или наночастиц известны специалистам в данной области.
Нанокапсулы как правило могут удерживать соединения стабильным и воспроизводимым образом. Для того чтобы избежать побочных эффектов в результате внутриклеточной полимерной перегрузки, такие ультратонкие частицы (размером примерно 0,1 мкм) как правило конструируют, используя полимеры, способные деградировать in vivo. Биодеградируемые наночастицы на основе полиалкилцианокрилата, которые удовлетворяют данным требованиям, рассматривают для применения в настоящем изобретении, и такие частицы могут быть легко получены.
Липосомы образуются из фосфолипидов, которые диспергированы в водной среде и самопроизвольно образуют мультиламеллярные концентрические бислойные везикулы (также называемые мультиламеллярными везикулами (MLV)). MLV как правило имеют диаметр от 25 нм до 4 мкм. Соникация MLV приводит к образованию небольших одноламеллярных везикул (SUV) с диаметрами в интервале 200-500 А, содержащих водный раствор в ядре. Физические характеристики липосом зависят от рН, ионной силы и присутствия двухвалентных катионов.
Наборы:
Наконец, согласно изобретению также предложены наборы, содержащие по меньшей мере одно антитело по изобретению. Наборы, содержащие антитела по изобретению, находят применение в детектировании экспрессии HER3 или в терапевтических или диагностических анализах. Наборы по изобретению могут содержать антитело, связанное с твердой подложкой, например, планшет для культуры ткани или шарики (например, шарики сефарозы). Могут быть предложены наборы, содержащие антитела для детектирования и количественного определения HER3 in vitro, например, в ELISA или Вестерн-блоттинге. Такое антитело, полезное в детектировании, может быть помечено, например, флуоресцентной меткой или радиометкой.
Изобретение дополнительно проиллюстрировано следующими графическими материалами и примерами. Однако данные примеры и графические материалы никоим образом не следует рассматривать как ограничивающие объем настоящего изобретения.
Графические материалы:
На Фиг. 1 показан взаимный аллостерический эффект mAb 9F7-F11 и NRG в отношении связывания с рецептором HER3 на клетках. Связывание 9F7-F11 с HER3 возрастает на клетках SKBR3 при добавлении разных концентраций NRG. В отличие от этого, на антитело А не влияет связывание NRG, а антитело В блокируется связыванием NRG (Панель А). Наоборот, связывание NRG с HER3 возрастает на НЕР2/НЕР3-трансфицированных фибробластах 3Т3 при добавлении разных концентраций mAb 9F7-F11, тогда как не играющий роли IgG не влияет на связывание NRG. В отличие от этого, свободный NRG вытесняет меченный NRG для связывания с HER3 (Панель Б).
На Фиг. 2 количественно охарактеризована аффинность 9F7-F11 в отношении рецептора HER3 с NRG или без него. 6-Кратное увеличение аффинности измеряли в присутствии NRG (0,47±0,07 нМ) относительно аффинности, измеренной в отсутствии NRG (2,33±0,30 нМ).
На Фиг. 3 показано ингибирование фосфорилирования рецепторов HER2/HER3 и PI3K/Akt и ERK сигнализации по направлению к клеточной мишени посредством использования mAb против HER3 9F7-F11 в клетках карциномы поджелудочной железы ВхРС3.
На Фиг. 4 показаны эффекты mAb 9F7-F11, оказываемые на экспрессию p53/MDM2 и фосфорилирование, как показано Вестерн-блоттингом (А) и количественно оценено Image J (Б).
На Фиг. 5 показаны эффекты mAb 9F7-F11, оказываемые на экспрессию р53-индуцибельных генов р21, Cyclin А2, PERP, Puma и Bcl-2, как показано количественной ПЦР. Относительную экспрессию мРНК нормировали относительно экспрессии GAPDH (глицеральдегид-3-фосфатдегидрогеназа).
На Фиг. 6 показаны эффекты mAb 9F7-F11, оказываемые на блокаду клеточного цикла раковых клеток поджелудочной железы ВхРС3.
На Фиг. 7 показаны эффекты mAb 9F7-F11, оказываемые на апоптоз раковых клеток поджелудочной железы ВхРС3 (А). Расщепление каспазы-9, которое инициирует митохондриальный апоптоз, показано вестерн-блоттингом лизатов клеток из клеток ВхРС3, обработанных 9F7-F11 (Б).
На Фиг. 8 показаны эффекты mAb 9F7-F11, отдельно или в комбинации с цетуксимабом или трастузумабом, оказываемые на пролиферацию раковых клеток поджелудочной железы ВхРС3 относительно эффектов, наблюдаемых только в присутствии трастузумаба или цетуксимаба.
На Фиг. 9 показан ADCC эффект mAb 9F7-F11 по сравнению с трастузумабом, оказываемый на клетки-мишени рака молочной железы MDA-МВ-453.
На Фиг. 10 показано ингибирование развития опухоли под действием mAb 9F7-F11 у голых мышей, которым ксенотрансплантировали клетки рака молочной железы с усилением HER2/PIK3CA-mut MDA-MB-361.
На Фиг. 11 показано ингибирование развития опухоли под действием mAb 9F7-F11 у голых мышей, которым ксенотрансплантировали клетки трижды негативного рака молочной железы PTEN-mut/p53-mut MDA-MB-468 (А). Кривую выживания Каплана-Мейера рассчитывали, когда опухоли MDA-MB-468 достигали объема 2000 мм3 (Б).
На Фиг. 12 показано развитие опухоли и выживание голых мышей, которым ксенотрансплантировали клетки NRG-зависимого рака поджелудочной железы, p53-mut, HER2low ВхРС3 и обработанных mAb 9F7-F11, отдельно (9F7) или в комбинации с пертузумабом (Р + 9F7), по сравнению с обработкой только пертузумабом (Р) или несущей средой (Ctrl) (Панель А) и комбинацией трастузумаба и пертузумаба (Р+Т) (Панель Б).
На Фиг. 13 показано ингибирование развития опухоли mAb 9F7-F11 у голых мышей, которым ксенотрансплантировали клетки рака поджелудочной железы ВхРС3 с shHER3- или shLuc (контроль)-нокаутом (А). Подавление экспрессии HER3 проверяют посредством вестерн-блоттинга на ксенотрансплантатах, восстановленных из обработанных мышей (Б).
Пример 1: Аллостерический эффект 9F7-F11 на связывание с HER3
Одной мыши Balb/c путем внутрибрюшинной инъекции вводили НЕР2/НЕР3-трансфицированную линию клеток NIH 3Т3 (около 2×106 клеток), предварительно стимулированных нейрегулином β1 (NRG) для стимуляции образования гетеродимера HER2/HER3. Клетки селезенки из иммунизированных мышей сливали согласно уже описанному протоколу (Salhi et al. Biochem. J. 2004) с использованием миеломы PX63Ag8.653. 105 слитых клеток на лунку культивировали в планшетах со средами НАТ(гипоксантин-аминоптерин-тимидиновая среда) для селекции гибридом. Спустя 12 суток после слияния, скрининг супернатантов гибридом проводили посредством ELISA, используя в качестве антигена белок HER3-Fc. В контроле скрининги осуществляются одновременно с выявлением различий между антигенами HER2-Fc и отдельно фрагментом Fc.
Цитометрический конкурентный эксперимент проводили для количественной оценки способности NRG ингибировать связывание антитела с HER3 в анализе на клетках SKBR3. С этой целью 105 клеток SKBR3 предварительно инкубировали с разными концентрациями конкурирующего лиганда NRG в течение 1,5 ч на льду. После одной промывки 1% PBS (фосфатно-солевым буферным раствором) BSA (бычьего сывороточного альбумина) отобранное mAb против HER3 9F7-F11, в концентрации, дающей 50% максимального связывания, добавляли в каждую лунку в течение 1 ч на льду. В некоторых экспериментах лиганд NRG и антитело против HER3 9F7-F11 совместно инкубировали в течение 2 ч на льду. Затем клетки промывали и дополнительно инкубировали с разведением 1:60 соответствующего FITC (флуоресцеин изотиоцианат)-конъюгированного вторичного антитела (Sigma) в течение 45 мин на льду перед цитометрическим анализом на приборе Quanta (Beckman-Coulter). Конкурентные эксперименты с помощью FACS (сортировка клеток с активацией флуоресценции) показали, что антитело 9F7-F11 не конкурировало с NRG, таким образом, давая основания полагать, что данное антитело не связывалось с NRG-связывающим сайтом (Фиг. 1А). Уровень связывания неконкурентного в отношении NRG антитела 9F7-F11 даже был повышен до 160% при добавлении NRG, демонстрируя, таким образом, аллостерический эффект mAb 9F7-F11 в отношении связывания с HER3. И наоборот, связывание антитела А положительного контроля не было модифицировано инкубацией с NRG, и антитело В положительного контроля демонстрировало NRG-зависимое связывание (Фиг. 1А).
Наоборот, 105 НЕР3-трансфицированных фибробластов 3Т3 культивировали в течение 2 суток перед голоданием и затем инкубировали с разными концентрациями mAb 9F7-F11 в буфере KREBS в течение 45 минут при +4°С. NRG, меченный красителем на основе криптата d2, добавляли в течение еще 45 минут. После промывания KREBS измеряли флуоресценцию при 620/670 нм, используя микропланшетный ридер Pherastar. Как показано на Фиг. 1Б, связывание 9F7-F11 вызывало увеличение связывания NRG с HER3, тогда как не играющий роли IgG - нет. В качестве контроля, разные концентрации свободного NRG вытесняли связывание меченного NRG с рецептором HER3 (Фиг. 1Б), демонстрируя, таким образом, аллостерическое взаимодействие между 9F7-F11 и NRG в отношении связывания с HER3.
Пример 2: Добавление NRG вызывает 6-кратное увеличение аффинности 9F7-F11 в отношении рецептора HER3
Используя технологию Tag-Lite, разработанную CisBio BioAssay, 104 экспрессирующих HER3 клеток НЕК, меченных Snap (белком, связанным с синаптосомой), метили Lumi4-KpnnTaTOM тербия в качестве донора и затем совместно инкубировали с NRG и разными концентрациями mAb 9F7-F11, меченного акцептором 62. Спустя 16 ч инкубации, флуоресценцию Lumi4-тербия и d2 измеряли соответственно при 620 и 665 нм (задержка 60 мкс, интеграция 400 мкс) при возбуждении флуоресценции при 337 нм на приборе Pherastar FS. Как показано на Фиг. 2, в присутствии NRG наблюдали дозозависимое увеличение связывания 9F7-F11 с рецептором HER3, относительно более низкого уровня связывания с HER3, измеренного без NRG. Величина Kd связывания 9F7-F11 с HER3 после совместной инкубации с NRG составляла 0,47±0,07 нМ, тогда как без NRG Kd измеряли на уровне 2,33±0,30 нм, показывая, таким образом, что добавление NRG аллостерически индуцирует 6-кратное повышение аффинности 9F7-F11 в отношении рецептора HER3.
Пример 3: неконкурентное в отношении NRG аллостерическое антитело против HER3 9F7-F11 ингибирует фосфорилирование HER2 и HER3, наряду с блокадой фосфорилирования ERK1/2 и АКТ
Пятьсот тысяч опухолевых клеток поджелудочной железы ВхРС3 добавляли в каждую лунку 6-луночного культурального планшета в течение 24 ч при 37°С. После сывороточного голодания в течение 16 ч в полной среде RPMI с 1% FCS (фетальной телячьей сыворотки) и дополнительного промывания клетки предварительно инкубировали с антителом 9F7-F11 в концентрации 50 мкг/мл или антителом отрицательного контроля в течение 15 минут или 1 ч при 37°С, перед промыванием и последующей стимуляцией 100 нг/мл разведения NRG или без нее. Затем клетки промывали, соскребали и лизировали буфером, содержащим 20 мМ Tris-HCl рН 7,5, 150 мМ NaCl, 1,5 мМ MgCl2, 1 мМ EDTA (этилендиаминтетрауксусная кислота), 1% Triton, 10% глицерин, 0,1 мМ фенилметилсульфонилфторид, 100 мМ фторид натрия, 1 мМ ортованадат натрия (Sigma-Aldrich) и одну таблетку полной смеси ингибиторов протеаз (Roche Diagnostics, Indianapolis, IN). После 30 минутной инкубации образцы очищали от нерастворимой фракции посредством центрифугирования, и концентрации белка в лизатах клеток определяли методом Бредфорда. Данные белковые лизаты непосредственно смешивали с буфером Лэммли (1-20 мкг общего белка в зависимости от мишени и линий клеток) и нагревали при 95°С в течение 5 минут. После электрофореза на 7% SDS-PAGE (электрофорез с додецилсульфатом натрия в полиакриламидном геле) в восстановительных условиях белки переносили на мембраны из поливинилидендифторида (Millipore), которые затем насыщали в TNT буфере (Tris 25 мМ рН 7,4, NaCl 150 мМ, Tween 0,1%), содержащем 5% обезжиренное сухое молоко, в течение 1 ч при 25°С. Первичные антитела, направленные на киназные рецепторы или киназы сигнализации и их фосфорилированные формы, инкубировали в TNT-5% BSA буфере в течение 18 ч при 4°С. После пяти промываний в TNT буфере кроличьи, козьи или мышиные поликлональные антитела, конъюгированные с пероксидазой (Sigma-Aldrich), при необходимости добавляли в TNT буфере, содержащем 5% обезжиренное сухое молоко, в течение 1 ч при 25°С. После пяти промывок в TNT буфере результаты блоттинга визуализировали, используя хемилюминесцентный субстрат (Western lightning Plus-ECL, Perkin Elmer).
Примечательно, что антитело 9F7-F11 блокировало лиганд-индуцированное фосфорилирование на Y1289-HER3 и Y1242-HER2 (Фиг. 3). Одновременно, аллостерическое неконкурентное антитело 9F7-F11 индуцировало ингибирование фосфорилирования Akt на Ser473 и фосфорилирование ERK1/2 на Thr202/204.
Пример 4: неконкурентное в отношении NRG аллостерическое антитело против HER3 9F7-F11 ингибирует экспрессию и фосфорилирование MDM2, наряду с модуляцией Р53 пути
Аналогично, как описано выше, опухолевые клетки ВхРС3 добавляли в каждую лунку 6-луночного культурального планшета в течение 24 ч при 37°С. После сывороточного голодания в течение 16 ч в полной среде RPMI с 1% FCS и дополнительным промыванием клетки предварительно инкубировали с антителом 9F7-F11 в концентрации 50 мкг/мл или антителом отрицательного контроля в течение 24 ч или 72 ч при 37°С перед промыванием и последующей стимуляцией 100 нг/мл разведения NRG или без нее. Клетки затем лизировали для SDS-PAGE и вестерн-блоттинга или подвергали выделению РНК, обратной транскрипции и количественной ПЦР с использованием соответствующих праймеров. Как показано на Фиг. 4 с помощью вестерн-блоттинга, обработка 9F7-F11 приводила к ингибированию экспрессии и фосфорилирования MDM2 и повышению уровня экспрессии р53. В соответствии с этим, обработка 9F7-F11 приводила к повышению р53-индуцируемой экспрессии генов, таких как р27, который вовлечен в блокаду клеточного цикла и пролиферации, и Puma и PERP, которые положительно регулировали апоптоз, как показано посредством количественной ПЦР (Фиг. 5). Напротив, экспрессия генов Cyclin А2 и Bcl2, которая стимулирует пролиферацию и ингибирует апоптоз, соответственно, снижалась после обработки неконкурентным в отношении NRG аллостерическим антителом 9F7-F11 (Фиг. 5).
Пример 5: неконкурентное в отношении NRG аллостерическое антитело против HER3 9F7-F11 блокирует клеточный цикл в фазе G1, ингибирует пролиферацию и восстанавливает апоптоз
Эффект НЕР3-специфичного Ab 9F7-F11, оказываемый на клеточный цикл, оценивали, используя окрашивание пропидия йодидом. Кратко, 300000 опухолевых клеток ВхРС3/лунка культивировали в 6-луночных микротитрационных планшетах в течение 24 ч и затем подвергали сывороточному голоданию и синхронизировали в среде RPMI без FCS в течение еще 24 ч перед совместной инкубацией с 100 мкг/мл Аb против HER3 9F7-F11 и 100 нг/мл NRG. Пермеабилизированные клетки окрашивали спустя 24 ч пропидия иодидом перед проточным цитометрическим анализом. Для анализов пролиферации и апоптоза 50000 клеток ВхРС3/лунка высевали в планшет за одни сутки перед голоданием (в RPMI-1% FCS). Затем добавляли НЕР3-специфичное Ab 9F7-F11 и NRG в течение 120 ч. Пролиферацию клеток измеряли посредством включения 5-этинил-2'-деоксиуридина (EdU), конъюгированного с Alexa Fluor 488 (Invitrogen), в течение последних 30 ч культивирования. Апоптоз клеток оценивали посредством инкубации с конъюгированным с флуоресцентной меткой Annexin V и 7-аминоактиномицином D (7-AAD; Beckman-Coulter). Все эксперименты проводили в трехкратной повторности. Для анализа каспазы-9 клетки ВхРС3 обрабатывали и лизировали, как описано выше. После SDS-PAGE и вестерн-блоттинга лизатов клеток активацию каспазы-9 посредством расщепления профермента подтверждали, используя соответствующее антитело. Как показано на Фиг. 6, 24-часовая обработка аллостерическим Ab 9F7-F11 блокировала клеточный цикл в фазе G1 с увеличением числа клеток в G1 с 36-38% для необработанных клеток или клеток, обработанных контрольным Ab, до 62% для клеток ВхРС3, обработанных 9F7-F11. Обработка 9F7-F11 одновременно снижала процент клеток ВхРС3 в фазе S и G2/m (Фиг. 6). Обработка клеток ВхРС3 mAb 9F7-F11 приводила к увеличению раннего (18%) и позднего (12%) апоптоза, по сравнению с необработанными клетками и клетками, обработанными контрольным Ab (Фиг. 7А), с сопутствующим расщеплением прокаспазы-9, которое инициирует митохондриальный апоптоз (Фиг. 7Б). Наконец, пролиферацию клеток ВхРС3 ингибировали после 120-часовой обработки Ab 9F7-F11. Специфического воздействия на пролиферацию клеток в случае отдельно взятого трастузимаба против HER2 на клетках HER2low ВхРС3 не наблюдали, тогда как цетуксимаб против EGFR был менее эффективным, чем Ab против HER3 9F7-F11 (Фиг. 8). Напротив, комбинация mAb 9F7-F11 и трастузумаба была более эффективной в отношении ингибирования пролиферации клеток, чем комбинация 9F7-F11/цетуксимаб, указывая на возможный синергетический эффект композиции трастузумаб/9Р7-F11, по сравнению с аддитивным эффектом композиции цетуксимаб/9Р7-Р11, на опухолевых клетках HER2low. В своей совокупности, данные результаты показали, что неконкурентное в отношении NRG аллостерическое антитело против HER3 9F7-F11 блокирует клеточный цикл в фазе G1, восстанавливает ранний и поздний митохондриальный апоптоз через расщепление прокаспазы-9 и ингибирует пролиферацию опухолевых клеток. В данном случае комбинация mAb 9F7-F11 с Ab против HER2 может представлять большой интерес в опухолях HER2low.
Пример 6: неконкурентное в отношении NRG аллостерическое антитело против HER3 9F7-F11 индуцирует антителозависимую клеточную цитотоксичность клеток рака молочной железы
Опухолевые клетки-мишени MDA-MB-453, полученные из базально-подобного трижды негативного рака молочной железы, высевали в планшет в количестве 20000 клеток/лунка плоскодонного 96-луночного микропланшета за одни сутки перед анализом ADCC. Линия клеток MDA-MB-453 экспрессирует около 180000 HER2 и 21000 HER3 рецепторов, тогда как экспрессии EGFR не наблюдают. После промывания в культуральной среде mAb 9F7-F11 добавляли в концентрации 10 мкг/мл в течение 30 минут перед добавлением эффекторных клеток, полученных из мононуклеарных клеток периферической крови (РВМС). РВМС получали посредством центрифугирования образцов крови от здоровых доноров, полученных в "Etablissement Francais du Sang", в градиенте плотности. Клетки-эффекторы/клетки-мишени (Е/Т) инкубировали при соотношении Е/Т 15/1 в течение 24 ч во влажной камере для клеток. Уничтожение клеток-мишеней MDA-MB-453 оценивали посредством измерения высвобождения лактатдегидрогеназы (LDH) из поврежденных клеток с использованием набора для выявления цитотоксичности (набор для выявления LDH; Promega G-1780) согласно инструкции изготовителя. Кратко, 50 мкл клеточного супернатанта осторожно переносили в новый плоскодонный 96-луночный микропланшет, и в каждую лунку добавляли реакционную смесь LDH (50 мкл/лунка) из набора. После 30 мин инкубации при 37°С добавляли 50 мкл останавливающего раствора (доступен в наборе), и при 490 нм измеряли оптическую плотность. Для каждого эксперимента устанавливали следующие контроли: только РВМС, только клетки-мишени MDA-MB-453 (спонтанное высвобождение LDH), клетки-мишени с РВМС (антителозависимое спонтанное высвобождение), клетки-мишени с лизирующим буфером (максимальное высвобождение LDH), РВМС с Ab, клетки-мишени с Ab. Процентную долю специфического лизиса каждого образца определяли с использованием следующей формулы: процентная доля специфического лизиса = (значение для образца - спонтанное высвобождение)/(максимальное высвобождение - спонтанное высвобождение)*100. Как показано на Фиг. 9, Ab 9F7-F11 индуцировало 5-10% специфический лизис клеток рака молочной железы MDA-MB-453 с использованием РВМС от здоровых доноров 1 и 2. В этом же эксперименте трастузумаб в качестве положительного контроля индуцировал примерно 40% лизис, вследствие того, что MDA-MB-453 экспрессируют в 10 раз больше рецепторов HER2, чем рецепторов HER3.
Пример 7: монотерапия 9F7-F11 у мышей, которым ксенотрансплантировали MDA-MB-361 с усилением HER2 и опухоли трижды негативного рака молочной железы MDA-MB-468
Самок бестимусных голых мышей возраста 6-8 недель BALB/c приобретали в Janvier и Charles Rivers Laboratories. Клетки рака молочной железы с усилением HER2/PIK3CA-mut MDA-MB-361 (10×106) и клетки трижды негативного рака молочной железы без усиления HER2/PTEN-mut/p53-mut/ER-/PR MDA-MB-468 (3,5×106) подкожно инъецировали в правый бок бестимусных голых мышей BALB/c. Обе линии клеток экспрессировали рецептор HER3 на низком уровне (около 10000 рецепторов/клетка). Все эксперименты in vivo проводили в соответствии с французским руководством для исследований на экспериментальных животных (Agreement no. В34-172-27).
Мышей, несущих опухоль, случайным образом распределяли на разные экспериментальные группы, когда опухоли достигали приблизительного объема 100 мм3. Мышей обрабатывали посредством и.п. (интраперитонеально) инъекций НЕР3-специфичных антител 9F7-F11 и несущей средой (PBS). Количество инъецируемого антитела составляло 300 мкг/инъекция (15 мг/кг), трижды в неделю, последовательно в течение 6 недель (Q2D-6W). Размеры опухолей измеряли дважды в неделю посредством калипера, и объемы рассчитывали по формуле D1×D2×D3/2. Развитие опухолей рассчитывали, используя формулу [(конечный объем)-(исходный объем)]/(исходный объем). Результаты также выражали в виде кривой выживания Каплана-Мейера, используя время, затраченное на достижение опухолью определенного конечного объема 2000 мм3. Среднюю задержку определяли, как время, при котором 50% мышей имело опухоль, достигающую определенного объема.
Как показано на Фиг. 10, авторы изобретения наблюдали значимое 47±5%-уменьшение роста опухолей MDA-MB-361 у мышей, обработанных 9F7-F11, на 55 сутки после имплантации опухоли (что соответствует концу обработки антителом; сутки 40), относительно среднего размера опухоли, измеренного у мышей, обработанных несущей средой (р<0,001). В конце эксперимента (97 суток) меньшее, но значимое, 21±2%-уменьшение размера опухоли наблюдали в группе, обработанной 9F7-F11, возможно, поскольку обработку 9F7-F11 прекращали с 57 суток.
Как показано на Фиг. 11А, средний объем опухоли был значительно ниже у мышей, обработанных 9F7-F11, которым ксенотрансплантировали клетки MDA-MB-468 (35% уменьшение объема на сутки 105 после ксенотрансплантации с последующей обработкой 9F7-F11), чем в контролях (несущая среда). Обработка Ab 9F7-F11 значительно пролонгировала 50% среднее время выживания на 20 суток у животных, которым ксенотрансплантировали клетки MDA-MB-468 (одну мышь стабилизировали для группы, обработанной 9F7-F11, в конце эксперимента, то есть 190 суток; р<0,05). В своей совокупности, данные результаты демонстрируют, что неконкурентное в отношении NRG аллостерическое Ab против HER3 9F7-F11 задерживало рост опухоли у мышей, которым ксенотрансплантировали либо линию клеток с усилением HER2, либо линию клеток трижды негативного рака молочной железы.
Пример 8: Комбинированная терапия 9F7-F11 с пертузумабом у мышей, которым ксенотрансплантировали NRG-зависимую опухоль рака поджелудочной железы ВХРС3
Авторы изобретения ранее показали, что комбинирование терапевтического антитела трастузумаба с другими таргетными терапиями демонстрировало синергетический эффект на карциномах предстательной железы с низким уровнем экспрессии HER2 (Larbouret, 2007, 2010). Теперь авторы изобретения оценивали комбинированную терапию аллостерическим Ab против HER3 9F7-F11 и Ab против HER2 Пертузумабом при HER2low карциноме предстательной железы. Самкам бестимусных мышей возраста шесть недель в правый бок подкожно инъецировали клетки рака поджелудочной железы HER2low ВхРС-3 (4,5×106), которые выделяли нейрегулин (NRG-зависимые). Мышей, несущих опухоль, случайным образом распределяли в разные экспериментальные группы (по меньшей мере 6 животных/группа), когда опухоли достигали объема 100 мм3, и затем обрабатывали 2 или 10 мг/кг пертузумаба, 10 мг/кг 9F7-F11 или комбинацией пертузумаба и 9F7-F11 (10 мг/кг каждого mAb). Антитела давали интраперитонеально (и.п.) дважды в неделю в течение 4 недель (Q3D-4W). Объемы опухолей рассчитывали по формуле: D1×D2×D3/2. Для сравнения выживаемости мышей умерщвляли, когда опухоль достигала объема 1000 мм3.
Оба антитела по отдельности заметно замедляли рост опухоли, по сравнению с необработанной группой (р<0,001), и значимого различия между Ab против HER3 9F7-F11 и пертузумабом (р=0,6488) не наблюдали (Фиг. 12А). 50% среднее время выживания было значительно пролонгировано на 17 суток у мышей, обработанных 9F7-F11, и на 23 суток у мышей, обработанных пертузумабом по сравнению с контролями (Фиг. 12А). Кроме того, совместная обработка 9F7-F11 и пертузумабом ингибировала рост опухоли гораздо сильнее, чем каждое антитело в отдельности (пертузумаб относительно 9F7-F11/пертузумаб; р=0,004). В конце 4-недельной обработки объем опухоли, продолжал увеличиваться у мышей, обработанных 9F7-F11 или пертузумабом по отдельности, тогда как он оставался довольно стабильным у животных, которые получали комбинацию 9F7-F11/пертузумаб (Фиг. 12А). Среднее выживание было более продолжительное у животных, обработанных комбинацией двух антител, чем у контрольных животных (выигрыш 42 суток; р=0,0001) или мышей, которые получали одно антитело (9F7-F11/пертузумаб относительно 9F7-F11 р=0,0013; 9F7-F11/ пертузумаб относительно пертузумаба р=0,0355) (Фиг. 12А). Наконец, комбинация Ab против HER3 9F7-F11 и пертузумаба была значительно эффективнее, чем композиция пертузумаб/трастузумаб с более продолжительным средним временем выживания у животных, обработанных комбинацией 9F7-F11/пертузумаб (42 суток), чем у животных, обработанных комбинацией пертузумаб/трастузумаб (13 суток) (Фиг. 12Б). В своей совокупности данные результаты показали, что комбинированная терапия с использованием неконкурентного в отношении NRG аллостерического Ab против HER3 9F7-F11 и пертузумаба против HER2 является более эффективной в HER2low опухолях, чем комбинированная терапия с использованием двух НЕР2-специфичных антител.
Пример 9: Нокаут HER3 подавляет эффективность 9F7-F11 in vitro у мышей, которым ксенотрансплантировали опухоль NRG-зависимого рака предстательной железы ВХРС3
На основе работы Lee-Hoeflich et al. (2008) два коротких шпилечных олигонуклеотида выбирали для нокдауна уровня мРНК HER3, как описано в обосновывающих материалах и методах. Контрольный вектор (shCTRL) pSIREN-shLuc был любезно предоставлен L. Le Cam и ранее описан (Le Cam et al., 2006). pSIREN-shHER3 и pSIREN-shLuc, содержащие ген устойчивости к пуромицину, кодирующий пуромицин N-ацетил трансферазу, затем трансфицировали в амфотропную упаковывающую линию клеток AmphoPack-293 (Clontech). Спустя 2 суток, супернатанты, содержащие вирусные частицы с дефектной репликацией, собирали и использовали для инфицирования клеток ВхРС3. Селекцию с использованием антибиотика (10 мкг/мл пуромицина) начинали, спустя двое суток. После 7 суток селекции клетки субклонировали и отбирали на основе отсутствия эндогенной экспрессии белка HER3. Самкам бестимусных мышей возраста шесть недель, приобретенным в Harlan (Le Malcourlet, Франция), в правый бок подкожно инъецировали родительские shHER3 (3,5×106) или контрольные shLuc ВхРС-3 клетки (4,5×106), как описано выше. Мышей, несущих опухоли, случайным образом распределяли в разные экспериментальные группы (по меньшей мере 6 животных/группа), когда опухоли достигали объема 100 мм3, и затем интраперитонеально обрабатывали 10 мг/кг 9F7-F11 дважды в неделю в течение 4 недель (Q3D-4W).
Для подтверждения связи между экспрессией HER3 и терапевтической эффективностью 9F7-F11 in vivo мышам ксенотрансплантировали клетки shHER3 или shCTRL ВхРС-3 (Фиг. 13А). Согласно in vitro данным авторов изобретения, неконкурентное в отношении NRG-аллостерическое антитело против HER3 9F7-F11 значительно ингибировало рост ксенотрансплантатов опухолей shCTRL ВхРС-3, по сравнению с необработанными контролями (р<0,0001 и р=0,0015) (Фиг. 13А). Напротив, значимой регрессии роста опухоли не наблюдали у мышей, которым ксенотрансплантировали раковые клетки shHER3 ВхРС-3, и обработанных Ab 9F7-F11, по сравнению с необработанными контролями (Фиг. 13А). В конце эксперимента экспрессию HER3 все еще подавляли в ксенотрансплантатах опухолей shHER3 ВхРС-3, выделенных из обработанных мышей (Фиг. 13Б). Данные результаты указывают на то, что нокдаун HER3 in vivo подавляет терапевтическую эффективность неконкурентного в отношении NRG аллостерического антитела против HER3 9F7-F11.
Ссылки:
По всему объему данной заявки в разных ссылках описан современный уровень техники, к которому принадлежит данное изобретение. Описания данных ссылок включены в настоящее описание в качестве ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| Мутантное полностью гуманизированное антитело против HER2 и кодирующий ген и их применение | 2015 |
|
RU2639531C1 |
| НОВЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2627185C1 |
| ИНГИБИТОР ИММУНОСУПРЕССИИ, СВЯЗАННЫЙ С РАКОМ | 2018 |
|
RU2805232C2 |
| ВВЕДЕНИЕ ФИКСИРОВАННЫХ ДОЗ HER-АНТИТЕЛ | 2005 |
|
RU2438705C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С ДОМЕНОМ II HER2, И ЕГО КИСЛЫЕ ВАРИАНТЫ | 2009 |
|
RU2543664C2 |
| ТЕРАПИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, РЕЗИСТЕНТНОЙ К ПРЕПАРАТАМ НА ОСНОВЕ ПЛАТИНЫ | 2005 |
|
RU2403065C2 |
| БИСПЕЦИФИЧНЫЕ АНТИ-HER2/АНТИ-HER3 АНТИТЕЛА | 2016 |
|
RU2653443C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ, ВЫЗЫВАЮЩИХ КОМПЛЕМЕНТ-ЗАВИСИМУЮ ЦИТОТОКСИЧНОСТЬ | 2015 |
|
RU2698205C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-R[альфа] ДОМЕНА SUSHI | 2012 |
|
RU2644671C2 |



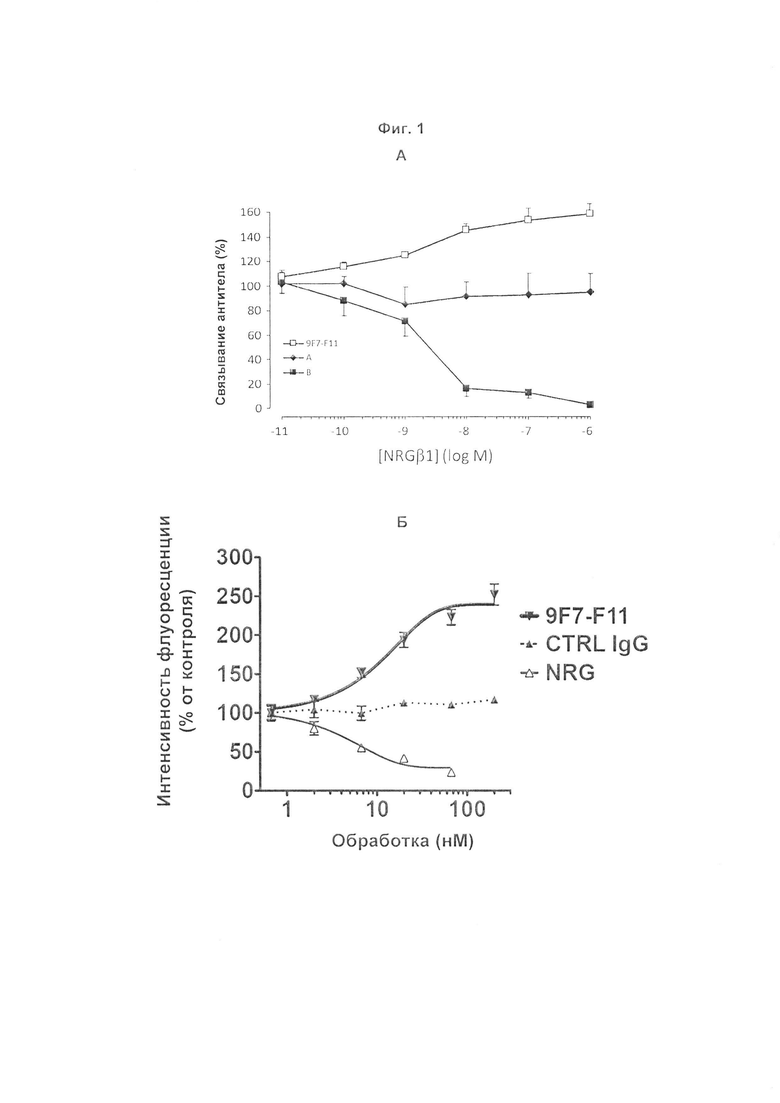
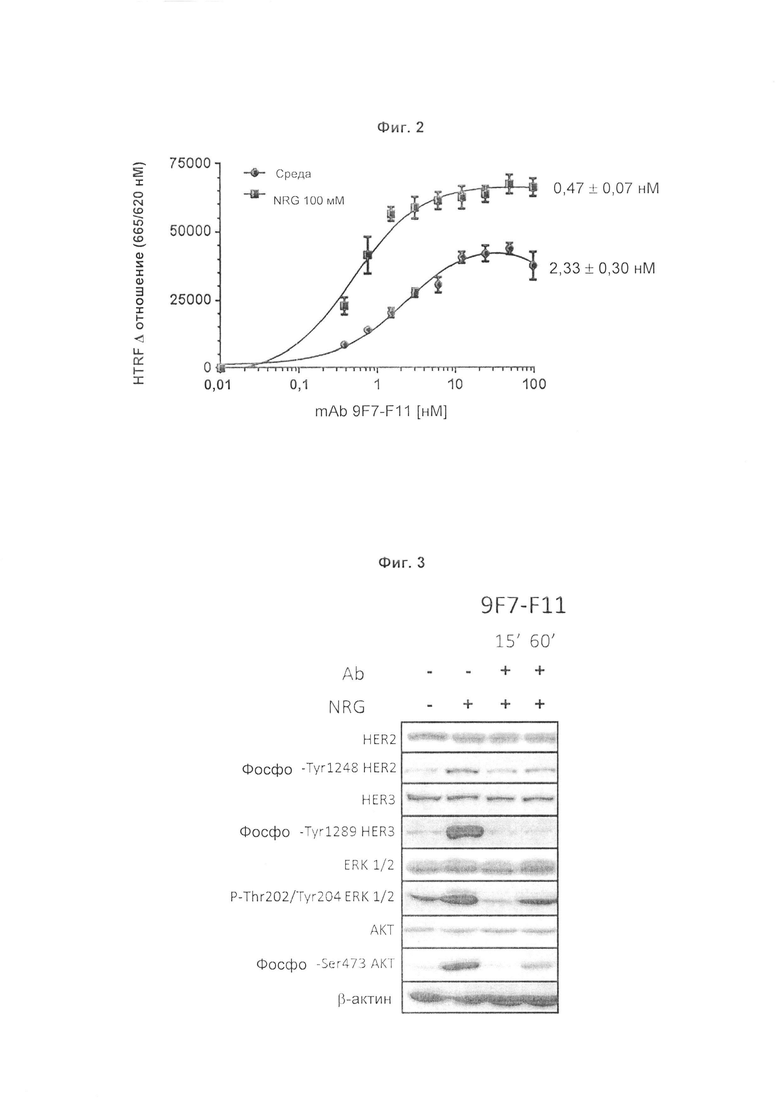
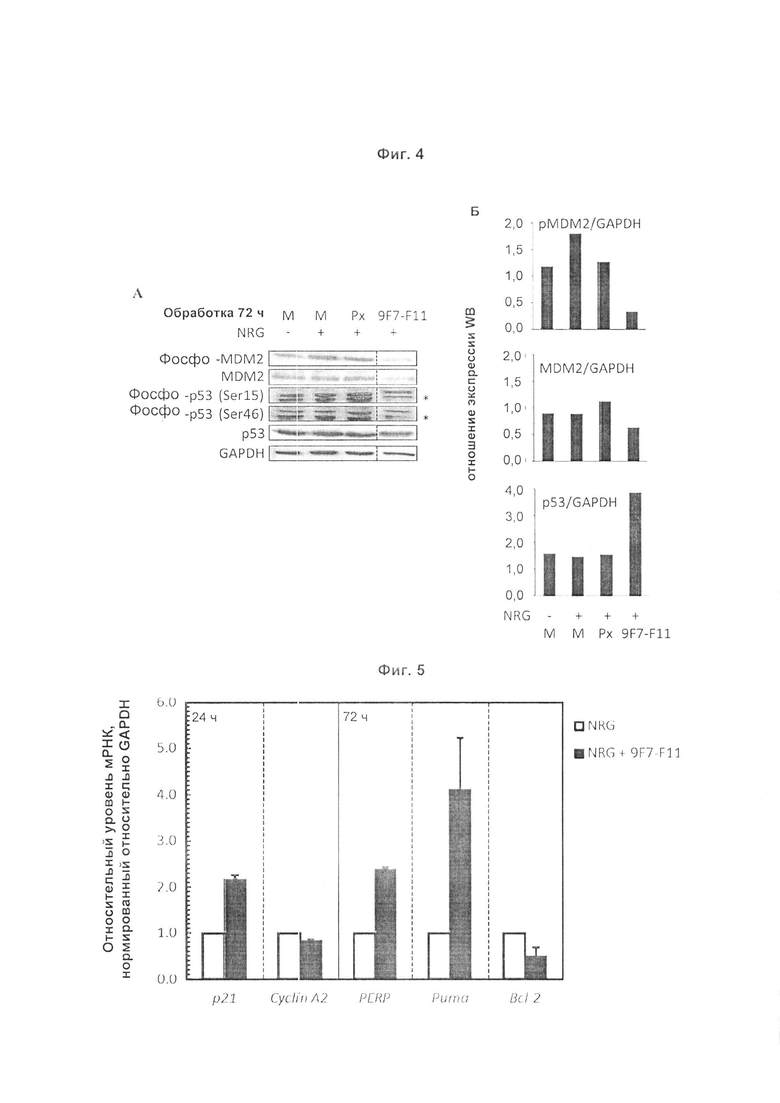
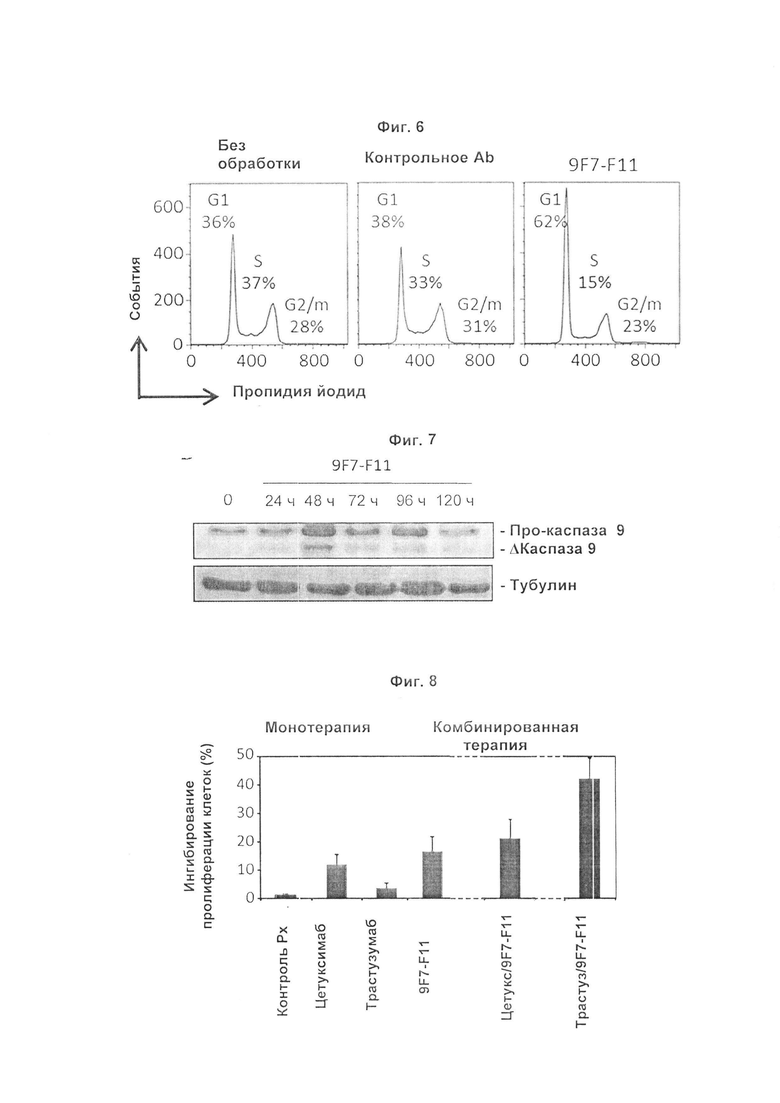
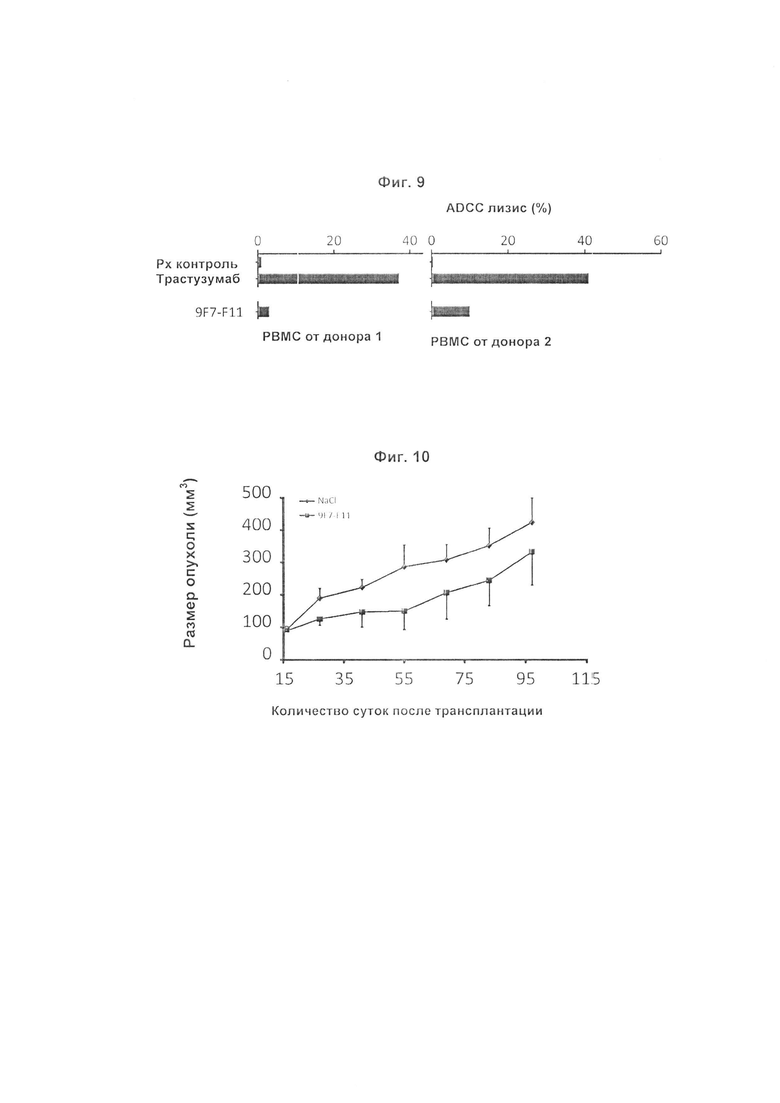
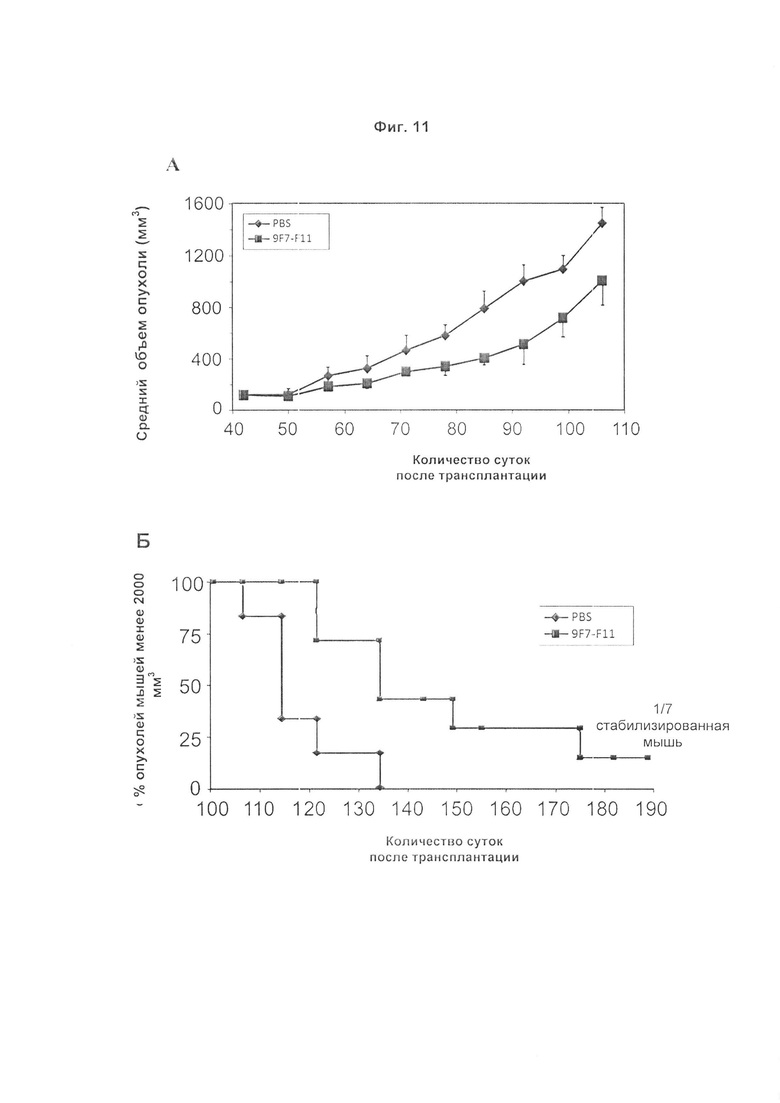
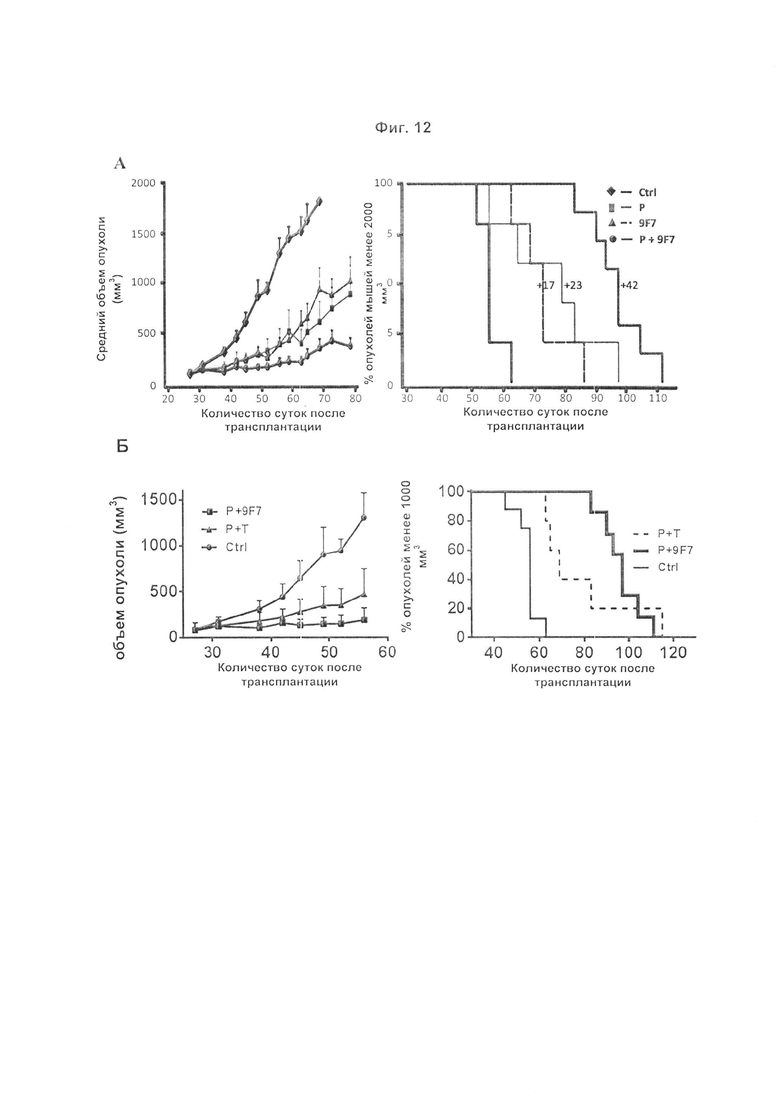
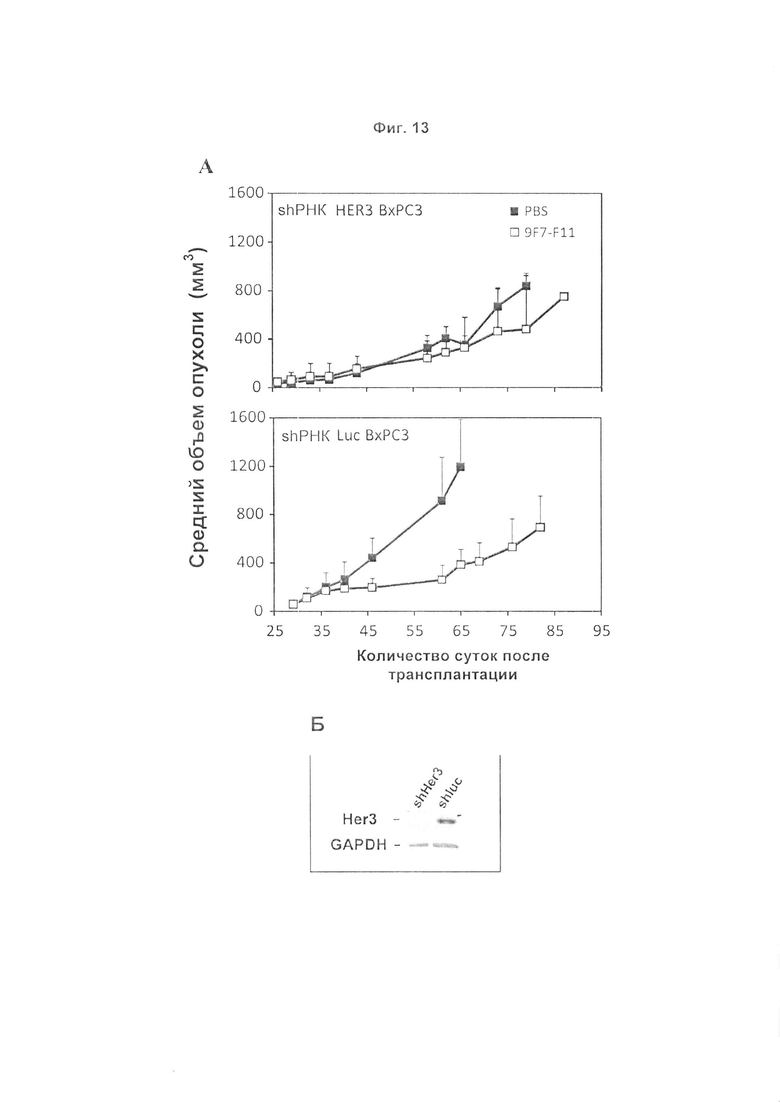
Изобретение относится к иммунологии. Предложено неконкурентное в отношении нейрегулина (NRG) аллостерическое антитело против человеческого HER3 и его фрагмент, а также кодирующая нуклеиновая кислота, вектор, клетка-хозяин, фармацевтическая композиция и способ лечения рака. Данное изобретение может найти дальнейшее применение в диагностике и терапии. 8 н. и 7 з.п. ф-лы, 13 ил., 2 табл., 9 пр.
1. Неконкурентное в отношении нейрегулина аллостерическое антитело против человеческого HER3, содержащее вариабельную область тяжелой цепи, содержащую SEQ ID NO:2 в области H-CDR1, SEQ ID NO:3 в области H-CDR2 и SEQ ID NO:4 в области H-CDR3; и вариабельную область легкой цепи, содержащую SEQ ID NO:6 в области L-CDR1, SEQ ID NO:7 в области L-CDR2 и SEQ ID NO:8 в области L-CDR3.
2. Антитело по п. 1, где вариабельная область тяжелой цепи указанного антитела имеет аминокислотную последовательность, представленную как SEQ ID NO: 1, и/или вариабельная область легкой цепи имеет аминокислотную последовательность, представленную как SEQ ID NO: 5.
3. Антитело по п. 1, представляющее собой химерное антитело, предпочтительно химерное мышиное/человеческое антитело.
4. Антитело по п. 1, представляющее собой гуманизированное антитело.
5. Неконкурентный в отношении нейрегулина (NRG) аллостерический фрагмент антитела по любому из пп. 1-4 против человеческого HER3, выбранный из группы, состоящей из Fv, Fab, F(ab’)2, Fab’, dsFv, scFv, sc(Fv)2 и диател.
6. Фрагмент по п. 5, содержащий цепь VL и VH.
7. Нуклеиновая кислота, кодирующая антитело по любому из пп. 1-4 или фрагмент по п. 5 или 6.
8. Нуклеиновая кислота, кодирующая тяжелую цепь и легкую цепь моноклонального антитела по любому из пп. 1-4.
9. Нуклеиновая кислота по п. 8, включающая SEQ ID NO:9 или SEQ ID NO:10.
10. Экспрессионный вектор, предназначенный для введения подходящему хозяину, содержащий нуклеиновую кислоту по п. 8 или 9.
11. Клетка-хозяин для экспрессии антитела по любому из пп. 1-4 или его фрагмента по п. 5 или 6, содержащая нуклеиновую кислоту по п. 8 или 9, или вектор по п. 10.
12. Фармацевтическая композиция для введения пациенту-реципиенту для лечения HER3-экспрессирующих раковых заболеваний, содержащая терапевтически эффективное количество антитела по любому из пп. 1-4 или его фрагмента по п. 5 или 6.
13. Антитело по любому из пп. 1-4 или его фрагмент по п. 5 или 6 для применения в качестве лекарственного средства.
14. Способ лечения рака у субъекта, включающий введение субъекту антитела по любому из пп. 1-4 или его фрагмента по п. 5 или 6.
15. Антитело по любому из пп. 1-4 или его фрагмент по п. 5 или 6 для применения в диагностике рака.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| LAZREK Y | |||
| et al., "Anti-HER3 domain 1 and 3 antibodies reduce tumor growth by hindering HER2/HER3 dimerization and AKT-induced MDM2, XIAP, and FoxO1 phosphorylation", NEOPLASIA, March 2013, 15(3):335 - 347 | |||
| SITHANANDAM G., ANDERSON L.M., "The ERBB3 receptor in cancer and cancer gene therapy." Cancer gene therapy, 2008, 15: 413-448 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2019-10-24—Публикация
2013-11-07—Подача