Предпосылки создания изобретения
Сахарный диабет - хроническое метаболическое нарушение, вызванное неспособностью организма вырабатывать достаточное количество гормона инсулина, что приводит к снижению способности организма усваивать глюкозу. Такая неспособность ведет к гипергликемии, т.е. избыточному содержанию глюкозы в крови. Устойчивая гипергликемия и/или гипоинсулинемия связаны с различными серьезными симптомами и долговременными угрожающими жизни осложнениями, такими как обезвоживание, кетоацидоз, диабетическая кома, сердечно-сосудистые нарушения, хроническая почечная недостаточность, повреждение сетчатки и повреждение нервов с риском ампутации конечностей. Поскольку восстановить выработку эндогенного инсулина пока невозможно, необходима постоянная терапия для обеспечения непрерывного контроля гликемии, чтобы концентрация глюкозы в крови всегда оставалась в пределах нормы. Такой контроль гликемии достигается путем регулярного введения в организм пациента инсулина извне с целью снижения повышенной концентрации глюкозы.
Эндогенные биологические препараты, такие как инсулин, часто вводятся в виде смеси быстродействующих препаратов и препаратов с промежуточной длительностью действия посредством многократных ежедневных инъекций с помощью шприца для подкожного введения. Обнаружено, что достижимая таким способом степень контроля гликемии ниже оптимальной, так как подобная доставка препарата отличается от физиологической выработки гормона, когда гормон поступает в кровь с меньшей скоростью и на протяжении более длительного времени. Улучшить контроль гликемии возможно с помощью так называемой интенсивной гормональной терапии, основанной на многократных ежедневных инъекциях, включающих в себя одну или две инъекции гормона длительного действия в сутки для создания базальной концентрации гормона и дополнительные инъекции быстродействующего гормона перед каждым приемом пищи в количестве, пропорциональном объему порции пищи. Хотя инсулиновые шприцы-ручки по меньшей мере частично заменили традиционные шприцы, частые инъекции очень неудобны для пациентов, особенно тех, кто не в состоянии делать себе инъекции надлежащим образом.
С разработкой устройства для доставки лекарств лечение диабета значительно усовершенствовалось, избавив пациента от необходимости делать многократные ежедневные инъекции при помощи шприцев или инсулиновых шприцев-ручек. Устройство для доставки препарата позволяет вводить препарат способом, более близким к естественным физиологическим процессам, и может регулироваться в соответствии со стандартными или индивидуальными протоколами, чтобы добиться лучшего контроля гликемии у пациента.
Кроме того, устройства для доставки лекарств позволяют вводить их непосредственно во внутрибрюшинное пространство или внутривенно. Устройства для доставки лекарств могут быть сконструированы в виде имплантируемых устройств для установки под кожу или в виде внешних устройств с инфузионной системой для подкожных инфузий посредством чрескожного катетера, канюли или трансдермального транспорта препарата, например, через пластырь. Внешние устройства для доставки лекарств размещаются поверх одежды, прячутся под одежду или внутри нее, либо размещаются на поверхности тела и обычно управляются с помощью встроенного пользовательского интерфейса или отдельного устройства для дистанционного управления.
Для достижения приемлемого контроля гликемии необходимо периодическое измерение аналитов в крови или тканевой жидкости. Например, доставка соответствующего количества инсулина с помощью устройства для доставки лекарств требует от пациента регулярного определения концентрации аналита в его крови и ручного ввода этого значения с помощью пользовательского интерфейса для внешних насосов, который затем рассчитывает требуемое изменение протокола введения инсулина по умолчанию или текущего протокола, т.е. дозировки и времени введения, и взаимодействует с устройством для доставки препарата с целью регулировки его работы соответствующим образом. Для определения концентрации аналита в крови обычно используются устройства для эпизодического измерения, например, ручные электронные анализаторы, измеряющие тест-полоски для анализа крови ферментативным методом и вычисляющие концентрацию аналита на основании ферментативной реакции.
Кроме того, на протяжении последних 20 лет непрерывный контроль аналита применяется в сочетании с устройствами для доставки лекарств с целью управления инфузией инсулина больным диабетом с помощью механизма обратной связи. Для обеспечения возможности контроля инфузии инсулина применяются пропорционально-интегрально-дифференциальные (ПИД)-контроллеры с математической моделью взаимодействий между глюкозой и инсулином у человека. ПИД-контроллеры можно настраивать на основании простых правил метаболических моделей. Однако если конфигурировать или настроить ПИД-контроллеры на агрессивную регулировку концентрации глюкозы в крови у пациента, может произойти передозировка, превышающая установленный уровень, за которой часто следуют колебания, крайне нежелательные в контексте регуляции концентрации глюкозы в крови. Были исследованы альтернативные контроллеры. Установлено, что контроллер с прогнозирующей моделью (КПМ), применяющийся в нефтехимической промышленности и характеризующийся значительными временными задержками и системными откликами, наиболее подходит для регулировки сложных взаимоотношений между инсулином, глюкагоном и глюкозой в крови. Показано, что КПМ более устойчив, чем ПИД, так как КПМ учитывает эффекты изменений в ближайшем будущем и ограничения при определении выхода КПМ, в то время как ПИД обычно учитывает только предыдущие выходы при определении будущих изменений. В КПМ могут использоваться ограничения, например, таким образом, чтобы КПМ предотвращал выход системы из-под контроля, когда предел уже достигнут. Другим преимуществом КПМ является то, что модель в КПМ может, в некоторых случаях, теоретически компенсировать динамические изменения системы, в то время как при регулировке по принципу обратной связи, такой как ПИД-контроль, подобная динамическая компенсация невозможна.
Таким образом, КПМ можно рассматривать как сочетание регулирования по принципу обратной связи и опережающего регулирования. Однако КПМ обычно требует метаболической модели, как можно точнее имитирующей взаимоотношения между инсулином и глюкозой в биологической системе. Таким образом, из-за индивидуальных биологических различий процесс разработки и уточнения КПМ все еще продолжается; детали КПМ, изменения КПМ и математических моделей, представляющих сложные взаимодействия между глюкозой и инсулином, показаны и описаны в следующих документах.
Заявка на патент США № 7060059.
Заявки на патент США № 2011/0313680 и 2011/0257627.
Международная публикация WO 2012/051344.
Percival et al., «Closed-Loop Control and Advisory Mode Evaluation of an Artificial Pancreatic β Cell: Use of Proportional-Integral-Derivative Equivalent Model-Based Controllers», Journal of Diabetes Science and Technology, Vol. 2, Issue 4, July 2008.
Paola Soru et al., «MPC Based Artificial Pancreas; Strategies for Individualization and Meal Compensation», Annual Reviews in Control 36, pp. 118-128 (2012).
Cobelli et al., «Artificial Pancreas: Past, Present, Future», Diabetes Vol. 60, Nov. 2011.
Magni et al., «Run-to-Run Tuning of Model Predictive Control for Type 1 Diabetes Subjects: In Silico Trial», Journal of Diabetes Science and Technology, Vol.3, Issue 5, September 2009.
Lee et al., «A Closed-Loop Artificial Pancreas Using Model Predictive Control and a Sliding Meal Size Estimator», Journal of Diabetes Science and Technology, Vol.3, Issue 5, September 2009.
Lee et al., «A Closed-Loop Artificial Pancreas based on MPC: Human Friendly Identification and Automatic Meal Disturbance Rejection», Proceedings of the 17th World Congress, The International Federation of Automatic Control, Seoul Korea July 6-11, 2008.
Magni et al., «Model Predictive Control of Type 1 Diabetes: An in Silico Trial», Journal of Diabetes Science and Technology, Vol.1, Issue 6, November 2007.
Wang et al., «Automatic Bolus and Adaptive Basal Algorithm for the Artificial Pancreatic β-Cell», Diabetes Technology and Therapeutics, Vol. 12, № 11, 2010.
Percival et al., «Closed-Loop Control of an Artificial Pancreatic β-Cell Using Multi-Parametric Model Predictive Control», Diabetes Research 2008.
Все статьи или документы, процитированные в этой заявке, включены в нее во всей своей полноте посредством ссылок.
Краткое описание изобретения
Заявитель обнаружил контропродуктивный эффект некоторых способов осуществления управления на основе модели (включая КПМ), которые не позволяют учитывать влияние приема пищи или сочетания приемов пищи и ручного болюсного введения. При таком сценарии модель в КПМ может предсказать статичную устойчивую тенденцию изменения концентрации глюкозы в ближайшем будущем, даже сразу после того, как пациент перекусывает пищевым продуктом, содержащим значительное количество углеводов, или употребляет его в составе приема пищи. При таком сценарии вероятно, что прогнозирование будущей концентрации глюкозы в этой модели будет ошибочным из-за того, что модель неспособна учитывать эффекты таких пищевых продуктов. Кроме того, заявитель обнаружил, что несостоятельность этой модели может дополнительно усугубиться при таком же сценарии, но если пациент сделал себе болюсную инъекцию с учетом употребленной закуски. Поскольку модель может распознать ручное болюсное введение (благодаря конфигурации насоса), но не употребление закуски, контроллер может уменьшить или даже совершенно прекратить инфузию инсулина после ручного болюсного введения. Полагают, что такое замедление введения инсулина контроллером после болюсного введения контрпродуктивно, так как эффективно нивелирует часть введенного болюса. Исходя из обнаруженного недостатка такого контроля по принципу обратной связи, заявитель разработал решение для смягчения такого контрпродуктивного эффекта контроля по принципу обратной связи (например, КПМ).
В одном аспекте этого решения заявитель предоставляет систему для управления диабетом, включающую инфузионный насос, датчик глюкозы и контроллер. Конфигурация инфузионного насоса позволяет доставлять инсулин в организм пациента. Конфигурация датчика глюкозы позволяет измерять концентрацию глюкозы у пациента и выдавать выходные сигналы, соответствующие этой концентрации глюкозы.
Контроллер получает сигналы от по меньшей мере одного из следующего: датчика глюкозы и насоса, и имеет такую конфигурацию, чтобы посылать сигналы насосу для подачи определенного количества инсулина, вычисленного контроллером, действующим по принципу обратной связи, с использованием модели упреждающего контроля у пациента в зависимости от желаемой концентрации глюкозы, введенного количества инсулина и результата измерения глюкозы у пациента. Контроллер имеет такую конфигурацию, чтобы доставлять по меньшей мере базальное количество инсулина каждый раз, когда пациент начал ручное болюсное введение инсулина и результат измерения концентрации глюкозы соответствует по меньшей мере первому порогу на протяжении первого периода времени.
Таким образом, применяется контроллер, позволяющий доставлять по меньшей мере базальное количество инсулина каждый раз, когда пациент начал ручное болюсное введение инсулина и результат измерения концентрации глюкозы соответствует по меньшей мере первому порогу на протяжении первого периода времени. В этом аспекте первый порог может составлять около 120 мг глюкозы на децилитр крови, а первая длительность может быть от приблизительно 15 минут до приблизительно 240 минут. Кроме того, датчик глюкозы может включать по меньшей мере одно из следующего: датчик глюкозы для эпизодического измерения и датчик глюкозы для непрерывного измерения.
Еще в одном аспекте решения, разработанного заявителем, используется способ управления диабетом у пациента с помощью инфузионного насоса, контроллера и датчика глюкозы. Способ может быть реализован этапами, включающими в себя: измерение концентрации глюкозы у пациента с помощью датчика глюкозы, производящего множество измерений глюкозы; вычисление количества вводимого инсулина контроллером на основе прогнозирующей модели, который использует множество результатов измерения концентрации глюкозы для прогнозирования тенденции изменения ее концентрации на основании оценок метаболического состояния пациента, чтобы вычислить количество инсулина для введения пациенту на протяжении установленного интервала времени; определение, начал ли пациент ручное болюсное введение, когда концентрация глюкозы соответствует по меньшей мере первому пороговому значению в течение первого периода времени; и, в случае, если ответ на стадии определения «да», ограничение введения инсулина на уровне по меньшей мере базального количества. В вышеперечисленных аспектах первый порог концентрации глюкозы может включать любую концентрацию от приблизительно 80 мг глюкозы на дл крови до приблизительно 180 мг глюкозы на дл крови; первый период времени может включать любую длительность от приблизительно 15 минут до 2 часов; предустановленный интервал может включать интервал, выбранный из группы, состоящей из по существу 1 минуты, 3 минут, 5 минут, 10 минут, 15 минут, 20 минут, 30 минут и их сочетаний. В этом методе датчик глюкозы может включать по меньшей мере одно из следующего: датчик глюкозы для эпизодического измерения и датчик глюкозы для непрерывного измерения. В этом аспекте дальнейшие вычисления могут включать рекурсивное определение оценки метаболического состояния пациента по результатам измерения концентрации глюкозы у пациента примерно в реальном времени.
В дальнейшем аспекте представлен способ управления диабетом у пациента с помощью инфузионного насоса, контроллера и датчика глюкозы. Способ может быть реализован этапами, включающими в себя: измерение концентрации глюкозы у пациента с помощью датчика глюкозы, производящего множество измерений глюкозы; вычисление базальной скорости доставки для пациента; определение, начал ли пациент ручное болюсное введение, когда концентрация глюкозы соответствует по меньшей мере первому порогу в течение первого интервала времени; в случае, если ответ на этапе определения «да», ограничение скорости доставки инсулина инфузионным насосом на уровне базальной скорости; в случае, если ответ «нет», ограничение скорости доставки инсулина инфузионным насосом приблизительно нулевой скоростью; вычисление дозы инсулина на основании сдерживающих и ограничивающих стадий; и подачу насосу команды на доставку дозы инсулина, вычисленной на стадии вычисления. В вышеперечисленных аспектах первый порог концентрации глюкозы может включать любую концентрацию от приблизительно 80 мг глюкозы на дл крови до приблизительно 180 мг глюкозы на дл крови; первый период времени может включать любую длительность от приблизительно 15 минут до 2 часов; предустановленный интервал может включать интервал, выбранный из группы, состоящей из по существу 1 минуты, 3 минут, 5 минут, 10 минут, 15 минут, 20 минут, 30 минут и их сочетаний. В этом методе датчик глюкозы может включать по меньшей мере одно из следующего: датчик глюкозы для эпизодического измерения и датчик глюкозы для непрерывного измерения. Дополнительно, дальнейшие вычисления могут включать в себя рекурсивное определение оценки метаболического состояния пациента по результатам измерения концентрации глюкозы у пациента примерно в реальном времени.
В вышеупомянутых аспектах изобретения этапы определения, калькуляции, вычисления, извлечения, подсчета и/или хранения (возможно, совместно с уравнением) могут быть выполнены посредством электронной схемы или микропроцессора. Данные этапы также могут быть реализованы в форме исполняемых команд, хранящихся на машиночитаемом носителе; причем команды, при их исполнении компьютером, могут реализовывать этапы любого из указанных выше способов.
В дополнительных аспектах описания подразумеваются машиночитаемые носители, причем каждый носитель содержит исполняемые команды, которые, при их исполнении компьютером, могут реализовывать этапы любого из указанных выше способов.
Эти и другие варианты осуществления, их отличительные особенности и преимущества станут очевидными для специалистов в данной области после изучения приведенного ниже более подробного описания различных примеров осуществления настоящего изобретения в сочетании с сопутствующими рисунками, которые кратко описаны в начале заявки.
Краткое описание чертежей
Сопутствующие фигуры, включенные в настоящую заявку и составляющие ее неотъемлемую часть, иллюстрируют считающиеся на сегодня предпочтительными варианты осуществления настоящего изобретения и, в сочетании с приведенным выше общим описанием и приводимым ниже подробным описанием, призваны разъяснить отличительные особенности раскрываемого изобретения (сходными номерами указаны сходные элементы).
На фиг.1 показан пример осуществления системы для лечения диабета в схематической форме.
На фиг.2 показана инфузионная система с фиг.1, в которой контроллер насоса или монитор(-ы) для отображения результатов измерения глюкозы отделены от инфузионного насоса и монитора(-ов) для отображения результатов измерения глюкозы и в которой можно подсоединить к контроллеру сеть с целью мониторинга в реальном времени.
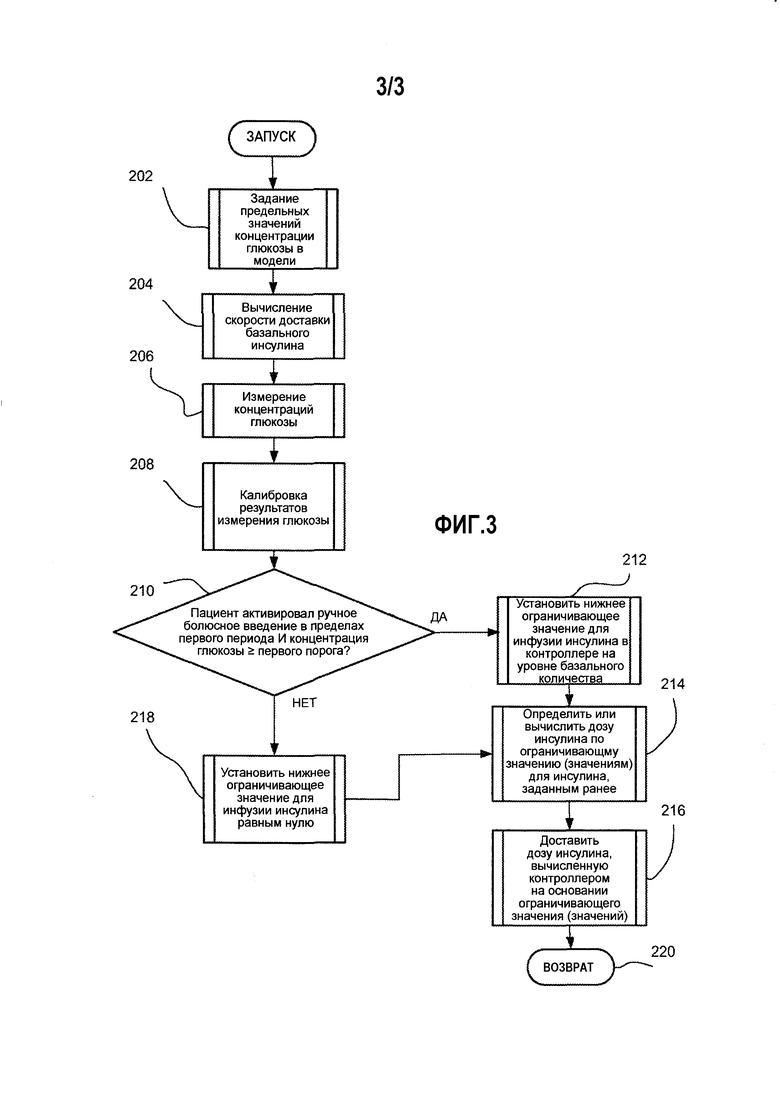
На фиг.3 показана логика, применяющаяся в контроллере согласно фиг.1 или 2.
Варианты выполнения изобретения
Приведенное ниже подробное описание следует толковать с учетом фигур, на которых одинаковые элементы на разных чертежах представлены под одинаковыми номерами. Приведенные фигуры, не обязательно выполненные в реальном масштабе, показывают выбранные варианты осуществления и не призваны ограничить сферу действия настоящего изобретения. Подробное описание раскрывает принципы настоящего изобретения с помощью примеров, которые не ограничивают настоящее изобретение. Настоящее описание позволяет специалисту в данной области реализовывать и применять настоящее изобретение, а также описывает несколько вариантов осуществления, доработок, модификаций, альтернативных вариантов и применений изобретения, включая способ осуществления изобретения, который в настоящее время считается наилучшим.
Для целей настоящего изобретения термин «приблизительно» применительно к любым числовым значениям или диапазонам указывает на приемлемый допуск на размер, который позволяет элементу или совокупности компонентов выполнять функцию, предусмотренную для них в настоящем изобретении. Конкретнее, «приблизительно» или «примерно» может означать диапазон показателей, составляющих ±10% от описываемого показателя, т.е. «около 90%» может означать показатели от 81% до 99%. Кроме этого, для целей настоящего документа термины «пациент», «оператор», «пользователь» и «субъект» относятся к любому человеку или животному и не предполагают ограничение области использования систем или способов только человеком, хотя использование предмета изобретения пациентом, который является человеком, представляет собой предпочтительный вариант осуществления изобретения. Для целей настоящего документа термин «осциллирующий сигнал» относится к сигналу(ам) напряжения или сигналу(ам) тока, которые, соответственно, меняют полярность или изменяют направление тока, или являются разнонаправленными. Также при использовании в настоящем изобретении считается, что фраза «электрический сигнал» или «сигнал» включает в себя сигнал постоянного тока, переменный сигнал или любой сигнал в пределах электромагнитного спектра. Считается, что термины «процессор», «микропроцессор» или «микроконтроллер» имеют одинаковое значение и взаимозаменяют друг друга. Используемый в настоящей заявке термин «подача сигнала оповещения» и его вариации означает выдачу текстового, звукового или визуального сигнала либо любого их сочетания для пользователя. Термин «лекарство» может включать в себя гормон, биологически активные материалы, фармацевтические препараты или другие химические вещества, вызывающие биологическую реакцию (например, гликемическую реакцию) в организме пользователя или пациента.
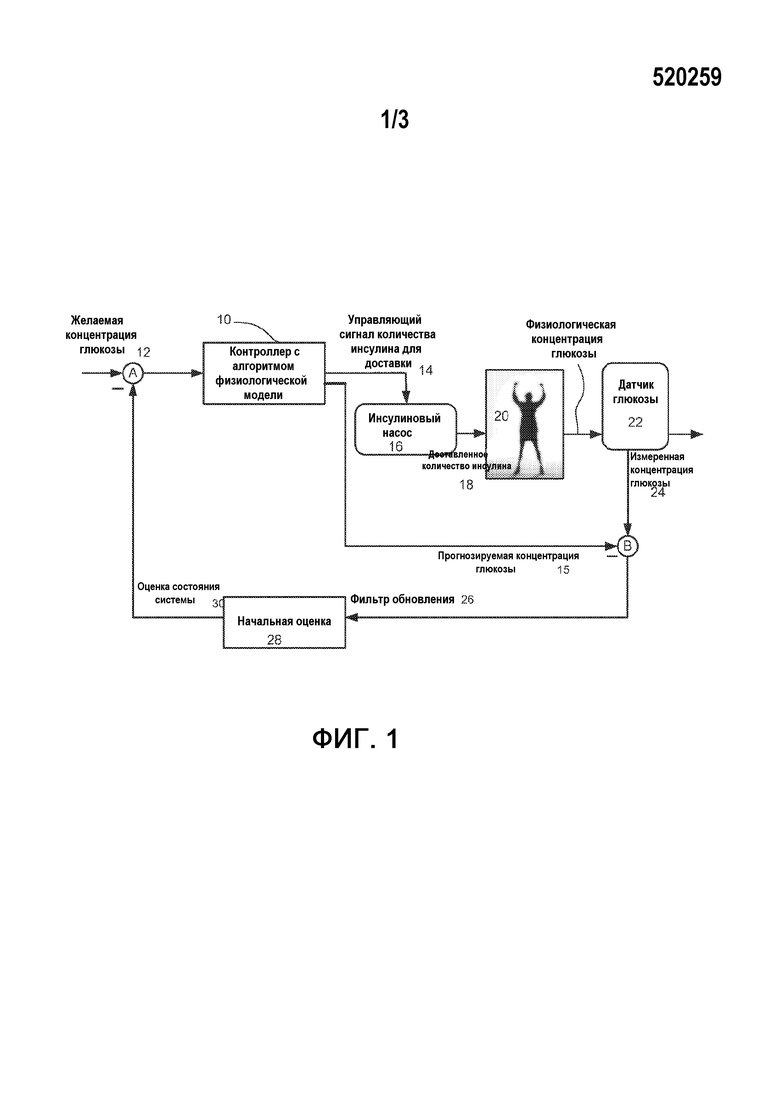
На фиг.1 показана схема системы, запрограммированной с использованием разработанного заявителем решения, чтобы предотвратить снижение эффекта системы управления на основе обратной связи ниже желаемого. В частности, на фиг.1 показан контроллер 10, получающий данные о желаемой концентрации глюкозы или диапазоне концентраций глюкозы 12 (вместе с любыми изменениями от фильтра обновлений 28). Контроллер 10 запрограммирован с помощью соответствующего КПМ для поддержания выходного значения (т.е. концентрации глюкозы) у субъекта в желаемом диапазоне.
Как показано на фиг.1, первый выход 14 контроллера с активированным КПМ может быть управляющим сигналом для инсулинового насоса 16 на доставку желаемого количества инсулина 18 живому пациенту 20 через предустановленные интервалы времени. Второй выход в форме прогнозируемого значения концентрации глюкозы 15 может использоваться в управляющем соединении B. Датчик глюкозы 22 измеряет концентрацию глюкозы у пациента 20, чтобы подать сигналы 24, отражающие фактическую или измеренную концентрацию глюкозы, на управляющее соединение B, которое учитывает различие между результатом измерения концентрации глюкозы 24 и прогнозами КПМ относительно измеренной концентрации глюкозы. На основании этого различия на фильтр обновлений 28 переменных состояний модели подается информация. Разница 26 служит параметром оценки (также фильтр обновлений 28) и позволяет оценить переменные состояния в модели, которые нельзя измерить непосредственно. Предпочтительно, когда фильтр обновлений 28 является рекурсивным фильтром в форме фильтра Кальмана с подстройкой параметров для модели. Выходной сигнал фильтра обновлений или рекурсивного фильтра 28 передается на управляющее соединение A, выход которого используется КПМ в контроллере 10 для дальнейшего уточнения управляющего сигнала 14 к насосу 16. Ниже представлен краткий обзор КПМ, использующегося в контроллере 10.
КПМ контроллера 10 включает в себя подробную модель динамики глюкозы-инсулина у человека при сахарном диабете I типа. Модель используется для прогнозирования будущих значений концентрации глюкозы и для вычисления будущих действий контроллера для приведения графика концентраций глюкозы в желаемый диапазон. КПМ могут программироваться как для дискретных, так и для непрерывных систем; контроллер устанавливается на дискретное время, при этом индекс дискретного времени (стадии) k относится к kth периоду дискретизации образца на протяжении непрерывного времени t=k⋅Ts, где Ts=5 мин - период отбора пробы. Программные ограничения гарантируют, что скорость доставки инсулина остается в пределах от минимального (например, нуль) до максимального значений. Затем вводится первая инфузия инсулина (вне соответствия шагам N). На следующем шаге,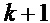 на основании нового результата измерения глюкозы и последней скорости введения инсулина, процесс повторяется.
на основании нового результата измерения глюкозы и последней скорости введения инсулина, процесс повторяется.
Алгоритм КПМ формулируется таким образом, чтобы контролировать нахождение концентрации глюкозы в безопасной зоне с нижней границей, колеблющейся в пределах 80-100 мг/дл, и верхней границей, колеблющейся в пределах приблизительно 140-180 мг/дл; далее этот алгоритм будет называться алгоритм «КПМ зоны». В целом, контроль желаемой зоны применяется к контролируемым системам, в которых отсутствует специфическое установленное значение, при этом цель контроллера заключается в поддержании контролируемой переменной (КП) в пределах установленной зоны. Контроль с целью поддержания в определенной зоне (т.е. нормогликемической зоне) очень хорошо подходит для искусственной поджелудочной железы по причине отсутствия установленного значения гликемии в естественных условиях. Кроме того, преимуществом метода контроля в определенной зоне является то, что при сохранении концентрации глюкозы в пределах зоны дополнительной коррекции не предлагается.
В реальном времени правило, регулирующее скорость доставки инсулина ID при КПМ зоны, вычисляется путем оптимизации в реальном времени, при этом в каждый момент отбора пробы оценивается скорость доставки следующей дозы инсулина. Оптимизация в каждое время отбора проб основывается на оценке метаболического состояния (концентрация глюкозы в плазме, подкожное введение инсулина), полученной из динамической модели.
С помощью признанного FDA (Управление по контролю продуктов питания и лекарств США) метаболического стимулятора UVa (Университета Вирджинии)/Падуи получена модель сниженного линейного различия, в которой устанавливается связь эффектов скорости инфузии инсулина (ID) и поступления углеводов (еды) и концентрации глюкозы в плазме. Эта модель представляет собой единичную среднюю модель для общей популяции субъектов. Модель и ее параметры фиксированы.
Модель включает передаточные функции входов второго порядка, которые применяются для генерации искусственных сведений о вводах в памяти при использовании схемы КПМ зоны для предотвращения передозировки инсулина и, следовательно, гипогликемии. Во избежание доставки чрезмерного количества инсулина при оценке любого последовательного введения инсулина необходимо учитывать инсулин, введенный в последний раз, в сравнении с длительностью действия инсулина. Однако линейная модель различия одного состояния с относительно низким порядком использует выход (гликемию) в качестве основного источника предыдущих вводов (инсулина) в памяти. В связи с несоответствием модели возможен шум, или изменение чувствительности пациента к инсулину, что может привести к доставке недостаточного или избыточного количества инсулина. Этот эффект можно снизить добавлением двух дополнительных состояний для внесенных в схему введений инсулина и приемов пищи с более длительной памятью об инсулине. В этой системе скорость доставки инсулина ID регулируется в пределах конечного интервала M управляющих действий, при этом прогнозируемые выходы G даются моделью в контрольном интервале P проб, принимая, что скорость доставки инсулина остается постоянной после времени M и до времени P. Отклонения результатов измерения концентрации глюкозы в плазме за пределы целевой зоны и скорости доставки инсулина от базальной скорости (для данного времени суток) ограничиваются параметрами Q и R, соответственно.
КПМ зоны применяется, когда специфическое установленное значение контролируемой переменной (КП) имеет низкую значимость по сравнению с зоной, задающейся верхней и нижней границами. Кроме того, в присутствии шума и несоответствия модели использование фиксированной установки не имеет практического значения. Соответствующий расчет КПМ зоны представлен в работе Maciejowski J.M. Predictive control with constraints. Harlow, UK: Prentice-Hall, Pearson Education Limited, 2002.
КПМ зоны вводится путем задания фиксированных верхней и нижней границ в качестве гибких ограничивающих значений, чтобы величины при оптимизации переключались между нулем и некоторыми окончательными значениями, когда предсказанные КП находятся внутри или вне желаемой зоны, соответственно. Прогнозируемые разности обычно определяются как различие между КП, выходящей за пределы желаемой зоны, и ближайшей границей. КПМ зона обычно делится на три разных зоны. Разрешенный диапазон является целью контроля и определяется верхней и нижней границами. Верхняя зона представляет нежелательные высокие прогнозируемые значения гликемии. Нижняя зона представляет нежелательно низкие прогнозируемые значения гликемии, что представляет зону гипогликемии или защитную область перед гипогликемией, которая считается нижней зоной предупреждения. КПМ зона оптимизирует прогнозируемую гликемию путем манипуляций с действиями, направленными на контроль инсулина в ближайшем будущем, чтобы концентрация оставалась в разрешенной зоне, ограниченной указанными значениями.
Сущность КПМ зоны заключается в целевой функциональной формулировке, которая содержит формулировку зоны. КПМ зоны, как и любые другие формы КПМ, прогнозирует будущие результаты с помощью подробной модели с использованием прошлых данных о вводах/выходах и будущих входных сигналов, которые нужно оптимизировать. Однако вместо приведения к специфическому фиксированному установленному значению попытки оптимизации направлены на поддержание или смещение прогнозируемых результатов в зону, заданную верхней и нижней границами. С помощью линейной модели различия прогнозируется динамика гликемии и проводится оптимизация, снижающая колебания гликемии в будущем за пределы зоны, определенной ограничениями и значениями, заданными в ее функции стоимости.
Для решения вышеописанной проблемы оптимизации применяется подходящее техническое программное обеспечение (например, MATLAB 'fmincon.m'), при этом к переменным, с которыми производятся манипуляции, применяются следующие жесткие ограничения (ID'): 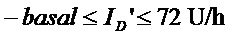
если ожидается, что базальная скорость для пациента (установленная его врачом) будет в пределах от примерно 0,6 Ед./ч до 1,8 Ед./ч.
После включения и запуска контроллера вычисления в реальном времени выполняются каждые 5 минут в соответствии со временем отбора проб для измерения датчиком глюкозы. Запуск соответствует сбору достаточного количества информации о предыдущих результатах измерения глюкозы и скорости доставки инсулина, таким образом, что модель позволяет предсказать будущие концентрации глюкозы.
Хотя значения параметров M и P значительно влияют на рабочие характеристики контроллера и в норме применяются для настройки контроллера на основе КПМ, они могут быть настроены эвристически на основании знаний системы. Правила настройки приведены на стр. 555-556 публикации Seborg DE, Edgar T.F, and Mellichamp D.A « Process dynamics and control», Hoboken, N.J: John Wiley & Sons, 2004 г. В соответствии с этими правилами, M и P могут колебаться между 2 и 10 (для М) и между 20 и 120 (для Р), предпочтительные значения M~5 и P~108. Соотношение весовых матриц выходной ошибки (Q) и весовая матрица изменения входного значения (R) могут варьировать от 10 до 1000, предпочтительное значение R/Q~500.
Прочие детали, связанные с предметом, включая оценку состояния и другие КПМ, описаны Rachel Gillis et al., «Glucose Estimation and Prediction through Meal Responses Using Ambulatory Subject Data for Advisory Mode Model Predictive Control», Journal of Diabetes Science and Technology Vol.1, Issue 6, Nov.2007, and Youqing Wang et al., «Closed-Loop Control of Artificial Pancreatic β-Cell in Type 1 Diabetes Mellitus Using Model Predictive Iterative Learning Control», IEEE Transactions on Biomedical Engineering, Vol. 57, № 2, February 2010, которые полностью включены в настоящую заявку посредством ссылки.
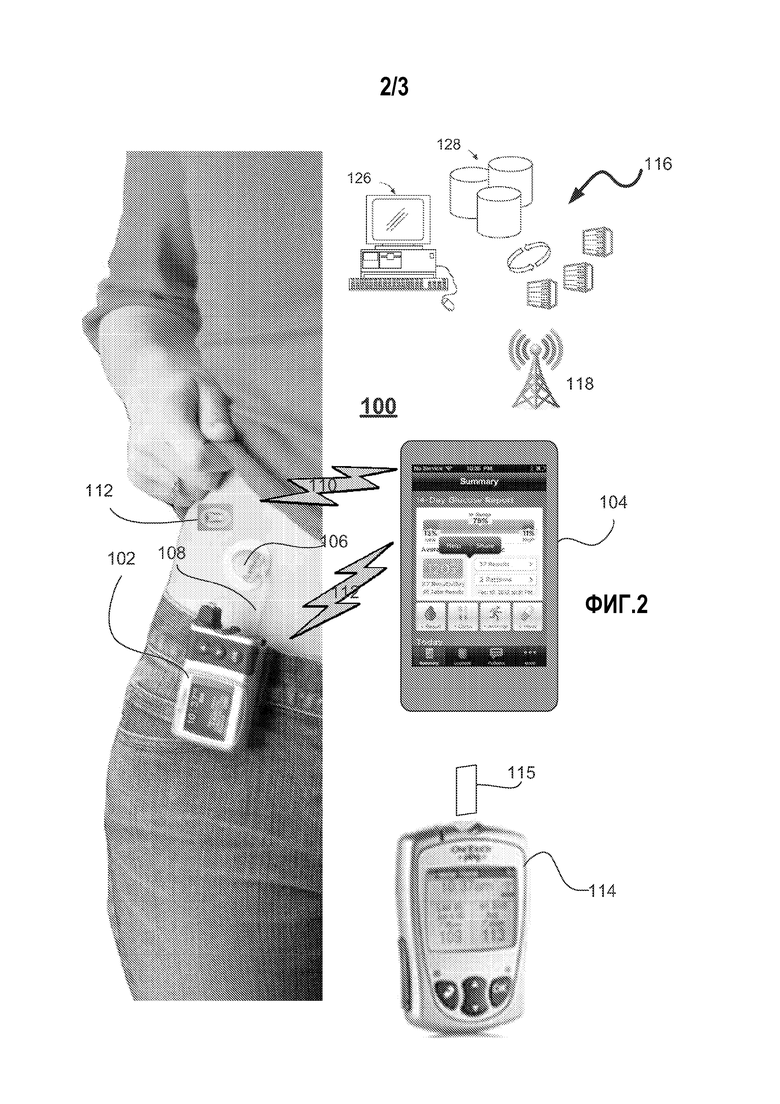
На фиг.2 показана система доставки препарата 100 в соответствии с примерным вариантом осуществления изобретения. Система доставки препарата 100 включает устройство для доставки препарата 102 и удаленный контроллер 104. Устройство для доставки препарата 102 подсоединено к инфузионной системе 106 через гибкую трубку 108.
Устройство для доставки препарата 102 выполнено с возможностью передачи данных на удаленный контроллер 104 и получения данных от него, например, посредством радиочастотной связи 112. Устройство для доставки препарата 102 также может функционировать как самостоятельное устройство со своим собственным встроенным контроллером. В одном варианте осуществления устройство для доставки препарата 102 представляет собой устройство для инфузии инсулина, а удаленный контроллер - ручной портативный контроллер. В таком варианте осуществления данные, переданные от устройства для доставки препарата 102 на удаленный контроллер 104, могут включать такую информацию, как, например, данные о доставке инсулина, информация о концентрации глюкозы в крови, базальной концентрации, болюсном введении, соотношении инсулина и углеводов или коэффициенте чувствительности к инсулину, в качестве нескольких примеров. Конфигурация контроллера 104 включает КПМ контроллер, запрограммированный таким образом, чтобы непрерывно получать результаты измерения аналита от датчика для непрерывного измерения концентрации глюкозы в крови 112. Данные, переданные от удаленного контроллера 104 на устройство для доставки инсулина 102, могут включать результаты измерения аналита и базу данных о приеме пищи, чтобы устройство для доставки препарата 102 могло вычислить количество инсулина, которое должно быть доставлено устройством для доставки 102. Альтернативно, дистанционный контроллер 104 может вычислять количество препарата для базального уровня или болюсного введения и отправлять результаты таких вычислений на устройство для доставки препарата. В альтернативном варианте осуществления измерительное устройство 114 для эпизодического измерения аналита в крови может применяться отдельно или в сочетании с датчиком 112 для непрерывного измерения концентрации глюкозы, чтобы передавать данные на контроллер 104 и/или устройство для доставки препарата 102. Альтернативно, дистанционный контроллер 104 может сочетаться с измерительным устройством 114, образуя (а) единое цельное устройство; или (b) два отдельных устройства, которые могут соединяться друг с другом для получения объединенного устройства. Каждое из устройств 102, 104 и 114 имеет подходящий микроконтроллер (не показан для краткости), запрограммированный для выполнения различных функций.
Устройство для доставки препарата 102 также может иметь конфигурацию для двунаправленной беспроводной связи с удаленной станцией для мониторинга состояния здоровья 116 посредством, например, беспроводной коммуникационной сети 118. Удаленный контроллер 104 и удаленная станция мониторинга 116 могут иметь конфигурацию, позволяющую двунаправленную проводную связь посредством, например, коммуникационной сети на основе телефонной линии. Станция удаленного мониторинга 116 может использоваться, например, для загрузки обновленного программного обеспечения на устройство для доставки препарата 102 и для обработки информации от устройства для доставки препарата 102. Примеры удаленных станций мониторинга 116 могут включать, без ограничений, персональный или сетевой компьютер 126, сервер 128 с памятью для хранения, карманный персональный компьютер, другой мобильный телефон, базовую станцию мониторинга в больнице или специальную удаленную станцию клинического мониторинга.
Устройство для доставки препарата 102 включает в себя обрабатывающую электронику, в том числе центральный процессор и элементы памяти для хранения программ управления и операционных данных, радиочастотный модуль 116 для отправки и приема радиокоммуникационных сигналов (т.е. сообщений) на/от удаленного контроллера 104, дисплей для отображения рабочей информации для пользователя, множество навигационных кнопок, позволяющих пользователю вводить информацию, аккумулятор для питания системы, предупреждения (визуальные, звуковые или тактильные) для обратной связи с пользователем, вибрационное устройство для обратной связи с пользователем, механизм доставки препарата (например, насос и приводной механизм) для вытеснения инсулина из инсулинового резервуара (например, патрона с инсулином) через боковое отверстие, к которому подключена инфузионная система 108/106, в тело пользователя.
Концентрация аналита может быть определена с помощью датчика 112 для непрерывного измерения глюкозы. Датчик 112 для непрерывного измерения глюкозы использует технологию амперометрического электрохимического измерения для определения аналита с помощью трех электродов, функционально связанных с электроникой датчика и покрытых чувствительной мембраной и биоинтерфейсной мембраной, которые присоединены с помощью зажима.
Верхние концы электродов находятся в контакте с электролитной фазой (не показана), которая представляет собой свободно плавающую жидкую фазу, расположенную между чувствительной мембраной и электродами. Чувствительная мембрана может включать фермент, например, оксидазу аналита, который покрывает электролитную фазу. В данном примере датчика используется противоэлектрод для уравновешивания тока, генерируемого при измерении вещества на рабочем электроде. В случае использования датчика, основанного на оксидазе аналита, на рабочем электроде измеряется H2O2. Ток, образующийся на рабочем электроде (и текущий через цепь к противоэлектроду) пропорционален диффузионному потоку H2O2. Соответственно, может создаваться необработанный сигнал, соответствующий концентрации аналита в организме пользователя, который, следовательно, может использоваться для оценки значимого количества аналита. Подробная информация о датчике и связанных компонентах показана и описана в заявке на патент США № 7276029, которая полностью включена в настоящую заявку посредством ссылки. В одном варианте осуществления также может использоваться датчик для непрерывного измерения аналита из системы Dexcom Seven (производитель Dexcom Inc.) в сочетании с описанными здесь примерами осуществления.
В одном варианте осуществления могут использоваться следующие компоненты в качестве системы для лечения диабета, созданной по типу искусственной поджелудочной железы: система для регулировки концентрации глюкозы OneTouch Ping® производства компании Animas Corporation, включающая по меньшей мере инфузионный насос и датчик для эпизодического измерения глюкозы; и DexCom® SEVEN PLUS® CGM производства DexCom Corporation с интерфейсом для соединения этих компонентов и программирования с помощью MATLAB®language и дополнительным аппаратным обеспечением для соединения компонентов вместе; а также алгоритмы управления в форме КПМ, автоматически регулирующие скорость доставки инсулина на основании концентрации глюкозы у пациента, прошлых результатов измерения глюкозы, прогнозируемых будущих тенденций изменения концентрации глюкозы и специфической информации о пациенте.
Заявитель обнаружил, что контроллер на основе КПМ, действующий по принципу обратной связи, не учитывает эффекты пищи; контроллер по принципу обратной связи может замедлить доставку инсулина в ситуации, когда пациент ввел инсулин болюсно вручную, что может привести к выходу концентрации глюкозы в крови пациента за желаемые пределы. Как показано на фиг.3, заявитель разработал способ 200, учитывающий ручное болюсное введение, без необходимости значительного изменения конфигурации модели, использующейся в контроллере 10, работающему по принципу обратной связи. В частности, на шаге 202 системе дается желаемый диапазон концентраций глюкозы, в соответствии с которым контроллер будет дозировать инсулин, чтобы достичь этого диапазона или поддерживать его. Система в форме процессора начинает логический процесс 200, вычисляя скорость введения базального инсулина 204 на основании по меньшей мере одной из следующих переменных: полное суточное количество инсулина, скорость введения инсулина в течение ночи, масса тела, коэффициент чувствительности к инсулину, соотношение углеводов или базальная концентрация инсулина в прошлом. Скорость доставки базального инсулина хорошо известна специалистам в этой области, как описано и показано, например, в заявке на патент США № 20120078067 «Управляющий процесс системы и модульная структура регулирования по незамкнутому и замкнутому контуру при лечении диабета»; заявке на патент США № 20100295686 под заглавием «удобство использования встроенной системы доставки инсулина»; или заявке на патент США № 20100057043 под заглавием «Способ, система и компьютерный программный продукт для обнаружения изменений физической активности по изменениям в частоте сердечных сокращений, оценки быстро изменяющихся метаболических состояний и применение регулирования по незамкнутому и замкнутому контуру для лечения диабета». Таким образом, для краткости техники определения базальной концентрации инсулина описываться не будут.
Возвращаясь к фиг.3, процессор также измеряет концентрации глюкозы на шаге 206 у пациента, чтобы определить подходящую дозу инсулина в связи с внешними факторами (возможно, неизмеренными), такими как пища, стресс, физические упражнения. В предпочтительных вариантах осуществления измерение на шаге 206 проводится с помощью датчика для непрерывного измерения глюкозы и, следовательно, через соответствующее время система может напомнить пользователю о необходимости калибровки датчика для непрерывного измерения с помощью устройства для измерения глюкозы другого типа на шаге 208. На шаге 210 логический процесс определяет, активировал ли пациент ручное болюсное введение в пределах первой длительности, и концентрация глюкозы выше или равна первому порогу. Если ответ «да», логический процесс переходит к шагу 212, на котором в контроллере устанавливается нижнее ограничительное значение инфузии, равное базальному количеству, а затем к шагу 214, чтобы установить подходящую дозу инсулина, которая будет введена на шаге 216, с помощью контроллера. Однако если ответ на шаге 210 «нет», логический процесс переходит к установке нижнего ограничивающего значения инфузии инсулина в контроллере приблизительно на 0 на шаге 218. В последующем логический процесс переходит к шагу 214, на котором контроллер определяет подходящую дозу инсулина, которая будет доставлена на шаге 216. Отмечено, что после определения подходящей дозы инсулина на шаге 214 на основании ограничивающего значения (значений) с шага 214 или шага 218 (которые выбираются в зависимости от активации ручного болюсного введения пользователем и результата измерения глюкозы) система переходит к доставке вычисленной дозы инсулина. На шаге 220 система возвращается к своей обычной работе.
В предпочтительном варианте осуществления первый порог может быть от приблизительно 80 мг глюкозы на дл крови (мг/дл) до приблизительно 180 мг/дл или эквивалентное количество в тканевой жидкости, а первая длительность может иметь любое значение от приблизительно 15 минут до приблизительно 2 ч. В большинстве предпочтительных вариантов осуществления первый порог равен примерно 120 мг/дл, а первая длительность может быть от примерно 15 минут до примерно 240 минут.
В процессе эксплуатации логика гарантирует, что при любом прогнозируемом замедлении доставки инсулина системой по причине неидентифицированного приема пищи в большом или малом объеме, сопровождаемого ручным болюсным введением, такое замедление будет смягчено тем, что пациенту будет введено по меньшей мере базальное количество инсулина. Полагают, что такая логика смягчения противодействует любому ослаблению доставки инсулина контроллером с замкнутым контуром регулирования, когда контроллер обнаруживает ручное болюсное введение. Полагают, что путем внедрения такой логики смягчения пациент получит полное преимущество за счет гарантии сохранения гликемии в желаемом диапазоне.
Хотя настоящее изобретение было описано для конкретных вариантов осуществления и иллюстрирующих их фигур, специалистам в данной области будет понятно, что настоящее изобретение не ограничивается описанными вариантами осуществления или описанными рисунками. Например, контроллер с замкнутым контуром регулирования не обязательно должен быть контроллером КПМ, а может быть, при соответствующей модификации специалистами, ПИД контроллером, ПИД контроллером с управлением с внутренней моделью (УВМ), с модельно-алгоритмическим управлением (МАУ), как обсуждается в публикации Percival et al., «Closed-Loop Control and Advisory Mode Evaluation of an Artificial Pancreatic β Cell: Use of Proportional-Integral-Derivative Equivalent Model-Based Controllers», Journal of Diabetes Science and Technology, Vol. 2, Issue 4, July 2008. Кроме этого, специалистам в данной области будет очевидно, что в тех случаях, когда описанные выше способы и этапы указывают на наступление определенных событий в определенном порядке, этот порядок для некоторых этапов может быть изменен, и что такие изменения соответствуют возможным вариантам осуществления настоящего изобретения. Кроме того, при возможности некоторые стадии могут выполняться одновременно параллельными процессами, а также последовательно согласно приведенному выше описанию. Таким образом, в той мере, в которой возможны вариации описываемого изобретения, которые соответствуют сущности описанного изобретения, или эквивалентны по содержанию пунктам формулы изобретения, настоящий патент призван охватывать все такие вариации.
Группа изобретений относится к медицинской технике. Система управления для пациентов, страдающих сахарным диабетом, содержит инфузионный насос, датчик глюкозы и контроллер, получающий сигналы по меньшей мере от одного из датчика глюкозы и инфузионного насоса. Конфигурация контроллера позволяет вычислять скорость введения базального инсулина и подавать сигналы инфузионному насосу для доставки количества инсулина, определенного контроллером с обратной связью, использующим управление на основе прогнозирующих моделей на основании желаемых концентраций глюкозы у пациента, количества введенного инсулина и результатов измерения глюкозы у пациента. Согласно изобретению контроллер сконфигурирован с возможностью устанавливать первое нижнее ограничительное значение инфузии инсулина, если контроллером определено, что пациент начал ручное болюсное введение инсулина в пределах первого периода времени, и концентрация глюкозы равна или выше первого заданного порога. Первое нижнее ограничительное значение инфузии инсулина равно вычисленной скорости введения базального инсулина. Контроллер также имеет возможность устанавливать второе нижнее ограничительное значение инфузии на 0, если определено, что пациент начал ручное болюсное введение инсулина в пределах периода времени, и концентрация глюкозы не более или равна заданному порогу. Управление на основе прогнозирующих моделей определяет количество инсулина для доставки на основе первого или второго нижнего ограничительного значения инфузии. Управление на основе прогнозирующих моделей непрерывно поддерживается системой. Раскрыты альтернативные варианты способа управления диабетом у пациента. Технический результат состоит в обеспечении управления с учетом приема пищи и ручного болюсного введения инсулина. 3 н. и 6 з.п. ф-лы, 3 ил.
1. Система управления для пациентов, страдающих сахарным диабетом, содержащая:
инфузионный насос с конфигурацией, позволяющей доставлять инсулин в организм пациента;
датчик глюкозы с конфигурацией, позволяющей измерять концентрацию глюкозы у пациента и выдавать выходные сигналы, соответствующие этой концентрации глюкозы; и
контроллер, получающий сигналы по меньшей мере от одного из: датчика глюкозы и инфузионного насоса, при этом конфигурация контроллера позволяет вычислять скорость введения базального инсулина и подавать сигналы инфузионному насосу для доставки количества инсулина, определенного контроллером с обратной связью, использующим управление на основе прогнозирующих моделей на основании желаемых концентраций глюкозы у пациента, количества введенного инсулина и результатов измерения глюкозы у пациента, причем контроллер дополнительно сконфигурирован с возможностью определять, что (а) пациент начал ручное болюсное введение инсулина, используя инфузионный насос в течение первого периода времени, и что (в) концентрация глюкозы, измеренная датчиком глюкозы, соответствует по меньшей мере первому порогу;
при этом контроллер сконфигурирован с возможностью устанавливать первое нижнее ограничительное значение инфузии инсулина, если контроллером определено, что пациент начал ручное болюсное введение инсулина в пределах первого периода времени, и концентрация глюкозы по меньшей мере равна или выше первого заданного порога, при этом первое нижнее ограничительное значение инфузии инсулина равно вычисленной скорости введения базального инсулина, и устанавливать второе нижнее ограничительное значение инфузии на 0, если контроллером определено, что пациент начал ручное болюсное введение инсулина в пределах периода времени, и концентрация глюкозы не более или равна заданному порогу, и причем управление на основе прогнозирующих моделей определяет количество инсулина для доставки на основе первого или второго нижнего ограничительного значения инфузии, и управление на основе прогнозирующих моделей непрерывно поддерживается системой.
2. Система по п. 1, в которой первый порог включает примерно 120 мг глюкозы на дл крови, а первый период включает примерно 45 минут.
3. Система по п. 2, в которой датчик глюкозы содержит по меньше мере один из датчика для эпизодического измерения глюкозы и датчика для непрерывного измерения глюкозы.
4. Способ управления диабетом у пациента с помощью инфузионного насоса, контроллера и по меньшей мере одного датчика глюкозы, при этом способ включает:
измерение концентрации глюкозы у пациента с помощью по меньшей мере одного датчика глюкозы для получения множества измерений глюкозы;
вычисление контроллером скорости введения базального инсулина для доставки инфузионным насосом на основе контроллера с прогнозирующей моделью, который использует множество измерений глюкозы для прогнозирования тенденции изменения концентрации глюкозы из оценок метаболического состояния пациента таким образом, чтобы обеспечивать вычисленное количество инсулина по отношению к вычисленной скорости введения базального инсулина, подлежащего введению пациенту в течение установленного периода времени;
определение с использованием контроллера с прогнозирующей моделью, начал ли пациент ручное болюсное введение инсулина, используя инфузионный насос, и соответствует ли при этом измеренная концентрация глюкозы по меньшей мере первому порогу глюкозы в течение первого периода времени;
если пациент начал ручное болюсное введение, в то время как измеренная концентрация глюкозы соответствует по меньшей мере первому порогу глюкозы в течение первого периода времени, то, используя контроллер с прогнозирующей моделью, ограничивают введение инсулина, подлежащего введению, на уровне первого нижнего ограничительного значения инфузии, равном вычисленной скорости введения базального инсулина; и
если пациент начал ручное болюсное введение в течение периода времени, и измеренная концентрация глюкозы не более или равна заданному порогу, то используют контроллер с прогнозирующей моделью для ограничения введения инсулина на уровне второго нижнего ограничительного значения инфузии, которое равно 0,
причем контроллер с прогнозирующей моделью определяет введение инсулина.
5. Способ управления диабетом у пациента с помощью инфузионного насоса, контроллера и по меньшей мере одного датчика глюкозы, при этом способ включает:
измерение концентрации глюкозы у пациента с помощью датчика глюкозы для получения множества измерений глюкозы;
вычисление скорости введения базального инсулина для введения инсулина пациенту на основе контроллера с прогнозирующей моделью, который использует множество результатов измерения концентрации глюкозы для прогнозирования тенденции изменения концентрации глюкозы на основании оценок метаболического состояния пациента, чтобы вычислить количество инсулина для введения пациенту на протяжении установленного интервала времени;
определение, с использованием контроллера с прогнозирующей моделью, начал ли (а) пациент ручное болюсное введение,
когда (в) измеренная концентрация глюкозы соответствует по меньшей мере уровню первого порогового значения в течение первого периода времени;
в случае, если пациент начал ручное болюсное введение с использованием инфузионного насоса, и измеренная концентрация глюкозы соответствует уровню по меньшей мере первого порога глюкозы в течение первого периода времени, с использованием контроллера с прогнозирующей моделью применение сдерживания к инфузионному насосу, чтобы доставлять инфузионным насосом минимум инсулина на уровне первого нижнего ограничительного значения инфузии, равном вычисленной скорости доставки базального инсулина;
в случае, если ответ «нет», с использованием контроллера с прогнозирующей моделью, применение ограничения к инфузионному насосу, чтобы доставлять инсулин на уровне второго нижнего ограничительного значения инфузии, соответствующем приблизительно нулю;
вычисление с использованием контроллера с прогнозирующей моделью дозы инсулина на основании указанного сдерживания и ограничения; и
подачу насосу команды на доставку дозы инсулина, вычисленной при вычислении.
6. Способ по п. 4 или 5, в котором первый порог концентрации глюкозы включает в себя любую концентрацию от примерно 80 мг глюкозы на дл крови до примерно 180 мг глюкозы на дл крови.
7. Способ по п. 6, в котором первый период времени включает любую длительность от примерно 15 минут до двух часов.
8. Способ по одному из пп. 4 или 5, в котором установленный интервал включает интервал, выбранный из группы, включающей по существу 1 минуту, 3 минуты, 5 минут, 10 минут, 15 минут, 20 минут, 30 минут и их сочетания.
9. Способ по одному из пп. 4 или 5, в котором датчик глюкозы содержит по меньшей мере один из датчика для эпизодического измерения глюкозы и датчика для непрерывного измерения глюкозы.
| US 2008183060 A1, 31.07.2008 | |||
| US 2012078067 A1, 29.03.2012 | |||
| US 2010295686 A1, 25.11.2010 | |||
| US 2008208113 A1, 28.08.2008 | |||
| Способ расшлифовки поверхностей нагрева топок паровых котлов струей пароводяной смеси | 1949 |
|
SU83694A1 |
Авторы
Даты
2018-01-23—Публикация
2013-06-18—Подача