Изобретение относится к области иммунологии и микробиологии и может быть использовано в клинической медицине, а именно для лечения неврологических заболеваний, при которых имеется выраженный иммунодефицит CD8+Т-клеток и дисбиоз (демиелинизирующие заболевания, нейродегенеративные заболевания, например - рассеянный склероз (PC)). Изобретение позволяет неинвазивным путем удлинять доклинический период, снижать выраженность неврологических симптомов (сопоставимую по эффективности с копаксоном) за счет коррекции иммунных функций. Для этого используется пероральное введение пробиотика Enterococcus feacium L3 в дозе 108 КОЕ.
Описание изобретения:
Нарушение функций иммунной системы лежит в основе многих неврологических социально значимых заболеваний - рассеянный склероз (PC), болезнь Паркинсона, болезнь Альцгеймера и др. Кроме того, почти у 70% больных отмечаются нарушения со стороны желудочно-кишечного тракта, в том числе - дисбиоз.
PC - хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Заболевание развивается в молодом и среднем возрасте (15-40 лет), известны случаи постановки этого диагноза у детей с 3-летнего возраста. Как многие аутоиммунные заболевания, рассеянный склероз чаще встречается у женщин и начинается у них в среднем на 1-2 года раньше, в то время как у мужчин преобладает неблагоприятная прогрессирующая форма течения заболевания.
Точная этиология рассеянного склероза неизвестна, предполагается роль взаимодействия генетических и ряда неблагоприятных внешних факторов (Poser, 1983). Генетическая предрасположенность к рассеянному склерозу, вероятно, обусловлена несколькими генами в системе иммунорегуляции, регуляции воспалительного ответа, в частности HLA-DRB1, IL7R (CD127), IL2RA (CD25), IL-1/IL1ra и др.
К провоцирующим факторам относят вирусные и/или бактериальные инфекции (Steiner et al., 2001; Ascherio, Munger, 2007); влияние токсических веществ и радиацию (в том числе солнечную) (обзор О' Gorman); особенности питания (обзор Lauer); стрессовые ситуации в жизни (Artemiadis et al., 2011). Все эти факторы окружающей среды влияют на качественный и количественный состав симбиотической микробиоты кишечника.
Наиболее часто триггером PC или его рецидивов являются инфекционные заболевания, поэтому на всем протяжении исследований этиологических факторов предпринимаются попытки выявить специфический возбудитель PC. В настоящее время показана связь PC не менее чем с 14 различными инфекционными агентами вирусами Эпштейна-Барр, герпеса 6 типа, ретровирусами человека, вирусами кори, краснухи, паротита, хламидиями и другими. Однако кишечная микробиота, постоянно населяющая организм человека, наряду с положительными функциями может оказывать и негативное влияние, в частности, стимулировать пролиферацию Th-17 клеток. Последние вследствие молекулярной мимикрии могут стать аутореактивными к различным белкам миелина (Westall, 2006). Как известно, именно активация аутореактивных CD4+ Т-клеток, синтез антител, способных связываться с миелином, и поляризация иммунного ответа по Th1 и Th17 путям являются принципиальными моментами для развития PC.
Регуляция иммунных функций осуществляется регуляторными Т- и В-клетками, продуцирующими противовоспалительный цитокин интерлейкин-10 (ИЛ-10), который является ключевым иммунорегуляторным цитокином, подавляющим продукцию провоспалительных цитокинов - интерферона-γ (ИФН-γ), фактора некроза опухоли-α (ФНО-α) и других. Выявлена связь между наличием полиморфизма в промоторе гена ИЛ-10 и высокой частотой встречаемости PC у жителей Европы. Препараты, стимулирующие продукцию ИЛ-10, потенциально перспективны для лечения PC.
Наиболее эффективные терапевтические подходы к лечению рассеянного склероза основаны на использовании иммуномодуляторов, препаратов интерферонового ряда (интерферон-β), а также синтетического кополимера 4-х аминокислот глутамина, лизина, аланина и тирозина - глатирамера ацетат (копаксон). Однако использование данных препаратов оказывает положительное действие только у части пациентов, сопряжено с локальными болезненными реакциями в месте инъекций, другими побочными эффектами, а также имеет высокую стоимость.
Поскольку не выявлен возбудитель заболевания, этиотропного лечения рассеянного склероза нет. С другой стороны, клинические наблюдения свидетельствуют, что не менее чем у 70% больных PC имеются нарушения со стороны желудочно-кишечного тракта, в том числе дисбиоз. Учитывая вовлеченность кишечной микробиоты в регуляцию иммунных функций организма-хозяина, можно предположить, что изменение ее качественного и количественного состава имеют ключевое значение в развитии и особенностях течения PC.
Предлагается метод лечения PC на основе применения по новому назначению пробиотического штамма Enterococcus faecium L-3 (Патент RU 2220199. Авторы - Алехина Г.Г., Суворов А.Н.), способного вызывать коррекцию дисбиотических состояний и обладающего иммуномодулирующей активностью, в частности, стимулирующего продукцию противовоспалительного цитокина - интерлейкина-10.
Enterococcus faecium L-3 задепонирован в коллекции г. Пушкин в институте Всесоюзный научно-исследовательский (ВНИИСХМ) ВАСХНИЛ и в международной коллекции Enterococcus faecium L-3=LMG P-27496 Laboratorium voor Microbiologie - Universiteit Gent K.L. Ledeganckstraat 35 B-9000 Gent Belgium. Депозитор данного штамма - ООО "Авена".
ДНК генома штамма Enterococcus faecium L-3 (номер депонирования в GenBank № SUB 167269) размером 2629318 пар оснований содержит 2717 генов. В геноме отсутствуют гены патогенности и идентифицированы гены: entA, entB, entP, enxA, enxB, кодирующие пять различных бактериоцинов (энтероцинов).
У штамма Е. faecium L-3 была проведена видовая и штаммовая идентификация по биохимическим, морфологическим и генетическим (в том числе на основе молекулярно-генетического определения нуклеотидной последовательности гена 16S РНК) признакам. Штамм характеризуются различным набором важных пробиотических и колонизационных свойств: он проявляет антибактериальную и антимикотическую активность по отношению к патогенным и условно-патогенным штаммам микроорганизмов (Staphylococcus aureus АТСС 25923, Pseudomonas aeruginosa АТСС 27853, Shigella sonnei I фазы 941, Bacillus subtillis 534, Escherichia coli 25922, Klebsiella pneumonia K1 5054, Candida albicans ATCC 885-653); способен продуцировать бактериоцины; ферментирует различные сахара и спирты без образования газа; устойчив к низким значениям рН. Штамм проявляет резистентность к ряду антибиотиков: цефаклору, цефиксиму, цефотаксиму, цефонициду, цефтазидиму, ципрофлоксацину, пефлоксацинц, миокамицину, котримаксозолу, чувствителен к ванкомицину и ампициллину.
Имеется длительный опыт применения штамма Enterococcus faecium L-3 в лечебной практике при различных патологических состояниях, обусловленных дисбиозами, у человека и животных. Штамм длительное время использовался в пищевой промышленности в СССР при производстве молочнокислых продуктов и с 1996 года стал применяться в качестве пробиотика в составе лечебных драже, лечебных молочнокислых заквасок, хлопьев с иммобилизованными бактериями, вагинальных свечей и т.д.
Преимущества штамма Е. faecium L-3 по сравнению с другими штаммами пробиотиков, содержащих энтерококки:
1. Более широкий спектр устойчивости к антибиотикам, что позволяет использовать продукты со штаммом Е. faecium L-3 параллельно с лечением антибиотиками.
2. Детально проверена устойчивость к высоким температурам, высушиванию, кислотам, желчи - данные неизвестны ни по Линексу, ни по Бифиформу.
3. Известна природа антагонизма - 2 высокоактивных бактериоцина - энтероцины А и В. Природа антагонизма у штаммов конкурентов не известна.
4. Доказано, что Е. faecium L-3 не подавляет собственные лактобациллы и бифидобактерии. Данные по конкурентам отсутствуют.
5. Доказано, что Е. faecium L-3 существенно превосходит штаммы-конкуренты по антагонизму к клебсиеллам, стафилококкам и листериям (Суворов и др., 2003; Tarasova et al., 2010; Гончар и др. 2014).
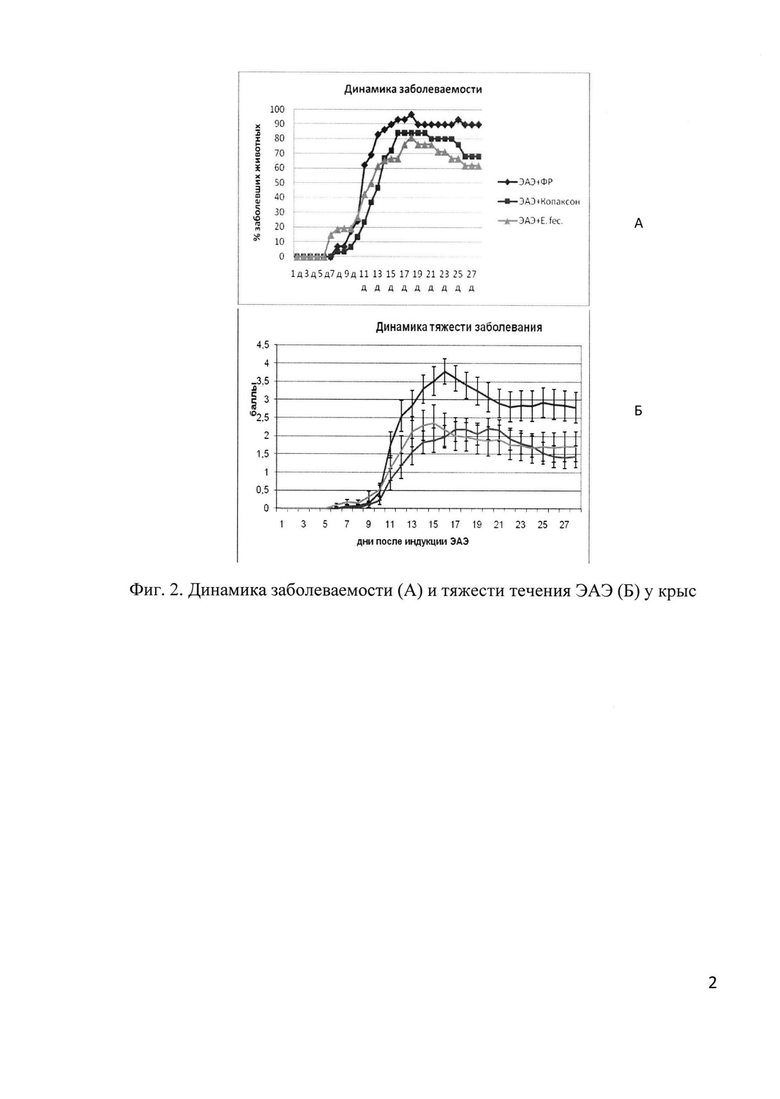
На экспериментальной модели рассеянного склероза - экспериментальном аллергическом энцефаломиелите (ЭАЭ) у крыс выявлена сопоставимая эффективность по предотвращению развития и снижению тяжести заболевания у данного пробиотика и копаксона при одинаковой длительности применения: на 19% увеличивалась доля незаболевших животных и снижалась доля тяжело болевших животных по сравнению с контрольной группой, получавшей физиологический раствор вместо лечебных препаратов (фиг. 1).
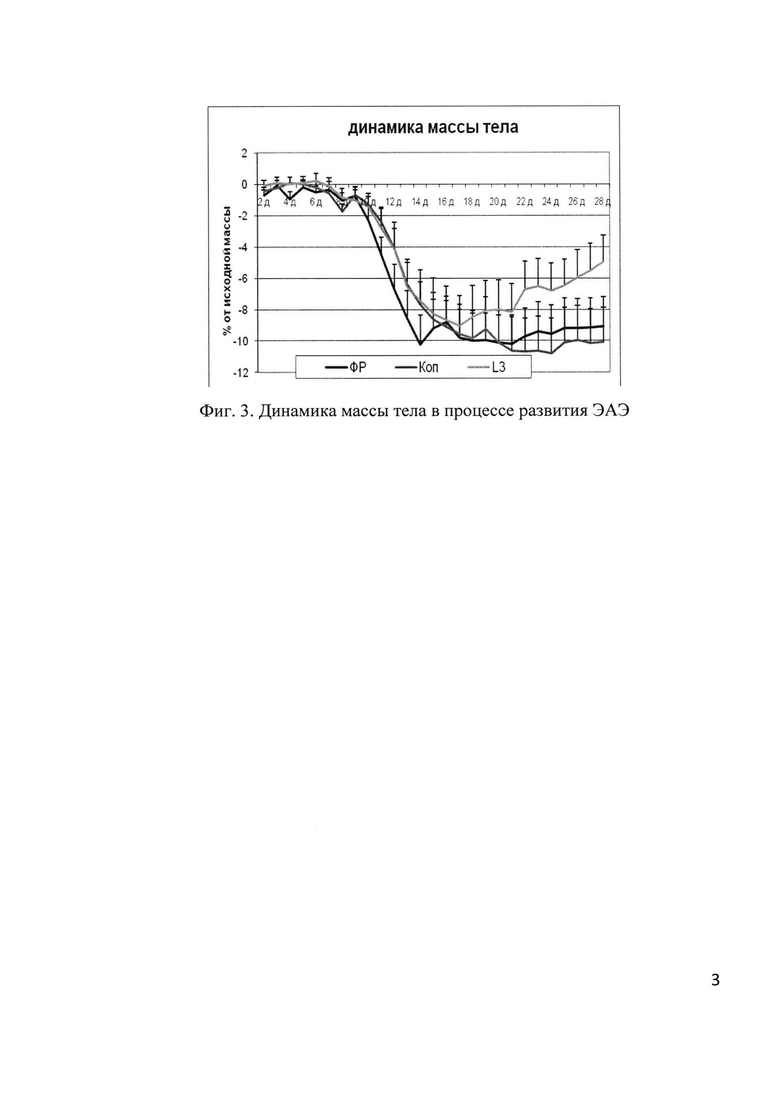
Другие оцениваемые параметры - продолжительность индуктивной фазы, длительность заболевания, клинический индекс на пике болезни и кумулятивный индекс, динамика развития заболевания не различались в группе, получавшей пробиотик и копаксон (фиг. 1 и 2). Крысы, получавшие пробиотик, более эффективно восстановили вес при выздоровлении, чем крысы других групп (фиг. 3).
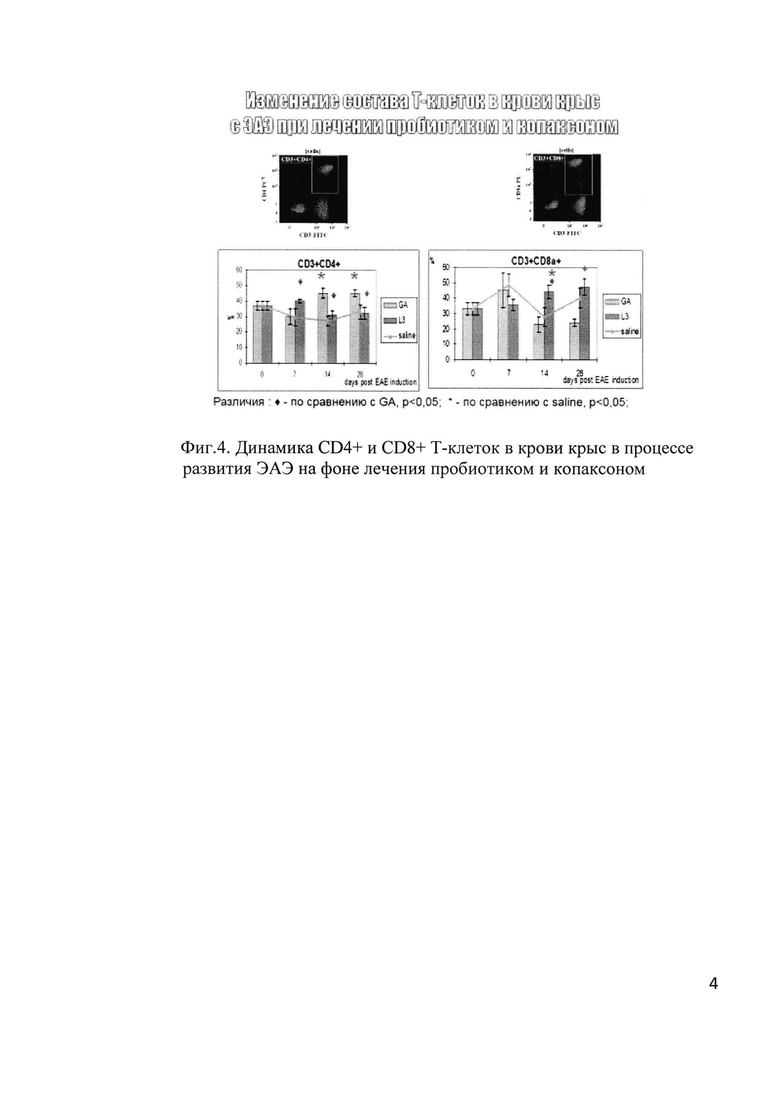
Однако пробиотик и копаксон осуществляют протекцию разными иммунорегуляторными путями (фиг. 4), что позволяет применять их последовательно: в период ремиссии - пробиотик, при обострении - копаксон. Данная схема позволяет увеличить длительность индуктивной фазы, снизить длительность и тяжесть заболевания у крыс, в конечном счете - увеличить эффективность лечения, повысить качество жизни и существенно снизить стоимость лечения.
Целью изобретения является выявление новой патогенетической мишени для коррекции при PC - кишечной микробиоты, а также выявление у пробиотика, обладающего иммуномодулирующим действием, новых свойств - снижать выраженность неврологических нарушений.
Задачей изобретения, которая определяет его назначение, является расширение арсенала пероральных неинвазивных эффективных средств для иммунокоррекции, ослабление нежелательных побочных эффектов, снижение себестоимости лечения.
Применение пробиотического штамма Enterococcus faecium L-3 в качестве нейропротективного препарата стало возможным вследствие выявления у него новых свойств - снижать тяжесть неврологических нарушений и уменьшать длительность заболевания сопоставимо с копаксоном. Преимуществом пробиотика перед копаксоном при сопоставимой эффективности является неинвазивный способ применения (перорально) по сравнению с ежедневными инъекциями.
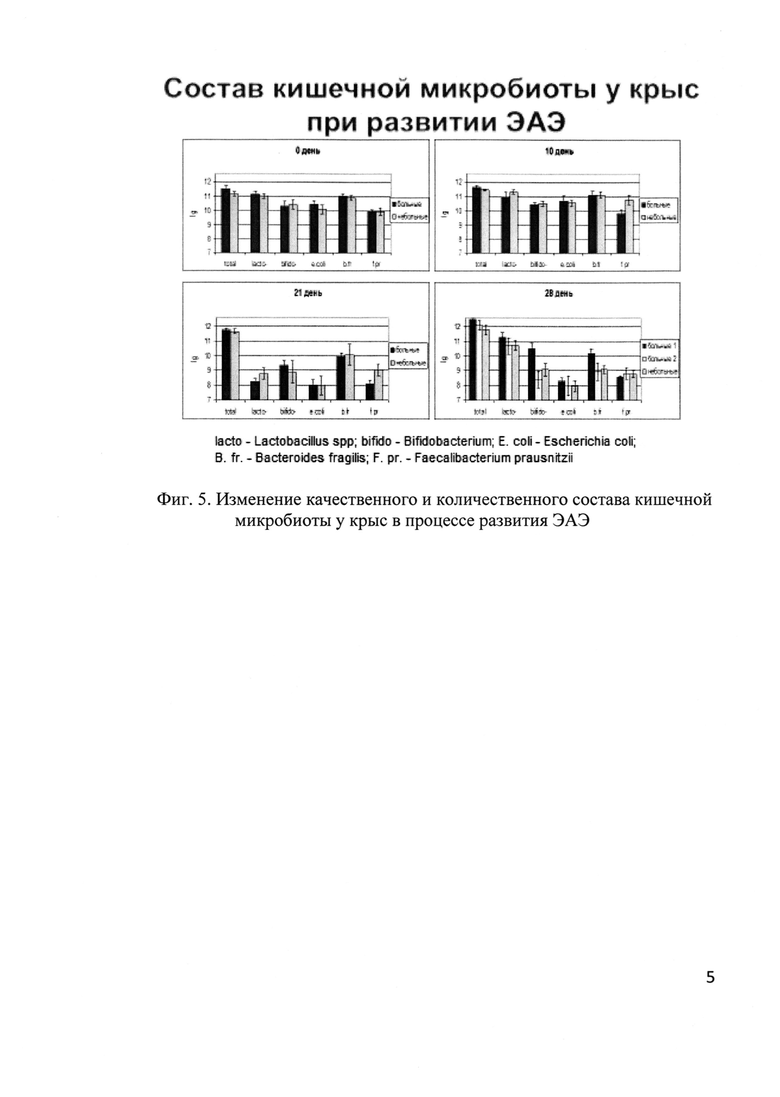
Основной технический результат, получаемый при осуществлении изобретения, заключается в создании нового подхода для иммунокоррекции при неврологических расстройствах: нормализация кишечной микробиоты, которая влияет на иммунные функции организма-хозяина (фиг. 5). Данный подход может быть применен при других нейродегенеративных заболеваниях.
Пробиотический штамм Enterococcus faecium L-3 рекомендуется использовать в стадии ремиссии для увеличения периода между обострениями. Терапия проводится короткими курсами (до месяца) с перерывами под контролем состава микробиоты кишечника и популяций циркулирующих в крови Т-клеток. При наступлении обострений можно использовать традиционную терапию копаксоном (использование пробиотика в этот период нужно прекратить). Данная схема лечения позволяет удлинить период ремиссии, уменьшить количество инъекций и оптимизировать стоимость лечения.
Литература
1. Суворов А.Н., Захаренко С.М., Алехина Г.Г. Энтерококки как пробиотики выбора. Клиническое питание. 2003. 1: 26-29.
2. Tarasova Е., Yermolenko Е., Donets V., Sundukova Z., Bochkareva A., Borschev I., Suvorova M., Ilyasov L., Simanenkov V., Suvorov A. The influence of probiotic enetrococci on the microbiota and cytokines expression in rats with dys-biosis induced by antibiotics. Beneficial Microbes. 2010. 1 (3): 265-27019.
3. Способ прогнозирования успешности профилактики инфекционных осложнений у недоношенных детей (патент РФ №2502995). Автор(ы): Гончар Наталья Васильевна (RU), Алехина Людмила Алексеевна (RU), Суворов Александр Николаевич (RU), Григорьев Степан Григорьевич (RU). 2014.
4. Alcina A., Fedetz М., Ndagire D., Fernandez О., Leyva L., Guerrero M., Arnal C., Delgado C., Matesanz F. The T244I variant of the interleukin-7 receptor-alpha gene and multiple sclerosis. Tissue Antigens, 2008. 72: 158-161.
5. Artemiadis A.K., Anagnostouli M.C., Alexopoulos E.C. Stress as a risk factor for multiple sclerosis oncet or relapse: a systematic Rewiew. Neuroepidemiology. 2011. 36: 109-120.
6. Ascherio A., Munger K.L. Environmental risk factors for multiple sclerosis. Part I: The role of infection. Ann Neurol, 2007, 61: 288-299.
7. Caillier S.J., Ban M., Goris A., Barcellos L.F. et al. Interleukin 7 receptor alpha chain (IL7R) shows allelic and functional association with multiple sclerosis. Nat. Genet, 2007. 39: 1083-1091.
8. Gregory S.G., Schmidt S., Seth P., Oksenberg J.R., Hart J., Prokop A., Lund-mark F., Duvefelt K., Iacobaeus E., Kockum I., Wallstrom E., Khademi M., Oturai A., Ryder L.P., Saarela J., Harbo H.F. et al. Variation in interleukin 7 receptor alpha chain (IL7R) influences risk of multiple sclerosis. Nat. Genet., 2007. 39: 1108-1113.
9. Lauer K. Notes on the epidemiology of multiple sclerosis, with special reference to dietary habits. Int. J. Mol. Sci. 2014. 15: 3533-3545.
10. O'Gorman C., Lucas R., Taylor B. Environmental risk factors for multiple sclerosis: a rewiew with a focus on molecular mechanisms. Int. J. Mol. Sci. 2012. 13: 11718-11752.
11. Oksenberg J.R., Barcellos L.F., Cree B.A., Baranzini S.E., Bugawan T.L., Khan O., Lincoln R.R., Swerdlin A., Mignot E., Lin L. et al. Mapping multiple sclerosis susceptibility to the HLA-DR locus in African Americans. Am. J. Hum. Genet., 2004. 74: 160-167.
12. Olerup O., Hillert J. HLA class И-associated genetic susceptibility in multiple sclerosis: a critical evaluation. Tissue Antigens, 1991. 38: 1-15.
13. Poser C.M., Paty D.W., Scheinberg L., McDonald W.I., Davis F.A., Ebers G.C., Johnson K.P., Sibley W.A., Silberberg D.H., Tourtellotte W.W. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol 1983. 13: 227-231.
14. Rubio J.P., Stankovich J., Field J., Tubridy N., Marriott M., Chapman C, Bahlo M., Perera D., Johnson L.J., Tait B.D. et al. Replication of KIAA0350, IL2RA, RPL5 and CD58 as multiple sclerosis susceptibility genes in Australians. Genes Immun., 2008. 9: 624-630.
15. Schrijver H.M., Crusius J.B.A., Uitdehaag B.M.J., Garcia Gonzalea M.A., Kostense P.J., Polman C.H., Pena A.S. Association of interleukin-1β and interleukin-1 receptor antagonist genes with disease severity in MS. Neurology. 1999. 52: 595-599.
16. Steiner I., Nisipianu P., Wirguin I. Infection and the etiology and pathogenesis of multiple sclerosis. Current Neurol. Neurosci Rep. 2001. 1: 271-276.
17. Teutsch S.M., Booth D.R., Bennetts B.H., Heard R.N., Stewart G.J. Identification of 11 novel and common single nucleotide polymorphisms in the interleukin-7 receptor-alpha gene and their associations with multiple sclerosis. Eur. J. Hum. Genet., 2003. 11: 509-515.
18. Weber F., Fontaine В., Cournu-Rebeix I., Kroner A., Knop M., Lutz S., Mul-ler-Sarnowski F., Uhr M., Bettecken Т., Kohli M. et al. IL2RA and IL7RA genes confer susceptibility for multiple sclerosis in two independent European populations. Genes Immun., 2008. 9: 259-263.
19. Westall F.C. Molecular mimicry revisited: Gut bacteria and multiple sclerosis. J. Clin. Microbiol., 2006. 44 (6): 2099-2104.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ приготовления аутопробиотика на основе анаэробного консорциума бактерий | 2018 |
|
RU2734896C2 |
| СПОСОБ ТЕРАПИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА С ИСПОЛЬЗОВАНИЕМ АУТОПРОБИОТИКОВ | 2024 |
|
RU2839320C1 |
| Способ уменьшения выраженности немоторных симптомов у пациентов, страдающих болезнью Паркинсона | 2019 |
|
RU2734718C1 |
| СПОСОБ ТЕРАПИИ РЕМИТТИРУЮЩЕГО РАССЕЯННОГО СКЛЕРОЗА | 2012 |
|
RU2523058C2 |
| Способ монотерапии гастрита, ассоциированного с инфекцией Helicobacter pylori | 2020 |
|
RU2758246C1 |
| СПОСОБ ЛИМФОСТИМУЛЯЦИИ И ИММУНОМОДУЛЯЦИИ ПРИ РАССЕЯНОМ СКЛЕРОЗЕ | 2003 |
|
RU2246942C2 |
| Противовоспалительная фармацевтическая композиция на основе бактериальных штаммов | 2015 |
|
RU2616899C1 |
| СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2001 |
|
RU2214839C2 |
| СПОСОБ ПОДБОРА ПРОБИОТИЧЕСКИХ И АУТОПРОБИОТИЧЕСКИХ ШТАММОВ МИКРООРГАНИЗМОВ ПО УСТОЙЧИВОСТИ К ЦИТОСТАТИКАМ ПРИ ТЕРАПИИ КОЛОРЕКТАЛЬНОГО РАКА | 2024 |
|
RU2835581C1 |
| ТЕСТ-МОДЕЛЬ ДЛЯ ИССЛЕДОВАНИЯ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ПРЕПЯТСТВУЮЩИХ ДЕМИЕЛИНИЗАЦИИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2736070C1 |

Изобретение относится к медицине и предназначено для лечения рассеянного склероза. Используют пробиотический штамм Enterococcus faecium L-3. Терапия проводится короткими курсами (до месяца) с перерывами под контролем состава микробиоты кишечника и популяций циркулирующих в крови Т-клеток. При наступлении обострений можно использовать традиционную терапию копаксоном (использование пробиотика в этот период нужно прекратить). Способ позволяет повысить эффективность лечения за счет стимуляции продукции противовоспалительного цитокина - интерлейкина-10. 5 ил.
Способ лечения рассеянного склероза путем перорального применения пробиотика Enterococcus faecium L-3.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ТЕРАПИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ, В ЧАСТНОСТИ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА | 2012 |
|
RU2491097C1 |
| TW 200716643 A, 01.05.2007 | |||
| ШПИГЕЛЬ А.С | |||
| Доказательная медицина // "Арнебия", 2004, с.40-43, 47-49 | |||
| ЮРЬЕВ К.Л | |||
| и др | |||
| Доказательная медицина | |||
| Кокрановское сотрудничество, Украинский медичний часопис, 2000, XI/XII, N6 (20), c.6. | |||
Авторы
Даты
2018-01-24—Публикация
2014-12-30—Подача