Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно к неврологии, и биотехнологии и предназначено для исследования in vitro действия лекарственных препаратов, препятствующих демиелинизации при заболевании рассеянным склерозом, с целью скрининга лекарственных препаратов, пригодных для терапевтических испытаний.
Уровень техники
Проблема рассеянного склероза (PC) остается одной из самых актуальных в неврологии ввиду распространенности заболевания среди лиц молодого дееспособного возраста (от 15 до 40 лет) и неизбежным развитием инвалидности на заключительной стадии болезни. Основной мишенью PC являются миелиновые оболочки аксонов головного и спинного мозга. За миелинизацию аксонов отвечают специализированные глиальные клетки - олигодендроциты, которые, обматывая своими длинными отростками аксоны, образуют многослойные миелиновые оболочки вокруг них. Заболевание приводит к патологической демиелинизации аксонов в белом веществе мозга с последующей демиелинизацией серого вещества, что препятствует нормальной передаче нервных импульсов и сопровождается прогрессирующей нейродегенерацией у пациентов. Патогенез заболевания до конца не выяснен. Долгое время его связывали с воспалительными и аутоиммунными процессами (Waksman В. Н., Reynolds W. Е. Multiple sclerosis as a disease of immune regulation // Exp. Biol. Med. - 1984. - Vol. 175(3). - P. 282-294; Hafler D. A. and Weine H. L. T cells in multiple sclerosis and inflammatory central nervous system diseases // Immunol. Rev. - 1987. - Vol. 100(1). - P. 307-332; Ransohoff R. M., Hafler D. A. and Lucchinetti C. F. Multiple sclerosis - a quiet revolution // Nat. Rev. Neurol. - 2015. -Vol. 11(3). - P. 134-142). Для лечения заболевания применяется иммунотерапия, однако во многих случаях и особенно при прогрессирующем развитии PC она не дает положительного результата (Friese М. A., Schattling В., Fugger L. Mechanisms of neurodegeneration and axonal dysfunction in multiple sclerosis // Nat. Rev. Neurol. - 2014. -Vol. 10(4). - P. 225-238). В некоторых случаях иммунотерапия неприменима, поскольку лекарственные препараты (например, широко используемые натализумаб и финголимод) обладают иммуноподавляющим действием, что у ряда пациентов может приводить к развитию вторичных вирусных и бактериальных инфекций (Grebenciucova Е. and Pruitt А. Infections in patients receiving multiple sclerosis disease-modifying therapies // Curr. Neurol. Neurosci. Rep. - 2017. - Vol. 17(11). - Art. 88; Khouy R. A., Karampoor S., Keyvani H. et al. The frequency of varicella-zoster virus infection in patients with multiple sclerosis receiving fingolimod // J. Neuroimmunol. - 2019. - Vol. 328. - P. 94-97). Поэтому остро стоит вопрос о совершенствовании и создании новых лекарственных средств, препятствующих демиелинизации и способствующих лечению заболевания. Работы последнего десятилетия показывают, что на фоне первичного воспаления в нервных тканях при PC возникают митохондриальные нарушения, приводящие к избыточной генерации активных форм кислорода (АФК) в митохондриях, что в конечном счете усугубляет окислительный стресс и во многом предопределяет патогенез заболевания (Witte М. Е., Geurts J. J., de Vries H. E. et al. Mitochondrial dysfunction: a potential link between neuroinflammation and neurodegeneration? // Mitochondrion - 2010. - Vol. 10(5). - P. 411-418; Sadeghian M., Mastrolia V., Haddad A. R. et al. Mitochondrial dysfunction is an important cause of neurological deficits in an inflammatory model of multiple sclerosis // Sci. Rep.- 2016. - Vol. 6. - Art. 33249; Fetisova E., Chernyak В., Korshunova G. et al. Mitochondria-targeted antioxidants as a prospective therapeutic strategy for multiple sclerosis // Curr. Med. Chem. - 2017. Vol. 24(19). -P. 2086-2114; Varhaug K. N., Vedeler C. A., Myhr К. M. et al. Increased levels of cell-free mitochondrial DNA in the cerebrospinal fluid of patients with multiple sclerosis // Mitochondrion - 2017. - Vol. 34. - P. 32-35). Ввиду этого, одним из возможных терапевтических подходов для повышения эффективности терапии PC могло бы стать использование антиоксидантов, в том числе митохондриально-направленных антиоксидантов, отличающихся одновременным сочетанием антивоспалительной и нейропротекторной активностей и высокой результативностью в чрезвычайно малых дозах. Поиск новых потенциальных лекарственных средств мог бы ускориться при наличии удобной тест-модели. Задача создания такой тест-модели складывается из 1) выбора подходящего объекта для тестирования, позволяющего проводить количественную оценку действия лекарственных средств, и 2) подбора техники приготовления биологического объекта, которая должна быть простой и малоэтапной.
Известно, что в качестве экспериментальной модели PC, как правило, используют лабораторных животных (чаще всего крысы, мыши) с индуцированным аутоиммунным энцефаломиелитом (ЕАЕ) для исследований in vivo. Исследования на животных многоэтапны и всегда сопряжены с большим объемом финансовых и технических трудностей. Этих этапов можно было бы избежать при использовании культуры клеток в качестве экспериментальной модели in vitro, позволяющей напрямую следить за мишенями заболевания вне живого организма. Такой мишенью при PC является миелинобразующая олигодендроглия, поэтому задача создания культуральной тест-модели PC с целью исследований in vitro требует, чтобы культура, образующая модель, содержала олигодендроциты. В свою очередь, задача культивирования олигодендроцитов, пригодных для тестирования, включает еще одно неотъемлемое требование, а именно, необходимость получить культуру, устойчиво, эффективно и репрезентативно синтезирующую миелин.
Начиная с первых работ, в которых удалось показать принципиальную возможность образования миелина in vitro на тканевых культурах млекопитающих, была отмечена высокая зависимость способности культур к миелинизации от многих факторов, объясняющая трудности достижения результата (Bornstein М. В. and Murray М. R. Serial observations on patterns of growth, myelin formation, maintenance and degeneration in cultures of new-born rat and kitten cerebellum // J. Cell Biol. - 1958. - Vol. 4(5). - P. 499-504). Кроме того, при последовательном переходе от тканевой культуры к смешанной клеточной и далее к чистой клеточной культуре достижение миелинизации прогрессивно затрудняется. Однако, проводить количественную оценку действия лекарственных средств на тканевой культуре затруднительно ввиду многослойности препаратов и связанного с этим неравномерного доступа действующих веществ к клеткам, а также трудностей учета числа клеток. В противоположность моделям in vivo на животных, модели PC in vitro на основе смешанных культур глиальных клеток, в состав которых входят олигодендроциты, не получили широкого развития ввиду малой разработанности методов (Kaneko S., Wang J., Kaneko M. et al. Protecting axonal degeneration by increasing nicotinamide adenine dinucleotide levels in experimental autoimmune encephalomyelitis models // J. Neurosci. - 2006. - Vol. 26(38). - P. 9794-9804).
В отличие от указанной выше работы Канеко и др., в которой исследовали опосредованное взаимодействие микроглии и нейронов, объектом рассмотрения в нашей задаче являются олигодендроциты - клетки, непосредственно отвечающие за производство миелина, - которые и должны составлять разрабатываемую модель. Ранее описанные методы получения таких моделей из глиальных тканей крысы (McCarthy К. D. and De Vellis J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue // J. Cell Biol. - 1980. - Vol. 85(3). - P. 890-902; Lehnardt S., Lachance C, Patrizi S. et al. The toll-like receptor TLR4 is necessary for lipopolysaccharide-induced oligodendrocyte injury in the CNS // J. Neurosci. - 2002. - Vol. 22(7). - P. 2478-2486; Elliott C, Lindner M., Arthur A. et al. Functional identification of pathogenic autoantibody responses in patients with multiple sclerosis // Brain - 2012. - Vol. 135(6). - P. 1819-1833) и человека (Pitt D., Nagelmeier I. E., Wilson H. C. and Raine C. S. Glutamate uptake by oligodendrocytes. Implications for excitotoxicity in multiple sclerosis // Neurology - 2003. - Vol. 61(8). - P. 1113-1120) достаточно трудоемки. Они требуют дезинтеграции тканей мозга путем механического растирания и последующего трипсинолиза или обработки другими ферментами, предусматривают проведение многих промежуточных этапов, таких как многократное центрифугирование, пропускание через фильтры, обработку антителами и серию пассажей в целях обогащения культур по определенному виду глиальных клеток. Сообщалось о нескольких системах для изучения механизма PC in vitro с использованием олигодендроцитов или смешанных клеточных культур нейронов совместно с клетками микроглии (Mitrovic В., Parkinson J. and Merrill J. E. An in vitro model of oligodendrocyte destruction by nitric oxide and its relevance to multiple sclerosis // Methods - 1996. - Vol. 10(3). - P. 501-513; Lehnardt S., Massillon L., Follett P. et al. Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway // Proc. Natl. Acad. Sci. USA - 2003. - Vol. 100(14). - P. 8514-8519). Однако, описанные модельные системы имеют ограничения ввиду сложности их приготовления.
Известен метод культивирования нервных тканей и клеток в камерах Максимова (Bornstein М. В. and Murray М. R. Serial observations on patterns of growth, myelin formation, maintenance and degeneration in cultures of new-born rat and kitten cerebellum // J. Cell Biol. -1958. - Vol. 4(5). - P. 499-504). В таких камерах малое покровное стекло с эксплантатом в капле питательной среды помещается между двух других стекол - второго покровного большего размера и предметного с лункой посередине, - где вся конструкция герметично закупоривается парафином. В таких камерах авторам впервые удалось получить миелинизацию in vitro на тканях млекопитающих, для чего ими была использована органотипическая культура эксплантов мозжечка. Метод позволил при помощи микроскопа проследить прижизненную миелинизацию волокон ткани во времени. Однако, применительно к созданию обсуждаемой нами тест-системы данный метод имеет ряд ограничений, а именно, требует специальных стекол для камер Максимова, в таких камерах затруднен газообмен, в них необходимо проводить трудоемкую смену питательной среды, что в свою очередь обуславливает необходимость в дополнительном обслуживающем персонале. По этим же причинам в такие культуральные камеры затруднительно вводить добавки, которые предназначены для испытания в тест-системе.
Наиболее близким к заявляемому является способ культивирования нервной ткани на стеклах в чашках Петри (чашечный метод) для получения органотипических эксплантатов нервной ткани, пригодных для гистологического и электронно-микроскопического исследования (Viktorov I. V. and Kenarskaya Е. М. A device for nerve tissue cultivation // Bull. Exp. Biol. Med. - 1975. - Vol. 80. - no. 2. - P. 991-992). В методике используется культивирование эксплантатов тканей мозга в одной чашке Петри диаметром 90 мм одновременно на 8 покровных стеклах, каждое из которых помещено на дополнительные подставки, приклеенные на дно чашки Петри. Такая конструкция не позволяет сохранить независимость условий как для культивирования образцов, так и для тестирования лекарственных соединений. Вариант этой методики, где используются чашки Петри диаметром 40 и 35 мм, использован для технически сложного получения диссоциированной путем трипсинолиза клеточной культуры из эксплантатов гиппокампа, перегородки и неокортекса эмбрионов мыши (Khaspekov L. G., Viktorov I. V. Action of quinolinic acid on neurons in dissociated cell cultures from various brain structures // Bull. Exp. Biol. Med. - 1988. - Vol. 106(1). - P. 1036-1039; Khaspekov L. G., Lyzhin A. A., Victorov I. V. et al. Hypoxic and posthypoxic neuronal injury in hippocampal cell culture: attenuation by lipophylic antioxidant U-18 and superoxide dismutase // Int. J. Neurosci. - 1995. -Vol. 82(1-2). -P. 33-45). В описанных работах исследовали защитный эффект искусственного антиоксиданта U-18 на нейронах в условиях гипоксии и реоксигенации. Однако, все вышеприведенные варианты чашечного метода не позволяют исключить возможное влияние дополнительных элементов конструкции (клеящих материалов) на результаты эксперимента, оценка действия которых требует дополнительных контрольных экспериментов, осложняющих трактовку результатов. Следует отметить, что разработка чашечного метода для получения монослойной первичной культуры олигодендроцитов с устойчивой миелинизацией и в силу этого пригодной для разработки тест-модели заболевания PC, также как и описание простого метода количественной оценки демиелинизации в доступных источниках не были описаны до настоящего времени.
Таким образом, существующие методы приготовления нейроглиальных клеточных культур являются технически непростыми и в полной мере не подходят для создания тест-модели с целью скрининга лекарственных препаратов на основе миелинобразующей культуры олигодендроцитов.
Задача скрининга лекарственных препаратов, препятствующих демиелинизации при заболевании PC и пригодных для терапевтических испытаний, требует создания простой в исполнении тест-модели, обеспечивающей быструю количественную оценку содержания миелина в олигодендроцитах с высокой степенью достоверности (р ≤ 0,05).
Технической проблемой являются технически сложные способы выращивания и ведения нейроглиальных клеточных культур, что не позволяет использовать их в качестве тест-моделей для скрининга лекарственных препаратов.
Техническая проблема решается созданием культуральной модели PC in vitro с возможностью быстрого изучения и скрининга лекарственных препаратов, препятствующих демиелинизации в ходе развития заболевания.
Раскрытие изобретения
Техническим результатом предлагаемого изобретения является создание простой тест-модели, позволяющей проводить тестирование лекарственных средств на большом количестве образцов миелинобразующей культуры олигодендроцитов со статистической достоверностью р < 0,05.
Технический результат достигается тест-моделью для исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro, представляющей собой первичную культуру олигодендроцитов на стеклянных покровных стеклах в чашках Петри. При этом, первичную культуру олигодендроцитов получают путем размещения свежеиссеченных фрагментов мозжечка новорожденных крысят на стеклянных покровных стеклах в чашках Петри с диаметром основания 35 мм. Покровные стекла предварительно покрывают подложкой, обеспечивающей прикрепление, распластывание и движение культивируемых клеток, а сверху размещают слой питательной среды, обеспечивающий рост культивируемых клеток.
В качестве питательной среды используют среду следующего состава (мл/л):
DMEM - 335
F12 - 335;
эмбриональная телячья сыворотка - 240;
экстракт куриных эмбрионов - 90 с добавлением следующих компонентов (г/л):
глютамин - 0,73;
ацетилсалициловая кислота - 0,0018;
инсулин - 0,005;
а также антибиотики - стрептомицин - 100 ед/мл и пенициллин - 100 ед/мл с допустимой величиной отклонения от указанного значения не более 1%.
Технический результат достигается способом получения тест-модели для исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro, заключающимся в том, что свежеиссеченные фрагменты мозжечка новорожденных крысят выкладывают на покровные стекла, покрытые подложкой, обеспечивающей прикрепление, распластывание и движение клеток, и покровные стекла помещают в чашки Петри с диаметром основания 35 мм, наносят 100-200 мкл питательной среды, и переносят на 10-12 часов в термостат при 37±0,4°С, затем объем питательной среды доводят до 1±0,01 мл и продолжают культивирование 14±0,1 день. Для размещения используют фрагменты мозжечка размером 1×2 мм, при этом культивирование клеток проводят в термостате «с поддувом» при 37±0,4°С в воздушной атмосфере с 5%-ным содержанием СО2. Подложка, обеспечивающая прикрепление, распластывание и движение клеток, образована водным раствором полилизина, в качестве которого используют поли-L-лизин или поли-D-лизин. Для образования подложки используют водный раствор поли-D-лизин с концентрацией 0,1-5 мкг/мл. Перед размещением фрагментов мозжечка покровные стекла смачивают опусканием в раствор PBS или раствор Хенкса.
Техническая проблема также решается способом исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro с использованием тест-системы, полученную заявляемым способом, заключающимся в том, что тест-систему обрабатывают раствором исследуемого лекарственного средства в течение всего периода культивирования, начиная с первого дня и с третьего дня культивирования, к тест-системе с тестируемым лекарственным средством добавляют токсическую обработку водным раствором липолисахарида, которую проводят в течение 10 дней, затем продолжают культивирование еще 2 дня и оценку действия лекарственных препаратов на заболевание рассеянным склерозом проводят, анализируя синтеза миелина олигодендроцитами путем зондирования культур кроличьими антителами к МВР. Для токсической обработки используют раствор ЛПС в концентрации 5 мкг/мл. Способ оценки синтеза миелина олигодендроцитами путем зондирования культур кроличьими антителами к МВР, проводят после завершения культивирования клеток, выращенных на стеклянных покровных стеклах, фиксируют 1%-ным формальдегидом в растворе PBS в течение времени, необходимого для тщательной фиксации и предотвращения отслоения фрагментов культуры, затем промывают PBS и окрашивают сначала антителами к МВР, а затем антителами, конъюгированными с флуоресцентным носителем с последующим проведением конфокальной микроскопии при использовании оптического фильтра "488 нм" и с параллельной фотосъемкой видимых полей, а оценку синтеза миелина проводят путем количественной оценки флуоресценции из данных, полученных в виде фотоизображений. Фиксацию образцов формальдегидом проводят в течение 1,5 часов. Для количественной оценки флуоресценции определяют суммарную площадь фигур ярко-зеленого цвета на полученных фотоизображениях, при этом на каждом фотоизображении определяют количество клеток, которое делят на значение площади фигур ярко-зеленого цвета.
Таким образом, технический результат достигается в силу использования предлагаемой методики культивирования, которая обеспечивает следующие возможности:
1) позволяет одновременно использовать столько стекол для посадки эксплантатов с целью получения культуры олигодендроцитов, сколько необходимо для получения достаточной выборки для статистического анализа,
2) предусматривает упрощение процедур за счет отсутствия так называемых «дополнительных элементов конструкции», а именно, отсутствия этапа изготовления и приклеивания дополнительных элементов и необходимости учитывать воздействие клеевого состава на культуру,
3) дает возможность статистической обработки результатов за счет однородности и монослойности первичной культуры олигодендроцитов, полученной в указанном временном интервале, что достигается миграцией олигодендроцитов из эксплантатов в первом эшелоне мигрирующих клеток (Berg О. and Kallen В. Studies on rat neuroglia cells in tissue culture // J. Neuropathol. Exp. Neurol. - 1959. - Vol. 18(3). - P. 458-467),
4) несмотря на однородность первичной культуры мигрировавших олигодендроцитов и условную чистоту по клеточному составу, в пределах поверхности одного и того же стекла сохраняется связь олигодендроцитов с остальными типами клеток, имеющимися в эксплантатах мозжечка: нейронами, микроглией и астроглией. Связь обеспечивается за счет общего покрывающего слоя питательной среды, что обеспечивает обмен стрессовыми факторами, необходимыми для выработки ответа модели на токсические воздействия,
5) элиминирование стадии сбора клеток культуры и приготовления образцов для микроскопирования, т.к. стекла с выросшей на них культурой уже готовы для проведения анализа,
6) элиминирование стадии дезинтеграции ткани для получения суспензии клеток, используемых в других методах, что зачастую травматично для крайне чувствительных клеток мозга и отрицательно сказывается на способности к синтезу миелина in vitro.
В предлагаемом способе скорость в проведении скрининга достигается за счет того, что лекарственные препараты можно добавлять к культивируемым клеткам и непосредственно в культуре последовательно изучать их воздействие во времени.
В целом, технический результат достигается за счет 1) проведения работы на культивируемых клетках олигодендроцитов с исключением стадии дезинтеграции ткани, используемой в других методах при подготовке к культивированию: последнее зачастую травматично для клеток мозга и отрицательно сказывается на способности к синтезу миелина in vitro, и 2) применения метода быстрой количественной оценки содержания миелина в олигодендроцитах в первичной культуре для расчета воздействия различных препаратов.
(1) Первичная культура олигодендроцитов в течение 14 дней образует на покровном стекле монослой клеток, радиально мигрирующих из эксплантатов мозжечка новорожденных крысят, что делает доступным обработку лекарственным препаратом практически всего массива клеток олигодендроцитов и регистрации результатов при помощи микроскопа. Миграция олигодендроцитов обеспечивается подвижностью самих клеток при наличии контакта с поверхностью стекла (прикрепление к стеклу). Особенность этой культуральной модели в том, что в ней преимущественно задействованы олигодендроциты, которые образуют миелиновую оболочку аксонов, т.е. модель базируется на клетках, являющихся мишенью заболевания PC. Последнее обуславливает возможность направленного изучения лекарственных препаратов. Моделирование заболевания PC на первичной культуре олигодендроцитов проводят по известной методике токсической обработкой клеток липополисахаридом (ЛПС), получаемым из E.coli (Felts P. A., Woolston А. М., Fernando Н. В. et al. Inflammation and primary demyelination induced by the intraspinal injection of lipopolysaccharide // Brain - 2005. - Vol. 128(7). - P. 1649-1666). При этом содержание миелина, который синтезируется непосредственно в клетках олигодендроцитов, снижается или прекращается в этих клетках подобно тому, как это имеет место в ходе заболевания PC. Известно, что токсическое действие ЛПС инициируется путем взаимодействия этого токсина со специфическими Toll-рецепторами на клетках микроглии, но не на олигодендроцитах. При этом в клетках микроглии запускается каскад реакций, ведущих к окислительному стрессу. В использованной культуре клетки микроглии располагаются в эксплантатах. Наличие общего слоя питательной среды, покрывающего эксплантат и монослой мигрировавших из него клеток, позволяет всем клеткам такой культуры обмениваться стрессовыми факторами, возникающими при окислительном стрессе. Среди факторов, приводящих к нарушению продукции миелина, могут быть как воспалительные процессы, так и окислительный стресс, приводящий к опасному повышению уровня АФК.
(2) В основе проведения скрининга результатов лежит количественная оценка миелина в монослое олигодендроцитов на покровных стеклах, которые одновременно служат для получения культуры клеток, приготовления тест-модели из растущей культуры, и оценки результатов. Количественная оценка миелина непосредственно на покровных стеклах с выросшей культурой проводится при помощи специфической иммунофлуоресцентной окраски на основной белок миелина (МВР) и последующего цифрового учета флуоресценции на микрофотографиях, полученных при флуоресцентном микроскопировании. Модель позволяет нарабатывать достаточную выборку для проведения статистической обработки результатов. МВР в образцах определяли количественно, измеряя окрашивание на МВР в 7-60 полях зрения на каждый тип обработки культуры в опыте и выражая степень окрашивания, как процент от окрашенной площади необработанных контрольных культур. Образцы были приготовлены из мозга восьми новорожденных крысят в четырех независимых экспериментах.
Краткое описание чертежей
Изобретение иллюстрируется следующими чертежами.
Фиг. 1 - фотоизображения видимых полей первичной культуры олигодендроцитов при органотипическом культивировании эксплантатов мозжечка крысят на покровных стеклах после иммуноокрашивания: (А) контрольная культура; культура, обработанная (Б) антиоксидантным средством Trolox (водорастворимый аналог витамина Е), либо (В) бактериальным токсином ЛПС, либо (Г) антиоксидантным средством Trolox на фоне токсической обработки ЛПС. Изображения получены при помощи конфокального микроскопа LSM 510 (Carl Zeiss, Германия).
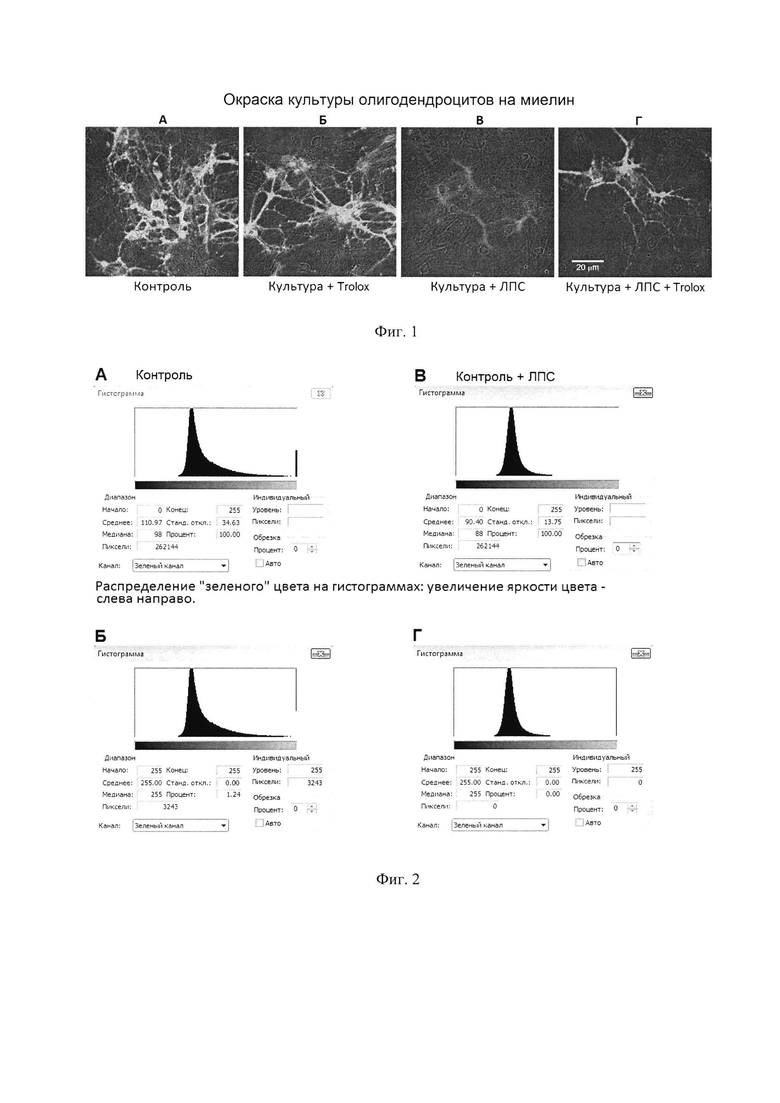
Фиг. 2 - снимки с экрана персонального компьютера, полученные при анализе фотоизображений первичной культуры олигодендроцитов с помощью программного продукта "Corel PHOTO-PAINT" (CorelDraw(R) Graphics Suite Х3). Снимки демонстрируют способ оценки уровня миелинизации в культуре олигодендроцитов на примере образцов (А, В) контрольной культуры и (Б, Г) культуры после токсической обработки ЛПС.
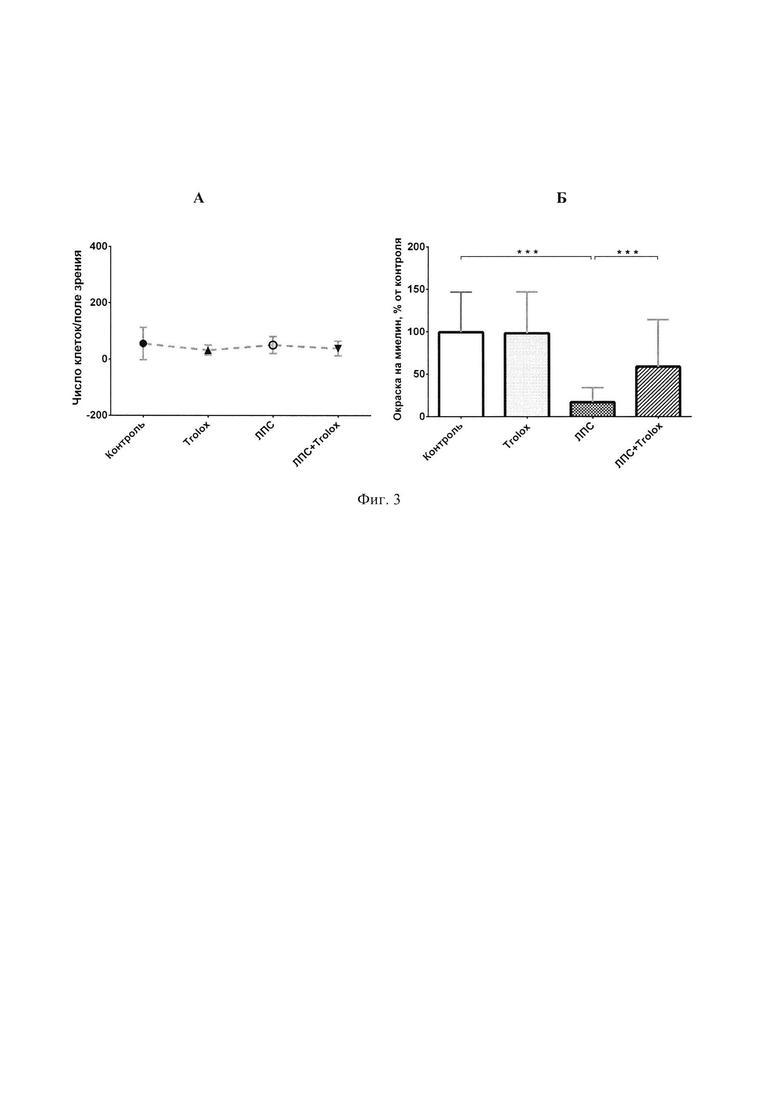
Фиг. 3 - данные о влиянии ЛПС и лекарственного антиоксидантного препарата Trolox (А) на число клеток и (Б) на продукцию миелина в первичной культуре олигодендроцитов при органотипическом культивировании эксплантатов мозжечка крысят на покровных стеклах.
Осуществление изобретения
Ниже представлено более детальное описание заявляемого способа, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
Приготовление первичной клеточной культуры олигодендроцитов
Первичная культура олигодендроцитов формируется клетками, радиально мигрирующими из длительно поддерживающихся (в предлагаемом способе - 14 дней) культур эксплантатов мозжечка крысят в пределах одного и того же покровного стекла. Культивирование эксплантатов мозжечка крысят проводят следующим образом.
Вся работа по культивированию выполняется в строго асептических условиях с использованием стерильных принадлежностей: посуды, инструментов и сред.
Мозжечок новорожденных крысят (1-2-дневного возраста) извлекают по методике Борнштайна и Мюррей и из мозжечка получают эксплантаты (Bornstein М. В. and Murray М. R. Serial observations on patterns of growth, myelin formation, maintenance and degeneration in cultures of new-born rat and kitten cerebellum // J. Cell Biol. - 1958. - V. 4(5). -P. 499-504). Также можно использовать методику, описанную для извлечения мозжечка новорожденных мышат, в которой приводится схема структур отделов головного мозга (Wolf М. К. Differentiation of neuronal types and synapses in myelinating cultures of mouse cerebellum // J. Cell Biol. - 1964. - V. 22(1). - P. 259-279). В общем случае инструменты и материалы, необходимые для препаративной работы, а также техника препарирования для взятия биоматериала приведены в руководстве (Культура нервной ткани // Жаботинский Ю. М. (ред.) - Москва: Медицина. - 1977. - 184 с).
Для получения клеточной культуры используют стерильные малые пластиковые чашки Петри с диаметром основания 35 мм; при этом в каждую чашку Петри помещают по одному покровному стеклу размером 24×24 мм, диагональ которого практически равна внутреннему диаметру основания чашки Петри; покровное стекло выкладывается непосредственно на дно каждой чашки без дополнительных элементов и без клеевых составов. Такой способ размещения покровных стекол для культивирования позволяет получить в каждой чашке Петри независимую изолированную тест-культуру пригодную для проведения испытания лекарственных средств. Для культивирования используют покровные стекла, покрытые слоем поли-D-лизина, выполняющим роль подложки. Для его нанесения стекла опускают в раствор поли-D-лизина (Sigma, США) с концентрацией 5±0,1 мкг/мл и затем высушивают на воздухе. Подготовленные таким образом стекла можно хранить при +4°С в течение ≥12 месяцев. В качестве подложки можно использовать и другие покрытия. С этой целью могут быть использованы положительно заряженные полиаминокислоты, которые благодаря электростатическому притяжению отрицательно заряженных частиц на мембранах клеток обеспечивают прикрепление и распластывание клеток, что в свою очередь ускоряет рост, дифференцировку и движение многих типов культивируемых клеток. Для формирования подложки подходят оба вида полилизинов (примеры дистрибьюторов - Merck, Германия; Sigma-Aldrich, США), как поли-L-лизин, так и поли-D-лизин (Sitterley G. Poly-L-lysine cell attachment protocol // BioFiles - 2008. - Vol. 3(8). - P. 12), но предпочтительнее использовать полимер из искусственного предшественника (D-лизина), в силу его устойчивости к энзиматическим воздействиям и длительной сохранности. В зависимости от способа нанесения покрытия и от типа культур, концентрации растворов полилизинов могут варьировать в широких пределах от 5 до 5000 мкг/мл. Также в качестве подложки можно использовать поли-L-орнитин (10-100 мкг/мл) (примеры дистрибьюторов - Merck, Германия; Advanced BioMatrix, США) и коллаген (пример дистрибьютора - Advanced BioMatrix, США), применяя эти соединения в соответствии с протоколами производителей.
Перед взятием биопроб покровное стекло, покрытое поли-D-лизином и предназначенное для выкладывания получаемого биоматериала, смачивают опусканием в раствор PBS или раствор Хенкса, чтобы на следующем этапе не допустить пересыхания отобранного биоматериала. Смоченное покровное стекло размещают в малой чашке Петри. Свежеиссеченные фрагменты мозжечка (эксплантаты) размером 1×2 мм выкладывают на подготовленные покровные стекла, помещенные в малые чашки Петри. На эксплантаты наносят небольшое количество питательной среды (приблизительно 100-200 мкл), которое способно закрыть эксплантаты. Через 10-12 часов (интервал времени подобран экспериментально так, чтобы исключить высыхание среды и позволить клеткам прикрепиться к стеклу) объем питательной среды на покровном стекле с эксплантатом доводят до 1 мл.
Для культивирования используют базовую питательную среду, приготовленную из готовых коммерческих компонентов (ПанЭко, Россия) в следующих соотношениях компонентов (мл/л):
DMEM – 335
F12 - 335;
эмбриональная телячья сыворотка - 240;
экстракт куриных эмбрионов - 90; к базовой среде добавляют остальные компоненты (г/л):
глютамин - 0,73;
ацетилсалициловая кислота - 0,0018;
инсулин - 0,0005;
антибиотики, как указано ниже, с допустимой величиной отклонения от указанного значения не более 1%.
Питательную среду готовят из DMEM, содержащей 4,5 г/л глюкозы (модифицированная по Дульбекко среда Игла) и F12 (среда Хэма) в соотношении 1:1 (по объему), добавляют остальные компоненты так, чтобы полученный раствор содержал 24 об. % эмбриональной телячьей сыворотки, 9 об. % экстракта куриных эмбрионов и 5 мМ глютамина (ПанЭко, Россия). Кроме того, в питательную среду добавляют 10 мкМ ацетилсалициловую кислоту (Sigma-Aldrich, США), 0,5 мкг/мл инсулина (Sigma, США), стрептомицин (100 ед/мл) и пенициллин (100 ед/мл). Каждые 2-3 дня питательную среду заменяют на свежую, как описано ранее (Пол Дж. Культура клеток и тканей // Навашина С.М. (пер. с англ.); Якобсон Л. М. (ред.). - Москва: Медгиз. - 1963. -346 с).
Известно, что скорость и степень миелинизации культуры, которые напрямую зависят от синтеза миелина олигодендроцитами, сильно зависят от температуры и состава питательной среды, использующихся при культивировании. К трудностям культивирования олигодендроглии относится чувствительность синтеза миелина в культуре и к другим изменениям внешних условий, таким как, например, яркая засветка. При этом процесс миелинизации может спонтанно обрываться и не возобновляется в данном микроокружении. Поэтому необходимо учитывать, что для достижения воспроизводимости результатов крайне важно соблюдать постоянство условий культивирования.
Культивирование проводят в термостате «с поддувом» при 37±0,4°С в воздушной атмосфере с 5%-ным содержанием СО2. Культуру считают выросшей на 14-ый ±0,1 день.
Тест-модель рассеянного склероза
Для моделирования заболевания PC in vitro на культуре олигодендроцитов, полученных при органотипическом культивировании эксплантатов мозжечка, применяют токсическую обработку культуры раствором ЛПС (конечная концентрация 5±0,1 мкг/мл). ЛПС добавляют в сменную питательную среду в течение 10 дней, начиная с третьего дня культивирования. В течение последних 2 дней культивирования ЛПС исключают из среды культивирования.
Для тестирования лекарственного средства опытные образцы культур обрабатывают водным раствором лекарственного средства в течение всего периода культивирования, начиная с первого дня. Для этого перед началом культивирования лекарственное средство вносят в питательную среду до требуемой концентрации. При этом, с третьего по двенадцатый день культивирования, в сменную среду, кроме тестируемого лекарственного средства, добавляется токсический компонент ЛПС.
В качестве лекарственных средств, препятствующих демиелинизации, наряду с традиционно применяемыми антиоксидантами могут быть использованы и перспективные антиоксиданты нового поколения - митохондриально-направленные соединения (Fetisova Е. К., Muntyan М. S., Lyamzaev К. G. and Chernyak В. V. Therapeutic effect of the mitochondria-targeted antioxidant SkQ1 on the culture model of multiple sclerosis // Oxid. Med. Cell. Longev. - 2019. - Vol. 2019. - Art. 2082561). При подборе действующей концентрации различных антиоксидантов в качестве ориентира можно использовать ранее полученные сведения. Так, в сравнительных исследованиях на клеточных моделях, где окислительный стресс индуцировался прооксидантами или с помощью рецептор-опосредованной передачи сигналов, митохондриально-направленные антиоксиданты, как правило, проявляют эффекты сходные с действием обычных антиоксидантов (N-ацетилцистеина, α-токоферола - водорастворимого аналога витамина Е (Trolox) и др.), но в дозах меньших на три и более порядков (Severina I. I., Severin F. F., Korshunova G. A. et al. In search of novel highly active mitochondria-targeted antioxidants: thymoquinone and its cationic derivatives // FEBS Lett. - 2013. - V. 587(13). - P. 2018-2024). Однако, для каждого нового объекта действующую концентрацию применяемого антиоксиданта необходимо подбирать экспериментально. При этом нужно учитывать, что радикалобразующие антиоксиданты (например, хинолсодержащие) могут обладать в низких концентрациях антиоксидантными, а в высоких концентрациях прооксидантными свойствами, что определяет для каждого такого антиоксиданта собственное эффективное концентрационное окно (Skulachev V. P., Anisimov V. N., Antonenko Y. N. et al. An attempt to prevent senescence: a mitochondrial approach. Biochim. Biophys. Acta - 2009. - V. 1787(5). - P. 437-461).
Исследование первичной культуры олигодендроцитов
В клеточной культуре, приготовленной по предложенной методике, олигодендроциты (в отличие от нейронов) мигрируют из фрагментов мозжечка в течение 14 дней и образуют монослой на покровном стекле. По истечении этого периода проводят исследование демиелинизации/ремиелинизации олигодендроцитов. Синтез миелина олигодендроцитами анализируют путем зондирования культур кроличьими антителами к МВР.
Иммуноокрашивание
Перед иммуноокрашиванием клетки, выращенные на стеклянных покровных стеклах, фиксируют 1%-ным формальдегидом в физиологическом растворе с фосфатным буфером (PBS) в течение 1,5±0,05 часов при комнатной температуре для обеспечения тщательной фиксации, необходимой для предотвращения отслоения фрагментов культуры. После этого препараты промывают PBS и первоначально окрашивают антителами против МВР. В качестве антител против МВР могут быть использованы коммерческие препараты (# М3821, Sigma-Aldrich, США). Затем проводят обработку вторичными антителами, конъюгированными с флуоресцентным носителем, в качестве которых могут быть использованы Alexa-Fluor-488-conjugated anti-IgG (Invitrogen, США). Иммунофлуоресценцию наблюдают и анализируют с помощью конфокального микроскопа LSM 510 (Carl Zeiss, Германия) с использованием соответствующего оптического фильтра.
Оценка содержания миелина
Оценка содержания миелина включает следующие этапы: окрашивание олигодендроцитов флуоресцентными антителами по протоколам производителей, конфокальную микроскопию с параллельной фотосъемкой видимых полей, количественную оценку флуоресценции олигодендроцитов из данных, полученных в виде фотоизображений, и статистическую обработку результатов. Для количественной оценки флуоресценции все изображения для анализа сохраняют в одном масштабе с одинаковым разрешением; при необходимости фотоизображения стандартизуют по яркости фона. Далее количественную оценку флуоресценции проводят путем обработки данных на персональном компьютере с помощью программного продукта "Corel PHOTO-PAINT". Для этого используют функцию определения суммарной площади фигур определенного цвета. Площадь фигур в поле определяют следующим образом: 1) открывают файл с фотоизображением препарата в указанной программе; 2) в редакционной строке в опции «Image» выставляют режим «RGB-24»; 3) затем в опции «Image» открывают опцию «Histogram»; в появившемся окне в опции «Channel» выставляют цвет, приобретаемый объектом после окраски флуоресцентным красителем; после этого линейка под гистограммой покажет плавное распределение интенсивности этого цвета. Гистограмма отображает в пикселях распределение цвета по яркости на всей площади изображения. Под гистограммой в строке «Pixels» высвечивается значение показателя для искомого цвета (заданной интенсивности) в пикселях, а в строке «Percent» - в процентах; оценку всех имеющихся изображений по выбранной интенсивности заданного цвета проводят либо в пикселях, либо в процентах и значения записывают. Полученные значения соответствуют площади, занятой цветом определенной интенсивности для исследуемого объекта на фотоизображении, и эквивалентны суммарной площади занимаемой объектом, окрашенные таким образом (например, олигодендроцитами с нормальной миелинизацией). Далее на каждом фотоизображении определяют количество клеток (подсчет выполняют при микроскопировании в режиме проходящего света) и делят эквивалент значения площади для выбранной интенсивности заданного цвета на количество клеток, определенное для каждого фотоизображения. Получают величину миелинизации в расчете на клетку в относительных единицах. Подобным образом оценивают величины миелинизации в полях всех анализируемых образцов и составляют таблицу значений миелинизации олигодендроцитов в контрольных и опытных образцах.
Статистический анализ
Статистическую обработку данных выполняют общепринятыми стандартными методами, например, по алгоритму ANOVA в одном направлении с последующим тестом Бонферрони, для чего используют доступный программный продукт для статистической обработки, например, GraphPad Prism версии 6.01 для Windows (GraphPad Software, США, www.graphpad.com). Статистически значимым считают значение р < 0,05.
Пример конкретного выполнения.
Эксплантаты мозжечка получали из мозга новорожденных крысят (1-2-дневного возраста). Для получения клеточной культуры в каждом варианте опыта (варианты: контроль, опыт + Trolox, опыт + ЛПС, опыт + Trolox + ЛПС) использовали по 4-8 стерильных малых пластиковых чашек Петри с диаметром основания 35 мм (Aptaca, Италия); при этом в каждую чашку Петри помещали по одному покровному стеклу размером 24×24 мм, покрытому раствором поли-D-лизина (Sigma, США) с концентрацией 5 мкг/мл. Перед размещением в чашке Петри покровное стекло смачивали раствором PBS. Свежеиссеченные фрагменты мозжечка (эксплантаты) размером 1×2 мм выкладывали на покровные стекла и наносили 100-200 мкл питательной среды. Через 12 часов объем питательной среды на покровном стекле с эксплантатом доводили до 1 мл.
Для культивирования использовали питательную среду, приготовленную из готовых коммерческих компонентов (ПанЭко, Россия) в следующих соотношениях (мл/л):
DMEM – 335
F12 - 335;
эмбриональная телячья сыворотка - 240;
экстракт куриных эмбрионов - 90; к базовой среде добавляли остальные компоненты (г/л):
глютамин - 0,73;
ацетилсалициловая кислота - 0,0018;
инсулин - 0,0005;
антибиотики, как указано ниже.
Питательную среду готовили из DMEM, содержащей 4,5 г/л глюкозы (модифицированная по Дульбекко среда Игла) и F12 (среда Хэма) в соотношении 1:1 (по объему), добавляют остальные компоненты так, чтобы полученный раствор содержал 24% эмбриональной телячьей сыворотки, 9% экстракта куриных эмбрионов и 5 мМ глютамина. Кроме того, в питательную среду добавляли 10 мкМ ацетилсалициловую кислоту, 0,5 мкг/мл инсулина (Sigma, США), стрептомицин (100 ед/мл) и пенициллин (100 ед/мл). Каждые 2-3 дня питательную среду заменяли на свежую.
Моделирование заболевания PC in vitro осуществляли путем токсического воздействия ЛПС на культуру олигодендроцитов, приводящего к их демиелинизации. Для этого культуру олигодендроцитов, полученных при органотипическом культивировании эксплантатов мозжечка, обрабатывали раствором ЛПС в конечной концентрации 5 мкг/мл (E.coli lipopolysaccharide, # 055:В5, Sigma-Aldrich, США). ЛПС добавляли в течение 10 дней, начиная с третьего дня культивирования. В течение последних 2 дней культивирования ЛПС исключали из среды культивирования.
Для тестирования лекарственного средства опытные образцы культур обрабатывали раствором лекарственного средства в течение всего периода культивирования, начиная с первого дня. В качестве лекарственного средства использовали препарат антиоксиданта Trolox, стоковый раствор которого имел концентрацию 0,1 М. При этом культуры обрабатывали 100 мкМ раствором Trolox в течение первых 12 дней и 200 мкМ раствором Trolox в течение последних 2 дней культивирования (в обоих случаях указана конечная концентрация Trolox в культуральной среде). Начиная с третьего дня культивирования, к опытному образцу культуры с тестируемым лекарственным средством добавляли токсическую обработку культуры раствором ЛПС. В качестве контроля служили образцы первичной клеточной культуры олигодендроцитов, полученные при органотипическом культивировании, как подвергшиеся, так и не подвергавшиеся токсическому воздействию ЛПС, но без внесения лекарственного препарата.
Культивирование проводили в термостате «с поддувом» при 37°С в воздушной атмосфере с 5%-ным содержанием СО2. Культуру считали выросшей на 14-ый день.
Исследование первичной культуры олигодендроцитов
По истечении этого периода проводили исследование демиелинизации/ремиелинизации олигодендроцитов. Синтез миелина олигодендроцитами анализировали путем зондирования культур кроличьими антителами к МВР.
Иммуноокрашивание
Перед иммуноокрашиванием клетки, выращенные на стеклянных покровных стеклах, фиксировали 1%-ным формальдегидом в растворе PBS в течение 1,5 часов при комнатной температуре для обеспечения тщательной фиксации, необходимой для предотвращения отслоения фрагментов культуры. После этого препараты промывали PBS и первоначально окрашивали антителами против МВР (# М3821, Sigma-Aldrich, США). Вторичные антитела, конъюгированные с флуоресцентным носителем Alexa-Fluor-488 (Invitrogen, США), использовали после обработки первичными антителами. Иммунофлуоресценцию наблюдали и анализировали с помощью конфокального микроскопа LSM 510 (Carl Zeiss, Германия) с использованием оптического фильтра "488 нм" (зеленый).
Оценка содержания миелина
Оценка содержания миелина включала следующие этапы: окрашивание олигодендроцитов флуоресцентными антителами по протоколам производителей, конфокальную микроскопию с параллельной фотосъемкой видимых полей (Фиг. 1) с использованием интерфейсного программного продукта "ImageJ" (http://rsb.info.nih.gov/ij/), количественную оценку флуоресценции олигодендроцитов из данных, полученных в виде фотоизображений (Фиг. 2), и статистическую обработку результатов. Для количественной оценки флуоресценции все изображения для анализа сохраняли в одном масштабе с одинаковым разрешением. Далее количественную оценку флуоресценции проводили путем обработки данных на персональном компьютере с помощью программного продукта "Corel PHOTO-PAINT" (версия CorelDraw(R) Graphics Suite Х3). Для этого использовали функцию определения суммарной площади фигур зеленого цвета, поскольку олигодендроциты окрашивались антителами на МВР в зеленый цвет. Площадь фигур зеленого цвета в поле определяли следующим образом: 1) открывали файл с фотоизображением препарата в указанной программе; 2) в редакционной строке в опции «Image» выставляли режим «RGB-24»; 3) затем в опции «Image» открывали опцию «Histogram»; в появившемся окне в опции «Channel» выставляли «Green channel», после этого линейка под гистограммой покажет плавное распределение цвета от черного до зеленого (Фиг. 2). Гистограмма отображает в пикселях распределение зеленого цвета по яркости в диапазоне от 0 до 255 на всей площади изображения. Олигодендроциты без патологии после иммуноокрашивания имеют ярко-зеленый цвет, который на гистограмме соответствует уровню [255]. В окне гистограммы курсором находили положение, когда в окошке "уровень" появлялся показатель [255] (на Фиг. 2А и 2 В крайнее правое положение на гистограмме). После этого под гистограммой в строке «Pixels» высвечивалось значение показателя для уровня [255] в пикселях, а в строке «Percent» - в процентах (Фиг. 2Б, Г); оценку всех имеющихся изображений проводили либо в пикселях, либо в процентах и значения записывали. Полученные значения соответствуют площади, занятой ярко-зеленым цветом на фотоизображении, и эквивалентны суммарной площади занимаемой олигодендроцитами с нормальной миелинизацией. Далее на каждом фотоизображении определяли количество клеток (подсчет выполняли при микроскопировании в режиме проходящего света) и делили эквивалент значения площади для ярко-зеленого цвета на количество клеток, определенное для каждого фотоизображения. Получали величину миелинизации в расчете на клетку в относительных единицах. Подобным образом оценивали величины миелинизации в полях всех анализируемых образцов и составляли таблицу значений миелинизации олигодендроцитов в контрольных и опытных образцах в 4 независимых экспериментах (таблица 1). 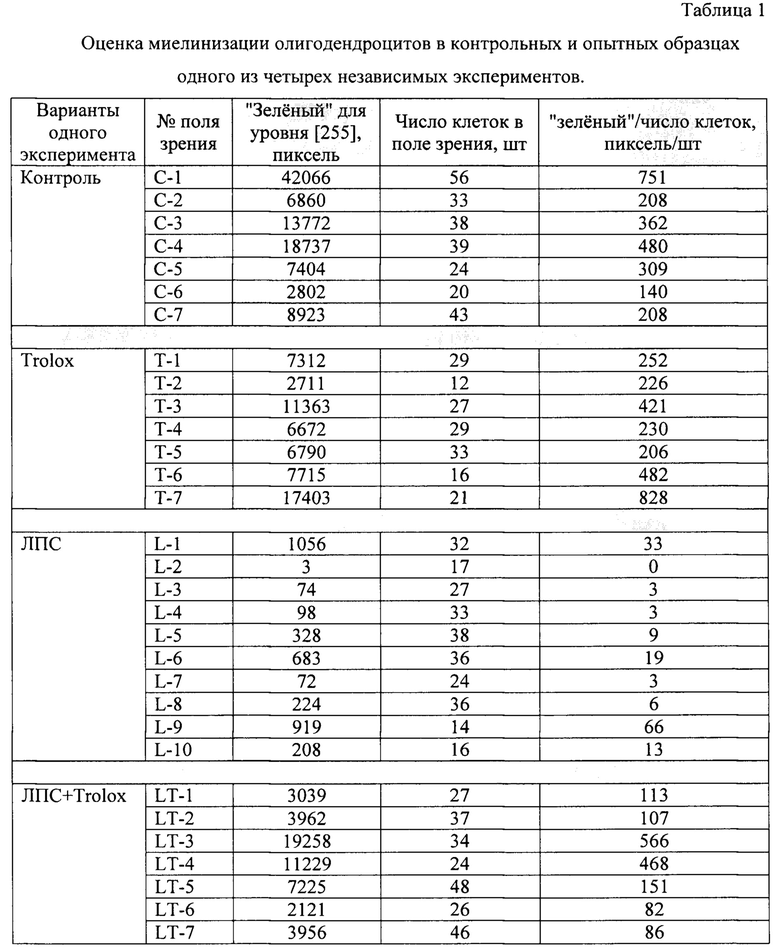

Статистический анализ
Статистическую обработку данных выполняли по алгоритму ANOVA в одном направлении с последующим тестом Бонферрони, для чего использовали программный продукт GraphPad Prism версии 6.01 для Windows (GraphPad Software, La Jolla California США, www.graphpad.com). Статистически значимым считали значение р < 0,05.
Проведенный анализ показывает:
1) культура в контроле демонстрирует устойчивый и репрезентативный уровень синтеза миелина (Фиг. 1А, таблица 1 и Фиг. 3Б), что свидетельствует о сбалансированности условий культивирования, и позволяет использовать культуру для создания модели PC;
2) обработка культуры по отдельности - посредством ЛПС или лекарственным средством, - равно как и совместная обработка ЛПС и лекарственным средством, не приводит к значительному изменению числа клеток в культуре (Фиг. 3А), что исключает объяснение эффектов использованных реагентов - токсина и лекарственного средства - за счет гибели или избыточной пролиферации клеток в культуре; это позволяет проводить оценку влияния реагентов на синтез миелина;
3) токсическая обработка культуры посредством ЛПС снижает уровень продукции миелина до 20%, что подтверждает работоспособность модели;
4) антиоксидантное лекарственное средство Trolox обеспечивает защиту клеток от токсического воздействия ЛПС на 60% (Фиг. 3Б).
Таким образом, предлагаемый способ может быть использован для быстрого изучения и скрининга лекарственных препаратов.
Метод органотипического культивирования эксплантатов мозжечка на стеклах в чашках Петри технически прост, исключает стадию дезинтеграции ткани и не требует большого количества персонала и оборудования. Метод позволяет за короткий срок получить значительное количество миелинизирующих клеток (олигодендроцитов), пригодных для тестирования лекарственных препаратов, и наработать любое число образцов, обуславливающих статистическую достоверность получаемых результатов. Метод не требует изготовления дополнительных конструкций и их приклеивания к чашкам Петри для культивирования клеток. Это исключает присутствие дополнительных воздействий на изучаемые клетки (в виде клеевого слоя), что упрощает трактовку получаемых результатов. Количественная оценка результатов технически проста и занимает короткое время.
Группа изобретений относится к области медицины, а именно к неврологии, и биотехнологии. Раскрыта тест-модель для исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro, характеризующаяся тем, что представляет собой первичную культуру олигодендроцитов, полученную эксплантатным методом, путем размещения свежеиссеченных фрагментов мозжечка новорожденных крысят на стеклянных покровных стеклах в чашках Петри с диаметром основания 35 мм, при этом покровные стекла покрыты подложкой, обеспечивающей прикрепление, распластывание и движение культивируемых клеток, а сверху размещен слой питательной среды, обеспечивающий рост культивируемых клеток. Также раскрыты способ получения указанной тест-модели и способ исследования действия лекарственных препаратов с использованием указанной тест-модели. Группа изобретений обеспечивает создание простой тест-модели, позволяющей проводить тестирование лекарственных средств на большом количестве образцов миелинобразующей культуры олигодендроцитов со статистической достоверностью р<0,05. 3 н. и 11 з.п. ф-лы, 1 табл., 3 ил.
1. Тест-модель для исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro, характеризующаяся тем, что представляет собой первичную культуру олигодендроцитов, полученную эксплантатным методом, путем размещения свежеиссеченных фрагментов мозжечка новорожденных крысят на стеклянных покровных стеклах в чашках Петри с диаметром основания 35 мм, при этом покровные стекла покрыты подложкой, обеспечивающей прикрепление, распластывание и движение культивируемых клеток, а сверху размещен слой питательной среды, обеспечивающий рост культивируемых клеток, в качестве которой используют среду следующего состава (мл/л):
DMEM - 335
F12 - 335;
эмбриональная телячья сыворотка - 240;
экстракт куриных эмбрионов - 90
с добавлением в питательную среду следующих компонентов (г/л):
глютамин - 0,73;
ацетилсалициловая кислота - 0,0018;
инсулин - 0,0005;
а также стрептомицин - 100 ед/мл и пенициллин - 100 ед/мл с допустимой величиной отклонения от указанных значений концентрации антибиотиков не более 1%.
2. Способ получения тест-модели для исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro по п. 1, характеризующийся тем, что свежеиссеченные фрагменты мозжечка новорожденных крысят выкладывают на покровные стекла, покрытые подложкой, для обеспечения прикрепления, распластывания и движения клеток; покровные стекла помещают в чашки Петри с диаметром основания 35 мм, наносят 100-200 мкл питательной среды, и переносят на 10-12 часов в термостат при 37±0,4°С, затем объем питательной среды доводят до 1±0,01 мл и продолжают культивирование 14±0,1 день.
3. Способ по п. 2, характеризующийся тем, что используют фрагменты мозжечка размером 1×2 мм.
4. Способ по п. 2, характеризующийся тем, что культивирование проводят в термостате «с поддувом» при 37±0,4°С в воздушной атмосфере с 5%-ным содержанием СО2.
5. Способ по п. 2, характеризующийся тем, что подложка, обеспечивающая прикрепление и распластывание клеток, образована водным раствором полилизина.
6. Способ по п. 5, характеризующийся тем, что в качестве полилизина используют поли-L-лизин или поли-D-лизин.
7. Способ по п. 5, характеризующийся тем, что для образования подложки используют водный раствор поли-D-лизина с концентрацией 0,1-5 мкг/мл.
8. Способ по п. 2, характеризующийся тем, что перед размещением фрагментов мозжечка покровные стекла смачивают опусканием в раствор PBS или раствор Хенкса.
9. Способ исследования действия лекарственных препаратов на заболевание рассеянным склерозом in vitro с использованием тест-модели по п. 1, полученной способом по п. 2, характеризующийся тем, что тест-модель обрабатывают раствором исследуемого лекарственного средства в течение всего периода культивирования, начиная с первого дня, к тест-модели с тестируемым лекарственным средством применяют токсическую обработку водным раствором липолисахаридов (ЛПС), начиная с третьего дня культивирования, которую проводят в течение 10 дней, затем продолжают культивирование еще 2 дня и оценку действия лекарственных препаратов на заболевание рассеянным склерозом проводят, анализируя синтез миелина олигодендроцитами путем зондирования культур кроличьими антителами к основному белку миелина (МВР), а именно сначала антителами к МВР, а затем вторичными антителами, конъюгированными с флуоресцентным носителем с последующим проведением конфокальной микроскопии при использовании оптического фильтра "488 нм" и с параллельной фотосъемкой видимых полей, а оценку синтеза миелина проводят путем количественной оценки флуоресценции из данных, полученных в виде фотоизображений.
10. Способ по п. 9, характеризующийся тем, что для обработки используют раствор ЛПС в конечной концентрации 5 мкг/мл.
11. Способ по п. 9, характеризующийся тем, что после завершения культивирования клетки, выращенные на стеклянных покровных стеклах, фиксируют 1%-ным формальдегидом в растворе PBS в течение времени, необходимого для предотвращения отслоения фрагментов культуры, затем промывают PBS.
12. Способ по п. 9, характеризующийся тем, что фиксацию проводят в течение 1,5 часов.
13. Способ по п. 9, характеризующийся тем, что для количественной оценки флуоресценции определяют суммарную площадь фигур ярко-зеленого цвета на полученных фотоизображениях.
14. Способ по п. 13, характеризующийся тем, что на каждом фотоизображении определяют количество клеток, которое делят на значение площади фигур ярко-зеленого цвета.
| THOMPSON C | |||
| E | |||
| et al | |||
| Myelinated, synapsing cultures of murine spinal cord - validation as an in vitro model central nervous system // European Journal of Neuroscience, 2008, V.28, pp.1518-1535 | |||
| D’SOUZA S | |||
| D | |||
| et al | |||
| Multiple Sclerosis: Fas Signaling in Oligodendrocyte Cell Death // J | |||
| Exp | |||
| Med., 1996, V.184, pp.2361-2370 | |||
| EP 1294770 B1, |
Авторы
Даты
2020-11-11—Публикация
2019-09-30—Подача