[001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/170,330, опубликованной 17 апреля 2009, содержание которой включено в настоящую публикацию посредством ссылки.
ЗАЯВЛЕНИЕ О ПРАВАХ ПРАВИТЕЛЬСТВА
[002] Настоящее изобретение было осуществлено при поддержке правительственного гранта R01CA078411, выданного Национальным Институтом здоровья. Правительство обладает определенными правами на изобретение.
ОБЛАСТЬ ТЕХНИКИ
[003] В целом варианты реализации настоящего изобретения относятся к исследованию продуктов питания, нутрицевтиков и лекарственных средств на наличие полезных для здоровья человека или животных свойств. Также, варианты реализации настоящего изобретения включают способы изготовления продуктов питания, нутрицевтиков или лекарственных средств, которые могут изменять уровни некоторых биологических маркеров - нуклеиновых кислот или белков, ассоциированных или в некоторой степени свидетельствующих о профилактике заболевания или излечении, что можно количественно определить с применением усовершенствованных способов анализа.
УРОВЕНЬ ТЕХНИКИ
[004] Инициация трансляции матричной РНК (мРНК) играет важную роль в регуляции роста и опухолевой трансформации клеток, поскольку экспрессия большинства онкогенных белков и белков, регулирующих рост клеток, регулируется на уровне трансляции (Flynn et al., 1996, Cancer Surv. 27:293; Sonenberg et al., 1998, Curr. Opin. Cell Biol. 10:268). По этой причине инициация трансляции представляет собой тщательно регулируемый клеточный процесс. Нарушение отрицательной регуляции инициации трансляции может приводить к индукции, возникновению или развитию рака (Donze et al, 1995, Embo J. 14: 3828; Rosenwald, 1996, Bioessays 18: 243-50; De Benedetti et al., 2004, Oncogene 23: 3189-99; and Rosenwald, 2004, Oncogene 23:3230). Подавление недостаточно хорошо регулируемой инициации трансляции также может вызывать обращение трансформированных фенотипов (Jiang et al., 2003, Cancer Cell Int. 3:2; Graff et al., 1995, Int. J. Cancer 60:255). Комплекс eIF2 GTP Met-тРНК (также известный как тройной комплекс) является ключевым положительным регулятором инициации трансляции. Ограничение его доступности сокращает начало новых циклов трансляции белка. В то время как трансляция многих онкогенных белков и других факторов роста клеток в значительной мере зависит от указанного тройного комплекса, то же самое нельзя сказать о генах домашнего хозяйства, поэтому продукты питания, нутрицевтики и лекарственные средства, которые способствуют ограничению количества, доступности или активности тройного комплекса, теоретически могут обеспечивать безопасный способ профилактики и лечения заболевания. Дополнительно, происходит усиление экспрессии определенных генов-супрессоров опухоли и проапоптотических генов и/или белков в присутствии ингибиторов тройного комплекса или в более общем смысле - ингибиторов инициации трансляции. Сниженная трансляция онкогенных белков, особенно в сочетании с положительной регуляцией генов-супрессоров опухолей и проапоптотических генов в целом приводит к предотвращению и/или подавлению злокачественного фенотипа.
[005] Эйкозапентаеновую кислоту (EPA), 3-полиненасыщенную жирную кислоту (n-3 PUFA), обнаруживают в больших количествах в жире, полученном из рыб, в частности из рыб диких популяций, обитающих в холодных океанических водах. Выращиваемая в искусственных условиях рыба содержат намного меньшее количество n-3 PUFAs, чем дикая рыба. Было отмечено, что, если пациенты с раком предстательной железы употребляют в пищу жир морских рыб, eIF2α подвергается фосфорилированию, что позволяет предположить, что доступность функционального eIF2 для тройного комплекса снижается, что согласуется с данными по применению EPA и синтетических ингибиторов тройного комплекса на животных моделях или клеточных экспериментальных системах. Соответственно пищевые добавки, которые содержат ингибиторы инициации трансляции, представляют собой привлекательные коммерческие продукты для лечения и/или профилактики рака и/или пролиферативных заболеваний, при которых ненормальная пролиферация клеток свидетельствует о патологической аномалии. Такие пищевые добавки также могут действовать как регуляторы инициации трансляции и представляют собой привлекательные коммерческие продукты для лечения и/или профилактики болезней обмена веществ, таких как ожирение и диабет.
[006] Рыбий жир из различных источников является широкодоступным для потребителей в качестве продукта питания или пищевой добавки. Жир или его фракции или компоненты, заключенные в различные партии, пакеты, образцы или дозы продукта, могут различаться по качеству или эффективности в зависимости от их источника (например, климата, вида рыб или условий выращивания, поставщиков) или условий производства. Это же касается содержания отдельной партии, пакета, образца или дозы продукта. Другие продукты питания, нутрицевтики или лекарственные средства, которые содержат природные или синтетические ингибиторы инициации трансляции, могут различаться по качеству или эффективности по тем же причинам.
[007] Существует необходимость в контроле качества и/или гарантии в отношении физиологического или медицинского действия продукта на потенциальных потребителей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[008] Пищевые добавки с лекарственным/профилактическим действием на заболевания человека во всем мире представляют собой быстро растущую отрасль производства с оборотом в несколько миллиардов. Однако существенной нерешенной проблемой в данной отрасли является отсутствие контроля за качеством продуктов, полученных из природных источников, для обеспечения гарантии конкретной биологической активности и эффективности, однородности биологического воздействия различных препаратов, выделенных/полученных из одного растительного/животного источника и сравнимой эффективности лекарственных средств, выделенных из одинаковых видов растений или животных, происходящих из различных географических регионов и/или от различных производителей.
[009] Ингибиторы, положительные регуляторы или другие модуляторы инициации трансляции оказывают широкий спектр воздействий в отношении рака, пролиферации клеток, а также разнообразное действие в отношении энергетического баланса. Нутрицевтики, содержащие ингибиторы, положительные регуляторы или другие модуляторы инициации трансляции, включая, но не ограничиваясь ими, препараты из рыбьего жира, можно применять для профилактики заболеваний человека, для которых характерна ненормальная пролиферация клеток, включая рак. Однако отсутствие в настоящее время биологических способов анализа для определения биологической активности нутрицевтиков такого рода не позволяет контролировать их качество, эффективность и/или однородность нутрицевтиков различных брендов, источников или из различных партий или различных продуктов одной партии или источника.
[010] Соответственно, согласно некоторым вариантам реализации настоящее изобретение предлагает способы контроля качества и/или обеспечения гарантии способности продуктов питания, нутрицевтиков и лекарственных средств модулировать инициацию трансляции мРНК, благодаря чему осуществляется предоставление точной информации потребителям о возможной пользе для здоровья таких продуктов.
[011] Обеспечиваются биологические способы анализа инициации трансляции, которые можно применять для количественной оценки биологической активности соединений, например, нутрицевтиков, которые содержат ингибиторы, положительные регуляторы или модуляторы трансляции. С помощью биологических способов анализа инициации трансляции согласно настоящему изобретению оценивают качество (например, биологическую активность), эффективность и однородность партии нутрицевтиков, которые содержат продукты, например, эндогенные продукты или добавки, которые выступают в качестве ингибиторов, положительных регуляторов или других модуляторов инициации трансляции.
[012] Указанные способы анализа предлагают точные и быстрые средства определения степени, с которой данный образец продукта питания, нутрицевтика или лекарственного средства может модулировать инициацию трансляции, тем самым, принося пользу человеку или животному, которое употребляет данный продукт или которому вводят данный продукт. Указанные способы анализа обычно позволяют исследовать способность образца такого продукта подавлять инициацию трансляции мРНК. Примеры указанных способов анализа, приведенные в настоящем описании, позволяют определить способность образца подавлять образование, доступность или активность тройного комплекса посредством фосфорилирования eIF2α или другим образом.
[013] Согласно некоторым вариантам реализации образец продукта можно проверить на способность положительно регулировать трансляцию некоторых транскриптов мРНК. Положительная регуляция трансляции таких транскриптов может указывать на наличие, уровень, доступность и/или активность EPA или других 3-n PUFA, содержащихся в образце. Согласно некоторым вариантам реализации можно определять способность образца усиливать трансляцию некоторых транскриптов мРНК, 5' нетранслируемые области (5' UTR) которых содержат две или более открытые рамки считывания (ORF). Согласно некоторым вариантам реализации можно исследовать способность образца усиливать трансляцию одного или более ATF-4, мРНКb BRCA1, CD59, TCTP и GCN4 как меру эффективности и/или способности образца приносить пользу здоровью человека или животного, которое употребляет или которому вводят соответствующий продукт. В таких способах анализа можно определять увеличение количества, доступности или активности белков, полученных в результате повышенной трансляции указанных мРНК. Степень, до которой усиливают, положительно регулируют или другим образом изменяют трансляцию маркерных белков, можно определить посредством сравнения результатов, полученных для опытного образца с результатом для контроля. Не желая быть связанными какой-либо определенной теорией, такой повышенной трансляции может способствовать фосфорилирование eIF2α и/или ингибирование тройного комплекса.
[014] Настоящее изобретение позволяет исследовать образец продукта питания, нутрицевтика или лекарственного средства на наличие благоприятной активности посредством детектирования нуклеиновых кислот продуктов генов, транскрипция которых усиливается, положительно регулируется или другим образом изменяется в присутствии EPA или других 3-n PUFA, содержащихся в таком образце.
[015] Согласно некоторым вариантам реализации настоящее изобретение обеспечивает определение транскриптов генов, количество которых увеличивается, положительно регулируются или иным образом модулируются в присутствии EPA, других 3-n PUFA или других полезных агентов. Такие транскрипты могут включать, но не ограничиваются ими, транскрипты, которые кодируют ATF-4, BiP, CHOP, Xpb-1 и синтетазы аминокислот. Некоторые варианты реализации настоящего изобретения обеспечивают возможность определения присутствия транскриптов мРНК, которые кодируют такие белки, например, с применением способов обратной транскрипции, амплификации нуклеиновых кислот (например, способом ПЦР или изотермической амплификации, которые известны в данной области техники) или способов гибридизации нуклеиновых кислот. Определение усиленной, положительно регулируемой или иным образом измененной транскрипции гена также можно осуществлять с применением способов анализа на основе репортерных генов, например, в которых промотор представляющего интерес гена функционально соединяют с репортерным геном перед осуществлением контакта с тестовым или контрольным образцом в системе, в которой может проходить транскрипция ДНК. Степень, до которой усиливается, положительно регулируется или иным образом модулируется транскрипция, определяют посредством сравнения уровней транскрипции или активности репортерного гена, наблюдаемых в исследуемом образце, с уровнями во внешнем или внутреннем стандарте (например, стандарте с двумя репортерными генами) или контроле.
[016] Согласно некоторым вариантам реализации обеспечивается способ анализа продуктов питания, нутрицевтиков и лекарственных средств посредством определения белков, кодируемых транскриптами генов, количество которых увеличивается, которые положительно регулируются или иным образом модулируются в присутствии EPA, других 3-n PUFA или других полезных агентов. Такие белки могут включать, но не ограничиваются ими, ATF-4, BiP, CHOP, Xbp-1 и синтетазы аминокислот. Уровни таких белков, наблюдаемые в присутствии исследуемого образца, можно сравнивать с уровнями, наблюдаемыми в присутствии стандартного или иного контрольного образца для определения эффективности исследуемого образца.
[017] Согласно другому варианту реализации обеспечивается способ определения однородности партии множества отдельных композиций, включающий этапы определения подавления инициации трансляции, повышенной регуляции или другой модулирующей активности по меньшей мере одной из указанных отдельных композиций, и сравнения подавления инициации трансляции, повышенной регуляции или другой модулирующей активности по меньшей мере одной из указанных отдельных композиций со стандартом для определения однородности партии.
[018] Соответственно, согласно некоторым вариантам реализации обеспечивается способ определения того, обладает ли вещество (например, вещество, полученное из рыбьего жира и/или вещество, содержащее EPA) одним или более полезным биологическим, нутрицевтическим или лекарственным свойством. Указанный способ включает этапы обеспечения второго образца, включающего вторую последовательность мРНК, которая имеет по меньшей мере две открытых рамки считывания в 5' нетранслируемой области (5' UTR), причем, указанная вторая последовательность мРНК кодирует второй белок, который представляет собой биологический маркер, приведение указанного второго образца в контакт с указанным веществом, и определение уровня трансляции указанных первого и второго биомаркерных белков, при этом уровень трансляции второго биомаркерного белка выше, чем уровень трансляции первого биомаркерного белка, если вещество обладает одним или более полезным биологическим, нутрицевтическим или лекарственным свойством. Согласно некоторым аспектам, осуществляют контакт указанного первого образца со стандартным веществом или контрольным веществом. Согласно другим аспектам первая мРНК и вторая мРНК имеют одинаковую последовательность. Согласно другим аспектам первый биомаркерный белок и второй биомаркерный белок являются одинаковыми. Согласно некоторым аспектам первый и второй биомаркерный белок выбирают из группы, состоящей из продукта транскрипта b гена предрасположенности к развитию рака груди 1 (BRCA1), фактора, активирующего транскрипцию 4 (ATF-4), трансляционно контролируемого белка опухоли (TCTP), протектина (CD59) и белка недерепрессибельного общего контроля (GCN4). Согласно другим аспектам этап определения уровней трансляции осуществляют посредством одного или более из: Вестерн-блоттинга, ИФА и иммуноцитохимии. Согласно некоторым аспектам указанный образец представляет собой животное, клетку или бесклеточную систему (например, систему лизата ретикулоцитов кролика), в которой может происходить, по необходимости, транскрипция ДНК и/или трансляция РНК. Клетки можно получать от людей, других млекопитающих (включая, но не ограничиваясь ими, мышей и крыс), цыплят или других птиц или дрожжей. Бесклеточные системы включают систему на основе ретикулоцитов кролика, ростков пшеницы или экстрактов цитоплазмы клеток млекопитающего, например, экстрактов HeLa S100. Согласно некоторым аспектам 5' UTR является природным или синтетическим. Согласно другим аспектам 5' UTR функционально связан с кодирующей последовательностью, которая кодирует репортерный белок. Согласно некоторым аспектам уровни трансляции определяют с помощью измерения одной или более активностей указанного репортерного белка. Согласно другим аспектам уровень трансляции второго биомаркерного белка составляет по меньшей мере 150% от уровня трансляции первого биологического маркера. Согласно некоторым аспектам указанное вещество исследуют на наличие активности n-3 полиненасыщенной жирной кислоты (PUFA) (например, эйкозапентаноевой кислоты (EPA)). Согласно некоторым аспектам указанное вещество представляет собой образец продукта питания, нутрицевтика или фармацевтического препарата.
[019] Согласно некоторым вариантам реализации обеспечивается способ определения того, обладает ли вещество (например, вещество, полученное из рыбьего жира и/или вещество, содержащее EPA) одним или более полезным биологическим, нутрицевтическим или лекарственным свойством. Указанный способ включает этапы обеспечения образца, включающего последовательность мРНК, которая имеет по меньшей мере две открытые рамки считывания в 5' UTR, при этом последовательность мРНК кодирует биомаркерный белок, осуществления контакта образца с указанным веществом, определения уровня трансляции указанного биомаркерного белка и определения уровня трансляции белка внутреннего стандарта, при этом уровень трансляции указанного биомаркерного белка является более высоким, по сравнению с уровнем трансляции белка внутреннего контроля, если вещество обладает одним или более полезным биологическим, нутрицевтическим или лекарственным свойством. Согласно некоторым аспектам указанный белок внутреннего стандарта кодируется последовательностью мРНК, которая имеет одну или более открытую рамку считывания в 5' UTR. Согласно другим аспектам указанный биомаркерный белок выбран из группы, состоящей из продукта транскрипта b гена BRCA1, ATF-4, TCTP, CD59 и GCN4. Согласно другим аспектам этап определения уровня трансляции осуществляют с помощью одного или более из: Вестерн-блоттинга, ИФА или иммуноцитохимии. Согласно другим аспектам 5' UTR представляет собой природную или синтетическую область. Согласно другим аспектам 5' UTR функционально связана с кодирующей последовательностью, которая кодирует репортерный белок. Согласно другим аспектам уровни трансляции определяют посредством исследования одной или более активностей указанного репортерного белка. Согласно другим аспектам уровень трансляции биомаркерного белка составляет по меньшей мере 150% от уровня трансляции указанного внутреннего стандарта. Согласно некоторым аспектам указанное вещество исследуют на наличие активности n-3 PUFA (например, EPA). Согласно некоторым аспектам указанное вещество представляет собой образец продукта питания, нутрицевтика или фармацевтического препарата.
[020] Согласно некоторым вариантам реализации обеспечивается способ определения того, опосредует ли вещество (например, вещество, полученное из рыбьего жира и/или вещество, содержащее EPA) положительную регуляцию транскрипции гена биологического маркера. Указанный способ включает этапы обеспечения первой тестовой системы, включающей последовательность мРНК, которая имеет кодирующую область первого репортерного белка, функционально связанную с промотором первого биологического маркера, обеспечения второй тестовой системы, включающей вторую последовательность мРНК, которая имеет кодирующую область второго репортерного белка, функционально соединенную с промотором второго биологического маркера, осуществления контакта указанной второй тестовой системы с указанным веществом и определения уровней транскрипции указанных первой и второй последовательностей мРНК, при этом уровень транскрипции второй последовательности мРНК является более высоким, по сравнению с уровнем транскрипции первой последовательности мРНК, если указанное вещество опосредует положительную регуляцию транскрипции гена биологического маркера. Согласно некоторым аспектам указанные первая и вторая тестовая системы представляют собой исследования на животных, клетках или в бесклеточной системе. Согласно некоторым аспектам осуществляют контакт первой тестовой системы со стандартным веществом или контрольным веществом. Согласно другим аспектам первая мРНК и вторая мРНК имеют одинаковую последовательность, и/или первый репортерный белок и второй репортерный белок являются одинаковыми. Согласно некоторым аспектам уровни транскрипции определяют методом ПЦР в режиме реального времени (например, in vitro или in vivo (например, в клетках)). Согласно некоторым аспектам транскрипционную активность определяют посредством определения одной или более активностей указанного репортерного белка. Согласно другим аспектам ген биологического маркера кодирует проапоптотический белок или белок - опухолевый супрессор (например, CHOP, BiP, ATF-4, Xbp-1 и синтетазу аминокислот и т.п.). Согласно некоторым аспектам транскрипция второй последовательности мРНК составляет по меньшей мере 150% от уровня транскрипции первой последовательности мРНК. Согласно некоторым аспектам исследуют наличие у вещества активности n-3 PUFA (например, EPA). Согласно некоторым аспектам указанное вещество представляет собой образец продукта питания, нутрицевтика или лекарственного средства.
[021] Согласно некоторым вариантам реализации обеспечивается способ изготовления продукта из рыбьего жира с контролем качества. Указанный способ включает этапы обеспечения первого образца, включающего первую последовательность мРНК, которая имеет по меньшей мере две открытых рамки считывания в 5' нетранслируемой области указанной первой последовательности мРНК, причем первая последовательность мРНК кодирует первый биомаркерный белок, обеспечения второго образца, включающего вторую последовательность мРНК, которая имеет по меньшей мере две открытых рамки считывания в 5' нетранслируемой области (UTR) указанной второй последовательности мРНК, причем вторая последовательность мРНК кодирует второй биомаркерный белок, контакта второго образца с продуктом рыбьего жира, определения уровней трансляции первого и второго биомаркерных белков, причем уровень трансляции второго биомаркерного белка является более высоким, чем уровень трансляции первого биологического маркера, если продукт из рыбьего жира может обладать полезными для пациента биологическими, нутрицевтическими или лекарственными свойствами, и отбор продукта из рыбьего жира, который имеет более высокий уровень трансляции в качестве продукта из рыбьего жира с контролем качества. Согласно некоторым аспектам указанный первый образец смешивают со стандартным веществом или контрольным веществом. Согласно другим аспектам указанные первая и вторая мРНК имеют одинаковую последовательность. Согласно другим аспектам первый биомаркерный белок и второй биомаркерный белок являются одинаковыми (например, продукт транскрипта b BRCA1, ATF-4, TCTP, CD59 и GCN4).
[022] Согласно некоторым вариантам реализации обеспечивается способ производства продукта из рыбьего жира с осуществлением контроля качества. Указанный способ включает этапы обеспечения образца, включающего последовательность мРНК, которая имеет по меньшей мере две открытые рамки считывания в 5' нетранслируемой области указанной последовательности мРНК, причем последовательность мРНК кодирует биомаркерный белок, осуществления контакта указанного образца с продуктом из рыбьего жира, определения уровня трансляции указанного биомаркерного белка, определения уровня трансляции белка внутреннего стандарта, причем уровень трансляции биомаркерного белка является более высоким, чем уровень трансляции белка внутреннего стандарта, если указанный продукт из рыбьего жира может оказать полезное для пациента биологическое, нутрицевтическое или лекарственное воздействие, и отбор продукта рыбьего жира, который имеет более высокий уровень трансляции в качестве продукта из рыбьего жира с контролем качества. Согласно некоторым аспектам биомаркерный белок выбран из группы, состоящей из продукта транскрипта b BRCA1, ATF-4, TCTP, CD59 и GCN4.
[023] Согласно некоторым вариантам реализации обеспечивается способ изготовления продукта из рыбьего жира с осуществлением контроля качества. Указанный способ включает этапы обеспечения первой тестовой системы, включающей последовательность мРНК, которая имеет кодирующий участок для первого репортерного белка, функционально связанный с промотором первого биологического маркера, обеспечения второй тестовой системы, включающей вторую последовательность мРНК, которая имеет кодирующий участок для второго репортерного белка, функционально связанный со вторым промотором биологического маркера, осуществления контакта указанной второй тестовой системы с продуктом из рыбьего жира, определения уровней транскрипции указанных первой и второй последовательностей мРНК, причем уровень транскрипции указанной второй последовательности мРНК является более высоким, чем уровень транскрипции указанной первой последовательности мРНК, если продукт из рыбьего жира может оказывать на пациента одно или более полезное биологическое, нутрицевтическое или лекарственное воздействие, и отбор продукта из рыбьего жира, который имеет более высокий уровень трансляции в качестве продукта из рыбьего жира с контролем качества. Согласно некоторым аспектам указанный промотор биологического маркера выбран из группы, состоящей из промотора CHOP, BiP, ATF-4, Xbp-1 или промотора синтетазы аминокислот и т.п. других промоторов, которые аналогично индуцируются при подавлении инициации трансляции.
[024] Согласно следующим вариантам реализации настоящего изобретения обеспечиваются способы обнаружения транскриптов в образце, количество которых увеличивается в результате активности омега-3 жирных кислот, с применением способов определения нуклеиновых кислот, таких как ПЦР в режиме реального времени. Также обеспечиваются способы обнаружения транскриптов в образце, количество которых увеличивается в результате активности омега-3 жирных кислот, посредством обнаружения активности репортерных белков, кодируемых генами под контролем промоторов, транскрипция которых положительно регулируется омега-3 жирными кислотами. Также обеспечиваются способы определения повышенной трансляции транскриптов, которые имеют две или более открытых рамок считывания в своих 5'UTR. Также обеспечиваются способы изготовления продуктов питания, нутрицевтиков и лекарственных средств с осуществления контроля качества с использованием способов определения транскриптов в образце, количество которых увеличивается в результате активности омега-3 жирных кислот.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[025] Другие особенности и преимущества настоящего изобретения станут более понятными из следующего подробного описания примеров вариантов реализации изобретения, взятыми вместе с сопутствующими Фигурами, на которых:
[026]. На Фигуре 1 отображены результаты, полученные при амплификации транскрипта мРНК, кодирующей CHOP.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[027] Было сделано неожиданное наблюдение, что некоторые мРНК транслируются более эффективно, если тройной комплекс присутствует в небольшом количестве, чем, если он присутствует в изобилии (Aktas et al., 2004, Journal of Nutrition 134(9): 2487S-2491S; Halperin и Aktas, международная заявка на получение патента № WO 2008/008333). К ним относится мРНК, кодирующая фактор транскрипции ATF-4, который оказывает положительное воздействие на транскрипцию многих генов ответа на стресс ER, такие как проапоптотический белок, гомологичный C/EBP (CHOP), или ER белок, связывающий шапероны (BiP) (Harding et al., 2000, MoL Cell 6: 1099). Изоформа мРНК BRCA1, обозначаемая как мРНКb, также более эффективно транслируется, если указанный тройной комплекс присутствует в небольшом количестве. Было отмечено, что n-3 полиненасыщенная жирная эйкозапентаеновая кислота (EPA) положительно регулирует CHOP (GenBank номер доступа S40706) и регулируемый глюкозой белок 78 (BiP, RefSeq номер доступа NM_005347) в раковых клетках и в опухолях, полученных от животных моделей или пациентов, и что она повышает трансляцию мРНКb BRCA1 в клеточных линиях опухоли молочной железы и опухолей животных.
[028] Как мРНКb BRCA1, так и мРНК, которая кодирует фактор активации транскрипции 4 (ATF-4, RefSeq номер доступа NM_001675), содержит множество открытых рамок считывания (ORF) в 5' нетранслируемой области (5' UTR). Без связи с определенной научной теорией, были обнаружены дополнительные мРНК, которые содержат две или более ORF в соответствующих 5' UTR. Такие мРНК включают, но не ограничиваются, мРНК транскрипты генов, которые кодируют трансляционно контролируемый белок опухоли (TCTP, RefSeq номер доступа NM_003295.2), протектин (CD59) и белок недерепрессибельного общего контроля 4 (GCN4, RefSeq номер допуска NC_00113). Согласно некоторым вариантам реализации настоящего изобретения образец продукта питания, нутрицевтика или лекарственного средства можно исследовать на наличие способности увеличивать присутствие, уровень или биологическую активность белка, кодируемого транскриптом мРНК, имеющим множество ORF в своей 5' UTR. В частности, такой образец можно исследовать на наличие свойства способствовать увеличению присутствия, уровня или активности одного или более из BRCA1, ATF-4, TCTP, CD59 и GCN4.
[029] Повышенная транскрипция некоторых генов также происходит в присутствии ингибиторов тройного комплекса. Кроме генов, которые кодируют ATF-4, BiP и CHOP, генами, которые демонстрируют усиленную транскрипцию в присутствии ингибиторов инициации трансляции, являются гены, которые кодируют белок 1, связывающий X-box (Xbp-1, RefSeq номер доступа NM_001079539.1) и синтетазы аминокислот. Такие гены обеспечивают подходящие биологические маркеры для ингибиторов инициации трансляции, исследованных согласно изобретению, например, обнаруженных в рыбьем жире. Указанные транскрипты генов можно обнаруживать и можно количественно оценивать их уровни до и после воздействия на подопытных животных, клетки или бесклеточные системы исследуемых продуктов питания, нутрицевтиков или лекарственных средств с помощью способов, известных в данной области техники, и можно сравнивать уровни транскриптов для определения степени, в которой исследуемый образец усилил транскрипцию маркерного гена. В другом случае, уровни транскриптов исследуемых биологических маркеров можно сравнивать с уровнями транскриптов контроля (например, генов домашнего хозяйства) или с транскриптами, полученными от животных, клеток или бесклеточных систем, которым предъявляли стандарты или контроли с известной биологической активностью. Аналогично можно определять и количественно оценивать белковые продукты транскриптов биологических маркеров и сравнивать их уровни с уровнями, полученными у необработанных животных, клеток или бесклеточных систем, которым предъявляли стандарты или контроли с известной биологической активностью.
[030] В настоящем описании термин «нутрицевтик» обозначает комбинацию «питательного вещества» и «лекарственного средства» (nutritional + pharmaceutical) и обозначает вещество для приема внутрь, которое оказывает благоприятное воздействие на организм, например, человека. Также термин «нутрицевтик» может обозначать одно или более соединение, которые присутствуют в веществе для приема внутрь. Вещества для приема внутрь включают, но не ограничиваются, пищевые добавки, продукты питания, напитки и т.п. Термины «нутрицевтик» и «пищевая добавка» могут использоваться взаимозаменяемо. Термин «вещество (например, продукт питания, нутрицевтик или лекарственное средство), имеющее полезные биологические, нутрицевтические или лекарственные свойства» относится к способности вещества оказывать полезное влияние на здоровье человека согласно настоящему описанию (например, для профилактики, снижения и/или излечения одного или более заболевания и/или расстройства согласно настоящему изобретению).
[031] Нутрицевтики согласно настоящему изобретению включают жиры, полученные из рыб, таких как рыбы холодных вод, рыбы теплых вод, рыбы пресноводных водоемов, рыбы соленых вод, рыбы солоноватых вод, дикие рыбы, рыбы, выращенные в искусственных условиях и т.п., и препараты жирных кислот, такие как препараты, содержащие омега-3 жирные кислоты.
[032] Термин «омега-3 жирная кислота» в настоящем описании обозначает полиненасыщенные жирные кислоты, такие как полиненасыщенные жирные кислоты, обнаруживаемые в жире жирных рыб, таких как макрель, лосось, сардины и т.п., или растительных источниках, таких как семена чии, периллы, льна, грецкого ореха, портулака, брусники, облепихи, конопли и т.п. и фруктах, таких как пальма ассаи. Омега-3 жирные кислоты включают, но не ограничиваются ими, α-линолевую кислоты (ALA), эйкозапентаеновую кислоту (EPA), докозагексаеновую кислоту (DHA) и т.п.
[033] Некоторые аспекты настоящего изобретения направлены на способы определения эффективности композиции в отношении подавления, положительной регуляции или модуляции инициации трансляции или транскрипции гена. Термин «эффективность» в настоящем описании включает, но не ограничивает эффективность соединения, например, нутрицевтика в отношении подавления, положительной регуляции или модуляции инициации трансляции или транскрипции гена. Эффективность композиции можно определить как способность композиции подавлять, положительно регулировать или иным образом модулировать инициацию трансляции или транскрипции гена по сравнению со стандартом или контролем.
[034] Стандарт или контроль согласно настоящему изобретению представляет собой соединение или композицию, обладающую способностью подавлять, положительно регулировать инициацию трансляции или транскрипции. Стандарты можно получать из различных источников, таких как источники омега-3 жирных кислот или других агентов согласно настоящему описанию. Стандарты могут быть синтезированы в лаборатории или быть получены из коммерческих источников. Стандарт может быть разбавлен или сконцентрирован для снижения или увеличения его активности в отношении подавления, положительной регуляции или модуляции трансляции, соответственно. В другом случае стандарт или контроль может являться внутренним по отношению к тестовой системе, например, гену, промотору гена, транскрипту мРНК или белку (например, гену домашнего хозяйства, промотору, транскрипту или белку), транскрипция или трансляция которых существенно не зависит от исследуемого вещества, например, β-актин, убиквитин, b-тубулин, GADPH и т.п.
[035] Согласно некоторым аспектам стандарт или контроль представляет собой омега-3 жирную кислоту, например, эйкозапентаеновую кислоту. Стандарт или контроль можно получать из рыбьего жира (например, жира морской рыбы) или семян льна.
[036] Согласно другим аспектам стандарт или контроль представляет собой биологический маркер, который достаточно нечувствителен к действию вещества, эффективность или биологическую активность которого исследуют. В настоящем описании по отношению к регуляции транскрипции гена или промотора гена или регуляции трансляции транскрипта мРНК или белка термин «достаточно нечувствительный» обозначает полностью не подверженные действию или измененные в значительно меньшей степени (например, по меньшей мере в 10, 100, 1000 раз или более чем в 1000 раз в меньшей степени) исследуемым веществом по сравнению с биомаркером активности исследуемого вещества.
[037] Согласно некоторым аспектам исследуемый образец калибруют таким образом, что его активные компоненты находятся в линейном диапазоне и не насыщают систему. Способы калибровки хорошо известны в данной области техники и включают простые разведения, серийные разведения и т.п.
[038] Настоящее изобретение обеспечивает анализы, в которых активность вещества в отношении подавления, положительной регуляции или модулирования трансляции или транскрипции сравнивают со стандартом с использованием одного или более биологических способов анализа согласно настоящему описанию. Композиция может иметь уровень активности, который составляет 0.001%, 0.01%, 0.1%, 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100%, 101%, 102%, 103%, 104%, 105%, 106%, 107%, 108%, 109%, 110%, 115%, 120%, 125%, 130%, 135%, 140%, 145%, 150%, 155%, 160%, 165%, 170%, 175%, 180%, 185%, 190%, 195%, 200%, 250%, 300%, 350%, 400%, 450%, 500%, 550%, 600%, 650%, 700%, 750%, 800%, 850%, 900%, 950%, 1000% или более 1000% от активности стандарта или контроля.
[039] Согласно некоторым аспектам подавление, положительная регуляция или другая модуляция активности в отношении инициации трансляции или транскрипции гена составляет приблизительно от 1% до 200%, от 5% до 195%, от 10% до 190%, от 20% до 180%, от 30% до 170%, от 40% до 160%, от 50% до 150%, от 60% до 140%, от 65% до 135%, от 70% до 130%, от 75% до 125%, от 80% до 120%, от 85% до 115%, от 90% до 110%, от 91% до 109%, от 92% до 108%, от 93% до 107%, от 94% до 106%, от 95% до 105%, от 96% до 104%, от 97% до 103%, от 98% до 102% или от 99% до 101% от активности стандарта или контроля. Согласно другим аспектам подавление, положительная регуляция или другая модуляция активности в отношении инициации трансляции или транскрипции гена составляет приблизительно от 50% до 150% от активности стандарта, от 80% до 120% от активности стандарта, от 90% до 110% от активности стандарта или от 95% до 105% от активности стандарта или контроля.
[040] Согласно некоторым вариантам реализации контроль или стандарт может обладать нулевой активностью. Поэтому для данной активности может быть получен двойной результат (т.е. положительный или отрицательный). В таком случае если необходимо точное количественное определение активности, ее можно определить в абсолютном значении или относительно стандарта, который обладает по меньшей мере некоторой активностью известного уровня.
[041] Нутрицевтик или композиция, которая содержит нутрицевтик согласно настоящему изобретению, могут быть разбавлены или концентрированы для снижения или повышения их активности в отношении подавления, положительной регуляции или модуляции трансляции или транскрипции по сравнению с контролем/стандартом, соответственно.
[042] Также настоящее изобретение обеспечивает способы анализа, в которых определяют однородность партии композиций посредством сравнения относительных активностей одной или более (например, 10, 100, 1000, 10,000 1,000,000 или более) композиций с использованием одного или более биологических способов анализа согласно настоящему описанию. В настоящем описании термин «однородность партии» или «однородность лота» обозначает, но не ограничивается ими, относительную активность в отношении положительной регуляции подавления инициации трансляции или модулирующую активность подавления инициации трансляции, или положительное воздействие на транскрипцию двух или более композиций партии или лота. Согласно настоящему описанию термин «партия» обозначает, но не ограничивается ею, группу из двух или более композиций. Партия включает композиции, полученные совместно или из двух или более источников (например, географических, животных, растительных, коммерческих или синтетических источников). Согласно настоящему описанию термин «партия» также может обозначать единой общей композиции, из которой необходимо получить единицы продуктов или исследуемых образцов или которая в дальнейшем будет иным образом разделена.
[043] В по меньшей мере некоторых примерах нутрицевтики согласно настоящему описанию можно использовать для лечения заболеваний, вызванных нарушенной пролиферацией клеток, таких как клеточные пролиферативные заболевания, (например, рак). Предполагается, что лечение клеточных пролиферативных заболеваний включает подавление пролиферации, включая быструю пролиферацию. В настоящем описании термин «клеточное пролиферативное заболевание» включает нарушения, для которых характерна нежелательная или неприемлемая пролиферация одной или более подгруппы (подгрупп) клеток у многоклеточного организма. Термин «рак» обозначает различные типы злокачественных новообразований, большинство из которых способно проникать в окружающие ткани, и могут метастазировать в различные места (смотри, например, PDR Медицинский словарь 1 издание, 1995). Термины «новообразование» и «опухоль» обозначают ненормальную ткань, которая растет посредством пролиферации клеток более быстро, чем нормальные ткани, и продолжает расти после удаления стимулов, которые вызвали пролиферацию (смотрите, например, PDR Медицинский словарь 1 издание, 1995). Такая ненормальная ткань демонстрирует частичное или полное отсутствие структурной организации и функционального соответствия нормальной ткани, которая может быть как доброкачественной (т.е. доброкачественная опухоль) или злокачественной (т.е. злокачественной опухолью).
[044] Выражение «лечение клеточных пролиферативных заболеваний» обозначает предотвращение индукции, начала, установления или роста новообразований у пациента или снижение роста существующих новообразований у пациента. Приведенное выражение также описывает подавление инвазии опухолевых клеток в окружающие ткани или метастазирование неоплазмы из одного места в другое. Примеры типов новообразований, включенных в область охвата настоящего изобретения, включают, но не ограничиваются ими, новообразования, ассоциированные с раком груди, кожи, костей, предстательной железы, яичников, матки, шейки матки, печени, легких, мозга, гортани, желчного пузыря, поджелудочной железы, прямой кишки, паращитовидной железы, щитовидной железы, надпочечников, иммунной систем, нервной ткани, головы и шеи, толстой кишки, живота, бронхов и/или почек.
[045] Заболевания нарушения пролиферации клеток также могут включать заболевания, вызванные чрезмерной пролиферацией клеток гладкомышечной мускулатуры сосудов, такие как пролиферативные сердечнососудистые заболевания, например, атеросклероз и рестеноз. Клеточные пролиферативные заболевания могут также включать нарушения, такие как пролиферативные заболевания кожи, например, X-сцепленный ихтиоз, атопический дерматит, аллергический контактный дерматит, эпидермолитический гиперкератоз и себорейный дерматит. Клеточные пролиферативные заболевания также могут включать заболевания, такие как аутосомно-доминантный поликистоз почек (ADPKD), мастоцитоз и нарушения пролиферации клеток, вызванные инфекционными агентами, такими как вирусы.
[046] Согласно по меньшей мере некоторым примерам исследуемые и/или полученные способами согласно настоящему описанию нутрицевтики можно применять для лечения заболеваний, вызванных нарушениями энергетического баланса, таких как нарушения обмена веществ, включая, но не ограничиваясь, диабет, ожирение, болезни накопления гликогена, болезни отложения жиров, митохондриальные заболевания и т.п. (смотри также сайт: emedicine.com/ped/GENETICS_AND_METABOLIC_DISEASE.htm). Согласно некоторым аспектам исследуемые и/или полученные способами согласно настоящему описанию нутрицевтики модулируют набор веса через взаимодействие с 5' UTR рецептора лептина.
[047] Способы обнаружения согласно настоящему описанию могут быть использованы для обнаружения одной или более представляющих интерес последовательностей ДНК, РНК, белков или полипептидов в биологическом образце in vitro, а также in vivo. Например, in vitro способы определения мРНК включают Нозерн-блоттинг и in situ гибридизацию. In vitro способы определения полипептида, соответствующего маркеру согласно настоящему изобретению, включают твердофазный иммуноферментный анализ (ИФА), Вестерн-блоттинг, иммунопреципитацию и иммунофлуоресценцию. In vitro способы определения геномной ДНК включают Саузерн-блоттинг. Также in vivo способы определения белка и/или полипептида включают введение пациенту меченого антитела, направленного против белка и/или полипептида. Например, антитело может быть мечено радиоактивным маркером, присутствие и расположение которого у пациента можно определить с помощью стандартных способов визуализации.
[048] Общий принцип обнаружения и/или количественной оценки включает получение образца или реакционной смеси, которая может содержать одну или более представляющих интерес последовательностей ДНК, РНК, белков или полипептидов, и зонд при соответствующих условиях и в течение времени, достаточном для взаимодействия и связывания указанного маркера с зондом, в результате чего образуется комплекс, который можно удалить из реакционной смеси и/или обнаружить в реакционной смеси. Указанные варианты анализа можно проводить различными способами.
[049] Например, один из способов проведения такого анализа будет включать иммобилизацию представляющей интерес последовательности ДНК, РНК, белка или полипептида или зонда на твердофазной подложке, также называемой субстратом, и определение целевых комплексов интересующей последовательности ДНК, РНК, белка или полипептида/пробы, иммобилизованных на твердофазной подложке, в конце реакции. Согласно одному варианту реализации указанного способа, образец, исследуемый на наличие и/или концентрацию маркера, можно иммобилизовать на носителе или твердофазной подложке. Согласно другому варианту реализации возможна обратная ситуация, когда зонд иммобилизован на твердой фазе, и образец, полученный от пациента, оставляют взаимодействовать в качестве не иммобилизованного компонента системы анализа.
[050] Существует множество известных способов закрепления компонентов системы анализа на твердой фазе. Они включают, но не ограничиваются, молекулы маркера или зонда, которые иммобилизованы посредством конъюгации с биотином или стрептавидином. Такие биотинилированные компоненты системы анализа можно получить с помощью способов с использованием биотин-NHS(N-гидрокси-сукцинимида), известных в данной области техники (например, набор для биотинилирования, Pierce Chemicals, Rockford, IL), и иммобилизовать в лунках 96-луночных планшетов, покрытых стрептавидином (Pierce Chemical). Согласно некоторым вариантам реализации поверхности с иммобилизованными компонентами системы анализа можно приготовить заранее и хранить.
[051] Другие подходящие носители или твердофазные подложки для таких способов анализа включают любой материал, способный связывать молекулы того класса, к которому относится материал илизонд. Хорошо известные подложки или носители включают, но не ограничиваются, стекло, полистирен, нейлон, полипропилен, полиэтилен, декстран, амилазы, природную и модифицированную целлюлозу, полиакриламиды, габбро и магнетит.
[052] Для проведения анализа с использованием указанных выше способов, не иммобилизованный компонент добавляют к твердой фазе, на которой закрепляют второй компонент. После завершения реакции компоненты, не образовавшие комплекс, можно удалить (например, с помощью отмывки) при таких условиях, что любые образованные комплексы останутся иммобилизованными на твердой фазе. Определение комплексов представляющей интерес последовательности ДНК, РНК, белка или полипептида/пробы, закрепленных на твердой фазе, можно выполнить с помощью различных способов, описанных в настоящем изобретении.
[053] Согласно некоторым вариантам реализации пробу, если она является не закрепленным компонентом системы анализа, можно метить в целях определения и считывания результатов анализа как напрямую, так и опосредованно, определимыми маркерами, известными специалисту в данной области техники. Примеры определимых маркеров включают различные радиоактивные группы, ферменты, простетические группы, флуоресцентные маркеры, люминесцентные маркеры, биолюминесцентные маркеры, частицы металлов, белок-белок связывающие пары, белок-антитела связывающие пары и т.п. Примеры флуоресцентных белков включают, но не ограничиваются, желтый флуоресцентный белок (YFP), зеленый флуоресцентный белок (GFP), голубой флуоресцентный белок (CFP), умбелиферон, флуоресцеин, флуоресцеин изотиоцианат, родамин, дихлоротриазинамин флуоресцеин, данзил хлорид, фикоэритрин и т.п. Примеры биолюминесцентных маркеров включают, но не ограничиваются ими, люциферазу (например, бактериальную, светлячков, щелкуна и т.п.), люциферин, аквеорин и т.п. Примеры ферментных систем, имеющих визуально детектируемые сигналы, включают, но не ограничиваются, галактозидазы, глюкоринидазы, фосфатазы, пероксидазы, холинэстеразы и т.п. Определимые маркеры также включают радиоактивные соединения, такие как 125I, 35S, 14C, 3H или 32P. Определимые маркеры являются коммерчески доступными из различных источников.
[054] Флуоресцентные метки и их прикрепление к нуклеотидам и/или олигонуклеотидам описаны во многих обзорах, включая Haugland, Handbook of Fluorescent Probes and Research Chemicals, 9 издание (Molecular Probes, Inc., Eugene, 2002); Keller и Manak, DNA Probes, 2 издание (Stockton Press, New York, 1993); Eckstein, издатель, Oligonucleotides and Analogues: A Practical Approach (IRL Press, Oxford, 1991); и Wetmur, Critical Reviews in Biochemistry and Molecular Biology, 26:227-259 (1991). Определенные способы, которые можно применять в соответствии с настоящим описанием, раскрыты в следующих публикациях: Патенты США №4,757,141, 5,151,507 и 5,091,519. Согласно одному аспекту используется один или более флуоресцентный краситель в качестве метки, например, описанный в Патентах США №5,188,934 (4,7-дихлорфлуоресцеин красители); 5,366,860 (спектрально разрешимые родаминовые красители); 5,847,162 (4,7-дихлорродаминовые красители); 4,318,846 (эфирно замещенные флуоресцентные красители); 5,800,996 (красители с переносом энергии флуоресценции); Lee et al.; 5,066,580 (ксантеновые красители); 5,688,648 (красители с переносом энергии флуоресценции) и т.п. Мечение также можно осуществлять с помощью квантовых точек, согласно описанию в следующих публикациях: Патент США №6,322,901, 6,576,291, 6,423,551, 6,251,303, 6,319,426, 6,426,513, 6,444,143, 5,990,479, 6,207,392, 2002/0045045 и 2003/0017264. Согласно настоящему изобретению термин «флуоресцентный краситель» включает сигнальную группу, которая передает информацию через поглощение и/или испускание флуоресценции одной или более молекулы. Такие флуоресцентные свойства включают интенсивность флуоресценции, продолжительность флуоресценции, характеристики спектра испускания, перенос энергии и т.п.
[055] Согласно другому варианту реализации определение способности зонда распознавать маркер можно осуществлять без мечения компонентов системы анализа (зонда или маркера) с использованием технологии, такой как анализ взаимодействия биологических молекул (BIA) (см., например, Sjolander et al. (1991) Anal. Chem. 63:2338 2345 и Szabo et al. (1995) Curr. Opin. Struct. Biol. 5:699 705). Согласно настоящему описанию термин «В1А» или «поверхностный плазмонный резонанс» обозначает способ исследования специфических биологических взаимодействий в режиме реального времени без мечения какого-либо участника процесса (например, BIAcore). Изменения массы на поверхности связывания (свидетельствующие о событии связывания) вызывают изменения коэффициента преломления света вблизи с поверхности (оптический феномен поверхностного плазмонного резонанса (SPR)), которые приводят к возникновению детектируемого сигнала, который можно использовать как показатель взаимодействий в режиме реального времени между биологическими молекулами.
[056] В другом случае, аналогичный количественный анализ и/или обнаружение можно осуществлять с использованием одной или более представляющей интерес последовательности ДНК, РНК, белка или полипептида и зонда в виде растворов в жидкой фазе. При таком исследовании комплекс представляющей интерес последовательности ДНК, РНК, белка или полипептида и зонда отделяют от не образовавших комплекс компонентов с помощью некоторых стандартных способов, включая, но не ограничиваясь ими: дифференциальное центрифугирование, хроматографию, электрофорез и иммунопреципитацию. При использовании дифференциального центрифугирования представляющую интерес последовательность ДНК, РНК, белка или полипептида можно отделить от не образовавших комплекс компонентов посредством нескольких этапов центрифугирования, благодаря различным скоростям осаждения комплексов по их размерам и плотности (см, например, Rivas and Minton (1993) Trends Biochem Sci. 18:284). Также можно использовать стандартные способы хроматографии для отделения молекул, образовавших комплекс, от молекул, не образовавших комплекс. Например, гель-фильтрация позволяет разделять молекулы по размеру и при использовании соответствующей смолы для гель-фильтрации на колонке, например, можно отделить относительно более крупный комплекс от относительно более малых не образовавших комплекс компонентов. Аналогично можно применять относительные различие в заряде комплексов представляющей интерес последовательности ДНК, последовательности РНК, белка или полипептида/зонда по сравнению с компонентами, не образовавшими комплекс, например, с использованием ионообменных смол для хроматографии. Такие смолы и способы хроматографии хорошо известны специалисту в данной области техники (см., например, Heegaard (1998) J. MoI. Recognit. 11: 141; Hage и Tweed (1997) J. Chromatogr. B. Biomed. Sci. Appl. 12:499). Гель электрофорез можно применять для отделения компонентов системы анализа, образовавших комплекс, от несвязавшихся компонентов (см., например, Ausubel et al, ed., Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1987 1999). При использовании указанного способа комплексы белков или нуклеиновых кислот разделяют, например, по размеру или заряду. Для поддержания связывающего взаимодействия в процессе электрофореза обычно отдают предпочтение не денатурирующим материалам матрикса геля и условиям в отсутствии восстанавливающего агента. Подходящие для конкретного варианта анализа условия и компоненты хорошо известны специалисту в данной области техники.
[057] Согласно некоторым вариантам реализации уровень представляющей интерес последовательности мРНК в биологическом образце можно определить как in situ, так и/или in vitro с использованием известных в данной области способов. Во многих способах определения экспрессии используется выделенная РНК. В способах in vitro для выделения РНК из клеток крови можно использовать любой способ выделения РНК, который не препятствует выделению мРНК (см., например, Ausubel et al, ed., Current Protocols in Molecular Biology, John Wiley & Sons, New York 1987 1999). Дополнительно можно обрабатывать большое количество клеток и/или образцов с использованием способов известных специалистам в данной области, такие как, например, одноэтапный способ выделения РНК согласно Chomczynski (1989, Патент США №4,843,155).
[058] Выделенную РНК можно использовать при анализе гибридизации или амплификации, которые включают, но не ограничиваются, Саузерн-блоттинг или Нозерн-блоттинг, полимеразную цепную реакцию или способ микрочипов. Согласно некоторым вариантам реализации диагностический способ определения уровня мРНК включает осуществление контакта указанной выделенной мРНК с молекулой нуклеиновой кислоты (зондом), который может гибридизоваться с мРНК, кодируемой определяемым геном. Зонд нуклеиновой кислоты может, например, представлять собой полноразмерную кДНК или ее часть, такую как олигонуклеотид длиной по меньшей мере 7, 15, 30, 50, 100, 250 или 500 нуклеотидов и достаточный для специфической гибридизации при строгих условиях с мРНК или геномной ДНК, кодирующей маркер согласно настоящему изобретению. Другие подходящие зонды для использования в диагностических системах анализа согласно настоящему изобретению описаны в настоящем изобретении.
[059] Согласно одному варианту мРНК иммобилизована на твердой поверхности и ее контакт с зондом осуществляют, например, посредством пропускания выделенной мРНК через агарозный гель и переноса мРНК из геля на мембрану, такую как нитроцеллюлозная мембрана. Согласно другому варианту зонд(ы) иммобилизован(ы) на твердой поверхности, и осуществляют контакт мРНК с зонд(ами), например, на микрочипах. Специалист в данной области техники с легкостью может адаптировать известные способы определения мРНК для применения для определения уровня мРНК, кодируемой маркерами согласно настоящему изобретению.
[060] Другой способ определения уровня мРНК, соответствующей маркеру согласно настоящему изобретению в образце включает процесс амплификации нуклеиновой кислоты, например, методом ПЦР с обратной транскрипцией (варианты экспериментов представлены в Патентах США №4,683,195 и 4,683,202), COLD-ПЦР (Li et al. (2008) Nat. Med. 14:579), лигазной цепной реакции (Barany, 1991, Proc. Natl. Acad. ScL USA, 88: 189), самоподдерживающейся реакции репликации последовательностей (Guatelli et al., 1990, Proc. Natl. Acad. ScL USA 87: 1874), системы амплификации, основанной на транскрипции (Kwoh et al. (1989) Proc. Natl. Acad. ScL USA 86: 1173), Q-бета репликазы (Lizardi et al. (1988) Bio/Technology 6: 1197), репликации по типу катящегося кольца (Патент США №5,854,033) или другим способом амплификации нуклеиновых кислот, с последующим определением амплифицированных молекул с использованием способов, известных специалисту в данной области. Указанные способы определения особенно полезны для определения молекул нуклеиновых кислот, если указанные молекулы присутствуют в очень малых количествах. Согласно настоящему описанию праймеры для амплификации определяют как пару молекул нуклеиновой кислоты, которые способны гибридизоваться с 5' или 3' областью гена (плюс и минус цепи, соответственно или наоборот) и содержат короткий участок между ними. В целом длина праймеров для амплификации составляет 10-30 нуклеотидов, и они располагаются с обеих сторон от участка длиной 50-200 нуклеотидов. При подходящих условиях и при наличии соответствующих реагентов такие праймеры способствуют амплификации молекулы нуклеиновой кислоты, содержащей последовательность нуклеотидов, по обеим сторонам которой расположены праймеры.
[061] В способах in situ не требуется выделять мРНК из образца (например, физиологической жидкости, например, клеток крови) перед обнаружением. В таких способах образец клетки или ткани обрабатывают с помощью известных гистологических способов. Затем образец иммобилизуют на подложке, обычно стекле, и затем объединяют с зондом, который гибридизуется с мРНК, кодирующей указанный маркер.
[062] В качестве альтернативы получению результатов на основе абсолютного значения уровня экспрессии представляющей интерес последовательности ДНК, РНК, белка или полипептида, можно получать результаты на основании определения нормализованного уровня экспрессии представляющей интерес последовательности ДНК, РНК, белка или полипептида. Уровни экспрессии нормализуют посредством корректировки абсолютного значения уровня экспрессии представляющей интерес последовательности ДНК, РНК, белка или полипептида посредством сравнения их экспрессии с экспрессией гена, который не является маркером, например, гена стандарта или контроля. Такая нормализация позволяет сравнивать уровень экспрессии образца из одного источника с уровнем экспрессии образца из другого источника.
[063] Согласно другому варианту реализации обнаруживают белок или полипептид. Согласно некоторым вариантам реализации агент для обнаружения полипептида согласно настоящему изобретению представляет собой антитело, способное связываться с полипептидом, который соответствует маркеру согласно настоящему изобретению, такое как антитело с определимой меткой. Антитела могут представлять собой поликлональные или более предпочтительно моноклональные антитела. Можно использовать целое антитело или его фрагмент (например, Fab или F(ab')2). Термин «меченый» при употреблении применительно к зонду или антителу обозначает прямое мечение зонда или антитела посредством присоединения (т.е. физического связывания) определяемого вещества к зонду или антителу, а также непрямое мечение зонда или антитела посредством взаимодействия с другим реагентом, который непосредственно мечен. Примеры непрямого мечения включают определение первого антитела с использованием флуоресцентно меченого второго антитела и конечное мечение ДНК зонда биотином, таким образом, что она может быть определена флуоресцентно меченым стрептавидином.
[064] Поликлональные антитела можно получить посредством иммунизации подходящего животного выбранным белком или полипептидом. Можно отслеживать титр выбранного белка в течение времени с помощью стандартных способов, таких твердофазный иммуноферментный анализ (ELISA), с использованием иммобилизованного белка. При необходимости молекулы антител, направленных против выбранного белка, можно выделять из млекопитающего (например, из крови) и далее очищать с использованием известных способов, таких как хроматография с иммобилизованным белком A, для получения фракции IgG. Через соответствующий промежуток времени после иммунизации, например, когда титр антитела к выбранному белку наибольший, у пациента можно получить антитело-продуцирующие клетки для получения антител с помощью стандартных методов, таких как метод гибридом, первоначально описанный Kohler и Milstein (1975) Nature 256:495-497) (также см., Brown et al. (1981) J. Immunol. 127:539-46; Brown et al. (1980) J. Biol. Chem. 255:4980-83; Yeh et al. (1976) Proc. Natl. Acad. ScL USA 76:2927-31; and Yeh et al. (1982) Int. J. Cancer 29:269-75), метод гибридом B-клеток человека (Kozbor et al. (1983) Immunol. Today 4:72), метод гибридом EBV (Cole et al. (1985), Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96) или методы триом. Способ получения моноклональных антител с помощью гибридом хорошо известен в данной области техники (см., например, R.H. Kenneth, Monoclonal Antibodies: A New Dimension In Biological Analyses, Plenum Publishing Corp., New York, N.Y. (1980); E.A. Lerner (1981) Yale J. Biol. Med. 54:387-402; Gefter et al. (1977) Somatic Cell Genet. 3:231-36). Вкратце иммортализованную клеточную линию (обычно клетки миеломы) сливают с лимфоцитами (обычно спленоцитами) млекопитающего, иммунизированного выбранным белком согласно описанию выше, и исследуют супернатант культуры полученных клеток гибридом для обнаружения гибридомы, продуцирующей моноклональное антитело, которое связывает выбранный белок.
[065] Для определения того, содержит ли образец белок, который связывается с данным антителом, существует множество способов. Примеры таких способов включают, но не ограничиваются ими, иммуноферментный анализ (EIA), радиоиммуноферментный анализ (RIA), Вестерн-блоттинг, твердофазный иммуноферментный анализ (ELISA) и т.п. Специалист в данной области техники с легкостью адаптирует известные способы определения белков/антител к применению для определения того, экспрессируют ли клетки (например, клетки биологических жидкостей (например, клетки крови) маркер согласно настоящему изобретению.
[066] Согласно одному варианту антитела или их фрагменты можно использовать в методах, таких как Вестерн-блоттинг или методы иммунофлуоресценции для определения экспрессированных белков. При таком применении обычно предпочтительно иммобилизовать антитело или белок на твердой подложке. Подходящие твердофазные подложки или носители включают любую подложку, способную связывать антиген или антитело. Хорошо известные носители или подложки включают стекло, полистирен, полипропилен, полиэтилен, декстран, нейлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, габбро, магнетит и т.п.
[067] Специалисту в данной области техники знакомы различные подходящие носители для связывания антитела или антигена, и они способны адаптировать такие подложки для применения согласно настоящему изобретению. Например, белки, выделенные из клеток (например, из клеток жидких тканей организма, такие как лейкоциты) можно прогонять на электрофорезе и иммобилизовать на твердофазной подложке, такой как нитроцеллюлозная подложка. Затем подложку можно промывать подходящими буферами с последующей обработкой меченым антителом. После этого твердофазную подложку можно второй раз промывать буфером для удаления несвязавшегося антитела. Затем количество связанной метки на твердофазной подложке можно определять традиционными способами.
[068] Согласно некоторым вариантам реализации системы анализа согласно настоящему изобретению можно проводить на животных моделях (включая, но не ограничиваясь ими, лошадей, коров, овец, свиней, коз, кроликов, морских свинок, крыс, мышей, песчанок, не человекообразных обезьян и т.п.), клетках (например, клетках микроорганизмов (например, бактерий, дрожжей и т.п., на вирусах) или в бесклеточных системах (например, in vitro анализы транскрипции, in vitro анализы трансляции, анализы с использованием лизата клеток, анализы с использованием лизата фракционированных клеток и т.п.).
[069] Следует понимать, что варианты реализации настоящего изобретения, которые были описаны, приведены для иллюстрации некоторых способов применения идеи настоящего изобретения. Специалисты в данной области техники смогут осуществить многочисленные модификации на основе идеи настоящего изобретения без отклонения от духа и области охвата изобретения. Содержание всех ссылок, патентов и опубликованных заявок на получение патентов, приведенных в настоящей заявке, включено в настоящее описание посредством ссылки в различных целях.
[070] Приведенные ниже примеры представлены для иллюстрации настоящего изобретения. Указанные примеры не следует понимать как ограничивающие масштаб изобретения, поскольку указанные и другие равные варианты реализации будут очевидны с учетом настоящего описания, фигур, таблиц и прилагаемой формулы изобретения.
ПРИМЕР 1
Определение мРНК биологического маркера методом ПЦР в режиме реального времени
[071] ПЦР в режиме реального времени представляет собой количественный способ определения изменений уровней определенных РНК; поэтому ПЦР в режиме реального времени проапоптотических генов и генов-супрессоров опухоли, транскрипция которых увеличивается в присутствии ингибиторов указанного тройного комплекса, обеспечивает быстрый и точный способ количественного анализа для измерения доступности указанного тройного комплекса, и представляет собой эффективный заместительный способ анализа фосфорилирования eIF2α, вызванного омега-3 жирными кислотами. Определили, что этот новый способ анализа также демонстрирует замечательную корреляцию с результатами, полученными при использовании существующего анализа с использованием ATF-4 клеток, который в значительной степени зависит от доступности указанного тройного комплекса. Таким образом, этот способ является улучшенным способом контроля качества и безопасности продуктов питания, нутрицевтиков и лекарственных средств относительно активности омега-3 жирный кислот и других полезных соединений, которые влияют на доступность указанного тройного комплекса для инициации трансляции мРНК.
Стандартный анализ ПЦР в режиме реального времени
[072] 1. Клетки человека, мыши или крысы, такие как гепатоциты крысы, фибробласты мыши или человека, высевают в в стандартную питательную среду, такую как DMEM или RPMI 1640 с 5-10% телячьей или бычьей сывороткой (в три лунки 6-луночного планшета или 100 мм планшета или в другой контейнер) для каждого условия;
[073] 2. Добавляют исследуемое соединение и контроль/стандарт;
[074] 3. Снимают клетки через 6 часов;
[075] 4. Выделяют РНК;
[076] 5. Осуществляют обратную транскрипцию РНК;
[077] 6. Амплифицируют обратный транскрипт мРНК биомаркера (например, той, которая кодирует CHOP, BiP, ATF-4, Xbp-1 или синтетазу аминокислот) и обратные транскрипты 18S РНК (внутренний стандарт);
[078] 7. Определяют количество обратного транскрипта биологического маркера после нормализации против обратного транскрипта 18S; и
[079] 8. Сравнивают количество обратного транскрипта биомаркера в образцах, обработанных различными веществами (например, обработанных исследуемыми веществами или носителем).
ПЦР в режиме реального времени в клетках
[080] 1. Высевают клетки (например, в 96-луночные планшеты или другие многокамерные контейнеры);
[081] 2. Обрабатывают различными дозами веществ или контролем;
[082] 3. Лизируют клетки через 6 часов;
[083] 4. Проводят обратную транскрипцию в тех же ячейках;
[084] 5. Амплифицируют обратный транскрипт мРНК биологического маркера (например, той, которая кодирует CHOP, BiP, ATF-4, Xbp-1 или синтетазу аминокист) и обратные транскрипты 18S РНК в одной лунке;
[085] 6. Определяют количество обратного транскрипта биологического маркера после нормализации против обратного транскрипта 18S; и
[086] 7. Сравнивают количество обратного транскрипта биологического маркера в образцах, обработанных различными веществами (например, обработанных исследуемыми веществами или носителем).
[087] Результаты, полученные после амплификации CHOP-кодирующего транскрипта мРНК, показаны на Фигуре 1, по сравнению с результатами, полученными при проведении существующего анализа ATF-4.
ПРИМЕР 2
Определение транскрипционной активности генов биологических маркеров с помощью анализа репортерного гена
[088] Другим способом, с помощью которого можно исследовать наличие и активность омега-3 жирных кислот в продуктах питания, нутрицевтиках и лекарственных средствах, является измерение положительной регуляции транксрипционной активности маркерного гена с использованием конструкций на основе репортерного гена. Согласно указанному способу каждая подобная конструкция содержит последовательность нуклеиновой кислоты, которая кодирует репортерный белок (например, люциферазу, зеленый, красный, дальний красный, dsRed, dsRed2, оранжевый, синий флуоресцентный белок, бета-галактозидазу, пероксидазу хрена, аквапорины, хлорамфеникол ацетилтрансферазу или другой белок, который производит определимый сигнал или обладает ферментативной или иной активностью, которую можно определить с помощью известных специалисту в данной области техники способов). С кодирующей последовательностью репортерного белка конструкции функционально соединена природная или синтетическая промоторная область, транскрипция которой усиливается в присутствии омега-3 жирных кислот или других подходящих ингибиторов инициации трансляции мРНК, например, ингибиторов тройного комплекса. Подходящие промоторы включают, но не ограничиваются, промоторы генов, которые кодируют биомаркеры, такие как CHOP, BiP, ATF-4, Xbp-1 или синтетазы аминокислот. При условиях, благоприятных для транскрипции нуклеиновых кислот или трансляции мРНК, система приводят в контакт или подвергают воздействию исследуемого образца. Подходящие отрицательные контроли включают, но не ограничиваются, параллельную тестовую систему, которая не контактировала или не подвергалась воздействию, или систему, которая взаимодействовала или подвергалась воздействию соответствующего стандартного образца. В тестовой и контрольной системе детектируют и количественно определяют функцию репортерного белка с помощью способов, известных в настоящей области техники, и уровни функции репортерного белка в тестовой и стандартной системе сравнивают для определения эффективности омега-3 жирных кислот, представленных в образце. В таком анализе сигнал, полученный с использованием конструкции с промотором ATF-4 или промотором CHOP, которые также включают природную 5'UTR ATF-4, амлифицируется в большей степени, чем сигналы, полученные при использовании других промоторов, т.к. в присутствии омега-3 жирных кислот усиливается транскрипция и трансляция ATF-4. С учетом этого могут быть получены репортерные конструкции, для того, чтобы сохранять уровни сигнала в линейном диапазоне уровня активности репортера, которая, как ожидается, возникает после воздействия тестовых образцов, в зависимости от их измеренной эффективности перед анализом, например, основанная на результатах, полученных на образцах, имеющих одинаковое происхождение, способ обработки и т.п.
[089] Некоторые репортерные конструкции согласно настоящему изобретению также включают промоторы с высокой эффективностью транскрипции и 5'UTR с высокой эффективностью трансляции, такие как конструкции с промотором CHOP и 5'UTR ATF-4, для обеспечения усиления сигнала, которое предпочтительно является геометрическим, посредством чего обеспечивается выгодное соотношение сигнал/помехи по сравнению с репортерными конструкциями, включающими только один из двух элементов. Такие репортерные конструкции являются особенно полезными для способов анализа, в которых требуется высокая чувствительность, например, при сравнении разбавленных или слабоположительных образцов, которые обычно встречаются на ранних этапах обработки, или при определении редкой активности. Промоторы и 5'UTR также можно объединять в одну репортерную конструкцию с использованием известных специалисту в данной области техники способов согласно настоящему описанию. Полезные промоторы включают, но не ограничиваются ими, промоторы генов, которые кодируют биомаркеры, такие как CHOP, BiP, ATF-4, Xbp-1 или синтетазы аминокислот и т.п., известные в данной области техники согласно настоящему описанию. Полезные 5'UTR включают 5'UTR ATF-4, мРНКb BRCA1, CD59, TCTP и GCN4 и т.п. и другие, известные в данной области техники согласно настоящему описанию. Полезная репортерная конструкция, включающая оба элемента, особенно предпочтительна, если выбранные элементы, т.е. пары 5'UTR и промотора, реагируют на одинаковый или похожий агент или сигнал.
ПРИМЕР 3
Определение повышенной трансляции белков биологических маркеров
[090] Для определения эффективности омега-3 жирных кислот или других полезных агентов в продуктах питания, нутрицевтиках или лекарственных средствах транскрипты мРНК, в которых последовательности 5'UTR, содержащие две или более ORF, функционально соединены с последовательностями, которые кодируют репортерные белки, помещают в условия, в которых происходит трансляция белка, например, в животное, клетку или бесклеточную систему трансляции, такую как лизат ретикулоцитов кролика или другую систему, содержащую необходимые компоненты для трансляции мРНК в белок. Транскрипты могут быть получены в системе (например, экспрессированы в животном, клетке или другой смеси, которые содержат репортерную конструкцию и соответствующую полимеразу нуклеиновых кислот, например, РНК полимеразу) или быть произведены вне системы и добавлены в нее. Указанная система дополнительно может содержать внутреннюю контрольную или другую контрольную репортерную мРНК, на эффективность трансляции которой не влияет наличие омега-3 жирных кислот или других полезных агентов, которые определяют в настоящем анализе, посредством чего можно нормализовать уровни активности трансляции исследуемого образца и контроля против относительных количеств исследуемых и контрольных транскриптов, доступных для трансляции. В другом случае уровни репортерной мРНК можно нормализовать между различными исследуемыми образцами и можно сравнивать уровни репортерной активности.
[091] Подходящие 5'UTR для исследуемых транскриптов включают, но не ограничиваются ими, 5'UTR генов или транскриптов мРНК, которые кодируют биомаркерные белки, такие как BRCA1, ATF-4, TCTP, CD59 или GCN4. Подходящие 5'UTR для контрольных транскриптов можно получить от генов или транскриптов мРНК, которые кодируют белки домашнего хозяйства и/или белки, которые содержат одну или менее (то есть не содержат) ORF в соответствующих 5'UTR.
[092] Описанные выше системы обрабатывают или приводят в контакт с образцом продукта питания, нутрицевтика или лекарственного средства, и выявляют и количественно определяют с помощью известных в данной области техники способов функцию репортерного белка в пробе и стандартном образце (например, в пробе, между пробой и необработанным образцом, между пробой и образцом, обработанным стандартом эффективности омега-3 жирной кислоты или другого полезного агента), при этом повышенный уровень функции репортера положительно коррелирует с трансляционной активностью мРНК исследуемых репортерных мРНК и соответственно с эффективностью омега-3 жирной кислоты или другого полезного агента, содержащегося в пробе.
ПРИМЕР 4
Изготовление нутрицевтиков и других продуктов из рыбьего жира с контролем качества
[093] Согласно описанию выше рыбий жир представляет собой важный источник омега-3 жирных кислот, однако продукты из рыбьего жира значительно различаются по содержанию и биологической активности этих полезных веществ. Настоящее изобретение обеспечивает способы изготовления продуктов на основе рыбьего жира, которые также обладают известной единообразной биологической активностью омега-3 жирных кислот.
[094] Рыбу вылавливают и при жизни или сразу после умерщвления прессуют при условиях, соответствующих изготовлению продуктов питания, для эффективного выделения масла из плоти. Тяжелые металлы и другие вещества, загрязняющие окружающую среду, удаляют с помощью фильтрации, хелатирования или других способов, известных специалисту в данной области техники. После этого рыбий жир можно дополнительно обработать, например, для улучшения вкуса, аромата и/или внешнего вида, для добавления других полезных агентов (включая, но не ограничиваясь ими, фитостеролы и другие полезные вещества) или для концентрирования омега-3 жирных кислот и/или других полезных агентов. Дополнительно не обработанный, частично переработанный (например, нейтрализованный), разделенный на фракции или другим образом обработанный рыбий жир можно упаковывать, например, в бутылки или другие несъедобные контейнеры, или съедобные контейнеры, такие как капсулы для продуктов питания или лекарственных средств, например, гелевые капсулы или каплеты. Дополнительно омега-3 жирные кислоты и/или другие полезные агенты, содержащиеся в рыбьем жире, можно частично очистить или даже полностью очистить, т.е. выделить.
[095] На одном или более из упомянутых выше этапов, исследуют способность рыбьего жира, промежуточного продукта или готового продукта влиять на повышенную транскрипцию одного или более генов, которые кодируют биомаркеры, такие как ATF-4, CHOP, BiP, Xbp-1 или синтетазы аминокислот, или в другом случае на повышенную трансляцию мРНК, содержащих в своих 5'UTR два или более ORF, включая, но не ограничиваясь, 5'UTR мРНК, которые кодируют биомаркеры, такие как BRCA1, ATF-4, TCTP, CD59 или GCN4, с использованием способов, описанных в предыдущих Примерах. Полученные на ранних этапах изготовления результаты анализов могут позволить осуществить изменения в концентрации омега-3 жирных кислот на последующих этапах производства, или могут в другом случае способствовать сборке, смешиванию или формулированию компонентов продукта для получения продукта питания, нутрицевтика или лекарственного средства с известной эффективностью в отношении биологической активности омега-3 жирной кислоты. Дополнительно можно провести анализ образцов готового продукта (например, аликвоты жидкости или порошка или одиночный каплет, каждый из которых представляет партию или лот, из которого его извлекли) перед распространением, результаты которого можно указать на этикетке или другой рекламной информации с отражением уровня полезных биологических, нутрицевтических или лекарственных свойств, которыми обладает продукт, например, относительно подавления инициации трансляции, или лекарственных или профилактических свойств, вызванных подавлением, положительной регуляцией или другим изменением транскрипции биомаркерного гена или трансляции мРНК.
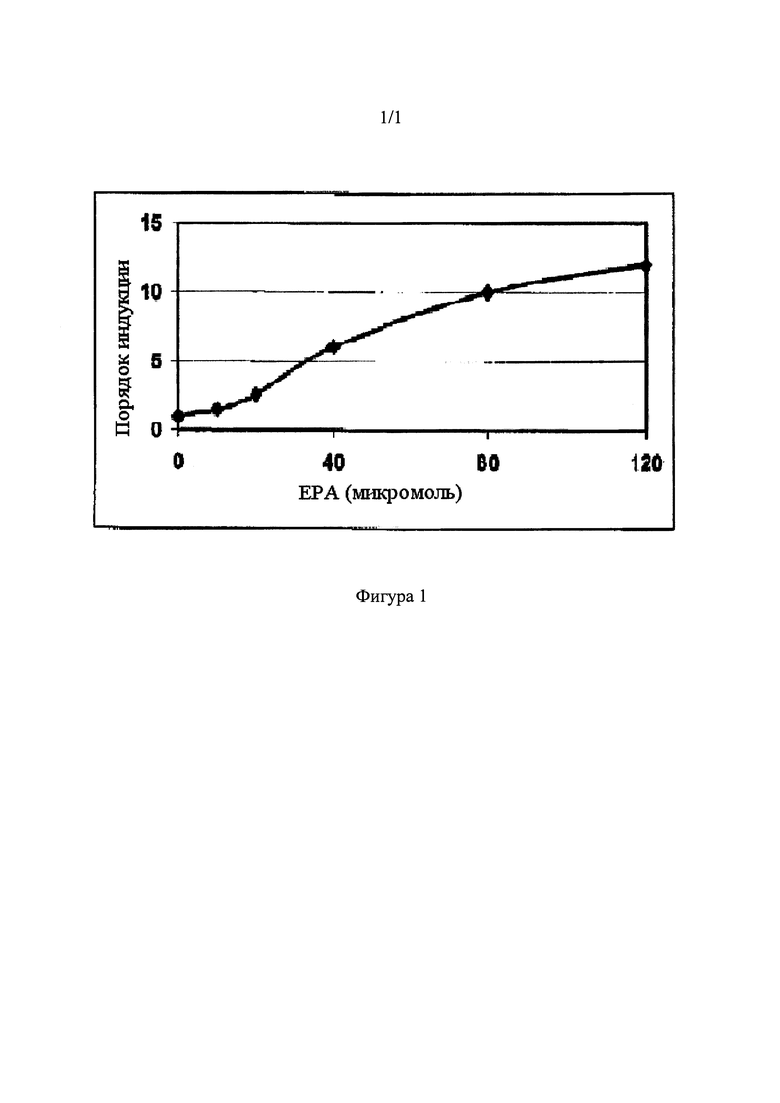
Изобретение относится к биотехнологии. Предложен способ in vitro определения наличия в образце рыбьего жира активности n-3 полиненасыщенной жирной кислоты (PUFA). Обеспечивают первую тестовую систему, включающую первую последовательность мРНК, кодируемую первым геном биомаркера, которая имеет кодирующую область первого репортерного белка, функционально связанную с промотором первого маркера. Приводят первую тестовую систему в контакт со стандартным веществом или контрольным веществом. Обеспечивают вторую тестовую систему, включающую вторую последовательность мРНК, кодируемую вторым геном биомаркера, которая имеет кодирующую область второго репортерного белка, функционально связанную со вторым промотором маркера. Приводят вторую тестовую систему в контакт с образцом рыбьего жира. Первый и второй гены маркеров выбраны из группы, состоящей из последовательностей нуклеиновых кислот, которые кодируют проапоптотический белок, гомологичный С/ЕВР (CHOP), ER белок, связывающий шапероны (BiP), фактор активации транскрипции 4 (ATF-4), и белок I, связывающий X-box (Xbp-1). Определяют уровни транскрипции первой и второй последовательностей мРНК. Определяют образец рыбьего жира как имеющий PUFA активность в случае, если образец опосредует положительную регуляцию транскрипции гена маркера и при этом уровень транскрипции второй последовательности мРНК является более высоким, чем уровень транскрипции первой последовательности мРНК. Изобретение позволяет исследовать продукты питания, нутрицевтики и лекарственные средства на наличие активности n-3 PUFA. 12 з.п. ф-лы, 1 ил., 4 пр.
1. Способ in vitro определения того, присутствует ли в образце рыбьего жира активность n-3 полиненасыщенной жирной кислоты (PUFA), включающий этапы:
- обеспечение первой тестовой системы, включающей первую последовательность мРНК, кодируемую первым геном биомаркера, которая имеет кодирующую область первого репортерного белка, функционально связанную с промотором первого биологического маркера,
- приведение указанной первой тестовой системы в контакт со стандартным веществом или контрольным веществом,
- обеспечение второй тестовой системы, включающей вторую последовательность мРНК, кодируемую вторым геном биомаркера, которая имеет кодирующую область второго репортерного белка, функционально связанную со вторым промотором биологического маркера,
- приведение указанной второй тестовой системы в контакт с образцом рыбьего жира, и определение уровней транскрипции указанных первой и второй последовательности мРНК, и
определение образца рыбьего жира как имеющего PUFA активность в случае, если образец опосредует положительную регуляцию транскрипции второго гена биологического маркера и при этом уровень транскрипции указанной второй последовательности мРНК является более высоким, чем уровень транскрипции указанной первой последовательности мРНК, и при этом указанные первый и второй гены биологических маркеров выбраны из группы, состоящей из последовательностей нуклеиновых кислот, которые кодируют проапоптотический белок, гомологичный С/ЕВР (CHOP), ER белок, связывающий шапероны (BiP), фактор активации транскрипции 4 (ATF-4), и белок I, связывающий X-box (Xbp-1).
2. Способ по п. 1, согласно которому указанные первая и вторая тестовые системы выбраны из группы, состоящей из исследований на клетке и бесклеточной системы.
3. Способ по п. 1, согласно которому уровни транскрипции определяют с применением ПЦР в режиме реального времени.
4. Способ по п. 3, согласно которому этап определения, включающий ПЦР в режиме реального времени, проводят in vitro.
5. Способ по п. 3, согласно которому этап определения, включающий ПЦР в режиме реального времени, проводят на клетках.
6. Способ по п. 1, согласно которому транскрипционную активность определяют посредством определения одной или более активностей указанного репортерного белка.
7. Способ по п. 1, согласно которому транскрипция указанной второй последовательности мРНК составляет по меньшей мере 150% от уровня транскрипции указанной первой последовательности мРНК.
8. Способ по п. 1, согласно которому указанный образец рыбьего жира выбирают из группы, состоящей из образца продукта питания, образца нутрицевтика и образца лекарственного средства.
9. Способ по п. 1, согласно которому указанный образец рыбьего жира содержит эйкозапентаеновую кислоту (ЕРА).
10. Способ по п. 1, отличающийся тем, что указанная n-3 PUFA активность выбрана из группы, состоящей из активности эйкозапентаеновой кислоты (ЕРА), активности α-линолевой кислоты (ALA) и активности докозагексаеновой кислоты (DHA).
11. Способ по п. 9, отличающийся тем, что указанный образец рыбьего жира получен из рыбы, выбранной из группы, состоящей из рыбы холодных вод, рыбы теплых вод, рыбы пресноводных водоемов, рыбы соленых вод, рыбы солоноватых вод, дикой рыбы, рыбы, выращенной в искусственных условиях.
12. Способ по п. 11, отличающийся тем, что указанная рыба представляет собой лосось, макрель или сардины.
13. Способ по п. 2, отличающийся тем, что указанная клетка представляет собой клетку дрожжей.
| WO 2008008333 A2, 17.01.2008 | |||
| US 2004115671 A1, 17.06.2004 | |||
| US 5955269 A1, 21.09.1999 | |||
| AKTAS et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| PALAKURTHI et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ПЕРЕРАБОТКИ РЫБЬЕГО ЖИРА С ПОЛУЧЕНИЕМ КОНЦЕНТРАТА ЭТИЛОВЫХ ЭФИРОВ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ | 1993 |
|
RU2041256C1 |
Авторы
Даты
2018-01-24—Публикация
2010-04-16—Подача