Настоящее изобретение относится к области молекулярной биологии растений и обеспечивает способы получения семя-специфичных и/или семя-предпочтительных промоторов высокой экспрессии и получения растений с усиленной семя-специфичной и/или семя-предпочтительной экспрессией нуклеиновых кислот, где нуклеиновые кислоты, усиливающие экспрессию нуклеиновой кислоты (NEENAs), функционально связаны с указанными промоторами и/или введены в растения.
Экспрессия трансгенов в растениях сильно зависит от различных внешних и внутренних факторов, приводящих к переменному и непредсказуемому уровню экспрессии трансгенов. Часто должно быть получено и проанализировано большое количество трансформантов, чтобы идентифицировать линии с желательной силой экспрессии. Поскольку трансформация и скрининг для линий с желательной силой экспрессии является дорогостоящим и трудоемким, существует потребность в высокой экспрессии одного или более трансгенов в растении. Эта проблема особенно резко выражена, когда несколько генов должны согласованно экспрессироваться в трансгенном растении, чтобы достигнуть определенного эффекта, поскольку должно быть идентифицировано растение, в котором сильно экспрессируется каждый ген.
Например, экспрессия трансгена может значительно изменяться в зависимости от дизайна конструкции и позиционных эффектов локуса инсерции Т-ДНК при отдельных событиях трансформации. Сильные промоторы могут частично решить эти проблемы. Однако доступность подходящих промоторов, демонстрирующих сильную экспрессию с желаемой специфичностью, часто ограничена. Чтобы гарантировать доступность достаточного количества промоторов с желаемой специфичностью экспрессии, идентификация и характеристика дополнительных промоторов могут помочь преодолеть этот пробел. Однако естественная доступность промоторов соответствующей специфичности и силы, и трудоемкость характеристики промоторов-кандидатов препятствуют идентификации подходящих новых промоторов.
Было показано, что разнообразные генетические элементы и/или мотивы, положительно влияют на экспрессию гена, чтобы преодолеть эти проблемы. Среди них некоторые интроны были признаны генетическими элементами с большим потенциалом для улучшения генной экспрессии. Было показано, что хотя механизм в основном неизвестен, некоторые интроны положительно влияют на количество стационарной зрелой м-РНК, возможно путем усиленной транскрипционной активности, улучшенным созреванием м-РНК, усиленным экспортом в ядро м-РНК и/или улучшенной инициацией трансляции (например, Huang and Gorman, 1990; Le Hir et al., 2003; Nott et al., 2004). Так как было показано, что только избранные интроны увеличивали экспрессию, сплайсинг, как таковой, вероятно не является ответственным за наблюдаемые эффекты.
Увеличение генной экспрессии, наблюдаемое при функциональном связывании интронов с промотором, называется интрон-опосредованным усилением (IME) генной экспрессии, и было отмечено в различных однодольных (например, Callis et al., 1987; Vasil et al., 1989; Bruce et al., 1990; Lu et al., 2008) и двудольных растениях (например, Chung et al., 2006; Kim et al., 2006; Rose et al., 2008). В этом отношении положение интрона относительно сайта инициации трансляции (ATG), как было показано, было крайне важно для интрон-опосредованного усиления генной экспрессии (Rose et al., 2004).
Наряду с их потенциалом для усиления генной экспрессии, было показано, что некоторые интроны также подвергаются влиянию тканевой специфичности в своем природном нуклеотидном окружении в растениях. Было найдено, что экспрессия репортерного гена зависела от присутствия геномных областей, содержащих до двух интронов (Sieburth et al., 1997; Wang et al., 2004). Также сообщали, что 5'-UTR интроны являются важными для надлежащей функциональности промоторных элементов, вероятно, из-за ткане-специфичных элементов генного контроля, располагающихся в интронах (Fu et al., 1995а; Fu et al., 1995b; Vitale et al., 2003; Kim et al., 2006). Однако эти исследования также показывают, что у комбинации интронов с гетерологичными промоторами могут быть сильные негативные воздействия на силу и/или специфичность генной экспрессии (Vitale et al., 2003; Kim et al., 2006, WO 2006/003186, WO 2007/098042). Например, сильный конститутивный промотор вируса мозаики цветной капусты CaMV35S подвергается отрицательному влиянию через комбинацию с интроном кунжута SeFAD2 5'UTR (Kim et al., 2006). В отличие от этих наблюдений, некоторые документы показывают усиленную экспрессию нуклеиновой кислоты посредством IME, не затрагивая тканевую специфичность соответствующего промотора (Schünmann et al., 2004). Интроны или NEENAs, которые увеличивают специфичную для семян и/или предпочтительную для семян экспрессию, когда функционально связаны с гетерологичным промотором, до сих пор не были известны.
В настоящей заявке описаны дополнительные молекулы нуклеиновой кислоты, которые усиливают экспрессию указанных промоторов, не затрагивая их специфичность при функциональном связывании со специфичными для семян и/или предпочтительными для семян промоторами. Эти молекулы нуклеиновой кислоты раскрываются в настоящей заявке как "нуклеиновая кислота, усиливающая экспрессию нуклеиновой кислоты" (NEENA). Интроны обладают внутренней особенностью, которая должна сплайсировать их из соответствующей пре-м-РНК. В отличие от этого нуклеиновые кислоты, представленные в рассматриваемой заявке, не обязательно должны быть включены в м-РНК или, если присутствуют в м-РНК, не обязательно должны сплайсироваться из м-РНК, чтобы увеличить экспрессию, происходящую от промотора, к которому функционально присоединены NEENAs.
Подробное описание изобретения
Первый вариант осуществления настоящего изобретения содержит способ получения специфичного для семян и/или предпочтительного для семян промотора высокой экспрессии, включающий функциональное связывание с промотором одной или более молекул нуклеиновой кислоты, усиливающих экспрессию нуклеиновой кислоты (NEENA), содержащих
i) молекулу нуклеиновой кислоты, имеющую последовательность как определено в любой из SEQ ID NO: 1-15, или
ii) молекулу нуклеиновой кислоты, имеющую последовательность с идентичностью 80% или больше к любой из последовательностей как определено посредством SEQ ID NO: 1-15, предпочтительно, идентичность составляет 85% или больше, более предпочтительно идентичность составляет 90% или больше, еще более предпочтительно, идентичность составляет 95% или больше, 96% или больше, 97% или больше, 98% или больше или 99% или больше, в самом предпочтительном варианте осуществления, идентичность составляет 100% к любой из последовательностей, определенных SEQ ID NO: 1-15 или
iii) фрагмент из 100 или более последовательных оснований, предпочтительно 150 или больше последовательных оснований, более предпочтительно 200 последовательных оснований или еще более предпочтительно 250 или больше последовательных оснований молекулы нуклеиновой кислоты по пунктам i) или ii), который имеет усиливающую экспрессию активностью, составляющую, например 65% или больше, предпочтительно 70% или больше, более предпочтительно 75% или больше, еще более предпочтительно 80% или больше, 85% или больше или 90% или больше, в самом предпочтительном варианте осуществления, 95% или больше от усиливающей экспрессию активностью соответствующей молекулы нуклеиновой кислоты, имеющей последовательность любой из последовательностей SEQ ID NO: 1-15, или iv) молекулу нуклеиновой кислоты, которая является комплементарной или обратно комплементарной любой из ранее упомянутых молекул нуклеиновой кислоты в пунктах i)-iii), или
v) молекулу нуклеиновой кислоты, которая может быть получена с помощью ПЦР, с использованием олигонуклеотидных праймеров, описанных SEQ ID NO: 20-29, 34-41, 44-51 и 54-57, как показано в Таблице 2 или
vi) молекулу нуклеиновой кислоты из 100 нуклеотидов или больше, 150 нуклеотидов или больше, 200 нуклеотидов или больше или 250 нуклеотидов или больше, гибридизующуюся при условиях, эквивалентных гибридизации в 7%-ом додецилсульфате натрия (ДСН), 0.5 M NaPO4, 1 мМ ЭДТА при 50°С с промывкой в 2 X SSC, 0.1% ДСН при 50°С или 65°С, предпочтительно 65°С, с молекулой нуклеиновой кислоты, содержащей по меньшей мере 50, предпочтительно по меньшей мере 100, более предпочтительно по меньшей мере 150, еще более предпочтительно по меньшей мере 200, наиболее предпочтительно по меньшей мере 250 последовательных нуклеотидов нуклеотидной последовательности, усиливающей транскрипцию, описанной SEQ ID NO: 1-15, или с ее комплементом. Предпочтительно, указанная молекула нуклеиновой кислоты гибридизуется при условиях, эквивалентных гибридизации в 7%-ном додецилсульфате натрия (ДСН), 0.5 M NaPO4, 1 мМ ЭДТА при 50°С с промывкой в 1 X SSC, 0.1% ДСН при 50°С или 65°С, предпочтительно 65°С, с молекулой нуклеиновой кислоты, содержащей по меньшей мере 50, предпочтительно по меньшей мере 100, более предпочтительно по меньшей мере 150, еще более предпочтительно по меньшей мере 200, наиболее предпочтительно по меньшей мере 250 последовательных нуклеотидов нуклеотидной последовательности, усиливающей транскрипцию, описанную посредством SEQ ID NO: 1-15 или комплементарной им, более предпочтительно указанная молекула нуклеиновой кислоты гибридизуется при условиях, эквивалентных гибридизации в 7%-ном додецилсульфате натрия (ДСН), 0.5 M NaPO4, 1 мМ ЭДТА при 50°С с промывкой в 0,1 X SSC, 0.1% ДСН при 50°С или 65°С, предпочтительно 65°С с молекулой нуклеиновой кислоты, содержащей по меньшей мере 50, предпочтительно по меньшей мере 100, более предпочтительно по меньшей мере 150, еще более предпочтительно по меньшей мере 200, наиболее предпочтительно по меньшей мере 250 последовательных нуклеотидов нуклеотидной последовательности, усиливающей транскрипцию, описанную любой из последовательностей SEQ ID NO: 1-15, или с ее комплементом.
В одном варианте осуществления одна или больше NEENA является гетерологичной по отношению к промотору, с которым она функционально связана.
Как описано выше в пункте v) молекула нуклеиновой кислоты, которая может быть получена с помощью ПЦР, с использованием олигонуклеотидов как определено SEQ IDs 20-29, 34-41, 44-51 и 54-57, как показано в Таблице 2, может быть получена, например, из геномной ДНК из растений Arabidopsis, таких как A. thaliana, с использованием условий, как описано ниже в Примере 1.
Специалист в данной области техники осведомлен об изменениях в температурном профиле, количестве циклов и/или буферной композиции или концентрации, чтобы получить соответствующую молекулу NEENA. Специфическая комбинация олигонуклеотидов, которые будут использоваться в соответствующей реакции ПЦР для того, чтобы получить соответствующую молекулу NEENA, описана в Таблице 2.
Специалист в данной области техники знает о способах для того, чтобы перевести однонаправленный промотор в двунаправленный, и способах, чтобы использовать комплементарную или обратно комплементарную промоторную последовательности для того, чтобы создать промотор, имеющий ту же самую промоторную специфичность как оригинальная последовательность. Такие способы, например, описаны для конститутивных, так же как и индуцибельных промоторов Xie et al. (2001) "Bidirectionalization of polar промоторе in plants" nature biotechnology 19 pages 677-679. Авторы описывают, что достаточно добавить минимальный промотор к 5'-концу любого данного промотора для получения промотора, контролирующего экспрессию в обоих направлениях с той же самой промоторной специфичностью. Следовательно, высоко экспрессионный промотор функционально связанный с NEENA, как описано выше, является функциональным как в комплементарном, так и в обратно комплементарном направлениях, и поэтому NEENA также функциональна как в комплементарном, так и в обратно комплементарном направлениях.
В принципе, NEENA может быть функционально связана с любым промотором, такими как тканеспецифические, индуцибельные, связанные с развитием или конститутивные промоторы. Соответствующая NEENA приведет к усилению специфической для семян и/или предпочтительной для семян экспрессии гетерологичной нуклеиновой кислоты под контролем соответствующего промотора, с которым одна или больше NEENA функционально связана. Усиление экспрессии промоторов, отличных от специфичных для семян и/или предпочтительных для семян промоторов, например конститутивных промоторов или промоторов с отличающейся тканеспецифичностью, будет обеспечивать специфичность этих промоторов. Экспрессия нуклеиновой кислоты под контролем соответствующего промотора будет значительно увеличена в семенах, где транскрипт указанной нуклеиновой кислоты может не быть или быть только слабо детектируемым без NEENA, функционально связанной с ее промотором. Следовательно, тканеспецифический или связанный с развитием или любой другой промотор может стать специфичным для семян и/или предпочтительным для семян промотором посредством функциональной связи с одной или более молекулами NEENA, как описанный выше промотор. Поэтому другой вариант осуществления изобретения относится к способу изменения специфичности любого данного промотора, функционального в растении, до специфичности в отношении семян и/или предпочтительности в отношении семян, посредством связывания соответствующего промотора с молекулой NEENA, содержащей последовательность, как описано выше а пунктах i)-vi).
Предпочтительно одна или больше NEENA является функционально связанной с любым специфичным для семян и/или предпочтительным для семян промотором и усиливает экспрессию молекулы нуклеиновой кислоты под контролем указанного промотора. Специфичные для семени и/или предпочтительные для семени промоторы, которые будут использоваться в любом способе настоящего изобретения, могут быть получены из растений, например однодольных или двудольных растений, из бактерий и/или вирусов или могут быть синтетическими промоторами. Специфичные для семян и/или предпочтительные для семян промоторы, которые могут быть использованы, представляют собой, например, SBP-промотор из Vicia faba, промотор неизвестного семенного белка (USP) из Vicia faba, промотор напина из Brassica napus, промотор конлинина из Linum usitatissmum, промотор из А. thaliana гена At5g01670, кодирующего пероксиредоксин-подобный белок, промотор пероксиредоксин-подобного белка из Linum usitatissmum, промотор глобулин-подобного белка из Brassica napus, промотор арселина 5-1 из Phaseolus vulgaris, промотор зеина из кукурузы, промотора глобулина от кукурузы, pKG86 промотор из кукурузы, как описано ниже в Примере 6 и т.п.
Специфичные для семени и/или предпочтительные для семени промоторы высокой экспрессии в соответствии с настоящим изобретением, функционально связанные с NEENA, могут использоваться в любом растении, включая, например, мох, папоротник, голосеменное растение или покрытосемянное растение, например однодольное или двудольное растение. В предпочтительном варианте осуществления указанный промотор в соответствии с настоящим изобретением, функционально связанный с NEENA, может быть использован в однодольных или двудольных растениях, предпочтительно в сельскохозяйственных культурах, таких как кукуруза, соя, канола, хлопок, картофель, сахарная свекла, рис, пшеница, сорго, ячмень, банан, сахарный тростник, мискантус и т.п. В предпочтительном варианте осуществления изобретения указанный промотор, который функционально связан с NEENA, может использоваться в однодольных в сельскохозяйственных культурах, таких как кукуруза, рис, пшеница, сорго, ячмень, банан, мискантус или сахарный тростник. В особенно предпочтительном варианте осуществления промотор функционально связанный с NEENA, может использоваться в двудольных в сельскохозяйственных культурах, таких как соя, канола, хлопок или картофель.
Специфичный для семени и/или предпочтительный для семени промотор высокой экспрессии, как раскрывается в настоящей заявке, означает, например, промотор, который функционально связан с NEENA, что является причинной усиленной специфичной для семян и/или предпочтительной для семян экспрессии промотора в семенах растений или их частях, где накопление РНК или скорость синтеза РНК в семенах, полученных из молекулы нуклеиновой кислоты под контролем соответствующего промотора, функционально связанного с NEENA, выше, предпочтительно значительно выше, чем экспрессия в семенах, с тем же самым промотором, у которого отсутствует NEENA в соответствии с настоящим изобретением. Предпочтительно количество РНК соответствующей нуклеиновой кислоты и/или скорость синтеза РНК и/или стабильность РНК в растении увеличены на 50% или больше, например 100% или больше, предпочтительно 200% или больше, более предпочтительно пятикратно или больше, еще более предпочтительно десятикратно или больше, наиболее предпочтительно двадцатикратно или более например, пятидесятикратно по сравнению с контрольным растением того же самого возраста, выращенным при тех же самых условиях, содержащим тот же самый специфичный для семян и/или предпочтительный для семян промотор, причем последний не является функционально связанным с NEENA в соответствии с настоящим изобретением.
При использовании в настоящем изобретении статистически значимые значения относятся к таковым, которые специалист в данной области техники способен определить, например, путем применения статистических тестов, таких как t-тест для соответствующих наборов данных.
Способы для определения экспрессии, вызываемой промотором, известны специалистам в данной области техники. Например, промотор может быть функционально связан с маркерным геном, такими как GUS, GFP или люцифераза, и активность соответствующего белка, закодированного соответствующим маркерным геном, может быть определена в растении или его части. Как репрезентативный пример, способ для детектирования люциферазы описан ниже подробно. Другие способы, например, измеряют уровень динамического равновесия или уровень синтеза РНК молекулы нуклеиновой кислоты, контролируемой посредством промотора, с помощью способов, известных специалистам в данной области техники, например, Нозерн блот-анализ, количественная ПЦР, кинетический анализ, или другими способами, описанными специалистами в данной области техники.
Специалист в данной области техники знает различные способы для того, чтобы функционально связать две или больше молекулы нуклеиновой кислоты. Такие способы могут включать рестрикцию/лигирование, лигаза-независимое клонирование, рекомбиниринг, рекомбинацию или синтез. Могут использоваться другие способы, чтобы функционально связать две или более молекулы нуклеиновых кислот.
Другой вариант выполнения настоящего изобретения относится к способу получения растения или его части с, по сравнению с соответствующим контрольным растением его или частью, усиленной семя-специфичной и/или семя-предпочтительной экспрессией одной или более молекул нуклеиновой кислоты, содержащий стадии введения в растения или его часть одной или более NEENA, содержащую молекулу нуклеиновой кислоты, как определено выше в пунктах i)-vi), и функционального связывания указанной одной или более NEENA с промотором, предпочтительно специфичным для семени и/или предпочтительным для семян промотором, и молекулой нуклеиновой кислоты, находящейся под контролем указанного промотора, предпочтительно специфичного для семян и/или предпочтительного для семян промотора, где NEENA является гетерологичной по отношению к указанной молекуле нуклеиновой кислоты.
NEENA может быть гетерологичной по отношению к молекуле нуклеиновой кислоты, которая находится под контролем указанного промотора, с которым функционально связана NEENA, или она может быть гетерологичной по отношению как к промотору, так и к молекуле нуклеиновой кислоты под контролем указанного промотора.
Термин "гетерологичный" по отношению к молекуле нуклеиновой кислоты или ДНК относится к молекуле нуклеиновой кислоты, которая функционально связана с или в результате манипуляций становится функционально связанной со второй молекулой нуклеиновой кислоты, с которой она не связана функционально в природе, или с которой она функционально связана в ином положении в природе. Например, NEENA в соответствии с настоящим изобретением в ее природном окружении функционально связана с ее естественным промотором, тогда как в настоящем изобретении она связана с другим промотором, который мог бы быть получен из того же самого организма, другого организма или мог бы быть синтетическим промотором. Это может также означать, что NEENA в соответствии с настоящим изобретением связана с ее естественным промотором, но молекула нуклеиновой кислоты под контролем указанного промотора является гетерологичной к промотору, содержащему его естественную NEENA. Следует, кроме того, иметь в виду, что промотор и/или молекула нуклеиновой кислоты под контролем указанного промотора, функционально связанного с NEENA в соответствии с настоящим изобретением, являются гетерологичными по отношению к указанной NEENA, поскольку их последовательность была изменена, например, мутацией, такой как вставки, делеции и т.д., чтобы естественная последовательность промотора и/или молекулы нуклеиновой кислоты под контролем указанного промотора модифицировалась и поэтому стала бы гетерологичной к NEENA в соответствии с настоящим изобретением. Следует также иметь в виду, что NEENA является гетерологичной по отношению к нуклеиновой кислоте, с которой она функционально связана, когда NEENA функционально связана с ее естественным промотором, в котором положение NEENA относительно указанного промотора изменено так, чтобы промотор показал более высокую экспрессию после такой манипуляции.
Растение, показывающее усиленную специфичную для семян и/или предпочтительную для семян экспрессию молекулы нуклеиновой кислоты, как это подразумевается в настоящем изобретении, означает растение, имеющее более высокую, предпочтительно статистически значимо более высокую специфичную для семян и/или предпочтительную для семян экспрессию молекулы нуклеиновой кислоты, по сравнению с контрольным растением, выращенным при тех же самых условиях без соответствующей NEENA, функционально связанной с соответствующей молекулой нуклеиновой кислоты. Такое контрольное растение может быть растением дикого типа или трансгенным растением, содержащим тот же самый промотор, управляющий тем же самым геном как в растении в соответствии с настоящим изобретением, но в котором промотор не связан с NEENA в соответствии с настоящим изобретением.
Получение растения согласно настоящему изобретению содержит способы стабильной трансформации, такие как введение рекомбинантной конструкции ДНК в растение или его часть посредством опосредованной агробактериями трансформации, протопластной трансформации, бомбардировкой частицами и т.п. и при необходимости последующей регенерацией трансгенного растения. Оно также содержит способы транзиентной трансформации растений или их частей, такие как вирусная инфекция или агробактериальная инфильтрация. Специалист в данной области техники знает о других способах для стабильной и/или транзиентной трансформации растений или их частей. Подходы, такие как методы селекции или слияние протопластов могли бы также использоваться для производства растений в соответствии с настоящим изобретением и охватываются настоящим изобретением.
Способ в соответствии с настоящим изобретением может быть применен к любому растению, например голосеменному растению или покрытосемянному растению, предпочтительно покрытосемянному растению, например двудольным или однодольным растениям, предпочтительно двудольным растениям. Предпочтительные однодольные растения, например, кукуруза, пшеница, рис, ячмень, сорго, банан, сахарный тростник, мискантус и брахиподиум, особенно предпочтительными однодольными растениями являются кукуруза, пшеница и фиг. Предпочтительными двудольными растениями являются, например, соя, рапсовое семя, канола, льняное семя, хлопок, картофель, сахарная свекла, бархатцы и Arabidopsis, особенно предпочтительными двудольными растениями являются соя, рапсовое семя, канола и картофель.
В одном варианте осуществления изобретения способы, как определено выше, содержат стадии
a) введения одной или более NEENA, содержащей молекулу нуклеиновой кислоты, как определено выше в пунктах i)-vi), в растение или его часть и
b) интеграции указанной одной или более NEENA в геном указанного растения или его части, посредством чего указанная одна или более NEENA функционально связывается с эндогенной предпочтительно семя-специфично и/или семя-предпочтительно экспрессируемой нуклеиновой кислотой, гетерологичной по отношению к указанной одной или более NEENA и при необходимости
c) регенерации растения или его части, содержащих указанную одну или более NEENA из указанной трансформированной клетки.
Одна или более молекула NEENA может быть введена в растения или его часть посредством бомбардировки частицами, электропорацией протопласта, вирусной инфекцией, опосредованной агробактериями трансформацией или любым другим подходом, известным специалисту в данной области техники. Молекула NEENA может быть введена интегрированной, например, в плазмиду или вирусную ДНК или вирусную РНК. Молекула NEENA может также содержаться в ВАС, YAC или искусственной хромосоме до введения в растения или часть растения. Она может быть также введена как линейная молекула нуклеиновой кислоты, содержащая последовательность NEENA, в которой дополнительные последовательности могут находиться рядом с последовательностью NEENA в молекуле нуклеиновой кислоты. Эти последовательности, граничащие с последовательностью NEENA, могут составлять около 20 п.о., например от 20 п.о. до нескольких сотен пар оснований, например 100 п.о. или больше, и могут облегчить интеграцию в геном, например, путем гомологичной комбинации. Может использоваться любой другой способ для интеграции в геном, будь то интеграционные подходы, такие как гомологичная рекомбинация, или подходы случайной интеграции, такие как незаконная рекомбинация.
Эндогенная, предпочтительно специфично для семян и/или предпочтительно для семени экспрессируемая нуклеиновая кислота, с которой может быть функционально связана молекула NEENA, может быть любой нуклеиновой кислотой, предпочтительно любой семя-специфично и/или семя-предпочтительно экспрессируемой молекулой нуклеиновой кислоты. Молекула нуклеиновой кислоты может быть кодирующей белок молекулой нуклеиновой кислоты или не кодирующей молекулой, как напримео антисмысловые РНК, р-РНК, т-РНК, микро-РНК, трансактивирующие ми-РНК, ми-РНК, дц-РНК, малые ядерные РНК, малые ядрышковые РНК или любые другие некодирующие РНК, известные специалисту в данной области техники.
Специалист в данной области техники знает о способах идентификации семя-специфично и/или семя-предпочтительно экспрессируемых молекул нуклеиновой кислоты, к которым способ в соответствии с настоящим изобретением может быть предпочтительно применен, как например гибридизация на микрочипе, количественная ПЦР, Нозерн блот-анализ, новое поколение секвенирования и т.д.
Следующим путем осуществления способов по настоящему изобретению может быть
а) обеспечение экспрессионной конструкции, содержащей одну или более NEENA, содержащую молекулу нуклеиновой кислоты, как определено выше в пунктах i)-vi), функционально связанную с промотором, предпочтительно специфичным для семян и/или предпочтительным для семян промотором, как определено выше, и с одной или более молекулами нуклеиновой кислоты, причем последние являются гетерологичными по отношению к указанной одной или более NEENA, и которая находится под контролем указанного промотора, предпочтительно специфичного для семян и/или предпочтительного для семян промотора и
b) интеграция указанной экспрессионной конструкции, содержащей указанную одну или более NEENA, в геном указанного растений или его части и при необходимости
c) регенерация растения или его части, содержащих указанные одну или более экспрессионную конструкцию, из указанного трансформированного растения или его части.
NEENA может быть гетерологичной по отношению к молекуле нуклеиновой кислоты, которая находится под контролем указанного промотора, с которым функционально связана NEENA, или она может быть гетерологичной как по отношению к промотору, так и к молекуле нуклеиновой кислоты под контролем указанного промотора.
Экспрессионная конструкция может быть интегрирована в геном соответствующего растения любым способом, известным специалисту в данной области техники. Интеграция может быть случайной с использованием способов, таких как бомбардировка частицами, или трансформация, опосредованная агробактериями. В предпочтительном варианте осуществления изобретения интеграция происходит через направленную интеграцию, например, с помощью гомологичной рекомбинации. Последний способ позволил бы интегрировать экспрессионную конструкцию, содержащую промотор высокой экспрессии, функционально связанный с NEENA, в благоприятную область генома. Благоприятными областями генома являются, например, областями генома, которые, как известно, содержат гены, которые высоко экс-прессируются, например, в семенах и, следовательно, могут увеличить экспрессию, происходящую из указанной экспрессионной конструкции, по сравнению с областью генома, которая не показывает транскрипционной активности.
В другом предпочтительном варианте осуществления изобретения указанная одна или более NEENA функционально связываются с промотором, предпочтительно специфичным для семян и/или предпочтительным для семян промотором, близким к сайту инициации транскрипции указанной гетерологичной молекулы нуклеиновой кислоты.
Выражение «близкий к сайту инициации транскрипции», как понимается в настоящем изобретении, содержит функциональное соединение одной или более NEENA с промотором, предпочтительно специфичным для семян и/или предпочтительным для семян промотором, 2500 п.о. или меньше, предпочтительно 2000 п.о. или меньше, более предпочтительно 1500 п.о. или меньше, еще более предпочтительно 1000 п.о. или меньше и наиболее предпочтительно 500 п.о. или менее от сайта инициации транскрипции указанной гетерологичной молекулы нуклеиновой кислоты. Следует понимать, что NEENA может быть интегрирована против хода транскрипции или по ходу транскрипции на соответствующем расстоянии от сайта инициации транскрипции соответствующего промотора. Следовательно, одна или более NEENA не должна обязательно быть включена в транскрипт соответствующей гетерологичной нуклеиновой кислоты под контролем предпочтительно специфичного для семян и/или предпочтительного для семян промотора, с которым функционально связывается одна или более NEENA. Предпочтительно одна или более NEENA интегрируется по ходу транскрипции от сайта инициации транскрипции соответствующего промотора, предпочтительно специфичного для семян и/или предпочтительного для семян промотора. Сайт интеграции по ходу транскрипции от сайта инициации транскрипции может находиться в 5' UTR, 3' UTR, экзоне или интроне, или он может заместить интрон или частично или полностью 5' UTR или 3' UTR гетерологичной нуклеиновой кислоты под контролем предпочтительно специфичного для семян и/или предпочтительного для семян промотора. Предпочтительно одна или более NEENA интегрируется в 5' UTR или интрон, или NEENA замещает интрон или частично или полностью 5'UTR, наиболее предпочтительно она интегрируется в 5'UTR соответствующей гетерологичной нуклеиновой кислоты.
Следующий вариант выполнения настоящего изобретения содержит рекомбинантную экспрессионную конструкцию, содержащий одну или более NEEN, содержащую молекулу нуклеиновой кислоты, как определено выше в пунктах i)-vi).
Рекомбинантная экспрессионная конструкция может дополнительно содержать один или более промоторов, предпочтительно специфичный для семян и/или предпочтительный для семян промотор, с которым одна или более NEENA функционально связываются, и при необходимости одну или более экспрессируемую молекулу нуклеиновой кислоты, причем последняя является гетерологичной по отношению к указанной одной или более NEENA.
NEENA может быть гетерологичной по отношению к молекуле нуклеиновой кислоты, которая находится под контролем указанного промотора, с которым функционально связывается NEENA, или она может быть гетерологичной по отношению как к как промотору, так и к молекуле нуклеиновой кислоты под контролем указанного промотора.
Экспрессионная конструкция может содержать одну или больше, например два или больше, например 5 или больше, например, 10 или больше комбинаций промоторов, предпочтительно специфичных для семян и/или предпочтительных для семян промоторов, функционально связанных с NEENA и молекулой нуклеиновой кислоты, которая будет экспрессироваться, которая гетерологична по отношению к соответствующей NEENA. Экспрессионная конструкция может также содержать дополнительные промоторы, не содержащие NEENA, функционально связанную с молекулами нуклеиновой кислоты, которые будут экспрессироваться, гомологичными или гетерологичными по отношению к соответствующему промотору.
Рекомбинантный экспрессионный вектор, содержащий одну или более рекомбинантных экспрессионных конструкций, как определено выше, является другим вариант осуществлениям настоящего изобретения. Множество экспрессионных векторов, которые могут использоваться в настоящем изобретении, известно специалисту в данной области техники. Способы введения такого в геном растений вектора, содержащего такую экспрессионную конструкцию, содержащую, например, промотор, функционально связанный с NEENA, и при необходимости другие элементы, такие как терминатор, и регенерации трансгенных растений из трансформированной клетки также известны специалистам в данной области техники. В зависимости от способа, используемого для трансформации растения или его части, целый вектор мог быть интегрирован в геном указанного растения или его части, или некоторые компоненты вектора могли бы быть интегрированы в геном, как например Т-ДНК.
Трансгенное растение или его часть, содержащие одну или более гетерологичную NEENA, как определено выше в пунктах i)-vi), также охватывается настоящим изобретением. NEENA следует понимать как являющуюся гетерологичной по отношению к растению, будь она синтетическая, полученная из другого организма или из того же самого организма, но ее природная геномная локализация отличается по сравнимой с контрольным растением, например растениями дикого типа. Необходимо понимать, что отличная геномная локализация означает, что NEENA локализована на другой хромосоме или на той же самой хромосоме, но на 10 т.п.о. или больше, например 10 т.п.о., предпочтительно 5 т.п.о. или больше, например 5 т.п.о., более предпочтительно 1000 п.о. или больше, например 1000 п.о., еще более предпочтительно 500 п.о. или больше, например 500 п.о., особенно предпочтительно 100 п.о. или больше, например 100 п.о., наиболее предпочтительно 10 п.о. или больше, например 10 п.о., отдаленная от ее естественной геномной локализации, например в растении дикого типа.
Трансгенная клетка или трансгенное растение или его часть, содержащие рекомбинантный экспрессионный вектор, как определено выше, или рекомбинантную экспрессионную конструкцию, как определено выше, являются другим вариантом осуществления настоящего изобретения. Трансгенная клетка, трансгенное растение или его часть могут быть выбраны из группы, состоящей из бактерий, грибов, дрожжей или растений, насекомого или клеток млекопитающих или растений. Предпочтительно трансгенные клетки являются бактериями, грибами, дрожжами, растительными клетками. Предпочтительными бактериями являются энтеробактерия, такая как Е. coli и бактерии рода Agrobacteria (агробактерии), например Agrobacterium tumefaciens и Agrobacteríum rhizogenes. Предпочтительно растения являются однодольными или двудольными растениями, например, однодольными или двудольными культурными растениями, такими как кукуруза, соя, канола, хлопок, картофель, сахарная свекла, рис, пшеница, сорго, ячмень, банан, сахарный тростник, мискантус и т.п.. Предпочтительными культурными растениями являются кукурузой, рисом, пшеницей, соей, канола, хлопком или картофелем. Особенно предпочтительными двудольными культурными растениями являются соей, канола, хлопком или картофелем.
Особенно предпочтительные однодольные культурные растения являются кукурузой, пшеницей и рисом.
Другими вариантами осуществления настоящего изобретения являются трансгенная клеточная культура, трансгенное семя, части или материал для размножения, полученные из трансгенной клетки или растения или его части, как определено выше, содержащие указанную гетерологичную NEENA, как определено выше в пунктах i)-vi), или указанную рекомбинантную экспрессионную конструкцию, или указанный рекомбинантный вектор, как определено выше.
Трансгенные части или материал для размножения согласно настоящему изобретению содержат все ткани и органы, например лист, стебель и плоды, а также материал, который полезен для размножения и/или регенерации растений, как например обрезки, отростки, черенок, ветви или побеги, содержащие соответствующую NEENA, рекомбинантную экспрессионную конструкцию или рекомбинантный вектор.
Следующим вариантом осуществления настоящего изобретения является применение NEENA, как определено выше в пунктах i)-vi), или рекомбинантной конструкции или рекомбинантного вектора, как определено выше, для усиления экспрессии в растениях или его частях.
Следовательно настоящая заявка обеспечивает молекулы нуклеиновой кислоты усиливающие генную семя-специфичную и/или семя-предпочтительную экспрессию, содержащие один или более промотор, предпочтительно специфичный для семян и/или предпочтительный для семян промотор, функционально связанный с одной или более NEENA. Кроме того, раскрывается применение таких молекул нуклеиновых кислот, усиливающих генную экспрессия, и экспрессионные конструкции, экспрессионные вектора, трансгенныхе растения или их части и трансгенные клетки, содержащих такие молекулы нуклеиновых кислот, усиливающих экспрессию гена.
Применение трансгенной клеточной культуры, трансгенного семени, частей или материала для размножения, полученного из трансгенной клетки или растения или его части, как определено выше, для получения продуктов питания, кормов для животных, семян, фармацевтических средств или химических продуктов тонкого органического синтеза также охватывается настоящим изобретением.
ОПРЕДЕЛЕНИЯ
Сокращения: NEENA - нуклеиновая кислота, усиливающая экспрессию нуклеиновой кислоты, GFP - зеленый флюоресцирующий белок, GUS - бета-глюкоронидаза, ВАР - 6-бензиламинопурин; 2,4-D - 2,4-дихлорфеноксиуксусная кислота; MS - Среда Мурасиге-Скуга; NAA - 1-нафталинуксусная кислота; MES, 2-(N-морфолино)-этансульфоновая кислота, IAA - индолилуксусная кислота; Кап: канамицин сульфат; GA3 - гиббереллиновая кислота; Timentin™: тикарциллин двунатрия / клавуланат калия, мкл: мифолитр.
Необходимо понимать, что настоящее изобретение не ограничено конкретными методиками или протоколами. Необходимо также понимать, что терминология, применяемая в настоящем изобретении, используется только в целях описания конкретных вариантов выполнения настоящего изобретения, и не ограничивает объем настоящего изобретения, который определяется только приложенной формулой изобретения. Необходимо понимать, что как в описании настоящего изобретения, так и в приложенной формуле изобретения, формы единственного числа включают также множественное число, если из контекста ясным образом не следует иное. Таким образом, например, ссылка на "вектор" также включает в себя ссылку на один или более векторов, и включает ссылку на их эквиваленты, известные специалистам в данной области техники, и так далее. Термин "около", как применяется в описании настоящего изобретения, означает приблизительно, грубо, примерно или в области. Термин "около", при применении вместе с числовым интервалом, модифицирует этот интервал путем расширения его границ выше и ниже установленных числовых значений. В общем, термин "около", как применяется в настоящем изобретении, модифицирует числовое значение выше и ниже числового значения путем отклонения на 20 процентов, предпочтительно 10 процентов, вверх или низ (выше или ниже). Как применяется в описании настоящего изобретения, предлог "или" означает любой член конкретного списка и также включает любую комбинацию членов этого списка. Слова "содержат", "содержащий", "включают", "включающий" и "включает", при применении в описании настоящего изобретения и в приложенной формуле, как подразумевается, уточняют присутствие одного или более установленных признаков, целых чисел, компонентов или стадий, но они не исключают присутствие или добавление одного или более других признаков, целых чисел, компонентов, стадий или их групп. Для ясности понимания необходимо отметить, что некоторые термины, применяемые в описании настоящего изобретения, определяются и применяются следующим образом:
Антипараллельные: термин "антипараллельные" согласно настоящему изобретению относится к двум нуклеотидным последовательностям, соединенным через водородные связи между остатками комплементарных оснований, причем фосфодиэфирные связи идут в 5’-3' направлении в одной нуклеотидной последовательности и в 3-5' другой нуклеотидной последовательности.
Антисмысловая: термин "антисмысловая" относится к нуклеотидной последовательности, которая повернута относительно ее нормальной ориентации для осуществления транскрипции или функции и, таким образом, экспрессирует РНК транскрипт, который комплементарен молекуле мРНК целевого гена, экспрессируемой внутри клетки-хозяина (например, она может гибридизоваться с молекулой мРНК целевого гена или однонитевой геномной ДНК через спаривание оснований по способу Ватсона-Крика), или которая комплементарна молекуле целевой ДНК, как например, геномной ДНК, присутствующей в клетке-хозяине.
Кодирующая область: согласно настоящему изобретению термин "кодирующая область" в отношении структурного гена относится к нуклеотидным последовательностям, которые кодируют аминокислоты, обнаруживаемые в создающемся полипептиде в результате трансляции молекулы мРНК. Кодирующая область ограничена в эукариотах на 5'-стороне триплетом нуклеотидов "ATG", который кодирует инициатор метионин, и на 3'-стороне тремя триплетами, которые определяют стоп кодоны (то есть ТАА, TAG, TGA). В дополнение к содержащимся интронам геномные формы гена также могут включать последовательности, локализованные на обоих 5'- и 3'-концах последовательностей, которые присутствуют на РНК транскрипте. Эти последовательности упоминаются как "фланкирующие" последовательности или области (эти фланкирующие последовательности локализованы 5' или 3' по отношению к нетранслируемым последовательностям, присутствующим на мРНК транскрипте). 5’-фланкирующая область может содержать регуляторные последовательности, как например, промоторы и энхансеры, которые контролируют транскрипцию гена или влияют на нее. 3'-фланкирующая область может содержать последовательности, которые управляют терминацией транскрипции, пост-трансляционным расщеплением и лолиаденилированием.
Комплементарные: термин "комплементарные" или "комплементарность" относится к двум нуклеотидным последовательностям, которые содержат антипараллельные нуклеотидные последовательности, способные спариваться друг с другом (по правилам спаривания оснований) при образовании водородных связей между остатками комплементарных оснований в антипараллельных нуклеотидных последовательностях. Например, последовательность 5’-AGT-3' комплементарна последовательности 5’-АСТ-3'. Комплементарность может быть "частичной" или "полной." "Частичная" комплементарность - это когда одно или более оснований нуклеиновых кислот не подобраны в соответствии с правилами спаривания оснований. "Общая" или "полная" комплементарность между молекулами нуклеиновых кислот - это когда каждое и все основания нуклеиновых кислот соответствуют другому основанию согласно правилам спаривания оснований. Степень комплементарности между нитями молекул нуклеиновых кислот оказывает значительное влияние на эффективность и силу гибридизации между нитями молекул нуклеиновых кислот. "Комплемент" последовательности нуклеиновой кислоты, как применяется в настоящем изобретении, относится к нуклеотидной последовательности, молекулы нуклеиновой кислоты которой показывают полную комплементарность молекулам нуклеиновой последовательности нуклеиновой кислоты.
Двухнитевая РНК: молекула "двухнитевой РНК" или молекула "днРНК' содержит фрагмент смысловой РНК нуклеотидной последовательности и фрагмент антисмысловой РНК нуклеотидной последовательности, которые оба содержат нуклеотидные последовательности комплементарные друг другу, таким образом, позволяя смысловым и антисмысловым фрагментам РНК спариваться и образовывать двухнитевую молекулу РНК.
Эндогенная: "эндогенная" нуклеотидная последовательность относится к нуклеотидной последовательности, которая присутствует в геноме нетранс-формированной растительной клетки.
Усиленная экспрессия: термины "усиление" или "повышение" экспрессии нуклеиновой кислоты в растительной клетке используются в описании настоящего изобретения эквивалентно и означают, что уровень экспрессии молекулы нуклеиновой кислоты в растении, части растения или растительной клетке, после применения способа по настоящему изобретению, выше, чем ее экспрессия в растении, части растения или растительной клетке перед применением способа или по сравнению с контрольным растением, не содержащим рекомбинантную молекулу нуклеиновой кислоты по изобретению. Например, контрольное растение содержит такую же конструкцию, в которой отсутствует только соответствующая NEENA. Термины "усиленная" и "повышенная", как применяется в описании настоящего изобретения, являются синонимами и означают в контексте настоящего изобретения более высокую, предпочтительно значительно более высокую экспрессию молекулы нуклеиновой кислоты, которая экспрессируется. Как применяется в описании настоящего изобретения, "усиление" или "повышение" уровня агента, как например, белка, мРНК или РНК, означает, что уровень повышается относительно по существу идентичного растения, части растения или растительной клетки, выращенных при по существу идентичных условиях, не содержащих рекомбинантную молекулу нуклеиновой кислоты по изобретению, например, не содержащих молекулу NEENA, рекомбинантную конструкцию или рекомбинантный вектор по изобретению. Как применяется в описании настоящего изобретения, "усиление" или "повышение" уровня агента, как например, преРНК, мРНК, рРНК, тРНК, snoPHK, мяРНК, экспрессируемого целевым геном, и/или белкового продукта, кодируемого им, означает, что уровень повышается на 50% или более, например, на 100% или более, предпочтительно на 200% или более, более предпочтительно в 5 раз или более, даже более предпочтительно в 10 раз или более, наиболее предпочтительно в 20 раз или более, например, в 50 раз относительно клетки или организма, не содержащих молекулу нуклеиновой кислоты по изобретению. Усиление или повышение может определяться способами, известными специалисту в данной области техники. Таким образом, усиление или повышение количества нуклеиновой кислоты или белка может быть определено, например, посредством иммунологического обнаружения белка. Более того, методики, как например, анализ белка, флуоресценция, Нозерн-гибридизация, анализ нуклеазной защиты, обратная транскрипция (количественная ОТ-ПЦР), ELISA (фермент-связанный иммуносорбентный анализ), Вестерн-блоттинг, радиоиммуноанализ (RIA) или другие иммуноанализы или анализы на основе флуорисцентно-активированных клеток (FACS) могут применяться для измерения конкретного белка или РНК в растении или растительной клетке. В зависимости от типа индуцированного белкового продукта также может быть определена его активность или влияние на фенотип организма или клетки. Способы определения количества белка известны специалистам в данной области техники. Можно привести следующие примеры: микробиуретовый способ (Goa J (1953) Scand J Clin Lab Invest 5:218-222), способ Folin-Ciocalteau (Lowry OH et al. (1951) J Biol Chem 193:265-275) или измерение абсорбции CBB G-250 (Bradford MM (1976) Analyt Biochem 72:248-254). Одним примером количественного измерения активности белка является обнаружение люциферазной активности, как раскрывается в приведенных далее примерах.
Экспрессия: термин "экспрессия" относится к биосинтезу генного продукта, предпочтительно к транскрипции и/или трансляции нуклеотидной последовательности, например эндогенного гена или гетерологичного гена, в клетке. Например, в случае структурного гена, экспрессия включает транскрипцию структурного гена в мРНК и, при необходимости, последующую трансляцию мРНК в один или более полипептиды. В других случаях экспрессия может относиться только к транскрипции ДНК с получением молекулы РНК.
Экспрессионная конструкция: термин "экспрессионная конструкция", как применяется в описании настоящего изобретения, означает последовательность ДНК, способную управлять экспрессией конкретной нуклеотидной последовательности в соответствующей части растения или растительной клетке, содержащую промотор, функциональный в указанной части растения или растительной клетке, в которую она будет вводиться, операбельно связанный с рассматриваемой нуклеотидной последовательность, которая, при необходимости, операбельно связана с сигналами терминации. Если необходима трансляция конструкция, как правило, также содержит последовательности, необходимые для надлежащей трансляции нуклеотидной последовательности. Кодирующая область может кодировать рассматриваемый белок, но также может кодировать представляющую интерес функциональную РНК, например, РНКа, миРНК, snoPHK, мяРНК, микроРНК, ta-siPHK или любую другую некодирующую регуляторную РНК, в смысловом и антисмысловом направлении. Экспрессионная конструкция, содержащая рассматриваемую нуклеотидную последовательность, может быть химерной, что означает, что один или более ее компонентов гетерологичны по отношению к одному или более другим ее компонентам. Экспрессионной конструкцией также может быть конструкция, которая встречается в природе, но была получена в рекомбинантной форме, полезной для гетерологичной экспрессии. Однако, как правило, экспрессионная конструкция является гетерологичной по отношению к хозяину, то есть конкретная ДНК последовательность экспрессионной конструкции в природе не встречается в клетке-хозяине и должна вводиться в клетку-хозяина или предшественник клетки-хозяина путем трансформации. Экспрессия нуклеотидной последовательности в экспрессионной конструкции может происходить под контролем семя-специфичного промотора или индуцируемого промотора, который инициирует транскрипцию только при воздействии на клетку-хозяина определенного внешнего стимула. В случае растения промотор также может быть специфичным по отношению к конкретной ткани, или органу, или стадии развития.
Чужеродная: термин "чужеродная" относится к любой молекуле нуклеиновой кислоты (например, генной последовательности), которая вводится в геном клетки путем экспериментальных манипуляций, и может включать последовательности, обнаруживаемые в этой клетке, при условии что введенная последовательность содержит некоторые модификации (например, точечную мутацию, наличие селектируемого маркерного гена и т.д.), и поэтому отличается от последовательности природного происхождения.
Функциональная связь: термин "функциональная связь" или "функционально связанный", как понимается, означает, например, последовательное расположение регуляторных элементов (например, промотора) с последовательностью нуклеиновой кислоты, подлежащей экспрессии, и, при необходимости, других регуляторных элементов (такие как, например, терминатор или NEENA), таким образом, что каждый из регуляторных элементов может выполнять предназначенную функции, обеспечивая, модифицируя, облегчая экспрессию указанной последовательности нуклеиновой кислоты, или влияя на нее иным образом. В качестве синонима применяются термины "операбельная связь" или "операбельно связанный". В зависимости от расположения последовательностей нуклеиновых кислот экспрессия может приводить к смысловой или антисмысловой РНК. В этих целях прямая связь в химическом смысле не является необходимой. Генные контролирующие последовательности, как например, энхансерные последовательности, могут также оказывать свое действие на целевую последовательность из положений, которые более удалены, или, на самом деле, из других молекул ДНК. Предпочтительными расположениями являются те, в которых последовательность нуклеиновой кислоты, которая экспрессируется рекомбинантно, находится перед последовательностью, действующей в качестве промотора, так что две последовательности связаны друг с другом ковалентно. Расстояние между промоторной последовательностью и последовательностью нуклеиновой кислоты, подлежащей рекомбинантной экспрессии, предпочтительно составляет менее 100 пар оснований, особенно предпочтительно менее 50 пар оснований. В предпочтительном варианте выполнения настоящего изобретения, последовательность нуклеиновой кислоты, которая подлежит транскрипции, находится перед промотором, таким образом, что старт транскрипции идентичен желательному началу химерной РНК по изобретению. Функциональная связь и экспрессионная конструкция могут быть созданы посредством обычных методик рекомбинации и клонирования, как описано (например, в Maniatis Τ, Fritsch EF and Sambrook J (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor (NY); Silhavy et al. (1984) Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor (NY); Ausubel et al. (1987) Current Protocols in Molecular Biology, Greene Publishing Assoc. and Wiley Interscience; Gelvin et al. (Eds) (1990) Plant Molecular Biology Manual; Kluwer Academic Publisher, Dordrecht, The Netherlands). Однако другие последовательности, которые, например, действуют в качестве линкера со специфическими сайтами расщепления для ферментов рестрикции или в качестве сигнального пептида, также могут быть расположены между двумя последовательностями. Вставка последовательностей может также приводить к экспрессии слитых белков. Предпочтительно экспрессионная конструкция, состоящая из связи регуляторной области, например, промотора и последовательности нуклеиновой кислоты, подлежащей экспрессии, может существовать в виде интегрированной в вектор формы и может быть вставлена в геном растения, например путем трансформации.
Ген: термин "ген" относится к области, операбельно связанной с соответствующими регуляторными последовательностями, способными регулировать экспрессию генного продукта (например, полипептид или функциональная РНК) некоторым образом. Ген включает нетранслируемые регуляторные области ДНК (например, промоторы, энхансеры, репрессоры и т.д.) предшествующие (против хода транскрипции) кодирующей области и следующие за ней (по ходу транскрипции) (открытая рамка считывания, ORF), а также, при необходимости, промежуточные последовательности (то есть интроны) между отдельными кодирующими областями (то есть экзоны). Термин "структурный ген", как подразумевается в описании настоящего изобретения, означает последовательность ДНК, которая транскрибируется в мРНК, которая затем подвергается трансляции в последовательность аминокислот конкретного полипептида.
Геном и геномная ДНК: термины "геном" или "геномная ДНК" относятся к наследственной генетической информации организма хозяина. Указанная геномная ДНК содержит ДНК ядра (так же упоминается как хромосомальная ДНК), а также ДНК пластид (например, хлоропласты) и других клеточных органелл (например, митохондрий). Предпочтительно термины геном и геномная ДНК относятся к хромосомальной ДНК ядра.
Гетерологичная: термин "гетерологичная" в отношении молекулы нуклеиновой кислоты или ДНК относится к молекуле нуклеиновой кислоты, которая операбельно связана или в результате манипуляций с ней становится операбельно связанной со второй молекулой нуклеиновой кислоты, с которой она не связана операбельным образом в природе, или с которой она операбельно связана в природе в ином положении. Гетерологичная экспрессионная конструкция, содержащая молекулу нуклеиновой кислоты и одну или более регуляторных молекул нуклеиновой кислоты (таких как промотор или сигнал терминации транскрипции), связанных с ней, например, представляет собой конструкции, полученные путем экспериментальных манипуляций, в которых либо а) указанная молекула нуклеиновой кислоты, либо b) указанная регуляторная молекула нуклеиновой кислоты, либо с) обе (от есть (а) и (b)) не локализованы в их природном (естественном) генном окружении или были модифицированы путем экспериментальных манипуляций, где примером модификации является замещение, добавление, делеция, инверсия или вставка одного или более нуклеотидных остатков. Естественное генное окружение относится к природному хромосомному локусу в организме источника, или к присутствующему в геномной библиотеке. В случае геномной библиотеки естественное генное окружение последовательности молекулы нуклеиновой кислоты предпочтительно сохраняется по меньшей мере частично. Окружение фланкирует последовательность нуклеиновой кислоты по меньшей мере с одной стороны и имеет последовательность длиной по меньшей мере 50 п. о., предпочтительно по меньшей мере 500 п.о., особенно предпочтительно по меньшей мере 1,000 п.о., наиболее предпочтительно по меньшей мере 5,000 п.о. Экспрессионная конструкция природного происхождения, например, комбинация промотора природного происхождения с соответствующим геном, становится трансгенной экспрессионной конструкцией при модификации не природными синтетическими "искусственными" способами, как например, мутагенез. Такие способы уже были описаны (US 5,565,350; WO 00/15815). Например, кодирующая белок молекула нуклеиновой кислоты, операбельно связанная с промотором, который не является природным промотором этой молекулы, рассматривается как гетерологичная по отношению к этому промотору. Предпочтительно, гетерологичная ДНК не является эндогенной по отношению к клетке, в которую она вводится, или не является связанной с ней в природе, а была получена из другой клетки или была синтезирована. Гетерологичная ДНК также включает эндогенную последовательность ДНК, которая содержит некоторую модификацию не природного происхождения, множество копий эндогенной последовательности ДНК, или последовательность ДНК, которая не связана естественным образом с другой последовательностью ДНК, физически связанной с ней. В общем, хотя и необязательно, гетерологичная ДНК кодирует РНК или белки, которые обычно не продуцируются клеткой, в которой она экс-прессируется.
Семя-специфичный и/или семя-предпочтительный промотор высокой экспрессии: термин "семя-специфичный и/или семя-предпочтительный промотор высокой экспрессии", как применяется в описании настоящего изобретения, означает промотор, вызывающий семя-специфичную или семя-предпочтительную экспрессию в растении или его части, где накапливание или скорость синтеза РНК, или стабильность РНК, полученной из молекулы нуклеиновой кислоты под контролем соответствующего промотора, является выше, предпочтительно значительно выше чем при экспрессии, вызванной промотором без NEENA по изобретению. Предпочтительно количество РНК и/или скорость синтеза РНК и/или стабильность РНК повышается на 50% или более, например, 100% или более, предпочтительно 200% или более, более предпочтительно в 5 раз или более, даже более предпочтительно в 10 раз или более, наиболее предпочтительно в 20 раз или более, например, в 50 раз, относительно семя-специфичного или семя-предпочтительного промотора без NEENA по изобретению.
Гибридизация: термин "гибридизация", как применяется в настоящем изобретении, включает "любой процесс, посредством которого нить молекулы нуклеиновой кислоты соединяется с комплементарной нитью через спаривание оснований." (J. Coombs (1994) Dictionary of Biotechnology, Stockton Press, New York). На гибридизацию и силу гибридизации (то есть силу ассоциации между молекулами нуклеиновых кислот) влияют такие факторы, как степень комплементарности между молекулами нуклеиновой кислоты, строгость условий, Тm образуемого гибрида и соотношение G:C внутри молекул нуклеиновых кислот. Как применяется в описании настоящего изобретения, термин "Тm" используется для обозначения "температуры плавления." Температура плавления представляет собой температуру, при которой совокупность двунитевых молекул нуклеиновых кислот становится наполовину диссоциированной на одиночные нити. Уравнение для вычисления Тm молекул нуклеиновых кислот хорошо известно в данной области техники. Как указанно в стандартных ссылочных источниках, простой расчет значения Тm может быть сделан по уравнению: Тm=81.5+0.41 (% G+C), где молекула нуклеиновой кислоты находится в водном растворе при 1 M NaCl [смотрите, например, Anderson and Young, Quantitative Filter Hybridization, in Nucleic Acid Hybridization (1985)]. Другие источники включают более сложные расчеты, в которых при расчете Тm учитываются как структурные характеристики, так и характеристики последовательности. Строгие условия известны специалистам в данной области техники и могут быть обнаружены в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6.
"Идентичность": термин "идентичность", при применении в отношении сравнения двух или более молекул нуклеиновых кислот или аминокислот, означает, что последовательности указанных молекул имеют некоторую степень подобия последовательностей, при этом последовательности являются частично идентичными.
Для определения процента идентичности (в настоящей заявке взаимозаменяемо используется термин «гомология») двух аминокислотных последовательностей или двух молекул нуклеиновых кислот, последовательности расписываются одна под другой для оптимального сравнения (например, гэпы могут быть вставлены в последовательность белка или нуклеиновой кислоты для того, чтобы получить оптимальное выравнивание с другим белком или другой нуклеиновой кислотой).
Затем сравниваются аминокислотные остатки или молекулы нуклеиновых кислот при соответствующих положениях аминокислот или положениях нуклеотидов. Если положение в одной последовательности занято тем же самым аминокислотным остатком или той же молекулой нуклеиновой кислоты, что и в соответствующем положении в другой последовательности, то молекулы являются гомологичными в этом положении (то есть "гомология" аминокислот или нуклеиновых кислот, как применяется в контексте настоящего изобретения, соответствует "идентичности" аминокислот или нуклеиновых кислот). Процент гомологии между двумя последовательностями представляет собой функцию от числа идентичных положений, поделенного на последовательности (то есть процент гомологии равен числу идентичных положений, разделенному на общее число положений, и умноженному на 100). Таким образом, термины "гомология" и "идентичность" рассматриваются как синонимы.
Для определения процента идентичности двух или более аминокислот или двух или более нуклеотидных последовательностей был разработан ряд программных обеспечений. Идентичных двух или более последовательностей может быть вычислена, например, с помощью программного обеспечения fasta, которое в настоящее время применяется в виде версии fasta 3 (W.R. Pearson and D.J. Lipman, PNAS 85, 2444(1988); W.R. Pearson, Methods in Enzymology 183, 63 (1990); W.R. Pearson and D.J. Lipman, PNAS 85, 2444 (1988); W.R. Pearson, Enzymology 183, 63 (1990)). Другой применяемой программой для вычисления идентичности различных последовательностей является стандартная программа blast, которая включена в программное обеспечение Biomax pedant (Biomax, Munich, Federal Republic of Germany). К сожалению, иногда это приводит к субоптимальным результатам, так как программа blast не всегда включает полные последовательности субъекта и запроса. Тем не менее, так как эта программа является очень эффективной, она может применяться для сравнения огромного числа последовательностей. Следующие параметры, как правило, применяются для сравнения последовательностей:
-р название программы [String]; -d база данных [String]; значение по умолчанию = nr; -i файл запроса [File In]; default = stdin; -e ожидаемое значение (Ε) [Real]; значение по умолчанию = 10.0; -m опции просмотра выравнивания: 0 = pairwise; 1 = query-anchored showing identities; 2 = query-anchored no identities; 3 = flat query-anchored, show identities; 4 = flat query-anchored, no identities; 5 = query-anchored no identities and blunt ends; 6 = flat query-anchored, no identities and blunt ends; 7 = XML Blast output; 8 = tabular; 9 tabular with comment lines [Integer]; значение по умолчанию = 0; -о отчет BLAST Output File [File Out] Optional; значение по умолчанию = stdout; -F фильтр последовательности запроса (DUST для blastn, SEG для других) [String]; значение по умолчанию = Τ; -G штраф за открытие гэпа (ноль означает работу по умолчанию) [Integer]; значение по умолчанию=0; -Е штраф за расширение гэпа (ноль означает работу по умолчанию) [Integer]; значение по умолчанию = 0; -Χ X уменьшение значения для выравнивания с гэпами (в битах) (ноль используется при работе по умолчанию); blastn 30, megablast 20, tblastx 0, все другие 15 [Integer]; значение по умолчанию = 0; -I Show Gl's in deflines [T/F]; значение по умолчанию = F; -q штраф за нуклеотидное несоответствие (blastn только) [Integer]; значение по умолчанию = -3; -r награда за нуклеотидное совпадение (blastn только) [Integer]; значение по умолчанию = 1; -v ряд последовательностей базы данных, чтобы показать построчную дискрипцию для (V) [Integer]; значение по умолчанию = 500; -b ряд последовательностей базы данных, чтобы показать выравнивания для (В) [Integer]; значение по умолчанию = 250; -f пороговая величина для расширения хитов, значение по умолчанию если ноль; blastp 11, blastn 0, blastx 12, tblastn 13; tblastx 13, megablast 0 [Integer]; значение по умолчанию = 0; -г осуществление выравнивания с гэпами (не доступно для tblastx) [T/F]; значение по умолчанию = Т; -Q генетический код запроса для применения [Integer]; значение по умолчанию = 1; -D DB генетический код (для tblast[nx] только) [Integer]; значение по умолчанию = 1; -а ряд процессоров для применения [Integer]; значение по умолчанию = 1; -О SeqAlign file [File Out] Optional; -J Believe the query defline [T/F]; значение по умолчанию = F; -M Matrix [String]; значение по умолчанию = BLOSUM62; -W размер слова, значение по умолчанию если ноль (blastn 11, megablast 28, все другие 3) [Integer]; значение по умолчанию = 0; -z эффективная длина базы данных (применяют ноль ля реального размера) [Real]; значение по умолчанию = 0; -К число наилучших хитов из области для сохранения (off по умолчанию, если применяется, то рекомендуется значение 100) [Integer]; значение по умолчанию = 0; -Р 0 для множества хитов, 1 для одного хита [Integer]; значение по умолчанию = 0; -Y эффективная длина пространства поиска (применение нуля для реального размера) [Real]; значение по умолчанию = 0; -S запрашиваемые нити для поиска по базе данных (для blastfnx], и tblastx); 3 для обоих, 1 - верхнее, 2 - нижнее [Integer]; значение по умолчанию = 3; -Т получить HTML на выходе [T/F]; значение по умолчанию = F; -I ограничение поиска по базе данных до перечня Gl's [String] Optional; -U применение фильтрации нижнего регистра последовательности FASTA [T/F] Optional; значение по умолчанию = F; -у X уменьшение значения для расширений без гэпов в битах (0.0 применяется при работе по умолчанию); blastn 20, megablast 10, все другие 7 [Real]; значение по умолчанию = 0.0; -Ζ X уменьшение значения klz конечного выравнивания с гэпами в битах (0.0 применяется при работе по умолчанию); blastn/megablast 50, tblastx 0, все другие 25 [Integer]; значение по умолчанию = 0; -R PSI-TBLASTN файл контрольной точки [File In] Optional; -n MegaBlast поиск [T/F]; значение по умолчанию = F; -I расположение на последовательности запроса [String] Optional; -А размер окна множества хитов, по умолчанию если ноль (blastn/megablast 0, все другие 40 [Integer]; значение по умолчанию = 0; -W штраф за сдвиг рамки (OOF алгоритм для blastx) [Integer]; значение по умолчанию = 0; -t длина самого большого интрона, разрешенного для tblastn для связывания HSPs (0 отключить связывание) [Integer]; значение по умолчанию = 0.
Результаты высокого качества достигнуты при помощи алгоритма Needleman и Wunsch или Smith и Waterman. Поэтому программы, основанные на указанных алгоритмах, предпочтительны. Предпочтительно сравнения последовательностей могут быть сделаны с помощью программы PileUp (J. Mol. Evolution., 25, 351 (1987), Higgins et al., CABIOS 5, 151 (1989)) или предпочтительно с помощью программ "Gap" и "Needle", которые и основаны на алгоритмах Needleman и Wunsch (J. Mol. Biol. 48; 443 (1970)) и "BestFit", которая основана на алгоритме Smith и Waterman (Adv. Appl. Math. 2; 482 (1981)). "Gap" и "BestFit" являются частью пакета программ GCG (Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711 (1991); Altschul et al., (Nucleic Acids Res. 25, 3389 (1997)), "Needle" is part of the The European Molecular Biology Open Software Suite (EMBOSS) (Trends in Genetics 16 (6), 276 (2000)). Поэтому предпочтительно, чтобы вычисления для определения процентов гомологии последовательностей проводились бы с помощью программ "Gap" и "BestFit" по всему диапазону последовательностей. Для сравнения последовательностей нуклеиновой кислоты использовалась следующие стандартные установки для "Needle": matrix: EDNAFULL, Gap_penalty: 10.0, Extend_penalty: 0.5. Для сравнения последовательностей нуклеиновой кислоты использовалась следующие стандартные установки для "Gap": gap weight: 50, length weight: 3, average match: 10.000, average mismatch: 0.000.
Например, последовательность, про которую говорят, что она имеет 80%-ную идентичность с последовательностью SEQ ID NO: 1 на уровне нуклеиновой кислоты следует понимать как то, что значение последовательности, которая при сравнении с последовательностью, представленной SEQ ID NO: 1 с помощью вышеупомянутой программы "Needle" с вышеупомянутым набором параметра, имеет 80%-ную идентичность. Предпочтительно гомология вычисляется на полной длине последовательности запроса, например SEQ ID NO:1.
Интрон: относится к частям ДНК (вставочные последовательности) внутри гена, которые не кодируют часть белка, которая образует ген, и которые вырезаются из мРНК, которая подвергается транскрипции из гена, перед экспортированием из клеточного ядра. Последовательность интрона относится к последовательности нуклеиновой кислоты интрона. Таким образом, нитроны представляют собой те области ДНК последовательностей, которые подвергаются транскрипции наряду с кодирующей последовательностью (экзоны), но удаляются в ходе образования зрелой мРНК. Интроны могут быть расположены внутри действующей кодирующей области, либо в 5', либо в 3' нетранслируемых лидерных последовательностях пре-мРНК (несплайсированная мРНК). Интроны в первичном транскрипте вырезаются, и кодирующие последовательности подвергаются лигированию одновременным и строгим образом с образованием зрелой мРНК. Стыки интронов и экзонов формируют сайты сплайсинга. Последовательность интрона начинается с GU и заканчивается AG. Более того, для растений были описаны два примера AU-AC интронов: четырнадцатый интрон гена RecA-подобного белка и седьмой интрон G5 гена из Arabidopsis thaliana представляют собой АТ-АС интроны. Пре-мРНК, содержащие интроны, имеют три короткие последовательности, которые помимо других последовательностей, необходимы для точного вырезания интрона. Эти последовательности представляют собой 5' сплайс-сайт, 3' сплайс-сайт и точку ветвления. Сплайсинг мРНК представляет собой удаление вставочных последовательностей (интронов), присутствующих в первичных мРНК транскриптах, и соединение или лигирование последовательностей экзонов. Это также известно как цис-сплайсинг, который приводит к соединению двух экзонов на одной и той же РНК с удалением вставочной последовательности (интрона). Функциональные элементы интрона содержат последовательности, которые распознаются и связываются конкретными белковыми компонентами сплайсингосомы (например, консенсусные последовательности сплайсинга на концах интронов). Взаимодействие функциональных элементов с сплайсингосомой приводит к удалению последовательности интрона из незрелой мРНК и воссоединению экзонных последовательностей. Интроны имеют три короткие последовательности, которые необходимы, но не достаточны, для точного удаления интрона. Эти последовательности представляют собой 5' сплайс-сайт, 3' сплайс-сайт и точку ветвления. Последовательность точки разветвления важна при сплайсинге и выборе сплайс-сайтов в растениях. Последовательность точки разветвления, как правило, находится на расстоянии 10-60 нуклеотидов от 3' сплайс-сайта против хода транскрипции.
Изогенный: организмы (например, растения), которые генетически идентичны, за исключением того, что они могут отличаться присутствием или отсутствием гетерологичной последовательности ДНК.
Выделенный: термин "выделенный", как применяется в описании настоящего изобретения, означает, что материал был удален человеком в ручную и существует отдельно от его природного естественного окружения, и, поэтому, не представляет собой продукт природного происхождения. Выделенный материал или молекула (как например, молекула ДНК или фермент) может существовать в очищенной форме или может существовать в неестественном окружении, как например, в трансгенной клетке-хозяине. Например, полинуклеотид или полипептид естественного происхождения, присутствующий в живом растении, является невыделенным, но такой же полинуклеотид или полипептид, отдельный от некоторых или всех сопутствующих материалов в природной системе, является выделенным. Такие полинуклеотиды могут быть частью вектора, и/или такие полинуклеотиды или полипептиды могли бы быть частью композиции, и были бы выделенными, так как вектор или композиция не являются частью их природного окружения. Предпочтительно термин "выделенная", при применении в отношении молекулы нуклеиновой кислоты, как в признаке "выделенная последовательность нуклеиновой кислоты", относится к последовательности нуклеиновой кислоты, которая идентифицируется и отделяется от по меньшей мере одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в ее природном источнике. Выделенная молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, присутствующую в форме или обстановке, которые отличны от тех, в которых она встречается в природе. Напротив, невыделенные молекулы нуклеиновых кислот представляют собой молекулы нуклеиновых кислот, как например, ДНК и РНК, которые обнаруживаются в состоянии, в котором они встречаются в природе. Например, данная последовательность ДНК (например, ген) обнаруживается в хромосоме клетки-хозяина в непосредственной близости от соседних геном; последовательности РНК, как например, конкретная последовательность мРНК, кодирующая конкретный белок, обнаруживаются в клетки в виде смеси с множеством других мРНК, которые кодируют множество белков. Однако выделенная последовательность нуклеиновой кислоты, содержащая, например, SЕQ ID NO: 1, включает, в качестве примера, такие последовательности нуклеиновых кислот в клетках, которые обычно содержат SEQ ID NO: 1, где последовательность нуклеиновой кислоты находится в хромосомном или внехромосомном положении, отличном от природных клеток, или, в ином случае, фланкируется отличной последовательностью нуклеиновой кислоты, чем та, которая встречается в природе. Выделенная последовательность нуклеиновой кислоты может присутствовать в однонитевой или двухнитевой форме. Когда выделенная последовательность нуклеиновой кислоты применяется для экспрессии белка, последовательность нуклеиновой кислоты будет содержать минимум по меньшей мере часть смысловой или кодирующей нити (то есть последовательность нуклеиновой кислоты может быть однонитевой). Альтернативно, она может содержать как смысловую, так и антисмысловую нити (то есть последовательность нуклеиновой кислоты может быть двунитевой).
Минимальный промотор: элементы промотора, в частности элемент TATA, которые неактивны или которые имеют весьма пониженную активность промотора в отсутствии повышающей активации. В присутствии подходящего фактора транскрипции минимальный промотор действует с обеспечением транскрипции.
NEENA: смотрите "нуклеиновая кислота, усиливающая экспрессию нуклеиновых кислот".
Некодирующие: Термин "некодирующие" относится к последовательностям молекул нуклеиновой кислоты, которые не кодируют часть или весь экспрессируемый белок. Некодирующие последовательности включают, но не ограничены этим, интроны, энхансеры, промоторные области, 3' нетранслируемые области и 5' нетранслируемые области.
Нуклеиновая кислота, усиливающая экспрессию нуклеиновых кислот (NEENA): Термин "нуклеиновая кислота, усиливающая экспрессию нуклеиновых кислот" относится к последовательности нуклеиновой кислоты и/или молекуле нуклеиновой кислоты конкретной последовательности, имеющей присущее ее свойство усиления экспрессии нуклеиновой кислоты под контролем промотора, с которым NEENA функционально связана. В отличие от промоторных последовательностей, NEENA как таковая, не способна управлять экспрессией. Для того чтобы осуществить функцию усиления экспрессии молекулы нуклеиновой кислоты, функционально связанной с NEENA, NEENA сама по себе должна быть функционально связана с промотором. В отличие от энхансерных последовательностей, известных в данной области техники, NEENA являются цис-, но не транс-действующими, и должны быть локализованы близко к сайту старта транскрипции нуклеиновой кислоты, подлежащей экспрессии.
Нуклеиновые кислоты и нуклеотиды: термины "нуклеиновые кислоты" и "нуклеотиды" относится к нуклеиновым кислотам или нуклеотидам природного происхождения, или синтетическим или искусственным нуклеиновым кислотам или нуклеотидам. Термины "нуклеиновые кислоты" и "нуклеотиды" охватывают дезоксирибонуклеотиды или рибонуклеотиды, или любые нуклеотидные аналоги, и их полимеры или гибриды либо в однонитевой, либо в двухнитевой, смысловой или антисмысловой форме. Если иного не указано, конкретная последовательность нуклеиновой кислоты также полностью охватывает ее консервативно модифицированные варианты (например, замещения вырожденных кодонов) и комплементарные последовательности, а также явно указанную последовательность. Термин "нуклеиновая кислота" в описании настоящего изобретения применяется взаимозаменяемо с термином "ген", "кДНК, "мРНК", "олигонуклеотид" и "полинуклеотид". Нуклеотидные аналоги включают нуклеотиды, имеющие модификации в химической структуре основания, сахара и/или фосфата, включая, но без ограничения к этому, модификации пиримидина в положении 5, модификации пурина в положении 8, модификации при цитозиновых экзоциклических аминах, замещение 5-бром-урацила и тому подобное; и модификации сахаров в 2'-полоджении, включая, но без ограничения к этому, сахар-модифицированные рибонуклеотиды, в которых 2'-ОН замещена группой, выбранной из Н, OR, R, гало, SH, SR, NH2, NHR, NR2 или CN. Короткие РНК, образующие шпильки (shPHK), также могут содержать элементы не природного происхождения, как например, не природные основания, например, инозин и ксантин, не природные сахара, например, 2’-метоксирибоза, или не природные сложные фосфодиэфирные связи, например, метилфосфонаты, фосфоротиоаты и пептиды.
Последовательность нуклеиновой кислоты: Фраза "последовательность нуклеиновой кислоты" относится к однонитевому или двухнитевому полимеру дезоксирибонуклеотидных или рибонуклеотидных оснований, читаемых от 5'- к 3'-концу. Она включает хромосомальную ДНК, самореплицирующиеся плазмиды, инфекционные полимеры ДНК или РНК, и ДНК или РНК, которые играют первичную структурную роль. "Последовательность нуклеиновой кислоты" также относится к последовательному перечислению аббревиатур, букв, символов или слов, которые обозначают нуклеотиды. В одном варианте выполнения настоящего изобретения, нуклеиновая кислота может представлять собой "зонд", который представляет собой относительно короткую нуклеиновую кислоту, обычно менее 100 нуклеотидов в длину. Часто нуклеиновая кислота в виде зонда составляет от около 50 нуклеотидов в длину до около 10 нуклеотидов в длину. "Целевая область" нуклеиновой кислоты представляет собой часть нуклеиновой кислоты, которая идентифицируется как представляющая интерес.
Олигонуклеотид: термин "олигонуклеотид" относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или их миметиков, а также к олигонуклеотидам, имеющим части не природного происхождения, которые имеют подобную функцию. Такие модифицированные или замещенные олигонуклеотиды часто предпочтительны по сравнению с природными формами из-за желательных свойств, как например, усиленное клеточное поглощение, усиленное сродство к целевой нуклеиновой кислоте и повышенная стабильность в присутствии нуклеаз. Олигонуклеотид предпочтительно включает два или более нуклеотидных мономеров, ковалентно связанных друг с другом связями (например, сложные фосфодиэфиры) или связями через заместители.
Липкий конец: "Липкий конец" является относительно короткой одноцепочечной нуклеотидной последовательностью на 5'- или 3'-гидроксильных концах двухцепочечной олигонуклеотидной молекулы (также называемый "расширение", "выступающий конец" или "липкий конец").
Растение: как понимается, в общем, означает любой эукариотический одноклеточный или многоклеточный организм, или его клетку, ткань, часть или материал размножения (как например, семена или плод), которые способны к фотосинтезу. В целях настоящего изобретения охватываются все роды и виды высших и низших растений царства растений. Предпочтительными являются однолетние, многолетние односемядольные и двудольные растения. Этот термин включает зрелые растения, семена, корни и саженцы, и происходящие из них части, материал размножения (как например, семена или микроспоры), органы растений, ткани, протопласты, каллюс и другие культуры, как например, клеточные культуры, и любой другой тип растительной клетки, группирующийся с образованием функциональных или структурных единиц. Зрелые растения относятся к растениям любой желательной стадии развития после высаживания. Саженец относится к молодому незрелому растению на ранней стадии развития. Однолетние, многолетние, односемядольные и двудольные растения являются предпочтительными организмами-хозяевами для создания трансгенных растений. Более того, экспрессия генов предпочтительно во всех вообразимых растениях, полезных или декоративных растениях, цветах, срезанных цветках, кустах или газонах. Растения, которые могут быть упомянуты в качестве примера, но не в целях ограничения, являются ангиоспермы, бриофиты, как например, Hepaticae (печеночник) и Musci (мхи); птеридофиты, как например, папоротники, хвощ и плауны; голосемянные растения, как например, хвойные деревья, цикадовые растения, гинкго и Gnetatae; водоросли, как например, Chlorophyceae, Phaeophpyceae, Rhodophyceae, Myxophyceae, Xanthophyceae, Bacillariophyceae (диатомовые водоросли) и Euglenophyceae. Предпочтительными являются растения, которые применяются в качестве пищи или корма, как например, семейство бобовые, как например, горох, люцерна и соя; семейство злаковые, как например, рис, кукуруза, пшеница, ячмень, сорго, просо, рожь, тритикале или овес; семейство зонтичные, особенно род Daucus, особенно вид carota (морковь) и Apium, особенно вид Graveolens dulce (сельдерей), и многие другие; семейство пасленовые, особенно род Lycopersicon, особенно вид esculentum (томат) и род Solarium, особенно вид tuberosum (картофель) и melongena (баклажан), и многие другие (как например табак); и род Capsicum, особенно вид аппиит (перец) и многие другие; семейство бобовые, особенно род Glycine, особенно вид max (соя), люцерна, горох, Люцерн, бобы или арахис, и многие другие; и семейство крестоцветные (Brassicacae), особенно род Brassica, особенно вид napus (масличный рапс), campestrís (свекла), oleracea cv Tastie (капуста), oleracea cv Snowball Y (цветная капуста) и oleracea cv Emperor (брокколи); и род Arabidopsis, особенно вид thaliana, и многие другие; семейство сложноцветные, особенно род Lactuca, особенно вид sativa (латук) и многие другие; семейство Asteraceae, как например подсолнечник, бархатцы, латук или календула, и многие другие; семейство тыквенные, как например, дыня, тыква/кабачок или цукини, и льняное семя. Также предпочтительными являются хлопок, сахарный тростник, конопля, лен, красный стручковый перец и различные виды деревьев, орехов и винограда.
Полипептид: термины "полипептид", "пептид", "олигопептид", "генный продукт", "продукт экспрессии" и "белок" применяются в описании настоящего изобретения взаимозаменяемого и означают полимер или олигополимер последовательных аминокислотных остатков.
Пре-белок (белок-предшественник): Белок, который обычно предназначается для внутриклеточной органеллы, такой как хлоропласт и все еще содержащий его транзитный пептид.
Первичный транскрипт: термин "первичный транскрипт", как применяется в описании настоящего изобретения, означает незрелый РНК транскрипт гена. "Первичный транскрипт", например, все еще содержит интроны и/или уже не содержит полиА часть или структуру cap и/или другие модификации, необходимые для его правильной функции в качестве транскрипта, как например, обрезка или сборка.
Промотор: термины "промотор" или "промоторная последовательности" являются эквивалентными и в описании настоящего изобретения относятся к последовательности ДНК, которая при лигировании с рассматриваемой нуклеотидной последовательностью способна контролировать транскрипцию рассматриваемой нуклеотидной последовательности в РНК. Такие промоторы можно, например, найти в следующих общедоступных базах данных http.//www.grassius.org/grasspromdb.html, http://mendel.cs.rhul. ac.uk/mendel.php?topic=plantprom, http://ppdb.gene.nagova-u.ac.ip/cqi-bin/index.cgi. Промоторы, перечисленные здесь, могут применяться в способах по изобретению и включены в настоящий документ посредством ссылки. Промотор располагается 5' (то есть против хода транскрипции), непосредственно около сайта начала транскрипции рассматриваемой нуклеотидной последовательности, чью транскрипцию в мРНК он контролирует, и обеспечивает сайт специфического связывания РНК полимеразы и других факторов транскрипции для инициации транскрипции. Указанный промотор содержит, например, по меньшей мере 10 кб, например, 5 кб или 2 кб, непосредственно у сайта старта транскрипции. Он также может содержать по меньшей мере 1500 п.о. непосредственно у сайта старта транскрипции, предпочтительно по меньшей мере 1000 п.о., более предпочтительно по меньшей мере 500 п.о:, даже более предпочтительно по меньшей мере 400 п.о., по меньшей мере 300 п. о., по меньшей мере 200 п.о. или по меньшей мере 100 п.о. В другом предпочтительном варианте выполнения настоящего изобретения промотор содержит по меньшей мере 50 п.о. непосредственно у сайта старта транскрипции, на пример, по меньшей мере 25 п. о. Промотор не содержит области экзонов и/или интронов или 5' нетранслируемые области. Промотор может, например, быть гетерологичным или гомологичным по отношению к соответствующему растению. Полинуклеотидная последовательность является "гетерологичной" по отношению к организму или второй нуклеотидной последовательности, если она происходит из чужеродного вида, или, если она происходит из того же вида, она модифицируется по отношению к исходной форме. Например, промотор, операбельно связанный с гетерологичной кодирующей последовательностью, относится к кодирующей последовательности из вида, отличного от того, из которого был получен промотор, или, если последовательность из того же вида, то к кодирующей последовательности, которая не является связанной с промотором в природе (например, кодирующая последовательность, сконструированная методами генной инженерии или аллель из отличного экотипа или варианта). Подходящие промоторы могут быть получены из генов клеток-хозяев, где должна происходить экспрессия, или из патогенов этих клеток-хозяев (например, растения или патогенны растений, такие как вирусы растений). Растение-специфичный промотор представляет собой промотор, подходящий для регуляции экспрессии в растении. Он может быть получен из растения, а также из патогенов растения, или он может представлять собой синтетический промотор, созданный человеком. Если промотором является индуцируемый промотор, то скорость транскрипции повышается в ответ на индуцирующий агент. Также промотор может регулироваться тканеспецифичным или тканепредпочтительным образом, так что он является только или предпочтительно активным при транскрипции связанной кодирующей области в специфическом типе(типах) ткани, как например, листья, корни или меристема. Термин "тканеспецифичный" при применении в отношении промотора относится к промотору, который способен управлять экспрессией нуклеотидной последовательности, представляющей интерес, в специфическом виде ткани (например, лепестки), при относительном отсутствии экспрессии той же нуклеотидной последовательности, представляющей интерес, в другом виде ткани (например, корни). Тканевая специфичность промотора может быть оценена, например, путем операбельного связывания репортерного гена с промоторной последовательностью для создания репортерной конструкции, введения репортерной конструкции в геном растения, так что репортерная конструкция интегрируется в каждую ткань полученного трансгенного растения, и обнаружения экспрессии репортерного гена (например, обнаружения мРНК, белка или активности белка, кодируемого репортерным геном) в различных тканях трансгенного растения. Обнаружение более высокого уровня экспрессии репортерного гена в одной или более тканях относительно уровня экспрессии в других тканях показывает, что промотор специфичен по отношению к ткани, в которой обнаружены более высокие уровни экспрессии. Термин "специфичный по отношению к клеточному типу" при применении в отношении промотора относится к промотору, который способен управлять селективной экспрессией рассматриваемой нуклеотидной последовательности в специфическом типе клетки по отношению к отсутствию экспрессии той же нуклеотидной последовательности в клетке отличного типа внутри той же самой ткани. Термин "специфичный по отношению к клеточному типу" при применении в отношении промотора также означает, что промотор способен способствовать селективной экспрессии нуклеотидной последовательности, представляющей интерес, в области внутри одной ткани. Специфичность по отношению к клеточному типу промотора может быть оценена, применяя способы, хорошо известные в данной области техники, например, окрашивание по GUS активности, окрашивание по GFP белку и иммуногистохимическое окрашивание. Термин "конститутивный", при применении в отношении промотора или экспрессии, управляемой промотором, означает, что промотор способен управлять транскрипцией операбельно связанной молекулы нуклеиновой кислоты в отсутствии стимула (например, теплового шока, химических реагентов, света и т.д.) в большинстве тканей растения и клеток растения на протяжении по существу всей жизни растения или части растения. Как правило, конститутивные промоторы способны управлять экспрессией трансгена в по существу любой клетке и ткани.
Специфичность промотора: термин "специфичность" в отношении промотора означает модель экспрессии, обеспечиваемую соответствующим промотором. Специфичность определяет ткани и/или стадию развития растения или части растения, где промотор обеспечивает экспрессию молекулы нуклеиновой кислоты под контролем соответствующего промотора. Специфичность промотора может также содержать условия окружающей среды, при которых промотор может быть активирован или может подвергаться понижающей регуляции, как например, индукция или репрессия под действием биологических или окружающих стрессов, как например, холод, засуха, ранение или инфекция.
Очищенные: как применяется в описании настоящего изобретения термин "очищенные" относится к молекулам либо последовательностей нуклеиновых кислот, либо последовательностей аминокислот, которые удаляются из их естественного окружения, выделяются или отделяются. "По существу очищенные" молекулы на по меньшей мере 60% свободны, предпочтительно на по меньшей мере 75% свободно, и более предпочтительно на по меньшей мере 90% свободны от других компонентов, с которыми они связаны в природе. Очищенная последовательность нуклеиновой кислоты может представлять собой выделенную последовательность нуклеиновой кислоты.
Рекомбинантные: термин "рекомбинантные" в отношении молекул нуклеиновых кислот относится к молекулам нуклеиновых кислот, полученным методиками рекомбинантных ДНК. Рекомбинантные молекулы нуклеиновых кислот могут также содержать молекулы, которые как таковые не существуют в природе, но являются модифицированными, измененными, мутированными или подвергаются манипуляциям человеком иным образом. Предпочтительно "рекомбинантная молекула нуклеиновой кислоты" представляет собой молекулу нуклеиновой кислоты не природного происхождения, которые отличаются от молекулы нуклеиновой кислоты природного происхождения с точки зрения последовательности на по меньшей мере одну нуклеиновую кислоту. "Рекомбинантная молекула нуклеиновой кислоты" также может содержать "рекомбинантную конструкцию", которая содержит, предпочтительно операбельно связанную, последовательность молекул нуклеиновых кислот не природного происхождения в установленном порядке. Предпочтительные способы получения указанной рекомбинантной молекулы нуклеиновой кислоты содержат методики клонирования, направленный или ненаправленный мутагенез, методики синтеза или рекомбинантные методики.
"Семя-специфичный промотор" в контексте настоящего изобретения означает промотор, который регулирует транскрипцию молекулы нуклеиновой кислоты под контролем соответствующего промотора в семенах, где транскрипция в любой ткани или клетке семян составляет до более 90%, предпочтительно более 95%, предпочтительно более 99% от общего числа РНК, транскрибированных из указанной последовательности нуклеиновой кислоты во всем растении в ходе любой из стадий его развития. Термин "семя-специфичная экспрессия" и "семя-специфичная NEENA" необходимо понимать соответствующим образом. Следовательно "семя-специфичная NEENA" повышает транскрипцию семя-специфичного или семя-предпочтительного промотора таким образом, что транскрипция в семенах, управляемая промотором, функционально связанным с соответствующей NEENA, составляет более 90%, предпочтительно более 95%, более предпочтительно более 99% от общего числа РНК, транскрибированных их соответствующего промотора, функционально связанного с NEENA, во всем растении в ходе любой из стадий его развития.
"Семя-предпочтительный промотор" в контексте настоящего изобретения означает промотор, который регулирует транскрипцию молекулы нуклеиновой кислоты под контролем соответствующего промотора в семенах, где транскрипция в любой ткани или клетке семян составляет более 50%, предпочтительно более 70%, более предпочтительно более 80% от всего числа РНК, транскрибированных из указанной последовательности нуклеиновой кислоты во всем растении в ходе любой стадии его развития. Термины "семя-предпочтительная экспрессия" и "семя-предпочтительная NEENA" должны пониматься соответствующим образом. Следовательно "семя-специфичная NEENA" усиливает транскрипцию семя-специфичного или семя-предпочтительного промотора таким образом, что транскрипция в семенах, управляемая указанным промотором, функционально связанным с соответствующей NEENA, составляет более 50%, предпочтительно более 70%, более предпочтительно более 80% от общего числа РНК, транскрибированных из соответствующего промотора, функционально связанного с NEENA, во всем растении в ходе любой стадии его развития.
Смысловая: термин "смысловая", как понимается, означает молекулу нуклеиновой кислоты, имеющую последовательность, которая комплементарна или идентична целевой последовательности, например, последовательность, которая связывается с фактором транскрипции белка и которая участвует в экспрессии данного гена. Согласно предпочтительному варианту выполнения настоящего изобретения, молекула нуклеиновой кислоты содержит ген, представляющий интерес, и элементы, обеспечивающие экспрессию указанного представляющего интерес гена.
Существенное повышение или понижение: повышение или понижение, например, ферментативной экспрессии или генной экспрессии, то есть больше, чем предел погрешности, присущий методике измерения, предпочтительно повышение или понижение около в 2 раза или более по сравнению с активностью контрольного фермента или экспрессией в контрольной клетке, более предпочтительно, повышение или понижение около в 5 раза или более, и наиболее предпочтительно повышение или понижение около в 10 раза или более.
Малые молекулы нуклеиновой кислоты: "малые молекулы нуклеиновой кислоты" понимаются как молекулы, состоящие из нуклеиновых кислот или их производных, таких как РНК или ДНК. Они могут быть двухцепочечными или одноцепочечными и могут содержать между около 15 и около 30 п.о., например между 15 и 30 п.о., более предпочтительно между около 19 и около 26 п.о., например между 19 и 26 п.о., еще более предпочтительно между около 20 и около 25 п.о., например, между 20 и 25 п.о. В особенно предпочтительном варианте осуществления олигонуклеотидны содержат между около 21 и около 24 п.о., например между 21 и 24 п.о. В самом предпочтительном варианте осуществления малыми молекулами нуклеиновой кислоты содержат около 21 п.о. и около 24 п.о., например 21 п.о. и 24 п.о. По существу комплементарная: в самом широком смысле термин "по существу комплементарная", при применении в описании настоящего изобретения касательно нуклеотидной последовательности в отношении ссылочной или целевой нуклеотидной последовательности, означает нуклеотидную последовательность, имеющую процент идентичности между по существу комплементарной нуклеотидной последовательностью и точно комплементарной последовательностью указанной контрольной или целевой нуклеотидной последовательности по меньшей мере 60%, более желательно по меньшей мере 70%, более желательно по меньшей мере 80% или 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 93%, еще более предпочтительно по меньшей мере 95% или 96%, еще более предпочтительно по меньшей мере 97% или 98%, еще более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% (последнее эквивалентно термину "идентичная" в этом контексте). Предпочтительно идентичность оценивается по длине в по меньшей мере 19 нуклеотидов, предпочтительно по меньшей мере 50 нуклеотидов, более предпочтительно по всей длине последовательности нуклеиновой кислоты, по отношению к указанной ссылочной последовательности (если иного не указано ниже). Сравнения последовательностей осуществляются, применяя анализ GAP, по умолчанию, университета Висконсин GCG, SEQWEB приложение для GAP, на основе алгоритма Нидельмана и Вунша (Needleman and Wunsch (1970) J Mol. Biol. 48: 443-453; как определено выше). Нуклеотидная последовательность "по существу комплементарная" контрольной нуклеотидной последовательности гибридизуется с ссылочной нуклеотидной последовательностью в условиях низкой строгости, предпочтительно в условиях средней строгости, наиболее предпочтительно в условиях высокой строгости (как определено выше).
Трансгенная: термин "трансгенная", как применяется в настоящем изобретении, относится к любой последовательности нуклеиновой кислоты, которая вводится в геном клетки путем экспериментальных манипуляций. Трансгеном может быть "эндогенная ДНК последовательность" или "гетерологичная ДНК последовательность" (то есть "чужеродная ДНК"). Термин "эндогенная ДНК последовательность" относится к нуклеотидной последовательности, которая в природе обнаруживается в клетке, в которую она вводится, до тех пор пока она не содержит некоторую модификацию (например, точечная мутация, присутствие селектируемого маркерного гена и т.д.) относительно последовательности природного происхождения.
Трансгенный: термин трансгенный при применении в отношении организма означает трансформированный, предпочтительно стабильно трансформированный молекулой рекомбинантной ДНК, которая предпочтительно содержит подходящий промотор, операбельно связанный с представляющей интерес ДНК последовательности.
Вектор: как применяется в описании настоящего изобретения термин "вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую молекулу нуклеиновой кислоты, с которой она была связана. Одним типом вектора является геномный интегрированный вектор или "интегрированный вектор", который может быть интегрирован в хромосомальную ДНК клетки-хозяина. Другим типом вектора является эписомальный вектор, то есть молекула нуклеиновой кислоты, способная к внехромосомной репликации. Векторы, способные управлять экспрессией генов, с которыми они операбельно связаны, упоминаются в описании настоящего изобретения как "экспрессионные вектора". В описании настоящего изобретения термины "плазмида" и "вектор" применяются взаимозаменяемо, если из контекста явным образом не следует иное. Экспрессионные вектора, предназначенные для продуцирования РНК, как описано в описании настоящего изобретения, in vitro или in vivo, могут содержать последовательности, распознаваемые РНК-полимеразой, включая митохондриальную РНК полимеразу, RNA pol I, RNA pol II и RNA pol III. Эти вектора могут применяться для транскрипции желательной молекулы РНК в клетке согласно настоящему изобретению. Под растительным трансформационным вектором необходимо понимать вектор, подходящий для применения в процессе трансформации растения.
Дикого типа: термин "дикого типа", "природный" или "природного происхождения" при применении в отношении организма, полипептида или последовательности нуклеиновой кислоты означает, что данный организм является организмом природного происхождения, или полипептид или последовательность нуклеиновой кислоты доступны из по меньшей мере одного организма природного происхождения, который не подвергался изменению, мутации или иным манипуляциям человеком.
ПРИМЕРЫ
Реактивы и общепринятые способы
Если не обозначено иначе, процедуры клонирования, выполненные в целях настоящего изобретения, включая расщепление рестриктазами, электрофорез в агарозном геле, очистка нуклеиновых кислот, лигирование нуклеиновых кислот, трансформация, селекция и культивирование бактериальных клеток осуществляли, как описано (Sambrook et al., 1989). Исследования последовательности рекомбинантной ДНК осуществляли с помощью секвенатора с лазерной ДНК флюоресценцией (Applied Biosystems, Foster City, CA, USA) с использованием метода Сангера (Sanger et al., 1977). Если не описано иначе, химикаты и реактивы получали от Sigma Aldrich (Sigma Aldrich, St. Louis, USA), от Promega (Madison, Wl, USA), Duchefa (Haarlem, The Netherlands) или Invitrogen (Carlsbad, CA, USA). Рестрикционные эндонуклеазы были от New England Biolabs (Ipswich, MA, USA) или Roche Diagnostics GmbH (Penzberg, Germany). Олигонуклеотидны синтезировали в Eurofins MWG Орегон (Ebersberg, Germany).
Пример 1: Идентификация кандидатных нуклеиновых кислот, усиливающих экспрессию нуклеиновой кислоты (NEENA), из генов с специфичной для семян или предпочтительной для семян экспрессией
1.1 Идентификация молекул NEENA из генов A. thaliana
Используя общедоступные последовательности геномной ДНК (например, http://www.ncbi.nlm.nih.gov/genomes/PLANTS/PlantList.html) и данные об экспрессии транскриптов (например, http.//www.weigelworld.org/resources/mkarray/AtGenExpress/), набор из 19 кандидатных NEENA, происходящих из транскриптов Arabidopsis thaliana со специфичной для семян или предпочтительной для семян экспрессией, отобрали для подробных анализов. Кандидаты назвали следующим образом:
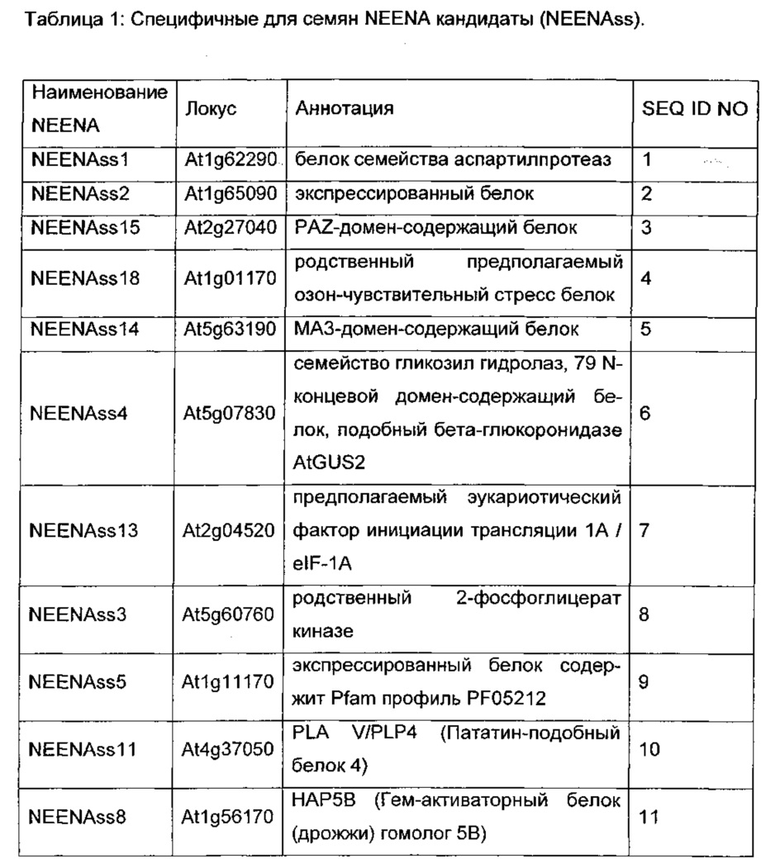
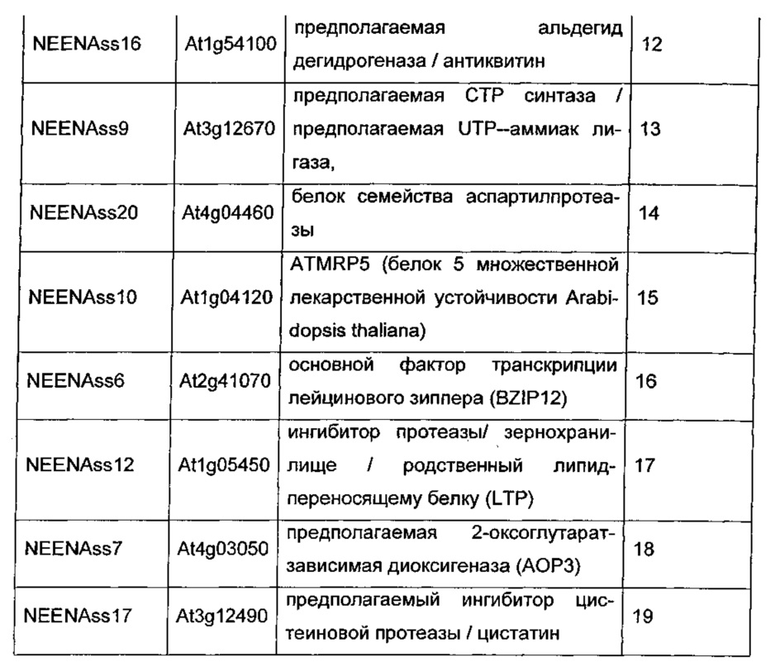
1.2 Выделение кандидатов NEENA
Геномную ДНК экстрагировали из зеленой ткани A. thaliana, используя Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden, Germany). Фрагменты геномной ДНК, содержащие предполагаемые молекулы NEENA, выделяли с помощью обычной полимеразной цепной реакции (ПЦР). Праймеры сконструировали на основе последовательности генома A. thaliana со множеством кандидатных NEENA. Реакция содержала 19 наборов праймеров (Таблица 2) и соответствовала протоколу, обрисованным в общих чертах Phusion High Fidelity DNA Polymerase (Cat No F-540L, New England Biolabs, Ipswich, MA, USA). Изолированная ДНК использовалась в качестве ДНК-матрицы для амплификации ПЦР с использованием следующих праймеров:


Амплификацию в течение ПЦР проводили со следующей композицией (50 мкл):
3,00 мкл геномной ДНК A. thaliana (50 нг/мкл)
10,00 мкл Phusion HF 5х буфер
4,00 мкл dNTP (2,5 мМ)
2,50 мкл прямой (for) праймер (10 мкМ)
2,50 мкл обратный (rev) праймер (10 мкМ)
0,50 мкл Phusion HF ДНК-полимераза (2 Ед/мкл)
Подход touch-down (ПЦР с плавным снижением температуры отжига) использовали для ПЦР со следующими параметрами: 98,0°С в течение 30 секунд (1 цикл), 98,0°С в течение 30 секунд, 56,0°С в течение 30 секунд и 72,0°С в течение 60 секунд (4 цикла), 4 дополнительных цикла каждый для 54,0°С, 51,0°С и 49,0°С температура отжига, сопровождаемой 20 циклами с 98,0°С в течение 30 секунд, 46,0°С в течение 30 секунд и 72,0°С в течение 60 секунд (4 цикла) и 72,0°С в течение 5 минут. Продукты амплификации загружали на 2% (масса/объем) гель агарозы и разделяли при 80 В. Продукты ПЦР вырезали из геля и очищали с помощью Qiagen Gel Extraction Kit (Qiagen, Hilden, Germany). После расщепление ДНК рестриктазами с помощью рестрикционных эндонуклеаз Ncol (10 Ед/мкл) и Kpnl (10 Ед/мкл), продукты расщепления снова очищали с помощью набора Qiagen Gel Extraction (Qiagen, Hilden, Germany).
1.3 Конструирование вектора
С использованием Multisite Gateway System (Invitrogen, Carlsbad, CA, USA), кассеты промотор::NEENA::репортерный ген собирали в бинарные конструкции для трансформации растений. A. thaliana p-AtPXR (At1g48130, GenBank AC023673.3; WO2006089950; с префиксом p- обозначающий промотор), промотор, специфичный для семян, отбирали в конструкции репортерного гена, и люциферазу светлячков (Promega, Madison, Wl, USA) использовали как репортерный белок для количественного определения эффектов усиления экспрессии молекул NEENA, которые предназначенных для анализа.
Вектор pENTR/A, содержащий промотор p-AtPXR, клонировали через сайт специфической рекомбинации (BP-реакция) между вектором pDONR/A и продуктами амплификации p-AtPXR с праймерами p-AtPXR-for и p-AtPXR-rev (Таблица 3) на геномной ДНК (см. выше) с сайтами специфической рекомбинации на обоих концах в соответствии с руководством изготовителей Invitrogen, Carlsbad, CA, USA). Позитивные pENTR/A клоны подвергали секвенированию, чтобы гарантировать правильность p-AtPXR промотора.

Создали вектор ENTR/B, содержащий последовательность, кодирующую люциферазу светлячка (Promega, Madison, WI, USA) со следующим за ней терминатором транскрипции t-nos нопалин синтазы (Genbank V00087). ПЦР фрагменты кандидата NEENA (см. выше) клонировали раздельно выше последовательности, кодирующей люциферазу светлячка, с использованием рестрикционных ферментов Kpnl и Ncol. Получающиеся векторы pENTR/B приведены в таблице 4, с промоторными молекулами, имеющими префикс р-, кодирующие последовательности, имеющие приставку с- и молекулы терминатора, имеющие приставку t-.


Вектор pENTR/C конструировали введением сайта множественного клонирования (полилинкер) (SEQ ID NO60) через сайты рестрикции Kpnl и Hindlll. Осуществлением сайт-специфической рекомбинации (LR-реакция), созданные pENTR/A, pENTR/B и pENTR/C соединяли с целевым вектором pSUN (pSUN производная) в соответствии с руководством изготовителей Multisite Gateway manual (Invitrogen, Carlsbad, CA, USA). Реакции привели к 1 бинарному вектору с промотором p-AtPXR, последовательностью, кодирующей люциферазу светлячка, c-LUC и терминатором t-nos и 19 векторов, несущих SEQ ID NO1, NO2, NO3, NO4, NO5, NO6, NO7, NO8, NO9, NO10, NO11, NO12, NO13, NO14, NO15, NO16, NO17, NO18 и NO19, непосредственно выше по течению от последовательности, кодирующей люциферазу светлячка (Таблица 5), для которой комбинация с SEQ ID NO1 дана в качестве примера (SEQ ID NO61). За исключением изменяющейся SEQ ID NO2 в NO19, нуклеотидная последовательность была идентична во всех векторах (Таблица 5). Получающиеся векторы трансформации растений приведены в таблице 5:
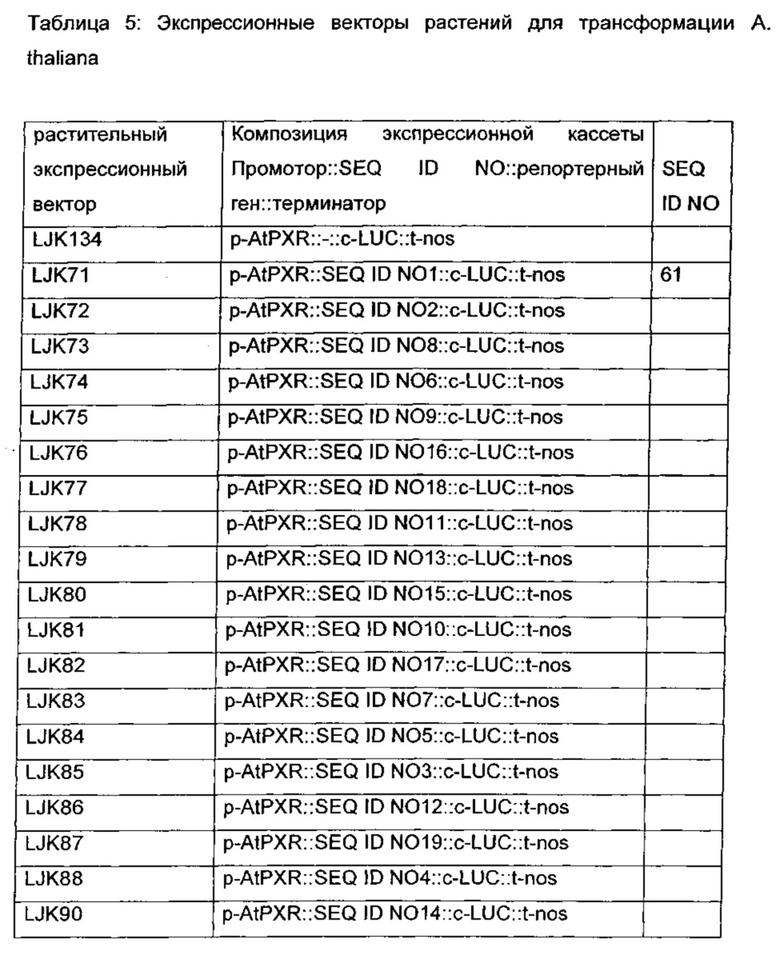
Получающиеся векторы впоследствии использовали для создания трансгенных растений A. thaliana.
Пример 2: Скрининг молекул NEENA на усиление генной экспрессии в трансгенных растениях A. thaliana
Этот пример иллюстрирует, что только отобранные молекулы NEENA-кандидаты способны к усилению генной экспрессии.
Все бинарные конструкции, содержащие отобранные кандидатные молекулы NEENA, описанные в примере 1, были стабильно трансформированы в растения Arabidopsis thaliana наряду с контрольными конструкциями без NEENA. Чтобы создать трансгенные растения A. thaliana, Agrobacterium tumefaciens (штамм C58C1 pGV2260) трансформировали различными векторными конструкциями, описанными выше. Для трансформации A. thaliana использовали метод Floral Dip (Clough and Bent, 1998, Plant Journal 16: 735-743). T1 трансгенные растения отбирали, проращивая и выращивая саженцы на канамицине. Через 12 дней семядоли трансформантов и контрольных растений дикого типа отбирали и распределяли в 96-луночные планшеты, предварительно загруженные 50 мкл 0,5х Murashige-Skoog Medium, и подвергали анализу на репортерный ген люциферазы (исправленный протокол Weigel and Glazebrook, 2002, Arabidopsis, a laboratory manual, Cold Spring Harbor Laboratory Press, Chapter 7, ISBN 0-87969-572-2). Люминесценцию семядолей определяли в растворе, содержащем 0,1 мМ D-люцеферин (Cat No: L-8220, BioSynth, Staad, Switzerland) и 0,01% Tween-20 (Sigma Aldrich, St. Louis, USA), записанную с помощью MicroLumat Plus LB96V (Berthold Technologies, Bad Wildbad, Germany) через 60 минут после добавления D-люцеферина. Показания приборов усредняли для каждой конструкции и на основе на этих усредненных значениях экспрессии, вычисляли значения кратности изменения, чтобы оценить влияния присутствия предполагаемой NEENA через конструкции репортерного гена, испытывающего недостаток в соответствующем предполагаемом NEENA. По сравнению с конструкциями репортерного гена только со специфичным для семян единственным промотором p-AtPXR и не содержащей NEENA, 19 протестированных кандидатов NEENA, содержащих конструкции, показали как отрицательные, так и положительные эффекты, в пределах от 0,8-кратной до 22,2-кратной индукции активности люциферазы (Фиг. 1). Всего 15 предполагаемых молекул NEENA, содержащие последовательности с SEQ ID NO1, NO2, NO3, NO4, NO5, NO6, NO7, NO8, NO9, NO10, NO11, NO12, NO13, NO14 и NO15, приводили к большему, чем 2,5-кратное усилению генной экспрессии, основанной на люциферазной активности репортерного гена по сравнению с конструкцией репортерного гена только со специфичным для семян единственным промотором p-ZmKG86 и не содержащей NEENA (Фиг. 1), и следовательно являются функциональными молекулами NEENA. Так как ряд проверенных кандидатных молекул NEENA, имеют незначительные или даже отрицательные эффекты на усиление генной экспрессии, не все предполагаемые молекулы NEENA опосредуют общий стимулирующий эффект, а только отобранные последовательности NEENA переносили существенное повышение генной экспрессии (SEQ ID NO 1-15).
Пример 3: Тестирование молекул NEENA на специфичное для семян усиление генной экспрессии в растениях рапса
Этот пример иллюстрирует, что молекулы NEENA могут применяться от вида к виду, для усиления генной экспрессии тканеспецифичного промотора по сравнению с подходом «без NEENA только промотор».
Молекулы NEENA, опосредующие самое мощное усиление генной экспрессии в предварительном скрининге (ср. Пример 2, SEQ ID NO1, NO2, NO3, NO4, NO5, NO6 и NO7), отобрали для определения уровня усиления генной экспрессии в трансгенных растениях рапса.
3.1 Конструирование вектора для трансформации растений В. napus
Для трансформации растений рапса экспрессионные кассеты репортерного гена без и с молекулами контроля генной экспрессией (SEQ IDs NO1 - NO7) объединяли с экспрессионной кассетой гена, несущей селектируемый маркерный ген для обнаружения линий трансгенных растений внутри вектора pENTR/C. Осуществлением сайт-специфической рекомбинации (LR-реакция), как ранее описано (см. выше, 1.3), pENTR/A, pENTR/B и pENTR/C-несущие кассеты с селектируемым маркером интегрировали с pSUN целевым вектором в соответствии с руководством изготовителей Multisite Gateway manual (Invitrogen, Carlsbad, CA, USA). Реакции привели к одному бинарному вектору с промотором p-AtPXR, последовательностью, кодирующей люциферазу светлячка c-LUC, t-nos терминатором и кассетой селектируемого маркера так же как 7 векторов, несущих SEQ ID NO1, NO2, NO3, NO4, NO5, NO6 и NO7 непосредственно выше по течению от последовательности, кодирующей люциферазу светлячка (Таблица 6), для которой комбинация с SEQ ID NO1 дается в качестве примера (SEQ ID NO62). За исключением изменяющейся SEQ ID NO2 в NO7, нуклеотидная последовательность была идентична во всех векторах (Таблица 6). Получающиеся векторы трансформации растений приведены в таблице 6:
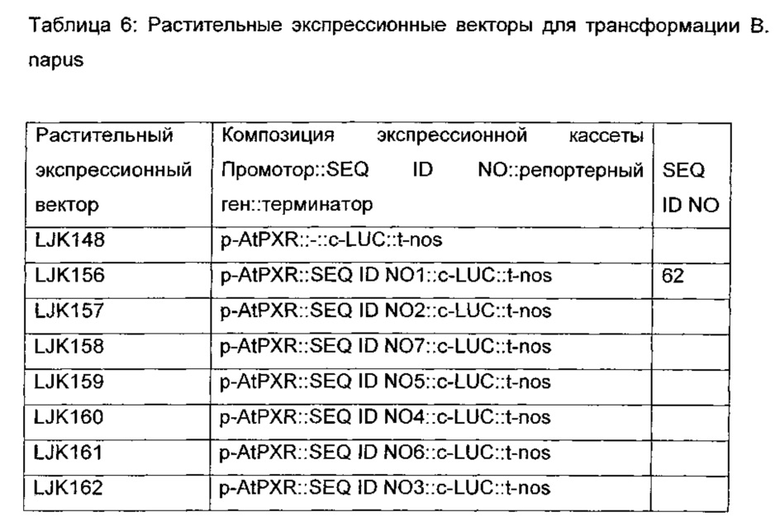
3.2 Генерация трансгенных растений рапса (исправленный протокол в соответствии с Moloney et al., 1992, Plant Cell Reports, 8: 238-242).
В приготовлениях для создания трансгенных растений рапса бинарные векторы трансформировали в Agrobacterium tumefaciens C58C1:pGV2260 (Deblaere et al., 1985, Nucl. Acids. Res. 13: 4777-4788). Разбавленную 1:50 ночную культуру Agrobacteria, несущую соответствующую двойную конструкцию, выращивали на среде Мурасиге-Скуга (Murashige and Skoog, 1962, Physiol. Plant 15, 473), дополненной 3%-ой сахарозой (3MS-среда). Для трансформации рапсовых растений черешки или семядоли стерильных растений инкубировали с 1:50 раствором Agrobacterium в течение 5-10 минут, с последующей трехдневной совместной инкубацией в темноте при 25°С на среде 3MS, дополненной 0,8% бакто-агаром. Через три дня экспланты перенесли на среду MS, содержащую 500 мг/л клафорана (цефотаксим-натрий), 100 нМ имазетапира, 20 мкм бензиламинопурина (ВАР) и 1,6 г/л глюкозы при режиме света-темноты 16 ч света/8 ч темноты, которые повторялись в еженедельные периоды. Выросшие ростки переносили на среду MS, содержащую 2%-ную сахарозу, 250 мг/л клафорана и 0,8% бакто-агара. Через 3 недели добавили к среде ростовой фактор 2-индолбутиловую кислоту, чтобы способствовать формированию корня. Саженцы переносили в почву после развития корня, выращенные в течение двух недель в ростовой камере, и выращивали до зрелости в условиях оранжереи.
3.3 Анализ растений
Образцы ткани собирали из созданных трансгенных растений от листьев, цветов и семян на различных стадиях развития хранили в морозильнике при -80°С, подвергали анализу на активность репортерного гена люциферазы (исправленный протокол Ow et al., 1986). После измельчения замороженные образцы ткани были повторно суспендированы в 800 мкл буфера I (0,1 M фосфатный буффер рН 7,8, 1 мМ DTT (Sigma Aldrich, St. Louis, MO, USA), 0,05% Tween 20 (Sigma Aldrich, St. Louis, MO, USA), с последующим центрифугированием при 10000×g в течение 10 минут, 75 мкл водного супер-натанта переносили в 96-луночные планшеты. После добавления 25 мкл буфера II (80 мМ глицин-глицил (Carl Roth, Karlsruhe, Germany), 40 мМ MgSO4 (Duchefa, Haarlem, The Netherlands), 60 мМ АТФ (Sigma Aldrich, St. Louis, MO, USA), pH 7,8) и D-люцеферин до конечной концентрации 0,5 мМ (Cat No: L-8220, BioSynth, Staad, Switzerland), люминесценцию регистрировали с помощью MicroLumat Plus LB96V (Berthold Technologies, Bad Wildbad, Germany), получая относительные световые единицы ОСЕ в минуту (ОСЕ/мин).
Чтобы нормировать люциферазную активность между образцами, определяли концентрацию белка в водном супернатанте параллельно с люциферазной активностью (адаптировано из Bradford, 1976, Anal. Biochem. 72, 248). 5 мкл водного клеточного экстракта в буфере I смешивали с 250 мкл реактива Брэдфорда (Sigma Aldrich, St. Louis, MO, USA), инкубировали в течение 10 минут при комнатной температуре. Поглощение определяли при 595 нм на планшетном ридере (Thermo Electron Corporation, Multiskan Ascent 354). Количество общего белка в образцах вычисляли с использованием ранее созданной стандартной кривой изменения концентрации. Значения, полученные из отношения ОСЕ/мин и мг белка/мл образца, усредняли для трансгенных растений, несущих идентичные конструкции, и вычисляли значения кратности изменения, чтобы оценить воздействие присутствия молекулы NEENA через конструкции репортерного гена без NEENA.
3.4 Последовательности NEENA опосредуют значительное усиление генной экспрессии в семенах рапса
Для того, чтобы оценить потенциал усиления генной экспрессии отобранных молекул NEENA (SEQ ID NO1, NO2, NO3, NO4, NO5, NO6, NO7) в семенах рапса, семена идентичных стадий развития собирали из отдельных линий трансгенных растений рапса, несущих либо конструкцию репортерного гена с только промотором, либо конструкции репортерного гена люциферазы, содержащие NEENA (SEQ ID NO1, NO2, NO3, NO4, NO5, NO6 или NO7). 10 семян отобрали из каждого трансгенного события, обработали и проанализировали на активность люциферазы, как описано выше (Пример 3.3).
По сравнению с конструкцией с конструкцией репортерного гена со специфичным для семян единственным промотором p-AtPXR и не содержащей NEENA, 7 протестированных молекул NEENA, которые все опосредовали мощные усиления генной экспрессии в пределах от 54-кратной до 380-кратной индукции активности люциферазы в семенах канолы (Фиг. 2а). Сопоставимое усиление экспрессии обнаруживали в семенах рапса на более поздних стадиях созревания (данные не показаны).
3.5 Молекулы NEENA повышают генную экспрессию тканеспецифично в семенах рапса
Чтобы оценить ткане-специфичное усиление генной экспрессии, опосредуемое молекулами NEENA (SEQ ID NO1, NO2, NO3, NO4, NO5, NO6 или NO7), определяли активность люциферазы в полностью развитых листьях и открытых цветах трансгенных растений рапса, несущих конструкции репортерного гена, обрисованные в общих чертах выше. Три образца листа идентичного размера, так же как целого цветка, забирали из каждого растений отдельно и подвергали тестированию на репортерный ген люциферазы как описано выше (Пример 3.3). Пять (Seq. SEQ ID NO1, NO2, NO3, NO4, NO5) из семи протестированных молекул NEENA показали уровни экспрессии люциферазы, сопоставимые с активностью конструкции репортерного гена не содержащей NEENA и с единственным промотором p-AtPXR в листьях и цветах, и таким образом не изменили тканеспецифичность специфичного для семян промотора p-AtPXR (Фиг. 2, b и с). 2 молекулы NEENA (SEQ ID NO6, NO7) немного увеличивали активность люциферазы в листьях и цветах проанализированных растений рапса (Фиг. 2, b и с) по сравнению с растениями, содержащими конструкцией, не содержащей NEENA. Следовательно, эти NEENAs SEQ ID NO 6 и 7 являются предпочтительными для семян NEENAs, тогда как другие NEENAs SEQ ID №1-5 являются специфичным для семян NEENAs.
Пример 4: Анализ NEENA на специфичное для семян усиление сильных специфичных семян для промоторов
Этот пример иллюстрирует, что способности к усилению экспрессии молекул NEENA могут использоваться в комбинации со множеством промоторных молекул, чтобы увеличить уровни тканеспецифичной экспрессии по сравнению с молекулами из одних только промоторов.
4.1 Конструирование вектора для трансформация растений В. napus
Отобранные молекулы NEENA из группы, протестированной в примере 3 (SEQ IDs NO1, NO2, NO3, NO5 и NO6), проверяли на их эффект на усиление тканеспецифической генной экспрессии сильных специфичных для семян промоторов p-LuPXR (WO2006089950, Sequence 9) и p-VfUSP (Х56240, Bae-umlein et al., 1991). Конструирование вектора осуществляли, как описано выше (ср. Пример 1.3 и 3.1), с последовательностями праймеров, обрисованными в общих чертах в таблице 7 и вектором LJB765 (WO2009/016202) как ДНК-матрица. Позитивные клоны pENTR/A подвергали анализу последовательности (секвенированию), чтобы гарантировать правильность p-LuPXR и p-VfUSP промоторов.

Выполнением сайт-специфической рекомбинации (LR-реакция), как ранее описано (см. выше, 1.3), векторы pENTR/A, pENTR/B и вектор pENTR/C, несущие кассету с селектируемым маркером, комбинировали с целевым вектором pSUN в соответствии с руководством изготовителей Multisite Gateway manual (Invitrogen, Carlsbad, CA, USA). Реакции приводили к 1 бинарному вектору с промотором p-LuPXR, последовательностью, кодирующей люциферазу светлячка, и терминатором t-nos так же как кассету с селектируемым маркером и 4 векторам, несущих SEQ ID NO1, NO2, NO3 и NO6 непосредственно вверх по течению от последовательности, кодирующей люциферазу светлячка (Таблица 8), для которой комбинация с SEQ ID NO1 дана в качестве примера (SEQ ID NO67). За исключением изменяющихся SEQ IDs NO2, NO3 и NO6, нуклеотидная последовательность была идентична во всех векторах (Таблица 8). Точно так же промотор p-VfUSP использовали, чтобы создать конструкцию только промотор LJK219, так же как конструкции LJK220, LJK221, LJK224 и LJK225, содержащие SEQ IDs NO1, NO2, NO3 и NO5 (Таблица 8). Получающиеся векторы трансформации растений приведены в таблице 8:
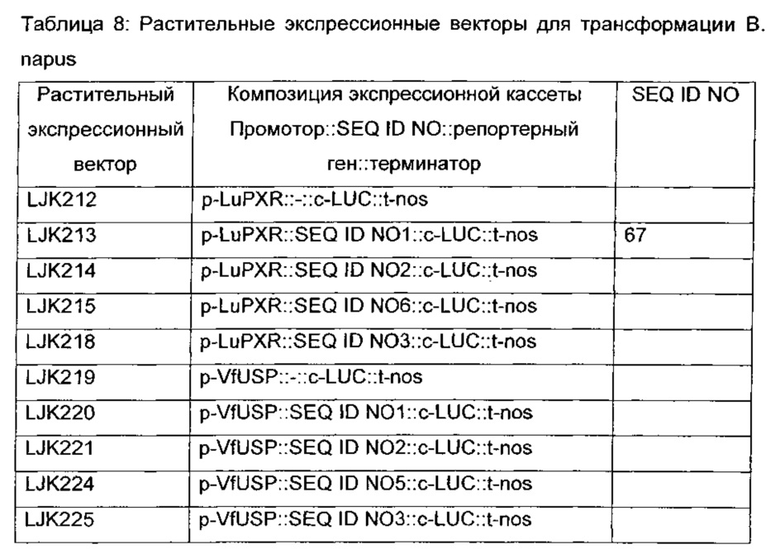
4.2 Последовательности NEENA опосредуют тканеспецифическое усиление генной экспрессии сильных специфичных для семян промоторов в семенах рапса
Создание трансгенных рапсовых растений и исследования растений проводили, как описано выше (пример 3.2 и 3.3).
Чтобы проверить эффект отобранных молекул NEENA в комбинации со специфичными для семян промоторами (SEQ ID NO1, NO2, NO3, NO5 и NO6) в семенах рапса, семена с идентичных стадий развития собирали из отдельных трансгенных линий растений рапса, несущих либо конструкцию репортерного гена «только промотор» (LJK212 и LJK219) или конструкции репортерного гена люциферазы, содержащие NEENA (SEQ ID NO1, NO2, NO3, NO5 и NO6) (Таблица 9). От каждого трансгенного события отбирали по 10 семян, обрабатывали и анализировали на активность люциферазы как описано выше (Пример 3.3).
По сравнению со специфичными для семени конструкциями репортерного гена только со специфичным для семян промоторами p-LuPXR и p-VfUSP и не содержащими NEENA, все протестированные молекулы NEENA опосредовали сильные повышения генной экспрессии в семенах рапса средней зрелости в комбинации как с промотором p-LuPXR, так и с промотором р-VfUSP (Таблица 9). Подобное усиление экспрессии было обнаружено в семенах рапса и на более поздних стадиях созревания.


Чтобы оценить тканеспецифическое усиление генной экспрессии, опосредованное молекулами NEENA (SEQ ID NO1, NO2, NO3, NO5 и NO6), определяли активность люциферазы в полностью развитых листьях трансгенных растений рапса, несущих конструкции репортерного гена, обрисованные в общих чертах выше. 3 образца листа идентичного размера забирали из каждого растения отдельно и подвергали анализу на репортерный ген люциферазы, как описано выше (Пример 3.2). Тканеспецифичности протестированных молекул NEENA (SEQ ID NO1, NO2, NO3, NO5, NO6) в комбинации с промотором p-LuPXR и промотором p-VfUSP напоминают ткане-специфичности, проанализированные с помощью промотора p-AtPXR выше (пример 3.5). Как с промотором p-AtPXR (пример 3.5), молекулы NEENA (SEQ ID NO1, NO2, NO3 и NO5) не показали изменения тканеспецифичности промоторов p-LuPXR или p-VfUSP (Таблица 10). Подобные активности с промотором p-AtPXR (пример 3.5), NEENA (SEQ ID NO6) перенесла повышение активности люциферазы в семена, но также и опосредовала экспрессию люциферазы в листьях проанализированных растений рапса (Таблица 10).
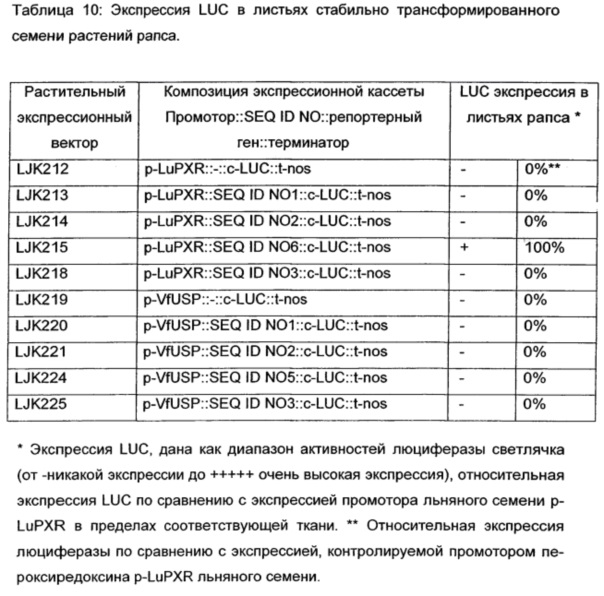
Пример 5: Анализ тканеспецифичного усиления генной экспрессии в растениях сои
Этот пример иллюстрирует, что требуемые молекулы NEENA могут использоваться в огромном количестве видов растений и через видовые границы от различных семейств растений для усиления генной экспрессии тканеспецифично по сравнению с подходом «без NEENA только промотор».
Молекулы последовательности NEENA, опосредующие самое мощное усиление генной экспрессии в предварительном скрининге (ср. Пример 2, SEQ ID NO1, NO2, NO4, NO5, NO6 и NO7), отбирали для определения уровней усиления генной экспрессии в трансгенной сое. Экспрессионные векторы растений LJK148, LJK156, LJK157, LJK158, LJK159, LJK160 и LJK161 (ср. Пример 3.1) использовали для стабильной трансформации сои.
5.1 Создание трансгенной сои (исправленный протокол согласно WO 2005/121345; Olhoft et al., 2007).
Прорастание семени сои, размножение, A. rhizogenes и приготовление экс-плантов пазушной меристемы и инокуляции осуществляли, как ранее описано (WO 2005/121345; Olhoft et al., 2007), за исключением того, что каждая конструкция LJK148, LJK156, LJK157, LJK158, LJK159, LJK160 и LJK161 (ср. пример 3.1) содержала мутированный ген AHAS, направляемый с помощью промотора убиквитина петрушки PcUbi4-2, обуславливающего толерантность к имидазолиноновым гербицидам для селекции.
5.2 Последовательности NEENA опосредуют мощное усиление генной экспрессии в соевых растениях при поддержании промоторной тканеспецифичности
Образцы ткани собирали из созданных трансгенных растений от листьев, цветов и семян. Образцы ткани обрабатывали и анализировали, как описано выше (ср. пример 3.3)
По сравнению с конструкцией репортерного гена LJK148 только со специфичным для семян промотором p-AtPXR, не содержащей NEENA, семь протестированных молекул NEENA опосредовали мощное усиление генной экспрессии в семенах сои на основе активности люциферазы (Фиг. 3а). Напротив, никаких существенных изменений в активности люциферазы, опосредованных молекулами NEENA ((SEQ ID NO1, NO2, NO4, NO5, NO6 и NO7), не обнаруживали в листьях и цветках сои (Фиг. 3, b и с).
Пример 6: Анализ активности NEENA в однодольных растениях
Этот пример описывает анализ последовательностей NEENA с SEQ ID NO 1, 2, 3, 4, 5, 6 и 7 в однодольных растениях.
6.1 Конструирование вектора
Для анализа последовательности NEENA с SEQ ID NO 1,2,3, 4, 5, 6 and 7 в однодольных растениях, экспрессионный вектор на основе pUC, несущий экспрессионную кассету, составленную из специфического для семени однодольного промотора p-KG86 из Z. mais без NEENA, был объединен с кодирующей последовательностью гена беты-глюкоронидазы (GUS), за которым следует терминатор транскрипции нопалин-синтазы (NOS). Геномную ДНК экстрагировали из зеленой ткани A. thaliana, используя Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden, Germany). Фрагменты геномной ДНК, содержащие молекулы NEENA, изолировали обычной полимеразной цепной реакцией (ПЦР). Праймеры были разработаны на основе последовательности генома A. thaliana со множеством кандидатов NEENA. Реакция содержала 7 наборов праймеров (Таблица 11) и следующий протокол, обрисованный в общих чертах посредством Phusion High Fidelity DNA Polymerase (Cat No F-540L, New England Biolabs, Ipswich, MA, USA), использовавший следующие праймеры:

Амплификацию в течение ПЦР и очистку продуктов амплификации осуществляли, как детально описано выше (пример 1.2). После рестрикции ДНК рестрикционной эндонуклеазой AscI (10 Ед/мкл) продукты расщепления очищали с помощью Qiagen Gel Extraction Kit (Qiagen, Hilden, Germany).
NEENA ПЦР фрагменты (см. выше) клонировали отдельно выше по течению последовательности бета-глюкоронидазы, используя сайты рестрикции AscI. Реакция дала один бинарный вектор с промотором p-KG86, последовательностью, кодирующей бета-глюкоронидазу c-GUS и терминатором t-nos, и семь векторов, несущих SEQ ID NO1, NO2, NO3, NO4, NO5, NO6 и NO7, расположенных сразу же после последовательности, кодирующей бета-глюкоронидазу (Таблица 12), для которой комбинация с SEQ ID NO1 является образцовой (SEQ ID NO82). За исключением изменяющихся SEQ ID NO2 - NO7, нуклеотидные последовательности в векторах идентичны (Таблица 12). Полученные векторы приведены в таблице 12, с промоторными молекулами, имеющими префикс р- кодирующими последовательностями, имеющими префикс с-, и молекулы терминатора, имеющие префикс t-.
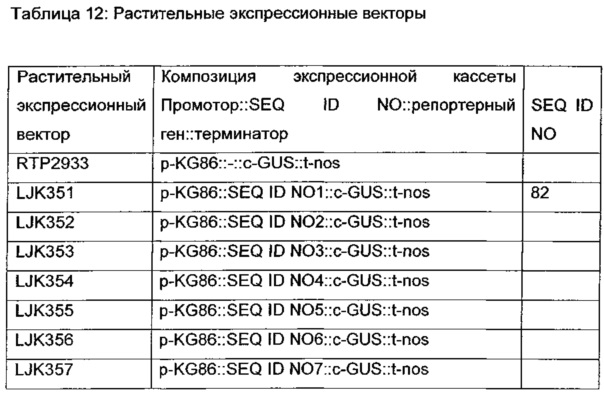
Получающиеся векторы использовали, чтобы проанализировать молекулы NEENA в экспериментах, обрисованных в общих чертах ниже (пример 6.2).
6.2 Анализ молекул NEENA, усиливающих генную экспрессию в тканях однодольных растений
Эти эксперименты выполняли с помощью бомбардировки однодольных растительных тканей или клеток культуры (Пример 6.2.1) или с помощью Agrobacterium-опосредованной трансформации (Пример 6.2.2). Тканью-мишенью для этих экспериментов могут быть растительные ткани (например, ткань листа), культивированные растительные клетки (например, кукуруза Black Mexican Sweetcorn (BMS) или эмбрионы растений по протоколам Agrobacterium.
6.2.1 Транзиентный анализ с использованием бомбардировки микрочастицами
Плазмидные конструкции изолировали, используя Qiagen plasmid kit (cat # 12143). ДНК осаждали на 0.6 мкМ золотых частиц (Bio-Rad cat #165 -2262) в соответствии с протоколом, описанным Sanford et al. (1993) (Optimizing the biolistic process for different biological applications. Methods in Enzymology, 217: 483-509) и ускоряли на ткани-мишени (например, двухнедельные листья кукурузы, культивируемые клетки BMS и т.д.), используя PDS-1000/Не системное устройство (Bio-Rad). Все стадии осаждения ДНК и стадии бомбардировки выполняли в стерильных условиях при комнатной температуре. Суспензионная клеточная культура черной мексиканской сахарной кукурузы (BMS) размножали в клеточной культуральной жидкой среде BMS [Murashige and Skoog (MS) соли (4.3 г/л), 3% (масса/объем) сахарозы, мио-инозит (100 мг/л), 3 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D), гидролизат казеина (1 г/л), тиамин (10 мг/л) и L-пролин (1.15 г/л), рН 5.8]. Каждую неделю 10 мл культуры стационарных клеток переносили на 40 мл свежей среды и культивировали на ротационном шейкере, в режиме 110 об/мин при 27°С во фляге на 250 мл.
60 мг золотых частиц в силиконизированной пробирке Eppendorf ресуспендировали в 100%-ом этаноле, с последующим центрифугированием в течение 30 секунд. Осадок промывали один раз 100%-ным этанолом и дважды стерилизованной водой с центрифугированием после каждой промывки. Осадок окончательно ресуспендировали в 1 мл стерильного 50%-го глицерина. Суспензию золота затем разделяли на аликвоты по 50 мкл и хранили при 4°С. Следующие реактивы добавляли к одной аликвоте: 5 мкл 1 мкг/мкл общей ДНК, 50 мкл 2.5 M СаСl2, 20 мкл 0.1 M спермидина, свободного основания. Раствор ДНК взбалтывали на вортексе в течение 1 минуты и содержали при -80°С в течение 3 минут, затем центрифугировали в течение 10 секунд. Супернатант удаляли. Осадок тщательно ресуспендировали в 1 мл 100% этанола, пощелкивая по пробирке, с последующим центрифугированием в течение 10 секунд. Супернатант удаляли, и осадок тщательно ресуспендировали в 50 мкл 100%-ного этанола и содержали при -80°С до использования (от 30 минут до 4 часов до бомбардировки). Если были заметны агрегаты золота в растворе, пробирки озвучивали в течение одной секунды в ультразвуковой бане непосредственно перед использованием.
Для бомбардировки двух-недельные листья кукурузы разрезали на кусочки приблизительно 1 см в длину и помещали верхнюю поверхность на осмотическую индукционную среду M-N6-702 [N6 соли (3.96 г/л), 3% (масса/объем) сахарозы, 1.5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D), гидролизат казеина (100 мг/л), и L-пролин (2.9 г/л), MS витаминный сток-раствор (1 мл/л), 0.2 M маннит, 0.2 M сорбитол, рН 5.8]. Кусочки инкубировали в течение 1-2 часов.
В случае культивируемых клеток BMS суспензию однонедельных клеток осаждали при 1000×g в центрифуге Beckman/Coulter Avanti J25, и супернатант отбрасывали. Клетки помещали на круглые обеззоленные фильтры No 42 Whatman слоем 1/16 дюйма толщиной, используя шпатель. Фильтровальные бумаги, поддерживающие растительные материалы, помещали на осмотическую индукционную среду при 27°С в темноту в течение 1-2 часов до бомбардировки. Непосредственно перед бомбардировкой фильтры удаляли из среды и помещали на стопку стерильной фильтровальной бумаги, чтобы позволить поверхности каллусов частично подсохнуть.
Каждую пластину расстреливали дважды 6 мкл раствора золото-ДНК при 1800 фунтов на квадратный дюйм для листовых материалов и при 1100 фунтах на квадратный дюйм для культивируемых клеток BMS. Для сохранения положения растительных материалов, сверху образца положили стерилизованный экран проволочной сетки. После бомбардировки, фильтры, поддерживающие образцы, переносили на среду M-N6-702 без маннита и сорбитола и инкубировали в течение 2 дней в темноте при 27°С до транзиентных анализов.
Транзиентную трансформацию посредством бомбардировки микрочастицами других однодольных растений выполняли, используя, например, методику, описанную в Wang et al., 1988 (Transient expression of foreign genes in rice, wheat and soybean cells following particle bombardment. Plant Molecular Biology, 11 (4), 433-439),.Christou, 1997 (Rice transformation: bombardment. Plant Mol Biol. 35 (1-2)).
Уровни экспрессии экспрессируемых генов в конструкциях, описанных выше (пример 6.1), определяли GUS окрашиванием, количественным определением люминесценции / флюоресценции, ОТ-ПЦР, относительным содержанием белка (обнаружение специфическими антителами) или метаболических продуктов, произведенных через экспрессионные кассеты, описанные выше с использованием протоколов, известных специалистам в данной области техники. GUS окрашивание осуществляли инкубацией растительных материалов в растворе GUS [100 мМ NaHPO4, 10 мМ ЭДТА, 0.05% Тритон Х100, 0.025% раствор X-Gluc (5 бром-4-хлор-3-индолил-бета-D-глюкуроновая кислота, растворенная в ДМСО), 10%-ный метанол, рН 7.0] при 37°С в течение 16-24 часов. Растительные ткани отфильтровывали под вакуумом 2 раза в течение 15 минут, для равномерного окрашивания. Исследования люциферазной активности выполняли, как описано выше (см. пример 2 и 3.3).
По сравнению с конструкцией репортерного гена только со специфичным для семян промотором p-ZmKG86 и не содержащей NEENA все молекулы NEENA опосредовали мощное усиление генной экспрессии в этих исследованиях.
6.2.2 Трансформация и регенерация однодольных культурных растений
Agrobacterium-опосредованная трансформация растений с использованием стандартных способов трансформации и регенерации может также быть выполнено в целях трансформации культурных растений (Gelvin and Schilpero-ort, 1995, Plant Molecular Biology Manual, 2nd Edition, Dordrecht: Kluwer Academic Publ. ISBN 0-7923-2731-4; Glick and Thompson (1993) Methods in Plant Molecular Biology and Biotechnology, Boca Raton: CRC Press, ISBN 0-8493-5164-2). Трансформация кукурузы или других однодольных растений может быть выполнена с использованием, например, методики, описанной в US 5591616. Трансформация растений с использованием бомбардировки частицами, опосредованное полиэтилен гликолем поглощение ДНК или посредством методики с волокнами карбоната кремния описаны, например, в руководстве Freeling & Walbot (1993) "The maize handbook" ISBN 3-540-97826-7, Springer Verlag New York).
Уровни экспрессии экспрессируемых генов определяли GUS окрашиванием, количественным определением люминесценции или флюоресценции, ОТ-ПЦР или относительным содержанием белка (обнаружение специфическими антителами) с использованием протоколов, известных специалистам в данной области техники. GUS окрашивание осуществляли инкубацией растительных материалов в растворе GUS [100 мМ NaHPO4, 10 мМ ЭДТА, 0.05% Тритон Х100, 0.025% раствор X-Gluc (5 бром-4 хлор-3-индолил-бета-D-глюкуроновая кислота, растворенная в ДМСО), 10%-ный метанол, рН 7.0] при 37°С в течение 16-24 часов. Растительные ткани отфильтровывали под вакуумом 2 раза в течение 15 минут, для равномерного окрашивания. Исследования люциферазной активности выполняли, как описано выше (см. пример 2 и 3.3).
По сравнению с конструкцией репортерного гена только со специфичным для семян промотором p-ZmKG86 и не содержащей NEENA молекулы NEENA опосредовали мощное и ткане-специфичное усиление генной экспрессии в растениях.
Пример 7: Количественный анализ активности NEENA в однодольных растениях
Этот пример описывает анализ последовательностей NEENA с SEQ ID NO 1 и 2 в растениях кукурузы.
7.1 Конструирование вектора
Для количественного анализа последовательностей NEENA с SEQ ID NO 1 и 2 в однодольных растениях, экспрессионный вектор на основе pUC, несущий экспрессионную кассету, составленную из специфического для семени однодольного промотора p-KG86 из Z. mais и без NEENA, был объединен с кодирующей последовательностью гена Люциферазы светлячка (LUC) (Promega, Madison, Wl, USA), за которым следует терминатор транскрипции нопалин-синтазы (NOS). Геномную ДНК экстрагировали из зеленой ткани А. thaliana, используя Qiagen DNeasy Plant Mini Kit (Qiagen, Hilden, Germany). Фрагменты геномной ДНК, содержащие молекулы NEENA, изолировали обычной полимеразной цепной реакцией (ПЦР). Праймеры были разработаны на основе последовательности генома A. thaliana со множеством кандидатов NEENA. Реакция содержала 2 набора праймеров (Таблица 11) и следующий протокол, обрисованный в общих чертах посредством Phusion High Fidelity DNA Polymerase (Cat No F-540L, New England Biolabs, Ipswich, MA, USA) с использованием следующих праймеров:

Амплификацию в течение ПЦР и очистку продуктов амплификации осуществляли, как детально описано выше (пример 1.2). После рестрикции ДНК ре-стрикционными эндонуклеазами Mlul (10 Ед/мкл) и AscI (10 Ед/мкл), продукты расщепления очищали с помощью Qiagen Gel Extraction Kit (Qiagen, Hil-den, Germany).
NEENA ПЦР фрагменты (см. выше) клонировали отдельно выше по течению последовательности люциферазы светлячка, используя сайты рестрикции AscI. Реакция дала один бинарный вектор с промотором p-KG86, последовательностью, кодирующей люциферазу светлячка c-LUC и терминатором t-nos, и два вектора, несущих SEQ ID NO1 и NO2, расположенных сразу же после последовательности, кодирующей люциферазу светлячка (Таблица 12), для которой комбинация с SEQ ID NO1 является образцовой (SEQ ID NO87). За исключением изменяющейся SEQ ID NO2, нуклеотидные последовательности в векторах были идентичны (Таблица 12). Полученные векторы приведены в таблице 12, с промоторными молекулами, имеющими префикс р-, кодирующими последовательностями, имеющими префикс с-, и молекулы терминатора, имеющие префикс t-.

Полученные векторы использовали для анализа молекул NEENA в экспериментах, обрисованных в общих чертах ниже (Пример 7.2).
7.2 Создание трансгенных растений кукурузы
Прорастание кукурузы, размножение, приготовление A. tumefaciens и прививки были сделаны так же, как ранее описано (WO 2006136596, US20090249514) за исключением того, что каждая из конструкций RTP5679, RTP5683 и RTP5684 (пример 7.1) содержали мутантаный ген AHAS, направляемый с помощью промотора убиквитина кукурузы p-Ubi, обуславливающий толерантность к имидазолиноновым гербицидам.
7.3 Последовательности NEENA опосредуют мощное и тканеспецифическое усиление генной экспрессии в растениях кукурузы
Образцы тканей листьев и зародышей собирали из созданных трансгенных растений. Образцы ткани обрабатывали и анализировали, как описано выше (пример 3.3)
По сравнению с конструкцией репортерного гена только со специфичным для семян промотором p-KG86 и не содержащей NEENA, две протестированные молекулы NEENA (SEQ ID NO1 и NO2) опосредовали мощное усиление генной экспрессии в зародыше (Фиг. 4а). Напротив, никаких существенных изменений в активности люциферазы, опосредованных молекулами NEENA (SEQ ID NO1 и NO2), не обнаруживали в листьях кукурузы (Фиг. 4b).
Пример 8: Количественный анализ активности NEENA в рисовых растениях
Этот пример описывает анализ последовательностей NEENA с SEQ ID NO 1 и 2 в рисовых растениях.
8.1 Конструирование вектора
Для того чтобы количественно проанализировать последовательности NEENA с SEQ ID NO 1 и 2 в рисовых растениях, векторы pENTR/B, LJK1, LJK19 и LJK20 (сравнить с примером 1.3) были объединены с целевым вектором, несущим промотор PRO0090, предпочтительный для семени риса, находящийся выше по течению сайта рекомбинации, с использованием сайта специфический рекомбинации (LR-реакция), в соответствии с руководством изготовителей Gateway manual (Invitrogen, Carlsbad, CA, USA). Реакции привели к одному бинарному вектору с промотором PRO0090, последовательностью, кодирующей люциферазу светлячка, c-LUC и t-nos терминатором, так же как и 2 вектора, несущие SEQ ID NO1 и NO2, непосредственно выше по течению от последовательности, кодирующей люциферазу светлячка (Таблица 13). За исключением изменяющейся SEQ ID NO2, последовательность нуклеотида в векторах была идентична (Таблица 13). Получающиеся векторы приведены в таблице 13 с молекулами промоторов, имеющими префикс p-, кодирующими последовательностями, имеющими префикс с- и молекулами терминаторов, имеющими префикс t-.

Полученные векторы использовали для анализа молекул NEENA в экспериментах, которые ниже описаны в общих чертах (Пример 8.2).
8.2 Создание трансгенных рисовых растений
Agrobacterium, содержащие соответствующий экспрессионный вектор, использовали для трансформации растений Oryza sativa. Зрелые сухие семена японского риса культивара Nipponbare вылущили. Стерилизацию осуществляли посредством инкубации в течение одной минуты в 70%-ном этаноле, за которым следовало 30 минут в 0.2% растворе HgCl2, за которым следовала 6-кратная 15-минутная промывка стерильной дистиллированной водой. Стерильные семена затем прорастали на среде, содержащей 2,4-D (среда для индукции каллуса). После инкубации в темноте в течение четырех недель, эмбриогенные, производные щитка зародыша каллусы вырезали и размножали на той же самой среде. Через две недели каллусы размножали или разводили посредством субкультуры на той же самой среде в течение еще 2 недель. Кусочки эмбриогенного каллуса пересевали на свежую среду за 3 дня до совместного культивирования (для повышения активности клеточного деления).
Agrobacterium штамм LBA4404, содержащий соответствующий экспрессионный вектор, использовали для совместного культивирования. Agrobacterium высевали на среду АВ с соответствующими антибиотиками и культивировали в течение 3 дней при 28°С. Затем бактерии собирали и суспендировали в жидкой среде для совместного культивирования до плотности (OD600) около 1. Затем суспензию переносили на чашку Петри и каллусы погружали в суспензию на 15 минут. Затем ткани каллуса отпечатывали как сухую реплику на фильтровальную бумагу и переносили на твердую среду для совместного культивирования и инкубировали в течение 3 дней в темноте при 25°С. Сокультивированные каллусы выращивали на 2,4-D-содержащей среде в течение 4 недель в темноте при 28°С в присутствии селектирующего агента. Во время этого периода образовывались быстро растущие островки резистентного каллуса. После переноса этого материала на регенерационную среду и инкубации при свете, реализовался эмбриогенный потенциал и развивались побеги в течение следующих четырех - пяти недель. Побеги отделяли от каллусов и инкубировали в течение 2-3 недель на ауксинсодержащей среде, из которой их переносили в почву. Отвердевшие побеги выращивали при высокой влажности и в короткие дни в оранжерее.
Приблизительно 35 независимых Т0 трансформантов риса создавали для одной конструкции. Первичные трансформанты переносили из камеры для культуры тканей в оранжерею. После количественного ПЦР-анализа для проверки числа копий вставки Т-ДНК только единственную копию трансгенных растений, которая показывает толерантность к селектирующему агенту, сохраняли для урожая семени Т1. Семена затем собирали спустя три - пять месяцев после пересадки. Способ дал единственный локус трансформантов в размере более 50% (Aldemita and Hodges1996, Chan et al., 1993, Hiei et al. 1994).
8.3 Последовательности NEENA опосредуют мощное и тканеспецифическое усиление генной экспрессии в рисовых растениях
Образцы тканей листьев и семян собирали из созданных трансгенных растений. Образцы ткани обрабатывали и анализировали, как описано выше (пример 3.3)
По сравнению с конструкцией репортерного гена только со специфичным для семян промотором p-KG86, не содержащей NEENA, две протестированные молекулы NEENA (SEQ ID NO1 и NO2), опосредовали мощное усиление генной экспрессии в семенах (Фиг. 5а). Напротив, никаких существенных изменений в активности люциферазы, опосредованное молекулами NEENA (SEQ ID NO1 и NO2), не обнаруживали в листьях риса (Фиг. 5b).
Описание чертежей
Фиг. 1: Анализ экспрессии репортерного гена люциферазы в семядолях, стабильно трансформированных растений A. thaliana не содержащими NEENA (LJK134) или содержащими NEENA (LJK71 - LJK90) конструкциями, представляющими предполагаемые молекулы NEENA, получаемые из семя-предпочтительно экспрессируемых генов под контролем промотора р-AtPXR. Значение экспрессии NEENA-содержащих конструкций показано по отношению к контрольной конструкции, не содержащей NEENA (LJK13=1).
Фиг. 2: Гистограммы активности репортерного гена люциферазы, показанные как относительные световые единицы (ОСЕ) независимых линий трансгенных растений рапса, несущих не содержащие NEENA (LJK148) или содержащие NEENA конструкции репортерного гена, представляющие молекулы NEENA из семя-предпочтительно экспрессируемых генов (LJK156 - LJK162) под контролем промотора p-AtPXR и после нормировки по содержанию белка каждого образца. Значения экспрессии растений, несущих NEENA-содержащие конструкции, показаны по отношению к растениям, экспрессирующим не содержащие NEENA контрольных конструкций (LJK-148) (средние значения, проанализированы ткани 20 независимых трансгенных растений). А) семена, В) ткани листьев, С) цветы.
Фиг. 3: Гистограмма активности репортерного гена люциферазы, показанная как относительные световые единицы (ОСЕ) независимых линий трасгенных растений сои, несущих не содержащие NEENA (LJK148) или содержащие NEENA конструкции репортерного гена, представляющие молекулы NEENA из семя-предпочтительно экспрессируемых генов (LJK156-LJK161) под контролем промотора p-AtPXR, и после нормировки по содержанию белка каждого образца. Значения экспрессии растений, несущих NEENA-содержащие конструкции показаны по отношению к растений, экспрессирующим не содержащие NEENA контрольные конструкции (LJK-148) (средние значения, проанализированы ткани 10 независимых трансгенных растений). А) семена, В) ткани листа, С) цветы.
Фиг. 4: Гистограмма активности репортерного гена люциферазы, показанная как относительные световые единицы (ОСЕ) независимых линий растений трасгенной кукурузы, несущих не содержащие NEENA (RTP5679) или содержащие NEENA конструкции репортерного гена, представляющие молекулы NEENA из семя-предпочтительно экспрессируемых генов (RTP5683 -RTP5684), под контролем промотора p-KG86, и после нормировки по содержанию белка каждого образца (средние значения, проанализированы ткани 15 независимых трансгенных растений). А) зародыш, В) ткани листа.
Фиг. 5: Гистограмма активности репортерного гена люциферазы, показанная как относительные световые единицы (ОСЕ) независимых линий растения трансгенного риса, несущих не содержащие NEENA (CD30977) или содержащие NEENA конструкции репортерного гена, представляющие молекулы NEENA из семя-предпочтительно экспрессируемых генов (CD30971 - CD30972) под контролем промотора PRO0090 и после нормировки по содержанию белка каждого образца (средние значения, проанализированы ткани 15 независимых трансгенных растений). А) семена, В) ткани листа.














































Изобретение относится к области биохимии, в частности к способу получения семя-специфичного растительного промотора высокой экспрессии, содержащему функциональное связывание с промотором одной молекулы нуклеиновых кислот, усиливающих экспрессию нуклеиновой кислоты (NEENA), гетерологичных по отношению к указанному промотору. Также раскрыты рекомбинантная экспрессионная конструкция, содержащая одну NEENA, по меньшей мере, один семя-специфичный промотор, гетерологичный по отношению к указанной одной NEENA, и, по меньшей мере, одну экспрессируемую молекулу нуклеиновой кислоты, а также трансгенная клетка, трансгенное растение и часть трансгенного растения, содержащие вышеуказанную конструкцию. Раскрыто применение NEENA или вышеуказанной рекомбинантной экспрессионной конструкции для усиления экспрессии молекулы нуклеиновой кислоты, гетерологичной по отношению к указанной NEENA, в растениях или их частях. Изобретение позволяет эффективно получать семя-специфичный растительный промотор высокой экспрессии. 6 н. и 15 з.п. ф-лы, 5 ил., 15 табл., 8 пр.
1. Способ получения семя-специфичного растительного промотора высокой экспрессии, содержащий функциональное связывание с промотором одной молекулы нуклеиновых кислот, усиливающих экспрессию нуклеиновой кислоты (NEENA), гетерологичных по отношению к указанному промотору, выбранной из
i) молекулы нуклеиновой кислоты, имеющей последовательность, как определено в SEQ ID NO: 6-15,
причем экспрессия, происходящая от указанного семя-специфичного промотора, функционально связанного с указанной молекулы NEENA, является повышенной по сравнению с таким же семя-специфичным промотором, не функционально связанным с указанной молекулы NEENA.
2. Способ по п. 1, содержащий стадии
a) введения одной NEENA, выбранной из молекулы нуклеиновой кислоты по п. 1 i), в растение или его часть и
b) интеграции указанной одной NEENA в геном указанного растения или его части, посредством чего указанная одна NEENA функционально связывается с эндогенной семя-специфично экспрессируемой нуклеиновой кислотой, гетерологичной по отношению к указанной одной NEENA, и при необходимости
c) регенерации растения или его части, содержащих указанную одну NEENA, из указанной трансформированной клетки.
3. Способ по п. 1, содержащий стадии
a) обеспечения экспрессионной конструкции, содержащей одну NEENA, выбранной из молекулы нуклеиновой кислоты по п. 1 i), функционально связанную с семя-специфичным промотором и с одной или более молекулами нуклеиновой кислоты, причем последняя является гетерологичной по отношению к указанной одной NEENA, и которая находится под контролем указанного семя-специфичного промотора, и
b) интеграции указанной экспрессионной конструкции, содержащей указанную одну NEENA, в геном указанного растения или его части, и при необходимости
c) регенерации растения или его части, содержащих указанную экспрессионную конструкцию, из указанного трансформированного растения или его части.
4. Способ по п. 2, в котором растение является однодольным растением или двудольным растением.
5. Способ по п. 4, в котором растение является двудольным растением.
6. Способ по п. 4, в котором растение является однодольным растением.
7. Способ по п. 1, в котором указанная одна NEENA функционально связывается с семя-специфичным промотором близко к сайту инициации транскрипции указанной гетерологичной молекулы нуклеиновой кислоты.
8. Способ по п. 7, в котором указанная одна NEENA функционально связывается с семя-специфичным промотором, удаленным от сайта инициации транскрипции указанной гетерологичной молекулы нуклеиновой кислоты на 2500 п.о. или меньше, предпочтительно 2000 п.о. или меньше, более предпочтительно 1500 п.о. или меньше, еще более предпочтительно 1000 п.о. или меньше и наиболее предпочтительно 500 п.о. или меньше.
9. Способ по п. 1, в котором указанная одна NEENA функционально связывается с семя-специфичным промотором против хода транскрипции от сайта инициации трансляции молекулы нуклеиновой кислоты, экспрессия которой находится под контролем указанного семя-специфичного промотора.
10. Способ по п. 1, в котором указанная одна NEENA функционально связывается с семя-специфичным промотором в пределах 5'UTR молекулы нуклеиновой кислоты, экспрессия которой находится под контролем указанного семя-специфичного промотора.
11. Рекомбинантная экспрессионная конструкция, содержащая одну NEENA, выбранную из
i) молекулы нуклеиновой кислоты, имеющей последовательность, как определено в SEQ ID NO: 6-15,
по меньшей мере, один семя-специфичный промотор, гетерологичный по отношению к указанной одной NEENA, и
по меньшей мере, одну экспрессируемую молекулу нуклеиновой кислоты.
12. Рекомбинантная экспрессионная конструкция по п. 11, содержащая одну NEENA, выбранную из молекулы нуклеиновой кислоты по п. 11 i), функционально связанной с одним или более семя-специфичным промотором и одой или более экспрессируемой молекулой нуклеиновой кислоты, причем последняя является гетерологичной по отношению к указанной одной NEENA.
13. Трансгенная клетка для получения пищевых продуктов, кормов для животных, семян, фармацевтических средств или химических продуктов тонкого органического синтеза, содержащая рекомбинантный экспрессионный вектор, содержащий одну или более рекомбинантную экспрессионную конструкцию по одному из пп. 11-12 или рекомбинантную экспрессионную конструкцию по одному из пп. 11-12.
14. Трансгенная клетка по п. 13, выбранная или полученная из группы, состоящей из бактерий, грибов, дрожжей или растений.
15. Трансгенное растение для получения пищевых продуктов, кормов для животных, семян, фармацевтических средств или химических продуктов тонкого органического синтеза, содержащее рекомбинантный экспрессионный вектор, содержащий одну или более рекомбинантную экспрессионную конструкцию по одному из пп. 11-12 или рекомбинантную экспрессионную конструкцию по одному из пп. 11-12.
16. Трансгенное растение по п. 15, в котором указанное растение является двудольным растением.
17. Трансгенное растение по п. 15, в котором указанное растение является однодольным растением.
18. Часть трансгенного растения для получения пищевых продуктов, кормов для животных, семян, фармацевтических средств или химических продуктов тонкого органического синтеза, содержащая рекомбинантный экспрессионный вектор, содержащий одну или более рекомбинантную экспрессионную конструкцию по одному из пп. 11-12 или рекомбинантную экспрессионную конструкцию по одному из пп. 11-12.
19. Часть трансгенного растения по п. 18, в которой указанное растение является двудольным растением.
20. Часть трансгенного растения по п. 18, в которой указанное растение является однодольным растением.
21. Применение NEENA, выбранной из
i) молекулы нуклеиновой кислоты, имеющей последовательность, как определена в SEQ ID NO: 6-15,
или рекомбинантной экспрессионной конструкции, как определено в одном из пп. 11-12, для усиления экспрессии молекулы нуклеиновой кислоты, гетерологичной по отношению к указанной NEENA, в растениях или их частях.
| WO2007112326 А1, 04.10.2007 | |||
| US2007006345 А1, 04.01.2007 | |||
| WO9320216 A1, 14.10.1993 | |||
| CHEN Z.L | |||
| et al., A DNA sequence element that confers seed-specific enhancement to a constitutive promoter, EMBO J., 1988, Vol.7, N.2, pp.297-302 | |||
| ЭКСПРЕССИЯ ПРОМОТОРА СИНТАЗЫ АЦЕТООКСИКИСЛОТ В ИНТРОДУЦИРОВАННЫХ ГЕНАХ РАСТЕНИЙ | 1995 |
|
RU2197527C2 |
Авторы
Даты
2019-06-28—Публикация
2010-08-11—Подача