Изобретение относится к области биотехнологии и медицины, а именно к РНК-аптамерам, способным специфично и высокоаффинно узнавать аутоантитела, характерные для рассеянного склероза.
Аптамеры - это синтетические молекулы ДНК и РНК, способные высокоаффинно и высокоспецифично связывать свои молекулы-мишени за счет образования уникальной пространственной структуры. Аптамеры, подобно пептидам, созданным с использованием фагового дисплея, или моноклональным антителам («мАт») способны специфически связываться с выбранными мишенями и модулировать активность мишеней, например посредством связывания аптамеры могут блокировать способность мишеней функционировать.
По специфичности и сродству к мишеням аптамеры не уступают моноклональным антителам, но при этом обладают по сравнению с ними целым рядом преимуществ, таких как лучшая способность проникать через биологические мембраны, низкая иммуногенность, возможность получения аптамеров к лигандам, на которые антитела не вырабатываются, восстановление активности после термической денатурации/ренатурации, а также возможность химического или химико-ферментативного синтеза в препаративных количествах [Toh SY., Citartan М, Gopinath SC., Tang TH. // Biosens Bioelectron. 2015. V.64. Р.392-403].
Аптамеры находят широкое применение для детекции различных молекул-мишеней и ингибирования их функциональной активности [Liu K., Lin В., Lan X. // J. Cell. Biochem. 2013. V. 114. N 2. P. 250-255; Yu Y., Liang C, Lv Q., Li D., Xu X., Lui В., Lu A., Zhang G. // Int. J. Mol. Sci. 2016. V. 17. P. 358; Maier K.E., Levy M. // Mol. Ther. Methods Clin. Dev. 2016. V. 5. P. 16014].
Однако известно, что немодифицированные аптамеры характеризуются очень коротким (не более нескольких минут) временем жизни в кровотоке [Griffin L.C., Tidmarsh G.F., Bock L.C., Toole J.J., Leung L.L.K. Blood 1993, v. 12, р.3271-3276]. Это свойство может препятствовать созданию на их основе эффективных лекарственных препаратов. В связи с этим для удлинения времени жизни in vivo базовые олигонуклеотидные последовательности могут подвергаться химическим модификациям. Эти модификации, во-первых, защищают аптамеры от действия нуклеаз, а во-вторых, замедляют их выведение через почки.
Например, известны модифицированные ДНК-аптамеры общей формулы: d R-GTGACGTANGGTTGGTGTGGTTGGGGCGTCAC-R, где d - дезоксирибоза, R - химические заместители. В качестве заместителей используют аминогексанол (NH2-группа), который этерифицирует фосфатную группу на 5'- или 3'-конце и остаток полиэтиленгликоля (PEG), который присоединяют по 5'- и/или 3'-концу. При этом как минимум один из присоединенных по 5'- или 3'-концу заместителей представляет собой полиэтиленгликоль. Данные модифицированные ДНК аптамеры ингибируют активность тромбина в плазме крови человека, удлиняя тромбиновое время, протромбиновое время и АЧТВ, и ингибируют стимулируемую тромбином агрегацию тромбоцитов (Патент RU 2410432 С1, опубл. 27.01.2011).
Рассеянный склероз (PC) - хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Это достаточно распространенное неизлечимое заболевание, которое развивается в основном у лиц молодого возраста и почти с неизбежностью приводит к инвалидизации [Шмидт Т.Е., Яхно Н.Н. Рассеянный склероз: руководство для врачей // М.: Медпресс-информ, 2016]. Ранняя диагностика и своевременное начало терапии позволяют существенно замедлить развитие заболевания и улучшить качество жизни пациентов. В то же время диагностика PC в настоящее время представляет собой сложную задачу: для этого используют комплекс исследований, включающий в себя магнитно-резонансную томографию, иммунологический мониторинг и анализ спинномозговой жидкости.
Сравнительно недавно было обнаружено, что для рассеянного склероза характерно появление в организме аутоантител-протеаз, которые разрушают миелиновую оболочку нервных волокон за счет деградации основного белка миелина (ОБМ) [Kalinina, E.V., Ponomarenko, N.A., Durova, О.М., Paleev, F.N., Vorob'ev, I.I., Kekenadze, N.N., Shogenov, Z.S., Zemtsova, M.E., Gnuchev, N.V., Gabibov, A.G. // J. Immunol. Meth. 2002. V. 269. N 1-2. P. 197-211; Polosukhina, D.I., Kanyshkova, T.G., Doronin, B.M., Tyshkevich, O.B., Buneva, V.N., Boiko, A.N., Gusev, E.I., Favorova, O.O., Nevinsky, G.A. // J. Cell. Mol. Med. 2004. V.8. N 3. P. 359-368]. В настоящее время предлагается рассматривать данные антитела как маркеры рассеянного склероза [Kostyushev, D., Gnatenko, D., Paltsev, M., Gabibov, A., Suchkov, S. // Autoimmune Disorders - Current Concepts and Advances from Bedside to Mechanistic Insights / Ed. H. Fang-Ping. InTech, 2011. P. 477-490].
На данный момент существует целый ряд ДНК- и РНК-аптамеров, способных высокоаффинно и специфично узнавать белки-маркеры различных заболеваний и биосенсоров на их основе [González V., Martín М., Fernández G., García-Sacristán А. // Pharmaceuticals (Basel). 2016. V. 9. N. 4; Vorobyeva М., Vorobjev P., Venyaminova A. // Molecules. 2016. V. 21. N. 12. P. 1613].
Наиболее близким к заявляемому аптамеру - прототипом, является РНК-аптамер Apt2-9c к анти-ОБМ антителам, характерным при PC, представляющий собой 57-звенный аптамер смешанного типа, содержащий пуриновые рибонуклеотиды и 2'дезокси-2'-фторпиримидиновые рибонуклеотиды (Патент RU 2549704 C1, опубл. 27.04.2015). Данный аптамер обладает высоким сродством к антителам-мишеням и специфичностью связывания по сравнению с антителами здоровых доноров.
С точки зрения потенциального диагностического применения, недостатком данного аптамера является большое число нуклеотидных звеньев (длина) его олигонуклеотидной последовательности. Химический синтез последовательности из 57 нуклеотидных звеньев с использованием автоматического ДНК/РНК синтезатора занимает около 20 часов, при этом присоединение каждого нуклеотидного звена требует расхода реактивов и растворителей. С другой стороны, удаление части нуклеотидной последовательности аптамера Apt2-9c снижает специфичность его связывания с аутоантителами-мишенями.
Задачей настоящего изобретения является получение нового устойчивого в биологических образцах РНК-аптамера, который обладал бы другой нуклеотидной последовательностью и содержал бы меньшее количество нуклеотидных звеньев по сравнению с аптамером-прототипом, с сохранением высокой аффинности и специфичности по отношению к анти-ОБМ аутоантителам, характерным для рассеянного склероза.
Технический результат: расширение ассортимента РНК-аптамеров, способных высокоаффинно и специфично узнавать анти-ОБМ антитела -маркеры PC.
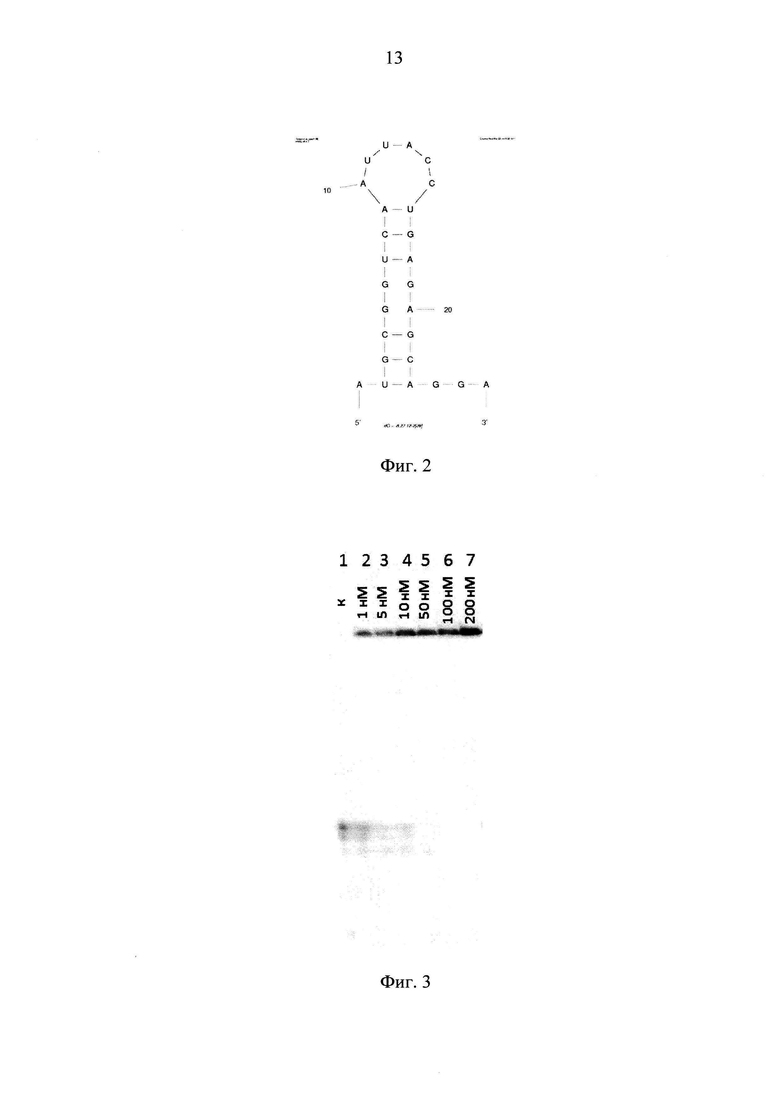
Поставленная задача достигается созданием РНК-аптамера (Apt26), представляющим собой 26-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2'-дезокси-2'-фторпиримидиновые рибонуклеотиды, имеющий следующую нуклеотидную последовательность: 5'-AUG CGG UCA AUU АСС UGA GAG CAG GA-3', представленную в SEQ ID NO: 1 (фиг. 1), где A, G - рибонуклеотиды; U, С - 2'-дезокси-2'-фтор-рибонуклеотиды.
Нуклеотидная последовательность аптамера Apt26 установлена с помощью метода селекции in vitro из комбинаторной 71-звенной библиотеки РНК с использованием в качестве мишеней поликлональных анти-ОБМ антител, выделенных из крови больных рассеянным склерозом. После десяти раундов отбора аптамеров на антитела-мишени было проведено два дополнительных раунда отбора, включающих в себя стадию негативной селекции на антитела здоровых доноров для уменьшения неспецифического связывания аптамера и стадию позитивной селекции на анти-ОБМ антитела из крови больных PC. После установления нуклеотидных последовательностей индивидуальных аптамеров проводили скрининг аффинности и специфичности их связывания с аутоантителами-мишенями, в результате которого был выбран наилучший по этим характеристикам 71-звенный аптамер. В результате последовательного укорочения его нуклеотидной последовательности был получен 26-звенный аптамер Apt26 с последовательностью 5'-AUG CGG UCA AUU АСС UGA GAG CAG GA-3' (SEQ ID NO: 1) со следующими характеристиками:
- обладает высоким сродством к протеолитическим анти-ОБМ аутоантителам, характерным при рассеянном склерозе;
- обладает значительно более низким сродством по отношению к антителам из крови здоровых доноров;
- представляет собой олигонуклеотид смешанного типа, в котором пиримидиновые рибонуклеотиды замещены на их 2'-F-модифицированные аналоги для повышения устойчивости в серологических образцах.
Определяющими отличиями полученного РНК-аптамера от прототипа являются:
- нуклеотидная последовательность заявляемого аптамера не имеет значимой гомологии с нуклеотидной последовательностью аптамера-прототипа;
- вторичная структура заявляемого аптамера отлична от вторичной структуры аптамера-прототипа;
- число нуклеотидных звеньев в составе заявляемого аптамера в два раза меньше по сравнению с аптамером-прототипом, что делает химический синтез заявляемого аптамера значительно более быстрым и экономичным.
Синтез РНК-аптамера по изобретению производят на автоматическом ДНК/РНК-синтезаторе ASM-800 с использованием стандартного протокола твердофазного фосфитамидного метода.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение РНК-аптамера Apt26
Синтез 2'-F-РНК-аптамера Apt26 проводили на автоматическом ДНК/РНК синтезаторе ASM-800 (Биоссет, Россия) по стандартным протоколам [Bellon L. Oligoribonucleotides with 2'-O-(tert-butyldimethylsilyl)groups. Current protocols in nucleic acids chemistry. 2001. S.1. P.3.6.1-3.6.13], оптимизированным для данного прибора, с использованием β-цианэтил фосфитамидов 5',2', N-защищенных пуриновых рибонуклеозидов и 5', N-защищенных пиримидиновых 2'-дезокси-2'-F-рибонуклеозидов. В качестве полимерного носителя использовали стеклянные частицы CPG (controlled pore glass) с диаметром пор 500  с присоединенным через 3-гидроксильную группу 5', 2', N-защищенным рибонуклеозидом.
с присоединенным через 3-гидроксильную группу 5', 2', N-защищенным рибонуклеозидом.
Каждый цикл синтеза состоял из следующих стадий:
1) детритилирование - удаление диметокситритильной защитной группы с 5'-гидроксила растущей олигонуклеотидной цепи путем обработки 3%-ным раствором дихлоруксусной кислоты в дихлорметане;
2) присоединение очередного мономерного звена, которое представляет собой β-цианэтил-N,N-бис-диизопропиламидофосфит одного из защищенных нуклеозидов. В качестве активирующего агента при конденсации использовали 5-этилтио-1Н-тетразол;
3) кэпирование - блокирование непрореагировавших 5'-гидроксилов с использованием уксусного ангидрида и N-метилимидазола, что позволяет избежать пропусков нуклеозидов в последовательности требуемого олигонуклеотида;
4) окисление раствором йода в пиридине, в ходе которого происходит превращение фосфиттриэфирных межнуклеозидных связей в фосфотриэфирные.
После проведения необходимого числа синтетических циклов и удаления 5'-концевой диметокситритильной группы получали защищенный полимерсвязанный 2'-F-пиримидинсодержащий РНК-аптамер. Для отделения полимерсвязанного олигонуклеотида от твердого носителя к полимеру приливали 0.3 мл 40%-ного водного метиламина, выдерживали в течение 2 ч при 25°С и постоянном перемешивании, затем при -20°С в течение 15-20 мин и отделяли от полимера центрифугированием. Полимер промывали 3×100 мкл смеси этанол:ацетонитрил:вода (1:1:1). Растворы объединяли и упаривали до сухого остатка в вакуумном испарителе Speed-Vac Concentrator SVC-100Н. Для удаления 2'-O-третбутилдиметилсилильных защитных групп к сухому остатку олигонуклеотида добавляли 200 мкл смеси N-метил-2-пирролидинон:триэтиламин:ТЕА⋅3HF (1.5:0.75:1) и выдерживали при 65°С в течение 1.5 ч. После охлаждения раствора до комнатной температуры добавляли 300 мкл этокситриметилсилана и перемешивали в течение 10 мин. К полученной смеси добавляли 1 мл серного эфира и центрифугировали, раствор декантировали, осадок промывали серным эфиром, высушивали на воздухе.
К реакционным смесям после синтеза олигодезоксирибонуклеотидов и деблокирования добавляли равный объем денатурирующего буфера и очищали от побочных синтетических продуктов при помощи препаративного гель-электрофореза в 15%-ном денатурирующем акриламидном геле. После проведения электрофореза гель помещали на пластину для ТСХ и визуализировали аптамер в УФ-свете. Участки геля, содержащие целевой олигонуклеотид, вырезали, добавляли 10 мл 0.3 М NaClO4 и перемешивали при 25°С в течение нескольких часов. Элюат отбирали, гель промывали 1 мл того же раствора. По окончании элюции проводили обессоливание объединенных элюатов с помощью картриджа Waters SepPac С18 (Waters, США). Для этого раствор олигонуклеотида наносили на картридж, промывали 4 мл водного 0.05 М NaClO4 и элюировали 1 мл 0.05 М NaClO4 в 50%-ном ацетонитриле. Полученные растворы упаривали до объема 0.1 мл. Олигонуклеотидный материал осаждали добавлением 10-ти кратного избытка 2%-ного NaClO4 в ацетоне с последующим выдерживанием при -20°C в течение 2 ч. Осадок отделяли центрифугированием в течение 10 мин при 4°C и 13200 об./мин. Супернатант отбирали, осадок олигонуклеотида промывали ацетоном, высушивали при 37°C.
Полученный РНК-аптамер (Apt26) представляющий собой 26-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2'-фторпиримидиновые аналоги, имеет нуклеотидную последовательность SEQ ID NO: 1 (фиг. 1).
Пример 2. Использование РНК-аптамера Apt26 для детекции анти-ОБМ аутоантител, характерных для рассеянного склероза (PC).
Проводили исследование комплексообразования РНК-аптамера Apt26, радиоактивно [32Р]-меченого с 3'-конца, с поликлональными анти-ОБМ аутоантителами из сыворотки крови пациентов с PC.
Реакцию проводили при 25°C в течение 16 часов в буферном растворе (50 мМ Трис-HCl, рН 7.5, 100 мМ NaCl, 0.1% Tween 20), концентрация [32Р]-меченой 2'-F-PHK была пренебрежительно малой по сравнению с концентрацией белка, но достаточной для радиоавтографии. Концентрация антител варьировала от 0.5 до 100 нМ. Связывание РНК-аптамер-мишень исследовали методом задержки в 6%-ном нативном полиакриламидном геле, который позволяет отделить свободные РНК-аптамеры от комплексов аптамер-антитело, в условиях: акриламид:N,N-метиленбисакриламид (50:1), 25 мМ Трис-борат (рН 8.3), напряжение 15 В/см. Для доказательства специфичности аналогично было исследовано связывание РНК-аптамера с суммарными IgG-антителами, выделенными из крови больных PC, из крови больных системной красной волчанкой (СКВ) и из крови здоровых доноров.
После окончания электрофореза гель высушивали и помещали в кассету с фоточувствительным экраном. Экран сканировали при помощи фосфоримиджера Bio-Rad. Для получения количественных характеристик радиоавтографы переводили в цифровую форму в программном пакете Quantity One. С использованием программного пакета GraphPad Prism 5.0.4.533 для каждой серии опытов были построены изотермы связывания, что позволило оценить сродство РНК-аптамеров к антителам и рассчитать константы связывания.
На фиг. 2 представлена вторичная структура РНК-аптамера Apt26 по данным компьютерного моделирования, проведенного на основе алгоритма минимизации свободной энергии с помощью программного пакета mfold version 2.3 (М. Zuker. // Nucleic Acids Res. 2003. V. 31. P. 3406-3415).
На фиг. 3 приведен радиоавтограф 6%-ного нативного полиакриламидного геля после электрофоретического анализа реакционных смесей. Дорожки 2-7 - инкубация РНК-аптамера с анти-ОБМ аутоантителами из крови больных рассеянным склерозом в указанной концентрации; дорожка 1 (контроль) - РНК-аптамер после инкубации в условиях реакции в отсутствие антител-мишеней.
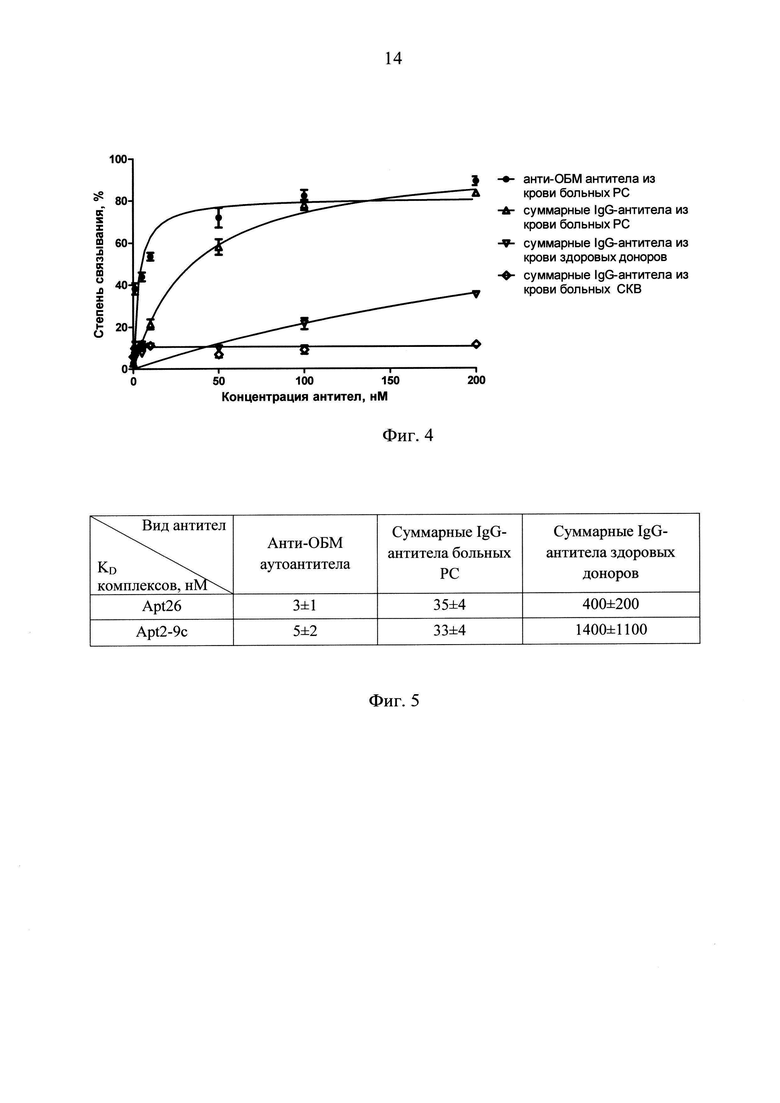
На фиг. 4 приведены изотермы связывания РНК-аптамера Apt26 с анти-ОБМ аутоантителами из крови больных PC, с суммарными антителами класса G, выделенными из крови больных PC, системной красной волчанкой и из крови здоровых доноров.
Из фиг. 4 видно, что РНК-аптамер Apt26 эффективно связывается с анти-ОБМ аутоантителами от больных PC, а также может дискриминировать суммарные антитела больных PC от антител здоровых доноров, используемых в качестве контроля, и антител больных системной красной волчанкой, для которой также характерно наличие анти-ОБМ аутоантител.
На фиг. 5 приведены константы диссоциации комплексов различных препаратов антител с РНК-аптамером Apt26 и РНК-аптамером-прототипом Apt2-9c для сравнения.
Можно видеть, что РНК-аптамер Apt26 обладает высоким сродством как к аффинно очищенному препарату анти-ОБМ антител из крови больных PC, так и к суммарным IgG-антителам из крови больных PC, при этом его сродство к суммарным IgG-антителам из крови здоровых людей значительно ниже (константа диссоциации комплекса около 400 нМ), что говорит о высокой специфичности связывания.
Таким образом, предлагаемый РНК-аптамер Apt26 обладает высоким сродством и специфичностью связывания с протеолитическими анти-ОБМ аутоантителами, характерными при PC, при этом количество нуклеотидных звеньев в его последовательности в два раза ниже, чем у РНК-аптамера-прототипа, что делает химический синтез аптамера Apt26 значительно более быстрым и экономичным и позволяет рассматривать данный аптамер в качестве перспективного компонента биосенсоров для диагностики рассеянного склероза.
| название | год | авторы | номер документа |
|---|---|---|---|
| РНК-АПТАМЕР, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ УЗНАВАТЬ ХАРАКТЕРНЫЕ ДЛЯ РАССЕЯННОГО СКЛЕРОЗА АУТОАНТИТЕЛА | 2014 |
|
RU2549704C1 |
| АПТАМЕРНЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, ПРИМЕНИМЫЕ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ РАССТРОЙСТВ | 2006 |
|
RU2406507C2 |
| ДНК-аптамер, специфично связывающийся с белком Dickkopf-1 человека | 2023 |
|
RU2814580C1 |
| МОЛЕКУЛЫ ХИМИЧЕСКИ МОДИФИЦИРОВАННОЙ КОРОТКОЙ ИНТЕРФЕРИРУЮЩЕЙ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ОПОСРЕДУЮТ ИНТЕРФЕРЕНЦИЮ РНК | 2006 |
|
RU2418068C2 |
| Способ выявления мишеней, ассоциированных с определенным диагнозом, в крови пациентов на основе ДНК-аптамеров | 2017 |
|
RU2685936C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pQe30_PS-CFP2/Turbo YFP_MBP7, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК PS-CFP2/Turbo YFP_MBP7, ШТАММ Escherichia coli BL21(DE3)/pQe30_PS-CFP2/Turbo YFP_MBP7 - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЛКА PS-CFP2/Turbo YFP_MBP7 | 2009 |
|
RU2430161C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ ЦНС | 2007 |
|
RU2426544C2 |
| СРЕДСТВА И СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2012 |
|
RU2601298C2 |
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И АНАЛИЗА ЭКЗОСОМ | 2022 |
|
RU2788198C1 |

Изобретение относится к области биохимии и биотехнологии, в частности к РНК-аптамеру, представляющему 26-звенный олигонуклеотид смешанного типа. Настоящий РНК-аптамер содержит пуриновые рибонуклеотиды и 2’-дезокси-2’-фторпиримидиновые рибонуклеотиды. Указанный РНК-аптамер имеет нуклеотидную последовательность 5’-AUG CGG UCA АUU АСС UGA GAG CAG GA-3’, где A, G - рибонуклеотиды, U, С - 2’-дезокси-2’-фтор-рибонуклеотиды. Указанный РНК-аптамер обладает способностью узнавать аутоантитела, характерные для рассеянного склероза, и является перспективным компонентом биосенсоров для диагностики рассеянного склероза. Настоящее изобретение позволяет получать РНК-аптамер, способный высокоаффинно и специфично связывать аутоантитела-маркеры, характерные для рассеянного склероза. 5 ил., 2 пр.
РНК-аптамер, представляющий собой 26-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2'-дезокси-2'-фторпиримидиновые рибонуклеотиды, имеющий нуклеотидную последовательность 5'-AUG CGG UCA АUU АСС UGA GAG CAG GA-3', где A, G - рибонуклеотиды, U, С - 2'-дезокси-2'-фтор-рибонуклеотиды, обладающий способностью узнавать аутоантитела, характерные для рассеянного склероза.
| РНК-АПТАМЕР, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ УЗНАВАТЬ ХАРАКТЕРНЫЕ ДЛЯ РАССЕЯННОГО СКЛЕРОЗА АУТОАНТИТЕЛА | 2014 |
|
RU2549704C1 |
| Vorobjeva MA., et al., RNA aptamer against autoantibodies associated with multiple sclerosis and bioluminescent detection probe on its basis, Analytical chemistry, 2014 | |||
| МОДИФИЦИРОВАННЫЕ ДНК АПТАМЕРЫ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ ТРОМБИНА | 2009 |
|
RU2410432C1 |
| Toh SY., et al., Aptamers as a replacement for antibodies in enzyme-linked immunosorbent assay | |||
| Biosensors and Bioelectronics, 2015. | |||
Авторы
Даты
2018-02-08—Публикация
2017-06-29—Подача