Изобретение относится к биотехнологии, а именно к производству пищевой продукции на основе рыбы, может быть использовано в качестве технологического вспомогательного средства на основе бактериофагов, предназначенного для деконтаминации, продления срока годности охлажденной рыбы, употребляемой в пищу, и снижения риска возникновения инфекций, передаваемых пищевым путем.
По данным всемирной организации здравоохранения небезопасные продукты питания, содержащие болезнетворные бактерии или вредные химические вещества, являются причиной более 200 заболеваний от диареи до онкологических заболеваний [Безопасность продуктов питания. Информационный бюллетень ВОЗ №399, Декабрь 2015 г.]. Повышенные требования потребителей к безопасности и экологической чистоте пищевой продукции возродило интерес к бактериофагам как альтернативному методу биодеконтаминации рыбных и мясных полуфабрикатов.
По данным Центров США по контролю и профилактике заболеваний (CDC) каждый год 1 из 6 жителей США заболевает при употреблении инфицированных пищевых продуктов. По оценкам CDC каждый год около 48 миллионов людей страдают от инфекций, передаваемых пищевым путем, из которых 128000 госпитализируются и 3000 умирает.
Листериоз - инфекционная болезнь людей и животных с полиморфизмом клинических проявлений и высокой летальностью. Основной путь заражения человека -алиментарный, при употреблении не прошедших термической обработки продуктов питания, в том числе рыбы. У пациентов с нарушением клеточного звена иммунной системы листериоз может сопровождаться серьезными осложнениями, в том числе сепсисом, менингитом, энцефалитом и приводить к летальным исходам. Доказано внутриутробное заражение плода от инфицированной листериозом матери: в результате рождается мертвый или недоношенный ребенок, который неизбежно погибает в течение первых 2 недель жизни [Бакулов И.А., Васильев Д.А., Колбасов Д.В., Кольпикова Т.И., Селянинов Ю.О., Егорова И.Ю. Листерии и листериоз. Ульяновск, 2008].
Представители рода Pseudomonas часто выделяются с поверхности свежевыловленной рыбы. Они причастны к порче рыбы при хранении, в том числе за счет выработки гистамина, протеолитических и липолитических ферментов [Austin В. The bacterial microflora of fish, revised // The Scientific World Journal. - 2006. - T. 6. - C. 931-945.; Abbas M.S. Isolation of bacteria from fish // Int. J. Adv. Res. - 2014. - T. 2. - C. 274-279].
Raoultella ornithinolytica, грамотрицательные, аэробные, оксидазо-негативные, неподвижные бактерии, относящиеся к семейству Enterobacteriaceae. Этот вид относится к гистамин-продуцирующим бактериям, вызывающим у человека при употреблении инфицированных рыбопродуктов пищевую токсикоинфекцию, характеризующуюся острым началом с аллергическими симптомами, в западной литературе имеющее название scombroid синдром. По данным CDC в Соединенных Штатах в течение 1998-2008 гг.зафиксированы 317 вспышек scombroid синдрома, обусловленных инфицированной рыбой [Gould L.Н., Walsh K.A., Vieira A.R., Herman K., Williams I.Т., Hall A.J., Cole D. Surveillance for foodborne disease outbreaks-United States, 1998-2008 // MMWR Surveill Summ. - 2013. - T. 62. - №.2. - C. 1-34].
Широко распространенное средство, используемое в настоящее время как биоконсервант в пищевой промышленности - бактериоцин низин, продуцируется грамположительными молочнокислыми стрептококками Lactococcus Lactis. В низких концентрациях он способен подавлять рост патогенных бактерий, таких как Listeria monocytogenes, Staphylococcus aureus, Clostridium botulinum, а также грамположительных микроорганизмов, способных вызывать порчу пищевой продукции. В настоящее время большое число исследований свидетельствуют о появлении новых штаммов бактерий, резистентных к этому бактериоцину [Blake K.L., Randall С.P.,  A.J. In vitro studies indicate a high resistance potential for the lantibiotic nisin in Staphylococcus aureus and define a genetic basis for nisin resistance // Antimicrobial agents and chemotherapy. - 2011. - T. 55. - №. 5. - C. 2362-2368.; Collins В., Joyce S., Hill C., Cotter P.D., Ross R.P. TelA contributes to the innate resistance of Listeria monocytogenes to nisin and other cell wall-acting antibiotics // Antimicrobial agents and chemotherapy. - 2010. - T. 54. - №. 11. - C. 4658-4663].
A.J. In vitro studies indicate a high resistance potential for the lantibiotic nisin in Staphylococcus aureus and define a genetic basis for nisin resistance // Antimicrobial agents and chemotherapy. - 2011. - T. 55. - №. 5. - C. 2362-2368.; Collins В., Joyce S., Hill C., Cotter P.D., Ross R.P. TelA contributes to the innate resistance of Listeria monocytogenes to nisin and other cell wall-acting antibiotics // Antimicrobial agents and chemotherapy. - 2010. - T. 54. - №. 11. - C. 4658-4663].
Классические химические и физические средства деконтаминации ухудшают экологическую частоту и вкусовые качества обрабатываемых пищевых полуфабрикатов, нередко вызывая формирование новой категории патогенов - штаммов условно-патогенных бактерий, резистентных к антибиотикам.
В связи с вышесказанным использование бактериофагов в качестве средства биоконсервации, не влияющего на безопасность и экологическую чистоту продукции, а также воздействующих на устойчивые к антибиотикам штаммы бактерий, становится перспективным.
Существует ряд существенных преимуществ фаг-опосредованного биопроцессинга перед химическими и физическими средствами деконтаминации: бактериофаги характеризуются специфической способностью к избирательному инфицированию микроорганизмов; способны уничтожать бактерии, устойчивые к другим антибактериальным агентам, свободно проникая в бактериальные клетки, как на плотных поверхностях, так и в жидких средах; не вызывают аллергических реакций при употреблении в пищу. Не обладают цитопатическим действием на эукариотические клетки. По истечении 48 часов после лизиса бактерии-мишени бактериофаги не идентифицируются с помощью микробиологических и молекулярно-генетических методов на обработанной пищевой продукции [Sulakvelidze A. Using lytic bacteriophages to eliminate or significantly reduce contamination of food by foodborne bacterial pathogens // Journal of the Science of Food and Agriculture. - 2013. - T. 93. - №. 13. - C. 3137-3146; Teufer, Т., Von Jagow, C., Which Path To Go?; European Food and Feed Law Review (EFFL), June 2007, Vol 3 pp 136-145].
В настоящее время в РФ антибактериальные композиции на основе бактериофагов для деконтаминации пищевой продукции не зарегистрированы.
В США и Нидерландах работают ряд компаний, успешно занимающихся разработкой средств на основе бактериофагов, которые используются для контроля бактериального загрязнения мясных и рыбных полуфабрикатов и овощей (так называемый фаг-опосредованный биоконтроль) [А.В. Алешкин, А.В. Караулов, Э.А. Светоч, Н.В. Воложанцев, В.А. Алешкин, С.С. Афанасьев, О.В. Рубальский, Д.А. Васильев, С.Н. Золотухин, М.С. Афанасьев, В.М. Лахтин, М.О. Рубальский Бактериофаги пробиотические средства регуляции микробиоценозов и деконтаминации микроорганизмами продуктов питания, животных и растений // Иммуноллогия, аллергология, инфектология - 2013. - Т. 3. - С. 80-89]. В настоящий момент ими зарегистрированы следующие фагосодержащие продукты:
 ListShield™ - натуральный, не содержащий химических добавок препарат, содержащий 6 различных бактериофагов лизирующих Listeria monocytogenes, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
ListShield™ - натуральный, не содержащий химических добавок препарат, содержащий 6 различных бактериофагов лизирующих Listeria monocytogenes, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
 Eco Shield™ - натуральный, не содержащий химических добавок препарат, состоящий из 3 вирулентных бактериофагов лизирующих Escherichia coli 0157:Н7, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
Eco Shield™ - натуральный, не содержащий химических добавок препарат, состоящий из 3 вирулентных бактериофагов лизирующих Escherichia coli 0157:Н7, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
 SalmoFresh™ - натуральный, не содержащий химических добавок препарат литических бактериофагов активных в отношении Salmonella enterica, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
SalmoFresh™ - натуральный, не содержащий химических добавок препарат литических бактериофагов активных в отношении Salmonella enterica, производящийся компанией Intralytix Inc. USA. [http://www.intralytix.com/]
 Listex™ - натуральный препарат, содержащий бактериофаг PI00 активный в отношении Listeria monocytogenes, [http://www.micreos.com/]
Listex™ - натуральный препарат, содержащий бактериофаг PI00 активный в отношении Listeria monocytogenes, [http://www.micreos.com/]
 SALMONELEX™ - натуральный препарат, содержащий бактериофаги, активные в отношении ряда серотипов сальмонелл, [http://www.micreos.com/]
SALMONELEX™ - натуральный препарат, содержащий бактериофаги, активные в отношении ряда серотипов сальмонелл, [http://www.micreos.com/]
 AgriPhage™ - биопестицид, содержащий коктейль вирулентных фагов, лизирующих Xanthomonas campestris pv. vesicatoria и Pseudomonas syringae pv. tomato, поражающих плоды томата и перца. Производится компанией OmniLytics Inc. USA [http://www.omnilytics.com/].
AgriPhage™ - биопестицид, содержащий коктейль вирулентных фагов, лизирующих Xanthomonas campestris pv. vesicatoria и Pseudomonas syringae pv. tomato, поражающих плоды томата и перца. Производится компанией OmniLytics Inc. USA [http://www.omnilytics.com/].
Недостатком данных средств деконтаминации является моновалентная направленность антибактериального действия, заключающаяся в уничтожении лишь одного конкретного бактериального вида, нарушающего микробиологическую чистоту пищевой продукции, в то время как неконтролируемый рост других, присутствующих на полуфабрикате видов микроорганизмов, также может приводить к скорой порче и риску возникновения инфекций, передаваемых пищевым путем (т.н. Food-borne infections). Так, по данным Долгановой с соавт. на охлажденной свежевыловленной рыбе присутствуют бактерии различных видов, вызывающих заболевания как у рыб, так и у людей, а также являющиеся причиной скорой порчи данной категории продуктов [Долганова Н.В., Першина Е.В., Хасанова З.К. Микробиология рыбы и рыбных продуктов // Санкт-Петербург [и др.]: Лань. - 2012].
Для определения видов бактерий, приводящих к порче свежевыловленной охлажденной рыбы мы производили смывы с тушек охлажденной радужной форели, приобретенной в торговых сетях гг.Москвы, Ульяновска и Астрахани, которые затем сеяли на селективные среды в соответствии с разделом настоящего описания «Среды и условия культивирования бактерий». В ходе эксперимента, на протяжении всего срока годности продукции - не более 12 суток с момента вылова по ГОСТ 814-96 «Рыба охлажденная» (введен в действие в качестве государственного стандарта РФ с 01 июля 1997 года, распространяется на охлажденную рыбу всех семейств и видов), проводился микробиологический мониторинг (Таблица 1), в ходе которого были выделены следующие штаммы бактерий: Pseudomonas fluorescens, Serratia liquefaciens, Acinetobacter baumannii, Acinetobacter johnsonii, Aeromonas salmonicida, Aeromonas hydrophila, Pseudomonas putida, Raoultella ornithinolytica, Aeromonas veronii, Citrobacter freundii, Listeria monocytogenes. Нарастание титра бактерий P. fluorescens, A. hydrophila, P. putida, R. ornithinolytica, C. freundii, L. monocytogenes при холодильном хранении происходило значительно быстрее, чем остальных представителей микрофлоры гидробионтов. На фоне возрастания титра данных бактерий выше 104 КОЕ/г, начинал изменяться цвет и запах продукции. Пожелтение мяса и появление запаха окислившегося жира наряду с нарастанием количества данных видов бактерий выше порогового значения, указанного в TP ТС 021/2011, позволило отнести эти микроорганизмы к вызывающим порчу.
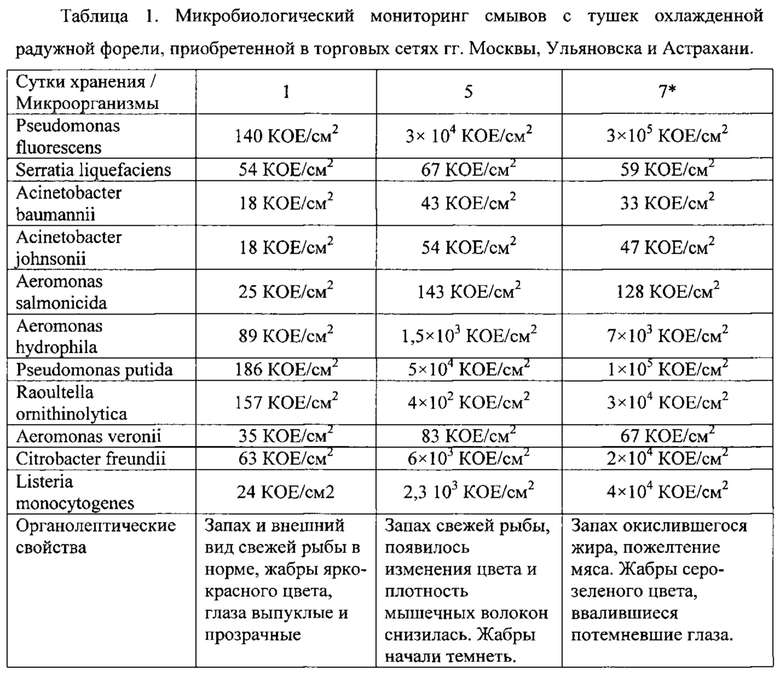
*Дальнейший микробиологический мониторинг не проводился из-за выхода микробиологических показателей за пределы порогового значения, установленного в TP ТС 021/2011 (КМАФАнМ не выше 1×105 КОЕ/г).
Проведенный микробиологический мониторинг позволил не только выявить наиболее часто встречаемые бактериальные виды, вызывающие порчу охлажденной рыбы, но и обосновать минимальный необходимый эффективно лизирующий эти бактерии коктейль бактериофагов, включенных в состав антибактериальной композиции для продления срока годности охлажденной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем.
Основной задачей, решаемой изобретением, является расширение спектра литической активности антибактериальной композиции, используемой для продления срока годности охлажденной свежевыловленной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем, за счет включения в ее состав поливалентного коктейля вирулентных бактериофагов с неперекрывающимся спектром литической активности в отношении бактерий, наиболее часто и в значительных количествах присутствующих на поверхности охлажденной рыбы, приводящих к ускоренной порче продукции и способных вызывать у потребителей инфекции, передаваемые пищевым путем.
Поставленная задача реализуется за счет того, что композиция антибактериальная включает комбинацию стерильных, очищенных от токсинов фильтратов фаголизатов бактерий с литической активностью каждого из бактериофагов не ниже 108 БОЕ/см2 по Грациа в отношении наиболее часто выделяемых с поверхности охлажденной рыбы штаммов микроорганизмов. В состав композиции входит фильтрат фаголизата Aeromonas hydrophila, полученный с использованием штамма бактериофага Aeromonas hydrophila Ah 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-129; фильтрат фаголизата Pseudomonas fluorescens, полученный с использованием штамма бактериофага Pseudomonas fluorescens Pf 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-132; фильтрат фаголизата Raoultella ornithinolytica, полученный с использованием штамма бактериофага Raoultella ornithinolytica R.o. 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-128; фильтрат фаголизата Pseudomonas putida, полученный с использованием штамма бактериофага Pseudomonas putida Psp6, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-130; фильтрат фаголизата Citrobacter freundii, полученный с использованием штамма бактериофага Citrobacter freundii Cf 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-131; фильтрат фаголизата Listeria monocytogenes, полученный с использованием штамма бактериофага Listeria monocytogenes Lm 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-133.
Техническим результатом заявленного изобретения является создание антибактериальной композиции в виде поливалентного коктейля вирулентных бактериофагов с неперекрывающимся спектром литической активности в отношении бактерий, наиболее часто и в значительных количествах присутствующих на поверхности охлажденной рыбы, обеспечивающей возможность продления сроков хранения охлажденной рыбы, определенных в ГОСТ 814-96 «Рыба охлажденная», на 5 суток до превышения пороговых значений микробиологических показателей, допустимых по TP ТС 021/2011 (Приложение №2) для данной категории продуктов, при полном сохранении их исходной экологической чистоты и пищевой ценности. Созданная композиция не обладает риском токсических или иных побочных эффектов для человека, обеспечивает стабильность и эффективность применения.
Согласно изобретению отбор 6 вирулентных бактериофагов с максимально широким спектром литической активности осуществляли, используя собственный банк патогенных и условно-патогенных микроорганизмов: 32 штамма Pseudomonas fluorescens, 38 штамма Pseudomonas putida, 32 штамма Aeromonas hydrophila, 24 штамма Raoultella ornithinolytica, 28 штаммов Citrobacter freundii и 43 штамма Listeria monocytogenes.
Среды и условия культивирования бактерий
Бактериальные культуры выращивали на жидких и плотных питательных средах общего назначения: мясопептонный бульон; 1,5% и 2% мясопептонный агар; 2% мясопептонный агар и мясопептонный бульон с глюкозой; среда Эндо-ГРМ (ФБУН ГНЦ ПМБ Оболенск); 2% МПА с кровью (кровяной агар); Уриселект 4 (Bio Rad, США).
Оценка литической активности бактериофагов.
Спектр литической активности бактериофагов оценивали:
- методом нанесения фага (spot-тест) на газон бактериальной культуры. В чашки Петри разливали 1,5% МПА. После застывания и подсушивания агара на чашки Петри наносили по 0,1 мл 16-18 часовой бульонной культуры микроорганизмов, растирали шпателем по всей поверхности чашки, чтобы получить равномерный сплошной рост культуры. После того, как культура впиталась и чашки подсохли, на них каплями (spot-тест) наносили бактериофаги. После того как жидкость впиталась в среду, чашки перевертывали вверх дном и ставили в термостат при 37°С на 18-24 часа. На следующие сутки производили учет результатов - наличие или отсутствие «пятна лизиса».
Получение отдельных фаголизатов и их комбинации.
4,5 мл 18 часовой бактериальной культуры штамма-хозяина в титре 109 КОЕ/мл засевают в матрац для культивирования - скошенная плотная питательная среда с толщиной слоя от 10 мм до 25 мм, культивируют в течение 3-3,5 часов при оптимальной температуре для роста культуры штамма-хозяина, затем на полученный газон культуры штамма-хозяина засевают маточный бактериофаг в титре 106-107 БОЕ/мл, герметично закрывают сосуд для культивирования. Культивируют в течение 4-5 часов при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с pH 7,0-7,2 в количестве 9-10 мл, отсасывают фаголизат в стерильную емкость, добавляют хлороформ в количестве 1:10, выдерживают в течение 30 минут при непрерывном шуттелировании, центрифугируют в течение 30 минут при 5000 об./мин. После центрифугирования для получения антибактериальной композиции смешивают надосадочные жидкости, содержащие бактериофаги, затем стерилизуют смесь фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину. В результате получаем комбинацию стерильных фильтратов фаголизатов, очищенных от токсинов, содержащий не менее 1011 БОЕ/мл каждого бактериофага.
Штаммы вирулентных бактериофагов, используемые для получения стерильных фильтратов фаголизатов, очищенных от токсинов 1. Штамм бактериофага Aeromonas hydrophila Ah 1 выделен из сточных вод Московской области на культуре бактерий Aeromonas hydrophila GTX 11 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-129.
Штамм бактериофага Aeromonas hydrophila Ah 1 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют мелкие негативные прозрачные колонии диаметром 1,5-2 мм с ровными краями без ореола.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 1, соответствующая таковой на прилагаемом машиночитаемом носителе.
Геном бактериофага представлен дцДНК размером 221116 п. н.
Оценку спектра литической активности фага определяли на 32 индикаторных штаммах A. hydrophila методом спот-теста. Наработанный фильтрат фаголизата наносили на свежезасеянные газоны A. hydrophila. О чувствительности штаммов A. hydrophila к фагу судили по появлению стерильного пятна на выросшем через 16-18 часов газоне испытуемого бактериального штамма. Результаты изучения спектра литического действия бактериофага представлены в табл.2.
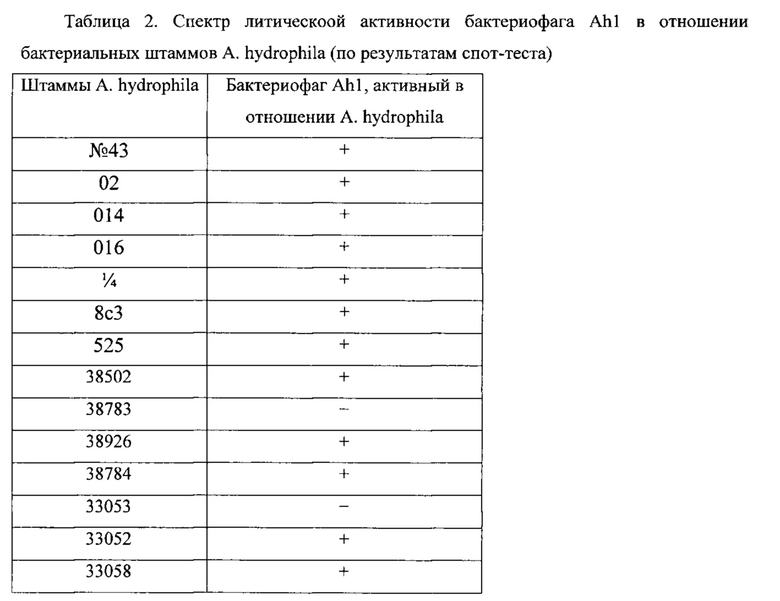
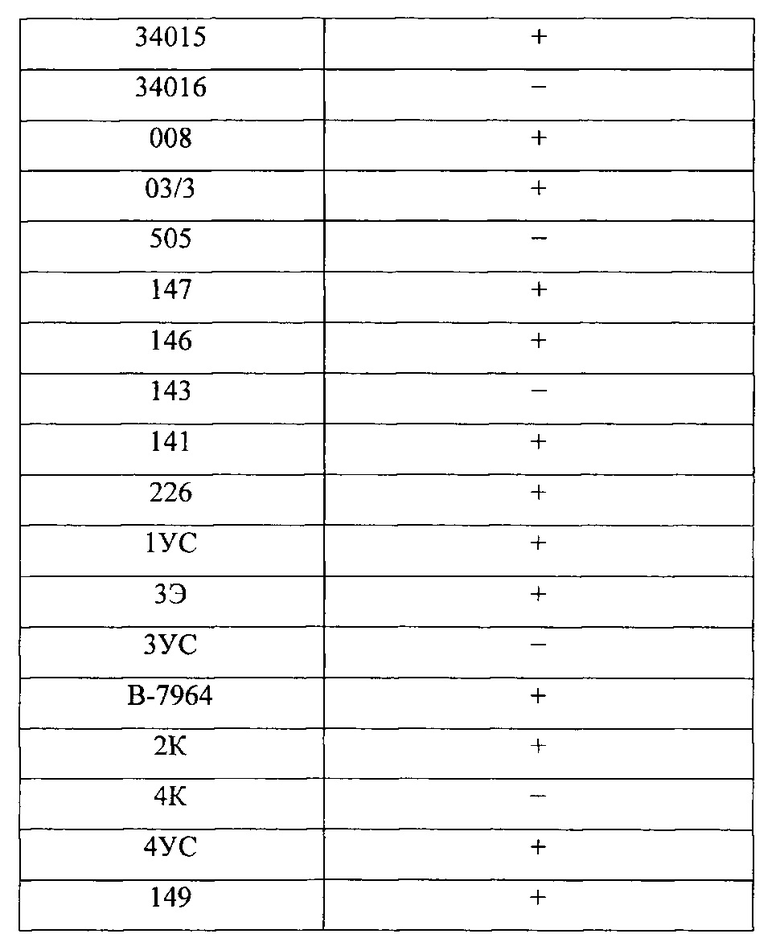
Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из полученных данных, спектр литического действия бактериофага АЫ составляет 78,1%.
Бактериофаг Ah 1 устойчив к воздействию хлороформа. Так, при обработке хлороформом в течение 30 минут фаг не терял своей активности.
При изучении жизнеспособности бактериофага Ah 1 выявлена его устойчивость к высоким температурам: только нагревание бактериофага в течение 15 минут при температуре выше 65°C полностью инактивировала его. Оптимальная температура хранения для поддержания исходного титра фагов в течение года составляет от 4 до 10°C.
2. Штамм бактериофага Pseudomonas fluorescens Pf 1 выделен из сточных вод Московской области на культуре бактерий Pseudomonas fluorescens GTX 2 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-132.
Штамм бактериофага Pseudomonas fluorescens Pf 1 характеризуется следующими свойствами: на газоне чувствительного бактериального штамма фаги образуют крупные негативные колонии диаметром 5-7 мм, мутные по периферии с ровными краями без ореола.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 2, соответствующая таковой на прилагаемом машиночитаемом носителе. Геном бактериофага представлен дцДНК размером 39195 п.н.
Бактериофаг Pf 1 устойчив к хлороформу: титр бактериофага стерилизованном фильтрованием через бактериальный фильтр диаметром пор 0,22 мкм, не превышал титр в аналогичном фаголизате, обработанным хлороформом. Бактериофаг Pf 1 устойчив к воздействию высоких температур, полная инактивация происходит в течение 15 минут при температуре более 80°C. Оптимальная температура хранения для поддержания исходного титра бактериофага в течение 12 месяцев составляет от 4 до 10°C.
Литический спектр бактериофага Pf 1 в отношении бактериальных штаммов Р. fluorescens, выделенных с поверхности рыбы: на рыбоперерабатывающем предприятии в республике Карелия; из реки Волги в Ленинском районе города Ульяновска; приобретенной из торговой сети города Москвы, представлены в таблице 3.


Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из данных таблицы 3, бактериофаг Pf 1 лизирует 26 штаммов из 32 индикаторных штаммов P. fluorescens (81,25%).
3. Штамм бактериофага Raoultella ornithinolytica R.o. 1 выделен из сточных вод Московской области на культуре бактерий Raoultella ornithinolytica GTX 1 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-128.
Штамм бактериофага Raoultella ornithinolytica R.o. 1 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют мелкие негативные колонии диаметром 1 - 2 мм округлой формы, с ровными краями.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 3, соответствующая таковой на прилагаемом машиночитаемом носителе.
Геном бактериофага представлен дцДНК размером 145759 п. н.
Бактериофаг устойчив к хлороформу и нагреванию до температуры 70°C, но инактивируются при 80°C в течение 15 минут. Хорошо сохраняется в лиофильно высушенном состоянии при температуре 4-8°C. Максимальный титр бактериофага при размножении на жидких и плотных питательных средах составляет не менее 1011 фаговых частиц в 1 мл фаголизата.
Спектр литической активности бактериофага R.o. 1 в отношении диких штаммов R. ornithinolytica выделенных с поверхности охлажденной рыбы представлен в табл.4.


Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из таблицы 4, выделенный бактериофаг лизирует 16 из 24 штаммов бактериальных культур, выделенных с форелеводческого предприятия, что составляет 66,5%
4. Штамм бактериофага Pseudomonas putida Psp 6 выделен из р. Волга в Ленинском районе г. Ульяновска на культуре бактерий Pseudomonas putida GTX 21 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-130.
Штамм бактериофага Pseudomonas putida Psp 6 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют негативные колонии диаметром 2-3 мм округлой формы с ровными краями.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 4, соответствующая таковой на прилагаемом машиночитаемом носителе.
Геном бактериофага представлен дцДНК размером 42789 п. н.
Оценку спектра литической ативности фага определяли на 38 индикаторных штаммах P. putida методом спот-теста, полученных из гг.Ульяновска, Астрахани, Москвы и Сегежи. Наработанный фаголизат стерилизовали хлороформом и наносили на свежезасеянные газоны P. putida. О чувствительности штаммов P. putida к фагам судили по появлению стерильного пятна на выросшем через 16-18 часов газоне индикаторного штамма. Результаты изучения спектра литического действия бактериофага представлены в табл.5.
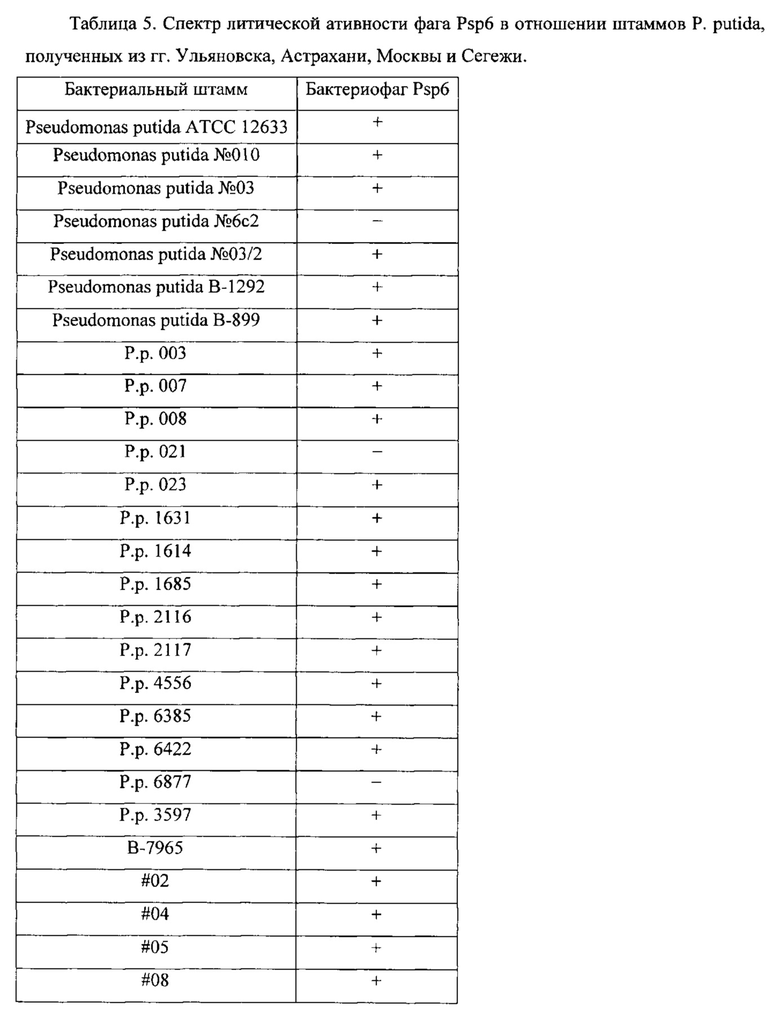
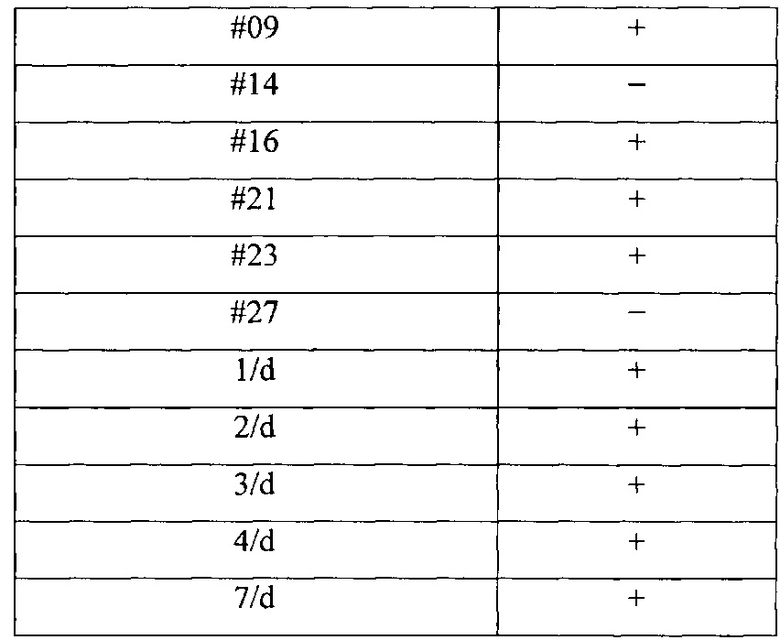
Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из таблицы 5, бактериофаг Psp6 лизировал 33 из 38 штаммов бактерий, выделенных из различных субъектов Российской Федерации. Бактериофаг Psp6 устойчив к воздействию хлороформа, сохраняется при температуре 65°C, а при нагревании в течение 15 минут до 75°C бактериофаг полностью инактивируется.
5. Штамм бактериофага Citrobacter freundii Cf 1 выделен из сточных вод Московской области на культуре бактерий Citrobacter freundii GTX 3 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-131.
Штамм бактериофага Citrobacter freundii Cf 1 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют негативные колонии диаметром 1-1,5 мм, с ровными краями, без ореола.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 5, соответствующая таковой на прилагаемом машиночитаемом носителе. Геном бактериофага представлен дцДНК размером 171911 п. н.
Для оценки спектра литической активности бактериофага Cf 1 использовали дикие штаммы, выделенные в форелеводческом хозяйстве в республике Карелия и клинические изоляты от пациентов КДЦ ФБУН МНИИЭМ им. Г.Н. Габрического (таблица 6).

Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из таблицы 6, бактериофаг Cf 1 лизировал 18 из 28 диких штаммов, полученных из разных источников, спектр литической активности составлял 64,3%. Бактериофаг Cf 1 устойчив к воздействию хлороформа, хорошо сохраняет свои биологические свойства при температуре 60°C, при нагревании в течение 15 минут до 70°C титр бактериофага падает на шесть логарифмических порядков.
6. Штамм бактериофага Listeria monocytogenes Lm 1 выделен из экскрементов овец в Астраханской области на культуре бактерий Listeria innocua М-4 и депонирован в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-133.
Штамм бактериофага Listeria monocytogenes Lm 1 характеризуется следующими свойствами: на газоне чувствительного штамма фаги образуют мелкие негативные колонии, диаметром 1-2 мм округлой формы, с ровными краями.
Получена нуклеотидная последовательность генома штамма SEQ ID NO: 6, соответствующая таковой на прилагаемом машиночитаемом носителе. Геном бактериофага представлен дцДНК размером 131381 п.н.
Для оценки спектра литической активности бактериофага Lm 1 использовали 43 штамма и 20 изолятов листерий, выделенных из клинического материала и объектов окружающей среды.

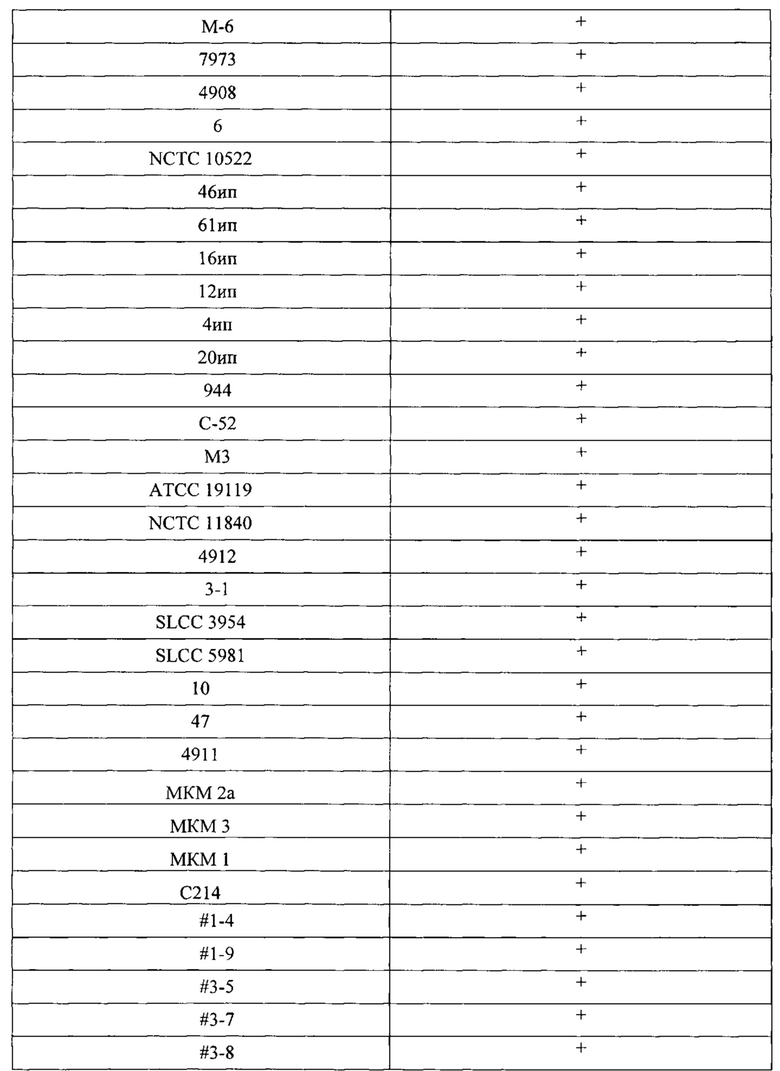
Примечание: «+» - наличие стерильного пятна на бактериальном газоне, отражающего лизис бактериальной культуры; «-» - отсутствие стерильного пятна.
Как следует из таблицы 7, бактериофаг Lm 1 лизировал 100% штаммов листерий. Бактериофаг Lm1 устойчив к воздействию хлороформа, хорошо сохраняется при температуре до 70°C, а при нагревании в течение 15 минут до 80°C бактериофаг полностью инактивируется.
Сущность изобретения поясняется на следующих примерах
Пример 1. Получение композиции антибактериальной для продления срока годности охлажденной свежевыловленной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем.
4,5 мл 18 часовой бактериальной культуры штамма-хозяина (из ряда: A. hydrophila, P. putida, P. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes) в титре 109 КОЕ/мл засевают в матрац для культивирования - скошенная плотная питательная среда с толщиной слоя от 10 мм до 25 мм, культивируют в течение 3-3,5 часов при оптимальной температуре для роста культуры штамма-хозяина, затем на полученный газон культуры штамма-хозяина засевают маточный бактериофаг (гомологичный бактериальной культуре) в титре 106-107 БОЕ/мл, герметично закрывают сосуд для культивирования. Культивируют в течение 4-5 часов при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с pH 7,0-7,2 в количестве 9-10 мл, отсасывают фаголизат в стерильную емкость, добавляют хлороформ в количестве 1:10, выдерживают в течение 30 минут при непрерывном шуттелировании, центрифугируют в течение 30 минут при 5000 об./мин. После центрифугирования для получения антибактериальной композиции смешивают надосадочные жидкости, содержащие бактериофаги A. hydrophila, P. putida, P. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes, затем стерилизуют смесь фильтрацией через фильтр с диаметром пор 0,2-0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину. В результате получаем композицию антибактериальную, содержащую комбинацию стерильных фильтратов фаголизатов A. hydrophila, P. putida, P. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes, очищенных от токсинов, с титром каждого бактериофага не менее 1011 БОЕ/мл.
Пример 2. Стабильность композиции антибактериальной для продления срока годности охлажденной свежевыловленной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем.
В таблице 8 представлены данные по изучению специфической литической активности коктейля бактериофагов, являющегося действующим веществом композиции антибактериальной, в течение 9 месяцев от даты его производства.
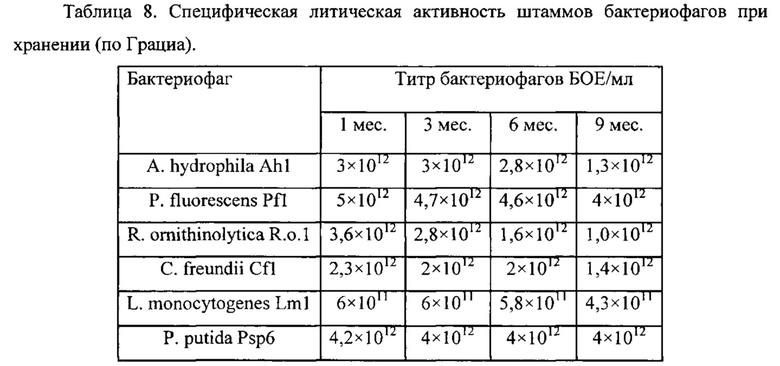
Результаты проведенной работы свидетельствуют о том, что в процессе хранения готового продукта при температуре 4±2°C активность всех бактериофагов не опускалась ниже нормативных значений в течение 6 месяцев (содержание БОЕ в 1 мл продукта 1011-12).
Пример 3. Оценка острой и хронической токсичности композиции антибактериальной для продления срока годности охлажденной свежевыловленной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем, на лабораторных животных.
Проявление острого токсического действия композиции антибактериальной оценивали согласно «Руководство по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты)» (Часть вторая. - М.: Гриф и К, 2013 - 536 с.) у 10 здоровых белых мышей обоего пола массой 19-21 г после однократного внутрибрюшинного введения им 1 мл композиции антибактериальной в течение 7 суток (Таблица 9). Контрольные животные получали 0,9% раствор натрия хлорида по той же схеме.


На основе полученных данных можно говорить о том, что однократное введение максимально возможной дозы композиции антибактериальной для животных не является токсичным.
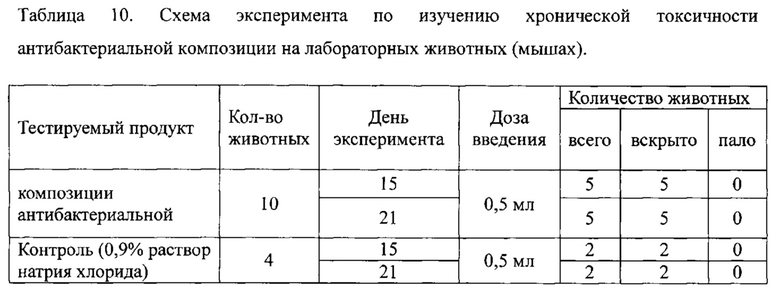
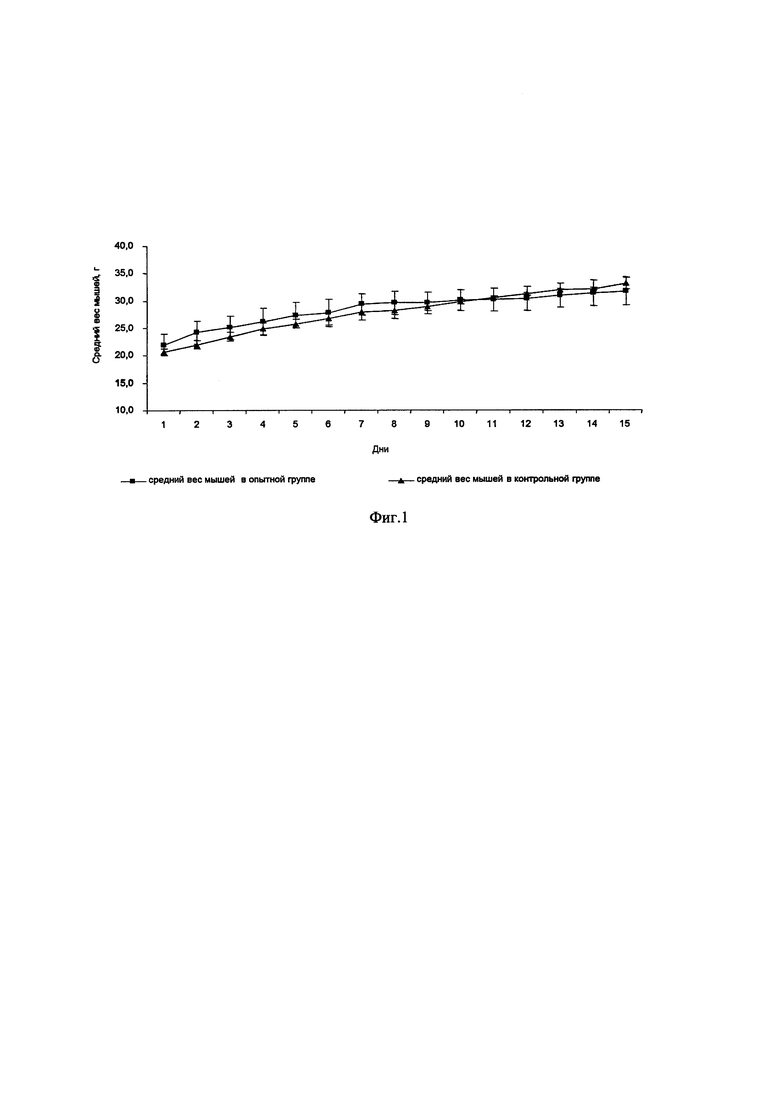
Оценку хронической токсичности композиции антибактериальной проводили согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» (Хабриев Р.У (ред.), 2005, М.: Медицина, 2005-832 с.). Исследование осуществляли на 10 здоровых белых мышах обоего пола массой 21-23 г. Композиции антибактериальной вводили животным внутрижелудочно по 0,5 мл раз в день в течение 14 дней. Мышам из контрольной группы давали по 0,5 мл внутрижелудочно 0,9% раствора натрия хлорида так же в течение 14 дней. У всех животных ежедневно регистрировали массу тела (рисунок 1), наличие клинических симптомов общей интоксикации, а также возможную гибель (таблица 10).
Изменение веса мышей в ходе изучения хронической токсичности антибактериальной композиции представлено на Фиг. 1.
Вскрытие мышей на 1 и 7 сутки после окончания введения композиции антибактериальной видимых изменений не показало. Гистологическое исследование органов животных патологических изменений не выявило.
Таким образом, изучение хронического токсического воздействия композиции антибактериальной на организм мышей не выявило негативного воздействия при его внутрижелудочном введении на протяжении 14 суток.
Пример 4. Элиминация L. monocytogenes с кусочков охлажденной рыбы в лабораторных условиях.
Стерилизованные образцы кусочков охлажденной рыбы весом 5 грамм искусственно контаминировали в течение двух часов путем погружения в емкость с суспензией, содержащей L. monocytogenes в количестве 1,5×106 КОЕ/мл, после чего опытные образцы переносили в емкость со стерильным фильтратом фаголизата Lm1 с титром фага 1×109 БОЕ/мл по Грациа, а контрольные в стерильный физиологический раствор. Через 24 часа после обработки опытных образцов уровень листерий (в КОЕ/мл) снижался более чем на 99%. Количество бактериальных клеток в контрольных образцах было в клинически значимом для человека титре (1,5×106 КОЕ/мл), способным вызвать кишечную форму листериоза.
Пример 5. Элиминация P. fluorescens с охлажденного сибаса в лабораторных условиях.
Охлажденный сибас весом 250-300 г, приобретенный в торговой сети города Москвы, естественно контаминированный Pseudomonas fluorescens, погружали в стерильный фильтрат фаголизата Pf1 на 60 секунд, в титре 1×108 БОЕ/мл по Грациа, контрольные образцы погружали в 0,9% раствор натрия хлорида и закладывали на хранение при 4±2°C. Через 24 часа после обработки, бактерии P. fluorescens не высевались с поверхности рыбы обработанной бактериофагом, в контрольных образцах их уровень превышал 75% от всей высеваемой с тушки микрофлоры.
Пример 6. Элиминация A. hydrophila с поверхности радужной форели в лабораторных условиях.
Свежевыловленная радужная форель весом 400-500 г из садка, содержащего рыбу, страдающую аэромонозом, вызванным A. hydrophila погружали в стерильный фильтрат фаголизата Ah1, в титре 1×10 БОЕ/мл по Грация на 30 секунд, контрольные образцы (также страдающие аэромонозом), погружали в 0,9% раствор натрия хлорида соответственно. Количество бактериальных клеток A. hydrophila снижалось на 99% в течении 24 часов по сравнению с контрольными образцами (3×10 КОЕ/г) и не обнаруживалась в последующие дни эксперимента (7 суток).
Пример 7. Элиминация гистамин-продуцирующей Raoultella ornithinolytica в лабораторных условиях.
Образцы охлажденной рыбы, размером 5×5 см, приобретенной в торговой сети города Москвы, стерилизовали в 70% спирте, затем отмывали от последнего 0,9% раствором натрия хлорида, искусственно контаминировали суспензией, содержащей гистамин-продуцирующую R. ornithinolytica в титре 2×109 КОЕ/мл. 1,0 мл суспезии равномерно распределяли по поверхности рыбы стеклянным шпателем. Давали кусочкам подсохнуть 30 минут при комнатной температуре, затем на поверхность наносили 2 мл стерильного фильтрата фаголизата R.o. 1 в титре 1011 БОЕ/мл, а на контрольные образцы наносили 2 мл 0,9% раствора натрия хлорида. Деконтаминировали в течение 120 минут при температуре 8±2°C, затем стерильной марлевой салфеткой размером 5×5 см делали смыв с поверхности образцов. Марлевую салфетку отбивали в 0,9% растворе натрия хлорида в течение 5 минут и сеяли 0,1 мл 2% МПА. Чашки инкубировали 24 часа при температуре 28°C. В результате уровень R. Ornithinolytica в опытных образцах снижался более чем на 99% по сравнению с контрольными образцами (2×106 КОЕ/г). Количество бактерий в контрольных образцах превышало пороговое значение по данному виду продукта прописанное в TP ТС 021/2011 (1×105 КОЕ/г).
Пример 8. Элиминация P. putida с охлажденной рыбы в лабораторных условиях.
Охлажденные рыбы весом 400-500 г, приобретенные в сети г. Ульяновска содержащие на поверхности P. putida в количестве 102-103 КОЕ/см2, были деконтаминированы путем погружения на 30 секунд в стерильный фильтрат фаголизата Psp6 с титром фага 108 БОЕ/мл, контрольные образцы погружали в 0,9% раствор натрия хлорида на тоже время и закладывали на хранение в герметичном контейнере при температуре 2-4°C. Через 24 часа на поверхности обработанной бактериофагом рыбы Р. putida не обнаруживалась, а в контрольных образцах ее уровень превышал 105 КОЕ/см2.
Пример 9. Элиминация С. freundii на поверхности охлажденной рыбы в лабораторных условиях.
Стерилизованные 70% спиртом образцы охлажденной рыбы, весом 10 г, искусственно контаминировали суспензией содержащей 2×109 КОЕ/мл С. freundii, погружением на 45 минут, затем погружали в стерильный фильтрат фаголизата СП с титром фага 1×1011 БОЕ/мл по Грациа (опытные образцы) или в стерильный 0,9% раствор натрия хлорида (контрольные образцы) на сутки при температуре 2-4°C. Через 24 часа после начала обработки уровень С. freundii на опытных образцах снижался более чем на 99%. Количество бактериальных клеток на контрольных образцах составляло 107 КОЕ/см2, что превышало допустимое в рамках TP ТС 021/2011 значение по данному продукту и могло спровоцировать пищевую токсикоинфекцию у человека.
Пример 10. Элиминация A. hydrophila, P. putida, P. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes с поверхности охлажденной рыбы в лабораторных условиях.
Стерилизованные 70% спиртом, а затем отмытые в стерильном физиологическом растворе контрольные и опытные образцы приобретенной в торговой сети охлажденной рыбой, нарезанные стерильным ножом, на стерильной доске, кусочками 5×5 см, были искусственно контаминированы микроорганизмами, персистирующими на поверхности рыбы и приводящими к скорой порче продукции, путем последовательного нанесения 0,5 мл суспензий, содержащих L. monocytogenes, С. freundii, R. ornithinolytica, P. fluorescens, P. putida, A. hydrophila в концентрации не менее 2×109 КОЕ/мл (каждого штамма). Суспензии равномерно распределялись по поверхности кусков рыбы стеклянным шпателем. Для адаптации микроорганизмов куски подсушивали в течение 30 минут при комнатной температуре, а затем опытные образцы погружали в стерильный фильтрат коктейля фаголизатов Lm 1, Cf 1, Ro 1, Pf 1, Psp6 и Ah 1, с титром каждого бактериофага не ниже 3×1011 БОЕ/мл. Время обеззараживания составляло 120 минут. Контрольные образцы погружали в стерильный 0,9% раствор натрия хлорида. Исследование проводили при температуре +4±2°C. Через 24 часа КМАФАнМ на поверхности обработанной рыбы снижалось на 95,1% в отличии от контрольных образцов (6×105 КОЕ/г).
Пример 11. Продление срока годности промышленной партии охлажденной рыбы.
На базе форелеводческого предприятия в процессе переработки свежевыловленной радужной форели была использована заявленная композиция антибактериальная, включающая в себя 6 штаммов бактериофагов (в титре не менее 1011 БОЕ/мл каждого) активных в отношении бактерий, приводящих к скорой порчи охлажденной рыбы. 85 мл композиции антибактериальной разводили в 10 литровом стерильном контейнере, после чего проводили обработку промышленной партии рыбы (всего 21 тушка, массой 600-800 г каждая, общий вес составлял 15 кг) на конвеере путем ее погружения в указанный объем на 30 секунд. В таблице 11 представлены данные мониторинга микробиологических и органолептических показателей, обработанных заявленной композицией антибактериальной тушек свежевыловленной радужной форели, которые подтвердили возможность продления сроков хранения свежевыловленной радужной форели, определенных в ГОСТ 814-96 «Рыба охлажденная», на 5 суток до превышения пороговых значений микробиологических показателей, допустимых по TP ТС 021/2011 (Приложение №2) для данной категории продуктов, при полном сохранении, по результатам исследований Филиала ФБУЗ "Центр Гигиены и эпидемиологии в городе Москва" в САО г. Москвы обработанной бактериофаговым коктейлем охлажденной рыбы, экологической чистоты и пищевой ценности продукта.

Таким образом, согласно заявляемому изобретению представлена перспективная антибактериальная композиция, лизирующая штаммы бактерий A. hydrophila, P. putida, Р. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes, в т.ч. устойчивые к антибиотикам, что, в свою очередь приводит к продлению срока хранения скоропортящейся продукции и снижению риска возникновения инфекций, передаваемых пищевым путем, не влияя на безопасность и не нарушая исходную экологическую чистоту продукции. Созданная композиция не обладает риском побочных, в т.ч. токсических эффектов на человека, сохраняет стабильный титр бактериофагов и эффективность применения в течение 6 месяцев. Справки о депонировании штаммов бактериофагов прилагаются.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ АНТИБАКТЕРИАЛЬНАЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ГОСПИТАЛЬНЫХ ИНФЕКЦИЙ (ВАРИАНТЫ), ШТАММЫ БАКТЕРИОФАГОВ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ | 2015 |
|
RU2628312C2 |
| Метод фаг-опосредованного биопроцессинга для продления срока годности охлажденной рыбы | 2020 |
|
RU2732792C1 |
| КОМПОЗИЦИЯ АНТИБАКТЕРИАЛЬНАЯ, ШТАММ БАКТЕРИОФАГА Escherichia coli, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ. | 2012 |
|
RU2518303C2 |
| Штамм бактериофага Pseudomonas phage Ka1 для лечения и/или профилактики инфекционных заболеваний, вызываемых Pseudomonas aeruginosa | 2024 |
|
RU2831173C1 |
| Антибактериальная композиция на основе штаммов бактериофагов для профилактики или лечения сальмонеллеза и/или эшерихиоза сельскохозяйственных животных или птиц, или человека | 2019 |
|
RU2705302C1 |
| ВИДОСПЕЦИФИЧЕСКИЙ ВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИОФАГА, ОБЛАДАЮЩИЙ ЛИТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ Staphylococcus aureus, ВКЛЮЧАЯ МУЛЬТИРЕЗИСТЕНТНЫЕ ШТАММЫ | 2012 |
|
RU2503716C1 |
| Штамм Clostridium sporogenes B-14642 - продуцент коллагеназы | 2024 |
|
RU2835110C1 |
| Штамм бактериофага Pseudomonas aeruginosa N 322 (500316), предназначенный для приготовления моно- и поливалентных лечебно-профилактических препаратов бактериофагов | 2019 |
|
RU2717973C1 |
| Штамм бактериофага Pseudomonas aeruginosa N 324 (500318), предназначенный для приготовления моно- и поливалентных лечебно-профилактических препаратов бактериофагов | 2019 |
|
RU2717972C1 |
| Штамм бактериофага Pseudomonas aeruginosa N 323 (500317), предназначенный для приготовления моно- и поливалентных лечебно-профилактических препаратов бактериофагов | 2019 |
|
RU2717451C1 |








































































































































































































Группа изобретений относится к биотехнологии. Предложена композиция антибактериальная для продления срока годности охлажденной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем. Композиция включает комбинацию стерильных, очищенных от токсинов фильтратов фаголизатов бактерий с литической активностью каждого из бактериофагов не ниже 108 БОЕ/см2 по Грациа в отношении наиболее часто выделяемых с поверхности охлажденной рыбы штаммов микроорганизмов. В состав композиции входит фильтрат фаголизата Aeromonas hydrophila, полученный с использованием штамма бактериофага Aeromonas hydrophila Ah 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-129; фильтрат фаголизата Pseudomonas fluorescens, полученный с использованием штамма бактериофага Pseudomonas fluorescens Pf 1, депонированного в «ГКПМ-Оболенск» под номером Ph-132; фильтрат фаголизата Raoultella ornithinolytica, полученный с использованием штамма бактериофага Raoultella ornithinolytica R.o. 1, депонированного в «ГКПМ-Оболенск» под номером Ph-128; фильтрат фаголизата Pseudomonas putida, полученный с использованием штамма бактериофага Pseudomonas putida Psp6, депонированного в «ГКПМ-Оболенск» под номером Ph-130; фильтрат фаголизата Citrobacter freundii, полученный с использованием штамма бактериофага Citrobacter freundii Cf 1, депонированного в «ГКПМ-Оболенск» под номером Ph-131; фильтрат фаголизата Listeria monocytogenes, полученный с использованием штамма бактериофага Listeria monocytogenes Lm 1, депонированного в «ГКПМ-Оболенск» под номером Ph-133. Предложены также соответствующие штаммы бактериофагов. Предложены также молекулы нуклеиновой кислоты, соответствующие геному указанных бактериофагов. 13 н.п. ф-лы, 1 ил., 11 табл., 11 пр.
1. Композиция антибактериальная для продления срока годности охлажденной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем, включающая комбинацию стерильных, очищенных от токсинов фильтратов фаголизатов бактерий, отличающаяся тем, что она обладает литической активностью не ниже 108 БОЕ/см2 по Грациа в отношении выделенных с поверхности охлажденной рыбы штаммов бактерий А. hydrophila, P. putida, P. fluorescens, R. ornithinolytica, С. freundii, L. monocytogenes и включает фильтрат фаголизата Aeromonas hydrophila, полученный с использованием штамма бактериофага Aeromonas hydrophila Ah 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-129; фильтрат фаголизата Pseudomonas fluorescens, полученный с использованием штамма бактериофага Pseudomonas fluorescens Pf 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-132; фильтрат фаголизата Raoultella ornithinolytica, полученный с использованием штамма бактериофага Raoultella ornithinolytica R.o. 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-128; фильтрат фаголизата Pseudomonas putida, полученный с использованием штамма бактериофага Pseudomonas putida Psp6, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-130; фильтрат фаголизата Citrobacter freundii, полученный с использованием штамма бактериофага Citrobacter freundii Cf 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-131; фильтрат фаголизата Listeria monocytogenes, полученный с использованием штамма бактериофага Listeria monocytogenes Lm 1, депонированного в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-133.
2. Штамм бактериофага Aeromonas hydrophila Ah 1, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-129.
3. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.2, представленному SEQ ID NO: 1.
4. Штамм бактериофага Pseudomonas fluorescens Pf 1, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-132.
5. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.4, представленному SEQ ID NO: 2.
6. Штамм бактериофага Raoultella ornithinolytica R.o. 1, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-128.
7. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.6, представленному SEQ ID NO: 3.
8. Штамм бактериофага Pseudomonas putida Psp6, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-130.
9. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.8, представленному SEQ ID NO: 4.
10. Штамм бактериофага Citrobacter freundii Cf 1, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-131.
11. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.10, представленному SEQ ID NO: 5.
12. Штамм бактериофага Listeria monocytogenes Lm 1, используемый для получения композиции антибактериальной по п.1, депонированный в «ГКПМ-Оболенск» (Государственной коллекции патогенных микроорганизмов и клеточных культур Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) под номером Ph-133.
13. Молекула нуклеиновой кислоты, соответствующая геному бактериофага по п.12, представленному SEQ ID NO: 6.
| Электрический котел | 1926 |
|
SU7099A1 |
| База данных EMBL-EBI, ЕМ_РН: КХ452695, 18.07.2016 | |||
| База данных EMBL-EBI, ЕМ_РН: КТ887558, 21.01.2016 | |||
| База данных EMBL-EBI, ЕМ_РН: КТ001915б 24.08.2015 | |||
| База данных EMBL-EBI, ЕМ_РН:KJ101592, 12.02.2014 | |||
| Чашечка для зубного цемента | 1925 |
|
SU4855A1 |
| АЛЕШКИН А.В | |||
| и др | |||
| Биодеконтаминация и продление сроков годности мясных и рыбных полуфабрикатов с помощью бактериофагов // Астраханский медицинский журнал, 2015, том 10, номер 4, с | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| КОМПОЗИЦИЯ АНТИБАКТЕРИАЛЬНАЯ, ШТАММ БАКТЕРИОФАГА Escherichia coli, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ТАКОЙ КОМПОЗИЦИИ. | 2012 |
|
RU2518303C2 |
| КОМПОЗИЦИЯ НА ОСНОВЕ БАКТЕРИОФАГА (ВАРИАНТЫ) | 2007 |
|
RU2366437C2 |
Авторы
Даты
2018-02-13—Публикация
2016-12-23—Подача