Ссылка на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.C. §119(е) предварительной заявки на выдачу патента США №61/611950, поданной 16 марта 2012 г., и предварительной заявки на выдачу патента США №61/736930, поданной 13 декабря 2012 г., полное содержание обеих включено в настоящий документ посредством ссылки.
Область техники, к которой относится настоящее изобретение
Предусмотрено генетически модифицированное отличное от человека животное (например, грызун, например, мышь или крыса), которое экспрессирует антитела, способные связываться с антигеном зависимым от pH образом. Предусмотрен способ получения модификаций вариабельной области легкой цепи иммуноглобулина отличного от человека животного, причем модификации включают в себя мутагенез остатков в гене вариабельной области легкой цепи, например, нуклеотидов, которые кодируют одну или несколько аминокислот в определяющей комплементарность области (CDR), для облегчения in vivo экспрессии антител, содержащих домены легкой цепи, которые проявляют зависимое от pH связывание с антигенами. Также предусмотрены способы получения антител с зависимым от pH связыванием антигена.
Предшествующий уровень техники настоящего изобретения
Антитела, как правило, содержат гомодимерный компонент тяжелой цепи, причем каждый мономер тяжелой цепи связан с идентичной легкой цепью. Антитела, содержащие гетеродимерный компонент тяжелой цепи (например, биспецифические антитела), желательны в качестве терапевтических антител. Но получение биспецифических антител, содержащих подходящий компонент легкой цепи, который может удовлетворительно ассоциировать с каждой из тяжелых цепей биспецифического антитела, оказалось проблематичным.
Согласно одному подходу легкая цепь может быть выбрана с помощью обзора статистики использования всех вариабельных доменов легкой цепи, идентифицирующего наиболее часто используемую легкую цепь в антителах человека и образующего пару этой легкой цепи in vitro с двумя тяжелыми цепями различной специфичности.
Согласно другому подходу легкая цепь может быть выбрана в результате наблюдения последовательностей легкой цепи в библиотеке фагового дисплея (например, библиотека фагового дисплея, содержащая последовательности вариабельной области легкой цепи человека, например, библиотека scFv человека) и выбора наиболее широко используемой вариабельной области легкой цепи из библиотеки. Легкая цепь может быть исследована на двух разных представляющих интерес тяжелых цепях.
Согласно другому подходу легкая цепь может быть выбрана путем анализа библиотеки фагового дисплея вариабельных последовательностей легкой цепи с использованием вариабельных последовательностей тяжелой цепи обеих представляющих интерес тяжелых цепей в качестве зондов. Легкая цепь, которая ассоциирует с обеими вариабельными последовательностями тяжелой цепи, может быть выбрана в качестве легкой цепи для тяжелых цепей.
Согласно другому подходу кандидатная легкая цепь может быть выровнена с родственными тяжелым цепям легкими цепями, и модификации в легкой цепи получают для более близкого соответствия характеристик последовательностей, общих для родственных легких цепей обеих тяжелых цепей. Если шансы иммуногенности должны быть сведены к минимуму, модификации предпочтительно приводят к последовательностям, которые присутствуют в известных последовательностях легкой цепи человека, таким образом, что протеолитический процессинг вряд ли будет производить эпитоп Т-клеток, основанный на параметрах и способах, известных в настоящей области техники для оценки вероятности иммуногенности (т.е., in silico, а также в мокрых анализах).
Все вышеперечисленные подходы основываются на способах in vitro, которые включают в себя ряд априорных ограничений, например, идентичность последовательности, способность ассоциировать со специфичными предварительно выбранными тяжелыми цепями и т.д. Существует необходимость в настоящей области техники в композициях и способах, которые не основываются на манипулировании условиями in vitro, но которые вместо этого применяют более биологически чувствительные подходы к созданию эпитопсвязывающих белков человека, которые включают общую легкую цепь.
Кроме того, терапевтические антитела, например, биспецифические терапевтические антитела, характеризуются некоторыми ограничениями в том, что они часто требуют высоких доз для достижения желаемой эффективности. Отчасти это связано с тем фактом, что комплексы антитело-антиген поглощаются в эндосомы, и нацеливаются на лизосомальную деградацию в процессе, называемом мишень-опосредованный клиренс. Таким образом, существует необходимость в настоящей области техники в способах и композициях, которые приводят к более эффективной рециркуляции антител, например, рециркуляции биспецифических антител, и предупреждают деградацию антител путем способствования диссоциации комплексов антитело-антиген в эндосомальном компартменте без снижения специфичности и аффинности антитела к антигену.
Краткое раскрытие настоящего изобретения
Согласно одному аспекту предусмотрена биологическая система для получения антитела или вариабельного домена антитела, который связывается с антигеном-мишенью при нейтральном значении pH, но проявляет сниженное связывание с тем же антигеном при кислом значении pH (например, pH 5,0-6,0). Биологическая система содержит отличное от человека животное, например, грызуна (например, мышь или крысу), которое содержит реаранжированную последовательность легкой цепи (например, реаранжированные V-J), которая содержит одну или несколько модификаций гистидина. Согласно различным аспектам одна или несколько модификаций гистидина находятся в кодоне CDR3 легкой цепи. Согласно различным аспектам отличное от человека животное содержит человеческий или гуманизированный локус тяжелой цепи иммуноглобулина. Согласно различным аспектам отличное от человека животное содержит замещение эндогенных вариабельных генных сегментов отличной от человеческой тяжелой цепи одним или несколькими сегментами VH, DH и JH тяжелой цепи человека, причем человеческие сегменты функционально связаны с отличной от человеческой константной областью иммуноглобулина. Согласно различным аспектам предусмотрены отличные от человека животные с универсальными легкими цепями, содержащими вариабельные домены легкой цепи с заменами негистидиновых остатков на остатки гистидина. Согласно различным аспектам эти отличные от человека животные с универсальными легкими цепями с модификациями гистидинов (например, грызуны, например, мыши) относятся к мышам с гистидин-универсальной легкой цепью, гистидин-ULC мышам или HULC мышам.
Таким образом, согласно одному аспекту в настоящем документе предусмотрено генетически модифицированное отличное от человека животное, которое содержит в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области иммуноглобулина человека функционально связана с генной последовательностью константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления генная последовательность константной области легкой цепи иммуноглобулина представляет собой отличную от человеческой генную последовательность константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления отличная от человеческой генная последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления отличное от человека животное не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина находится в эндогенном отличном от человеческого локусе легкой цепи иммуноглобулина.
Согласно одному варианту осуществления животное дополнительно содержит в своей зародышевой линии локус тяжелой цепи иммуноглобулина, который содержит нереаранжированную генную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой отличную от человеческой генную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления отличная от человеческой генная последовательность константной области тяжелой цепи представляет собой эндогенную генную последовательность константной области тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления локус тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR). Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей CDR3. Согласно одному варианту осуществления замена представляет собой замену одного, двух, трех, четырех или более кодонов CDR3. Согласно одному аспекту единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, находящаяся в локусе легкой цепи иммуноглобулина, происходит из генного сегмента Vκ1-39 или Vκ3-20 человека. Согласно одному варианту единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5, и генная последовательность Vκ1-39/Jκ5 содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ3-20/Jκ1, и генная последовательность Vκ3-20/Jκ1 содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации.
Согласно одному аспекту описанное в настоящем документе отличное от человека животное содержит популяцию В-клеток в ответ на представляющий интерес антиген, которая обогащена антителами, которые проявляют снижение диссоциационного периода полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления снижение t1/2 при кислом значении pH, по сравнению с нейтральным значением pH, происходит приблизительно в 30 или более раз.
Согласно одному варианту осуществления животное экспрессирует антитело, содержащее вариабельный домен легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового остатка на остаток гистидина в аминокислотном положении, кодируемом по меньшей мере одним кодоном, замененным в генной последовательности вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления животное экспрессирует антитело, которое сохраняет замену по меньшей мере одного негистидинового остатка на остаток гистидина в экспрессированном вариабельном домене легкой цепи иммуноглобулина человека, несмотря на соматические гипермутации.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее. Согласно одному варианту осуществления млекопитающее представляет собой грызуна, например, крысу или мышь. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь. Таким образом, согласно одному аспекту в настоящем документе предусмотрена генетически модифицированная мышь, содержащая в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления мышь не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина.
Согласно одному варианту осуществления единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина в зародышевой линии мыши функционально связана с генной последовательностью константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления генную последовательность константной области легкой цепи иммуноглобулина выбирают из генной последовательности константной области легкой цепи иммуноглобулина крысы или мыши. Согласно одному варианту осуществления генная последовательность константной области легкой цепи иммуноглобулина представляет собой последовательность мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина находится в эндогенном локусе легкой цепи иммуноглобулина мыши.
Согласно дополнительному варианту осуществления мышь также содержит в своей зародышевой линии локус тяжелой цепи иммуноглобулина, который содержит переаранжированную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина. Согласно одному аспекту генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой генную последовательность константной области тяжелой цепи крысы или мыши. Согласно одному варианту осуществления генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой последовательность мыши. Согласно одному варианту осуществления локус тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина мыши.
Согласно одному аспекту мышь содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем замена происходит в нуклеотидной последовательности, кодирующей CDR. Согласно одному варианту осуществления замена происходит в ко доне CDR3, например в одном, двух, трех, четырех или более кодонах CDR3. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, полученную из генного сегмента Vκ1-39 или Vκ3-20 человека, например единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ1-39/Jκ5, и генная последовательность Vκ1-39/Jκ5 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанное для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 105, 106, 108 и 111. Согласно другому варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 106, 108 и 111.
Согласно другому варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ3-20/Jκ1, и последовательность Vκ3-20/Jκ1 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанное для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 105, 106, 107 и 109 Согласно другому варианту осуществления такое замещение разрабатывается для замены гистидинов в положениях 105, 106 и 109.
Согласно одному варианту осуществления описанная в настоящем документе мышь содержит популяцию В-клеток в ответ на представляющий интерес антиген, которая обогащена антителами, которые проявляют сниженный диссоциационный период полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления уменьшение t1/2 при кислом значении pH, по сравнению с нейтральным значением pH, происходит приблизительно в 30 или более раз.
Согласно одному варианту осуществления описанная в настоящем документе мышь экспрессирует популяцию антигенспецифических антител в ответ на представляющий интерес антиген, причем все антитела содержат (a) вариабельные домены легкой цепи иммуноглобулина, полученные из той же единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и (b) вариабельные домены тяжелой цепи иммуноглобулина, полученные из репертуара сегментов V, D и J тяжелой цепи человека.
Также в настоящем документе предусмотрен отличный от человеческого локус, например, локус мыши, содержащий единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления локус содержится в зародышевой линии отличного от человека животного. Согласно одному варианту осуществления локус содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, полученную из генных сегментов Vκ1-39 или Vκ3-20 человека, например, полученную из реаранжированных генных последовательностей Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления, при котором присутствующая в локусе единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной последовательности Vκ1-39/Jκ5, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления, при котором присутствующая в локусе единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной последовательности Vκ3-20/Jκ1, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно различным вариантам осуществления описанные в настоящем документе отличные от человеческих локусы могут быть получены с использованием описанных ниже способов для получения генетически модифицированного отличного от человека животного.
Согласно еще одному аспекту в настоящем документе предусмотрен способ получения отличного от человека животного, которое содержит генетически модифицированный локус легкой цепи иммуноглобулина в своей зародышевой линии, причем способ предусматривает модификацию генома отличного от человека животного для удаления или приведения в нефункциональное состояние эндогенных сегментов V и J легкой цепи иммуноглобулина в локусе легкой цепи иммуноглобулина, и размещение в геноме единственной реанаржированной генной последовательности вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления такой способ приводит к генетически модифицированному отличному от человека животному, которое содержит популяцию В-клеток, обогащенных антителами, обладающими зависимым от pH связыванием с представляющим интерес антигеном. Согласно одному варианту осуществления размещенная в геноме единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из генной последовательности Vκ1-39 или Vκ3-20, например, реаранжированной Vκ1-39/Jκ5 или Vκ3-20/Jκ1 человека. Таким образом, согласно варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной Vκ1-39/Jκ5, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, при котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной Vκ3-20/Jκ1, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105,106, 107, 109 и их комбинации.
Согласно другому аспекту в настоящем документе предусмотрен способ получения антитела, которое проявляет зависимое от pH связывание с представляющим интерес антигеном, предусматривающий (a) получение описанной в настоящем документе мыши (например, мыши, которая содержит в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL, и замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в своей реаранжированной последовательности вариабельной области легкой цепи), (b) иммунизацию мыши представляющим интерес антигеном и (c) отбор антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью при нейтральном значении pH, при этом демонстрируя сниженное связывание с антигеном при кислом значении pH. Согласно одному варианту осуществления способ приводит к получению антитела, которое проявляет t1/2 при кислом значении pH и 37°C, составляющее приблизительно 2 минуты или менее. Согласно одному варианту осуществления способ приводит к получению антитела, которое проявляет снижение в диссоциационном периоде полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH, по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз.
Согласно другим аспектам в настоящем документе предусмотрены дополнительные способы получения антитела, которое проявляет зависимое от pH связывание с представляющим интерес антигеном. Один из таких способов предусматривает: (a) выбор первого антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (b) модификацию нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела для получения замены по меньшей мере одного негистидинового кодона на гистидиновый кодон, (c) экспрессию тяжелой цепи иммуноглобулина первого антитела и модифицированной легкой цепи иммуноглобулина в клетке и (d) выбор второго антитела, экспрессируемого в клетке, которое сохраняет требуемую аффинность к представляющему интерес антигену при нейтральном значении pH и отображает сниженное связывание с представляющим интерес антигеном при кислом значении pH. Согласно одному варианту осуществления нуклеотидная последовательность легкой цепи иммуноглобулина первого антитела содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека. Согласно одному варианту осуществления первое антитело получают от отличного от человека животного, например, мыши, содержащего последовательность легкой цепи иммуноглобулина, полученную из единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека, и модификацию легкой цепи иммуноглобулина выполняют в единственной реаранжированной последовательности вариабельной области иммуноглобулина человека. Согласно одному варианту осуществления первое антитело получают от отличного от человека животного, например, мыши, дополнительно содержащего последовательность тяжелой цепи иммуноглобулина, полученную из репертуара сегментов VH, DH и JH человека. Согласно одному варианту осуществления единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека выбирают из генной последовательности Vκ1-39/Jκ5 и Vκ3-20/Jκ1. Согласно одному варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека представляет собой Vκ1-39/Jκ5, модификацию в нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела выполняют в кодоне CDR3 в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека представляет собой Vκ3-20/Jκ1, модификацию в нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела выполняют в кодоне CDR3 в положении, выбранном из 105, 106, 107, 109 и их комбинации.
Согласно одному варианту осуществления способ получения антитела, которое проявляет зависимое от pH связывание с описанным в настоящем документе представляющим интерес антигеном приводит к антителу, которое проявляет снижение в диссоциационном периоде полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH, по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления способ получения антител приводит к антителу, которое проявляет t1/2 при кислом значении pH и 37°C, равное приблизительно 2 минуты или менее.
Описанные в настоящем документе любые из вариантов осуществления и аспектов могут быть использованы в сочетании друг с другом, если не указано иное или не очевидно из контекста. Другие варианты осуществления будут очевидны специалистам в настоящей области техники при рассмотрении последующего описания.
Краткое описание графических материалов
На фиг. 1 показано аминокислотное выравнивание полученных из Vκ1-39 легких цепей человека из различных антигенспецифических антител (антитела А-К). Гистидиновые (Н) остатки, расположенные в каждой последовательности легкой цепи, выделены жирным шрифтом. Различные области легкой цепи (каркасная область и CDR) указаны выше выравнивания.
На фиг.2 показаны комбинации и расположение остатков гистидина, встроенных в области CDR3 человека полученных из Vκ1-39 легких цепей с помощью мутагенеза. Включены соответствующие последовательности нуклеиновых кислот. Гистидиновые остатки введены путем мутагенеза, и соответствующие остатки нуклеиновых кислот выделены жирным шрифтом. Аминокислотные позиции (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно найти на www.imgt.org.
На фиг. 3 показан уровень экспрессии антитела в нг/мл, обнаруженный в супернатантах клеток СНО, трансфицированных с нуклеиновыми кислотами, кодирующими пять (1-5) различных тяжелых цепей и полученными из Vκ1-39 легкими цепями, содержащими остатки гистидина, встроенные в указанных местах (смотрите ось Y) в CDR3.
Фиг. 4 представляет собой вестерн-блот, показывающий экспрессию отдельных антигенспецифических антител человека, содержащих легкие цепи со встроенным гистидином, в клеточных супернатантах СНО.
На фиг. 5А-5Е показаны кинетики связывания для определенных тяжелых цепей (1-5) из антигенспецифических антител, спаренных с различными легкими цепями со встроенным гистидином при нейтральном (7,4) и кислом (5,75) значениях pH. Показаны различные кинетические параметры, включающие в себя ka, kd, KD и t1/2. NB = нет связывания.
На фиг. 6 показаны кинетические параметры (KD и t1/2) для антител, содержащих исходную универсальную легкую цепь или универсальную легкую цепь с модификациями гистидина, спаренную с указанными тяжелыми цепями (2, 3 и 6). Гистидиновые замены приводят к сильной зависимости от pH в нескольких антителах. Гистидиновые замены были сделаны в CDR3, чтобы преобразовать последовательность 105QQSYSTP111 (SEQ ID NO: 3) в 105HHSYSTH111 (SEQ ID NO: 5). Обратите внимание, что NB = не обнаружено связывания (KD>10 мкмоль).
На фиг. 7 показаны последовательность и свойства (% содержания GC, N, % ошибочно спаренных оснований, Tm) выбранных праймеров мутагенеза, используемых для встраивания остатков гистидина в CDR3 реаранжированной последовательности легкой цепи Vκ1-39/Jκ5 человека. SEQ ID NO для этих праймеров, используемые в списке последовательностей, включены в приведенной ниже таблице. F = прямой праймер, R = обратный праймер.
На фиг. 8А-8В показана общая стратегия конструирования нацеливающих векторов для встраивания остатков гистидина в реаранжированную последовательность вариабельной области легкой цепи человека, полученной из вариабельной области Vκ1-39/Jκ5 для получения генетически модифицированной мыши, которая экспрессирует антитела, содержащие модифицированную легкую цепь человека. На фиг. 8C-8D показано введение нацеливающего вектора для замен ULC-Н105/106/108/111 в ES клетки и получения с ними гетерозиготных мышей; в то время как на фиг. 8E-8F показано введение нацеливающего вектора для замен ULC-Н106/108/111 в клетки ES и получения с ними гетерозиготных мышей. Диаграммы представлены не в масштабе. Если не указано иное, заполненные формы и сплошные линии представляют последовательность мыши, пустые формы и двойные линии представляют последовательности человека.
На фиг. 9 показаны титры антисыворотки против иммуногена от мышей, гетерозиготных по гистидин-универсальной легкой цепи (HULC) (с 4 заменами гистидина - HULC 1927 мыши; с 3 заменами гистидина - HULC 1930 мыши) и животных дикого типа при вторичном заборе крови.
Фиг. 10 представляет собой сравнение количества всех антигенположительных клонов и количества антигенположительных клонов, проявляющих чувствительное к pH связывание антигенов, полученные из гибридомных слияний из гетерозиготных HULC (1927 против 1930) и мышей дикого типа. На фигуре приведены данные для двух мышей для каждого типа мыши (ʺмышь 1ʺ и ʺмышь 2ʺ).
На фиг. 11А-11С показаны сенсограммы экспериментов связывания с помощью поверхностного плазмонного резонанса, в которых моноклональным антителам (АА, ВВ, СС, DD, НН, GG, NN и OO) или от гетерозиготных HULC, или мышей дикого типа было позволено ассоциировать с иммуногеном при нейтральном значении pH (pH 7,4) с последующим переходом в буфер с pH 7,4 или 6,0 на стадии диссоциации. Отдельные линии в каждом графике отражают реакции связывания при различных концентрациях соответствующих антител. Все эксперименты проводили при 25°C. Значения диссоциационного периода полувыведения (t1/2) отмечены над соответствующими сенсограммами, и кратность изменения t1/2 представлена справа от каждой сенсограммы. Антитела АА, ВВ, СС, DD, НН и GG были от гетерозиготных HULC 1927 мышей с использованием His-замещенной легкой цепи, NN - от гетерозиготной HULC 1927 мыши с использованием легкой цепи WT, и OO - от мыши WT (смотрите таблицу 4 для уточнения).
На фиг. 12 показаны положения остатков гистидина, встроенных в область CDR3 человека полученных из Vκ3-20 легких цепей с помощью мутагенеза. Гистидиновые остатки вводили путем мутагенеза, и соответствующие остатки нуклеиновых кислот выделены жирным шрифтом. Аминокислотные позиции (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно найти на www.imgt.org.
На фиг. 13 показаны последовательность и свойства (% содержания GC, N, % ошибочно спаренных оснований, Tm) выбранных праймеров мутагенеза, используемых для встраивания остатков гистидина в CDR3 реаранжированной последовательности легкой цепи Vκ3-20/Jκ1 человека. SEQ ID NO для этих праймеров, используемые в списке последовательностей, включены в приведенной ниже таблице. F = прямой праймер, R = обратный праймер.
На фиг. 14А-14В показана общая стратегия конструирования нацеливающих векторов для встраивания остатков гистидина в реаранжированную последовательность вариабельной области легкой цепи человека, полученной из вариабельной области легкой цепи Vκ3-20/Jκ1 для получения генетически модифицированной мыши, которая экспрессирует антитела, содержащие модифицированную легкую цепь человека. На фиг. 14С показано введение нацеливающего вектора для замен ULC-Q105H/Q106H/Y107H/S109H в ES клетки и получения с ними гетерозиготных мышей; в то время как на фиг. 14D показано введение нацеливающего вектора для замен ULC-Q105H/Q106H/S109H в клетки ES и получения с ними гетерозиготных мышей. Диаграммы представлены не в масштабе. Если не указано иное, заполненные формы и сплошные линии представляют последовательность мыши, пустые формы и двойные линии представляют последовательности человека.
Подробное описание настоящего изобретения
Определения
В настоящем изобретении предусмотрены генетически модифицированные отличные от человека животные (например, мыши, крысы, кролики, хомяки и т.д.), которые содержат в своем геноме, например, в своей зародышевой линии, нуклеотидную последовательность(и), кодирующую молекулы антител человека, которые проявляют зависимое от pH связывание антигена, например, нуклеотидную последовательность легкой цепи иммуноглобулина, содержащую реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина, кодирующую антитела, которые проявляют зависимое от pH связывание антигена; содержащие их эмбрионы, клетки и ткани; способы их получения; а также способы их применения. Если не указано иное, все используемые в настоящем документе термины и фразы включают в себя те значения, которыми характеризуются термины и фразы в настоящей области техники, если иное прямо не указано или не очевидно из контекста, в котором используется этот термин или фраза.
Используемый в настоящем документе термин ʺантителоʺ включает молекулы иммуноглобулина, содержащие четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельный домен тяжелой цепи и константную область тяжелой цепи (CH). Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельный домен легкой цепи и константную область легкой цепи (CL). Вариабельные домены тяжелой цепи и легкой цепи могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с областями, которые более консервативны, называемые каркасными областями (FR). Каждый вариабельный домен тяжелой и легкой цепи содержит три CDR и четыре FR, расположенные с аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращенно представлены в виде HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращенно представлены в виде LCDR1, LCDR2 и LCDR3). Термин ʺвысокая аффинностьʺ антитела относится к антителу, которое характеризуется KD по отношению к эпитопу-мишени равным приблизительно 10-9 M или ниже (например, приблизительно 1×10-9 М, 1×10-10 M, 1×10-11 M или приблизительно 1×10-12 M). Согласно одному варианту осуществления KD измеряется с помощью поверхностного плазмонного резонанса, например, BIACORE™; согласно другому варианту осуществления KD измеряется с помощью ELISA.
Термин ʺбиспецифические антителаʺ включает антитело, способное селективно связываться с двумя или более эпитопами. Биспецифические антитела, как правило, содержат две неидентичные тяжелые цепи, каждая из тяжелых цепей специфически связывается с различным эпитопом - или на двух различных молекулах (например, различные эпитопы на двух различных иммуногенах), или на той же молекуле (например, различные эпитопы на том же иммуногене). Если биспецифическое антитело способно селективно связываться с двумя различными эпитопами (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи к первому эпитопу будет, как правило, составлять по меньшей мере от одного до двух или трех, или четырех или более порядков ниже, чем аффинность первой тяжелой цепи ко второму эпитопу, и наоборот. Эпитопы, специфически связанные биспецифическим антителом, могут быть на той же самой или другой мишени (например, на том же или другом белке). Иллюстративные биспецифические антитела включают в себя те, у которых первая тяжелая цепь специфична к опухолевому антигену и вторая тяжелая цепь специфична к цитотоксическому маркеру, например, Fc-рецептору (например, FcγRI, FcγRII, FcγRIII и т.д.) или Т-клеточному маркеру (например, CD3, CD28 и т.д.). Кроме того, второй вариабельный домен тяжелой цепи может быть заменен вариабельным доменом тяжелой цепи, характеризующимся другой требуемой специфичностью. Например, биспецифические антитела с первой тяжелой цепью, специфичной к опухолевому антигену, и второй тяжелой цепью, специфичной к токсину, могут быть спарены для того, чтобы доставить токсин (например, сапорин, алкалоид барвинка и т.д.) к опухолевой клетке. Другие иллюстративные биспецифические антитела включают в себя те, у которых первая тяжелая цепь специфична к активирующему рецептору (например, В-клеточный рецептор, FcγRI, FcγRIIA, FcγRIIIA, FcαRI, Т-клеточный рецептор и т.д.) и вторая тяжелая цепь специфична к ингибирующему рецептору (например, FcγRIIB, CD5, CD22, CD72, CD300a и т.д.). Такие биспецифические антитела могут быть сконструированы для терапевтических условий, связанных с активацией клеток (например, аллергия и бронхиальная астма). Биспецифические антитела могут быть получены, например, путем объединения тяжелых цепей, которые распознают различные эпитопы одного и того же иммуногена. Например, последовательности нуклеиновых кислот, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного и того же иммуногена, могут быть слиты с последовательностями нуклеиновых кислот, кодирующими одинаковые или различные константные области тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело содержит две тяжелые цепи, каждая из которых содержит три CDR тяжелой цепи, с последующими (от N-конца к С-концу) доменом CH1, шарниром, доменом CH2 и доменом CH3, и легкую цепь иммуноглобулина, которая либо не придает эпитопсвязывающую специфичность, но которая может ассоциировать с каждой тяжелой цепью, либо которая может ассоциировать с каждой тяжелой цепью и которая может связываться с одним или несколькими эпитопами, связанными с эпитопсвязывающими областями тяжелой цепи, либо которая может ассоциировать с каждой тяжелой цепью и обеспечивать связывание одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин ʺклеткаʺ включает любую клетку, которая подходит для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают в себя прокариоты и эукариоты (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы E. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки отличных от человека животных, клетки человека или клеточные слияния, такие как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, обезьяны, хомячка, крысы или мыши. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую и ее выбирают из следующих клеток: СНО (например, СНО К1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почки (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, НВ 8065, HL-60, (например, ВНК21), Jurkat, Daudi, А431 (эпидермальные), CV-1, U937, 3Т3, клетки L, клетки С127, SP2/0, NS-0, ММТ 060562, клетки Сертоли, клетки BRL 3А, клетки НТ1080, клетки миеломы, клетки опухоли и полученной из вышеупомянутых клеток клеточной линии. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Термин ʺопределяющая комплементарность областьʺ или термин ʺCDRʺ включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулинов организма, которая, как правило, (то есть, у животного дикого типа) появляется между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или Т-клеточного рецептора). CDR могут кодироваться, например, с помощью последовательности зародышевой линии или реаранжированной или переаранжированной последовательности и, например, наивной или зрелой В-клеткой или Т-клеткой. CDR может быть соматически мутировавшей (например, отличаться от последовательности, закодированной в зародышевой линии животного), гуманизированной и/или модифицированной аминокислотными заменами, добавками или делениями. В некоторых обстоятельствах (например, для CDR3), CDR могут кодироваться двумя или более последовательностями (например, последовательностями зародышевой линии), которые не представляют собой смежные (например, в нереаранжированной последовательности нуклеиновой кислоты), но представляют собой смежные в последовательности нуклеиновой кислоты В-клеток, например, в результате сплайсинга или соединения последовательностей (например, V-D-J рекомбинация с образованием CDR3 тяжелой цепи).
Используемый для описания консервативной замены аминокислот термин ʺконсервативныеʺ включает замену аминокислотного остатка на другой аминокислотный остаток, содержащий боковую цепь группы R со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная замена аминокислот не будет существенно изменять функциональные свойства представляющего интерес белка, например, способность вариабельной области специфически связываться с эпитопом-мишенью с требуемой аффинностью. Примеры групп аминокислот, которые характеризуются наличием боковых цепей со сходными химическими свойствами, включают в себя такие алифатические боковые цепи, как глицин, аланин, валин, лейцин, изолейцин и такие алифатические-гидроксильные боковые цепи, как серии и треонин; такие содержащие амид боковые цепи, как аспарагин и глутамин; такие ароматические боковые цепи, как фенилаланин, тирозин и триптофан; такие основные боковые цепи, как лизин, аргинин, гистидин; и такие кислотные боковые цепи, как аспарагиновая кислота и глутаминовая кислота, и такие серосодержащие боковые цепи, как цистеин и метионин. Группы консервативных замен аминокислот включают в себя, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глутамин. Согласно некоторым вариантам осуществления консервативная замена аминокислот может представлять собой замену любого нативного остатка в белке аланином, что применяется, например, в сканирующем аланином мутагенезе. Согласно некоторым вариантам осуществления полученная консервативная замена характеризуется положительным значением в логарифмической функции правдоподобия матрицы РАМ250, раскрытой в Gonnet et al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256:1443-45, включенной в настоящий документ посредством ссылки. Согласно некоторым вариантам осуществления замена представляет собой умеренную консервативную замену, причем замена характеризуется неотрицательным значением в логарифмической функции правдоподобия матрицы РАМ250.
Согласно некоторым вариантам осуществления положения остатков в легкой цепи или тяжелой цепи иммуноглобулина отличаются одной или несколькими консервативными заменами аминокислот. Согласно некоторым вариантам осуществления положения остатков в легкой цепи иммуноглобулина или его функционального фрагмента (например, фрагмента, который обеспечивает экспрессию и секрецию из, например, В-клеток) не идентичны легкой цепи, чья аминокислотная последовательность перечислена в настоящем документе, но отличается одной или несколькими консервативными заменами аминокислот.
Термин ʺсвязывающий эпитоп белокʺ включает белок, который содержит по меньшей мере один CDR и который способен к избирательному распознаванию эпитопа, например, способен связываться с эпитопом с KD, составляющей приблизительно один мкмоль или меньше (например, KD, составляющей приблизительно 1×10-6 M, 1×10-7 M, 1×10-8 M, 1×10-9 M, 1×10-10 M, 1×10-11 M или приблизительно 1×10-12 M). Терапевтические связывающие эпитоп белки (например, терапевтические антитела) часто нуждаются в KD, которая находится в наномолярном или пикомолярном диапазоне.
Термин ʺфункциональный фрагментʺ включает фрагменты связывающих эпитопы белков, которые могут экспрессироваться, секретироваться и специфически связываться с эпитопом с KD в микромолярном, наномолярном или пикомолярном диапазоне. Специфическое распознавания включает в себя характеризующееся KD, которая находится по меньшей мере в микромолярном диапазоне, наномолярном диапазоне или пикомолярном диапазоне.
Термин ʺзародышевая линияʺ по отношению к последовательности нуклеиновой кислоты иммуноглобулина включает последовательность нуклеиновой кислоты, которая может быть передана потомству.
Термин ʺтяжелая цепьʺ или ʺтяжелая цепь иммуноглобулинаʺ включает последовательность тяжелой цепи иммуноглобулина, включающую в себя последовательности константной области тяжелой цепи иммуноглобулина из любого организма. Вариабельные домены тяжелой цепи включают в себя три CDR тяжелой цепи и четыре области FR, если не указано иное. Фрагменты тяжелых цепей включают в себя CDR, CDR и FR и их комбинации. Типичная тяжелая цепь содержит после вариабельного домена (от N-конца к С-концу) домен CH1, шарнир, домен CH2 и домен CH3. Функциональный фрагмент тяжелой цепи включает в себя фрагмент, который способен специфически распознавать эпитоп (например, распознавание эпитопа с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен экспрессировать и секретировать из клетки и который содержит по меньшей мере одну CDR. Вариабельный домен тяжелой цепи кодируется с генной последовательностью вариабельной области, которая, как правило, содержит сегменты VH, DH и JH, полученные из репертуара присутствующих в зародышевой линии сегментов VH, DH и JH. Последовательности, расположение и номенклатура для сегментов тяжелой цепи V, D и J для различных организмов можно найти в базе данных IMGT, www.imgt.org.
Используемый в отношении последовательности термин ʺидентичностьʺ включает идентичность, определенную с помощью ряда различных известных в настоящей области алгоритмов, которые могут быть использованы для измерения идентичности последовательности нуклеотидов и/или аминокислот. Согласно некоторым описанным в настоящем документе вариантам осуществления идентичности определяют с использованием выравнивания ClustalW v. 1.83 (медленно) с использованием открытого штрафного пробела 10,0, продленного штрафного пробела 0,1 и используя матрицу сходства Gonnet (MACVECTOR™ 10.0.2, MacVector Inc., 2008). Длина сравниваемых последовательностей по отношению к идентичности последовательностей будет зависеть от конкретных последовательностей, но в случае константного домена легкой цепи, длина должна содержать последовательность достаточной длины, чтобы сложиться в константный домен легкой цепи, который способен к самоассоциации для образования канонического константного домена легкой цепи, например, способен образовывать два бета-листа, содержащих бета-цепи, и способен взаимодействовать по меньшей мере с одним доменом CH1 человека или мыши. В случае домена CH1 длина последовательности должна содержать последовательность достаточной длины, чтобы сложиться в домен CH1, который способен образовывать два бета листа, содержащих бета-цепи, и способен взаимодействовать по меньшей мере с одним константным доменом легкой цепи мыши или человека.
Фраза ʺмолекула иммуноглобулинаʺ включает две тяжелые цепи иммуноглобулина и две легкие цепи иммуноглобулина. Тяжелые цепи могут быть одинаковыми или различными, и легкие цепи могут быть одинаковыми или различными.
Термин ʺлегкая цепьʺ включает последовательность легкой цепи иммуноглобулина от любого организма и, если не указано иное, включает в себя человеческие легкие цепи каппа и лямбда и VpreB, а также суррогатные легкие цепи. Вариабельные домены легкой цепи, как правило, включают в себя три CDR легкой цепи и четыре каркасные (FR) области, если не указано иное. Как правило, полноразмерная легкая цепь включает в себя от аминоконца к карбоксиконцу вариабельный домен, который включает в себя FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и константную область легкой цепи. Вариабельный домен легкой цепи кодируется генной последовательностью вариабельной области легкой цепи, которая, как правило, содержит сегменты VL и JL, полученные из репертуара присутствующих в зародышевой линии сегментов V и J. Последовательности, расположение и номенклатуру для сегментов V и J легкой цепи для различных организмов можно найти в базе данных IMGT, www.imgt.org. Легкие цепи включают в себя, например, те, которые не селективно связываются или с первым, или со вторым эпитопом, селективно связанным связывающим эпитоп белком, в котором они появляются. Легкие цепи также включают в себя те, которые связывают и распознают или помогают тяжелой цепи со связыванием и распознаванием одного или нескольких эпитопов, селективно связанных связывающим эпитоп белком, в котором они появляются. Общие или универсальные легкие цепи включают в себя те, которые получены из гена Vκ1-39Jκ5 человека или гена Vκ3-20Jκ1 человека, и включают в себя соматически мутировавшие (например, со зрелой аффинностью) версии их же.
Фраза ʺмикромолярный диапазонʺ означает 1-999 микромоль; фраза ʺнаномолярный диапазонʺ означает 1-999 наномоль; фраза ʺпикомолярный диапазонʺ означает 1-999 пикомоль.
Фраза ʺсоматически мутировавшийʺ включает отсылку к последовательности нуклеиновой кислоты из В-клетки, которая подверглась переключению класса, причем последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (например, нуклеотидная последовательность, кодирующая вариабельный домен тяжелой цепи или включающая в себя последовательности CDR или FR тяжелой цепи) в В-клетке, которая подверглась переключению класса, не идентична последовательности нуклеиновой кислоты в В-клетке до переключения класса, например, различие в последовательности нуклеиновой кислоты CDR или каркасной области между В-клеткой, которая не подверглась переключению класса, и В-клеткой, которая подверглась переключению класса. ʺСоматически мутировавшийʺ включает в себя отношение к последовательности нуклеиновых кислот от В-клеток с созревшей аффинностью, которые не идентичны соответствующим последовательностям вариабельных областей иммуноглобулина в В-клетках, которые не характеризуются созревшей аффинностью (т.е. последовательности в геноме клеток зародышевой линии). Фраза ʺсоматически мутировавшийʺ также включает в себя отношение к последовательности нуклеиновой кислоты вариабельной области иммуноглобулина из В-клетки после воздействия на В-клетку представляющего интерес эпитопа, причем последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты до воздействия на В-клетку представляющего интерес эпитопа. Фраза ʺсоматически мутировавшийʺ относится к последовательностям из антител, которые были получены от животного, например, мыши, содержащего последовательности нуклеиновых кислот вариабельных областей иммуноглобулина человека, в ответ на сенсибилизацию иммуногеном, и что представляет собой по своей сути результат процессов отбор, а действующих в таком животном.
Термин ʺнереаранжированныеʺ по отношению к последовательности нуклеиновой кислоты включает в себя последовательности нуклеиновых кислот, которые существуют в зародышевой линии клетки животного.
Термин ʺвариабельный доменʺ включает аминокислотную последовательность легкой или тяжелой цепи иммуноглобулина (модифицированной по желанию), которая содержит следующие аминокислотные области в последовательности от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин ʺфункционально связанныйʺ относится к связи, в которой функционально связанные компоненты функционируют предназначенным образом. В одном случае последовательность кодирующей белок нуклеиновой кислоты может быть функционально связана с регуляторными последовательностями (например, последовательностью промотора, энхансера, сайленсера и т.п.) с тем, чтобы сохранить необходимое регулирование транскрипции. В одном случае последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (или V(D)J сегменты) может быть функционально связана с последовательностью нуклеиновой кислоты константной области иммуноглобулина таким образом, чтобы обеспечить необходимую рекомбинацию между последовательностями в последовательности тяжелой или легкой цепи иммуноглобулина.
Термин ʺзамещениеʺ по отношению к замещению генов относится к размещению экзогенного генетический материала в эндогенном генетическом локусе, тем самым замещая все или часть эндогенного гена ортологичной или гомологичной последовательностью нуклеиновой кислоты.
Используемый в настоящем документе термин ʺфункциональныйʺ, например, по отношению к функциональному полипептиду, включает в себя полипептид, который сохраняет по меньшей мере одну биологическую активность, как правило, связанную с нативным белком. В другом случае функциональный генный сегмент иммуноглобулина может включать в себя вариабельный генный сегмент, который способен к продуктивной реаранжировке, чтобы производить реаранжированную генную последовательность иммуноглобулина.
ʺНейтральное значение pHʺ включает в себя значение pH от приблизительно 7,0 и до приблизительно 8,0, например, значение pH от приблизительно 7,0 и до приблизительно 7,4, например, от приблизительно 7,2 и до приблизительно 7,4, например, физиологическое значение pH. ʺКислое значение pHʺ включает в себя значение pH 6,0 и ниже, например, значение pH от приблизительно 5,0 и до приблизительно 6,0, pH от приблизительно 5,75 и до приблизительно 6,0, например, pH эндосомальных или лизосомальных компартментов.
Сконструированные остатки гистидина в генах легких цепей иммуноглобулина
Авторы настоящего изобретения обнаружили, что отличные от человека животные, которые экспрессируют антитела, способные связываться с антигеном зависимым от pH образом, могут быть получены путем модификации вариабельной области легкой цепи иммуноглобулина в одном или нескольких положениях вдоль последовательности легкой цепи. Описаны способы внесения модификаций в зародышевую линию отличного от человека животного таким образом, что животное будет экспрессировать гистидины в CDR антител. В частности, описаны способы получения модификаций в вариабельной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши. Последовательность вариабельной области, например, легких цепей, как правило, показывает соматическую гипермутацию вдоль последовательности вариабельной области, и, в некоторых случаях, такие мутации могут приводить к замене остатков гистидина (смотрите, например, фиг. 1). Такие мутации могут происходить даже в определяющих комплементарность областях (CDR), которые представляют собой области вариабельных доменов, ответственных за связывание антигена. В некоторых случаях такие мутации могут приводить к антителам, которые проявляют зависимое от pH связывание антигена, например, снижение связывания антигена при кислом значении pH, по сравнению со связыванием антигена при нейтральном значении pH. Такое зависимое от pH связывание антигена желательно, потому что это может позволить антителу связываться с антигеном за пределами клетки, и, после захвата в эндосомы, высвобождать антиген и возвращаться обратно на поверхность, чтобы связать другой антиген, избегая опосредованного мишенью клиренса. Были зарегистрированы подходы для введения остатков гистидина для достижения этого эффекта с использованием случайного сканирующего гистидином мутагенеза для конструирования зависимых от pH связывающих свойств в антителах к IL-6R (США 2011/0111406 A1). Тем не менее, случайный мутагенез остатков антитела может приводить к снижению аффинности антитела к антигену. Отличное от человека животное, генетически модифицированное, чтобы экспрессировать замену гистидина в последовательности антитела, делает возможным производство высокоаффинных антител в ответ на представляющий интерес антиген, благодаря модификации(ям) гистидина будет также показывать зависимое от pH связывание антигена.
Таким образом, согласно различным вариантах осуществления в настоящем документе предусмотрено генетически модифицированное отличное от человека животное (например, грызун, например, мышь или крыса), которое содержит в своем геноме, например, в своей зародышевой линии, последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую модификации, которые приводят к получению животного, экспрессирующего антитела, способные связываться с антигенами зависимым от pH образом. Согласно одному варианту осуществления отличное от человека животное содержит модификации в последовательности вариабельной области легкой цепи иммуноглобулина человека (например, последовательность сегмента VL и/или JL), которые содержат замены по меньшей мере одного негистидинового кодона на гистидиновый кодон (в некоторых случаях, также может упоминаться как ʺзамена гистидинаʺ, ʺзамена гистидинового кодонаʺ или тому подобное). Согласно одному варианту осуществления животное содержит по меньшей мере одну замену негистидинового кодона на гистидиновый кодон в нуклеотидной последовательности определяющей комплементарность области (CDR; например, CDR1, CDR2 и/или CDR3) легкой цепи иммуноглобулина человека. Согласно одному варианту осуществления замена происходит в кодоне CDR3. Согласно одному варианту осуществления легкая цепь представляет собой легкую цепь к. Согласно одному варианту осуществления животное экспрессирует легкую цепь иммуноглобулина, например, CDR легкой цепи, например, CDR3 легкой цепи, содержащую замену по меньшей мере одной аминокислоты на гистидин. Согласно другому варианту осуществления легкая цепь представляет собой легкую цепь λ. Согласно еще одному варианту осуществления мышь содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в обеих легких цепях κ и λ.
Остаток гистидина кодируется двумя различными кодонами, CAT и САС (остатки дезоксирибонуклеиновой кислоты). Таким образом, негистидиновый кодон может быть заменен CAT или САС. Замену встраивают в кодон, который в его конфигурации зародышевой линии (т.е. несоматически мутировавшем состоянии) не кодирует остаток гистидина.
Согласно одному варианту осуществления легкая цепь представляет собой универсальную легкую цепь (также называемую общей легкой цепью). Как описано в заявке на патент США №13/022759, 13/093156, 13/412936 и 13/488628 (опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, включенных в настоящий документ посредством ссылки), отличное от человека животное (например, мышь), которое выбирает общую легкую цепь для множества тяжелых цепей, характеризуется практической ценностью. Согласно различным вариантам осуществления антитела, экспрессируемые у отличного от человека животного, содержащего только общую легкую цепь, будут содержать тяжелые цепи, которые могут ассоциировать и экспрессировать с идентичной или по существу идентичной легкой цепью. Это особенно применимо при получении биспецифических антител. Например, такое животное может быть иммунизировано первым иммуногеном для производства В-клетки, которая экспрессирует антитело, которое специфически связывается с первым эпитопом. Животное (или генетически такое же животное) может быть иммунизировано вторым иммуногеном для производства В-клетки, которая экспрессирует антитело, которое специфически связывается со вторым эпитопом. Вариабельные области тяжелой цепи могут быть клонированы из В-клеток и экспрессированы с константной областью той же тяжелой цепи и той же легкой цепи (например, общая легкая цепь) в клетке, чтобы получить биспецифическое антитело, причем компонент тяжелой цепи биспецифического антитела был выбран животным, чтобы ассоциировать и экспрессировать с тем же компонентом легкой цепи. Согласно различным описанным вариантам осуществления вариабельные области генетически сконструированных мышей представляют собой вариабельные области человека.
Таким образом, была сконструирована мышь, которая способна производить легкие цепи иммуноглобулина, которые будут соответствующим образом образовывать пары с довольно разнообразным семейством тяжелых цепей, включающим в себя тяжелые цепи, чьи человеческие вариабельные области отклоняются от последовательностей зародышевой линии, например, с созревшей аффинностью или соматически мутировавшие вариабельные области. Согласно различным вариантам осуществления мышь разрабатывают для того, чтобы образовывать пары вариабельных доменов легкой цепи человека с вариабельными доменами тяжелой цепи человека, которые содержат соматические мутации, таким образом, делая возможным доступ к высокоаффинным связывающим белкам, пригодным для использования в качестве человеческих терапевтических средств.
Подвергнутая генной инженерии мышь через длительный и сложный процесс отбора антител в организме делает соответствующий биологический выбор в образовании пары разнообразной коллекции вариабельных доменов тяжелой цепи человека с ограниченным числом вариантов легкой цепи человека. Для того чтобы достичь этого, мышь конструируют так, чтобы представить ограниченное число вариантов вариабельных доменов легкой цепи человека в сочетании с широким разнообразием вариантов вариабельных доменов тяжелой цепи человека. После сенсибилизации иммуногеном мышь максимизирует число решений в своем репертуаре для получения антитела к иммуногену, ограничиваясь в основном или исключительно количеством или вариантами легкой цепи в своем репертуаре. Согласно различным вариантам осуществления это включает в себя возможность для мыши в достижении подходящих и совместимых соматических мутаций в вариабельном домене легкой цепи, которые будут, тем не менее, совместимы с относительно большим разнообразием вариабельных доменов тяжелой цепи человека, включающим в себя, в частности, соматически мутировавшие вариабельные домены тяжелой цепи человека.
Сконструированная мышь с общей легкой цепью, описанная в опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, содержала последовательность нуклеиновой кислоты, кодирующую ограниченный репертуар вариантов легкой цепи, например, общую или универсальную легкую цепь ʺULCʺ, которая содержал не более двух сегментов VL или единственную реаранжированную последовательности вариабельной области легкой цепи иммуноглобулина человека. Для достижения такого ограниченного репертуара мышь конструировали для того, чтобы привести в нефункциональное или по существу в нефункциональное состояние свою способность создавать или реаранжировать нативный вариабельный домен легкой цепи мыши. Согласно одному аспекту это было достигнуто, например, путем удаления генных сегментов вариабельной области легкой цепи мыши. Как описано ранее, эндогенный локус мыши может быть затем модифицирован с помощью выбранных экзогенных подходящих генных сегментов вариабельной области легкой цепи человека, функционально связанных с эндогенным константным доменом легкой цепи мыши, таким образом, чтобы экзогенные генные сегменты вариабельной области человека можно было комбинировать с эндогенным геном константной области легкой цепи мыши и образовывать реаранжированный обратный химерный ген легкой цепи (человеческий вариабельный, мышиный константный). Согласно различным вариантам осуществления вариабельная область легкой цепи может быть соматически мутировавшей. Согласно различным вариантам осуществления для того, чтобы максимизировать способность вариабельной области легкой цепи приобретать соматические мутации, соответствующий энхансер(ы) сохраняется в мыши. Согласно одному аспекту в модификации локуса легкой цепи κ мыши для замены эндогенных генных сегментов легкой цепи κ мыши генными сегментами легкой цепи κ человека, функционально поддерживаются или не разрушаются интронный энхансер к мыши и 3' энхансер.
Таким образом, предусмотрена подвергнутая генной инженерии мышь, которая экспрессирует ограниченный репертуар обратных химерных (человеческая вариабельная, мышиная константная) легких цепей, ассоциированных с разнообразием обратных химерных (человеческая вариабельная, мышиная константная) тяжелых цепей. Согласно различным вариантам осуществления эндогенные генные сегменты легкой цепи κ мыши удаляют и заменяют одной (или двумя) реаранжированной областью легкой цепи человека, функционально связанной с эндогенным геном Сκ мыши. Согласно вариантам осуществления для максимизации соматической гипермутации реаранжированной области легкой цепи человека, поддерживаются интронный энхансер κ мыши и 3' энхансер мыши. Согласно различным вариантам осуществления мышь также содержит нефункциональный локус легкой цепи λ или его делецию, или делецию, которая приводит локус в состояние не возможности производить легкую цепь λ.
Мышь с универсальной легкой цепью производила антитела в ответ на различные антигены, которые были способны использовать разнообразный репертуар последовательностей вариабельных областей тяжелых цепей, содержащих разнообразный репертуар сегментов VH, DH и JH. Антитела, произведенные такой подвергнутой генной инженерии ULC мышью, применимы для разработки биспецифических терапевтических антител; однако, как с любым другим антителом, каждое биспецифическое антитело может связываться только с одной мишенью во время его жизни в плазме; антитело поглощается эндосомой и нацеливается на лизосомальную деградацию. Исследования показали, что FcRn рецептор Fcγ подобный МНС класса I способен спасти иммуноглобулины от лизосомальной деградации путем рециркулирования его обратно к клеточной поверхности из сортирующей эндосомы. Simister and Mostov (1989) An Fc receptor structurally related to MHC class I antigens. Nature 337: 184-87. Как описано выше, для повышения эффективности рециркулирования антител полезны дополнительные модификации последовательностей антител, например, модификации, которые приводят к снижению связывания антигена при кислом значении pH (например, pH эндосомы), при этом сохраняя аффинность и специфичность антиген-антитела при нейтральном значении pH (например, физиологическом значение pH). Описанные в настоящем документе отличные от человека животные, у которых остатки гистидина заменяют негистидиновые остатки в последовательности универсальной легкой цепи, полезны, так как они способны производить высокоаффинные антитела, основанные на формате универсальной легкой цепи, которые также отражать зависимое от pH связывание, например, отражают сниженное связывание с антигеном при кислом значении pH против нейтрального значения pH.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрено отличное от человека животное (например, грызун, например, мышь или крыса), которое содержит в своем геноме, например, в своей зародышевой линии, ограниченный репертуар вариабельных областей легких цепей человека или единственную вариабельную область легкой цепи человека из ограниченного репертуара вариабельных генных сегментов легкой цепи человека, причем вариабельная область(и) легкой цепи человека содержит по меньшей мере одну замену негистидинового кодона на гистидиновый кодон. Согласно некоторым вариантам осуществления предусмотрены отличные от человека животные, которые подвергнуты генной инженерии, чтобы включить в себя единственный нереаранжированный генный сегмент вариабельной области легкой цепи человека (или два генных сегмента вариабельной области легкой цепи человека), который реаранжирует для того, чтобы образовать реаранжированный ген вариабельной области легкой цепи человека (или два реаранжированных гена вариабельной области легкой цепи), который экспрессирует единственную легкую цепь (или которые экспрессируют одну или обе из двух легких цепей), причем ген(ы) вариабельной области легкой цепи содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Реаранжированные вариабельные домены легкой цепи человека, кодируемые этим гистидин-замененным геном(ами) вариабельной области легкой цепи способны образовывать пару с множеством тяжелых цепей человека с созревшей аффинностью, выбранных с помощью животных, причем вариабельные области тяжелой цепи специфически связываются с различными эпитопами. Согласно различным вариантам осуществления по меньшей мере одна замена негистидинового остатка на остаток гистидина приводит к реаранжированной легкой цепи человека, которая, при экспрессии с родственной тяжелой цепью, связывается со своим антигеном зависимым от pH образом.
Предусмотрены подвергнутые генной инженерии животные, которые экспрессируют ограниченный репертуар вариабельных доменов легкой цепи человека или единственный вариабельный домен легкой цепи человека из ограниченного репертуара генных последовательностей вариабельной области легкой цепи человека, причем генные последовательности вариабельной области содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон. Согласно некоторым вариантам осуществления предусмотрены животные, которых подвергли генной инженерии, чтобы включить единственную V/J последовательность легкой цепи человека (или две последовательности V/J), которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон и экспрессирует вариабельную область единственной легкой цепи (или которые экспрессируют одну или обе из двух вариабельных областей). Согласно одному аспекту содержащая вариабельную последовательность легкая цепь способна образовывать пару с множеством тяжелых цепей человека с созревшей аффинностью, клонально выбранных с помощью животного, причем вариабельные области тяжелой цепи специфически связываются с различными эпитопами. Согласно одному варианту осуществления антитело связывается со своим антигеном(ами) зависимым от pH образом. Согласно одному варианту осуществления единственную V/J последовательность легкой цепи человека выбирают из Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления две последовательности V/J представляют собой Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1 представляют собой реаранжированные последовательности V/J.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, которое содержит единственный генный сегмент VL легкой цепи иммуноглобулина человека, который способен к реаранжировке с генным сегментом JL человека (выбранного из одного или множества сегментов JL) и кодированию вариабельного домена человека легкой цепи иммуноглобулина, причем единственный генный сегмент VL легкой цепи иммуноглобулина человека и/или генный сегмент JL человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно другому аспекту предусмотрена генетически модифицированная мышь, которая содержит не более двух генных сегментов VL человека, каждый из которых способен к реаранжировке с генным сегментом JL человека (выбранным из одного или множества сегментов JL) и кодированию вариабельного домена человека легкой цепи иммуноглобулина, причем каждый из не более двух генных сегментов VL и/или генный сегмент JL содержат замену по меньшей мере одного негистидинового остатка на гистидиновый остаток.
Кроме того, в настоящем документе предусмотрено генетически модифицированное отличное от человека животное, которое содержит в своем геноме, например, в своей зародышевой линии, единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности VL и JL человека, причем единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному аспекту единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из генных последовательностей VL и JL зародышевой линии человека, но для гистидиновой замены(замен). Согласно одному варианту осуществления легкая цепь иммуноглобулина человека представляет собой цепь κ иммуноглобулина человека. Таким образом, согласно одному варианту осуществления генную последовательность VL человека выбирают из Vκ1-39 и Vκ3-20. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит реаранжированную последовательность Vκ1-39/J или Vκ3-20/J. Согласно одному варианту осуществления генную последовательность JL человека выбирают из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5. Согласно одному варианту осуществления последовательность JL человека выбирают из Jκ1 и Jκ5. Согласно одному варианту осуществления единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека выбирают из Vκ1-39Jκ5 и Vκ3-20Jκ1 (например, но до гистидиновой замены(-)). Согласно альтернативному варианту легкая цепь иммуноглобулина человека представляет собой цепь λ человека.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR) вариабельного домена легкой цепи. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей CDR1, CDR2 или CDR3 вариабельного домена легкой цепи. Согласно одному конкретному варианту осуществления замена происходит в кодирующей CDR3 нуклеотидной последовательности.
Согласно одному аспекту замена представляет собой замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в кодоне CDR3 генной последовательности вариабельной области легкой цепи человека. Согласно одному варианту осуществления замена представляет собой замену одного, двух, трех, четырех или более кодонов CDR3. Согласно варианту осуществления, в котором единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека представляет собой вариабельную область Vκ1-39Jκ5, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон содержит замещение в положении в генной последовательности легкой цепи иммуноглобулина, кодирующей CDR3, разработанное для экспрессии гистидинов в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидинов в положениях 105 и 111 Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидинов в положениях 105 и 108. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106 и 108 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106 и 108. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106, 108 и 111. Согласно еще одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106, 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106 и 111. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106, 108 и 111. Последовательности нуклеиновых кислот и аминокислот из областей CDR3 с заменами гистидина изображены на выравнивании последовательностей на фиг. 2 и приведены в SEQ ID NO: 4-33. Последовательности нуклеиновых кислот и аминокислот CDR3 дикого типа (изображены на фиг. 2) приведены в SEQ ID NO: 2 и 3, соответственно.
Согласно варианту осуществления, в котором единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека представляет собой вариабельную область Vκ3-20Jκ1, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон содержит замещение в положении в генной последовательности легкой цепи иммуноглобулина, кодирующей область CDR3, которое разрабатывают для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 107 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 107 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 106, 108 и 111. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106 и 109. Согласно другому варианту осуществления замещение разрабатывают для экспрессии гистидинов в положениях 105, 106, 107 и 109. Последовательности нуклеиновых кислот и аминокислот иллюстративных областей CDR3 с заменами гистидина изображены на выравнивании последовательностей на фиг. 12 и приведены в SEQ ID NO: 76-79. Последовательности нуклеиновых кислот и аминокислот CDR3 дикого типа (изображены на фиг. 12) приведены в SEQ ID NO: 74 и 75, соответственно.
Положения аминокислот (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно увидеть на www.imgt.org.
Согласно одному варианту осуществления генный сегмент VL человека функционально связан с человеческой или отличной от человеческой лидерной последовательностью. Согласно одному варианту осуществления лидерная последовательность представляет собой отличную от человеческой лидерную последовательность. Согласно конкретному варианту осуществления отличная от человеческой лидерная последовательность представляет собой лидерную последовательность Vκ3-7 мыши. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с реаранжированной последовательностью VL/JL человека. Таким образом, согласно одному конкретному варианту осуществления единственная реаранжированная генная последовательность вариабельной области Vκ1-39/Jκ5 или Vκ3-20/Jκ1, содержащая по меньшей мере одну замену гистидина, функционально связана с лидерной последовательностью Vκ3-7 мыши.
Согласно одному варианту осуществления генный сегмент VL функционально связан с промоторной последовательностью иммуноглобулина. Согласно одному варианту осуществления промоторная последовательность представляет собой промоторную последовательность человека. Согласно конкретному варианту осуществления промотор иммуноглобулина человека представляет собой промотор Vκ3-15 человека. Согласно конкретному варианту осуществления промотор функционально связан с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления промотор функционально связан с реаранжированной последовательностью VL/JL человека. Таким образом, согласно одному конкретному варианту осуществления единственная реаранжированная генная последовательность вариабельной области Vκ1-39/Jκ5 или Vκ3-20/Jκ1, содержащая по меньшей мере одну замену гистидина, функционально связана с промотором Vκ3-15 человека.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность с примыкающим со стороны 5' (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и с примыкающим со стороны 3' генным сегментом VL человека, который реаранжирует с сегментом JL человека и кодирует вариабельный домен обратной химерной легкой цепи, содержащей эндогенную отличную от человеческой константную область (CL) легкой цепи. Согласно конкретному варианту осуществления генные сегменты VL и JL находятся в отличном от человеческого локусе Vκ, и отличная от человеческой CL представляет собой отличную от человеческой Сκ (например, Сκ мыши). Согласно одному конкретному варианту осуществления последовательность вариабельной области функционально связана с отличной от человеческой последовательностью константной области, например, отличной от человеческой генной последовательностью Сκ.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность с примыкающим со стороны 5' (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и с примыкающей со стороны 3' реаранжированной последовательностью вариабельной области человека (последовательность VL/JL), и кодирует вариабельный домен обратной химерной легкой цепи, содержащей эндогенную отличную от человеческой константную область (CL) легкой цепи. Согласно конкретному варианту осуществления реаранжированная последовательность человека VL/JL находится в отличном от человеческого локусе каппа (κ), и отличная от человеческой CL представляет собой отличную от человеческой Сκ. Согласно одному конкретному варианту осуществления реаранжированная последовательность вариабельной области человека функционально связана с отличной от человеческой последовательностью константной области легкой цепи иммуноглобулина, например, отличной от человеческой генной последовательностью Сκ. Согласно одному варианту осуществления отличная от человеческой последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную отличную от человеческой последовательность. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь, и генная последовательность Сκ представляет собой генную последовательность Сκ мыши. Согласно одному варианту осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, представляет собой эндогенный отличный от человеческого (например, мышиный) локус легкой цепи иммуноглобулина (локус κ). Иллюстративные варианты осуществления локуса представлены на фиг. 8С, 8Е, 14С и 14D.
Согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой мышь, и локус вариабельной области мыши представляет собой локус легкой цепи κ, и локус легкой цепи κ содержит интронный энхансер κ мыши, 3' энхансер κ мыши или как интронный энхансер, так и 3' энхансер.
Согласно одному варианту осуществления отличное от человека животное (например, грызун, например, крыса или мышь) содержит нефункциональный локус легкой цепи лямбда (λ) иммуноглобулина. Согласно конкретному варианту осуществления локуса легкой цепи λ содержит делецию одной или нескольких последовательностей локуса, причем одна или несколько делеций делает локус легкой цепи λ неспособным к реаранжированию для образования гена легкой цепи. Согласно другому варианту осуществления все или по существу все генные сегменты VL локуса легкой цепи λ удаляются. Согласно одному варианту осуществления отличное от человека животное (например, грызун, например, мышь или крыса) содержит реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина, например, эндогенную нереаранжированную вариабельную область легкой цепи. Согласно одному варианту осуществления реаранжированная гистидин-замещенная генная последовательность вариабельной области легкой цепи иммуноглобулина человека замещает эндогенную нереаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина.
Согласно одному варианту осуществления животное производит легкую цепь, которая содержит соматически мутировавший вариабельный домен, полученный из последовательности вариабельной области человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления легкая цепь содержит соматически мутировавший вариабельный домен, полученный из последовательности вариабельной области человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон и отличную от человеческой область Сκ. Согласно одному варианту осуществления отличное от человека животное не экспрессирует легкую цепь λ.
Специалисту в настоящей области техники должно быть понятно, что, хотя замена(ы) по меньшей мере одного негистидинового остатка на остаток гистидина генетически встраивается в вариабельную область легкой цепи иммуноглобулина человека в результате соматических гипермутаций, не все антитела, которые производятся в генетически модифицированном отличном от человека животном, будут содержать этот остаток(ки) гистидина во встроенном положении(ях). Тем не менее, поколение широкого репертуара антител в отличном от человека животном позволит выбирать для in vivo произведенные антигенспецифические антитела, которые показывают высокую аффинность к представляющему интерес антигену, при этом сохраняя модификации гистидина, введенного в зародышевую линию, и, предпочтительно, демонстрируя зависимое от pH связывание антигена.
Таким образом, согласно одному варианту осуществления животное сохраняет по меньшей мере одну аминокислоту гистидин, введенную путем замены по меньшей мере одного негистидинового кодона на гистидиновый кодон в ген вариабельной области. Согласно одному варианту осуществления животное сохраняет все или по существу все гистидиновые замены в своем соматически мутировавшем вариабельном домене легкой цепи, которые были введены в его ген вариабельной области.
Согласно одному варианту осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное также содержит в своем геноме, например, в своей зародышевой линии, нереаранжированную вариабельную область тяжелой цепи иммуноглобулина, содержащую последовательности генных сегментов VH, DH и JH. Согласно одному варианту осуществления последовательности генных сегментов VH, DH и JH представляют собой последовательности генных сегментов VH, DH и JH человека, и нереаранжированная вариабельная область тяжелой цепи иммуноглобулина представляет собой вариабельную область тяжелой цепи человека. Согласно одному варианту осуществления последовательности генных сегментов VH, DH и JH человека функционально связаны с отличной от человеческой последовательностью константной области тяжелой цепи. Согласно одному варианту осуществления отличная от человеческой последовательность константной области тяжелой цепи представляет собой эндогенную отличную от человеческой последовательность константной области тяжелой цепи. Согласно одному варианту осуществления последовательности генных сегментов тяжелой цепи человека находятся в эндогенном отличном от человеческого локусе тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления последовательность вариабельной области тяжелой цепи иммуноглобулина человека, содержащаяся в отличном от человека животном, также содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления описанное в настоящем документе отличное от человека животное экспрессирует легкую цепь иммуноглобулина, которая содержит отличную от человеческой последовательность константной области легкой цепи. Согласно одному варианту осуществления отличное от человека животное экспрессирует легкую цепь иммуноглобулина, которая содержит последовательность константной области легкой цепи человека.
Согласно одному варианту осуществления описанное в настоящем документе отличное от человека животное экспрессирует тяжелую цепь иммуноглобулина, которая содержит отличную от человеческой последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно одному варианту осуществления отличное от человека животное экспрессирует тяжелую цепь иммуноглобулина, которая содержит человеческую последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно варианту осуществления, где животное содержит единственную реаранжированную вариабельную область легкой цепи иммуноглобулина, содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, реаранжированная последовательность легкой цепи иммуноглобулина в зародышевой линии животного находится в эндогенном отличном от человеческого локусе легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина, содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в зародышевой линии животного, замещает все или по существу все эндогенные отличные от человеческих последовательности сегментов V и J легкой цепи в эндогенном отличном от человеческого локусе легкой цепи иммуноглобулина.
Согласно одному варианту осуществления отличное от человека животное содержит замещение эндогенных генных сегментов VH одним или несколькими генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с отличным от человеческого геном области CH, так, что отличное от человека животное реаранжирует генные сегменты VH человека и экспрессирует обратную химерную тяжелую цепь иммуноглобулина, которая содержит домен VH человека и отличный от человеческого CH. Согласно одному варианту осуществления 90-100% нереаранжированных отличных от человеческих генных сегментов VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все (например, 90-100%) отличные от человеческих генные сегменты VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещения составляют по меньшей мере 19, по меньшей мере 39 или по меньшей мере 80 или 81 нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления замещения составляют по меньшей мере 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере 25 функциональных нереаранжированных генных сегментов VH человека или по меньшей мере 43 функциональных нереаранжированных генных сегмента VH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH по меньшей мере одним нереаранжированным сегментом DH человека и по меньшей мере одним нереаранжированным сегментом JH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH всеми нереаранжированными сегментами DH человека и всеми нереаранжированными сегментами JH человека.
Отличное от человека животное, например, мышь, содержащее в своем геноме, например, в своей зародышевой линии, ограниченный репертуар вариабельных областей легкой цепи иммуноглобулина человека, например, единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека (например, Vκ1-39/Jκ5 или Vκ3-20/Jκ1), с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон и разнообразным репертуаром нереаранжированных сегментов VH, DH и JH человека, способно производить антигенсвязывающие белки, кодируемые последовательностями вариабельной области тяжелой цепи, полученными из различных перестановок нереаранжированных сегментов Vh, Dh и Jh человека, причем сегменты VH, DH и JH, присутствующие в вариабельных последовательностях тяжелой цепи, получают из всех или по существу всех функциональных сегментов VH, DH и JH человека, присутствующих в геноме животного. Различные доступные возможности для последовательностей вариабельных доменов тяжелой цепи, экспрессируемых в клетках, например, В-клетках, описанных в настоящем документе генетически модифицированных животных (то есть, полученных из комбинации различных функциональных сегментов VH, DH и JH человека), описаны в опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, все из которых включены в настоящий документ посредством ссылки. Согласно различным вариантам осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон и нереаранжированная последовательность вариабельной области тяжелой цепи иммуноглобулина человека содержатся в зародышевой линии отличного от человека животного.
Согласно одному варианту осуществления отличное от человека животное содержит одну копию одной или обеих из реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека. Согласно другому варианту осуществления отличное от человека животное содержит две копии одной или обеих из реаранжированных последовательностей вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека. Таким образом, отличное от человека животное может быть гомозиготным или гетерозиготным по одной или обеим реаранжированным последовательностям вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека.
В дополнение к генетически модифицированных отличным от человека животным, содержащим в своем геноме генную последовательность вариабельной области легкой цепи иммуноглобулина (например, единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина), содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон (например, в CDR3 легкой цепи), также в настоящем документе предусмотрены генетически модифицированные отличные от человека животные, содержащие генную последовательность вариабельной области легкой цепи иммуноглобулина с одной или несколькими добавками/вставками гистидинового кодона(ов), таким образом, что экспрессируемый вариабельный домен содержит дополнительную аминокислоту(ы), которая, если не подлежит соматической гипермутации, представляет собой гистидин.
Описанное в настоящем документе генетически модифицированное отличное от человека животное, содержащее генную последовательность вариабельной области легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон, может быть выбрано из группы, состоящей из мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса). Для отличных от человека животных, где подходящие генетически модифицированные клетки ES не относятся к легко доступным, используют отличные от описанных в настоящем документе способы для получения отличного от человека животного, содержащего генетическую модификацию. Такие способы включают в себя, например, модификацию генома не-ES клетки (например, фибробластов или индуцированных плюрипотентных клеток) и использование метода переноса ядра для переноса модифицированного генома в подходящую клетку, например, яйцеклетку, и постепенное формирование модифицированной клетки (например, модифицированного ооцита) в отличном от человека животном при подходящих условиях с образованием эмбриона.
Согласно одному аспекту отличное от человека животное представляет собой млекопитающее. Согласно одному аспекту отличное от человека животное представляет собой мелкое млекопитающее, например, из надсемейства Dipodoidea или Muroidea. Согласно одному варианту осуществления генетически модифицированное животное представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из мыши, крысы и хомяка. Согласно одному варианту осуществления грызуна выбирают из надсемейства Muroidea. Согласно одному варианту осуществления генетически модифицированные животное представляет собой животное из семейства, выбранного из Calomyscidae (например, мышевидные хомячки), Cricetidae (например, хомячок, крысы и мыши Нового Света, полевки), Muridae (истинные мыши и крысы, песчанки, колючие мыши, хохлатые крысы), Nesomyidae (рипидомисы, скальные мыши, белохвостые крысы, Малагасийские крысы и мыши), Platacanthomyidae (например, колючие соневидные хомяки) и Spalacidae (например, кроты, бамбуковые крысы и цокоры). Согласно конкретному варианту осуществления генетически модифицированного грызуна выбирают из истинной мыши или крысы (семейство Muridae), песчанки, колючей мыши и косматого хомяка. Согласно одному варианту осуществления генетически модифицированная мышь представляет собой представителя семейства Muridae. Согласно одному варианту осуществления животное представляет собой грызуна. Согласно конкретному варианту осуществления грызуна выбирают из мыши и крысы. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь.
Согласно конкретному варианту осуществления отличное от человека животное представляет собой грызуна, который представляет собой мышь линии C57BL, выбранной из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/O1a. Согласно другому варианту осуществления мышь представляет собой мышь линии 129, выбранной из группы, состоящей из линии, которая представляет собой 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 129S1/SV, 129Sl/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129Т1, 129Т2 (смотрите, например, Festing et al. (1999) Revised nomenclature for strain 129 mice, Mammalian Genome 10:836, смотрите также Auerbach et al. (2000) Establishment and Chimera Analysis of 129/SvEv-and C57BL/6-Derived Mouse Embryonic Stem Cell Lines). Согласно конкретному варианту осуществления генетически модифицированная мышь представляет собой сочетание вышеуказанной линии 129 и вышеуказанной линии C57BL/6. Согласно другому конкретному варианту осуществления мышь представляет собой сочетание вышеуказанных линий 129 или сочетание вышеуказанных линий BL/6. Согласно конкретному варианту осуществления линия 129 сочетания представляет собой линию 129S6 (129/SvEvTac). Согласно другому варианту осуществления мышь представляет собой линию BALB, например, линию BALB/C. Согласно еще одному варианту осуществления мышь представляет собой сочетание линии BALB и другой вышеуказанной линии.
Согласно одному варианту осуществления отличное от человека животное представляет собой крысу. Согласно одному варианту осуществления крысу выбирают из крысы линии Wistar, линии LEA, линии Sprague Dawley, линии Fischer, F344, F6 и Dark Agouti. Согласно одному варианту осуществления линия крысы представляет собой сочетание двух или более линий, выбранных из группы, состоящей из Wistar, Lea, Sprague Dawley, Fischer, F344, F6 и Dark Agouti.
Таким образом, согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой грызуна. Согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой крысу или мышь. Согласно одному варианту осуществления животное представляет собой мышь. Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрена генетически модифицированная мышь, содержащая в своем геноме, например, в своей зародышевой линии, единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека, содержащую геные последовательности VL и JL человека, причем единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления мышь не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина (например, отсутствуют функциональные нереаранжированные последовательности генных сегментов V и J). Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи иммуноглобулина человека с гистидиновым замещением(ями) кодона представляет собой вариабельную область Vκ1-39/Jκ или Vκ3-20/Jκ. Согласно одному варианту осуществления последовательность сегмента J выбирают из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5. Согласно одному варианту осуществления последовательность сегмента J представляет собой Jκ1 или Jκ5. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности кодирующей области CDR3. Согласно одному варианту осуществления, в котором реаранжированная последовательность вариабельной области представляет собой последовательность Vκ1-39/Jκ5, замена(ы) гистидина разрабатывают для экспрессии в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления, в котором реаранжированная последовательность вариабельной области представляет собой последовательность Vκ3-20/Jκ1, замена(ы) гистидина разрабатывают для экспрессии в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи иммуноглобулина с замененным гистидиновым кодоном(ами) функционально связана с эндогенной генной последовательностью константной области иммуноглобулина мыши (например, генной последовательностью Сκ). Согласно одному варианту осуществления мышь дополнительно содержит в своем геноме, например, в своей зародышевой линии, нереаранжированную вариабельную область тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека. Согласно одному варианту осуществления сегменты VH, DH и JH человека функционально связаны с эндогенной генной последовательностью константной области иммуноглобулина мыши. Согласно различным вариантам осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированная последовательность вариабельной области тяжелой цепи иммуноглобулина человека содержатся в зародышевой линии мыши.
Также в настоящем документе предусмотрены нацеливающие векторы для создания описанных в настоящем документе генетически модифицированных отличных от человека животных, например мышей. Согласно одному аспекту предусмотрен нацеливающий вектор, содержащий от 5' к 3' в направлении транскрипции по отношению к последовательностям 5' и 3' плечей гомологии мыши вектора, 5' плечо гомологии мыши, промотор иммуноглобулина человека или мыши, лидерную последовательность человека или мыши, вариабельную область человека, выбранную из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20Jκ1 человека, и содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и 3' плечо гомологии мыши. Согласно одному варианту осуществления 5' и 3' плечи гомологии нацеливают вектор на 5' последовательность по отношению к энхансерной последовательности, которая присутствует на 5' и проксимальна гену Сκ мыши. Согласно другому варианту осуществления нацеливающий вектор содержит 5' плечо гомологии мыши, за которым следует кассета отбора, к которой примыкают сайты рекомбинации, промотор иммуноглобулина человека или мыши, лидерная последовательность человека или мыши, вариабельная область человека, выбранная из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20J1 человека и содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, за которой следует 3' плечо гомологии мыши, которое содержит энхансеры и последовательности константной области (Сκ) мыши.
Кассета отбора представляет собой нуклеотидную последовательность, вставленную в нацеливающий конструкт для облегчения отбора клеток (например, клеток ES), которую интегрировали в представляющий интерес конструкт. Некоторое количество подходящих кассет отбора известно в настоящей области техники. Как правило, кассета отбора дает возможность положительного отбора в присутствии определенного антибиотика (например, Neo, HYG, Pur, CM, Spec и т.д.). Кроме того, кассета отбора может быть окружена сайтами рекомбинации, которые позволяют удалять кассету отбора при обработке ферментами рекомбиназы. Обычно используются такие сайты рекомбинации, как LoxP и Frt, узнаваемые ферментами Cre и Flp, соответственно, но в настоящей области техники известны и другие.
Согласно одному варианту осуществления промотор представляет собой промотор генного сегмента вариабельной области иммуноглобулина человека. Согласно конкретному варианту осуществления промотор представляет собой промотор Vκ3-15 человека. Согласно одному варианту осуществления лидерная последовательность представляет собой лидерную последовательность мыши. Согласно конкретному варианту осуществления лидерная последовательность мыши представляет собой лидерную последовательность Vκ3-7 мыши. Иллюстративные варианты осуществления нацеливающих векторов представлены на фиг. 8В и 14В.
Согласно одному аспекту в настоящем документе предусмотрен описанный выше нацеливающий вектор, но вместо 5' плеча гомологии мыши к промотору человека или мыши с 5' примыкает сайт узнавания сайт-специфической рекомбиназой (SRRS), а вместо 3' плеча гомологии мыши к области VL человека с 3' примыкает SRRS. Также в настоящем документе предусмотрены способы получения описанных в настоящем документе генетически модифицированных отличных от человека животных (например, грызунов, например, мышей и крыс). Согласно одному аспекту в способе получения описанного в настоящем документе генетически модифицированного отличного от человека животного используют нацеливающий вектор, полученный с использованием технологии VELOCIGENE®, который вносит конструкт в ES клетки и вносит нацеленные клоны ES клеток в эмбрион мыши с использованием технологии VELOCIGENE®, как описано в примерах. Гистидиновые модификации могут быть введены в нацеливающий вектор с использованием различных техник молекулярной биологии, например, с помощью сайт-направленного мутагенеза или синтеза ДНК de novo. После завершения нацеливания генов ES клетки генетически модифицированных отличных от человека животных подвергают скринингу для подтверждения успешного включения представляющей интерес экзогенной нуклеотидной последовательности или экспрессии экзогенного полипептида. Специалистам в настоящей области техники известны многочисленные техники, которые включают в себя (но без ограничения) Саузерн-блоттинг, длинную ПЦР, количественную ПЦР (например, ПЦР в реальном времени с использованием TAQMAN®), флуоресцентную гибридизацию in situ, Нозерн-блоттинг, проточную цитометрию, Вестерн анализ, иммуноцитохимию, иммуногистохимию и т.д. В одном примере отличные от человека животные (например, мыши), несущие представляющую интерес генетическую модификацию, могут быть идентифицированы путем скрининга уменьшения аллеля мыши и/или увеличения аллеля человека с использованием модификации анализа аллелей, описанной в Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659. Другие анализы, которые идентифицируют специфическую нуклеотидную или аминокислотную последовательность у генетически модифицированных животных, известны специалистам в настоящей области техники.
Таким образом, согласно одному варианту осуществления способ получения генетически модифицированных отличных от человека животных предусматривает замещение генной последовательности вариабельной области легкой цепи иммуноглобулина у животного генной последовательностью вариабельной области легкой цепи иммуноглобулина человека (содержащей генные сегменты VL и JL человека), причем генная последовательность вариабельной области иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей область CDR, например, область CDR3.
Согласно одному варианту осуществления способ получения описанных в настоящем документе генетически модифицированных отличных от человека животных предусматривает замещение генной последовательности вариабельной области легкой цепи иммуноглобулина у животного единственной реаранжированной генной последовательностью вариабельной области легкой цепи иммуноглобулина человека, содержащей последовательности генных сегментов VL и JL человека, причем единственная реаранжированная генная последовательностью вариабельной области иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления замена происходит в кодоне CDR. Согласно одному варианту осуществления замена происходит в одном, двух, трех, четырех или более кодоне(ах) CDR3. Согласно одному варианту осуществления единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека основана на реаранжированной последовательности вариабельной области легкой цепи зародышевой линии человека, выбранной из Vκ1-39Jκ5 и Vκ3-20Jκ1. Таким образом, согласно одному варианту осуществления, где единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из Vκ1-39Jκ5, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывают для экспрессии гистидина в положениях, выбранных из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, где единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из Vκ3-20κ1, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывают для экспрессии гистидина в положениях, выбранных из 105, 106, 107,109 и их комбинации.
Согласно другому варианту осуществления способ получения описанного в настоящем документе отличного от человека животного (т.е. содержащего описанный в настоящем документе генетически модифицированный локус легкой цепи иммуноглобулина) предусматривает модификацию генома отличного от человека животного для удаления или приведение в нефункциональное состояние эндогенных сегментов V и J легкой цепи иммуноглобулина в локусе легкой цепи иммуноглобулина и размещение в геноме единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления способ приводит к генетически модифицированному отличному от человека животному, которое содержит популяцию В-клеток, обогащенных антителами, проявляющими зависимое от pH связывания с представляющим интерес антигеном.
Согласно некоторым вариантам осуществления способы получения описанных в настоящем документе генетически модифицированных отличных от человека животных предусматривают замещение генной последовательности вариабельной области легкой цепи иммуноглобулина генной последовательностью вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон у животного, которое также содержит замещение эндогенной отличной от человеческой генной последовательности вариабельной области тяжелой цепи иммуноглобулина генной последовательностью вариабельной области тяжелой цепи иммуноглобулина человека, содержащей по меньшей мере один из каждого или репертуар описанных выше последовательностей VH, DH и JH человека. Согласно одному варианту осуществления для того, чтобы получить отличное от человека животное, содержащее замещение эндогенной генной последовательности вариабельной области легкой цепи иммуноглобулина генной последовательностью вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и замещение эндогенной отличной от человеческой генной последовательности вариабельной области тяжелой цепи иммуноглобулина генной последовательностью вариабельной области тяжелой цепи иммуноглобулина человека, животное с замещением генной последовательности вариабельной области легкой цепи скрещивают с животным с замещением генной последовательности вариабельной области тяжелой цепи.
Авторы настоящего изобретения предусматривают подвергнутых генной инженерии отличных от человека животных (например, грызунов, например, крыс и мышей), которые экспрессируют антигенсвязывающие белки, например, антитела, которые содержат универсальную легкую цепь, например, универсальную легкую цепь человека (например, легкую цепь, полученную из единственной реаранжированной вариабельной области легкой цепи иммуноглобулина человека), которая содержит одну или несколько модификаций гистидина, причем антигенсвязывающие белки проявляют зависимое от pH связывания антигена-мишени. Животных подвергают генной инженерии для того, чтобы включить CDR3 легкой цепи, которая содержит одну или несколько модификаций гистидина. Согласно различным вариантам осуществления CDR3 легкой цепи содержит два, три или четыре, или более остатков гистидина в кластере.
Согласно одному варианту осуществления в настоящем документе предусмотрено подвергнутое генной инженерии отличное от человека животное (например, мышь или крыса), которое содержит популяцию В-клеток, характеризующихся повышенным наличием гистидинов в легких цепях иммуноглобулинов, например, вариабельных доменов иммуноглобулинов, например, CDR иммуноглобулинов, по сравнению с животным дикого типа. Согласно одному варианту осуществления повышение наличия гистидина составляет от 2 до 4 раз. Согласно одному варианту осуществления повышение гистидинов составляет от 2 до 10 раз.
Согласно одному варианту осуществления в настоящем документе предусмотрено подвергнутое генной инженерии отличное от человека животное, которое содержит популяцию антигенспецифических антител, которые экспрессируют остаток(ки) гистидина в результате модификаций кодонов в генной последовательности вариабельной области легкой цепи, и отображают зависимое от pH связывание антигена-мишени. Согласно одному варианту осуществления эти животные содержат популяцию В-клеток, которые обогащенны антителами, например, антигенспецифическими антителами, которые отображают зависимые от pH связывающие свойства (например, снижение диссоциационного периода полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH), по сравнению с популяцией антигенспецифических антител, производимых у животных, которые не содержат замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в описанной в настоящем документе вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления обогащение антигенспецифических антител, отображающих зависимые от pH антигенсвязывающие свойства, производимые у описанных в настоящем документе подвергнутых генной инженерии животных, по сравнению с аналогичными животными, которые содержат гистидиновые замены в вариабельной области легкой цепи, больше, чем приблизительно в 2 раза, например, больше, чем приблизительно в 5 раз, например, больше чем приблизительно в 10 раз. Таким образом, генетически модифицированные животные согласно настоящему изобретению обогащены антителами с улучшенными свойствами рециркуляции антител, которые желательны для уменьшения мишень-опосредованного клиренса, а также для снижения дозы и/или частоты приема терапевтического антигенсвязывающего белка, разработанного на основе такого полученного in vivo формата антител.
Таким образом, в настоящем документе предусмотрен антигенсвязывающий белок, произведенный у описанных в настоящем документе генетически модифицированных отличных от человека животных, причем антигенсвязывающий белок отображает зависимое от pH связывание антигена. Согласно одному варианту осуществления антигенсвязывающий белок представляет собой антитело, например, антигенспецифическое антитело. Согласно одному варианту осуществления антитело содержит легкую цепь, которая содержит вариабельный домен легкой цепи человека, полученный из реаранжировки генных сегментов вариабельной области легкой цепи иммуноглобулина человека, где по меньшей мере один негистидиновый кодон заменен на гистидиновый кодон в генной последовательности зародышевой линии, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельной домене легкой цепи человека. Согласно одному варианту осуществления антитело содержит легкую цепь, которая содержит вариабельный домен легкой цепи человека, полученный из единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, причем единственная реаранжированная генная последовательность вариабельной области легкой цепи содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления антитело содержит легкую цепь, полученную из реаранжировки Vκ1-39Jκ5 или Vκ3-20Jκ1 человека, причем генная последовательность Vκ1-39Jκ5 или Vκ3-20Jκ1 человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно некоторым вариантам осуществления антитело сохраняет все или по существу все гистидиновые замены в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления замена представляет собой замену трех негистидиновых кодонов тремя кодонами гистидина в нуклеотидной последовательности, кодирующей CDR3 генной последовательности вариабельной области легкой цепи, и антитело сохраняет все три замены гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления замена представляет собой замену четырех негистидиновых кодонов четырьмя кодонами гистидина в нуклеотидной последовательности, кодирующей CDR3 генной последовательности вариабельной области легкой цепи, и антитело сохраняет все четыре замены гистидина в своем экспрессированном вариабельном домене легкой цепи.
Согласно одному варианту осуществления легкая цепь антитела дополнительно содержит отличную от человеческой аминокислотную последовательность константной области легкой цепи, например, эндогенную аминокислотную последовательность константной области легкой цепи. Кроме того, антитело, например, антигенспецифическое антитело, производимое у описанного в настоящем документе генетически модифицированного отличного от человека животного, также содержит тяжелую цепь, которая содержит вариабельный домен тяжелой цепи человека, полученный из реаранжированных сегментов V, D и J тяжелой цепи человека. Сегменты V, D и J тяжелой цепи человека могут быть выбраны из репертуара сегментов тяжелых цепей человека, присутствующих в эндогенном отличном от человеческого локусе тяжелой цепи, например, по меньшей мере одного функционального сегмента V, по меньшей мере одного функционального сегмента D и по меньшей мере одного функционального сегмента J, например, до полного репертуара функциональных сегментов V, D и J человека. Иллюстративные возможные реаранжировки вариабельных сегментов тяжелой цепи человека можно почерпнуть из списка функциональных сегментов V, D и J человека в базе данных IMGT, и из опубликованных заявок США №2011/0195454, 2012/0021409, 2012/0192309 и 2013/0045492, которые включены в настоящий документ посредством ссылки. Кроме того, согласно одному варианту осуществления тяжелая цепь антитела содержит отличную от человеческой аминокислотную последовательность константной области тяжелой цепи, например, эндогенную отличную от человеческой аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления отличная от человеческой константная область тяжелой цепи содержит домены CH1, шарнир, CH2 и CH3. Согласно одному варианту осуществления антитело представляет собой изотип IgG, IgE, IgD, IgM или IgA.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрен связывающий белок, производимый в описанных в настоящем документе генетически модифицированных отличных от человека животных, причем связывающий белок содержит обратную химерную легкую цепь, содержащую (a) вариабельный домен легкой цепи, полученный от реаранжировки Vκ1-39Jκ5 человека, содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем легкая цепь сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области легкой цепи, причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (a) вариабельный домен тяжелой цепи, полученный из реаранжированных сегментов V, D и J человека, причем сегменты V, D и J выбирают из репертуара сегментов V, D и J человека, присутствующих у животного, и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления репертуар сегментов V, D и J человека содержит по меньшей мере один функциональный сегмент V, по меньшей мере один функциональный сегмент D и по меньшей мере один функциональный сегмент J, например, до полного репертуара функциональных сегментов V, D и J человека. Согласно одному варианту осуществления константные домены тяжелой и легкой цепи представляют собой эндогенные константные области тяжелой и легкой цепей. Согласно одному варианту осуществления вариабельные домены тяжелой и легкой цепи представляют собой соматически мутировавшие домены. Согласно одному варианту осуществления соматически мутировавший домен легкой цепи сохраняет по меньшей мере одну замену гистидина, введенную в последовательность зародышевой линии. Согласно некоторым вариантам осуществления соматически мутировавший домен легкой цепи сохраняет все или по существу все гистидиновые замены, введенные в последовательность зародышевой линии. Согласно одному варианту осуществления антигенсвязывающий белок отображает зависимые от pH антигенсвязывающие свойства.
Согласно другому варианту осуществления в настоящем документе предусмотрен связывающий белок, производимый в описанных в настоящем документе генетически модифицированных отличных от человека животных, причем связывающий белок содержит обратную химерную легкую цепь, содержащую (а) вариабельный домен легкой цепи, полученный от реаранжировки Vκ3-20Jκ1 человека, содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем легкая цепь сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области легкой цепи, причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (a) вариабельный домен тяжелой цепи, полученный из реаранжированных сегментов V, D и J человека, причем сегменты V, D и J выбирают из репертуара сегментов V, D и J человека, присутствующих у животного, и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления репертуар сегментов V, D и J человека содержит по меньшей мере один функциональный сегмент V, по меньшей мере один функциональный сегмент D и по меньшей мере один функциональный сегмент J, например, до полного репертуара функциональных сегментов V, D и J человека. Согласно одному варианту осуществления константные домены тяжелой и легкой цепи представляют собой эндогенные константные области тяжелой и легкой цепей. Согласно одному варианту осуществления вариабельные домены тяжелой и легкой цепи представляют собой соматически мутировавшие домены. Согласно одному варианту осуществления соматически мутировавший домен легкой цепи сохраняет по меньшей мере одну замену гистидина, введенного в последовательность зародышевой линии. Согласно некоторым вариантам осуществления соматически мутировавший домен легкой цепи сохраняет все или по существу все гистидиновые замены, введенные в последовательность зародышевой линии. Согласно одному варианту осуществления антигенсвязывающий белок отображает зависимые от pH антигенсвязывающие свойства.
Согласно одному варианту осуществления также в настоящем документе предусмотрена В-клетка описанного в настоящем документе генетически модифицированного животного, которое содержит в своей зародышевой линии последовательность вариабельной области легкой цепи человека с модифицированным гистидином, например, описанную в настоящем документе единственную реаранжированную последовательность вариабельной области легкой цепи человека с модифицированным гистидином, и экспрессирует описанный в настоящем документе антигенсвязывающий белок. Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, экспрессированный в В-клетке, сохраняет по меньшей мере один остаток гистидина, введенный в зародышевую линию, и отображает зависимые от pH антигенсвязывающие свойства. Согласно некоторым вариантам осуществления антигенсвязывающий белок, например, антитело, экспрессированный в В-клетке, сохраняет все или по существу все гистидиновые остатки, введенные в зародышевую линию, и отображает зависимые от pH антигенсвязывающие свойства.
Согласно различным вариантам осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное содержит генную последовательность вариабельной области легкой цепи человека, например, единственную реаранжированную генную последовательность вариабельной области легкой цепи человека (например, последовательность Vκ1-39Jκ5 или Vκ3-20Jκ1), которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон (или добавление гистидинового кодона в последовательность зародышевой линии). Эти добавления или замены приводят к получению отличного от человека животного, которое содержит популяцию В-клеток, обогащенных антигенсвязывающими белками с зависимыми от pH связывающими свойствами к их антигенам. Согласно одному варианту осуществления антигенсвязывающие белки, например, антитела, производимые у описанных в настоящем документе отличных от человека животных, в ответ на антигенную стимуляцию проявляют зависимое от pH связывание антигена, при этом проявляя высокую аффинность в отношении антигена при нейтральном значении pH, например, pH между приблизительно 7,0 и приблизительно 8,0, например, pH между приблизительно 7,0 и 7,4, например, pH между приблизительно 7,2 и приблизительно 7,4, например, при физиологическом значении pH. Согласно одному варианту осуществления аффинность антигенсвязывающего белка к своему антигену, выраженная в виде константы диссоциации (KD) при нейтральном значении pH составляет менее чем 10-6 М, например менее чем 10-8 М, например менее чем 10-9 М, например менее чем 10-10 М, например менее чем 10-11 М, например менее чем 10-12 М.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, проявляет сниженное связывание со своим антигеном при кислом значении pH (например, pH 6,0 или ниже, например, pH между приблизительно 5,0 и приблизительно 6,0, pH между приблизительно 5,75 и приблизительно 6,0, например, pH эндосомальных или лизосомальных компартментов), по сравнению с нейтральным значением pH. Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, не проявляет связывание с антигеном при кислом значении pH, сохраняя при этом связывание с антигеном при нейтральном значении pH. Согласно одному варианту осуществления антигенсвязывающий белок, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, характеризуется сниженным диссоциационным периодом полувыведения (t1/2) при кислом значении pH, по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH, по меньшей мере, приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 37°C равным менее чем приблизительно 1 мин. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 25°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 25°C равным менее чем приблизительно 1 мин.
Такие кинетические параметры, как равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t1/2) могут быть рассчитаны из кинетической константы скорости как: KD (М)=kd/ka; and t1/2 (min)=ln2/(60*kd).
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, проявляет повышенное связывание с молекулой FcRn. Как описано выше, FcRn представляет собой рецептор, присутствующий внутри эндосомального компартмента, который способен связывать иммуноглобулины при кислом значении pH и рециркулировать их обратно на поверхность. Скрининг молекул антитела в описанных в настоящем документе генетически модифицированных отличных от человека животных представляет собой уникальную возможность отбора антител с тремя полезными параметрами: высокая аффинность к антигену, зависимое от pH связывания антигена (с более слабым связыванием антигена при кислом значении pH) и увеличенным связыванием с FcRn.
Согласно одному варианту осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное содержит популяцию В-клеток в ответ на антиген, которое производит и обогащено антигенсвязывающими белками, например, антителами, которые при преобразовании в лекарственные средства, проявляют увеличенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с эквивалентной В-клеточной популяцией, полученной в ответ на тот же антиген у отличных от человека животных, которые не содержат модификацию(и) гистидина в своих генных последовательностях вариабельных областей легкой цепи человека. Таким образом, согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, произведенный в ответ на представляющий интерес антиген в описанном в настоящем документе генетически модифицированном животном, при преобразовании в лекарственное средство, проявляют увеличенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с периодом полужизни в сыворотке антигенсвязывающего белка (при преобразовании в лекарственное средство в той же терапевтической дозе), который был произведен в ответ на тот же антиген в отличном от человека животном, который не содержит модификацию(и) гистидина в своей генной последовательности вариабельной области легкой цепи человека. Согласно некоторым вариантам осуществления происходит увеличение периода полужизни в сыворотке приблизительно в 2 раза, например, приблизительно в 5 раз, например, приблизительно в 10 раз, например, приблизительно в 15 раз, например, приблизительно в 20 раз или более.
Согласно одному аспекту предусмотрена плюрипотентная, индуцированная плюрипотентная или тотипотентная клетка, полученная из описанного в настоящем документе отличного от человека животного. Согласно конкретному варианту осуществления клетка представляет собой эмбриональную стволовую (ES) клетку.
Согласно одному аспекту предусмотрена ткань, полученная от описанного в настоящем документе отличного от человека животного. Согласно одному варианту осуществления ткань получают из селезенки, лимфатического узла или костного мозга описанного в настоящем документе отличного от человека животного.
Согласно одному аспекту предусмотрено ядро, полученное от описанного в настоящем документе отличного от человека животного. Согласно одному варианту осуществления ядро получают из диплоидной клетки, которая не представляет собой В-клетку.
Согласно одному аспекту предусмотрена отличная от человеческой клетка, которая изолирована от описанного в настоящем документе отличного от человека животного (например, грызуна, например, мыши или крысы). Согласно одному варианту осуществления клетка представляет собой ES клетку. Согласно одному варианту осуществления клетка представляет собой лимфоцит. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку. Согласно одному варианту осуществления В-клетка экспрессирует химерную тяжелую цепь, содержащую вариабельный домен, полученный из генного сегмента человека; и легкую цепь, полученную из реаранжированной последовательности Vκ1-39/J человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон, реаранжированной последовательности Vκ3-20/J человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон или их комбинации, и дополнительно содержащую замену по меньшей мере одной аминокислоты, кодируемой в зародышевой линии вместо гистидина; причем вариабельный домен тяжелой цепи сливают с отличной от человеческой или человеческой константной областью тяжелой цепи и вариабельный домен легкой цепи сливают с отличной от человеческой или человеческой константной областью легкой цепи.
Согласно одному аспекту предусмотрена гибридома, причем гибридому получают с В-клеткой описанного в настоящем документе отличного от человека животного. Согласно конкретному варианту осуществления В-клетку получают от описанной в настоящем документе мыши, которая была иммунизирована иммуногеном, содержащим представляющий интерес эпитоп, и В-клетка экспрессирует связывающий белок, который связывает представляющий интерес эпитоп, связывающий белок содержит соматически мутировавший вариабельный домен тяжелой цепи человека и CH мыши и содержит вариабельный домен легкой цепи человека, полученный из реаранжированного Vκ1-39Jκ5 человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон или реаранжированного Vκ3-20Jκ1 человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон и CL мыши, причем домен легкой цепи человека содержит замену по меньшей мере одной аминокислоты, кодируемой в зародышевой линии гистидином.
Кроме того, предусмотрена клетка, экспрессирующая антигенсвязывающий белок, производимая в описанных в настоящем документе отличных от человека животных. Согласно одному варианту осуществления клетку выбирают из СНО, COS, 293, HeLa и клетки сетчатки, экспрессирующих вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
Согласно одному аспекту предусмотрен отличный от человеческого эмбрион, причем эмбрион содержит ES клетку донора, которая происходит от описанного в настоящем документе отличного от человека животного.
Описанные в настоящем документе отличные от человека животные применимы для получения В-клеток, которые экспрессируют антитела, содержащие гистидины в CDR3. Животное, которое помещает гистидины в CDR3, применимо для создания антител в целом, и, в частности, применимо для разработки антител, которые связываются с мишенью с достаточной аффинностью в или в пределах нейтрального значения pH, но которые либо не связываются, либо связываются слабее с той же мишенью при кислом значении pH.
Отличное от человека животное применимо для получения вариабельных областей антител, которые могут быть использованы для получения, например, человеческих терапевтических связывающих белков, которые связывают свои мишени вариабельными доменами иммуноглобулина человека, которые содержат гистидины в CDR3. Измененное связывание при более низком значении pH будет при некоторых обстоятельствах позволять более быстрое обновление, потому что лекарственное средство будет связывать мишень на поверхности клетки, поглощаться в эндосому и легче и быстрее отделяться от мишени в эндосоме, так что лекарственное средство может рециркулировать, чтобы связать еще одну молекулу мишени (например, на другой клетке или той же клетке). В некоторых случаях это будет приводить к возможности введения лекарственного средства в более низкой дозе или снижения частоты приема лекарственного средства. Это особенно полезно, когда не желателен частый прием или введение выше определенной дозы по причине безопасности и токсичности. В результате, период полураспада в сыворотке терапевтического антитела при введении субъекту будет увеличен.
Отличное от человека животное, например, грызун, например, мышь или крыса, применимо в способе для увеличения количества В-клеток у животного, которое проявляет вариабельную область антитела, содержащую CDR3 с одним или несколькими гистидинами в ней. Отличное от человека животное применимо для производства последовательностей антител, которые будут проявлять зависимое от pH связывание антигена. Отличное от человека животное применимо для получения большего количества последовательностей антител, в результате однократной иммунизации, причем антитела будут проявлять зависимое от pH связывание антигена.
Антигенсвязывающие белки и способы их получения
Согласно одному аспекту также в настоящем документе предусмотрены способы получения человеческих антигенсвязывающих белков, например, антител, которые проявляют зависимое от pH связывание антигена, из описанных в настоящем документе генетически модифицированных отличных от человека животных с использованием стандартных способов, используемых в настоящей области техники.
Были описаны некоторые способы получения антител. Например, согласно различным вариантам осуществления химерные антитела продуцируют у мышей, как описано в настоящем документе. Антитела могут быть выделены непосредственно из В-клеток иммунизированной мыши (например, смотрите U.S. 2007/0280945 A1) и/или В-клетки иммунизированной мыши можно использовать для получения гибридом (Kohler and Milstein, 1975, Nature 256:495-497). ДНК, кодирующую антитела (человеческие тяжелые и/или легкие цепи) из описанных в настоящем документе отличных от человека животных легко выделяют и секвенируют, используя обычные техники. Гибридома и/или В-клетки, полученные из описанных в настоящем документе отличных от человека животных, служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, которые в ином случае не продуцируют белок иммуноглобулина, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем замены кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо отличных от человеческих последовательностей. Таким образом, когда определяются последовательности нуклеиновых кислот антител с желаемыми характеристиками, например, аффинностью, эпитопом, зависимым от pH связыванием антигена и т.д., отличные от человеческих генные последовательности константных областей заменяют на требуемые последовательности константных областей человека для производства полностью человеческого антитела, содержащего изотип не-IgM, например, IgG1, IgG2, IgG3 или IgG4.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрен способ получения антитела, которое проявляет зависимые от pH антигенсвязывающие свойства, предусматривающий получение описанного в настоящем документе отличного от человека животного (например, мыши), иммунизацию мыши представляющим интерес антигеном, что позволяет отличному от человека животному усиливать иммунный ответ на антиген, и отбор в отличном от человека животном антигенспецифического антитела, которое проявляет зависимые от pH антигенсвязывающие свойства, например, более слабое связывание с антигеном при кислом, по сравнению с нейтральным значением pH.
Также в настоящем документе предусмотрены способы получения мультиспецифических антигенсвязывающих белков, например, биспецифических антигенсвязывающих белков. Эти молекулы способны связываться более, чем с одним эпитопом с высокой аффинностью. Преимущества настоящего изобретения включают в себя возможность выбирать соответствующие высокосвязывающие (например, с созревшей аффинностью) тяжелые цепи иммуноглобулина, каждая из которых будет ассоциировать с единственной легкой цепью. Кроме того, преимущества настоящего изобретения включают в себя способность производить мультиспецифический, например, биспецифический, антигенсвязывающий белок, который проявляет зависимое от pH связывание антигена.
В связи с двойственной природой биспецифических антител (т.е., могут быть специфическими к различным эпитопам одного полипептида или могут содержать антигенсвязывающие домены, специфические к более, чем одному полипептиду-мишени, смотрите, например, Tutt et al., 1991, J. Immunol. 147:60-69; Kufer et al., 2004, Trends Biotechnol. 22:238-244), они предлагают много полезных преимуществ для терапевтического применения. Например, биспецифические антитела могут быть использованы для перенаправленной цитотоксичности (например, чтобы уничтожать опухолевые клетки), в качестве адъюванта вакцины, для доставки тромболитических агентов к сгусткам, для преобразования активируемых ферментами пролекарств в сайте-мишени (например, опухоли), для лечения инфекционных заболеваний, нацеливания иммунных комплексов на рецепторы клеточной поверхности или для доставки иммунотоксинов к опухолевым клеткам.
Описанные в настоящем документе биспецифические антитела могут также быть использованы в таких различных терапевтических и не терапевтических и/или диагностических способах анализа, как иммуноферментные анализы, двухсайтовые иммуноанализы, in vitro или in vivo иммунодиагностики различных заболеваний (например, злокачественной опухоли), анализы конкурентного связывания, прямые и косвенные сэндвич-анализы и анализы иммунопреципитации. Другие применения для биспецифических антител будут очевидны для специалистов в настоящей области техники.
Сообщалось о нескольких способах для получения фрагментов биспецифических антител из культуры рекомбинантных клеток. Однако синтез и экспрессия биспецифических связывающих белков были проблематичными, отчасти из-за вопросов, связанных с идентификацией подходящей легкой цепи, которая может ассоциировать и экспрессировать с двумя различными тяжелыми цепями, и отчасти, из-за проблем выделения. Согласно различным вариантам осуществления описанные в настоящем документе композиции и способы предусматривают преимущество полноразмерных биспецифических антител, которые не требуют специальной модификации(й), чтобы поддерживать традиционную структуру иммуноглобулина, увеличивая стабильность/взаимодействие компонентов. Согласно различным вариантам осуществления такая модификация(и) показала себя трудоемкой и служила в качестве препятствия для развития технологии биспецифических антител и их потенциального применения в лечении заболевания человека. Таким образом, согласно различным вариантам осуществления посредством обеспечения естественной структуры иммуноглобулина (т.е., полноразмерной), характеризующейся дополнительным свойством множественных специфичностей, полноразмерные биспецифические антитела поддерживают их критические эффекторные функции, которыми не характеризовались предыдущие биспецифические фрагменты, и дополнительно обеспечивают лекарственные средства, которые демонстрируют важный фармакокинетический параметр более длительного периода полужизни.
Описанные в настоящем документе способы и композиции позволяют генетически модифицированной мыши выбрать при естественных процессах подходящую легкую цепь, которая может ассоциировать и экспрессировать более чем с одной тяжелой цепью, включающей в себя тяжелые цепи, которые соматически мутировавшие (например, с созревшей аффинностью), причем легкая цепь дополнительно наделяет антигенсвязывающий белок его зависимым от pH антигенсвязывающим свойством. Последовательности вариабельной области тяжелой и легкой цепей человека из подходящих В-клеток описанных в настоящем документе иммунизированных мышей, которые экспрессируют антитела с созревшей аффинностью, содержащие обратные химерные тяжелые цепи (например, вариабельные человека и константные мыши), могут быть идентифицированы и клонированы в рамке считывания в векторе экспрессии с подходящей генной последовательность константной области человека (например, IgG1 человека). Могут быть получены два таких конструкта, причем каждый конструкт кодирует человеческий вариабельный домен тяжелой цепи, который связывает различные эпитопы. Один из вариабельных областей легкой цепи человека (например, Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека), содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, может быть слит в рамке считывания с подходящим геном константной области легкой цепи человека (например, константным геном к человека). Эти три полностью человеческие тяжелые и легкие конструкты могут быть помещены в подходящую клетку для экспрессии. Клетка будет экспрессировать два основных вида: гомодимерную тяжелую цепь с идентичной легкой цепью и гетеродимерную тяжелую цепь с идентичной легкой цепью. Для обеспечения более легкого разделения этих основных видов одну из тяжелых цепей модифицируют, чтобы пропускать связывающую белок А детерминанту, приводя к дифференциальной аффинности гомодимерного связывающего белка из гетеродимерного связывающего белка. Композиции и способы решения этого вопроса описаны в USSN 12/832838, поданной 25 июня 2010 г., под названием "Readily Isolated Bispecific Antibodies with Native Immimoglobulin Format", опубликованной как US 2010/0331527 A1, включенной в настоящий документ посредством ссылки. После того, как вид, содержащий гетеродимерную тяжелую цепь с идентичной легкой цепью выбран, этот биспецифический антигенсвязывающий белок может быть подвергнут скринингу для подтверждения сохранения его зависимого от pH антигенсвязывающего свойства.
Согласно одному аспекту предусмотрен описанный в настоящем документе эпитопсвязывающий белок, причем последовательности вариабельной области легкой цепи и тяжелой цепи человека получают от описанных в настоящем документе животных, которые были иммунизированы содержащим представляющий интерес эпитоп антигеном.
Согласно одному варианту осуществления предусмотрен эпитопсвязывающий белок, который содержит первый и второй полипептид, первый полипептид, содержащий от N-конца к С-концу первую эпитопсвязывающую область, которая селективно связывает первый эпитоп, после которой следует константная область, которая содержит первую область CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и второй полипептид, содержащий от N-конца к С-концу вторую эпитопсвязывающую область, которая селективно связывает второй эпитоп, после которой следует константная область, которая содержит вторую область CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, причем вторая область CH3 содержит модификацию, которая уменьшает или устраняет связывание второго домена CH3 с белком А. Различные такие модификации описаны, например, в опубликованной заявке US №2010/0331527 и 2011/0195454, включенной в настоящий документ посредством ссылки.
Один из способов получения эпитопсвязывающего белка, который связывается более чем с одним эпитопом и проявляет зависимое от pH эпитопсвязывающее свойство, состоит в иммунизации первой мыши в соответствии с настоящим изобретением антигеном, который содержит первый представляющий интерес эпитоп, причем мышь содержит (1) эндогенный локус вариабельной области легкой цепи иммуноглобулина, который не содержит эндогенную генную последовательность вариабельной области легкой цепи мыши, которая способна к реаранжированию и образованию легкой цепи, причем в эндогенном локусе вариабельной области легкой цепи иммуноглобулина мыши находится единственная реаранжированная вариабельная область легкой цепи человека, функционально связанная с эндогенным геном константной области легкой цепи мыши, и реаранжированную вариабельную область легкой цепи человека выбирают из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека, содержащих замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и (2) эндогенные генные сегменты VH мыши, замененные полностью или частично генными сегментами VH человека, таким образом, что полученные с помощью мыши тяжелые цепи иммуноглобулина представляют собой исключительно или по существу тяжелые цепи, которые содержат вариабельные домены человека и константные домены мыши. После иммунизации такая мышь будет производить обратное химерное антитело, содержащее только один из двух вариабельных доменов легкой цепи человека (например, один из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека, например, содержащий замену по меньшей мере одной аминокислоты на гистидин). Как правило, по меньшей мере некоторые из замененных остатков гистидина, введенных в последовательность зародышевой линии, будут сохранены в обратном химерном антителе. После того, как идентифицируют В-клетку, которая кодирует вариабельный домен тяжелой цепи, который связывается с представляющим интерес эпитопом и экспрессирует антитело, которое проявляет зависимые от pH антигенсвязывающие свойства, нуклеотидная последовательность вариабельной области тяжелой цепи (и, возможно, вариабельная область легкой цепи) может быть получена (например, с помощью ПЦР) и клонирована в конструкт экспрессии в рамке считывания с подходящей последовательностью константной области тяжелой цепи иммуноглобулина человека. Этот процесс может быть повторен для идентификации второго вариабельного домена тяжелой цепи, который связывает второй эпитоп, и может быть получена вторая генная последовательность вариабельной области тяжелой цепи и клонирована в вектор экспрессии в рамке считывания для второй пригодной последовательности константной области тяжелой цепи иммуноглобулина человека. Первый и второй константные домены иммуноглобулина, кодируемые генной последовательностью константной области, могут быть одинакового или различного изотипа, и один из константных доменов иммуноглобулина (но не другой) может быть модифицирован, как описано в настоящем документе или в US 2010/0331527 A1, и эпитопсвязывающий белок может быть экспрессирован в подходящей клетке и выделен на основе своей дифференциальной аффинности к белку А, по сравнению с гомодимерным эпитопсвязывающий белком, например, как описано в US 2010/0331527 А1.
Таким образом, согласно различным вариантам осуществления после выделения ДНК и отбора первой и второй последовательностей нуклеиновых кислот, которые кодируют первый и второй вариабельные домены тяжелой цепи человека, характеризующихся желаемыми специфичностями/аффинностями, и третьей последовательности нуклеиновой кислоты, которая кодирует домен легкой цепи человека (реаранжированная последовательность зародышевой линии или последовательность легкой цепи, выделенная из описанного в настоящем документе отличного от человека животного) и содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, три последовательности нуклеиновых кислот, кодирующие молекулы, экспрессируются для образования биспецифического антитела с использованием рекомбинантных техник, которые широко доступны в настоящей области техники. Часто, экспрессионная система выбора будет включать в себя вектор экспрессии клетки млекопитающих и хозяина таким образом, что биспецифическое антитело соответствующим образом гликозилируют (например, в случае биспецифических антител, содержащих домены антител, которые гликозилированы). Тем не менее, молекулы могут быть также получены в прокариотических экспрессионных системах. Как правило, клетка-хозяин будет трансформирована с ДНК, кодирующей как первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека, домен легкой цепи человека на единственном векторе, так и независимые векторы. Тем не менее, можно экспрессировать как первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека и домен легкой цепи человека (компоненты биспецифических антител) в независимых системах экспрессии и объединить экспрессированные полипептиды in vitro. Согласно различным вариантам осуществления домен легкой цепи человека происходит от последовательности зародышевой линии, но вместо замены по меньшей мере одного негистидинового кодона на гистидиновый кодон, например, в кодоне CDR. Согласно различным вариантам осуществления домен легкой цепи человека содержит не более одного, не более двух, не более трех, не более четырех или не более пяти соматических гипермутаций внутри вариабельной последовательности легкой цепи домена легкой цепи. Согласно некоторым вариантам осуществления соматические гипермутации не изменяют наличие по меньшей мере одного остатка гистидина, введенного в последовательности зародышевой линии вариабельной области легкой цепи.
Согласно различным вариантам осуществления нуклеиновая кислота(ы) (например, кДНК или геномная ДНК), кодирующая две тяжелые цепи и одну легкую цепь человека с заменой по меньшей мере одного негистидина на гистидин, вставляется в вектор репликации для дальнейшего клонирования (амплификации ДНК) и/или для экспрессии. Многие векторы доступны, и, как правило, включают в себя без ограничения один или несколько из следующих: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Каждый компонент может быть выбран индивидуально или на основе выбора клетки-хозяина или других критериев, определенных экспериментально. Несколько примеров каждого компонента известно в настоящей области техники.
Векторы экспрессии и клонирования обычно содержат промотор, который распознается организмом-хозяином и функционально связан с последовательностями нуклеиновых кислот, которые кодируют каждый или все компоненты биспецифического антитела. Большое количество промоторов, узнаваемых различными потенциальными клетками-хозяевами, хорошо известны. Эти промоторы функционально связаны с биспецифической кодирующей антитела ДНК путем удаления промотора из источника ДНК с помощью фермента рестрикции, расщепляющего и вставляющего выделенную последовательность промотора в вектор.
Векторы экспрессии, используемые в эукариотических клетках-хозяевах (дрожжах, грибах, насекомых, растениях, животных, человека или ядерных клетках из других многоклеточных организмов), могут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5', а иногда 3', нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей компоненты биспецифических антител. Подходящие векторы экспрессии для различных вариантов осуществления включают в себя те, которые предусмотрены для временной экспрессии в клетках млекопитающих ДНК, кодирующей биспецифическое антитело. В общем, временная экспрессия включает в себя использование вектора экспрессии, который способен эффективно реплицироваться в клетке-хозяине, таким образом, что клетка-хозяин накапливает множество копий вектора экспрессии и, в свою очередь, синтезирует высокие уровни желаемого полипептида, кодируемого вектором экспрессии. Системы временной экспрессии, содержащие подходящий вектор экспрессии и клетку-хозяина, дают возможность удобной положительной идентификации полипептидов, кодируемых клонированными ДНК, а также быстрого скрининга биспецифических антител, обладающих желаемой специфичностью/аффинностью связывания или желаемой характеристикой пробега в геле, по отношению к исходным антителам, содержащим гомодимеры первого или второго вариабельных доменов тяжелой цепи человека.
Согласно различным вариантам осуществления, как только ДНК, кодирующие компоненты биспецифического антитела, собраны в нужном описанном выше векторе(ах), их вводят в подходящую клетку-хозяина для экспрессии и восстановления. Трансфекция клеток-хозяев может быть выполнена с использованием известных в настоящей области техники стандартных техник, подходящих для выбранной клетки хозяина (например, электропорации, ядерной микроинъекции, слияния бактериальных протопластов с интактными клетками или поликатионов, например, полибрена, полиорнитин и т.д.).
Согласно различным вариантам осуществления клетку-хозяина выбирают ту, которая наилучшим образом соответствует вектору экспрессии, содержащему компоненты, и позволяет наиболее эффективно и благоприятно производить виды биспецифических антител. Иллюстративные клетки-хозяева для экспрессии включают в себя прокариоты и эукариоты (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы E. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni, и т.д.), клетки отличных от человека животных, клетки человека или клеточные слияния, такие как, например, гибридомы или квадромы. Согласно различным вариантам осуществления клетка представляет собой клетку человека, мартышки, обезьяны, хомячка, крысы или мыши. Согласно различным вариантам осуществления клетка представляет собой эукариотическую клетку, выбранную из СНО (например, CHO K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почек (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, ВНК21), Jurkat, Daudi, A431 (эпидермальная), CV-1, U937, 3T3, клетки L, клетки C127, SP2/0, NS-0, MMT 060562, клетки Сертоли, клетки BRL 3А, клетки HT1080, клетки миеломы, клетки опухоли и клеточной линии, полученной из вышеуказанной клетки. Согласно различным вариантам осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Клетки-хозяева млекопитающих, используемые для производства биспецифического антитела, могут культивироваться в различных средах. Такие коммерчески доступные среды, как F10 Хэма (Sigma), минимальная поддерживающая среда ((MEM), Sigma), RPMI-1640 (Sigma) и среда Игла, модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma), подходят для культивирования клеток-хозяев. Среды могут быть дополнены, при необходимости, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (например, хлоридом натрия, кальция, магния и фосфатом), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками (например, GENTAMYCIN™), следовыми элементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие добавки также могут быть включены в соответствующих концентрациях, известных специалистам в настоящей области техники. Такие условия культивирования, как температура, pH и т.п., согласно различным вариантам осуществления, представляют собой ранее использованные с клеткой-хозяином, выбранной для экспрессии, и будут очевидны специалистам в настоящей области техники.
Биспецифическое антитело может быть выделено из культуральной среды в виде секретируемого полипептида, хотя оно также может быть выделено из лизата клеток-хозяев, когда производится непосредственно без секреторного сигнала. Если биспецифическое антитело связано с мембраной, оно может быть высвобождено из мембраны с использованием подходящего раствора детергента (например, Triton Χ-100).
После выделения биспецифическое антитело, содержащее две тяжелые цепи человека и одну легкую цепь человека, полученную из реаранжированной генной последовательности вариабельной области легкой цепи человека, выбранной из последовательностей Vκ1-39Jκ5 и Vκ3-20Jκ1, которые содержат замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, подвергают скринигу на способность проявлять зависимое от pH связывание с одним, предпочтительно с обоими его антигенами. Способность биспецифических антител связывать свои антигены по-разному при нейтральном и кислом значении pH (например, их способность демонстрировать уменьшенный t1/2 при кислом значении pH, по сравнению с нейтральным значением pH) может быть определена с помощью различных техник, доступных в настоящей области техники и описанных в следующих примерах, например, анализ BIACORE™.
Дополнительные способы получения антигенсвязывающих белков с зависимым от pH связыванием антигенов
Предусмотрены различные способы получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами у описанных в настоящем документе генетически модифицированных отличных от человека животных. Также предусмотрены способы получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами in vitro. Такие способы могут включать в себя получение различных компонентов антигенсвязывающих белков in vivo у генетически модифицированных отличных от человека животных, а затем их модификацию и сборку in vitro за пределами организма в виде белковых комплексов, экспрессированных в культуре клеток млекопитающих.
Согласно одному варианту осуществления способ получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами использует последовательность антигенсвязывающего белка, например, последовательность антитела, который производится в мыши, содержащей ограниченный репертуар сегментов V и J вариабельной области легкой цепи, например, сегменты V и J вариабельной области легкой цепи человека, мыши с ʺуниверсальной легкой цепьюʺ или ʺобщей легкой цепьюʺ (ʺULCʺ мыши), такой как мышь, описанная в опубликованных заявках US №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, включенных в настоящий документ посредством ссылки. Согласно одному варианту осуществления способ получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами использует последовательность антигенсвязывающего белка, который производится в мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека. Согласно одному варианту осуществления способ использует антигенсвязывающий белок, производимый в мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека, выбранную из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязывающими свойствами предусматривает выбор первого антитела, которое связывается с представляющим интерес антигеном (например, связывается с представляющим интерес антигеном с требуемой аффинностью), модификацию нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела для того, чтобы включить в себя замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, экспрессию тяжелой цепи иммуноглобулина первого антитела и модифицированной легкой цепи иммуноглобулина в клетке и выбор второго антитела, экспрессируемого в клетке, которое сохраняет связывание с представляющим интерес антигеном (например, сохраняет требуемую аффинность к представляющему интерес антигену) при нейтральном значении pH и отображает уменьшенное связывание с представляющим интерес антигеном при кислом значении pH.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязывающими свойствами предусматривает выбор тяжелой цепи иммуноглобулина из антитела (например, полученного из отличного от человека животного, например, мыши, например, ULC мыши), которое содержит легкую цепь иммуноглобулина, содержащую единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, причем антитело связывается с представляющим интерес антигеном (например, связывается с представляющим интерес антигеном с требуемой аффинностью); модификацию последовательности нуклеиновой кислоты легкой цепи иммуноглобулина так, что единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон; экспрессию выбранной тяжелой цепи иммуноглобулина и легкой цепи иммуноглобулина, содержащей замену по меньшей мере одной аминокислоты на гистидин в своем вариабельном домене; и выбор антитела, которое сохраняет связывание с представляющим интерес антигеном при нейтральном значении pH (например, сохраняет требуемую аффинность к представляющему интерес антигену), при этом отображая уменьшенное связывание с представляющим интерес антигеном при кислом значении pH. Согласно различным вариантам осуществления тяжелая цепь иммуноглобулина происходит от реаранжировки вариабельных генных сегментов (сегментов V, D и J человека) тяжелой цепи человека.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязывающими свойствами предусматривает (1) иммунизацию отличного от человека животного, например, мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека и репертуар нереаранжированных вариабельных генных сегментов (сегментов V, D и J) тяжелой цепи человека, представляющим интерес антигеном и позволение мыши усиливать иммунный ответ на указанный антиген, (2) выбор у отличного от человека животного, например, у мыши, антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (3) выделение из отличного от человека животного, например, из мыши, нуклеотидной последовательности тяжелой цепи иммуноглобулина антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (4) определение нуклеотидной последовательности указанной тяжелой цепи, (5) модификацию нуклеотидной последовательности легкой цепи иммуноглобулина, содержащей единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека, чтобы включить замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, (6) экспрессию тяжелой цепи иммуноглобулина антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, и легкой цепи иммуноглобулина, содержащей модификацию гистидина, в клетке, и (7) определение того, сохраняет ли экспрессируемое в клетке антитело связывание с антигеном при нейтральном значении pH, при этом отображая сниженное связывание при кислом значении pH. Согласно одному варианту осуществления экспрессируемое в клетке антитело проявляет требуемую аффинность к антигену при нейтральном значении pH. Согласно различным вариантам осуществления тяжелая цепь иммуноглобулина происходит от реаранжировки вариабельных генных сегментов (сегментов V, D и J человека) тяжелой цепи человека.
Согласно одному варианту осуществления мышь, содержащая единственную реаранжированную генную последовательность вариабельной области легкой цепи человека, представляет собой мышь с универсальной легкой цепью или общей легкой цепью ʺULCʺ мышь, описанную, например, в опубликованной заявке US №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492. Согласно одному варианту осуществления единственную реаранжированную генную последовательность вариабельной области легкой цепи человека выбирают из последовательности Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека.
Согласно одному варианту осуществления представляющий интерес антиген выбирают из растворимого антигена, антигена клеточной поверхности (например, опухолевого антигена) и рецептора клеточной поверхности. Согласно конкретному варианту осуществления рецептор клеточной поверхности представляет собой рецептор-иммуноглобулин. Согласно конкретному варианту осуществления рецептор-иммуноглобулин представляет собой Fc-рецептор.
Согласно одному варианту осуществления требуемая аффинность антитела к антигену, выраженная в виде константы диссоциации (KD) при нейтральном значении pH меньше, чем 10-6 М, например, меньше, чем 10-8 М, например, меньше, чем 10-9 М, например, меньше, чем 10-10 М, например, меньше, чем 10-11 М, например, меньше, чем 10-12 М.
Как описано выше, согласно одному варианту осуществления ULC мыши содержат единственную реаранжированную генную последовательность вариабельной области легкой цепи человека и экспрессируют антитела в ответ на антиген, где аффинность антител к антигену в первую очередь опосредована через тяжелые цепи их антител. Эти мыши содержат репертуар вариабельных сегментов (V, D и J) тяжелых цепей человека, которые реаранжируют для кодирования вариабельного домена тяжелой цепи антитела человека, которое также содержит легкую цепь, полученную из единственной реаранжированной вариабельной последовательности легкой цепи человека. Согласно одному варианту осуществления при воздействии антигена эти мыши используют разнообразный репертуар вариабельных сегментов (V, D и J) тяжелых цепей человека, чтобы производить антитело с аффинностью и специфичностью к антигену. Таким образом, при воздействии антигена нуклеотидная последовательность тяжелой цепи иммуноглобулина антитела, производимая в ULC мышах, может быть выделена и использована для получения требуемого связывающего белка, также содержащего легкую цепь иммуноглобулина, полученную из единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека (например, единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон).
Согласно одному варианту осуществления ULC мышей 90-100% нереаранжированных отличных от человеческих генных сегментов VH замещают по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все (например, 90-100%) эндогенные отличные от человеческих генные сегменты VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере 19, по меньшей мере 39 или по меньшей мере 80 или 81 нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере 25 функциональных нереаранжированных генных сегментов VH человека или по меньшей мере 43 функциональных нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH по меньшей мере одним нереаранжированным сегментом DH человека и по меньшей мере одним нереаранжированным сегментом JH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH всеми переаранжированными сегментами DH человека и всеми нереаранжированными сегментами JH человека. Таким образом, ULC мышь использует широкий репертуар генных сегментов вариабельных областей человека (V, D и J сегментов) для производства антитела в ответ на представляющий интерес антиген.
Как только тяжелая цепь антитела, которое связывается с представляющим интерес антигеном с желаемой аффинностью, определена, нуклеотидную последовательность тяжелой цепи выделяют и секвенируют. Последовательность клонируют в вектор для экспрессии в подходящих клетках-хозяевах, например, эукариотических клетках, например, клетках СНО. Согласно одному варианту осуществления последовательность константной области тяжелой цепи человека клонируют ниже по ходу транскрипции последовательности вариабельной области тяжелой цепи человека, выделенной из мыши (например, из ULC мыши).
Согласно одному варианту осуществления способ получения антигенсвязывающего белка с зависимыми от pH антигенсвязывающими свойствами предусматривает модификацию нуклеотидной последовательности легкой цепи иммуноглобулина, в частности, последовательности с единственной реаранжированной вариабельной областью легкой цепи иммуноглобулина человека, чтобы включить в себя замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Различные техники модификации нуклеотидной последовательности известны в настоящей области техники, например, сайт-направленный мутагенез. Кроме того, нуклеотидная последовательность, содержащая требуемую замену гистидина, может быть синтезирована de novo.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон предусматривает замену, приводящую к экспрессии одного, двух, трех, четырех или более остатков гистидина. Согласно одному варианту осуществления замена(ы) приводит к экспрессии трех или четырех остатков гистидина. Согласно одному варианту осуществления замена(ы) происходит в вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления замена(ы) происходит в кодоне CDR, например, кодоне CDR1, CDR2 и/или CDR3. Согласно одному варианту осуществления замена(ы) происходит в кодоне CDR3.
Согласно одному варианту осуществления, в котором последовательность нуклеиновой кислоты легкой цепи иммуноглобулина содержит генную последовательность Vκ1-39Jκ5, и замена(ы) происходит в кодоне CDR3, замена приводит к экспрессии гистидина в положении, выбранном из 105, 106, 108, 111, а также их комбинаций. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106, 108 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 108 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 108 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106, 108 и 111. Последовательности аминокислот и нуклеиновых кислот областей CDR3 Vκ1-39Jκ5, содержащие различные гистидиновые замены, изображены на фиг. 2 и включены в список последовательностей.
Согласно одному варианту осуществления, в котором последовательность нуклеиновой кислоты легкой цепи иммуноглобулина содержит генную последовательность Vκ3-20Jκ1, и замена(ы) происходит в кодоне CDR3, замена приводит к экспрессии гистидина в положении, выбранном из 105, 106, 107, 109, а также их комбинаций. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106, 107 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 107 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 107 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106, 107 и 109. Выбранные последовательности аминокислот и нуклеиновых кислот областей CDR3 Vκ3-20Jκ1, содержащие различные гистидиновые замены, изображены на фиг. 12 и включены в список последовательностей.
Как только последовательность легкой цепи иммуноглобулина, например, вариабельный домен легкой цепи иммуноглобулина человека, модифицируют, чтобы включить в себя остатки гистидина в требуемых положениях, нуклеотидную последовательность легкой цепи клонируют в вектор для экспрессии в подходящих клетках-хозяевах, например, эукариотических клетках, например, клетках СНО. Согласно одному варианту осуществления последовательность константной области легкой цепи человека клонируют ниже по ходу транскрипции от модифицированной нуклеотидной последовательности вариабельной области человека.
Согласно одному варианту осуществления векторы, содержащие нуклеотидную последовательность, кодирующую модифицированную легкую цепь иммуноглобулина человека и выбранную тяжелую цепь иммуноглобулина человека, коэкспрессируют в подходящей клетке-хозяине, например, эукариотической клетке-хозяине, например, клетке СНО для производства антигенсвязывающего белка. Различные клетки-хозяева, которые могут быть использованы для экспрессии, хорошо известны в настоящей области техники и упоминаются в настоящем описании.
Антигенсвязывающий белок, например, антитело, полученный в клетке-хозяине, может быть секретирован в клеточный супернатант, который подвергают скринингу на правильную экспрессию и аффинность к исходному антигену при нейтральном значении pH. Антигенсвязывающий белок также может быть выделен из лизата клеток или, если он связан с мембраной, освобожден от мембраны с использованием подходящего детергента (например, Тритон-Х). Антигенсвязывающий белок с требуемыми характеристиками может быть очищен.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий модификацию(и) гистидина, сохраняет аффинность к антигену, что сопоставимо с аффинностью к тому же антигену (исходному) антигенсвязывающего белка, который не содержит модификации(й) гистидина. Согласно одному варианту осуществления аффинность антигенсвязывающего белка с модифицированным гистидином к представляющему интерес антигену, выраженная как константа диссоциации (KD), при нейтральном значении pH меньше, чем 10-6 М, например, меньше, чем 10-8 М, например, меньше, чем 10-9 М, например, меньше, чем 10-10 М, например, меньше чем 10-11 М, например, меньше, чем 10-12 М.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, содержащий описанные в настоящем документе модификации гистидина, проявляет зависимые от pH антигенсвязывающие свойства. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий гистидиновые модификации, обладает усиленными зависимыми от pH свойствами, по сравнению с эквивалентным антигенсвязывающим белком без модификаций гистидина (антигенсвязывающим белком с той же аминокислотной последовательностью, но вместо модификаций гистидина). Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок сохраняет связывание с антигеном при нейтральном значении pH (например, сохраняет требуемую аффинность к антигену при нейтральном значении pH), при этом отображая уменьшенное связывание при кислом значении pH. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок, например, антитело, не проявляет связывание с антигеном при кислом значении pH, сохраняя при этом связывание с антигеном при нейтральном значении pH. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется уменьшением диссоциационного периода полувыведения (t1/2) при кислом значении pH, по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 1 мин. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 25°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 25°C равным менее чем приблизительно 1 мин.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, содержащий описанные в настоящем документе модификации гистидина, проявляет повышенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с периодом полужизни в сыворотке при введении эквивалентной терапевтической дозы антигенасвязывающего белка, который не содержит модификации гистидина (например, исходный антигенсвязывающий белок, который не содержит гистидиновые модификации). Согласно некоторым вариантам осуществления увеличение периода полужизни в сыворотке при введении дозы антигенсвязывающего белка, содержащего описанные в настоящем документе модификации гистидина, превышает период полужизни в сыворотке при введении той же дозы антигенсвязывающего белка, не содержащего модификации гистидина, приблизительно в 2 раза, например, приблизительно в 5 раз, например, приблизительно в 10 раз, например, приблизительно в 15 раз, например, в 20 раз или более. Согласно одному варианту осуществления период полужизни в сыворотке составляет по меньшей мере приблизительно 1 день, например, по меньшей мере приблизительно 2 дня, например, по меньшей мере приблизительно 7 дней, например, по меньшей мере приблизительно 14 дней, например, по меньшей мере приблизительно 30 дней, например, по меньшей мере приблизительно 60 дней.
В дополнение к способам in vitro для получения описанных выше антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами также в настоящем документе предусмотрены антигенсвязывающие белки, например, антитела, получаемые указанным способом. Кроме того, указанный способ может быть использован для создания мультиспецифических, например, биспецифических, антигенсвязывающих белков, путем выбора двух различных тяжелых цепей иммуноглобулина человека, которые связываются с общей (универсальной) легкой цепью в мыши, определения нуклеотидных последовательностей тяжелых цепей, модификации универсальной легкой цепи для включения описанных выше замен гистидина и коэкспрессии двух тяжелых цепей человека с единственной универсальной легкой цепью с модификациями гистидина в клетке-хозяине. Различные стадии получения описанного выше антигенсвязывающего белка могут быть применимы к способу получения биспецифического антигенсвязывающего белка. Биспецифический антигенсвязывающий белок, обладающий подтвержденной требуемой аффинностью к антигену(ам) и зависимыми от pH антигенсвязывающими свойствами, может быть очищен. Таким образом, предусмотрены биспецифические антитела, содержащие две тяжелые цепи человека и единственную легкую цепь человека, содержащую последовательность вариабельного домена легкой цепи человека, кодируемую геном вариабельной области человека, например, геном вариабельной области Vκ1-39Jκ5 или Vκ3-20Jκ1, содержащим замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Кроме того, предусмотрены конструкты, используемые для получения антигенсвязывающего белка, содержащего тяжелую цепь иммуноглобулина человека и легкую цепь иммуноглобулина человека, содержащую замены гистидина. Также предусмотрены клетки-хозяева, экспрессирующие описанные в настоящем документе антигенсвязывающие белки, например, антитела.
ПРИМЕРЫ
Следующие примеры приведены для того, чтобы описать специалистам в настоящей области техники, как выполнять и применять способы и композиции согласно настоящему изобретению, и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением. Были предприняты усилия, чтобы обеспечить точность в отношении используемых чисел (например, суммы, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны учитываться. Примеры не включают в себя подробные описания обычных способов, которые хорошо известны специалистам в настоящей области техники (техники молекулярного клонирования и т.д.). Если не указано иное, части представляют собой массовые части, молекулярная масса представляет собой среднюю молекулярную массу, температура указана в градусах Цельсия, а давление равно или близко к атмосферному.
Пример 1. Идентификация остатков гистидина в антигенспецифических легких цепях человека
Получение мыши с общей легкой цепью (например, мыши с общей легкой цепью Vκ1-39 или Vκ3-20) и антигенспецифических антител у тех мышей, описано в заявках на патент США №13/022759, 13/093156 и 13/412936 (публикация №2011/0195454, 2012/0021409 и 2012/0192300, соответственно), включенных полностью в настоящий документ посредством ссылки. Вкратце, нацеливающий вектор реаранжированной легкой цепи зародышевой линии человека получали с использованием технологии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6): 652-659)), для модификации мышиных геномных клонов бактериальной искусственной хромосомы (ВАС), и геномные конструкты разрабатывали для включения единственной реаранжированной области легкой цепи зародышевой линии человека, и встраивали в эндогенный локус легкой цепи κ, который ранее модифицировали для удаления эндогенных генных сегментов вариабельных и соединяющих κ. Нацеленные ДНК ВАС затем использовали для электропорации ES клеток мыши для создания модифицированных ES клеток для получения химерных мышей, которые экспрессируют реаранжированные области Vκ1-39Jκ5 или Vκ3-20Jκ1 зародышевой линии человека. Нацеленные ES клетки использовали в качестве донорских ES клеток и вводили в эмбриона мыши на стадии 8-клеток с помощью способа VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1): 91-99). VELOCIMICE® независимо несущие сконструированную область легкой цепи Vκ1-39Jκ5 или Vκ3-20Jκ1 зародышевой линии человека идентифицировали путем генотипирования с использованием анализа модификации аллеля (Valenzuela et al., смотрите выше), который обнаруживает наличие уникальной реаранжированной области легкой цепи зародышевой линии человека.
Мышей, несущих сконструированный локус легкой цепи зародышевой линии человека (ULC мышей), скрещивали с мышами, которые содержат замещение эндогенного локуса вариабельного гена тяжелой цепи мыши с локусом вариабельного гена тяжелой цепи человека (смотрите US 6596541; the VELOCIMMUNE® mouse, Regeneran Pharmaceuticals, Inc.).
VELOCIMMUNE® мышь, содержащая единственную реаранжированную область легкой цепи зародышевой линии человека сенсибилизируют представляющим интерес антигеном, и антитела, содержащие универсальную легкую цепь (например, Vκ1-39Jκ5), изолируют и секвенируют.Выравнивали аминокислотные последовательности выбранных легких цепей (A-K) из антигенспецифических антител человека, полученных от мыши с общей легкой цепью Vκ1-39Jκ5. Идентифицировали гистидиновые мутации в CDR полученных от Vκ1-39 легких цепей человека для выбранного числа антигенспецифических человеческих антител (фиг. 1). Частичная аминокислотная последовательность вариабельного домена Vκ1-39Jκ5 зародышевой линии показана над выравниваниями и представлена в SEQ ID NO: 1, полная аминокислотная последовательность вариабельного домена представлена в SEQ ID NO: 80.
Пример 2. Конструирование и характеристика антител человека с универсальными легкими цепями с заменами гистидина
Пример 2.1. Встраивание остатков гистидина в реаранжированную легкую цепь зародышевой линии человека
Остатки гистидина встраивали в реаранжированную легкую цепь Vκ1-39Jκ5 человека с использованием праймеров сайт-направленного мутагенеза, специально разработанных для введения сконструированных остатков гистидина в положения Q105, Q106, Y108 и Р111 легкой цепи Vκ1-39Jκ5 человека. Сайт-направленный мутагенез проводили с использованием молекулярных техник, известных в настоящей области техники (например, QuikChange II XL Site Directed Mutagenesis Kit, Agilent Technologies). Положения встроенных остатков в CDR3 показаны на фиг. 2, последовательности нуклеиновых кислот CDR3 с заменами гистидинов, изображенные на фиг. 2, приведены в SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30 и 32 (соответствующие аминокислотные последовательности представлены в SEQ ID NO: 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31 и 33). Последовательности нуклеиновых кислот и аминокислот CDR3 реаранжированных Vκ1-39Jκ5 зародышевой линии, представлены в SEQ ID NO: 2 и 3, соответственно.
Пример 2.2. Конструкция и экспрессия легких цепей с встроенными гистидинами
Полученные из Vκ1-39 легкие цепи человека, содержащие зародышевую линию со встроенными остатками гистидина, полученные в соответствии с примером 2, конструировали и спаривали с различными тяжелыми цепями человека (обозначены 1-5), специфичными к рецептору клеточной поверхности человека, для анализа экспрессии в клетках СНО. Пять тяжелых цепей человека, специфичных к рецептору клеточной поверхности человека, которые были спарены с полученными из Vκ1-39 легких цепей с заменами гистидинов, получали от мышей, которые содержат единственную реаранжированную легкую цепь человека (реаранжированную легкую цепь Vκ1-39/Jκ5 человека; смотрите US 2011/0195454 А1).
Иммуноферментный анализ (ELISA): секрецию антител из клеток СНО обнаруживали с помощью Fc ELISA для легких цепей с указанными модификациями гистидина с пятью различными тяжелыми цепями. Последовательности легких и тяжелых цепей (но без модификаций) получали на мышах, которые содержат единственную реаранжированную легкую цепь человека (например, реаранжированную легкую цепь Vκ1-39/Jκ5 человека, смотрите US 2011/0195454 A1). Захватывающим антителом было козье к IgG человека и обнаруживающим антителом было козье к HRP человека (Fc гамма-специфическое). Результаты показаны на фиг. 3. ULC + тяжелая: специфическая тяжелая цепь и немодифицированная производная от Vκ1-39 легкая цепь человека. Как показано на фиг. 3, экспрессию обнаруживали приблизительно у всех мутантов.
Иммуноблоттинг белка. Экспрессию в супернатантах клеток СНО спаренных антигенспецифических тяжелых цепей с легкими цепями со встроенным гистидином дополнительно анализировали с помощью вестерн-блоттинга. Образцы подвергали электрофорезу на 4-12% трис-глициновом геле. Результаты использования выбранной тяжелой цепи (тяжелой цепи 3) показаны на фиг. 4. ULC относится к реаранжированной полученной из Vκ1-39 легкой цепи человека (как описано выше).
Пример 2.3. Определение аффинности связывания легких цепей со встроенным гистидином
Равновесные константы диссоциации (KD), диссоциационные периоды полувыведения (t1/2) и другие кинетические параметры для выбранных супернатантов антител определяли с помощью SPR (поверхностного плазмонного резонанса) с использованием прибора BIACORE™ Т200 (GE Healthcare). Кинетики измеряли при pH 7,4 и при pH 5,75. Результаты показаны на фиг. 5А-5Е.
Числовые значения для свойств кинетики связывания (например, ka, kd, KD, t1/2 и т.д.) антител, связывающихся с иммуногеном при нейтральном значении pH (pH 7,4) и при кислом значении pH (pH 5,75) получали с использованием биосенсора поверхностного плазмонного резонанса в реальном времени (Biacore Т200). Сенсорный чип Biacore СМ5 получали с использованием мышиного антитела к Fc человека для захвата антител из супернатанта. Одну концентрацию (50 нм) иммуногена затем вносили на поверхность с захваченнными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали в течение 2,5 минут, а затем наблюдали диссоциацию антигена от захваченного антитела в течение 8 минут. Константы скорости кинетической ассоциации (ka) и диссоциации (kd) определяли путем обработки и подгонки данных связывания 1:1 с массовой транспортной моделью с использованием программного обеспечения Biacore Т200 Evaluation версии 1.0. Равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t1/2) рассчитывали из констант кинетической скорости как: KD (М)=kd/ka; и t1/2 (мин)=(ln2/(60*kd).
Как показано на фиг. 5 в анализе связывания антитела с рецептором клеточной поверхности, двое из пяти антител с общими легкими цепями с модифицированными гистидинами (CDR3 легких цепей Vκ1-39/Jκ5 с модифицированными гистидинами), которые были спарены с антигенспецифическими тяжелыми цепями человека, проявляющими связывание с антигеном (например, с рецептором клеточной поверхности) с различными аффинностями при pH 7,4 и pH 5,75. Желательны антитела с модификациями гистидина, которые сохраняют связывание при pH 7,4, но проявляют сниженное связывание или не обнаруживаемое связывание при pH 5,75. Желательны антитела с модификацией гистидина, которые демонстрируют сниженный t1/2 при pH 5,75, по сравнению с pH 7,4.
Данные связывания антигена для трех антител, содержащих общие легкие цепи с модифицированным гистидином и три антигенспецифические тяжелые цепи (обозначенные 2, 3 и 6) при различных значениях pH суммировали дополнительно на фиг. 6. Эти антитела проявляли значительное падение в связывании антигена при pH 5,75, по сравнению с pH 7,4, о чем свидетельствует, например, сокращение в t1/2 или не обнаруженное связывание при pH 5,75.
Пример 3. Конструирование и характеристика генетически модифицированной мыши, содержащей универсальную легкую цепь Vκ1-39Jκ5 с заменами гистидина
Пример 3.1. Конструкция нацеливающего вектора для встраивания остатков гистидина в реаранжированную вариабельную область легкой цепи человека
Генетически модифицированную мышь, содержащую реаранжированный ген легкой цепи человека, содержащий остатки гистидина, встроенные в область CDR легкой цепи человека, получали с помощью нацеливающих векторов, полученных с помощью стандартных техник молекулярного клонирования, известных в настоящей области техники.
Кратко, различные реаранжированные нацеливающие векторы легкой цепи зародышевой линии человека получают с использованием технологии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659) для модификации геномной ДНК бактериальной искусственной хромосомы (ВАС) мыши для включения единственной реаранжированной области легкой цепи зародышевой линии человека и вставляют в эндогенный локус легкой цепи κ, который был ранее модифицирован для удаления эндогенных генных сегментов вариабельных и соединяющих κ. Реаранжированную область легкой цепи зародышевой линии человека модифицировали в одном или нескольких положениях нуклеотидов в последовательности легкой цепи для кодирования остатков гистидина, которые обычно не присутствуют в соответствующих положениях в последовательности зародышевой линии. Нацеливающие векторы электропорировали в мышиные эмбриональные стволовые (ES) клетки и подтверждали с использованием анализа количественной ПЦР (например, TAQMAN™).
В частности, стратегия для конструирования этих нацеливающих векторов показана на фиг. 8A-8F. Плазмиду, используемую для производства нацеливающего вектора для мыши с общей (универсальной) легкой цепью (ʺULC мышиʺ, описанной, например, в US 2011/0195454 A1), содержащего pBS + FRT-Ub-Hyg-FRT + лидер Vκ3-7 мыши + Vκ1-39Jκ5 человека, модифицировали с помощью сайт-направленного мутагенеза (QuickChange II Kit XL) для замещения Q105, Q106, Y108 и P111 или Q106, Y108 и Р111 остатками гистидина в области CDR3 с использованием праймеров сайт-направленного мутагенеза, показанных на фиг. 7 (смотрите фиг. 8А для этой стадии встраивания). Результирующие векторы (H105/106/108/111 и Н106/108/111) дополнительно модифицировали и лигировали в вектор, содержащий константную область Igκ мыши, энхансеры мыши, плечо гомологии 3' мыши и кассету SPEC (фиг. 8В). Дополнительная модификация включала в себя лигацию в вектор, несущий плечо 5' мыши и содержащий кассету Frt-Ub-NEO-Frt (фиг. 8В). Результирующие нацеливающие векторы электропорировали в ES клетки, содержащие делецию вариабельного локуса IgK мыши (содержащего вариабельные и соединяющие генные сегменты к) (фиг. 8C-8F).
Позитивные клоны ES клеток подтверждали с использованием модификации аллельного анализа (Valenzuela et al.) с использованием зондов, специфичных к сконструированной области легкой цепи Vκ1-39Jκ5, вставленных в эндогенный локус легкой цепи κ. Используемые в анализе праймеры и зонды представлены в таблице 1 ниже и представлены в списке последовательностей; места расположения зондов изображены на фиг. 8C-8F.
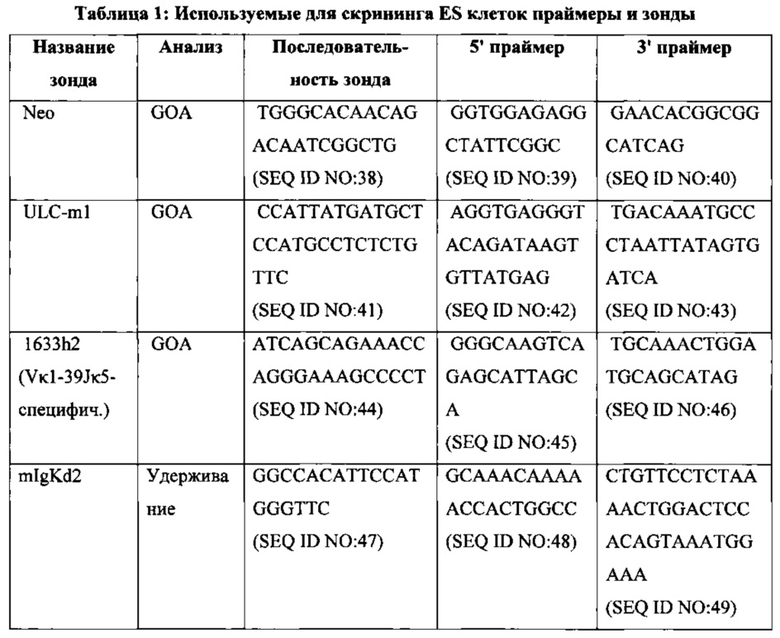

Кассету отбора NEO, введенную с помощью нацеливающих конструктов, удаляли с помощью трансфекции ES клеток с плазмидой, которая экспрессирует FLP (фиг. 8С и 8Е). Необязательно, неомициновая кассета может быть удалена путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, US 6774279). Необязательно, неомициновая кассета сохраняется у мышей.
Описанные выше нацеленные ES клетки использовали в качестве доноров ES клеток и вводили в эмбрион мыши на стадии 8-клеток способом VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially folly derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99). VELOCIMICE® независимо несущие сконструированный ген легкой цепи человека, который содержит остатки гистидина, мутировавшие в одном или нескольких положениях по последовательности, получали из описанных выше нацеленных ES клеток.
Детенышей генотипировали и выбирали детенышей, гетерозиготных по сконструированным легким цепям человека с модифицированным гистидином, для характеристики экспрессии легкой цепи и связывающих возможностей экспрессированных антител. Праймеры и зонды для генотипирования мышей, специфически содержащих универсальный ген легкой цепи либо с тремя (H106/108/111; ʺ1930ʺ), либо с четырьмя (H105/105/108/111; ʺ1927ʺ) модификациями гистидина, перечислены в таблице 2 ниже и приведены в списке последовательностей. Мыши, содержащие модификацию гистидина в своих универсальных легких цепях, называются в настоящем документе как ʺHULCʺ мыши (мыши с гистидин-универсальными легкими цепями).
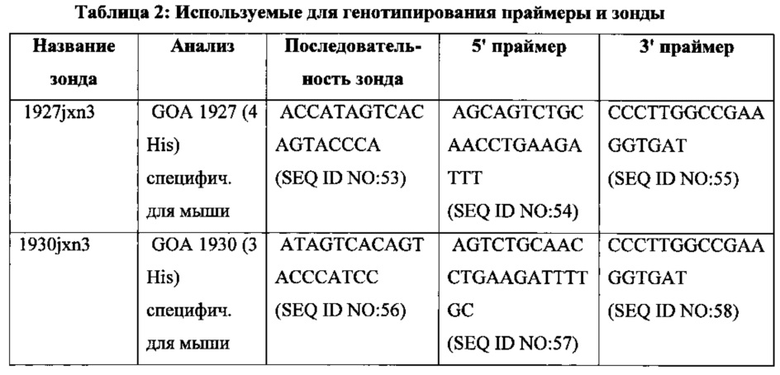
Пример 3.2. Анализ иммунного ответа на антиген у мышей с универсальными легкими цепями с заменами гистидина
Рецептор клеточной поверхности (ʺантиген Аʺ) использовали в качестве иммуногена для иммунизации мышей, которые были либо гетерозиготными по экспрессии заранее подготовленной легкой цепи каппа человека, использующей Vκ1-39 и Jκ5, который содержит 4 гистидиновые замены в CDR3 (далее ʺHULC 1927ʺ), либо гетерозиготными по экспрессии заранее подготовленной легкой цепи каппа человека, использующей Vκ1-39 и Jκ5, который содержит 3 гистидиновые замены в CDR3 (далее ʺHULC 1930ʺ), либо гомозиготных мышей WT. Предварительно иммунную сыворотку собирали у мышей до начала иммунизации. Иммуноген вводили для начальной примированной иммунизации в количестве 2,35 мкг белка, смешанного с 10 мкг олигонуклеотида CpG в качестве адъюванта (Invivogen) в объеме 25 мкл через подушечку лапы (FP). Впоследствии, мышей повторно иммунизировали тем же путем в количестве 2,35 мкг антигена А вместе с 10 мкг CpG и 25 мкг Adju-Phos (Brenntag) в качестве адъювантов на 3, 6, 11, 13, 17, 20 день для достижения в общей сложности шести повторных иммунизаций. У мышей брали кровь на 15 и 22 дни после четвертой и шестой повторной иммунизации, соответственно, и антисыворотку оценивали на титры антител с антигеном А.
Титры антител сыворотки против иммуногена определяли с использованием стандартного анализа ELISA. Для выполнения ELISA 96-луночные планшеты для микротитрования (Thermo Scientific) покрывали 2 мкг/мл антигена А в фосфатном буфере (PBS, Irvine Scientific) в течение ночи при 4°C. На следующий день планшеты отмывали фосфатным буфером, содержащим 0,05% Tween 20 (PBS-T, Sigma-Aldrich) четыре раза, используя машину для мойки планшетов (Molecular Devices). Затем планшеты блокировали с помощью 250 мкл 0,5% бычьего сывороточного альбумина (BSA, Sigma-Aldrich) в PBS и инкубировали в течение 1 часа при комнатной температуре. Затем планшеты отмывали четыре раза в PBS-T. Сыворотки от иммунизированных мышей и предварительно иммунные сыворотки серийно разводили в три раза в 0,5% BSA PBS-T, начиная с 1:300 или 1:1000, добавляли к блокированным планшетам в двух экземплярах и инкубировали в течение 1 часа при комнатной температуре. Последние две лунки оставляли пустыми для использования в качестве вторичного антитела контроля (фоновый контроль). Планшеты снова отмывали четыре раза PBS-T в машине для мойки планшетов. Козье антитело к мышиному конъюгированному вторичному антителу IgG-Fc-пероксидаза хрена (HRP, Jackson Immunoresearch) затем добавляли в планшеты в разведении 1:5000/1:10000 и инкубировали в течение одного часа при комнатной температуре. Планшеты снова отмывали восемь раз PBS-T и развивали с использованием в качестве субстрата ТМВ/Н2О2. Субстрат инкубировали в течение двадцати минут, и реакцию останавливали с помощью 2 N серной кислоты (H2SO4, VWR, кат. # BDH3500-1) или 1 N фосфорной кислоты (JT Baker, кат. # 7664-38-2). Планшеты считывали на спектрофотометре (Victor, Perkin Elmer) при 450 нм. Титры антител рассчитывали с использованием программного обеспечения Graphpad PRISM.
Индуцированный у мышей к введенному иммуногену иммунный ответ представляли как титры антител, которые определяются как величина, обратная наибольшему разведению сыворотки, при котором антигенсвязывающая абсорбция в два раза выше фоновой. Таким образом, чем больше число, тем больше гуморальный иммунный ответ на иммуноген. Индуцированные к иммуногену титры антител были очень высокими как в обеих линиях HULC мышей, так и у мышей дикого типа, без наблюдаемых существенных различий среди линий (фиг. 9).
Пример 3.3. Получение чувствительных к pH моноклональных антител
Когда требуемый иммунный ответ на иммуноген достигал как в обеих линиях HULC мышей, так и у мышей дикого типа, спленоциты из каждой линии мышей собирали и сливали с клетками миеломы мыши, чтобы производить гибридомные клетки, которые позволяли расти в 96-луночных планшетах. После 10 дней роста супернатанты от каждой содержащей клетки гибридомы лунки подвергали скринингу с помощью иммуноген-специфического анализа ELISA для идентификации позитивных антигенсвязывающих образцов. Для ELISA 96-луночные планшеты для микротитрования покрывали 1 мкг/мл поликлональным антителом к myc (Novus Biologicals, #NB600-34) в течение ночи при 4°C для иммобилизации myc-меченого антигена с последующим блокированием раствором 0,5% (вес/объем) БСА в PBS. Планшеты отмывали, растворы антигена добавляли в планшеты в концентрации 1 мкг/мл и позволяли связаться с покрытым планшетом в течение 1 часа при комнатной температуре. Затем супернатанты от гибридомных клеток добавляли к лункам при разведении 1:50 и оставляли для связывания в течение 1 часа при комнатной температуре. Связавшие антитела планшеты детектировали с использованием поликлональных антител к IgG мыши, конъюгированного с HRP (Jackson Immunoresearch, #115-035-164). ТМВ субстраты добавляли к планшетам (BD Biosciences, # 51-2606KC/51-2607KC), и колориметрические сигналы разрабатывали в соответствии с рекомендованным производителем протоколом. Абсорбцию записывали при 450 нм на планшетном ридере Victor Wallac. Образцы положительных антигенов, определенные как характеризующиеся OD равным или более, чем 0,5 (с базовым OD приблизительно 0,1) подвергали скринингу на аффинность с использованием биосенсора поверхностного плазмонного резонанса в режиме реального времени (Biacore 4000).
Записывали кинетические параметры связывания (например, ka, kd, KD, t1/2 и т.д.) антител, связывающихся с иммуногеном при нейтральном значении pH (pH 7,4) и при кислых значениях pH (pH 6,0). Сенсорный чип Biacore СМ4 получали с использованием поликлонального козьего антитела к Fc мыши для захвата антител из супернатанта. Одну концентрацию (100 нм) иммуногена затем вносили на поверхность с захваченными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали в течение 1,5 минут, а затем диссоциацию антигена от захваченного антитела наблюдали в течение 2,5 мин. Константы скорости кинетической ассоциации (ka) и диссоциации (kd) определяли путем обработки и подгонки данных к связыванию 1:1 с массовой транспортной моделью с использованием программного обеспечения Biacore Т200 Evaluation версии 1.0. Равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t1/2) рассчитывали из констант кинетической скорости как: KD (М)=kd/ka; и t1/2 (мин)=ln2/(60*kd). Набор образцов, которые отображали сниженное связывание при pH 6,0, по сравнению с тем же при pH 7,4 (чувствительность к pH), а также набор контрольных образцов, которые не отображали никаких существенных изменений скорости между pH 7,4 и pH 6,0 (не чувствительные к pH контроли) выбирали для клонального производства. На фиг. 10 изображено сравнение числа всех положительных антигенов и числа положительных антигенов, отображающих чувствительное к pH связывание антигена от HULC и WT мышей.
Среди положительных антигенов сделали моноклональными 18 и 7 клонов, выделенных из двух гетерозиготных HULC 1927 мышей и двух HULC 1930, соответственно, и 1 клон от мыши WT. Супернатанты из моноклональных гибридом подвергали анализу скорости диссоциации антигена при нейтральном и низком значении pH (скорость диссоциации), и клеточные осадки использовали для секвенирования ДНК вариабельного домена легкой цепи.
Пример 3.4. Секвенирование и соматические гипермутации в области CDR3 основанных на Vκ1-39Jκ5 мышей с гистидин-универсалъными легкими цепями
Осадки клеток из моноклональных гибридом из HULC мышей и мышей дикого типа использовали для секвенирования ДНК вариабельного домена легкой цепи. Из 26 клонов, сделанных моноклональными (пример 3.3 выше) и подвергнутых секвенированию, 15 были подтверждены как с использованием легких цепей либо HULC, либо WT мышей (ММ и NN, смотрите таблицу 4). 14 клонов были получены из HULC гетерозиготных мышей (1927 или 1930) и 1 был получен из мыши WT (ОО, смотрите таблицу 4).
Из 14 антиген положительных образцов, полученных из HULC гетерозиготных мышей, 12 моноклональных антител использовали их соответствующую легкую цепь HULC, в то время как 2 использовали легкую цепь мыши WT. Все, кроме одного использующего HULC антитела, сохраняли все введенные мутации гистидина, как показано в таблице 3 (антитела курсивом). Секвенирование клона АА производило 2 разных последовательности HULC, что отражается двумя записями в таблице 3.


Пример 3.5. Зависимое от pH связывание моноклоналъных антител, полученных от основанных на Vκ1-39Jκ5 мышей с гистидин-универсальными легкими цепями
Для дальнейшей оценки зависимых от pH характеристик связывания моноклональных антител, выделенных из HULC мышей и мышей дикого типа, проводили эксперименты по связыванию, в которых фаза ассоциации антитела/антигена наблюдалась при нейтральном значении pH, а фаза диссоциации антитела/антигена наблюдалась как при нейтральных, так и при кислых значениях pH.
Сенсорный чип Biacore СМ4 получали с использованием поликлонального кроличьего антитела к Fc мыши. Супернатанты моноклональных антител захватывали на поверхности сенсора Fc мыши. Две концентрации, 50 нм (в двух повторах) и 16,7 нМ, иммуногена вводили на поверхность с захваченными моноклональными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали при pH 7,4 в течение 4 минут, а затем диссоциацию антигена из захваченного моноклонального антитела наблюдали в течение 15 минут как при pH 7,4, так и 6,0. Константы скорости диссоциации (kd) определяли с помощью обработки и подгонки данных с использованием программного обеспечения подгонки кривой Scrubber версии 2.0 и они показаны в таблице 4. Диссоциационный период полувыведения (ti/2) рассчитывали из констант скорости диссоциации, как: t1/2 (мин)=(ln2/kd)/60 и они показаны в таблице 4. Сенсограммы, изображающие характеристики ассоциации/диссоциации нескольких антител, перечисленные в таблице 4 при различных условиях pH, показаны графически на фиг. 11. Отдельные линии в каждом графике представляют собой связывающие реакции при различных концентрациях соответствующих антител. Все эксперименты проводились при 25°C. Значения диссоциационных периодов полувыведения (t1/2) отмечены выше соответствующих сенсограмм. Реакция измеряется в RU.
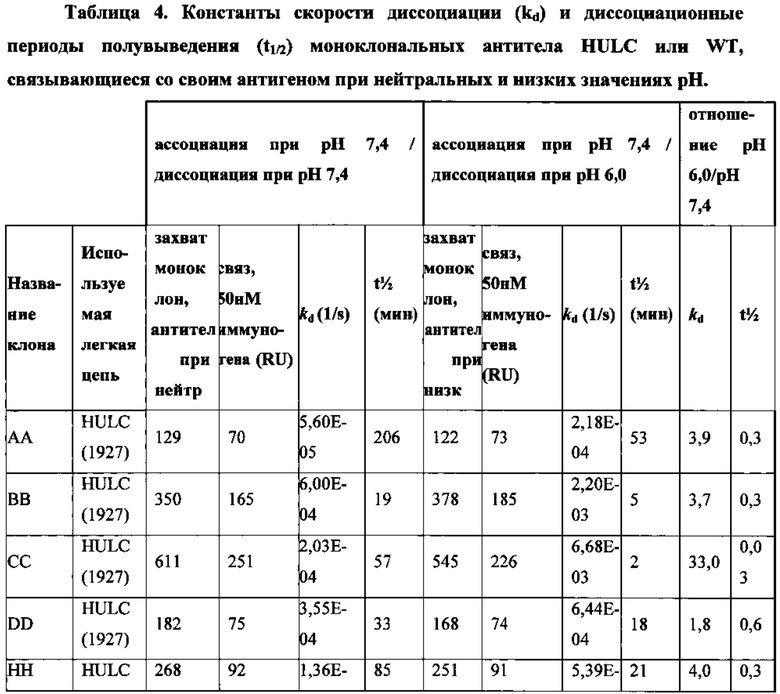
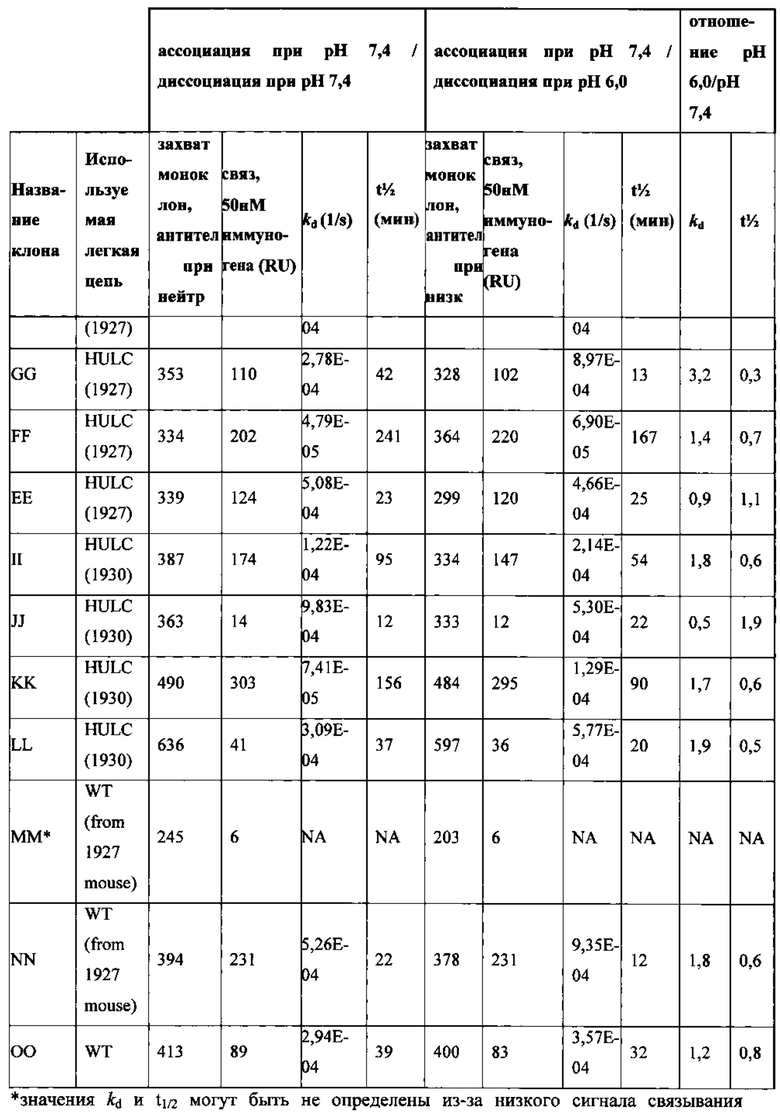
антигена
Пример 4. Конструирование генетически модифицированной мыши, содержащей универсальную легкую цепь Vκ3-20Jκ1 с заменами гистидина
Мышь, содержащую общую легкую цепь Vκ3-20Jκ1, получали как описано, например, в заявке на патент США №13/022759, 13/093156, 13/412936 и 13/488628 (публикации №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, соответственно), а также в примере 1 выше. Аминокислотная последовательность зародышевой линии из вариабельного домена универсальной легкой цепи Vκ3-20Jκ1 представлена в SEQ ID NO: 59.
Гистидиновые замены вводили в нацеливающий вектор универсальной легкой цепи Vκ3-20Jκ1, и получали мышей, используя подобную описанной выше в примере 3 стратегию для мышей с универсальными легкими цепями Vκ1-39Jκ5 с модифицированным гистидином (HULC 1927 и 1930).
Вкратце, стратегия для получения нацеливающего вектора универсальной легкой цепи Vκ3-20Jκ1 с модификациями гистидина представлена на фиг. 14A-14D. Плазмиду, используемую для производства нацеливающего вектора для общей (универсальной) легкой цепи мыши (ʺULC мышиʺ, описанной, например, в US 2011/0195454 А1), содержащего pBS + FRT-Ub-Hyg-FRT + лидер Vκ3-7 мыши + Vκ3-20Jκ1 человека, модифицировали с помощью сайт-направленного мутагенеза (QuickChange II Kit XL) для замещения Q105, Q106, Y107 и S109 или Q105, Q106 и S109 (смотрите выравнивание на фиг. 12) остатками гистидина в области CDR3 с использованием праймеров сайт-направленного мутагенеза, показанных на фиг. 13 (смотрите фиг. 14А для этой стадии встраивания). Результирующие векторы (H105/106/107/109 и H105/106/109) дополнительно модифицировали и лигировали в вектор, содержащий константную область Igκ мыши, энхансеры мыши, плечо гомологии 3' мыши и кассету SPEC (фиг. 14В). Дополнительная модификация включала в себя лигацию в вектор, несущий плечо 5' мыши и содержащий кассету Frt-Ub-NEO-Frt (фиг. 14В). Результирующие нацеливающие векторы электропорировали в ES клетки, содержащие делецию вариабельного локуса Igκ мыши (содержащего вариабельные и соединяющие генные сегменты κ) (фиг. 14C-14D).
Положительные клоны ES клеток подтверждали с использованием модификации аллельного анализа (Valenzuela et al.) с использованием зондов, специфических к сконструированной области легкой цепи Vκ3-20Jκ1, вставленной в эндогенный локус легкой цепи κ. Используемые в анализе праймеры и зонды представлены в таблице 5 ниже и представлены в списке последовательностей; места расположения зондов изображены на фиг. 14C-14D.

Кассету отбора NEO, введенную с помощью нацеливающих конструктов, удаляли с помощью трансфекции ES клеток с плазмидой, которая экспрессирует FLP (фиг. 14С и 14D). Необязательно, неомициновая кассета может быть удалена путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, US 6774279). Необязательно, неомициновая кассета сохраняется у мышей.
Описанные выше нацеленные ES клетки использовали в качестве доноров ES клеток и вводили в эмбрион мыши на стадии 8-клеток способом VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99. VELOCIMICE® независимо несущие сконструированный ген легкой цепи человека, который содержит остатки гистидина, мутировавшие в одном или нескольких положениях по последовательности, получали из описанных выше нацеленных ES клеток.
Детенышей генотипировали и выбирали детенышей, гетерозиготных по сконструированным легким цепям человека с модифицированным гистидином, для характеристики экспрессии легкой цепи и связывающих возможностей экспрессированных антител. Праймеры и зонды для генотипирования мышей, специфически содержащих универсальный ген легкой цепи либо с тремя (Н105/106/109; ʺ6183ʺ), либо с четырьмя (Н105/105/108/111; ʺ6181ʺ) модификациями гистидина, перечислены в таблице 6 ниже и приведены в списке последовательностей. Мыши, содержащие модификацию гистидина в своих универсальных легких цепях, называются в настоящем документе как ʺHULCʺ мыши (мыши с гистидин-универсальными легкими цепями).

Мышей иммунизировали представляющим интерес антигеном и исследовали на способность производить антитела с зависимым от pH связыванием.
Пример 5. Скрещивание мышей, содержащих единственную реаранжированную универсальную легкую цепь человека (HULC) с заменами гистидина
В этом примере описаны несколько других генетически модифицированных линий мышей, которые могут быть скрещены с любой из описанных в настоящем документе HULC мышей для создания множественных генетически модифицированных линий мышей, несущих множественные генетически модифицированные локусы иммуноглобулинов.
Эндогенный нокаут Igλ (KO). Чтобы оптимизировать использование сконструированного локуса легкой цепи, любое из описанных выше HULC животных (например, содержащее универсальную легкую цепь с заменами гистидина Vκ1-39Jκ5 или Vκ3-20Jκ1) может быть скрещено с другой мышью, содержащей делецию в эндогенном локусе легкой цепи λ. Таким образом, полученное потомство будет экспрессировать в качестве единственного легкой цепи реаранжированную область легкой цепи зародышевой линии человека с заменами гистидина, как описано в примерах 3 и 4 выше. Скрещивание выполняется с помощью стандартных техник, признанных в настоящей области техники и, в качестве альтернативы, коммерческим заводчиком (например, Jackson Laboratory). Линии мышей, несущие сконструированный локус легкой цепи с заменами гистидина и делецию эндогенного локуса легкой цепи λ, подвергают скринингу на присутствие области уникальной легкой цепи и отсутствие эндогенных легких цепей λ мыши.
Гуманизированный эндогенный локус тяжелой цепи. Мышей, несущих сконструированный локус легкой цепи зародышевой линии человека с заменами гистидина (HULC мыши), скрещивают с мышами, которые содержат замещение эндогенного локуса вариабельного гена тяжелой цепи мыши локусом вариабельного гена тяжелой цепи человека (смотрите US 6596541; VELOCIMMUNE® мышь, Regeneran Pharmaceuticals, Inc.). VELOCIMMUNE® мыши содержат геном, содержащий вариабельные области тяжелой цепи человека, функционально связанные с эндогенными локусами константной области мыши таким образом, что мышь продуцирует антитела, содержащие вариабельный домен тяжелой цепи человека и константную область тяжелой цепи мыши в ответ на антигенную стимуляцию.
Получают мышей, несущих замещение эндогенного локуса вариабельной области тяжелой цепи мыши на локус вариабельной области тяжелой цепи человека и единственную реаранжированную вариабельную область легкой цепи человека с заменами гистидина в эндогенном локусе легкой цепи κ. Получают обратные химерные антитела, содержащие соматически мутировавшие тяжелые цепи (вариабельный домен тяжелой цепи человека и CH мыши) с единственной легкой цепью человека с заменами гистидина (HULC, вариабельный домен легкой цепи человека и CL мыши) при иммунизации с представляющим интерес антигеном. Идентифицируют полученные у таких мышей зависимые от pH антитела человека с использованием выделения и скрининга антител способами, известными в настоящей области техники или описанными выше. Идентифицируют нуклеотидные последовательности вариабельных областей легкой и тяжелой цепей экспрессирующих антитела В-клеток, например, чувствительные к pH антитела, и получают полностью человеческие антитела путем слияния нуклеотидных последовательностей вариабельных областей легкой и тяжелой цепей с нуклеотидными последовательностями CH и CL человека, соответственно, в подходящей системе экспрессии.
Эквиваленты
Специалистам в настоящей области техники будет понятно или они в будут состоянии определить, используя не более чем рутинные эксперименты, многие эквиваленты описанных в настоящем документе конкретных вариантов осуществления настоящего изобретения. Предполагается, что такие эквиваленты охватываются прилагаемой формулой изобретения.
Полное содержание всех не патентных документов, заявок и патентов, указанных в настоящей заявке, полностью включено в настоящий документ посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА СО ВСТРОЕННЫМ В ЛЕГКИЕ ЦЕПИ ГИСТИДИНОМ И ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2694728C2 |
| ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ, ЭКСПРЕССИРУЮЩИЕ ЧУВСТВИТЕЛЬНЫЕ К pН ПОСЛЕДОВАТЕЛЬНОСТИ ИММУНОГЛОБУЛИНОВ | 2013 |
|
RU2664473C2 |
| НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ ЖИВОТНЫЕ С МОДИФИЦИРОВАННЫМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ ТЯЖЕЛЫХ ЦЕПЕЙ ИММУНОГЛОБУЛИНОВ | 2014 |
|
RU2618886C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2812814C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2689664C2 |
| МЫШЬ С ОБЩЕЙ ЛЕГКОЙ ЦЕПЬЮ | 2013 |
|
RU2683514C2 |
| МЫШИ С ГУМАНИЗИРОВАННОЙ УНИВЕРСАЛЬНОЙ ЛЕГКОЙ ЦЕПЬЮ | 2012 |
|
RU2664232C2 |
| МЫШИ С ГУМАНИЗИРОВАННОЙ УНИВЕРСАЛЬНОЙ ЛЕГКОЙ ЦЕПЬЮ | 2012 |
|
RU2787781C2 |
| ГУМАНИЗИРОВАННЫЕ НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕКУ ЖИВОТНЫЕ С ОГРАНИЧЕННЫМИ ЛОКУСАМИ ТЯЖЕЛОЙ ЦЕПИ ИММУНОГЛОБУЛИНА | 2013 |
|
RU2656155C2 |
| МЫШИ С ОГРАНИЧЕННОЙ ТЯЖЕЛОЙ ЦЕПЬЮ ИММУНОГЛОБУЛИНА | 2012 |
|
RU2603090C2 |























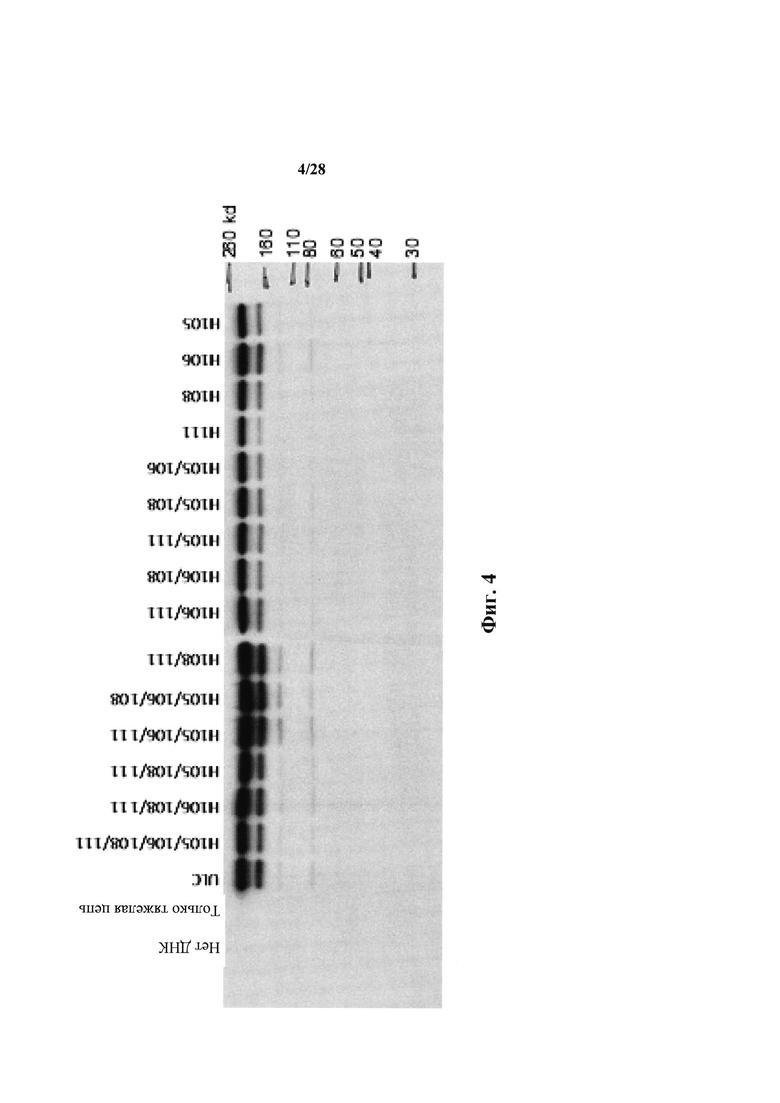
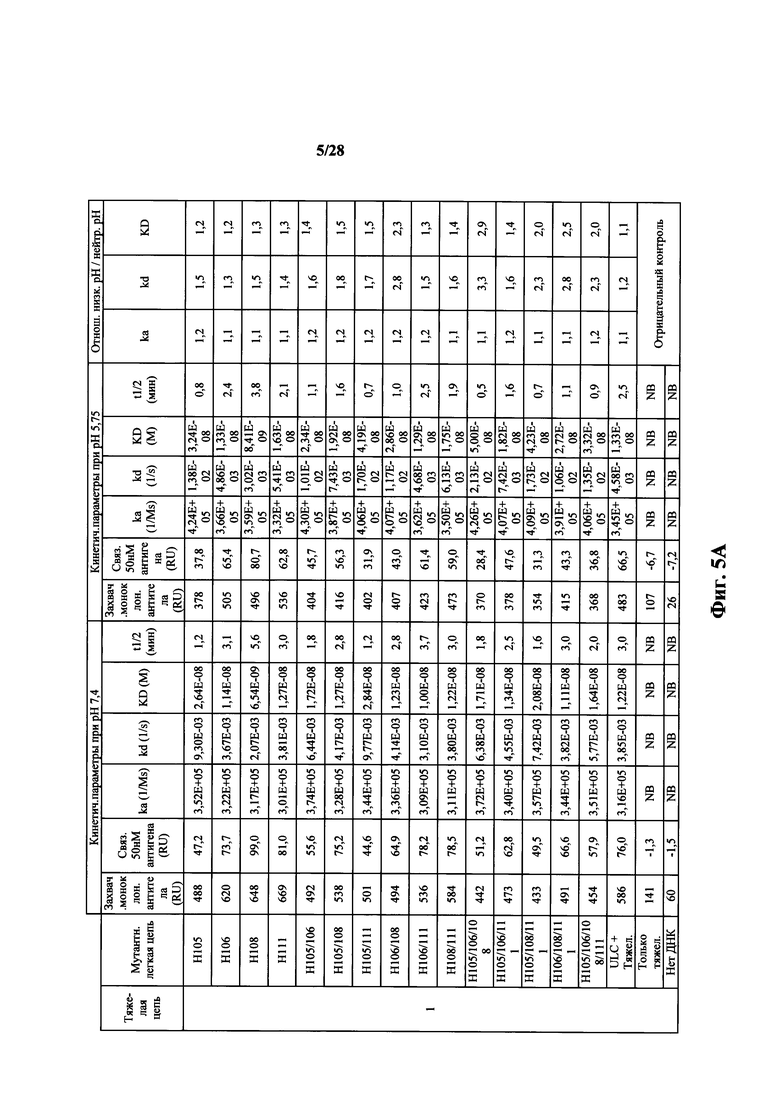

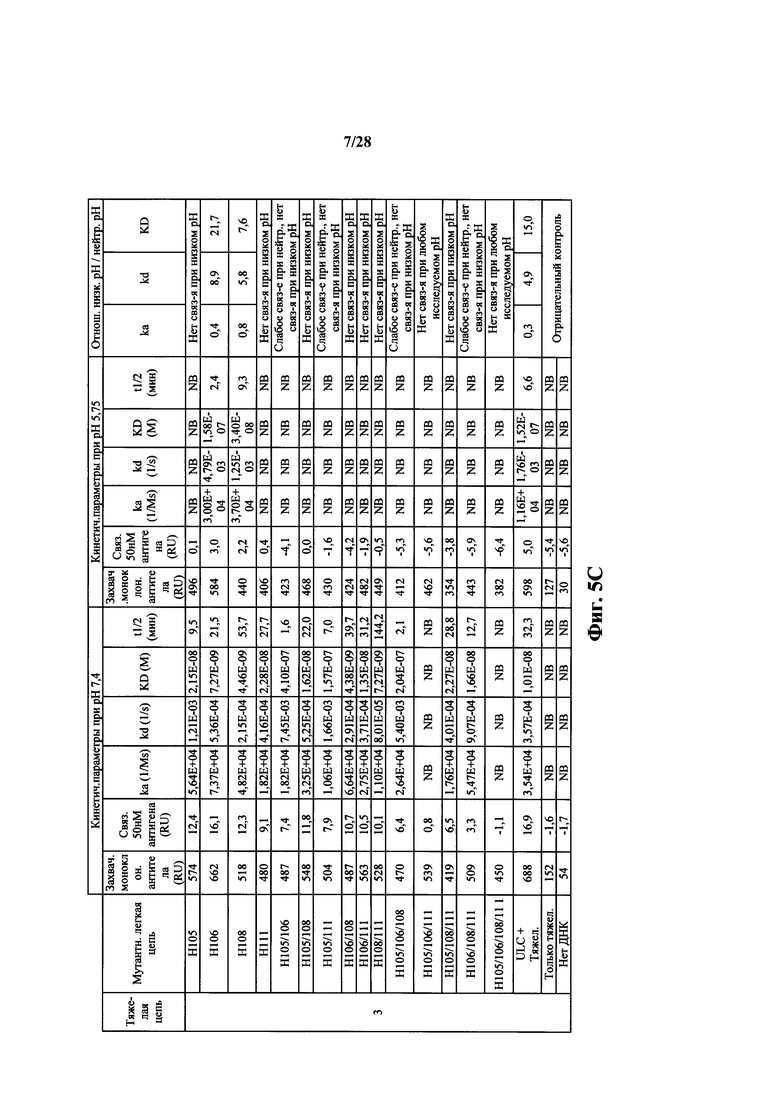
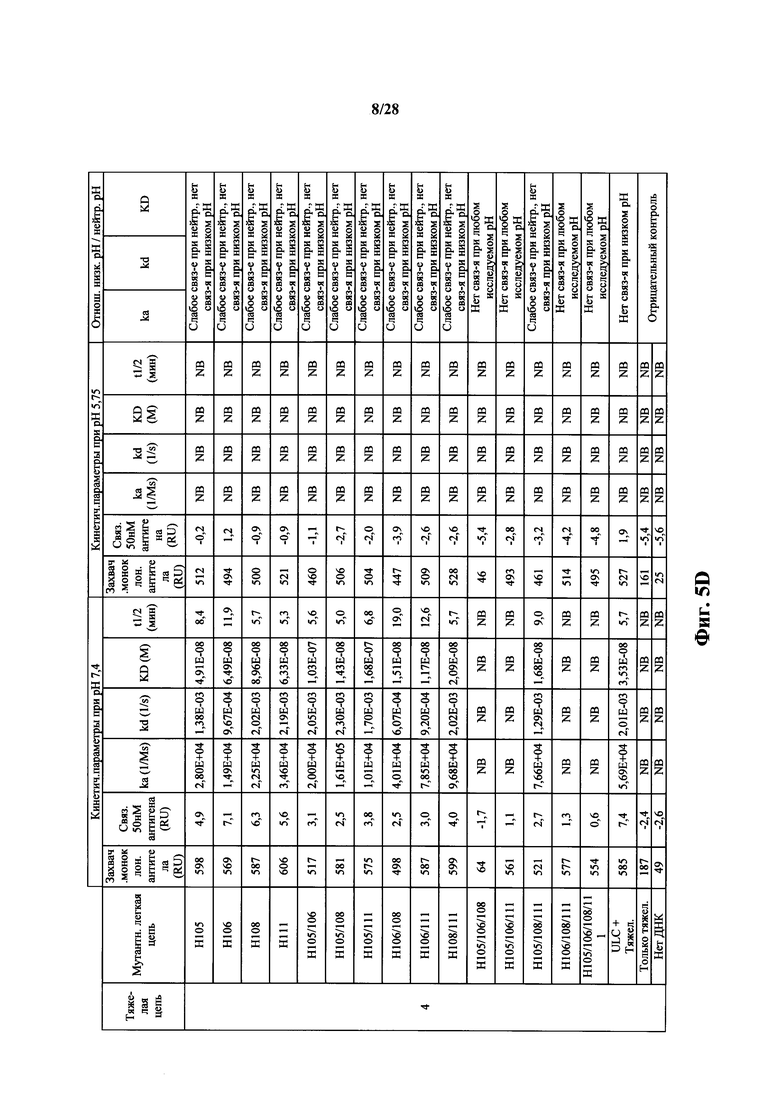

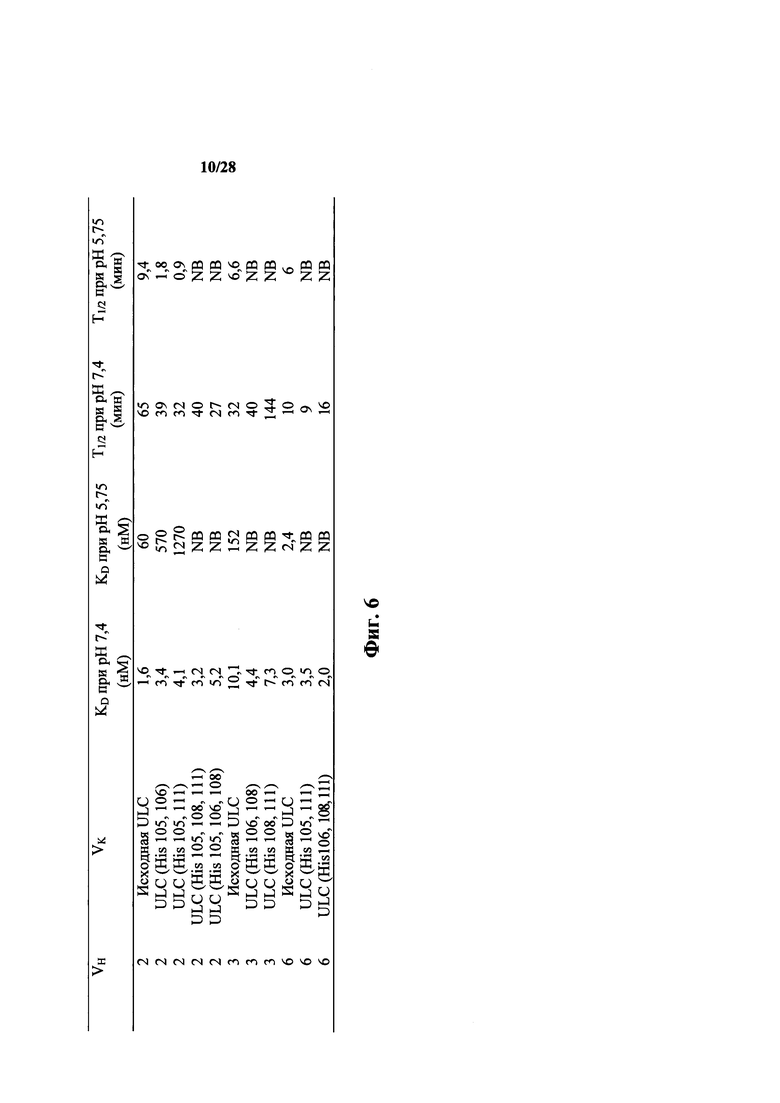


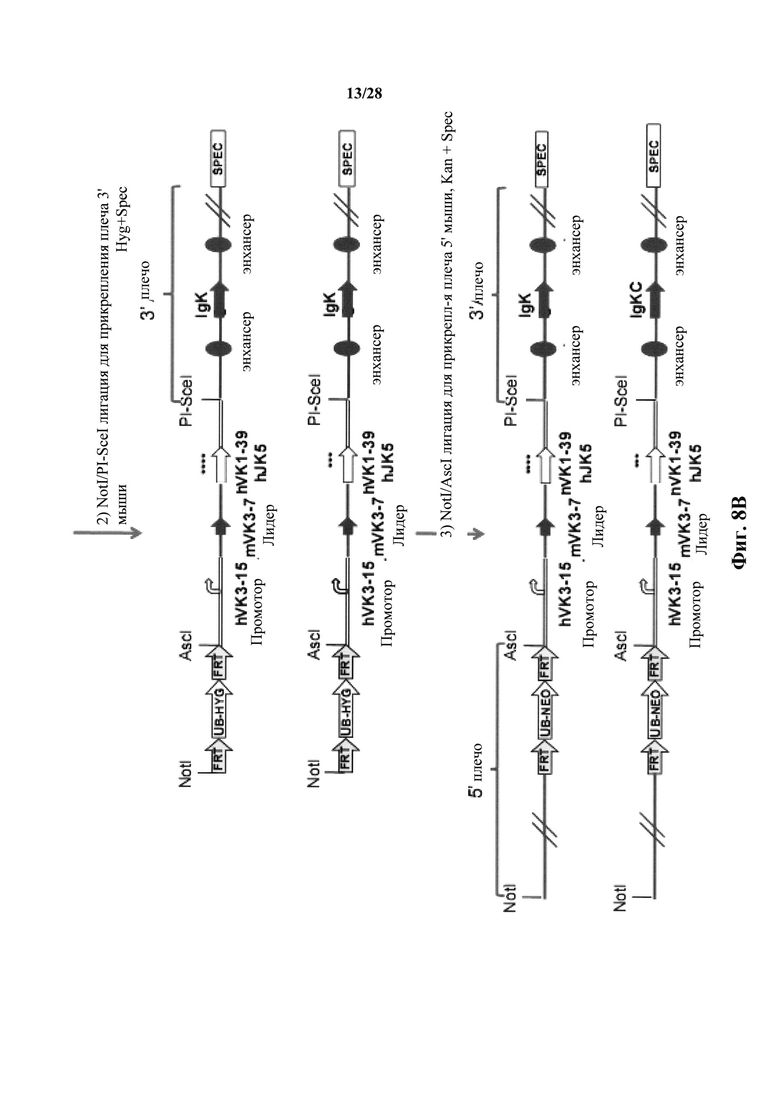


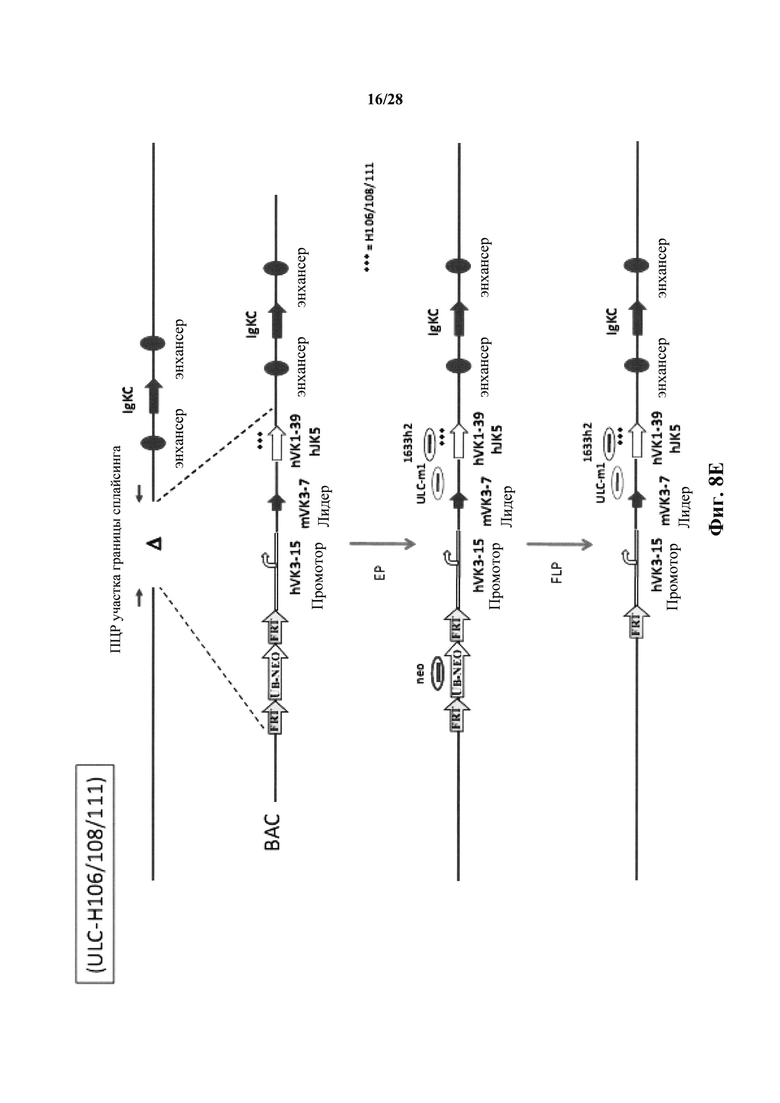

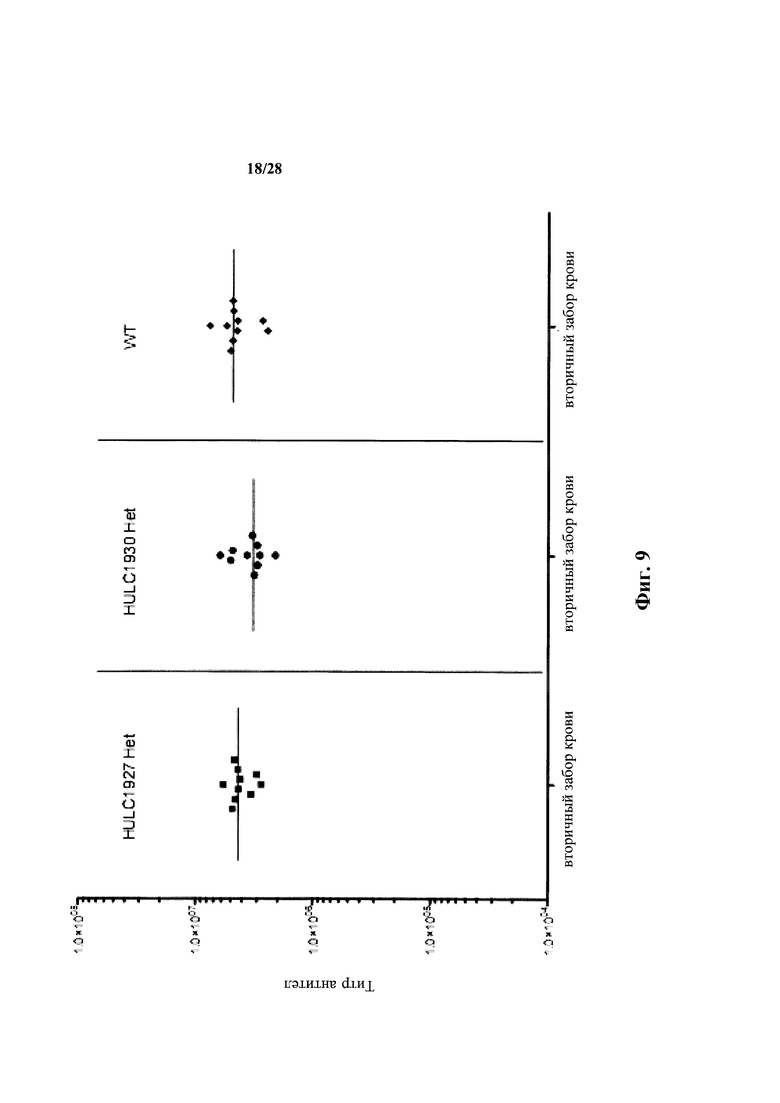
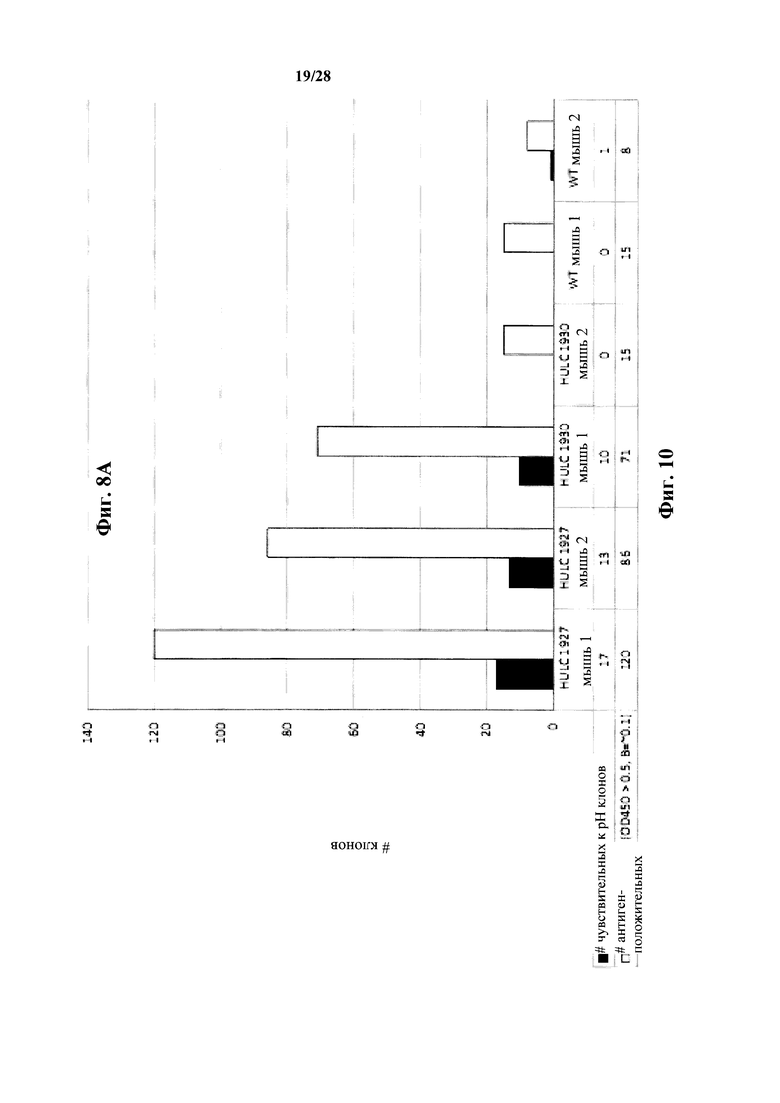

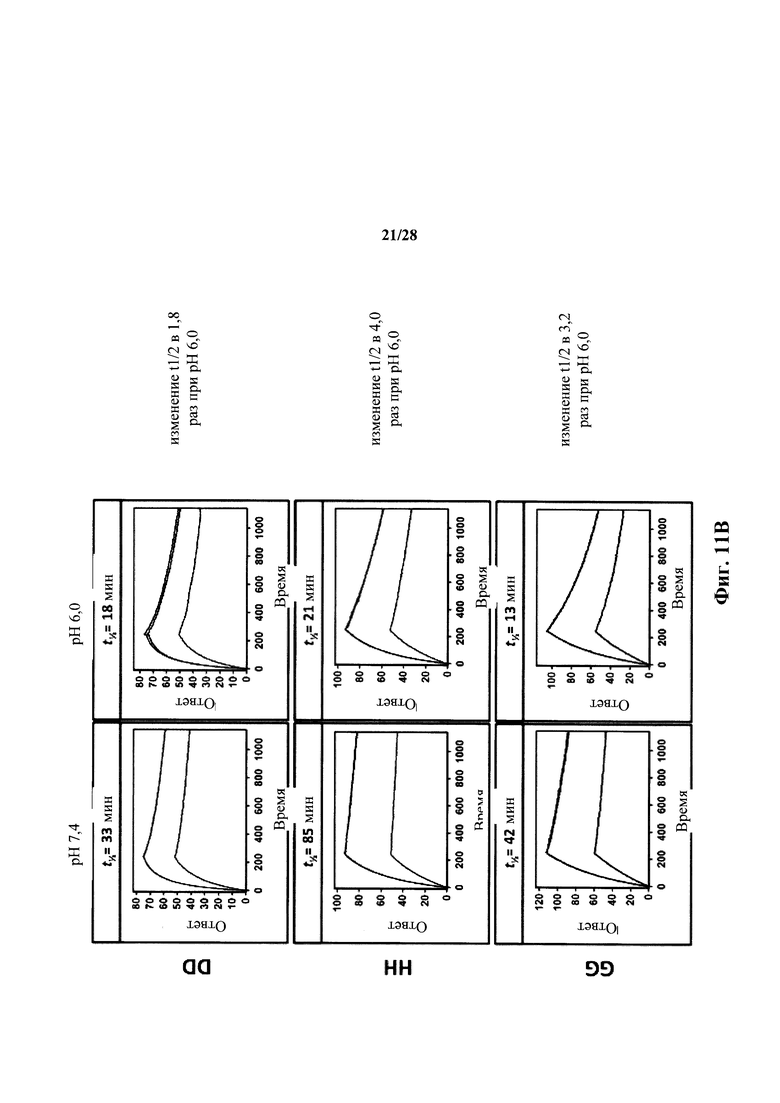
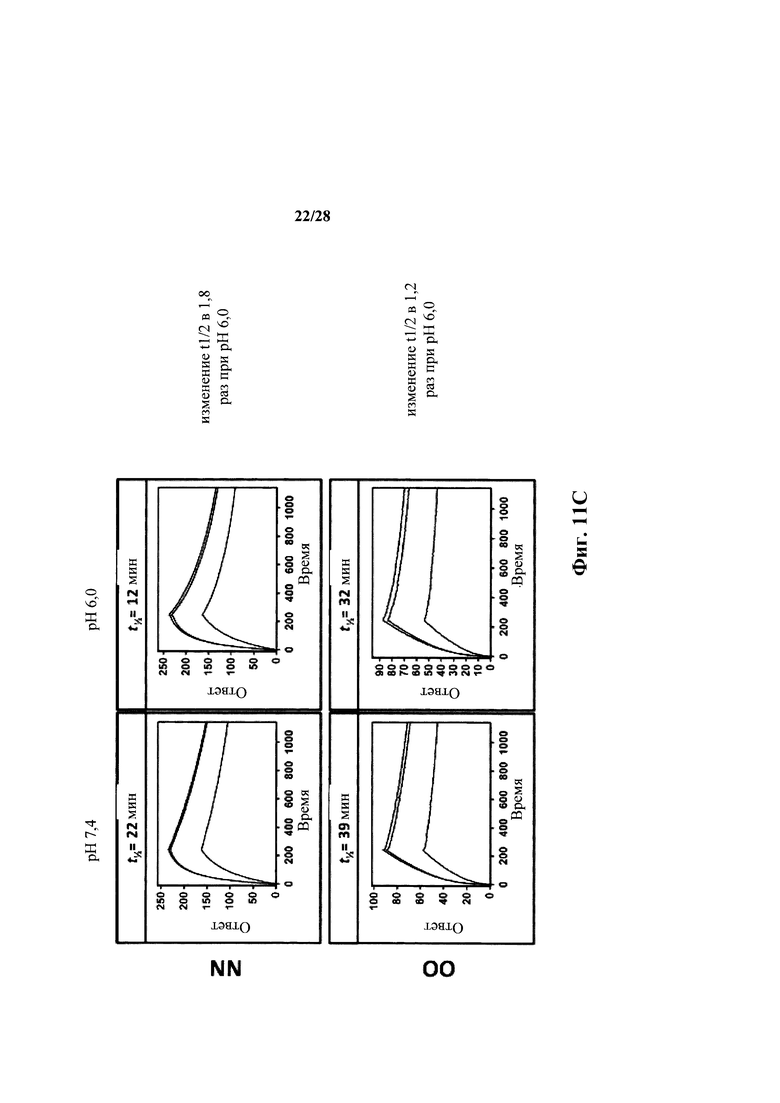


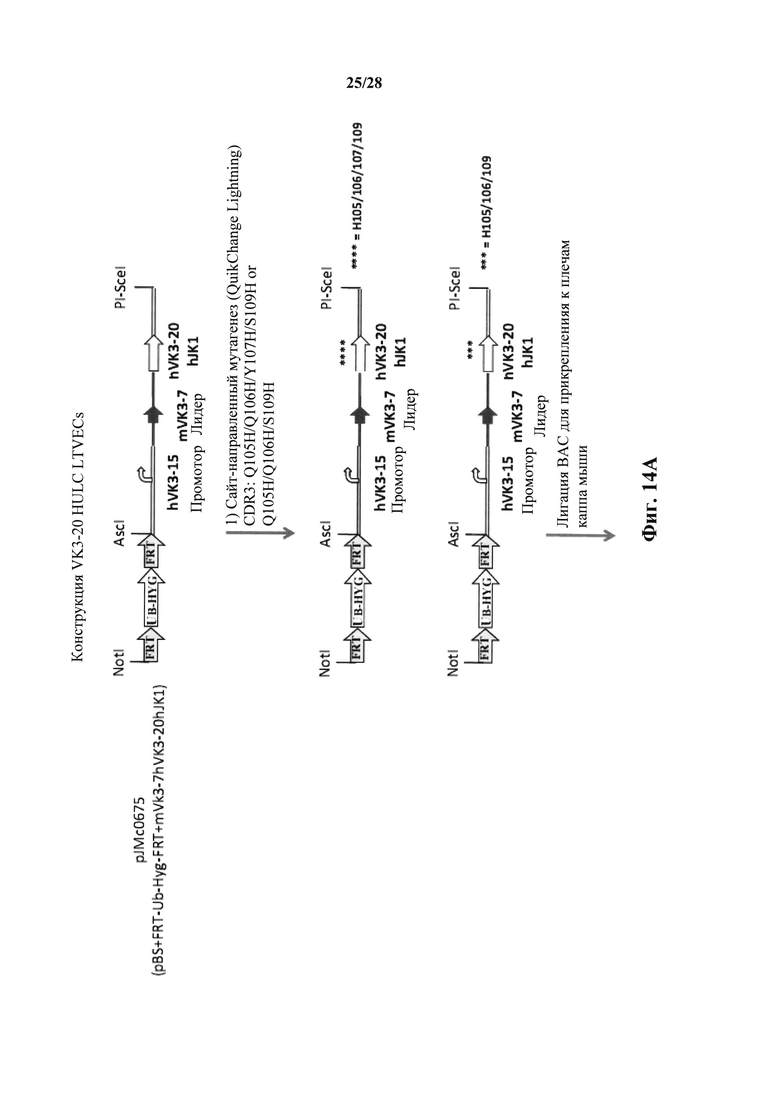
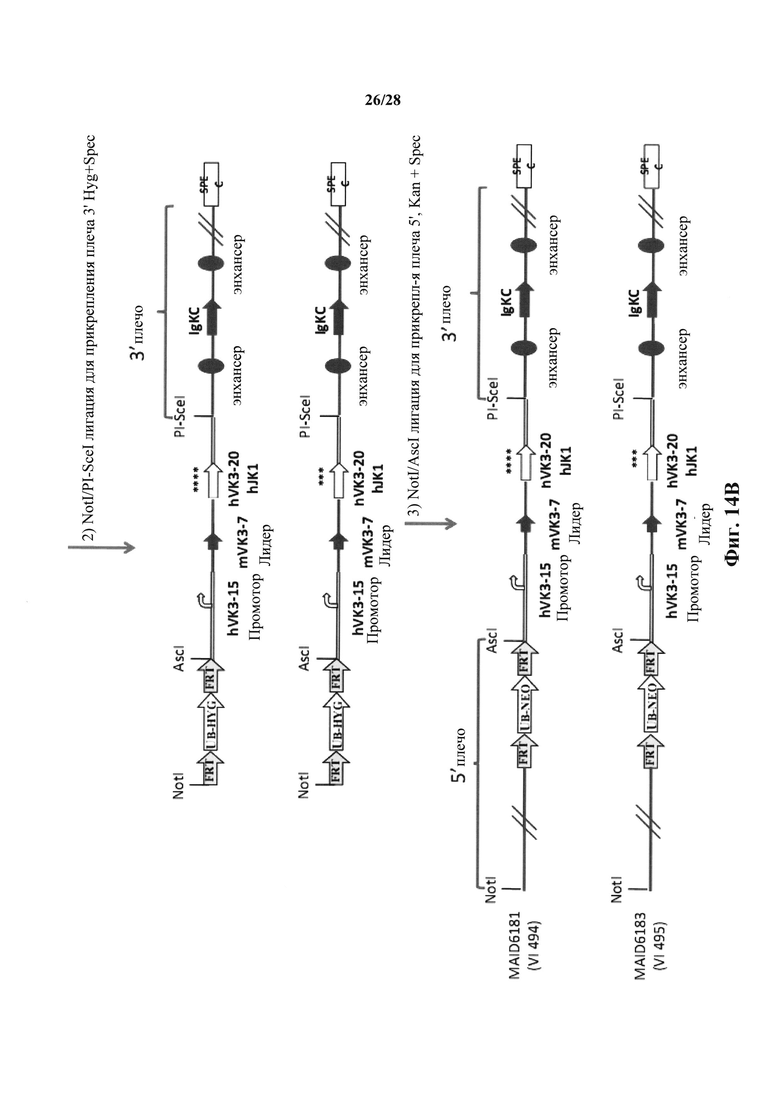
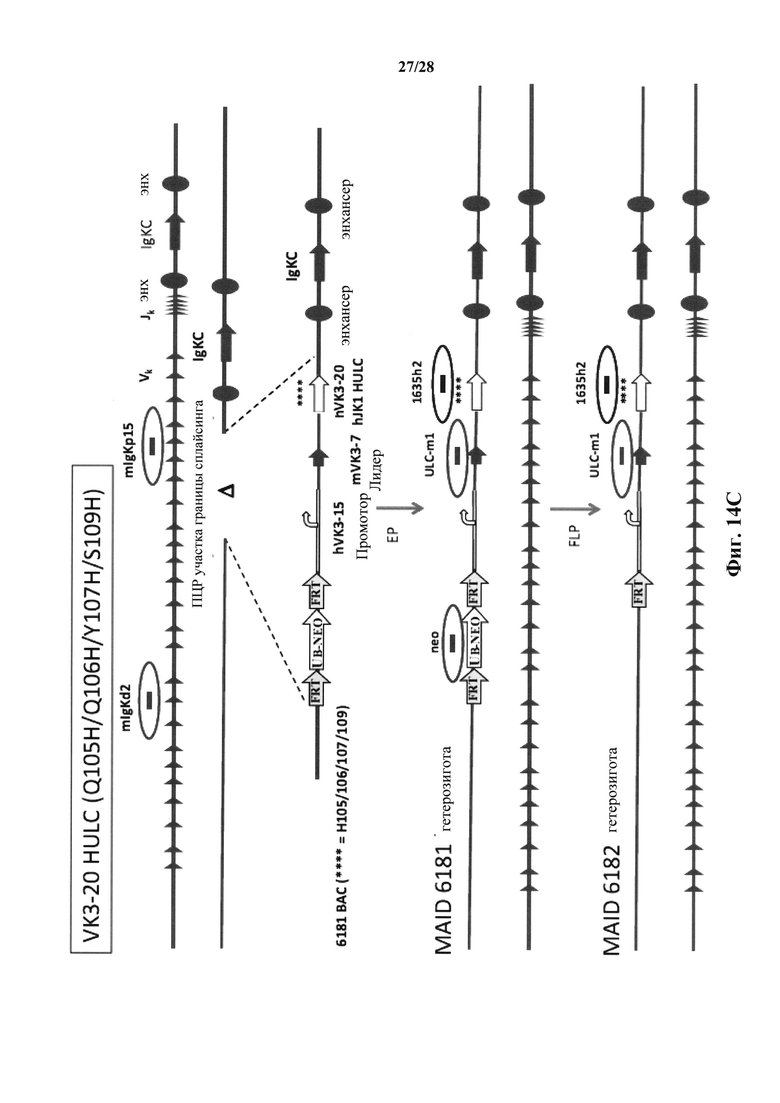
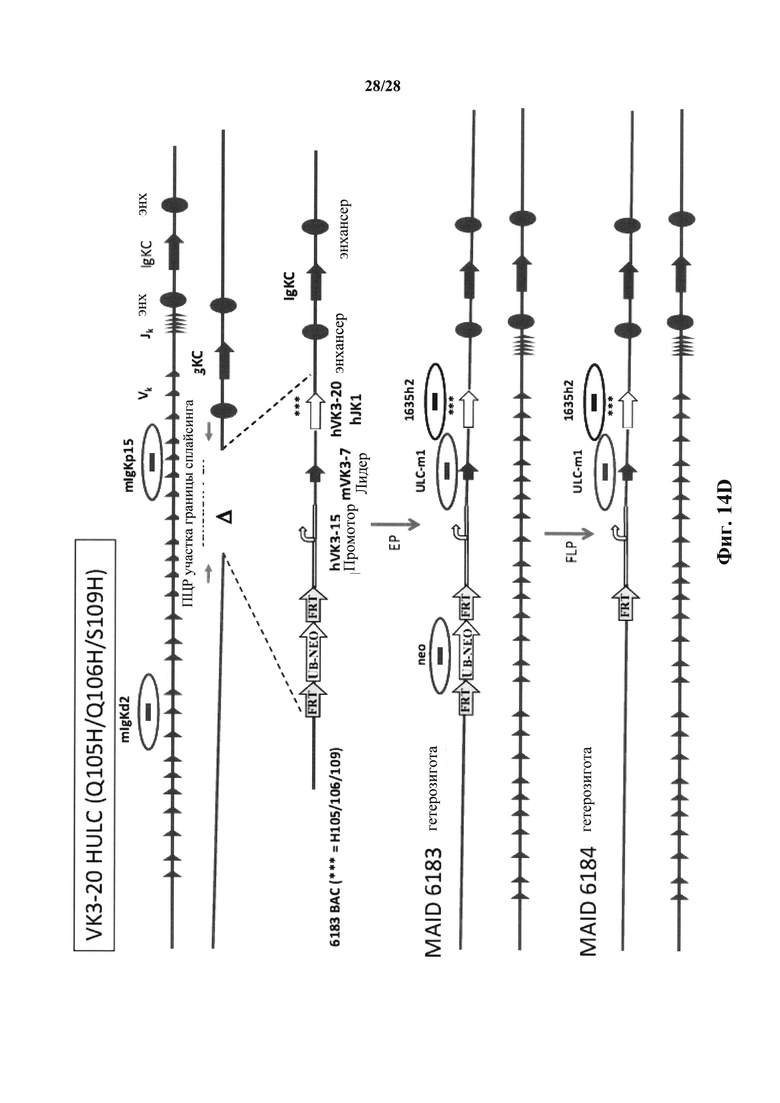
Настоящее изобретение относится к генетической инженерии, в частности к генетически модифицированным грызунам, а именно крысам и мышам. Указанные грызуны созданы для получения антител, содержащих лёгкую цепь иммуноглобулина с вариабельным доменом человека, в котором аминокислота гистидин кодируется замещенным или вставленным в зародышевый геном гистидиновым кодоном. Для получения таких грызунов производят модификацию его зародышевого генома для удаления или приведения в нефункциональное состояние эндогенных сегментов V и J лёгкой цепи иммуноглобулина. После чего в геном указанного грызуна вставляют единственную реаранжированную генную последовательность вариабельной области лёгкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, и генную последовательность константной области лёгкой цепи иммуноглобулина, функционально связанную с единственной реаранжированной генной последовательностью вариабельной области легкой цепи иммуноглобулина человека. Лёгкая цепь иммуноглобулина способна образовывать пару со множеством тяжёлых цепей иммуноглобулина, выбираемых у грызуна, причём каждая из множества тяжёлых цепей иммуноглобулина специфически связывается с различными эпитопами. Настоящее изобретение позволяет получить антитела, имеющие более эффективную рециркуляцию, а также предупредить деградацию антител путём способствования диссоциации комплексов антитело-антиген в эндосомальном компартменте без снижения специфичности и аффинности антитела к антигену. 4 н. и 43 з.п. ф-лы, 14 ил., 6 табл., 5 пр.
1. Генетически модифицированный грызун, который производит антитело, содержащее легкую цепь иммуноглобулина с вариабельным доменом человека, содержащим аминокислоту гистидин, кодируемую замещенным или вставленным в зародышевый геном гистидиновым кодоном, при этом грызун содержит в своей зародышевой линии ген легкой цепи иммуноглобулина, который содержит (i) единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, и (ii) генную последовательность константной области легкой цепи иммуноглобулина, функционально связанную с единственной реаранжированной генной последовательностью вариабельной области легкой цепи иммуноглобулина человека,
причем последовательности сегментов VL и JL человека единственной реаранжированной генной последовательности вариабельной области легкой цепи иммуноглобулина человека содержат по меньшей мере один гистидиновый кодон, который не кодируется соответствующими генными последовательностями сегментов VL и JL зародышевой линии человека,
причем единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека кодирует цепь иммуноглобулина, содержащую вариабельный домен легкой цепи, который содержит по меньшей мере один остаток гистидина в аминокислотном положении, кодируемом по меньшей мере одним замещенным или вставленным гистидиновым кодоном,
причем легкая цепь иммуноглобулина, кодируемая геном легкой цепи иммуноглобулина, способна образовывать пару со множеством тяжелых цепей иммуноглобулина, выбираемых у грызуна, причем каждая из множества тяжелых цепей иммуноглобулина специфически связывается с различными эпитопами при образовании пары с легкой цепью иммуноглобулина, и
причем грызун представляет собой крысу или мышь.
2. Грызун по п. 1, у которого генная последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина.
3. Грызун по п. 1, у которого генная последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина крысы.
4. Грызун по п. 1, у которого генная последовательность константной области легкой цепи иммуноглобулина грызуна представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина мыши.
5. Грызун по п. 1, дополнительно содержащий в своей зародышевой линии ген тяжелой цепи иммуноглобулина, который содержит нереаранжированную генную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина.
6. Грызун по п. 5, у которого генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой генную последовательность константной области тяжелой цепи иммуноглобулина грызуна.
7. Грызун по п. 6, у которого генная последовательность константной области тяжелой цепи иммуноглобулина грызуна представляет собой эндогенную генную последовательность константной области иммуноглобулина грызуна.
8. Грызун по п. 1, причем грызун не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина.
9. Грызун по п. 1, у которого ген легкой цепи иммуноглобулина находится в эндогенном локусе легкой цепи иммуноглобулина грызуна.
10. Грызун по п. 5, у которого ген тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина грызуна.
11. Грызун по п. 1, у которого по меньшей мере один гистидиновый кодон находится в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR) 3.
12. Грызун по п. 11, у которого по меньшей мере один гистидиновый кодон представляет собой один, два, три или четыре кодона CDR3.
13. Грызун по п. 1, у которого единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из генного сегмента Vκ1-39 или Vκ3-20 человека.
14. Грызун по п. 13, у которого единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1.
15. Грызун по п. 14, у которого единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 и у которого генная последовательность Vκ1-39/Jκ5 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации.
16. Грызун по п. 14, у которого единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ3-20/Jκ1 и у которого генная последовательность Vκ3-20/Jκ1 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации.
17. Грызун по п. 1, причем грызун содержит популяцию В-клеток, которые в ответ на представляющий интерес антиген производят антитела, которые проявляют снижение диссоциационного периода полувыведения (t1/2) при кислом значении рН, по сравнению с нейтральным значением рН, по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз.
18. Грызун по п. 17, у которого снижение диссоциационного периода полувыведения (t1/2) при кислом значении рН, по сравнению с нейтральным значением рН, составляет приблизительно 30 или более раз.
19. Грызун по любому из пп. 1-18, у которого ген легкой цепи иммуноглобулина находится в эндогенном локусе легкой цепи иммуноглобулина грызуна и у которого генная последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина.
20. Грызун по п. 19, причем грызун экспрессирует антитело, содержащее вариабельный домен легкой цепи иммуноглобулина человека, содержащий по меньшей мере один остаток гистидина в аминокислотном положении, кодируемом по меньшей мере одним гистидиновым кодоном в генной последовательности вариабельной области легкой цепи иммуноглобулина.
21. Грызун по п. 20, причем грызун представляет собой мышь.
22. Грызун по п. 20, причем грызун представляет собой крысу.
23. Генетически модифицированная мышь, которая производит антитело, содержащее легкую цепь иммуноглобулина с вариабельным доменом человека, содержащим аминокислоту гистидин, кодируемую замещенным или вставленным в зародышевый геном гистидиновым кодоном, при этом мышь содержит в своей зародышевой линии (1) ген легкой цепи иммуноглобулина, который содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, и (2) генную последовательность константной области легкой цепи иммуноглобулина, функционально связанную с единственной реаранжированной генной последовательностью вариабельной области легкой цепи иммуноглобулина человека,
причем последовательности сегментов VL и JL человека единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека содержат по меньшей мере один гистидиновый кодон, который не кодируется соответствующими генными последовательностями сегментов VL и JL зародышевой линии человека, и
причем мышь не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина.
24. Мышь по п. 23, у которой генная последовательность константной области легкой цепи иммуноглобулина представляет собой генную последовательность константной области легкой цепи иммуноглобулина крысы.
25. Мышь по п. 24, у которой генная последовательность константной области легкой цепи иммуноглобулина представляет собой генную последовательность константной области легкой цепи иммуноглобулина мыши.
26. Мышь по п. 23, дополнительно содержащая в своей зародышевой линии ген тяжелой цепи иммуноглобулина, который содержит нереаранжированную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина.
27. Мышь по п. 26, у которой генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой генную последовательность константной области тяжелой цепи крысы или мыши.
28. Мышь по п. 23, у которой ген легкой цепи иммуноглобулина находится в эндогенном локусе легкой цепи иммуноглобулина мыши.
29. Мышь по п. 26, у которой ген тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина мыши.
30. Мышь по п. 23, у которой по меньшей мере один гистидиновый кодон находится в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR) 3.
31. Мышь по п. 30, у которой по меньшей мере один гистидиновый кодон представляет собой один, два, три или четыре кодона CDR3.
32. Мышь по п. 23, у которой единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из генного сегмента Vκ1-39 или Vκ3-20 человека.
33. Мышь по п. 32, у которой единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1.
34. Мышь по п. 33, у которой единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 и у которой генная последовательность Vκ1-39/Jκ5 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации.
35. Мышь по п. 34, у которой генная последовательность Vκ1-39/Jκ5 содержит замещение негистидиновых кодонов на гистидиновые кодоны, разработанные для экспрессии гистидинов в положениях 105, 106, 108 и 111.
36. Мышь по п. 34, у которой генная последовательность Vκ1-39/Jκ5 содержит замещение негистидиновых кодонов на гистидиновые кодоны, разработанные для экспрессии гистидинов в положениях 106, 108 и 111.
37. Мышь по п. 33, у которой единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ3-20/Jκ1 и у которой генная последовательность Vκ3-20/Jκ1 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации.
38. Мышь по п. 37, у которой генная последовательность Vκ3-20/Jκ1 содержит замещение негистидиновых кодонов на гистидиновые кодоны, разработанные для экспрессии гистидинов в положениях 105, 106, 107 и 109.
39. Мышь по п. 37, у которой генная последовательность Vκ3-20/Jκ1 содержит замещение негистидиновых кодонов на гистидиновые кодоны, разработанные для экспрессии гистидинов в положениях 105, 106 и 109.
40. Мышь по п. 23, причем мышь экспрессирует популяцию антигенспецифических антител в ответ на представляющий интерес антиген, причем все антитела содержат:
вариабельные домены легкой цепи иммуноглобулина, полученные из той же единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, содержащей последовательности сегментов VL и JL человека, которые содержат по меньшей мере один гистидиновый кодон, который не кодируется соответствующими генными последовательностями сегментов VL и JL зародышевой линии человека, и тяжелые цепи иммуноглобулина, содержащие вариабельные домены тяжелых цепей человека, полученные из репертуара сегментов тяжелой цепи человека V, D и J.
41. Способ получения антитела, которое проявляет зависимое от рН связывание с представляющим интерес антигеном, предусматривающий:
получение мыши по п. 23;
иммунизацию мыши представляющим интерес антигеном; и
выбор антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью при нейтральном значении рН, при этом проявляя сниженное связывание с представляющим интерес антигеном при кислом значении рН.
42. Способ по п. 41, при котором антитело проявляет диссоциационный период полувыведения (t1/2) при кислом значении рН и 37°C равный приблизительно 2 минутам или менее.
43. Способ получения грызуна, который производит антитело, содержащее легкую цепь иммуноглобулина с вариабельным доменом человека, содержащим аминокислоту гистидин, кодируемую замещенным или вставленным в зародышевый геном гистидиновым кодоном, при этом способ предусматривает:
модификацию зародышевого генома грызуна для удаления или приведения в нефункциональное состояние эндогенных сегментов V и J легкой цепи иммуноглобулина в гене легкой цепи иммуноглобулина и
размещение в геноме единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, содержащей последовательности сегментов VL и JL человека, содержащие по меньшей мере один гистидиновый кодон, который не кодируется соответствующими последовательностями сегментов VL и JL зародышевой линии человека.
44. Способ по п. 43, который приводит к генетически модифицированному грызуну, который содержит популяцию В-клеток, обогащенную антителами, проявляющими зависимое от pH связывание с представляющим интерес антигеном.
45. Способ по п. 43, при котором грызун представляет собой крысу.
46. Способ по п. 43, при котором грызун представляет собой мышь.
47. Способ по п. 43, при котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1 человека и по меньшей мере один гистидиновый кодон представляет собой кодон CDR3.
| WO 2011097603 A1, 11.08.2011 | |||
| WO 9203918 A1, 19.03.1992 | |||
| US 5545806 A, 13.08.1996 | |||
| CHAPARRO-RIGGERS J | |||
| et al., Increasing serum half-life and extending cholesterol lowering in vivo by engineering antibody with pH-sensitive binding to PCSK9, J Biol Chem., 2012, 287(14), pp | |||
| УСТРОЙСТВО ДЛЯ ОБУЧЕНИЯ УПРАВЛЕНИЮ АВТОМОБИЛЕМ ИЛИ ТРАКТОРОМ | 1926 |
|
SU11090A1 |
| IGAWA T | |||
| et al., Antibody recycling by engineered pH-dependent antigen binding improves the duration of antigen neutralization, Nat Biotechnol., 2010, 28(11), pp | |||
| Врезной замок с секретным запором | 1921 |
|
SU1203A1 |
| РЫБЧИН В.Н | |||
| Основы генетической инженерии, Учебник для ВУЗов, Санкт-Петербург, Издательство СПбГТУ, 2002, 522 с., с | |||
| Устройство анодов катодных ламп | 1923 |
|
SU410A1 |
Авторы
Даты
2018-02-13—Публикация
2013-03-15—Подача