Область техники, к которой относится настоящее изобретение
Генетически модифицированное отличное от человека животное, которое экспрессирует антитела, способные связываться с антигеном зависимым от pH образом. Генетически модифицированные отличные от человека животные, которые содержат локусы иммуноглобулинов, которые модифицированы для включения по меньшей мере одной замены или вставки кодона, кодирующего способную к протонированию аминокислоту. Генетически модифицированные отличные от человека животные, которые содержит локусы иммуноглобулинов, которые модифицированы для включения по меньшей мере одной замены гистидина и/или по меньшей мере одной вставки гистидина в генный сегмент V, D или J тяжелой цепи иммуноглобулина или в сегмент V или J легкой цепи, или их реаранжированную область VDJ тяжелой цепи, или реаранжированную область VJ легкой цепи. Генетически модифицированные отличные от человека животные, которые экспрессируют иммуноглобулины, которые проявляют чувствительность к pH в связывании антигена. Генетически модифицированные животные, которые содержат популяции В-клеток, которые обогащены по отношению к вариабельным доменам иммуноглобулина, содержащим по меньшей мере один гистидин. Генетически модифицированные отличные от человека животные, которые содержат кластеры двух или более гистидинов, присутствующих в виде вставок и/или замен в генном сегменте V, D или J тяжелой цепи иммуноглобулина и/или генном сегменте V и/или J легкой цепи, и/или их реаранжированных последовательностях VDJ тяжелой цепи, или реаранжированных последовательностях VJ легкой цепи.
Генетически модифицированные локусы иммуноглобулина отличных от человека животных, содержащих нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Отличные от человека животные, включающие в себя грызунов, например, мышей и крыс, содержащие генетически модифицированный локус иммуноглобулина в своем геноме нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Подвергнутые генной инженерии отличные от человека животные, способные к экспрессии антигенсвязывающего белка, который характеризуется зависимым от pH связыванием антигена, улучшенной способностью к рециркулированию и/или повышенным периодом полужизни в сыворотке.
Предшествующий уровень техники настоящего изобретения
Связывающие домены иммуноглобулинов находят терапевтическое применение в самых разнообразных форматах, включающих в себя традиционный формат антитела в виде гомодимерной тяжелой цепи иммуноглобулина, связанной с родственной легкой цепью. Многие из этих форматов, включающих в себя традиционный формат, проявляют фармакокинетические особенности in vivo, которые представляют собой субоптимальные в связи с широким спектром факторов. В последние десятилетия были попытки несопоставимыми подходами улучшить фармакокинетику. Эти подходы включают в себя, например, увеличение гидродинамического радиуса для снижения почечного клиренса путем конъюгации с полимерами (например, ПЭГ; рассмотренным, например, в Duncan, R. (2006) Polymer conjugates as anticancer nanomedicines, Nat. Rev. Cancer 6:688-701); сиалирование N-гликанов (рассмотренное, например, в Stork, R. et al. N-glycosylation as novel strategy to improve pharmacokinetic properties of bispecific single-chain diabodies, J. Biol. Chem. 283(12): 7804-7812); модификации Fc для способствования связывания Fc-FcRn при нейтральном pH, при этом способствуя высвобождению при эндосомальном pH и ассоциации с сывороточным альбумином (смотрите, например, Chuang et al. (2002) Pharmaceutical Strategies Utilizing Recombinant Serum Albumin, Pharm. Res. 19(5): 569-577). В соответствующих приложениях и для соответствующих форматов каждый из этих подходов может предложить некоторые преимущества.
Однако, в настоящей области техники существует потребность для улучшения терапевтических эффектов и способа воздействия биофармацевтических препаратов, включающих в себя без ограничения для манипулирования структурами вариабельного домена иммуноглобулина для того, чтобы проектировать вариабельные домены, которые проявляют зависимое от pH связывание. Существует потребность в вариабельных доменах для использования в антигенсвязьгвающих белках различных форматов, причем вариабельные домены (или их антигенсвязывающие фрагменты) придают антигенсвязывающему белку чувствительность к pH в отношении связывания антигена-мишени или рецептора. Также в настоящей области техники существует потребность в системах и способах для производства зависимых от pH вариабельных доменов иммуноглобулина и их антигенсвязывающих фрагментов. Существует потребность в биологических системах, которые могут производить широкое разнообразие вариабельных доменов иммуноглобулина, причем широкое разнообразие обогащается относительно титруемых аминокислот, которые могут придавать чувствительность к pH вариабельному домену, например, способность связывать антиген-мишень или эпитоп-мишень при одном значении pH (например, нейтральном или высоком значении pH), при этом высвобождая антиген-мишень или эпитоп-мишень при втором значении pH (например, низком или эндосомальном значении pH).
Легкие цепи иммуноглобулина в определенных форматах представляют собой уникальные сенсибилизаторы. Антитела, как правило, содержат гомодимерный компонент тяжелой цепи, причем каждый мономер тяжелой цепи связан с идентичным легкой цепи. Антитела, содержащие гетеродимерный компонент тяжелой цепи (например, биспецифические антитела) желательны в качестве терапевтических антител. Но получение биспецифических антител, содержащих соответствующий компонент легкой цепи, который может удовлетворительно ассоциировать с каждой из тяжелых цепей, биспецифического антитела оказалось проблематичным.
Согласно одному подходу легкая цепь может быть выбрана с помощью обзора статистики использования всех вариабельных доменов легкой цепи, идентифицирующего наиболее часто используемую легкую цепь в антителах человека и образующего пару этой легкой цепи in vitro с двумя тяжелыми цепями различной специфичности.
Согласно другому подходу легкая цепь может быть выбрана путем наблюдения последовательностей легкой цепи в библиотеке фагового дисплея (например, библиотека фагового дисплея, содержащая последовательности вариабельной области легкой цепи человека, например, библиотека scFv человека) и выбора наиболее широко используемой вариабельной области легкой цепи из библиотеки. Легкая цепь может быть исследована на двух разных представляющих интерес тяжелых цепях.
Согласно другому подходу легкая цепь может быть выбрана путем анализа библиотеки фагового дисплея вариабельных последовательностей легкой цепи с использованием вариабельных последовательностей тяжелой цепи обеих представляющих интерес тяжелых цепей в качестве зондов. Легкая цепь, которая ассоциирует с обеими вариабельными последовательностями тяжелой цепи, может быть выбрана в качестве легкой цепи для тяжелых цепей.
Согласно другому подходу кандидатная легкая цепь может быть выравнена с родственными тяжелым цепям легкими цепями, и модификации в легкой цепи получают для более близкого соответствия характеристик последовательностей, общих для родственных легких цепей обеих тяжелых цепей. Если шансы иммуногенности должны быть сведены к минимуму, модификации предпочтительно приводят к последовательностям, которые присутствуют в известных последовательностях легкой цепи человека, таким образом, что протеолитический процессинг вряд ли будет производить эпитоп Т-клеток, основанный на параметрах и способах, известных в настоящей области техники для оценки вероятности иммуногенности (т.е., in silico, а также в мокрых анализах).
Все вышеперечисленные подходы основываются на способах in vitro, которые включают в себя ряд априорных ограничений, например, идентичность последовательности, способность ассоциировать со специфичными предварительно выбранными тяжелыми цепями и т.д. Существует необходимость в настоящей области техники в композициях и способах, которые не основываются на манипулировании условиями in vitro, но которые вместо этого применяют более биологически чувствительные подходы к созданию эпитопсвязывающих белков человека, которые включают общую легкую цепь.
Кроме того, терапевтические антитела, например, биспецифические терапевтические антитела, характеризуются некоторыми ограничениями в том, что они часто требуют высоких доз для достижения желаемой эффективности. Отчасти это связано с тем фактом, что комплексы антитело-антиген поглощаются в эндосомы, и нацеливаются на лизосомальную деградацию в процессе, называемом мишень-опосредованный клиренс. Таким образом, существует необходимость в настоящей области техники в способах и композициях, которые приводят к более эффективной рециркуляции антител, например, рециркуляции биспецифических антител, и предупреждают деградацию антител путем способствования диссоциации комплексов антитело-антиген в эндосомальном компартменте без снижения специфичности и аффинности антитела к антигену.
На вводимые в организм лекарственные средства, включающие в себя терапевтические моноклональные антитела, можно воздействовать с помощью различных механизмов элиминации, включающих в себя клубочковую фильтрацию (например, в мочу), секрецию (например, в желчь) и катаболизм клетками. В то время как низкомолекулярные молекулы выводятся из организма через почечную фильтрацию, большинство секретируемых антител (например, IgG, которые слишком большие для того, чтобы фильтроваться через клубочки) в первую очередь выводятся из организма через опосредованный клетками катаболизм, например, пиноцитоз (фагоцитоз) или рецепторно-опосредованный эндоцитоз. Например, растворимые молекулы с несколькими повторными эпитопами связаны посредством множества циркулирующих антител, и полученные крупные комплексы антиген-антитело быстро фагоцитируют в клетки для деградации. С другой стороны, рецепторы-мишени клеточной поверхности, которые связаны с антителами (т.е. комплексы рецептор-антитело), подвергаются мишень-опосредованному эндоцитозу зависимым от дозы образом, что приводит к образованию эндосом, предназначенных для лизосомальной деградации внутри клеток. В некоторых случаях, эндоцитированные комплексы рецептор-антитело связываются с неонатальными рецепторы Fc (FcRn) внутри эндосом зависимым от pH образом и направляются обратно на поверхность клеток для высвобождения в плазму или интерстициальные жидкости после воздействия нейтральным внеклеточным значением pH (например, pH 7,0-7,4).
В настоящей области техники существует потребность в системах, например, отличных от человека животных, клетках и геномных локусах, которые производят антигенсвязывающие белки с титруемыми остатками, например, генетически модифицированные локусы, которые реаранжируют генные сегменты иммуноглобулина для производства вариабельных доменов тяжелой цепи, которые отвечают на изменения pH, например, которые выступают в качестве доноров или акцепторов протонов, и, например, чьи характеристики связывания отличаются в зависимости от состояния протонирования.
В настоящей области техники существует потребность в способах и композициях, которые могут дополнительно увеличивать рециркулирующую эффективность эндоцитированных антигенсвязывающих белков, способствуя диссоциации антигенсвязывающих белков от комплексов рецептор-антигенсвязывающий белок или путем увеличения аффинности антигенсвязывающих белков по отношению к FcRn в кислом эндосомальном компартменте без ущерба специфичности и аффинности антигенсвязывающего белка по отношению к представляющему интерес антигену.
Краткое раскрытие настоящего изобретения
Предусмотрены композиции и способы для создания генетически модифицированных животных, которые производят вариабельные домены иммуноглобулина, которые содержат по меньшей мере один остаток гистидина, кодируемый с помощью модификации зародышевой линии отличного от человека животного, причем модификация зародышевой линии содержит по меньшей мере одну вставку гистидинового кодона в сегмента V, D или J тяжелой цепи, вставку гистидинового кодона в сегмент V или J легкой цепи, вставку гистидинового кодона в реаранжированный ген VJ легкой цепи, замену негистидинового кодона на гистидиновый кодон в сегменте V, D или J тяжелой цепи, замену негистидинового кодона на гистидиновый кодон в сегменте V или J легкой цепи, замену негистидинового кодона на гистидиновый кодон в реаранжированной последовательности VJ.
Также предусмотрены композиции и способы для введения кластеров гистидиновых кодонов в зародышевую линию последовательностей иммуноглобулина отличных от человека животных.
Также предусмотрены композиции и способы для введения гистидиновых вставок или замен негистидиновых кодонов на гистидиновые кодоны в N-концевых кодирующих областях генов иммуноглобулинов, кодирующих областях петли 4 генов иммуноглобулинов, кодирующих CDR областях генов иммуноглобулинов (например, реаранжированные последовательности V(D)J или генные сегменты V, (D), J).
Композиции и способы получения потомства отличного от человека животного, которое содержит вставки гистидиновых кодонов и/или замены негистидиновых кодонов на гистидиновые кодоны, как в локусах тяжелой цепи иммуноглобулина, так и локусах легкой цепи иммуноглобулина.
Согласно одному аспекту генетически модифицированное отличное от человека животное, содержащее в своей зародышевой линии локус иммуноглобулина, содержащий замену или вставку в вариабельный локус иммуноглобулина по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления вариабельный локус (например, нереаранжированный локус сегментов V(D)J) содержит по меньшей мере часть вариабельного локуса (сегментов (V(D)J) человека).
Согласно одному варианту осуществления генетически модифицированное отличное от человека животное содержит в своей зародышевой линии первый вариабельный локус (например, нереаранжированный локус сегментов V(D)J тяжелой цепи иммуноглобулина) и второй вариабельный локус (например, нереаранжированный локус сегментов V, J легкой цепи иммуноглобулина или реаранжированную последовательность VJ легкой цепи иммуноглобулина).
Согласно одному варианту осуществления отличное от человека животное содержит первый и второй вариабельный локус, причем по меньшей мере первый или второй вариабельный локус содержит вставку по меньшей мере одного гистидинового кодона или замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления, как первый, так и второй вариабельный локус содержит замену или вставку по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления первый вариабельный локус содержит по меньшей мере функциональную часть переаранжированного вариабельного локуса тяжелой цепи (нереаранжированные сегменты V, D, J).
Согласно одному варианту осуществления нереаранжированный вариабельный локус тяжелой цепи содержит по меньшей мере часть локуса человека (нереаранжированные сегменты V, D, J).
Согласно одному варианту осуществления нереаранжированный локус тяжелой цепи представляет собой локус человека, содержащий нереаранжированные сегменты V, синтетический сегмент D, который содержит линкер, и сегмент J человека. Согласно одному варианту осуществления синтетический сегмент D содержит по меньшей мере один кодон гистидина.
Согласно одному варианту осуществления второй вариабельный локус содержит по меньшей мере функциональную часть нереаранжированного локуса легкой цепи (нереаранжированные сегменты V, J).
Согласно одному варианту осуществления второй вариабельный локус содержит реаранжированную последовательность вариабельного гена легкой цепи иммуноглобулина (реаранжированная последовательность VJ).
Согласно одному варианту осуществления замена негистидинового кодона на гистидиновый кодон и/или вставка гистидинового кодона находится в последовательности нуклеиновой кислоты, которая кодирует вариабельный домен, и гистидин находится в области, выбранной из N-концевой области цепи иммуноглобулина, области петли 4 цепи иммуноглобулина, CDR1 тяжелой цепи, CDR2 тяжелой цепи, CDR3 тяжелой цепи, CDR1 легкой цепи, CDR2 легкой цепи, CDR3 легкой цепи и их комбинации.
Согласно одному варианту осуществления по меньшей мере один из первого вариабельного локуса или второго вариабельного локуса функционально связан с эндогенной отличной от человеческой последовательностью нуклеиновой кислоты константной области в эндогенном отличном от человеческого локусе иммуноглобулина человека.
Согласно одному варианту осуществления первый вариабельный локус (нереаранжированные сегменты V, D, J человека) функционально связан с эндогенной отличной от человеческой последовательностью нуклеиновой кислоты константной области тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления первый вариабельный локус (нереаранжированные сегменты V, D, J человека) функционально связан с эндогенной отличной от человеческой последовательностью нуклеиновой кислоты константной области тяжелой цепи иммуноглобулина в эндогенном отличном от человеческого локусе иммуноглобулина.
Согласно одному варианту осуществления второй вариабельный локус (нереаранжированные сегменты V, J) функционально связан с эндогенной отличной от человеческой последовательностью константной области легкой цепи иммуноглобулина.
Согласно одному варианту осуществления эндогенная отличная от человеческой последовательность константной области легкой цепи иммуноглобулина находится в эндогенном отличном от человеческого локусе иммуноглобулина.
Согласно одному варианту осуществления последовательность вариабельной области содержит кластер из 2, 3, 4 или 5 гистидинов, которые представляют собой замены негистидиновых кодонов на гистидиновые кодоны и/или вставки кодонов гистидина.
Согласно одному варианту осуществления нереаранжированный локус тяжелой цепи содержит генные сегменты D, которые инвертированы по отношению к направлению ориентации локуса тяжелой цепи. Согласно одному варианту осуществления инвертированные сегменты D находятся в гидрофильной рамке считывания.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, содержащее по меньшей мере часть нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека (нереаранжированные сегменты V, D, J), функционально связанную с генной последовательностью константной области, причем один или несколько генных сегментов V, D и J содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или по меньшей мере одну вставку гистидинового кодона; по меньшей мере часть нереаранжированной последовательности нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека (нереаранжированные сегменты V, J), функционально связанную с генной последовательностью константной области, причем один или несколько генных сегментов V и J содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или одну вставку гистидинового кодона; причем отличное от человека животное экспрессирует вариабельный домен тяжелой цепи иммуноглобулина и/или вариабельный домен легкой цепи иммуноглобулина, который содержит гистидин, полученный из замены или вставки гистидина в зародышевую линию мыши.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее. Согласно одному варианту осуществления млекопитающее представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из группы, состоящей из мыши, крысы и хомяка.
Согласно одному варианту осуществления нереаранжированная последовательность нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с отличной от человеческой последовательностью константной области.
Согласно одному варианту осуществления отличная от человеческой последовательность нуклеиновой кислоты константной области, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека, находится в эндогенном отличном от человеческого локусе иммуноглобулина в зародышевой линии отличного от человека животного.
Согласно одному варианту осуществления отличная от человеческой последовательность нуклеиновой кислоты константной области, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека, находится в эндогенном отличном от человеческого локусе иммуноглобулина в зародышевой линии отличного от человека животного.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, содержащее по меньшей мере часть нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека (нереаранжированные сегменты V, D, J), функционально связанную с генной последовательностью константной области, причем один или несколько нереаранжированных генных сегментов V, D и J содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или по меньшей мере одну вставку гистидинового кодона; реаранжированную последовательность нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека (реаранжированная последовательность VJ), функционально связанную с генной последовательностью константной области легкой цепи, причем реаранжированная последовательность VJ содержит по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или одну вставку гистидинового кодона; причем отличное от человека животное экспрессирует вариабельный домен тяжелой цепи иммуноглобулина и/или вариабельный домен легкой цепи иммуноглобулина, который содержит гистидин, полученный из замены или вставки гистидина в зародышевую линию мыши.
Согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой млекопитающее. Согласно одному варианту осуществления млекопитающее представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из группы, состоящей из мыши, крысы и хомяка.
Согласно одному варианту осуществления нереаранжированная последовательность нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с отличной от человеческой последовательностью константной области. Согласно одному варианту осуществления отличная от человеческой последовательность константной области, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека, находится в эндогенном отличном от человеческого локусе иммуноглобулина в зародышевой линии отличного от человека животного. Согласно одному варианту осуществления отличная от человеческой последовательность константной области, функционально связанная с реаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека, находится в эндогенном отличном от человеческого локусе иммуноглобулина в зародышевой линии отличного от человека животного.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, причем животное содержит популяцию В-клеток, которая характеризуется повышенным наличием остатков гистидина в тяжелых и легких цепях иммуноглобулина популяции В клеток, по сравнению с отличным от человека животным дикого типа. Согласно одному варианту осуществления повышение представляет собой повышение приблизительно в 2-4 раза. Согласно одному варианту осуществления повышение представляет собой повышение приблизительно в 2-10 раз.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, которое экспрессирует легкие и тяжелые цепи иммуноглобулина, которые содержат гистидины, кодируемые заменами и/или вставками в последовательности иммуноглобулина зародышевой линии отличного от человека животного.
Согласно одному аспекту предусмотрен способ получения отличного от человека животного, которое производит вариабельные домены антител с гистидинами, кодируемыми гистидиновыми кодонами зародышевой линии, предусматривающий: модификацию отличного от человека животного в его зародышевой линии для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в нереаранжированный вариабельный локус (нереаранжированные сегменты V, D, J) тяжелой цепи иммуноглобулина; и модификацию отличного от человека животного в его зародышевой линии для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в нереаранжированный вариабельный локус (нереаранжированные сегменты V, J) легкой цепи иммуноглобулина.
Согласно одному варианту осуществления способ предусматривает генетическую модификацию зародышевой линии мыши для включения по меньшей мере части нереаранжированного вариабельного локуса (сегменты V, D, J) тяжелой цепи иммуноглобулина человека, и получение замены или вставки гистидина в нереаранжированном вариабельном локусе (нереаранжированных сегментах V, D, J) тяжелой цепи иммуноглобулина человека.
Согласно одному варианту осуществления способ предусматривает генетическую модификацию зародышевой линии мыши для включения по меньшей мере части нереаранжированного вариабельного локуса (нереаранжированных сегментов V, J) легкой цепи иммуноглобулина человека, и получение замены или вставки гистидина в нереаранжированном локусе легкой цепи иммуноглобулина человека.
Согласно одному варианту осуществления способа отличное от человека животное представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из мыши, крысы и хомяка.
Согласно одному аспекту предусмотрен способ для получения отличного от человека животного, которое производит вариабельные домены антител с гистидинами, кодируемыми гистидиновыми ко донами зародышевой линии, предусматривающий: модификацию отличного от человека животного для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в нереаранжированный вариабельный локус (нереаранжированные сегменты V, D, J) тяжелой цепи иммуноглобулина; и модификацию отличного от человека животного для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в нереаранжированную вариабельную последовательность (реаранжированная последовательность VJ) легкой цепи иммуноглобулина в зародышевую линию.
Согласно одному варианту осуществления способа отличное от человека животное представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из мыши, крысы и хомяка.
Согласно различным аспектам и вариантам осуществления отличные от человека животные представляют собой генетически модифицированные с помощью генетической модификации плюрипотентных или тотипотентных клеток (например, эмбриональных стволовых (ES) клеток), а также использования генетически модифицированных клеток в качестве донорских клеток с эмбрионом-хозяином в суррогатной матери для вынашивания животного, полученного из генетически модифицированных донорских клеток. Согласно различным аспектам и вариантам осуществления отличные от человека животные представляют собой генетически модифицированные любым другим известным в настоящей области техники способом.
Предусмотрены способы и композиции для получения вариабельных доменов антител, которые проявляют зависимое от pH связывание антигена. Предусмотрены модифицированные антигенсвязывающие белки, а также композиции и способы для их получения, которые связывают антиген-мишень с низкой аффинностью при низком (например, эндосомальном) значении pH и которые связывают тот же антиген-мишень с высокой аффинностью при более высоком (например, внеклеточном) или нейтральном значении pH.
Согласно одному аспекту предусмотрен способ получения антитела, которое проявляет зависимое от pH связывание, предусматривающий модификацию последовательности вариабельного домена антитела для добавления остатка гистидина или замены существующего остатка на остаток гистидина с образованием вариабельного домена с модифицированным гистидином. Согласно одному варианту осуществления замена представляет собой замену остатка, который не критичен для связывания антигена (например, при нейтральном или внеклеточном значении pH).
Согласно одному варианту осуществления два, три, четыре, пять или шесть или более остатков заменяют на гистидины. Согласно одному варианту осуществления два, три, четыре, пять, шесть или более замененных на гистидины остатков находятся в кластере. Согласно одному варианту осуществления кластер содержит две или более последовательных замен гистидина. Согласно одному варианту осуществления кластер содержит две или более гистидиновые замены, разделенные одним или несколькими негистидиновыми остатками. Согласно одному варианту осуществления кластер составляет 2, 3, 4, 5, 6, 7, 8, 9 или 10 остатков в длину, и все остатки не критичные для связывания антигена (например, при нейтральном или внеклеточном значении pH), модифицированы на гистидин.
Согласно одному варианту осуществления вариабельный домен представляет собой вариабельный домен легкой цепи (например, κ или λ). Согласно одному варианту осуществления вариабельный домен находится в вариабельном домене тяжелой цепи. Согласно одному варианту осуществления последовательность вариабельного домена легкой цепи и вариабельного домена тяжелой цепи модифицирована.
Согласно одному варианту осуществления последовательность вариабельного домена представляет собой последовательность CDR. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR тяжелой цепи. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR легкой цепи. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR тяжелой цепи и последовательность CDR легкой цепи.
Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR3. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR2. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR3.
Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR1, CDR2 и/или CDR3 легкой цепи. Согласно одному варианту осуществления последовательность CDR представляет собой последовательность CDR1, CDR2 и/или CDR3 тяжелой цепи.
Согласно одному варианту осуществления последовательность вариабельного домена антитела представляет собой последовательность петли 4. Согласно одному варианту осуществления последовательность петли 4 представляет собой последовательность петли 4 тяжелой цепи. Согласно одному варианту осуществления последовательность петли 4 представляет собой последовательность петли 4 легкой цепи.
Согласно одному варианту осуществления последовательность вариабельного домена антитела представляет собой N-концевую последовательность. Согласно одному варианту осуществления N-концевая последовательность представляет собой N-концевую последовательность тяжелой цепи. Согласно одному варианту осуществления N-концевая последовательность представляет собой N-концевую последовательность легкой цепи.
Согласно одному варианту осуществления последовательность вариабельного домена антитела выбирают из последовательности CDR тяжелой цепи, последовательности CDR легкой цепи, последовательности петли 4 тяжелой цепи, последовательности петли 4 легкой цепи, N-концевой последовательности тяжелой цепи, N-концевой последовательности легкой цепи и их комбинации.
Согласно одному варианту осуществления вариабельный домен происходит из тяжелой цепи, и последовательность вариабельного домена содержит первую последовательность CDR и последовательность, выбранную из N-концевой последовательности, последовательности петли 4, второй последовательности CDR, третьей последовательности CDR и их комбинации. Согласно конкретному варианту осуществления первая последовательность CDR представляет собой CDR3, и последовательность вариабельного домена дополнительно содержит последовательность, выбранную из N-концевой последовательности, последовательности петли 4, последовательности CDR2, последовательности CDR1 и их комбинации.
Согласно одному варианту осуществления вариабельный домен с модификацией гистидина происходит из тяжелой цепи, и модификация гистидина находится в последовательности петли 4 и последовательности, выбранной из последовательности CDR1 или CDR2 или CDR3, N-концевой, а также их комбинации. Согласно конкретному варианту осуществления модификация гистидина находится в последовательности петли 4 и последовательности CDR3. Согласно конкретному варианту осуществления модификация гистидина находится в последовательности петли 4 и последовательности CDR3 и N-концевой последовательности. Согласно конкретному варианту осуществления модификация гистидина находится в последовательности петли 4 и N-концевой последовательности.
Согласно одному аспекту предусмотрен описанный в настоящем документе вариабельный домен иммуноглобулина с модифицированным гистидином, причем вариабельный домен иммуноглобулина с модифицированным гистидином, который не связывается с представляющим интерес антигеном или который связывается с представляющим интерес антигеном с первой аффинностью при значении pH менее 6; и связывается с тем же представляющим интерес антигеном со второй аффинностью при значении pH приблизительно 7 или более. Согласно одному варианту осуществления первое значение pH меньше 5,5 или меньше, чем 5. Согласно одному варианту осуществления первое значение pH равно 5,75. Согласно одному варианту осуществления второе значение pH равно приблизительно 7 или выше. Согласно одному варианту осуществления второе значение pH представляет собой значение внеклеточного pH человека. Согласно одному варианту осуществления второе значение pH от 7,2 до 7,4. Согласно конкретному варианту осуществления второе значение pH составляет 7,2.
Согласно одному варианту осуществления вариабельный домен с модифицированным гистидином содержит один, два, три, четыре, пять или шесть или больше гистидиновых замен в последовательности, выбранной из CDR, N-концевой, петли 4 и их комбинации. Согласно конкретному варианту осуществления вариабельный домен с модифицированным гистидином содержит модификацию в CDR3. Согласно одному варианту осуществления вариабельный домен с модифицированным гистидином содержит модификацию, выбранную из модификации CDR3 в тяжелой цепи, модификации CDR3 в легкой цепи и их комбинации. Согласно одному варианту осуществления вариабельный домен с модифицированным гистидином содержит по меньшей мере одну замену в CDR (например, CDR3) и по меньшей мере одну замену в последовательности, выбранной из N-концевой, петли 4 и их комбинации.
Согласно одному варианту осуществления CDR, выбирают из группы, состоящей из CDR1 тяжелой цепи, CDR2 тяжелой цепи, CDR3 тяжелой цепи, CDR1 легкой цепи, CDR2 легкой цепи, CDR3 легкой цепи и их комбинации.
Согласно одному варианту осуществления по меньшей мере один CDR содержит CDR3 легкой цепи. Согласно одному варианту осуществления по меньшей мере один CDR содержит CDR3 легкой цепи и CDR3 тяжелой цепи.
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при нейтральном или основном значении pH (например, pH 7-7,4) с KD приблизительно 10-6 или менее (например, 10-7, 10-8, 10-9, 10-10,10-11,10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит: CDR1, причем все не связывающие антиген аминокислотные остатки заменены гистидином или причем CDR1 содержит кластер гистидиновых замен. Согласно одному варианту осуществления вариабельный домен не связывается с представляющим интерес антигеном или связывается с представляющим интерес антигеном в 102-106 раз слабее при кислом значении pH (например, pH 5-6, согласно одному варианту осуществления pH 6).
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при нейтральном или основном значении pH (например, pH 7-7,4) с KD приблизительно 10-6 или менее (например, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит: CDR2, причем все не связывающие антиген аминокислотные остатки заменены гистидином или причем CDR2 содержит кластер гистидиновых замен. Согласно одному варианту осуществления вариабельный домен не связывается с представляющим интерес антигеном или связывается с представляющим интерес антигеном в 102-106 раз слабее при кислом значении pH (например, pH 5-6, согласно одному варианту осуществления pH 6).
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при нейтральном или основном значении pH (например, pH 7-7,4) с KD приблизительно 10-6 или менее (например, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит: CDR3, причем все не связывающие антиген аминокислотные остатки заменены гистидином или причем CDR3 содержит кластер гистидиновых замен. Согласно одному варианту осуществления вариабельный домен не связывается с представляющим интерес антигеном или связывается с представляющим интерес антигеном в 102-106 раз слабее при кислом значении pH (например, pH 5-6, согласно одному варианту осуществления pH 6).
Согласно одному аспекту предусмотрен способ для получения антигенсвязывающего полипептида человека, содержащего домен с модифицированным гистидином, предусматривающий модификацию описанной в настоящем документе нуклеотидной последовательности вариабельного домена иммуноглобулина для кодирования одного или нескольких гистидинов для образования последовательности нуклеиновой кислоты, кодирующей домен с модифицированным гистидином, и слияние последовательности нуклеиновой кислоты, кодирующей домен с модифицированным гистидином (непосредственно или с линкером), с последовательностью иммуноглобулина человека.
Согласно одному варианту осуществления последовательность иммуноглобулина человека представляет собой последовательность константного домена иммуноглобулина. Согласно конкретному варианту осуществления последовательность константного домена иммуноглобулина человека кодирует аминокислотную последовательность, выбранную из группы, состоящей из CH1, шарнира, CH2, CH3 и их комбинации.
Согласно одному аспекту предусмотрена клетка, которая экспрессирует домен с модифицированным гистидином, причем домен с модифицированным гистидином модифицирован, как описано в настоящем документе. Согласно одному варианту осуществления клетка представляет собой клетку млекопитающего. Согласно одному варианту осуществления клетка выбрана из клетки HeLa, клетки DU145, клетки Lncap, клетки MCF-7, клетки MDA-MB-438, клетки РС3, клетки T47D, клетки ТНР-1, клетки U87, клетки SHSY5Y (нейробластомы человека), клетки Saos-2, клетки Vero, клетки CHO, клетки GH3, клетки PC12, клетки сетчатки человека (например, клетки PERC.6™) и клетки МС3Т3. Согласно конкретному варианту осуществления клетка представляет собой клетку CHO.
Согласно одному аспекту предусмотрен описанный в настоящем документе домен иммуноглобулина с модифицированным гистидином, причем домен иммуноглобулина с модифицированным гистидином не связывается с представляющим интерес антигеном или связывается с представляющим интерес антигеном с первой аффинностью при значении pH 5-6 (например, 5,75) и связывается с тем же представляющим интерес антигеном со второй аффинностью при значении pH 7-7,4 (например, 7,2), причем по меньшей мере одна CDR содержит две или более гистидиновые замены и по меньшей мере одна последовательность не-CDR содержит одну или несколько гистидиновых замен, причем по меньшей мере одну последовательность не-CDR выбирают из N-концевой последовательности, последовательность петли 4, а также их комбинации.
Согласно одному варианту осуществления первая аффинность характеризуется не связыванием или KD 10-6 или выше (например, 10-3), а вторая аффинность характеризуется большей силой по меньшей мере в 2 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 102 раз, по меньшей мере в 103 раз, по меньшей мере в 104 раз, по меньшей мере в 105 раз или по меньшей мере в 106 раз, чем первая аффинность.
Согласно одному варианту осуществления последовательность не-CDR находится на том же полипептиде, что и по меньшей мере одна последовательность CDR. Согласно одному варианту осуществления последовательность не-CDR находится на другом полипептиде, относительно по меньшей мере одной последовательности CDR.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 тяжелой и/или легкой цепи, и CDR3 содержит замену на гистидин по меньшей мере половины не связывающих антиген аминокислотных остатков. Согласно конкретному варианту осуществления все не связывающие антиген аминокислотные остатки в CDR3 заменены на гистидин.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 тяжелой и/или легкой цепи, и CDR3 содержит замену трех или более не связывающих антиген аминокислотных остатков на гистидин. Согласно одному варианту осуществления четыре или более не связывающих антиген аминокислотных остатка заменены на гистидин.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 тяжелой и/или легкой цепи, и CDR3 содержит замену на гистидин двух или более не связывающих антиген аминокислотных остатков. Согласно одному варианту осуществления три или более не связывающих антиген аминокислотных остатка заменены на гистидин.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 легкой и/или тяжелой цепи и дополнительно содержит CDR, выбранную из CDR1 легкой цепи, CDR2 легкой цепи, а также их комбинации.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 легкой и/или тяжелой цепи и дополнительно содержит CDR, выбранную из CDR1 тяжелой цепи, CDR2 тяжелой цепи, а также их комбинации.
Согласно одному варианту осуществления CDR выбирают из группы, состоящей из CDR1 тяжелой цепи, CDR2 тяжелой цепи, CDR3 тяжелой цепи, CDR1 легкой цепи, CDR2 легкой цепи, CDR3 легкой цепи, и их комбинации.
Согласно одному варианту осуществления по меньшей мере одна CDR содержит CDR3 легкой цепи. Согласно одному варианту осуществления по меньшей мере одна CDR содержит CDR3 легкой цепи и CDR3 тяжелой цепи.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 легкой и/или тяжелой цепи и по меньшей мере одна последовательность не-CDR представляет собой последовательность петли 4, причем последовательность петли 4 содержит одну или несколько гистидиновых замен.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 легкой и/или тяжелой цепи и по меньшей мере одна последовательность не-CDR представляет собой N-концевую последовательность, причем N-концевая последовательность содержит одну или несколько гистидиновых замен.
Согласно одному варианту осуществления по меньшей мере одна CDR, представляет собой CDR3 легкой цепи, по меньшей мере одна последовательность не-CDR содержит N-концевую последовательность с одним или несколькими заменами гистидина и последовательность петли 4 с одной или несколькими заменами гистидина.
Согласно одному варианту осуществления по меньшей мере одна CDR представляет собой CDR3 тяжелой цепи, по меньшей мере одна последовательность не-CDR содержит N-концевую последовательность с одной или несколькими заменами гистидина и последовательность петли 4 с одной или несколькими заменами гистидина.
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при значении pH 7-7,4 (например, pH 7,2) с KD приблизительно 10-7 или менее (например, 10-8, 10-9, 10-10, 10-11, 10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит CDR1, причем все не связывающие антиген аминокислотные остатки замещены гистидином.
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при значении pH 7-7,4 (например, pH 7,2) с KD приблизительно 10-7 или менее (например, 10-8, 10-9, 10-10, 10-11, 10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит CDR2, причем все не связывающие антиген аминокислотные остатки замещены гистидином.
Согласно одному варианту осуществления вариабельный домен иммуноглобулина с модифицированным гистидином связывается с представляющим интерес антигеном при значении pH 7-7,4 (например, pH 7,2) с KD приблизительно 10-7 или менее (например, 10-8, 10-9, 10-10, 10-11, 10-12), причем вариабельный домен иммуноглобулина с модифицированным гистидином содержит CDR3, причем все не связывающие антиген аминокислотные остатки замещены гистидином.
Согласно одному аспекту предусмотрено использование описанного в настоящем документе способа в производстве лекарственного средства для лечения заболевания или нарушения человека. Согласно одному варианту осуществления лекарственное средство представляет собой антитело. Согласно конкретному варианту осуществления антитело представляет собой антитело человека.
Согласно одному аспекту предусмотрено использование описанного в настоящем документе вариабельного домена с модифицированным гистидином в производстве лекарственного средства для лечения заболевания или нарушения человека. Согласно одному варианту осуществления лекарственное средство представляет собой антитело. Согласно конкретному варианту осуществления антитело представляет собой антитело человека.
Согласно одному аспекту предусмотрено использование описанного в настоящем документе способа или вариабельного домена с модифицированным гистидином в производстве лекарственного средства для лечения заболевания или нарушения человека, причем лекарственное средство содержит антигенсвязывающий белок, выбранный из антитела, мультиспецифического антитела (например, биспецифического антитела), scFv, биспецифического scFv, диатела, триатела, тетратела, V-NAR, VHH, VL, F(ab), F(ab)2, DVD (т.е. антигенсвязывающего белка с двойным вариабельным доменом), SVD (т.е., антигенсвязывающего белка с единственным вариабельным доменом) или биспецифического Т-клеточного поручателя (т.е., BiTE).
Согласно одному аспекту описанный в настоящем документе способ используется для производства последовательности вариабельной области тяжелой цепи и легкой цепи κ или λ для получения антигенсвязывающего белка человека, который дополнительно содержит слияние последовательностей вариабельной области с модификацией гистидина тяжелой и/или легкой цепи (непосредственно или через линкер) с последовательностями константных областей тяжелой и легкой цепи человека для образования слитых последовательностей, экспрессирующих слитые последовательности в клетке, и восстановление экспрессированного антигенсвязывающего белка, содержащего слитые последовательности. Согласно различным вариантам осуществления константные области тяжелой цепи человека выбирают из IgM, IgD, IgA, IgE и IgG. Согласно различным конкретным вариантам осуществления IgG выбирают из IgG1, IgG2, IgG3 и IgG4. Согласно различным вариантам осуществления константную область тяжелой цепи человека выбирают из последовательности, содержащей CH1, шарнир, CH2, CH3, CH4 и их комбинации. Согласно конкретному варианту осуществления комбинация представляет собой CH1, шарнир, CH2 и CH3. Согласно конкретному варианту осуществления комбинация представляет собой CH1, CH2 и CH3. Согласно конкретному варианту осуществления комбинация представляет собой шарнир, CH2 и CH3. Согласно конкретному варианту осуществления комбинация представляет собой шарнир, CH2 и CH3.
Согласно одному аспекту предусмотрена биологическая система для производства антитела или вариабельного домена антитела, который связывается с антигеном-мишенью при нейтральном значении pH, но проявляет сниженное связывание с тем же антигеном при кислом значении pH (например, pH 5,0-6,0). Биологическая система содержит отличное от человека животное, например, грызуна (например, мышь или крысу), которое содержит реаранжированную последовательность легкой цепи (например, реаранжированную V-J), которая содержит одну или несколько модификаций гистидина. Согласно различным аспектам одна или несколько модификаций гистидина находятся в кодоне CDR3 легкой цепи. Согласно различным аспектам отличное от человека животное содержит человеческий или гуманизированный локус тяжелой цепи иммуноглобулина. Согласно различным аспектам отличное от человека животное содержит замещение эндогенных отличных от человеческих вариабельных генных сегментов тяжелой цепи одним или несколькими сегментами VH, DH, и JH тяжелой цепи человека, причем человеческие сегменты функционально связаны с отличной от человеческой константной областью иммуноглобулина. Согласно различным аспектам предусмотрены отличные от человека животные с универсальными легкими цепями, содержащими вариабельные домены легкой цепи с заменами негистидиновых остатков на остатки гистидина. Согласно различным аспектам эти отличные от человека животные с универсальными легкими цепями с модификациями гистидинов (например, грызуны, например, мыши) относятся к мышам с гистидин-универсальной легкой цепью, гистидин-ULC мышам или HULC мышам.
Таким образом, согласно одному аспекту в настоящем документе предусмотрено генетически модифицированное отличное от человека животное, которое содержит в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области иммуноглобулина человека функционально связана с генной последовательностью константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления генная последовательность константной области легкой цепи иммуноглобулина представляет собой отличную от человеческой генную последовательность константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления отличная от человеческой генная последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную генную последовательность константной области легкой цепи иммуноглобулина.
Согласно одному варианту осуществления отличное от человека животное не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина находится в эндогенном отличном от человеческом локусе легкой цепи иммуноглобулина.
Согласно одному варианту осуществления животное дополнительно содержит в своей зародышевой линии локус тяжелой цепи иммуноглобулина, который содержит нереаранжированную генную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой отличную от человеческой генную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления отличная от человеческой генная последовательность константной области тяжелой цепи представляет собой эндогенную генную последовательность константной области тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления локус тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR). Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей CDR3. Согласно одному варианту осуществления замена представляет собой замену одного, двух, трех, четырех или более кодонов CDR3. Согласно одному аспекту единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, находящаяся в локусе легкой цепи иммуноглобулина, происходит из генного сегмента Vκ1-39 или Vκ3-20 человека. Согласно одному варианту осуществления единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ1-39/Jκ5, и генная последовательность Vκ1-39/Jκ5 содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанный для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека происходит из реаранжированной генной последовательности Vκ3-20/Jκ1, и генная последовательность Vκ3-20/Jκ1 содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанную для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации.
Согласно одному аспекту описанное в настоящем документе отличное от человека животное содержит популяцию В-клеток в ответ на представляющий интерес антиген, которая обогащена антителами, которые проявляют снижение диссоциационного периода полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления снижение t1/2 при кислом значении pH, по сравнению с нейтральным значением pH, происходит приблизительно в 30 или более раз.
Согласно одному варианту осуществления животное экспрессирует антитело, содержащее вариабельный домен легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового остатка на остаток гистидина в аминокислотном положении, кодируемом по меньшей мере одним кодоном, замененным в генной последовательности вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления животное экспрессирует антитело, которое сохраняет замену по меньшей мере одного негистидинового остатка на остаток гистидина в экспрессированном вариабельном домене легкой цепи иммуноглобулина человека, несмотря на соматические гипермутации.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее. Согласно одному варианту осуществления млекопитающее представляет собой грызуна, например, крысу или мышь. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь. Таким образом, согласно одному аспекту в настоящем документе предусмотрена генетически модифицированная мышь, содержащая в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления мышь не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина.
Согласно одному варианту осуществления единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина в зародышевой линии мыши функционально связана с генной последовательностью константной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления генную последовательность константной области легкой цепи иммуноглобулина выбирают из генной последовательности константной области легкой цепи иммуноглобулина крысы или мыши. Согласно одному варианту осуществления генная последовательность константной области легкой цепи иммуноглобулина представляет собой последовательность мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина находится в эндогенном локусе легкой цепи иммуноглобулина мыши.
Согласно дополнительному варианту осуществления мышь также содержит в своей зародышевой линии локус тяжелой цепи иммуноглобулина, который содержит нереаранжированную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина. Согласно одному аспекту генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой генную последовательность константной области тяжелой цепи крысы или мыши. Согласно одному варианту осуществления генная последовательность константной области тяжелой цепи иммуноглобулина представляет собой последовательность мыши. Согласно одному варианту осуществления локус тяжелой цепи иммуноглобулина находится в эндогенном локусе тяжелой цепи иммуноглобулина мыши.
Согласно одному аспекту мышь содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем замена происходит в нуклеотидной последовательности, кодирующей CDR. Согласно одному варианту осуществления замена происходит в кодоне CDR3, например в одном, двух, трех, четырех или более ко донах CDR3. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, полученную из генного сегмента Vκ1-39 или Vκ3-20 человека, например единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ1-39/Jκ5, и генная последовательность Vκ1-39/Jκ5 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанное для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 105, 106, 108 и 111. Согласно другому варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 106, 108 и 111.
Согласно другому варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина происходит из реаранжированной генной последовательности Vκ3-20/Jκ1, и последовательность Vκ3-20/Jκ1 содержит замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон, разработанное для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления такое замещение разрабатывается для замещения гистидинов в положениях 105, 106, 107 и 109 Согласно другому варианту осуществления такое замещение разрабатывается для замены гистидинов в положениях 105,106 и 109.
Согласно одному варианту осуществления описанная в настоящем документе мышь содержит популяцию В-клеток в ответ на представляющий интерес антиген, которая обогащена антителами, которые проявляют сниженный диссоциационный период полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления уменьшение t1/2 при кислом значении pH, по сравнению с нейтральным значением pH, происходит приблизительно в 30 или более раз.
Согласно одному варианту осуществления описанная в настоящем документе мышь экспрессирует популяцию антиген-специфических антител в ответ на представляющий интерес антиген, причем все антитела содержат (а) вариабельные домены легкой цепи иммуноглобулина, полученные из той же единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и (b) вариабельные домены тяжелой цепи иммуноглобулина, полученные из репертуара сегментов V, D и J тяжелой цепи человека.
Также в настоящем документе предусмотрен отличный от человеческого локус, например, локус мыши, содержащий единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL человека, причем единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления локус содержится в зародышевой линии отличного от человека животного. Согласно одному варианту осуществления локус содержит единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина человека, полученную из генных сегментов Vκ1-39 или Vκ3-20 человека, например, полученную из реаранжированных генных последовательностей Vκ1-39/Jκ5 или Vκ3-20/Jκ1. Согласно одному варианту осуществления, при котором присутствующая в локусе единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной последовательности Vκ1-39/Jκ5, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления, при котором присутствующая в локусе единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной последовательности Vκ3-20/Jκ1, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно различным вариантам осуществления описанные в настоящем документе отличные от человеческих локусы могут быть получены с использованием описанных ниже способов для получения генетически модифицированного отличного от человека животного.
Согласно еще одному аспекту в настоящем документе предусмотрен способ получения отличного от человека животного, которое содержит генетически модифицированный локус легкой цепи иммуноглобулина в своей зародышевой линии, причем способ предусматривает модификацию генома отличного от человека животного для удаления или приведения в нефункциональное состояние эндогенных сегментов V и J легкой цепи иммуноглобулина в локусе легкой цепи иммуноглобулина, и размещение в геноме единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления такой способ приводит к генетически модифицированному отличному от человека животному, которое содержит популяцию В-клеток, обогащенных антителами, обладающими зависимым от pH связыванием с представляющим интерес антигеном. Согласно одному варианту осуществления размещенная в геноме единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из генной последовательности Vκ1-39 или Vκ3-20, например, реаранжированной Vκ1-39/Jκ5 или Vκ3-20/Jκ1 человека. Таким образом, согласно варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной Vκ1-39/Jκ5, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, при котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из реаранжированной Vκ3-20/Jκ1, замена по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывается для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации.
Согласно другому аспекту в настоящем документе предусмотрен способ получения антитела, которое проявляет зависимое от pH связывание с представляющим интерес антигеном, предусматривающий (а) получение описанной в настоящем документе мыши (например, мыши, которая содержит в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности сегментов VL и JL, и замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в своей реаранжированной последовательности вариабельной области легкой цепи), (b) иммунизацию мыши представляющим интерес антигеном и (с) отбор антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью при нейтральном значении pH, при этом демонстрируя сниженное связывание с антигеном при кислом значении pH. Согласно одному варианту осуществления способ приводит к получению антитела, которое проявляет t1/2 при кислом значении pH и 37°C, составляющее приблизительно 2 минуты или менее. Согласно одному варианту осуществления способ приводит к получению антитела, которое проявляет снижение в диссоциационном периоде полувыведения (t1/2) при кислом значении pH, по сравнению с нейтральным значением pH, по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз.
Согласно другим аспектам в настоящем документе предусмотрены дополнительные способы получения антитела, которое проявляет зависимое от pH связывание с представляющим интерес антигеном. Один из таких способов предусматривает: (а) выбор первого антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (b) модификацию нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела для получения замены по меньшей мере одного негистидинового кодона на гистидиновый кодон, (с) экспрессию тяжелой цепи иммуноглобулина первого антитела и модифицированной легкой цепи иммуноглобулина в клетке и (d) выбор второго антитела, экспрессированного в клетке, которое сохраняет требуемую аффинность к представляющему интерес антигену при нейтральном значении pH и отображает сниженное связывание с представляющим интерес антигеном при кислом значении pH. Согласно одному варианту осуществления нуклеотидная последовательность легкой цепи иммуноглобулина первого антитела содержит единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека. Согласно одному варианту осуществления первое антитело получают от отличного от человека животного, например, мыши, содержащего последовательность легкой цепи иммуноглобулина, полученную из единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека, и модификацию легкой цепи иммуноглобулина выполняют в единственной реаранжированной последовательности вариабельной области иммуноглобулина человека. Согласно одному варианту осуществления первое антитело получают от отличного от человека животного, например, мыши, дополнительно содержащего последовательность тяжелой цепи иммуноглобулина, полученную из репертуара сегментов VH, DH и JH человека. Согласно одному варианту осуществления единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека выбирают из генной последовательности Vκ1-39/Jκ5 и Vκ3-20/Jκ1. Согласно одному варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека представляет собой Vκ1-39/Jκ5, модификацию в нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела выполняют в кодоне CDR3 в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, в котором единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека представляет собой Vκ3-20/Jκ1, модификацию в нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела выполняют в кодоне CDR3 в положении, выбранном из 105, 106, 107, 109 и их комбинации.
Согласно одному варианту осуществления способ получения антитела, которое проявляет зависимое от pH связывание с описанным в настоящем документе представляющим интерес антигеном приводит к антителу, которое проявляет снижение в диссоциационном периоде полувыведения при кислом значении pH, по сравнению с нейтральным значением pH, по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления способ получения антител приводит к антителу, которое проявляет t1/2 при кислом значении pH и 37°C, равное приблизительно 2 минуты или менее.
Предусмотрены генетически модифицированные локусы тяжелой цепи иммуноглобулина в геноме зародышевой линии отличных от человека животных, причем локусы тяжелой цепи иммуноглобулина содержат генетически модифицированную нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи (например, один или несколько генетически модифицированных генных сегментов VH, D и/или JH человека), причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Согласно различным вариантам осуществления генетически модифицированная нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит по меньшей мере один гистидиновый кодон по меньшей мере в одной рамке считывания, которая кодирует вариабельный домен тяжелой цепи иммуноглобулина. Согласно различным вариантам осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая по меньшей мере один гистидиновый кодон, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи (например, нуклеотидной последовательностью константной области тяжелой цепи, которая кодируют изотип иммуноглобулина, выбранный из IgM, IgD, IgA, IgE и IgG).
Предусмотрены отличные от человека животные (млекопитающие, например, такие грызуны, как мыши, крысы или хомяки), которые подвергнуты генной инженерии для включения геномных локусов тяжелой цепи иммуноглобулина в свой геном зародышевой линии, причем геномные локусы содержат нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи (например, один или несколько генетически модифицированных генных сегментов VH, D и/или JH человека), причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Согласно различным вариантам осуществления геном отличных от человека животных содержит модификацию (i), которая удаляет или приводит в нефункциональное состояние все или по существу все эндогенные генные сегменты VH, D и/или JH иммуноглобулина (например, путем введения нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности, в локус иммуноглобулина или путем нефункциональной реаранжировки или инверсии эндогенных генных сегментов VH, D и/или JH); и (ii) которая вводит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека (например, генетически модифицированные генные сегменты VH, D или JH человека), причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Согласно различным вариантам осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса тяжелой цепи иммуноглобулина в своем геноме), или в пределах своего эндогенного локуса (например, в пределах вариабельного локуса иммуноглобулина, причем эндогенный локус расположен или перемещен в другое место в геноме). Согласно различным вариантам осуществления нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи (например, нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgA, IgE и IgG).
Предусмотрены генетически модифицированные отличные от человека животные, которые способны экспрессировать генетически модифицированный тяжелый вариабельный домен иммуноглобулина, содержащий один или несколько гистидинов, причем один или несколько гистидинов не кодируются генным сегментом зародышевой линии соответствующего отличного от человека животного дикого типа.
Предусмотрены генетически модифицированные отличные от человека животные, которые содержат популяцию В-клеток, которая характеризуется реаранжированными вариабельными генами тяжелой цепи иммуноглобулина, которые кодируют вариабельный домен тяжелой цепи иммуноглобулина с одним или несколькими гистидинами, которые не кодируются генным сегментом зародышевой линии соответствующего отличного от человека животного дикого типа.
Предусмотрены способы и композиции для получения отличных от человека животных, которые содержат генетически модифицированный вариабельный локус тяжелой цепи иммуноглобулина, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, содержащую один или несколько гистидиновых кодонов по меньшей мере в одной рамке считывания, которая кодирует вариабельный домен тяжелой цепи.
Предусмотрены способы и композиции для отличных от человека животных, которые производят антигенсвязывающие белки, которые проявляют зависимое от pH связывание антигена. Предусмотрены способы и композиции для получения отличных от человека животных, которые характеризуются наличием популяций В-клеток или популяций антитела, которые обогащены (по сравнению с соответствующими животными дикого типа) антигенсвязывающими белками, которые характеризуются зависимостью от pH, например, в частности, вариабельными доменами тяжелых цепей и/или их антигенсвязывающими фрагментами.
Согласно одному аспекту предусмотрен генетически модифицированный локус иммуноглобулина в геноме зародышевой линии отличного от человека животного, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в генном сегменте тяжелой цепи иммуноглобулина, выбранном из генного сегмента VH человека, генного сегмента D человека, генного сегмента JH человека и их комбинации. Согласно одному варианту осуществления генный сегмент тяжелой цепи иммуноглобулина выбирают из генного сегмента VH зародышевой линии человека, генного сегмента D зародышевой линии человека, генного сегмента JH зародышевой линии человека и их комбинации.
Согласно одному варианту осуществления генный сегмент V человека (VH) выбирают из группы, состоящей из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека выбирают из группы, состоящей из D1-1, D1-7, D1-14, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-12, D5-5, D5-18, D5-24, D6-6, D6-13, D6-19, D6-25, D7-27 и их комбинации.
Согласно одному варианту осуществления генный сегмент J человека выбирают из группы, состоящей из JH1, JH2, JH3, JH4, JH5, JH6 и их комбинации.
Согласно одному варианту осуществления добавленный или замененный гистидиновым кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует N-концевую область, область петли 4, CDR1, CDR2, CDR3 или их комбинацию.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более гистидиновых кодонов.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е. там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое место в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434 Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256E); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую один или несколько генных сегментов VH, D и/или JH человека, содержащих один или несколько гистидиновых кодонов, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эктопически присутствующий ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную (например, реаранжированную последовательность V/J λ или κ) последовательность, которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется снижением по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз диссоциацонного периода полувыведения (t1/2) при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с описанным в настоящем документе антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному аспекту предусмотрен генетически модифицированный локус иммуноглобулина в геноме зародышевой линии отличного от человека животного, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более эндогенных негистидиновых кодонов заменены гистидиновыми кодонами.
Согласно одному варианту осуществления эндогенный негистоновый кодон кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления эндогенный негистидиновый кодон, который заменен гистидиновым кодоном, присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует вариабельный домен иммуноглобулина, выбранный из N-концевой области, области петли 4, CDR1, CDR2, CDR3, их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует определяющую комплементарность область (CDR), выбранную из CDR1, CDR2, CDR3 и их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует каркасную область (FR), выбранную из FR1, FR2, FR3, FR4 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит генетически модифицированный генный сегмент VH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента VH человека были заменены гистидиновым кодоном.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента VH человека на гистидиновый кодон, причем генный сегмент VH человека выбирают из группы, состоящей из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит генетически модифицированный генный сегмент JH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента JH человека были заменены гистидиновым кодоном.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента JH человека на гистидиновый кодон, причем генный сегмент JH человека выбирают из группы, состоящей из JH1, JH2, JH3, JH4, JH5, JH6 и их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует часть CDR3. Согласно одному варианту осуществления часть CDR3 содержит аминокислотную последовательность, происходящую из рамки считывания генетически модифицированного генного сегмента D человека, содержащего модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в рамке считывания на гистидиновый кодон.
Согласно одному варианту осуществления эндогенный негистидиновый кодон, который заменен гистидиновым кодоном, кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует по меньшей мере в одной рамке считывания генного сегмента D человека, который наиболее часто наблюдается у VELOCIMMUNE® мышей с гуманизированными иммуноглобулинами.
Согласно одному варианту осуществления рамку считывания генетически модифицированного генного сегмента D человека, который кодирует часть CDR3, выбирают из гидрофобной рамки, стоп рамки и гидрофильной рамки.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофобную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (GTTGT; SEQ ID NO: 88), D1-7 (GITGT; SEQ ID NO: 89), D1-20 (GITGT; SEQ ID NO: 89) и D1-26 (GIVGAT; SEQ ID NO: 90), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (DIVVVPAAI; SEQ ID NO: 92), D2-8 (DIVLMVYAI; SEQ ID NO: 94), D2-15 (DIVVVVAAT; SEQ ID NO: 95) и D2-21 (HIVVVTAI; SEQ ID NO: 97), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (ITIFGVVII; SEQ ID NO: 98), D3-9 (ITIF*LVII; SEQ ID NO: 99, SEQ ID NO: 100), D3-10 (ITMVRGVII; SEQ ID NO: 101), D3-16 (IMITFGGVIVI; SEQ ID NO: 102) и D3-22 (ITMIVVVIT; SEQ ID NO: 103), генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (TTVT; SEQ ID NO: 105), D4-11 (TTVT; SEQ ID NO: 105), D4-17 (TTVT; SEQ ID NO: 105), D4-23 (TTVVT; SEQ ID NO: 106), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (VDTAMV; SEQ ID NO: 107), D5-12 (VDIVATI; SEQ ID NO: 108), D5-18 (VDTAMV; SEQ ID NO: 107) и D5-24 (VEMATI; SEQ ID NO: 109), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (SIAAR; SEQ ID NO: 111), D6-13 (GIAAAG; SEQ ID NO: 113) и D6-19 (GIAVAG; SEQ ID NO: 115), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка содержит нуклеотидную последовательность, которая кодирует человеческий D7-27 (LTG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой стоп рамку считывания генного сегмента D человека.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (VQLER; SEQ ID NO: 8), D1-7 (V*LEL), D1-20 (V*LER), D1-26 (V*WELL; SEQ ID NO: 12), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (RIL**YQLLY; SEQ ID NO: 14), D2-8 (RILY*WCMLY; SEQ ID NO:16 и SEQ ID NO: 17), D2-15 (RIL*WW*LLL) и D2-21 (SILWW*LLF; SEQ ID NO: 19), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (VLRFLEWLLY; SEQ ID NO: 21), D3-9 (VLRYFDWLL*; SEQ ID NO: 23), D3-10 (VLLWFGELL*; SEQ ID NO: 25), D3-16 (VL*LRLGELSLY; SEQ ID NO: 27) и D3-22 (VLL***WLLL; SEQ ID NO: 29), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (*LQ*L), D4-11 (*LQ*L), D4-17 (*LR*L) и D4-23 (*LRW*L), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (WIQLWL; SEQ ID NO: 35); D5-12 (WI*WLRL; SEQ ID NO: 37), D5-18 (WIQLWL; SEQ ID NO: 35) и D5-24 (*RWLQL; SEQ ID NO: 39), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (V*QLV), D6-13 (V*QQLV; SEQ ID NO: 41) и D6-19 (V*QWLV; SEQ ID NO: 43), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (*LG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофильную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (YNWND; SEQ ID NO: 45), D1-7 (YNWNY; SEQ ID NO: 47), D1-20 (YNWND; SEQ ID NO: 45) и D1-26 (YSGSYY; SEQ ID NO: 49), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (GYCSSTSCYT; SEQ ID NO: 51), D2-8 (GYCTNGVCYT; SEQ ID NO: 53), D2-15 (GYCSGGSCYS; SEQ ID NO: 55) и D2-21 (AYCGGDCYS; SEQ ID NO: 57), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (YYDFWSGYYT; SEQ ID NO: 59), D3-9 (YYDILTGYYN; SEQ ID NO: 61), D3-10 (YYYGSGSYYN; SEQ ID NO: 63), D3-16 (YYDYVWGSYRYT; SEQ ID NO: 65) и D3-22 (YYYDSSGYYY; SEQ ID NO: 67), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (DYSNY; SEQ ID NO: 69), D4-11 (DYSNY; SEQ ID NO: 69), D4-17 (DYGDY; SEQ ID NO: 71) и D4-23 (DYGGNS; SEQ ID NO: 73), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (GYSYGY; SEQ ID NO: 75), D5-12 (GYSGYDY; SEQ ID NO: 77), D5-18 (GYSYGY; SEQ ID NO: 75) и D5-24 (RDGYNY; SEQ ID NO: 79), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (EYSSSS; SEQ ID NO: 81), D6-13 (GYSSSWY; SEQ ID NO: 83) и D6-19 (GYSSGWY; SEQ ID NO: 85), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 76 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (NWG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е. там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое место в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т); или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434 Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т, и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M248L, T250Q или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус содержит модификацию, которая удаляет или приводит в нефункциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и геномный локус содержит генетически модифицированную нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон по меньшей мере в одной рамке считывания. Согласно одному варианту осуществления генетически модифицированная нереаранжированная генная последовательность вариабельной области тяжелой цепи иммуноглобулина присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус содержит эктопически присутствующий ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи к функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную (например, реаранжированную последовательность V/J λ или κ) последовательность, которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий описанный в настоящем документе вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с описанным в настоящем документе антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрен генетически модифицированный локус иммуноглобулина отличного от человека животного, содержащий генный сегмент VH, D и JH человека, причем по меньшей мере один из генных сегментов D человека был инвертирован с 5ʹ к 3ʹ по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в геноме зародышевой линии.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина кодирует вариабельный домен тяжелой цепи иммуноглобулина, содержащий один или более, 2 или более, 3 или больше, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более того, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более или 34 или более остатков гистидина.
Согласно одному варианту осуществления по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять, по меньшей мере одиннадцать, по меньшей мере двенадцать, по меньшей мере тринадцать, по меньшей мере четырнадцать, по меньшей мере пятнадцать, по меньшей мере шестнадцать, по меньшей мере семнадцать, по меньшей мере восемнадцать, по меньшей мере девятнадцать, по меньшей мере двадцать, по меньшей мере двадцать один, по меньшей мере двадцать два, по меньшей мере двадцать три, по меньшей мере двадцать четыре или все или по существу все функциональные генные сегменты D человека характеризуются инвертированной ориентацией по отношению к соответствующим последовательностям дикого типа.
Согласно одному варианту осуществления все или по существу все из эндогенных генных сегментов VH, D, JH иммуноглобулина удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности, в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии всех или по существу всех эндогенных сегментов VH, D, JH иммуноглобулина), и генетически модифицированный локус иммуноглобулина содержит генные сегменты VH, D, JH человека, причем по меньшей мере один генный сегмент D человека присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания в инвертированном генном сегменте D человека содержит по меньшей мере один гистидиновый кодон.
Согласно одному варианту осуществления инвертированный генный сегмент D человека функционально связан с генным сегментом VH человека и/или генным сегментом JH человека.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, выбирают из группы, состоящей из D1-1, D1-7, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-5, D5-12, D5-18, D5-24, D6-6, D6-13, D6-19, D7-27 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D1, выбранный из группы, состоящей из D1-1, D1-7, D1-20, D1-26 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D2, выбранный из группы, состоящей из D2-2, D2-8, D2-15, D2-21 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D3, выбранный из группы, состоящей из D3-3, D3-9, D3-10, D3-16, D3-22 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D4, выбранный из группы, состоящей из D4-4, D4-11, D4-17, D4-23 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D5, выбранный из группы, состоящей из D5-5, D5-12, D5-18, D5-24 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D6, выбранный из группы, состоящей из D6-6, D6-13, D6-19 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой D7-27.
Согласно одному варианту осуществления рамку считывания генного сегмента D человека выбирают из стоп рамки считывания, гидрофильной рамки считывания и гидрофобной рамки считывания, и по меньшей мере одна рамка считывания из инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434 Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую один описанный в настоящем документе инвертированный генный сегмент D человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека.
Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную последовательность (например, реаранжированную последовательность V/J λ или κ), которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с описанным в настоящем документе антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрено отличное от человека животное, содержащее в своем геноме зародышевой линии генетически модифицированный локус иммуноглобулина, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в генном сегменте тяжелой цепи иммуноглобулина, выбранном из генного сегмента VH человека, генного сегмента D человека, генного сегмента JH человека и их комбинации. Согласно одному варианту осуществления генный сегмент тяжелой цепи иммуноглобулина выбирают из генного сегмента VH зародышевой линии человека, генного сегмента D зародышевой линии человека, генного сегмента JH зародышевой линии человека и их комбинации.
Согласно одному варианту осуществления генный сегмент VH человека выбирают из группы, состоящей из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека выбирают из группы, состоящей из D1-1, D1-7, D1-14, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-12, D5-5, D5-18, D5-24, D6-6, D6-13, D6-19, D6-25, D7-27 и их комбинации.
Согласно одному варианту осуществления генный сегмент JH человека выбирают из группы, состоящей из JH1, JH2, JH3, JH4, JH5, JH6 и их комбинации.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, кодирующей N-концевую область, область петли 4, CDR1, CDR2, CDR3 или их комбинацию.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более гистидиновых кодонов.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е. там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое место в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434 Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью не функциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую один или несколько генных сегментов VH, D и/или JH человека, содержащих один или несколько гистидиновых кодонов, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ.
Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную последовательность (например, реаранжированную последовательность V/J λ или κ), которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления отличное от человека животное характеризуется гетерозиготностью для генетически модифицированного локуса тяжелой цепи иммуноглобулина, и отличное от человека животное способно к экспрессии вариабельного домена тяжелой цепи иммуноглобулина человека, содержащего по меньшей мере один остаток гистидина, происходящий преимущественно из описанного в настоящем документе генетически модифицированного локуса тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз диссоциацонного периода полувыведения (t1/2) при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрено отличное от человека животное, содержащее генетически модифицированный локус иммуноглобулина, причем генетически модифицированный локус иммуноглобулина содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, и причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более эндогенных негистидиновых кодонов заменены гистидиновыми ко донами.
Согласно одному варианту осуществления эндогенный негистоновый кодон кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует вариабельный домен иммуноглобулина, выбранный из N-концевой области, области петли 4, CDR1, CDR2, CDR3, их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует определяющую комплементарность область (CDR), выбранную из CDR1, CDR2, CDR3 и их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует каркасную область (FR), выбранную из FR1, FR2, FR3, FR4 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит генетически модифицированный генный сегмент VH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента VH человека были заменены на гистидиновый кодон.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента VH человека на гистидиновый кодон, причем генный сегмент VH человека выбирают из группы, состоящей из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит генетически модифицированный генный сегмент JH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента JH человека были заменены на гистидиновый кодон.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента JH человека на гистидиновый кодон, причем генный сегмент JH человека выбирают из группы, состоящей из JH1, JH2, JH3, JH4, JH5, JH6 и их комбинации.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует в нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует часть CDR3. Согласно одному варианту осуществления часть CDR3 содержит аминокислотную последовательность, происходящую из рамки считывания генетически модифицированного генного сегмента D человека, содержащего модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в рамке считывания на гистидиновый кодон.
Согласно одному варианту осуществления эндогенный негистидиновый кодон, который заменен гистидиновым кодоном, кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления замененный гистидиновый кодон присутствует по меньшей мере в одной рамке считывания генного сегмента D человека, который наиболее часто наблюдается у VELOCIMMUNE® мышей с гуманизированными иммуноглобулинами.
Согласно одному варианту осуществления рамку считывания генетически модифицированного генного сегмента D человека, который кодирует часть CDR3, выбирают из гидрофобной рамки, стоп рамки и гидрофильной рамки.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофобную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (GTTGT; SEQ ID NO: 88), D1-7 (GITGT; SEQ ID NO: 89), D1-20 (GITGT; SEQ ID NO: 89) и D1-26 (GIVGAT; SEQ ID NO: 90), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (DIVVVPAAI; SEQ ID NO: 92), D2-8 (DIVLMVYAI; SEQ ID NO: 94), D2-15 (DIVVVVAAT; SEQ ID NO: 95) и D2-21 (HIVVVTAI; SEQ ID NO: 97), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (ITIFGVVII; SEQ ID NO: 98), D3-9 (ITIF*LVII; SEQ ID NO: 99, SEQ ID NO: 100), D3-10 (ITMVRGVII; SEQ ID NO: 101), D3-16 (IMITFGGVIVI; SEQ ID NO: 102) и D3-22 (ITMIVVVIT; SEQ ID NO: 103), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (TTVT; SEQ ID NO: 105), D4-11 (TTVT; SEQ ID NO: 105), D4-17 (TTVT; SEQ ID NO: 105), D4-23 (TTVVT; SEQ ID NO: 106), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (VDTAMV; SEQ ID NO: 107), D5-12 (VDIVATI; SEQ ID NO: 108), D5-18 (VDTAMV; SEQ ID NO: 107) и D5-24 (VEMATI; SEQ ID NO: 109), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (SIAAR; SEQ ID NO: 111), D6-13 (GIAAAG; SEQ ID NO: 113) и D6-19 (GIAVAG; SEQ ID NO: 115), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка содержит нуклеотидную последовательность, которая кодирует человеческий D7-27 (LTG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой стоп рамку считывания генного сегмента D человека.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (VQLER; SEQ ID NO: 8), D1-7 (V*LEL), D1-20 (V*LER), D1-26 (V*WELL; SEQ ID NO: 12), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (RIL**YQLLY; SEQ ID NO: 14), D2-8 (RILY*WCMLY; SEQ ID NO: 16 и SEQ ID NO: 17), D2-15 (RIL*WW*LLL) и D2-21 (SILWW*LLF; SEQ ID NO: 19), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (VLRFLEWLLY; SEQ ID NO: 21), D3-9 (VLRYFDWLL*; SEQ ID NO: 23), D3-10 (VLLWFGELL*; SEQ ID NO: 25), D3-16 (VL*LRLGELSLY; SEQ ID NO: 27) и D3-22 (VLL***WLLL; SEQ ID NO: 29), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (*LQ*L), D4-11 (*LQ*L), D4-17 (*LR*L) и D4-23 (*LRW*L), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (WIQLWL; SEQ ID NO: 35); D5-12 (WI*WLRL; SEQ ID NO: 37), D5-18 (WIQLWL; SEQ ID NO: 35) и D5-24 (*RWLQL; SEQ ID NO: 39), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (V*QLV), D6-13 (V*QQLV; SEQ ID NO: 41) и D6-19 (V*QWLV; SEQ ID NO: 43), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (*LG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофильную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (YNWND; SEQ ID NO: 45), D1-7 (YNWNY; SEQ ID NO: 47), D1-20 (YNWND; SEQ ID NO: 45) и D1-26 (YSGSYY; SEQ ID NO: 49), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (GYCSSTSCYT; SEQ ID NO: 51), D2-8 (GYCTNGVCYT; SEQ ID NO: 53), D2-15 (GYCSGGSCYS; SEQ ID NO: 55) и D2-21 (AYCGGDCYS; SEQ ID NO: 57), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (YYDFWSGYYT; SEQ ID NO: 59), D3-9 (YYDILTGYYN; SEQ ID NO: 61), D3-10 (YYYGSGSYYN; SEQ ID NO: 63), D3-16 (YYDYVWGSYRYT; SEQ ID NO: 65) и D3-22 (YYYDSSGYYY; SEQ ID NO: 67), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (DYSNY; SEQ ID NO: 69), D4-11 (DYSNY; SEQ ID NO: 69), D4-17 (DYGDY; SEQ ID NO: 71) и D4-23 (DYGGNS; SEQ ID NO: 73), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (GYSYGY; SEQ ID NO: 75), D5-12 (GYSGYDY; SEQ ID NO: 77), D5-18 (GYSYGY; SEQ ID NO: 75) и D5-24 (RDGYNY; SEQ ID NO: 79), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (EYSSSS; SEQ ID NO: 81), D6-13 (GYSSSWY; SEQ ID NO: 83) и D6-19 (GYSSGWY; SEQ ID NO: 85), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 76 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (NWG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434 Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419QHV422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус содержит модификацию, которая удаляет или приводит в нефункциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и геномный локус содержит генетически модифицированную нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон по меньшей мере в одной рамке считывания. Согласно одному варианту осуществления генетически модифицированная нереаранжированная генная последовательность вариабельной области тяжелой цепи иммуноглобулина присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи к представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную последовательность (например, реаранжированную последовательность V/J λ или κ), которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий описанный в настоящем документе вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с описанным в настоящем документе антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию IB-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному варианту осуществления отличное от человека животное характеризуется гетерозиготностью для генетически модифицированного локуса тяжелой цепи иммуноглобулина, и отличное от человека животное способно к экспрессии вариабельного домена тяжелой цепи иммуноглобулина человека, содержащего по меньшей мере один остаток гистидина, происходящий преимущественно из описанного в настоящем документе генетически модифицированного локуса тяжелой цепи иммуноглобулина.
Согласно одному аспекту предусмотрено отличное от человека животное, содержащее генетически модифицированный локус иммуноглобулина, содержащий генный сегмент VH, D и JH человека, причем по меньшей мере один из генных сегментов D человека был инвертирован с 5ʹ к 3ʹ по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в геноме зародышевой линии.
Согласно одному варианту осуществления, при котором рамка считывания инвертированного генного сегмента D человека содержит один или более, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более того, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более или 34 или более гистидиновых кодонов.
Согласно одному варианту осуществления по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять, по меньшей мере одиннадцать, по меньшей мере двенадцать, по меньшей мере тринадцать, по меньшей мере четырнадцать, по меньшей мере пятнадцать, по меньшей мере шестнадцать, по меньшей мере семнадцать, по меньшей мере восемнадцать, по меньшей мере девятнадцать, по меньшей мере двадцать, по меньшей мере двадцать один, по меньшей мере двадцать два, по меньшей мере двадцать три, по меньшей мере двадцать четыре или все или по существу все функциональные генные сегменты D человека характеризуются инвертированной ориентацией по отношению к соответствующим последовательностям дикого типа.
Согласно одному варианту осуществления все или по существу все из эндогенный генных сегментов VH, D, JH иммуноглобулина удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности, в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии всех или по существу всех эндогенных сегментов VH, D, JH иммуноглобулина) и генетически модифицированный локус иммуноглобулина содержит генные сегменты VH, D, JH человека, причем по меньшей мере один генный сегмент D человека присутствует в инвертированной ориентации по отношению к соответствующим последовательностям дикого типа, и причем по меньшей мере одна рамка считывания в инвертированном генном сегменте D человека содержит по меньшей мере один гистидиновый кодон.
Согласно одному варианту осуществления инвертированный генный сегмент D человека функционально связан с генным сегментом VH человека и/или генным сегментом JH человека.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, выбирают из группы, состоящей из D1-1, D1-7, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-5, D5-12, D5-18, D5-24, D6-6, D6-13, D6-19, D7-27 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D1, выбранный из группы, состоящей из D1-1, D1-7, D1-20, D1-26 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D2, выбранный из группы, состоящей из D2-2, D2-8, D2-15, D2-21 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D3, выбранный из группы, состоящей из D3-3, D3-9, D3-10, D3-16, D3-22 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D4, выбранный из группы, состоящей из D4-4, D4-11, D4-17, D4-23 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D5, выбранный из группы, состоящей из D5-5, D5-12, D5-18, D5-24 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D6, выбранный из группы, состоящей из D6-6, D6-13, D6-19 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой D7-27.
Согласно одному варианту осуществления рамку считывания генного сегмента D человека выбирают из стоп рамки считывания, гидрофильной рамки считывания, гидрофобной рамки считывания и их комбинации, причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98%) или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую по меньшей мере один описанный в настоящем документе инвертированный генный сегмент D человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную (например, реаранжированную последовательность V/J λ или κ) последовательность, которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления отличное от человека животное характеризуется гетерозиготностью для генетически модифицированного локуса тяжелой цепи иммуноглобулина, и отличного от человека животное способно к экспрессии вариабельного домена тяжелой цепи иммуноглобулина человека, содержащего по меньшей мере один остаток гистидина, происходящий преимущественно из описанного в настоящем документе генетически модифицированного локуса тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному варианту осуществления предусмотрено отличное от человека животное, которое способно к экспрессии антигенсвязывающего белка с улучшенной зависимой от pH способностью к рециркулированию и/или увеличенным периодом полужизни в сыворотке, причем отличное от человека животное содержит в геноме своей зародышевой линии нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи иммуноглобулина человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит описанное в настоящем документе добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с описанным в настоящем документе антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина.
Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрен нацеливающий конструкт, содержащий нацеливающие плечи, гомологичные геномной области D или геномной области V и J отличного от человека животного, причем по меньшей мере один генный сегмент VH, D и JH содержит любую из описанных выше модификаций, например добавление по меньшей мере одного гистидинового кодона, замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон и/или инверсию по меньшей мере одного функционального генного сегмента D по отношению к соответствующей последовательности дикого типа.
Согласно одному аспекту предусмотрена гибридома или квадрома, которая происходит из клетки любого описанного в настоящем документе отличного от человека животного. Согласно одному варианту осуществления отличное от человека животное представляет собой грызуна, например, мышь, крысу или хомяка.
Согласно одному аспекту предусмотрены плюрипотентные, индуцированные плюрипотентные или тотипотентные стволовые клетки, полученные от отличного от человека животного, содержащего различные описанные в настоящем документе геномные модификации. Согласно конкретному варианту осуществления плюрипотентные, индуцированные плюрипотентные или тотипотентные стволовые клетки представляют собой эмбриональные стволовые (ES) клетки мыши или крысы. Согласно одному варианту осуществления плюрипотентные, индуцированные плюрипотентные или тотипотентные стволовые клетки характеризуются кариотипом XX или кариотипом XY. Согласно одному варианту осуществления плюрипотентные или индуцированные плюрипотентные стволовые клетки представляют собой гемопоэтические стволовые клетки.
Согласно одному аспекту также предусмотрены клетки, которые содержат ядро, содержащее описанную в настоящем документе генетическую модификацию, например, модификацию, введенную в клетку путем пронуклеарной инъекции. Согласно одному варианту осуществления плюрипотентные, индуцированные плюрипотентные или тотипотентные стволовые клетки содержат генетически модифицированный геномный локус иммуноглобулина, причем геномный локус содержит от 5ʹ к 3ʹ, (1) сайт рекомбинации FRT, (2) генные сегменты VH человека, (3) ген adam6 мыши, (4) сайт рекомбинации loxP, (5) генные сегменты D человека с замененным гистидином, (6) генные сегменты JH человека с последующими (7) Ei (интронный энхансер) мыши и (8) нуклеотидная последовательность константной области IgM мыши.
Согласно одному аспекту предусмотрен лимфоцит, выделенный из описанного в настоящем документе генетически модифицированного отличного от человека животного. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку, причем В-клетка содержит геномный локус иммуноглобулина, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, причем нереаранжированная генная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному аспекту предусмотрен лимфоцит, выделенный из описанного в настоящем документе генетически модифицированного отличного от человека животного. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку, причем В-клетка содержит локус иммуноглобулина, который содержит генный сегмент V, D и J человека, причем по меньшей мере один из генных сегментов D человека был инвертирован от 5ʹ к 3ʹ по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека кодирует по меньшей мере один остаток гистидина. Согласно одному варианту осуществления В-клетка способна производить антигенсвязывающий белок, содержащий описанный в настоящем документе генетически модифицированный вариабельный домен тяжелой цепи.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный вариабельный домен тяжелой цепи функционально связан с аминокислотной последовательностью константной области тяжелой цепи.
Согласно одному аспекту предусмотрена популяция В-клеток, которая способна экспрессировать антигенсвязывающий белок, причем антигенсвязывающий белок содержит по меньшей мере один остаток гистидина в вариабельном домене тяжелой цепи, причем популяция В-клеток содержит любые описанные в настоящем документе генетические модификации. Согласно одному варианту осуществления по меньшей мере один остаток гистидина присутствует в CDR тяжелой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления по меньшей мере один остаток гистидина присутствует в CDR3.
Согласно одному аспекту предусмотрена популяция В-клеток, которая способна экспрессировать антигенсвязывающий белок с увеличенным периодом полужизни в сыворотке и/или улучшенной зависимой от pH способностью к рециркулированию, причем популяция В-клеток содержит любые описанные в настоящем документе генетические модификации.
Согласно одному аспекту предусмотрен способ для получения отличного от человека животного, содержащего генетически модифицированный вариабельный локус тяжелой цепи иммуноглобулина, предусматривающий: (а) модификацию генома отличного от человека животного для удаления или приведения в нефункциональное состояние эндогенных генных сегментов V, D и J тяжелой цепи иммуноглобулина (например, с помощью вставки нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности, в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH) и (b) размещение в геноме нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит описанное в настоящем документе добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления отличного от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более эндогенных негистидиновых кодонов заменены гистидиновыми ко донами.
Согласно одному варианту осуществления эндогенный негистоновый кодон кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует вариабельный домен иммуноглобулина, выбранный из N-концевой области, области петли 4, CDR1, CDR2, CDR3, их комбинации.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует определяющую комплементарность область (CDR), выбранную из CDR1, CDR2, CDR3 и их комбинации.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует каркасную область (FR), выбранную из FR1, FR2, FR3, FR4 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит генетически модифицированный генный сегмент VH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента VH человека были заменены гистидиновым кодоном.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента VH человека на гистидиновый кодон, причем генный сегмент VH человека выбирают из группы, состоящей из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-30-3, VH3-30-5, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73, VH3-74, VH4-4, VH4-28, VH4-30-1, VH4-30-2, VH4-30-4, VH4-31, VH4-34, VH4-39, VH4-59, VH4-61, VH5-51, VH6-1, VH7-4-1, VH7-81 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит генетически модифицированный генный сегмент JH человека, причем один или несколько эндогенных негистидиновых кодонов по меньшей мере в одной рамке считывания генного сегмента JH человека были заменены гистидиновым кодоном.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон генного сегмента JH человека на гистидиновый кодон, причем генный сегмент JH человека выбирают из группы, состоящей из JH1, JH2, JH3, JH4, JH5, JH6 и их комбинации.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует в нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует часть CDR3. Согласно одному варианту осуществления часть CDR3 содержит аминокислотную последовательность, происходящую из рамки считывания генетически модифицированного генного сегмента D человека, содержащего модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в рамке считывания на гистидиновый кодон.
Согласно одному варианту осуществления эндогенный негистидиновый кодон, который заменен гистидиновым кодоном, кодирует аминокислоту, выбранную из Y, N, D, Q, S, W и R.
Согласно одному варианту осуществления добавленный или замененный гистидиновый кодон присутствует по меньшей мере в одной рамке считывания генного сегмента D человека, который наиболее часто наблюдается у VELOCIMMUNE® мышей с гуманизированными иммуноглобулинами.
Согласно одному варианту осуществления рамку считывания генетически модифицированного генного сегмента D человека, который кодирует часть CDR3, выбирают из гидрофобной рамки, стоп рамки и гидрофильной рамки.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофобную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (GTTGT; SEQ ID NO: 88), D1-7 (GITGT; SEQ ID NO: 89), D1-20 (GITGT; SEQ ID NO: 89) и D1-26 (GIVGAT; SEQ ID NO: 90), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (DIVVVPAAI; SEQ ID NO: 92), D2-8 (DIVLMVYAI; SEQ ID NO: 94), D2-15 (DIVVVVAAT; SEQ ID NO: 95) и D2-21 (HIVVVTAI; SEQ ID NO: 97), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (ITIFGVVII; SEQ ID NO: 98), D3-9 (ITIF*LVII; SEQ ID NO: 99, SEQ ID NO: 100), D3-10 (ITMVRGVII; SEQ ID NO: 101), D3-16 (IMITFGGVIVI; SEQ ID NO: 102) и D3-22 (ITMIVVVIT; SEQ ID NO: 103), генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (TTVT; SEQ ID NO: 105), D4-11 (TTVT; SEQ ID NO: 105), D4-17 (TTVT; SEQ ID NO: 105), D4-23 (TTVVT; SEQ ID NO: 106), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (VDTAMV; SEQ ID NO: 107), D5-12 (VDIVATI; SEQ ID NO: 108), D5-18 (VDTAMV; SEQ ID NO: 107) и D5-24 (VEMATI; SEQ ID NO: 109), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (SIAAR; SEQ ID NO: 111), D6-13 (GIAAAG; SEQ ID NO: 113) и D6-19 (GIAVAG; SEQ ID NO: 115), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофобная рамка содержит нуклеотидную последовательность, которая кодирует человеческий D7-27 (LTG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой стоп рамку считывания генного сегмента D человека.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (VQLER; SEQ ID NO: 8), D1-7 (V*LEL), D1-20 (V*LER), D1-26 (V*WELL; SEQ ID NO: 12), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (PIL**YQLLY; SEQ ID NO: 14), D2-8 (RILY*WCMLY; SEQ ID NO: 16 и SEQ ID NO: 17), D2-15 (RIL*WW*LLL) и D2-21 (SILWW*LLF; SEQ ID NO: 19), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (VLRFLEWLLY; SEQ ID NO: 21), D3-9 (VLRYFDWLL*; SEQ ID NO: 23), D3-10 (VLLWFGELL*; SEQ ID NO: 25), D3-16 (VL*LRLGELSLY; SEQ ID NO: 27) и D3-22 (VLL***WLLL; SEQ ID NO: 29), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (*LQ*L), D4-11 (*LQ*L), D4-17 (*LR*L) и D4-23 (*LRW*L), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (WIQLWL; SEQ ID NO: 35); D5-12 (WI*WLRL; SEQ ID NO: 37), D5-18 (WIQLWL; SEQ ID NO: 35) и D5-24 (*RWLQL; SEQ ID NO: 39), и генный сегмент D человека содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (V*QLV), D6-13 (V*QQLV; SEQ ID NO: 41) и D6-19 (V*QWLV; SEQ ID NO: 43), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный негистидиновый кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления стоп рамка считывания генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (*LG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления рамка считывания представляет собой гидрофильную рамку генного сегмента D человека.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D1-1 (YNWND; SEQ ID NO: 45), D1-7 (YNWNY; SEQ ID NO: 47), D1-20 (YNWND; SEQ ID NO: 45) и D1-26 (YSGSYY; SEQ ID NO: 49), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D2-2 (GYCSSTSCYT; SEQ ID NO: 51), D2-8 (GYCTNGVCYT; SEQ ID NO: 53), D2-15 (GYCSGGSCYS; SEQ ID NO: 55) и D2-21 (AYCGGDCYS; SEQ ID NO: 57), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D3-3 (YYDFWSGYYT; SEQ ID NO: 59), D3-9 (YYDILTGYYN; SEQ ID NO: 61), D3-10 (YYYGSGSYYN; SEQ ID NO: 63), D3-16 (YYDYVWGSYRYT; SEQ ID NO: 65) и D3-22 (YYYDSSGYYY; SEQ ID NO: 67), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D4-4 (DYSNY; SEQ ID NO: 69), D4-11 (DYSNY; SEQ ID NO: 69), D4-17 (DYGDY; SEQ ID NO: 71) и D4-23 (DYGGNS; SEQ ID NO: 73), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D5-5 (GYSYGY; SEQ ID NO: 75), D5-12 (GYSGYDY; SEQ ID NO: 77), D5-18 (GYSYGY; SEQ ID NO: 75) и D5-24 (RDGYNY; SEQ ID NO: 79), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из D6-6 (EYSSSS; SEQ ID NO: 81), D6-13 (GYSSSWY; SEQ ID NO: 83) и D6-19 (GYSSGWY; SEQ ID NO: 85), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон. Согласно одному варианту осуществления гидрофильная рамка содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 76 и их комбинации.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует D7-27 (NWG), и генный сегмент D человека дополнительно содержит модификацию, которая замещает по меньшей мере один эндогенный кодон в нуклеотидной последовательности на гистидиновый кодон.
Согласно одному варианту осуществления гидрофильная рамка генного сегмента D человека содержит нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86 и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из Н433К, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит как модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU), так и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и геномный локус содержит генетически модифицированную нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, содержащую замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон по меньшей мере в одной рамке считывания. Согласно одному варианту осуществления генетически модифицированная нереаранжированная вариабельная генная последовательность тяжелой цепи иммуноглобулина присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус содержит эндогенный ген Adam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную (например, реаранжированную последовательность V/J λ или κ) последовательность, которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрен способ для получения отличного от человека животного, содержащего генетически модифицированный вариабельный локус тяжелой цепи иммуноглобулина, предусматривающий: (а) модификацию генома отличного от человека животного для удаления или приведения в нефункциональное состояние эндогенных генных сегментов V, D и J тяжелой цепи иммуноглобулина (например, с помощью вставки нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности), в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH) и (b) размещение в геноме генных сегментов VH, D, JH человека, причем по меньшей мере один из генных сегментов D человека был инвертирован с 5ʹ к 3ʹ по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее, включающее в себя грызуна, например, мышь, крысу или хомяка.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина находится в геноме зародышевой линии.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина кодирует вариабельный домен тяжелой цепи иммуноглобулина, содержащий 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более остатков гистидина.
Согласно одному варианту осуществления по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять, по меньшей мере одиннадцать, по меньшей мере двенадцать, по меньшей мере тринадцать, по меньшей мере четырнадцать, по меньшей мере пятнадцать, по меньшей мере шестнадцать, по меньшей мере семнадцать, по меньшей мере восемнадцать, по меньшей мере девятнадцать, по меньшей мере двадцать, по меньшей мере двадцать один, по меньшей мере двадцать два, по меньшей мере двадцать три, по меньшей мере двадцать четыре или все или по существу все функциональные генные сегменты D человека характеризуются инвертированной ориентацией по отношению к соответствующим последовательностям дикого типа.
Согласно одному варианту осуществления все или по существу все из эндогенный генных сегментов VH, D, JH иммуноглобулина удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности, например, экзогенной нуклеотидной последовательности, в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии всех или по существу всех эндогенных сегментов VH, D, JH иммуноглобулина) и генетически модифицированный локус иммуноглобулина содержит генные сегменты VH, D, JH человека, причем по меньшей мере один из генных сегментов D человека присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания в инвертированном генном сегменте D человека содержит по меньшей мере один гистидиновый кодон.
Согласно одному варианту осуществления инвертированный генный сегмент D человека функционально связан с генным сегментом VH человека и/или генным сегментом JH человека.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к последовательностям дикого типа, выбирают из группы, состоящей из D1-1, D1-7, D1-20, D1-26, D2-2, D2-8, D2-15, D2-21, D3-3, D3-9, D3-10, D3-16, D3-22, D4-4, D4-11, D4-17, D4-23, D5-5, D5-12, D5-18, D5-24, D6-6, D6-13, D6-19, D7-27 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D1, выбранный из группы, состоящей из D1-1, D1-7, D1-20, D1-26 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D2, выбранный из группы, состоящей из D2-2, D2-8, D2-15, D2-21 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D3, выбранный из группы, состоящей из D3-3, D3-9, D3-10, D3-16, D3-22 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D4, выбранный из группы, состоящей из D4-4, D4-11, D4-17, D4-23 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D5, выбранный из группы, состоящей из D5-5, D5-12, D5-18, D5-24 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой генный сегмент D6, выбранный из группы, состоящей из D6-6, D6-13, D6-19 и их комбинации.
Согласно одному варианту осуществления генный сегмент D человека, который присутствует в инвертированной ориентации по отношению к соответствующей последовательности дикого типа, представляет собой D7-27.
Согласно одному варианту осуществления рамку считывания генного сегмента D человека выбирают из стоп рамки считывания, гидрофильной рамки считывания, гидрофобной рамки считывания и их комбинации.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи, содержащая инвертированный генный сегмент D человека, функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA.
Согласно одному варианту осуществления нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи, выбранной из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит CH1, шарнир, CH2 и CH3 (CH1-шарнир-CH2-CH3).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т) или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. Согласно одному варианту осуществления модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); и модификацию 307 и/или 308 (например, 308F или 308Р), причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию N434A.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность константной области тяжелой цепи человека, содержащую мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит: (1) первый аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с первой нуклеотидной последовательностью константной области тяжелой цепи, кодирующей первую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и (2) второй аллель, причем описанная в настоящем документе нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана со второй нуклеотидной последовательностью константной области тяжелой цепи, кодирующей вторую аминокислотную последовательность CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, и причем вторая аминокислотная последовательность CH3 содержит модификацию, которая уменьшает или устраняет связывание второй аминокислотной последовательности СН3 с белком А (смотрите, например, US 2010/0331527 А1).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 дополнительно содержит модификацию Y96F (по нумерации экзонов IMGT; H436F по EU). Согласно другому варианту осуществления вторая аминокислотная последовательность CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU) и модификацию Y96F (по нумерации экзонов IMGT; H436F по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG1 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L38M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG2 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT: N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая аминокислотная последовательность CH3 происходит из модифицированного IgG4 человека и дополнительно содержит мутацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT: Q355R, N384S, K392N, V397M, R409K, E419QH V422I по EU).
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления все или по существу все эндогенные генные сегменты VH, D и JH удаляют из локуса тяжелой цепи иммуноглобулина или приводят в нефункциональное состояние (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более или приблизительно 99% или более всех эндогенных генных сегментов VH, D, или JH удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98%) или 99% эндогенных функциональных генных сегментов V, D или J удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в не функциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую по меньшей мере один описанный в настоящем документе инвертированный генный сегмент D человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме).
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит эндогенный ген Abam6a, ген Adam6b или оба, и генетическая модификация не влияет на экспрессию и/или функцию эндогенного гена Adam6a, гена Adam6b или обоих.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит присутствующий эктопически ген Adam6a, ген Adam6b или оба. Согласно одному варианту осуществления ген Adam6a представляет собой отличный от человеческого ген Adam6a. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a мыши. Согласно одному варианту осуществления ген Adam6a представляет собой ген Adam6a человека. Согласно одному варианту осуществления ген Adam6b представляет собой отличный от человеческого ген Adam6b. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b мыши. Согласно одному варианту осуществления ген Adam6b представляет собой ген Adam6b человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина дополнительно содержит гуманизированную нереаранжированную вариабельную генную последовательность легкой цепи λ и/или κ. Согласно одному варианту осуществления гуманизированная нереаранжированная вариабельная генная последовательность легкой цепи λ и/или κ функционально связана с нуклеотидной последовательностью константной области легкой цепи иммуноглобулина, выбранной из нуклеотидной последовательности константной области легкой цепи λ и нуклеотидной последовательности константной области легкой цепи κ. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ функционально связана с нуклеотидной последовательностью константной области легкой цепи λ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи λ представляет собой последовательность мыши, крысы или человека. Согласно одному варианту осуществления гуманизированная нереаранжированная нуклеотидная последовательность вариабельной области легкой цепи κ функционально связана с нуклеотидной последовательностью константной области легкой цепи κ. Согласно одному варианту осуществления нуклеотидная последовательность константной области легкой цепи κ представляет собой последовательность мыши, крысы или человека.
Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит нереаранжированную вариабельную генную последовательность легкой цепи, которая содержит по меньшей мере одну модификацию, которая вводит по меньшей мере один гистидиновый кодон по меньшей мере в одну рамку считывания, кодирующую вариабельный домен легкой цепи. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина содержит реаранжированную последовательность (например, реаранжированную последовательность V/J λ или κ), которая содержит один, два, три, или четыре кодона для гистидина в CDR легкой цепи. Согласно одному варианту осуществления CDR выбирают из CDR1, CDR2, CDR3 и их комбинации. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи представляет собой нереаранжированную или реаранжированную нуклеотидную последовательность вариабельной области легкой цепи λ или κ человека. Согласно одному варианту осуществления нереаранжированная или реаранжированная нуклеотидная последовательность вариабельной области легкой цепи λ или κ человека присутствует в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус κ мыши. Согласно одному варианту осуществления локус легкой цепи иммуноглобулина мыши представляет собой локус λ мыши.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина присутствует в локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления генетически модифицированный локус иммуноглобулина присутствует в гуманизированном локусе тяжелой цепи иммуноглобулина у VELOCIMMUNE® мыши.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, проявляет более слабое связывание антигена в кислой среде (например, при значении pH от приблизительно 5,5 до приблизительно 6,0), чем соответствующий описанный в настоящем документе вариабельный домен тяжелой цепи дикого типа без генетической модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с антигенсвязывающий белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному аспекту предусмотрен способ для получения отличного от человека животного, которое способно к производству вариабельного домена тяжелой цепи иммуноглобулина с увеличенным периодом полужизни в сыворотке и/или улучшенной зависимой от pH способностью к рециркулированию, предусматривающий: (а) модификацию генома отличного от человека животного для удаления или приведения в нефункциональное состояние эндогенных генных сегментов V, D и J тяжелой цепи иммуноглобулина (например, с помощью вставки нуклеотидной последовательности (например, экзогенной нуклеотидной последовательности) в локус иммуноглобулина или с помощью нефункциональной реаранжировки или инверсии эндогенных сегментов VH, D, JH) и (b) размещение в геноме нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон, и причем антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи иммуноглобулина, производимый отличным от человека животным, проявляет увеличенный период полужизни в сыворотке и/или улучшенную зависимую от pH способность к рециркулированию, по сравнению с доменом тяжелой цепи иммуноглобулина дикого типа.
Согласно одному варианту осуществления отличное от человека животное после контакта с антигеном может производить обогащенную популяцию репертуара В-клеток, которая экспрессирует антигенсвязывающий белок с увеличенным периодом полужизни в сыворотке и/или улучшенной зависимой от pH способностью к рециркулированию, причем обогащенная популяция В-клеток содержит любые описанные в настоящем документе генетические модификации.
Согласно одному варианту осуществления антигенсвязывающий белок, произведенный генетически модифицированным отличным от человека животным, характеризуется достаточной аффинностью к представляющему интерес антигену при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4) и повышенной диссоциацией антитела из комплекса антиген-антигенсвязывающий белок при значении pH меньше, чем нейтральное значение pH (например, при эндосомальном значении pH, например, значении pH от приблизительно 5,5 до 6,0).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз диссоциационного периода полувыведения (t1/2) при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина, характеризуется улучшенной зависимой от pH способностью к рециркулированию, увеличенным периодом полужизни в сыворотке или обоими, по сравнению с антигенсвязывающим белком дикого типа без генетической модификации.
Согласно одному варианту осуществления описанный в настоящем документе генетически модифицированный локус иммуноглобулина содержит обогащенную популяцию В-клеток, которая, после стимуляции представляющим интерес антигеном, способна производить антигенсвязывающие белки, например антитела, содержащие вариабельный домен тяжелой цепи с одним или несколькими остатками гистидина. Описанные в настоящем документе антигенсвязывающие белки при введении субъекту проявляют увеличенный период полужизни в сыворотке, по сравнению с соответствующим антигенсвязывающим белком дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи. Согласно некоторым вариантам осуществления описанный в настоящем документе антигенсвязывающий белок проявляет увеличенный период полужизни в сыворотке, который по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз выше, чем у соответствующего антигенсвязывающего белка дикого типа, который обладает схожей или достаточно схожей аминокислотной последовательностью, которая кодирует вариабельный домен тяжелой цепи, но не содержит остаток гистидина в вариабельном домене тяжелой цепи.
Согласно одному варианту осуществления антигенсвязывающий белок содержит вариабельный домен тяжелой цепи иммуноглобулина, который способен специфически связываться с представляющим интерес антигеном с аффинностью (KD) более низкой, чем 10-6, 10-7, 10-8, 10-9, 10-10, 10-11 и 10-12 и при нейтральном значении pH (значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному аспекту предусмотрен способ получения антигенсвязывающего белка с улучшенной способностью к рециркулированию и/или увеличенным периодом полужизни в сыворотке, предусматривающий: (а) иммунизацию отличного от человека животного, содержащего описанный в настоящем документе генетически модифицированный локус иммуноглобулина, причем отличное от человека животное содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, содержащую, добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон; (b) позволение отличному от человека животному усиливать иммунный ответ; (с) сбор лимфоцита (например, В-клетки) от иммунизированного отличного от человека животного; (d) слияние лимфоцита с клеткой миеломы с образованием клетки гибридомы и (е) получение антигенсвязывающего белка, производимого клеткой гибридомы, причем антигенсвязывающий белок проявляет улучшенное рециркулирование и/или стабильность в сыворотке.
Согласно одному аспекту предусмотрен генетически модифицированный локус тяжелой цепи иммуноглобулина, получаемой с помощью любого из описанных в настоящем документе способов.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, получаемое с помощью любого из описанных в настоящем документе способов.
Согласно различным вариантам осуществления отличное от человека животное представляет собой млекопитающее. Согласно одному варианту осуществления млекопитающее представляет собой грызуна, например, мышь, крысу или хомяка.
Согласно различным вариантам осуществления описанные в настоящем документе генетически модифицированные локусы иммуноглобулинов присутствуют в геноме зародышевой линии отличного от человека животного, например, млекопитающего, например, грызуна, например, мыши, крысы или хомяка.
Краткое описание графических материалов
На фиг. 1А и 1В показаны аминокислотные последовательности, кодируемые тремя рамками считывания (т.е., стоп, гидрофильными и гидрофобными рамками считывания) генных сегментов D человека (D), и аминокислотные последовательности, кодируемые тремя рамками считывания генных сегментов D человека с замененным гистидином (HD). Введение гистидиновых кодонов (выделены жирным шрифтом) в гидрофильную рамку считывания также меняло много стоп-кодонов в стоп рамке считывания на сериновые кодоны (выделены жирным шрифтом), но вводило некоторые изменения в гидрофобную рамку считывания. Символ "*" обозначает стоп-кодон, и запятая между двумя SEQ ID NO указывает на то, что существуют две аминокислотные последовательности, разделенные стоп-кодоном.
На фиг. 2 показаны схемы для нацеливания pLMa0174, содержащие спектиномициновую кассету отбора на 5ʹ конце MAID 1116 (стадия 1. BHR (Spec)). На стадии 1 хлорамфеникольную кассету отбора, неомициновую кассету отбора, сайт loxP, два генный сегмент VH (hVH1-3 и hVH1-2), ген Adam6 человека, все из которых расположены выше по ходу транскрипции от hVH6-1, удаляли из клона и замещали спектиномициновой кассетой с получением клона VI433. На стадии 2 (BHR (Hyg + Spec)) pNTu0002, содержащая гигромициновую кассету, фланкированную сайтами FRT, нацеливали в область, содержащую генные сегменты D иммуноглобулина человека. На стадии 2 все генные сегменты D человека удаляли из VI433 и замещали гигромициновой кассетой с получением MAID6011 VI 434 (клон 1).
На фиг. 3 показаны схемы сборки генных сегментов D человека с замененным гистидином с помощью последовательного лигирования.
На фиг. 4 показано введение предварительно собранных генных сегментов D человека с замененным гистидином, содержащих неомициновую кассету в области между наиболее проксимальным D отделом генного сегмента VH (VH 6-1) и наиболее проксимальным D отделом генного сегмента JH (JH1) с помощью опосредованного ферментом расщепления (PI-SceI и I-CeuI) и лигации. Этот процесс удаляет гигромициновую кассету из MAID 6011 VI434 и вводит предварительно собранные генные сегменты D человека с замененным гистидином в клон. Бактериальные клетки, содержащие успешно нацеленный клон, отбирают на основе как неомициновой, так и спектиномициновой устойчивости. Полученный клон (MAID6012 VI469) содержит от 5ʹ к 3ʹ (1) спектиномициновую кассету отбора, (2) плечо 50 kb, содержащее генный сегмент VH человека (VH 6-1), (3) неомициновую кассету, фланкированную сайтами loxP, (4) генные сегменты D человека, содержащие гистидиновые замены (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)), (5) приблизительно 25 kb геномной области, содержащей генные сегменты JH человека, (6) последовательность Ei мыши (SEQ ID NO: 5; интронный энхансер, который способствует реаранжировке VH с DJH при развитии В-клетки) и (7) нуклеотидную последовательность константной области IgM мыши (экзон 1 mIgM; SEQ ID NO: 7).
На фиг. 5 показаны схемы для удаления генной области D тяжелой цепи иммуноглобулина человека из гетерозиготных по MAID 1460 ES клеток путем нацеливания полученной из линии 129 хромосомы среднего полокусного генного разнообразия MAID 1460 с гигромициновой кассетой отбора в MAID 6011 VI434.
На фиг. 6 показан список праймеров и зондов, используемых для подтверждения снижения частоты аллеля (LOA), увеличения частоты аллеля (GOA) или исходного аллеля (Исходный) в скрининговом исследовании для идентификации MAID 6011.
На фиг. 7 показаны схемы конструирования среднего полокусного генного разнообразия MAID 6012 путем нацеливания гетерозиготных по MAID 6011 ES клеток с MAID 6012 VI469. Электропорация конструкта MAID 6012 VI469 в гетерозиготные по MAID 6011 ES клетки приводила к гетерозиготным по MAID 6012 ES клеткам, в которых полученная из линии 129 хромосома модифицируется для включения в направлении от 5ʹ к 3ʹ: сайт FRT, генные сегменты VH человека, геномную область мыши, содержащую гены adam6, фланкированную loxP неомициновую кассету отбора, генные сегменты D человека, содержащие гистидиновые замены (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)), генные сегменты JH человека, последовательность Ei мыши (SEQ ID NO: 5; интронный энхансер, который способствует реаранжировке VH с DJH при развитии В-клетки) и нуклеотидную последовательность константной области IgM мыши (экзон 1 mIgM; SEQ ID NO: 7).
На фиг. 8 показан список праймеров и зондов, используемых для подтверждения снижения частоты аллеля (LOA), увеличения частоты аллеля (GOA) или исходного аллеля (Исходный) в скрининговом исследовании для идентификации MAID 6012.
На фиг. 9 показаны схемы для удаления неомициновой кассеты из гетерозиготных по MAID 6012 ES клеток. Электропорация экспрессирующей Cre плазмиды в MAID 6012 ES клетки приводит к рекомбинации и делеции фланкированной loxP неомициновой кассеты, приводя к образованию гетерозиготных по MAID 6013 ES клеток.
На фиг. 10А и 10Е показаны нуклеотидные последовательности генного сегмента D человека с трансляциями для каждой из шести рамок считывания, т.е., три рамки считывания для прямой ориентации от 5ʹ к 3ʹ и три рамки считывания для инвертированной ориентации (ориентации от 3ʹ к 5ʹ). Символ "*" обозначает стоп-кодон, и запятая между двумя SEQ ID NO указывает на то, что существуют две аминокислотные последовательности, разделенные стоп-кодоном.
На фиг. 11-13 показаны последовательности мРНК и кодируемые ими последовательности белков, экспрессированные гетерозиготными F0 6013 мышами, которые содержат генные сегменты D человека с замененным гистидином (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)) в локусе тяжелой цепи иммуноглобулина в полученной из линии 129 хромосоме. Обведенные прямоугольником последовательности на каждой фигуре указывают на наличие кодонов гистидина в последовательностях CDR3, полученных из генетически модифицированного локуса тяжелой цепи иммуноглобулина, содержащего генные сегменты D человека с замененным гистидином. FWR обозначает каркасную область и CDR обозначает определяющую комплементарность область. В выравнивании точка "." указывает на последовательность, идентичную последовательности запросов, и тире "-" указывает на пробел в последовательности.
На фиг. 14 показана частота включения гистидина в последовательности CDR3 тяжелой цепи иммуноглобулина. Ось X представляет собой число кодонов гистидина, появившихся в каждой последовательности CDR3, и ось Y представляет собой соответствующее отношение считываний. "Среднее полокусное генное разнообразие F0 6013" указывает на последовательности CDR3, экспрессированные гетерозиготными мышами 6013, содержащими генные сегменты D с замененным гистидином."VI3-Adam6" указывает на последовательности CDR3, полученные от контрольных мышей, содержащих генные сегменты VH, D и JH человека без описанной в настоящем документе модификации гистидина. "ASAP" указывает на последовательности CDR3, полученных из базы данных антител Regeneron, которую использовали в качестве еще одного контроля.
На фиг. 15 показано выравнивание аминокислот полученных из Vκ1-39 легких цепей человека из различных антиген-специфических антител (антитела АК). Гистидиновые (Н) остатки, расположенные в каждой последовательности легкой цепи выделены жирным шрифтом. Различные области легкой цепи (каркасная область и CDR) указаны над выравниванием.
На фиг. 16 показаны комбинации и расположение остатков гистидина, встроенных в области CDR3 человека полученных из Vκ1-39 легких цепей с помощью мутагенеза. Включены соответствующие последовательности нуклеиновых кислот. Гистидиновые остатки введены путем мутагенеза, и соответствующие остатки нуклеиновых кислот выделены жирным шрифтом. Аминокислотные позиции (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно увидеть на www.imgt.org.
На фиг. 17 показан уровень экспрессии антитела в нг/мл, обнаруженный в супернатантах клеток CHO, трансфицированных с нуклеиновыми кислотами, кодирующими пять (1-5) различных тяжелых цепей и полученными из Vκ1-39 легкими цепями, содержащими остатки гистидина, встроенные в указанных местах (смотрите ось Y) в CDR3.
Фиг. 18 представляет собой вестерн-блот, показывающий экспрессию отдельных антиген-специфических антител человека, содержащих легкие цепи со встроенным гистидином, в клеточных супернатантах CHO.
На фиг. 19A-19J показаны кинетики связывания для определенных тяжелых цепей из антиген-специфических антител, образующих пары с различными легкими цепями со встроенным гистидином при нейтральном (7,4) и кислом (5,5) значениях pH.
На фиг. 20А-20Е показаны кинетики связывания для определенных тяжелых цепей (1-5) образующих пары с различными легкими цепями со встроенным гистидином при нейтральном (7,4) и кислом (5,75) значениях pH. Показаны различные кинетические параметры, включающие в себя ka, kd, KD и t1/2. NB = нет связывания.
На фиг. 21 показаны кинетические параметры (KD и t1/2) для антител, содержащих исходную универсальную легкую цепь или универсальную легкую цепь с модификациями гистидина, спаренную с указанными тяжелыми цепями (2, 3 и 6). Гистидиновые замены приводят к сильной зависимости от pH в нескольких антителах. Гистидиновые замены были сделаны в CDR3, чтобы преобразовать последовательность 105QQSYSTP111 (SEQ ID NO: 3) в 105HHSYSTH111 (SEQ ID NO: 329). Обратите внимание, что NB = не обнаружено связывания (KD>10 мкмоль).
На фиг. 22 показаны последовательность и свойства (% содержания GC, N, % ошибочно спаренных оснований, Tm) выбранных праймеров мутагенеза, используемых для встраивания остатков гистидина в CDR3 реаранжированной последовательности легкой цепи Vκ1-39/Jκ5 человека. SEQ ID NO для этих праймеров, используемые в списке последовательностей, включены в приведенной ниже таблице. F = прямой праймер, R = обратный праймер.
На фиг. 23А-23В показана общая стратегия конструирования нацеливающих векторов для встраивания остатков гистидина в реаранжированную последовательность вариабельной области легкой цепи человека, полученной из вариабельной области Vκ1-39/Jκ5, для получения генетически модифицированной мыши, которая экспрессирует антитела, содержащие модифицированную легкую цепь человека. На фиг. 23C-23D показано введение нацеливающего вектора для замен ULC-H105/106/108/111 в ES клетки и получения с ними гетерозиготных мышей; в то время как на фиг. 23E-23F показано введение нацеливающего вектора для замен ULC-H106/108/111 в ES клетки и получения с ними гетерозиготных мышей. Диаграммы представлены не в масштабе. Если не указано иное, заполненные формы и сплошные линии представляют последовательность мыши, пустые формы и двойные линии представляют последовательности человека.
На фиг. 24 показаны титры антисыворотки против иммуногена от мышей, гетерозиготных по гистидин-универсальной легкой цепи (HULC) (с 4 заменами гистидина - HULC 1927 мыши; с 3 заменами гистидина - HULC 1930 мыши) и животных дикого типа при вторичном заборе крови.
Фиг. 25 представляет собой сравнение количества всех антигенположительных клонов и количества антигенположительных клонов, проявляющих чувствительное к pH связывание антигенов, полученные из гибридомных слияний из HULC мышей (1927 против 1930) и мышей дикого типа. На фигуре приведены данные для двух мышей для каждого типа мыши ("мышь 1" и "мышь 2").
На фиг. 26А-26С показаны сенсограммы экспериментов связывания с помощью поверхностного плазмонного резонанса, в которых моноклональным антителам (AA, BB, CC, DD, HH, GG, NN и OO) или от гетерозиготных HULC, или мышей дикого типа было позволено ассоциировать с иммуногеном при нейтральном значении pH (pH 7,4) с последующим переходом в буфер с pH 7,4 или 6,0 на стадии диссоциации. Отдельные линии в каждом графике отражают реакции связывания при различных концентрациях соответствующих антител. Все эксперименты проводили при 25°C. Значения диссоциационного периода полувыведения (t1/2) отмечены над соответствующими сенсограммами, и кратность изменения t1/2 представлена справа от каждой сенсограммы. Антитела AA, BB, CC, DD, HH, и GG были от HULC 1927 мышей с использованием His-замещенной легкой цепи, NN - от HULC 1927 мыши с использованием легкой цепи WT, и OO - от мыши WT (смотрите таблицу 5 для уточнения).
На фиг. 27 показаны положения остатков гистидина, встроенных в область CDR3 человека полученных из Vκ3-20 легких цепей с помощью мутагенеза. Гистидиновые остатки вводили путем мутагенеза, и соответствующие остатки нуклеиновых кислот выделены жирным шрифтом. Аминокислотные позиции (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно увидеть на www.imgt.org.
На фиг. 28 показаны последовательность и свойства (% содержания GC, N, % ошибочно спаренных оснований, Tm) выбранных праймеров мутагенеза, используемых для встраивания остатков гистидина в CDR3 реаранжированной последовательности легкой цепи Vκ3-20/Jκ1 человека. SEQ ID NO для этих праймеров, используемые в списке последовательностей, включены в приведенной ниже таблице. F = прямой праймер, R = обратный праймер.
На фиг. 29A-29B показана общая стратегия конструирования нацеливающих векторов для встраивания остатков гистидина в реаранжированную последовательность вариабельной области легкой цепи человека, полученной из вариабельной области легкой цепи Vκ3-20/Jκ1 для получения генетически модифицированной мыши, которая экспрессирует антитела, содержащие модифицированную легкую цепь человека. На фиг. 29C показано введение нацеливающего вектора для замен ULC-Q105H/Q106H/Y107H/S109H в ES клетки и получения с ними гетерозиготных мышей; в то время как на фиг. 29D показано введение нацеливающего вектора для замен ULC-Q105H/Q106H/S109H в клетки ES и получения с ними гетерозиготных мышей. Диаграммы представлены не в масштабе. Если не указано иное, заполненные формы и сплошные линии представляют последовательность мыши, пустые формы и двойные линии представляют последовательности человека.
Подробное описание настоящего изобретения
Настоящее изобретение не ограничивается описанными конкретными способами и экспериментальными условиями, поскольку такие способы и условия могут варьировать. Кроме того, следует понимать, что используемая в настоящем документе терминология предназначена для целей описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения определяется формулой изобретения.
Если не указано иное, все используемые в настоящем документе термины и фразы включают в себя те значения, которыми характеризуются термины и фразы в настоящей области техники, если иное прямо не указано или не очевидно из контекста, в котором используется этот термин или фраза. Хотя любые способы и материалы, подобные или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, конкретные способы и материалы описаны ниже.
Определения
Используемый в настоящем документе термин "антитело" включает в себя молекулы иммуноглобулина, содержащие четыре полипептидные цепи, две тяжелые (H) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельный домен тяжелой цепи и константную область тяжелой цепи (CH). Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельный домен легкой цепи и константную область легкой цепи (CL). Вариабельные домены тяжелой цепи и легкой цепи могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с областями, которые более консервативны, называемые каркасными областями (FR). Каждый вариабельный домен тяжелой и легкой цепи содержит три CDR и четыре FR, расположенные с амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращенно представлены в виде HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращенно представлены в виде LCDR1, LCDR2 и LCDR3). Термин "высокая аффинность" антитела относится к антителу, которое характеризуется Ко по отношению к эпитопу-мишени, равным приблизительно 10-9 M или ниже (например, приблизительно 1×10-9 M, 1×10-10 M, 1×10-11 M или приблизительно 1×10-12 M). Согласно одному варианту осуществления Ко измеряется с помощью поверхностного плазмонного резонанса, например, BIACORE™; согласно другому варианту осуществления KD измеряется с помощью ELISA.
Термин "биспецифические антитела" включает в себя антитело, способное селективно связываться с двумя или более эпитопами. Биспецифические антитела, как правило, содержат две неидентичные тяжелые цепи, каждая из тяжелых цепей специфически связывается с различным эпитопом - или на двух различных молекулах (например, различные эпитопы на двух различных иммуногенах), или на той же молекуле (например, различные эпитопы на том же иммуногене). Если биспецифическое антитело способно селективно связываться с двумя различными эпитопами (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи к первому эпитопу будет, как правило, составлять по меньшей мере от одного до двух или трех, или четырех или более порядков ниже, чем аффинность первой тяжелой цепи ко второму эпитопу, и наоборот. Эпитопы, специфически связанные биспецифическим антителом, могут быть на той же самой или другой мишени (например, на том же или другом белке). Иллюстративные биспецифические антитела включают в себя те, у которых первая тяжелая цепь специфична к опухолевому антигену и вторая тяжелая цепь специфична к цитотоксическому маркеру, например, Fc-рецептору (например, FcγRI, FcγRII, FcγRIII и т.д.) или Т-клеточному маркеру (например, CD3, CD28 и т.д.). Кроме того, второй вариабельный домен тяжелой цепи может быть заменен вариабельным доменом тяжелой цепи, характеризующимся другой требуемой специфичностью. Например, биспецифические антитела с первой тяжелой цепью, специфичной к опухолевому антигену, и второй тяжелой цепью, специфичной к токсину, могут быть спарены для того, чтобы доставить токсин (например, сапорин, алкалоид барвинка, и т.д.) к опухолевой клетке. Другие иллюстративные биспецифические антитела включают в себя те, у которых первая тяжелая цепь специфична к активирующему рецептору (например, В-клеточный рецептор, FcγRI, FcγRIIA, FcγRIIIA, FcαRI, Т-клеточный рецептор и т.д.) и вторая тяжелая цепь специфична к ингибирующему рецептору (например, FcγRIIB, CD5, CD22, CD72, CD300a и т.д.). Такие биспецифические антитела могут быть сконструированы для терапевтических условий, связанных с активацией клеток (например, аллергия и бронхиальная астма). Биспецифические антитела могут быть получены, например, путем объединения тяжелых цепей, которые распознают различные эпитопы одного и того же иммуногена. Например, последовательности нуклеиновых кислот, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного и того же иммуногена, могут быть слиты с последовательностями нуклеиновых кислот, кодирующими одинаковые или различные константные области тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело содержит две тяжелые цепи, каждая из которых содержит три CDR тяжелой цепи, с последующими (от N-конца к С-концу) доменом CH1, шарниром, доменом CH2 и доменом CH3, и легкую цепь иммуноглобулина, которая либо не придает эпитопсвязывающую специфичность, но которая может ассоциировать с каждой тяжелой цепью, либо которая может ассоциировать с каждой тяжелой цепью и которая может связываться с одним или несколькими эпитопами, связанными с эпитопсвязывающими областями тяжелой цепи, либо которая может ассоциировать с каждой тяжелой цепью и обеспечивать связывание одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин "клетка" включает в себя любую клетку, которая подходит для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают в себя прокариотические и эукариотические (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы E. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки отличных от человека животных, клетки человека или клеточные слияния, такие как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, обезьяны, хомячка, крысы или мыши. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую и ее выбирают из следующих клеток: CHO (например, CHO K1, DXB-11 CHO, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почки (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, BHK), HeLa, HepG2, WI38, MRC 5, Colo205, НВ 8065, HL-60, (например, BHK21), Jurkat, Daudi, А431 (эпидермальные), CV-1, U937, 3Т3, клетки L, клетки С127, SP2/0, NS-0, ММТ 060562, клетки Сертоли, клетки BRL 3А, клетки НТ1080, клетки миеломы, клетки опухоли и полученной из вышеупомянутых клеток клеточной линии. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Используемый в настоящем документе термин "определяющая комплементарность область" или "CDR" включает в себя аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулинов организма, которая, как правило, (то есть, у животного дикого типа) появляется между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или Т-клеточного рецептора). CDR могут кодироваться, например, с помощью последовательности зародышевой линии или реаранжированной последовательности и, например, наивной или зрелой В-клеткой или Т-клеткой. CDR может быть соматически мутировавшей (например, отличаться от последовательности, закодированной в зародышевой линии животного), гуманизированной и/или модифицированной аминокислотными заменами, добавками или делециями. В некоторых обстоятельствах (например, для CDR3), CDR могут кодироваться двумя или более последовательностями (например, последовательностями зародышевой линии), которые не представляют собой смежные (например, в нереаранжированной последовательности нуклеиновой кислоты), но представляют собой смежные в последовательности нуклеиновой кислоты В-клеток, например, в результате сплайсинга или соединения последовательностей (например, V-D-J рекомбинация с образованием CDR3 тяжелой цепи).
Используемый для описания консервативной замены аминокислот термин "консервативные" включает в себя замену аминокислотного остатка на другой аминокислотный остаток, содержащий боковую цепь группы R со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная замена аминокислот не будет существенно изменять функциональные свойства представляющего интерес белка, например, способность вариабельной области специфически связываться с эпитопом-мишенью с требуемой аффинностью. Примеры групп аминокислот, которые характеризуются наличием боковых цепей со сходными химическими свойствами, включают в себя такие алифатические боковые цепи, как глицин, аланин, валин, лейцин, изолейцин и такие алифатические-гидроксильные боковые цепи, как серии и треонин; такие содержащие амид боковые цепи, как аспарагин и глутамин; такие ароматические боковые цепи, как фенилаланин, тирозин и триптофан; такие основные боковые цепи, как лизин, аргинин, гистидин; и такие кислотные боковые цепи, как аспарагиновая кислота и глутаминовая кислота, и такие серосодержащие боковые цепи, как цистеин и метионин. Группы консервативных замен аминокислот включают в себя, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глутамин. Согласно некоторым вариантам осуществления консервативная замена аминокислот может представлять собой замену любого нативного остатка в белке аланином, что применяется, например, в сканирующем аланином мутагенезе. Согласно некоторым вариантам осуществления полученная консервативная замена характеризуется положительным значением в логарифмической функции правдоподобия матрицы РАМ250, раскрытой в Gonnet et al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256:1443-45. Согласно некоторым вариантам осуществления замена представляет собой умеренную консервативную замену, причем замена характеризуется неотрицательным значением в логарифмической функции правдоподобия матрицы РАМ250.
Согласно некоторым вариантам осуществления положения остатков в легкой цепи или тяжелой цепи иммуноглобулина отличаются одной или несколькими консервативными заменами аминокислот. Согласно некоторым вариантам осуществления положения остатков в легкой цепи иммуноглобулина или его функционального фрагмента (например, фрагмента, который обеспечивает экспрессию и секрецию, например, из В-клеток) не идентичны легкой цепи, чья аминокислотная последовательность перечислена в настоящем документе, но отличается одной или несколькими консервативными заменами аминокислот.
Используемый в настоящем документе термин "диссоциационный период полувыведения" или "t1/2" относится к величине, рассчитанной по следующей формуле: t1/2 (мин)=ln2/(60*kd), где kd представляет собой константу скорости диссоциации.
Термин "связывающий эпитоп белок" включает в себя белок, который содержит по меньшей мере один CDR и который способен к избирательному распознаванию эпитопа, например, способен связываться с эпитопом с KD, составляющей приблизительно один мкмоль или меньше (например, KD, составляющей приблизительно 1×10-6 M, 1×10-7 M, 1×10-8 M, 1×10-9 M, 1×10-10 M, 1×10-11 M или приблизительно 1×10-12 M). Терапевтические связывающие эпитоп белки (например, терапевтические антитела) часто нуждаются в KD, которая находится в наномолярном или пикомолярном диапазоне.
Используемый в настоящем документе термин "функциональный", например, по отношению к функциональному полипептиду, включает в себя полипептид, который сохраняет по меньшей мере одну биологическую активность, как правило, связанную с нативным белком. В другом случае функциональный генный сегмент иммуноглобулина может включать в себя переменный генный сегмент, который способен к продуктивной реаранжировке, чтобы производить реаранжированную генную последовательность иммуноглобулина.
Термин "функциональный фрагмент" включает в себя фрагменты связывающих эпитопы белков, которые могут экспрессироваться, секретироваться и специфически связываться с эпитопом с KD в микромолярном, наномолярном или пикомолярном диапазоне. Специфическое распознавание включает в себя характеризующееся KD, которая находится по меньшей мере в микромолярном диапазоне, наномолярном диапазоне или пикомолярном диапазоне.
Используемый в настоящем документе термин "зародышевая линия" по отношению к последовательности нуклеиновой кислоты иммуноглобулина включает в себя отношение к последовательностям нуклеиновой кислоты, которые могут быть переданы потомству.
Термин "тяжелая цепь" или "тяжелая цепь иммуноглобулина" включает в себя последовательность тяжелой цепи иммуноглобулина, включающую в себя последовательность константной области тяжелой цепи иммуноглобулина из любого организма. Вариабельные домены тяжелой цепи включают в себя три CDR тяжелой цепи и четыре области FR, если не указано иное. Фрагменты тяжелых цепей включают в себя CDR, CDR и FR и их комбинации. Типичная тяжелая цепь содержит после вариабельного домена (от N-конца к С-концу) домен CH1, шарнир, домен CH2 и домен CH3. Функциональный фрагмент тяжелой цепи включает в себя фрагмент, который способен специфически распознавать эпитоп (например, распознавание эпитопа с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен экспрессировать и секретировать из клетки и который содержит по меньшей мере одну CDR. Вариабельные домены тяжелой цепи кодируются нуклеотидной последовательностью вариабельной области, которая, как правило, содержит сегменты VH, DH и JH, полученные из репертуара присутствующих в зародышевой линии сегментов VH, DH и JH. Последовательности, расположение и номенклатура для сегментов тяжелой цепи V, D и J для различных организмов можно найти в базе данных IMGT, которая доступна через интернет на www с URL "imgt.org".
Используемый в отношении последовательности термин "идентичность" включает в себя идентичность, определенную с помощью ряда различных известных в настоящей области алгоритмов, которые могут быть использованы для измерения идентичности последовательности нуклеотидов и/или аминокислот. Согласно некоторым описанным в настоящем документе вариантам осуществления идентичности определяют с использованием выравнивания ClustalW v. 1.83 (медленно) с использованием открытого штрафного пробела 10,0, продленного штрафного пробела 0,1 и используя матрицу сходства Gonnet (MACVECTOR™ 10.0.2, Mac Vector Inc., 2008). Длина сравниваемых последовательностей по отношению к идентичности последовательностей будет зависеть от конкретных последовательностей, но в случае константного домена легкой цепи, длина должна содержать последовательность достаточной длины, чтобы сложиться в константный домен легкой цепи, который способен к самоассоциации для образования канонического константного домена легкой цепи, например, способен образовывать два бета-листа, содержащих бета-цепи, и способен взаимодействовать по меньшей мере с одним доменом CH1 человека или мыши. В случае домена CH1 длина последовательности должна содержать последовательность достаточной длины, чтобы сложиться в домен CH1, который способен образовывать два бета листа, содержащих бета-цепи, и способен взаимодействовать по меньшей мере с одним константным доменом легкой цепи мыши или человека.
Фраза "молекула иммуноглобулина" включает в себя две тяжелые цепи иммуноглобулина и две легкие цепи иммуноглобулина. Тяжелые цепи могут быть одинаковыми или различными, и легкие цепи могут быть одинаковыми или различными.
Термин "легкая цепь" включает в себя последовательность легкой цепи иммуноглобулина от любого организма, и если не указано иное включает в себя человеческие легкие цепи каппа (κ) и лямбда (λ) и VpreB, а также суррогатные легкие цепи. Вариабельные домены легкой цепи, как правило, включают в себя три CDR легкой цепи и четыре каркасные (FR) области, если не указано иное. Как правило, полноразмерная легкая цепь включает в себя от амино-конца к карбокси-концу вариабельный домен, который включает в себя FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и аминокислотную последовательность константной области легкой цепи. Вариабельные домены легкой цепи кодируется нуклеотидной последовательностью вариабельной области легкой цепи, которая, как правило, содержит генные сегменты легкой цепи VL и JL, полученные из репертуара присутствующих в зародышевой линии генных сегментов легкой цепи V и J. Последовательности, положение и номенклатуру для генных сегментов V и J легкой цепи для различных организмов можно найти в базе данных IMGT, которая доступна через интернет на www с URL "imgt.org". Легкие цепи включают в себя, например, те, которые не селективно связываются или с первым, или со вторым эпитопом, селективно связанным связывающим эпитоп белком, в котором они появляются. Легкие цепи также включают в себя те, которые связывают и распознают или помогают тяжелой цепи со связыванием и распознаванием одного или нескольких эпитопов, селективно связанных связывающим эпитоп белком, в котором они появляются. Легкие цепи также включают в себя те, которые связывают и распознают или помогают тяжелой цепи со связыванием и распознаванием одного или нескольких эпитопов, селективно связанных связывающим эпитоп белком, в котором они появляются. Общие или универсальные легкие цепи включают в себя те, которые получены из гена Vκ1-39Jκ5 человека или гена Vκ3-20Jκ1 человека, и включают в себя соматически мутировавшие (например, со зрелой аффинностью) версии их же.
Фраза "микромолярный диапазон" означает 1-999 микромоль; фраза "наномолярный диапазон" означает 1-999 наномоль; фраза "пикомолярный диапазон" означает 1-999 пикомоль.
"Нейтральное значение pH" включает в себя значение pH от приблизительно 7,0 и до приблизительно 8,0, например, значение pH от приблизительно 7,0 и до приблизительно 7,4, например, от приблизительно 7,2 и до приблизительно 7,4, например, физиологическое значение pH, например, мыши или человека. "Кислое значение pH" включает в себя значение pH 6,0 и ниже, например, значение pH от приблизительно 5,0 и до приблизительно 6,0, pH от приблизительно 5,75 и до приблизительно 6,0, например, pH эндосомальных или лизосомальных компартментов.
Термин "функционально связанный" относится к связи, в которой функционально связанные компоненты функционируют предназначенным образом. В одном случае последовательность нуклеиновой кислоты, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, промотор, энхансер, сайленсер последовательности и т.п.) с тем, чтобы сохранить надлежащее регулирование транскрипции. В одном случае последовательность нуклеиновой кислоты вариабельной области (или сегментов V(D)J) иммуноглобулина может быть функционально связана с последовательностью нуклеиновой кислоты константной области иммуноглобулина таким образом, чтобы обеспечить надлежащую рекомбинацию между последовательностями в последовательности тяжелой и легкой цепи иммуноглобулина.
Используемая в настоящем документе фраза "соматически мутировавший" включает в себя отношение к последовательности нуклеиновой кислоты из В-клетки, которая подверглась переключению класса, причем последовательность нуклеиновой кислоты вариабельной области иммуноглобулина, например, вариабельный домен тяжелой цепи (например, вариабельный домен тяжелой цепи или включающая в себя последовательность CDR или FR тяжелой цепи) в В-клетке, которая подверглась переключению класса, не идентична последовательности нуклеиновой кислоты в В-клетке до переключения класса, например, различие в последовательности нуклеиновой кислоты CDR или каркасной области между В-клеткой, которая не подверглась переключению класса, и В-клеткой, которая подверглась переключению класса. Фраза "соматически мутировавший" включает в себя отношение к последовательности нуклеиновых кислот от В-клеток с созревшей аффинностью, которые не идентичны соответствующим нуклеотидным последовательностям вариабельных областей иммуноглобулина в В-клетках, которые не характеризуются созревшей аффинностью (т.е. последовательности в геноме клеток зародышевой линии). Фраза "соматически мутировавший" также включает в себя отношение к последовательности нуклеиновой кислоты вариабельной области иммуноглобулина из В-клетки после воздействия на В-клетку представляющего интерес эпитопа, причем последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты до воздействия на В-клетку представляющего интерес эпитопа. Термин "соматически мутировавший" относится также к последовательностям из антител, которые были получены от животного, например, мыши, содержащего последовательности нуклеиновых кислот вариабельных областей иммуноглобулина человека, в ответ на сенсибилизацию иммуногеном, и что представляет собой по своей сути результат процессов отбора, действующих в таком животном.
Термин "нереаранжированные" по отношению к последовательности нуклеиновой кислоты включает в себя последовательности нуклеиновых кислот, которые существуют в зародышевой линии клетки животного.
Термин "вариабельный домен" включает в себя аминокислотную последовательность легкой или тяжелой цепи иммуноглобулина (модифицированной по желанию), которая содержит следующие аминокислотные области в последовательности от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин "функционально связанный" относится к смежному положению, в котором таким образом описываемые компоненты находятся в связи, позволяющей им функционировать предназначенным образом. В одном случае последовательность кодирующей белок нуклеиновой кислоты может быть функционально связана с регуляторными последовательностями (например, последовательностью промотора, энхансера, сайленсера и т.п.) с тем, чтобы сохранить необходимое регулирование транскрипции. В одном случае последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (или V(D)J сегменты) может быть функционально связана с последовательностью нуклеиновой кислоты константной области иммуноглобулина таким образом, чтобы обеспечить необходимую рекомбинацию между последовательностями в последовательности тяжелой или легкой цепи иммуноглобулина.
Термин "замещение" по отношению к замещению генов относится к размещению экзогенного генетический материала в эндогенном генетическом локусе, тем самым замещая все или часть эндогенного гена ортологичной или гомологичной последовательностью нуклеиновой кислоты.
Используемый в настоящем документе термин "функциональный", например, по отношению к функциональному полипептиду, включает в себя полипептид, который сохраняет по меньшей мере одну биологическую активность, как правило, связанную с нативным белком. В другом случае функциональный генный сегмент иммуноглобулина может включать в себя вариабельный генный сегмент, который способен к продуктивной реаранжировке, чтобы производить реаранжированную генную последовательность иммуноглобулина.
Вариабельные домены с заменами гистидина
Разработка основанных на иммуноглобулине человека лекарственных средств представляет собой хорошо изученное явление, но остаются некоторые нерешенные проблемы в производстве таких лекарственных средств с оптимальными характеристиками, например, увеличенный период полужизни в сыворотке таких лекарственных средств или иное улучшение их способности связывать больше мишеней на терапевтическую молекулу. Большая работа в течение последних двух десятилетий, направленная на выявление оборота сывороточного иммуноглобулина, была сосредоточена на путях увеличения периода полужизни в сыворотке терапевтически важных антител или основанных на иммуноглобулинах лекарственных средств путем модификации структуры антител. По большей части, эта работа по модификации была сосредоточена на взаимодействии константных доменов антител с неонатальным рецептором Fc (FcRn). Неонатальный рецептор Fc на внеклеточной поверхности связывает циркулирующие антитела через их области Fc для образования комплекса антиген-FcRn, который включается или эндоцитируется в клетку, где пути лиганда и части антител и комплекс антитело-FcRn подвергаются процессу циркулирования, который приносит антитело и FcRn назад к поверхности клетки, где антитело высвобождается и может повторно связывать новую молекулу-мишень. Циркулирование комплекса антитело-FcRn стало предметом повышенного интереса в связи с открытием общих механизмов циркулирования рецепторов.
Циркулирование рецепторов может происходить с помощью различных механизмов. Опосредованный рецепторами эндоцитоз обеспечивает эндосомальный путь для регулируемого рециркулирования рецепторов клеточной поверхности и их лигандов (в некоторых случаях, например, FcRns). (Пиноцитированные молекулы, как правило, иным образом курсируют через эндосомальный путь, который заканчивается деградацией). Открытие механизма опосредованного рецепторами эндоцитоза и объем работы в отношении рециркулирования мембранных рецепторов обеспечили каркас для детального понимания оборота рецептор-лиганд в общем (для обзора смотрите, например, Brown, M.S., Anderson, R.G.W., and Goldstein, J.L. (1983) Recycling Receptors: The Round-Trip Itinerary of Migrant Membrane Proteins, Cell 32:663-667; смотрите также Goldstein, J.L. and Brown, M.S. (2009) The LDL Receptor, Arterioscler. Thromb. Vasc. Biol. 29:431-438; Basu, S.K. (1984) Receptor-mediated endocytosis: An overview of a dynamic process, J. Biosci. 6(4): 535-542). Другая работа над эндосомальной сортировкой помогла правильно ограничить вопрос о судьбе циркулирующих иммуноглобулинов и феномене рециркулирования рецептора иммуноглобулина и фармакокинетики лекарственных средств с антителами. Эта работа выявила сложный процесс рециркулирования комплекса антитело-FcRn, который, похоже, в первую очередь отвечает за относительно длительный период полужизни молекул IgG в сыворотке крови. Действительно, даже довольно ранняя работа в этой области установила, что эндосомы представляют собой наиболее многочисленный источник FcRn in vivo (смотрите, Roberts, D.M. et al. (1990) Isolation and Characterization of the Fc Receptor from the Fetal Yolk Sac of the Rat, J. Cell. Biol. 111:1867-1876). И уже давно было замечено, что рецептор-положительные эндосомальные фракции в значительной части не направляются на лизосомальную деградацию (смотрите, например, Brown, M.S. et al. (1983) Recycling Receptors: The Round-Trip Itinerary of Migrant Membrane Proteins, Cell 32:663-667; смотрите также, von Figura et al. (1984) Antibody to mannos 6-phosphate specific receptor induces receptor deficiency in human fibroblasts, EMBO J. 3(6): 1281-1286), в отсутствие агрегации (смотрите, например, Dunn, K.W. et al. (1989) Iterative Fractionation of Recycling Receptors from Lysosomally Destined Ligands in an Early Sorting Endosome, J. Cell. Biol. 109(6): 3303-3314). Именно эта эндосомальная система, которая участвует в процессе циркулирования, обеспечивает, что антитела, которые связываются с FcRn в кислых условиях (например, антитела IgG1 человека), сохраняются в течение длительного периода времени в сыворотке крови.
По некоторым данным, механизм рециркулирования содержащих FcRn эндосом представляет собой новый и необычный; он не включает в себя убиквитин-зависимое слияние целых органелл, а скорее напоминает неполное слияние, опосредованное трубчатыми расширениями, более похожими на модель касания и удерживания (Gan, Z. et al. (2009) Analyses of the recycling receptor, FcRn, in live cells reveal novel pathways for lysosomal delivery, Traffic 10(5): 600; смотрите также, Tzaban, S. et al. (2009) The recycling and transcytotic pathways for IgG transport by FcRn are distinct and display an inherent polarity, J. Cell Biol. 185(4): 673-684). Таким образом, модель циркулирования антитело-FcRn, похоже, отличается от других эндосомальных путей.
Эндосомальный механизм циркулирования антитело-FcRn обеспечивает антителам, которые связываются с FcRn способность поддерживать длительное присутствие в сыворотке благодаря более или менее продолжительному защищающему FcRn процессу, что влечет за собой отделение связанного антитела в эндосомальный компартмент, где поддерживается связывание антитела с FcRn, предотвращая лизосомальную деградацию связанного с FcRn антитела. Как правило, циркулирующие молекулы антител связываются с FcRn на клеточной поверхности. Комплексы антитело-FcRn появляются в эндосомах в результате непрерывного процесса эндоцитоза. Связавшие FcRn молекулы (например, антитела или слитые белки Fc) остаются ассоциированными с FcRn в кислом эндосомальном компартменте благодаря устойчивому к кислой среде взаимодействию Fc-FcRn. Не связанные с эндосомальной поверхностью молекулы (через, например, FcRn или другой рецептор) курсируют по лизосомальному пути и деградируют, в то время как связавшие рецептор молекулы рециркулируют к плазматической мембране, когда эндосома сливается с плазматической мембраной. После слияния с плазматической мембраной стабильное к кислой среде взаимодействие Fc-FcRn подвергается воздействию приблизительно нейтрального внеклеточного pH, где Fc легко диссоциирует от FcRn. Это представляет собой дифференциал pH связывания Fc, спаренного с дифференциалом термической стабильности FcRn, которая изменяется с состоянием протонирования, что, как полагают, в первую очередь отвечает за способность определенных Fc поддерживать концентрации в сыворотке путем связывания FcRn. Ключ к эндосомальному механизму циркулирования представляет собой высвобождение лигандов рецепторами в кислом эндосомальном компартменте (представлено, например, в Brown, M.S. et al. (1983)).
Фрагменты Fc IgG1 связываются с FcRn с высокой аффинностью при значении pH от 6,0 до приблизительно 6,5; связывание при значении pH от 7,0 до pH 7,5 приблизительно на два порядка слабее, по-видимому, в связи с титрованием остатков гистидина вблизи области Fc, которое связывает FcRn, остатки 310-433, и внутримолекулярным дифференциалом термической стабильности FcRn, опосредованным состоянием протонирования (Raghaven, M. et al. (1995) Analysis of the pH dependence of the neonatal Fc receptor/immunoglobulin G interaction using antibody and receptor variants, Biochemistry 34:14649-14657; Vaughn, D.E. and Bjorkman, P.J. (1998) Structural basis of pH-dependent antibody binding by the neonatal Fc receptor, Structure 6:63-73); было показано, что FcRn крысы проявляет лучший профиль термической стабильности при значении pH 6,0, чем при значении pH 8,0 (Raghavan, M. et al. (1993) The class I МНС-related Fc receptor shows pH dependent stability differences correlating with immunoglobulin binding and release, Biochemistry 32:8654-8660).
Хотя природа обусловила структуры Fc, которые связывают FcRn дифференциально, возникла наука конструирования Fc для разработки структур Fc, которые могли бы приводить к более крепкому связыванию с FcRn и, видимо, большему периоду полужизни в сыворотке. Многие такие структуры были разработаны и испытаны, слишком многочисленные, чтобы рассматривать в настоящем документе, с разной степенью успеха. Мутирование последовательностей константной области иммуноглобулина для обеспечения рециркулирования антитела с помощью модификации связывающих характеристик FcRn характеризуется долгой и богатой историей. На сегодняшний день, большинство, если не все усилия для идентификации мутаций, были сосредоточены на остатках, которые, как полагают, характеризуются решающим значением в связывании или взаимодействии с FcRn, т.е. остатках, модификация которых влияет на аффинность Fc к FcRn.
Но связывание Fc с FcRn само по себе представляет собой сложный вопрос. Различные типы терапевтических антител (гуманизированые, химерные и мышиные) и даже в пределах типов (например, сравнение различных гуманизированных антител друг с другом, сравнение изотипа IgG1 антител друг с другом и т.д.) проявляют константы диссоциации по отношению к FcRn, которые варьируют приблизительно в два раза (смотрите, например, Suzuki, Т. et al. (2010) Importance of Neonatal FcR in Regulating the Serum Half-Life of Therapeutic Proteins Containing the Fc Domain of Human IgG1: A Comparative Study of the Affinity of Monoclonal Antibodies and Fc-Fusion Proteins to Human Neonatal FcR, J. Immunol. 184:1968-1976). Это наблюдение позволяет вывод, что первичная структура константной области не может объяснить все фармакокинетическое поведение. Другие исследователи предположили, что общая изоэлектрическая точка (pI) антитела, поддерживая фиксированной первичную структуру константной области, представляет собой важную детерминанту периода полужизни в сыворотке, по-видимому, через неспецифический не зависимый от FcRn механизм (Igawa, Т. et al. (2010) Reduced elimination of IgG antibodies by engineering the variable region, Protein Engineering, Design & Selection 23(5): 385-392). С этой точки зрения, чем ниже pI антитела, тем крепче связывание с FcRn (Id.). Для по меньшей мере одного изотипа IgG4 антитела изменение pI от 9,2 до 7,2 коррелирует с 2,4-кратным увеличением периода полужизни и 4,4-кратному снижению клиренса (Id.), указывающее на умозаключение, что неспецифическое снижение pI путем модификации остатков в обеих вариабельных областях тяжелой и легкой цепи совместно может значительно повлиять на фармакокинетическое поведение. В этом докладе модификация остатка не следовала по любому конкретному шаблону и никакой остаток не был заменен на гистидин, хотя по меньшей мере один остаток в CDR2 легкой цепи был изменен с остатка гистидина на остаток глутамата (Id., на фиг. 5, с. 390). Кроме того, странный парадокс может возникнуть при сравнении связывания FcRn in vitro и фармакокинетики in vivo: для по меньшей мере одного клинически важного антитела IgG1 с множественными заменами в области Fc, который взаимодействует с FcRn, связывание FcRn in vitro не коррелируют с фармакокинетическим поведением in vivo (смотрите, Petkova, S.B. et al. (2006) Enhanced half-life of genetically engineered human IgG1 antibodies in a humanized FcRn mouse model: potential application in humorally mediated autoimmune disease, Int'l Immunol. 18(12): 1759-1769). Наконец, высвобождение лиганда Fc из FcRn после слияния с плазматической мембраной, по-видимому, происходит в две фазы - быструю фазу и продолжительную фазу - неизвестного механизма (смотрите, Ober R.J. et al. (2004) Exocytosis of IgG as mediated by the receptor FcRn: an analysis at the single-molecule level, Proc. Natl Acad. Sci. USA 101:11076-11081).
Наконец, расширение периода полужизни антител в сыворотке представляет собой один из способов повышения эффективности терапии с антителами. Повышенная эффективность или улучшенная доступность того же антитела или вариабельного домена для связывания и устранения двух или трех, или более молекул-мишеней не обязательно решать путем улучшения связывания с FcRn и оборота, который влияет на антиген-мишень. Модификации, которые увеличивают аффинность Fc к FcRn, как ожидается, будут увеличивать оборот и тем самым улучшать фармакокинетику терапевтического антитела. Комплексы антиген-антитело крепко связываются с FcRn, в результате чего комплекс антиген-антитело циркулирует обратно в межклеточное пространство, а не деградирует с помощью лизосомального пути. В этом случае, однако, антиген или мишень может в значительной степени оставаться в комплексе с антителом и рециркулировать вместе с антителом во внеклеточное пространство. Для терапевтических антител этот феномен может быть очень нежелательным.
Однако антитела, чье взаимодействие с антигеном характеризуется зависимостью от pH, т.е., антитела, сконструированные для связывания антигена с более низкой аффинностью при эндосомальном значении pH, не будут рециркулировать антиген зависимым от FcRn образом в результате нестабильности комплекса антиген-антитело в эндосомальном компартменте. Это потому, что в кислой среде эндосомы антиген будет отсоединяться от комплекса антитело-FcRn, и связанный с антителом FcRn будет рециркулировать на поверхность клетки, в то время, как расцепленный свободный антиген будет курсировать по лизосомальному пути деградации. Таким образом, зависимое от pH связывание антигена может обеспечивать повышенную эффективность и/или фармакокинетические свойства в контексте опосредованного FcRn циркулирования (но не прямо зависимого взаимодействия от Fc-FcRn) путем освобождения циркулирующего антитела для связывания с антигеном, связывания с FcRn, циркулирования через эндосомы и повторного входа во внеклеточное пространство для связывания большего количества антигенов и перенос большего количества антигенов к лизосомальному пути деградации.
Используя наблюдение, что лиганды часто будут диссоциировать от их рецепторов при эндосомальном pH, было предложено искать антитела, которые эффективно высвобождают антиген при эндосомальном pH для того, чтобы получить некоторые специфические многофункциональные молекулы, которые нацелено воздействуют на специфические клетки с целью импортировать токсины в клетки и высвобождать токсины в эндосомы (смотрите, например, патент США №5599908 и патент США №5603931). Но он не рассматривает циркулирование антиген-антитела, в частности для человеческих лекарственных средств.
Чтобы использовать структуру антитела для переноса эндосомально отсоединенного антигена через лизосомный путь при этом сохраняя зависимое от FcRn циркулирование комплексов антиген-FcRn, были изучены определенные подходы к зависимому от pH связыванию антигена. Такие подходы включают в себя обобщенное сканирование гистидинов в вариабельной области для замены остатков на гистидин и исследования того, приведет ли обобщенный подход замещения гистидинов к антителу с требуемым зависимым от pH связыванием антигена (смотрите, например, Igawa, Т. et al. (2010) Antibody recycling by engineered pH-dependent antigen binding improves the duration of antigen neutralization, Nature Biotech. 28(11): 1203-1208; смотрите также, опубликованную заявку на патент США №2011/0111406 А1)). Скорее всего, недостаток этого подхода состоит в том, что модификация важных для связывания антигена остатков может нарушить связывание как при кислом, так и при нейтральном значении pH, что может устранить любые преимущества из-за различного значения pH между эндосомальным компартментом и внеклеточным пространством.
Согласно различным аспектам предусмотрены композиции и способы для получения одной или нескольких гистидиновых замен в нескольких продуманно выбранных областях в вариабельной области антитела (вариабельном домене тяжелой цепи и/или легкой цепи). Предусмотрен способ получения вариабельных доменов антител, которые связываются с антигеном-мишенью зависимым от pH образом, например, вариабельные домены, которые связываются с представляющим интерес антигеном с первой аффинностью при нейтральном или основном, или внеклеточном значении pH, при этом связываются с тем же представляющим интерес антигеном со второй аффинностью при кислом значении pH, причем первая аффинность высокая и причем вторая аффинность низкая.
Согласно различным аспектам одна или несколько гистидиновых замен находятся в CDR1, CDR2, CDR3, N-концевой последовательности и/или последовательности петли 4.
Согласно некоторым аспектам одна или несколько гистидиновых замен находятся в CDR1, CDR2 и/или CDR3.
Согласно некоторым аспектам одна или несколько гистидиновых замен находятся в CDR3 и последовательности петли 4. Согласно дополнительному варианту осуществления замены находятся также в N-концевой последовательности.
Согласно некоторым аспектам одна или несколько гистидиновых замен находятся в CDR3 и в N-концевой последовательности. Согласно дополнительному варианту осуществления замены находятся также в последовательности петли 4.
Согласно некоторым аспектам одна или несколько гистидиновых замен находятся в последовательности CDR2 и последовательности петли 4. Согласно дополнительному варианту осуществления замены находятся также в N-концевой последовательности.
Согласно некоторым аспектам последовательность петли 4 представляет собой остатки 83-88 вариабельного домена легкой цепи λ; остатки 83-88 вариабельного домена легкой цепи κ и 82-88 вариабельной области тяжелой цепи (нумерация IMGT).
Согласно некоторым аспектам N-концевая последовательность для вариабельного домена легкой цепи или вариабельного домена тяжелой цепи представляет собой остатки 1-26 (нумерация IMGT). Согласно одному варианту осуществления N-концевая последовательность, которая содержит одну или несколько (например, кластеры) гистидиновых замен, представляет собой остатки 1-5, согласно одному варианту осуществления остатки 1-10, согласно одному варианту осуществления 1-15, согласно одному варианту осуществления 1-20, согласно одному варианту осуществления 1-25, согласно одному варианту осуществления 5-10, согласно одному варианту осуществления 10-15, согласно одному варианту осуществления 15-20, согласно одному варианту осуществления 20-25, согласно одному варианту осуществления 5-15, согласно одному варианту осуществления 10-20, согласно одному варианту осуществления 5-20. Согласно одному варианту осуществления замены гистидина представляют собой две или более (например, три, четыре, пять или шесть или более) и по меньшей мере две или более из гистидиновых замен выполнены в участке N-концевой последовательности, которая составляет приблизительно 3 остатка, 4 остатка, пять остатков или шесть остатков или более. Согласно одному варианту осуществления множество гистидиновых замен выполнены на N-конце, и замены гистидина содержат кластеры по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех замен гистидина. Согласно одному варианту осуществления по меньшей мере один кластер гистидиновых замен содержит замены гистидина, которые отделены друг от друга одной или несколькими негистидиновыми заменами.
Согласно некоторым аспектам одна или несколько гистидиновых замен CDR составляют две, три, четыре, пять или шесть замен в CDR. Согласно одному варианту осуществления все остатки в CDR, которые не критичны для связывания при нейтральном значении pH, заменены на гистидин. Согласно одному варианту осуществления две, три, четыре, пять или шесть замен представляют собой смежные; согласно одному варианту осуществления одна или более из двух, трех, четырех, пяти или шести замен присутствуют в кластере, причем кластер содержит по меньшей мере один негистидиновый остаток; согласно одному варианту осуществления кластер содержит два негистидиновых остатка; согласно одному варианту осуществления кластер содержит три негистидиновых остатка; согласно одному варианту осуществления кластер содержит четыре негистидиновых остатка.
Согласно некоторым аспектам одна или несколько гистидиновых замен в N-конце составляют одну, две, три, четыре, пять или шесть замен. Согласно одному варианту осуществления все остатки в N-конце, которые не снижают связывание антигена при нейтральном значении pH (например, более чем на 1%, 2%, 3%, 4% или 5%), замещают на гистидин. Согласно одному варианту осуществления две, три, четыре, пять или шесть замен представляют собой смежные; согласно одному варианту осуществления одна или более из двух, трех, четырех, пяти или шести замен присутствуют в кластере, причем кластер содержит по меньшей мере один негистидиновый остаток; согласно одному варианту осуществления кластер содержит два негистидиновых остатка; согласно одному варианту осуществления кластер содержит три негистидиновых остатка; согласно одному варианту осуществления кластера содержит четыре негистидиновых остатка.
Согласно некоторым аспектам способ предусматривает модификацию вариабельного домена для включения кластера гистидиновых замен (например, описанного в настоящем документе смежного или прерванного одним или несколькими негистидиновыми остатками) в область, выбранную из CDR1, CDR2, CDR3, N-концевой, петли 4 и их комбинации. Согласно некоторым аспектам кластер представляет собой последовательность, ограниченную выше по ходу транскрипции первым остатком гистидина и ниже по ходу транскрипции вторым остатком гистидина, и содержит один или несколько остатков между первым и вторым остатками гистидина. Согласно одному варианту осуществления один или несколько остатков между первым и вторым остатками гистидина составляют 1, 2, 3, 4, 5 или 6, или более негистидиновых остатков. Согласно одному варианту осуществления один или несколько остатков между первым и вторым остатками гистидина составляют 1, 2, 3, 4, 5 или шесть остатков гистидина. Согласно одному варианту осуществления кластер представляет собой 3 остатка, согласно одному варианту осуществления 4 остатка, согласно одному варианту осуществления 5 остатков, согласно одному варианту осуществления 6 остатков, согласно одному варианту осуществления 7 остатков, согласно одному варианту осуществления 8 или более остатков.
Согласно различным аспектам способ предусматривает идентификацию последовательностей в вариабельном домена антитела (тяжелой и/или легкой цепи), которые необходимы для связывания антигена (например, при нейтральном значении pH, например, pH 7-7,4, например, pH 7,2, например, внеклеточном значении pH) и замену одного или нескольких остатков в последовательности на гистидин, причем замена на гистидин не устраняет связывание вариабельного домена с антигеном-мишенью при нейтральном значении pH. Согласно различным аспектам кластер из двух или более, трех или более, четырех или более или пять или более остатков, которые не критичны для связывания при нейтральном значении pH, заменены остатками гистидина. Согласно различным аспектам кластер остатков гистидина находится в CDR, петле 4, N-конце или их комбинации.
Согласно различным аспектам остаток, который важен для связывания идентифицируют как остаток, который при замене аминокислотой при приблизительно нейтральном (или внеклеточном) значении pH уменьшает связывание вариабельного домена согласно одному варианту осуществления по меньшей мере на 5%, согласно одному варианту осуществления по меньшей мере на 10%, согласно одному варианту осуществления по меньшей мере на 20%, согласно одному варианту осуществления по меньшей мере на 30%, согласно одному варианту осуществления по меньшей мере на 40%), согласно одному варианту осуществления по меньшей мере на 50%, согласно одному варианту осуществления по меньшей мере на 60%, согласно одному варианту осуществления по меньшей мере на 70%, согласно одному варианту осуществления по меньшей мере на 80%, согласно одному варианту осуществления по меньшей мере на 90%, согласно одному варианту осуществления не приводит к обнаруживаемому связыванию. Согласно одному варианту осуществления аминокислота-заменитель представляет собой гистидин. Согласно одному варианту осуществления аминокислота-заменитель представляет собой аланин.
Согласно одному аспекту предусмотрен способ для получения вариабельного домена антитела, который связывается с антигеном слабее при кислом значении pH, чем он связывается с тем же антигеном при нейтральном или основном значении pH, причем способ содержит замену одного или нескольких аминокислотных остатков вариабельной области на один или несколько остатков гистидина. Согласно одному варианту осуществления связывание при кислом значении pH незначительно или равно нулю.
Согласно одному варианту осуществления один или несколько замененных аминокислотных остатков находятся в легкой цепи. Согласно конкретному варианту осуществления один или несколько остатков находятся в области N-конца легкой цепи.
Согласно конкретному варианту осуществления N-концевые остатки выбирают из 1-26, 1-20, 1-15, 1-10, 1-6 или 1-5 (нумерация IMGT). Согласно одному варианту осуществления один или несколько остатков находятся в петле 3. Согласно конкретному варианту осуществления остатки петли 4 представляют собой 83-88 в Vκ или Vλ и 82-88 в VH (нумерация IMGT).
Согласно одному варианту осуществления один или несколько остатков находятся в тяжелой цепи. Согласно конкретному варианту осуществления один или несколько остатков находятся в области N-конца тяжелой цепи. Согласно конкретному варианту осуществления N-концевые остатки выбирают из 1-26, 1-20, 1-15, 1-10, 1-6 или 1-5 (нумерация IMGT). Согласно одному варианту осуществления один или несколько остатков находятся в петле 4. Согласно конкретному варианту осуществления остатки петли 3 выбирают из (для Vκ и/или Vλ) 83, 84, 85, 86, 87, 88 и их комбинации (нумерация IMGT) или (для VH) 82, 83, 84, 85, 86, 87, 88 и их комбинации (нумерация IMGT) и их комбинации.
Согласно одному варианту осуществления один или несколько остатков находятся в CDR, выбранном из CDR1, CDR2 и CDR3; и один или несколько остатков при замещении (например, аланином или гистидином) не приводят к снижению связывания антигена-мишени при нейтральном или основном значении pH. Согласно конкретному варианту осуществления сниженное связывание антигена-мишени при нейтральном или основном значении pH в результате замены (например, замены аланином или гистидином) составляет не более 5%, не более 10%, не более 15% или не более 20%, не более 25% или не более 30%, по сравнению с незамененным вариабельным доменом.
Согласно некоторым аспектам вариабельный домен с модифицированным гистидином, образовавший комплекс с антигеном-мишенью, проявляет период полужизни по меньшей мере приблизительно 20 минут при повышенном значении pH (например, внеклеточном значении pH или значении pH от 7-7,4, например, pH 7,2) и проявляет период полужизни менее 5 минут, менее 4 минут, менее 3 минут, менее 2 минут или менее минуты при эндосомальном значении pH или значении pH от, например, pH 5-6, например, pH 5,75. Согласно одному варианту осуществления вариабельный домен с модифицированным гистидином, образовавший комплекс с антигеном-мишенью, проявляет период полужизни по меньшей мере приблизительно 20 минут при повышенном значении pH и проявляет период полужизни при эндосомальном значении pH менее 60 секунд, менее 30 секунд, менее 10 секунд, менее 5 секунд, менее 4 секунд, менее 3 секунд или менее 2 секунд. Согласно одному варианту осуществления вариабельный домен с модифицированным гистидином, образовавший комплекс с антигеном-мишенью, проявляет период полужизни по меньшей мере приблизительно 20 минут при повышенном значении pH (например, pH 7-7,4, например, pH 7,2) и проявляет период полужизни при эндосомальном значении pH менее секунды, менее 0,5 секунды, менее 0,1 секунды или менее 0,05 секунды. Согласно одному варианту осуществления период полужизни при эндосомальном значении pH измеряют с использованием анализа BIACORE™, в котором вариабельный домен с модифицированным гистидином, образовавший комплекс с антигеном-мишенью, уравновешивают на поверхности чипа BIACORE™ при нейтральном или повышенном значении pH, и буфер при эндосомальном значении pH (или, например, pH 5-6, например, pH 5,75) протекает через комплекс.
Согласно различным аспектам способ получения вариабельного домена антитела, который связывается с антигеном-мишенью с первой аффинностью при внеклеточном значении pH, и который не связывается с антигеном-мишенью или связывается с антигеном-мишенью со второй аффинностью при эндосомальном значении pH, причем первая аффинность составляет приблизительно 10, 102, 103, 104, 105, 106, 107, 108, 109, 1010, 1011 или 1012 раз (или больше раз), чем вторая аффинность. Согласно некоторым аспектам, первая аффинность находится от пикомолярного до наномолярного диапазона (например, KD составляет от 10-12 до 10-9), а вторая аффинность находится в микромолярном или более высоком диапазоне (например, KD=10-6 или больше, например, 10-5, 10-4, 10-3, 10-2, 10-1, 1 или выше). Согласно некоторым аспектам первая аффинность находится в диапазоне от приблизительно KD 10-9 до приблизительно KD 10-12, а вторая аффинность находится в диапазоне от приблизительно KD 10-3 до приблизительно 1 или больше. Согласно одному варианту осуществления первая аффинность находится в диапазоне от приблизительно KD 10-9 до приблизительно KD 10-12, а вторая аффинность характеризуется KD>1; согласно конкретному варианту осуществления вторая аффинность характеризуется KD>>1 (например, 10, 102, 103 или выше). Согласно конкретному варианту осуществления первая аффинность характеризуется KD приблизительно от 10-9 до 10-12, а вторая аффинность характеризуется невозможностью обнаружения связывания выше фонового в анализе связывания BIACORE™.
Различные аспекты иллюстрируются конкретным случаем, в котором вариабельную последовательность легкой цепи человека модифицируют для введения одного или нескольких, в том числе кластер, гистидинов в CDR3 легкой цепи, и легкая цепь экспрессируется в клетке CHO с родственной тяжелой цепью человека. Идентичность антигена, с которым связывается антитело с модифицированным гистидином, не важна, как и, в частности, последовательность вариабельного домена легкой цепи. Принципы, показанные в примерах, применимы к CDR3, CDR2, CDR1, N-концевой области или петле 4. Например, остатки в указанных областях могут быть заменены на гистидин по отдельности или в кластерах 2, 3, 4 или 5, например, и полученные антитела исследовали на зависимое от pH связывание антигена.
Способы конструирования антител, которые способны связываться с антигеном зависимым от pH образом, могут быть выполнены путем получения модификаций вариабельной области легкой цепи иммуноглобулина в одном или нескольких положениях вдоль последовательности легкой цепи, как описано (например, в CDR3, CDR2, CDR1, петле 4, N-конце). Гистидины допускаются в областях CDR; легкие цепи, как правило, показывают, соматическую гипермутацию вдоль последовательности вариабельной области и, в некоторых случаях, такие мутации могут приводить к замене остатков гистидина в CDR (фиг. 15).
В примерах гистидиновые замены были идентифицированы от одной до четырех позиций в CDR3 области легкой цепи, в не критичных для связывания антигена-мишени остатках при нейтральном значении pH, из которого были получены пятнадцать мутантных конструктов. Конкретная показанная легкая цепь - с множеством различных, но родственных тяжелых цепей - происходит из единственного сегмента Vκ и единственного сегмента Jκ (Vκ1-39/Jκ5). Такие мутанты при экспрессии придают антителу (совместно с родственной тяжелой цепью) свойство зависимого от pH связывания антигена. Мутантные конструкты получали с использованием антиген-специфических вариабельных доменов антител и исследовали на экспрессию и связывание антигена при приблизительно нейтральном значении pH и высвобождение при низком значении pH ("захват и высвобождение"). В некоторых примерах показанные положения четырех идентифицированных остатков (где мутация гистидина не критична для связывания при нейтральном значении pH) представляют собой Q105H, Q106H, Y108H и Р111Н. Для антитела, которое связывается с другим антигеном-мишенью, или для антитела, содержащего другую реаранжированную последовательность V-J, остатки с мутировавшим гистидином для получения зависимого от pH вариабельного домена находятся путем идентификации того, какие остатки не критичны для связывания при нейтральном значении pH, а затем модификации одного или нескольких из этих остатков (например, в кластерах) и экспрессии антитела, содержащего мутации, и исследование на связывание (и/или время высвобождения, например, t1/2) при нейтральном значении pH (например, внеклеточном значении pH) и при кислом значении pH (например, эндосомальном значении pH). Хотя приведенные в настоящем документе данные представлены для легкой цепи Vκ1-39/Jκ5, другие легкие цепи, включающие в себя полученные из реаранжировки Vκ3-20/Jκ1, поддаются описанному в настоящем документе подходу так же, как и тяжелые цепи.
Все конструкты легкой цепи со встроенным гистидином, которые были получены в этом эксперименте, экспрессировали в сочетании с тяжелыми цепями. Кроме того, связывание антител с антигеном зависимым от pH образом было продемонстрировано на основании данных анализа BIACORE™, показывающих связывание антигена при приблизительно нейтральном значении pH и при кислом значении pH для 15 мутантов с пятью различными тяжелыми цепями, которые специфически распознают то же антиген клеточной поверхности (фиг. 19А-J).
Описанные способы и эти конкретные способы, используемые для целей иллюстрации в некоторых из примеров и фигур в настоящем описании, могут быть использованы для создания вариабельных областей антител, которые могут быть использованы для получения, например, человеческих терапевтических связывающих белков, которые связывают свои мишени вариабельными доменами иммуноглобулина человека, которые содержат гистидины в CDR3. Измененное связывание при более низком значении pH будет в некоторых случаях позволять более быстрый оборот, потому что лекарственное средство будет связываться с мишенью на поверхности клетки, поглощать в эндосому и легче и быстрее диссоциировать от мишени в эндосоме так, что лекарственное средство может рециркулировать, чтобы еще связаться с другой молекулой мишени (например, на другой клетке или той же клетке). Согласно различным вариантам осуществления это приведет к возможности дозирования лекарственного средства в более низкой дозе или введения лекарственного средства реже. Это особенно применимо, когда не желательно частое введение или для введения выше определенной дозировки, для обеспечения безопасности и по причинам токсичности. Например, период полужизни терапевтического антитела в сыворотке субъекта будет в результате увеличен.
Таким образом, согласно различным вариантам осуществления кодоны в гене, кодирующем реаранжированную легкую цепь человека, могут быть получены в положениях 105, 106, 108, 111 или их комбинации. Например, положение 105 в сочетании с одним или несколькими из 106, 108 и 111; положение 106 в сочетании с одним или несколькими из 105, 108 и 111; положение 108 в сочетании с одним или несколькими 105, 106 и 111; положение 111 в сочетании с одним или несколькими из 105, 106 и 108. Соответствующие положения в других легких цепях (т.е. происходящих из других реаранжировок V-J) включены в различные варианты осуществления.
Отличные от человека животные, которые экспрессируют вариабельный домен тяжелой цепи иммуноглобулина, содержащий остатки гистидина
Описанное изобретение предусматривает генетически модифицированные отличные от человека животные, которые могут производить антигенсвязывающие белки с зависимыми от pH характеристиками связывания антигенов. Согласно различным вариантам осуществления антигенсвязывающие белки, продуцируемые описанными в настоящем документе генетически модифицированными отличными от человека животными, проявляют повышенную зависимую от pH эффективность рециркулирования и/или повышенный период полужизни в сыворотке крови. В частности, в описанном изобретении используются генетические модификации в локусе тяжелой цепи иммуноглобулина для введения гистидиновых кодонов в нуклеотидную последовательность вариабельной области тяжелой цепи человека, и, при необходимости, введения мутации(й) в нуклеотидную последовательность константной области, которая кодирует домены CH2 и/или CH3, что увеличивает связывание константной области антител с рецептором FcRn, который облегчает рециркулирование антигенсвязывающего белка. Содержащие модификацию антигенсвязывающие белки могут более свободно связываться со своей мишенью в кислом внутриклеточном пространстве (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0), чем во внеклеточной среде или на поверхности клетки (т.е., при физиологическом значении pH, например, значении pH в диапазоне от приблизительно 7,0 до приблизительно 7,4) благодаря протонированным остаткам гистидина, расположенным в антигенсвязывающих сайтах. Таким образом, антигенсвязывающие белки, содержащие описанные в настоящем документе генетические модификации могли бы рециркулировать более быстро и эффективно после мишень-опосредованного эндоцитоза, чем антигенсвязывающие белки дикого типа, которые не содержат такие генетические модификации. Кроме того, поскольку модифицированные остатки гистидина протонируются только в кислой среде, но не при нейтральном значении pH, можно ожидать, что такая модификация не повлияет на аффинность связывания и/или специфичность антигенсвязывающего белка по отношению к представляющему интерес антигену при физиологическом значении pH.
Согласно различным аспектам предусмотрены отличные от человека животные, содержащие локусы тяжелой цепи иммуноглобулина, которые содержат нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи человека содержит добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно различным аспектам также предусмотрены способы получения и применения отличных от человека животных. После иммунизации представляющим интерес антигеном генетически модифицированные отличные от человека животные способны производить популяции В-клеток, которые производят антигенсвязывающие белки, содержащие вариабельные домены тяжелой цепи с остатками гистидина, причем антигенсвязывающие белки проявляют повышенное зависимое от pH рециркулирование и/или увеличенный период полужизни в сыворотке. Согласно различным вариантам осуществления отличные от человека животные производят популяции В-клеток, которые экспрессируют вариабельные домены тяжелой цепи человека наряду с родственными вариабельными доменами легкой цепи человека. Согласно различным вариантам осуществления генетически модифицированные локусы тяжелой цепи иммуноглобулина присутствуют в геноме зародышевой линии отличного от человека животного.
Согласно различным вариантам осуществления генетически модифицированный локус тяжелой цепи иммуноглобулина содержит модификацию, которая удаляет или приводит в нефункциональное состояние все или по существу все эндогенные генные сегменты VH, D и JH; и генетически модифицированный локус содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи, содержащую одну или несколько генных сегментов VH, D и JH человека, содержащих один или несколько кодонов гистидина, причем нереаранжированная нуклеотидная последовательность вариабельной области тяжелой цепи присутствует в эндогенном положении (т.е., там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое положение в геноме). Согласно одному варианту осуществления, например, приблизительно 80% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 95% или более, приблизительно 96% или более, приблизительно 97% или более, приблизительно 98% или более, или приблизительно 99% или более от всех эндогенных генных сегментов V, D или J тяжелой цепи удаляют или приводят в нефункциональное состояние. Согласно одному варианту осуществления, например, по меньшей мере 95%, 96%, 97%, 98% или 99% от эндогенных функциональных генных сегментов V, D или J тяжелой цепи удаляют или приводят в нефункциональное состояние.
Согласно одному варианту осуществления отличное от человека животное представляет собой млекопитающее. Хотя варианты осуществления, направленные на внедрение гистидиновых кодонов в нереаранжированную вариабельную генную последовательность тяжелой цепи человека в мышь, широко обсуждаются в настоящем документе, предусмотрены также другие отличные от человека животные, которые содержат генетически модифицированный локус иммуноглобулина, содержащий нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, содержащую добавление по меньшей мере одного гистидинового кодона или замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон. Такие отличные от человека животные включают в себя любые из тех, которые могут быть генетически модифицированы для экспрессии описанного в настоящем документе содержащего гистидин вариабельного домена тяжелой цепи, включая в себя, например, мышь, крысу, кролика, свинью, крупный рогатый скот (например, корову, быка, буйвола), оленя, овцу, козу, курицу, кошку, собаку, хорька, примата (например, мартышку, макака-резуса) и т.д. Например, для тех отличных от человека животных, для которых подходящие генетически модифицируемые ES клетки не легкодоступны, используются другие способы для получения отличного от человека животного, содержащего генетическую модификацию. Такие способы включают в себя, например, модификацию генома не-ES клетки (например, фибробласта или индуцированной плюрипотентной клетки) и использование переноса ядра соматической клетки (SCNT) для переноса генетически модифицированного генома подходящей клетке, например, безъядерному ооциту, и формирование модифицированной клетки (например, модифицированного ооцита) в отличном от человека животном в подходящих условиях для образования эмбриона. Способы модификации генома отличного от человека животного (например, генома свиньи, коровы, грызуна, курицы и т.д.) включают в себя, например, использование цинк-пальцевой нуклеазы (ZFN) или подобной активаторам транскрипции эффекторной нуклеазы (TALEN) для модификации генома для включения последовательности нуклеотиды, которая кодирует.
Согласно одному варианту осуществления отличное от человека животное представляет собой мелкое млекопитающее, например, из надсемейства Dipodoidea или Muroidea. Согласно одному варианту осуществления генетически модифицированное животное представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из мыши, крысы и хомяка. Согласно одному варианту осуществления грызуна выбирают из надсемейства Muroidea. Согласно одному варианту осуществления генетически модифицированные животное представляет собой животное из семейства, выбранного из Calomyscidae (например, мышевидные хомячки), Cricetidae (например, хомячок, крысы и мыши Нового Света, полевки), Muridae (истинные мыши и крысы, песчанки, колючие мыши, хохлатые крысы), Nesomyidae (рипидомисы, скальные мыши, белохвостые крысы, Малагасийские крысы и мыши), Platacanthomyidae (например, колючие соневидные хомяки) и Spalacidae (например, кроты, бамбуковые крысы и цокоры). Согласно конкретному варианту осуществления генетически модифицированного грызуна выбирают из истинной мыши или крысы (семейство Muridae), песчанки, колючей мыши и косматого хомяка. Согласно одному варианту осуществления генетически модифицированная мышь представляет собой представителя семейства Muridae. Согласно одному варианту осуществления животное представляет собой грызуна. Согласно конкретному варианту осуществления грызуна выбирают из мыши и крысы. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь.
Согласно одному варианту осуществления отличное от человека животное представляет собой грызуна, который представляет собой мышь линии C57BL, выбранной из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6N, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/Ola. Согласно другому варианту осуществления мышь представляет собой мышь линии 129. Согласно одному варианту осуществления линию 129 выбирают из группы, состоящей из линии, которая представляет собой 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 129S1/SV, 129S1/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129T1, 129T2 (смотрите, например, Festing et al. (1999) Revised nomenclature for strain 129 mice, Mammalian Genome 10:836, смотрите также Auerbach et al. (2000) Establishment and Chimera Analysis of 129/SvEv- and C57BL/6-Derived Mouse Embryonic Stem Cell Lines). Согласно одному варианту осуществления генетически модифицированная мышь представляет собой сочетание вышеуказанной линии 129 и вышеуказанной линии C57BL (например, линии C57BL/6). Согласно другому варианту осуществления мышь представляет собой сочетание вышеуказанных линий 129 или сочетание вышеуказанных линий C57BL/6. Согласно одному варианту осуществления линия 129 сочетания представляет собой линию 129S6 (129/SvEvTac). Согласно другому варианту осуществления мышь представляет собой сочетание линий, происходящих из 129/SvEv и C57BL/6. Согласно конкретному варианту осуществления мышь представляет собой сочетание линий, происходящих из 129/SvEv и C57BL/6, как описано в Auerbach et al. 2000 BioTechniques 29:1024-1032. Согласно другому варианту осуществления мышь представляет собой линию BALB, например, линию BALB/c. Согласно еще одному варианту осуществления мышь представляет собой сочетание линии BALB (например, линии BALB/c) и другой вышеуказанной линии.
Согласно одному варианту осуществления отличное от человека животное представляет собой крысу. Согласно одному варианту осуществления крысу выбирают из крысы линии Wistar, линии LEA, линии Sprague Dawley, линии Fischer, F344, F6 и Dark Agouti. Согласно одному варианту осуществления линия крысы представляет собой сочетание двух или более линий, выбранных из группы, состоящей из Wistar, LEA, Sprague Dawley, Fischer, F344, F6 и Dark Agouti.
Согласно одному варианту осуществления отличное от человека животное представляет собой мышь. Согласно одному варианту осуществления мышь представляет собой VELOCIMMUNE® гуманизированную мышь.
VELOCIMMUNE® гуманизированные мыши (смотрите, например, US 6596541, US 7105348 и US 20120322108 A1), которые содержат точное замещение вариабельных областей иммуноглобулина мыши на вариабельные области иммуноглобулина человека в эндогенных локусах мыши, отображая удивительное и поразительное сходство с мышью дикого типа в отношении развития В-клеток. VELOCIMMUNE® гуманизированные мыши обнаруживают по существу нормальный ответ дикого типа на иммунизацию, которая отличалась только в одном существенном отношении от мышей дикого типа - производимые в ответ на иммунизацию вариабельные области представляют собой полностью человеческие.
VELOCIMMUNE® гуманизированные мыши содержат точное, масштабное замещение нуклеотидных последовательностей вариабельной области зародышевой линии тяжелой цепи иммуноглобулина мыши (IgH) и легкой цепи иммуноглобулина (например, легкой цепи κ, Ig κ) на соответствующие нуклеотидные последовательности вариабельной области иммуноглобулина человека в эндогенных локусах (смотрите, например, US 6596541, US 7105348, US 20120322108 А1). В общей сложности, приблизительно шесть мегабаз локусов мыши замещают приблизительно 1,5 мегабазами геномной последовательности человека. Эти точные замещения приводят к мышам с гибридными локусами иммуноглобулина, которые производят тяжелые и легкие цепи, которые содержит вариабельные области человека и константную область мыши. Точное замещение сегментов VH-D-JH и Vκ-Jκ мыши оставляют фланкирующие последовательности мыши интактными и функциональными в гибридных локусах иммуноглобулинов. Гуморальная иммунная система мыши функционирует как таковая у мыши дикого типа. Развития В-клеток беспрепятственно в любом значимом отношении и богатое разнообразие вариабельных областей человека производится у мыши при антигенной сенсибилизации.
VELOCIMMUNE® гуманизированные мыши возможны, так как генные сегменты иммуноглобулинов для тяжелых и легких к цепей реаранжируют сходным образом у людей и мышей, при этом нельзя сказать, что их локусы одинаковы или даже близки - ясно, что нет. Тем не менее, локусы схожи достаточно, чтобы гуманизация вариабельного генного локуса тяжелой цепи могла быть достигнута путем замещения приблизительно трех миллионов пар оснований непрерывной последовательности мыши, которая содержит все генные сегменты VH, D и JH, на приблизительно один миллион оснований непрерывной геномной последовательности человека, покрывающей в основном эквивалентную последовательность из локуса иммуноглобулина человека.
Согласно некоторым вариантам осуществления дополнительное замещение определенных нуклеотидных последовательностей константной области мыши на нуклеотидные последовательности константной области человека (например, замещение нуклеотидной последовательности CH1 тяжелой цепи мыши на нуклеотидную последовательность CH1 тяжелой цепи человека, и замещение нуклеотидной последовательности константной области легкой цепи мыши на нуклеотидную последовательность константной области легкой цепи человека) приводит к получению мышей с гибридными локусами иммуноглобулина, которые производят антитела, содержащие человеческие вариабельные области и частично человечески константные области, подходящие, например, для создания полностью человеческих фрагментов антител, например, полностью человеческих Fab. Мыши с гибридными локусами иммуноглобулинов проявляют нормальную реаранжировку вариабельных генных сегментов, нормальные частоты соматических гипермутаций и нормальное переключение класса. Эти мыши проявляют гуморальную иммунную систему, которая не отличается от мышей дикого типа, и отображают нормальные клеточные популяции на всех стадиях развития В-клеток, и нормальные структуры лимфоидных органов, даже когда мыши не содержат полный репертуар нуклеотидных сегментов вариабельных областей человека. Иммунизация этих мышей приводит к надежным гуморальным ответам, которые отображают широкое разнообразие использования вариабельных генных сегментов.
Точное замещение нуклеотидной последовательности вариабельной области зародышевой линии мыши позволяет получить мышей, которые содержат частично человеческие локусы иммуноглобулинов. Поскольку частично человеческие локусы иммуноглобулинов реаранжируют, гипермутируют и переключают класс нормально, частично человеческие локусы иммуноглобулинов производят антитела у мыши, которые содержат вариабельные области человека. Нуклеотидные последовательности, которые кодируют вариабельные области, могут быть идентифицированы и клонированы, а затем слиты (например, в системе in vitro) с любыми последовательностями отбора, например, любым изотипом иммуноглобулина, подходящим для конкретного использования, приводя к получению антитела или антигенсвязывающего белка, производящего полностью человеческие последовательности.
Согласно различным вариантам осуществления по меньшей мере один гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует N-концевую область, область петли 4, CDR1, CDR2, CDR3 или их комбинации.
Согласно различным вариантам осуществления по меньшей мере один гистидиновый кодон присутствует в нереаранжированной нуклеотидной последовательности вариабельной области тяжелой цепи, которая кодирует каркасную область (FR), выбранную из группы, состоящей из FR1, FR2, FR3 и FR4.
Согласно различным аспектам генетически модифицированный локус иммуноглобулина содержит нуклеотидную последовательность, причем по меньшей мере один кодон был заменен на гистидиновый кодон.
Согласно различным аспектам генетически модифицированный локус иммуноглобулина содержит нереаранжированную нуклеотидную последовательность вариабельной области тяжелой цепи человека, содержащую замену по меньшей мере одного эндогенного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более, 25 или более, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, 39 или более, 40 или более, 41 или более, 42 или более, 43 или более, 44 или более, 45 или более, 46 или более, 47 или более, 48 или более, 49 или более, 50 или более, 51 или более, 52 или более, 53 или более, 54 или более, 55 или более, 56 или более, 57 или более, 58 или более, 59 или более, 60 или более или 61 или более эндогенных негистидиновых кодонов замещены гистидиновыми ко донами.
В предыдущих исследованиях по использованию рамки считывания генных сегментов D иммуноглобулина человека показали, что из трех рамок считывания (т.е., стоп, гидрофобная и гидрофильная), стоп рамка используется очень редко. По-видимому, некоторые стоп рамки chewed back и приводят к экспрессии. Тем не менее, стоп рамки считывания используются при такой низкой частоте, какая для целей встраивания гистидиновых кодонов более эффективна, чем не использовать стоп рамку считывания. Между гидрофильными и гидрофобными рамками считывания гидрофильная рамка считывания, по-видимому, предпочтительнее. Таким образом, согласно одному варианту осуществления гидрофильную рамку считывания генных сегментов D человека конструируют так, чтобы содержать один или несколько гистидиновых кодонов (по сравнению со стоп рамкой или с гидрофобной рамкой).
Способы введения мутации in vitro, например, сайт-направленный мутагенез, хорошо известны в настоящей области техники. Согласно некоторым вариантам осуществления описанного изобретения гистидиновые кодоны обогащены разработанными генными сегментами D человека с заменами гистидина in silico (например, мутация кодонов Y, D и N в кодоны Н, например, CAT, САС), которые синтезируют (например, химическим синтезом) с (уникальными) рестриктазами сайтов для лигирования их вместе. Синтезированные генные сегменты D получают с соответствующими последовательностями сигнала рекомбинации (RSS) выше и ниже по ходу транскрипции. Согласно одному варианту осуществления, когда лигированы друг с другом, синтезированные генные сегменты D с заменами гистидина включают в себя межгенные последовательности, наблюдаемые у человека между каждым генным сегментом D.
Следует понимать, что кодоны, которые кодируют один или несколько гистидинов, после реаранжировки и/или соматической гипермутации, могут быть изменены таким образом, что один или несколько из гистидинов изменяются на другую аминокислоту. Однако, это не может произойти для каждого кодирующего гистидин кодона в каждой реаранжировке у отличного от человека животного. Если такие изменения происходят, то изменения могут происходить в некоторых, но не всех В-клетках или в некоторых, но не всех вариабельных последовательностях тяжелой цепи.
Согласно различным аспектам генетически модифицированный локус иммуноглобулина содержит генный сегмент V, D и J тяжелой цепи человека, причем по меньшей мере один из генных сегментов D человека был инвертирован с 5ʹ к 3ʹ по отношению к соответствующей последовательности дикого типа, и причем по меньшей мере одна рамка считывания инвертированного генного сегмента D человека содержит гистидиновый кодон.
Согласно различным вариантам осуществления нуклеотидная последовательность содержит один или более, 2 или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 11 или более, 12 или более, 13 или более, 14 или более, 15 или более, 16 или более, 17 или более, 18 или более, 19 или более, 20 или более, 21 или более, 22 или более, 23 или более, 24 или более или 25 или более кодонов гистидина.
Существует 25 функциональных генных сегментов D человека в 6 семействах 3-5 представителей в каждом (одно семейство - семейство D7 - содержит единственного представителя). Прямая рекомбинация генных сегментов D человека встречается гораздо чаще, чем инверсия, хотя инвертированные рамки считывания проявляют больше гистидиновых кодонов. Определенные генные сегменты D и рамки считывания используются чаще, чем другие. Все три прямые рамки считывания и все три рамки считывания с инвертированной ориентацией для всех функциональных генных сегментов D представлены на фиг. 10А-10Е. Как показано на фиг. 10А-10Е существует гораздо больше гистидиновых кодонов в инвертированных рамках считывания, чем в прямых рамках считывания. В частности, существует 34 гистидина в инвертированных рамках считывания и только четыре в прямых рамках считывания. Кроме того, из четырех прямых рамок считывания три гистидина кодируются псевдогенами или присутствуют в альтернативных аллелях. Таким образом, существует только единственная прямая рамка считывания генного сегмента D зародышевой линии человека, которая содержит гистидиновый кодон, с последующими гистидиновыми кодонами, возможно, встречающимися в альтернативных аллелях (по-видимому, в подмножестве человеческой популяции).
Реаранжировки инвертированных D встречаются крайне редки. Tuaillon et al. (J. Immunol., 154(12): 5453-6465) показали, что использование инвертированных рамок считывания (что измерялось с помощью РСТ предельного разведения) встречается очень редко, т.е., что отношение прямых и непрямых реаранжировок составляет, в большинстве случаев, от 100 до 1000. В тех случаях, когда отношение прямых и непрямых реаранжировок была низкой, она наблюдалась только в тех сегментах D, которые проявляют очень низкое использование. Также было показано, что семейство 7 генных сегментов D, которое находится рядом с J1 (далеко вниз от других представителей семейства D), в основном используется в зародышах, но проявляет низкое использование у взрослых (Schroeder et al., Immunology 30, 2006, 119-135). Таким образом, согласно одному варианту осуществления последовательности семейства 7D характеризуются тем, что они не инвертированы от 5ʹ к 3ʹ.
Согласно одному варианту осуществления по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять, по меньшей мере одиннадцать, по меньшей мере двенадцать, по меньшей мере тринадцать, по меньшей мере четырнадцать, по меньшей мере пятнадцать, по меньшей мере шестнадцать, по меньшей мере семнадцать, по меньшей мере восемнадцать, по меньшей мере девятнадцать, по меньшей мере двадцать, по меньшей мере двадцать один, по меньшей мере двадцать два, по меньшей мере двадцать три, по меньшей мере двадцать четыре или все или по существу все функциональные генные сегменты D человека инвертированы от 5ʹ к 3ʹ по отношению к соответствующим последовательностям дикого типа.
Согласно одному варианту осуществления вариабельный домен тяжелой цепи иммуноглобулина человека, содержащий по меньшей мере один не встречающийся в природе остаток гистидина, проявляет зависимые от pH антигенсвязывающие характеристики. Например, антитело, содержащее модифицированный вариабельный домен тяжелой цепи иммуноглобулина, связывается с мишенью с достаточной аффинностью приблизительно при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4), но либо не связывается или связывается слабее с той же мишенью при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0). Согласно одному варианту осуществления кислые значения pH выбирают из приблизительно 5,5, приблизительно 5,6, приблизительно 5,7, приблизительно 5,8, приблизительно 5,9 и приблизительно 6,0. Согласно одному варианту осуществления нейтральные значения pH выбирают из приблизительно 7,0, приблизительно 7,1, приблизительно 7,2, приблизительно 7,3 и приблизительно 7,4.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 2 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 25°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом тяжелой цепи иммуноглобулина, характеризуется диссоциационным периодом полувыведения (t1/2), равным менее 1 мин при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0) при 37°C. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий вариабельный домен тяжелой цепи, экспрессированный описанным в настоящем документе генетически модифицированным локусом иммуноглобулина характеризуется снижением диссоциационного периода полувыведения (t1/2) по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз при кислом значении pH (например, значении pH от приблизительно 5,5 до приблизительно 6,0), по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH (например, значении pH от приблизительно 7,0 до приблизительно 7,4).
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий генетически модифицированный вариабельный домен тяжелой цепи иммуноглобулина человека, способен специфически связываться с представляющим интерес антигеном с аффинностью (KD) более низкой, чем 10-6, 10-7, 10-8, 10-9, 10-10, 10-11 и 10-12 при нейтральном или физиологическом значении pH (значение pH от приблизительно 7,0 до приблизительно 7,4).
Измененное свойство связывания вариабельного домена тяжелой цепи иммуноглобулина при кислом значении pH (например, значении pH приблизительно от 5,5 до 6,0) при некоторых обстоятельствах будет обеспечивать более быстрый оборот антитела, поскольку терапевтическое антитело будет связываться с мишенью на поверхность клетки, поглощаться в эндосомы и легче и быстрее диссоциировать от мишени в эндосоме так, что лекарственное средство может рециркулировать, чтобы еще связаться с другой молекулой мишени, присутствующей на другой клетке. Это приведет к возможности введения лекарственного средства в более низкой дозе или к менее частому введению лекарственного средства. Это особенно применимо в ситуации, когда не желательно вводить терапевтическое антитело часто или вводить в количестве выше определенной дозировки для обеспечения безопасности и по причинам токсичности.
Согласно различным вариантам осуществления описанная в настоящем документе нуклеотидная последовательность вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с человеческой или отличной от человеческой нуклеотидной последовательностью константной области тяжелой цепи (например, нуклеотидной последовательностью константной области тяжелой цепи, которая кодирует изотип иммуноглобулина, выбранный из IgM, IgD, IgG, IgE и IgA). Согласно различным вариантам осуществления человеческую или отличную от человеческой нуклеотидную последовательность константной области тяжелой цепи выбирают из группы, состоящей из CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления нуклеотидная последовательность константной области содержит CH1, шарнир, CH2 и CH3 (например, CH1-шарнир-CH2-CH3).
Согласно различным вариантам осуществления нуклеотидная последовательность константной области тяжелой цепи присутствует в эндогенном локусе (т.е. там, где нуклеотидная последовательность находится у отличного от человека животного дикого типа) или присутствует эктопически (например, в локусе, отличном от эндогенного локуса цепи иммуноглобулина в своем геноме, или в своем эндогенном локусе, например, в вариабельном локусе иммуноглобулина, причем эндогенный локус находится или перемещен в другое место в геноме).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи содержит модификацию в CH2 или CH3, причем модификация увеличивает аффинность аминокислотной последовательности константной области тяжелой цепи к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Неонатальный рецептор Fc для IgG (FcRn) был хорошо охарактеризован в передаче пассивного гуморального иммунитета от матери ее ребенку во время беременности через плаценту и проксимальную тонкую кишку (Roopenian, D. and Akilesh, S., Nat. Rev. Immun., 2007, 7:715-725). FcRn связывается с участком Fc из IgG в сайте, отличном от сайтов связывания классических FcγR или компонента комплемента C1q, который инициирует классический путь активации комплемента. Более конкретно, было показано, что FcRn связывается с шарнирной областью CH2-CH3 антител IgG - универсальной областью Fc, которая также связывается со стафилококковым белком А, стрептококковым белком G и ревматоидным фактором. В отличие от других связывающих Fc белков, однако, FcRn связывается с областью Fc IgG строго зависимым от pH образом; при физиологическом значении pH 7,4 FcRn не связывается с IgG, в то время как при кислом значении pH эндосомы (например, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0), FcRn проявляет низкую (от микромолярной до наномолярной) аффинность к области Fc IgG. Это зависимое от pH взаимодействие, как было показано, опосредуется титрованием остатков гистидина в области CH2-CH3 IgG и их последующим взаимодействием с кислым остатком на поверхности FcRn (Roopenian, D. and Akilesh, S., Nat. Rev. Immun., 2007, 7:715-725).
Различные мутации в области CH2-CH3 в IgG, которые могут увеличить аффинность области Fc к FcRn при кислом значении pH, известны в настоящей области техники. Они включают в себя без ограничения модификацию в положении 250 (например, E или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т); или модификацию в 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в 250 и/или 428; или модификацию в 307 или 308 (например, 308F, V308F) и 434. В другом примере модификация содержит модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 259I (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L или их комбинацию.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 252 и 257, причем модификация увеличивает аффинность аминокислотной последовательности CH2 человека к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH2 человека, содержащую по меньшей мере одну модификацию между аминокислотными остатками в положениях 307 и 311, причем модификация увеличивает аффинность аминокислотной последовательности CH2 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи кодирует аминокислотную последовательность CH3 человека, причем аминокислотная последовательность CH3 содержит по меньшей мере одну модификацию между аминокислотными остатками в положениях 433 и 436, причем модификация увеличивает аффинность аминокислотной последовательности CH3 к FcRn в кислой среде (например, в эндосоме, где значение pH находится в диапазоне от приблизительно 5,5 до приблизительно 6,0).
Согласно одному варианту осуществления аминокислотная последовательность константной области человека, кодируемая описанной в настоящем документе нуклеотидной последовательностью константной области тяжелой цепи, содержит мутацию, выбранную из группы, состоящей из M428L, N434S и их комбинации. Согласно одному варианту осуществления аминокислотная последовательность константной области человека содержит мутацию, выбранную из группы, состоящей из M428L, V259I, V308F и их комбинации. Согласно одному варианту осуществления аминокислотная последовательность константной области человека содержит мутацию N434A. Согласно одному варианту осуществления аминокислотная последовательность константной области человека содержит мутацию, выбранную из группы, состоящей из M252Y, S254T, Т256Е и их комбинации. Согласно одному варианту осуществления аминокислотная последовательность константной области человека содержит мутацию, выбранную из группы, состоящей из T250Q, M248L или обеих. Согласно одному варианту осуществления аминокислотная последовательность константной области человека содержит мутацию, выбранную из группы, состоящей из H433K, N434Y или обеих.
Согласно одному варианту осуществления аминокислотная последовательность константной области тяжелой цепи представляет собой отличную от человеческой аминокислотную последовательность константной области, и аминокислотная последовательность константной области тяжелой цепи содержит одну или несколько модификаций любого из описанных выше типов.
Согласно одному варианту осуществления нуклеотидная последовательность константной области тяжелой цепи представляет собой аминокислотную последовательность константной области тяжелой цепи человека, и аминокислотная последовательность константной области тяжелой цепи человека содержит одну или несколько модификаций любого из описанных выше типов.
Встроенные остатки гистидина в генах легких цепей иммуноглобулина
Согласно различным вариантам осуществления предусмотрены генетически модифицированные отличные от человека животные (например, млекопитающие, например, мыши, крысы, кролики и т.д.), которые содержит в своем геноме, например, в своей зародышевой линии, нуклеотидную последовательность(и), кодирующую молекулы антител человека, которые проявляют зависимое от pH связывание антигена, например, нуклеотидную последовательность легкой цепи иммуноглобулина, содержащую реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, кодирующую антитела, которые проявляют зависимое от pH связывание антигена; содержащие их эмбрионы, клетки и ткани; способы их получения; а также способы их применения.
Авторы настоящего изобретения обнаружили, что отличные от человека животные, которые экспрессируют антитела, способные связываться с антигеном зависимым от pH образом, могут быть получены путем модификации вариабельной области легкой цепи иммуноглобулина в одном или нескольких положениях вдоль последовательности легкой цепи. Описаны способы внесения модификаций в зародышевую линию отличного от человека животного таким образом, что животное будет экспрессировать гистидины в CDR антител. В частности, описаны способы получения модификаций в вариабельной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши. Последовательность вариабельной области, например, легких цепей, как правило, показывает соматическую гипермутацию вдоль последовательности вариабельной области, и, в некоторых случаях, такие мутации могут приводить к замене остатков гистидина (смотрите, например, фиг. 15). Такие мутации могут происходить даже в определяющих комплементарность областях (CDR), которые представляют собой области вариабельных доменов, ответственных за связывание антигена. В некоторых случаях такие мутации могут приводить к получению антител, которые проявляют зависимое от pH связывание антигена, например, снижение связывания антигена при кислом значении pH, по сравнению со связыванием антигена при нейтральном значении pH. Такое зависимое от pH связывание антигена желательно, потому что это может позволить антителу связываться с антигеном за пределами клетки, и, после захвата в эндосомы, высвобождать антиген и возвращаться обратно на поверхность, чтобы связать другой антиген, избегая мишень-опосредованного клиренса. Были зарегистрированы подходы для введения остатков гистидина для достижения этого эффекта с использованием случайного сканирующего гистидином мутагенеза для конструирования зависимых от pH связывающих свойств в антителах к IL-6R (США 2011/0111406 А1). Тем не менее, случайный мутагенез остатков антитела может приводить к снижению аффинности антитела к антигену. Отличное от человека животное, генетически модифицированное, чтобы экспрессировать замену гистидина в последовательности антитела, делает возможным производство высокоаффинных антител в ответ на представляющий интерес антиген, благодаря модификации(ям) гистидина будет также показывать зависимое от pH связывание антигена.
Таким образом, согласно различным вариантах осуществления в настоящем документе предусмотрено генетически модифицированное отличное от человека животное (например, грызун, например, мышь или крыса), которое содержит в своем геноме, например, своей зародышевой линии, последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую модификации, которые приводят к получению животного, экспрессирующего антитела, способные связываться с антигенами зависимым от pH образом. Согласно одному варианту осуществления отличное от человека животное содержит модификации в последовательности вариабельной области легкой цепи иммуноглобулина человека (например, последовательность сегмента VL и/или JL), которые содержат замены по меньшей мере одного негистидинового кодона на гистидиновый кодон (в некоторых случаях, также может упоминаться как "замена гистидина", "замена гистидинового кодона" или тому подобное). Согласно одному варианту осуществления животное содержит по меньшей мере одну замену негистидинового кодона на гистидиновый кодон в нуклеотидной последовательности определяющей комплементарность области (CDR; например, CDR1, CDR2 и/или CDR3) легкой цепи иммуноглобулина человека. Согласно одному варианту осуществления замена происходит в кодоне CDR3. Согласно одному варианту осуществления легкая цепь представляет собой легкую цепь κ. Согласно одному варианту осуществления животное экспрессирует легкую цепь иммуноглобулина, например, CDR легкой цепи, например, CDR3 легкой цепи, содержащую замену по меньшей мере одной аминокислоты на гистидин. Согласно другому варианту осуществления легкая цепь представляет собой легкую цепь λ. Согласно еще одному варианту осуществления мышь содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в обеих легких цепях κ и λ.
Остаток гистидина кодируется двумя различными кодонами, CAT и CAC (остатки дезоксирибонуклеиновой кислоты). Таким образом, негистидиновый кодон может быть заменен CAT или CAC. Замену встраивают в кодон, который в его конфигурации зародышевой линии (т.е. несоматически мутировавшем состоянии) не кодирует остаток гистидина.
Согласно одному варианту осуществления легкая цепь представляет собой универсальную легкую цепь (также называемую общей легкой цепью). Как описано в заявке на патент США №13/022759, 13/093156, 13/412936 и 13/488628 (опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492), отличное от человека животное (например, мышь), которое выбирает общую легкую цепь для множества тяжелых цепей, характеризуется практической ценностью. Согласно различным вариантам осуществления антитела, экспрессируемые у отличного от человека животного, содержащего только общую легкую цепь, будут содержать тяжелые цепи, которые могут ассоциировать и экспрессировать с идентичной или по существу идентичной легкой цепью. Это особенно применимо при получении биспецифических антител. Например, такое животное может быть иммунизировано первым иммуногеном для производства В-клетки, которая экспрессирует антитело, которое специфически связывается с первым эпитопом. Животное (или генетически такое же животное) может быть иммунизировано вторым иммуногеном для производства В-клетки, которая экспрессирует антитело, которое специфически связывается со вторым эпитопом. Вариабельные области тяжелой цепи могут быть клонированы из В-клеток и экспрессированы с константной областью той же тяжелой цепи и той же легкой цепи (например, общая легкая цепь) в клетке, чтобы получить биспецифическое антитело, причем компонент тяжелой цепи биспецифического антитела был выбран животным, чтобы ассоциировать и экспрессировать с тем же компонентом легкой цепи. Согласно различным описанным вариантам осуществления вариабельные области генетически сконструированных мышей представляют собой вариабельные области человека.
Таким образом, была сконструирована мышь, которая способна производить легкие цепи иммуноглобулина, которые будут соответствующим образом образовывать пары с довольно разнообразным семейством тяжелых цепей, включающим в себя тяжелые цепи, чьи человеческие вариабельные области отклоняются от последовательностей зародышевой линии, например, с созревшей аффинностью или соматически мутировавшие вариабельные области. Согласно различным вариантам осуществления мышь разрабатывают для того, чтобы образовывать пары вариабельных доменов легкой цепи человека с вариабельными доменами тяжелой цепи человека, которые содержат соматические мутации, таким образом, делая возможным доступ к высокоаффинным связывающим белкам, пригодным для использования в качестве человеческих терапевтических средств.
Подвергнутая генной инженерии мышь через длительный и сложный процесс отбора антител в организме делает соответствующий биологический выбор в образовании пары разнообразной коллекции вариабельных доменов тяжелой цепи человека с ограниченным числом вариантов легкой цепи человека. Для того чтобы достичь этого, мышь конструируют так, чтобы представить ограниченное число вариантов вариабельных доменов легкой цепи человека в сочетании с широким разнообразием вариантов вариабельных доменов тяжелой цепи человека. После сенсибилизации иммуногеном мышь максимизирует число решений в своем репертуаре для получения антитела к иммуногену, ограничиваясь в основном или исключительно количеством или вариантами легкой цепи в своем репертуаре. Согласно различным вариантам осуществления это включает в себя возможность для мыши достижения подходящих и совместимых соматических мутаций в вариабельном домене легкой цепи, которые будут, тем не менее, совместимы с относительно большим разнообразием вариабельных доменов тяжелой цепи человека, включающим в себя, в частности, соматически мутировавшие вариабельные домены тяжелой цепи человека.
Сконструированная мышь с общей легкой цепью, описанная в опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, содержала последовательность нуклеиновой кислоты, кодирующую ограниченный репертуар вариантов легкой цепи, например, общую или универсальную легкую цепь "ULC", которая содержала не более двух сегментов VL или единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека. Для достижения такого ограниченного репертуара мышь конструировали для того, чтобы привести в нефункциональное или по существу в нефункциональное состояние ее способность создавать или реаранжировать нативный вариабельный домен легкой цепи мыши. Согласно одному аспекту это было достигнуто, например, путем удаления генных сегментов вариабельной области легкой цепи мыши. Как описано ранее, эндогенный локус мыши может быть затем модифицирован с помощью выбранных экзогенных подходящих генных сегментов вариабельной области легкой цепи человека, функционально связанных с эндогенным константным доменом легкой цепи мыши, таким образом, чтобы экзогенные генные сегменты вариабельной области человека можно было комбинировать с эндогенным геном константной области легкой цепи мыши и образовывать реаранжированный обратный химерный ген легкой цепи (человеческий вариабельный, мышиный константный). Согласно различным вариантам осуществления вариабельная область легкой цепи может быть соматически мутировавшей. Согласно различным вариантам осуществления для того, чтобы максимизировать способность вариабельной области легкой цепи приобретать соматические мутации, соответствующий энхансер(ы) сохраняется у мыши. Согласно одному аспекту в модификации локуса легкой цепи κ мыши для замены эндогенных генных сегментов легкой цепи κ мыши генными сегментами легкой цепи κ человека, функционально поддерживаются или не разрушаются интронный энхансер κ мыши и 3ʹ энхансер.
Таким образом, предусмотрена подвергнутая генной инженерии мышь, которая экспрессирует ограниченный репертуар обратных химерных (человеческая вариабельная, мышиная константная) легких цепей, ассоциированных с разнообразием обратных химерных (человеческая вариабельная, мышиная константная) тяжелых цепей. Согласно различным вариантам осуществления эндогенные генные сегменты легкой цепи κ мыши удаляют и заменяют одной (или двумя) реаранжированной областью легкой цепи человека, функционально связанной с эндогенным геном Сκ мыши. Согласно вариантам осуществления для максимизации соматической гипермутации реаранжированной области легкой цепи человека, поддерживаются интронный энхансер κ мыши и 3ʹ энхансер мыши. Согласно различным вариантам осуществления мышь также содержит нефункциональный локус легкой цепи λ или его делецию, или делецию, которая приводит локус в состояние не возможности производить легкую цепь λ.
Мышь с универсальной легкой цепью производила антитела в ответ на различные антигены, которые были способны использовать разнообразный репертуар последовательностей вариабельных областей тяжелых цепей, содержащих разнообразный репертуар сегментов VH, DH и JH. Антитела, произведенные такой подвергнутой генной инженерии ULC мышью, применимы для разработки биспецифических терапевтических антител; однако, как с любым другим антителом, каждое биспецифическое антитело может связываться только с одной мишенью во время его жизни в плазме; антитело поглощается эндосомой и нацеливается на лизосомальную деградацию. Исследования показали, что FcRn рецептор Fcγ подобный MHC класса I способен спасти иммуноглобулины от лизосомальной деградации путем рециркулирования его обратно к клеточной поверхности из сортирующей эндосомы.
Simister and Mostov (1989) An Fc receptor structurally related to MHC class I antigens. Nature 337:184-87. Как описано выше, для повышения эффективности рециркулирования антител полезны дополнительные модификации последовательностей антител, например, модификации, которые приводят к снижению связывания антигена при кислом значении pH (например, pH эндосомы), при этом сохраняя аффинность и специфичность антиген-антитела при нейтральном значении pH (например, значении pH таких жидкостей тела, как кровь). Описанные в настоящем документе отличные от человека животные, у которых остатки гистидина заменяют негистидиновые остатки в последовательности универсальной легкой цепи, полезны, так как они способны производить высокоаффинные антитела, основанные на формате универсальной легкой цепи, которые также отражают зависимое от pH связывание, например, отражают сниженное связывание с антигеном при кислом значении pH против нейтрального значения pH.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрено отличное от человека животное (например, грызун, например, мышь или крыса), которое содержит в своем геноме, например, в своей зародышевой линии, ограниченный репертуар вариабельных областей легких цепей человека или единственную вариабельную область легкой цепи человека из ограниченного репертуара вариабельных генных сегментов легкой цепи человека, причем вариабельная область(и) легкой цепи человека содержит по меньшей мере одну замену негистидинового кодона на гистидиновый кодон. Согласно некоторым вариантам осуществления предусмотрены отличные от человека животные, которые подвергнуты генной инженерии, чтобы включить единственный нереаранжированный генный сегмент вариабельной области легкой цепи человека (или два генных сегмента вариабельной области легкой цепи человека), который реаранжирует для того, чтобы образовать реаранжированный ген вариабельной области легкой цепи человека (или два реаранжированных гена вариабельной области легкой цепи), который экспрессирует единственную легкую цепь (или которые экспрессируют одну или обе из двух легких цепей), причем ген(ы) вариабельной области легкой цепи содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Реаранжированные вариабельные домены легкой цепи человека, кодируемые этим геном(ами) вариабельной области легкой цепи с замененным гистидином способны образовывать пару с множеством тяжелых цепей человека с созревшей аффинностью, выбранных с помощью животных, причем вариабельные области тяжелой цепи специфически связываются с различными эпитопами. Согласно различным вариантам осуществления по меньшей мере одна замена негистидинового остатка на остаток гистидина приводит к реаранжированной легкой цепи человека, которая, при экспрессии с родственной тяжелой цепью, связывается со своим антигеном зависимым от pH образом.
Предусмотрены подвергнутые генной инженерии животные, которые экспрессируют ограниченный репертуар вариабельных доменов легкой цепи человека или единственный вариабельный домен легкой цепи человека из ограниченного репертуара генных последовательностей вариабельной области легкой цепи человека, причем генные последовательности вариабельной области содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон. Согласно некоторым вариантам осуществления предусмотрены животные, которых подвергли генной инженерии, чтобы включить единственную V/J последовательность легкой цепи человека (или две последовательности V/J), которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон и экспрессирует вариабельную область единственной легкой цепи (или которые экспрессируют одну или обе из двух вариабельных областей). Согласно одному аспекту содержащая вариабельную последовательность легкая цепь способна образовывать пару с множеством тяжелых цепей человека с созревшей аффинностью, клонально выбранных с помощью животного, причем вариабельные области тяжелой цепи специфически связываются с различными эпитопами. Согласно одному варианту осуществления антитело связывается со своим антигеном(ами) зависимым от pH образом. Согласно одному варианту осуществления единственную последовательность V/J легкой цепи человека выбирают из Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления две последовательности V/J представляют собой Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1 представляют собой реаранжированные последовательности V/J.
Согласно одному аспекту предусмотрено генетически модифицированное отличное от человека животное, которое содержит единственный генный сегмент VL легкой цепи иммуноглобулина человека, который способен к реаранжировке с генным сегментом JL человека (выбранного из одного или множества сегментов JL) и кодированию вариабельного домена человека легкой цепи иммуноглобулина, причем единственный генный сегмент VL легкой цепи иммуноглобулина человека и/или генный сегмент JL человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно другому аспекту предусмотрена генетически модифицированная мышь, которая содержит не более двух генных сегментов VL человека, каждый из которых способен к реаранжировке с генным сегментом JL человека (выбранным из одного или множества сегментов JL) и кодированию вариабельного домена человека легкой цепи иммуноглобулина, причем каждый из не более двух генных сегментов VL и/или генный сегмент JL содержат замену по меньшей мере одного негистидинового остатка на гистидиновый остаток.
Кроме того, в настоящем документе предусмотрено генетически модифицированное отличное от человека животное, которое содержит в своем геноме, например, в своей зародышевой линии, единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую последовательности VL и JL человека, причем единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному аспекту единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из генных последовательностей VL и JL зародышевой линии человека, но вместо гистидиновой замены(замен). Согласно одному варианту осуществления легкая цепь иммуноглобулина человека представляет собой цепь κ иммуноглобулина человека. Таким образом, согласно одному варианту осуществления генную последовательность VL человека выбирают из Vκ1-39 и Vκ3-20. Согласно одному варианту осуществления единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит реаранжированную последовательность Vκ1-39/J или Vκ3-20/J. Согласно одному варианту осуществления генную последовательность JL человека выбирают из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5. Согласно одному варианту осуществления последовательность JL человека выбирают из Jκ1 и Jκ5. Согласно одному варианту осуществления единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека выбирают из Vκ1-39Jκ5 и Vκ3-20Jκ1 (например, но до гистидиновой замены(-)). Согласно альтернативному варианту легкая цепь иммуноглобулина человека представляет собой цепь λ человека.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей определяющую комплементарность область (CDR) вариабельного домена легкой цепи. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей CDR1, CDR2 или CDR3 вариабельного домена легкой цепи. Согласно одному конкретному варианту осуществления замена происходит в кодирующей CDR3 нуклеотидной последовательности.
Согласно одному аспекту замена представляет собой замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в кодоне CDR3 генной последовательности вариабельной области легкой цепи человека. Согласно одному варианту осуществления замена представляет собой замену одного, двух, трех, четырех или более кодонов CDR3. Согласно варианту осуществления, в котором единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека представляет собой вариабельную область Vκ1-39Jκ5, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон содержит замещение в положении в генной последовательности легкой цепи иммуноглобулина, кодирующей CDR3, разработанное для экспрессии гистидина в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидина в положениях 105 и 106. Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидина в положениях 105 и 111 Согласно одному варианту осуществления замещение разрабатывают экспрессии гистидина в положениях 105 и 108. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106 и 108 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106 и 108. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106, 108 и 111. Согласно еще одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106, 108 и 111 Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106 и 111. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106, 108 и 111. Последовательности нуклеиновых кислот и аминокислот из областей с замененным гистидином изображены на выравнивании последовательностей на фиг. 16 и приведены в SEQ ID NO: 327-357.
Согласно варианту осуществления, в котором единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека представляет собой вариабельную область Vκ3-20Jκ1, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон содержит замещение в положении в генной последовательности легкой цепи иммуноглобулина, кодирующей область CDR3, которое разрабатывают для экспрессии гистидина в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105 и 106. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 107 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106 и 107. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 107 и 109. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 106, 108 и 111. Согласно одному варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106 и 109. Согласно другому варианту осуществления замещение разрабатывают для экспрессии гистидина в положениях 105, 106, 107 и 109. Последовательности нуклеиновых кислот и аминокислот иллюстративных областей с замененным гистидином изображены на выравнивании последовательностей на фиг. 27 и приведены в SEQ ID NO: 398-403.
Положения аминокислот (105, 106 и т.д.) основаны на уникальной нумерации, описанной в Lefranc et al. (2003) Dev. Comp. Immunol. 27:55-77, а также ее можно увидеть на www.imgt.org.
Согласно одному варианту осуществления генный сегмент VL человека функционально связан с человеческой или отличной от человеческой лидерной последовательностью. Согласно одному варианту осуществления лидерная последовательность представляет собой отличную от человеческой лидерную последовательность. Согласно конкретному варианту осуществления отличная от человеческой лидерная последовательность представляет собой лидерную последовательность Vκ3-7 мыши. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с реаранжированной последовательностью VL/JL человека. Таким образом, согласно одному конкретному варианту осуществления единственная реаранжированная генная последовательность вариабельной области Vκ1-39/Jκ5 или Vκ3-20/Jκ1, содержащая по меньшей мере одну замену гистидина, функционально связана с лидерной последовательностью Vκ3-7 мыши.
Согласно одному варианту осуществления генный сегмент VL функционально связан с промоторной последовательностью иммуноглобулина. Согласно одному варианту осуществления промоторная последовательность представляет собой промоторную последовательность человека. Согласно конкретному варианту осуществления промотор иммуноглобулина человека представляет собой промотор Vκ3-15 человека. Согласно конкретному варианту осуществления промотор функционально связан с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления промотор функционально связан с реаранжированной последовательностью VL/JL человека. Таким образом, согласно одному конкретному варианту осуществления единственная реаранжированная генная последовательность вариабельной области Vκ1-39/Jκ5 или Vκ3-20/Jκ1, содержащая по меньшей мере одну замену гистидина, функционально связана с промотором Vκ3-15 человека.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность с примыкающим со стороны 5ʹ (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и с примыкающим со стороны 3ʹ генным сегментом VL человека, который реаранжирует с сегментом JL человека и кодирует вариабельный домен обратной химерной легкой цепи, содержащей эндогенную отличную от человеческой константную область (CL) легкой цепи. Согласно конкретному варианту осуществления генные сегменты VL и JL находятся в отличном от человеческого локусе Vκ, и отличная от человеческой CL представляет отличную от человеческой Сκ (например, Сκ мыши).
Согласно одному конкретному варианту осуществления последовательность вариабельной области функционально связана с отличной от человеческой последовательностью константной области, например, отличной от человеческой генной последовательностью Сκ.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность с примыкающим со стороны 5ʹ (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и с примыкающей со стороны 3ʹ реаранжированной последовательностью вариабельной области человека (последовательность VL/JL), и кодирует вариабельный домен обратной химерной легкой цепи, содержащей эндогенную отличную от человеческой константную область (CL) легкой цепи. Согласно конкретному варианту осуществления реаранжированная последовательность человека VL/JL находится в отличном от человеческого локусе каппа (κ), и отличная от человеческой CL представляет собой отличную от человеческой Сκ. Согласно одному конкретному варианту осуществления реаранжированная последовательность вариабельной области человека функционально связана с отличной от человеческой последовательностью константной области легкой цепи иммуноглобулина, например, с отличной от человеческой генной последовательностью Сκ. Согласно одному варианту осуществления отличная от человеческой последовательность константной области легкой цепи иммуноглобулина представляет собой эндогенную отличную от человеческой последовательность. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь, и генная последовательность Сκ представляет собой генную последовательность Сκ мыши. Согласно одному варианту осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, представляет собой эндогенный отличный от человеческого (например, мышиный) локус легкой цепи иммуноглобулина (локус κ). Иллюстративные варианты осуществления локуса представлены на фиг. 23C, 23E, 29C и 29D.
Согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой мышь, и локус вариабельной области мыши представляет собой локус легкой цепи κ, и локус легкой цепи κ содержит интронный энхансер κ мыши, 3ʹ энхансер к мыши или как интронный энхансер, так и 3ʹ энхансер.
Согласно одному варианту осуществления отличное от человека животное (например, грызун, например, крыса или мышь) содержит нефункциональный локус легкой цепи лямбда (λ) иммуноглобулина. Согласно конкретному варианту осуществления локус легкой цепи λ содержит делецию одной или нескольких последовательностей локуса, причем одна или несколько делеций делает локус легкой цепи λ неспособным к реаранжировке для образования гена легкой цепи. Согласно другому варианту осуществления все или по существу все генные сегменты VL локуса легкой цепи λ удаляются. Согласно одному варианту осуществления отличное от человека животное (например, грызун, например, мышь или крыса) содержит реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина, например, эндогенную нереаранжированную вариабельную область легкой цепи. Согласно одному варианту осуществления реаранжированная генная последовательность с замещенным гистидином вариабельной области легкой цепи иммуноглобулина человека замещает эндогенную нереаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина.
Согласно одному варианту осуществления животное производит легкую цепь, которая содержит соматически мутировавший вариабельный домен, полученный из последовательности вариабельной области человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления легкая цепь содержит соматически мутировавший вариабельный домен, полученный из последовательности вариабельной области человека, которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон и отличную от человеческой область Сκ. Согласно одному варианту осуществления отличное от человека животное не экспрессирует легкую цепь λ.
Специалисту в настоящей области техники должно быть понятно, что, хотя замена(ы) по меньшей мере одного негистидинового остатка на остаток гистидина генетически встраивается в вариабельную область легкой цепи иммуноглобулина человека в результате соматических гипермутаций, не все антитела, которые производятся в генетически модифицированном отличном от человека животном, будут содержать этот остаток(ки) гистидина во встроенном положении(ях). Тем не менее, поколение широкого репертуара антител у отличного от человека животного позволит выбирать для in vivo произведенные антиген-специфические антитела, которые показывают высокую аффинность к представляющему интерес антигену, при этом сохраняя модификации гистидина, введенного в зародышевую линию, и, таким образом, демонстрируя зависимое от pH связывание антигена.
Таким образом, согласно одному варианту осуществления животное сохраняет по меньшей мере замену по меньшей мере одной негистидиновой аминокислоты на гистидин. Согласно одному варианту осуществления животное сохраняет все или по существу все гистидиновые замены в своем соматически мутировавшем вариабельном домене легкой цепи, которые были введены в его ген вариабельной области.
Согласно одному варианту осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное также содержит в своем геноме, например, в своей зародышевой линии, нереаранжированную вариабельную область тяжелой цепи иммуноглобулина, содержащую последовательности генных сегментов VH, DH и JH. Согласно одному варианту осуществления последовательности генных сегментов VH, DH и JH представляют собой последовательности генных сегментов VH, DH и JH человека, и нереаранжированная вариабельная область тяжелой цепи иммуноглобулина представляет собой вариабельную область тяжелой цепи человека. Согласно одному варианту осуществления последовательности генных сегментов VH, DH и JH человека функционально связаны с отличной от человеческой последовательностью константной области тяжелой цепи. Согласно одному варианту осуществления отличая от человеческой последовательность константной области тяжелой цепи представляет собой эндогенную отличную от человеческой последовательность константной области тяжелой цепи. Согласно одному варианту осуществления последовательности генных сегментов тяжелой цепи человека находятся в эндогенном отличном от человеческого локусе тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления последовательность вариабельной области тяжелой цепи иммуноглобулина человека, содержащаяся в отличном от человека животном, также содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Согласно одному варианту осуществления описанное в настоящем документе отличное от человека животное экспрессирует легкую цепь иммуноглобулина, которая содержит отличную от человеческой последовательность константной области легкой цепи. Согласно одному варианту осуществления отличное от человека животное экспрессирует легкую цепь иммуноглобулина, которая содержит последовательность константной области легкой цепи человека.
Согласно одному варианту осуществления описанное в настоящем документе отличное от человека животное экспрессирует тяжелую цепь иммуноглобулина, которая содержит отличную от человеческой последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно одному варианту осуществления отличное от человека животное экспрессирует тяжелую цепь иммуноглобулина, которая содержит человеческую последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно варианту осуществления, где животное содержит единственную реаранжированную вариабельную область легкой цепи иммуноглобулина, содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, реаранжированная последовательность легкой цепи иммуноглобулина в зародышевой линии животного находится в эндогенном отличном от человека локусе легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина, содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в зародышевой линии животного, замещает все или по существу все эндогенные отличные от человеческих последовательности сегментов V и J легкой цепи в эндогенном отличном от человеческого локусе легкой цепи иммуноглобулина.
Согласно одному варианту осуществления отличное от человека животное содержит замещение эндогенных генных сегментов VH одним или несколькими генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с отличным от человеческого геном области CH, так, что отличное от человека животное реаранжирует генные сегменты VH человека и экспрессирует обратную химерную тяжелую цепь иммуноглобулина, которая содержит домен VH человека и отличный от человеческого CH. Согласно одному варианту осуществления 90-100% нереаранжированных отличных от человеческих генных сегментов VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все (например, 90-100%) отличные от человеческих генные сегменты VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещения составляют по меньшей мере 19, по меньшей мере 39 или по меньшей мере 80 или 81 нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления замещения составляют по меньшей мере 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере 25 функциональных нереаранжированных генных сегментов VH человека или по меньшей мере 43 функциональных нереаранжированных генных сегмента VH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH по меньшей мере одним нереаранжированным сегментом DH человека и по меньшей мере одним нереаранжированным сегментом JH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH всеми переаранжированными сегментами DH человека и всеми переаранжированными сегментами JH человека.
Отличное от человека животное, например, мышь, содержащее в своем геноме, например, в своей зародышевой линии, ограниченный репертуар вариабельных областей легкой цепи иммуноглобулина человека, например, единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека (например, Vκ-39/Jκ5 или Vκ3-20/Jκ1), с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон и разнообразным репертуаром нереаранжированных сегментов VH, DH и JH человека, способно производить антигенсвязывающие белки, кодируемые последовательностями вариабельной области тяжелой цепи, полученными из различных перестановок нереаранжированных сегментов VH, DH и JH человека, причем сегменты VH, DH и JH, присутствующие в вариабельных последовательностях тяжелой цепи, получают из всех или по существу всех функциональных сегментов VH, DH и JH человека, присутствующих в геноме животного. Различные доступные возможности для последовательностей вариабельных доменов тяжелой цепи, экспрессируемых в клетках, например, В-клетках, описанных в настоящем документе генетически модифицированных животных (то есть, полученных из комбинации различных функциональных сегментов VH, DH и JH человека), описаны в опубликованной заявке США №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492. Согласно различным вариантам осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон и нереаранжированная последовательность вариабельной области тяжелой цепи иммуноглобулина человека содержатся в зародышевой линии отличного от человека животного.
Согласно одному варианту осуществления отличное от человека животное содержит одну копию одной или обеих из реаранжированных последовательностей вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека. Согласно другому варианту осуществления отличное от человека животное содержит две копии одной или обеих из реаранжированных последовательностей вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека. Таким образом, отличное от человека животное может быть гомозиготным или гетерозиготным по одной или обеим реаранжированным последовательностям вариабельной области легкой цепи иммуноглобулина человека, содержащей замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированной последовательности вариабельной области тяжелой цепи иммуноглобулина человека.
В дополнение к генетически модифицированным отличным от человека животным, содержащим в своем геноме генную последовательность вариабельной области легкой цепи иммуноглобулина (например, единственную реаранжированную генную последовательность вариабельной области легкой цепи иммуноглобулина), содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон (например, в CDR3 легкой цепи), также в настоящем документе предусмотрены генетически модифицированные отличные от человека животные, содержащие генную последовательность вариабельной области легкой цепи иммуноглобулина с одним или несколькими добавлениями гистидинового кодона(ов), таким образом, что экспрессируемый вариабельный домен содержит дополнительную аминокислоту(ы), которая, если не подлежит соматической гипермутации, представляет собой гистидин.
Описанное в настоящем документе генетически модифицированное отличное от человека животное, содержащее генную последовательность вариабельной области легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон, может быть выбрано из группы, состоящей из мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса). Для отличных от человека животных, где подходящие генетически модифицированные клетки ES не относятся к легко доступным, используют отличные от описанных в настоящем документе способы для получения отличного от человека животного, содержащего генетическую модификацию. Такие способы включают в себя, например, модификацию генома не-ES клетки (например, фибробластов или индуцированных плюрипотентных клеток) и использование метода переноса ядра для переноса модифицированного генома в подходящую клетку, например, яйцеклетку, и постепенное формирование модифицированной клетки (например, модифицированного ооцита) в отличном от человека животном при подходящих условиях с образованием эмбриона.
Согласно одному аспекту отличное от человека животное представляет собой млекопитающее. Согласно одному аспекту отличное от человека животное представляет собой мелкое млекопитающее, например, из надсемейства Dipodoidea или Muroidea. Согласно одному варианту осуществления генетически модифицированное животное представляет собой грызуна. Согласно одному варианту осуществления грызуна выбирают из мыши, крысы и хомяка. Согласно одному варианту осуществления грызуна выбирают из надсемейства Muroidea. Согласно одному варианту осуществления генетически модифицированные животное представляет собой животное из семейства, выбранного из Calomyscidae (например, мышевидные хомячки), Cricetidae (например, хомячок, крысы и мыши Нового Света, полевки), Muridae (истинные мыши и крысы, песчанки, колючие мыши, хохлатые крысы), Nesomyidae (рипидомисы, скальные мыши, белохвостые крысы, Малагасийские крысы и мыши), Platacanthomyidae (например, колючие соневидные хомяки) и Spalacidae (например, кроты, бамбуковые крысы и цокоры). Согласно конкретному варианту осуществления генетически модифицированного грызуна выбирают из истинной мыши или крысы (семейство Muridae), песчанки, колючей мыши и косматого хомяка. Согласно одному варианту осуществления генетически модифицированная мышь представляет собой представителя семейства Muridae. Согласно одному варианту осуществления животное представляет собой грызуна. Согласно конкретному варианту осуществления грызуна выбирают из мыши и крысы. Согласно одному варианту осуществления отличное от человека животное представляет собой мышь.
Согласно конкретному варианту осуществления отличное от человека животное представляет собой грызуна, который представляет собой мышь линии C57BL, выбранной из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/O1a. Согласно другому варианту осуществления мышь представляет собой мышь линии 129, выбранной из группы, состоящей из линии, которая представляет собой 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 129S1/SV, 129S1/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129Т1, 129Т2 (смотрите, например, Festing et al. (1999) Revised nomenclature for strain 129 mice, Mammalian Genome 10:836, смотрите также Auerbach et al. (2000) Establishment and Chimera Analysis of 129/SvEv-and C57BL/6-Derived Mouse Embryonic Stem Cell Lines). Согласно конкретному варианту осуществления генетически модифицированная мышь представляет собой сочетание вышеуказанной линии 129 и вышеуказанной линии C57BL/6. Согласно другому конкретному варианту осуществления мышь представляет собой сочетание вышеуказанных линий 129 или сочетание вышеуказанных линий BL/6. Согласно конкретному варианту осуществления линия 129 сочетания представляет собой линию 129S6 (129/SvEvTac). Согласно другому варианту осуществления мышь представляет собой линию BALB, например, линию BALB/C. Согласно еще одному варианту осуществления мышь представляет собой сочетание линии BALB и другой вышеуказанной линии.
Согласно одному варианту осуществления отличное от человека животное представляет собой крысу. Согласно одному варианту осуществления крысу выбирают из крысы линии Wistar, линии LEA, линии Sprague Dawley, линии Fischer, F344, F6 и Dark Agouti. Согласно одному варианту осуществления линия крысы представляет собой сочетание двух или более линий, выбранных из группы, состоящей из Wistar, Lea, Sprague Dawley, Fischer, F344, F6 и Dark Agouti.
Таким образом, согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой грызуна. Согласно одному варианту осуществления генетически модифицированное отличное от человека животное представляет собой крысу или мышь. Согласно одному варианту осуществления животное представляет собой мышь. Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрена генетически модифицированная мышь, содержащая в своем геноме, например, в своей зародышевой линии, единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека, содержащую генные последовательности VL и JL человека, причем единственная реаранжированная вариабельная область легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления мышь не содержит функциональную нереаранжированную вариабельную область легкой цепи иммуноглобулина (например, отсутствуют функциональные нереаранжированные последовательности генных сегментов V и J). Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи иммуноглобулина человека с гистидиновым замещением(ями) кодона представляет собой вариабельную область Vκ1-39/Jκ или Vκ3-20/Jκ. Согласно одному варианту осуществления последовательность сегмента J выбирают из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5. Согласно одному варианту осуществления последовательность сегмента J представляет собой Jκ1 или Jκ5. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности кодирующей области CDR3. Согласно одному варианту осуществления, в котором реаранжированная последовательность вариабельной области представляет собой последовательность Vκ1-39/Jκ5, замену(ы) гистидина разрабатывают для экспрессии в положении, выбранном из 105, 106, 108, 111 и их комбинации. Согласно другому варианту осуществления, в котором реаранжированная последовательность вариабельной области представляет собой последовательность Vκ3-20/Jκ1, замену(ы) гистидина разрабатывают для экспрессии в положении, выбранном из 105, 106, 107, 109 и их комбинации. Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи иммуноглобулина с замененным гистидиновым кодоном(ами) функционально связана с эндогенной генной последовательностью константной области иммуноглобулина мыши (например, генной последовательностью Сκ). Согласно одному варианту осуществления мышь дополнительно содержит в своем геноме, например, в своей зародышевой линии, нереаранжированную вариабельную область тяжелой цепи иммуноглобулина, содержащую сегменты VH, DH и JH человека. Согласно одному варианту осуществления сегменты VH, DH и JH человека функционально связаны с эндогенной генной последовательностью константной области иммуноглобулина мыши. Согласно различным вариантам осуществления реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека, содержащая замену(ы) по меньшей мере одного негистидинового кодона на гистидиновый кодон, и нереаранжированная последовательность вариабельной области тяжелой цепи иммуноглобулина человека содержатся в зародышевой линии мыши.
Также в настоящем документе предусмотрены нацеливающие векторы для создания описанных в настоящем документе генетически модифицированных отличных от человека животных, например мышей. Согласно одному аспекту предусмотрен нацеливающий вектор, содержащий от 5ʹ к 3ʹ в направлении транскрипции по отношению к последовательностям 5ʹ и 3ʹ плечей гомологии мыши вектора, 5ʹ плечо гомологии мыши, промотор иммуноглобулина человека или мыши, лидерную последовательность человека или мыши, вариабельную область человека, выбранную из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20Jκ1 человека, и содержащую замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и 3ʹ плечо гомологии мыши. Согласно одному варианту осуществления 5ʹ и 3ʹ плечи гомологии нацеливают вектор на 5ʹ последовательность по отношению к энхансерной последовательности, которая присутствует на 5ʹ и проксимальна гену Сκ мыши. Согласно другому варианту осуществления нацеливающий вектор содержит 5ʹ плечо гомологии мыши, за которым следует кассета отбора, к которой примыкают сайты рекомбинации, промотор иммуноглобулина человека или мыши, лидерная последовательность человека или мыши, вариабельная область человека, выбранная из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20Jκ1 человека, и содержащая замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, за которой следует 3ʹ плечо гомологии мыши, которое содержит энхансеры и последовательности константной области (Сκ) мыши.
Кассета отбора представляет собой нуклеотидную последовательность, вставленную в нацеливающий конструкт для облегчения отбора клеток (например, клеток ES), которую интегрировали в представляющий интерес конструкт. Некоторое количество подходящих кассет отбора известно в настоящей области техники. Как правило, кассета отбора дает возможность положительного отбора в присутствии определенного антибиотика (например, Neo, HYG, Pur, CM, Spec и т.д.). Кроме того, кассета отбора может быть окружена сайтами рекомбинации, которые позволяют удалять кассету отбора при обработке ферментами рекомбиназы. Обычно используются такие сайты рекомбинации, как LoxP и Frt, узнаваемые ферментами Cre и Flp, соответственно, но в настоящей области техники известны и другие.
Согласно одному варианту осуществления промотор представляет собой промотор генного сегмента вариабельной области иммуноглобулина человека. Согласно конкретному варианту осуществления промотор представляет собой промотор Vκ3-15 человека. Согласно одному варианту осуществления лидерная последовательность представляет собой лидерную последовательность мыши. Согласно конкретному варианту осуществления лидерная последовательность мыши представляет собой лидерную последовательность Vκ3-7 мыши. Иллюстративные варианты осуществления нацеливающих векторов представлены на фиг. 23В и 29В.
Согласно одному аспекту в настоящем документе предусмотрен описанный выше нацеливающий вектор, но вместо 5ʹ плеча гомологии мыши к промотору человека или мыши с 5ʹ примыкает сайт узнавания сайт-специфической рекомбиназой (SRRS), а вместо 3ʹ плеча гомологии мыши к области VL человека с 3ʹ примыкает SRRS.
Также в настоящем документе предусмотрены способы получения описанных в настоящем документе генетически модифицированных отличных от человека животных (например, грызунов, например, мышей и крыс). Согласно одному аспекту в способе получения описанного в настоящем документе генетически модифицированного отличного от человека животного используют нацеливающий вектор, полученный с использованием технологии VELOCIGENE®, который вносит конструкт в ES клетки, и вносит нацеленные клоны ES клеток в эмбрион мыши с использованием технологии VELOCIGENE®, как описано в примерах. Гистидиновые модификации могут быть введены в нацеливающий вектор с использованием различных техник молекулярной биологии, например, с помощью сайт-направленного мутагенеза или синтеза ДНК de novo. После завершения нацеливания генов ES клетки генетически модифицированных отличных от человека животных подвергают скринингу для подтверждения успешного включения представляющей интерес экзогенной нуклеотидной последовательности или экспрессии экзогенного полипептида. Специалистам в настоящей области техники известны многочисленные техники, которые включают в себя (но без ограничения) Саузерн-блоттинг, длинную ПЦР, количественную ПЦР (например, ПЦР в реальном времени с использованием TAQMAN®), флуоресцентную гибридизацию in situ, Нозерн-блоттинг, проточную цитометрию, Вестерн анализ, иммуноцитохимию, иммуногистохимию и т.д. В одном примере отличные от человека животные (например, мыши), несущие представляющую интерес генетическую модификацию, могут быть идентифицированы путем скрининга уменьшения аллеля мыши и/или увеличения аллеля человека с использованием модификации анализа аллелей, описанной в Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659. Другие анализы, которые идентифицируют специфическую нуклеотидную или аминокислотную последовательность у генетически модифицированных животных, известны специалистам в настоящей области техники.
Таким образом, согласно одному варианту осуществления способ получения генетически модифицированных отличных от человека животных предусматривает замещение генной последовательности вариабельной области легкой цепи иммуноглобулина у животного генной последовательностью вариабельной области легкой цепи иммуноглобулина человека (содержащей генные сегменты VL и JL человека), причем генная последовательность вариабельной области иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон происходит в нуклеотидной последовательности, кодирующей область CDR, например, область CDR3.
Согласно одному варианту осуществления способ получения описанных в настоящем документе генетически модифицированных отличных от человека животных предусматривает замещение генной последовательности вариабельной области легкой цепи иммуноглобулина у животного единственной реаранжированной генной последовательностью вариабельной области легкой цепи иммуноглобулина человека, содержащей последовательности генных сегментов VL и JL человека, причем единственная реаранжированная генная последовательность вариабельной области иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления замена происходит в кодоне CDR. Согласно одному варианту осуществления замена происходит в одном, двух, трех, четырех или более кодоне(ах) CDR3. Согласно одному варианту осуществления единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека основана на реаранжированной последовательности вариабельной области легкой цепи зародышевой линии человека, выбранной из Vκ1-39Jκ5 и Vκ3-20Jκ1. Таким образом, согласно одному варианту осуществления, где единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из Vκ1-39Jκ5, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывают для экспрессии гистидина в положениях, выбранных из 105, 106, 108, 111 и их комбинации. Согласно одному варианту осуществления, где единственная реаранжированная генная последовательность вариабельной области легкой цепи иммуноглобулина человека происходит из Vκ3-20κ1, замещение по меньшей мере одного негистидинового кодона на гистидиновый кодон разрабатывают для экспрессии гистидина в положениях, выбранных из 105, 106, 107, 109 и их комбинации.
Согласно другому варианту осуществления способ получения описанного в настоящем документе отличного от человека животного (т.е. содержащего описанный в настоящем документе генетически модифицированный локус легкой цепи иммуноглобулина) предусматривает модификацию генома отличного от человека животного для удаления или приведение в нефункциональное состояние эндогенных сегментов V и J легкой цепи иммуноглобулина в локусе легкой цепи иммуноглобулина, и размещение в геноме единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Согласно одному варианту осуществления способ приводит к генетически модифицированному отличному от человека животному, которое содержит популяцию В-клеток, обогащенных антителами, проявляющими зависимое от pH связывания с представляющим интерес антигеном.
Согласно некоторым вариантам осуществления способы получения описанных в настоящем документе генетически модифицированных отличных от человека животных предусматривают замещение генной последовательности вариабельной области легкой цепи иммуноглобулина последовательностью человека у животного, которое также содержит замещение эндогенной отличной от человеческой генной последовательности вариабельной области тяжелой цепи иммуноглобулина генной последовательностью вариабельной области тяжелой цепи иммуноглобулина человека, содержащей по меньшей мере один из каждого или репертуар описанных выше последовательностей VH, DH, и JH человека. Согласно одному варианту осуществления для того, чтобы получить отличное от человека животное, содержащее замещение эндогенной генной последовательности вариабельной области легкой цепи иммуноглобулина генной последовательностью вариабельной области легкой цепи человека, содержащей замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и замещение эндогенной отличной от человеческой генной последовательности вариабельной области тяжелой цепи иммуноглобулина генной последовательностью вариабельной области тяжелой цепи иммуноглобулина человека, животное с замещением генной последовательности вариабельной области легкой цепи скрещивают с животным с замещением генной последовательности вариабельной области тяжелой цепи.
Авторы настоящего изобретения предусматривают подвергнутых генной инженерии отличных от человека животных (например, грызунов, например, крыс и мышей), которые экспрессируют антигенсвязывающие белки, например, антитела, которые содержат универсальную легкую цепь, например, универсальную легкую цепь человека (например, легкую цепь, полученную из единственной реаранжированной вариабельной области легкой цепи иммуноглобулина человека), которая содержит одну или несколько модификаций гистидина, причем антигенсвязьшающие белки проявляют зависимое от pH связывания антигена-мишени. Животных подвергают генной инженерии для того, чтобы включить CDR3 легкой цепи, которая содержит одну или несколько модификаций гистидина. Согласно различным вариантам осуществления CDR3 легкой цепи содержит два, три или четыре, или более остатков гистидина в кластере.
Согласно одному варианту осуществления в настоящем документе предусмотрено подвергнутое генной инженерии отличное от человека животное, которое содержит популяцию антиген-специфических антител, которые экспрессируют остаток(ки) гистидина в результате модификаций кодонов в генной последовательности вариабельной области легкой цепи, и отображают зависимое от pH связывание антигена-мишени. Согласно одному варианту осуществления эти животные содержат популяцию В-клеток, которые обогащены антителами, например, антиген-специфическими антителами, которые отображают зависимые от pH связывающие свойства (например, снижение диссоциационного периода полувыведения (ti/г) при кислом значении pH, по сравнению с нейтральным значением pH), по сравнению с популяцией антиген-специфических антител, производимых у животных, которые не содержат замену по меньшей мере одного негистидинового кодона на гистидиновый кодон в описанной в настоящем документе вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления обогащение антиген-специфических антител, отображающих зависимые от pH антигенсвязывающие свойства, производимые у описанных в настоящем документе подвергнутых генной инженерии животных, по сравнению с аналогичными животными, которые содержат гистидиновые замены в вариабельной области легкой цепи, больше, чем приблизительно в 2 раза, например, больше, чем приблизительно в 5 раз, например, больше чем приблизительно в 10 раз. Таким образом, генетически модифицированные животные согласно настоящему изобретению обогащены антителами с улучшенными свойствами рециркуляции антител, которые желательны для уменьшения мишень-опосредованного клиренса, а также для снижения дозы и/или частоты приема терапевтического антигенсвязывающего белка, разработанного на основе такого полученного in vivo формата антител.
Таким образом, в настоящем документе предусмотрен антигенсвязьшающий белок, произведенный у описанных в настоящем документе генетически модифицированных отличных от человека животных, причем антигенсвязывающий белок отображает зависимое от pH связывание антигена. Согласно одному варианту осуществления антигенсвязывающий белок представляет собой антитело, например, антиген-специфическое антитело. Согласно одному варианту осуществления антитело содержит легкую цепь, которая содержит вариабельный домен легкой цепи человека, полученный из реаранжировки генных сегментов вариабельной области легкой цепи иммуноглобулина человека, где по меньшей мере один негистидиновый кодон заменен на гистидиновый кодон в генной последовательности зародышевой линии, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи человека. Согласно одному варианту осуществления антитело содержит легкую цепь, которая содержит вариабельный домен легкой цепи человека, полученный из единственной реаранжированной генной последовательности вариабельной области легкой цепи человека, причем единственная реаранжированная генная последовательность вариабельной области легкой цепи содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления антитело содержит легкую цепь, полученную из реаранжировки Vκ1-39Jκ5 или Vκ3-20Jκ1 человека, причем генная последовательность Vκ1-39Jκ5 или Vκ3-20Jκ1 человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и причем антитело сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно некоторым вариантам осуществления антитело сохраняет все или по существу все гистидиновые замены в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления замена представляет собой замену трех негистидиновых кодонов тремя кодонами гистидина в нуклеотидной последовательности, кодирующей CDR3 генной последовательности вариабельной области легкой цепи, и антитело сохраняет все три замены гистидина в своем экспрессированном вариабельном домене легкой цепи. Согласно одному варианту осуществления замена представляет собой замену четырех негистидиновых кодонов четырьмя кодонами гистидина в нуклеотидной последовательности, кодирующей CDR3 генной последовательности вариабельной области легкой цепи, и антитело сохраняет все четыре замены гистидина в своем экспрессированном вариабельном домене легкой цепи.
Согласно одному варианту осуществления легкая цепь антитела дополнительно содержит отличную от человеческой аминокислотную последовательность константной области легкой цепи, например, эндогенную аминокислотную последовательность константной области легкой цепи. Кроме того, антитело, например, антиген-специфическое антитело, производимое у описанного в настоящем документе генетически модифицированного отличного от человека животного, также содержит тяжелую цепь, которая содержит вариабельный домен тяжелой цепи человека, полученный из реаранжированных сегментов V, D и J тяжелой цепи человека. Сегменты V, D и J тяжелой цепи человека могут быть выбраны из репертуара сегментов тяжелых цепей человека, присутствующих в эндогенном отличном от человеческого локусе тяжелой цепи, например, по меньшей мере одного функционального сегмента V, по меньшей мере одного функционального сегмента D и по меньшей мере одного функционального сегмента J, например, до полного репертуара функциональных сегментов V, D и J человека. Иллюстративные возможные реаранжировки вариабельных сегментов тяжелой цепи человека можно почерпнуть из списка функциональных сегментов V, D, и J человека в базе данных IMGT и из опубликованных заявок США №2011/0195454, 2012/0021409, 2012/0192309 и 2013/0045492. Кроме того, согласно одному варианту осуществления тяжелая цепь антитела содержит отличную от человеческой аминокислотную последовательность константной области тяжелой цепи, например, эндогенную отличную от человеческой аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления отличная от человеческой константная область тяжелой цепи содержит домены CH1, шарнир, CH2 и CH3. Согласно одному варианту осуществления антитело представляет собой изотип IgG, IgE, IgD, IgM или IgA.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрен связывающий белок, производимый в описанных в настоящем документе генетически модифицированных отличных от человека животных, причем связывающий белок содержит обратную химерную легкую цепь, содержащую (а) вариабельный домен легкой цепи, полученный от реаранжировки Vκ1-39Jκ5 человека, содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем легкая цепь сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области легкой цепи, причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (а) вариабельный домен тяжелой цепи, полученный из реаранжированных сегментов V, D и J человека, причем сегменты V, D и J выбирают из репертуара сегментов V, D и J человека, присутствующих у животного, и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления репертуар сегментов V, D и J человека содержит по меньшей мере один функциональный сегмент V, по меньшей мере один функциональный сегмент D и по меньшей мере один функциональный сегмент J, например, до полного репертуара функциональных сегментов V, D и J человека. Согласно одному варианту осуществления константные домены тяжелой и легкой цепи представляют собой эндогенные константные области тяжелой и легкой цепей. Согласно одному варианту осуществления вариабельные домены тяжелой и легкой цепи представляют собой соматически мутировавшие домены. Согласно одному варианту осуществления соматически мутировавший домен легкой цепи сохраняет по меньшей мере одну замену гистидина, введенную в последовательность зародышевой линии. Согласно некоторым вариантам осуществления соматически мутировавший домен легкой цепи сохраняет все или по существу все гистидиновые замены, введенные в последовательность зародышевой линии. Согласно одному варианту осуществления антигенсвязывающий белок отображает зависимые от pH антигенсвязывающие свойства.
Согласно другому варианту осуществления в настоящем документе предусмотрен связывающий белок, производимый в описанных в настоящем документе генетически модифицированных отличных от человека животных, причем связывающий белок содержит обратную химерную легкую цепь, содержащую (а) вариабельный домен легкой цепи, полученный от реаранжировки Vκ3-20Jκ1 человека, содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, причем легкая цепь сохраняет по меньшей мере одну замену гистидина в своем экспрессированном вариабельном домене легкой цепи и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области легкой цепи, причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (а) вариабельный домен тяжелой цепи, полученный из реаранжированных сегментов V, D и J человека, причем сегменты V, D и J выбирают из репертуара сегментов V, D и J человека, присутствующих у животного, и (b) отличную от человеческой, например, мышиную, аминокислотную последовательность константной области тяжелой цепи. Согласно одному варианту осуществления репертуар сегментов V, D и J человека содержит по меньшей мере один функциональный сегмент V, по меньшей мере один функциональный сегмент D и по меньшей мере один функциональный сегмент J, например, до полного репертуара функциональных сегментов V, D и J человека. Согласно одному варианту осуществления константные домены тяжелой и легкой цепи представляют собой эндогенные константные области тяжелой и легкой цепей. Согласно одному варианту осуществления вариабельные домены тяжелой и легкой цепи представляют собой соматически мутировавшие домены. Согласно одному варианту осуществления соматически мутировавший домен легкой цепи сохраняет по меньшей мере одну замену гистидина, введенного в последовательность зародышевой линии. Согласно некоторым вариантам осуществления соматически мутировавший домен легкой цепи сохраняет все или по существу все гистидиновые замены, введенные в последовательность зародышевой линии. Согласно одному варианту осуществления антигенсвязывающий белок отображает зависимые от pH антигенсвязывающие свойства.
Согласно одному варианту осуществления также в настоящем документе предусмотрена В-клетка описанного в настоящем документе генетически модифицированного животного, которое содержит в своей зародышевой линии последовательность вариабельной области легкой цепи человека с модифицированным гистидином, например, описанную в настоящем документе единственную реаранжированную последовательность вариабельной области легкой цепи человека с модифицированным гистидином, и экспрессирует описанный в настоящем документе антигенсвязывающий белок. Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, экспрессированный в В-клетке, сохраняет по меньшей мере один остаток гистидина, введенный в зародышевую линию, и отображает зависимые от pH антигенсвязывающие свойства. Согласно некоторым вариантам осуществления антигенсвязывающий белок, например, антитело, экспрессированный в В-клетке, сохраняет все или по существу все гистидиновые остатки, введенные в зародышевую линию, и отображает зависимые от pH антигенсвязывающие свойства.
Согласно различным вариантам осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное содержит генную последовательность вариабельной области легкой цепи человека, например, единственную реаранжированную генную последовательность вариабельной области легкой цепи человека (например, последовательность Vκ1-39Jκ5 или Vκ3-20Jκ1), которая содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон (или добавление гистидинового кодона в последовательность зародышевой линии). Эти добавления или замены приводят к получению отличного от человека животного, которое содержит популяцию В-клеток, обогащенных антигенсвязывающими белками с зависимыми от pH связывающими свойствами к их антигенам. Согласно одному варианту осуществления антигенсвязывающие белки, например, антитела, производимые у описанных в настоящем документе отличных от человека животных, в ответ на антигенную стимуляцию проявляют зависимое от pH связывание антигена, при этом проявляя высокую аффинность в отношении антигена при нейтральном значении pH, например, значении pH между приблизительно 7,0 и приблизительно 8,0, например, значении pH между приблизительно 7,0 и 7,4, например, значении pH между приблизительно 7,2 и приблизительно 7,4, например, при значении pH таких жидкостей тела, как кровь. Согласно одному варианту осуществления аффинность антигенсвязывающего белка к своему антигену, выраженная в виде константы диссоциации (KD) при нейтральном значении pH составляет менее, чем 10-6 М, например, менее, чем 10-8 М, например, менее, чем 10-9 М, например, менее, чем 10-10 М, например, менее, чем 10-11 М, например, менее, чем 10-12 М.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, проявляет сниженное связывание со своим антигеном при кислом значении pH (например, значении pH 6,0 или ниже, например, значении pH между приблизительно 5,0 и приблизительно 6,0, pH между приблизительно 5,75 и приблизительно 6,0, например, значении pH эндосомальных или лизосомальных компартментов), по сравнению с нейтральным значением pH. Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, не проявляет связывание с антигеном при кислом значении pH, сохраняя при этом связывание с антигеном при нейтральном значении pH. Согласно одному варианту осуществления антигенсвязывающий белок, производимый в описанном в настоящем документе генетически модифицированном отличном от человека животном, характеризуется сниженным диссоциационным периодом полувыведения (t1/2) при кислом значении pH, по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH, по меньшей мере, приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления антигенсвязьшающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 37°C равным менее, чем приблизительно 1 мин. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 25°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления антигенсвязывающий белок, экспрессированный описанным в настоящем документе генетически модифицированным отличным от человека животным, характеризуется t1/2 при кислом значении pH и 25°C равным менее, чем приблизительно 1 мин.
Такие кинетические параметры, как равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t1/2) могут быть рассчитаны из кинетической константы скорости как: KD (М)=kd/ka; и t½ (мин)=ln2/(60*kd).
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, производимый в описанном в настоящем документе генетически модифицированном отличным от человека животном, проявляет повышенное связывание с молекулой FcRn. Как описано выше, FcRn представляет собой рецептор, присутствующий внутри эндосомального компартмента, который способен связывать иммуноглобулины при кислом значении pH и рециркулировать их обратно на поверхность. Скрининг молекул антитела в описанных в настоящем документе генетически модифицированных отличных от человека животных представляет собой уникальную возможность отбора антител с тремя полезными параметрами: высокая аффинность к антигену, зависимое от pH связывания антигена (с более слабым связыванием антигена при кислом значении pH) и увеличенным связыванием с FcRn.
Согласно одному варианту осуществления описанное в настоящем документе генетически модифицированное отличное от человека животное содержит популяцию В-клеток в ответ на антиген, которое производит и обогащено антигенсвязывающими белками, например, антителами, которые при преобразовании в лекарственные средства, проявляют увеличенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с эквивалентной В-клеточной популяцией, полученной в ответ на тот же антиген у отличных от человека животных, которые не содержат модификацию(и) гистидина в своих генных последовательностях вариабельных областей легкой цепи человека. Таким образом, согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, произведенный в ответ на представляющий интерес антиген у описанного в настоящем документе генетически модифицированного животного, при преобразовании в лекарственное средство, проявляют увеличенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с периодом полужизни в сыворотке антигенсвязывающего белка (при преобразовании в лекарственное средство в той же терапевтической дозе), который был произведен в ответ на тот же антиген у отличного от человека животного, который не содержит модификацию(и) гистидина в своей генной последовательности вариабельной области легкой цепи человека. Согласно некоторым вариантам осуществления происходит увеличение периода полужизни в сыворотке приблизительно в 2 раза, например, приблизительно в 5 раз, например, приблизительно в 10 раз, например, приблизительно в 15 раз, например, приблизительно в 20 раз или более.
Согласно одному аспекту предусмотрена плюрипотентная, индуцированная плюрипотентная или тотипотентная клетка, полученная из описанного в настоящем документе отличного от человека животного. Согласно конкретному варианту осуществления клетка представляет собой эмбриональную стволовую (ES) клетку.
Согласно одному аспекту предусмотрена ткань, полученная от описанного в настоящем документе отличного от человека животного. Согласно одному варианту осуществления ткань получают из селезенки, лимфатического узла или костного мозга описанного в настоящем документе отличного от человека животного.
Согласно одному аспекту предусмотрено ядро, полученное от описанного в настоящем документе отличного от человека животного. Согласно одному варианту осуществления ядро получают из диплоидной клетки, которая не представляет собой В-клетку.
Согласно одному аспекту предусмотрена отличная от человеческой клетка, которая изолирована от описанного в настоящем документе отличного от человека животного (например, грызуна, например, мыши или крысы). Согласно одному варианту осуществления клетка представляет собой ES клетку. Согласно одному варианту осуществления клетка представляет собой лимфоцит. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку. Согласно одному варианту осуществления В-клетка экспрессирует химерную тяжелую цепь, содержащую вариабельный домен, полученный из генного сегмента человека; и легкую цепь, полученную из реаранжированной последовательности Vκ1-39/J человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон, реаранжированной последовательности Vκ3-20/J человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон или их комбинации, и дополнительно содержащую замену по меньшей мере одной аминокислоты, кодируемой в зародышевой линии вместо гистидина; причем вариабельный домен тяжелой цепи сливают с отличной от человеческой константной областью и вариабельный домен легкой цепи сливают с отличной от человеческой или человеческой константной областью.
Согласно одному аспекту предусмотрена гибридома, причем гибридому получают с В-клеткой описанного в настоящем документе отличного от человека животного. Согласно конкретному варианту осуществления В-клетку получают от описанной в настоящем документе мыши, которая была иммунизирована иммуногеном, содержащим представляющий интерес эпитоп, и В-клетка экспрессирует связывающий белок, который связывает представляющий интерес эпитоп, связывающий белок содержит соматически мутировавший вариабельный домен тяжелой цепи человека и CH мыши и содержит вариабельный домен легкой цепи человека, полученный из реаранжированного Vκ1-39Jκ5 человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон или реаранжированного Vκ3-20Jκ1 человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон и CL мыши, причем домен легкой цепи человека содержит замену по меньшей мере одной аминокислоты, кодируемой в зародышевой линии гистидином.
Кроме того, предусмотрена клетка, экспрессирующая антигенсвязывающий белок, производимая у описанных в настоящем документе отличных от человека животных. Согласно одному варианту осуществления клетку выбирают из CHO, COS, 293, HeLa и клетки сетчатки, экспрессирующих вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
Согласно одному аспекту предусмотрен отличный от человеческого эмбрион, причем эмбрион содержит ES клетку донора, которая происходит от описанного в настоящем документе отличного от человека животного.
Описанные в настоящем документе отличные от человека животные применимы для получения В-клеток, которые экспрессируют антитела, содержащие гистидины в CDR3. Животное, которое помещает гистидины в CDR3, применимо для создания антител в целом, и, в частности, применимо для разработки антител, которые связываются с мишенью с достаточной аффинностью в или в пределах нейтрального значения pH, но которые либо не связываются, либо связываются слабее с той же мишенью при кислом значении pH.
Отличное от человека животное применимо для получения вариабельных областей антител, которые могут быть использованы для получения, например, человеческих терапевтических связывающих белков, которые связывают свои мишени вариабельными доменами иммуноглобулина человека, содержащими гистидины в CDR3. Измененное связывание при более низком значении pH будет при некоторых обстоятельствах позволять более быстрое обновление, потому что лекарственное средство будет связывать мишень на поверхности клетки, поглощаться в эндосому и легче и быстрее отделяться от мишени в эндосоме, так что лекарственное средство может рециркулировать, чтобы связать еще одну молекулу мишени (например, на другой клетке или той же клетке). В некоторых случаях это будет приводить к возможности введения лекарственного средства в более низкой дозе или снижения частоты приема лекарственного средства. Это особенно полезно, когда не желателен частый прием или введение выше определенной дозы по причине безопасности и токсичности. В результате, период полураспада в сыворотке терапевтического антитела при введении субъекту будет увеличен.
Отличное от человека животное, например, грызун, например, мышь или крыса, применимо в способе для увеличения количества В-клеток у животного, которое проявляет вариабельную область антитела, содержащую CDR3 с одним или несколькими гистидинами в ней. Отличное от человека животное применимо для производства последовательностей антител, которые будут проявлять зависимое от pH связывание антигена. Отличное от человека животное применимо для получения большего количества последовательностей антител, в результате однократной иммунизации, причем антитела будут проявлять зависимое от pH связывание антигена.
Антигенсвязывающие белки и способы их получения
Согласно одному аспекту также в настоящем документе предусмотрены способы получения человеческих антигенсвязывающих белков, например, антител, которые проявляют зависимое от pH связывание антигена, из описанных в настоящем документе генетически модифицированных отличных от человека животных с использованием стандартных способов, используемых в настоящей области техники.
Были описаны некоторые способы получения антител. Например, согласно различным вариантам осуществления химерные антитела продуцируют у мышей, как описано в настоящем документе. Антитела могут быть выделены непосредственно из В-клеток иммунизированной мыши (например, смотрите U.S. 2007/0280945 А1) и/или В-клетки иммунизированной мыши можно использовать для получения гибридом (Kohler and Milstein, 1975, Nature 256:495-497). ДНК, кодирующую антитела (человеческие тяжелые и/или легкие цепи) из описанных в настоящем документе отличных от человека животных легко выделяют и секвенируют, используя обычные техники. Гибридома и/или В-клетки, полученные из описанных в настоящем документе отличных от человека животных, служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, которые в ином случае не продуцируют белок иммуноглобулина, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем замены кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо отличных от человеческих последовательностей. Таким образом, когда определяются последовательности нуклеиновых кислот антител с желаемыми характеристиками, например, аффинностью, эпитопом, зависимым от pH связыванием антигена и т.д., отличные от человеческих генные последовательности константных областей заменяют на требуемые последовательности константных областей человека для производства полностью человеческого антитела, содержащего изотип не-IgM, например, IgG1, IgG2, IgG3 или IgG4.
Таким образом, согласно одному варианту осуществления в настоящем документе предусмотрен способ получения антитела, которое проявляет зависимые от pH антигенсвязывающие свойства, предусматривающий получение описанного в настоящем документе отличного от человека животного (например, мыши), иммунизацию мыши представляющим интерес антигеном, что позволяет отличному от человека животному усиливать иммунный ответ на антиген, и отбор у отличного от человека животного антиген-специфического антитела, которое проявляет зависимые от pH антигенсвязывающие свойства, например, более слабое связывание с антигеном при кислом, по сравнению с нейтральным значением pH.
Также в настоящем документе предусмотрены способы получения мультиспецифических антигенсвязывающих белков, например, биспецифических антигенсвязывающих белков. Эти молекулы способны связываться более, чем с одним эпитопом с высокой аффинностью. Преимущества настоящего изобретения включают в себя возможность выбирать соответствующие высокосвязывающие (например, с созревшей аффинностью) тяжелые цепи иммуноглобулина, каждая из которых будет ассоциировать с единственной легкой цепью. Кроме того, преимущества настоящего изобретения включают в себя способность производить мультиспецифический, например, биспецифический, антигенсвязывающий белок, который проявляет зависимое от pH связывание антигена.
В связи с двойственной природой биспецифических антител (т.е., могут быть специфическими к различным эпитопам одного полипептида или могут содержать антигенсвязывающие домены, специфические к более, чем одному полипептиду-мишени, смотрите, например, Tutt et al, 1991, J. Immunol. 147:60-69; Kufer et al, 2004, Trends Biotechnol. 22:238-244), они предлагают много полезных преимуществ для терапевтического применения. Например, биспецифические антитела могут быть использованы для перенаправленной цитотоксичности (например, чтобы уничтожать опухолевые клетки), в качестве адъюванта вакцины, для доставки тромболитических агентов к сгусткам, для преобразования активируемых ферментами пролекарств в сайте-мишени (например, опухоли), для лечения инфекционных заболеваний, нацеливания иммунных комплексов на рецепторы клеточной поверхности или для доставки иммунотоксинов к опухолевым клеткам.
Описанные в настоящем документе биспецифические антитела могут также быть использованы в таких различных терапевтических и не терапевтических и/или диагностических способах анализа, как иммуноферментные анализы, двухсайтовые иммуноанализы, in vitro или in vivo иммунодиагностики различных заболеваний (например, злокачественной опухоли), анализы конкурентного связывания, прямые и косвенные сэндвич-анализы и анализы иммунопреципитации. Другие применения для биспецифических антител будут очевидны для специалистов в настоящей области техники.
Сообщалось о нескольких способах для получения фрагментов биспецифических антител из культуры рекомбинантных клеток. Однако синтез и экспрессия биспецифических связывающих белков были проблематичными, отчасти из-за вопросов, связанных с идентификацией подходящей легкой цепи, которая может ассоциировать и экспрессировать с двумя различными тяжелыми цепями, и отчасти из-за проблем выделения. Согласно различным вариантам осуществления описанные в настоящем документе композиции и способы предусматривают преимущество полноразмерных биспецифических антител, которые не требуют специальной модификации(й), чтобы поддерживать традиционную структуру иммуноглобулина, увеличивая стабильность/взаимодействие компонентов. Согласно различным вариантам осуществления такая модификация(и) показала себя трудоемкой и служила в качестве препятствия для развития технологии биспецифических антител и их потенциального применения в лечении заболевания человека. Таким образом, согласно различным вариантам осуществления посредством обеспечения естественной структуры иммуноглобулина (т.е., полноразмерной), характеризующейся дополнительным свойством множественных специфичностей, полноразмерные биспецифические антитела поддерживают их критические эффекторные функции, которыми не характеризовались предыдущие биспецифические фрагменты, и дополнительно обеспечивают лекарственные средства, которые демонстрируют важный фармакокинетический параметр более длительного периода полужизни.
Описанные в настоящем документе способы и композиции позволяют генетически модифицированной мыши выбрать при естественных процессах подходящую легкую цепь, которая может ассоциировать и экспрессировать более чем с одной тяжелой цепью, включающей в себя тяжелые цепи, которые соматически мутировавшие (например, с созревшей аффинностью), причем легкая цепь дополнительно наделяет антигенсвязывающий белок его зависимым от pH антигенсвязывающим свойством. Последовательности вариабельной области тяжелой и легкой цепей человека из подходящих В-клеток описанных в настоящем документе иммунизированных мышей, которые экспрессируют антитела с созревшей аффинностью, содержащие обратные химерные тяжелые цепи (например, вариабельные человека и константные мыши), могут быть идентифицированы и клонированы в рамке считывания в векторе экспрессии с подходящей генной последовательностью константной области человека (например, IgG1 человека). Могут быть получены два таких конструкта, причем каждый конструкт кодирует человеческий вариабельный домен тяжелой цепи, который связывает различные эпитопы. Один из вариабельных областей легкой цепи человека (например, Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека), содержащий замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, может быть слит в рамке считывания с подходящим геном константной области легкой цепи человека (например, константным геном к человека). Эти три полностью человеческие тяжелые и легкие конструкты могут быть помещены в подходящую клетку для экспрессии. Клетка будет экспрессировать два основных вида: гомодимерную тяжелую цепь с идентичной легкой цепью и гетеродимерную тяжелую цепь с идентичной легкой цепью. Для обеспечения более легкого разделения этих основных видов одну из тяжелых цепей модифицируют, чтобы пропускать связывающую белок А детерминанту, приводя к дифференциальной аффинности гомодимерного связывающего белка из гетеродимерного связывающего белка. Композиции и способы решения этого вопроса описаны в USSN 12/832838, поданной 25 июня 2010 г., под названием "Readily Isolated Bispecific Antibodies with Native Immunoglobulin Format", опубликованной как US 2010/0331527 A1. После того, как вид, содержащий гетеродимерную тяжелую цепь с идентичной легкой цепью выбран, этот биспецифический антигенсвязывающий белок может быть подвергнут скринингу для подтверждения сохранения его зависимого от pH антигенсвязывающего свойства.
Согласно одному аспекту предусмотрен описанный в настоящем документе эпитопсвязывающий белок, причем последовательности вариабельной области легкой цепи и тяжелой цепи человека получают от описанных в настоящем документе животных, которые были иммунизированы содержащим представляющий интерес эпитоп антигеном.
Согласно одному варианту осуществления предусмотрен эпитопсвязывающий белок, который содержит первый и второй полипептид, первый полипептид, содержащий от N-конца к С-концу первую эпитопсвязывающую область, которая селективно связывает первый эпитоп, после которой следует константная область, которая содержит первую область CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и второй полипептид, содержащий от N-конца к С-концу вторую эпитопсвязывающую область, которая селективно связывает второй эпитоп, после которой следует константная область, которая содержит вторую область CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации, причем вторая область CH3 содержит модификацию, которая уменьшает или устраняет связывание второго домена CH3 с белком А. Различные такие модификации описаны, например, в опубликованной заявке US №2010/0331527 и 2011/0195454.
Один из способов получения эпитопсвязывающего белка, который связывается более чем с одним эпитопом и проявляет зависимое от pH эпитопсвязывающее свойство, состоит в иммунизации первой мыши в соответствии с настоящим изобретением антигеном, который содержит первый представляющий интерес эпитоп, причем мышь содержит (1) эндогенный локус вариабельной области легкой цепи иммуноглобулина, который не содержит эндогенную генную последовательность вариабельной области легкой цепи мыши, которая способна к реаранжировке и образованию легкой цепи, причем в эндогенном локусе вариабельной области легкой цепи иммуноглобулина мыши находится единственная реаранжированная вариабельная область легкой цепи человека, функционально связанная с эндогенным геном константной области легкой цепи мыши, и реаранжированную вариабельную область легкой цепи человека выбирают из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека, содержащих замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, и (2) эндогенные генные сегменты VH мыши, замененные полностью или частично генными сегментами VH человека, таким образом, что полученные с помощью мыши тяжелые цепи иммуноглобулина представляют собой исключительно или по существу тяжелые цепи, которые содержат вариабельные домены человека и константные домены мыши. После иммунизации такая мышь будет производить обратное химерное антитело, содержащее только один из двух вариабельных доменов легкой цепи человека (например, один из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека, например, содержащий замену по меньшей мере одной аминокислоты на гистидин). Как правило, по меньшей мере некоторые из замененных остатков гистидина, введенных в последовательность зародышевой линии, будут сохранены в обратном химерном антителе. После того, как идентифицируют В-клетку, которая кодирует вариабельный домен тяжелой цепи, который связывается с представляющим интерес эпитопом и экспрессирует антитело, которое проявляет зависимые от pH антигенсвязывающие свойства, нуклеотидная последовательность вариабельной области тяжелой цепи (и, возможно, вариабельная область легкой цепи) может быть получена (например, с помощью ПЦР) и клонирована в конструкт экспрессии в рамке считывания с подходящей последовательностью константной области тяжелой цепи иммуноглобулина человека. Этот процесс может быть повторен для идентификации второго вариабельного домена тяжелой цепи, который связывает второй эпитоп, и может быть получена вторая генная последовательность вариабельной области тяжелой цепи и клонирована в вектор экспрессии в рамке считывания для второй пригодной последовательности константной области тяжелой цепи иммуноглобулина человека. Первый и второй константные домены иммуноглобулина, кодируемые генной последовательностью константной области, могут быть одинакового или различного изотипа, и один из константных доменов иммуноглобулина (но не другой) может быть модифицирован, как описано в настоящем документе или в US 2010/0331527 А1, и эпитопсвязывающий белок может быть экспрессирован в подходящей клетке и выделен на основе своей дифференциальной аффинности к белку А, по сравнению с гомодимерным эпитопсвязывающий белком, например, как описано в US 2010/0331527 А1.
Таким образом, согласно различным вариантам осуществления после выделения ДНК и отбора первой и второй последовательностей нуклеиновых кислот, которые кодируют первый и второй вариабельные домены тяжелой цепи человека, характеризующихся желаемыми специфичностями/аффинностями, и третьей последовательности нуклеиновой кислоты, которая кодирует домен легкой цепи человека (реаранжированная последовательность зародышевой линии или последовательность легкой цепи, выделенная из описанного в настоящем документе отличного от человека животного) и содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, три последовательности нуклеиновых кислот, кодирующие молекулы, экспрессируются для образования биспецифического антитела с использованием рекомбинантных техник, которые широко доступны в настоящей области техники. Часто, экспрессионная система выбора будет включать в себя вектор экспрессии клетки млекопитающих и хозяина таким образом, что биспецифическое антитело соответствующим образом гликозилируют (например, в случае биспецифических антител, содержащих домены антител, которые гликозилированы). Тем не менее, молекулы могут быть также получены в прокариотических экспрессионных системах. Как правило, клетка-хозяин будет трансформирована с ДНК, кодирующей как первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека, домен легкой цепи человека на единственном векторе, так и независимые векторы. Тем не менее, можно экспрессировать как первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека и домен легкой цепи человека (компоненты биспецифических антител) в независимых системах экспрессии и объединить экспрессированные полипептиды in vitro. Согласно различным вариантам осуществления домен легкой цепи человека происходит от последовательности зародышевой линии, но вместо замены по меньшей мере одного негистидинового кодона на гистидиновый кодон, например, в кодоне CDR. Согласно различным вариантам осуществления домен легкой цепи человека содержит не более одного, не более двух, не более трех, не более четырех или не более пяти соматических гипермутаций внутри вариабельной последовательности легкой цепи домена легкой цепи. Согласно некоторым вариантам осуществления соматические гипермутации не изменяют наличие по меньшей мере одного остатка гистидина, введенного в последовательности зародышевой линии вариабельной области легкой цепи.
Согласно различным вариантам осуществления нуклеиновая кислота(ы) (например, кДНК или геномная ДНК), кодирующая две тяжелые цепи и одну легкую цепь человека с заменой по меньшей мере одного негистидина на гистидин, вставляется в вектор репликации для дальнейшего клонирования (амплификации ДНК) и/или для экспрессии. Многие векторы доступны, и, как правило, включают в себя без ограничения один или несколько из следующих: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Каждый компонент может быть выбран индивидуально или на основе выбора клетки-хозяина или других критериев, определенных экспериментально. Несколько примеров каждого компонента известно в настоящей области техники.
Векторы экспрессии и клонирования обычно содержат промотор, который распознается организмом-хозяином и функционально связан с последовательностями нуклеиновых кислот, которые кодируют каждый или все компоненты биспецифического антитела. Большое количество промоторов, узнаваемых различными потенциальными клетками-хозяевами, хорошо известны. Эти промоторы функционально связаны с биспецифической кодирующей антитела ДНК путем удаления промотора из источника ДНК с помощью фермента рестрикции, расщепляющего и вставляющего выделенную последовательность промотора в вектор.
Векторы экспрессии, используемые в эукариотических клетках-хозяевах (дрожжах, грибах, насекомых, растениях, животных, человека или ядерных клетках из других многоклеточных организмов), могут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5ʹ, а иногда 3ʹ нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей компоненты биспецифических антител. Подходящие векторы экспрессии для различных вариантов осуществления включают в себя те, которые предусмотрены для временной экспрессии в клетках млекопитающих ДНК, кодирующей биспецифическое антитело. В общем, временная экспрессия включает в себя использование вектора экспрессии, который способен эффективно реплицироваться в клетке-хозяине, таким образом, что клетка-хозяин накапливает множество копий вектора экспрессии и, в свою очередь, синтезирует высокие уровни желаемого полипептида, кодируемого вектором экспрессии. Системы временной экспрессии, содержащие подходящий вектор экспрессии и клетку-хозяина, дают возможность удобной положительной идентификации полипептидов, кодируемых клонированными ДНК, а также быстрого скрининга биспецифических антител, обладающих желаемой специфичностью/аффинностью связывания или желаемой характеристикой пробега в геле, по отношению к исходным антителам, содержащим гомодимеры первого или второго вариабельных доменов тяжелой цепи человека.
Согласно различным вариантам осуществления, как только ДНК, кодирующие компоненты биспецифического антитела, собраны в нужном описанном выше векторе(ах), их вводят в подходящую клетку-хозяина для экспрессии и восстановления. Трансфекция клеток-хозяев может быть выполнена с использованием известных в настоящей области техники стандартных техник, подходящих для выбранной клетки хозяина (например, электропорации, ядерной микроинъекции, слияния бактериальных протопластов с интактными клетками или поликатионов, например, полибрена, полиорнитин и т.д.).
Согласно различным вариантам осуществления клетку-хозяина выбирают ту, которая наилучшим образом соответствует вектору экспрессии, содержащему компоненты, и позволяет наиболее эффективно и благоприятно производить виды биспецифических антител. Иллюстративные клетки-хозяева для экспрессии включают в себя прокариотические и эукариотические (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы E.coli, Bacillus spp., Streptomyces spp.и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S.cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni, и т.д.), клетки отличных от человека животных, клетки человека или клеточные слияния, такие как, например, гибридомы или квадромы. Согласно различным вариантам осуществления клетка представляет собой клетку человека, мартышки, обезьяны, хомячка, крысы или мыши. Согласно различным вариантам осуществления клетка представляет собой эукариотическую клетку, выбранную из CHO (например, CHO K1, DXB-11 CHO, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почек (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, BHK), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, BHK21), Jurkat, Daudi, А431 (эпидермальная), CV-1, U937, 3Т3, клетки L, клетки С127, SP2/0, NS-0, MMT 060562, клетки Сертоли, клетки BRL 3А, клетки HT1080, клетки миеломы, клетки опухоли и клеточной линии, полученной из вышеуказанной клетки. Согласно различным вариантам осуществления клетка содержит один или несколько вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Клетки-хозяева млекопитающих, используемые для производства биспецифического антитела, могут культивироваться в различных средах. Такие коммерчески доступные среды, как F10 Хэма (Sigma), минимальная поддерживающая среда ((MEM), Sigma), RPMI-1640 (Sigma) и среда Игла, модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma), подходят для культивирования клеток-хозяев. Среды могут быть дополнены, при необходимости, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (например, хлоридом натрия, кальция, магния и фосфатом), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками (например, GENTAMYCIN™), следовыми элементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие добавки также могут быть включены в соответствующих концентрациях, известных специалистам в настоящей области техники. Такие условия культивирования, как температура, pH и т.п., согласно различным вариантам осуществления, представляют собой ранее использованные с клеткой-хозяином, выбранной для экспрессии, и будут очевидны специалистам в настоящей области техники.
Биспецифическое антитело может быть выделено из культуральной среды в виде секретируемого полипептида, хотя оно также может быть выделено из лизата клеток-хозяев, когда производится непосредственно без секреторного сигнала. Если биспецифическое антитело связано с мембраной, оно может быть высвобождено из мембраны с использованием подходящего раствора детергента (например, Triton X-100).
После выделения биспецифическое антитело, содержащее две тяжелые цепи человека и одну легкую цепь человека, полученную из реаранжированной генной последовательности вариабельной области легкой цепи человека, выбранной из последовательностей Vκ1-39Jκ5 и Vκ3-20Jκ1, которые содержат замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, подвергают скринигу на способность проявлять зависимое от pH связывание с одним, предпочтительно с обоими его антигенами. Способность биспецифических антител связывать свои антигены по-разному при нейтральном и кислом значении pH (например, их способность демонстрировать уменьшенный t1/2 при кислом значении pH, по сравнению с нейтральным значением pH) может быть определена с помощью различных техник, доступных в настоящей области техники и описанных в следующих примерах, например, анализ BIACORE™.
Дополнительные способы получения антигенсвязывающих белков с зависимым от pH связыванием антигенов
Предусмотрены различные способы получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами у описанных в настоящем документе генетически модифицированных отличных от человека животных. Также предусмотрены способы получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами in vitro. Такие способы могут включать в себя получение различных компонентов антигенсвязывающих белков in vivo у генетически модифицированных отличных от человека животных, а затем их модификацию и сборку in vitro за пределами организма в виде белковых комплексов, экспрессированных в культуре клеток млекопитающих.
Согласно одному варианту осуществления способ получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами использует последовательность антигенсвязывающего белка, например, последовательность антитела, который производится в мыши, содержащей ограниченный репертуар сегментов V и J вариабельной области легкой цепи, например, сегменты V и J вариабельной области легкой цепи человека, мыши с "универсальной легкой цепью" или "общей легкой цепью" ("ULC" мыши), такой как мышь, описанная в опубликованных заявках US №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492. Согласно одному варианту осуществления способ получения антигенсвязывающих белков с зависимыми от pH антигенсвязывающими свойствами использует последовательность антигенсвязывающего белка, который производится в мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека. Согласно одному варианту осуществления способ использует антигенсвязывающий белок, производимый в мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека, выбранную из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязывающими свойствами предусматривает выбор первого антитела, которое связывается с представляющим интерес антигеном (например, связывается с представляющим интерес антигеном с требуемой аффинностью), модификацию нуклеотидной последовательности легкой цепи иммуноглобулина первого антитела для того, чтобы включить в себя замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, экспрессию тяжелой цепи иммуноглобулина первого антитела и модифицированной легкой цепи иммуноглобулина в клетках и выбор второго антитела, экспрессированного в клетке, которое сохраняет связывание с представляющим интерес антигеном (например, сохраняет требуемую аффинность к представляющему интерес антигену) при нейтральном значении pH и отображает уменьшенное связывание с представляющим интерес антигеном при кислом значении pH.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязьшающими свойствами предусматривает выбор тяжелой цепи иммуноглобулина из антитела (например, полученного из отличного от человека животного, например, мыши, например, ULC мыши), которое содержит легкую цепь иммуноглобулина, содержащую единственную реаранжированную последовательность вариабельной области легкой цепи иммуноглобулина человека, причем антитело связывается с представляющим интерес антигеном (например, связывается с представляющим интерес антигеном с требуемой аффинностью); модификацию последовательности нуклеиновой кислоты легкой цепи иммуноглобулина так, что единственная реаранжированная последовательность вариабельной области легкой цепи иммуноглобулина человека содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон; экспрессию выбранной тяжелой цепи иммуноглобулина и легкой цепи иммуноглобулина, содержащей замену по меньшей мере одной аминокислоты на гистидин в своем вариабельном домене; и выбор антитела, которое сохраняет связывание с представляющим интерес антигеном при нейтральном значении pH (например, сохраняет требуемую аффинность к представляющему интерес антигену), при этом отображая уменьшенное связывание с представляющим интерес антигеном при кислом значении pH. Согласно различным вариантам осуществления тяжелая цепь иммуноглобулина происходит от реаранжировки вариабельных генных сегментов (сегментов V, D и J человека) тяжелой цепи человека.
Согласно одному варианту осуществления способ получения антигенсвязывающего белка, например, антитела, с зависимыми от pH антигенсвязывающими свойствами предусматривает (1) иммунизацию отличного от человека животного, например, мыши, содержащей единственную реаранжированную генную последовательность вариабельной области легкой цепи человека и репертуар нереаранжированных вариабельных генных сегментов (сегментов V, D и J) тяжелой цепи человека, представляющим интерес антигеном и позволение мыши усиливать иммунный ответ на указанный антиген, (2) выбор у отличного от человека животного, например, у мыши, антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (3) выделение из отличного от человека животного, например, из мыши, нуклеотидной последовательности тяжелой цепи иммуноглобулина антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, (4) определение нуклеотидной последовательности указанной тяжелой цепи, (5) модификацию нуклеотидной последовательности легкой цепи иммуноглобулина, содержащей единственную реаранжированную вариабельную область легкой цепи иммуноглобулина человека, чтобы включить замену по меньшей мере одного негистидинового кодона на гистидиновый кодон, (6) экспрессию тяжелой цепи иммуноглобулина антитела, которое связывается с представляющим интерес антигеном с требуемой аффинностью, и легкой цепи иммуноглобулина, содержащей модификацию гистидина, в клетке, и (7) определение того, сохраняет ли экспрессируемое в клетке антитело связывание с антигеном при нейтральном значении pH, при этом отображая сниженное связывание при кислом значении pH. Согласно одному варианту осуществления экспрессируемое в клетке антитело проявляет требуемую аффинность к антигену при нейтральном значении pH. Согласно различным вариантам осуществления тяжелая цепь иммуноглобулина происходит от реаранжировки вариабельных генных сегментов (сегментов V, D и J человека) тяжелой цепи человека.
Согласно одному варианту осуществления мышь, содержащая единственную реаранжированную генную последовательность вариабельной области легкой цепи человека, представляет собой мышь с универсальной легкой цепью или общей легкой цепью "ULC" мышь, описанную, например, в опубликованной заявке US №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492. Согласно одному варианту осуществления единственную реаранжированную генную последовательность вариабельной области легкой цепи человека выбирают из последовательности Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека.
Согласно одному варианту осуществления представляющий интерес антиген выбирают из растворимого антигена, антигена клеточной поверхности (например, опухолевого антигена) и рецептора клеточной поверхности. Согласно конкретному варианту осуществления рецептор клеточной поверхности представляет собой рецептор-иммуноглобулин. Согласно конкретному варианту осуществления рецептор-иммуноглобулин представляет собой Fc-рецептор.
Согласно одному варианту осуществления требуемая аффинность антитела к антигену, выраженная в виде константы диссоциации (KD) при нейтральном значении pH меньше, чем 10-6 М, например, меньше, чем 10-8 М, например, меньше, чем 10-9 М, например, меньше, чем 10-10 М, например, меньше, чем 10-11 М, например, меньше, чем 10-12 М.
Как описано выше, согласно одному варианту осуществления ULC мыши содержат единственную реаранжированную генную последовательность вариабельной области легкой цепи человека и экспрессируют антитела в ответ на антиген, где аффинность антител к антигену в первую очередь опосредована через тяжелые цепи их антител. Эти мыши содержат репертуар вариабельных сегментов (V, D и J) тяжелых цепей человека, которые реаранжируют для кодирования вариабельного домена тяжелой цепи антитела человека, которое также содержит легкую цепь, полученную из единственной реаранжированной вариабельной последовательности легкой цепи человека. Согласно одному варианту осуществления при воздействии антигена эти мыши используют разнообразный репертуар вариабельных сегментов (V, D и J) тяжелых цепей человека, чтобы производить антитело с аффинностью и специфичностью к антигену. Таким образом, при воздействии антигена нуклеотидная последовательность тяжелой цепи иммуноглобулина антитела, производимая в ULC мышах, может быть выделена и использована для получения требуемого связывающего белка, также содержащего легкую цепь иммуноглобулина, полученную из единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека (например, единственной реаранжированной последовательности вариабельной области легкой цепи иммуноглобулина человека с заменой по меньшей мере одного негистидинового кодона на гистидиновый кодон).
Согласно одному варианту осуществления ULC мышей 90-100% переаранжированных отличных от человеческих генных сегментов VH замещают по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все (например, 90-100%) эндогенные отличные от человеческих генные сегменты VH замещены по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере 19, по меньшей мере 39 или по меньшей мере 80 или 81 нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере 25 функциональных нереаранжированных генных сегментов VH человека или по меньшей мере 43 функциональных нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH по меньшей мере одним нереаранжированным сегментом DH человека и по меньшей мере одним нереаранжированным сегментом JH человека. Согласно одному варианту осуществления отличное от человека животное содержит замещение всех отличных от человеческих сегментов DH и JH всеми переаранжированными сегментами DH человека и всеми переаранжированными сегментами JH человека. Таким образом, ULC мышь использует широкий репертуар генных сегментов вариабельных областей человека (V, D и J сегментов) для производства антитела в ответ на представляющий интерес антиген.
Как только тяжелая цепь антитела, которое связывается с представляющим интерес антигеном с желаемой аффинностью, определена, нуклеотидную последовательность тяжелой цепи выделяют и секвенируют. Последовательность клонируют в вектор для экспрессии в подходящих клетках-хозяевах, например, эукариотических клетках, например, клетках CHO. Согласно одному варианту осуществления последовательность константной области тяжелой цепи человека клонируют ниже по ходу транскрипции последовательности вариабельной области тяжелой цепи человека, выделенной из мыши (например, ULC мыши).
Согласно одному варианту осуществления получение антигенсвязывающего белка с зависимыми от pH антигенсвязывающими свойствами предусматривает модификацию нуклеотидной последовательности легкой цепи иммуноглобулина, в частности, последовательности с единственной реаранжированной вариабельной областью легкой цепи иммуноглобулина человека, чтобы включить в себя замену по меньшей мере одного негистидинового кодона на гистидиновый кодон. Различные техники модификации нуклеотидной последовательности известны в настоящей области техники, например, сайт-направленный мутагенез. Кроме того, нуклеотидная последовательность, содержащая требуемую замену гистидина, может быть синтезирована de novo.
Согласно одному варианту осуществления замена по меньшей мере одного негистидинового кодона на гистидиновый кодон предусматривает замену, приводящую к экспрессии одного, двух, трех, четырех или более остатков гистидина. Согласно одному варианту осуществления замена(ы) приводит к экспрессии трех или четырех остатков гистидина. Согласно одному варианту осуществления замена(ы) происходит в вариабельной области легкой цепи иммуноглобулина. Согласно одному варианту осуществления замена(ы) происходит в кодоне CDR, например, CDR1, CDR2 и/или CDR3. Согласно одному варианту осуществления замена(ы) происходит в кодоне CDR3.
Согласно одному варианту осуществления, в котором последовательность нуклеиновой кислоты легкой цепи иммуноглобулина содержит генную последовательность Vκ1-39Jκ5, и замена(ы) происходит в кодоне CDR3, замена приводит к экспрессии гистидина в положении, выбранном из 105, 106, 108, 111, а также их комбинаций. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106, 108, и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 108 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 108. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 108 и 111. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106, 108 и 111. Последовательности аминокислот и нуклеиновых кислот областей CDR3 Vκ1-39Jκ5, содержащие различные гистидиновые замены, изображены на фиг. 16 и включены в список последовательностей.
Согласно одному варианту осуществления, в котором последовательность нуклеиновой кислоты легкой цепи иммуноглобулина содержит генную последовательность Vκ3-20Jκ1, и замена(ы) происходит в кодоне CDR3, замена приводит к экспрессии гистидина в положении, выбранном из 105, 106, 107, 109, а также их комбинаций. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106, 107, и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 106. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 107 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 107. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 106 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 105, 107 и 109. Согласно одному варианту осуществления замены приводят к экспрессии гистидинов в положениях 106, 107 и 109. Выбранные последовательности аминокислот и нуклеиновых кислот областей CDR3 Vκ3-20Jκ1, содержащие различные гистидиновые замены, изображены на фиг. 27 и включены в список последовательностей.
Как только последовательность легкой цепи иммуноглобулина, например, вариабельный домен легкой цепи иммуноглобулина человека, модифицируют, чтобы включить в себя остатки гистидина в требуемых положениях, нуклеотидную последовательность легкой цепи клонируют в вектор для экспрессии в подходящих клетках-хозяевах, например, эукариотических клетках, например, клетках CHO. Согласно одному варианту осуществления последовательность константной области легкой цепи человека клонируют ниже по ходу транскрипции от модифицированной нуклеотидной последовательности вариабельной области человека.
Согласно одному варианту осуществления векторы, содержащие нуклеотидную последовательность, кодирующую модифицированную легкую цепь иммуноглобулина человека и выбранную тяжелую цепь иммуноглобулина человека, коэкспрессируют в подходящей клетке-хозяине, например, эукариотической клетке-хозяине, например, клетке CHO для производства антигенсвязывающего белка. Различные клетки-хозяева, которые могут быть использованы для экспрессии, хорошо известны в настоящей области техники и упоминаются в настоящем описании.
Антигенсвязывающий белок, например, антитело, полученный в клетке-хозяине, может быть секретирован в клеточный супернатант, который подвергают скринингу на правильную экспрессию и аффинность к исходному антигену при нейтральном значении pH. Антигенсвязывающий белок также может быть выделен из лизата клеток или, если он связан с мембраной, освобожден от мембраны с использованием подходящего детергента (например, Тритон-Х). Антигенсвязывающий белок с требуемыми характеристиками может быть очищен.
Согласно одному варианту осуществления антигенсвязывающий белок, содержащий модификацию(и) гистидина, сохраняет аффинность к антигену, что сопоставимо с аффинностью к тому же антигену (исходному) антигенсвязывающего белка, который не содержит модификации(й) гистидина. Согласно одному варианту осуществления аффинность антигенсвязывающего белка с модифицированным гистидином к представляющему интерес антигену, выраженная как константа диссоциации (KD), при нейтральном значении pH меньше, чем 10-6 М, например, меньше, чем 10-8 М, например, меньше, чем 10-9 М, например, меньше, чем 10-10 М, например, меньше чем 10-11 М, например, меньше, чем 10-12 М.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, содержащий описанные в настоящем документе модификации гистидина, проявляет зависимые от pH антигенсвязывающие свойства. Согласно одному варианту осуществления антигенсвязывающий белок, содержащий гистидиновые модификации, обладает усиленными зависимыми от pH свойствами, по сравнению с эквивалентным антигенсвязывающим белком без модификаций гистидина (антигенсвязывающим белком с той же аминокислотной последовательностью, но вместо модификаций гистидина). Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок сохраняет связывание с антигеном при нейтральном значении pH (например, сохраняет требуемую аффинность к антигену при нейтральном значении pH), при этом отображая уменьшенное связывание при кислом значении pH. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок, например, антитело, не проявляет связывание с антигеном при кислом значении pH, сохраняя при этом связывание с антигеном при нейтральном значении pH. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется уменьшением диссоциационного периода полувыведения (t1/2) при кислом значении pH, по сравнению с диссоциационным периодом полувыведения (t1/2) антигенсвязывающего белка при нейтральном значении pH по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 5 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 15 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 25 раз или по меньшей мере приблизительно в 30 раз. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 37°C равным приблизительно 1 мин. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязывающий белок характеризуется t1/2 при кислом значении pH и 25°C равным приблизительно 2 мин или менее. Согласно одному варианту осуществления описанный в настоящем документе антигенсвязьшающий белок характеризуется t1/2 при кислом значении pH и 25°C равным менее, чем приблизительно 1 мин.
Согласно одному варианту осуществления антигенсвязывающий белок, например, антитело, содержащий описанные в настоящем документе модификации гистидина, проявляет повышенный период полужизни в сыворотке при введении терапевтической дозы субъекту, по сравнению с периодом полужизни в сыворотке при введении эквивалентной терапевтической дозы антигенсвязывающего белка, который не содержит модификации гистидина (например, исходный антигенсвязывающий белок, который не содержит гистидиновые модификации). Согласно некоторым вариантам осуществления увеличение периода полужизни в сыворотке при введении дозы антигенсвязывающего белка, содержащего описанные в настоящем документе модификации гистидина, превышает период полужизни в сыворотке при введении той же дозы антигенсвязывающего белка, не содержащего модификации гистидина, приблизительно в 2 раза, например, приблизительно в 5 раз, например, приблизительно в 10 раз, например, приблизительно в 15 раз, например, в 20 раз или более. Согласно одному варианту осуществления период полужизни в сыворотке составляет по меньшей мере приблизительно 1 день, например, по меньшей мере приблизительно 2 дня, например, по меньшей мере приблизительно 7 дней, например, по меньшей мере приблизительно 14 дней, например, по меньшей мере приблизительно 30 дней, например, по меньшей мере приблизительно 60 дней.
В дополнение к способам in vitro для получения описанных выше антигенсвязывающих белков с зависимыми от pH антигенсвязьшающими свойствами также в настоящем документе предусмотрены антигенсвязывающие белки, например, антитела, получаемые указанным способом. Кроме того, указанный способ может быть использован для создания мультиспецифических, например, биспецифических, антигенсвязывающих белков, путем выбора двух различных тяжелых цепей иммуноглобулина человека, которые связываются с общей (универсальной) легкой цепью в мыши, определения нуклеотидных последовательностей тяжелых цепей, модификации универсальной легкой цепи для включения описанных выше замен гистидина и коэкспрессии двух тяжелых цепей человека с единственной универсальной легкой цепью с модификациями гистидина в клетке-хозяине. Различные стадии получения описанного выше антигенсвязывающего белка могут быть применимы к способу получения биспецифического антигенсвязывающего белка. Биспецифический антигенсвязывающий белок, обладающий подтвержденной требуемой аффинностью к антигену(ам) и зависимыми от pH антигенсвязывающими свойствами, может быть очищен. Таким образом, предусмотрены биспецифические антитела, содержащие две тяжелые цепи человека и единственную легкую цепь человека, содержащую последовательность вариабельного домена легкой цепи человека, кодируемую геном вариабельной области человека, например, геном вариабельной области Vκ1-39Jκ5 или Vκ3-20Jκ1, содержащим замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
Кроме того, предусмотрены конструкты, используемые для получения антигенсвязывающего белка, содержащего тяжелую цепь иммуноглобулина человека и легкую цепь иммуноглобулина человека, содержащую замены гистидина. Также предусмотрены клетки-хозяева, экспрессирующие описанные в настоящем документе антигенсвязывающие белки, например, антитела.
ПРИМЕРЫ
Следующие примеры приведены для того, чтобы обеспечить специалиста в настоящей области техники полным раскрытием и описанием того, как выполнять и применять настоящее изобретение, и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением, и они не предназначены для представления того, что эксперименты ниже представляют собой все или только проведенные эксперименты. Были предприняты усилия, чтобы обеспечить точность в отношении используемых чисел (например, суммы, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны учитываться. Если не указано иное, части представляют собой массовые части, молекулярная масса представляет собой среднюю молекулярную массу, температура указана в градусах Цельсия, а давление равно или близко к атмосферному.
Пример 1. Конструирование гуманизированных локусов тяжелых цепей иммуноглобулина, содержащих генные сегменты D с гистидиновыми заменами
Конструирование гуманизированных локусов тяжелых цепей иммуноглобулина, содержащих генные сегменты D с гистидиновыми заменами, выполняли с помощью серий гомологичных реакций рекомбинации в клетках бактерий (BHR) с использованием ДНК бактериальной искусственной хромосомы (BAC). Несколько нацеленных конструктов для создания подвергнутой генной инженерии мыши, которая экспрессирует вариабельный домен тяжелой цепи, содержащий один или несколько остатков гистидина, получали с использованием технологии генной инженерии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela, D. M. et al. (2003), High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotechnology 21(6):652-659).
Вначале, генные сегменты D человека синтезировали in silico в виде четырех частей (4 повторов), в которых кодоны, кодирующие тирозин (Y), аспарагин (N), серии (S), глицин (G) и аспартат (D) в гидрофильной рамке были заменены кодонами гистидина (в дальнейшем "генные сегменты D человека с гистидиновыми заменами", т.е., HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4) (фиг. 3). Четыре повтора также содержали уникальные сайты ферментов рестрикции на концах для лигирования их вместе. Специфическое расположение замен гистидина (обозначены жирным шрифтом) в каждом генном сегменте D человека показано на фиг. 1А и 1В в столбце "гидрофильный". Как показано на фиг. 1, в то время как модификация вводила гистидиновые кодоны в гидрофильную рамку считывания, также изменяли некоторые стоп-кодоны на сериновые кодоны в "стоп" рамке считывания. Модификацией, однако, получили несколько изменений в "гидрофобной" рамке считывания. Подробная процедура лигирования четырех синтезированных повторов сегмента D показана на фиг. 3 (последовательное дотирование). Полученный клон содержал от 5ʹ к 3ʹ: 5ʹ плечо гомологии мыши, фланкированную loxP неомициновую кассету, генные сегменты D человека, содержащие гистидиновые замены (т.е., HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1,7-6,13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)), хлорамфеникольную кассету отбора и 3ʹ плечо гомологии.
Следующие шесть генетических модификаций выполняли с целью замещения эндогенных генных сегментов D человека в VELOCIMMUNE® гуманизированной мыши с описанными выше геннымисегментами D человека с гистидиновыми заменами.
Во-первых, pLMa0174, содержащим спектиномициновую кассету отбора и сайт рестрикции AsiSI, нацелено воздействовали на 5ʹ конец клона MAID 1116 (стадия 1. BHR (Spec); фиг 2.). На стадии 1 хлорамфеникольную кассету отбора, неомициновую кассету отбора, сайт loxP, два генных сегмента VH (hVH1-3 и hVH1-2) и ген Adam6p человека, все из которых расположены 5ʹ выше по ходу транскрипции hVH6-1, удаляли из клона MAID 1116 и замещали спектиномициновой кассетой с получением клона VI433.
Во-вторых, на стадии 2 (BHR (Hyg + Spec); фиг. 2), pNTu0002, содержащим фланкированную сайтами FRT гигромициновую кассету, нацелено воздействовали на область, содержащую генные сегменты DH иммуноглобулина человека. На стадии 2 все генные сегменты D тяжелой цепи человека удаляли из VI433 и замещали гигромициновой кассетой с получением MAID 6011 VI 434 (клон 1). Модификация также включала PI-SCEI и сайты рестрикции I-CeuI на 5ʹ и 3ʹ конце гигромициновой кассеты.
В-третьих, геномную область, содержащую генные сегменты D человека с гистидиновыми заменами (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)) вводили в область между PI-SceI и сайтами I-CeuI в MAID 6011 VI434 через рестрикционное расщепление и лигирование (PI-SCEI/I-CeuI лигирование, модифицировавшее 1116 (Kan + Spec);. рис 4). Это привело к получению MAID6012 VI469, содержащего от 5ʹ к 3ʹ, спектиномициновую кассету, геномную область размером приблизительно 50 т.п.н., содержащую VH6-1, фланкированную loxP неомициновую кассету, генные сегменты D человека с гистидиновыми заменами размером приблизительно 40 т.п.н. (HD 1.1-6,6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)) и приблизительно геномную область размером 25 т.п.н., содержащую генные сегменты JH человека, за которыми следует Ei мыши (интронный энхансер mIgH; SEQ ID NO: 5), область переключения мыши (SEQ ID NO: 6) и нуклеотидная последовательность константной области IgM мыши (экзон 1mIgM; SEQ ID NO: 7). Бактериальные клетки, содержащие модификацию, выбирали на основе канамицинового и спектиномицинового отбора.
В-четвертых, MAID 1460 гетерозиготные ES клетки мыши нацеливали с MAID 6011 VI434 через электропорацию для удаления всех эндогенных генных сегментов D человека от клона MAID 1460, как показано на фиг. 5. Это приводило к MAID 6011 гетерозиготным ES клеткам мыши, содержащим в своем локусе тяжелой цепи иммуноглобулина (в хромосоме, полученной из линии 129) от 5ʹ к 3ʹ сайт FRT, генные сегменты VH человека, геномную область мыши, охватывающую гены adam6a/b, гигромициновую кассету, фланкированную сайтами FRT, и сегменты JH человека, за которыми следует последовательность Еi мыши и нуклеотидная последовательность константной области IgM. Генетическую модификацию MAID 6011 (уменьшение аллелей, увеличение аллелей и присутствие исходных аллелей) подтверждали с помощью зондов и праймеров, как показано на фиг. 6.
В-пятых, MAID 6011 гетерозиготные ES клетки мыши электропорировали с MAID 6012 VI469 в целях внедрения генных сегментов D человека с гистидиновыми заменами (т.е., HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)) в MAID 6011. На стадии нацеливания удаляли фланкированную loxP гигромициновую кассету отбора из MAID 6011 и замещали последовательностью с генными сегментами D человека с гистидиновыми заменами. Это приводило к MAID 6012 гетерозиготной ES клетке мыши, содержащей полученную из линии C57BL/6 хромосому дикого типа и генетически модифицированную полученную из линии 129 хромосому, содержащую генные сегменты VH и JH человека дикого типа и описанные в настоящем документе генные сегменты D человека с гистидиновыми заменами. Кроме того, ES клетки содержали геномную область мыши, охватывающую гены adam6a/b и фланкированную loxP неомициновую кассету между сегментами VH и D (фиг. 7). Генетическую модификацию MAID 6012 (уменьшение аллелей, увеличение аллелей и присутствие исходных аллелей) подтверждали с помощью зондов и праймеров, как показано на фиг. 8.
Наконец, MAID 6012 ES клетки электропорировали с плазмидой, которая экспрессирует рекомбиназу Cre для удаления неомициновой кассеты отбора из MAID 6012 ES клеток, приводя к MAID 6013 гетерозиготным ES клеткам (фиг. 9). Конечные MAID 6013 гетерозиготные ("MAID 6013 гет") ES клетки содержат полученную из линии C57BL/6 хромосому дикого типа и генетически модифицированную полученную из линии 129 хромосому, содержащую в своем локусе тяжелой цепи иммуноглобулина от 5ʹ к 3ʹ (1) сайт FRT; (2) генные сегменты VH человека; (3) геномную область мыши, охватывающую гены adam6a/b; (4) фланкированную loxP неомициновую кассету отбора; (5) генные сегменты D человека с гистидиновыми заменами (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4)); (6) генные сегменты JH человека; за которыми следуют (7) последовательность Ei мыши (интронный энхансер mIgH; SEQ ID NO: 5), (8) область переключения (SEQ ID NO: 6) и (9) нуклеотидная последовательность константной области мыши IgM (экзон 1 mIgM; SEQ ID NO: 7), как показано на рис. 9.
Описанные выше нацеленные ES клетки (MAID 6013) использовали в качестве доноров ES клеток и вводили в эмбрион мыши на 8-клеточной стадии способом VELOCIMOUSE® (смотрите, например, US 7576259, US 7659442, US 7294754, US 2008-0078000 A1). Мышей, несущих генетически модифицированный локус тяжелой цепи иммуноглобулина, содержащий описанные в настоящем документе генные сегменты D тяжелой цепи человека с гистидиновыми заменами, идентифицировали путем генотипирования с использованием праймеров и зондов, представленных на фиг. 8. Полученную генетически модифицированную F0 мышь скрещивали с мышью дикого типа для получения потомства F1. Детенышей F1 генотипировали, и детенышей F1, которые были гетерозиготны по генетически модифицированному локусу иммуноглобулина, содержащему генные сегменты D тяжелой цепи человека с гистидиновыми заменами, отбирали для дальнейшей характеристики.
Пример 2. Анализ реаранжированных нуклеотидных последовательностей вариабельной области тяжелой цепи
Далее исследовали, может ли генетически модифицированная мышь, содержащая описанные в настоящем документе генные сегменты D человека с гистидиновыми заменами, например, 6013 F0 гетерозиготная мышь, которая содержит в своей зародышевой линии полученную из линии 129 хромосому, содержащую генные сегменты VH, JH человека и генные сегменты D человека с гистидиновыми заменами (HD 1.1-6.6 (9586 п. н.; SEQ ID NO: 1), HD 1.7-6.13 (9268 п. н.; SEQ ID NO: 2), HD 1.14-6.19 (9441 п. н.; SEQ ID NO: 3) и HD 1.20-6.25, 1.26 (11592 п. н.; SEQ ID NO: 4), экспрессировать реаранжированные последовательности V(D)J тяжелой цепи, содержащие один или несколько кодонов гистидина, полученные из генетически модифицированного локуса тяжелой цепи иммуноглобулина.
В связи с этим, последовательности мРНК, выделенных из В клеток селезенки 6013 F0 гетерозиготных мышей, анализировали с помощью полимеразной цепной реакции с обратной транскрипцией (RT-PCR) на наличие последовательностей CDR3 IgM, полученных из генных сегментов D человека с гистидиновыми заменами.
Кратко, селезенки собирали и гомогенизировали в 1×PBS (Gibco) с использованием стеклянных слайдов. Клетки осаждали в центрифуге (с ускорением 500 g в течение 5 минут), и эритроциты лизировали в лизирующем буфере АСК (Gibco) в течение 3 минут. Клетки отмывали 1xPBS и фильтровали с использованием сетчатого фильтра с ячейками 0,7 мкм. В-клетки выделяли из клеток селезенки с использованием магнитной позитивной селекции MACS для CD 19 (Miltenyi Biotec). Всю РНК выделяли из осажденных В-клеток с использованием набора RNeasy Plus (Qiagen). ПолиА + мРНК выделяли из всей РНК с использованием Oligotex® Direct mRNA mini kit (Qiagen).
Двухцепочечную кДНК получали из мРНК В-клеток селезенки с помощью 5ʹ RACE с использованием набора SMARTer™ Pico cDNA Synthesis Kit (Clontech). Обратную транскриптазу Clontech и dNTP заменяли Superscript II и dNTP от Invitrogen. Репертуары вариабельных областей тяжелых цепей (VH) антител амплифицировали из кДНК с использованием праймеров, специфичных к константным областям IgM и праймера SMARTer™ 5ʹ RACE (таблица 1). ПЦР-продукты очищали с использованием набора для очистки QIAquick® PCR (Qiagen). Второй раунд ПЦР проводили с использованием того же праймера 5ʹ RACE и вложенного праймера 3ʹ, специфичного к константным областям IgM (таблица 2). Продукты второго раунда ПЦР очищали с использованием системы SizeSelect™ E-gel® (Invitrogen). Третий раунд ПЦР выполняли с использованием праймеров, которые добавляли 454 адаптеров и штрих-коды. Продукты третьего раунда ПЦР очищали с использованием гранул Agencourt® AMPure® ХР. Очищенные продукты ПЦР количественно определяли с помощью SYBR®-qPCR с использованием набора KAPA Library Quantification Kit (KAPA Biosystems). Объединенные библиотеки подвергались эмульсионной ПЦР (emPCR) с использованием набора 454 GS Junior Titanium Series Lib-A emPCR Kit (Roche Diagnostics) и двунаправленному секвенированию с использованием прибора Roche 454 GS Junior в соответствии с протоколами изготовителя.


Биоинформативный анализ
454 последовательности сортировали на основе идеального соответствия штрих-кода образца и уменьшали по качеству. Последовательности аннотировали на основе выравнивания реаранжированных последовательностей Ig по отношению к базе данных сегментов V, D и J зародышевой линии человека с использованием локальной установки igblast (NCBI, v2.2.25+). Последовательность помечали как неоднозначную и удаляли из анализа, когда обнаруживали множественные лучшие попадания с идентичным показателем. Набор Perl-скриптов разработывали для анализа результатов и сохранения данных в базе данных mysgl. Область (SEQ ID NO: 320) для легких цепей и мотивом WGXG (SEQ ID NO: 321) для тяжелых цепей. Длину CDR3 определяли с использованием только продуктивных антител.
Как показано на фиг. 11-13, 6013 F0 гетерозиготные мыши экспрессировали разнообразный репертуар реаранжированных последовательностей мРНК вариабельной области тяжелый цепи (реаранжированные последовательности VDJ), кодирующие один или несколько гистидиновые кодоны, которые появились в CDR3, получали из генетически модифицированном локусе тяжелой цепи иммуноглобулина у описанных в настоящем документе 6013 мышей.
Пример 3. Использование гистидина в антиген-специфических легких цепях человека
Выравнивали аминокислотные последовательности выбранных легких цепей из антиген-специфических антител человека. Идентифицировали гистидиновые мутации в CDR полученных из Vκ1-39 легких цепей человека для выбранного числа антиген-специфических человеческих антител (фиг. 15). Полученные из Vκ1-39 легкие цепи человека изолировали из иммунизированных мышей, сконструированных для включения единственной реаранжированной легкой цепи Vκ1-39 человека (смотрите US 2011/0195454 А1), и несения соматических гипермутаций, как производимых в репертуаре антител мыши.
Остатки гистидина встраивали в реаранжированную легкую цепь Vκ1-39 человека с использованием известных в настоящей области техники способов молекулярного мутагенеза. Положение этих сконструированных остатков показаны на фиг. 16.
Вариабельные области полученных из Vκ1-39 легких цепей человека, содержащие встроенные остатки гистидина, конструировали и образовывали пары с различными вариабельными областями тяжелых цепей человека в формате антител, специфических к рецептору клеточной поверхности человека, для анализа экспрессии в клетках CHO.
Клетки CHO, содержащие определенную тяжелую цепь и легкую цепь с указанными его модификациями (например, 105, 106, 108, 111), высевали в лунки 48-луночного планшета. На следующий день ДНК, соответствующую тяжелой цепи и легкой цепи, в равной массе (400 нг) смешивали с реагентом для трансфекции (Lipofectin 2000), позволяя образовывать комплекс путем инкубации, и комплекс добавляли к клеткам в планшете. Четыре дня спустя собирали среду. Среда содержала экспрессированное антитело.
Клетки CHO, содержащие различные тяжелые цепи в паре с такой же легкой цепью, содержащей одну или несколько замен гистидина в CDR3, экспрессируют в лунке. Определяли уровень (нг/мл) экспрессии антитела в нг/мл обнаруживали в супернатантах клеток CHO, трансфицированных с генами антител, содержащих остатки гистидина, встроенные в выбранные положения в CDR3 легких цепей.
Экспрессия в супернатантах клеток CHO спаренных антиген-специфических тяжелых цепей с встроенным в легкие цепи гистидином с использованием отдельных тяжелых цепей, измеряемых блоттингом белков, показана на фиг. 18. ULC относится к реаранжированной полученной из Vκ1-39 легкой цепи человека.
Аликвоту среды подвергали анализу на приборе BIACORE™ с использованием антигена-мишени для антитела (последовательность рецептора клеточной поверхности). Антитела захватывали на чипе. Уровень захваченных антител показан на фиг. 19A-19J как RU. Захваченные антитела на чипе BIACORE™ подвергали потоку, содержащему последовательность антигена-мишени. Как показано, измеряли захват антителом антигена-мишени, а также скорость ассоциации и другие параметры. Поток антигена останавливали, и скорость диссоциации определяли как антиген, отделенный от связанного антитела.
Равновесные константы диссоциации (KD) (очевидно) для отдельных супернатантов антител определяли с помощью SPR (поверхностного плазмонного резонанса) с использованием прибора BIACORE™ Т100 (GE Healthcare). Кинетику измеряли при pH 7,4 и при pH 5,75. Результаты показаны на фиг. 19A-19J.
Как показано на фиг. 19A-19J, данные для связывания антител с рецептором клеточной поверхности, где легкие цепи были модифицированы для кодирования остатков гистидина в конкретных положениях CDR для легких цепей Vκ1-30/Jκ5, спаренных с указанными тяжелыми цепями, показывают, что модификации гистидина непосредственно влияют на связывание антигена (например, рецептора клеточной поверхности) с различными аффинностями при значении pH 7,4 и значении pH 5,75. Желательны гистидиновые модификации, которые сохраняют связывание при значении pH 7,4, но которые проявляют низкое связывание или незаметное связывание при значении pH 5,75.
Пример 4. Идентификация остатков гистидина в антиген-специфических легких цепях человека
Получение мыши с общей легкой цепью (например, мыши с общей легкой цепью Vκ1-39 или Vκ3-20) и антиген-специфических антител у тех мышей, описано в заявках на патент США №13/022759, 13/093156 и 13/412936 (публикация №2011/0195454, 2012/0021409 и 2012/0192300, соответственно). Вкратце, нацеливающий вектор реаранжированной легкой цепи зародышевой линии человека получали с использованием технологии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6): 652-659)), для модификации мышиных геномных клонов бактериальной искусственной хромосомы (BAC), и геномные конструкты разрабатывали для включения единственной реаранжированной области легкой цепи зародышевой линии человека, и встраивали в эндогенный локус легкой цепи κ, который ранее модифицировали для удаления эндогенных генных сегментов вариабельных и соединяющих κ. Нацеленные ДНК ВАС затем использовали для электропорации ES клеток мыши для создания модифицированных ES клеток для получения химерных мышей, которые экспрессируют реаранжированные области Vκ1-39Jκ5 или Vκ3-20Jκ1 зародышевой линии человека. Нацеленные ES клетки использовали в качестве донорских ES клеток и вводили в эмбрион мыши на стадии 8-клеток с помощью способа VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1): 91-99). VELOCIMICE® независимо несущие сконструированную область легкой цепи Vκ1-39Jκ5 или Vκ3-20Jκ1 зародышевой линии человека идентифицировали путем генотипирования с использованием анализа модификации аллеля (Valenzuela et al., смотрите выше), который обнаруживает наличие уникальной реаранжированной области легкой цепи зародышевой линии человека.
Мышей, несущих сконструированный локус легкой цепи зародышевой линии человека (ULC мышей), скрещивали с мышами, которые содержат замещение эндогенного локуса вариабельного гена тяжелой цепи мыши с локусом вариабельного гена тяжелой цепи человека (смотрите US 6596541; the VELOCIMMUNE® mouse, Regeneron Pharmaceuticals, Inc.).
VELOCIMMUNE® мышь, содержащая единственную реаранжированную область легкой цепи зародышевой линии человека сенсибилизируют представляющим интерес антигеном, и антитела, содержащие универсальную легкую цепь (например, Vκ1-39Jκ5), изолируют и секвенируют. Выравнивали аминокислотные последовательности выбранных легких цепей (А-K) из антиген-специфических антител человека, полученных от мыши с общей легкой цепью Vκ1-39Jκ5. Идентифицировали гистидиновые мутации в CDR полученных от Vκ1-39 легких цепей человека для выбранного числа антиген-специфических человеческих антител (фиг. 15). Частичная аминокислотная последовательность вариабельного домена Vκ1-39Jκ5 зародышевой линии показана над выравниваниями и представлена в SEQ ID NO: 325, полная аминокислотная последовательность вариабельного домена представлена в SEQ ID NO: 404.
Пример 5. Конструирование и характеристика антител человека с универсальными легкими цепями с заменами гистидина
Пример 5.1. Встраивание остатков гистидина в реаранжированную легкую цепь зародышевой линии человека Остатки гистидина встраивали в реаранжированную легкую цепь Vκ1-39Jκ5 человека с использованием праймеров сайт-направленного мутагенеза, специально разработанных для введения сконструированных остатков гистидина в положения Q105, Q106, Y108 и Р111 легкой цепи Vκ1-39Jκ5 человека. Сайт-направленный мутагенез проводили с использованием молекулярных техник, известных в настоящей области техники (например, QuikChange II XL Site Directed Mutagenesis Kit, Agilent Technologies). Положения встроенных остатков в CDR3 показаны на фиг. 16, последовательности нуклеиновых кислот CDR3 с заменами гистидинов, изображенные на фиг. 16, приведены в SEQ ID NO 328, 330, 332, 334, 336, 338, 340, 342, 344, 346, 348, 350, 352, 354 и 356 (соответствующие аминокислотные последовательности представлены в SEQ ID NO: 329, 331, 333, 335, 337, 339, 341, 343, 345, 347, 349, 351, 353, 355 и 357). Последовательности нуклеиновых кислот и аминокислот CDR3 реаранжированных Vκ1-39Jκ5 зародышевой линии, представлены в SEQ ID NO: 326 и 327, соответственно.
Пример 5.2. Конструкция и экспрессия легких цепей со встроенными гистидинами
Полученные из Vκ1-39 легкие цепи человека, содержащие зародышевую линию со встроенными остатками гистидина, полученные в соответствии с примером 2, конструировали и спаривали с различными тяжелыми цепями человека (обозначены 1-5), специфичными к рецептору клеточной поверхности человека, для анализа экспрессии в клетках CHO. Пять тяжелых цепей человека, специфичных к рецептору клеточной поверхности человека, которые были спарены с полученными из Vκ1-39 легких цепей с заменами гистидинов, получали от мышей, которые содержат единственную реаранжированную легкую цепь человека (реаранжированную легкую цепь Vκ1-39/Jκ5 человека; смотрите US 2011/0195454 A1).
Иммуноферментный анализ (ELISA): секрецию антител из клеток CHO обнаруживали с помощью Fc ELISA для легких цепей с указанными модификациями гистидина с пятью различными тяжелыми цепями. Последовательности легких и тяжелых цепей (но без модификаций) получали на мышах, которые содержат единственную реаранжированную легкую цепь человека (например, реаранжированную легкую цепь Vκ1-39/Jκ5 человека, смотрите US 2011/0195454 A1). Захватывающим антителом было козье к IgG человека и обнаруживающим антителом было козье к HRP человека (Fc гамма-специфическое). Результаты показаны на фиг. 17.
ULC + тяжелая: специфическая тяжелая цепь и не модифицированная производная от Vκ1-39 легкая цепь человека. Как показано на фиг. 17, экспрессию обнаруживали приблизительно у всех мутантов.
Иммуноблоттинг белка. Экспрессию в супернатантах клеток CHO спаренных антиген-специфических тяжелых цепей с легкими цепями со встроенным гистидином дополнительно анализировали с помощью вестерн-блоттинга. Образцы подвергали электрофорезу на 4-12% трис-глициновом геле. Результаты использования выбранной тяжелой цепи (тяжелой цепи 3) показаны на фиг. 18. ULC относится к реаранжированной полученной из Vκ1-39 легкой цепи человека (как описано выше).
Пример 5.3. Определение аффинности связывания легких цепей со встроенным гистидином
Равновесные константы диссоциации (KD), диссоциационные периоды полувыведения (t1/2) и другие кинетические параметры для выбранных супернатантов антител определяли с помощью SPR (поверхностного плазмонного резонанса) с использованием прибора BIACORE™ Т200 (GE Healthcare). Кинетические параметры измеряли при pH 7,4 и при pH 5,75. Результаты показаны на фиг. 20А - 20Е.
Числовые значения для свойств кинетики связывания (например, ka, kd, KD, t½ и т.д.) антител, связывающихся с иммуногеном при нейтральном значении pH (pH 7,4) и при кислом значении pH (pH 5,75) получали с использованием биосенсора поверхностного плазмонного резонанса в реальном времени (Biacore Т200). Сенсорный чип Biacore СМ5 получали с использованием мышиного антитела к Fc человека для захвата антител из супернатанта. Одну концентрацию (50 нм) иммуногена затем вносили на поверхность с захваченными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали в течение 2,5 минут, а затем наблюдали диссоциацию антигена от захваченного антитела в течение 8 минут. Константы скорости кинетической ассоциации (ka) и диссоциации (kd) определяли путем обработки и подгонки данных связывания 1:1 с массовой транспортной моделью с использованием программного обеспечения Biacore Т200 Evaluation версии 1.0. Равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t½) рассчитывали из констант кинетической скорости как: KD (М)=kd/ka; и t½ (мин)=(ln2/(60*kd).
Как показано на фиг. 20 в анализе связывания антитела с рецептором клеточной поверхности, двое из пяти антител с общими легкими цепями с модифицированными гистидинами (CDR3 легких цепей Vκ1-39/Jκ5 с модифицированными гистидинами), которые были спарены с антиген-специфическими тяжелыми цепями человека, проявляющими связывание с антигеном (например, с рецептором клеточной поверхности) с различными аффинностями при pH 7,4 и pH 5,75. Желательны антитела с модификациями гистидина, которые сохраняют связывание при значении pH 7,4, но проявляют сниженное связывание или не обнаруживаемое связывание при значении pH 5,75. Желательны антитела с модификацией гистидина, которые демонстрируют сниженный t½ при значении pH 5,75, по сравнению с pH 7,4.
Данные связывания антигена для трех антител, содержащих общие легкие цепи с модифицированным гистидином и три антиген-специфические тяжелые цепи (обозначенные 2, 3 и 6) при различных значениях pH суммировали дополнительно на фиг. 21. Эти антитела проявляли значительное падение в связывании антигена при значении pH 5,75, по сравнению с pH 7,4, о чем свидетельствует, например, сокращение в ty2 или не обнаруженное связывание при значении pH 5,75.
Пример 6. Конструирование и характеристика генетически модифицированной мыши, содержащей универсальную легкую цепь Vκ1-39Jκ5 с заменами гистидина
Пример 6.1. Конструкция нацеливающего вектора для встраивания остатков гистидина в реаранжированную вариабельную область легкой цепи человека
Генетически модифицированную мышь, содержащую реаранжированный ген легкой цепи человека, содержащий остатки гистидина, встроенные в область CDR легкой цепи человека, получали с помощью нацеливающих векторов, полученных с помощью стандартных техник молекулярного клонирования, известных в настоящей области техники.
Кратко, различные реаранжированные нацеливающие векторы легкой цепи зародышевой линии человека получают с использованием технологии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659) для модификации геномной ДНК бактериальной искусственной хромосомы (ВАС) мыши для включения единственной реаранжированной области легкой цепи зародышевой линии человека и вставляют в эндогенный локус легкой цепи κ, который был ранее модифицирован для удаления эндогенных генных сегментов вариабельных и соединяющих κ. Реаранжированную область легкой цепи зародышевой линии человека модифицировали в одном или нескольких положениях нуклеотидов в последовательности легкой цепи для кодирования остатков гистидина, которые обычно не присутствуют в соответствующих положениях в последовательности зародышевой линии. Для создания нацеливающие векторы электропорировали в мышиные эмбриональные стволовые (ES) клетки и подтверждали с использованием анализа количественной ПЦР (например, TAQMAN™).
В частности, стратегия для конструирования этих нацеливающих векторов показана на фиг. 23А - 23F. Плазмиду, используемую для производства нацеливающего вектора для мыши с общей (универсальной) легкой цепью ("ULC мыши", описанной, например, в US2011/0195454A1), содержащего pBS + FRT-Ub-Hyg-FRT + лидер Vκ3-7 мыши + Vκ1-39Jκ5 человека, модифицировали с помощью сайт-направленного мутагенеза (QuickChange II Kit XL) для замещения Q105, Q106, Y108 и P111 или Q106, Y108 и P111 остатками гистидина в области CDR3 с использованием праймеров сайт-направленного мутагенеза, показанных на фиг. 22 (смотрите фиг. 23А для этой стадии встраивания). Результирующие векторы (Н105/106/108/111 и Н106/108/111) дополнительно модифицировали и лигировали в вектор, содержащий константную область Igκ мыши, энхансеры мыши, плечо гомологии 3ʹ мыши и кассету SPEC (фиг. 23В). Дополнительная модификация включала в себя лигацию в вектор, несущий плечо 5ʹмыши и содержащий кассету Frt-Ub-NEO-Frt (фиг. 23В). Результирующие нацеливающие векторы электропорировали в ES клетки, содержащие делецию вариабельного локуса Igκ мыши (содержащего вариабельные и соединяющие генные сегменты κ) (фиг. 23C - 23F).
Позитивные клоны ES клеток подтверждали с использованием модификации аллельного анализа (Valenzuela et al.) с использованием зондов, специфичных к сконструированной области легкой цепи Vκ1-39Jκ5, вставленных в эндогенный локус легкой цепи κ. Используемые в анализе праймеры и зонды представлены в таблице 3 ниже и представлены в списке последовательностей; места расположения зондов изображены на фиг. 23C - 23F.

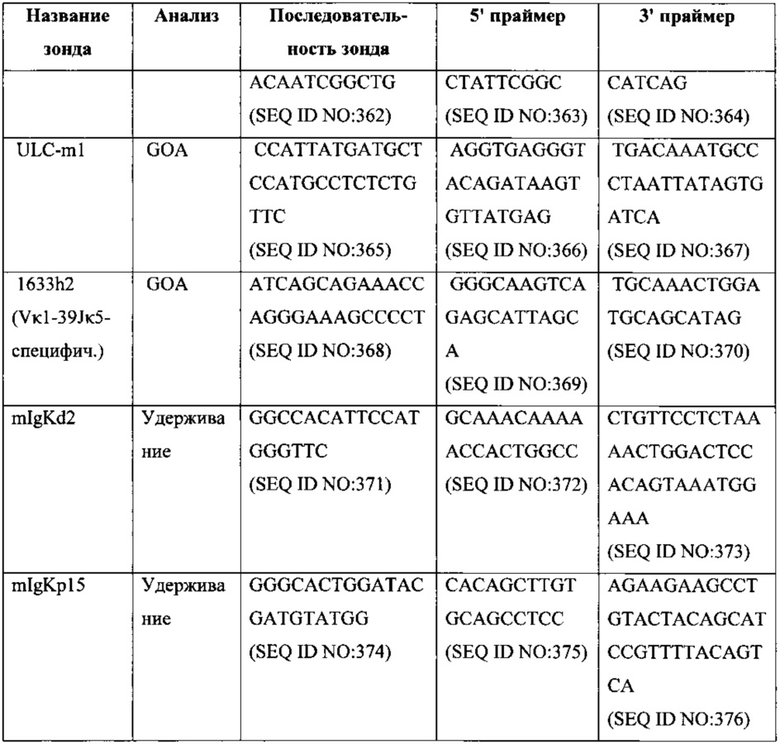
Кассету отбора NEO, введенную с помощью нацеливающих конструкторов, удаляли с помощью трансинфекции ES клеток с плазмидой, которая экспрессирует FLP (фиг. 23C и 23E). Необязательно, неомициновая кассета может быть удалена путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, US6774279). Необязательно, неомициновая кассета сохраняется у мышей.
Описанные выше нацеленные ES клетки использовали в качестве доноров VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1): 91-99). VELOCIMICE® независимо несущие сконструированный ген легкой цепи человека, который содержит остатки гистидина, мутировавшие в одном или нескольких положениях по последовательности, получали из описанных выше нацеленных ES клеток.
Детенышей генотипировали и выбирали детенышей, гетерозиготных по сконструированным легким цепям человека с модифицированным гистидином, для характеристики экспрессии легкой цепи и связывающих возможностей экспрессированных антител. Праймеры и зонды для генотипирования мышей, специфически содержащих универсальный ген легкой цепи либо с тремя (H106/108/111; "1930"), либо с четырьмя (H105/105/108/111; "1927") модификациями гистидина, перечислены в таблице 4 ниже и приведены в списке последовательностей. Мыши, содержащие модификацию гистидина в своих универсальных легких цепях, называются в настоящем документе как "HULC" мыши (мыши с гистидин-универсальными легкими цепями).
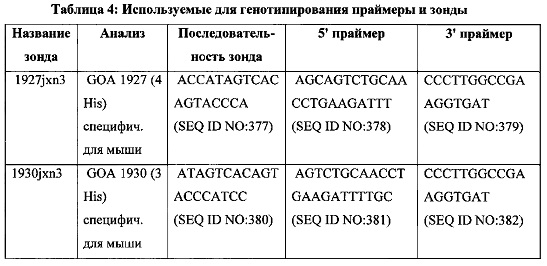
Пример 6.2. Анализ иммунного ответа на антиген у мышей с универсальными легкими цепями с заменами гистидина
Рецептор клеточной поверхности (“антиген A”) использовали в качестве иммуногена для иммунизации мышей, которые были либо гетерозиготными по экспрессии заранее подготовленной легкой цепи каппа человека, использующей Vk1-39 и Jk5, который содержит 4 гистидиновые замены в CDR3 (далее “HULC 1927”), либо гетерозиготными по экспрессии заранее подготовленной легкой цепи каппа человека, использующей Vk1-39 и Vk5, который содержит 3 гистидиновые замены CDR3 (далее "HULC 1930"), либо гомозиготных мышей WT. Предварительно иммунную сыворотку собирали у мышей до начала иммунизации. Иммуноген вводили для начальной примированной иммунизации в количестве 2,35 мкг белка, смешанного с 10 мкг олигонуклеотида CpG в качестве адъюванта (Invivogen) в объеме 25 мкл через подушечку лапы (FP). Впоследствии, мышей повторно иммунизировали тем же путем в количестве 2,35 мкг антигена А вместе с 10 мкг CpG и 25 мкг Adju-Phos (Brenntag) в качестве адъювантов на 3, 6, 11, 13, 17, 20 день для достижения в общей сложности шести повторных иммунизаций. У мышей брали кровь на 15 и 22 дни после четвертой и шестой повторной иммунизации, соответственно, и антисыворотку оценивали на титры антител с антигеном А.
Титры антител сыворотки против иммуногена определяли с использованием стандартного анализа ELISA. Для выполнения ELISA 96-луночные планшеты для микротитрования (Thermo Scientific) покрывали 2 мкг/мл антигена А в фосфатном буфере (PBS, Irvine Scientific) в течение ночи при 4°C. На следующий день планшеты отмывали фосфатным буфером, содержащим 0,05% Tween 20 (PBS-T, Sigma-Aldrich) четыре раза, используя машину для мойки планшетов (Molecular Devices). Затем планшеты блокировали с помощью 250 мкл 0,5% бычьего сывороточного альбумина (BSA, Sigma-Aldrich) в PBS и инкубировали в течение 1 часа при комнатной температуре. Затем планшеты отмывали четыре раза в PBS-T. Сыворотки от иммунизированных мышей и предварительные иммунные сыворотки серийно разводили в три раза в 0,5% BSA PBS-T, начиная с 1:300 или 1:1000, добавляли к блокированным планшетам в двух экземплярах и инкубировали в течение 1 часа при комнатной температуре. Последние две лунки оставляли пустыми для использования в качестве вторичного антитела контроля (фоновый контроль). Планшеты снова отмывали четыре раза PBS-T в машине для мойки планшетов. Козье антитело к мышиному конъюгированному вторичному антителу IgG-Fc-пероксидаза хрена (HRP, Jackson Immunoresearch) затем добавляли в планшеты в разведении 1:5000/1:10000 и инкубировали в течение одного часа при комнатной температуре. Планшеты снова отмывали восемь раз PBS-T и развивали с использованием в качестве субстрата ТМВ/Н202. Субстрат инкубировали в течение двадцати минут, и реакцию останавливали с помощью 2 N серной кислоты (H2S04, VWR, кат.# BDH3500-1) или 1 N фосфорной кислоты (JT Baker, кат.# 7664-38-2). Планшеты считывали на спектрофотометре (Victor, Perkin Elmer) при 450 нм. Титры антител рассчитывали с использованием программного обеспечения Graphpad PRISM.
Индуцированный у мышей к введенному иммуногену иммунный ответ представляли как титры антител, которые определяются как величина, обратная наибольшему разведению сыворотки, при котором антигенсвязывающая абсорбция в два раза выше фоновой. Таким образом, чем больше число, тем больше гуморальный иммунный ответ на иммуноген. Индуцированные к иммуногену титры антител были очень высокими как в обеих линиях HULC мышей, так и у мышей дикого типа, без наблюдаемых существенных различий среди линий (фиг. 24).
Пример 6.3. Получение чувствительных к pH моноклональных антител
Когда требуемый иммунный ответ на иммуноген достигал как в обеих линиях HULC мышей, так и у мышей дикого типа, спленоциты из каждой линии мышей собирали и сливали с клетками миеломы мыши, чтобы производить гибридомные клетки, которые позволяли расти в 96-луночных планшетах. После 10 дней роста супернатанты от каждой содержащей клетки гибридомы лунки подвергали скринингу с помощью иммуноген-специфического анализа ELISA для идентификации позитивных антигенсвязывающих образцов. Для ELISA 96-луночные планшеты для микротитрования покрывали 1 мкг/мл поликлональным антителом к myc (Novus Biologicals, #NB600-34) в течение ночи при 4°C для иммобилизации тус-меченого антигена с последующим блокированием раствором 0,5% (вес/объем) БСА в PBS. Планшеты отмывали, растворы антигена добавляли в планшеты в концентрации 1 мкг/мл и позволяли связаться с покрытым планшетом в течение 1 часа при комнатной температуре. Затем супернатанты от гибридомных клеток добавляли к лункам при разведении 1:50 и оставляли для связывания в течение 1 часа при комнатной температуре. Связавшие антитела планшеты детектировали с использованием поликлонального антитела к IgG мыши, конъюгированного с HRP (Jackson Immunoresearch, #115-035-164). ТМВ субстраты добавляли к планшетам (BD Biosciences, # 51-2606KC/51-2607KC), и колориметрические сигналы разрабатывали в соответствии с рекомендованным производителем протоколом. Абсорбцию записывали при 450 нм на планшетном ридере Victor Wallac. Образцы положительных антигенов, определенные как характеризующиеся OD равным или более, чем 0,5 (с базовым OD приблизительно 0,1) подвергали скринингу на аффинность с использованием биосенсора поверхностного плазмонного резонанса в режиме реального времени (Biacore 4000).
Записывали кинетические параметры связывания (например, ka, kd, KD, t½ и т.д.) антител, связывающихся с иммуногеном при нейтральном значении pH (pH 7,4) и при кислых значениях pH (pH 6,0). Сенсорный чип Biacore СМ4 получали с использованием поликлонального козьего антитела к Fc мыши для захвата антител из супернатанта. Одну концентрацию (100 нм) иммуногена затем вносили на поверхность с захваченными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали в течение 1,5 минут, а затем диссоциацию антигена от захваченного антитела наблюдали в течение 2,5 мин. Константы скорости кинетической ассоциации (ka) и диссоциации (kd) определяли путем обработки и подгонки данных к связыванию 1:1 с массовой транспортной моделью с использованием программного обеспечения Biacore Т200 Evaluation версии 1.0. Равновесные константы диссоциации (KD) и диссоциационные периоды полувыведения (t½) рассчитывали из констант кинетической скорости как: KD (М)=kd/ka; и t½ (мин) = ln2/(60*kd). Набор образцов, которые отображали сниженное связывание при значении pH 6,0, по сравнению с тем же при значении pH 7,4 (чувствительность к pH), а также набор контрольных образцов, которые не отображали никаких существенных изменений скорости между значениями pH 7,4 и pH 6,0 (не чувствительные к pH контроли) выбирали для клонального производства. На фиг. 25 изображено сравнение числа всех положительных антигенов и числа положительных антигенов, отображающих чувствительное к pH связывание антигена от HULC и WT мышей.
Среди положительных антигенов сделали моноклональными 18 и 7 клонов, выделенных из двух гетерозиготных HULC 1927 мышей и двух HULC 1930, соответственно, и 1 клон от мыши WT. Супернатанты из моноклональных гибридом подвергали анализу скорости диссоциации антигена при нейтральном и низком значении pH (скорость диссоциации), и клеточные осадки использовали для секвенирования ДНК вариабельного домена легкой цепи.
Пример 6.4. Секвенирование и соматические гипермутации в области CDR3 основанных на Vκ1-39Jκ5 мышей с гистидин-универсалъными легкими цепями
Осадки клеток из моноклональных гибридом из HULC мышей и мышей дикого типа использовали для секвенирования ДНК вариабельного домена легкой цепи. Из 26 клонов, сделанных моноклональными (пример 3.3 выше) и подвергнутых секвенированию, 15 были подтверждены как с использованием легких цепей либо HULC, либо WT мышей (MM и NN, смотрите таблицу 4). 14 клонов были получены из HULC гетерозиготных мышей (1927 или 1930) и 1 был получен из мыши WT.
Из 14 антиген положительных образцов, полученных образцов, полученных из HULC гетерозиготных мышей, 12 моноклональных антител использовали их соответствующую легкую цепь HULC, в то время как 2 использовали легкую цепь мыши WT. Все, кроме одного использующего HULC антитела, сохраняли все введенные мутации гистидина, как показано в таблице 3 (антитела курсивом). Секвенирование клона AA производили 2 разных последовательности HULC, что отражается двумя записями в таблице 5.
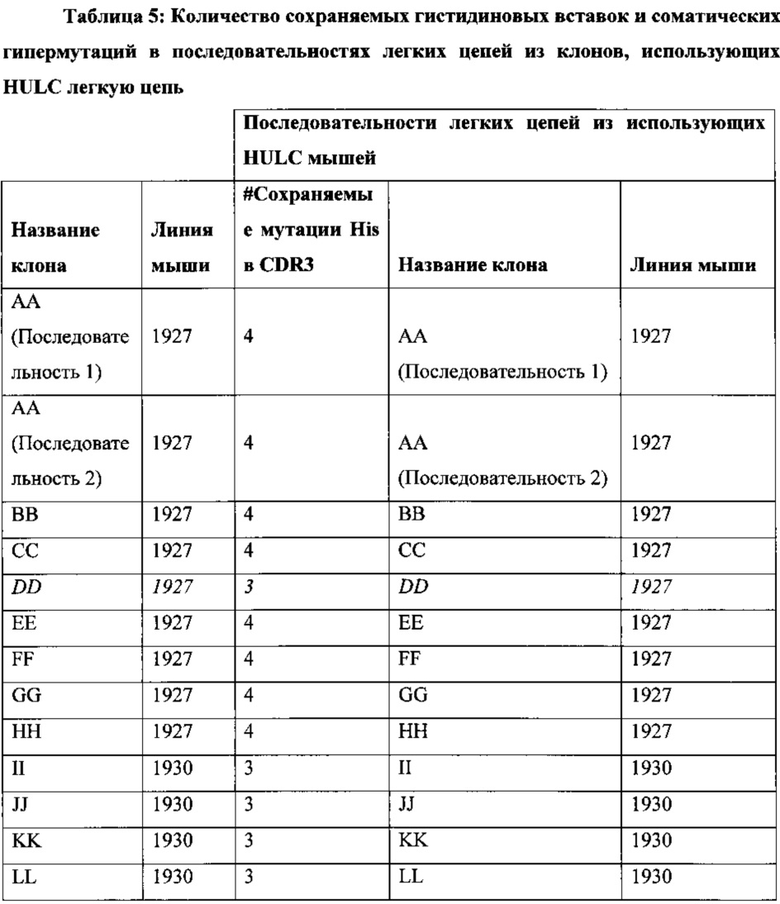
Пример 6.5. Зависимое от pH связывание моноклональных антител, полученных от основанных на Vκ1-39Jκ5 мышей с гистидин-универсальными легкими цепями
Для дальнейшей оценки зависимых от pH характеристик связывания моноклональных антител, выделенных из HULC мышей и мышей дикого типа, проводили эксперименты по связыванию, в которых фаза ассоциации антител а/антигена наблюдалась при нейтральном значении pH, а фаза диссоциации антител а/антигена наблюдалась как при нейтральных, так и при кислых значениях pH.
Сенсорный чип Biacore СМ4 получали с использованием поликлонального кроличьего антитела к Fc мыши. Супернатанты моноклональных антител захватывали на поверхности сенсора Fc мыши. Две концентрации, 50 нм (в двух повторах) и 16,7 нМ, иммуногена вводили на поверхность с захваченными моноклональными антителами при скорости потока 30 мкл/мин. Ассоциацию антитело-антиген наблюдали при pH 7,4 в течение 4 минут, а затем диссоциацию антигена из захваченного моноклонального антитела наблюдали в течение 15 минут как при pH 7,4, так и 6,0. Константы скорости диссоциации (kd) определяли с помощью обработки и подгонки данных с использованием программного обеспечения подгонки кривой Scrubber версии 2.0 и они показаны в таблице 6. Диссоциационный период полувыведения (t1/2) рассчитывали из констант скорости диссоциации, как: t1/2 (мин)=(ln2/kd)/60 и они показаны в таблице 6. Сенсограммы, изображающие характеристики ассоциации/диссоциации нескольких антител, перечисленные в таблице 4 при различных условиях pH, показаны графически на фиг. 26. Отдельные линии в каждом графике представляют собой связывающие реакции при различных концентрациях соответствующих антител. Все эксперименты проводились при 25°C. Значения диссоциационных периодов полувыведения (t1/2) отмечены выше соответствующих сенсограмм. Реакция измеряется в RU.
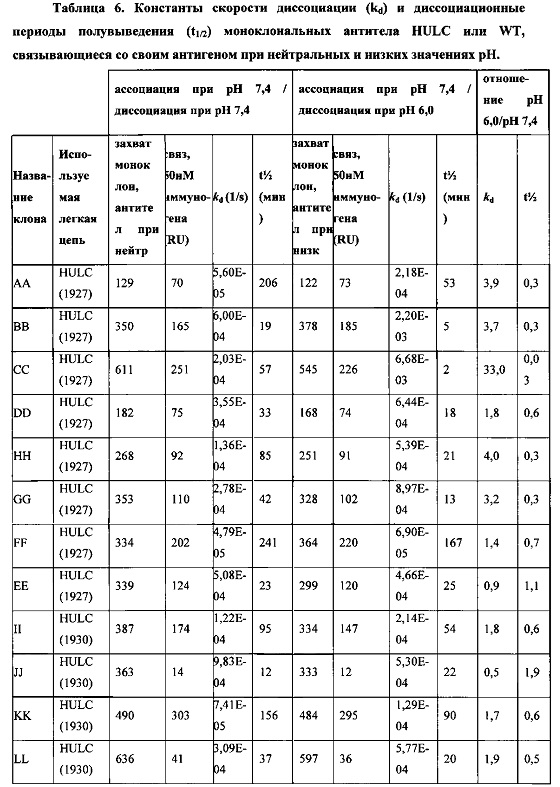
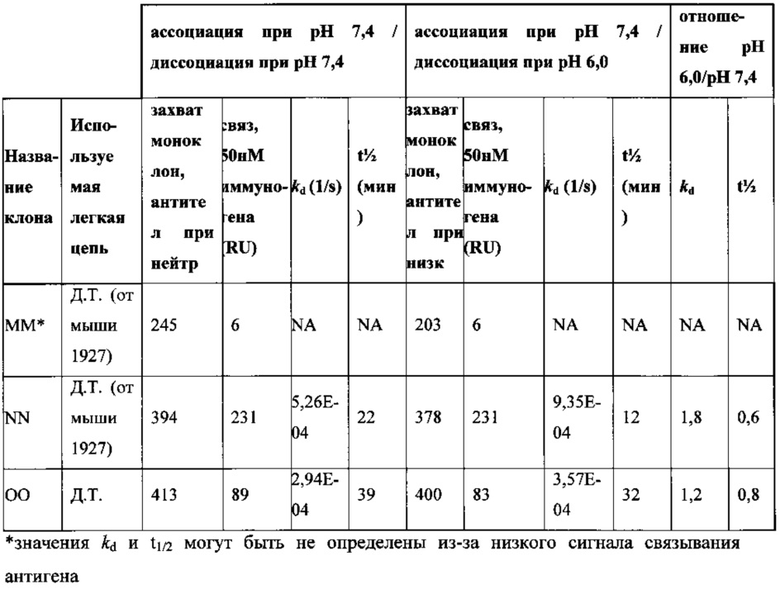
Пример 7. Конструирование генетически модифицированной мыши, содержащей универсальную легкую цепь Vκ3-20Jκ1 с заменами гистидина
Мышь, содержащую общую легкую цепь Vκ3-20Jκ1, получали как описано, например, в заявке на патент США №13/022759, 13/093156, 13/412936 и 13/488628 (публикации №2011/0195454, 2012/0021409, 2012/0192300 и 2013/0045492, соответственно), а также в примере 1 выше. Аминокислотная последовательность зародышевой линии из вариабельного домена универсальной легкой цепи Vκ3-20Jκ1 представлена в SEQ ID NO: 383.
Гистидиновые замены вводили в нацеливающий вектор универсальной легкой цепи Vκ3-20Jκ1, и получали мышей, используя подобную описанной выше в примере 3стратегию для мышей с универсальными легкими цепями Vκ1-39Jκ5 с модифицированным гистидином (HULC 1927 и 1930).
Вкратце, стратегия для получения нацеливающего вектора универсальной легкой цепи Vκ3-20Jκ1 с модификациями гистидина представлена на фиг. 29A - 29D. Плазмиду, используемую для производства нацеливающего вектора для общей (универсальной) легкой цепи мыши ("ULC мыши", описанной, например, в US 2011/0195454 А1), содержащего pBS + FRT-Ub-Hyg-FRT + лидер Vκ3-7 мыши + Vκ3-20Jκ1 человека, модифицировали с помощью сайт-направленного мутагенеза (QuickChange II Kit XL) для замещения Q105, Q106, Y107 и S109 или Q105, Q106 и S109 (смотрите выравнивание на фиг. 27) остатками гистидина в области CDR3 с использованием праймеров сайт-направленного мутагенеза, показанных на фиг. 28 (смотрите фиг. 29А для этой стадии встраивания). Результирующие векторы (Н105/106/107/109 и Н105/106/109) дополнительно модифицировали и лигировали в вектор, содержащий константную область Igκ мыши, энхансеры мыши, плечо гомологии 3ʹ мыши и кассету SPEC (фиг. 29В). Дополнительная модификация включала в себя лигацию в вектор, несущий плечо 5ʹ мыши и содержащий кассету Frt-Ub-NEO-Frt (фиг. 29В). Результирующие нацеливающие векторы электропорировали в ES клетки, содержащие делецию вариабельного локуса Igκ мыши (содержащего вариабельные и соединяющие генные сегменты к) (фиг. 29C - 29D).
Положительные клоны ES клеток подтверждали с использованием модификации аллельного анализа (Valenzuela et al.) с использованием зондов, специфических к сконструированной области легкой цепи Vκ3-20Jκ1, вставленной в эндогенный локус легкой цепи κ. Используемые в анализе праймеры и зонды представлены в таблице 7 ниже и представлены в списке последовательностей; места расположения зондов изображены на фиг. 29C - 29D.

Кассету отбора NEO, введенную с помощью нацеливающих конструктов, удаляли с помощью трансфекции ES клеток с плазмидой, которая экспрессирует FLP (фиг. 29С и 29D). Необязательно, неомициновая кассета может быть удалена путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, US 6774279). Необязательно, неомициновая кассета сохраняется у мышей.
Описанные выше нацеленные ES клетки использовали в качестве доноров ES клеток и вводили в эмбрион мыши на стадии 8-клеток способом VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99. VELOCIMICE® независимо несущие сконструированный ген легкой цепи человека, который содержит остатки гистидина, мутировавшие в одном или нескольких положениях по последовательности, получали из описанных выше нацеленных ES клеток.
Детенышей генотипировали и выбирали детенышей, гетерозиготных по сконструированным легким цепям человека с модифицированным гистидином, для характеристики экспрессии легкой цепи и связывающих возможностей экспрессированных антител. Праймеры и зонды для генотипирования мышей, специфически содержащих универсальный ген легкой цепи либо с тремя (H105/106/109; "6183"), либо с четырьмя (H105/105/108/111; "6181") модификациямигистидина, перечислены в таблице 6 ниже и приведены в списке последовательностей. Мыши, содержащие модификацию гистидина в своих универсальных легких цепях, называются в настоящем документе как "HULC" мыши (мыши с гистидин-универсальными легкими цепями).

Мышей иммунизировали представляющим интерес антигеном и исследовали на способность производить антитела с зависимым от pH связыванием.
Пример 8. Скрещивание мышей, содержащих единственную реаранжированную универсальную легкую цепь человека (HULC) с заменами гистидина
В этом примере описаны несколько других генетически модифицированных линий мышей, которые могут быть скрещены с любой из описанных в настоящем документе HULC мышей для создания множественных генетически модифицированных линий мышей, несущих множественные генетически модифицированные локусы иммуноглобулинов.
Эндогенный нокаут Igλ (KO). Чтобы оптимизировать использование сконструированного локуса легкой цепи, любое из описанных выше HULC животных (например, содержащее универсальную легкую цепь с заменами гистидина Vκ1-39Jκ5 или Vκ3-20Jκ1) может быть скрещено с другой мышью, содержащей делецию в эндогенном локусе легкой цепи λ. Таким образом, полученное потомство будет экспрессировать в качестве единственной легкой цепи реаранжированную область легкой цепи зародышевой линии человека с заменами гистидина, как описано в примерах 3 и 4 выше. Скрещивание выполняется с помощью стандартных техник, признанных в настоящей области техники, и, в качестве альтернативы, коммерческим заводчиком (например, Jackson Laboratory). Линии мышей, несущие сконструированный локус легкой цепи с заменами гистидина и делецию эндогенного локуса легкой цепи λ, подвергают скринингу на присутствие области уникальной легкой цепи и отсутствие эндогенных легких цепей λ мыши.
Гуманизированный эндогенный локус тяжелой цепи. Мышей, несущих сконструированный локус легкой цепи зародышевой линии человека с заменами гистидина (HULC мыши), скрещивают с мышами, которые содержат замещение эндогенного локуса вариабельного гена тяжелой цепи мыши локусом вариабельного гена тяжелой цепи человека (смотрите US 6596541; VELOCIMMUNE® мышь, Regeneran Pharmaceuticals, Inc.). VELOCIMMUNE® мыши содержат геном, содержащий вариабельные области тяжелой цепи человека, функционально связанные с эндогенными локусами константной области мыши таким образом, что мышь продуцирует антитела, содержащие вариабельный домен тяжелой цепи человека и константную область тяжелой цепи мыши в ответ на антигенную стимуляцию.
Получают мышей, несущих замещение эндогенного локуса вариабельной области тяжелой цепи мыши на локус вариабельной области тяжелой цепи человека и единственную реаранжированную вариабельную область легкой цепи человека с заменами гистидина в эндогенном локусе легкой цепи κ. Получают обратные химерные антитела, содержащие соматически мутировавшие тяжелые цепи (вариабельный домен тяжелой цепи человека и СH мыши) с единственной легкой цепью человека с заменами гистидина (HULC, вариабельный домен легкой цепи человека и CL мыши) при иммунизации с представляющим интерес антигеном. Идентифицируют полученные у таких мышей зависимые от pH антитела человека с использованием выделения и скрининга антител способами, известными в настоящей области техники или описанными выше. Идентифицируют нуклеотидные последовательности вариабельных областей легкой и тяжелой цепей экспрессирующих антитела В-клеток, например, чувствительные к pH антитела, и получают полностью человеческие антитела путем слияния нуклеотидных последовательностей вариабельных областей легкой и тяжелой цепей с нуклеотидными последовательностями CH и CL человека, соответственно, в подходящей системе экспрессии.
Пример 9. Потомство генетически модифицированных мышей
Описанных в настоящем документе мышей, несущих сконструированный локус легкой цепи зародышевой линии человека, содержащий ограниченный репертуар реаранжированных последовательностей вариабельной области легкой цепи человека или единственную реаранжированную последовательность вариабельной области легкой цепи человека (HULC мыши), скрещивают с мышами, которые содержат описанный в настоящем документе локус вариабельного гена тяжелой цепи человека с модифицированным гистидином. Получают мышей, и наличие последовательности легкой цепи, содержащей вариабельную область легкой цепи человека с модифицированным гистидином, и последовательности тяжелой цепи, содержащей вариабельную область тяжелой цепи человека с модифицированным гистидином, подтверждают генотипированием.
Обратные химерные антитела, содержащие тяжелые цепи с модифицированным гистидином (вариабельный домен тяжелой цепи человека с модифицированным гистидином и CH мыши) и единственную легкую цепь человека с модифицированным гистидином (HULC, вариабельный домен легкой цепи человека с модифицированным гистидином и CL мыши) получают после иммунизации с представляющим интерес антигеном. Зависимые от pH антитела человека, полученные у таких мышей, идентифицируют с использованием известных в настоящей области техники или описанных выше способов выделения антител и скрининга. Идентифицируют нуклеотидные последовательности вариабельных областей легкой и тяжелой цепей В-клеток, экспрессирующих антитела, например, чувствительные к pH антитела, и полностью человеческие антитела получают путем слияния нуклеотидных последовательностей вариабельных областей легкой и тяжелой цепей с нуклеотидными последовательностями CH и CL человека, соответственно, в подходящей системе экспрессии.
Эквиваленты
Специалистам в настоящей области техники будет понятно или они будут в состоянии определить, используя не более чем рутинные эксперименты, многие эквиваленты описанных в настоящем документе конкретных вариантов осуществления настоящего изобретения. Предполагается, что такие эквиваленты охватываются прилагаемой формулой изобретения. В то время как описанное изобретение было описано со ссылкой на его конкретные варианты осуществления, специалистам в настоящей области техники должно быть понятно, что могут быть выполнены различные изменения, и эквиваленты могут быть заменены без отхождения от сущности и объема настоящего изобретения. Кроме того, могут быть выполнены многие модификации в зависимости от конкретной ситуации, материала, состава вещества, процесса, стадии или стадий, объективной сущности и объема описанного изобретения. Предполагается, что все такие модификации находятся в пределах объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА СО ВСТРОЕННЫМ В ЛЕГКИЕ ЦЕПИ ГИСТИДИНОМ И ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2644684C2 |
| АНТИТЕЛА СО ВСТРОЕННЫМ В ЛЕГКИЕ ЦЕПИ ГИСТИДИНОМ И ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2694728C2 |
| НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ ЖИВОТНЫЕ С МОДИФИЦИРОВАННЫМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ ТЯЖЕЛЫХ ЦЕПЕЙ ИММУНОГЛОБУЛИНОВ | 2014 |
|
RU2618886C2 |
| МЫШЬ С ОБЩЕЙ ЛЕГКОЙ ЦЕПЬЮ | 2013 |
|
RU2683514C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2812814C2 |
| ГУМАНИЗИРОВАННЫЕ НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕКУ ЖИВОТНЫЕ С ОГРАНИЧЕННЫМИ ЛОКУСАМИ ТЯЖЕЛОЙ ЦЕПИ ИММУНОГЛОБУЛИНА | 2013 |
|
RU2656155C2 |
| МЫШИ С ГУМАНИЗИРОВАННОЙ ЛЕГКОЙ ЦЕПЬЮ | 2012 |
|
RU2664181C2 |
| МЫШИ С ОГРАНИЧЕННОЙ ТЯЖЕЛОЙ ЦЕПЬЮ ИММУНОГЛОБУЛИНА | 2012 |
|
RU2603090C2 |
| ГУМАНИЗИРОВАННЫЕ ГРЫЗУНЫ, КОТОРЫЕ ЭКСПРЕССИРУЮТ ТЯЖЕЛЫЕ ЦЕПИ, СОДЕРЖАЩИЕ ДОМЕНЫ VL | 2013 |
|
RU2664185C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2689664C2 |
















































































































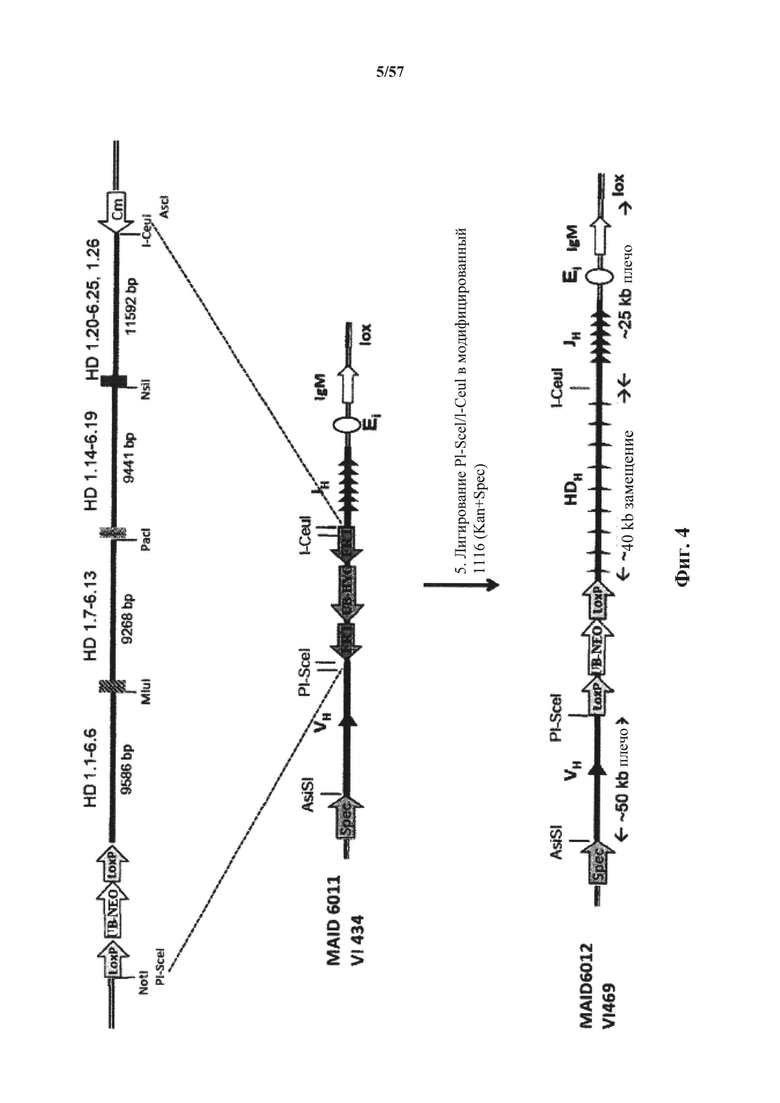
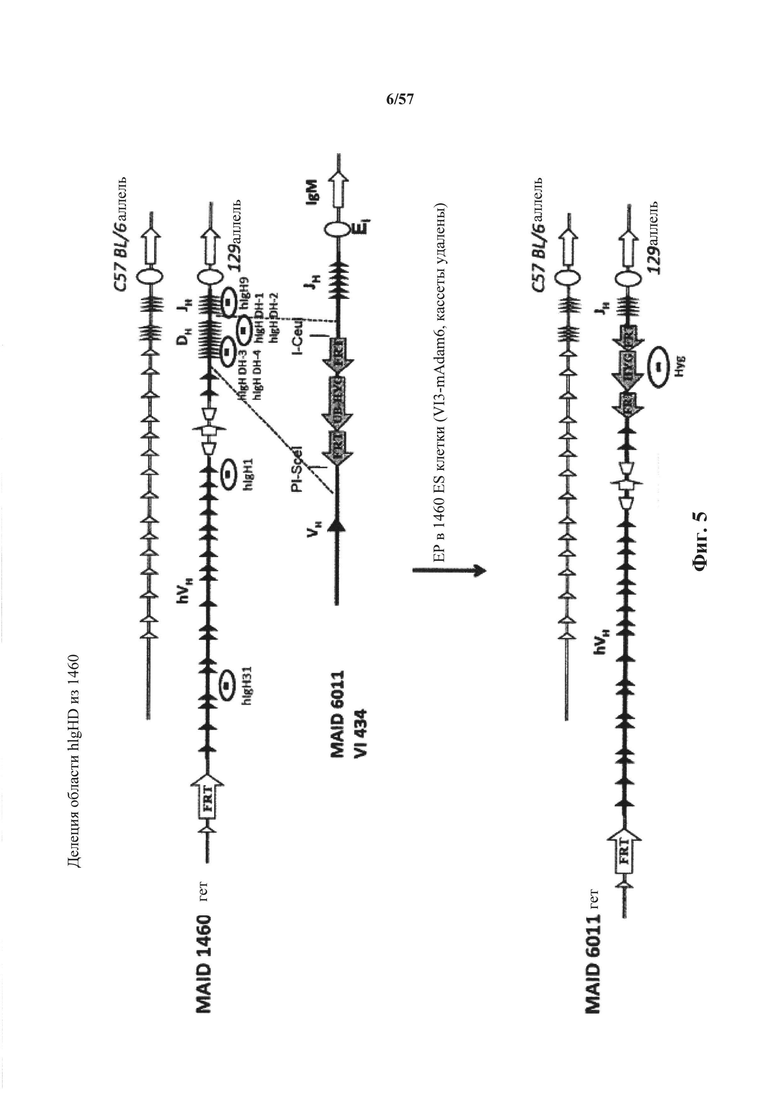
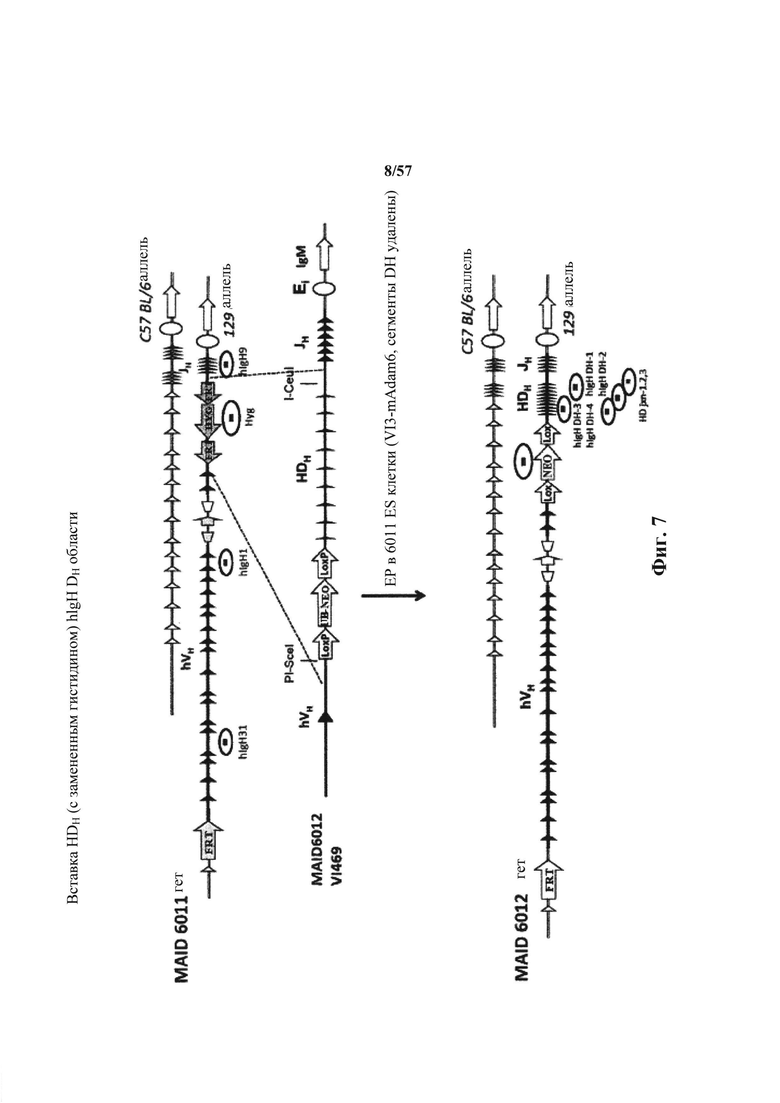

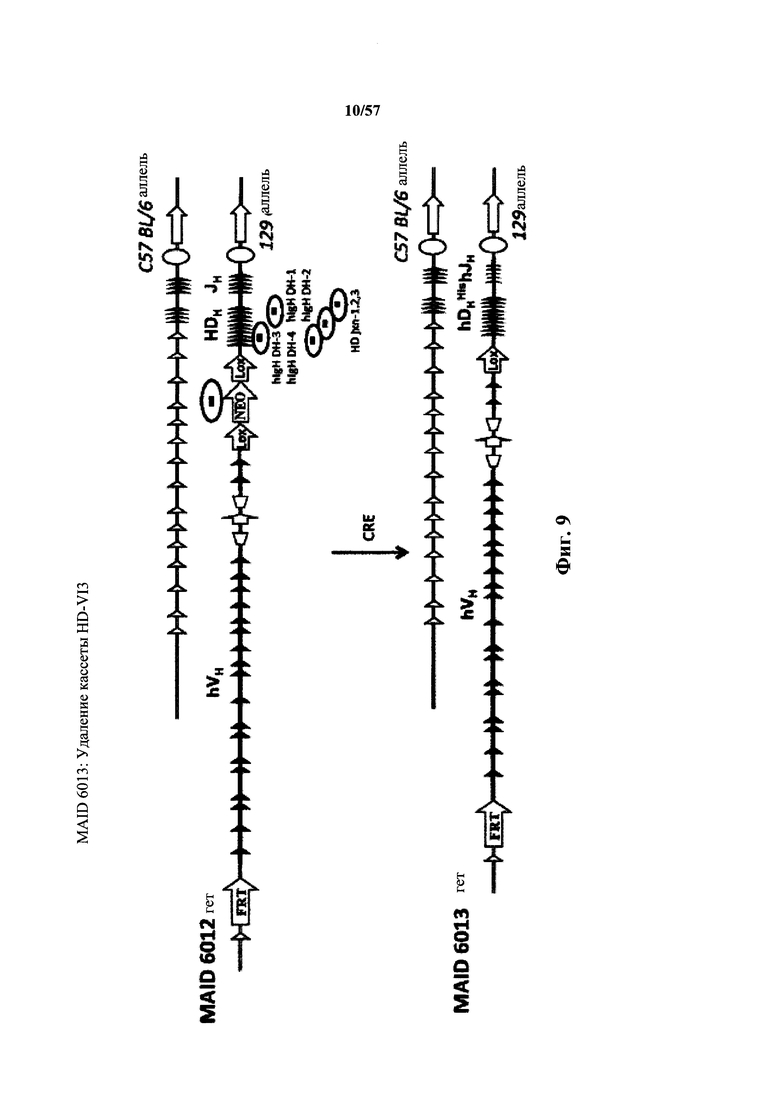
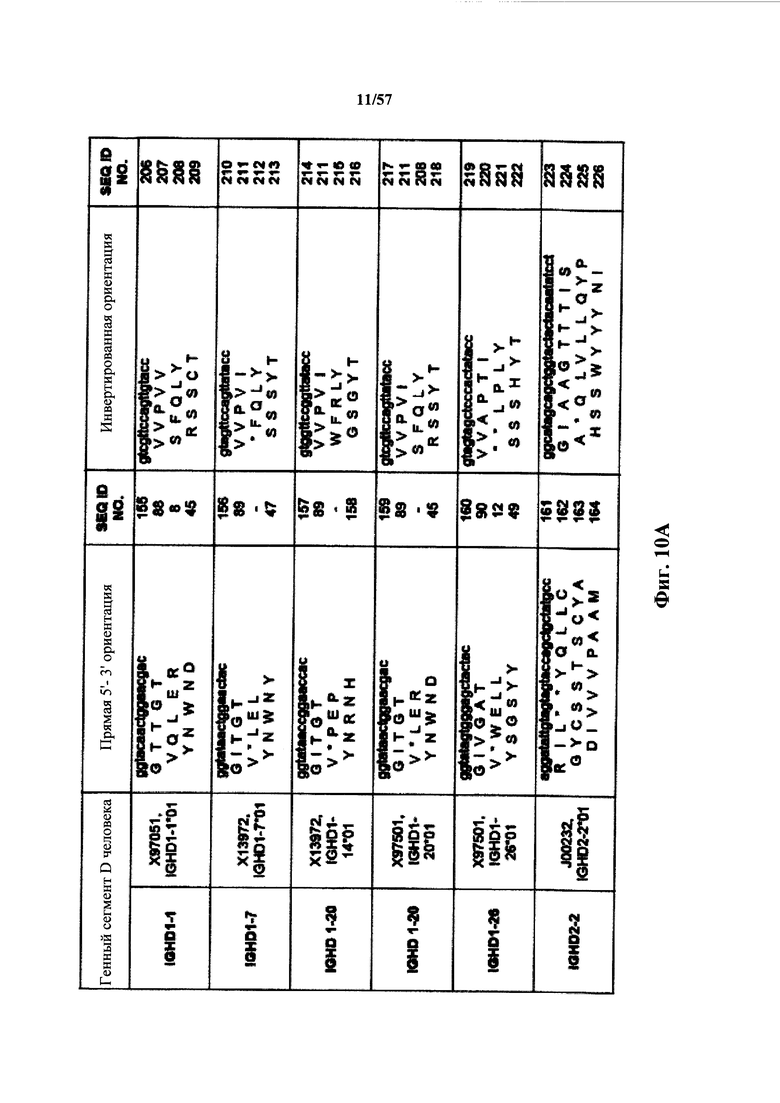
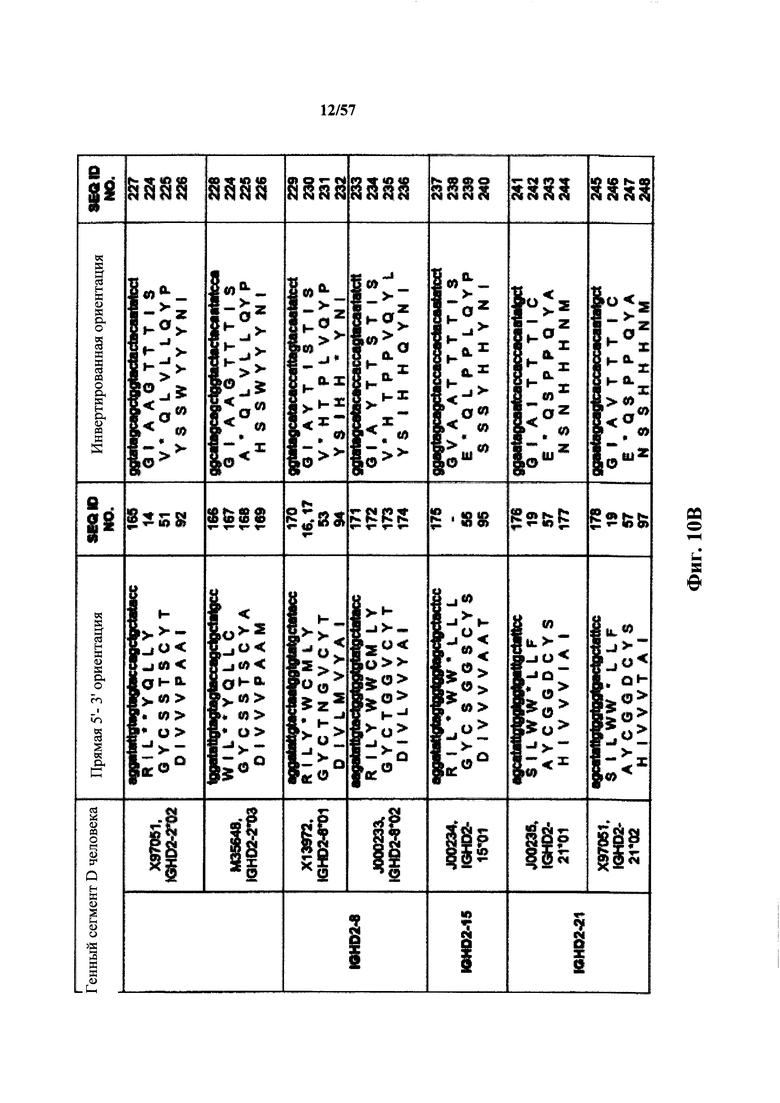
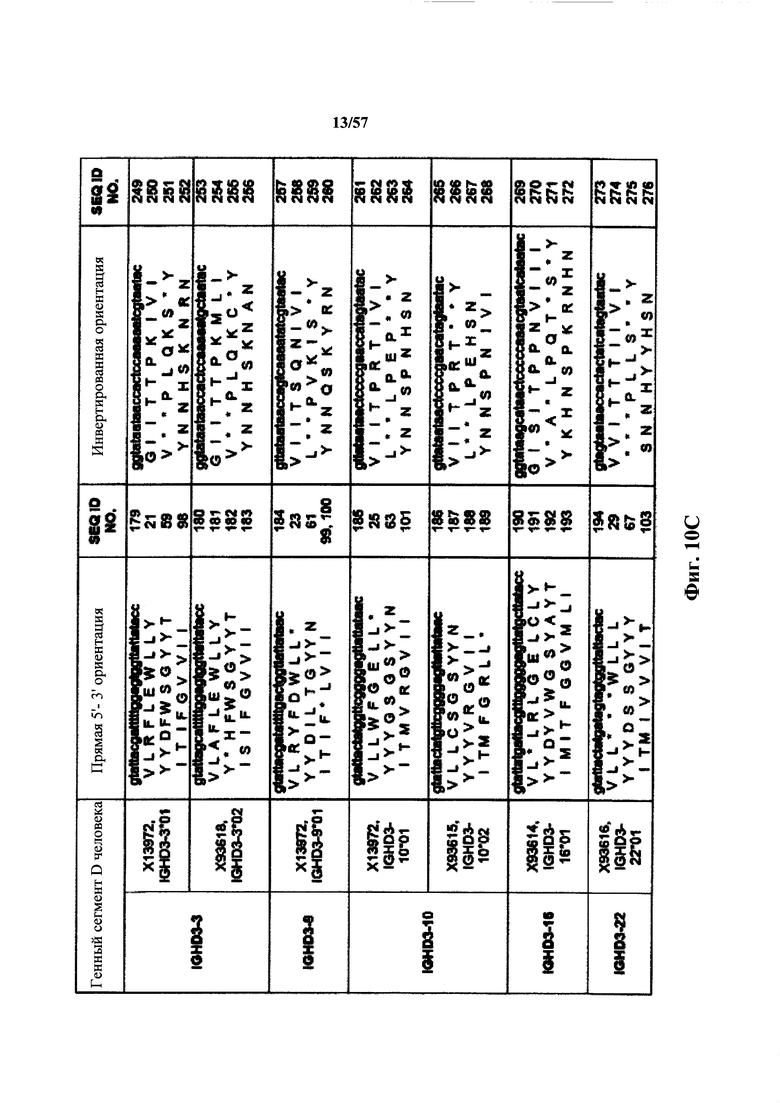
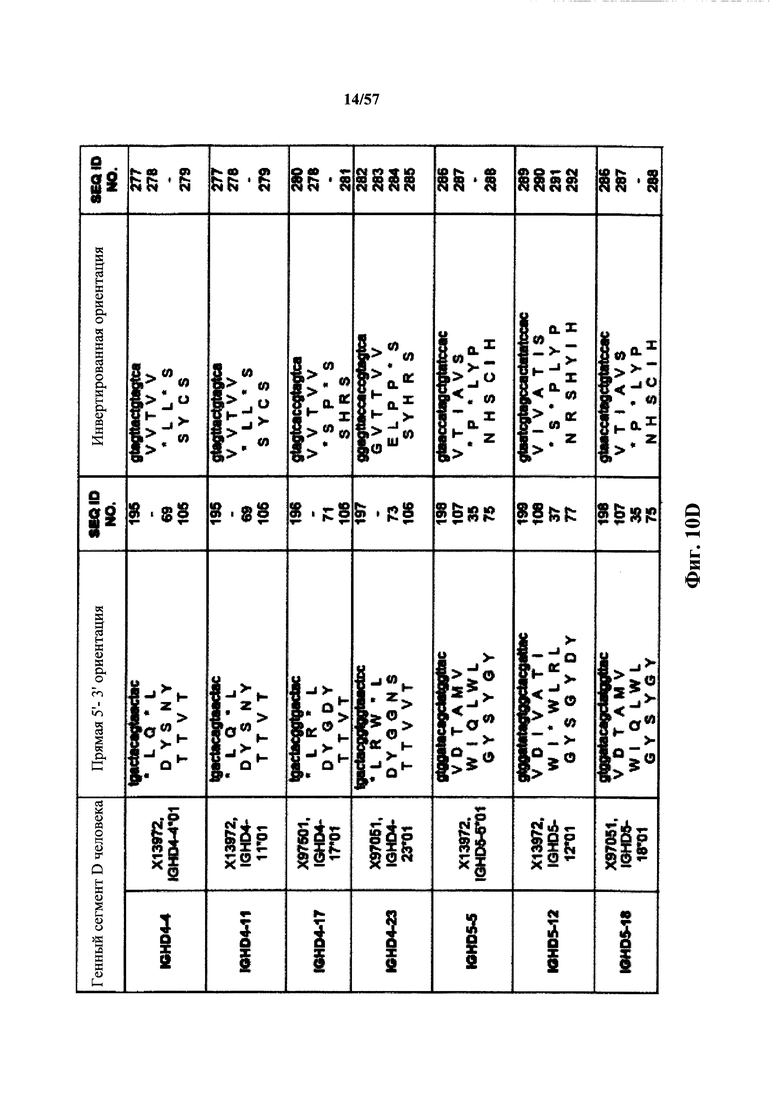
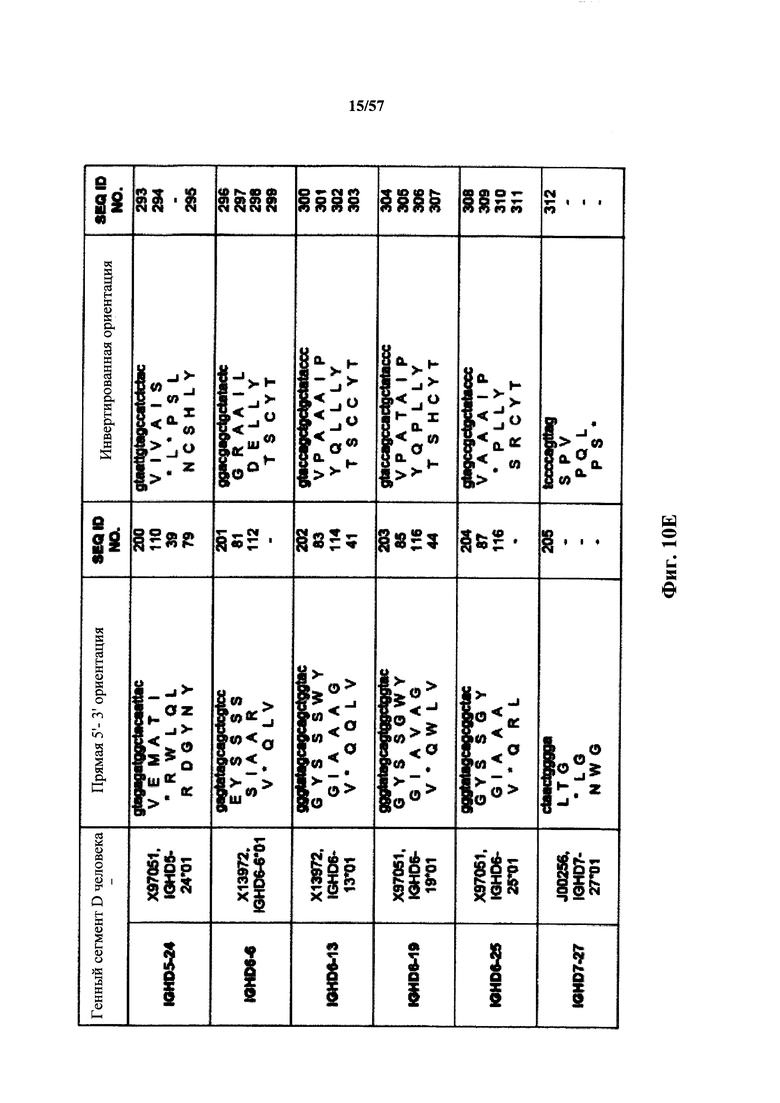
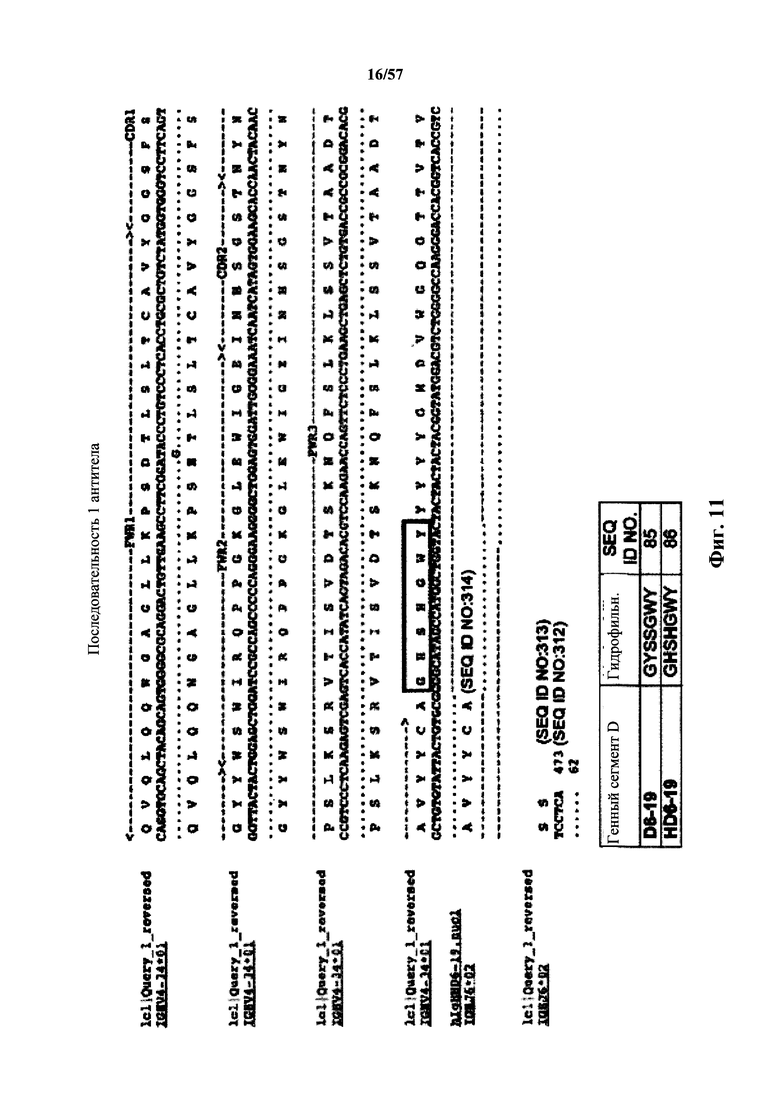

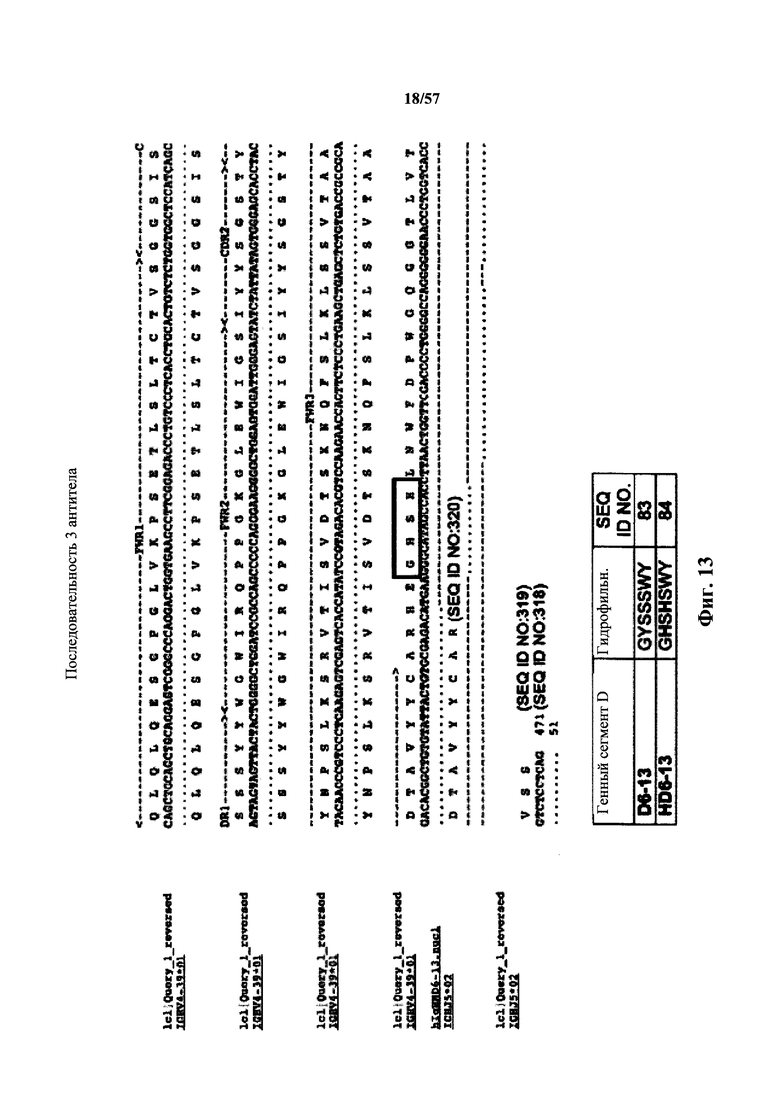
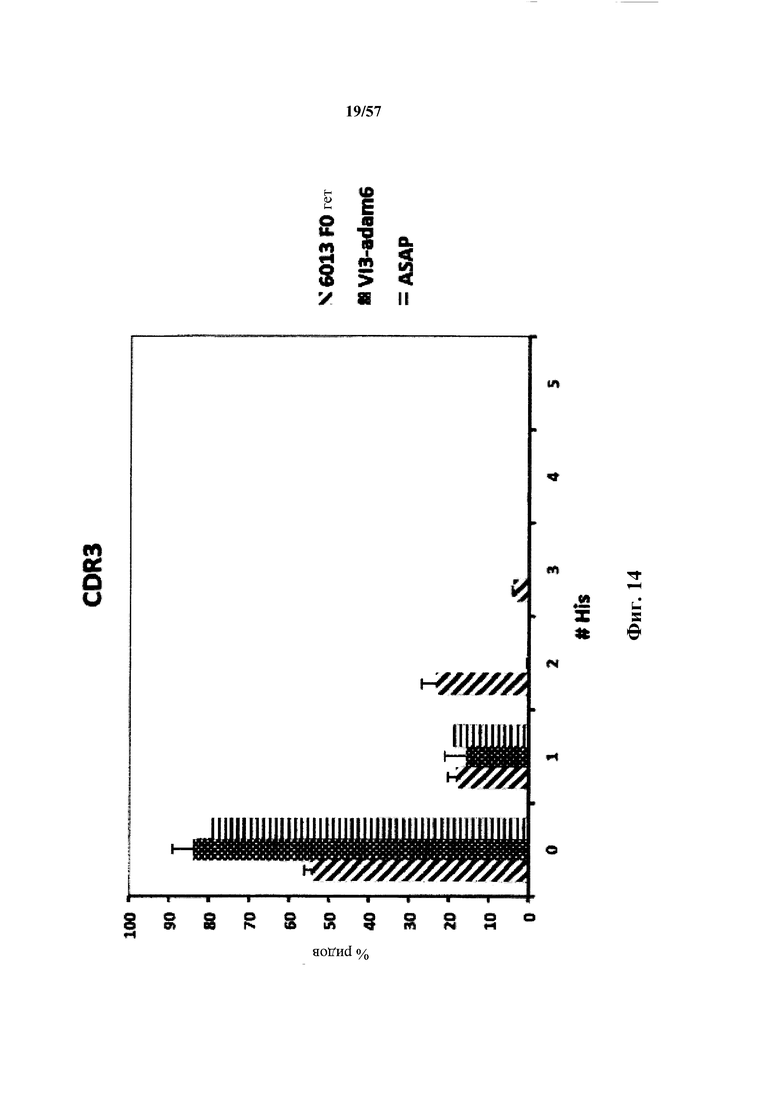
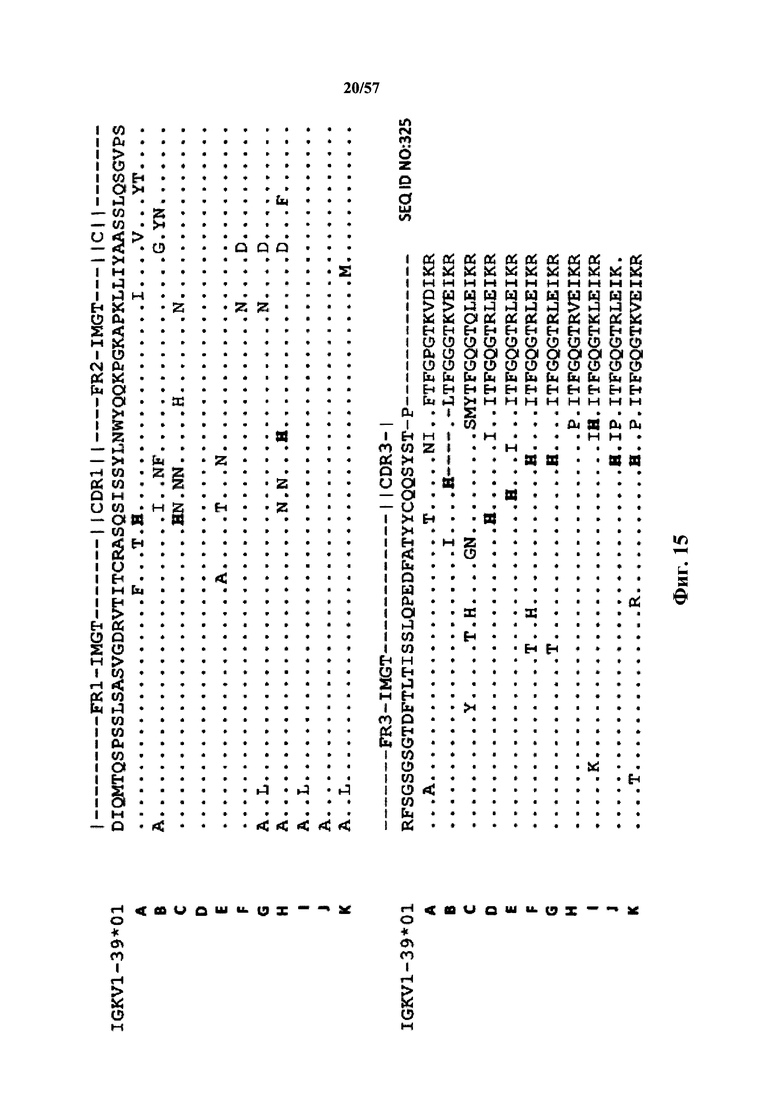

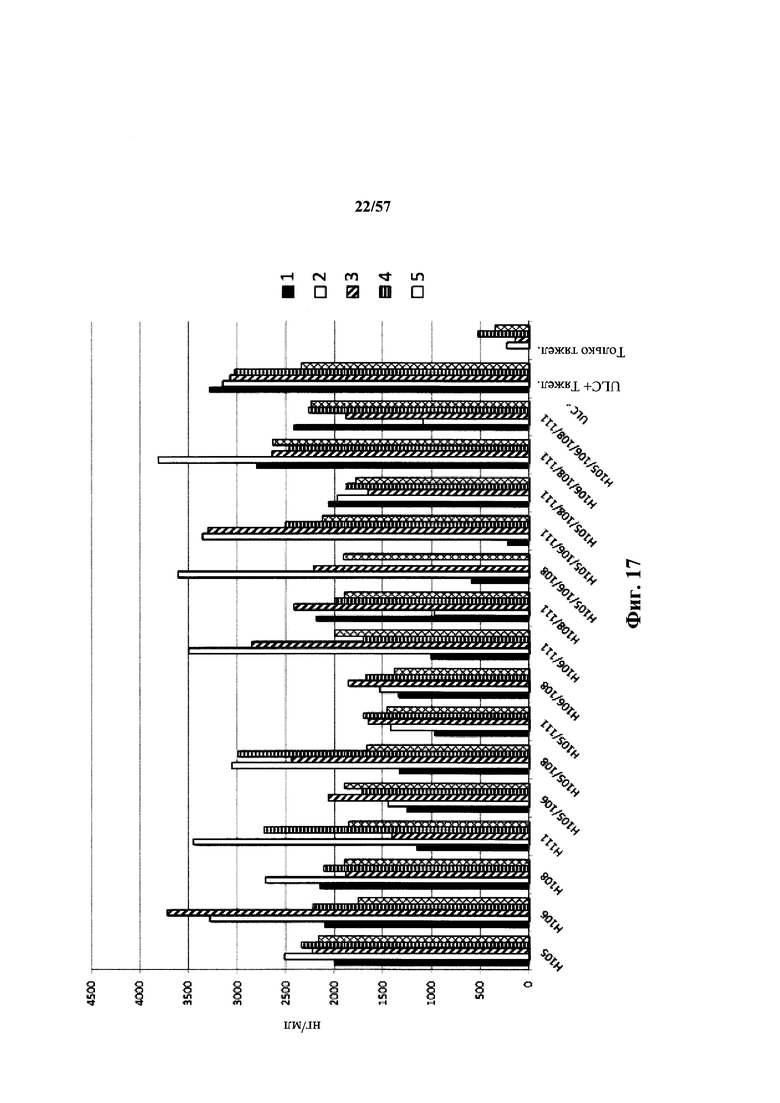
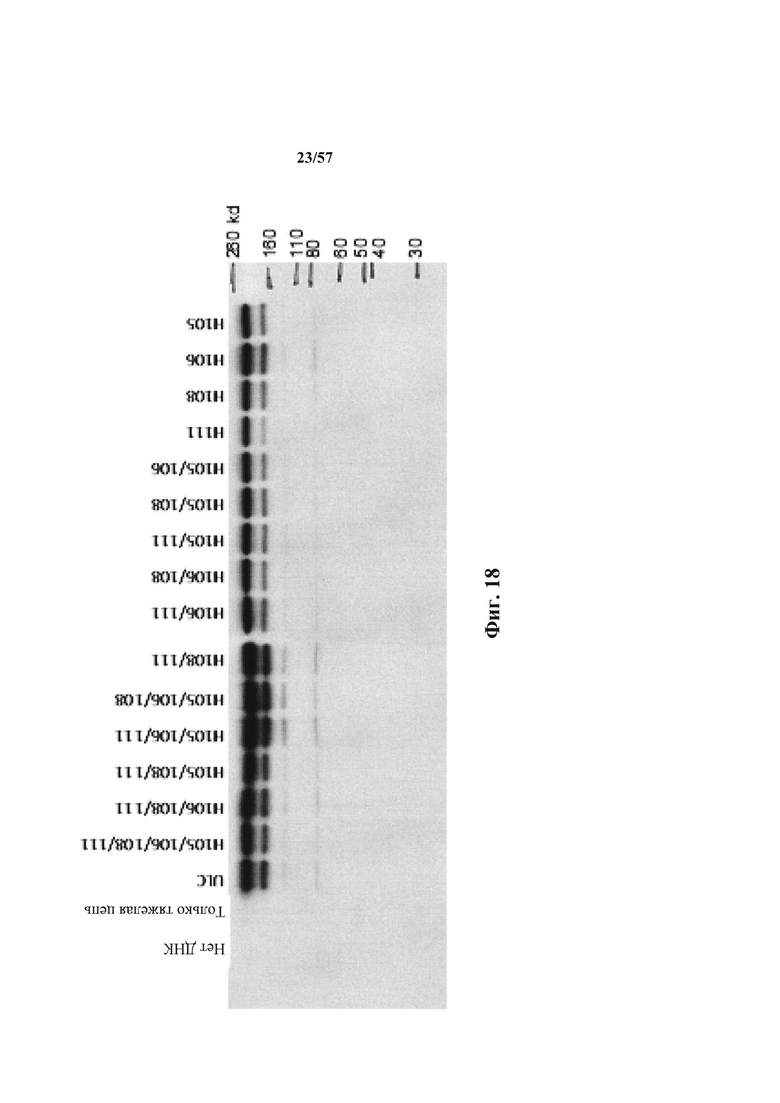
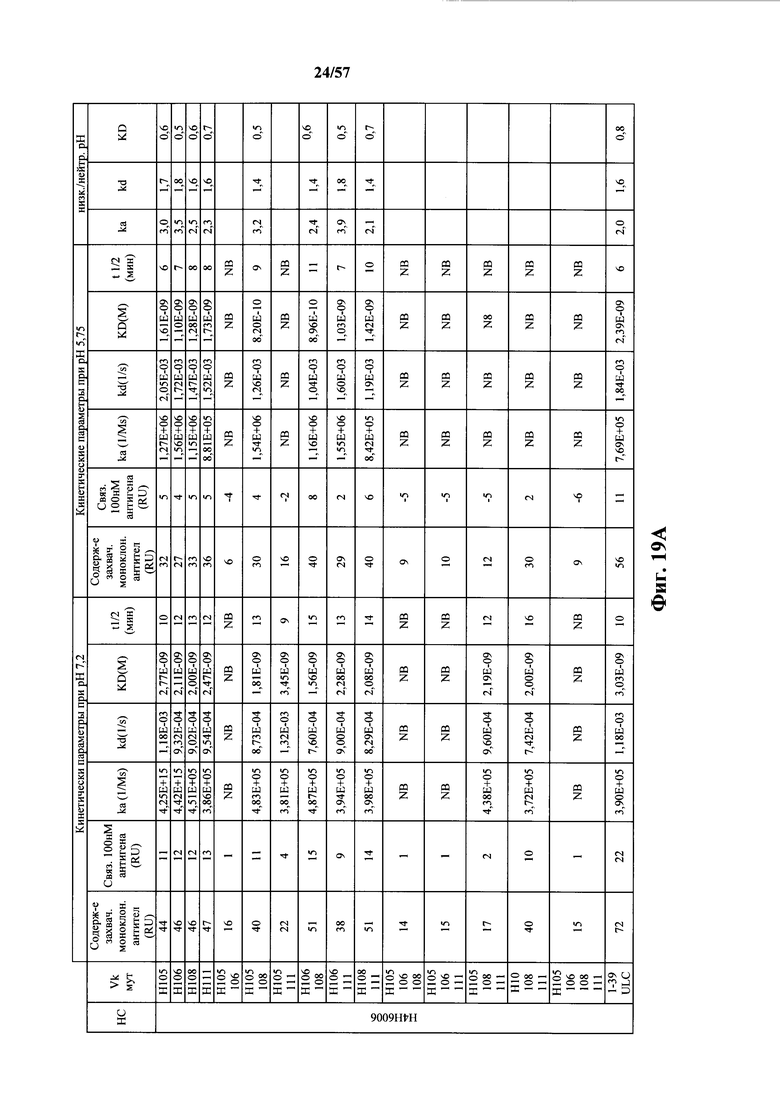
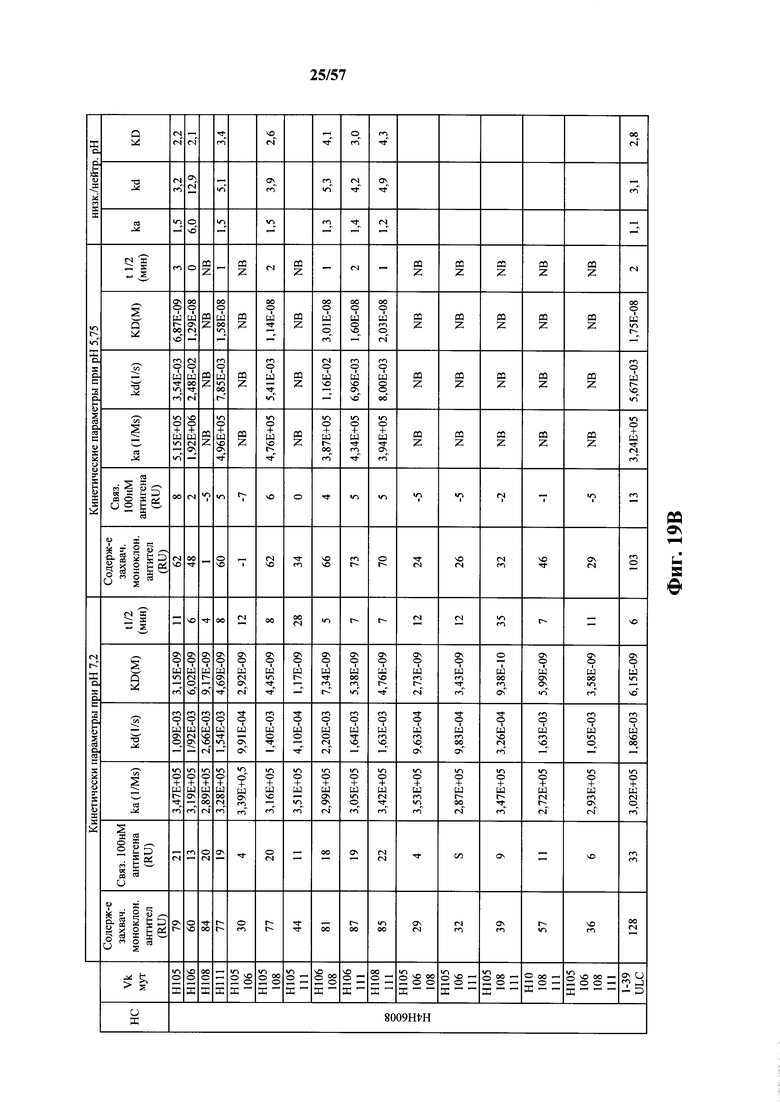

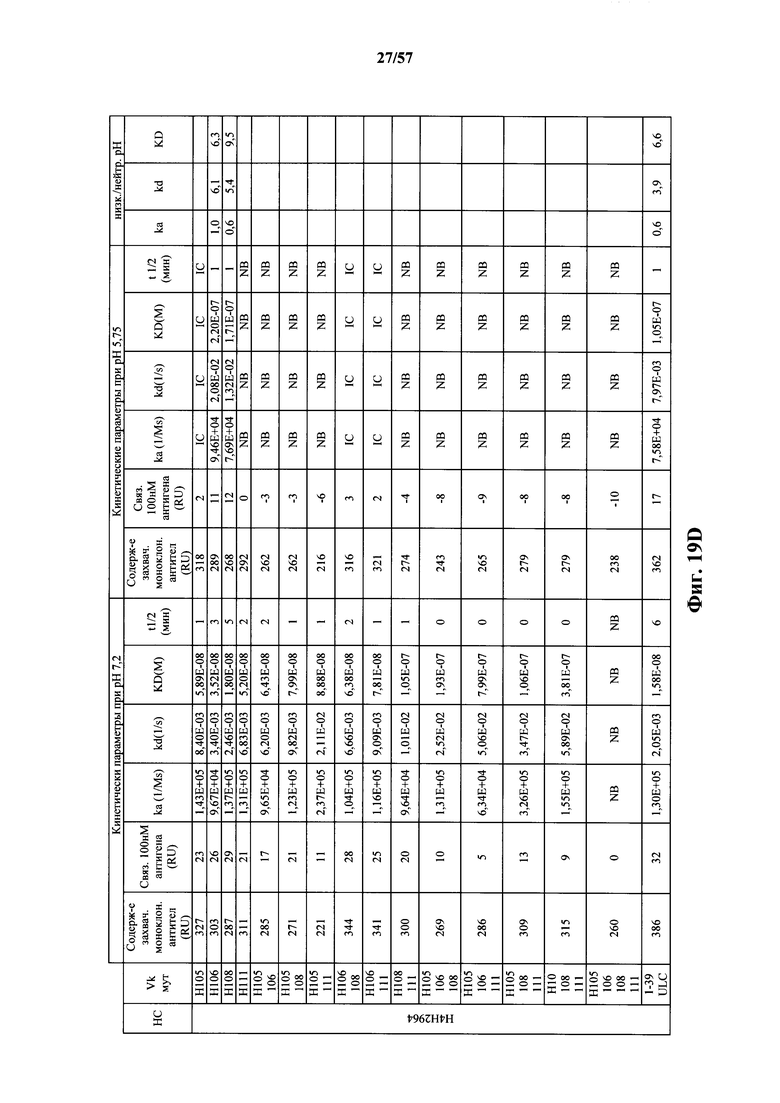
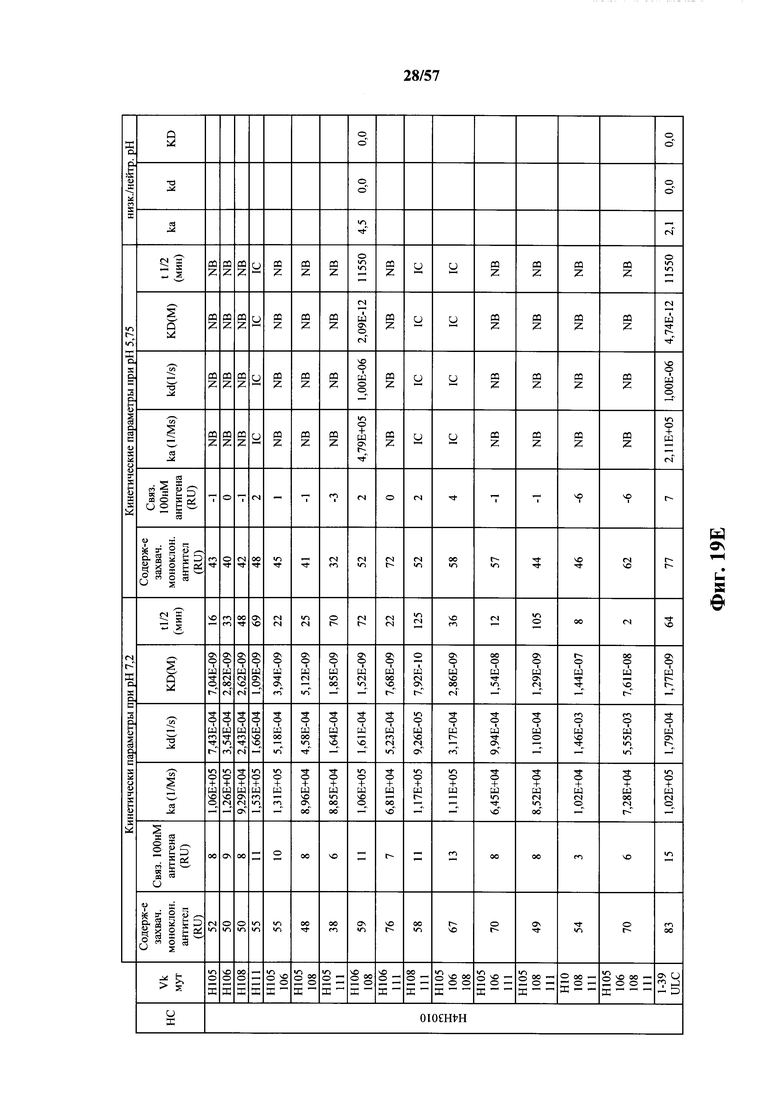
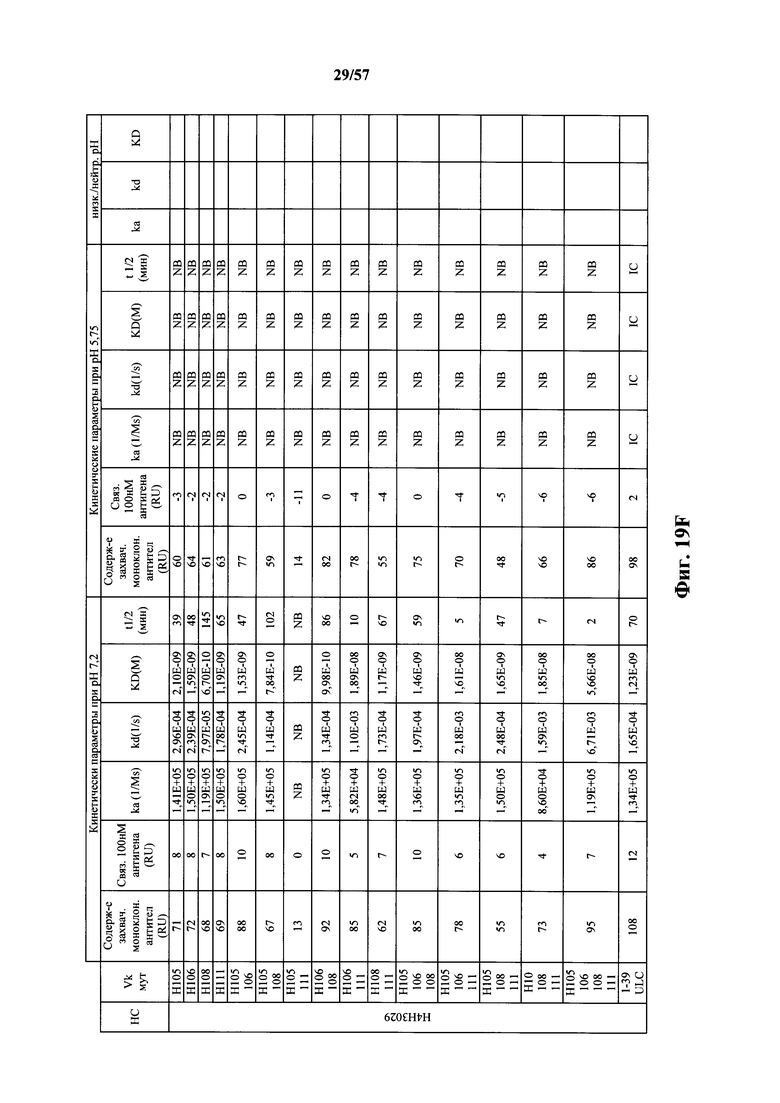
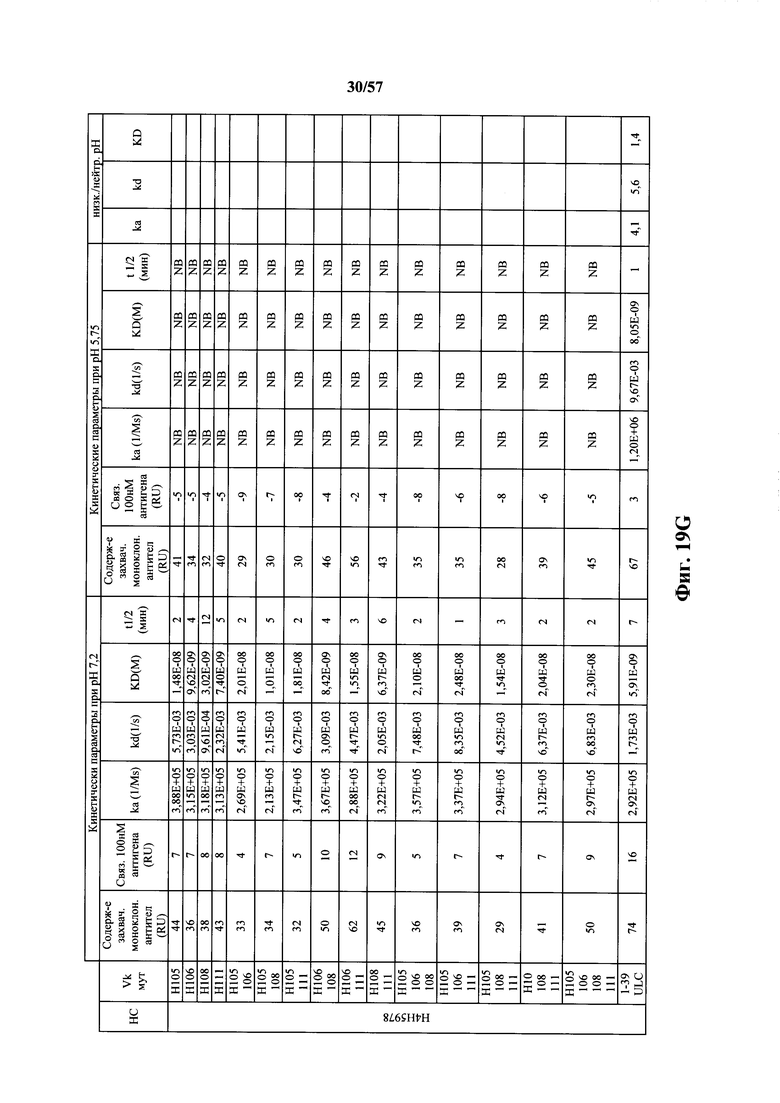
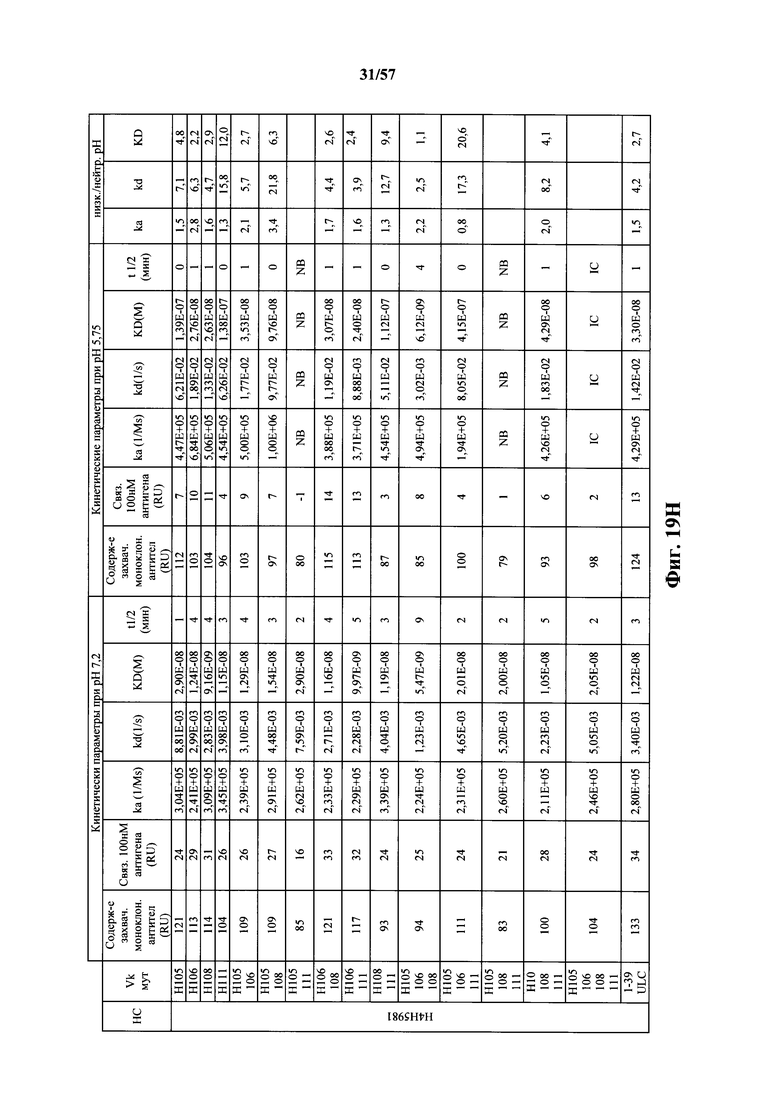
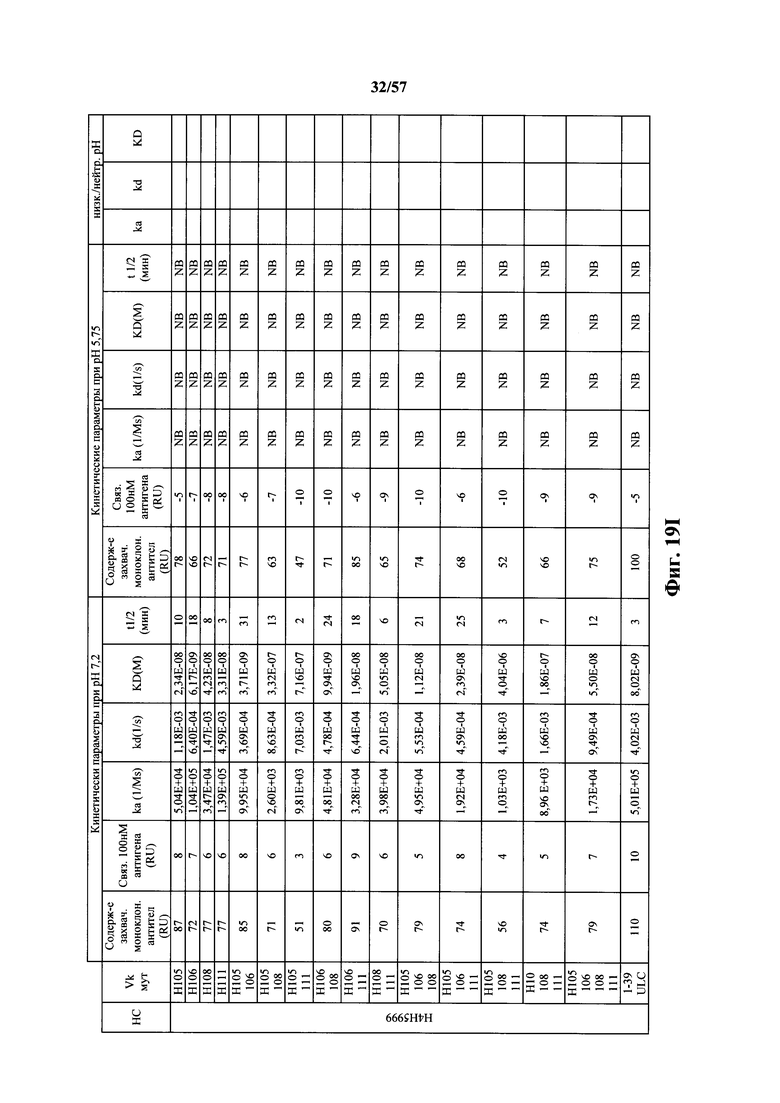
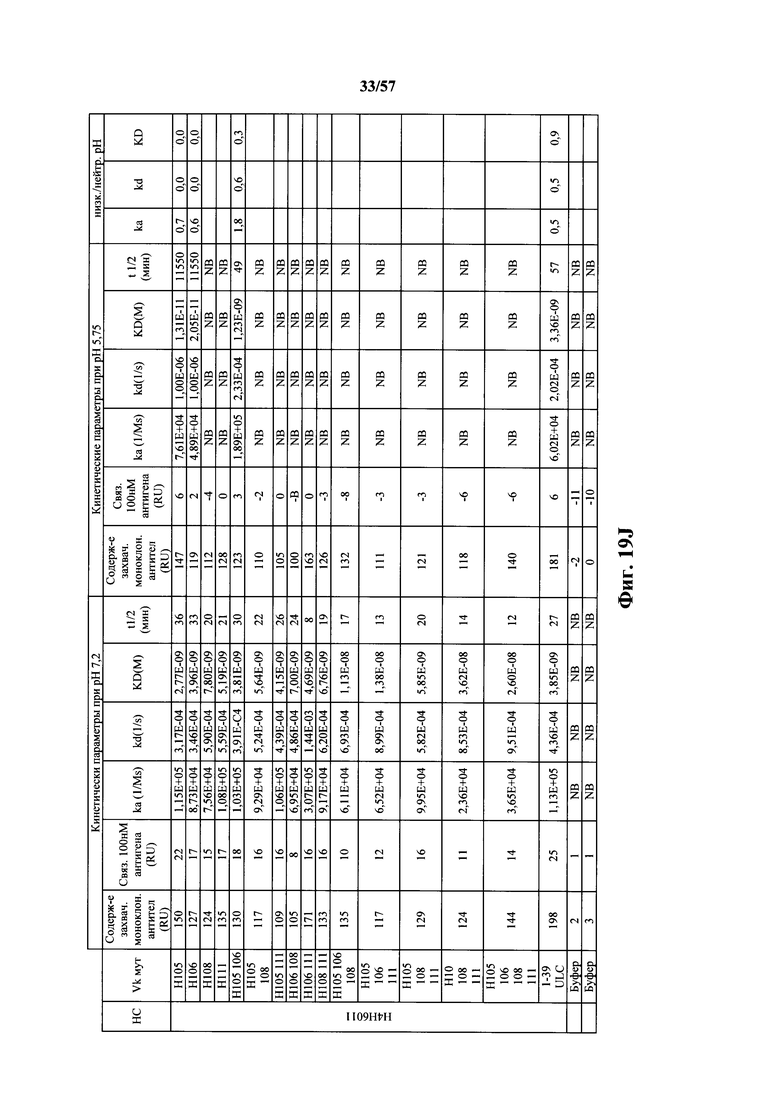
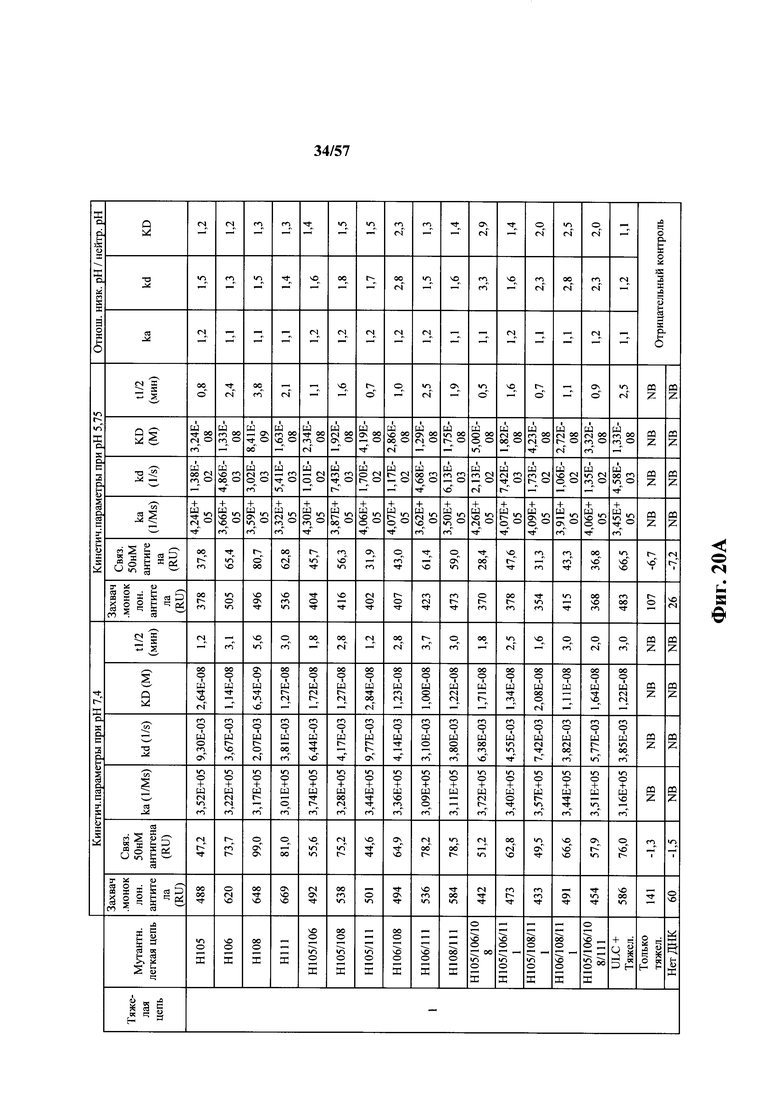
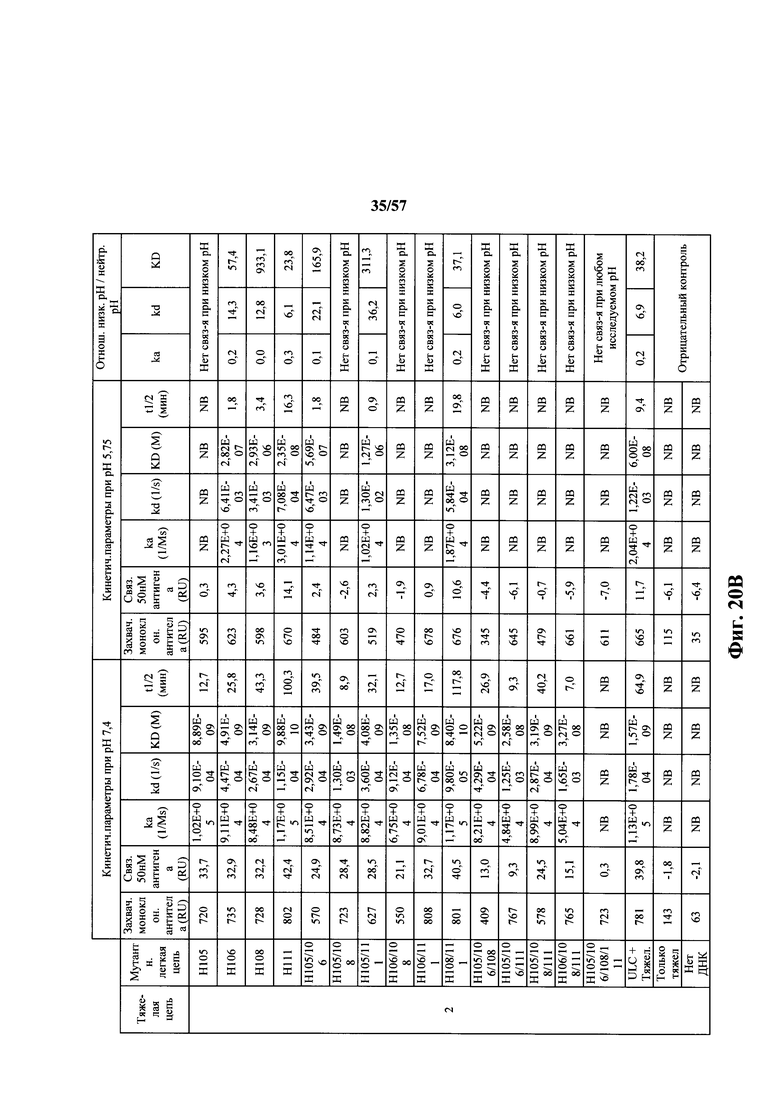
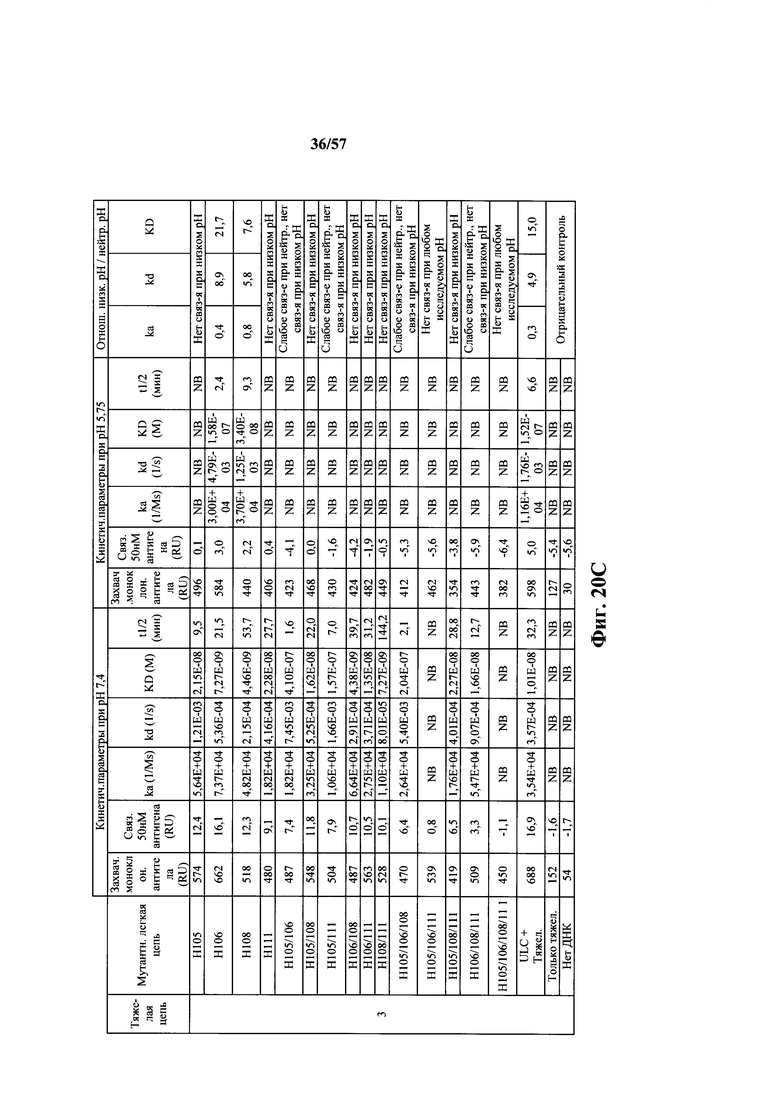
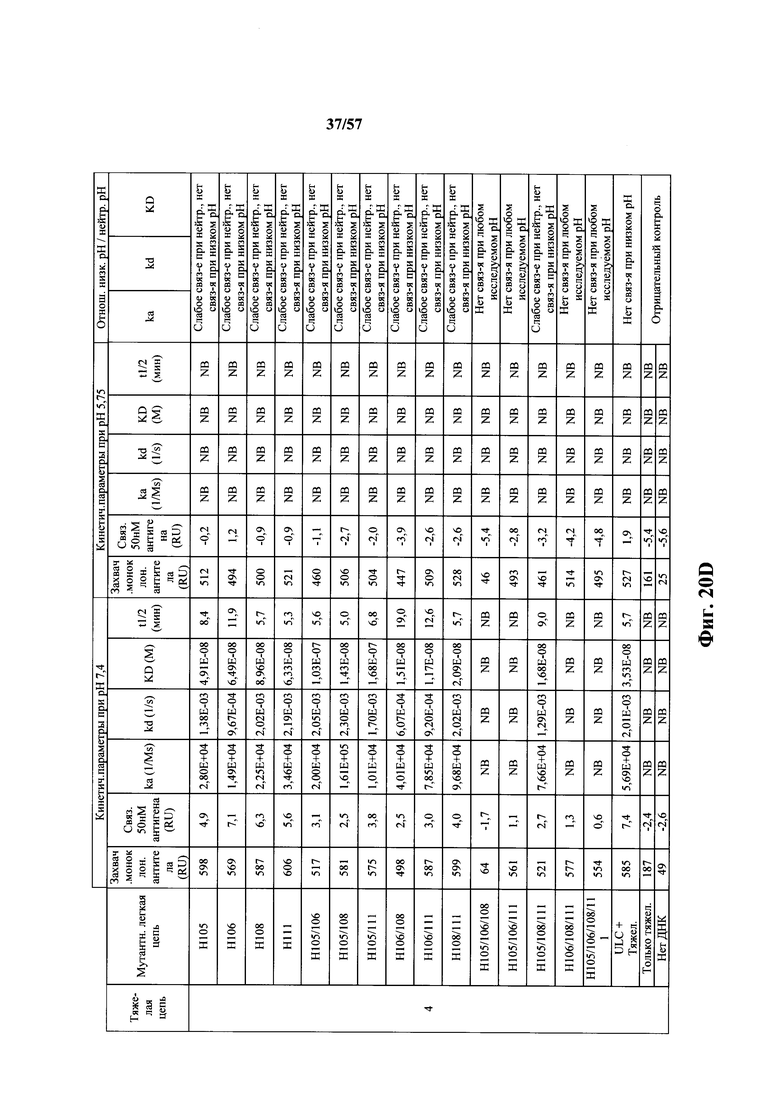
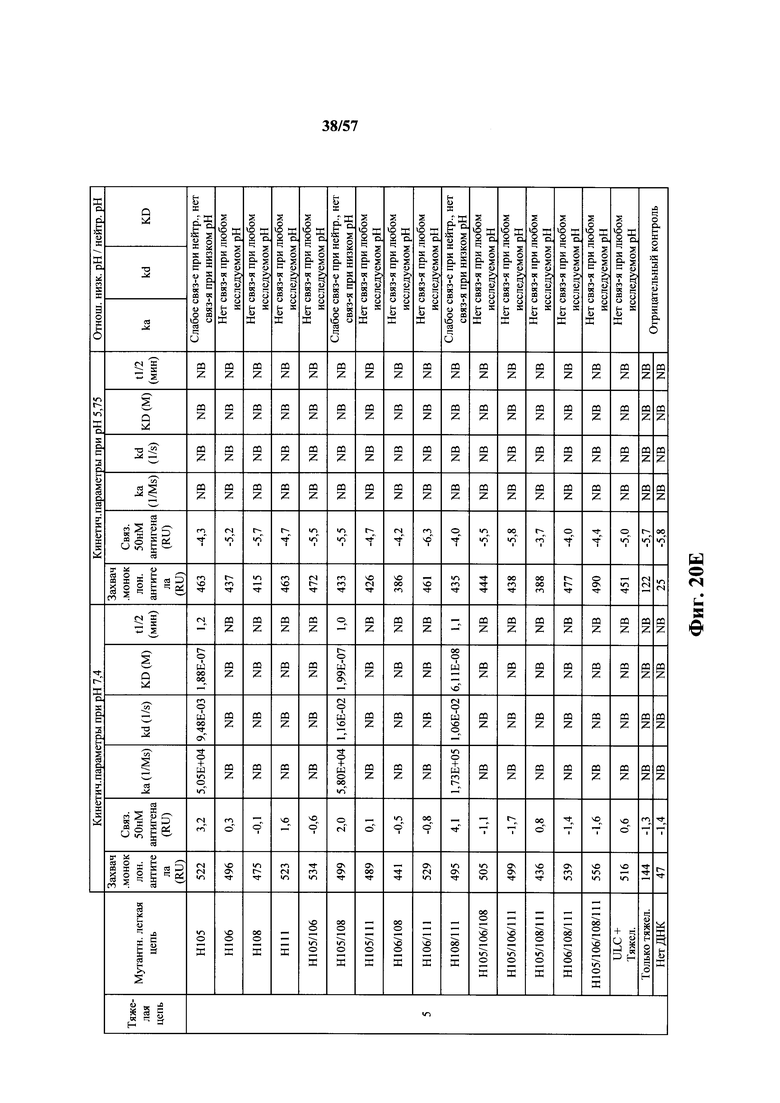
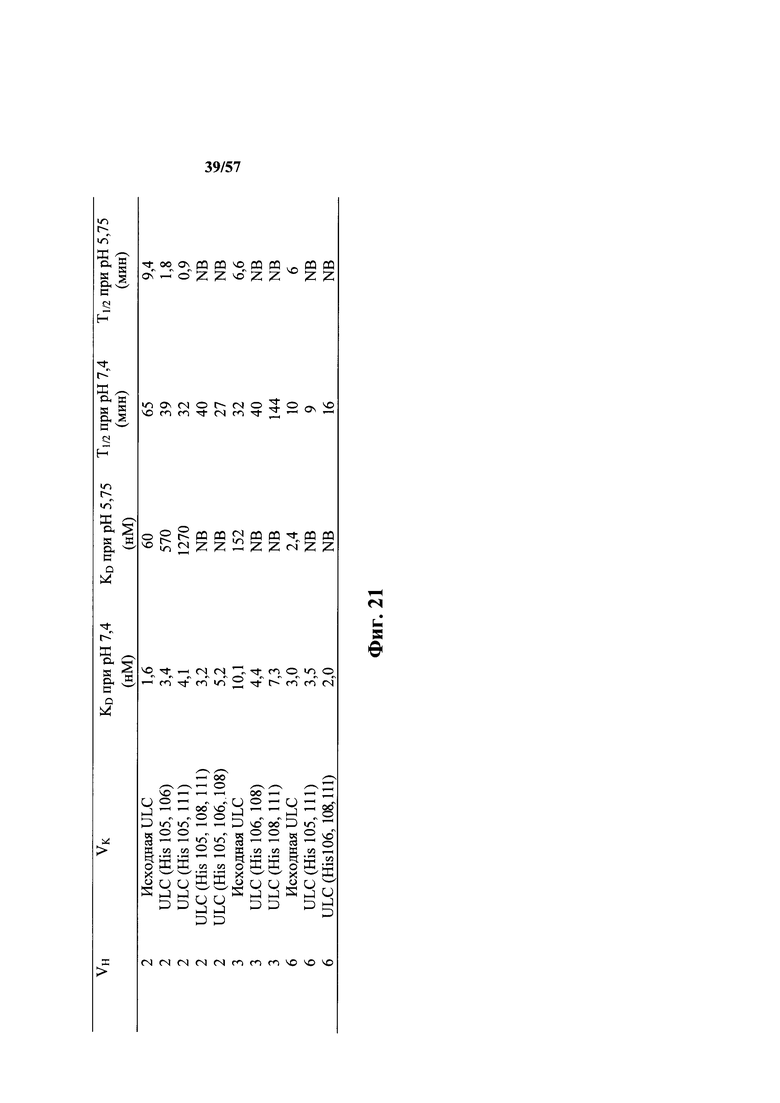

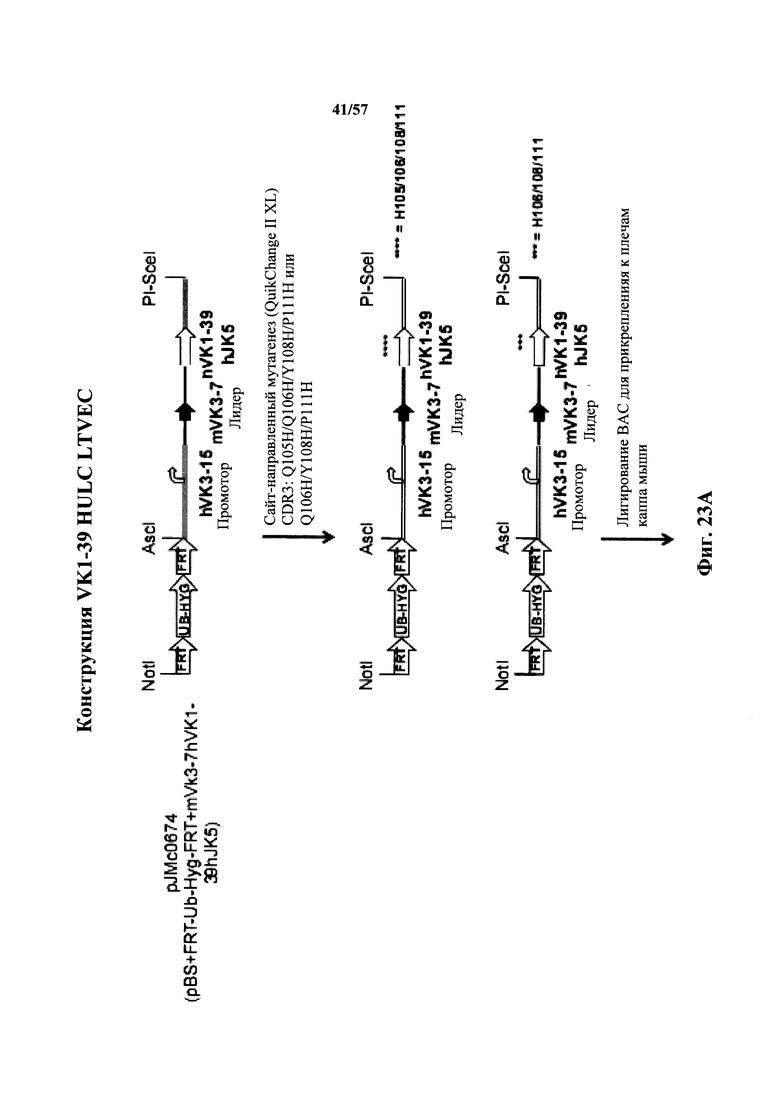
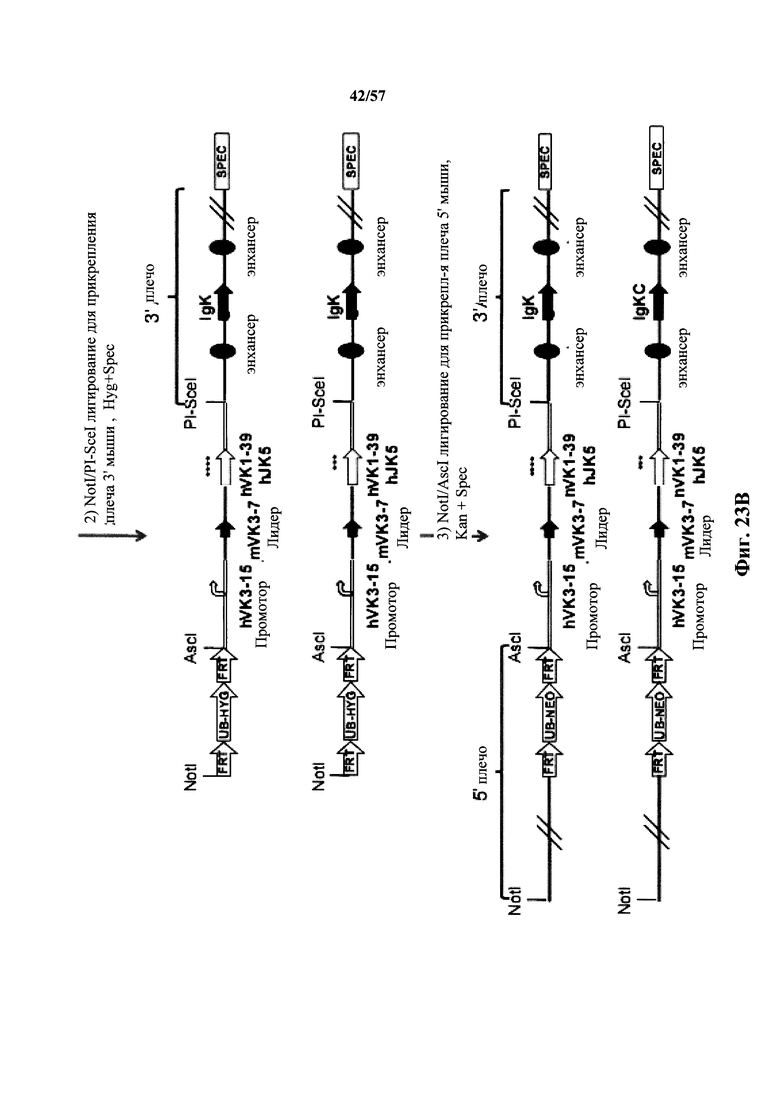
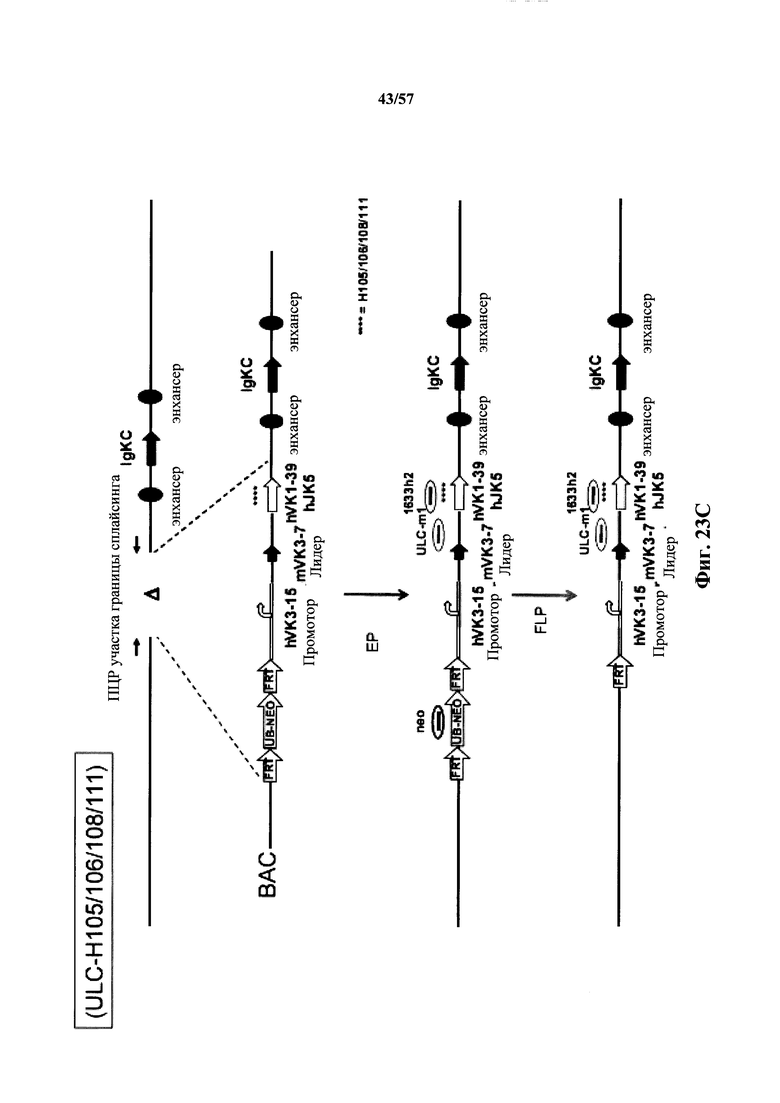
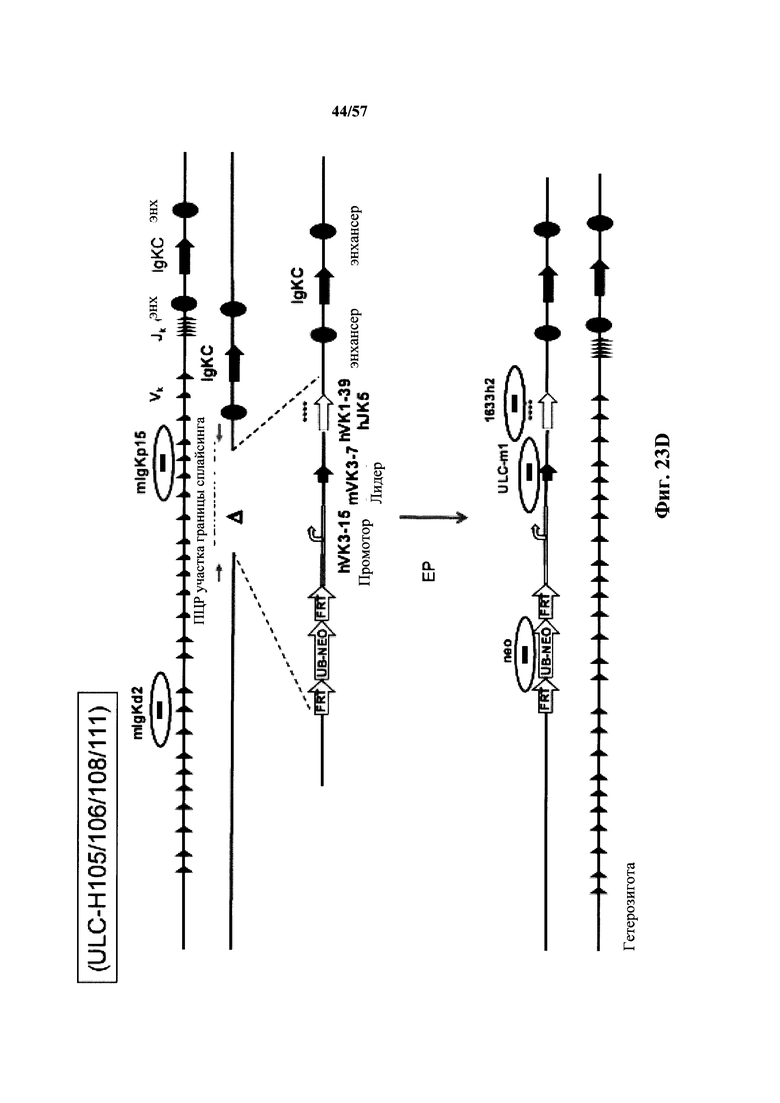
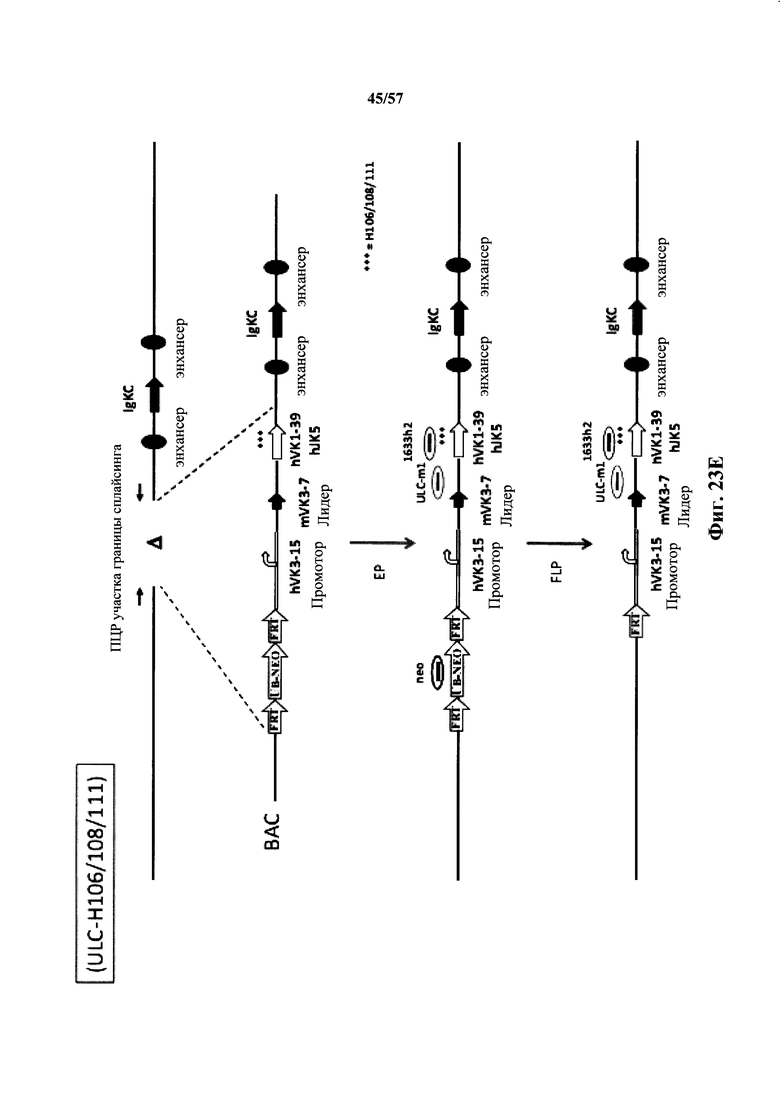
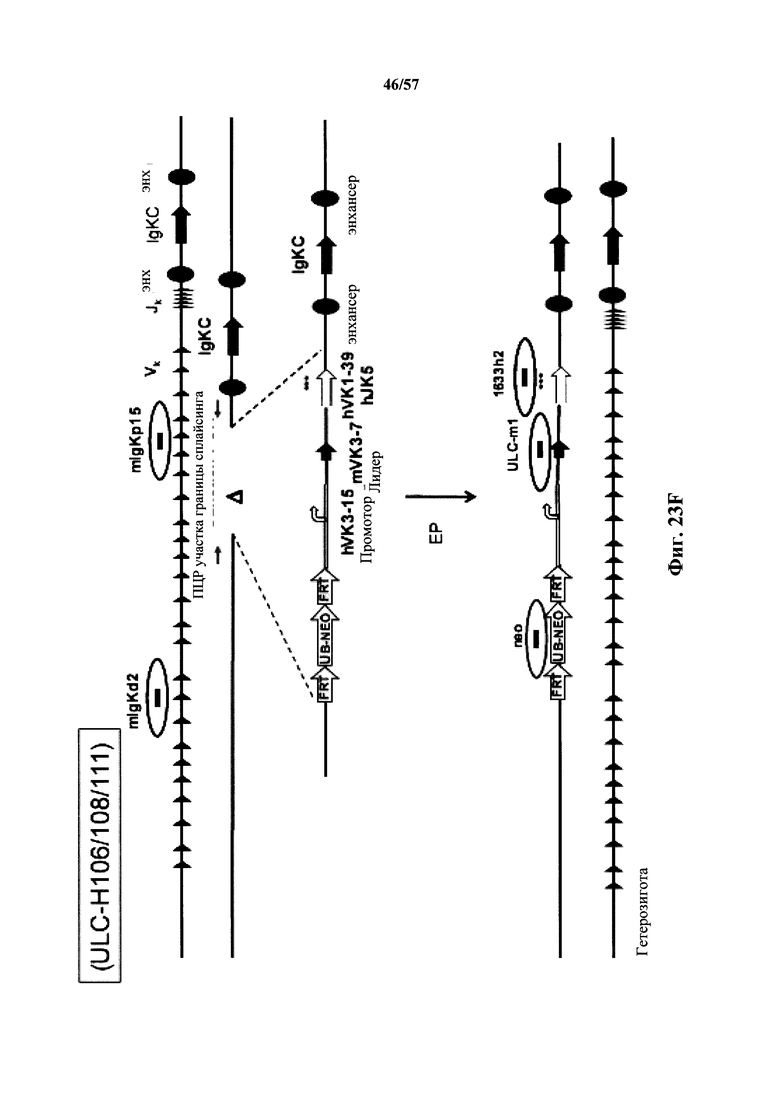
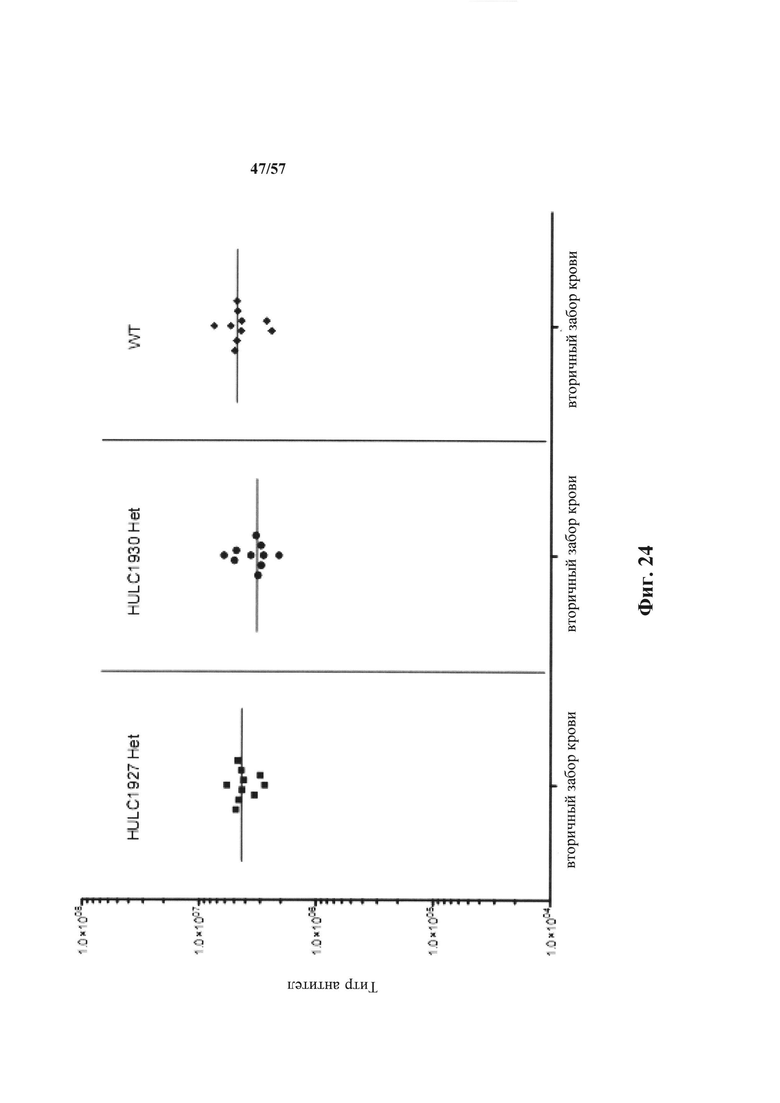
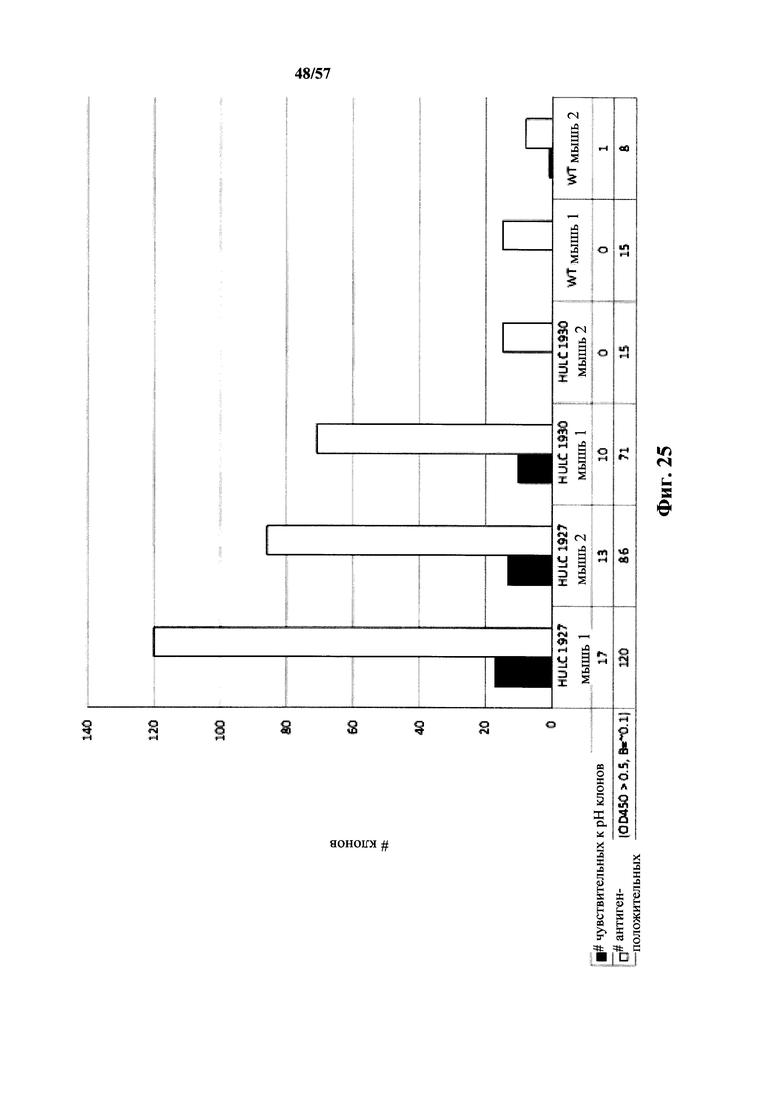
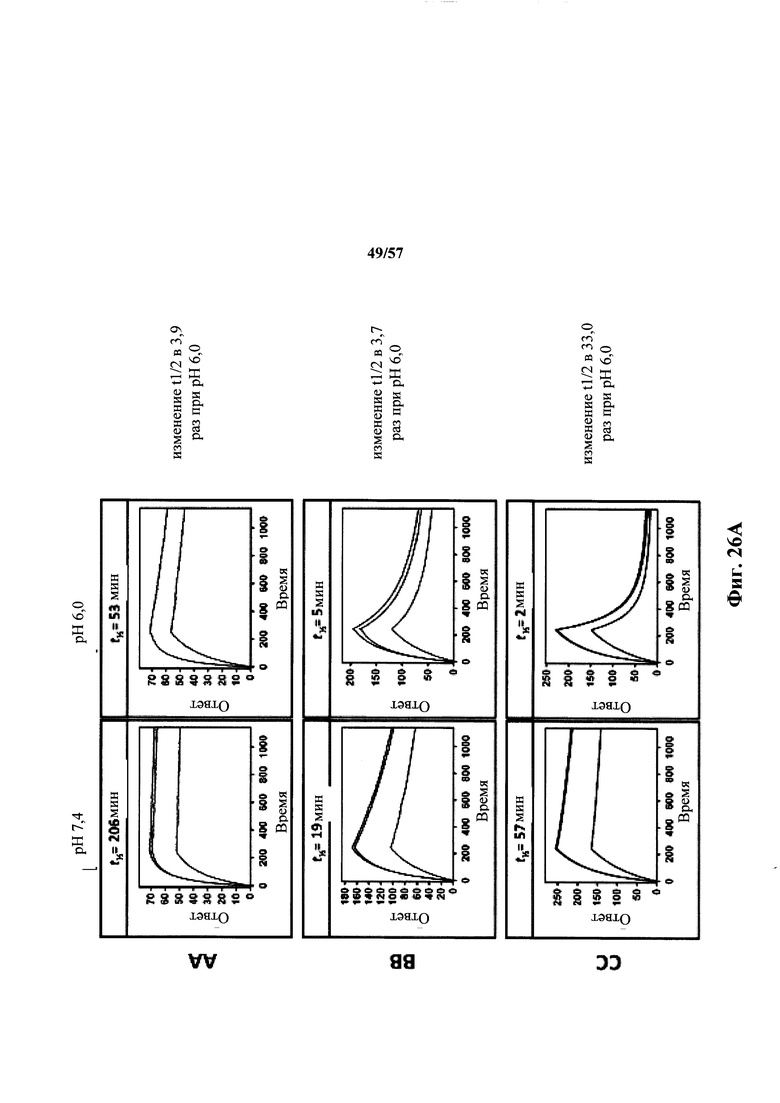
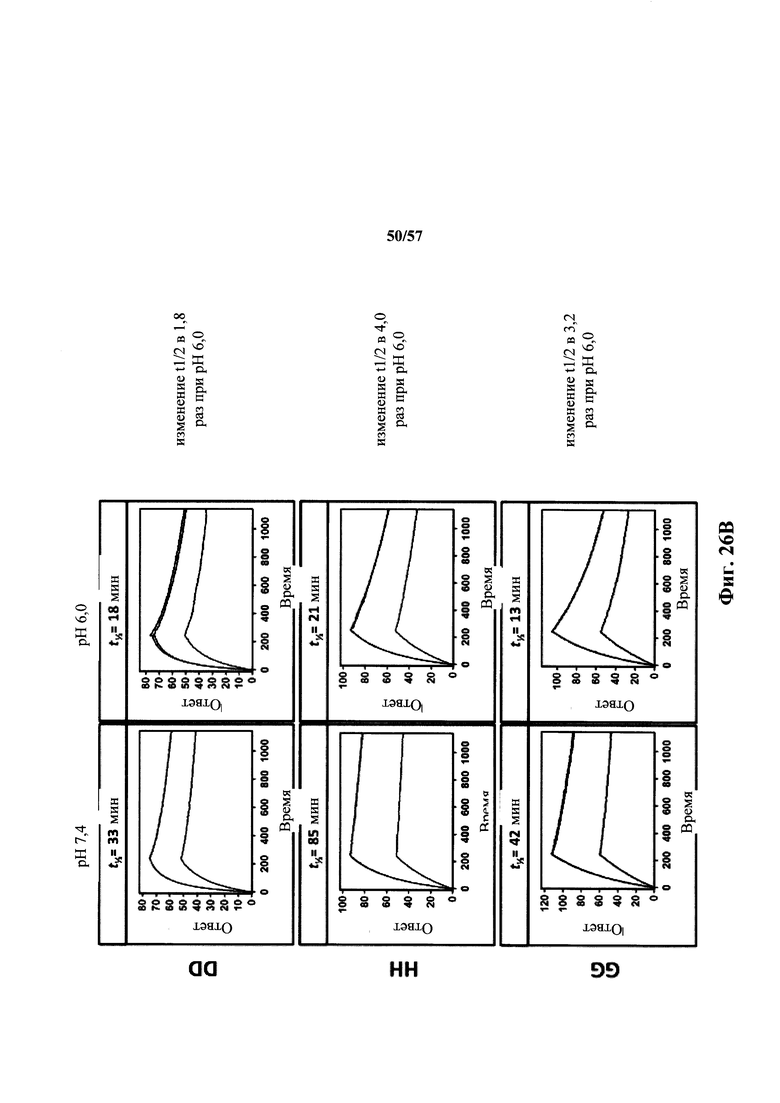




Изобретение относится к области биохимии, в частности к генетически модифицированному грызуну для получения вариабельных доменов иммуноглобулина, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии. При этом вышеуказанный грызун содержит в своей зародышевой линии локус иммуноглобулина, который содержит нереаранжированную последовательность вариабельного гена иммуноглобулина, содержащую в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), замену по меньшей мере одного негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона. Также раскрыт способ получения вышеуказанного грызуна. Изобретение позволяет эффективно получать домены иммуноглобулинов, которые связываются с антигенами чувствительным к рН образом. 5 н. и 42 з.п. ф-лы, 29 ил., 8 табл., 9 пр.
1. Генетически модифицированный грызун для получения вариабельных доменов иммуноглобулина, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии, содержащий в своей зародышевой линии локус иммуноглобулина, который содержит нереаранжированную последовательность вариабельного гена иммуноглобулина, содержащую в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), замену по меньшей мере одного негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона, где замещающий или вставленный гистидиновый кодон не кодируется соответствующим генным сегментом дикого типа, при этом грызун экспрессирует нуклеотидную последовательность, кодирующую вариабельный домен иммуноглобулина, который содержит в определяющей комплементарность области 3 (CDR3) аминокислоту гистидин, полученную путем замены по меньшей мере одного негистидинового кодона или вставки по меньшей мере одного гистидинового кодона в нереаранжированную последовательность вариабельного гена иммуноглобулина,
при этом грызун представляет собой крысу или мышь.
2. Грызун по п. 1, причем грызун содержит первый и второй вариабельный локус иммуноглобулина, причем по меньшей мере первый или второй вариабельный локус иммуноглобулина содержит нереаранжированную последовательность вариабельного гена иммуноглобулина, содержащую в определяющей комплементарность области 3 (CDR3) вставку по меньшей мере одного гистидинового кодона или замену по меньшей мере одного негистидинового кодона на гистидиновый кодон.
3. Грызун по п. 2, у которого как первый, так и второй вариабельный локус иммуноглобулина - каждый содержит нереаранжированную последовательность вариабельного гена иммуноглобулина, содержащую в определяющей комплементарность области 3 (CDR3) замену по меньшей мере одного негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона.
4. Грызун по п. 2, у которого первый вариабельный локус иммуноглобулина содержит по меньшей мере функциональную часть нереаранжированной последовательности вариабельного гена тяжелой цепи иммуноглобулина, содержащую переаранжированные генные сегменты VH, DH и JH.
5. Грызун по п. 4, у которого нереаранжированная вариабельная генная последовательность тяжелой цепи иммуноглобулина содержит по меньшей мере часть генной последовательности тяжелой цепи иммуноглобулина человека, содержащую нереаранжированные генные сегменты VH, DH и JH.
6. Грызун по п. 4, у которого нереаранжированная вариабельная генная последовательность тяжелой цепи иммуноглобулина представляет собой генную последовательность тяжелой цепи иммуноглобулина человека, содержащую нереаранжированные сегменты V, синтетический сегмент D, который содержит линкер, и сегмент J человека.
7. Грызун по п. 6, у которого синтетический сегмент D содержит по меньшей мере один гистидиновый кодон.
8. Грызун по п. 2, у которого второй вариабельный локус иммуноглобулина содержит по меньшей мере функциональную часть нереаранжированной последовательности вариабельного гена легкой цепи иммуноглобулина, содержащую нереаранжированные сегменты VL и JL.
9. Грызун по п. 8, у которого нереаранжированная генная последовательность легкой цепи представляет собой нереаранжированную генную последовательность легкой цепи человека, содержащую нереаранжированные генные сегменты VL/JL человека.
10. Грызун по п. 2, у которого второй вариабельный локус иммуноглобулина содержит реаранжированную последовательность вариабельного гена легкой цепи иммуноглобулина, содержащую реаранжированную последовательность VL/JL.
11. Грызун по п. 10, у которого реаранжированная последовательность вариабельного гена легкой цепи иммуноглобулина представляет собой реаранжированную последовательность вариабельного гена легкой цепи иммуноглобулина человека, содержащую реаранжированную последовательность VL/JL человека.
12. Грызун по п. 1, который дополнительно содержит замену по меньшей мере одного негистидинового кодона на гистидиновый кодон и/или вставку по меньшей мере одного гистидинового кодона в последовательности нуклеиновой кислоты, которая кодирует вариабельный домен иммуноглобулина, и вставленный или замещающий гистидин находится в области, выбранной из N-концевой области цепи иммуноглобулина, области петли 4 цепи иммуноглобулина, CDR1 тяжелой цепи иммуноглобулина, CDR2 тяжелой цепи иммуноглобулина, CDR1 легкой цепи иммуноглобулина, CDR2 легкой цепи иммуноглобулина и их комбинации.
13. Грызун по п. 2, у которого по меньшей мере один из первого вариабельного локуса иммуноглобулина или второго вариабельного локуса иммуноглобулина функционально связан с эндогенной последовательностью нуклеиновой кислоты константной области грызуна в эндогенном локусе иммуноглобулина грызуна.
14. Грызун по п. 5, у которого нереаранжированная последовательность вариабельного гена тяжелой цепи иммуноглобулина, содержащая нереаранжированные сегменты VH, DH и JH человека, функционально связана с эндогенной последовательностью нуклеиновой кислоты константной области тяжелой цепи иммуноглобулина грызуна.
15. Грызун по п. 12, у которого нереаранжированная последовательность вариабельного гена тяжелой цепи иммуноглобулина, содержащая нереаранжированные сегменты VH, DH и JH человека, функционально связана с эндогенной последовательностью нуклеиновой кислоты константной области тяжелой цепи иммуноглобулина грызуна в эндогенном локусе иммуноглобулина грызуна.
16. Грызун по п. 8, у которого последовательность вариабельного гена легкой цепи иммуноглобулина, содержащая нереаранжированные сегменты VL и JL, функционально связана с эндогенным локусом константной области легкой цепи иммуноглобулина грызуна.
17. Грызун по п. 16, у которого эндогенная последовательность константной области легкой цепи иммуноглобулина грызуна находится в эндогенном локусе иммуноглобулина грызуна.
18. Грызун по п. 1, при этом грызун представляет собой крысу.
19. Грызун по п. 1, при этом грызун представляет собой мышь.
20. Генетически модифицированный грызун для получения вариабельных областей иммуноглобулина, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии, содержащий:
нереаранжированные сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина, причем один или несколько из сегментов V, D и J в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона, где замещающий или вставленный гистидиновый кодон в одном или нескольких из сегментов V, D и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека не кодируется соответствующим генным сегментом дикого типа зародышевой линии человека; и
нереаранжированные сегменты VL и JL человека, функционально связанные с генной последовательностью константной области легкой цепи иммуноглобулина, причем один или несколько из сегментов V и J в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или по меньшей мере одну вставку гистидинового кодона, где замещающий или вставленный гистидиновый кодон в одном или нескольких из сегментов V и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека не кодируется соответствующим генным сегментом дикого типа зародышевой линии человека; и
причем грызун экспрессирует вариабельный домен тяжелой цепи иммуноглобулина и вариабельный домен легкой цепи иммуноглобулина, при этом один или оба вариабельных домена тяжелой и/или легкой цепей иммуноглобулина содержат гистидин в кодирующей определяющую комплементарность области 3 (CDR3), полученный путем замены или вставки гистидиновых кодонов в одном или нескольких из сегментов V, D и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека и/или в одном или нескольких из сегментов V и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека соответственно,
при этом грызун представляет собой крысу или мышь.
21. Генетически модифицированный грызун по п. 20, причем грызун представляет собой крысу.
22. Генетически модифицированный грызун по п. 20, причем грызун представляет собой мышь.
23. Генетически модифицированный грызун по п. 20, у которого нереаранжированная последовательность нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с последовательностью константной области тяжелой цепи иммуноглобулина грызуна.
24. Генетически модифицированный грызун по п. 23, у которого последовательность нуклеиновой кислоты константной области тяжелой цепи иммуноглобулина грызуна, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека, находится в эндогенном локусе тяжелой цепи иммуноглобулина грызуна в зародышевой линии грызуна.
25. Генетически модифицированный грызун по п. 20, у которого последовательность нуклеиновой кислоты константной области легкой цепи иммуноглобулина грызуна функционально связана с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека.
26. Генетически модифицированный грызун по п. 25, у которого последовательность нуклеиновой кислоты константной области легкой цепи иммуноглобулина грызуна, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека, находится в эндогенном локусе иммуноглобулина грызуна в зародышевой линии грызуна.
27. Генетически модифицированный грызун для получения вариабельных областей иммуноглобулина, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии, содержащий:
нереаранжированные сегменты VH, DH и JH человека, функционально связанные с генной последовательностью константной области тяжелой цепи иммуноглобулина, причем один или несколько из нереаранжированных сегментов V, D и J в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), содержат по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона, где замещающий или вставленный гистидиновый кодон в одном или нескольких из сегментов V, D и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека не кодируется соответствующим генным сегментом дикого типа зародышевой линии человека; и
реаранжированную последовательность VL/JL человека, функционально связанную с генной последовательностью константной области легкой цепи иммуноглобулина, причем реаранжированная последовательность VJ содержит в последовательности, кодирующей определяющую комплементарность область 3 (CDR3), по меньшей мере одну замену негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона, где замещающий или вставленный гистидиновый кодон в реаранжированной последовательности VJ не кодируется соответствующим генным сегментом дикого типа зародышевой линии человека;
причем грызун экспрессирует вариабельный домен тяжелой цепи иммуноглобулина и/или вариабельный домен легкой цепи иммуноглобулина,
при этом один или оба вариабельных домена тяжелой и/или легкой цепей иммуноглобулина содержат в определяющей комплементарность области 3 (CDR3) гистидин, полученный путем замены или вставки по меньшей мере одного гистидинового кодона в один или несколько из сегментов V, D и J нереаранжированной последовательности нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека и/или реаранжированной последовательности VJ соответственно,
при этом грызун представляет собой крысу или мышь.
28. Генетически модифицированный грызун по п. 27, который представляет собой крысу.
29. Генетически модифицированный грызун по п. 27, который представляет собой мышь.
30. Генетически модифицированный грызун по п. 27, у которого нереаранжированная последовательность нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека функционально связана с последовательностью константной области тяжелой цепи иммуноглобулина грызуна.
31. Генетически модифицированный грызун по п. 30, у которого последовательность константной области тяжелой цепи иммуноглобулина грызуна, функционально связанная с нереаранжированной последовательностью нуклеиновой кислоты вариабельной области тяжелой цепи иммуноглобулина человека, находится в эндогенном локусе тяжелой цепи иммуноглобулина грызуна в зародышевой линии грызуна.
32. Генетически модифицированный грызун по п. 31, у которого последовательность константной области легкой цепи иммуноглобулина грызуна функционально связана с реаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека.
33. Генетически модифицированный грызун по п. 32, у которого последовательность константной области легкой цепи иммуноглобулина грызуна, функционально связанная с реаранжированной последовательностью нуклеиновой кислоты вариабельной области легкой цепи иммуноглобулина человека, расположена в эндогенном локусе легкой цепи иммуноглобулина грызуна в зародышевой линии грызуна.
34. Генетически модифицированный грызун по п. 1 для получения вариабельных областей тяжелой и/или легкой цепей иммуноглобулина, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии, причем грызун содержит популяцию В-клеток, которая характеризуется повышенным наличием остатков гистидина в цепях иммуноглобулина в популяции В-клеток, по сравнению с грызуном дикого типа, при этом остатки гистидина кодируются за счет замены или вставки гистидиновых кодонов, которые не кодируются соответствующими генными последовательностями.
35. Генетически модифицированный грызун по п. 34, у которого повышение представляет собой повышение приблизительно в 2-4 раза.
36. Генетически модифицированный грызун по п. 34, у которого повышение представляет собой повышение приблизительно в 2-10 раз.
37. Генетически модифицированный грызун по п. 1 для получения вариабельных областей, содержащих аминокислоту гистидин, кодируемую из его зародышевой линии, который экспрессирует цепи иммуноглобулина, которые содержат гистидины, кодируемые заменами и/или вставками в эндогенные последовательности иммуноглобулина зародышевой линии грызуна.
38. Генетически модифицированный грызун по п. 1, у которого последовательность вариабельной области иммуноглобулина в вариабельном локусе иммуноглобулина содержит 2, 3, 4 или 5 гистидинов, которые представляют собой замены гистидиновым кодоном негистидинового кодона и/или вставки гистидиновых кодонов.
39. Генетически модифицированный грызун по п. 5, у которого нереаранжированная последовательность вариабельного гена тяжелой цепи иммуноглобулина содержит генные сегменты D, которые инвертированы по отношению к направлению ориентации генной последовательности тяжелой цепи иммуноглобулина.
40. Способ получения грызуна, который производит вариабельные домены антитела с гистидинами, кодируемыми гистидиновыми кодонами зародышевой линии, предусматривающий:
модификацию грызуна в его зародышевой линии для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в нереаранжированную последовательность вариабельного гена, в последовательности, кодирующей определяющую комплементарность области 3 (CDR3), содержащую нереаранжированные сегменты VH, DH и JH тяжелой цепи иммуноглобулина, при этом гистидиновый кодон нереаранжированной последовательности вариабельного генного сегмента тяжелой цепи иммуноглобулина не кодируется соответствующим генным сегментом дикого типа зародышевой линии; и
модификацию грызуна в его зародышевой линии для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в определяющую комплементарность область 3 (CDR3) нереаранжированной последовательности вариабельного гена, содержащую нереаранжированные сегменты VL и JL легкой цепи иммуноглобулина человека, при этом гистидиновый кодон нереаранжированной последовательности вариабельного генного сегмента легкой цепи иммуноглобулина не кодируется соответствующим генным сегментом дикого типа зародышевой линии,
при этом грызун представляет собой крысу или мышь.
41. Способ по п. 40, при котором способ предусматривает генетическую модификацию зародышевой линии мыши для включения по меньшей мере части нереаранжированной последовательности вариабельного гена, содержащей нереаранжированные генные сегменты VH, DH и JH тяжелой цепи иммуноглобулина человека, и получение по меньшей мере одной замены или вставки гистидина в нереаранжированной последовательности вариабельного гена тяжелой цепи иммуноглобулина человека.
42. Способ по п. 40, при котором способ предусматривает генетическую модификацию зародышевой линии мыши для включения по меньшей мере части нереаранжированной последовательности гена легкой цепи иммуноглобулина человека, содержащей нереаранжированные генные сегменты VL и JL, и получение по меньшей мере одной замены или вставки гистидина в нереаранжированную генную последовательность легкой цепи иммуноглобулина человека.
43. Способ по п. 40, при котором грызун представляет собой крысу.
44. Способ по п. 40, при котором грызун представляет собой мышь.
45. Способ получения грызуна, который производит вариабельные домены антител с гистидинами, кодируемыми гистидиновыми кодонами зародышевой линии, предусматривающий:
модификацию грызуна для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в последовательность, кодирующую определяющую комплементарность область 3 (CDR3) нереаранжированной последовательности гена вариабельной области тяжелой цепи иммуноглобулина, содержащей нереаранжированные генные сегменты VH, DH и JH, при этом гистидиновый кодон нереаранжированной последовательности вариабельного гена тяжелой цепи иммуноглобулина не кодируется соответствующим генным сегментом дикого типа зародышевой линии; и
модификацию грызуна для включения по меньшей мере одной замены гистидиновым кодоном негистидинового кодона или вставки гистидинового кодона в последовательность, кодирующую определяющую комплементарность область 3 (CDR3) реаранжированной вариабельной последовательности, содержащей реаранжированную последовательность VL/JL в зародышевой линии, при этом гистидиновый кодон, содержащийся в реаранжированной вариабельной области легкой цепи иммуноглобулина, не кодируется соответствующим генным сегментом дикого типа зародышевой линии,
при этом грызун представляет собой крысу или мышь.
46. Способ по п. 45, при котором грызун представляет собой крысу.
47. Способ по п. 45, при котором грызун представляет собой мышь.
| WO 2011097603 A1, 11.08.2011 | |||
| US 2006015957 A1, 19.01.2006 | |||
| MENDEZ M | |||
| J | |||
| et al | |||
| Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice, NATURE GENETICS, NATURE PUBLISHING GROUP, NEW YORK, US, 1997, vol | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ТРАНСФОРМАЦИИ СТВОЛОВЫХ КЛЕТОК СЕМЕННИКОВ ЖИВОТНЫХ IN VIVO | 2005 |
|
RU2290442C2 |
Авторы
Даты
2018-08-17—Публикация
2013-03-15—Подача