Изобретение относится к биотехнологии. Конкретно, изобретение относится к способу предупреждения феномена усиления токсичности глазных инстилляций при совместном применении комбинации лекарственных препаратов. Изобретение может быть использовано для предупреждения феномена усиления токсичности глазных инстилляций при совместном применении комбинации лекарственных препаратов.
Известно использование клеточной культуры Chang conjunctiva, клон 1-5 С-4, каталожный номер АТСС - CCL 20.2 ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ для исследований in vitro [27].
В настоящее время необходимым этапом доклинических испытаний является оценка цитотоксичности офтальмологических лекарственных препаратов в рамках стандартов Надлежащей лабораторной практики (Good Laboratory Practice). Среди различных способов оценки токсичности существенную роль играют лабораторные методы, основанные на феномене изменения степени адсорбции клеточной культурой определенных красителей в зависимости от функционального состояния клеток, которое, в свою очередь зависит прежде всего от токсичности испытуемых лекарственных средств. Эти колориметрические методы важны для оценки токсичности и потенциальной опасности лекарственных веществ в условиях in vivo, и в частности - для определения предварительных нетоксических концентраций для дальнейшего применения у лабораторных животных на следующем этапе доклинических испытаний. В качестве материала принято использовать различные клеточные линии, содержащие клетки роговицы (эпителий, эндотелий), и конъюнктивы (эпителий, фибробласты, бокаловидные клетки) [1, 2, 3, 4].
Кроме доклинических исследований, данные методы актуальны и на постклиническом этапе. В частности, в работах Ayaki М. с соавт, Sawazaki R. с соавт, Qu М. с соавт., Kinnunen с соавт., Александровой О.И. с соавт., большое внимание уделено оценке цитотоксичности готовых офтальмологических лекарственных форм разных фармакологических групп (антибиотики, нестероидные противовоспалительные средства, корнеопротекторы), а также зависимости жизнеспособности клеток от наличия в составе глазных капель консервантов [5, 6, 7, 8, 9, 10, 11, 12]. Так, Qu М с соавт, сравнивая токсичность четырех нестероидных противовоспалительных препаратов выявили наименьшую у бромфенака, a Kinnunen с соавт [8, 9]. показали, что катионное соединение цеталкония хлорида и поликвад обладают значительно меньшей токсичностью по сравнению с бензалконием хлоридом.
Существенную информацию о том, как именно влияют исследуемые препараты (или потенциальные лекарственные вещества) на жизненную активность клеток конъюнктивы или роговицы может дать изучение продукции цитокинов как in vivo так и in vitro. Исследование продукции цитокинов in vivo для оценки иммунных эффектов офтальмологических препаратов были проведены Акберовой С.И. с соавт., Кочергиным С.А. с соавт., Майчуком Д.Ю. с соавт.[13, 14, 15, 16]. Результаты аналогичных исследований на клеточных культурах были опубликованы Leonardi А с соавт., Li J с соавт, Contreras-Ruiz L с соавт., Lambiase А. с соавт., Guzman-Aranguez А с соавт.[17, 18, 19, 20, 21].
Крайне мало работ посвящено изучению местных цитокиновых реакций и эффектам воздействия готовых глазных капель (и их комбинаций) на клеточные культуры, в частности, при вирусных инфекциях глаз.
В литературе недостаточно внимания уделяется развитию научно-обоснованных подходов к терапии воспалительных заболеваний глаз вирусной природы с использованием общепринятых фундаментальных биологических методов, тогда как обилие готовых лекарственных форм создает условия развитию полипрагмазии и лекарственной аллергии в офтальмологии [23, 24, 25].
Известен способ исследования динамики и механизмов изменений типов клеток естественных киллеров (NK) на поверхности слизистой оболочки глаза человека in situ в течение инфекции [1].
Известен способ оценки цитотоксического эффекта ганцикловира (GCV) на культивируемые эндотелиальные клетки роговицы человека (HCECs). НСЕС культивировали и подвергали воздействию различных концентраций (0-20 мг / мл) GCV (Cytovene). Оценивали жизнеспособность клеток. Клеточная морфология оценивалась с использованием фазоконтрастной микроскопии после 48 часов воздействия GCV. Клеточный цикл и апоптоз анализировали с использованием NC-3000 для оценки влияния GCV на НСЕС. Скорость пролиферации клеток оценивали с помощью анализа пролиферации бромдезоксиуридином [22].
Техническим результатом является предупреждение феномена усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов. Также техническим результатом является расширение арсенала средств для оценки цитотоксических эффектов офтальмологических препаратов при совместном применении лекарственных препаратов.
Изобретение сочетает возможности классических, давно существующих методов оценки токсичности лекарственных препаратов на культурах тканей в сочетании с использованием новых иммунологических методик.
Настоящее изобретение относится к способу предупреждения феномена усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов, включающему использование культуры клеток конъюнктивы, при этом осуществляют подбор оптимальных концентраций глазных препаратов, входящих в комбинацию, путем оценки метаболитической активности культуры клеток конъюнктивы качественно через морфологическую оценку с помощью визуального контроля и количествено с помощью МТТ-теста при воздействии указанных глазных препаратов в различных концентрациях на культуру клеток конъюнктивы; оценивают продукцию цитокинов в сравнении с контролем по уровню транскрипции после 48 ч инкубирования с комбинацией препаратов с подобранной концентрацией для каждого, в качестве контроля используют не обработанную культуру клеток конъюнктивы, при этом усиление продукции цитокинов указывает на отсутствие усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов, что позволяет применять проверенную комбинацию лекарственных препаратов для лечения воспалительных заболеваний конъюнктивы и роговицы.
Предпочтительно изобретение относится к способу, где культура клеток конъюнктивы является культурой нормальных клеток конъюнктивы человека Chang conjunctiva, клон 1-5 С-4, каталожный номер АТСС - CCL 20.2 ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ.
Предпочтительно изобретение относится к способу, где для визуального контроля изменений морфологии клеток клетки выращивают на стерильных покровных стеклах в 6-луночных панелях, оценивают под микроскопом их морфологическое состояние в процессе культивирования с препаратами Броксинака и Офтальмоферона в сравнении с контролем, проводят фотофиксацию.
Предпочтительно изобретение относится к способу, где уровень транскрипции оценивают по экспрессии генов интерлейкина (ИЛ)-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-17, ИЛ-18, фактора некроза опухолей (ФНО)-α, интерферона (ИФН)-α, ИФН-β, ИФН-γ, ИФН-λ1, ИФН-λ2, ИФН-λ3, а также факторов роста эндотелия сосудов (Vegf)A, VegfC, и их рецепторов Vegf R1, Vegf R2, Vegf R3.
Предпочтительно изобретение относится к способу, где экспрессию генов оценивают по активности их мРНК, которую проводят с использованием методов обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР).
Материалы и методы.
Для работы использована перевиваемая культура нормальных клеток конъюнктивы человека Chang conjunctiva, клон 1-5 С-4, каталожный номер АТСС - CCL 20.2 ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ. Действие препаратов Броксинак и Офтальмоферон количественно определяли по их влиянию на жизнеспособность клеток с помощью МТТ-метода; для изучения изменения морфологии клеток в процессе культивирования использовали метод прижизненного визуального наблюдения. Влияние комбинации препаратов на функциональную активность клеток конъюнктивы оценивали с помощью изучения продукции цитокинов на уровне их транскрипции in vitro.
Культивирование клеток проводили на стандартной питательной среде Игла MEM производства Московского института полиомиелита и вирусных энцефалитов им. М.П. Чумакова с 10% эмбриональной телячьей сывороткой (ЭТС) фирмы «ПанЭко».
С целью оценки метаболической активности клеток использовали МТТ-тест. МТТ-колориметрический тест служит биологическим стандартом и рекомендован в этом качестве для оценки цитотоксического действия различных чужеродных веществ на клетки [26]. Этот тест основан на прямой коррекции количества жизнеспособных клеток и интенсивности метаболизма специального реактива МТТ до водорастворимого темноокрашенного формазана под действием митохондриальной сукцинатдегидрогеназы, тогда как мертвые клетки и клетки со сниженной жизнеспособностью такой способностью не обладают. Последующая спектрофотометрия растворенного с помощью ДМСО формазана позволяет точно сопоставить изменение оптической плотности раствора по отношению к контролю с изменением количества жизнеспособных клеток, а в цитотоксических исследованиях оценить специфическую гибель клеток, индуцированную тем или иным цитотоксическим агентом [26]. Клетки рассевали на 96-луночную панель фирмы «Costar» (США) в концентрации 200 тыс. кл/мл в каждую лунку в объеме 100 мкл культуральной среды с 10% ЭТС и инкубировали в СО2-термостате с 5% СО2 при 37°С. Через 24 часа после посадки и образования субконфлюэнтного монослоя клеток перед внесением исследуемых препаратов инкубационную среду меняли, добавляя по 100 мкл среды с 1% ЭТС в лунку.
В работе были использованы коммерческие офтальмологические препараты в виде глазных капель: Броксинак (Швейцария) и Офтальмоферон (РФ). Действие препаратов Броксинак и Офтальмоферон in vitro на культуру конъюнктивальных клеток оценивали количественно (МТТ-тест) и качественно (морфологически).
Пример 1
Жизнеспособность клеток и МТТ-метод.
После инкубации клеток с препаратами Броксинак и Офтальмоферон в течение 48 часов в СО2 термостате при 37°С культуральную среду отсасывали из лунок, добавляли по 100 мкл среды с 20 мкл МТТ (3[4,5-диметил-тиазол-2-ил]-2.5-дифенилтетразолия, Sigma) в исходной концентрации 5 мг/мл и инкубировали в течение 4 часов. Затем среду с МТТ удаляли и добавляли по 100 мкл диметилсульфоксида (ДМСО) для растворения образовавшихся кристаллов формазана. Осадок клеток ресуспендировали в течение 5 мин пипетированием. Жизнеспособность клеток оценивали по интенсивности окраски раствора синего формазана, измеряя оптическую плотность при длине волны 545 нм фотометра Immunochem 2100 (США). Оценку результатов МТТ-теста проводили путем сопоставления оптической плотности в опытных и контрольных лунках, процент жизнеспособных клеток рассчитывали как отношение оптической плотности обработанных клеток и контрольных клеток.
Качественная оценка результатов теста.
Для визуального контроля изменений морфологии клеток, клетки выращивали на стерильных покровных стеклах в 6-луночных панелях, оценивали под микроскопом их морфологическое состояние в процессе культивирования с препаратами Броксинака и Офтальмоферона в сравнении с контролем, проводили фотофиксацию.
Изучение продукции цитокинов.
Влияние комбинации препаратов на функциональную активность клеток конъюнктивы оценивали изучением продукции цитокинов на уровне их транскрипции in vitro. Изучаемые препараты в исходной концентрации 0,9 мг/мл Броксинак и 10000МЕ\мл Офтальмоферон раститровывали в двухкратных разведениях от 1/2 до 1/4096 с помощью внесения их по 100 мкл в лунку панели и инкубировали с клетками в течение 48 часов в CO2-термостате при 37°С. Эксперименты выполняли с тремя повторами. Контролем служили интактные клетки конъюнктивы человека Chanq conjunctiva, культивируемые параллельно с опытными. За 100% жизнеспособность принимали интенсивность окраски в лунках панели с контрольными клетками. Изменение функциональной клеточной активности изучалось по продукции цитокинов на уровне их транскрипции in vitro в клеточной культуре после инкубации клеток с препаратами в течение 48 часов.
Клетки (Chanq conjunctiva) высевались в 6-луночные панели в посевной дозе 200 тыс. кл/мл, инкубировались 24 часа до образования монослоя и затем после смены среды изучаемые препараты в выбранных концентрациях вносились в лунки в отдельности или вместе одновременно. Экспрессия генов интерлейкина (ИЛ)-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-17, ИЛ-18, фактора некроза опухолей (ФНО)-α, интерферона (ИФН)-α, ИФН-β, ИФН-γ, ИФН-λl, ИФН-λ2, ИФН-λ3, а также факторов роста эндотелия сосудов (Vegf)A, VegfC, и их рецепторов Vegf R1, Vegf R2, Vegf R3, оценивалась по активности их мРНК. Определение активности мРНК цитокинов и 3-х рецепторов проводили с использованием методов обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). В качестве положительного контроля использовали β-актин. Регистрацию результатов ПЦР осуществляли электрофоретически в 2,5% агарозном геле, окрашенным бромистым этидием. Для идентификации нуклеотидных последовательностей использовали маркер для электрофореза фирмы Promega (G 1758).
Статистическую обработку результатов проводили с использованием программного обеспечения Microsoft Excel, «Statistica 6.0». Достоверность различия средних величин устанавливали с помощью t-критерия Стьюдента при уровне значимости p≤0,01.
Результаты и обсуждение.
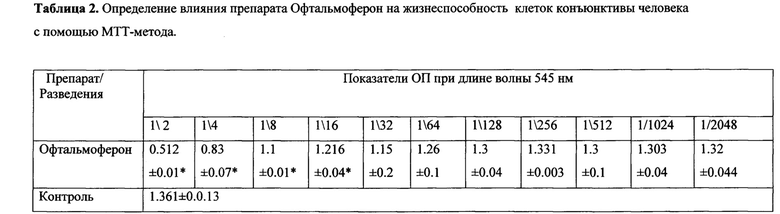
На первом этапе работы при оценке цитотоксического действия готовых лекарственных препаратов in vitro на жизнеспособность клеток Chanq conjunctiva с помощью МТТ-теста были получены ориентировочные нетоксичные для данной клеточной культуры концентрации готовых лекарственных форм препаратов Броксинак и Офтальмоферон с целью дальнейшего изучения цитокиновых реакций клеток при комбинированном применении препаратов в искомых концентрациях. Полученные данные представлены в таблицах 1 и 2.

*различия достоверны при уровне значимости p≤0,01
*различия достоверны при уровне значимости p≤0,01
Полученные данные свидетельствуют о том, что два исследуемых нами препарата при инкубации с клетками в течение 48 часов вызывают угнетение ростовой активности и жизнеспособности нормальных клеток человека Chang conjunctiva в разведениях 1/2-1/256 (свыше 3 мкг/мл Броксинак) и 1/2-1/16 (свыше 625 МЕ/мл Офтальмоферон). Данные концентрации послужили дальнейшим ориентиром для изучения влияния комбинации Броксинака и Офтальмоферона на продукцию цитокинов клетками конъюнктивы в культуре.
При визуальном изучении клеток в процессе их культивирования с изучаемыми препаратами в микроскопе Olympus CKX41 было показано, что клетки в контрольных лунках через 72 часа сформировали конфлюэнтный монослой и не отличались от исходной перевиваемой культуры нормальных клеток конъюнктивы человека Chang conjunctiva, состоящих из эпителиоподобных клеток с крупными округлыми ядрами. В ядрах содержалось 1-4 ядрышка и хроматиновая зернистость, встречались четырех-ядерные клетки, цитоплазма была зернистая. В серии последующих экспериментов было показано, что при одновременном внесении в лунки препаратов в субтоксичных концентрациях (3 мкг/мл Броксинак и 625 МЕ/мл Офтальмоферон) и инкубации с клетками в течение 48 часов, наблюдается достоверное снижение значений ОП 545 нм, что свидетельствует о некотором снижении жизнеспособности клеток конъюнктивы.
Полученные необходимо принимать во внимание при разработке оптимальных схем комбинированного применения препаратов в офтальмологической практике, а также для разработки схем длительной реабилитации после воспалительных заболеваний глаз.
Результаты исследования цитотоксического действия при внесении препаратов на морфологию клеток Chang conjunctiva, окрашенных по Романовскому, в световом микроскопе представлены на фиг. 1-3. Клетки в контроле не отличаются от исходной культуры, также состоят из эпителиоподобных клеток с крупными округлыми ядрами, ядра и клетки с четко выраженной границей. В ядрах содержится 1-4 ядрышка и хроматиновая зернистость. На представленных фотографиях видно, что в течение 48 часов инкубации с клетками препараты в нетоксичных концентрациях (Броксинак 3 мкг/мл и Офтальмоферон 625 МЕ/мл фиг. 3) не оказывают цитотоксического действия и видимых изменений морфологии клеток не выявлено.
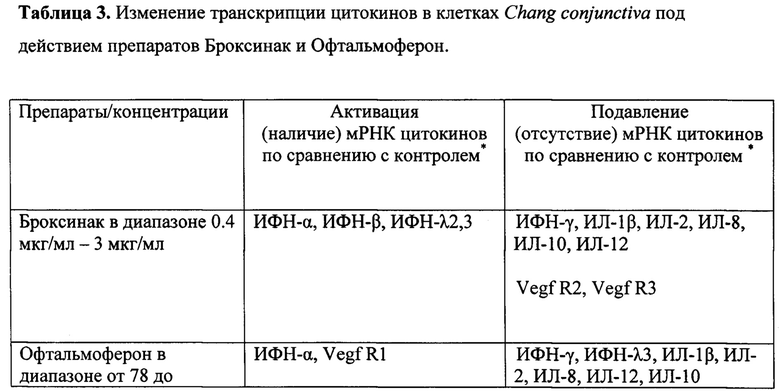
Как было указано выше, ориентировочные нетоксичные концентрации готовых лекарственных форм препаратов Броксинак и Офтальмоферон дали возможность изучения цитокиновых реакций клеток как при самостоятельном, так и при комбинированном применении препаратов в диапазоне концентраций от искомых нетоксичных и ниже (таблица 3). Нами были получены достаточно неожиданные результаты двоякого действия препарата Броксинак на клетки конъюнктивы - он стимулировал продукцию основных двух типов противовирусного ИФН - ИФН-α и ИФН-λ, одновременно подавляя выработку некоторых провоспалительных цитокинов, необходимых для формирования адекватного иммунного ответа по клеточному типу (ИФН-γ, ИЛ-2, ИЛ-8, ИЛ-12). Примечательно, что при совместном применении препаратов в культуре подобного ингибирующего эффекта Броксинака не наблюдалось. Офтальмоферон в диапазоне субтоксических концентраций стимулировал выработку ИФН-α и Vegf R1, что может убедительно свидетельствовать о том, что рекомбинантный ИФН-α2б в составе препарата Офтальмоферон не только выполняет заместительную функцию, восполняя дефицит эндогенного ИФН, но и стимулирует его продукцию по принципу аутокринной регуляции. Стимуляция Офтальмофероном рецепторного белка Vegf R1 может свидетельствовать, как ни странно, об антипролиферативном эффекте данного препарата, поскольку рецептор Vegf R1 может выступать в качестве ингибитора самого фактора роста эндотелия. При совместном применении в клеточной культуре комбинации Броксинак+Офтальмоферон наблюдается продукция противовирусного ИФН типа I (ИФН-α) и типа III (ИФН-λ2), а также провоспалительных цитокинов ИЛ-2 и ИЛ-12; подавления же продукции цитокинов при этом не выявлено. Вышеуказанные процессы, наблюдаемые нами в культуре клеток конъюнктивы, выявили феномен перекрестного взаимодействия двух лекарственных веществ на уровне клеточных цитокиновых реакций. Таким образом, можно предполагать, что синергидный положительный эффект данной комбинации препаратов in vivo может обеспечивать адекватную противовирусную защиту клеток без потери иммунологического потенциала.

*Контроль - клетки без препарата
Офтальмологические препараты Броксинак и Офтальмоферон при инкубировании с клетками в течение 48 часов не вызывают угнетение ростовой активности и жизнеспособности нормальных клеток человека Chang conjunctiva в разведениях 1\512-1/2048 (3 мкг/мл и менее - Броксинак) и 1/32-1/2048 (625 МЕ/мл и менее - Офтальмоферон). Внесение исследуемых лекарственных средств в культуру клеток Chang conjunctiva в данных концентрациях не изменяет морфологии клеток и испытуемые образецы не отличаются от состояния клеток в контроле. Исследование продукции цитокинов клетками конъюнктивы при самостоятельном использовании Броксинака выявило стимуляцию продукции противовирусных ИФН-α и ИФН-λ и угнетение выработки провоспалительных ИФН-γ, ИЛ-2, ИЛ-8, ИЛ-12. Офтальмоферон стимулировал выработку ИФН-α и Vegf R1. При совместном применении препаратов наблюдали продукцию РНК ИФН-α, ИФН-λ2, ИЛ-2, ИЛ-12.
Совместное использование Броксинака и Офтальмоферона в культуре клоток конъюнктивы человека Chang приводит к формированию адекватного противовирусного и противовоспалительного цитокинового ответа - наблюдается усиление продукции ИФН-α, ИФН-λ, ИЛ-2 и ИЛ-12.
Результаты настоящего исследования позволяют свидетельствовать о том, что методы оценки жизнеспособности клеток конъюнктивы человека Chang могут быть использованы для исследования влияния комбинаций офтальмологических препаратов, применяемых для лечения воспалительных (вирусных) инфекций глаз на функциональную активность клеток. Для изучения цитокиновых реакций в клеточных культурах целесообразно определить нетоксичные для данной клеточной культуры концентрации препаратов с помощью МТТ-теста, что и было сделано нами на первом этапе работы. Второй этап работы - изучение цитологии клеток конъюнктивы человека при внесении препаратов Броксинак и Офтальмоферон в субтоксичных концентрациях подтвердил отсутствие морфологических изменений клеток в культуре (сохранены формы и размеры ядер и самих клеток). И, наконец, третий этап - изучение функциональной активности клеток при раздельном и совместном применении препаратов выявил три разных цитокиновых профиля. Броксинак стимулировал продукцию основных двух типов противовирусного ИФН - ИФН-α и ИФН-λ, одновременно подавляя выработку некоторых провоспалительных цитокинов, необходимых для формирования адекватного иммунного ответа по клеточному типу (ИФН-γ, ИЛ-2, ИЛ-8, ИЛ-12). Офтальмоферон в диапазоне субтоксических концентраций стимулировал выработку ИФН-α, что свидетельствует об эффекте индукции эндогенного ИФН рекомбинантным ИФН-α2б в составе данного препарата.
Совместное использование Броксинака и Офтальмоферона в клеточной культуре приводит к формированию адекватного противовирусного и противовоспалительного цитокинового ответа - наблюдается усиление продукции ИФН-α, ИФН-λ, ИЛ-2 и ИЛ-12, что дает научное обоснование для успешного применения данной комбинации лекарственных препаратов для лечения воспалительных заболеваний конъюнктивы и роговицы.
Список литературы
1. Yawata N, Selva KJ, Liu YC, Tan KP, Lee AW, Siak J, Lan W, Vania M, Arundhati A, Tong L, Li J, Mehta JS, Yawata M. Dynamic change in natural killer cell type in the human ocular mucosa in situ as means of immune evasion by adenovirus infection. Mucosal immunology. 2016;9(1):159-170. doi: 10.1038/mi.2015.47.
2. Diebold Y, Calonge M, Enriquez de Salamanca A., Callejo S, Corrales RM, Saez V, Siemasko KF, Stern ME. Characterization of a spontaneously immortalized cell line (IOBA-NHC) from normal human conjunctiva. Investigative ophthalmology and visual science. 2003;44(10):4263-4274.
3. Ammar DA., Kahook MY. Effects of benzalkonium chloride- or polyquad-preserved fixed combination glaucoma medications on human trabecular meshwork cells. Journal Molecular Vision. 2011;17:1806-1813.
4. Schuerer N, Stein E, Inic-Kanada A, Pucher M, Hohenadl C, Bintner N, Ghasemian E, Montanaro J, Barisani-Asenbauer T. Implications for Ophthalmic Formulations: Ocular Buffers Show Varied Cytotoxic Impact on Human Corneal-Limbal and Human Conjunctival Epithelial Cells Cornea. 2017;36(6):712-718. doi: 10.1097/ICO.0000000000001199.
5. Ayaki M, Iwasawa A, Soda M, Yaguchi S, Koide R. Cytotoxicity of five fluoroquinolone and two nonsteroidal anti-inflammatory benzalkonium chloride-free ophthalmic solutions in four corneoconjunctival cell lines. Clinical ophthalmology (Auckland, N.Z.). 2010;4:1019-1024.
6. Ayaki M, Yaguchi S, Iwasawa A, Koide R. Cytotoxicity of ophthalmic solutions with and without preservatives to human corneal endothelial cells, epithelial cells and conjunctival epithelial cells. Clinical and experimental ophthalmology. 2008;36(6):553-559. doi: 10.1111/j.1442-9071.2008.01803.x
7. Sawazaki R, Ishihara T, Usui S, Hayashi E, Tahara K, Hoshino T, Higuchi A, Nakamura S, Tsubota K, Mizushima T. Diclofenac protects cultured human corneal epithelial cells against hyperosmolarity and ameliorates corneal surface damage in a rat model of dry eye. Investigative ophthalmology and visual science. 2014;55(4):2547-2556. doi: 10.1167/iovs.l3-13850.
8. Qu M, Wang Y, Yang L, Zhou Q Different cellular effects of four anti-inflammatory eye drops on human corneal epithelial cells: independent in active components. Molecular vision. 2011;17:3147-3155.
9. Kinnunen K, Kauppinen A, Piippo N, Koistinen A, Toropainen E, Kaarniranta K Cationorm shows good tolerability on human HCE-2 corneal epithelial cell cultures. Experimental eye research. 2014;120:82-89. doi: 10.1016/j.exer.2014.01.006.
10. Александрова О.И., Околов И.Н., Хорольская Ю.И., Блинова М.И., Чураков Т.К. Оценка влияния бензалкония хлорида на цитотоксичность глазных капель Неттацин и Тобрекс в условиях in vitro. Мвтериалы XIII Всероссийской научно-практической конференции с международным участием «Федоровские чтения-2016». 2016.
11. Александрова О.И., Околов И.Н., Тахтаев Ю.В., Хорольская Ю.И., Хинтуба Т.С., Блинова М.И. Сравнительная оценка цитотоксичности антимикробных глазных капель. Офтальмологические ведомости. 2015;8(1):89-97.
12. Александрова О.И., Хорольская Ю.И., Майчук Д.Ю., Блинова М.И. Исследование общей цитотоксичности антибиотиков аминогликозидного и фторхинолонового ряда на клеточных культурах. Вестник Офтальмологии. 2015;131(5):43-53.
13. Акберова С.И., Ершов Ф.И., Мусаев Галбинур П.И. Динамика интерферонового статуса у больных с герпетическими кератитами при лечении новым индуктором интерферона актиполом. Вестник офтальмологии. 2001;117(1):33-35.
14. Кочергин С.А., Чернакова Г.М., Клещева Е.А., Шаповал И.М., Мезенцева М.В. Локальный цитокиновый статус при хронических формах аденовирусной инфекции глаз. Вестник РАЕН. 2012;1:61-67.
15. Майчук Д.Ю., Васильева О.А., Руссу Л.И., Мезенцева М.В. Сравнительная клинико-иммунологическая оценка вариантов терапии инфильтративного поражения роговицы после перенесенного аденовирусного кератоконъюнктивита. Вестник офтальмологии. 2015;131(4):49-55.
16. Lin Y, Zhang M, Barnes PF. Chemokine production by human alveolar epithelial cell line in response by Mycobacterium tuberculosis. Infection and Immunity. 1998;66(3):1121-1126. doi: 10.1128/IAI.70.2.577-583.2002
17. Leonardi A, DeFranchis G, Fregona IA, Violato D, Plebani M, Secchi AG. Effects of cyclosporin A on human conjunctival fibroblasts. Archives of ophthalmology. 2001;119(10):1512-1517.
18. Li J, Lehmann C, Chen X, Romerio F, Lu W. Total chemical synthesis of human interferon alpha-2b via native chemical ligation. Journal of peptide science. 2015;21(7):554-560. doi: 10.1002/psc.2760.
19. Contreras-Ruiz L, Schulze U,  , Arranz-Valsero I,
, Arranz-Valsero I,  A, Paulsen F, Diebold Y. Structural and functional alteration of corneal epithelial barrier under inflammatory conditions. Current eye research. 2012;37(11):971-981. doi: 10.3109/02713683.2012.700756.
A, Paulsen F, Diebold Y. Structural and functional alteration of corneal epithelial barrier under inflammatory conditions. Current eye research. 2012;37(11):971-981. doi: 10.3109/02713683.2012.700756.
20. Lambiase A, Micera A, Bonini S Multiple action agents and the eye: do they really stabilize mast cells? Current opinion in allergy and clinical immunology. 2009;9(5):454-465. doi: 10.1097/ACI.0b013e3283303ebb.
21. Guzman-Aranguez A, Calvo P, Ropero I, Pintor J. In vitro effects of preserved and unpreserved anti-allergic drugs on human corneal epithelial cells Journal of ocular pharmacology and therapeutics. 2014;30(9):790-798. doi: 10.1089/jop.2014.0030.
22. Choi WS, Koh JW, Chung TY, Hyon JY, Wee WR, Shin YJ Cytotoxicity of ganciclovir on cultured human corneal endothelial cells. Antiviral therapy. 2013;18(6):813-820. doi: 10.3851/IMP2556.
23. Майчук, Ю.Ф. Фармакотерапия аллергических заболеваний глаз. М., 1997.
24. Сычев Д.А., Отделенов В.А., Андреев Д.А., Богова О.Т., Бордовский С.П., Салпагарова З.К., Головина О.В., Данилина К.С, Захарова Г.Ю., Ильина Е.С., Клейменова Е.Б., Краснова Н.М., Назаренко Г.И., Орехов Р.Е., Пающик С.А., Сосновский Е.Е., Шуев Г.Н., Яшина Л.П. Полипрагмазия в клинической практике: проблема и решения. Санкт-Петербург: ЦОП «Профессия»; 2016.
25. Сычев Д.А. Как избежать «фармагеддона». электронный ресурс http://gmpnews.ru/2015/07/dmitrij-sychev-kak-izbezhat-farmageddona/.
26. Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина; 2005.
27. Meral Esen, и др. Invasion of Human Epithelial Cells by Pseudomonas aeruginosa Involves Src-Like Tyrosine Kinases p60Src and p59Fyn, Infect Immun. 2001 Jan; 69(1):281-287.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ отбора и подготовки пробы клеток конъюнктивы для проведения бактериологического, вирусологического и иммунологического исследований | 2017 |
|
RU2643955C1 |
| Способ диагностики смешанных хронических рецидивирующих инфекций глаза методом ПЦР | 2017 |
|
RU2658206C1 |
| Способ определения степени раздражающего действия дезинфекционных средств на кожу человека | 2018 |
|
RU2681874C1 |
| СПОСОБ ВЫБОРА ТЕРАПИИ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ГЛАЗНОЙ ПОВЕРХНОСТИ НА ОСНОВЕ УПРАВЛЯЕМОГО ПОТЕНЦИРОВАНИЯ ЭКССУДАТИВНОЙ РЕАКЦИИ С ПОМОЩЬЮ МЕХАНИЧЕСКОГО ИЛИ ИММУННОГО ВОЗДЕЙСТВИЙ | 2009 |
|
RU2421193C2 |
| Способ лечения герпетических кератитов рецидивирующего течения | 2023 |
|
RU2808915C1 |
| СПОСОБ ВЫБОРА ПАТОГЕНЕТИЧЕСКИ ОБУСЛОВЛЕННОЙ ТАКТИКИ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ | 2012 |
|
RU2494741C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ОТЕКА РОГОВИЦЫ И ДРУГИХ ПРОЯВЛЕНИЙ РАННЕЙ БУЛЛЕЗНОЙ КЕРАТОПАТИИ | 2008 |
|
RU2357743C1 |
| СРЕДСТВО ПРОФИЛАКТИКИ И КОРРЕКЦИИ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ | 2006 |
|
RU2318533C1 |
| ПРОТИВОЭНТЕРОВИРУСНОЕ И ИММУНОСТИМУЛИРУЮЩЕЕ СРЕДСТВО | 2014 |
|
RU2554761C1 |
| СРЕДСТВО ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2337703C1 |


Изобретение относится к биотехнологии. Конкретно, изобретение относится к предупреждению феномена усиления токсичности глазных инстилляций при совместном применении комбинации лекарственных препаратов. Используют культуры клеток конъюнктивы, при этом осуществляют подбор оптимальных концентраций глазных препаратов путем оценки метаболитической активности культуры клеток конъюнктивы качественно через морфологическую оценку с помощью визуального контроля и количествено с помощью МТТ-теста. Оценка осуществляется при воздействии указанных глазных препаратов или их комбинаций в различных концентрациях. Оценивают продукцию цитокинов в сравнении с контролем по уровню транскрипции после 48 ч инкубирования с указанными глазными препаратами или их комбинацией в подобранной концентрации. В качестве контроля используют не обработанную культуру клеток конъюнктивы. Усиление продукции цитокинов указывает на отсутствие усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов, что позволяет применять проверенную комбинацию лекарственных препаратов для лечения воспалительных заболеваний конъюнктивы и роговицы. Изобретение может быть использовано для предупреждения феномена усиления токсичности глазных инстилляций при совместном применении комбинации лекарственных препаратов. 4 з.п. ф-лы, 3 ил., 3 табл., 1 пр.
1. Способ предупреждения феномена усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов, включающий использование культуры клеток конъюнктивы, при этом осуществляют подбор оптимальных концентраций глазных препаратов, входящих в комбинацию, путем оценки метаболитической активности культуры клеток конъюнктивы качественно через морфологическую оценку с помощью визуального контроля и количествено с помощью МТТ-теста при воздействии указанных глазных препаратов в различных концентрациях на культуру клеток конъюнктивы; оценивают продукцию цитокинов в сравнении с контролем по уровню транскрипции после 48 ч инкубирования с комбинацией препаратов с подобранной концентрацией для каждого, в качестве контроля используют не обработанную культуру клеток конъюнктивы, при этом усиление продукции цитокинов указывает на отсутствие усиления токсичности глазных инстилляций при совместном применении лекарственных препаратов, что позволяет применять проверенную комбинацию лекарственных препаратов для лечения воспалительных заболеваний конъюнктивы и роговицы.
2. Способ по п. 1, где культура клеток конъюнктивы является культурой нормальных клеток конъюнктивы человека Chang conjunctiva, клон 1-5 С-4, каталожный номер АТСС - CCL 20.2 ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи МЗ РФ.
3. Способ по п. 1, где для визуального контроля изменений морфологии клеток клетки выращивают на стерильных покровных стеклах в 6-луночных панелях, оценивают под микроскопом их морфологическое состояние в процессе культивирования с препаратами Броксинака и Офтальмоферона в сравнении с контролем, проводят фотофиксацию.
4. Способ по п. 1, где уровню транскрипции оценивают по экспрессии генов интерлейкина (ИЛ)-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-17, ИЛ-18, фактора некроза опухолей (ФНО)-α, интерферона (ИФН)-α, ИФН-β, ИФН-γ, ИФН-λ1, ИФН-λ2, ИФН-λ3, a также факторов роста эндотелия сосудов (Vegf)A, VegfC, и их рецепторов Vegf R1, Vegf R2, VegfR3.
5. Способ по п. 4, где экспрессию генов оценивают по активности их мРНК, которую проводят с использованием методов обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР).
| АЛЕКСАНДРОВСКАЯ О.И | |||
| и др., Исследование общей цитотоксичности антибиотиков аминогликозидного и фторхинолонового ряда на клеточных культурах, Вестник Офтальмологии, 2015, 131(5): 43-53 | |||
| МАЙЧУК Д.Ю | |||
| и др., Сравнительная клинико-иммунологическая оценка вариантов терапии инфильтративного поражения роговицы после перенесенного аденовирусного кератоконъюнктивита, 2015, 131(4): 49-55. |
Авторы
Даты
2018-03-01—Публикация
2017-07-11—Подача