Изобретение относится к медицине и ветеринарии, а именно к лечению ожоговой токсемии.
Известен способ профилактики острой ожоговой токсемии путем некроэктомии ожогового струпа (см. кн. В.И. Петрова и Ю.Б. Сладкова «Хирургия лучевых поражений кожи». - Л., 1973; Н.Е. Повстяной «Восстановительная хирургия ожогов»., М., 1973).
Известен также способ предупреждения ожоговой токсемии с немедленной ауто- или ксенолпластикой (см. кн. А.А. Лимберга «Планирование операций на поверхности тела.» - Л., 1963).
Недостатком способов является их слабая дезинтоксикационная эффективность, поскольку оперативное вмешательство не обеспечивает нейтрализации ожоговых токсинов, циркулирующих в крови, лимфе, органах и тканях пораженных животных, т.к. через 2-3 суток после нанесения ожога наступает значительная антигенемия (токсемия) крови, ведущая к ожоговой токсемии, с последующим нарушением гомеостаза, метаболизма и развития токсико-инфекции.
Известен также способ дезинтоксикации очаговой токсемии путем переливания крови, плазмы, альбумина, протеина, раствора Рингера (см. ст. Д.Е. Пекарского «Концепция патогенеза и принципы терапии острой ожоговой токсемии. - Клиническая хирургия. - 1978. - №3. - С. 320).
Недостатком способа является ежедневное в течение недели переливание крови или их заменителей, что трудновыполнимо как для исполнителя, так и для пациента; кроме того, малодоступность и дороговизна переливаемого субстрата.
Известен также способ дезинтоксикации ожоговой токсемии путем введения антистафилококкового гамма-глобулина, антистафилококковой и синегнойной плазмы (см ст. «Ожоги». БМЭ, 1981. Т. 17. - С. 231).
Недостатком способа является слабая токсиннейтрализирующая способность используемых препаратов, поскольку они, ингибируя развитие стафилококковой инфекции, не обладают свойством нейтрализовать ожоговые антигены и термотоксины.
Между тем из источников информации известно, что в патогенезе термического поражения ключевую роль играют токсические продукты тканевого распада - ожоговые антигены, приобретающие свойства термотоксинов (см. ст. Н.А. Федорова и др. «Экспериментальные исследования по ожоговому антигену» в кн.: Актуальные вопросы иммунологии. - М., 1964.), обуславливающих развитие в организме патологической аутоиммунной (противотканевой иммунной) цитотоксической реакции, ведущей к посттермической гибели клеток. Наводнение обожженного организма продуктами тканевой дезинтеграции приводит, с одной стороны, к снижению количества нормальных противотканевых антител (НПТА) и, с другой - в отдаленный период к ожоговой болезни - синтезу противоожоговых противотканевых антител.
Следовательно, введение в организм обожженных животных аутоантителсодержащей крови, сывороток, плазмы, лимфы, обогащенных как нормальными, так и гипериммунными антителами, может обладать противоожоговой дезинтоксикационной активностью путем нейтрализации аутоантигенов, термотоксинов, токсичных продуктов распада клеток и тканей.
Учитывая, что антисыворотки, полученные от гипериммунизированных специфическими антигенами животных, обладают более выраженными лечебно-профилактическими свойствами, представляется перспективным получение и использование антисывороток от гипериммунизированных ожоговым антигеном животных - доноров сывороток.
Поэтому в качестве концептуального положения терапии ожоговой токсемии нами выбран принцип получения и применения противоожоговых антитоксических антител путем гипериммунизации животных-доноров тканевыми антигенами, полученными от больных ожоговой болезнью животных.
Задачей изобретения является повышение эффективности способа лечения острой ожоговой токсемии за счет применения гипериммунной противоожоговой антитоксической сыворотки, приводящей к увеличению антитоксической активности и уменьшению ее лечебной дозы в 2 раза.
Поставленная задача решается за счет введения в организм биологически активного препарата - гипериммунной противоожоговой антитоксической сыворотки млекопитающих, которую вводят подкожно, 3-кратно через 24, 48 и 112 час после ожоговой травмы, в дозе 100-125 мг/кг - взрослым животным. Гипериммунную противоожоговую антитоксическую сыворотку млекопитающих для лечения острой ожоговой токсемии получают путем предварительного получения ожогового антигена, полученного водным экстрагированием гомогенатов печени, взятых у убитых в период токсемии на 8-9 сут ожоговой болезни животных, выделения белковой фракции антигена путем его дробного центрифугирования в течение 15 мин при 10000 об/мин в присутствии насыщенных растворов сульфата аммония 25-30%-ного насыщения для одной фракции и 30-33 5-ного насыщения - для другой, их последующего диализа против дистиллированной воды, затем полученные фракции объединяют, определяют белок и стандартизируют его до концентрации 5 мг/мл, далее полученный ожоговый антиген с неполным адъювантом Фрейнда в соотношении 1:1 используют для гипериммунизации животных (кроликов, овец, свиней, коров и лошадей), проводят 7-9 кратное подкожное и внутривенное введение в дозе 18,7-22,2 мг по белку полученного антигена с 2-3-дневным интервалом, при этом на 7 сутки после последней инъекции антигена берут кровь у доноров, а через 18 часов отделяют сыворотку, определяют титр антител и содержание белка, доводят его до концентрации 25-30 мг/мл, затем сыворотку подвергают радиационной стерилизации путем облучения гамма-лучами в дозе 20-25 кГр с помощью гамма-установки и 3-кратно (через 24, 48 и 112 часов после ожоговой травмы) вводят полученную гипериммунную противоожоговую антитоксическую сыворотку молодым животным в дозе 100-125 мг/кг и взрослым - 150-190 мг/кг живой массы тела.
Такая технология получения сыворотки приводит к увеличению выхода целевого продукта, позволяет получить как гетерологичные, так и гомологичные, а также универсальные сыворотки (например сыворотки лошади), которые используют как в ветеринарной так и в медицинской практике, позволяет повысить эффективность лечения, уменьшить лечебную дозу в 2 раза.
Важным преимуществом используемой технологии является возможность многократно и длительно использовать крупных млекопитающих (например лошадей), которые используются в качестве продуцентов в вакцинном и сывороточном производстве как ветеринарных, так и медицинских лечебных препаратов.
Использование стационарных гамма-установок с надежной защитой обеспечивают также радиационную безопасность технологического персонала по получению сыворотки.
Технологический процесс получения противоожоговой сыворотки осуществляется следующим образом.
На первом этапе проводят работу по изоляции и очистке тканевых аутоантигенов (ожоговых антигенов) из органов и тканей обожженных животных.
Моделирование термического ожога проводят путем приложения раскаленного металлического предмета (пластинки размером 5×2 см) на выстриженный участок кожи, например на спинной части туловища или боковой поверхности тела животного (белых крыс, кроликов), создавая ожог III степени (приложение раскаленной пластинки в течение 3 сек с охватом 10% поверхности тела). Через 8-9 дней после нанесения ожога (в период максимального развития ожоговой токсемии), животных убивают и извлекают печень, почки, лимфатические узлы, струпы коагулированной ткани кожи, затем их отмывают от крови физиологическим раствором, измельчают ножницами, смешивают с тем же раствором в соотношении 1:4 и гомогенизируют в скоростном микроизмельчителе, для полноты экстракции рН гомогената доводят до 8,6-8,9 путем добавления раствора NaOH. Гомогенат тканей центрифугируют 15 мин при 10000 об/мин; супернатант после удаления центри-фугата дробно фракционируют насыщенным раствором сульфата аммония в диапазоне 25-30%-ного (белково-полисахаридного) и 30-33%-ного насыщения (белковая фракция антигена).
Полученные фракции диализуют против дистиллированной воды. Полученные порции объединяют и определяют белок по Лоури.
Токсичность определяют на белых мышах при внутрибрюшинном введении антигена, ЛД50 расчитывают по И.А. Ашмарину. Антигенную активность полученных фракций оценивают в РПК (реакции потребления комплемента) по А.А. Иванову (см. ст. «Модификация реакции комплемента для количественного определения аутоантигенов. Лабор. дело, 1968, №10, с. 611).
Путем титрования в РПК устанавливают, что максимум специфического антигена находится во фракции, в которой количество белка составляет 90,5%, а титр антигена в РПК составляет 1:64.
Полученный вышеописанным способом очищенный антиген стандартизируют путем разведения фракции в стерильном физиологическом растворе в концентрации 5 мг/мл, разливают по 1 см3 в ампулы и лиофилизируют. Высушенный антиген хранят в холодильнике при температуре (4±2)°С.
На следующем (2-м) этапе проводят гипериммунизацию кроликов тканевыми антигенами из органов обожженных животных.
Для получения гипериммунной противоожоговой антисыворотки в качестве доноров используют кроликов или баранов. В качестве антигена используют изолированные из печени, селезенки, лимфатических узлов, струпов кожи обожженных животных и очищенные фракции гомогенатов.
В качестве адъюванта используют стерильные: безводный ланолин, вазелиновое масло и антиген в соотношении 1:1:1 (неполный адъювант Фрейнда). Смесь антигена с неполным адъювантом Фрейнда готовят перед иммунизацией с подогревом до 37°С.
Приготовленную смесь (тканевой препарат с неполным адъювантом Фрейнда) вводят кроликам в область внутренней поверхности бедра 7-9-кратно с интервалом между введениями 2-3 дня. Первое, третье, седьмое и девятое введение антигена проводят внутрибрюшинно; второе, четвертое, пятое и шестое - подкожно. Животным в течение 24 дней делают 8-9 инъекций, причем 2 из них (2-ая и 6-ая) - в сочетании с неполным адъювантом Фрейнда. На весь цикл иммунизации используется 150-200 мг белка.
В третьей стадии получают сыворотки крови от гипериммунизированных животных.
Для получения сывороток у животных забор крови проводят на 7 сутки (на 31-е сутки после начала иммунизации) после последней инъекции антигена. Кровь от каждого животного собирают в отдельный стеклянный цилиндр ГОСТ 18770-74 и выдерживают 30 мин при температуре 37°С, затем сгусток крови отделяют от стенок сосуда и помещают на 18 часов в холодильник при температуре 4°С.
Через 18 часов отделяют сыворотку общепринятым методом (см. кн. «Руководство по вакцинному и сывороточному делу». Под ред. П.П. Бургасова. - М.: Медицина, 1978. - 439 с.), определяют в ней титр РПК (см. «Лабор. дело, 1968, №10, с.611), и содержание белка биуретовым методом (см. кн. «Экспериментальная иммунохимия». Под ред. Н.В. Холчева. - М.: Медицина, 1968. - С. 665), доводят его содержание стерильным физиологическим раствором до концентрации 25-30 мг/мл, затем подвергают стерилизующей фильтрации, разливают во флаконы и хранят в холодильнике при температуре 4-6°С.
Способ терапии ожоговой токсемии организма иллюстрируется следующими примерами.
Пример 1. Определение оптимального источника ожогового антигена для иммунизации животных
В качестве доноров антигенного материала использовали белых крыс средней живой массой 180-200 г., которых подвергли ожоговой травме I, II и III степени тяжести путем приложения раскаленной металлической пластинки на 1, 2 и 3 сек на выбритый участок кожи, создавая 10%-ное поражение поверхности тела. Через 2, 3, 4, 5, 6, 7, 8, 9, 10 дней после нанесения термической травмы, животных убивали, извлекали: печень, почки, селезенку, лимфатические узлы, струпья коагулированной ткани и готовили антигены по вышеописанной технологии.
Полученные антигены вводили подкожно интактным белым крысам однократно по 20 мг/животное и в динамике (через 7, 10 и 14 дней) брали пробы крови для определения титра антител. Серологическую активность испытуемых антигенных материалов оценивали по титру антител в РПК тест-системе. Установлено, что антисыворотки, полученные на 14 день после введения печеночного антигена от обожженных животных на 8-9 день после нанесения ожоговой травмы, обладали более высокой серологической активностью (титр антител в РПК до 1:64) по сравнению с таковой от животных, получавших антигены из почек, селезенки, лимфатических узлов и струпа коагулированной ткани, титры которых колебались в пределах от 1:8 до 1:32.
Поэтому в дальнейшем для иммунизации доноров с целью получения гипериммунных противоожоговых лечебных сывороток использовали антиген, полученный из печени обожженных животных на 8-9 день после нанесения термической травмы.
Пример 2. Определение оптимальной схемы гипериммунизации животных ожоговым антигеном
Для этой цели ожоговый антиген вводили по различным схемам, предполагающим: I-я - 3-5 - кратное введение антигена с интервалом между введениями 1-2 дня; II-я - 6-8 кратное введение препарата с интервалом 3-4 дня; III-я - 7-9 - кратное введение препарата с интервалом 2-3 дня; IV-я - 8-10 - кратное введение с интервалом 4-5 дней, меняя при этом как дозу вводимого антигена (16,6; 17,7; 18,7; 19,1; 19,7; 20,1; 20,7; 21,7; 22,1; 22,2; 22,7; 23,1 мг белка), место введения (только подкожное, только внутрибрюшинное, сочетанное: подкожно-брюшинное), так и сроки взятия крови - на 1, 2, 3, 4, 5, 6, 7, 8 и 9 сутки после последней инъекции антигена.
Результаты серологического анализа сывороток крови на содержание противоожоговых антител в РПК-тест-системе показали, что наиболее высокую активность (титр 1:126) имели сыворотки, полученные при иммунизации по III-й схеме, предполагающей 7-9 кратное с интервалом между введениями 2-3 дня введения антигена в дозе 18,7-22,2 мг белка (150-200 мг на весь цикл), взятие крови на 7 сутки после последней инъекции антигена.
Как показали опыты, ни повышение или снижение кратности, дозы, интервала, места введения антигена и срока взятия крови после последней инъекции антигена не обеспечивали достаточно высокой иммунологической активности гипериммунных сывороток - титры антител в РПК при этом колебались в пределах 1:8-1:32.
Пример 3. Определение безвредности гомологичных и гетерологичных сывороток
Для оценки биологической активности сывороток в зависимости от их гомологичности и гетерологичности, опыты проводили на двух видах животных: кроликах (гомологичные животные, от которых получена противоожоговая сыворотка) и на овцах (гетерологичные животные). Для этого кроликам и овцам после термической ожоговой травмы III-й степени подкожно вводили противоожоговую сыворотку в дозах 50, 100, 125, 150, 200, 250, 300 мг/кг одно -, двух - и трехкратно с интервалом 24, 48, 72 часа; 48, 72, 96 часов; 24, 48 и 126 часов.
Безвредность полученной сыворотки определяли по появлению или отсутствию анафилактической реакции (одышка, беспокойство, повышение температуры тела, шок), а оптимальную лечебную дозу - по степени модификации ожоговой болезни. Установлено, что хотя испытуемый препарат в дозах от 100 до 300 мг/кг оказывал благоприятное воздействие на течение ожоговой болезни, при 3-кратном введении с интервалом 24, 48 и 126 часов после нанесения ожога, однако овцы, которым вводили гетерологичную (кроличью) сыворотку, переносили такую операцию тяжело (появление одышки, беспокойства, повышение температуры тела). Полученные данные свидетельствуют о необходимости снижения анафилактогенности гетерологичных сывороток.
Пример 4
Для нейтрализации видовой специфичности сывороток полученных от кроликов, сыворотки подвергали радиационной обработке в стерилизующих дозах (5, 10, 15, 20 и 25 кГр). Степень нейтрализации видовой специфичности сывороток после облучения проверяли на гетерологичных животных (овцы, свиньи, крупный рогатый скот, лошади) путем одно -, двух -, и трехкратного подкожного введения кроличьих сывороток в терапевтических дозах (150-200 мг/кг по белку). Степень безвредности и нейтрализации гетерологичности облученных сывороток оценивали по наличию или отсутствию побочных реакций на введение препарата. Установлено, что все животные, которым вводили облученную сыворотку, оставались здоровыми в течение 10 сут без проявления побочных реакций, что свидетельствует об отсутствии анафилактогенности гетерологичных сывороток.
Пример 5. Проверка стерильности облученных сывороток
Для оценки радиостерилизующей эффективности γ-лучей, облученные в дозах 5, 10, 15, 20 и 25 кГр сыворотки высевали на жидкие (МПБ) и твердые (МПА) питательные среды по 1 мл пробы из каждой серии сывороток. Посевы термостатировали в течение 7 суток, ведя наблюдение за ними и регистрируя появление колоний на МПА и рост культур микроорганизмов на МПБ по помутнению среды.
Установлено, что в посевах с пробами из облученных в дозах 15, 20 и 25 кГр, роста не отмечено, что свидетельствует о стерильности облученных сывороток. Следовательно, облучение гипериммунных сывороток γ-лучами в дозах 20-25 кГр ведет не только к нейтрализации антивидовых антител, анти-комплементарности, но и, одновременно, оказывает стерилизующий эффект, что позволяет избежать сложную длительную стерилизующую фильтрацию сывороток через асбестовые или миллипоровые пластины-фильтры, на которых сорбируются иммуноглобулины (антитела, белки), что ведет к потере активности сывороток.
Пример 6
Для изучения влияния облучения на антитоксическую активность противоожоговой гипериммунной сыворотки, опыты проводили на 10 больных ожоговой болезнью III-й степени тяжести белых крысах. У животных в период ожоговой токсемии (8-9 сут после нанесения термического ожога) брали пробы крови из хвостовой вены, получали сыворотку и в ней определяли содержание ожогового токсина (антигена) в реакции бентонитовой флокуляции (РБФ). Для сопоставительного анализа активности сывороток в иммунохимической тест-системе использовали 2 варианта антительного бентонитового диагностикума (АТБД): сенсибилизированные необлученной противоожоговой сывороткой микрочастицы бентонита (НАТБД) и сенсибилизированные облученной в стерилизующих дозах (20-25 кГр) противоожоговой сывороткой микрочастицы бентонита (ОАТБД). Постановку РБФ и учет ее результатов проводили по разработанной P.P. Гайнуллиным технологии (см. автореферат «Разработка бентонитового диагностикума для индикации радиоиндуцированных токсических соединений. Казань, 2009, 23 с.).
Результаты параллельных иммунохимических исследований проб сывороток крови больных ожоговой болезнью белых крыс показали, что нейтрализация ожогового токсина (антигена) в исследуемых сыворотках происходит при использовании нативной (необлученной) противоожоговой сыворотки при разведениях сыворотки 1:32-1:64, а при использовании препарата на основе облученной (радиостерилизованной) противоожоговой сыворотки - 1:16-1:32, т.е. облученная противоожоговая сыворотка оказалась более активной по сравнению с необлученной, поскольку для нейтрализации ожоговой токсемии потребовалось в 2 раза меньше антитоксической (противоожоговой) гипериммунной сыворотки.
Пример 7
Для оценки дезинтоксикационной эффективности противоожоговой гипериммунной сыворотки, опыты проводили на 12 половозрелых овцах породы «Прекос» со средней живой массой 37 кг, которых подвергали термической ожоговой травме путем приложения раскаленной металлической пластинки на выстриженный участок кожи боковой поверхности тела, моделируя III-ю степень ожоговой болезни с поражением 10% поверхности тела. Животным 1-й группы (3 овцы) 3-кратно с интервалом 24, 48 и 112 часов подкожно вводили нативную (необлученную) противоожоговую гипериммунную сыворотку в дозе 200-250 мг/кг живой массы; овцам 2-й группы в аналогичных условиях вводили облученную в дозе 20 кГр противоожоговую сыворотку в дозе 200-250 мг/кг; животным 3-й группы в аналогичных условиях вводили облученную сыворотку в дозе 150-190 мг/кг; овцам 4-й группы вводили плазму крови по 20 мл по 2 раза в день в течение недели после нанесения ожоговой травмы (известный способ).
На 9-е сутки после нанесения термического ожога (период максимальной ожоговой токсемии) у всех животных брали пробы крови и в сыворотках определяли содержание ожогового антигена (термотоксина) в РБФ-тест-системе и по клинике леченных испытуемыми сыворотками больных ожоговой болезнью овец.
Результаты иммунологических исследований в РБФ-тест-системе по модификации ожогового антигена (термотоксина) в сыворотке крови овец представлены в таблице.
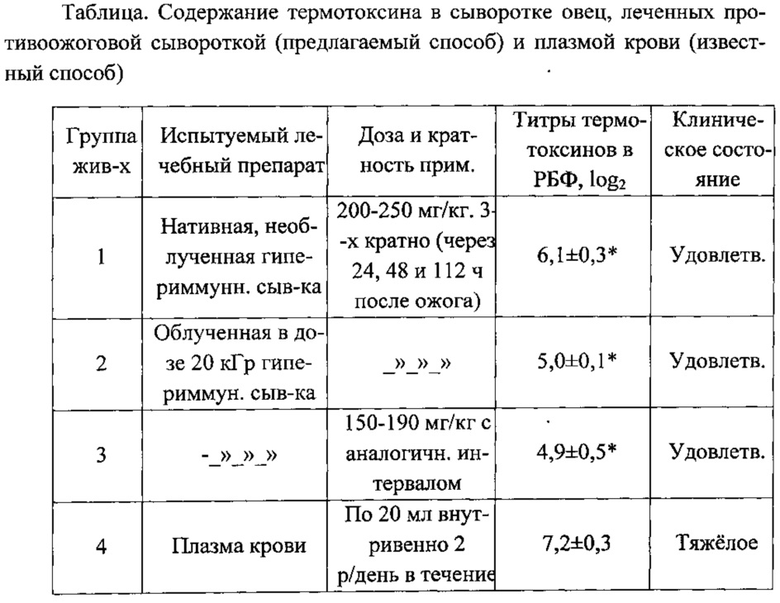

Из данных таблицы видно, что использование гипериммунных противоожоговых сывороток оказывало детоксицирующее действие на организм обожженных животных, снижая содержание термотоксина в крови на 1,36 раза (1-я группа), 1,66 (2-я группа), 1,69 (3-я группа) и в 1,15 раза (4-ая группа), по сравнению с таковым обожженных и нелеченных животных. При этом установлено, что применение противоожоговой гипериммунной сыворотки обеспечивает более выраженный детоксицирующий эффект, снижая концентрацию термотоксина в крови в 1,36 раза (Р<0,005) против 1,15 раза в 4-й группе (известный способ дезинтоксикации).
Использование гипериммунной противоожоговой сыворотки оказывает на обожженный организм специфический лечебный эффект, основанный на нейтрализации ожоговых и тканевых токсинов, термоиндуцированных и термомодифицированных антигенов, аутоантигенов и других агрессивных метаболитов (детоксицирующий эффект), облучение противоожоговой сыворотки γ-лучами в дозах 20-25 кГр оказывает стерилизующий эффект, обеспечивая исключение из технологического цикла получения сывороточного препарата сложной, длительной и не всегда надежной в микробиологическом отношении операции - фильтрации через дорогие и труднодоступные миллипоровые фильтры. Наиболее важными изменениями в свойствах облученной сыворотки являются: увеличение антитоксической активности (что позволяет уменьшить ее лечебную дозу в 2 раза), увеличение антикомплементарности (снижение активности комплемента, индуцированной ожоговой травмой) и, самое главное - снижение анафилоктогенности, создающей серьезную проблему при использовании с лечебной целью гетерологичных сывороток, т.е. нейтрализация гетерологичных антигенов и антител, являющихся индукторами анафилоктогенного эффекта при применении гетерологичных лечебных сывороток.
Таким образом, из приведенных примеров видно, что использование изобретения позволяет повысить дезинтоксикационный эффект, предупреждая развитие ожоговой токсемии, не прибегая к систематическому, многократному переливанию крови, плазмы, кровезаменителей, альбумина, протеина, которые не устраняют главной причины ожоговой токсемии - циркулирующих в крови термотоксинов и ожоговых антигенов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОСТРОЙ ОЖОГОВОЙ ТОКСЕМИИ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООЖОГОВОЙ СЫВОРОТКИ РЕКОНВАЛЕСЦЕНТОВ ДЛЯ ЛЕЧЕНИЯ ОЖОГОВОЙ ТОКСЕМИИ ОРГАНИЗМА | 2016 |
|
RU2647369C2 |
| СПОСОБ ДИАГНОСТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2145712C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ МЕТАБОЛИЗМА БИФИДОБАКТЕРИЙ ДЛЯ ЛЕЧЕНИЯ КОМБИНИРОВАННОГО РАДИАЦИОННО-ТЕРМИЧЕСКОГО ПОРАЖЕНИЯ ОРГАНИЗМА И СПОСОБ ЛЕЧЕНИЯ КОМБИНИРОВАННОГО РАДИАЦИОННО-ТЕРМИЧЕСКОГО ПОРАЖЕНИЯ ОРГАНИЗМА | 2016 |
|
RU2627669C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОРАДИАЦИОННОГО АНТИТЕЛЬНОГО ЭРИТРОЦИТАРНОГО ПРЕПАРАТА ДЛЯ ДИАГНОСТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА | 2003 |
|
RU2240137C1 |
| Способ диагностики радиационных поражений организма и способ получения противолучевого антительного бентонитового препарата для диагностики радиационных поражений организма | 2019 |
|
RU2731521C1 |
| СПОСОБ ЛЕЧЕНИЯ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА | 1997 |
|
RU2169572C2 |
| СПОСОБ ЛЕЧЕНИЯ РАДИАЦИОННОГО, ХИМИЧЕСКОГО И/ИЛИ БИОЛОГИЧЕСКОГО ПОРАЖЕНИЯ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ГЛОБУЛИНОВ ДЛЯ ЛЕЧЕНИЯ РАДИАЦИОННОГО, ХИМИЧЕСКОГО И/ИЛИ БИОЛОГИЧЕСКОГО ПОРАЖЕНИЯ ОРГАНИЗМА | 2011 |
|
RU2524612C2 |
| Способ индикации радиотоксинов в облученных пищевых продуктах и кормах | 2019 |
|
RU2715900C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЫВОРОТКИ ДЛЯ ЛЕЧЕНИЯ ПАСТЕРЕЛЛЕЗА ЖИВОТНЫХ (ВАРИАНТЫ) | 2006 |
|
RU2304442C1 |
| Способ получения препарата для лечения радиационных поражений организма животных | 2024 |
|
RU2837739C1 |
Группа изобретений относится к медицине и касается способа лечения острой ожоговой токсемии организма, предусматривающего введение в организм биологически активного препарата, где в качестве специфического препарата используют гипериммунную противоожоговую антитоксическую сыворотку млекопитающих, которую вводят трехкратно - через 24, 48 и 112 часов после ожоговой травмы, подкожно в дозе 100-125 мг/кг массы молодым и 150-190 мг/кг - взрослым животным. Группа изобретений также касается способа получения препарата для лечения острой ожоговой токсемии организма, характеризующегося тем, что предварительно получают ожоговый антиген, далее полученный ожоговый антиген с неполным адъювантом Фрейда в соотношении 1:1 используют для гипериммунизации кроликов, овец, свиней, коров или лошадей, через 18 часов отделяют сыворотку, определяют титр антител и содержание белка, доводят его до концентрации 25-30 мг/мл, затем сыворотку подвергают радиационной стерилизации путем облучения гамма-лучами. Группа изобретений обеспечивает повышение дезинтоксикационного эффекта, предупреждая развитие ожоговой токсемии, не прибегая к систематическому, многократному переливанию крови, плазмы, кровезаменителей, альбумина, протеина. 2 н.п. ф-лы, 7 пр., 1 табл.
1. Способ лечения острой ожоговой токсемии организма, предусматривающий введение в организм биологически активного препарата, отличающейся тем, что в качестве специфического препарата используют гипериммунную противоожоговую антитоксическую сыворотку млекопитающих, полученную согласно способу по п. 2, которую вводят трехкратно - через 24, 48 и 112 часов после ожоговой травмы, подкожно в дозе 100-125 мг/кг массы молодым и 150-190 мг/кг - взрослым животным.
2. Способ получения препарата для лечения острой ожоговой токсемии организма, характеризующийся тем, что предварительно получают ожоговый антиген путем водного экстрагирования гомогенатов печени, взятых у убитых в период токсемии на 8-9 сутки ожоговой болезни животных, гомогенат тканей центрифугируют 15 минут при 10000 об/мин, супернатант после удаления центрифугата дробно фракционируют насыщенным раствором сульфата аммония в диапазоне 25-30%-ного (белкового-полисахаридного) и 30-33%-ного (белковая фракция антигена); полученные фракции диализуют против дистиллированной воды, затем фракции объединяют, определяют белок и стандартизируют его до концентрации 5 мг/мл, далее полученный ожоговый антиген с неполным адъювантом Фрейда в соотношении 1:1 используют для гипериммунизации кроликов, овец, свиней, коров или лошадей, проводят 7-9-кратное подкожное и внутривенное введение в дозе 18,7-22,2 мг по белку полученного антигена с 2-3 дневным интервалом, а на 7 сутки после последней инъекции антигена берут кровь у доноров, через 18 часов отделяют сыворотку, определяют титр антител и содержание белка, доводят его до концентрации 25-30 мг/мл, затем сыворотку подвергают радиационной стерилизации путем облучения гамма-лучами в дозе 20-25 кГр с помощью гамма-установки и 3-кратно через 24, 48 и 112 часов после ожоговой травмы вводят полученную гипериммунную противоожоговую антитоксическую сыворотку молодым животным в дозе 100-125 мг/кг и взрослым - 150-190 мг/кг живой массы тела.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WANG SB., et al., [Changes in the plasma levels of endotoxin in severe burn patients under the treatment of antibiotics].[Article in Chinese] Zhonghua Shao Shang Za Zhi | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| TAN XD., et al., [Effects of early administration of imipenem on subeshcar and plasma TNF-alpha in rabbits with severe burns].[Article in Chinese] Di Yi Jun Yi Da Xue Xue Bao | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| NURKHANOV BM., [The comparative efficacy of a new hydrogel enterosorbent in the detoxification therapy of combined radiation-thermal lesions].[Article in Russian] Patol Fiziol Eksp Ter | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
Авторы
Даты
2018-03-15—Публикация
2016-07-20—Подача