Изобретение относится к радиационной биологии, в частности к производству препаратов, предназначенных для диагностики радиационных поражений организма.
Известен способ получения антительного эритроцитарного препарата (АТЭД) для диагностики радиационных поражений организма, включающий извлечение из облученных тканей млекопитающих лучевого антигенного материала, гипериммунизацию им кроликов, приготовление адсорбентов и очистку ими гипериммунных сывороток, сенсибилизацию последними формалинизированных и танизированных эритроцитов барана (см. патент РФ №2145712, G 01 N 33/49 за 2000 г.).
Недостатком этого способа является неспецифичность гипериммунных сывороток, обусловленная наличием в их составе антитканевых (неспецифических) антител, что диктует необходимость проведения сложного 3-ступенчатого цикла очистки сывороток с использованием специальных иммуносорбентов (препаратов, полученных от интактных, иммунизированных бактериальными вакцинами и подвергнутых термическому воздействию животных), то есть как изготовление антигенного материала для получения гипериммунных сывороток (технологического сырья - источника антител для сенсибилизации эритроцитов), так и приготовление иммуносорбентов для очистки антител предполагает использование (убой, извлечение органов, экстрагирование антигена) дорогостоящих лабораторных и сельскохозяйственных животных, что ведет к удорожанию получаемого препарата. Адсорбция получаемых по известному способу сывороток, во-первых, ведет к, значительному снижению исходного титра (активности) гипериммунных сывороток и, во-вторых, несмотря на 3-ступенчатую адсорбцию известных сывороток тремя адсорбентами не обеспечивает полноту адсорбции, поскольку указанные сыворотки являются поликлональными, т.е. в них содержится значительное количество других общетканевых антицитотоксических антител, обусловливающих неспецифические реакции при проведении РНГА-теста с испытуемыми сыворотками.
Задачей предлагаемого изобретения является повышение активности и специфичности диагностического препарата при сохранении его диагностической ценности, а также упрощение технологии его получения
Поставленная задача решается тем, что способ получения противолучевого антительного эритроцитарного препарата (АТЭД) для диагностики радиационных поражений организма, включающий извлечение из облученных объектов антигенного материала, гипериммунизацию ими кроликов и получение диагностических сывороток, сенсибилизацию последними формалинизированных и танизированных эритроцитов барана, в качестве иммунизирующего антигена используют извлеченный из облученного картофеля естественный радиомиметик - радиотоксин, а в качестве антител для сенсибилизации эритроцитов используют антирадиотоксическую гипериммунную сыворотку кроликов, полученную путем 4-кратного с интервалом в 14 дней внутримышечного в дозе по 1,0-2,0 см3 введения извлеченного из облученных в дозе 350-400 Гр клубней картофеля радиотоксина и конъюгированного с неполным адъювантом Фрейнда (НАФ) в соотношении 1:1, а сенсибилизацию эритроцитов осуществляют путем смешивания равных объемов разведении физиологическим раствором с рН 7,2 (1:10) антирадиотоксических сывороток и 3%-ной взвеси эритроцитов с последующим термостатированием смеси в течение 10-15 мин; осадок после декантирования супернатанта заливают фосфатно-буферным раствором (ФБР) с рН 7,2 с содержанием 0,5% "нормальной" лошадиной сыворотки, повторяют эту операцию трижды и получают продукт (антирадиотоксический антительный эритроцитарный диагностикум - АТЭД) консервируют 0,3%-ным фенолом и хранят в холодильнике при 2-6°С.
Существенным отличием способа получения препарата для диагностики радиационных поражений организма является то, что для сенсибилизации эритроцитов используют гипериммунную антирадиотоксическую сыворотку, получаемую путем гипериммунизации животных специфическим лучевым антигеном - конъюгированным с иммуномодулятором - НАФ радиомиметиком - растительным радиотоксином, ответственным за развитие в организме радиобиологического эффекта - лучевой болезни, т.е. последний является специфическим этиопатогенетическим агентом при радиационном поражении организма. Можно предположить, что иммунизация животных-продуцентов специфическим антигеном-радиотоксином будет индуцировать синтез антирадиотоксических антител, комплементарно связываться в РНГА с исходным антигеном радиотоксином как в модельных опытах с чистым (исходным) антигеном-радиотоксином, так и в опытах с сыворотками облученных животных, содержащими радиоиндуцированный лучевой антиген-радиотоксин.
Использование в качестве сенситина антирадиотоксических антител для сенсибилизации эритроцитов и радиотоксина в качестве специфического антигена для гипериммунизации животных-продуцентов позволяет повышать специфичность диагностикума, поскольку он свободен от неспецифических общетканевых антигенов, содержащихся в известном препарате.
Использование полученного диагностикума (АТЭД) в иммунохимической тест-системе (РНГА) позволяет за 1,5-2 часа обнаруживать в сыворотке крови облученного организма лучевые антигены-радиотоксины (РТ), которые появляются в первые часы и сутки после облучения и регистрируются до 10-14 суток после облучения, вызывая радиоинтоксикацию и радиосенсибилизацию облученного организма, ведущих его к гибели. Следовательно, своевременное (раннее) обнаружение радиотоксина в облученном организме в иммунохимической экспресс тест-системе (РНГА) с использованием АТЭД на основе антирадиотоксических антител (АРТА) является залогом успешного лечения лучевой болезни, а также проведения мониторинга (контроля) эффективности терапии при радиационном поражении организма.
Исключение из технологического цикла использования лабораторных и сельскохозяйственных животных в качестве доноров тканевых (иммунизирующих) и гетерологичных (адсорбирующих) антигенов, приготовление тканевых антигенов и сложного (3-этапного) и длительного процесса адсорбирования гипериммунных сывороток значительно упрощает и удешевляет технологию, обеспечивая высокую специфичность полученного диагностического препарата и улучшает условия реализации способа.
Способ получения диагностического препарата осуществляется следующим образом.
Начальным этапом изготовления диагностического препарата (антирадиотоксического антительного эритроцитарного диагностикума - АТЭД) является получение моноспецифической гипериммунной диагностической сыворотки, которая служит источником специфических антирадиотоксических антител (сенситином) для сенсибилизации формалинизированных и танизированных эритроцитов барана, служащих биологическим иммуносорбентом (носителем) специфических антирадиотоксических антител.
Антирадиотоксическую сыворотку получают путем гипериммунизации кроликов конъюгированным антигеном, содержащим специфический радиомиметик-радиотоксин, в качестве которого используют этаноловый экстракт облученной растительной ткани. Для получения радиотоксина используют клубни картофеля, которые облучают гамма-лучами в дозе 350-400 Гр при мощности экспозиционной дозы 2500 Гр/ч. Облученные клубни выдерживают при температуре 18-22°С в течение 24 часов. Дальнейшую обработку облученного объекта с целью изолирования антигенного материала - радиотоксина проводят по методике С.К.Мельниковой и В.А.Копылова (см. кн. Радиотоксины, их природа и роль. Под ред. А.М.Кузина. - М.: Атомиздат, 1966. - С.86-91). С клубней картофеля снимают верхний слой толщиной 3-4 мм и оставшуюся ткань гомогенизируют в трехкратном объеме 96%-ного этанола. Экстрагирование проводят в течение 1 ч при постоянном перемешивании, строму отделяют и спирт удаляют под вакуумом при температуре 28-33°С.
В полученном этаноловом экстракте определяют белок по Лоури, хиноны - по А.М.Кузину и В.А.Копылову (Радиотоксины. - М.: Наука, 1983, - с.27-28), содержание сухого вещества - общепринятым методом высушивания, биологическую активность - в тесте 50%-ного гемолиза эритроцитов по методу кислотных эритрограмм (И.А.Терсков, И.Н.Гительзон. - Биофизика, 1957, №2, с.259.), антигенную активность - в реакции диффузионной преципитации - РДП по Э.Н.Шляхову (Антигены макроорганизмов и ответные реакции. - Кишинев, 1962, - с.123-126).
Полученный концентрированный экстракт, содержащий хиноидные радиотоксины, стандартизируют путем разведения стерильной дистиллированной водой рН 7,2 до концентрации 1,0 мг/мл. Полученный препарат, состоящий в основном из хинонов, является неполноценным в антигенном отношении, поскольку из-за незначительного (1-1,8%) количества белка, имеет низкую молекулярную массу (5-6 кДа), что характеризует его как гаптен и, ввиду этого, не может вызывать иммунный ответ в иммунизируемом организме. Поэтому для перевода гаптена в полноценный белковый антиген, полученный этаноловый экстракт (0,1%-ный раствор растительного радиотоксина) смешивают в соотношении 1:1 с неполным адъювантом Фрейнда (НАФ). Конъюгирование антигена и иммуномодулятора проводят на шейкере при интенсивности 110-120 качаний в минуту в течение 15-17 мин. Конъюгированный антиген, содержащий специфическую лучевую субстанцию - радиотоксин, используют в качестве иммунизирующего агента для гипериммунизации лабораторных (кроликов) или сельскохозяйственных (овец) животных.
Гипериммунизацию кроликов живой массой 2,0-2,5 кг проводят по следующей схеме. Приготовленный по вышеописанной методике конъюгированный антиген в виде эмульсии подогревают в водяной бане до 37°С перед применением и вводят кроликам 4-кратно, внутримышечно в область внутренней поверхности бедра с интервалом в 14 дней между введениями по 1,0-2,0 см3 на каждое введение. На восьмой день после последней инъекции антигена (АГ) у кроликов берут пробу крови из ушной вены для определения уровня антирадиотоксических антител, который изучают в реакции непрямой гемагглютинации (РНГА) по К.Мальборгу (Иммунологические методы М.: Медицина, 1987, с.211-218). В качестве положительного антигена используют растительный радиотоксин (РТ), в качестве отрицательного - АГ из необлученных клубней картофеля.
Кролики, в сыворотке которых обнаруживают антитела (AT) в титрах не менее 1:100, обескровливают, из крови получают сыворотки. Инактивируют их путем прогревания при 56°С в течение 30 мин и используют в дальнейшем в качестве специфических антител (сенситина) для сенсибилизации эритроцитов барана с целью приготовления антительного противолучевого диагностикума (АТЭД).
Для приготовления АТЭД в качестве иммуносорбента используют танизированные и формалинизированные по Фили и Чизмесу (см. ж-л “Лабораторное дело”, 1968, №11, с. 604) эритроциты барана, на которых адсорбируют (нагружают) сенситин (полученную по вышеописанной схеме гипериммунную антирадиотоксическую сыворотку кролика).
Сенсибилизацию (нагружение специфическими антителами) эритроцитов барана осуществляют следующим образом: инактивированную антирадиотоксическую сыворотку разводят физиологическим раствором 1:10 и к ней добавляют буфер из расчета 5 см3 на 1 см3 разведенной сыворотки. Затем сливают равные объемы 3% взвеси формалинизированных, танизированных эритроцитов барана и разведенной антирадиотоксической сыворотки. Эритроцитарную взвесь помещают в термостат при температуре 37°С на 2,5-3 часа. Сенсибилизацию ведут при постоянном перемешивании. По истечении указанного времени эритроциты осаждают в течение 10 минут центрифугированием при 1000-1500 g.
Надосадочную жидкость и осадок заливают фосфатно-буферным раствором с рН 7,2 с содержанием 0,5% лошадиной сыворотки. Такую операцию повторяют 3 раза. Затем из осадка готовят 3%-ную взвесь эритроцитов на этом же фосфатно-буферном растворе с содержанием 0,5% "нормальной" лошадиной сыворотки
Полученный таким способом антирадиотоксический антительный эрит-роцитарный диагностикум (АТЭД) консервируют 0,3%-ным раствором фенола и хранят в холодильнике при температуре (2-6)°С и используют в качестве источника специфических антител в реакции непрямой гемагглютинации (РНГА) для обнаружения радиотоксинов (РТ) в исследуемых сыворотках млекопитающих.
Пример 1. Получение антигена - радиотоксина.
Радиотоксический антиген (РТ - антиген) получали путем облучения клубней картофеля в дозах 50-1500 Гр и выдерживали при температурах 10-40°С в течение 1-42 часов после облучения и общепринятым методом готовили радиотоксин. Установлено, что наибольший выход РТ - антигена (35 мг/мл) с максимальной биологической активностью (ускорение 50%-ного гемолиза эритроцитов в два раза по сравнению с 0,5-0,9 раза при других вариантах опытов) препарата достигается при облучении растительного объекта в дозах 350-400 Гр и выдерживании его при температуре 18-22°С в течение 23-25 часов. Уменьшение (300 Гр) или увеличение (500 Гр) дозы облучения, а также сокращение (22 часа) или увеличение (26 часов) времени экспозиции на воздухе не обеспечивают оптимального выхода РТ - антигена (концентрация радиотоксина при этих режимах не превышает 25-30 мг/см3).
Пример 2. Получение антирадиотоксической гипериммунной сыворотки.
Гипериммунную антирадиотоксическую сыворотку получали путем многократного введения радиотоксина в отдельности и в сочетании с неполным адъювантом Фрейнда (НАФ) в соотношениях 0,2:1; 0,4:1; 0,5:1; 0,8:1; 1:1; 1:0,8; 1:0,6; 1:0,4 1:0,2 радиотоксина и НАФ, используя при этом различные дозы и схемы введения антигенов. При этом использовали 1-, 2-, 3-, 4-, 5- и 6-кратное введение антигенного материала, различные дозы (0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6; 1,8; 2,0; 2,2; 2,4; 2,8; 3,0 см3), интервалы между введениями (через 3, 6, 8, 10, 12, 14, 16, 18, 20 дней), а также область инъекции антигенного материала (подкожно, внутривенно, внутримышечно, внутрикожно, внутрибрюшинно). Активность антисывороток определяли в реакции непрямой гемагглютинации (РНГА) с антигенным вариантом эритроцитарного диагностикума (АГЭД).
Результаты опытов показали, что наибольший титр антирадиотоксических антител (АРТА) (1:400-1:800) получали от кроликов, подвергнутых иммунизации конъюгированным антигеном (РТ + НАФ в соотношении 1:1) по схеме, предполагающей 4-кратное введение с интервалом в 14 дней внутримышечно антигена в дозе по 1-2 см3 на каждое введение.
Изменение состава антигена (изолированное применение РТ без иммуномодулятора), схемы иммунизации (1-, 2-, 3-, 5- и 6-кратное введение антигена), уменьшение (0,2; 0,4; 0,6 и 0,8 см3) или увеличение (2,2; 2,4; 2,6; 2,8 и 3,0 см3) дозы антигена, интервала (3, 6, 8, 10, 12, 16, 18 и 20 сут) между введениями и места введения (внутрикожное, подкожное, внутривенное и внутрибрюшинное) антигена не обеспечивали получение антисывороток с достаточной серологической активностью, ибо титр антирадиотоксических сывороток при указанных изменениях препаратов в РНГА не превышал 1:40-1:120.
Пример 3. Определение оптимальных условий сенсибилизации эритроцитов барана.
Для определения оптимальных параметров сенсибилизации эритроцитов использовали различные соотношения компонентов (сенситина и эритроцитов), температуры инкубирования и экспозиции адсорбирования. При этом использовали различные разведения сенситина (антирадиотоксической сыворотки в физрастворе 1:2; 1:4; 1:8 и 1:10), различные соотношения сенситина и взвеси эритроцитов (1:2; 1:4; 1:8 и 1:10), температуры (20, 25, 30, 35 и 40°С) и экспозиции адсорбирования (1; 2; 2,5; 3; 3,5 и 4 часа). Установили, что оптимальными условиями сенсибилизации эритроцитов является разведение сыворотки 1:10, соотношение сыворотки и 3%-ной взвеси эритроцитов 1:1, температура термостатирования 37°С и экспозиция сенсибилизации - 2,5-3 часа. Изменение указанных параметров как в сторону увеличения, так и в сторону уменьшения не обеспечивали достаточной степени сенсибилизации, ибо увеличение их ведет к самоагглютинации эритроцитов, а уменьшение - к отсутствию гемагглютинации при контакте со специфическим антигеном-радиотоксином.
Пример 4. Проверка активности и специфичности антительного антира-диотоксического эритроцитарного диагностикума в реакции непрямой гемагглютинации (РНГА).
Для проверки активности и специфичности полученного диагностикума использовали тканевые антигены-экстракты из органов (печени, почек, сердца, селезенки, лимфатических узлов) интактных, облученных, больных лейкозом, а также подвергнутых термическому воздействию животных. В качестве гомологичного антигена в опытах использовали растительный радиотоксин (РТ), в качестве источников определяющих (детектирующих) антител - полученные по известной (АТЭД на основе антитканевой противолучевой сыворотки) и предлагаемой (АТЭД на основе антирадиотоксической сыворотки) технологиям диагностикумы.
Реакцию ставили на полистироловых микропанелях в объеме 0,2 см3. На полистироловых микропанелях готовили серийные двукратные разведения антигенов в физиологическом растворе с рН 7,2. В каждую лунку с соответствующими разведениями антигенов добавляли по 1 капле (0,03 см3) эритроцитарного диагностикумов (АТЭД), изготовленных по известной и предлагаемой технологии; смесь тщательно встряхивали и оставляли при комнатной температуре. Реакцию сопровождали постановкой контроля на отсутствие спонтанной самоагглютинации эритроцитарных диагностикумов.
Результаты реакции учитывали визуально через 20 мин. Реакцию считали положительной, когда эритроциты располагались на дне лунки в виде “зонтика” с выраженным фистончатым краем и полным просветлением надосадочной жидкости. При отрицательной реакции эритроциты равномерно выстилали все дно лунки в виде пятна коричневого цвета.
Установлено, что при использовании предлагаемого диагностикума (АТЭД) на основе растительного радиотоксина неспецифические реакции с гетерологичными антигенами не были выявлены, в то время как при параллельном проведении аналогичной реакции (РНГА) с известным диагностикумом отмечается неспецифическая реакция (1:8-1:16) с антигенами из селезенки, сердца, почек и лимфатических узлов необлученных животных. Специфический титр антигена в РНГА с известным диагностикумом не превышал 1:128, в то время как максимальный титр гомологичного антигена в аналогичной реакции с предлагаемым диагностикумом равнялся 1:1024, т.е. чувствительность реакции с предлагаемым диагностикумом оказалась эффективнее на 7 разведений антигена (1:1024 и 1:128).
Пример 5. Проверку эффективности предлагаемого препарата для диагностики радиационных поражений организма проводили на кроликах. С этой целью в опытах использовали 35 кроликах со средней живой массой 2,0-2,5 кг, используя по 7 животных на каждый вариант опыта. При этом кроликов 1-й группы облучали гамма-лучами в летальной дозе (11-12 Гр), 2-й группы - в сублетальной (7-8 Гр) дозе, 3-й группы - подвергали термическому воздействию (ожогу), 4-й группы - заражению вирусом лейкоза, а животных 5-й группы не подвергали никакому воздействию (биологический контроль).
У всех кроликов в динамике (ежедневно в течение 15 дней после физического и биологического воздействия) брали пробы крови для серологического анализа сывороток в РНГА на предмет обнаружения специфического радиоиндуцированного антигена - радиотоксина. В качестве определяющих антител в РНГА использовали предлагаемый и известный антительные эритроцитарные диагностикумы. Установили, что как у облученных в летальной, так и в сублетальной дозах животных после облучения в сыворотке крови регистрировали радиотоксин в титрах 1:64-1:128 (с использованием предлагаемого диагностикума) и 1:16-1:32 (с использованием известного диагностикума), т.е. чувствительность предлагаемого диагностикума была в 4 раза выше по сравнению с известным. Кроме высокой чувствительности, предлагаемый диагностикум был более специфичен - в параллельных реакциях с сыворотками от зараженных вирусом лейкоза животных от интактных и обожженных животных результаты РНГА были отрицательными, в то время как в аналогичной реакции с известным диагностикумом 3 животных из 7 зараженных вирусом лейкоза животных реагировали положительно в титрах 1:8-1:16, что свидетельствует о высокой специфичности предлагаемого диагностикума.
Результаты испытания эффективности предлагаемого диагностикума на пораженных ионизирующим излучением лабораторных животных послужил основой для изготовления экспериментальных серий предлагаемого диагностикума, который проходит широкие производственные испытания на облученных в сублетальных и летальных дозах ионизирующих излучений крупных (сельскохозяйственных) животных.
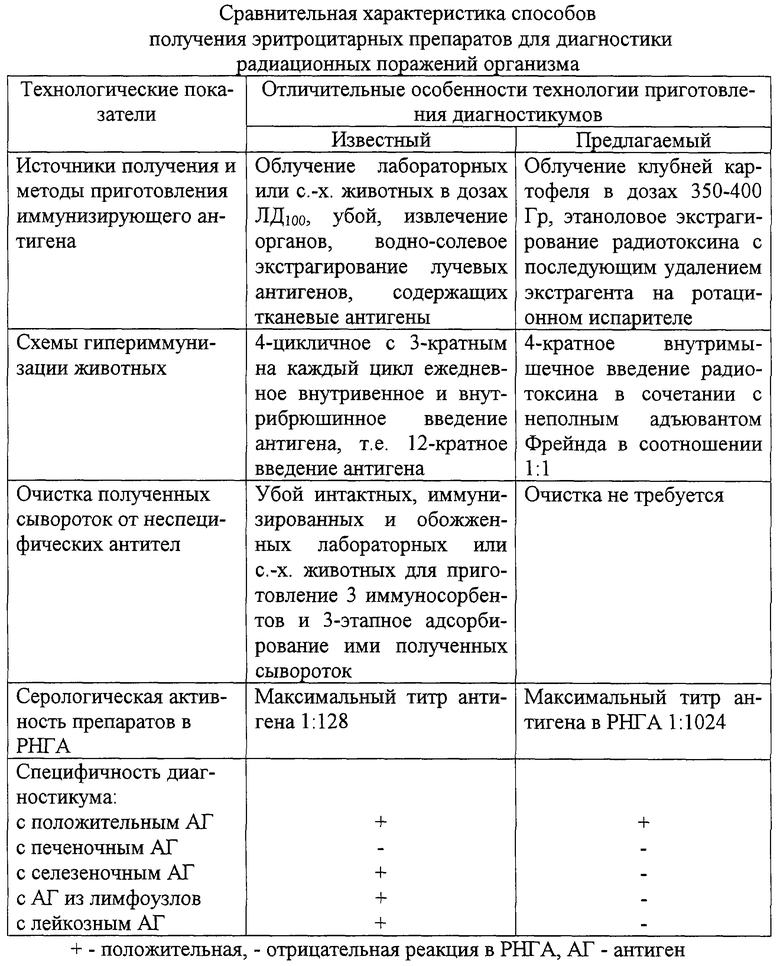
Сравнительная характеристика способов получения противолучевых диагностикумов представлена в таблице. Как видно из ее данных, предлагаемый способ позволяет упростить технологию получения диагностического препарата, повысить его активность и специфичность, сохраняя одновременно его диагностическую ценность.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ РАДИОТОКСИНОВ В ОБЛУЧЕННЫХ ПИЩЕВЫХ ПРОДУКТАХ | 2006 |
|
RU2324176C1 |
| СПОСОБ ДИАГНОСТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2145712C1 |
| Способ индикации радиотоксинов в облученных пищевых продуктах и кормах | 2019 |
|
RU2715900C1 |
| Способ диагностики радиационных поражений организма и способ получения противолучевого антительного бентонитового препарата для диагностики радиационных поражений организма | 2019 |
|
RU2731521C1 |
| СПОСОБ ПОЛУЧЕНИЯ R-БРУЦЕЛЛЕЗНОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) | 2008 |
|
RU2411041C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОТУЛЯРЕМИЙНОЙ ГИПЕРИММУННОЙ СЫВОРОТКИ И СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО ТУЛЯРЕМИЙНОГО ИММУНОГЛОБУЛИНОВОГО СУХОГО | 2002 |
|
RU2240822C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 2013 |
|
RU2540902C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) ПРИ КЛОСТРИДИОЗАХ ЖИВОТНЫХ | 2020 |
|
RU2754465C1 |
| НАБОР ЭРИТРОЦИТАРНЫХ ДИАГНОСТИКУМОВ ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ К ВИРУСУ ЧУМЫ ПЛОТОЯДНЫХ В РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ | 1996 |
|
RU2119671C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО АНТИТЕЛЬНОГО ОВИСНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) С ЦЕЛЬЮ ИНДИКАЦИИ ОВИСНОГО АНТИГЕНА В БИОМАТЕРИАЛЕ | 2012 |
|
RU2509306C2 |
Изобретение относится к области радиационной биологии, в частности к производству препаратов, предназначенных для диагностики радиационных поражений организма. Сущность изобретения состоит в использовании в качестве антигена для сенсибилизации эритроцитов антирадиотоксическую гипериммунную сыворотку кроликов, а в качестве иммунизирующего агента - радиотоксин из облученного картофеля. Техническим результатом является повышение активности и специфичности диагностического препарата при сохранении его диагностической ценности, упрощение технологии его получения. 1 табл.
Способ получения противолучевого антительного эритроцитарного препарата (АТЭД) для диагностики радиационных поражений организма, включающий извлечение из облученных объектов антигенного материала, гипериммунизацию им кроликов и получение диагностических сывороток, сенсибилизацию последними формалинизированных и танизированных эритроцитов барана, отличающийся тем, что в качестве иммунизирующего агента используют извлеченный из облученного картофеля естественный радиомиметик - радиотоксин, а в качестве сенситина для сенсибилизации используют антирадиотоксическую гипериммунную сыворотку кроликов, получаемую путем 4-кратного с интервалом в 14 дней внутримышечного в дозе 1,0-2,0 см3 введения извлеченного из облученных в дозе 350-400 Гр клубней картофеля радиотоксина и конъюгированного с неполным адъювантом Фрейнда (НАФ) в соотношении 1:1, а сенсибилизацию эритроцитов осуществляют путем смешивания равных объемов разведенной физиологическим раствором (1:10) антирадиотоксической сыворотки и 3%-ной взвеси эритроцитов с последующим термостатированием смеси в течение 10-15 мин; осадок после декантирования супернатанта заливают фосфатно-буферным раствором (ФБР) с рН 7,2 с содержанием 0,5% "нормальной" лошадиной сыворотки, повторяют эту операцию трижды; полученный продукт (антирадио-токсический антительный эритроцитарный диагностикум - АТЭД) консервируют 0,3%-ным фенолом и хранят в холодильнике при 2-6°С.
| СПОСОБ ДИАГНОСТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2145712C1 |
| Аутоантитела облученного организма | |||
| /Под ред | |||
| Н.Н.Клемпарской | |||
| - М | |||
| Контрольный висячий замок в разъемном футляре | 1922 |
|
SU1972A1 |
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| СКАЛЕЦКИИ Ю.Н | |||
| и др | |||
| Современные подходы к диагностике радиационных поражений в ВМФ | |||
| Проблемы клинической и военной медицины | |||
| - М., 1993, с.243 и 244. | |||
Авторы
Даты
2004-11-20—Публикация
2003-04-03—Подача