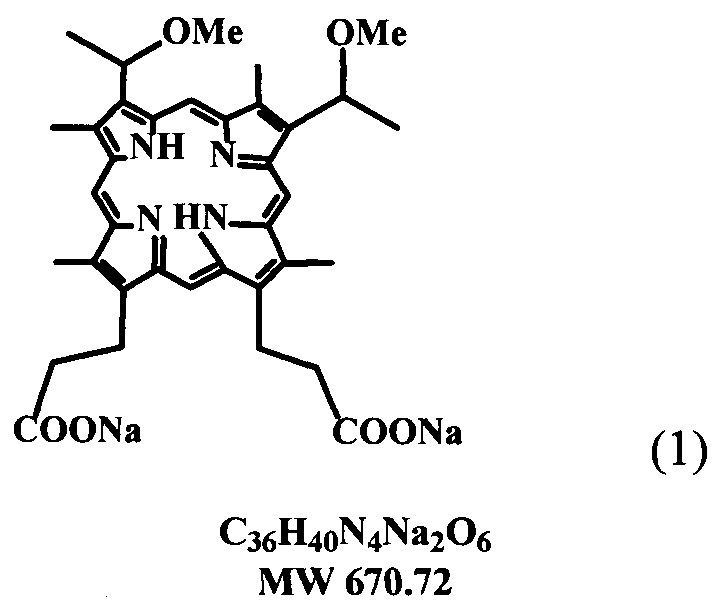
Изобретение относится к фармакологии, а именно к получению биологически активного соединения порфиринового ряда --, динатриевой соли 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX (ДИМЕГИНА) общей формулы (1) в лиофильно высушенной форме, которое может быть использовано в качестве высокоэффективного фотосенсибилизатора (ФС) для фотодинамической терапии (ФДТ) некоторых форм рака и других новообразований различного генезиса, многочисленных воспалительных и гнойных процессов, в косметологии для фотоомоложения кожи, а также для флюоресцентной диагностики раковых клеток.
В составе большинства современных фотосенсибилизаторов (ФС), так называемого первого поколения, для ФДТ рака и других заболеваний используются производные гематопорфирина-IX (ГП) общей формулы (2).
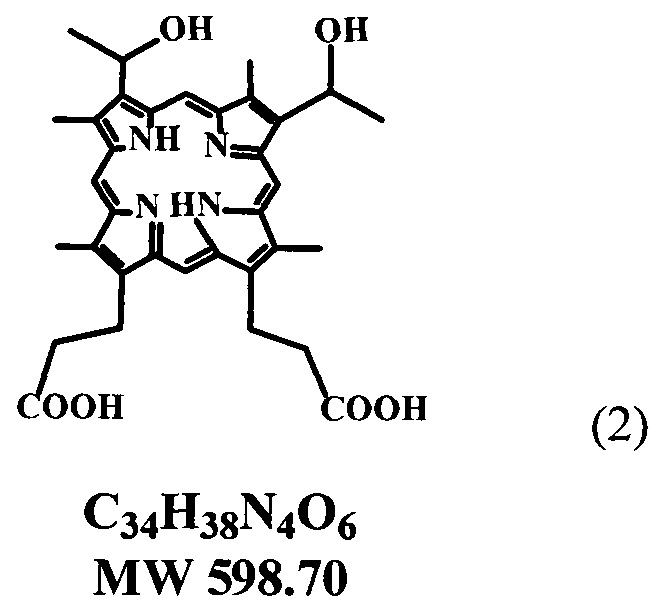
Некоторые из этих производных нашли реальное воплощение в мировой медицинской практике и широко применяются в настоящее время в качестве разрешенных препаратов для ФДТ рака и других новообразований. Наиболее известные среди этих ФС - ФОТОФРИН II (США) и ФОТОГЕМ (Россия), которые представляют собой сложную смесь продуктов конденсации молекул гематопорфирина-IX в виде натриевых солей без точного установления молекулярной структуры и молекулярной массы этой смеси, в составе которой в основном имеются изомерные димеры, содержащие простые эфирные и сложноэфирные связи, а также, вероятно, и С-С связанные полимеры. (Pushpan S.K., Venkatraman S., Anand V., Sankar J. et al. (2002) Curr. Med. Chem., Anti-Cancer Agents, 187-207; Пат. России 2128993, 20.04.1999, Миронов А.Ф.; Нокель А.Ю.)
Основными недостатками вышеперечисленных ФС являются следующие:
1) олигомерная структура ФС требует очень тщательного хроматографического отделения определенных фракций из сложной смеси продуктов конденсации гематопорфирина-IX для получения стандартизированной лекарственной формы препарата, что значительно удорожает весь технологический процесс;
2) полимерная структура ФС обусловливает значительную вариабельность электронных спектров в зависимости от рН раствора и соотношения компонентов в составе ФС;
3) присутствие в составе ФС близкорасположенных тетрапиррольных колец макроциклов приводит к гипохромному эффекту и снижению флюоресценции за счет самогашения фотовозбужденных молекул гематопорфирина и, соответственно, уменьшению генерации синглетного кислорода, что сказывается на эффективности ФОТОФРИНА II или ФОТОГЕМА как фотосенсибилизатора.
В последнее время осуществлен синтез нового димерного порфирина - СИНОПОРФИНА, аналога ФОТОФРИНА, структура которого представляет собой смесь трех изомерных димеров, порфириновые единицы в которых связаны между собой простой эфирной связью. Но его синтез представляет значительные трудности, по сравнению с уже известными ФС аналогичного строения. (Photochem Photobiol Sci. 2015 Apr, №14 (4), p. 815-32. doi: 10.1039/c4pp00463a.Lin N1, Li C, Wang Z, Zhang J, Ye X, Gao W, Wang A, Jin H, Wei J.)
Известен способ получения ДИМЕГИНА динатриевой соли 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX (1) (Авт. свид. СССР 1160710 от 28.04.84). Способ заключается в том, что 1 г диметилового эфира 2,4-ди-(α-метоксиэтил) дейтеропорфирина-IX выдерживают при комнатной температуре в 100 мk 25%-ного раствора соляной кислоты, через 12 ч нейтрализуют насыщенным раствором ацетата натрия, выпавший осадок отфильтровывают, многократно промывают горячей дистиллированной водой и сушат при 40-50°C. Сухой остаток растворяют в смеси хлороформ-метанола (5:1), фильтруют, добавляют гексан до полноты осаждения, осадок отфильтровывают, сушат на воздухе и получают 0,82 г (85%) 2,4-ди-(α-метоксиэтил) дейтеропорфирина-IX.
К раствору 1,0 г (1,6 ммоль) порфирина в смеси метанола и хлороформа (40 мл, 1:9) прибавляют 73,6 мг (3,2 ммоль) металлического натрия в 10 мл метанола. Через 30 мин растворитель удаляют в вакууме, остаток растворяют в минимальном количестве метанола (20 мл) и высаживают при постепенном добавлении смеси гексан-эфир (1:1), осадок отфильтровывают, сушат в вакуум-эксикаторе над NaOH и получают 0,9 г (84%) динатриевой соли 2,4-ди-(α-метоксиэтил) дейтеропорфирина-IX.
Основным недостатком данного способа является тот факт, что при кислотном гидролизе диметилового эфира 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX] обязательно происходит частичное отщепление молекул метанола от метоксиэтильных групп дейтеропорфирина-IX с возникновением порфиринов, содержащих винильные заместители, что приводит к снижению выхода ДИМЕГИНА.
Наиболее близким по технической сущности и выбранным в качестве прототипа является патент ЕР 0149995 В1, 07.03.1990, который заключается в получении ДИМЕГИНА путем гидролиза диметилового эфира 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX в растворе пиридина гидроксидом натрия в метаноле при перемешивании при 90°C в течение 2-х часов, после чего выделяют кристаллический осадок целевого продукта с выходом ~10%.
Технической проблемой является создание ФС, обладающего более высокими потребительскими свойствами для целей ФДТ, чем известные препараты ФОТОФРИН II ФОТОГЕМ или СИНОПОРФИН, т.е.:
1) высокой степени чистоты и гомогенности лекарственной формы препарата ФС;
2) достаточной растворимостью в воде для создания оптимальной концентрации при создании удобных в использовании инъекционных растворов, а также возможностью растворения в гелевых и мазевых композициях в виде мономолекулярных структур для наружного применения,
3) лучшей способностью генерировать синглетный кислород при облучении светом лазера с различной длиной волны (от области 390-410 нм, до 600-625 нм),
4) а также по простоте и удобству технологических операций при получении лекарственной формы и ее устойчивостью при длительном хранении.
Техническим результатом от использования изобретения по сравнению с прототипом является повышение выхода целевого продукта до 95%, многократное упрощение технологии получения исходя из исходного вещества «тетраметилового эфира гематопорфирина-IX», полученного из доступного исходного сырья - протогемина.
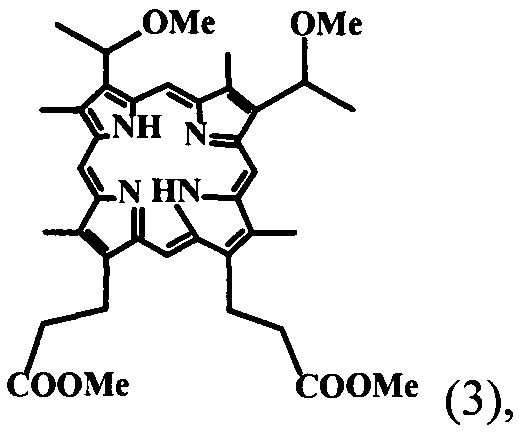
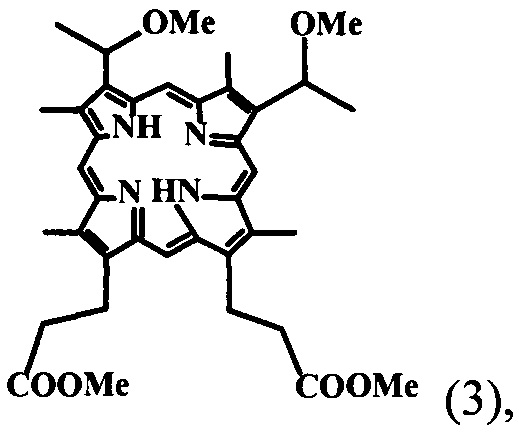
В предложенном нами настоящем изобретении разработаны условия щелочного омыления сложноэфирных остатков эфиров пропионовых кислот в молекуле «тетраметилового эфира» гематопорфирина-IX. Соединение ТМГ общей формулы (3)
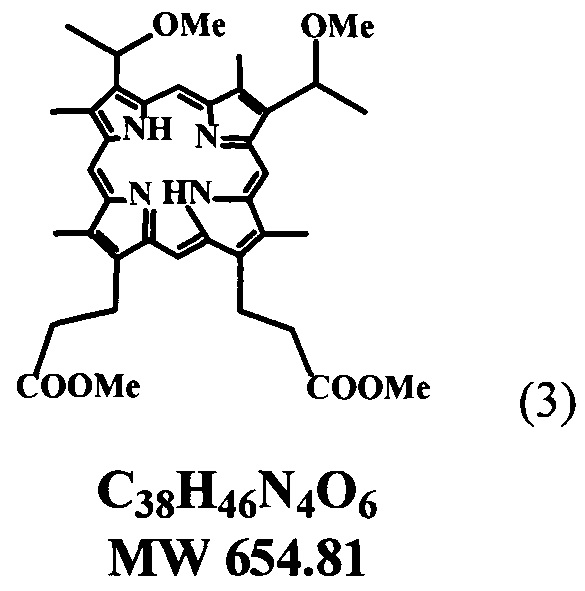
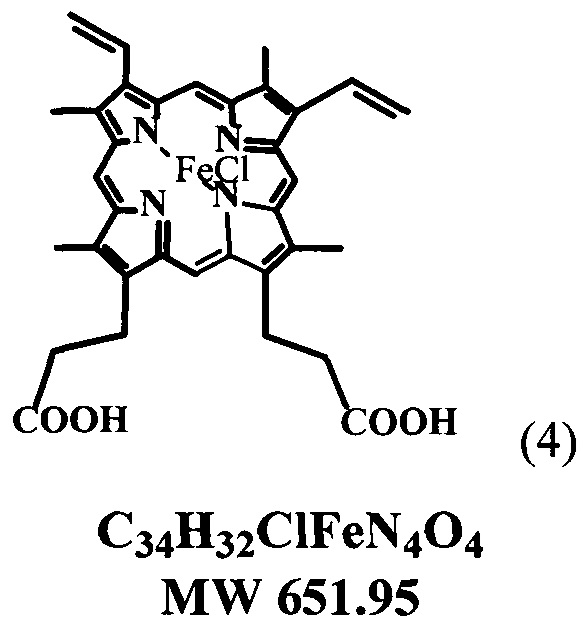
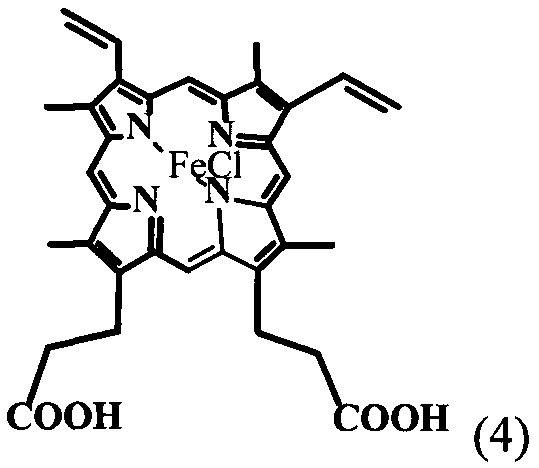
полученного в свою очередь из природного протогемина общей формулы (4) сразу до образования кристаллической динатриевой соли 2,4(1-метоксиэтил)-дейтеропорфирина-IX (ДИМЕГИНА) общей формулы (1) с высоким выходом и содержанием в образце основного продукта не менее 99%, что подтверждается данными элементного анализа, электронных и ПМР-спектров, а также данных ЖХВД.
На фиг. 1а и 1б представлены электронные спектры ДИМЕГИНА в воде и в этаноле, из которых видно, что данный порфирин как в водной, так и в органической среде находится в мономерной форме, которая способствует максимальной генерации синглетного кислорода и эффективному использованию его как фотосенсибилизатора для ФДТ. Из фиг. 1а и 1б видно, что область полосы Соре (380-410 нм) по интегральной интенсивности как в воде, так и в спирте значительно превышает поглощение в видимой части спектра. Поэтому использование лазерных или светодиодных источников для возбуждения молекул ДИМЕГИНА в «фиолетовой» области спектра» происходит с максимальной эффективностью, в отличие от стандартных методик облучения родственных известных фотосенсибилизаторов типа ФОТОФРИН, ФОТОФРИН II или ФОТОГЕМ, для которых обычно используется лазерный источник облучения при ~630 нм.
На фиг. 1а представлен электронный спектр (общий вид) ДИМЕГИНА в воде (синий цвет) и спирте (красный цвет).
На фиг. 1б представлен электронный спектр ДИМЕГИНА в видимой части спектра (450 нм - 650 нм).
Способ получения динатриевой соли 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX (ДИМЕГИНА), путем щелочного гидролиза характеризуется тем, что в качестве исходного компонента для гидролиза используют тетраметиловый эфир гематопорфирина-IX. (ТМГ) (3), полученный путем смешения протогемина (4) с уксусной кислотой с получением реакционной смеси, в которую добавляют метанол и далее добавляют ацетата натрия в воде с получением тетраметилового эфира гематопорфирина-IX. (ТМГ) (3), который используют в качестве исходного вещества для гидролиза в растворе диоксан-вода при 70-80°C в течение 1 часа, с последующим добавлением изопропилового спирта к реакционной смеси, выделением целевого продукта динатриевой соли 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX (1).
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
30 г протогемина (4) перемешивают на качалке в 300 мл уксусной кислоты, насыщенной HBr (d=1.45) в колбе с плотно закрытой пробкой при комнатной температуре 24-48 часов до полного растворения осадка, реакционную смесь медленно в течение 15 минут выливают при перемешивании к 2400 мл метанола, через 12 часов к реакционной смеси добавляют при перемешивании раствор 1 кг ацетата натрия в 1 л воды так, чтобы температура не превышала 18-20°C, через 24 часа выпавший кристаллический осадок отфильтровывают, промывают горячей (60°C) дистиллированной водой, сушат на воздухе и получают 29 г (96.2%) технического «тетраметилового эфира» гематопорфирина IX (3), который растворяют в 700 мл хлороформа, хроматографируют на колонке с окисью алюминия (III степени активности) в хлороформе, основную ярко-красную фракцию отделяют, упаривают досуха, остаток растворяют в этаноле, выдерживают при 8-10°C 24 часа, выпавший крупнокристаллический осадок отфильтровывают, сушат на воздухе и получают 21.9 г (72.7%) «тетраметилового эфира» гематопорфирина-IX. (ТМГ) (3). Электронный спектр в хлороформе λ max, нм (ε): 400 (166000), 500 (12800), 534 (8100), 569 (5900), 623 (3900). ТМГ в CDC13 (δ):10.55, 10.51, 10.13, 10.08 все с, мезо-Н, 4Н; 6.05 к, СН-СН3; 2Н; 4.42 т и 3.30 т 2хСН2СН2СОО, 4Н и 4Н; 3.71, 3.68, 3.66, 3.65, 3.61, все с, 24Н, 4хСН3-кольца, 2хСН-СН3, 2хСООСН3; NH -3.92, с, 2Н.
Пример 2
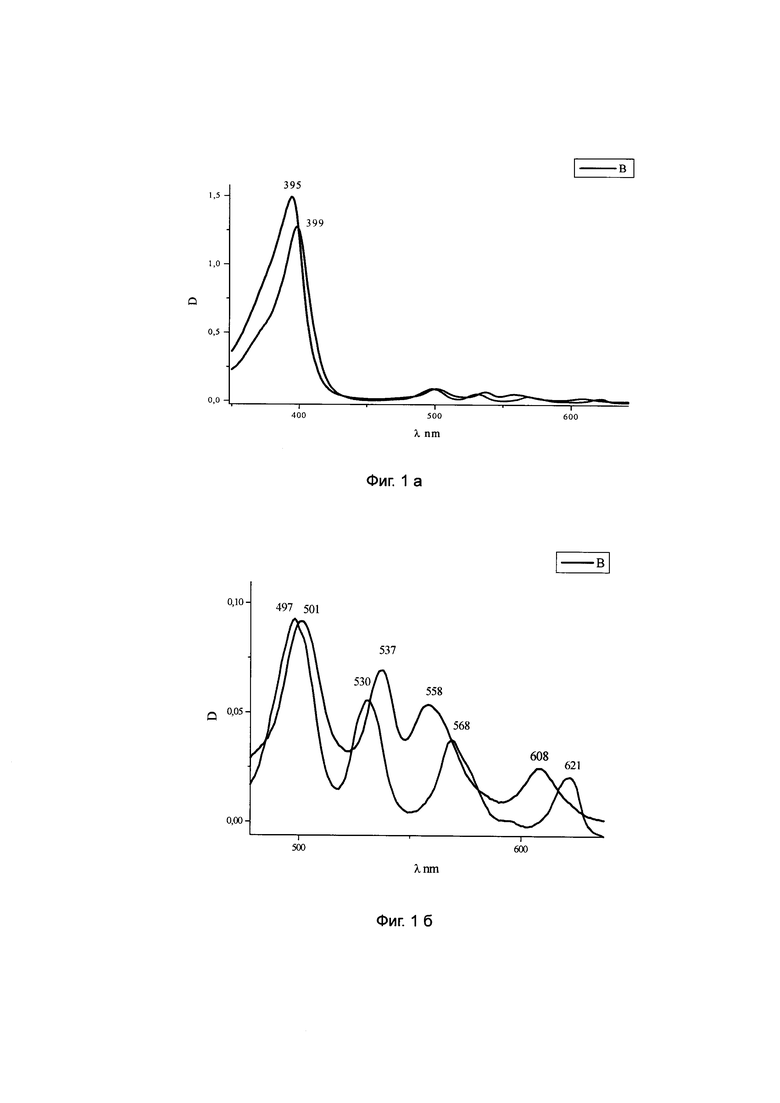
К раствору 21.9 г ТМГ в 130 мл свежеперегнанного диоксана при 70°C добавляют раствор 2.85 г гидроокиси натрия в 38 мл воды, перемешивают 1 час при 70-80°C, медленно (в течение 20 минут) приливают при перемешивании 250 мл изопропилового спирта, охлаждают до 50°C, приливают при перемешивании за 10 минут 700 мл ацетона, выпавший осадок отфильтровывают, промывают на фильтре 300 мл ацетона, сушат на воздухе при 50-55°C, до отсутствия в образце органических растворителей методом ГЖХ и получают 21.6 г (96.6%) динатриевой соли 2,4-ди(1-метоксиэтил)дейтеропорфирина-IX, считая на исходный «тетраметиловый эфир» гематопорфирина-IX. Спектр ПМР в DMSO-d6 (δ) 10.67, 10.56, 10.46, 10.18 все с, мезо-Н, 4Н; 6.16, 6.15 два к, СН-ОМе, 2Н; 4.33 т, 4.31 т, 2xCH2CH2COONa, 4Н; 3.71, 3.69, 3.57, 3.56, 3.54, 3.51 все с, 3Нх4 кольца и 2хСН-ОМе; 2.92 т, 2.90 т, 2xCH2CH2COONa, 4Н; 2.20, 2.19, 2.15, 2.14 два д, СН-Ме, 6Н; -3.92, с, 2Н. NH приведенный на фиг. 2 «Спектр ПМР динатриевой соли 2,4-ди(1-метоксиэтил) дейтеропорфирина-IX» свидетельствует о том, что в образце отсутствуют примеси сопутствующих порфиринов, а из данных ЖХВД следует, что содержание основного вещества составляет 99.2%.
Ниже представлены фотосенсибилизирующие свойства ДИМЕГИНА.
Высокая эффективность «Димегина» как фотосенсибилизатора была установлена при сравнительном изучении его фотофизических свойств со свойствами фотосенсибилизаторов «Фотодитазин» и «Радахлорин». Прежде всего «Димегин» обладает высокой фотостабильностью (выше в 22 раза), интенсивной люминесценцией (выше в 2 раза), эффективной генерацией синглетного кислорода (выше в 2,5 раза).. Дополнительным приемуществом «Димегина» является его низкая токсичность (при в/в введении - 240 мг/кг) в сравнении с «Фотодитазином» (при в/в введении - 86 мг/кг). (А.В. Дадеко, Т.Д. Муравьева, А.М. Стародубцев, С.И. Горелов, М.В. Добрун, Т.К. Крисько, И.В. Багров, И.М. Белоусова, Г.В. Пономарев. Оптика и спектроскопия. 2015, том 119, №4, с. 617-622).
Ранее было исследовано накопление фотосенсибилизатора в клетке, его внутриклеточная локализация и выживаемость клеток после фотодинамической обработки «Димегином» на примере линий клеток человека, полученных из кожи. (SCL1 и SCL2, клеток карциномы и фибробластов.) Как было отмечено, «Димегин» преимущественно накапливается в митохондриях клеток. Высокая способность генерации синглетного кислорода при облучении клеток, обработанных Димегином, провоцирует окислительный стресс, который приводит к освобождению каспаз и последующему митохондриальному пути развития апоптоза, в итоге приводящему к гибели клетки.
Облучение клеточного материала, обработанного раствором «Димегина» с концентрацией 15 мМ, некогерентным источником света (580-740 нм) с дозой 24 J/cm2 во всех случаях приводило к значительному фототоксическому эффекту. (S. Fickweiler, R.-M. Szeimies, С. Abels, G.V. Ponomarev, F. 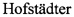 , O.S. Wolfbeis, M. Landthaler // Photodermatology, Photoimmunology & Photomedicine, V. 14, №3-4, P. 125-131, 1998.)
, O.S. Wolfbeis, M. Landthaler // Photodermatology, Photoimmunology & Photomedicine, V. 14, №3-4, P. 125-131, 1998.)
Проведена оценка фотодинамических свойств «ДИМЕГИНА» на примере его противомикробного действия, которая показала, что облучение светодиодом (λ=400 нм) с плотностью мощности 0,05 Вт/см2 микробных клеток S. aureus, Е. coli, С. Albicans и др., предварительно обработанных 0,35% раствором «Димегина», приводило к бактерицидному эффекту, сравнимому с таковым у стандартных антисептиков - хлоргексидина и диоксидина.
Для работы использовали приготовленный за сутки до опыта раствор «Димегина», хранившийся после приготовления при комнатной температуре.
Установлено, что эффективность «Димегина» не уступает эффективности «Фотодитазина» в этом диапазоне длин волн, однако, учитывая простоту и дешевизну его изготовления, он может оказаться при массовом производстве достаточно конкурентноспособным (В.М. Бондаренко, Ю.В. Алексеев, О.В. Миславский, Г.В. Пономарев. Биомедицинская химия, 2014 том 60, вып. 3, с. 338-347).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИКАЛИЕВОЙ СОЛИ ИТТЕРБИЕВОГО КОМПЛЕКСА 2,4-ДИ(α-МЕТОКСИЭТИЛ)ДЕЙТЕРОПОРФИРИНА IX АЦЕТИЛАЦЕТОНАТА | 2019 |
|
RU2697418C1 |
| ВОДОРАСТВОРИМЫЕ СОЛИ 2,4-ДИ -( α -МЕТОКСИЭТИЛ)ДЕЙТЕРОПОРФИРИНА-IX, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ЛОКАЛИЗОВАТЬСЯ В РАКОВЫХ ТКАНЯХ | 1984 |
|
SU1160710A1 |
| ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ ЖИВОТНОГО | 2015 |
|
RU2604412C2 |
| ФЛУОРЕСЦЕНТНАЯ ДИАГНОСТИКА ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ ЖИВОТНОГО | 2015 |
|
RU2604388C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2006 |
|
RU2314806C1 |
| СИСТЕМА ДОСТАВКИ ЛЕКАРСТВ ДЛЯ ГИДРОФОБНЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2279872C2 |
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2276976C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИНОВ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2009 |
|
RU2513483C2 |
| Способ получения монокарбоксилпроизводных деметаллированных нефтяных порфиринов | 2021 |
|
RU2783726C1 |
| Фотосенсибилизатор для лечения рака предстательной железы и способ его получения | 2018 |
|
RU2670087C1 |
Изобретение относится к фармакологии, а именно к способу получения динатриевой соли 2,4-ди(1-метоксиэтил)дейтеропорфирина-IX (ДИМЕГИНА). Способ включает проведение щелочного гидролиза тетраметилового эфира гематопорфирина-IX (ТМГ) общей формулы
 полученного путем смешения протогемина общей формулы
полученного путем смешения протогемина общей формулы
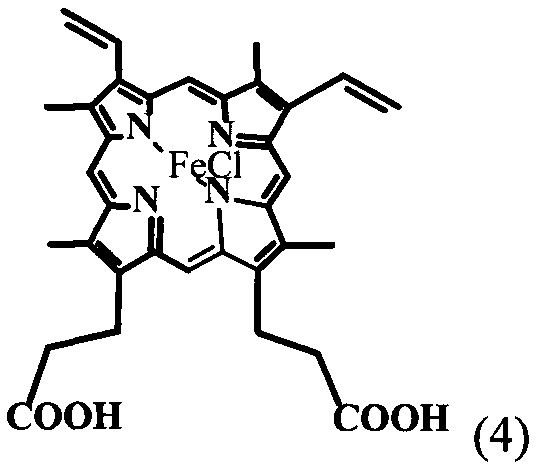
с уксусной кислотой с получением реакционной смеси, в которую добавляют метанол и далее добавляют ацетат натрия в воде с получением тетраметилового эфира гематопорфирина-IX (ТМГ) (3). Гидролиз проводят в растворе диоксан-вода при 70-80°C в течение 1 часа с последующим добавлением изопропилового спирта к реакционной смеси, выделением целевого продукта динатриевой соли 2,4-ди(1-метоксиэтил)дейтеропорфирина-IX (1). Изобретение позволяет повысить выход целевого продукта и упростить технологию получения. 3 ил., 2 пр.
Способ получения динатриевой соли 2,4-ди(1-метоксиэтил)дейтеропорфирина-IX (ДИМЕГИНА) путем щелочного гидролиза, отличающийся тем, что в качестве исходного вещества для гидролиза используют тетраметиловый эфир гематопорфирина-IX (ТМГ) общей формулы
 полученный путем смешения протогемина общей формулы
полученный путем смешения протогемина общей формулы
с уксусной кислотой с получением реакционной смеси, в которую добавляют метанол и далее добавляют ацетат натрия в воде с получением тетраметилового эфира гематопорфирина-IX (ТМГ) (3), который используют для гидролиза в растворе диоксан-вода при 70-80°C в течение 1 часа, с последующим добавлением изопропилового спирта к реакционной смеси, выделением целевого продукта динатриевой соли 2,4-ди(1-метоксиэтил)дейтеропорфирина-IX (1).
| Вибратор к вибрационным загрузочным устройствам | 1961 |
|
SU149995A1 |
| ВОДОРАСТВОРИМЫЕ СОЛИ 2,4-ДИ -( α -МЕТОКСИЭТИЛ)ДЕЙТЕРОПОРФИРИНА-IX, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ЛОКАЛИЗОВАТЬСЯ В РАКОВЫХ ТКАНЯХ | 1984 |
|
SU1160710A1 |
| Способ получения 2,4-ди-/L-алкоксиэтил/-6,7-ди-/2-карбалкоксиэтил/1,3,5,8-тетраметилпорфиринов | 1979 |
|
SU857138A1 |
Авторы
Даты
2018-03-16—Публикация
2017-04-06—Подача