Настоящее изобретение относится к химико-фармацевтической промышленности, а именно к разработке новых противораковых препаратов.
Рак предстательной железы - одно из наиболее распространенных злокачественных новообразований у мужчин. Ежегодно в мире выявляется свыше 400000 случаев рака предстательной железы; в ряде стран он занимает в структуре онкологических заболеваний 2-е или 3-е место после рака легких и рака желудка (так, в Европе в 2004 году заболеваемость раком предстательной железы составляла 214 случаев на 100000 мужчин, в результате чего рак простаты занимал 2-е место среди основных причин смерти от рака у мужчин, опережая рак легких и колоректальный рак). Согласно данным общемировой статистики в 2012 году рак простаты зафиксирован у 1,1 млн мужчин, и одновременно привел к 307 тыс.летальных исходов. Рак предстательной железы является причиной почти 10% смертей от рака у мужчин и служит одной из главных причин смерти у пожилых мужчин. В США рак предстательной железы является третьей по частоте причиной смерти от злокачественных опухолей[https://ru.wikipedia.org/wiki/Рак_предстательной_железы].
Фотодинамическая терапия (ФДТ) - метод лечения онкологических заболеваний, некоторых заболеваний кожи или инфекционных заболеваний, основанный на применении светочувствительных веществ - фотосенсибилизаторов (в том числе красителей), и, как правило, видимого света определенной длины волны [https://ru.wikipedia.org/wiki/Фотодинамическая_терапия]. Сенсибилизатор вводится в организм чаще всего внутривенно, но может применяться аппликационно или перорально. Вещества для ФДТ обладают свойством избирательного накопления в опухоли или иных целевых тканях (клетках). Затем пораженные патологическим процессом ткани облучают светом с длиной волны, соответствующей максимуму поглощения красителя. В качестве источника света в настоящее время используются лазерные установки, позволяющие излучать свет определенной длины волны и высокой интенсивности. Поглощение молекулами фотосенсибилизатора квантов света в присутствии кислорода приводит к фотохимической реакции, в результате которой молекулярный триплетный кислород превращается в синглетный, а также образуется большое количество высокоактивных радикалов. Синглетный кислород и радикалы вызывают в клетках опухоли некроз и апоптоз (два варианта гибели клеток). ФДТ также приводит к нарушению питания и гибели опухоли за счет повреждения ее микрососудов [Улащик B.C. Фото динамическая терапия - технология XXI века // Физиотерапия, бальнеология и реабилитация: журнал. - 2013. - №1. - С. 36-43.].
В настоящее время применяются в клинике или находятся на разных стадиях клинических испытаний фотосенсибилизаторы (ФС) различных классов (порфирины и их металлокомплексы, хлорины, бензопорфирины, фталоцианины и др.). Особый интерес представляют природные хлорофиллы и их производные с интенсивным поглощением в ближней ИК-области спектра. Свет с длиной волны 650-700 нм проникает в ткани на глубину до 20-25 мм, это существенно расширяет возможности используемых в настоящее время методов лечения крупных и глубокозалегающих опухолей. В основе большинства современных фотосенсибилизаторов лежит структура хлорина еб, получаемого из природного сырья.
Одним из распространенных фотосенсибилизаторов, является коммерчески доступный «Фотофрин» (Photofrin II®) [Dougherty, T.J. Hematoporphyrin as a photosensitizer of tumors / T.J. Dougherty // Photochem. Photobiol. - 1983. - V.38, № 3 - Р. 377-79]. Этот порфириновый сенсибилизатор на самом деле состоит из нескольких порфириновых димеров и цепей. Препарат активируется на нескольких длинах волн, но 630 нм является клинически оптимальной для проникновения ткани.
Отечественным аналогом «Фотофрина» является препарат «Фотогем» [Патент РФ №2128993, 1999 г.]. Другим клинически успешным порфириновым фотосенсибилизатором, используемым в гинекологии, является 5-аминолевулиновая кислота, которая при введении изменяет метаболизм гема и приводит к выработке протопорфирина IX [Musiol R, Serda М, Polanski J (2011). «Prodrugs in photodynamic anticancer therapy». Curr. Pharm. Des. 17 (32): 3548-59.]. В России выпускается под названием «Аласенс». Другим отечественным препаратом является «Фотодитазин», который представляет собой соль хлорина е 6 с щелочными металлами и N-метил-D-глюкамином [патент РФ 2276976, опубл. 2006 г.].
Фотосенсибилизатор на основе синтетического хлорина является «Фоскан» (Темопорфин) также успешно применяется в клинике и в биологических исследованиях [Bonnett, R. Hydroporphyrins of the mesotetra(hydroxyphenyl)poprhyrin series as tumor photosensitizers / R. Bonnett, R.D. White, U.J. Winfield, C. Berenbaum // Biochem. J. - 1989. - V. 261. - P. 277-80].
К препаратам третьего поколения относятся препараты «Tookad» и «Tookad Soluable (WST11)», которые являются производными природного бактериохлорофилла а и могут быть использованы для широкого круга глубокозалегающих новообразований [Taneja, S.S. Final Results of a Phase I/II Multicenter Trial of WST11 Vascular Targeted Photodynamic Therapy for Hemi-Ablation of the Prostate in Men with Unilateral Low Risk Prostate Cancer Performed in the United States / S.S. Taneja, J. Bennett, J. Coleman // J Urol. - 2016. - V. 196, №4. - P. 1096-104].
Из уровня техники также известно применение малых векторных лигандов, обеспечивающих таргетную доставку ФС в опухолевые ткани. Так, известен ПСМА-лиганд, который является векторным пептидомиметиком на ПСМА-рецепторы, сверхэкспрессированные на поверхности ряда опухолей предстательной железы. На его основе известны таргетные радиофармпрепараты для радиотерапии и диагностики [Патент WO 2015171792 A1,Metal/radiometal-labeled psma inhibitors for psma-targeted imaging and radiotherapy].
Ближайшим аналогом заявляемого изобретения является фотосенсибилизатор «Радахлорин» (ООО Радафарма) [https://www.rlsnet.ru/tn_index_id_24446.htm], представляющий собой водный раствор смеси различных хлоринов переменного состава, в которой содержание основного продукта - тринатриевой соли хлорина е6 составляет 80-90% от общей суммы всех хлоринов [патент РФ №2183956].
К недостаткам препарата «Радахлорин» следует отнести низкую эффективность. Указанный недостаток обусловлен низким уровнем селективности накопления препарата в опухоли предстательной железы.
Таким образом, задачей заявленного изобретения является создание фотосенсибилизатора, обладающего высокой эффективностью при проведении ФДТ рака предстательной железы, а также расширение арсенала данного класса препаратов.
Решение поставленной задачи обеспечивает фотосенсибилизатор для фотодинамической терапии с формулой (1):
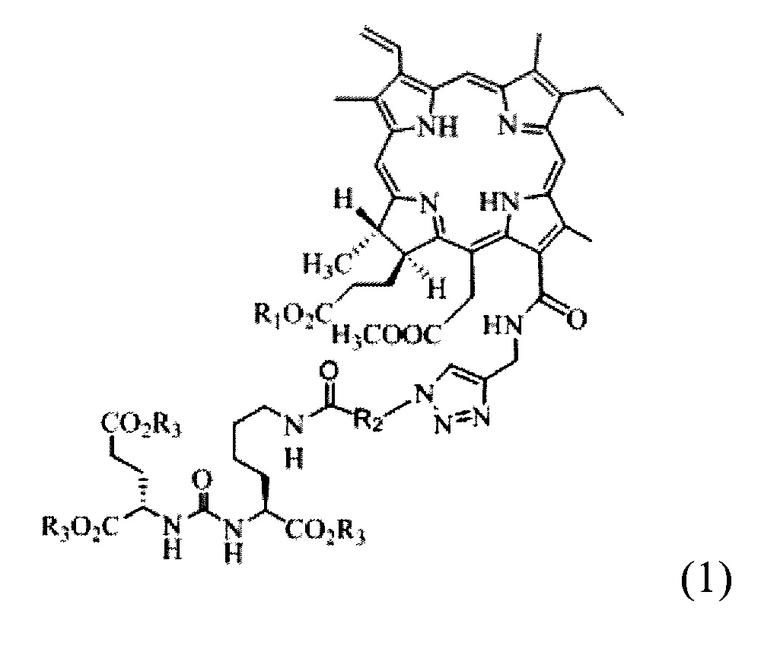
,где в качестве R1 может выступать водород (Н), натрий (Na), калий (К), C1-C2 - алкил, в качестве R2 может выступать соединение общей формулы СхН2х, где х=4÷17, в качестве R3 может выступать водород (Н), натрий (Na) или калий (К).
Эффективность заявленного фотосенсибилизатора обусловлена синергетическим эффектом, обусловленным наличием в структуре молекулы векторного фрагмента, связывающегося в организме с ПСМА-рецепторами в клетках рака предстательной железы, а также высоким уровнем фотоиндуцированной активности заявленного соединения.
ПСМА-лиганд и молекула хлорина е6 соединены друг с другом через спейсер, который разделяет фотоактивную и таргетную компоненты в пространстве. Данный спейсер может быть различной природы (алкильный, пептидный, полиэтиленгликолевый и др.) и не оказывает существенного влияния на эффективность заявляемого фотосенсибилизатора.
В немалой степени решение поставленной задачи обеспечивает способ получения указанного выше фотосенсибилизатора, включающий в себя:
- реакцию раскрытия циклопентанового кольца соединения со структурной формулой (2)
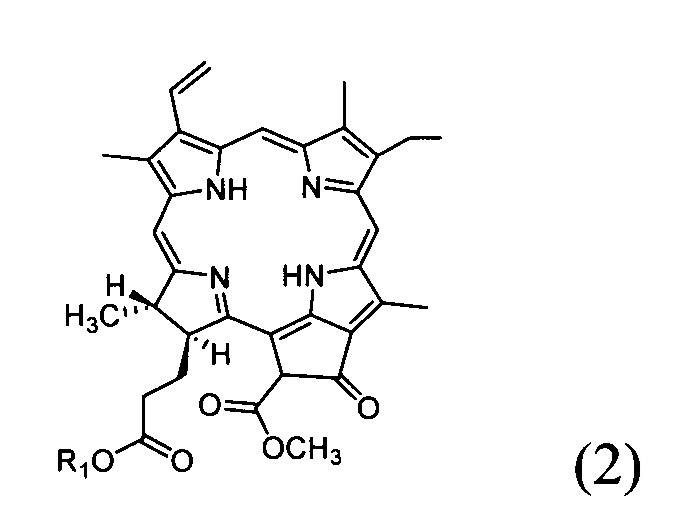
в органическом растворителе при нагревании с получением соединения с формулой (3);
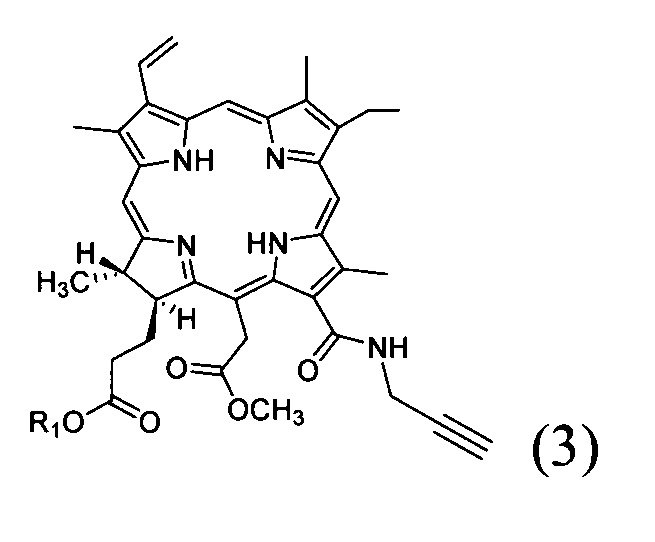
- добавление к соединению со структурной формулой (3) ацетата цинка с получением соединения со структурной формулой (4);
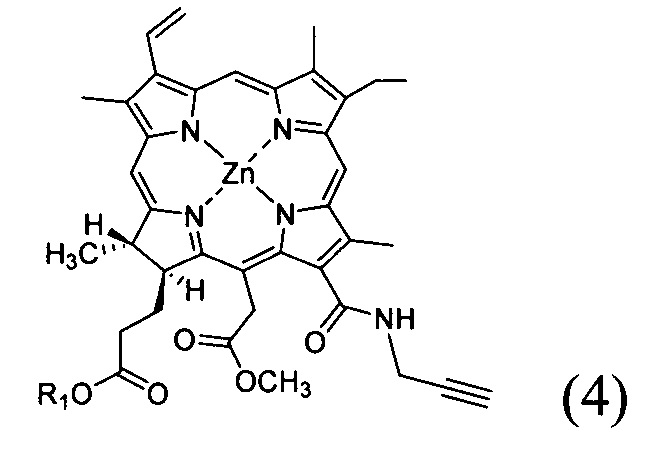
- добавление соединения со структурной формулой (5)
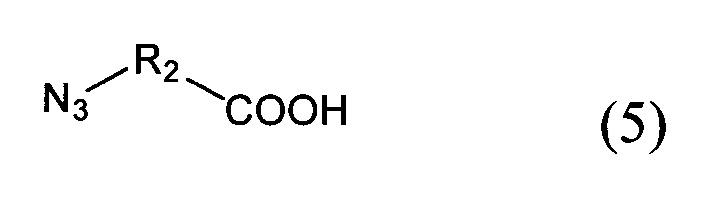
к соединению (6)
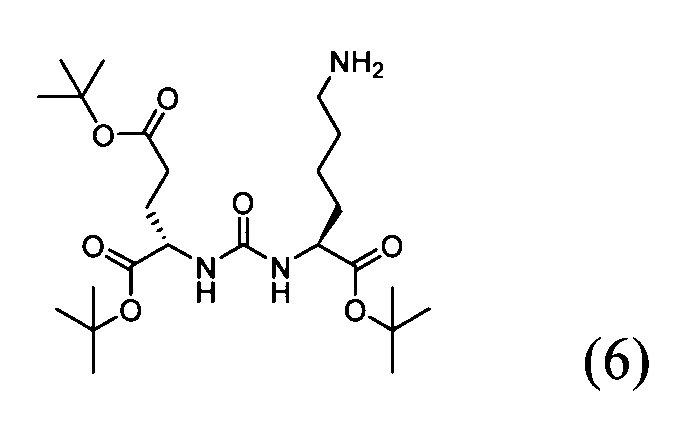
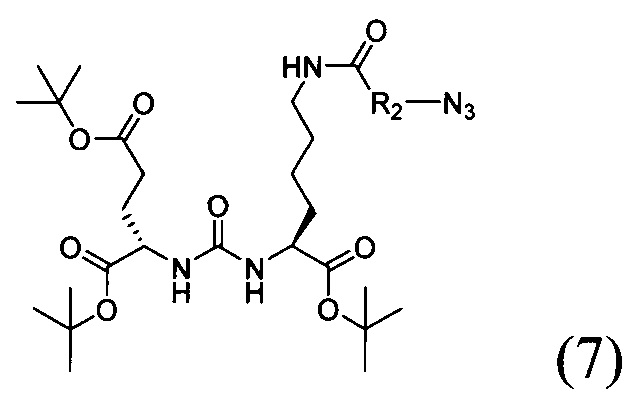
в органическом растворителе в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида с получением соединения со структурной формулой (7);
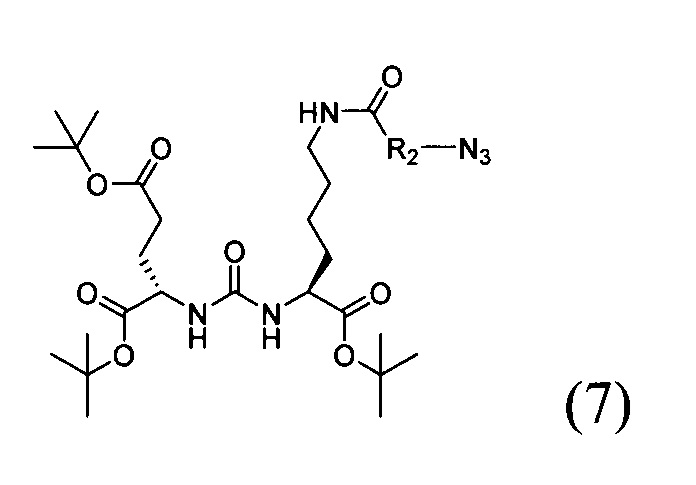
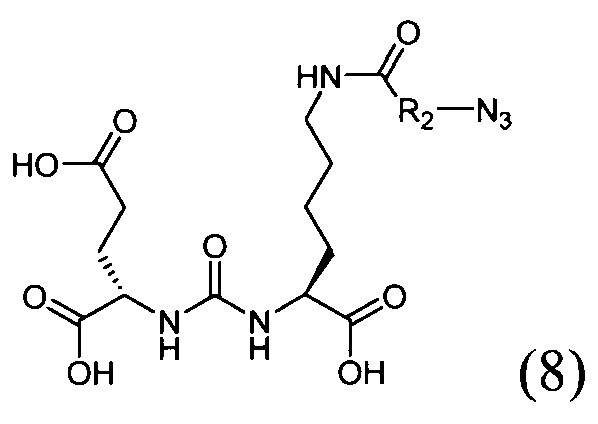
- воздействие на соединение со структурной формулой (7) трифторуксусной кислотой в органическом растворителе с получением соединения со структурной формулой (S);
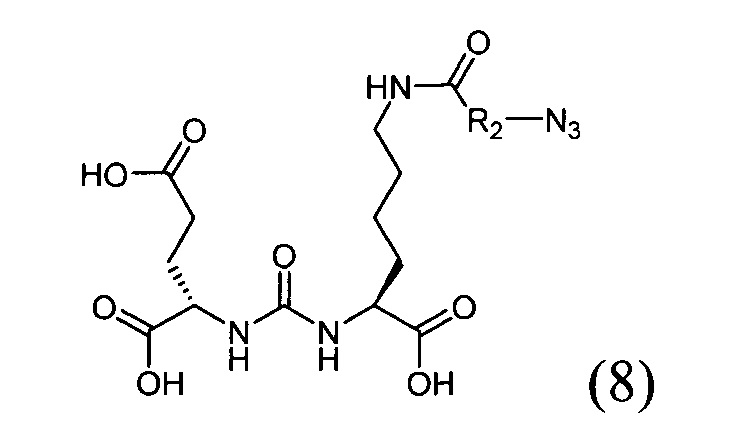
- реакцию соединения со структурной формулой (4) с соединением со структурной формулой (S) в присутствии йодида меди с получением соединения со структурной формулой (9);

- воздействие на соединение со структурной формулой (9) трифторуксусной кислотой в диметилсульфоксиде с получением неочищенного соединения со структурной формулой (1);
- промывку неочищенного соединения со структурной формулой (1) с получением заявленного фотосенсибилизатора.
, где в качестве R1 может выступать водород (Н), натрий (Na), калий (К), С1-С2 - алкил, в качестве R2 может выступать соединение общей формулы СхН2х, где х=4÷17, в качестве R3 может выступать водород (Н), натрий (Na) или калий (К).
Как вариант, заявленный способ может дополнительно включать стадию лиофильного высушивания полученного фотосенсибилизатора с получением его кристаллической формы.
Стратегия синтеза состоит в реализации реакции медь -катализируемого азид-алкинового циклоприсоединения. Данный подход позволяет ввести спейсерную группу в состав молекулы и получить целевой продукт с высокими выходами. В качестве алкиновой компоненты был получен цинковый комплекс диметилового эфира 131-(пропаргилкарбомоил)изохлорина е4. Азидная компонента была получена путем ацилирования терминальной аминогруппы вышеупомянутого PSMA-лиганда, полученного по ранее описанной методике исходя из защищенных производных лизина и глутаминовой кислоты с использованием трифосгена. После удаления гарега-бутильных групп была реализована click-реакция с получением соединения. Основная сложность при проведении click-реакции заключалась в выборе растворителя, поскольку PSMA-лиганд плохо растворяется как в неполярных растворителях, так и в полярных, а также легко подвергается этерификации в присутствии спиртов. Использование высокополярных растворителей при работе с хлоринами приводит к окислению и, как следствие, к загрязнению продукта. Реакция проводилась в ДМФА, который был тщательно дегазирован. После проведения реакции, целевой продукт был кристаллизован с использованием ацетонитрила, с дальнейшей промывкой кристаллов смесью ацетонитрила, воды и гексана.
Выбор природного пигмента для создания ФС обусловлен рядом факторов, в том числе их распространенностью в природе, интенсивностью поглощения в длинноволновой области спектра, структурной близостью к эндогенным порфиринам. Наличие указанных свойств позволяет предположить относительно низкий уровень токсичности подобных соединений и их быстрое выведение из организма.
Также заявленное изобретение обеспечивает лекарственное средство для лечения рака предстательной железы, включающее в себя заявленный фотосенсибилизатор и фармацевтически приемлемые добавки.
Как вариант, в качестве фармацевтически приемлемой добавки заявленное лекарственное средство может включать изотонический раствор.
Предлагаемое изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение заявленного фотосенсибилизатора.
Метиловый эфир феофорбида а (40 мг) и пропаргиламин (200 мкл) были растворены в хлористом метилене (2 мл) с добавлением диизопропилэтиламина (100 мкл) и перемешивались в течение 48 часов. По завершению реакции, смесь разбавляли хлористым метиленом (50 мл) и промывали 6% раствором соляной кислоты. Органический слой отделяли, сушили над сульфатом натрия и упаривали при пониженном давлении. Очистку осуществляли с помощью колоночной хроматографии на силикагеле (хлороформ/метанол, 50/1, v/v) с получением 43 мг метилового эфира 131-(пропаргилкарбамоил)изохлорина е4. Полученный продукт растворяли в хлористом метилене (2 мл) с добавлением суспензии ацетата цинке (50 мг) в метаноле (500 мкл). Смесь перемешивали в течение 30 минут. После этого к реакции добавляли насыщенный раствор поваренной соды и фильтровали смесь через фильтр Шотта. Смесь разбавляли дихлорметаном (100 мл) и промывали дистиллированной водой. Органический слой был высушен над сульфатом натрия и упарен при пониженном давлении. В результате было получено 34 мг цинкового комплекса метилового эфира 131-(пропаргилкарбамоил)изохлорина е4.
К раствору 11-азидоундекановой кислоты (173 мг) в ДМФА (4 мл) был добавлен EDC (78,5 мг) и N-гидрокисукцинимид (58,3 мг) при перемешивании. По истечению 60 минут к смеси добавили (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-(трет-бутокси)-1-оксогексан)уреидо)пентадиоат (70 мг). Реакцию вели в течение 48 часов, после чего смесь была разбавлена хлористым метиленом (70 мл) и промыла раствором поваренной соли. Органический слой высушивали над сульфатом натрия и упаривали на роторном испарителе. Продукт очищали в помощью колоночной хроматографии на силикагеле (гексан/этилацетат, 3/2, v/v) с получением 73 мг (S)-ди-трет-бутил-2-(3-((S)-6-(11-азидоундеканамидо)-1-(трет-бутокси)-1-оксогексан)уреидо)пентадиоата, который в последствии растворяли в 11%об растворе трифторуксусной кислоты в хлористом метилене (5 мл). Смесь перемешивали в течение 16 часов, а затем упаривали и очищали обращено-фазовой флеш-хроматографией (градиент ацетонитрил-вода). Получали 48 мг (S)-2-(3-((S)-5-(11-азидоундеканамидо)-1-карбоксипентил)уреидо)пентандиовой кислоты.
Реакция циклоприсоединения цинкового комплекса метилового эфира 131-(пропаргилкарбамил)изохлорина е4 (33,7 мг) и (S)-2-(3-((S)-5-(11-азидоундеканамидо)-1-карбоксипентил)уреидо)пентандиовой кислоты (26 мг;) была проведена в ДМФА с добавлением DIPEA. Реакция катализировалась иодидом меди (0.4 мг) при перемешивании в течение 16 часов. Окончание реакции фиксировали по аналитической ТСХ. Реакционная смесь было выпарена и сухой остаток был промыт ацетонитрилом, смесью ацетонитрил - вода и гексаном. Полученный продукт перерастворяли в 10% растворе трифтоуксусной кислоты в ДМСО и перемешивали в течении 30 минут. Затем смесь была разбавлена двумя объемами воды и выпавший осадок отделяли центрифугированием. Осадок трижды промывали дистиллированной водой, а затем высушивали при низком давлении. Выход составил 59 мг.
1Н ЯМР (400 МГц, CDCl3, δ, мд): 9.52 (s, 1Н), 9.48 (s, 1H), 9.32 (br s, 1Н), 8.65 (s, 1Н), 8.23 (ш, 3Н), 7.72(br s, 1H), 6.25-6.18 (dd, 1Н), 6.02-5.98 (dd, 1H), 5.42-5.35 (d, 1H), 5.14-5.07(d, 1Н), 4.45(m, 4Н), 4.30-4.27(d, 1Н), 3.81-3.79(s, 3H),3.64(s, 3H), 3.53(s, 3H), 2.98(br s, 2Н), 2.73(s, 1Н), 2.38-1.83 (m, 10Н), 1.66 (t, 6H), 1.59 (d, 6H), 1.54-1.42 (m, 8H), 1,28 (m, 20H) 1.15 (s, 3H), 0.88-0.76(m, 2H).
MALDI MS: m/z рассчитано [M+H] 1190.41; найдено 1190.52
UV/VIS (H2O), λmax, нм (ε, М-1 см-1): 390 (132000), 502 (12000), 530 (4800), 607 (4700), 662 (46000)
Таким образом, был получен заявленный фотосенсибилизатор.
Пример 2. Получение заявленного фотосенсибилизатора.
Феофорбид а (50 мг) и пропаргиламин (200 мкл) были растворены в хлористом метилене (4 мл) с добавлением диизопропилэтиламина (100 мкл) и перемешивались в течение 72 часов. По завершению реакции, смесь разбавляли хлористым метиленом (70 мл) и промывали 6% раствором соляной кислоты. Органический слой отделяли, сушили над сульфатом натрия и упаривали при пониженном давлении. Очистку осуществляли с помощью колоночной хроматографии на силикагеле (хлороформ/метанол, 25/1, v/v) с получением 49 мг 131-(пропаргилкарбамоил)изохлорина е4. Полученный продукт растворяли в хлористом метилене (3 мл) с добавлением суспензии ацетата цинке (50 мг) в метаноле (500 мкл). Смесь перемешивали в течение 25 минут, после чего к реакции добавляли насыщенный раствор NaHCO3 и фильтровали смесь через фильтр Шотта. Смесь разбавляли дихлорметаном (100 мл) и промывали дистиллированной водой. Органический слой был высушен над сульфатом натрия и упарен роторном испарителе. В результате было получено 44 мг цинкового комплекса 131-(пропаргилкарбамоил)изохлорина е4.
К раствору 6-азидогексановой кислоты (184 мг) в ДМФА (4 мл) был добавлен EDC (117,8 мг) и N-гидрокисукцинимид (87,5 мг) при перемешивании. По истечению 60 минут к смеси добавили (S)-ди-трет-бутил-2-(3-((S)-6-амино-1-(трет-бутокси)-1 оксогексан)уреидо)пентадиоат (105 мг). Реакцию вели в течение 48 часов, после чего смесь была разбавлена хлористым метиленом (100 мл) и промыла раствором поваренной соли. Органический слой сушили над сульфатом натрия и упаривали на роторном испарителе. Продукт очищали в помощью колоночной хроматографии на силикагеле (гексан/этилацетат, 3/2, v/v) с получением 95 мг (S)-ди-трет-бутил-2-(3-((S)-6-(6-азидогексанамидо)-1-(трет-бутокси)-1-оксогексан)уреидо)пентадиоата, который в последствии растворяли в 12%об растворе трифторуксусной кислоты в хлористом метилене (6 мл). Смесь перемешивали в течение 16 часов, а затем упаривали и очищали обращено-фазовой флеш-хроматографией (градиент ацетонитрил-вода). Получали 48 мг (S)-2-(3-((S)-5-(6-азидогексанамидо)-1-карбоксипентил)уреидо)пентандиовой кислоты. Реакция циклоприсоединения цинкового комплекса 131-(пропаргилкарбамоил)изохлорина е4 (44 мг) и (S)-2-(3-((S)-5-(6-азидогексанамидо)-1-карбоксипентил)уреидо)пентандиовой кислоты (21 мг) была проведена в ДМФА с добавлением DIPEA. Реакция катализировалась иодидом меди (0.5 мг) при перемешивании в течение 16 часов. Окончание реакции фиксировали по аналитической ТСХ. Реакционная смесь было упарена, сухой остаток был промыт ацетонитрилом, смесью ацетонитрил-вода и гексаном. Полученный продукт перерастворяли в 10% растворе трифтоуксусной кислоты в ДМСО и перемешивали в течение 30 минут. Затем смесь была разбавлена двумя объемами воды и выпавший осадок отделяли центрифугированием. Осадок трижды промывали дистиллированной водой, а затем высушивали при низком давлении. Выход составил 59 мг.
1Н ЯМР (400 МГц, CDCl3, δ, мд): 9.52 (s, 1Н), 9.48 (s, 1H), 9.32 (br s, 1H), 8.65 (s, 1Н), 8.23 (m, 3H), 7.72 (br s, 1H), 6.25-6.18 (dd, 1H), 6.02-5.98 (dd, 1Н), 5.42-5.35 (d, 1Н), 5.14-5.07(d, 1Н), 4.45 (m, 4Н), 4.30-4.27 (d, 1Н), 3.81-3.79 (s, 3H),3.64 (s, 3H), 3.53 (s, 3H), 2.98 (br s, 2Н), 2.73 (s, 1H), 2.38-1.83 (m, 8Н), 1.78 (m, 1Н), 1.66 (t, 6H), 1.59 (d, 6H), 1.54-1.42 (m, 6H), 1,28 (m, 10Н) 1.15 (s, 3H), 0.88-0.76(m, 2H).
MALDI MS: m/z рассчитано [M+H] 1106.25; найдено 1106.28
UV/VIS (H2O), λmax, hm (ε, M-1см-1): 390 (134000), 502 (13000), 530 (4700), 607 (4600), 662 (49000)
Таким образом, был получен заявленный фотосенсибилизатор.
Пример 3. Эффективность заявленного фотосенсибилизатора в отношении опухолевых клеток простаты (22Rv1).
Цель исследования
Целью исследования является оценка эффективности заявленного фотостабилизатора in vitro.
Материалы и методы
Для оценки эффективности заявленного фотостабилизатора in vitro были использована культура опухолевых клеток простаты (22Rv1). Данная культура проявляет сверхэкспрессию PSMA - рецепторов на поверхности.
Клетки рассевали в лунки плоскодонного 96-луночного микропланшета (Costar, США) в количестве 15×10 (22Rv1) клеток на лунку. Тестируемые соединения - заявленный фотосенсибилизатор (группа 1) и препарат «Радахлорин» в качестве положительного контроля (группа 2) вносили через 24 часа после посева, варьируя концентрацию заявленного фотосенсибилизатора от 0,07 до 17 мкМ, препарата «Радахлорин» - от 1,9 до 30 мкМ. Для оценки эффективности через 0,5, 1, 2, 4 и 6 часов инкубации с фотосенсибилизаторами клетки облучали галогеновой лампой через широкополосный фильтр КС-10 (λ≥620 нм). Плотность мощности составляла 16,2±0,7 мВт/см2, расчетная световая доза - 10 Дж/см2. После облучения клетки инкубировали в стандартных условиях в течение суток.
Отрицательным контролем послужили клетки, не подвергавшиеся воздействию. Выживаемость клеток оценивали с использованием колориметрического МТТ-теста [Carmichael J., DeGraff W.G., Gazdar A.F., Minna J.D., Mitchell J.B Evaluation of a tetrazolium-based semiautomated colorimetric assay: assessment of chemosensitivity testing. Canser Res. 47: 936-942; 1987], по результатам которого вычисляли величину ИК50, концентрацию ФС при которых после воздействия наблюдается 50% гибель клеток. Количественные параметры рассчитывали по результатам трех независимых тестов.
Для статистического анализа полученных результатов использовался критерий Стьюдента.
Результаты
При изучении эффективности заявленного фотосенсибилизатора в сравнении с препаратом «Радахлорин» выявлено, что оба ФС проявляют активность в отношении опухолевых клеток предстательной железы (Таблица 1). Максимальная эффективность заявленного фотосенсибилизатора (группа 1) определялась после 6 часовой инкубации ФС с клетками, препарата «Радахлорин» (группа 2) - через 4-6 часов инкубации. ИК50 для группы 1 для клеток 22Rv1 составила 1,2±0,1 мкМ, что, возможно, связано с высокой экспрессией ПСМА рецепторов у данной культуры клеток. Следует отметить, что препарат «Радахлорин» (группа 2) проявил более низкую эффективность на клетках 22Rv1 (ИК50=3,0±0,2 мкМ) по сравнению с заявленным фотосенсибилизатором.

* - значимое отличие (р<0,5) от группы 2 Выводы
Исходя из полученных данных можно сделать вывод о высокой эффективности (по сравнению с препаратом «Радахлорин») заявленного фотосенсибилизатора по отношению к опухолевым клеткам простаты (22Rv1), проявляющим сверхэкспрессию PSMA - рецепторов, что говорит о высокой эффективности заявленного фотосенсибилизатора при проведении ФДТ рака предстательной железы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фотосенсибилизатор и способ его получения | 2021 |
|
RU2772691C1 |
| ФОТОСЕНСИБИЛИЗАТОР БАКТЕРИОХЛОРИНОВОГО РЯДА ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2720806C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ МЕЛАНОМА В-16 МЫШЕЙ ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА С ПСМА-ЛИГАНДОМ | 2020 |
|
RU2739193C1 |
| Способ получения водорастворимого металлокомплекса хлорина е6 с медью | 2022 |
|
RU2810784C1 |
| КАРБОКСИЛАТНОЕ ПРОИЗВОДНОЕ ХЛОРИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2023 |
|
RU2822269C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ КАРЦИНОМА ЭРЛИХА МЫШЕЙ С ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА | 2022 |
|
RU2788766C2 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |
| ПРЕПАРАТ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2521327C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ СУБЪЕКТОВ, СТРАДАЮЩИХ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ | 2010 |
|
RU2440158C2 |
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2367434C1 |
Настоящее изобретение относится к фотосенсибилизатору для фотодинамической терапии рака предстательной железы. Фотосенсибилизатор имеет структурную формулу (1)
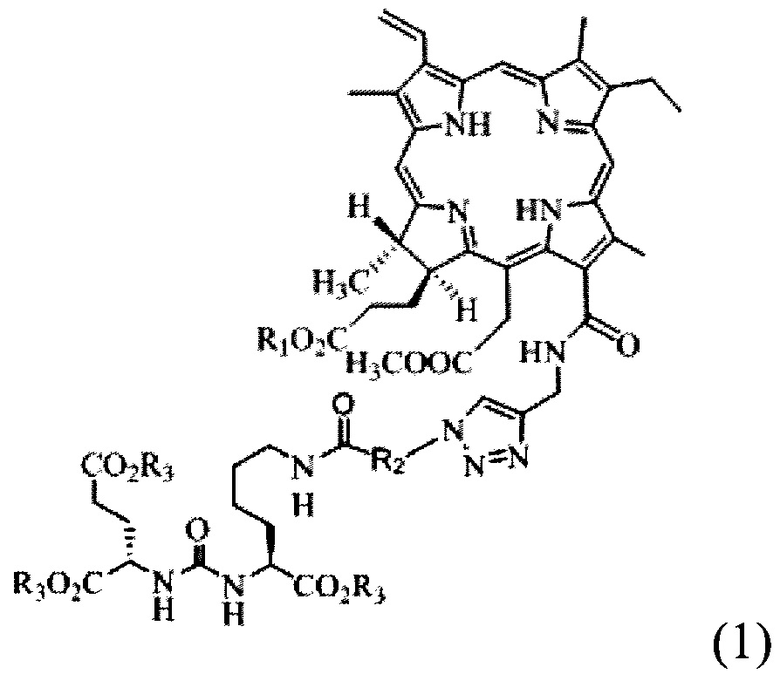 ,
,
где в качестве R1 может выступать водород (Н), натрий (Na), калий (К), С1-С2 - алкил, в качестве R2 может выступать соединение общей формулы СхН2х, где х=4÷17, в качестве R3 может выступать водород (Н), натрий (Na) или калий (К). Также предложены способ получения фотосенсибилизатора и лекарственное средство для лечения рака предстательной железы. Изобретение позволяет получить фотосенсибилизатор, который обладает высокой эффективностью при проведении ФДТ рака предстательной железы. 3 н. и 2 з.п. ф-лы, 1 табл., 3 пр.
1. Фотосенсибилизатор для фотодинамической терапии рака предстательной железы со структурной формулой (1)
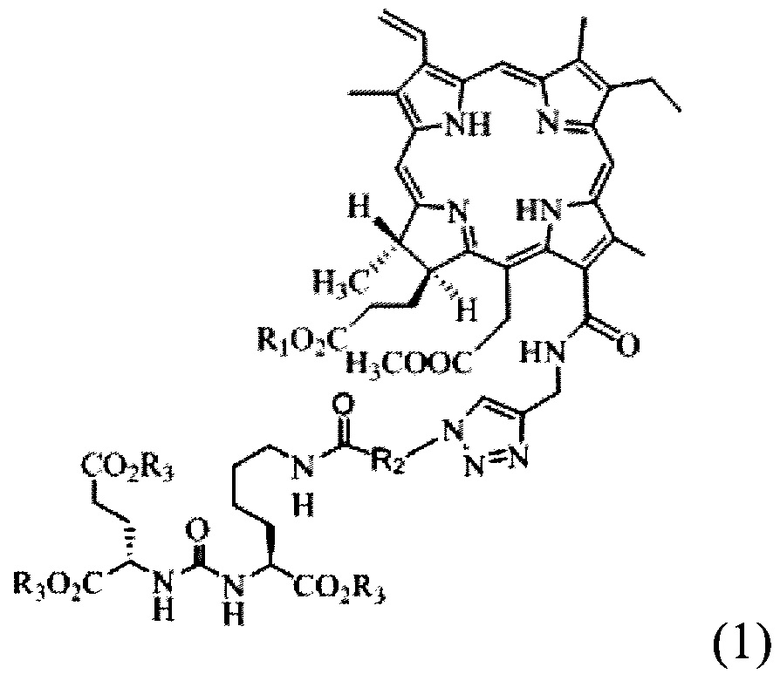
где в качестве R1 может выступать водород (Н), натрий (Na), калий (К), С1-С2 - алкил, в качестве R2 может выступать соединение общей формулы СхН2х, где х=4÷17, в качестве R3 может выступать водород (Н), натрий (Na) или калий (К).
2. Способ получения фотосенсибилизатора по п. 1, включающий:
- реакцию раскрытия циклопентанового кольца соединения со структурной формулой (2)
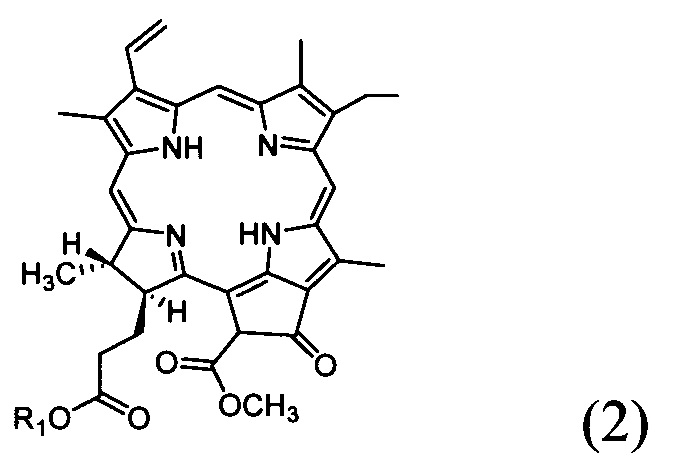
в органическом растворителе при нагревании с получением соединения с формулой (3);
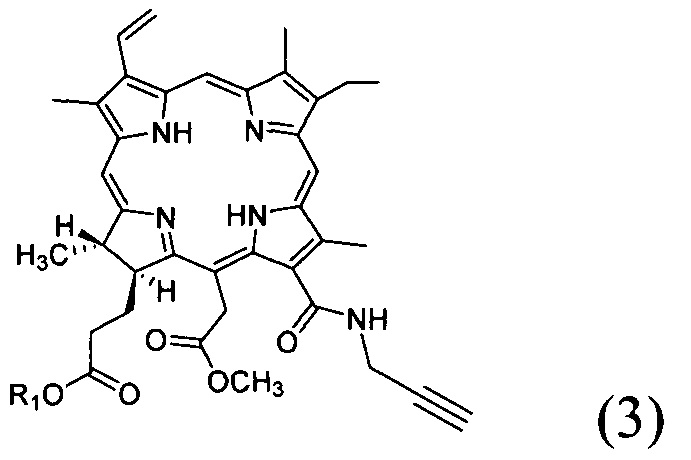
- добавление к соединению со структурной формулой (3) ацетата цинка с получением соединения со структурной формулой (4);
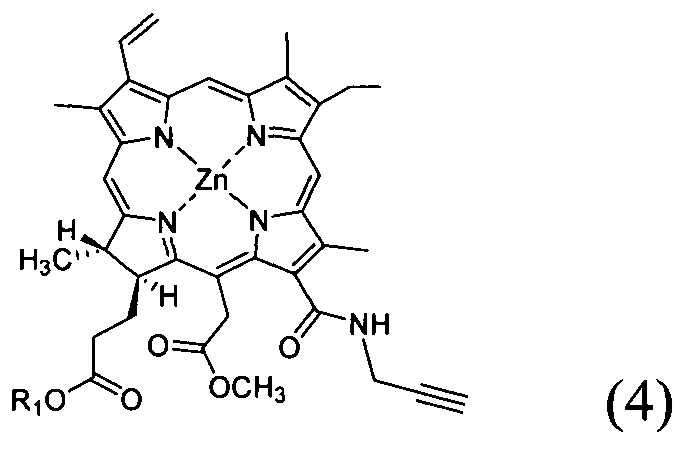
- добавление соединения со структурной формулой (5)
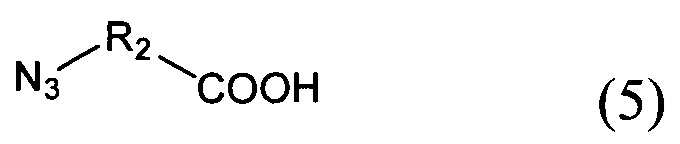
к соединению (6)

в органическом растворителе в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида с получением соединения со структурной формулой (7);
- воздействие на соединение со структурной формулой (7) трифторуксусной кислотой в органическом растворителе с получением соединения со структурной формулой (8);
- реакцию соединения со структурной формулой (4) с соединением со структурной формулой (8) в присутствии йодида меди с получением соединения со структурной формулой (9);
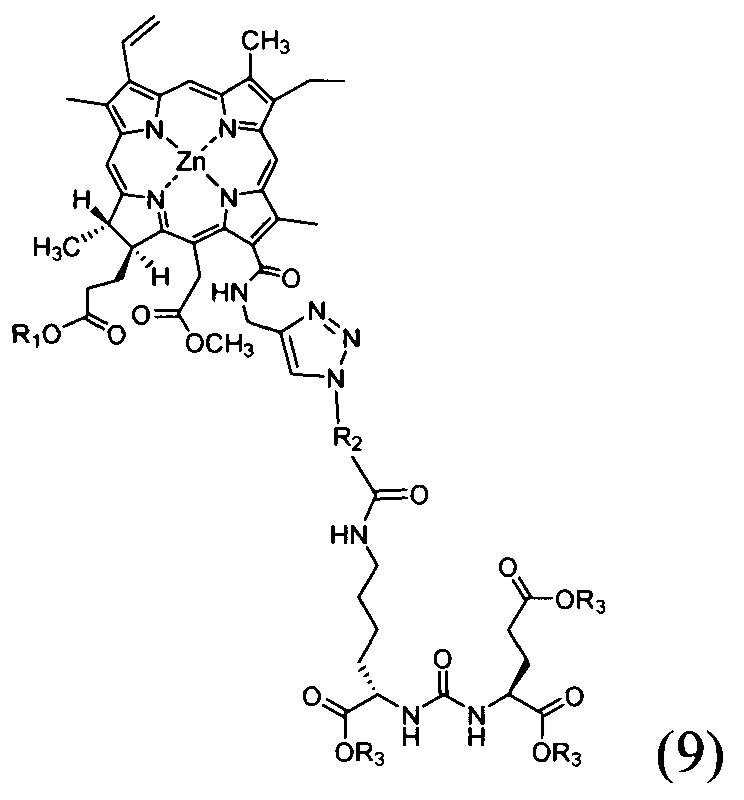
- воздействие на соединение со структурной формулой (9) трифторуксусной кислотой в диметилсульфоксиде с получением неочищенного соединения со структурной формулой (1);
- промывку неочищенного соединения со структурной формулой (1) с получением фотосенсибилизатора по п. 1,
где в качестве R1 может выступать водород (Н), натрий (Na), калий (К), C1-C2 - алкил, в качестве R2 может выступать соединение общей формулы СхН2х, где х=4÷17, в качестве R3 может выступать водород (Н), натрий (Na) или калий (К).
3. Способ по п. 2, отличающийся тем, что включает стадию лиофильного высушивания полученного фотосенсибилизатора по п. 1 с получением его кристаллической формы.
4. Лекарственное средство для лечения рака предстательной железы, включающее в себя фотосенсибилизатор по п. 1 и фармацевтически приемлемые добавки.
5. Лекарственное средство по п. 4, отличающееся тем, что в качестве фармацевтически приемлемых добавок используют изотонический раствор.
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2183956C1 |
| WO 2015171792 A1, 12.11.2015 | |||
| BREGADZE V.I | |||
| et al, Novel types of boronated chlorin e 6 conjugates via 'click chemistry', Appl | |||
| Organometal | |||
| Chem., 2009, v | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Разборное колесо | 1921 |
|
SU370A1 |
| PANCHENKO P.A | |||
| et al, A novel bacteriochlorin-styrylnaphthalimide conjugate for simultaneous photodynamic therapy and fluorescence imaging, Phys | |||
| Chem | |||
| Chem | |||
| Phys., 2017, v | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Фасонная торцевая фреза | 1929 |
|
SU30195A1 |
Авторы
Даты
2018-10-18—Публикация
2018-01-29—Подача