Изобретение относится к области биомедицины и направлено на создание «ростовой добавки», пригодной для культивирования клеток, в том числе на этапах получения клеточных продуктов и тканеинженерных конструкций, предназначенных для введения в организм человека.
Культивирование и наращивание клеток человека in vitro является начальным, промежуточным этапом или самостоятельной процедурой во многих сферах, и в частности:
1. культивирование и наращивание разных типов клеток для экспериментальных разработок;
2. культивирование и наращивание клеток гибридом с целью получения моноклональных антител;
3. культивирование и наращивание клеток разных типов (дифференцированных, прогениторных, стволовых) для целей клеточной терапии;
4. культивирование и наращивание клеток - как этап создания тканеинженерных конструкций для регенеративной медицины;
5. культивирование и наращивание клеток для биотехнологических целей (включая генетическую инженерию).
Культивирование клеток человека in vitro осуществляют в коммерческих питательных средах разных типов с добавками (supplements). Добавки делятся на 2 основных типа:
1) традиционно используемые как источники факторов роста, гормонов, витаминов -эмбриональная телячья сыворотка (далее - ЭТС);
2) специальные добавки для решения конкретных задач.
Одной из актуальных проблем регенеративной медицины является безопасность биомедицинских клеточных продуктов и тканеинженерных конструкций, использование которых способствовало бы восстановлению структуры и функции утраченных органов и тканей у пациентов без угрозы возникновения у них различных осложнений, в том числе иммунологических.
Для стандартизации и валидации процесса получения безопасных биомедицинских клеточных продуктов требуется разработка регламента их доклинических испытаний. К этому разделу относится и разработка технологий безопасного культивирования клеток, в частности, с использованием адекватных культуральных сред и добавок.
Традиционно в качестве ростовой добавки («supplement») для культивирования клеток используют ЭТС, которая считается комплексной смесью высоко- и низкомолекулярных биомолекул с физиологическим балансом стимулирующих и блокирующих факторов роста (ФР), с низким содержанием γ-глобулинов - ингибиторов роста и пролиферации клеток [Bieback K., 2013; Mojica-Henshaw М.P. et al., 2013]. Однако использование ЭТС как источника ксеногенных протеинов на этапах приготовления клеточных препаратов и тканеинженерных конструкций, предназначенных для введения человеку, в настоящее время не рекомендуется вследствие возможности аллергических реакций, а также переноса в организм человека вирусов, прионов и зоонозов [Flemming A. et al., 2011; Azouna N. et al., 2012; Vasanthan P. et al., 2014; Naaijkens B.A. et al., 2012; Chen B. et al., 2012; Griffiths S. et al., 2013; Warnke P.H. et al, 2013]. Так, в частности, показано, что при введении человеку ММСК, культивированных с ЭТС, вырабатываются антитела, опосредующие развитие реакции Артюса (Selvaggi et al, 1997). Возможная экспрессия главного комплекса гистосовместимости II типа (МНС II) в мультипотентных мезенхимальных стромальных клетках (ММСК) в присутствии ЭТС, по мнению ряда авторов, также ограничивает использование ЭТС в технологиях регенеративной медицины [Bieback K., 2013; Griffiths S. et al., 2013]. He исключено, что генетическая нестабильность ММСК ряда доноров in vitro тоже может быть индуцирована компонентами ЭТС [Crespo-Diaz R. et al., 2013].
Кроме того, известно, что состав ЭТС значительно варьирует по содержанию активных компонентов от лота к лоту, что не дает возможности стандартизовать ее по наиболее значимым компонентам (Flemming A. et al., 2011; Vasanthan P. et al., 2014; Naaijkens B.A. et al., 2012). Это часто создает трудности при подборе ЭТС для определенных клеточных линий, а в ряде случаев - при сопоставлении результатов, полученных при использовании разных лотов ЭТС.
На этапах разработки гуманизированных ростовых добавок к культуральным средам были апробированы экстракты различных тканей, биологические жидкости и бессывороточные среды с рекомбинантными ФР, однако удовлетворительные результаты получены не были [Seo J. et al., 2013; Vasanthan P. et al., 2014]. Аллогенные сыворотки в качестве замены ЭТС вызывали арест пролиферации и гибель ММСК (Shahdadfar et al., 2005). В аутологичных сыворотках ММСК пролиферировали адекватно, но делать ее дорого и непрактично (Kobayashi et al., 2005).
В последние годы внимание исследователей обращено к тромбоцитам - естественным источникам многих ФР (PDGF, изоформы АА, АВ, ВВ; TGFα1, -β; HGF; IGF-1; VEGF; EGF; FGFb), в частности, к лизату тромбоцитов (ЛТ) человека для замены ЭТС [Шанский Я.Д. и соавт., 2013; Naaijkens В. et al., 2012; Flemming A. et al., 2011; Azouna N. et al., 2012; Chen B. et al., 2012; Vasanthan P. et al., 2014; Ruggiu A. et al., 2013; Griffiths S. et al., 2013; Warnke P.H. et al., 2013].
Основными недостатками ЭТС, как ростовой добавки для культивирования клеток, предназначенных для введения человеку, являются:
- ЭТС - ксеногенный (в отношении человека) материал,
- возможность переноса с ЭТС инфекционных агентов, включая зоонозы, прионы и вирусы (в т.ч. нераспознанные),
- возможность переноса с ЭТС свободной ксеногенной ДНК,
- возможность переноса с ЭТС нежелательных метаболитов,
- возможность иммунологического ответа на ЭТС, в т.ч. аллергических реакций на ксеногенные компоненты,
- изменение экспрессии ряда маркеров в клетках человека, культивируемых в присутствии ЭТС,
- нестандартизированность ЭТС по функциональной активности,
- во многих странах, включая Россию, запрещено введение в организм (минуя желудочно- кишечный тракт) человека биологических клеточных продуктов, которые в процессе приготовления имели контакт с ксеногенными биологическими материалами.
Известен способ получения ЛТ из богатой тромбоцитами плазмы крови взрослых животных (WO 2006/137778 А1), в котором лизис тромбоцитов осуществляют добавлением к тромбоцитам в плазме растворимых солей кальция, либо деионизированной воды. Далее смесь центрифугируют и фильтруют.
Однако данный способ получения ЛТ, обогащенный солями кальция в использованных концентрациях, может быть токсичным для ряда клеточных культур. Кальций в среде культивирования может изменять функционирование клеток, как один из ключевых ионов-регуляторов жизнедеятельности.
Отличительные признаки (от предложенного нами способа) являются:
- используют периферическую кровь животных;
- способы дегрануляции тромбоцитов (для выхода в плазму ФР) - соли кальция или деионизированная вода.
Известен способ приготовления ЛТ и культуральной среды с ЛТ (ЕР 0413727 А1) из цельной крови животных для выращивания гибридом с целью получения антител. Отличия от нашего изобретения:
- используют периферическую кровь животных с бойни;
- получаемый ЛТ - ксеногенный, исключена лишь внутрисердечная пункция эмбриона коровы;
- способ разрушения и дегрануляции тромбоцитов - добавление Са+2.
Как и в предыдущем известном способе, полученный ЛТ, обогащенный солями кальция в использованных концентрациях, может быть токсичным для ряда клеточных культур. Кальций в среде культивирования может изменять функционирование клеток, как один из ключевых ионов-регуляторов жизнедеятельности.
Известен способ получения ростовой добавки из обогащенной тромбоцитами плазмы крови животных (US 5198357 А) для культивирования гибридомных клеток. ЛТ получают из цельной крови животных с раствором цитрата натрия для предотвращения свертывания. Способ лизиса - добавление кальция, что одновременно приводит к коагуляции фибриногена. Сепарацию производят путем центрифугирования, последующую стерилизацию - путем фильтрования. Используют как более дешевую альтернативу ЭТС.
Известен способ выделения ЛТ из ТМ, полученный путем афереза у доноров (CN 104673747 А). Общие с заявляемым способом черты получения ЛТ:
- для разрушения тромбоцитов используют несколько циклов замораживания (-80°C) - оттаивания (+37°C) ТМ;
- авторы доказывают, что несколько циклов замораживания/оттаивания дают лучший выход ФР;
- используют центрифугирование для освобождения от фрагментов тромбоцитов;
- индивидуальные ЛТ, полученные описанным способом, поддерживают рост клеток в сходной с ЭТС концентрацией (10%).
Известен способ получения ростовой добавки из обогащенной тромбоцитами плазмы крови (US 2012276632 Al), включающий температурный лизис тромбоцитов (замораживание/оттаивание).
В отличие от предлагаемого нами метода, авторы перед лизисом тромбоцитов в ТМ освобождаются от плазмы крови центрифугированием, разводя тромбоциты в среде, содержащей альбумин человеческой сыворотки, декстран и гидроксиэтилкрахмал, для восстановления осмолярности.
Известен способ изготовления и применения ЛТ (CN10467 3747-А-2015-06-03) из тромбомассы, полученной путем афереза. Лизис осуществляют путем однократного замораживания (-80°С) - оттаивания (+37°С) тромбомассы с последующей обработкой ультразвуком (100-400 вт, 3-6 секунд), повторяя последнюю процедуру от 5 до 15 раз. Далее ЛТ центрифугируют (для осаждения дебриса), освобождают от фибрина рекальцинацией (глюконатом кальция или хлористым кальцием) и используют ЛТ как ростовую добавку для культивирования ММСК. В полученном ЛТ определяют содержание VEGF, PDGF, заявляя их как наиболее значимые характеристики ЛТ для его функциональной активности.
Самым близким к заявляемому нами способу является способ приготовления композиции, содержащий лизат тромбоцитов (WO 2010/033605 А2 ((Compositions, containing platelet contents»). Приготовление ЛТ включает в себя не менее 2-х циклов замораживания (-80°С) - оттаивания (+37°С), последующее центрифугирование (2000-4000g, оптимально - 3000g) в течение 30 минут. Для стерилизации ЛТ осуществляют ультрафильтрацию (размер пор - 0,45 мкм и 0,2 мкм). Полученный ЛТ в концентрации 5-10% от объема культуральной среды используют в качестве ростовой добавки к средам для культивирования ММСК из жировой ткани (ЖТ), или фибробластов человека (ФЧ), или культур опухолевых клеток (глиомы), что обеспечивает длительную (более 30 дней) пролиферацию этих культур in vitro с динамикой нарастания клеточной популяции, сходной с таковой для 5-10% ЭТС.
Однако в предложенном способе оценку качества приготовленного ЛТ проводят по содержанию фактора роста сосудов VEGF - не менее 200 пг/мл. В предлагаемом нами способе стандартизацию проводят по функциональным свойствам.
Техническим результатом заявляемого изобретения является получение стандартизованных образцов нексеногенной ростовой добавки для культивирования клеток человека разных типов с функциональной активностью образцов, определяемой по скорости прироста тест-культур, различающейся не более чем на 10,0%.
Задачей изобретения является получение добавки к ростовой среде лизата тромбоцитов, полученного из тромбомассы для наращивания клеточной массы.
Указанный технический результат при осуществлении изобретения достигается за счет того, что так же, как в известном способе проводят нормирование образца ТМ до заданной концентрации тромбоцитов (1,75×109 тромбоцитов/мл) путем центрифугирования ТМ при 3130g в течение 40 минут при 20°С и ресуспендировании осадка в супернатанте заданного объема до концентрации тромбоцитов 1,75×109 тромбоцитов/мл, 3-кратный температурный лизис тромбоцитов путем замораживания
на сутки до -80°С и размораживания при +37°С, осаждение клеточного дебриса путем центрифугирования при 3130 g, 40 минут, 20°С, сбор супернатанта, микроскопический контроль при увеличении ×200 на наличие в поле зрения не более 3-х фрагментов тромбоцитов.
Особенность заявляемого способа заключается в том, что стандартизацию лизата тромбоцитов проводят путем пулирования, объединяя равные по объему образцы, полученные из тромбоцитарной массы не менее 12 доноров обеих тендерных групп, пулированный ЛТ центрифугируют при 3130g, 40 минут при 20°С, далее осуществляют ультрафильтацию пулированного образца на фильтрах 0,45 μкм или 0,22 μкм, после чего разливают по аликвотам требуемого объема и замораживают до -80°С до использования.
Изобретение поясняется подробным описанием, таблицами и иллюстрациями, на которых изображено:
Фиг. 1 - Относительное изменение оптической плотности (OD) раствора формазана культуры фибробластов человека (5-е сутки культивирования) при использовании образцов ЛТ и ЭТС, инактивированных в течение 1 часа при различных температурах (в %, относительно 37°С).
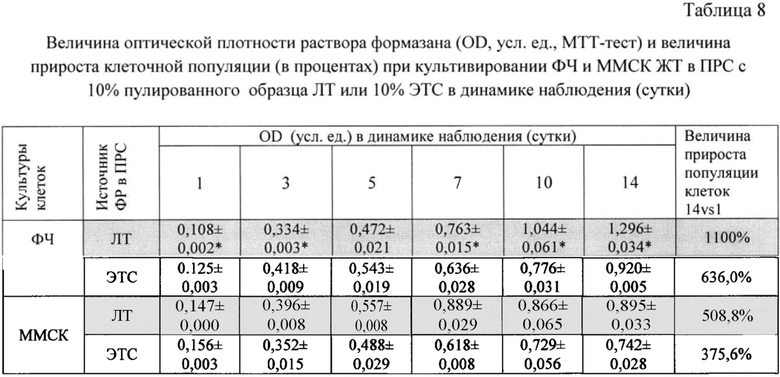
Фиг. 2 - Изменение оптической плотности раствора формазана (МТТ-тест) при культивировании ФЧ в ПРС, содержащей 10% пулированного образца ЛТ или 10% ЭТС.
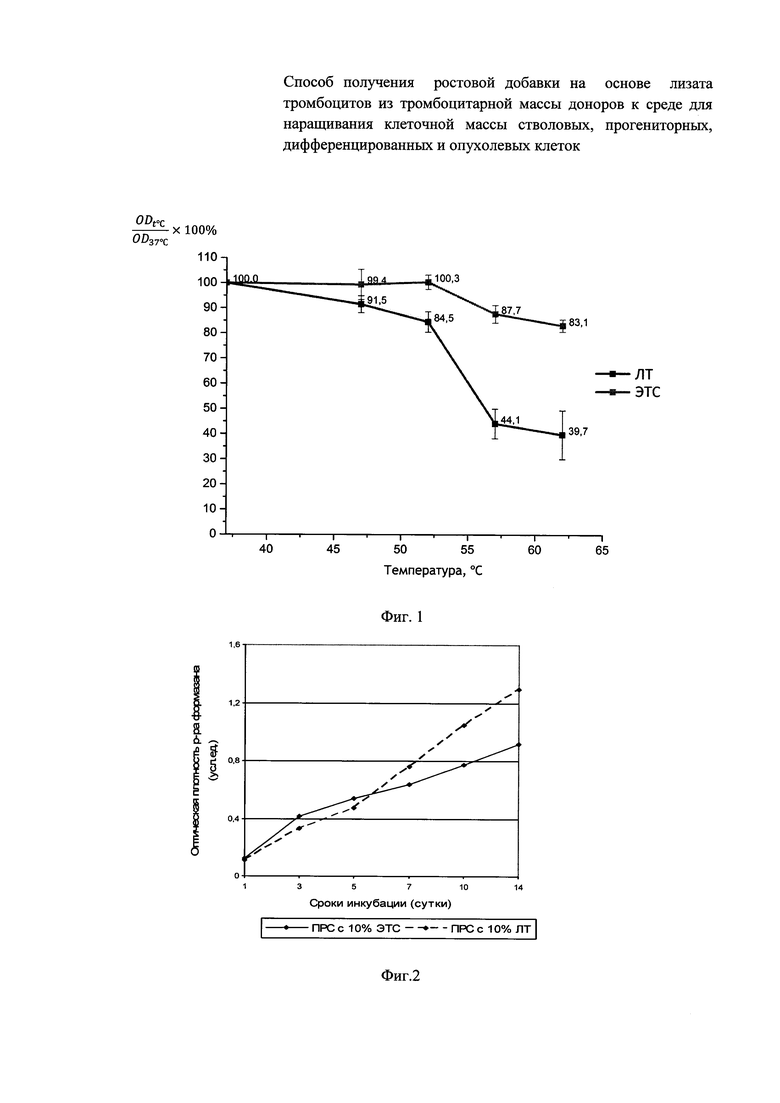
Фиг. 3 - Изменение оптической плотности раствора формазана (МТТ-тест) при культивировании ММСК в ПРС, содержащей 10% пулированного образца ЛТ или 10% ЭТС.
Способ осуществляют следующим образом.
Технологическая схема получения ЛТ
1. Материал для получения ЛТ - образцы ТМ доноров, полученный путем аппаратного афереза.
Процедура заготовки ТМ валидирована и предполагает контаминацию лейкоцитами в количестве не более 1×106 на дозу (~2×1011 тромбоцитов), что контролируется в соответствии с техническим регламентом «О требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии, а также с применением стандарта «Донорская кровь и ее компоненты: характеристики и контроль качества. IX. Тромбоциты, полученные методом афереза» (Общероссийская общественная организация «Российская ассоциация трансфузиологов»)».
2. Полученный образец ТМ доноров в стерильных условиях переносят в пробирку, тщательно перемешивают и отбирают аликвоту объемом 0,1 мл для определения концентрации тромбоцитов. Перед исследованием аликвоту разводят в 10 раз цитратным буфером ACD-A. Концентрацию тромбоцитов определяют с помощью автоматического гематологического анализатора (например, Sysmex КХ20, Япония).
3. Производят нормирование образца ТМ до заданной концентрации тромбоцитов (1,75×109 тромбоцитов/мл). Для этого ТМ центрифугируют в пробирке объемом 15 мл (например, Corning, США) при 3000 g в течение 40 мин при 20°C (например, центрифуга Eppendorf 5810R, Германия). Осадок тромбоцитов ресуспендируют в супернатанте рассчитанного объема, обеспечивающего конечную концентрацию тромбоцитов (1,75×109 тромбоцитов/мл).
4. Температурный лизис образца ТМ.
Для получения ЛТ - пробирку с образцом ТМ, нормированным по концентрации тромбоцитов, подвергают процедуре температурного лизиса: быстро замораживают при -80°C (низкотемпературный холодильник, например, Sanyo MDF-U500VX) и через 24 ч размораживают при +37°C (20-40 мин; термостат, например ТС-80М-2) до достижения указанной температуры. Процедуру повторяют трехкратно.
5. Центрифугирование образца ЛТ.
Для осаждения фрагментов тромбоцитов (клеточного дебриса) пробирку с образцом ЛТ центрифугируют при 3000g в течение 40 мин при 20°C с минимальной скоростью торможения (например, центрифуга Eppendorf 5810R, Германия). После завершения этапа центрифугирования собирают супернатант, представляющий собой ЛТ.
Представляем обоснование использования 3-х циклов замораживания и оттаивания и указанного режима центрифугирования.
Количество циклов замораживания/оттаивания в литературе варьирует, но очевидно, что оно должно быть минимизировано для сохранения структуры значимых компонентов. Поэтому с помощью световой микроскопии оценивали отсутствие неразрушенных тромбоцитов в образцах лизированной ТМ после 1, 2 и 3 циклов размораживания/оттаивания. Для отделения раствора, обогащенного ФР, от фрагментов тромбоцитов, были апробированы 6 режимов центрифугирования. В этих режимах варьировали такие показатели, как время центрифугирования (20, 30, 40 мин), температура (10, 20°C) и кратность центрифугирования (×1, ×2 и ×3) (табл. 1).

Выбор количества циклов замораживания/оттаивания для получения образцов ЛТ осуществляли в соответствии с визуальным и микроскопическим контролем супернатанта после окончания процедуры (прозрачность, наличие неразрушенных тромбоцитов и/или их фрагментов). Результаты наблюдений показали, что после 3 циклов замораживания/оттаивания наблюдается наименьшее количество неразрушенных тромбоцитов (табл. 2).
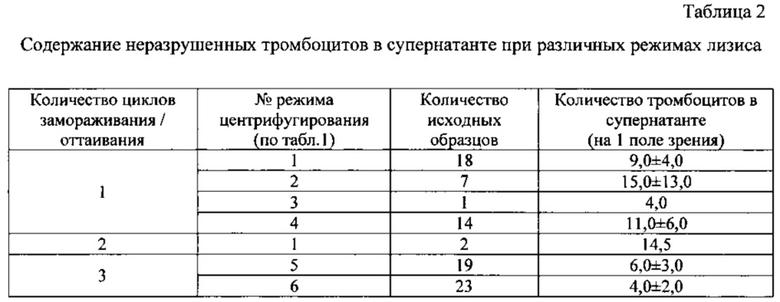
По результатам содержания тромбоцитов в супернатанте для оценки содержания ФР в ЛТ были отобраны следующие режимы центрифугирования:
- Режим №1: 3000 об/мин (1400g), 30 мин, 20°C, 3-кратно;
- Режим №2: 3000 об/мин (1600g), 20 мин, 20°C, 3-кратно;
- Режим №3: 4000 об/мин (3130g), 40 мин, 20°C, однократно.
Результаты определения концентрации ФР в образцах ЛТ, полученных при данных режимах, приведены в Таблице 3.
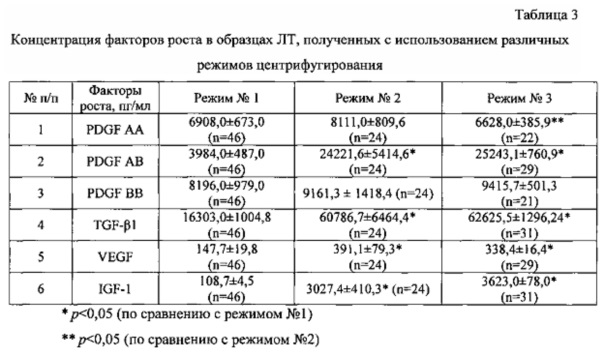
Из приведенных в табл. 3 данных можно видеть, что при использовании всех трех режимов центрифугирования в образцах ЛТ определяются все исследованные нами ФР. Однако при использовании режимов центрифугирования №2 и №3 наблюдается статистически достоверно более высокий выход факторов PDGF АВ, TGF-β1, VEGF, IGF-1, чем при использовании режима №1. Также значимые отличия наблюдаются для режимов №1 vs №3 в отношении содержания PDGF АА в супернатанте. Выход фактора PDGF АА не различался значимо при режимах №1 vs №2, №2 vs №3 (р<0,05). Содержание фактора PDGF ВВ в супернатанте не различалось значимо для всех трех режимов центрифугирования. Выход PDGF АВ, TGF-β, VEGF и IGF-1 не различался значимо при режимах центрифугирования №2 и №3 и был достоверно выше, чем при использовании режима №1.
Таким образом, режимы центрифугирования №2 и №3 обеспечивают наиболее высокое и сходное содержание исследованных нами ФР в супернатанте после лизиса тромбоцитов и осаждения их фрагментов. В то же время, режим №3 требует меньших затрат времени на проведение операции центрифугирования (1 цикл центрифугирования в течение 40 мин vs 3 циклов центрифугирования в течение 20 мин).
6. Микроскопический контроль образца ЛТ
Пробу образца ЛТ оценивают под световым микроскопом при увеличении ×200 на наличие/отсутствие видимых нелизированных тромбоцитов и/или их фрагментов. Очистку считают адекватной при наличии в поле зрения не более 3 фрагментов тромбоцитов.
7. Пулирование образцов ЛТ
Обоснование принципа
Установлено, что образцы ЛТ и ЭТС существенно различаются по содержанию ряда биохимических и гормональных показателей и, главное, по содержанию основных ФР, которые считались ранее ответственными за активирующую способность ЭТС как ростовой добавки. Так, содержание ФР (TGF-β, VEGF, PDGF АА, PDGF АВ, IGF-1, FGFb) в образцах ЛТ было в десятки, а для отдельных ФР в сотни раз выше, чем в образцах ЭТС (табл. 3). Пулы образцов ЛТ от мужчин и женщин обладали сходной способностью активировать пролиферацию клеток, несмотря на существенные различия в содержании женских и мужских половых гормонов. Кроме того, нами установлены различия в термочувствительности образцов ЭТС и ЛТ (Фиг. 1). Это позволило сделать заключение, что за функциональные свойства ЛТ и ЭТС как ростовых добавок ответственны различные коктейли факторов.
Поэтому в основу принципа пулирования мы положили функциональные свойства ЛТ как ростовой добавки - его способность обеспечивать пролиферацию иммортализованных фибробластов кожи человека (ФЧ, штамм 1608h TERT, ФГБУН «Институт молекулярной биологии В.А. Энгельгардта» РАН), задав условие, что по этому признаку пулы ЛТ не должны отличаться более чем нам 10%.
Выбранный нами принцип пулирования образцов ЛТ был основан, таким образом, на оценке пролиферативной активности модельной культуры клеток (ФЧ) в присутствии ЛТ (как ростовой добавки) от индивидуальных доноров. Оценочной величиной служила скорость роста культуры клеток ФЧ in vitro в экспоненциальной фазе роста, наблюдавшейся на начальном этапе культивирования.
В исследовании влияния ЛТ (как ростовой добавки) на пролиферацию ФЧ in vitro средой культивирования служила DMEM с добавлением глютамина 0,58 мг/мл, гентамицина 1,25 мкг/мл, гепарина 2 МЕ/мл. Как ростовую добавку использовали образцы лизатов тромбоцитов от индивидуальных доноров (15 мужчин и 13 женщин) в концентрации 5%, а также образец 5% пулированного ЛТ (от указанных 28 доноров). Культивирование было проведено в 96-луночных планшетах Costar (США) в течение 1-7 суток при плотности посева клеток 1,5×104 клеток/см2. Жизнеспособность клеток оценивали с помощью МТТ-теста (количество повторов каждой пробы - 5).
По результатам измерения оптической плотности (OD) раствора формазана в МТТ-тесте вычислены скорости роста популяции ФЧ в экспоненциальной фазе в присутствии индивидуальных образцов лизатов по формуле
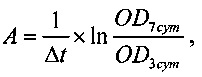
где А - скорость роста популяции клеток (сут-1), Δt - интервал времени культивирования в экспоненциальной фазе роста (4 суток), OD - оптическая плотность раствора формазана на 3-й и 7-е сутки культивирования.
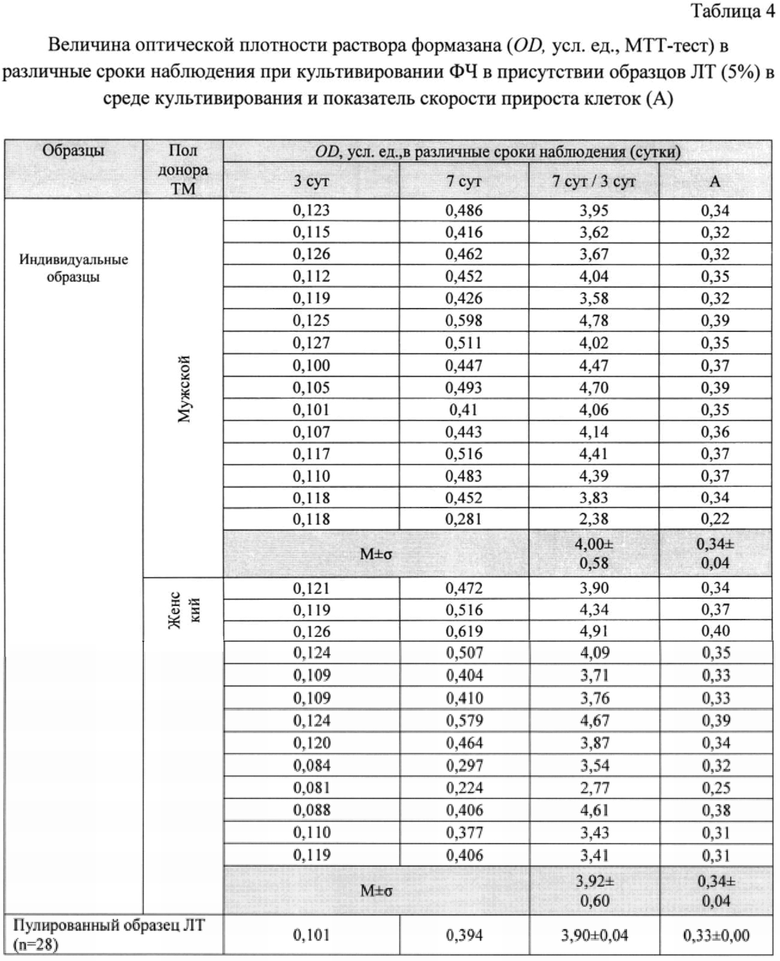
В таблице 4 приведены рассчитанные по получаемым OD значения «А» для индивидуальных доноров, средние значения генеральной совокупности (Aср. ген.) и генеральные стандартные отклонения (σген).
Данные таблицы 4 свидетельствуют о том, что скорость прироста клеток в присутствии индивидуальных образцов ЛТ в отдельных случаях отличалась примерно в 2 раза: минимальное соотношение OD на 7-е сутки к таковой на 3-й составило 2,77, а максимальное - 4,91. Соответствующие индивидуальные скорости находились в диапазоне 0,25-0,4.
Средний прирост культуры ФЧ за 4 суток в присутствии пулированного 5% ЛТ (от 28 доноров) практически совпал с рассчитанными средними для индивидуальных образцов ЛТ мужчин и женщин - 3,90±0,04 vs 4,00±0,58 vs 3,92±0,60. Очевидно, что пулирование с целью стандартизации можно проводить, используя меньшее количество индивидуальных образцов, что математически обосновано ниже.
Далее рассчитывали количество образцов ЛТ для пулирования, исходя из следующих положений.
Если имеются 2 пула, состоящие из n образцов каждый и выбранные из одной нормально распределенной генеральной совокупности, то стандартное отклонение σразн разности
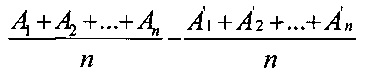
может быть вычислено по формуле
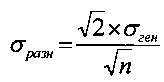
Для того чтобы эта разность не превосходила по абсолютной величине с вероятностью 0,95 значение, равное 10% от Аср.ген, требуется выполнение условия
1,96×σразн≤0,1×Aср,ген
или
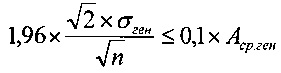
Отсюда количество образцов в пуле, соответствующее выполнению условия, вычисляется по формуле
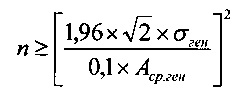
В нашем случае:
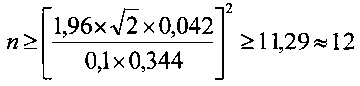
Таким образом, для того чтобы скорости прироста популяции ФЧ in vitro в присутствии образца пулированного ЛТ отличались от средней (по группе индивидуальных образцов ЛТ) скорости прироста не более чем на 10,0%, требуется объединять не менее 12 индивидуальных образцов ЛТ. Так как скорости прироста ФЧ в присутствии образцов ЛТ мужчин значимо не отличаются от таковых в присутствии образцов ЛТ женщин, для пулирования можно брать образцы обеих тендерных групп.
Учитывая вышесказанное, при пулировании ЛТ объединяют равные (по объему) образцы, полученные из ТМ 12 доноров. Повторяют центрифугирование по n5.
7. Микрофильтрация и аликвотирование образцов ЛТ
ЛТ подвергают ультрафильтрации (фильтры 0,45 мкм и 0,22 мкм) и разливают в стерильные пластиковые криопробирки (например, Corning, США) по аликвотам от 100 до 500 мкл, маркируют с указанием номера образца, даты изготовления и объема образца ЛТ и замораживают до использования (-80°C).
Пример конкретного исполнения №1
1. Заготовка образцов тромбоцитарной массы доноров
В стерильных условиях методом аппаратного тромбоцитафереза получено 12 индивидуальных образцов тромбоцитарной массы (ТМ, 6 мужчин, 6 женщин). Перед процедурой заготовки ТМ доноры проходили обследование на наличие ВИЧ I и II типа, HBs-антигена, вируса HCV, возбудителя сифилиса. Также был осуществлен клинический анализ крови.
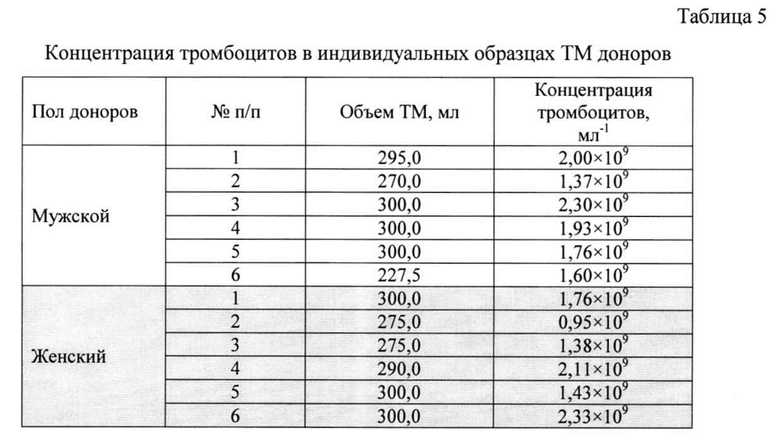
Через 24 часа после процедуры тромбоцитафереза образцы ТМ доноров в специальных пластиковых мешках помещали в транспортировочный контейнер и переносили в лабораторию с прилагаемой сопроводительной информацией (ФИО донора, пол, возраст, дата заготовки ТМ, результаты лабораторных исследований), где в асептических условиях (ламинарный бокс 2-класса защиты) тщательно перемешивали и переносили в пластиковые пробирки (например, Corning, США), примерно по 13,5 мл. Объем полученной ТМ доноров варьировал от 228 до 330 мл (табл. 5).
2. Определение концентрации тромбоцитов в образцах ТМ
Производили определение концентрации тромбоцитов в образце ТМ каждого донора. Для этого тромбоциты ресуспендировали в указанных пробирках путем тщательного перемешивания с использованием механической пипетки на 5,0 мл (например, Eppendorf, Biohit). Далее отбирали пробу ТМ каждого донора объемом 50,0 мкл для определения в ней концентрации тромбоцитов и переносили в пластиковую пробирку (например, Eppendorf) объемом 0,5 или 1,0 мл. В пробирку с пробой добавляли 450 мкл цитратного буфера ACD-A для получения рабочего разведения пробы 1:10. Разведенную пробу вносили в лабораторный анализатор (например, Sysmex КХ21) и измеряли концентрацию тромбоцитов (табл. 5).
3. Нормирование образцов ТМ по количеству тромбоцитов
Образцы ТМ в указанных закрытых пробирках помещали в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин при 20°C для осаждения тромбоцитов.
Нормирование тромбоцитов производили в расчете на стандартную концентрацию: рассчитывали объем супернатанта для разведения в нем осадка тромбоцитов, необходимый для достижения концентрации 1,75×109 тромбоцитов/мл. При концентрации тромбоцитов меньше заданной (образцы ТМ от доноров - мужчин №№2, 6 и 2, 3 и 5 доноров - женщин), удаляли лишний объем супернатанта и ресуспендировали осадок тромбоцитов в нужном для достижения указанной концентрации объеме. При концентрации тромбоцитов больше заданной (образцы №1, 3, 4, 5 от доноров - мужчин и 1, 4, 6 от доноров - женщин) ТМ разводили плазмой, аналогичной по составу бесклеточной фракции ТМ.
4. Температурный лизис образцов ТМ
Образцы ТМ доноров, нормированные по концентрации тромбоцитов, в указанных закрытых пробирках переносили в низкотемпературный холодильник (например, Sanyo) и выдерживали при температуре -80°C в течение 1 суток. По истечении указанного времени пробирки переносили в термостат (например, ТС-80М-2) и размораживали содержимое пробирок при +37°С в течение 20-30 мин. Циклы замораживания/оттаивания повторяли 3 раза.
5. Центрифугирование образцов ЛТ
Для освобождения образцов лизированной тромбомассы от фрагментов тромбоцитов производили их центрифугирование. Пробирки с образцами ЛТ переносили в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин для осаждения фрагментов тромбоцитов. Собирали супернатант из каждой пробирки.
6. Микроскопический контроль образцов ЛТ доноров осуществляли под световым микроскопом при увеличении ×200, оценивая на наличие/отсутствие видимых нелизированных тромбоцитов и/или их фрагментов. Содержание частиц клеточного дебриса в пробах ЛТ от 12 доноров не превосходило 2.
7. Пулирование, микрофильтрация и аликвотирование образцов ЛТ доноров
На заключительном этапе производили пулирование образцов ЛТ доноров, пользуясь математической выкладкой о количестве образцов ЛТ в пуле.
Для этого равные объемы 12 образцов ЛТ в стерильных условиях объединяли путем переноса с помощью механической лабораторной пипетки указанного типа в пластиковые пробирки объемом 15 мл (например, Corning, США).
Образец пулированного ЛТ в пробирке помещали в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин для дополнительного осаждения остаточного дебриса. Пробирку извлекали из центрифуги и в стерильных условиях осуществляли ультрафильтрацию супернатанта, последовательно через фильтры 0,45 мкм и 0,2 мкм (например, Corning, США) в пробирку аналогичного типа. Далее образец пулированного ЛТ разливали в стерильные пробирки по аликвотам (от 100 до 500 мкл), маркировали и замораживали при -80°С.
7. Проверка функциональной активности образца пулированного ЛТ на модели культивирования перевивной клеточной линии остеосаркомы человека (MG-63) и ФЧ
Эксперименты in vitro по оценке динамики роста культур MG-63 с использованием пулированного образца ЛТ доноров (n=12) и образца ЭТС (РАА, Австрия, лот № А10106-0671) в качестве ростовых добавок к среде культивирования состава: среда DMEM (например, ПанЭко, Россия), глутамин (0,65 мг/мл, например, ПанЭко, Россия), буферный раствор HEPES (20 мМ, например, ПанЭко, Россия), гепарин (2 ЕД/мл), осуществляли в 96-луночных планшетах (например, Corning, США) с плотностью посева 5×103 кл./лунка и со сменой среды дважды в неделю. На сроках культивирования 1, 3, 6 суток определяли
жизнеспособность клеток с помощью МТТ-теста (МТТ, Sigma, США). Для проведения МТТ-теста по окончании срока культивирования из каждой лунки отбирали по 100 мкл среды и вносили по 25 мкл раствора МТТ в концентрации 5 мг/мл. Через 3 ч инкубации (5% СО2, 37°C) из каждой лунки полностью удаляли среду и производили растворение образовавшегося формазана с помощью изопропилового спирта (200 мкл/лунку). От осадка, образующегося в результате преципитации белков в изопропиловом спирте, освобождались центрифугированием планшет в течение 10 мин при 3000 об/мин (например, Jouan, Франция). Далее из каждой лунки переносили по 100 мкл супернатанта в 96-луночный планшет для спектрофотометрии (например, Costar, США) и оценивали оптическую плотность раствора формазана на спектрофотометре FC (например, Thermoscientific, США) при длине волны 540 нм. В качестве контроля использовали ПРС без клеток.
На основании результатов МТТ-теста рассчитывали величину прироста популяции клеток А (в процентах) в конкретный срок наблюдения по формуле:
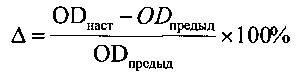
где ОDнастыд - оптическая плотность раствора формазана в условных единицах в конкретный срок эксперимента, ODпредыд- оптическая плотность раствора формазана в предыдущий срок эксперимента. Результаты оценки функциональной активности клеток при культивировании приведены в табл. 6.
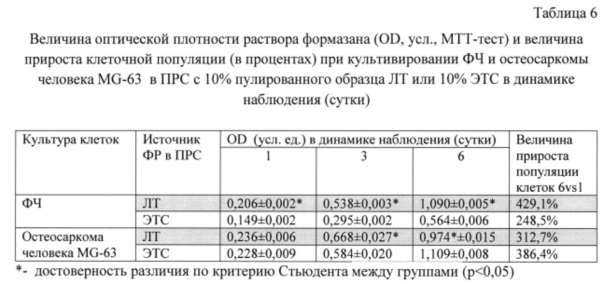
Показано, что при данном способе пулирования образцов ЛТ популяция ФЧ при культивировании в ПРС, обогащенной 10% ЛТ, эффективно нарастает и, начиная с 3-х суток наблюдения статистически достоверно превышает популяцию фибробластов в ПРС с 10% ЭТС. Так, показатель OD раствора формазана на 6-е сутки культивирования ФЧ в ПРС с 10% ЛТ (пул от 12 доноров) составил 1,090 усл. ед., величина прироста популяции ФЧ - 429% vs 0.564 усл. ед. и 248% при культивировании клеток в ПРС с 10% ЭТС соответственно (Табл. 6).
Скорость пролиферации клеток линии остеосаркомы человека MG-63 при условии ее культивирования в ПРС с 10% пулированного ЛТ доноров или в ПРС с 10% ЭТС при плотности посева 5 тыс. кл. на лунку практически не отличалась: величина OD раствора формазана составляла на 5 сутки 0,974 усл. ед., величина прироста 313% vs 1,109 усл. ед. и 386%, для ПРС с 10% пула ЛТ и ПРС с 10% ЭТС соответственно (Табл. 6).
Пример конкретного исполнения 2
Для культивирования ФЧ и ММСК, выделенных их жировой ткани (ЖТ) человека (пассаж 4), был приготовлен образец пулированного ЛТ из ТМ других 12 доноров.
1. Заготовка образцов тромбоцитарной массы доноров
В стерильных условиях методом аппаратного тромбоцитафереза было получено 12 индивидуальных образцов ТМ (6 мужчин, 6 женщин). Перед процедурой заготовки ТМ доноры проходили обследование на наличие ВИЧ I и II типа, HBs-антигена, вируса HCV, возбудителя сифилиса. Также был осуществлен клинический анализ крови.
Через 24 часа после процедуры тромбоцитафереза образцы ТМ доноров в специальных пластиковых мешках помещали в транспортировочный контейнер и переносили в лабораторию с прилагаемой сопроводительной информацией (ФИО донора, пол, возраст, дата заготовки ТМ, результаты лабораторных исследований), где в асептических условиях (ламинарный бокс 2-класса защиты) тщательно перемешивали и переносили в пластиковые пробирки (например, Corning, США) приметно по 13,5 мл. Объем полученной ТМ данных доноров варьировал от 249 до 330 мл (табл. 7).
2. Определение концентрации тромбоцитов в образцах ТМ
Производили определение концентрации тромбоцитов в образце ТМ каждого донора. Для этого тромбоциты ресуспендировали в указанных пробирках путем тщательного перемешивания с использованием механической пипетки на 5,0 мл (например, Eppendorf, Biohit). Далее отбирали пробу ТМ каждого донора объемом 50,0 мкл для определения в ней концентрации тромбоцитов и переносили в пластиковую пробирку (например, Eppendorf) объемом 0,5 мл или 1,0 мл. В пробирку с пробой добавляли 450 мкл цитратного буфера ACD-A для получения рабочего разведения пробы 1:10. Разведенную пробу вносили в лабораторный анализатор (например, Sysmex КХ21) и измеряли концентрацию тромбоцитов (табл. 7).

3. Нормирование ТМ по количеству тромбоцитов
ТМ в указанных закрытых пробирках помещали в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин при 20°C для осаждения тромбоцитов.
Нормирование тромбоцитов производили в расчете на стандартную концентрацию: рассчитывали объем супернатанта для разведения в нем осадка тромбоцитов, необходимый для достижения концентрации 1,75×109 тромбоцитов/мл. При концентрации тромбоцитов меньше заданной (образцы ТМ от доноров-мужчин №№11 и 12 и №№10 и 12 от доноров-женщин) удаляли лишний объем супернатанта и ресуспендировали осадок тромбоцитов в нужном для достижения указанной концентрации объеме. При концентрации тромбоцитов больше заданной (образцы №№7, 8, 9, 10 от доноров - мужчин и №№7, 8, 9, 11 от доноров - женщин) ТМ разводили плазмой, аналогичной по составу бесклеточной фракции ТМ.
4. Температурный лизис образцов ТМ
Образцы ТМ доноров, нормированные по концентрации тромбоцитов, в указанных закрытых пробирках переносили в низкотемпературный холодильник (например, Sanyo) и выдерживали при температуре -80°C в течение 1 суток. По истечении указанного срока пробирки переносили в термостат (например, ТС-80М-2) и размораживали содержимое пробирок при +37°C в течение 20-30 мин. Циклы замораживания/оттаивания повторяли 3 раза.
5. Центрифугирование ЛТ
Для освобождения образцов лизированной ТМ от фрагментов тромбоцитов производили их центрифугирование.
Пробирки с образцами ЛТ переносили в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин для осаждения фрагментов тромбоцитов. Собирали супернатант из каждой пробирки.
6. Микроскопический контроль образцов ЛТ доноров осуществляли под световым микроскопом при увеличении ×200, оценивая на наличие/отсутствие видимых нелизированных тромбоцитов и/или их фрагментов. Содержание частиц клеточного дебриса в пробах ЛТ от 12 доноров не превосходило 2.
7. Пулирование, микрофильтрация и аликвотирование образцов ЛТ доноров.
На заключительном этапе производили пулирование образцов ЛТ доноров, пользуясь математической выкладкой о количестве образцов ЛТ в пуле.
Для этого равные объемы 12 образцов ЛТ в стерильных условиях объединяли путем переноса с помощью механической лабораторной пипетки указанного типа в пластиковые пробирки объемом 15 мл (например, Corning, США).
Образец пулированного ЛТ в пробирке помещали в лабораторную центрифугу (например, Eppendorf 5810R, Швеция) и центрифугировали при 3130g в течение 40 мин для дополнительного осаждения остаточного дебриса. Пробирку извлекали из центрифуги и в стерильных условиях фильтровали супернатант, представляющий собой очищенный ЛТ, последовательно через фильтры 0,45 мкм и 0,2 мкм (Corning, США) в пробирку аналогичного типа. Далее образец пулированного ЛТ разливали в стерильные пробирки по аликвотам (от 100 до 500 мкл), маркировали и замораживали при -80°С.
8. Проверка функциональной активности образца пулированного ЛТ на модели ФЧ и ММСК из ЖТ человека.
Эксперименты in vitro по оценке динамики роста культур ФЧ и ММСК ЖТ человека проводили с использованием 10% пулированного образца ЛТ доноров (n=12) и 10% образца ЭТС (РАА, Австрия, лот № А10106-0671) в качестве ростовых добавок к среде культивирования ФЧ состава: среда DMEM (например, ПанЭко, Россия), глутамин (0,65 мг/мл, например, ПанЭко, Россия), буферный раствор HEPES (20 мМ, например, ПанЭко, Россия), гепарин (2 ЕД/мл); к среде культивирования ММСК: среда DMEM/F12 (например, ПанЭко, Россия), глутамин (0,65 мг/мл, например, ПанЭко, Россия), буферный раствор HEPES (20 мМ, например, ПанЭко, Россия), гепарин (2 ЕД/мл). Культивирование клеток осуществляли в 96-луночных планшетах (например, Corning, США) с плотностью посева 2,5×103 кл./лунка (ФЧ) и 5×103 кл./лунка (ММСК) со сменой среды дважды в неделю. На сроках культивирования 1, 3, 5, 7, 10 и 14 суток определяли жизнеспособность клеток с помощью МТТ-теста. Для проведения МТТ-теста по окончании срока культивирования из каждой лунки отбирали по 100 мкл среды и вносили по 25 мкл раствора МТТ в концентрации 5 мг/мл. Через 3 ч инкубации (5% СО2, 37°C) из каждой лунки полностью удаляли среду и производили растворение образовавшегося формазана с помощью изопропилового спирта (200 мкл/лунку). От осадка, образующегося в результате преципитации белков в изопропиловом спирте, освобождались центрифугированием планшет в течение 10 мин. при 3000 об/мин (например, Jouan, Франция). Далее из каждой лунки переносили по 100 мкл супернатанта в 96-луночный планшет для спектрофотометрии (например, Costar, США) и оценивали оптическую плотность раствора формазана на спектрофотометре FC (например, Thermoscientific, США) при длине волны 540 нм. В качестве контроля использовали ПРС без клеток.
На основании результатов МТТ-теста рассчитывали величину прироста популяции клеток А (в процентах) в конкретный срок наблюдения по формуле:
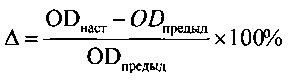
где ODнаст - оптическая плотность раствора формазана в условных единицах в конкретный срок эксперимента, ODпредыд - оптическая плотность раствора формазана в предьщущий срок эксперимента. Результаты оценки функциональной активности клеток при культивировании приведены в таблице 8 и на фиг. 2, 3.
Выявлена высокая скорость клеточной экспансии как ФЧ, так и ММСК человека при их культивировании на протяжении 14 суток в ПРС, обогащенной 10% пулированного образца ЛТ: величина OD раствора формазана для ФЧ на 14 сутки эксперимента составила 1,296 усл. ед., показатель прироста клеточной популяции за весь период наблюдения 1100% vs 0,920 усл. ед. и 636% при использовании ПРС с 10% ЭТС, соответственно (статистически достоверная разница, р<0,05). Для ММСК эти показатели составили 0,895 усл. ед. и 509% vs 0,895 усл. ед. и 375% (ПРС с 10% ЭТС), соответственно (Табл. 8, Фиг. 2, 3).
Заявленный способ позволил разработать технологию получения и пулирования ЛТ из тромбоцитарной массы (ТМ) доноров как стандартизированную по функциональной активности нексеногенную ростовую добавку для культивирования клеток человека разных типов (стволовых, прогениторных, дифференцированных, опухолевых).
Использование способа в биологических исследованиях и медицинской практике позволит:
- избежать контакта культивируемых in vitro биомедицинских клеточных продуктов, предназначенных для введения человеку с диагностическими, профилактическими или лечебными целями, с ксеногенными компонентами, и исключить инфицирования агентами разных типов, аллергических и других нежелательных реакций;
- культивировать клетки человека (стволовые, прогениторные, дифференцированные опухолевые, гибридомы, ооциты, в том числе в рамках ЭКО, и эндотелиальные прогениторы) для диагностических или лечебных или исследовательских целей в физиологическом микроокружении, что обеспечит сохранность их иммунофенотипа и функциональных характеристик;
- обеспечить повторяемость и возможность сопоставления результатов, полученных в разных сериях экспериментов при культивировании клеток in vitro, что было невозможно при использовании в качестве ростовых добавок разных лотов ЭТС и разных образцов ЛТ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРАЛЬНОЙ РОСТОВОЙ ДОБАВКИ НА ОСНОВЕ ЛИЗАТА ТРОМБОЦИТОВ ЧЕЛОВЕКА | 2017 |
|
RU2664478C2 |
| Биотрансплантат для лечения дисплазии суставов и способ его получения | 2017 |
|
RU2659204C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРОЙ РЕАКЦИИ ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА ПОСЛЕ ТРАНСПЛАНТАЦИИ АЛЛОГЕННОГО КОСТНОГО МОЗГА | 2010 |
|
RU2454247C1 |
| Способ получения аутологичного лизата тромбоцитов в качестве основы для клеточных биомедицинских препаратов ветеринарной медицины | 2020 |
|
RU2732150C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛИЗАТА ТРОМБОЦИТОВ С ВЫСОКИМ СОДЕРЖАНИЕМ ФАКТОРОВ РОСТА | 2020 |
|
RU2739515C1 |
| Средство, способное стимулировать пролиферацию клеток культур МСК - мезенхимальных стволовых клеток из костного мозга донора и ФЭЧ - эмбриональных фибробластов человека | 2022 |
|
RU2794155C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МАТРИКСА ДЛЯ КУЛЬТИВИРОВАНИЯ И РАЗМНОЖЕНИЯ КЛЕТОЧНОЙ МАССЫ | 2009 |
|
RU2413000C1 |
| Роботизированная медицинская система и манипулятор для 3D-биопечати для полнослойного закрытия кожного дефекта | 2023 |
|
RU2814949C1 |
| Способ создания клеточных трансплантатов для лечения сахарного диабета 1-го типа | 2020 |
|
RU2765913C1 |
| СПОСОБ ОЦЕНКИ ВЛИЯНИЯ НАНОЧАСТИЦ НА ЖИЗНЕДЕЯТЕЛЬНОСТЬ КЛЕТОЧНЫХ КУЛЬТУР | 2011 |
|
RU2460997C1 |
Изобретение относится к области биомедицины и касается способа получения ростовой добавки к среде для культивирования клеток человека из тромбоцитарной массы доноров. Представленный способ включает нормирование образца тромбоцитарной массы до заданной концентрации тромбоцитов 1,75×109 кл/мл посредством центрифугирования тромбоцитарной массы при 3130 g в течение 40 минут при 20°С и ресуспендирования осадка в супернатанте заданного объема до указанной концентрации тромбоцитов. Трехкратный температурный лизис нормированного образца путем замораживания на сутки до -80°С и размораживания при +37°С. Осаждение клеточного дебриса посредством центрифугирования при 3130 g в течение 40 минут при 20°С, сбор супернатанта с получением индивидуального образца лизата тромбоцитов с последующим его микроскопическим контролем при увеличении ×200 на наличие в поле зрения не более 3-х фрагментов тромбоцитов. При этом стандартизацию проводят путем пулирования равных по объему индивидуальных образцов лизата, полученных из тромбоцитарной массы не менее 12 доноров обеих тендерных групп, и полученный лизат тромбоцитов центрифугируют при 3130 g в течение 40 минут при 20°С, с последующей ультрафильтацией на фильтрах 0,45 мкм или 0,22 мкм, полученную ростовую добавку делят на аликвоты требуемого объема и замораживают до -80°С. Изобретение позволяет получить стандартизованные образцы нексеногенной ростовой добавки для культивирования клеток человека разных типов с функциональной активностью образцов, определяемой по скорости прироста тест-культур, различающейся не более чем на 10,0%. 3 ил., 8 табл., 2 пр.
Способ получения ростовой добавки к среде для культивирования клеток человека из тромбоцитарной массы доноров, включающий нормирование образца тромбоцитарной массы до заданной концентрации тромбоцитов 1,75×109 кл/мл посредством центрифугирования тромбоцитарной массы при 3130g в течение 40 минут при 20°С и ресуспендирования осадка в супернатанте заданного объема до указанной концентрации тромбоцитов, 3-кратный температурный лизис нормированного образца путем замораживания на сутки до -80°С и размораживания при +37°С, осаждение клеточного дебриса посредством центрифугирования при 3130g в течение 40 минут при 20°С, сбор супернатанта с получением индивидуального образца лизата тромбоцитов с последующим его микроскопическим контролем при увеличении ×200 на наличие в поле зрения не более 3-х фрагментов тромбоцитов, отличающийся тем, что проводят стандартизацию путем пулирования равных по объему индивидуальных образцов лизата, полученных из тромбоцитарной массы не менее 12 доноров обеих тендерных групп, и полученный лизат тромбоцитов центрифугируют при 3130g в течение 40 минут при 20°С с последующей ультрафильтацией на фильтрах 0,45 мкм или 0,22 мкм, полученную ростовую добавку делят на аликвоты требуемого объема и замораживают до -80°С.
| Н.С | |||
| СЕРГЕЕВА и др | |||
| Биологические эффекты тромбоцитарного лизата при добавлении в среду культивирования клеток человека | |||
| Гены энд Клетки, 2014, том IX, 31, с | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| ЖУРЛОВ О.С | |||
| Фракционирование антимикробных пептидов тромбоцитарного лизата (hPL) | |||
| МЕЖДУНАРОДНЫЙ ЖУРНАЛ ПРИКЛАДНЫХ И ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ, 22.03.2016, 3 (ч | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление для картограмм | 1921 |
|
SU247A1 |
| WO 2010033605 A2, 25.03.2010. | |||
Авторы
Даты
2018-03-22—Публикация
2016-04-21—Подача