Область техники, к которой относится группа изобретений
Группа изобретений относится к области медицины и медицинских устройств, в целом к трехмерной (3D) печати и созданию трехмерных биологических органных и тканеинженерных конструктов. В частности, изобретение относится к устройству для печати кожи в условиях операционной.
Предпосылки создания группы изобретений
Сегодня робототехника все больше интегрируется во многие направления развития научно-технического прогресса. Одним из таких направлений является 3D-б иопринтинг.
3D-биопринтинг - технология создания объемных моделей на клеточной основе с использованием 3D-печати, при которой сохраняются функции и жизнеспособность клеток. При этом биопечать всегда характеризуется несколькими важными этапами: создание цифровой модели органа или ткани, ее печать каким-либо способом и выращивание клеток в инкубаторе. Обычно после этих этапов проводится трансплантация органа в тело пациента. Когда для создания или восстановления органа пациента наносят материал прямо на его тело, это называют in situ, либо in vivo биопринтингом. В данном направлении ведутся активные исследования на протяжении нескольких десятков лет. Одним из преимуществ данного направления над «классическим» 3D-биопринтингом является то, что сам организм пациента является инкубатором для выращивания клеток, и нет необходимости проводить операцию трансплантации напечатанного органа.
На данный момент in situ биопринтинг в первую очередь занимается заживлением относительно простых органов и тканей, таких как хрящ, кожа и кости, так как это легче всего реализовать. Одной из важных проблем в данной области является способ нанесения материала на тело. Существует несколько путей решения данной проблемы. Например, используются ручные полуавтоматические инструменты, либо роботизированные системы.
Технология in situ подразумевает сочетание хирургической робототехники с трехмерной биопечатью. Использование специальных роботических рук позволяет печатать не только на горизонтальных поверхностях, но и заполнять тканевые дефекты неправильной формы под нужным углом.
Биопечать in situ минимизирует риски развития осложнений после трансплантации. Этот метод представляется перспективным, так как может решить проблемы васкуляризации (кровоснабжения) имплантата. В напечатанную тканеинженерную конструкцию мигрируют родные эндотелиальные прогениторные клетки реципиента - клетки, которые участвуют в формировании сосудов, а также прорастают капилляры из окружающей дефект ткани.
Разработка авторов настоящего изобретения стала первым шагом на пути применения технологии биопечати в условиях операционной для дальнейшего использования на людях. В будущем это позволит печатать трехмерные тканеинженерные конструкты непосредственно в месте дефекта конкретного органа пациента. Это существенно расширит спектр применения технологии биопечати, так как поможет избавиться от этапа доращивания конструктов в специализированных биореакторах и инкубационных системах.
Из уровня техники известна минимально инвазивная система (WO 2018185755 А1), использующая хирургического робота в качестве трехмерного принтера для изготовления биологических тканей внутри тела субъекта. Предоперационный план используется для направления и контроля как движения робота, так и роботизированной экструзии биочернил. Движения робота координируются с экструзией краски для формирования слоев желаемой толщины и размеров, а использование различных типов чернил позволяет укладывать составные элементы. Такие системы имеют механизм выброса биочернил небольшого диаметра, как правило, в виде канюли с поршневым приводом, обеспечивающий доступ к таким областям, как суставы, с ограниченным пространством. Управление роботом запрограммировано таким образом, что угловое движение происходит вокруг точки вращения в точке введения в предмет. Биочернила можно хранить в заранее определенных слоях в канюле, чтобы обеспечить возможность последовательного дозирования из одной канюли. Однако инвазивность системы является существенным ограничением для ее применения.
US 2016122723 А1 раскрывает метод формирования трехмерной инженерной биологической ткани кожи. Способ заключается в приготовлении дермальных биочернил, содержащих дермальные фибробласты; приготовление эпидермальных биочернил, содержащих кератиноциты; нанесение дермальных биочернил на поверхность; нанесение эпидермальных биочернил таким образом, чтобы эпидермальные биочернила образовывали слой по меньшей мере на одной поверхности дермальных биочернил; а также созревание депонированных биочернил в среде для культивирования клеток, позволяющее клеткам сцепляться с образованием трехмерной инженерной биологической ткани кожи. В то же время, нанесение кожных биочернил сначала на поверхность, а не непосредственно на дефект кожи пациента, усложняет и ограничивает применение этого способа в клинических условиях.
Также известно оборудование для «ремонта» кожи. Оборудование включает в себя системный модуль оптической когерентной томографии (ОКТ) и модуль трехмерной биопечати кожи (CN 206261600 U). Такая система не обеспечивает синхронизацию с движущейся поверхностью дефекта кожи (ввиду дыхания пациента) и не учитывает изгибы поверхности кожи на теле пациента.
WO 2020089840 А1 раскрывает миниатюрный костный робот, сконфигурированный для выполнения минимально инвазивной ортопедической хирургии в сочетании с технологией регенеративной трехмерной биопечати для восстановления хряща и пораженной кости. Робот устанавливается в кость, после чего он совершает установку изделий в кость и/или костный дефект.
WO 2020084263 А1 относится к системе биопечати, включающей печатающий узел, содержащий по меньшей мере одну печатающую головку. При этом в процессе печати печатающие головки остаются неподвижными, в то время как печатаемая мишень перемещается относительно печатающих головок с помощью роботизированной руки. Такая система позволяет печать объемные биологические объекты, однако не предусматривает нанесение материала непосредственно на тело пациента.
Из документа KR 20200138842 А известно устройство для биопечати и способ быстрой печати биочернилами на пораженных участках живых организмов, независимо от смещения пораженных участков, связанного с дыханием организмов. Устройство биопечати включает в себя: секцию определения формы для определения формы пораженного участка, присутствующего на части тела; распылительный узел, снабженный форсункой для распыления биочернил на пораженный участок; секцию транспортировки распылительного устройства для горизонтального или вертикального перемещения распылительного устройства по заданному пути на основе информации о форме пораженного участка, полученной от секции определения формы; секцию обнаружения смещения для обнаружения смещения целевой точки распыления, на которую направлено сопло, вызванного дыханием пациента, при распылении биочернил на пораженный участок; и секцию транспортировки сопла для транспортировки сопла таким образом, что интервал между целевой точкой распыления и соплом может поддерживаться постоянным на основе информации о смещении целевой точки распыления, полученной от секции обнаружения смещения. Однако низкая скорость системы контроля дыхания, отсутствие коллаборативности, возможности печати без сканера, а также учета изгиба поверхности при печати являются существенными ограничениями для применения такого устройства в практической медицине.
Наиболее близким к предлагаемому изобретению техническим решением является раскрытая в документе TN 202111006553 система биопечати для заживления ран в режиме реального времени (in vivo), которая содержит сканирующий блок, пользовательский интерфейс, управляющий блок и устройство биопечати, содержащее конечный эффектор, примыкающий к манипулятору для нанесения биочернил на целевую область, сканер для мониторинга целевой области в режиме реального времени, по крайней мере два сменных шприца, заполненных биосмесью для дозирования биочернил на целевую область в зависимости от силы срабатывания, и, по крайней мере, одну ультрафиолетовую лампу для дезинфекции и затвердевания верхнего слоя биочернил, дозируемых в целевой области. Ограничениями для применения такой системы в клинических условиях также являются низкая скорость системы контроля дыхания, невозможность печати без использования сканера, отсутствие коллаборативности, невозможность учета изгиба поверхности при печати. Также существенным ограничением является невозможность печати сфероидами, уже давно зарекомендовавшими себя как эффективный строительный материал для биопечати.
Таким образом, несмотря на известность устройств различных конфигураций, существует необходимость разработки усовершенствованного устройства - роботизированной системы для трехмерной неинвазивной биопечати кожи, которая позволит осуществлять биопечать на теле пациента.
Раскрытие сущности группы изобретений
Трехмерная печать на живых организмах, как правило, выполняется на зафиксированных участках, так как поверхность, которая должна быть покрыта материалом в процессе биопечати, в отсутствии ее фиксации, подвижна и колеблется в трех измерениях с различной амплитудой и частотой из-за процесса дыхания. Группа изобретений предназначена для синхронизации позиционирования устройства биопечати с поверхностью, на которую выполняется печать.
Кроме того, настоящая группа изобретений может быть использована для обеспечения автоматизированного процесса нанесения печатаемого материала на открытую кожную рану, такого как биочернила или лечебный материал.
Таким образом, технической задачей, на решение которой направлена группа изобретений, является разработка роботизированной системы для трехмерной неинвазивной биопечати (3D), которая позволяет осуществлять биопечать на теле пациента непосредственно на месте дефекта кожи пациента в режиме реального времени (in situ).
Поставленная техническая задача решается путем разработки роботизированной системы для трехмерной неинвазивной (3D) биопечати путем непосредственного in situ нанесения материала для печати на дефект кожи пациента в режиме реального времени, включающей:
а) манипулятор, выполненный в виде коллаборативной роботизированной руки с по меньшей мере 5-ю степенями свободы, причем к фланцу роботизированной руки прикреплен рабочий орган, включающий
- по меньшей мере один диспенсер, обеспечивающий возможность как выдавливания, так и всасывания наносимого материала для печати с помощью шагового двигателя диспенсера, при этом диспенсер имеет шток, в наконечник которого вкручен поршень сменного шприца с соплом,
- охлаждающую систему, выполненную с возможностью обеспечения охлаждения и поддержания заданной температуры материала для печати в по меньшей мере одном шприце,
-модуль позиционирования, состоящий из двух поворотных механизмов, закрепленный с помощью фланцев на диспенсере, выполненных с возможностью перемещения диспенсера вдоль поверхности дефекта, и линейного механизма перемещения для перемещения диспенсера вдоль оси диспенсера, которая перпендикулярна поверхности печати, для корректировки траектории движения рабочего органа при печати,
- блок управления, закрепленный на диспенсере, содержащий контроллер управления модулем позиционирования, драйвер управления шаговым двигателем диспенсера, драйвер управления охлаждающей системой,
- по меньшей мере, один датчик расстояния, направленный на сопло,
б) контроллер манипулятора;
в) вычислительный модуль, выполненный с возможностью
- получения от контроллера манипулятора записанных в его память координат точек, характеризующих поверхность дефекта,
- расчета траектории печати на основе полученных данных и отправки ее на контроллер манипулятора,
- управления скоростью и направлением движения манипулятора в пространстве,
- управления линейной скоростью перемещения по меньшей мере одного диспенсера с помощью по меньшей мере одного линейного актуатора,
- управления скоростью выдавливания материала для печати из сопла по меньшей мере одного шприца,
- контроля температуры материала для печати в по меньшей мере одном шприце и управления охлаждающей системой посредством драйвера управления охлаждающей системой,
- управления печатью, в процессе которой
- вычислительный модуль выполнен с возможностью направления в контроллер манипулятора команды о начале печати, а также о режиме печати, для обеспечения нанесения материала для печати на дефект кожи пациента в соответствии с рассчитанной траекторией,
причем контроллер манипулятора выполнен с возможностью управления движением роботизированной руки и соединенного с ней рабочего органа таким образом, чтобы сопло шприца, который в данный момент используется для печати, было перпендикулярно поверхности дефекта кожи в каждый момент нанесения материала для печати на дефект, при этом контроллер манипулятора выполнен с возможностью направления информации о ходе печати на вычислительный модуль,
в которой траектория печати корректируется на основании данных, полученных от датчика расстояния, характеризующих расстояние между соплом и поверхностью печати, в режиме реального времени, для синхронизации с дыханием пациента так, чтобы расстояние между целевой точкой впрыска на дефекте кожи пациента и носиком сопла шприца оставалось постоянным.
Разработанная роботизированная система обеспечивает достижение следующих технических результатов:
- быстрая неинвазивная печать материала на большинство неровных поверхностей, в том числе с учетом изгиба поверхности тела человека (пациента) в месте дефекта, а также неровностей самой раневой поверхности;
- синхронизация позиционирования устройства биопечати с поверхностью, на которую выполняется печать, что позволяет осуществлять печать кожи in situ на поверхностях частей тела пациента, которые подвержены физиологическим колебаниям (связанных, например, с дыхательными движениями);
- возможность печати различными материалами для печати, в том числе термочувствительными гелями;
- непосредственное нанесение материала для печати на дефект кожи пациента in situ в режиме реального времени с высокоточным позиционированием, что положительно влияет на эффективность лечения, сводит к минимуму риск загрязнения поврежденной поверхности кожи и исключает необходимость проведения дорогостоящей и трудоемкой хирургической кожной пластики.
Технические преимущества предлагаемой роботизированной системы, обуславливающие достижение вышеуказанных технических результатов, заключаются в следующем:
- для синхронизации с дыханием пациента используется 3 отдельных оси, которые перемещают только печатающую головку: одна линейная параллельная соплу экструдера и 2 поворотные оси, перпендикулярные друг другу и перпендикулярные оси сопла, при этом поворотные оси пересекаются с осью сопла.
- наличие 3D сканера, позволяющего получать трехмерную модель поверхности печати,
- наличие охлаждающей системы, обеспечивающей охлаждение и поддержание заданной температуры материала для печати в печатающей(-их) головке(-ах),
- возможность использования в системе нескольких печатающих головок, например, первой печатающей головки для экструзии гидрогелей и второй печатающей головки для дискретной печати тканевыми сфероидами;
- наличие специализированного программного обеспечения (ПО), позволяющего проецировать 2D траекторию на 3D поверхность, что предоставляет большой выбор стратегий печати;
- ПО позволяет генерировать структуры, состоящие из слоев гидрогеля и отдельных сфероидов, исходя из толщины заполнения и необходимой плотности клеток в напечатанной конструкции,
- учет кривизны поверхности при печати, при этом ПО роботизированной системы минимизирует угол между нормалью к поверхности печати и осью диспенсера;
- коллаборативность устройства позиционирования диспенсера за счет силомоментного очувствления, что позволяет реагировать при соприкосновении пациента и роботизированной системы, повышая безопасность для пациента;
- возможность заполнения поврежденного участка кожи с использованием схемы простой формы (аппроксимация дугами) без использования сканера; оператор проставляет роботом ключевые точки вручную, либо сканирование проводится в автоматическом режиме (границы, форма и глубина раны определяются автоматически);
- отсутствие необходимости установки меток на коже для синхронизации с дыханием пациента, то есть система не касается пациента, а осуществляет только нанесение материала.
Краткое описание чертежей
Признаки группы изобретений станут более очевидными на основе последующего подробного описания, в котором сделана ссылка на прилагаемые чертежи, на которых изображено:
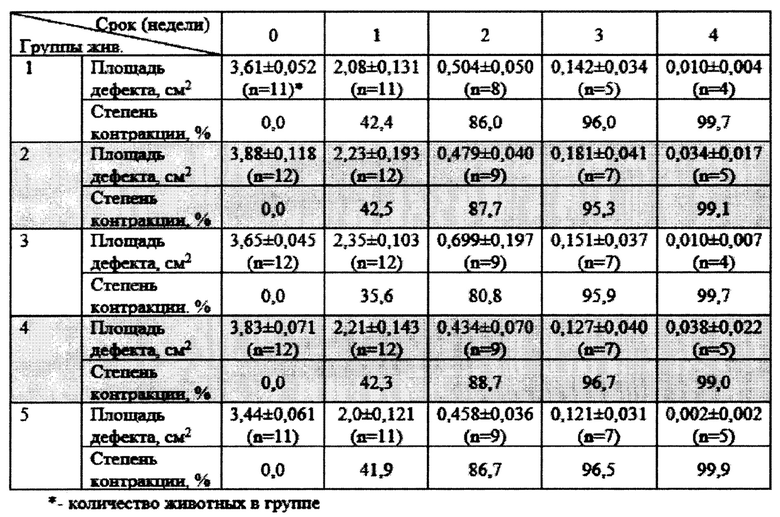
Фиг. 1 - Внешний вид роботизированной системы
Фиг. 2 - Внешний вид системы диспенсера.
Фиг. 3 - Разрез охлаждающей системы.
Фиг. 4 - Принципиальная схема рабочего органа.
Фиг. 5 - Сборка электрических компонентов на рабочем органе.
Фиг. 6 - Сборка рабочего органа.
Фиг. 7 - Внешний вид систему диспенсера сбоку.
Фиг. 8 - Внешний вид систему диспенсера органа снизу.
Фиг. 9 - Расположение точек на дефекте.
Фиг. 10 - Общий вид полнослойного дефекта кожи крыс.
Фиг. 11 - Схема вырезки для изготовления гистологических препаратов для изучения полной и неполной эпителизации.
Фиг. 12 - Динамика закрытия полнослойного дефекта кожи крысы при использовании готовой коллагеновой сетки в качестве имплантационного материала.
Фиг. 13 - Динамика закрытия полнослойного дефекта кожи крысы гидрогелем на основе коллагенового продукта Viscoll.
Фиг. 14 - Динамика закрытия полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагенового продукта Viscoll и культуры аллогенных фибробластов кожи.
Фиг. 15 - Динамика закрытия полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагенового продукта Viscoll и пулированного аллогенного лизата тромбоцитов.
Фиг. 16 - Динамика закрытия полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного аллогенного лизата тромбоцитов и культуры фибробластов кожи.
Фиг. 17 - Закрытие полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагена в динамике наблюдения.
Фиг. 18 - Закрытие полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагена и аллогенных фибробластов кожи в динамике наблюдения.
Фиг. 19 - Закрытие полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагена и аллогенного лизата тромбоцитов в динамике наблюдения.
Фиг. 20 - Закрытие полнослойного дефекта кожи крысы гидрогелевой композицией на основе коллагена и аллогенного лизата тромбоцитов в динамике наблюдения.
Фиг. 21 - Закрытие полнослойного кожного дефекта у крыс гидрогелевой композицией на основе коллагена и аллогенного лизата тромбоцитов, насыщенной аллогенными фибробластами.
Фиг. 22 - Схема расположения по группам полнослойных дефектов кожи и состав композиций для их закрытия у мини-пигов.
Фиг. 23 - Формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll и культуры аутологичных фибробластов кожи.
Фиг. 24 - Формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ и культуры аутологичных фибробластов кожи.
Фиг. 25 - Формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта тонкой коллагеновой мембраной.
Фиг. 26 - Формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ, культуры аутологичных фибробластов кожи при вакуумной компрессии зоны дефекта.
Фиг. 27 - Формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll и пулированного ЛТ при вакуумной компрессии зоны дефекта.
Термины и определения
Для лучшего понимания настоящего группы изобретений ниже приведены некоторые термины, использованные в настоящем описании изобретений. Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
В документах данного изобретения термины «включает», «включающий» и т.п., а также «содержит», «содержащий» и т.п. интерпретируются как означающие «включает, помимо всего прочего» (или «содержит, помимо всего прочего»). Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «и/или» означает один, несколько или все перечисленные элементы.
Также здесь перечисление числовых диапазонов по конечным точкам включает все числа, входящие в этот диапазон.
Использование терминов порядка или важности, включая «первый» и «второй», «верхний» или «нижний» («сверху»/ «снизу», «на»/ «под»), заключается в том, чтобы различать и идентифицировать отдельные элементы, а не обозначать или подразумевать конкретный порядок или важность, если это четко не указано в контексте.
Термин «необязательный» или «необязательно» или «опциональный» или «опционально», используемый в данном документе, означает, что описываемое впоследствии событие или обстоятельство может, но не обязательно, произойти, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, в которых оно не происходит.
В рамках настоящей группы изобретений под термином «материал для печати» понимают материал, который используется при печати с помощью роботизированной системы по изобретению В различных вариантах изобретений это могут быть биочернила для формирования в последующем кожи, закрывающей поврежденный участок, на который производилась печать, лекарственный (ранозаживляющий, обезболивающий и др.) материал, гидрогелевая композиция (например, гидрогелевая композиция на основе коллагена), гидрогелевая композиция, обогащенная ростовыми факторами и/или питательными веществами (например, гидрогелевая композиция на основе коллагена, обогащенная аутологичным или аллогенным лизатом тромбоцитов) или их комбинация, но не ограничиваясь ими. Состав и физико-химические свойства (вязкость, рН и др.) материала для печати выбирают в зависимости от выбранной тактики лечения пациента и в соответствии с параметрами, обеспечивающими ожидаемый эффект при проведении печати и проводимого лечения.
Под термином «биочернила» понимают материал, который используется при печати с помощью роботизированной системы по изобретению, и из которого в дальнейшем непосредственно формируются ткани кожи. Примерами биочернил могут выступать клетки (например, фибробласты, кератиноциты), гидрогель с клетками, тканевые сфероиды, но не ограничиваясь ими (сфероиды могут быть окружены во временно защищающую клетки округлую оболочку, например, из гидрогеля, не позволяющую сфероидам слипаться друг с другом).
В данном контексте термин «тканевые сфероиды» (или «сфероиды») относится к тканевым сфероидам, которые могут быть созданы из различных типов клеток. Так, например, сфероиды могут состоять из фибробластов, кератиноцитов, первичных астроцитов, тироцитов, ММСК (мультипотентные мезенхимальные стромальные клетки), но не ограничиваясь ими. В некоторых вариантах воплощения изобретения могут быть использованы разные типы тканевых сфероидов (т.е. состоящих из разных типов клеток) для одновременной фабрикации.
Термин «пациент» охватывает любые виды животных, предпочтительно млекопитающих, более предпочтительно, подразумевает человека.
Под «дефектом кожи» пациента в рамках настоящего изобретения понимают поврежденный участок кожи, требующий лечения (в частности, повреждение кожи, вызванное термическим или химическим ожогом, открытую кожную рану и др.).
Под «системой диспенсера» в рамках настоящего изобретения подразумевают рабочий орган робота, включающий в себя диспенсер, модуль позиционирования, модуль 3D сканера.
Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Подробное описание группы изобретений
Описание вариантов осуществления настоящей группы изобретений, приведенное ниже, приводится исключительно в качестве примера и предназначено для иллюстративных целей и не предназначено для ограничения объема раскрываемой группы изобретений.
Описание основных компонентов
Настоящая группа изобретений представляет собой роботизированную систему для 3D-биопечати путем непосредственного (in situ) нанесения материала для печати на дефект кожи пациента в режиме реального времени, которая включает:
- манипулятор, представляющий собой коллаборативную роботизированную руку с по меньшей мере 5-ю степенями свободы,
- рабочий орган, содержащий блок управления (включающий, в том числе, контроллер рабочего органа, систему датчиков расстояния, драйвер управления шаговым двигателем, драйвер управления охлаждающей системой), по меньшей мере один диспенсер, содержащий дозатор со штоком (в наконечник которого вкручивается поршень сменного шприца) в качестве устройства для нанесения материала, охлаждающую систему для обеспечения охлаждения материла в шприце(-ах), 3 отдельных оси, которые перемещают только печатающую головку: одна линейная параллельная соплу экструдера и 2 поворотные оси, перпендикулярные друг другу и перпендикулярные оси сопла, при этом поворотные оси пересекаются с осью сопла.
- систему компьютерного зрения (опционально),
- вычислительный модуль, представляющий собой персональный компьютер (ПК) или любое другое устройство, сконфигурированное для выполнения последовательности операций.
Внешний вид роботизированной системы представлен на фиг. 1.
Роботизированная система содержит манипулятор (1), представляющий собой коллаборативную роботизированную руку с по меньшей мере 5-ю степенями свободы, каждая ось (обеспечивающая одну из степеней свободы манипулятора) которой оснащена по меньшей мере одним силомоментным датчиком, позволяющим руке безопасно взаимодействовать с людьми и живыми организмами. В некоторых вариантах воплощения в манипуляторе может быть использован один 6-осевой силомоментный датчик, установленный на фланце робота. В качестве роботизированной руки в рамках изобретения может использоваться, например, коллаборативный робот KUKA LBR iiwa 14 R820, который удовлетворяет всем необходимым требованиям для осуществления настоящего изобретения. При выборе данного робота важным аспектом является его система управления KUKA Sunrise Cabinet, которая позволяет осуществлять гибкое программирование робота на языке высокого уровня Java. Одним из главных преимуществ такой системы управления является то, что в нее можно загружать различные траектории движения прямо с ПК, не осуществляя никаких ручных операций. При этом можно легко настроить общение между ПК и контроллером роботизированной руки (манипулятора) по протоколу TCP/IP.
Также роботизированная система содержит систему диспенсера (2), подробное изображение представлено на фиг 2.
Блок управления (3) закреплен на диспенсере (15). К диспенсеру прикреплена охлаждающая система (7) на которой установлен датчик расстояния(14), направленный на сопло (8). Диспенсер жестко закреплен с фланцем (10), перемещающийся вдоль оси Z. Фланец перемещается двигателями оси Z(5) установленными во фланце В (9). Фланец В вращается с помощью моторов оси В (4), установленных во фланце оси А (12). Фланец оси А вращается с помощью мотора оси А (6). К манипулятору система диспенсера крепится с помощью консоли (П) к которой прикреплен 3D сканер (13). Общий вид системы также представлен фиг 6 и 7.
В качестве диспенсера для целей настоящего изобретения может быть использован диспенсер Fishman SDAV, с помощью которого можно гибко управлять подачей материала. Для того, чтобы иметь возможность полностью программно управлять процессом нанесения материала, диспенсер содержит дозатор со штоком. Наконечник штока имеет винтовую резьбу, в которую вкручивается поршень сменного шприца, что позволяет осуществлять как выдавливание, так и всасывание материала, что очень важно при работе с материалами, которые являются сжимаемыми. В процессе печати материал для печати поступает из шприца через сопло - насадки на шприц, в качестве которой могут быть использованы например иглы пластиковые конические жесткие Pink Techcon TT20-RIGTD-РК. Диспенсер выдавливает материал с помощью шагового двигателя, и для его управления используется, например, драйвер DRV8825.
Охлаждающая система устанавливается на диспенсер для поддержания температуры, необходимой для печатного материала. Наличие охлаждающей системы, обеспечивающей охлаждение и поддержание заданной температуры материала для печати в печатающей головке, позволяет использовать для печати материалы, чувствительные к температуре, такие как термочувствительные гели, полимеризующиеся при температуре среды выше 10°С. Так как в операционной обычно температура около 20°С, при использовании таких материалов для печати необходимо обеспечить охлаждение материала в шприце. Для этого была разработана специальная охлаждающая система. На фиг. 3 представлен разрез охлаждающей системы.
Охлаждающая система состоит из следующих элементов: модуль Пельтье (16), который при подаче на него напряжения охлаждает одну сторону и нагревает другую. Модуль Пельтье (16) выполнен цилиндрическим с внутренним отверстием, охватывающим шприц, вставляемый в шток дозатора. К охлаждающейся стороне модуля Пельтье (16) прилегает металлическая часть (17) которая охлаждает сам шприц и которая конгруэнтна поверхности внутреннего отверстия модуля Пельтье (16). К нагреваемой стороне модуля Пельтье (16) прилегает радиатор (18) для быстрого оттока тепла, а к радиатору прикреплен охлаждающий вентилятор (19), который обеспечивает отток тепла с радиатора. Все части крепятся к корпусу (20), который уменьшает теплообмен металлической части с внешней средой.
Для того чтобы обеспечить цифровое управление системой охлаждения, используется драйвер Cytron MD13S, который способен управлять устройствами, с текущим в них током до 13А. В некоторых вариантах воплощения изобретения режим охлаждения может быть выбран в виде напряжения 6 В и силы тока около 1А. В качестве преобразователей напряжения могут быть выбраны LM2596S-ADJ, при этом они не только понижают напряжение, но и стабилизируют его. Для драйвера управления шаговым двигателем такой преобразователь выставляют на выход на 9 В, а для модуля Пельтье - на 6 В.
Таким образом, чтобы управлять шаговым двигателем и охлаждающей системой, используется следующая принципиальная схема, представленная на фиг. 4. Для питания системы используется источник питания постоянного тока с напряжением 12 В и максимальной силой тока 2А. Так как шаговый двигатель и модуль Пельтье работают на более низком напряжении, перед этими элементами ставят понижающие преобразователи постоянного тока.
Все электрические компоненты компактно расположены на рабочем органе, для того чтобы обеспечить компактность устройства, чтобы оно не занимало лишнее место в операционной. Для этого в целях настоящего изобретения спроектирован корпус и держатель самого диспенсера, который крепит рабочий орган к фланцу роботизированной руки. Данные детали могут быть изготовлены на 3D принтере, что позволяет создать рабочий орган по очень низкой себестоимости, простого и удобного при сборке. При таком варианте конструкции диспенсер с натягом устанавливается в держатель, а блок управления с натягом устанавливается на диспенсер так, чтобы нижняя часть блока соприкасалась с верхней поверхностью держателя.
На печатающую головку рабочего органа также крепится система датчиков расстояния (могут быть использованы например инфракрасные триангуляционные датчики (например, Sharp GP2Y0A41), лазерные дальномеры по технологии времяпролетного метода (Time-of-Flight, ToF), например, VL53L0X или др.), ориентированная для измерения расстояния от носика (кончика) сопла шприца печатающей головки, которая в данный момент используется для печати, до точки впрыска на поверхности дефекта кожи пациента, на которую производится печать. Данные от системы датчиков расстояния передаются на вычислительный модуль (например, персональный компьютер, ПК) через контроллер рабочего органа.
На ПК устанавливается специализированное программное обеспечение, которое на основании полученных данных от датчиков расстояния вычисляет расстояние между соплом и поверхностью печати, осуществляет внесение коррекции в траекторию движения рабочего органа по высоте и боковому смещению которое будет осуществляться модулем позиционирования, рассчитывает скорректированную траекторию движения рабочим органом и передает ее обратно в контроллер рабочего органа в режиме реального времени для повышения точности печати путем синхронизации позиционирования устройства биопечати с поверхностью, на которую выполняется печать, что позволяет осуществлять печать кожи in situ на поверхностях частей тела пациента, которые подвержены физиологическим колебаниям (связанных, например, с дыхательными движениями). При этом измерение расстояния между носиком сопла шприца печатающей головки до поверхности печати происходит с частотой 50 Гц.
Поверхность, на которой происходит печать, непрерывно смещается вследствие дыхания/сердцебиения/микродвижений. В качестве средства перемещения диспенсера используется робот (манипулятор), обладающий большой инертностью, и не способный с требуемой погрешностью повторить смещения поверхности. Поэтому для компенсации данных смещений используются датчики расстояния и модуль позиционирования, установленный на фланце рабочего органа.
В каждой точке поверхности находится вектор смещения поверхности. При генерации траектории робота его путь строится так, чтобы ось сопла была направлена вдоль вектора смещения поверхности. Тогда движения робота будут осуществлять траекторию нанесения материала, а движения модуля позиционирования будут компенсировать перемещения поверхности печати с наименьшей погрешностью.
В зависимости от текущего смещения Z и текущего положения на раневой поверхности можно вычислить смещение траектории вдоль поверхности. Исходя из смещений вычисляются координаты повороты двигателей А, В и смещение оси Z.
Для достижения необходимого результата на фланец робота установлена дополнительная линейная ось Z, параллельная оси диспенсера, содержащая датчик расстояния (фиг 6). Контроллер узла биопечати принимает данные от датчика расстояния, вычисляет разность между текущим значением расстояния и целевым и отправляет команду перемещения модулю перемещения переместиться. Также установлены дополнительные оси А, В, для компенсации смещения вдоль поверхности раны (фиг. 6).
Координаты точек, характеризующих поверхность дефекта, могут определяются оператором роботизированной системы в процессе подготовки к печати в ручном режиме или с помощью 3D сканирования. При проведении 3D сканирования используется система компьютерного зрения, которая автоматически производит локализацию раны и определяет ее размер, форму и расположение. Затем с помощью технологии лазерной триангуляции или структурированного света рана сканируется в 3D и информация о картине раны передается на ПК. Используя собранные данные, на ПК рассчитывается трехмерная модель поверхности для процесса печати. В различных вариантах осуществления настоящего изобретения система компьютерного зрения может представлять собой, например, стереосистему (систему из 2-х камер), работающую по принципу стереоскопии, или камеру в комбинации лазерным паттерном для освещения, работающую на основе использования структурированного света, и может быть установлена как отдельно, так и на манипуляторе роботизированной руки.
Все электрические компоненты в предпочтительных вариантах изобретения помещают в блок управления. Сборка блока управления представлена на фиг. 5. К основному корпусу блока управления (21) крепятся все электрические компоненты: преобразователи напряжения (22, 24), драйвер управления шаговым двигателем (23), контроллер рабочего органа (25) и драйвер управления охлаждающей системой (не указан). Сверху надевается крышка (26), которая защищает электрические компоненты от внешних воздействий.
Таким образом, настоящее изобретение имеет несколько программируемых устройств: контроллер роботизированной руки, контроллер рабочего органа и вычислительный модуль (персональный компьютер, ПК). В приведенном примере ПК и рабочий орган связаны по USB, а также ПК и контроллер роботизированной руки связаны по Ethernet. ПК обеспечивает управление и связь с периферийными устройствами (датчиками расстояния, охлаждающей системой и др.). Программное обеспечение, управляющее всей системой, устанавливается на ПК и на основании данных, полученных от системы компьютерного зрения и параметров печати, задаваемых оператором (таких как, например, выбор последовательности и направления заполнения дефекта кожи, размеров ячейки решетки при печати в виде решетки и др.), рассчитывает траекторию печати в виде решетки или любого другого способа заполнения поверхности для печати. Информация о траектории поступает в контроллер робота, который выполняет биопечать в ране по программе управления. Полная структурная схема роботизированной системы представлена на фиг. 8.
Последовательность операций печати
Роботизированная система согласно настоящей группе изобретений имеет несколько устройств, связанных между собой. Таким образом, можно выделить основные этапы проведения операции. Операция разбита на два основных этапа: подготовка к операции и процесс печати.
Этап 1. Подготовка к операции.
Пациента располагают таким образом, чтобы дефект располагался в рабочей зоне системы.
На этом этапе производится сканирование поверхности печати, ввод пользователем параметров сетки заполнения, генерация траектории, подготовка и заправка материала в шприц. В результате проведения всех мероприятий на выходе имеется система, в которой записана траектория, а материал для печати заправлен в рабочий орган.
В случае осуществления печати с использованием материалов, чувствительных к температуре, охлаждающую систему рабочего органа включают заранее, так, чтобы металлическая часть охлаждающей системы успела выйти на требуемый уровень температуры.
Далее производится анализ и запись координат точек, характеризующих поверхность дефекта. Как уже указывалось координаты точек могут определяются оператором роботизированной системы в процессе подготовки к печати в ручном режиме или с помощью 3D сканирования.
В случае ручного сканирования поверхности оператор, управляя в ручном режиме роботизированной рукой, записывает в память контроллера манипулятора точки, характеризующие поверхность дефекта. Далее оператор запускает сначала программу на контроллере манипулятора, а затем управляющую программу на ПК. При этом сначала производится пересылка координат записанных точек с контроллера робота на ПК, ПК рассчитывает траекторию и пересылает ее на контроллер робота. Таким образом, получается полностью готовая к печати система Этап 2. Процесс печати.
Далее происходит процесс печати, результатом которого является нанесение материала для печати на поврежденный участок кожи. Несмотря на то, что процесс печати осуществляется в автоматическом режиме, для обеспечения безопасности на каждом из этапов необходимо присутствие оператора системы.
После того как оператор нажимает кнопку начала печати, запускается процесс печати. Вычислительный модуль (ПК) отправляет сообщение контроллеру манипулятора о начале печати. Контроллер посылает последовательно команды движения роботизированной руке и информацию о режиме печати на ПК. ПК в свою очередь пересылает информацию о режиме печати на рабочий орган. В процессе биопечати контроллер роботизированной руки считывает данные, передаваемые с датчиков расстояния, установленных на печатающей головке, и в соответствии с этой информацией корректирует траекторию так, чтобы расстояние до поверхности было фиксированным. После того как все команды движения были отработаны, роботизированная рука возвращается в исходную позицию, и процесс печати завершается.
Программное обеспечение рабочего органа
Основным устройством управления рабочего органа является контроллер рабочего органа, в качестве которого может быть использован, например, микроконтроллер Arduino MEGA 2560. Для разработки управляющих программ такого микроконтроллера применяется среда разработки Arduino IDE. Написание кода осуществляется на языке С++ с использованием специальных встроенных функций Arduino. Программа разбивается на две части: инициализация, которая вызывается один раз, и бесконечный цикл, который вызывается после инициализации бесконечное количество раз, пока питание контроллера не будет выключено либо произойдет перезапуск контроллера с помощью подачи импульса на пин RESET.
Для обеспечения возможности одновременно управлять шаговым двигателем диспенсера и принимать данные от вычислительного модуля, используются внутренние прерывания микроконтроллера. Для управления внутренними прерываниями используется библиотека timer-api. У такого алгоритма управления есть существенное преимущество в том, что в случае необходимости можно управлять несколькими шаговыми двигателями независимо при небольшой доработке программы. Это необходимо, например, при печати с использованием нескольких диспенсеров.
Выполнение программы начинается при подключении микроконтроллера к питанию, питание микроконтроллера может осуществляться, например, от управляющего компьютера по кабелю USB. Происходит инициализация всех переменных, открытие СОМ порта для подключения к ПК, установка пинов, а также установка внутреннего прерывания по таймеру с частотой 2 кГц. Далее программа начинает выполнять команды, содержащиеся в бесконечном цикле loop.
Поскольку материал для печати является ньютоновской жидкостью, для того чтобы выдавливание материала для печати началось сразу после отправки сообщения с ПК, сначала выдавливается на максимальной скорости небольшой объем материала для печати, который устанавливает пользователь (оператор). В конце печати, чтобы не оставалось лишнего материала на поверхности дефекта, шаговый двигатель поднимается на величину того же небольшого объема, всасывая материал, который был выдавлен вначале.
Программное обеспечение контроллера манипулятора (роботизированной руки)
Робот KUKA LBR iiwa 14 R820 имеет систему управления KUKA Sunrise Cabinet. Программирование данной системы управления осуществляется в среде Eclipse на языке Java. Для удобной работы компания KUKA разработала специальный интерфейс KUKA Sunrise.Workbench. При составлении программ для роботизированной руки существует особая структура. Сначала вызывается подпрограмма инициализации основных переменных и создание объектов, затем вызывается подпрограмма, находящаяся в блоке Run.
В начале работы оператор записывает в память контроллера манипулятора точки, характеризующие форму дефекта. Поэтому при начале работы программы на контроллере манипулятора производится извлечение данных о координатах записанных точек во временный массив. Далее оператор открывает сервер, который ожидает сообщение от ПК. Как только сообщение приходит, контроллер манипулятора отсылает координаты записанных точек из временного массива. Затем ПК отсылает вычисленную траекторию контроллеру манипулятора в виде массива строк. Контроллер расшифровывает строки и записывает в массивы координаты точек, по которым он должен пройти, и команды, которые должны быть отправлены на рабочий орган. Затем контроллер манипулятора ожидает сообщения от ПК о начале печати. Как только данное сообщение приходит, контроллер манипулятора начинает отсылать команды роботизированной руке о движении и одновременно отсылать команды подачи материала на ПК. Когда все команды траектории отработаны, отсылается команда на роботизированную руку о возвращении в исходную позицию и команда на ПК об остановке подачи материала.
Программное обеспечение вычислительного модуля ГТК
Одним из широко развивающихся и удобных языков программирования является Python. Поэтому интерфейс пользователя в целях настоящего изобретения написан на Python 3.8, в среде программирования IDLE. Для создания оконного приложения использовалась библиотека PyQt5. За отображение и работу с трехмерной графикой отвечает библиотека OpenGL. Чтобы реализовать соединение по протоколу UART используется библиотека Serial, а для соединения по протоколу ТСР/ГР используется библиотека Socket. Для управления библиотеками используют программу pip, позволяющую быстро загружать и обновлять библиотеки.
На интерфейсе пользователя отображаются кнопки для передачи сообщения контроллеру робота, ручного управления рабочим органом, а также графическое отображение построенной траектории.
В начале работы системы оператор подключается к рабочему органу, вводит необходимый режим работы и скорость передвижения штока.
После установки в рабочем органе шприца(-ов) с материалом для печати, оператор, в случае ручного сканирования поверхности, проставляет точки и открывает сервер на роботизированной руке. Затем он нажимает кнопку отправки траектории на ПК, программа принимает значения координат точек от контроллера манипулятора и вычисляет траекторию движения в подпрограмме формирования траектории. При этом данная траектория записывается в текстовый файл, и этот файл построчно отправляется на контроллер манипулятора.
После этого, когда оператор убедился в том, что ничто не мешает процессу печати, он запускает печать. Программа пересылает сообщение на контроллер манипулятора о начале печати. В процессе данной операции управляющая программа ожидает сообщения от контроллера манипулятора рабочему органу о подаче материала. После того, как контроллер отрабатывает все команды, он отсылает сообщение управляющей программе о конце печати, и на этом работа системы завершается.
Метод построения траектории печати при ручном сканировании. Поскольку, дефект на коже, как правило, является не плоским, а имеет сложную искривленную поверхность, для того чтобы адаптировать траекторию печати к реальной поверхности, плоскую траекторию проецируют на модель кривой поверхности, близкой к поверхности реального дефекта по специальному алгоритму. Модель такой поверхности формируется с помощью одиннадцати точек, пример их расположения на дефекте представлен на фиг. 9.
Оси координат расположены на рисунке в соответствии с осями координат базы роботизированной руки. В настоящей версии программы нумерация точек важна, так как в дальнейшем вычисления траектории привязаны к конкретным номерам точек. Можно характеризовать сложную поверхность большим количеством точек, тем самым сильнее приближая модель к реальной форме дефекта. Точки 1, 2, 3, 4, 5, 6, 7, 8, 9 (фиг. 9) формируют три дуги, и можно однозначно определить их центры и радиусы. Точки 10, 11 позволяют найти угол поворота С рабочего органа. Поверхность между дугами находится как среднее значение радиусов и центров дуг между ними.
Также важно чтобы сопло шприца, установленного на рабочем органе, было перпендикулярно к поверхности дефекта кожи в каждый момент нанесения материала для печати на дефект. Угол наклона рабочего органа в системе управления KUKA характеризуется тремя углами А, В, С. Они соответствуют повороту рабочего органа относительно соответствующих осей X, Y, Z. Для того чтобы обеспечить перпендикулярность сопла шприца к поверхности, вычисляется величина углов В и С.
После этого сформированный массив с траекторией в записывается в текстовый файл, который затем передается на контроллер роботизированной руки с помощью специальной подпрограммы. Для того, чтобы получить корректное графическое отображение траектории, массив точек масштабируется, так как координаты сцены изменяются в других пределах. Затем данный массив пересылается в подпрограмму графического отображения.
Таким образом, для построения траектории используется метод аппроксимации криволинейной поверхности с помощью точек, что позволяет строить сложную траекторию, используя только точки, выставленные оператором.
В случае глубоких дефектов кожи биопечать производят в виде нескольких последовательных слоев. При этом траектория печати рассчитывается так, что сначала формируется слой, покрывающий всю поверхность дефекта кожи, а затем слой за слоем формируются следующие слои, каждый из которых покрывает всю поверхность дефекта кожи, до тех пор, пока дефект кожи не будет заполнен на всю глубину.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящей группы изобретений, и их не следует рассматривать как каким-либо образом ограничивающие их объем.
Метод построения траектории печати при использовании 3D сканера. Сначала получают 3д модель раневой поверхности. Для этого рабочий орган робота подводится к месту раны и производится 3D сканирование.
Построение траектории происходит следующим образом. Сначала производится генерация плоской траектории. Для этого реализован алгоритм генерации траектории в виде решетки. Затем происходит обрезка траектории по контуру раны. Заключительным шагом производится проецирование плоской траектории на 3D скан.
Экспериментальные данные
Использование роботизированной системы по изобретению для закрытия полнослойного кожного дефекта критического размера у крыс гидрогелевой композицией на основе коллагена или гидрогелевой композицией на основе коллагена, аллогенного лизата тромбоцитов без клеток и/или насыщенной аллогенными фибробластами кожи, с учетом ш наличия дыхательных экскурсий.
Работа выполнена на базе экспериментально-биологической клиники (с виварием) МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» МЗ РФ. Лабораторные животные - spf крысы-самцы линии Wistar весом 220 - 250 г (66 голов) были получены из питомника лабораторных животных «Пущино» - филиал ИБХ РАН.
На протяжении всего эксперимента животные содержались в индивидуальных вентилируемых клетках в виварии в условиях постоянно действующей принудительной приточно-вытяжной вентиляции, постоянного температурного режима (24°С), освещения (12 часов), при относительной влажности воздуха 50-60% и со свободным доступом к воде и пище.
1. Дизайн эксперимента
1.1 Получение аллогенного лизата тромбоцитов (ЛТ) крыс.
Аллогенный ЛТ получали из богатой тромбоцитами плазмы крыс. Для этого осуществляли седацию крыс - доноров весом 220 - 250 г (6 голов) с помощью кратковременного эфирного наркоза, вскрывали грудную клетку и отбирали у них из сердца кровь с помощью одноразового шприца, смоченного консервантом ACD-A. После взятия крови животных выводили из эксперимента путем помещения их в СО2-бокс для эвтаназии AN045AR Medium CO2 chamber (VetTech, Италия). В образцах крови на гематологическом анализаторе определяли содержание тромбоцитов. Далее для осаждения эритроцитов кровь переносили в пробирки с консервантом (цитрат натрия в составе буфера ACD-A) и центрифугировали при скорости 158 g в течение 15 минут (Eppendorf 581 OR, Германия). Из пробирок отбирали супернатант - фракцию, обогащенную тромбоцитами, т.е. богатую тромбоцитами плазму (БоТП) и повторно определяли концентрацию тромбоцитов. Подобная процедура позволила получить 4,5-кратный концентрат тромбоцитов крысы. Для получения ЛТ осуществляли 3-кратный температурный лизис образцов БоТП (замораживание при - 80°С в течение 24 часов/оттаивание при+37°С до равномерного прогревания БоТП) Для осаждения фрагментов тромбоцитов производили центрифугирование образцов ЛТ при 3130 g в течение 15 минут. Для удаления фибриногена к образцу ЛТ добавляли 10% раствор хлорида кальция (ПанЭко, Россия) до конечной концентрации 10 ммоль/л и инкубировали в термостате при 37°С в течение 2,5 часов и затем стабилизировали сгусток фибрина (+4°С, 16-18 часов) На следующем этапе осуществляли пулирование, для чего образцы ЛТ, полученные от 6 голов крыс, объединяли и тщательно перемешивали путем пипетирования. На заключительном этапе работы пулированный образец ЛТ последовательно отфильтровали через фильтры 0,45 мкм и 0,2 мкм (Sarsted, Германия), разлили по аликвотам (200 мкл) и заложили на хранение при -20°С.
1.2 Получение первичной культуры клеток фибробластов кожи (ФК) новорожденных крыс
Для получения первичной культуры ФК новорожденных крысят линии Wistar подвергали эвтаназии, затем в асептических условиях ламинарного бокса у них производили забор кожного лоскута со стороны спины и переносили его в среду ДМЕМ с добавлением 100 мкг/мл гентамицина (ПанЭко, Россия). Полученную ткань измельчали ножницами на фрагменты размером 1-2 мм и далее проводили несколько туров ферментативной дезагрегации (37°С; 0,25% раствора трипсина (ПанЭко, Россия) и 200 Ед/мл коллагеназы типа I (Gibco, США)) с заменой каждый раз ферментативного коктейля на свежую порцию. На следующем этапе работы порции суспензии ФК объединяли, фильтровали через нейлоновые сита с диаметром пор 100 меш для удаления клеточных агрегатов (Sarstedt, Германия), добавляли двойной объем полной ростовой среды (ПРС) следующего состава: среда ДМЕМ, 60 мг/мл L-глютамина, 20 мМ раствора Хепес, 50 мкг/мл гентамицина (ПанЭко, Россия) и осуществляли отмывку центрифугированием (1000 об/мин, 15 минут). Полученный осадок ресуспендировали в ПРС и подсчитывали концентрацию жизнеспособных ФК в автоматическом счетчике клеток (Countess, Invitrogen, Thermoscientific, США). Клетки рассеивали по флаконам (Costar, Thermoscientific, США) при плотности посева 2×105 кл./см2. Культивирование ФК проводили при 37°С и 5% СО2 (СО2-инкубатор Sanyo, Япония). Каждые 2-4 дня проводили смену среды на свежую порцию. Пересев культуры осуществляли при получении предконфлюэнтного монослоя. Для эксперимента использовали 5×105 кл. ФК на животное.
1.3 Оперативные вмешательства животным выполняли под общим наркозом. Перед операцией крысам вводили метидин (АПИ-САН, Россия) из расчета 20 мкг на кг веса животного, внутримышечно, затем золетил-100 (Virbac Sante Animale, Франция) из расчета 40 мг на кг веса животного внутримышечно. Далее крысам с помощью аппарата для стрижки животных Moser 1400 (Германия) выбривали шерсть на спине в области грудного отдела позвоночника и проводили оперативное вмешательство.
1.4 Условно асептический полнослойный плоскостной дефект кожи подлопаточной области спины крысы формировали с помощью пинцета и глазных ножниц по заранее подготовленному шаблону в форме круга площадью 3,14 см2 (фиг. 10). Область раны закрывали гидрогелевыми имплантатами различных составов (раздел 1.5): готовой 1-слойной коллагеновой решеткой («Имтек», Россия) или путем печати in situ в виде 3-хслойной решетки. Дополнительно область дефекта не укрывали и далее оставляли открытой на протяжении всего периода наблюдения.
1.5 Приготовление «биочернил» для биопечати in situ.
Для приготовления «биочернил» для биопечати in situ использовали коммерческие стерильные растворы коллагена «Viscoll» с концентрацией 80 мг/мл («Имтек», Россия) и буфер для нейтрализации на основе TRIS (рН 7,2-7,4), компоненты смешивали в соотношении 1:1. В отдельных случаях в зависимости от номера экспериментальной группы «биочернила» содержали также или суспензию клеток, и/или 20%-й раствор пулированного аутологичного образца ЛТ крыс или их сочетание. В среднем, на формирование 3-хслойной гидрогелевой решетчатой структуры для заполнения полнослойного кожного дефекта у одного экспериментального животного расходовался приблизительно 1 мл готовых «биочернил».
Для биопечати использовались следующие составы «биочернил»:
- Коллагеновый продукт Viscoll (раствор коллагена 80 мг/мл, «Имтек», Россия);
- Коллагеновый продукт Viscoll+культура аллогенных первичных ФК (5×105 кл. /животное);
- Коллагеновый продукт Viscoll+пулированный аллогенный ЛТ крысы (80/20);
- Коллагеновый продукт Viscoll+пулированный аллогенный ЛТ крысы (80/20)+культура аллогенных первичных ФК (5×105 кл. /животное).
1.6 In situ биопечать с помощью роботизированной системы.
Координаты точек, характеризующих поверхность дефекта, были определены оператором роботизированной системы в ручном режиме. Биопечать имплантата in situ осуществляли в область кожного дефекта крыс согласно траектории печати, рассчитанной ПК на основании введенных координат, с учетом дыхательных экскурсий животного и кривизны площади операционного поля. Была использована траектория печати в виде решетки с параметрами: размер ячейки - 1,7×1,7 мм, толщина филамента - 0,9 мм, количество слоев - 3, высота слоя - 400 мкм. Время печати составило 5 минут.
1.7 Послеоперационное ведение животных.
В послеоперационном периоде все животные однократно получили антибактериальную терапию (толфедин 4 мг/кг) (Vetoquinol, Франция). В течение всего эксперимента оценивали общее состояние подопытных животных, внешний вид ран, наличие и характер отделяемого, вид струпа, отмечали сроки полного закрытия кожной раны и время отхождения струпа.
1.8 Группы животных
Для выполнения эксперимента было сформировано 5 групп животных по 12 голов в каждой:
- группа №1 (контроль) - полнослойный кожный дефект, закрытый коммерческой коллагеновой мембраной («Имтек», Россия);
- группа №2 (опыт) - полнослойный кожный дефект, закрытый решетчатым гидрогелевым имплантатом на основе коллагенового продукта Viscoll, сформированным путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению;
- группа №3 (опыт) - полнослойный кожный дефект, закрытый решетчатым гидрогелевым имплантатом на основе коллагенового продукта Viscoll с аллогенными ФК (плотность 5×105 клеток /мл гидрогеля), сформированным путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению;
- группа №4 (опыт) - полнослойный кожный дефект, закрытый решетчатым гидрогелевым имплантатом состава: 90% коллагеновый продукт Viscoll, 10% аллогенный ЛТ, сформированным путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению;
- группа №5 (опыт) - полнослойный кожный дефект, закрытый решетчатым гидрогелевым имплантатом состава: 90% коллагеновый продукт Viscoll, 10% аллогенный ЛТ с аллогенными ФК (плотность 5×105 клеток /мл гидрогеля), сформированным путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению
1.9 Проведение гистологического исследования зоны операции.
На этапах исследования (1, 2, 3, 4 недели после оперативного вмешательства) планиметрическим способом у каждого животного оценивали площадь дефекта кожи. Для получения гистологических препаратов через 1, 2, 3 и 4 недели по 3 животных из каждой группы выводили из эксперимента с помощью СО2-бокса для эвтаназии. Иссекали участки кожи, отступая от зоны дефекта по 1-1,5 см с каждой стороны. Иссеченные фрагменты кожи расправляли на пластиковом каркасе с вырезанным «окном» для качественной фиксации биологического материала, которую проводили в 10% нейтральном растворе формалина на фосфатном буфере (ООО «Биовитрум» (Санкт-Петербург)). Далее готовили фронтальные срезы кожи толщиной 4-5 мкм на различных уровнях зоны репарации дефекта, материал заливали в парафин и окрашивали их гематоксилином и эозином (фиг. 11).
Анализ гистологических препаратов проводили на микроскопе Nikon Eclipse Ti (Япония), ориентируясь при их описании на расположение среза (центральное, пограничное) относительно центральной части дефекта.
1.10 Определение механической прочности сформированных кожных регенератов
Изучение механических свойств кожных регенератов проводили через 4 недели после формирования и заполнения полнослойньгх дефектов. Для этого использовали вырезки кожи длиной 5 см и шириной 1 см, включающие как саму область восстановленного дефекта, так и соседние фрагменты здоровой кожи, необходимые для фиксации образцов в установке. Испытания проводили при помощи разрывной машины Instron 5965 (ITW, США) на базе Отдела нанобиоматериалов и структур Курчатовского комплекса НБИКС-технологий Национального исследовательского центра "Курчатовский институт". В каждой экспериментальной группе исследовали не менее 2-3 образцов.
2. Результаты эксперимента
2.1 Динамика формирования кожного регенерата при закрытии полнослойного дефекта кожи крыс гидрогелевыми имплантатами, сформированными путем биопечати in situ с помоьцъю роботизированной системы согласно настоящему изобретению.
На протяжении всего периода наблюдения, несмотря на перенесенные оперативные вмешательства, животные во всех группах выглядели активными, о чем свидетельствовал их внешний вид, аппетит, реакции на внешние раздражители.
Макроскопически у животных в контроле и в опытных группах уже в первую неделю после операции в области кожного дефекта был отмечен достаточно плотный струп, несколько возвышающийся над здоровыми участками кожи. Сроки очистки раневой поверхности от струпа не зависели от способа закрытия кожного дефекта: у животных всех пяти групп это происходило через 3-4 недели (фиг. 12-16).
Скорость репаративных процессов (формирование кожного регенерата) при закрытии кожных дефектов в группах у контрольных и опытных животных, оцененная планиметрическим методом, также была близка, о чем свидетельствуют данные табл. 1.

Далее проводили световую микроскопию гистологических препаратов. При их описании учитывали наличие отека и лимфоидной инфильтрации в области раны, рельеф кожного регенерата, сроки и особенности эпителизации раны, характер и сроки созревания грануляционной ткани, наличие в ней кровеносных сосудов, формирование de novo производных кожи (волосяные фолликулы, сальные железы) в зоне дефекта. Гистоструктура интактной кожи крыс в области, прилегающей к травме, служила дополнительным контролем.
Группа Мз 1. Тонкая коллагеновая мембрана (фиг. 17)
1 неделя
Рана полностью закрыта тонкой коллагеновой мембраной. Под ней -новообразованная многоклеточная васкуляризированная соединительная ткань, полностью заполняющая дефект. На границе соединительной ткани и коллагеновой мембраны - лейкоцитарная инфильтрация сегментоядерными нейтрофилами. В зоне контакта коллагеновой мембраны с эпителием на краю раны - валик гипертрофии эпителия.
2 недели
Основная картина та же. Эпителий начинает прорастать по краям раны под слой коллагена.
3 недели
Основная картина та же. Эпителизация (между коллагеновой мембраной и новообразованной дермой) занимает 50% площади раны. В отдельных полях зрения эпителий образует сосочки в дерме.
4 недели
Полная эпителизация «плоским слоем» многослойного эпителия.
На фиг. 17 показано закрытие кожного дефекта у крыс коллагеновой мембраной в динамике наблюдения (окраска: гематоксилин-эозин), где:
1 неделя: а - общий вид; д - край имплантата с гипертрофированным слоем эпителия; и - сегментоядерные клетки между имплантатом и новообразованной соединительной тканью;
2 недели: 6 - тонкий слой коллагена, прилегающий к новообразованной соединительной ткани (на границе - лейкоцитарная инфильтрация); е - эпителий врастает между коллагеном и новообразованной соединительной тканью;
3 недели: в - эпителизация с образованием сосочковых структур в дерме; отслоение имплантата; ж - почти полное смыкание эпителия в центе раны; к - край нарастающего эпителия;
4 недели: г - полная эпителизация, граница с нормальной кожей; з - полная эпителизация, граница с нормальной кожей, образование сосочковых структур.
Группа №2. 3-х слойный коллагеновый имплантат, напечатанный in situ с помощью роботизированной системы согласно настоящему изобретению (риг.18)
1 неделя
Раневая поверхность закрыта имплантатом. В имплантате видна ориентация волокон коллагена. Зона дефекта полностью заполнена многоклеточной васкуляризированной соединительной тканью. Наблюдаются 3 вала лейкоцитарной инфильтрации: на границе новообразованной дермы и 1 слоя коллагена, на границе 1 и 2 слоев коллагена и на границе 2 и 3 слоев коллагена. В остальной толще коллагена -единичные сегментоядерные лейкоциты.
2 недели
Общая картина та же. Начало прорастания эпителия между дермой и имплантатом с краев раны.
3 недели
Зона эпителизации по длине раны больше. На отдельных препаратах полная эпителизация.
4 недели
Общая картина та же. Есть срезы с полной и неполной эпителизацией.
На фиг. 18 показано закрытие полнослойного кожного дефекта у крыс гидрогелевой композицией на основе коллагена путем печати in situ с помощью роботизированной системы согласно настоящему изобретению (окраска: гематоксилин-эозин), где:
1 неделя: а - граница нормальной кожи с раной, закрытой имплантатом, два вала лейкоцитарной инфильтрации; д - сегментоядерные лимфоциты в коллагене; к -лейкоцитарный вал между слоями коллагена;
2 недели: 6 - имплантат местами отслаивается; на границе с соединительной тканью -лейкоцитарная инфильтрация; ж - начало врастания эпителия в место контакта имплантата с интактной дермой;
3 недели: в - край отслаивающегося имплантата, начало зоны эпителизации; з - конец зоны эпителизации; л - граничащая с имплантатом нормальная кожа;
4 недели: г - участок полной эпителизации, граница с нормальной кожей, образование сосочковых структур; и - участок неполной эпителизации с неотслоившимся имплантатом.
Группа №3. 3-х слойный коллагеновый имплантат, содержащий аллогенные фибробласты (фиг. 19)
1 неделя
Коллагеновый имплантат отслоился от раны. В имплантате 3 слоя лейкоцитарной инфильтрации: между новообразованной дермой и имплантатом и между слоями коллагена в имплантате (между 1 и 2, 2 и 3 слоями). Зона дефекта полностью заполнена новообразованной васкуляризированной многоклеточной соединительной тканью. Имплантат пропитан кровью (эритроцитами).
2 недели
Основная картина та же. Начало эпителизации по краям раны (эпителий врастает между имплантатом и новообразованной дермой).
3 недели
Основная картина та же. На одних препаратах полная, на других, - неполная эпителизация.
4 недели
Основная картина та же. Полная эпителизация. На отдельных препаратах -тенденция к образованию эпителием сосочковых структур в дерме.
На фиг. 19 показано закрытие полнослойного кожного дефекта у крыс гидрогелевой композицией на основе коллагена и аллогенных фибробластов кожи путем печати in situ с помощью роботизированной системы согласно настоящему изобретению в динамике наблюдения (окраска: гематоксилин-эозин), где:
1 неделя: а - два вала лейкоцитарной инфильтрации в коллагеновом имплантате;
2 недели: 6 - начало врастания эпителия между имплантатом и новообразованной дермой;
3 недели: в - почти полная эпителизация;
4 неделя: г, д - участок полной эпителизации с отслоившимся имплантатом.
Группа №4. 3-х слойный коллагеновый имплантат, содержащий аллогенный лизат тромбоцитов (фиг. 20)
1 неделя
Зона дефекта полностью заполнена очень хорошо васкуляризированной многоклеточной соединительной тканью. Коллаген интимно прилегает к этой соединительной ткани. Как и в предыдущих группах животных, наблюдается 3 вала лейкоцитарной инфильтрации: между имплантатом и новообразованной дермой и между слоями коллагена (1 и 2, 2 и 3 слоями) в имплантате У некоторых животных имплантат пропитан кровью. Наблюдается начало эпителизации раны с краев.
2 недели
Общая картина та же. В одних срезах полная, в других - неполная эпителизация.
3 недели
Общая картина та же. В одних срезах полная, на других - неполная эпителизация (70-80% длины раны). Эпителий образует сосочки в дерме.
4 недели
Общая картина та же. Сохраняются участки интимной связи имплантата с новообразованной дермойа, где эпителизация отсутствует. Эпителий может быть плоским слоем, а может быть с тенденцией образования сосочковых структур в дерме.
На фиг. 20 показано закрытие полнослойного кожного дефекта у крыс гидрогелевой композицией на основе коллагена и аллогенного лизата тромбоцитов путем печати in situ с помощью роботизированной системы согласно настоящему изобретению в динамике наблюдения (окраска: гематоксилин-эозин), где:
1 неделя: а - первый слой коллагена, пропитанный эритроцитами; д - новообразованная соединительная ткань и имплантат пропитаны кровью; и - начало врастания эпителия между имплантатом и новообразованной дермой;
2 недели: 6 - протяженное врастание эпителия под имплантат, отслоение имплантата; е - почти полная эпителизация под имплантатом, тенденция к формированию сосочковых структур;
3 недели: в, ж - почти полная эпителизация под имплантатом; к - в отдельных местах - образование сосочковых структур; н - участок эпителизации под имплантатом, очень васкуляризированная дерма;
4 недели: г - на одном участке неполная эпителизация с неотслоившимся имплантатом; з - полная эпителизация на границе с нормальным эпителием; л - тенденция к образованию сосочковых эпителиальных структур в дерме.
Группа №5. 3-х слойный коллагеновый имплантат, содержащий аллогенные фибробласты и аллогенный лизат тромбоцитов тромбоцитов (фиг. 21)
1 недели
Рана полностью заполнена очень хорошо васкуляризированной новообразованной многоклеточной соединительной тканью. Рана покрыта 3-х слойным коллагеновым имплантатом, интимно прилегающим к новообразованной дерме. Два вала лейкоцитарной инфильтрации. В отдельных полях зрения имплантат пропитан кровью. Наблюдается эпителизация с краев раны. В один из срезов попал край раны с избыточным количеством коллагена.
2 недели
Общая картина та же. Есть срезы с полной и неполной эпителизацией. Есть участок гипертрофии эпителия.
3 недели
Общая картина та же. Срезы с полной и неполной эпителизацией. Участки неполной эпителизации там, где имплантат интимно прилегает к дерме. В некоторых полях зрения эпителий с тенденцией к образованию на границе с поверхностью зубчатых структур.
4 недели
Общая картина та же. Полная эпителизация с тенденцией образования сосочковых структур в дерме.
На фиг. 21 показано закрытие полнослойного кожного дефекта у крыс гидрогелевой композицией на основе коллагена и аллогенного лизата тромбоцитов, насыщенной аллогенными фибробластами путем печати in situ с помощью роботизированной системы согласно настоящему изобретению в динамике наблюдения (окраска: гематоксилин-эозин), где:
1 неделя: а, д - врастание эпителия между имплантатом и вновь образованной соединительной тканью; и - два вала лейкоцитарной инфильтрации; м - двойная толщина коллагена на краю имплантата;
2 недели: 6 - участки протяженной эпителизации; е - разрастание новообразованного эпителия в дерме под имплантатом;
3 недели: в, ж - полная эпителизация под имплантатом, общий вид; к - полная эпителизация с образованием сосочковых эпителиальных структур в дерме, край контакта имплантата с нормальной кожей, отслоение имплантата; к - эпителий в месте травмы образует «возвышения», характерные для нормальной кожи; н - эпителий ороговевающий с кератиновыми чешуйками;
4 недели: г, з - полная эпителизация, сосочковые эпителиальные структуры в дерме; л, о - полная эпителизация под имплантатом.
2.2 Изучение биомеханических свойств кожных регенератов Результаты проведенных испытаний представлены в таблице 2.

Из полученных результатов видно, что новообразованная кожа у животных групп 2 и 3 похожа по своим механическим свойствам на контрольную группу интактных образцов, в то время как в группах 1 и 4 образцы кожи оказались существенно более жесткими (возможно за счет формирования рубцовой ткани). При этом группа 5 отличалась как по параметрам прочности, так и по модулю упругости, что, с некоторыми допущениями, можно интерпретировать как отображение более сбалансированного процесса заживления полнослойного дефекта.
Таким образом, в процессе проведенного эксперимента у крыс - самцов линии Wistar в области спины ниже лопаток формировали полнослойный кожный дефект, который закрывали решетчатым имплантатом, сформированным путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению, используя в качестве «биочернил» гидрогелевые композиции на основе коллагенового продукта Viscoll («Имтек», Россия). Выявлено, что во всех группах животных процесс формирования кожного регенерата проходил в классические три фазы: воспаления, пролиферации и созревания и завершался в близкие сроки: через 3-4 недели после оперативного вмешательства.
Так, через неделю после формирования кожного дефекта во всех пяти группах наблюдалась лейкоцитарная инфильтрация: в контроле - на границах между соединительной тканью и коллагеновой мембраной; в опыте - между соединительной тканью и первым слоем имплантата, между первым и вторым, а также между вторым и третьим слоями имплантата. Ко второй неделе эксперимента выявленная лейкоцитарная инфильтрация во всех группах животных стихала.
Полученные результаты свидетельствуют об эффективном закрытии кожных дефектов гидрогелевыми решетчатыми имплантатами на основе коллагена («Имтек», Россия), сформированными путем биопечати in situ с помощью роботизированной системы согласно настоящему изобретению.
Использование роботизированной системы настоящего изобретения для закрытия полнослойного кожного дефекта критического размера у мини-пигов гидрогелевой композицией на основе коллагена или коллагена и аллогенного лизата тромбоцитов, без клеток и/или насыщенной аутологичными фибробластами кожи
1.1 Дизайн эксперимента Работа выполнена на 6 самцах мини-пигов (F1 гибриды пород Везинау и Вьетнамских вислобрюхих свиней), которые были распределены в три группы по два животных в каждой. Животным из группы I производили 4 полнослойных кожных дефекта в виде круга диаметром 5 см (по два дорсолатерально справа и слева, отступив от позвоночника приблизительно по 4-5 см с каждой стороны и с расстоянием между кожными ранами~ 4 см). У животных из групп 2 и 3 кожные дефекты формировали по два дорсолатерально справа (фиг. 22).
Для проведения операции животным проводилась седация и обезболивание: внутримышечно вводили препараты «Ксилазин» - 0,5-1 мл, «Золетил 100» - 0,2-0,5 мл и «Атропин» - 0,5-1,0 мл, после чего проводили ингаляционный наркоз «Изофлураном». Кожный дефект формировали остро-тупо с радиальным хирургическим разрезом на глубину всех слоев кожи (приблизительно 7-8 мм), последующим отслаиванием круглого кожного лоскута от подлежащей мышечной фасции. После удаления лоскута края раны в 4-х равноудаленных точках (на 3, 6,9,12 «часах») пришивали к подлежащим тканям в целях торможения контракции кожного дефекта. Свободные концы шовного материала использовали для фиксации стерильных марлевых салфеток, наложенных животным после нанесения гидрогелевых композиций с помощью роботизированной системы или коллагеновых мембран. Салфетки удаляли через 6 суток после операции В случае дополнительной установки аппаратов для формирования вакуума в области раневого дефекта использовалось оригинальное покрытие по методике Оболенского В Н., которое снимали через 9 суток после операций.
Для закрытия кожных дефектов использовали три варианта гидрогелей для печати:
- коллаген Viscol, насыщенный аутологичными фибробластами кожи (ФК) (животные 1 и 2, левый бок, верх и низ, группа 1);
- коллаген Viscol, насыщенный аутологичными ФК и аллогенным пулированным ЛТ (животные 1 и 2, правый бок, верх, низ, группа 1; животные 4 и 6, верх, группа III);
- коллаген Viscol, насыщенный аллогенным пулированным ЛТ (животные 4 и 6, низ, группа III).
Во второй группе животных (животные 3 и 5, верх, низ) сформированный дефект покрывали тонкой коллагеновой мембраной Viscol.
Послеоперационное ведение ран включало ветеринарный осмотр и санитарно-гигиеническую обработку ран. Начиная с 1-х суток после оперативных вмешательств все животные были активны; аппетит, жажда - в норме; дефекация, диурез - без изменений. Кожа чистая, эластичная; поверхностные лимфоузлы не пальпировались. Видимые слизистые оболочки были розовые, влажные. Живот мягкий, безболезненный. Дыхание частое, везикулярное. Температура - в пределах нормы.
Для ведения ран было назначено:
- ежедневная наружная обработка марлевых салфеток (водный раствор 0,05 хлоргексидина) в течение 1-й недели всем животным;
- «Доксициклин» в объеме 1,5 мл, внутримышечно, всем животным в 1-е и на 3-й сутки после операций;
- «Кетоджект» в объеме 1,0 мл, внутримышечно, всем животным в 1-е и на 3-й сутки после операций;
- круглосуточное дежурство до снятия вакуумных повязок.
1.2 Методика получения первичной культуры аутологичных фибробластов кожи (ауто-ФК) мини-пигов
Для получения аутологичной культуры ФК использовали 6 голов животных. В асептических условиях операционной производили забор кожного лоскута из шейной области размером 0,8×1,5 см, толщиной 0,8-0,9 см и переносили в среду для транспортировки: среда ДМЕМ с добавлением двукратной концентрации антибиотиков (стрептомицин 200 мкг/мл; пенициллин, 200 ед./мл, ПанЭко, Россия) (АБ). Транспортировку полученных образцов ткани в лабораторию осуществляли в сумке-холодильнике в тот же день.
В лаборатории в стерильных условиях ламинарного бокса полученную ткань переносили в пробирки с раствором фосфатно-солевого буферного раствора Дюльбекко (DPBS) с добавлением двухкратной концентрации АБ и тщательно ополаскивали. Для вымывания эритроцитов из биоптата пробирки с фрагментами кожи в DPBS помещали в С02 инкубатор (Sanyo, Япония) на 5 минут при 37°С. После замены фосфатного буфера на свежую порцию процедуру повторяли несколько раз.
Для выделения клеток из образцов кожи использовали сочетание механической и ферментативной дезагрегации. Образцы кожи переносили в чашку Петри с 5-10 мл холодного DPBS, содержащего 100 мкг/мл гентамицина и механически измельчали на фрагменты размером 1,0-2,0 мм. Полученные фрагменты ткани переносили в пробирку объемом 50 мл (Costar, США) и осаждали центрифугированием при 1200 об/мин. в течение 10 минут (Eppendorf, Германия). После удаления супернатанта к осадку добавляли 20 мл раствора Версена (ПанЭко, Россия) и такой же объем 0,25% раствора трипсина (ПанЭко, Россия), перемешивали, содержимое переносили в колбу Эрленмейера и ставили на шейкер (Elmi, Латвия) в термостат на 15 минут для ферментативной дезагрегации.
Выделенные клетки собирали с помощью сита в центрифужную пробирку объемом 50 мл, добавляли среду для отмывки состава: питательная среда DMEM («ПанЭко», Россия), 10% эмбриональной телячьей сыворотки (ЭТС, «НуОопе», США), 100 мкг/мл гентамицина (в соотношении 1:3-1:5) и центрифугировали в течение 10 минут при 200g в центрифуге с охлаждением (+6°С, Eppendorf, Германия). Супернатант после центрифугирования сливали, к осадку добавляли 5 мл полной ростовой среды (ПРС) состава: питательная среда DMEM, 2 мМ глютамина, 10% ЭТС, 50 мкг/мл гентамицина и 25 мМ буфера HEPES. Пробирку с суспензией выделенных клеток оставляли в холодильнике при+4°С (1-я порция).
Процедуру трипсинизации повторяли трижды, после чего выделенные порции суспензии клеток объединяли, фильтровали через нейлоновые сита с диаметром пор 100 меш (Sarstedt, Германия), для удаления клеточных агрегатов добавляли двойной объем ПРС и осуществляли отмывку центрифугированием (1000 об/мин, 15 минут). Полученный осадок ресуспендировали в ПРС и подсчитывали концентрацию жизнеспособных ФК в автоматическом счетчике клеток (Countess, Tnvitrogen, Thermoscientific, США).
Клетки рассеивали по флаконам (Costar, Thermoscientific, США) при плотности посева 2×105 кл./см2. Культивирование ФК проводили при 37°С и 5% С02 (С02-инкубатор Sanyo, Япония). Каждые 3-4 дня проводили смену среды на свежую порцию. Пересев культуры осуществляли при получении предконфлюэнтного монослоя.
Для экспериментов по закрытию полнослойного кожного дефекта мини-пигов гидрогелевой композицией с использованием культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению использовали культуру аутологичных ФК (пассаж 4). Для этого полученные культуры ФК, выращенные в культуральных флаконах, снимали с помощью раствора трипсин-версена (1:1), отмывали центрифугированием в DPBS- растворе в течение 10 минут при 1000 об/мин. Суспензию клеток после отмывки ресуспендировали в среде DMEM без фенолового красного.
В результате было получено следующее количество клеток:
ФК №1 - 6,5 млн.кл. в 10,0 мл DMEM
ФК №2 - 6,7 млн.кл. в 10,0 мл DMEM
ФК №4 - 6,6 млн.кл. в 15,0 мл DMEM
ФК №6 -6,7 млн.кл. в 15,0 мл DMEM.
В экспериментах использовали 3×106 ФК на дефект.
1.3 Методика получения пулированного образца лизата тромбоцитов (ЛТ) мини-пигов.
Образцы венозной крови мини-пигов (п=6) объемом по 20 мл от каждого животного (две пробирки по 10 мл с консервантом (цитрат натрия в составе буфера ACD-A)) были доставлены в лабораторию в сумке-контейнере с хладоагентами. Для осаждения эритроцитов первым этапом производили центрифугирование образцов крови (скорость 158 g, 15 минут, центрифуга Eppendorf 581 OR, Германия). Далее из пробирок отбирали супернатант, обогащенный тромбоцитами (богатая тромбоцитами плазма - БоТП), объединяли в отдельной маркированной (номер животного, дата) пробирке с консервантом (цитрат натрия) и определяли концентрацию тромбоцитов (лабораторный анализатор Sysmex/Beckman Coulter).
Далее образцы БоТП концентрировали до конечной концентрации тромбоцитов 1,75×109 в мл, осаждая тромбоциты центрифугированием при 3130 g в течение 15 минут (центрифуга Eppendorf 8150R) и отбирая излишний объема супернатанта.
Для получения лизата тромбоцитов (ЛТ) осуществляют 3-кратный температурный лизис образцов БоТП (замораживание при -80°С в течение 24 часов в низкотемпературном холодильнике/ оттаивание при +37°С на водяной бане до равномерного прогревания БоТП). Для осаждения фрагментов тромбоцитов образцы ЛТ от каждого животного центрифугировали при 3130 g в течение 15 минут (центрифуга Eppendorf 8150R).
Для удаления фибриногена к каждому образцу ЛТ добавляли 10% раствор кальция хлорида (до конечной концентрации 10 ммоль/л), инкубировали в термостате при +37°С в течение 2,5 часов и затем стабилизировали сгусток фибрина при +4°С в течение 16-18 часов.
Для его осаждения ЛТ центрифугировали при 3130 g в течение 15 минут (центрифуга Eppendorf 8150R).
На заключительном этапе работы образцы ЛТ пулировали и затем последовательно фильтровали через фильтры 0,45 мкм и 0,2 мкм (Costar, США) разливали по аликвотам и хранили при -20°С до начала экспериментов с 3D-печатью.
1.4 Состав биочернил для 3D-печати patches (заплаток) для закрытия полнослойного кожного дефекта у мини-пигов с использованием роботизированной системы согласно настоящему изобретению
Для приготовления каждой порции «биочернил» для биопечати in situ с целью заполнения одного полнослойного кожного дефекта использовали коммерческие стерильные 1,5 мл раствора коллагена «Viscoll» с концентрацией 80 мг/мл («Имтек», Россия). Буфер для нейтрализации коллагена на основе 160 мМ TRIS (рН 7,2-7,4) добавляли в объеме 120 мкл к 1,38 мл культуральной среды, содержащей в отдельных случаях 20%-й раствор пулированного аутологичного образца ЛТ свиней или 2 млн. аутологичных фибробластов кожи, после чего смешивали в соотношении 1:1 с раствором коллагена. Таким образом, для формирования 3-слойной гидрогелевой решетчатой структуры с целью заполнения 1 полнослойного кожного дефекта расходовалось приблизительно 3 мл готовых «биочернил».
1.5 Проведение гистологического исследования зоны операции
Для получения гистологических препаратов примерно через 35 суток после закрытия дефекта практически у всех животных их выводили из эксперимента путем внутривенной эвтаназии (Ксила - 3.0 мл, Золетил 100 - 0.5 мл, Анастефол 5% - 4 мл). Участки кожи иссекали, отступая от зоны дефекта по 1 - 1,5 см с каждой стороны. Иссеченные фрагменты кожи расправляли на пластиковом каркасе с вырезанным «окном» для качественной фиксации биологического материала, которую проводили в 10% нейтральном растворе формалина на фосфатном буфере (ООО «Биовитрум» (Санкт-Петербург)). Далее готовили фронтальные срезы кожи толщиной 4-5 мкм центральной зоны и далее материал заливали в парафин и окрашивали их гематоксилином и эозином. Анализ гистологических препаратов проводили на микроскопе Nikon Eclipse Ti (Япония).
2. Описание гистологических препаратов
2.1 Контроль
Нормальная кожа мини-пигов представлена многослойным ороговевающим эпителием, который вдается в дерму сосочками. Дерма малоклеточная, содержит много коллагена. Редкие (в сравнении с мышами) луковицы волос.
2.2 Закрытие полнослойного кожного дефекта мини-пигов гидрогелевой композицией на основе коллагенового продукта Viscoll и культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настотцему изобретению
Место дефекта на всем протяжении закрыто многослойным эпителием, формирующий выпячивания в дерму-сосочки. В местах прилегания к эпителию фибрина - гипертрофия эпителия с крупными сосочками (на срезах выглядят овальными образованиями, заполненными дермой). В отдельных местах между эпителием и дермой – скопления эритроцитов. Дерма в сравнении с нормой более многоклеточная (фиг. 23).
На фиг. 23 показано формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll и культуры аутологичных фибробластов кожи (окраска: гематоксилин-эозин), где: а, б - животное №1, в-е - животное №2 (группа I).
2.3 Закрытие полнослойного кожного дефекта мини-пигов гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ и культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению
На гистологических препаратах прослеживается хорошо развитый многослойный эпителий с сосочками на большей части протяженности дефекта. В местах прилегания к эпителию фибрина - гипертрофия эпителия с крупными сосочками. В отдельных местах между эпителием и дермой - скопления эритроцитов. Дерма в сравнении с нормой - более многоклеточная (фиг. 24).
На фиг. 24 показано формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ и культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению (окраска: гематоксилин-эозин), где: а, б - животное №1, в, г - животное №2 (группа I).
2.4 Закрытие полнослойного кожного дефекта мини-пигов тонкой коллагеновой мембраной
На части участков новообразованной кожи эпителий нормальной толщины с тенденцией к формированию сосочков. На части участков (в местах прилипания к эпителию фибрина, пропитанного лейкоцитами) гипертрофия эпителия с крупными сосочками. Многоклеточная хорошо васкуляризированная дерма (фиг. 25).
На фиг. 25 показано формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта тонкой коллагеновой мембраной (окраска: гематоксилин-эозин), где: а, б, в - животное №3, г, д, е - животное №5 (группа II).
2.5 Закрытие полнослойного кожного дефекта мини-пигов гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ, культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению при вакуумной компрессии зоны дефекта
На гистологических препаратах в ряде участков - хорошо развитый эпителий с сосочками, в отдельных местах между эпителием и дермой-скопления эритроцитов. В местах прилегания к эпителию фибрина с лимфоидной инфильтрацией - эпителий гипертрофирован, с крупными сосочками. Дерма более многоклеточная, чем в норме (фиг. 26).
На фиг. 26 показано формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll, пулированного ЛТ, культуры аутологичных фибробластов кожи при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению при вакуумной компрессии зоны дефекта (окраска: гематоксилин-эозин), где: а-г - животное №4, д, е - животное №6 (группа III).
2. б. Закрытие полнослойного кожного дефекта мини-пигов гидрогелевой композицией на основе коллагенового продукта Viscoll и пулированного ЛТ при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению при вакуумной компрессии зоны дефекта
В ряде участков - сравнительно тонкий эпителий с сосочками (норма). В отдельных местах гипертрофия эпителия с развитыми сосочками (там, где к эпителию снаружи прилегает фибрин, пропитанный лимфоцитами) (фиг. 27).
На фиг. 27 показано формирование кожного регенерата у мини-пигов при закрытии полнослойного кожного дефекта гидрогелевой композицией на основе коллагенового продукта Viscoll и пулированного ЛТ при in situ биопечати с помощью роботизированной системы согласно настоящему изобретению при вакуумной компрессии зоны дефекта (окраска: гематоксилин-эозин), где: а, 6 - животное №4, в, г - животное №6 (группа III).
Резюмируя данные проведенного эксперимента, можно отметить, что во всех трех группах животных сроки очистки раневой поверхности от струпа не зависят от способа послеоперационного ведения раны, у всех животных это происходило в течение 32-35 суток. На основании анализа гистологических препаратов выявлено, что на 35-е сутки после формирования полнослойного кожного дефекта у мини-пигов произошло органотипическое замещение дефекта с формированием многослойного эпителия с сосочками в дерме и собственно дермы. В участках воспалительной реакции (наличие фибрина, пропитанного лимфоцитами, снаружи новообразованного эпителия) эпителий и сосочки гипертрофированы. Дерма в новообразованной коже, в отличие от интактной, более многоклеточная, не содержит волосяных луковиц, наиболее васкуляризована у животных, где рана закрывалась коллагеновой сеткой Viscol.
Таким образом, роботизированная система биопечати in situ согласно настоящей группе изобретений может быть использована на поверхностях частей тела, которые подвержены физиологическим колебаниям (связанными, например, с дыхательными движениями), для лечения дефектов кожи на всю толщину.
Эксперименты продемонстрировали его реализуемость в качестве доказательства концепции и показали ранозаживляющие свойства с использованием «биочернил» на основе коллагена, лизата тромбоцитов и дермальных фибробластов.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные случаи приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть, понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ БИОЧЕРНИЛ ДЛЯ ЛИСТА ДЛЯ РЕГЕНЕРАЦИИ ДЕРМЫ, СПОСОБ ИЗГОТОВЛЕНИЯ ИНДИВИДУАЛИЗИРОВАННОГО ЛИСТА ДЛЯ РЕГЕНЕРАЦИИ ДЕРМЫ С ИСПОЛЬЗОВАНИЕМ КОМПОЗИЦИИ И ИНДИВИДУАЛИЗИРОВАННЫЙ ЛИСТ ДЛЯ РЕГЕНЕРАЦИИ ДЕРМЫ, ИЗГОТОВЛЕННЫЙ С ИСПОЛЬЗОВАНИЕМ СПОСОБА ИЗГОТОВЛЕНИЯ БИОЧЕРНИЛ | 2018 |
|
RU2793240C2 |
| СПОСОБ ОПЕРАТИВНОГО ЛЕЧЕНИЯ ОЖОГОВЫХ РАН | 2018 |
|
RU2673806C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ВРОЖДЕННЫМ БУЛЛЕЗНЫМ ЭПИДЕРМОЛИЗОМ ПУТЕМ КОМБИНИРОВАННОГО ПРИМЕНЕНИЯ АЛЛОГЕННЫХ ФИБРОБЛАСТОВ ЧЕЛОВЕКА И ЖИВОГО ЭКВИВАЛЕНТА КОЖИ | 2020 |
|
RU2779997C2 |
| СПОСОБ КОРРЕКЦИИ СТРУКТУРНО-ФУНКЦИОНАЛЬНЫХ ИЗМЕНЕНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 2005 |
|
RU2277423C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛУБОКОГО ОЖОГА КОЖИ | 2008 |
|
RU2372922C1 |
| Способ создания тканеинженерных конструкций методом биопечати биочернилами для регенерации хрящевой ткани в условиях организма | 2021 |
|
RU2770558C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО АНАЛОГА ПЕРИФЕРИЧЕСКОГО НЕРВА В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2815265C1 |
| БИОЛОГИЧЕСКИЙ АКТИВНЫЙ КОМПЛЕКС ДЛЯ ОРГАНОГЕНЕЗА | 2003 |
|
RU2254146C2 |
| Ранозаживляющий гель с липосомами и способ его получения | 2019 |
|
RU2697669C1 |
| СПОСОБ ПРИМЕНЕНИЯ БЕСКЛЕТОЧНОГО ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ ЗАЖИВЛЕНИЯ РАН | 2023 |
|
RU2816034C1 |
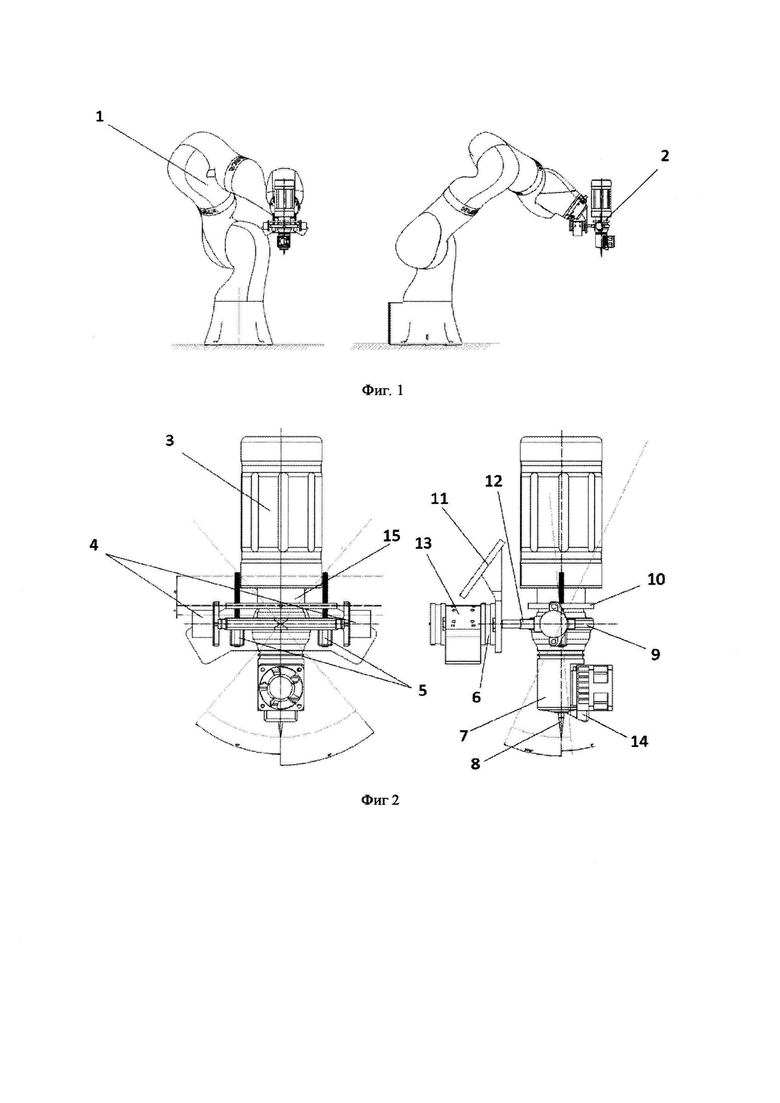
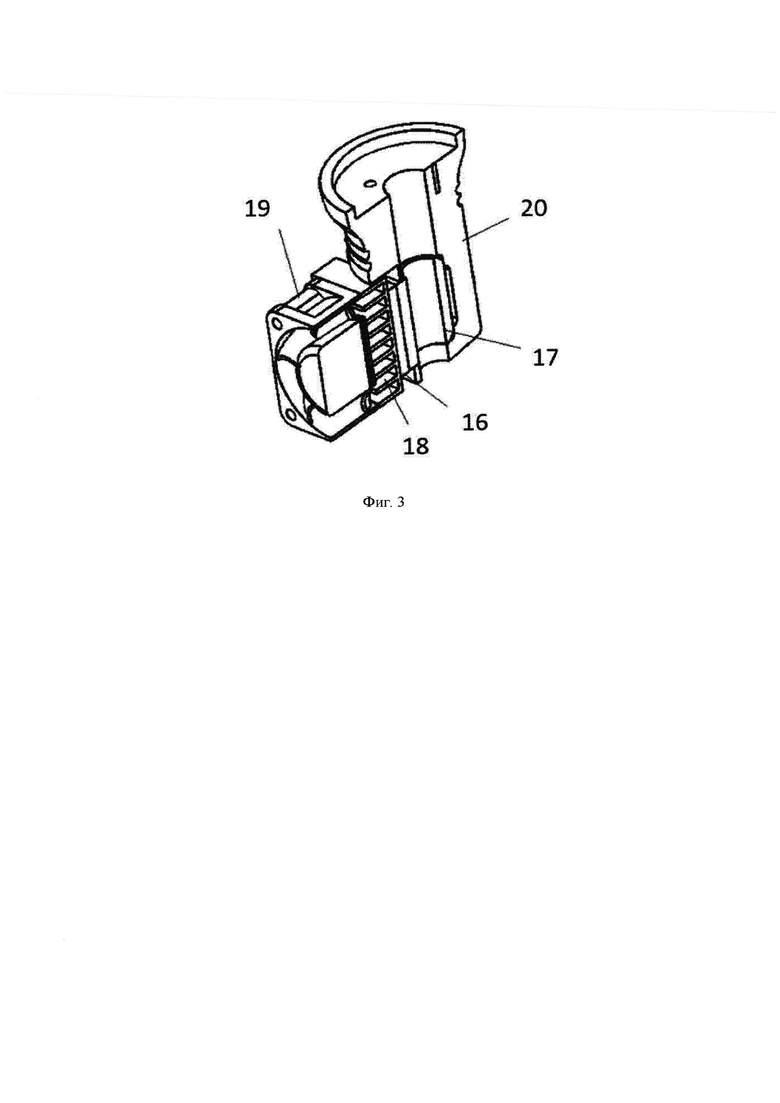
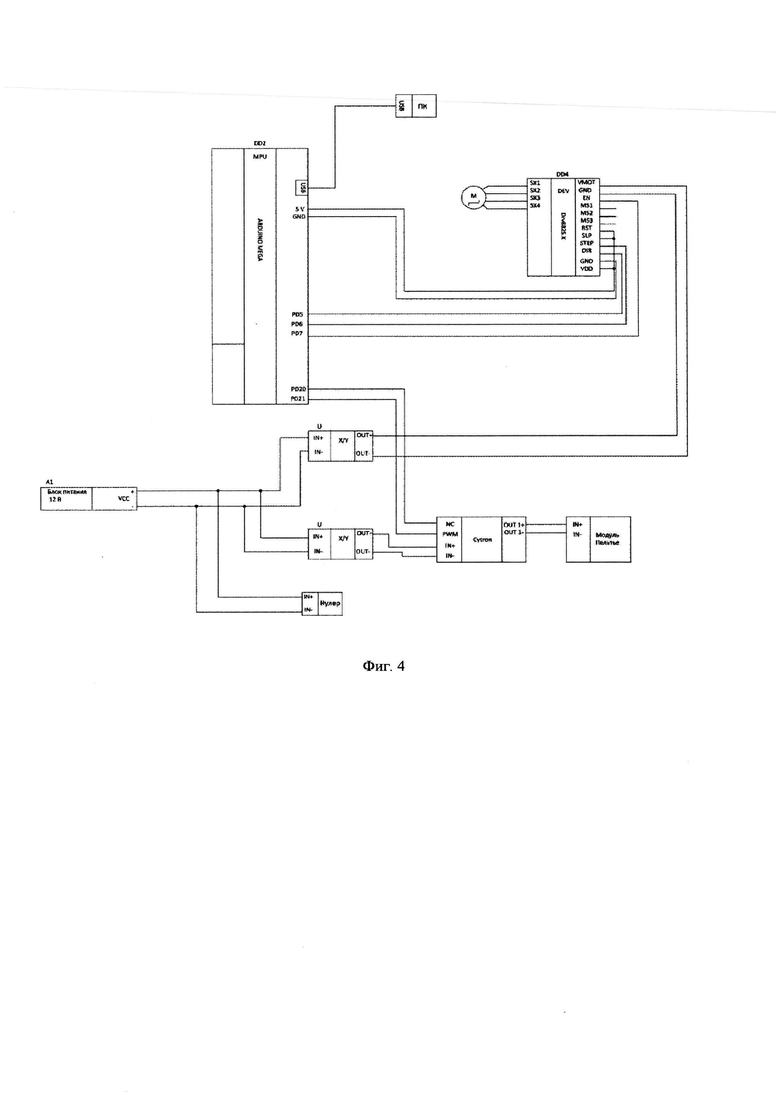
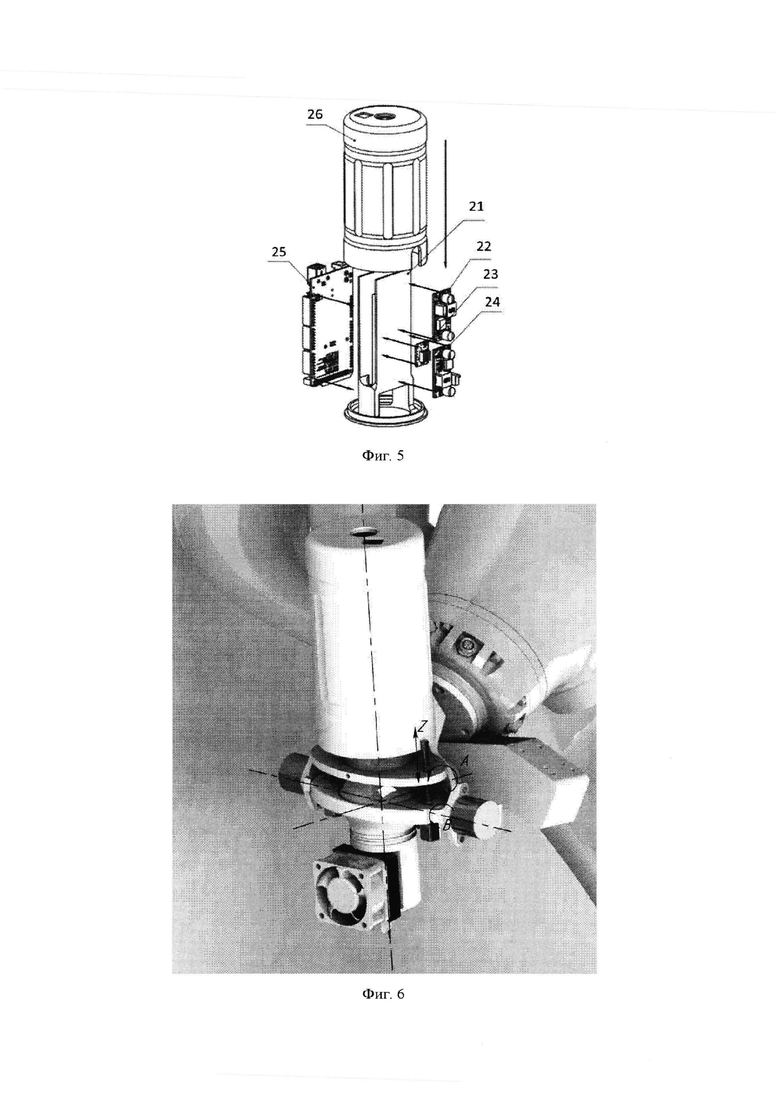
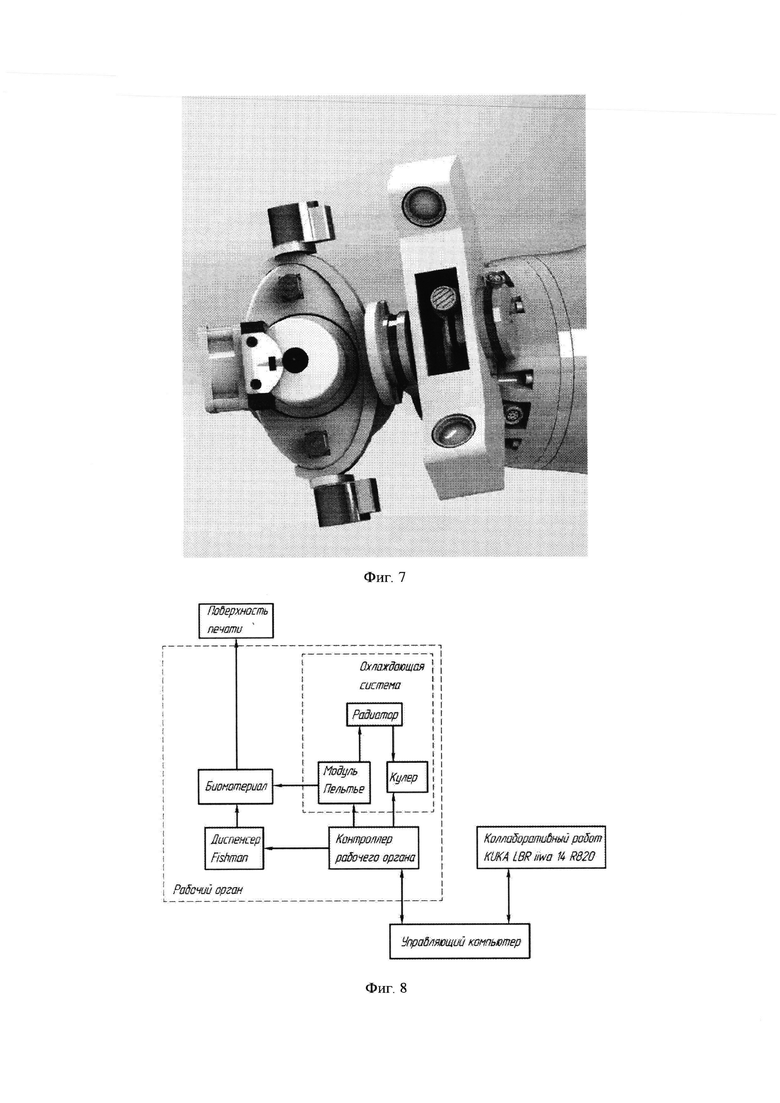
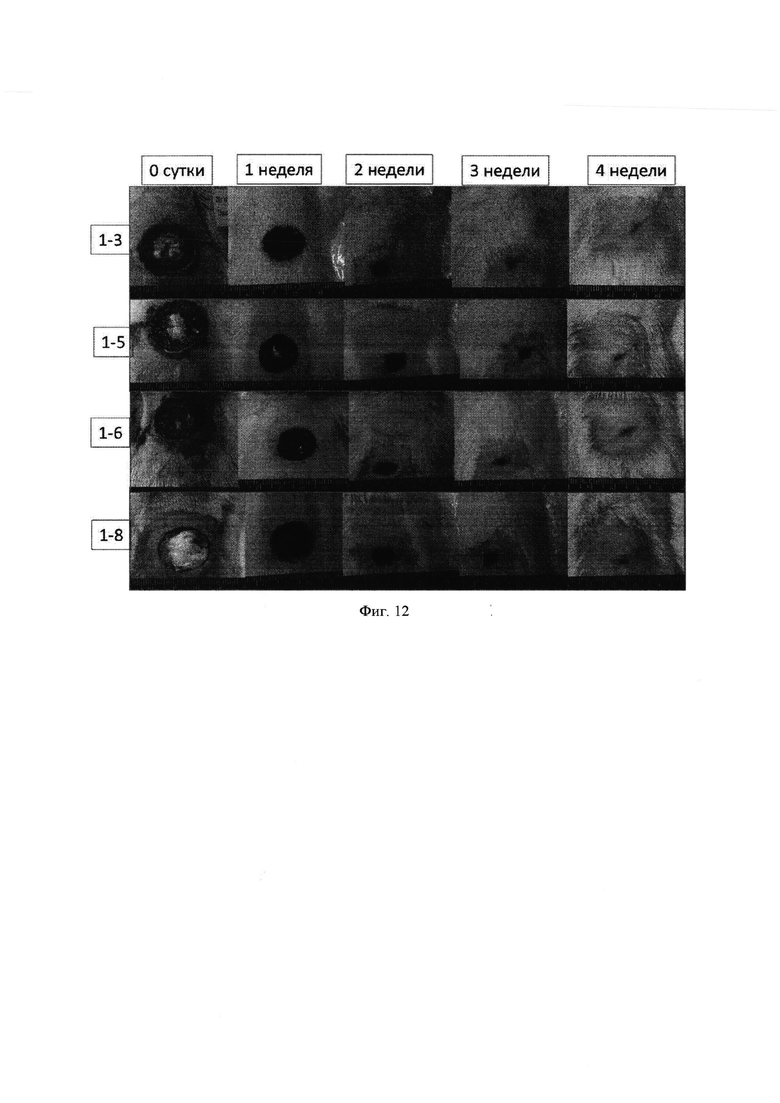
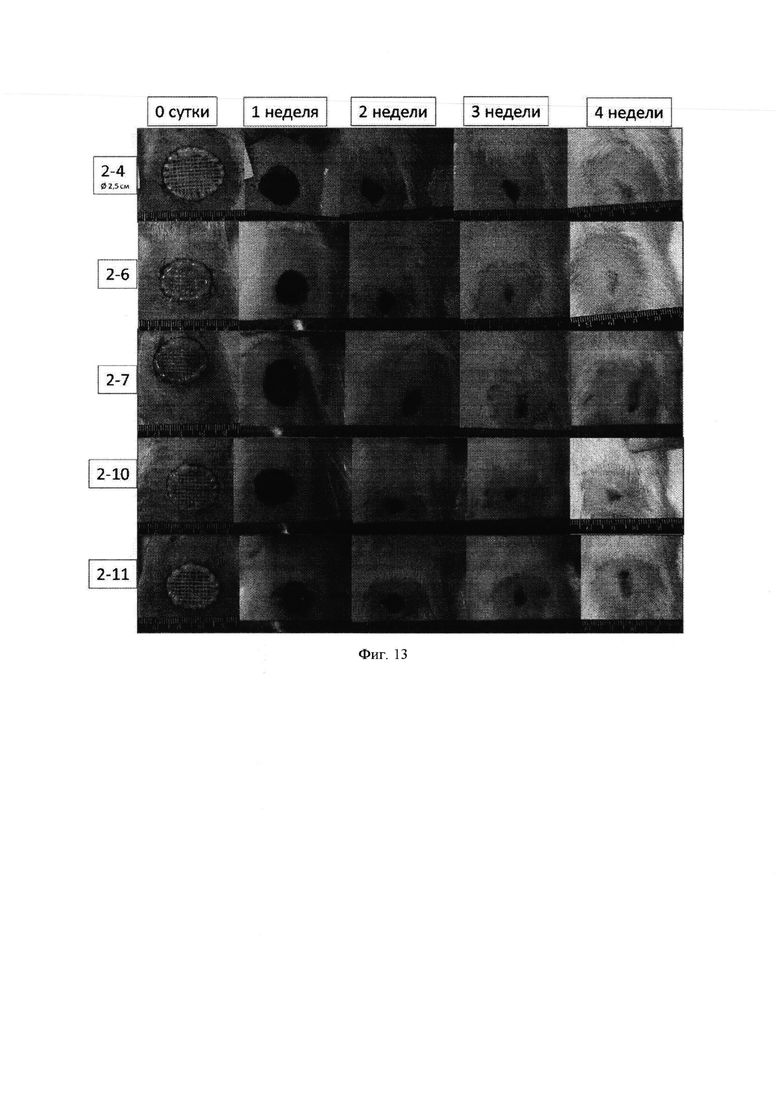

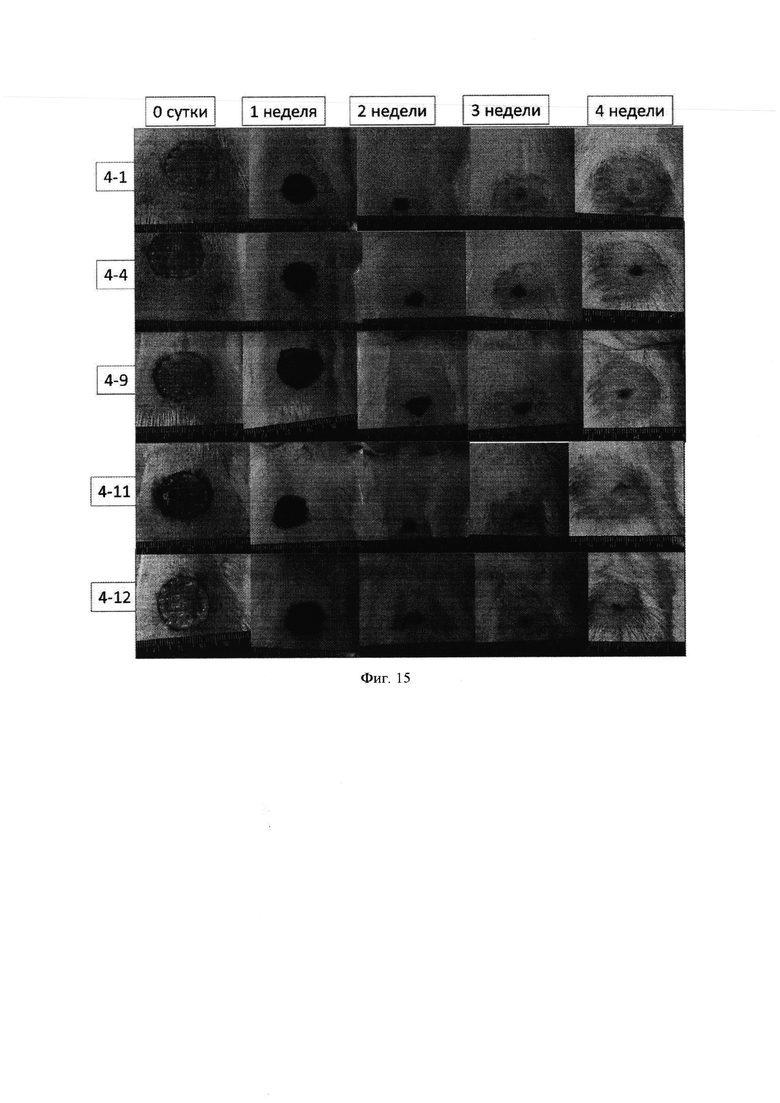
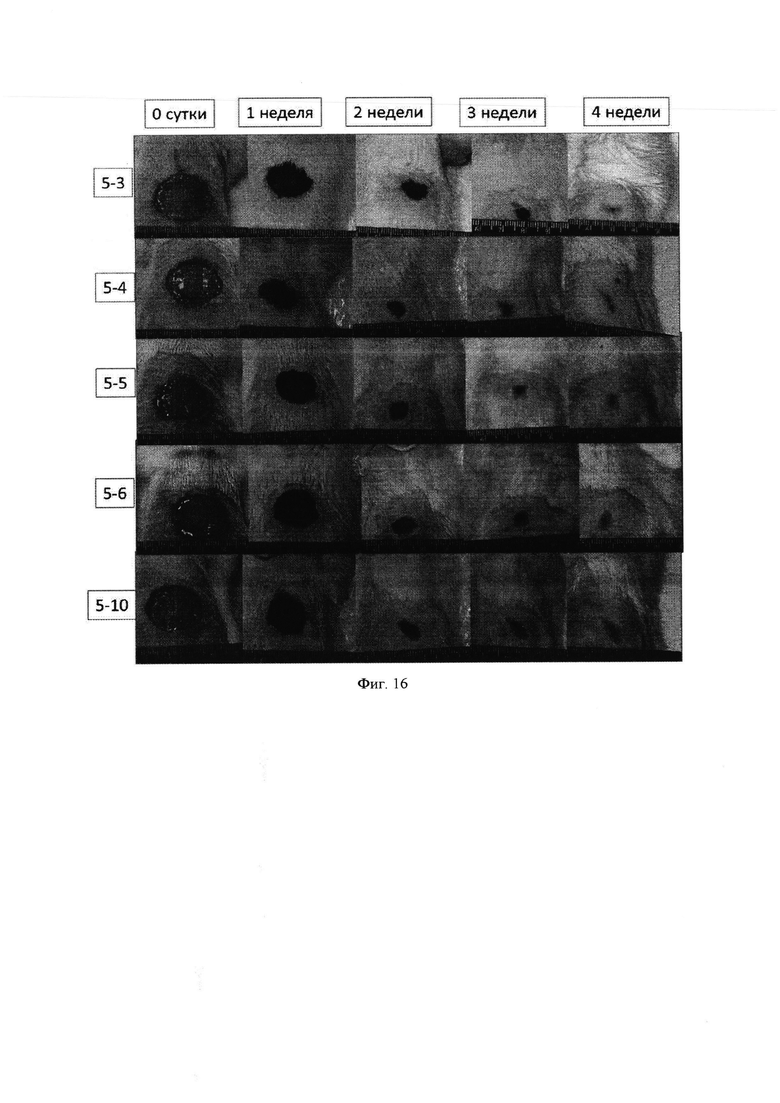

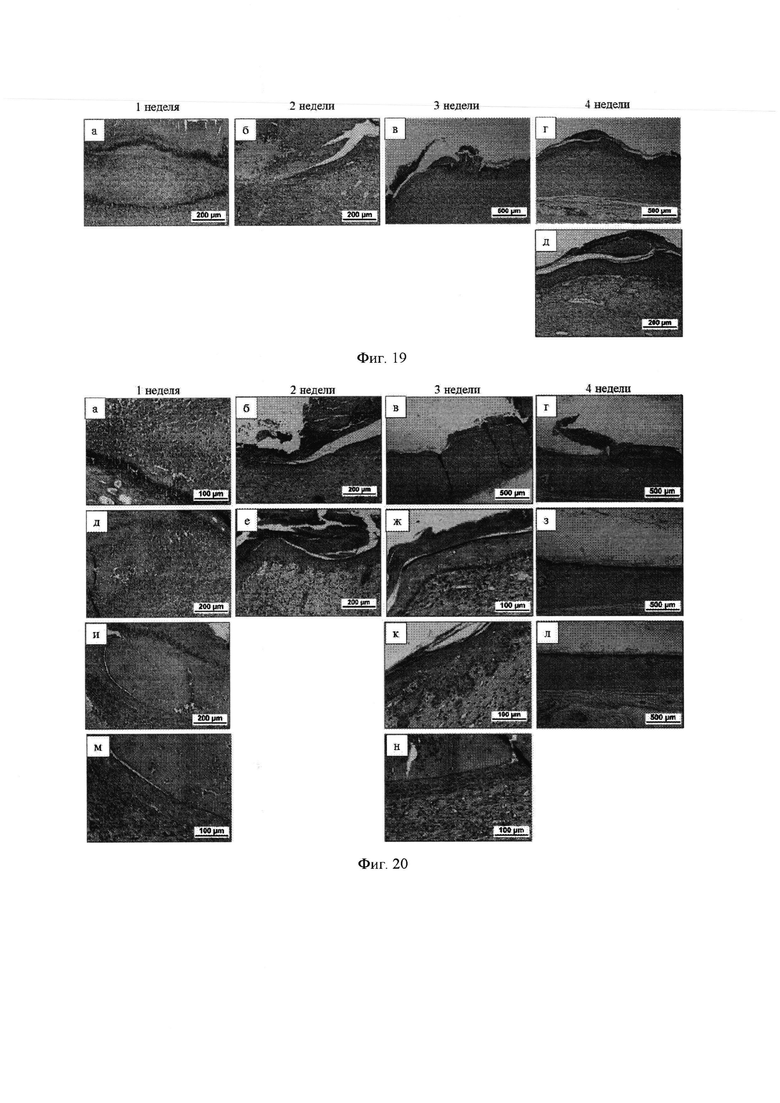


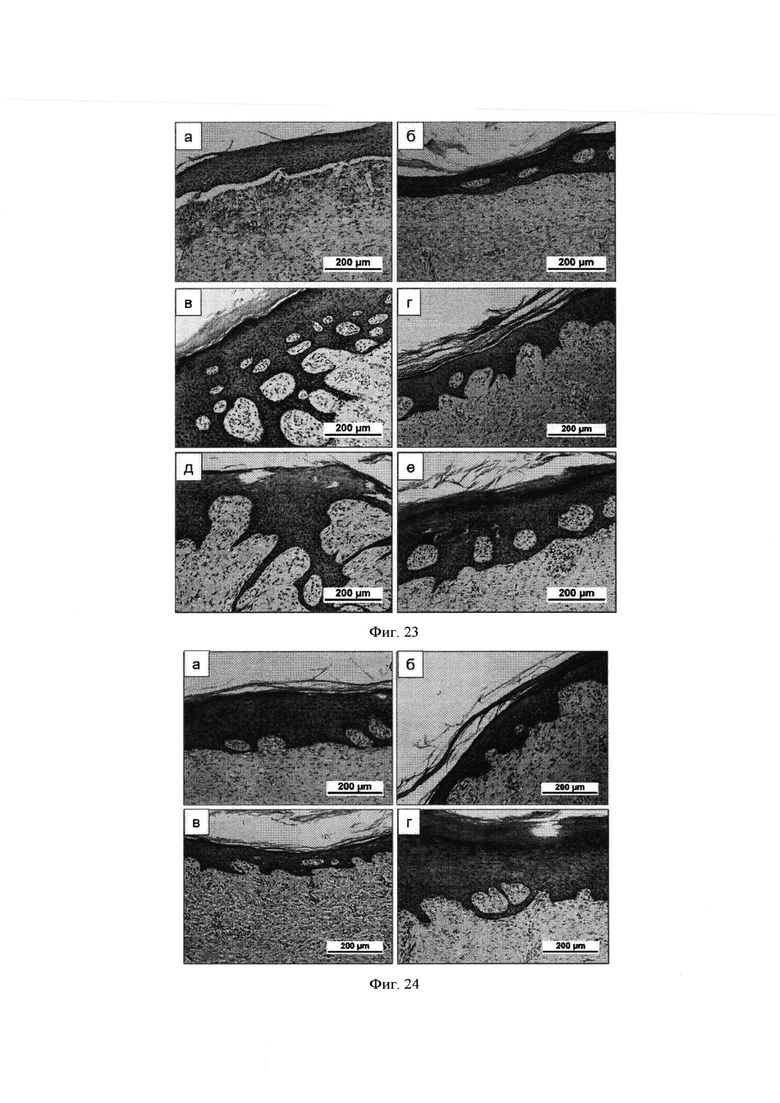
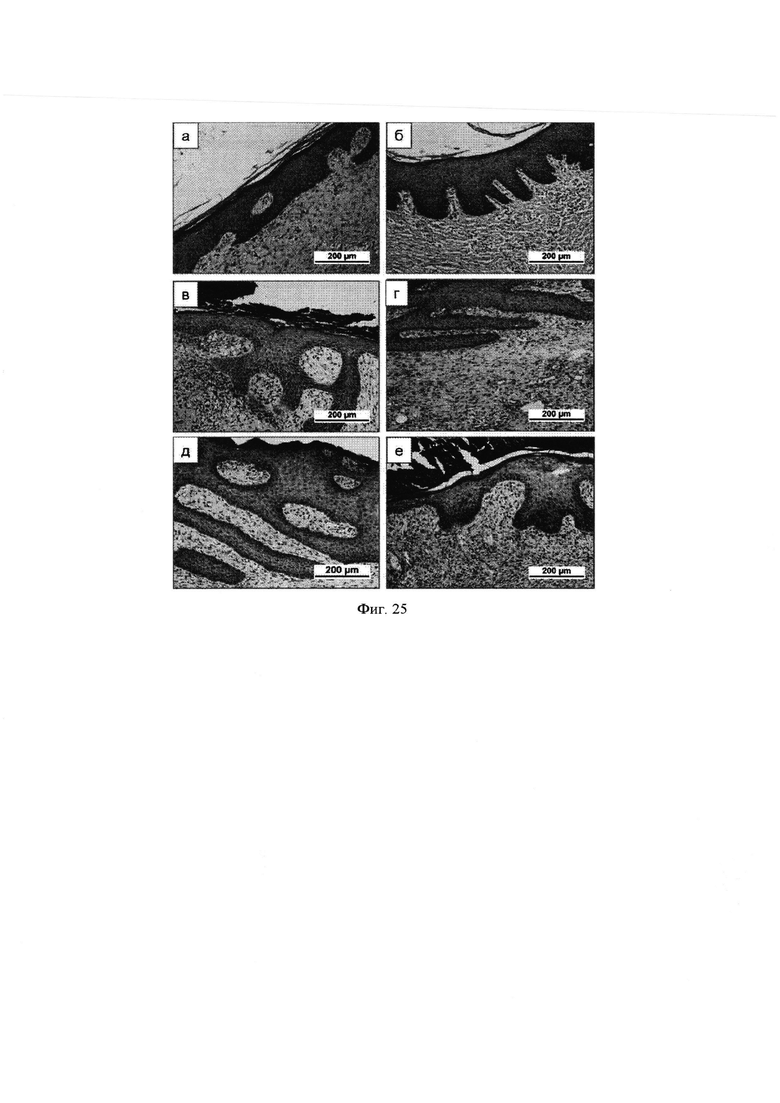
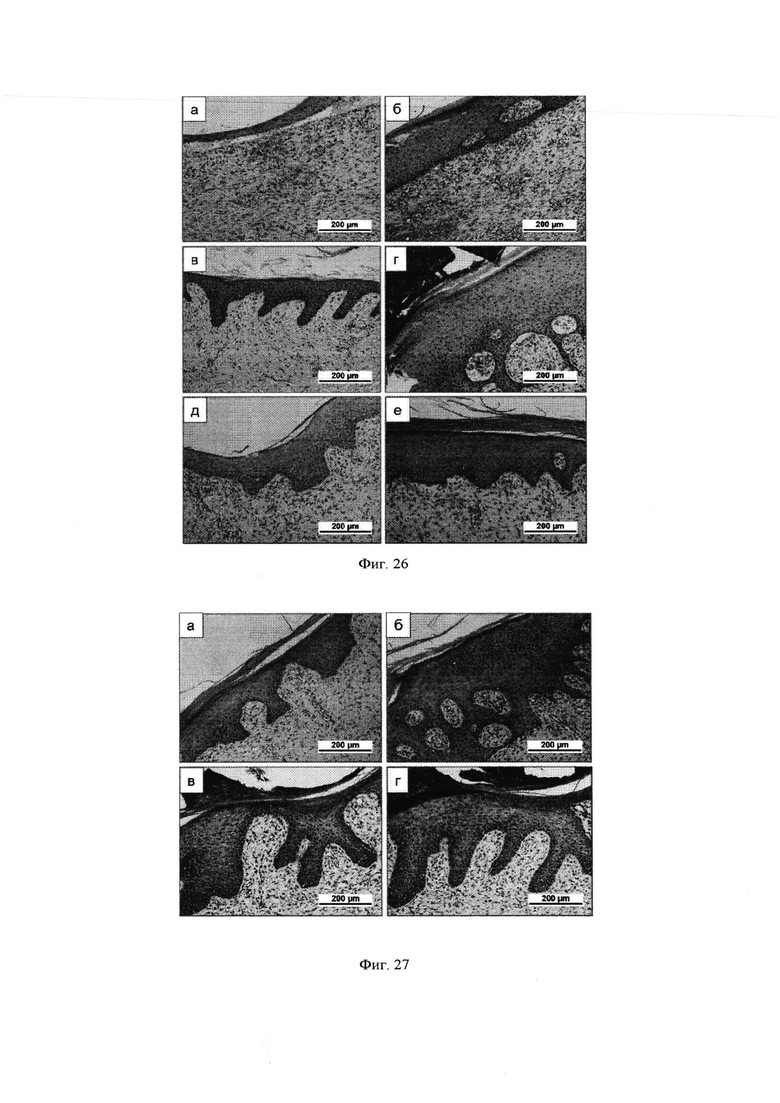
Изобретение относится к роботизированной медицинской системе для 3D-биопечати путем непосредственного нанесения материала для печати на дефект кожи пациента в режиме реального времени. Технический результат заключается в обеспечении возможности быстрой неинвазивной печати материала на большинство неровных поверхностей, в том числе с учетом изгиба поверхности тела человека (пациента) в месте дефекта, а также неровностей самой раневой поверхности. Предложенная система включает в себя манипулятор, контроллер манипулятора, вычислительный модуль, выполненный с возможностью расчета траектории печати на основе полученных данных, управления скоростью и направления движения манипулятора, управления скоростью выдавливания материала и контроля температуры материала для печати, управления печатью. Манипулятор выполнен в виде коллаборативной роботизированной руки, к фланцу которой прикреплен рабочий орган, включающий по меньшей мере один диспенсер, охлаждающую систему, модуль позиционирования, блок управления, по меньшей мере, один датчик расстояния, направленный на поверхность печати. Выполнение модуля позиционирования из двух поворотных механизмов, выполненных с возможностью перемещения диспенсера вдоль поверхности дефекта, и линейного механизма перемещения для перемещения диспенсера вдоль оси диспенсера, которая перпендикулярна поверхности печати, позволяет корректировать траекторию движения рабочего органа при печати. 2 н. и 24 з.п. ф-лы, 27 ил., 2 табл.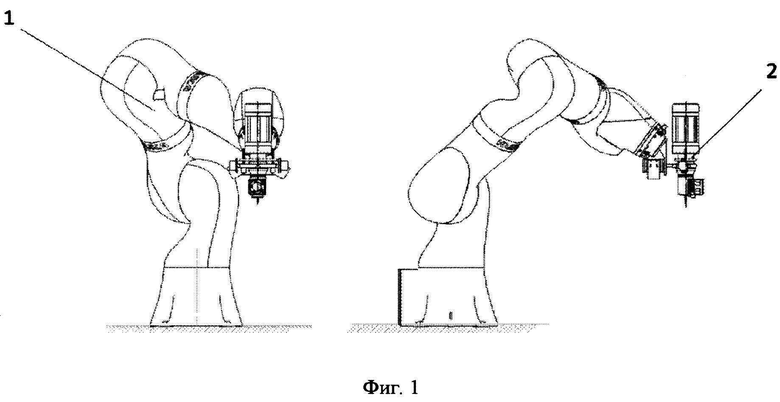
1. Роботизированная медицинская система для 3D-биопечати путем непосредственного (in situ) нанесения материала для печати на дефект кожи пациента в режиме реального времени, которая включает:
а) манипулятор, выполненный в виде коллаборативной роботизированной руки с по меньшей мере 5-ю степенями свободы, причем к фланцу роботизированной руки прикреплен рабочий орган, включающий
- по меньшей мере один диспенсер, обеспечивающий возможность как выдавливания, так и всасывания наносимого материала для печати с помощью шагового двигателя диспенсера, при этом диспенсер имеет шток, в наконечник которого вкручен поршень сменного шприца с соплом,
- охлаждающую систему, выполненную с возможностью обеспечения охлаждения и поддержания заданной температуры материала для печати в по меньшей мере одном шприце,
-модуль позиционирования, состоящий из двух поворотных механизмов, закрепленный с помощью фланцев на диспенсере, выполненных с возможностью перемещения диспенсера вдоль поверхности дефекта, и линейного механизма перемещения для перемещения диспенсера вдоль оси диспенсера, которая перпендикулярна поверхности печати, для корректировки траектории движения рабочего органа при печати,
- блок управления, закрепленный на диспенсере, содержащий контроллер управления модулем позиционирования, драйвер управления шаговым двигателем диспенсера, драйвер управления охлаждающей системой,
- по меньшей мере, один датчик расстояния, направленный на сопло,
б) контроллер манипулятора;
в) вычислительный модуль, выполненный с возможностью
- получения от контроллера манипулятора записанных в его память координат точек, характеризующих поверхность дефекта,
- расчета траектории печати на основе полученных данных и отправки ее на контроллер манипулятора,
- управления скоростью и направлением движения манипулятора в пространстве,
- управления линейной скоростью перемещения по меньшей мере одного диспенсера с помощью по меньшей мере одного линейного актуатора,
- управления скоростью выдавливания материала для печати из сопла по меньшей мере одного шприца,
- контроля температуры материала для печати в по меньшей мере одном шприце и управления охлаждающей системой посредством драйвера управления охлаждающей системой,
- управления печатью, в процессе которой
- вычислительный модуль выполнен с возможностью направления в контроллер манипулятора команды о начале печати, а также о режиме печати, для обеспечения нанесения материала для печати на дефект кожи пациента в соответствии с рассчитанной траекторией,
причем контроллер манипулятора выполнен с возможностью управления движением роботизированной руки и соединенного с ней рабочего органа таким образом, чтобы сопло шприца, который в данный момент используется для печати, было перпендикулярно поверхности дефекта кожи в каждый момент нанесения материала для печати на дефект, при этом контроллер манипулятора выполнен с возможностью направления информации о ходе печати на вычислительный модуль,
в которой траектория печати корректируется на основании данных, полученных от датчика расстояния, характеризующих расстояние между соплом и поверхностью печати, в режиме реального времени, для синхронизации с дыханием пациента так, чтобы расстояние между целевой точкой впрыска на дефекте кожи пациента и носиком сопла шприца оставалось постоянным.
2. Роботизированная медицинская система по п. 1, в которой в манипуляторе может быть использован один 6-осевой силомоментный датчик, установленный на фланце манипулятора.
3. Роботизированная медицинская система по п. 1, в которой охлаждающая система содержит радиатор, кулер, элементы Пельтье.
4. Роботизированная медицинская система по п. 1, в которой охлаждающая система включает цилиндрический с внутренним отверстием, охватывающим шприц, вставляемый в диспенсер, модуль Пельтье, одна сторона которого прилегает к металлической части, конгруэнтной поверхности внутреннего отверстия и охлаждающей шприц, а другая - к радиатору для оттока тепла, причем к радиатору прикреплен вентилятор.
5. Роботизированная медицинская система по п. 1, характеризующаяся тем, что охлаждающая система выполнена с возможностью охлаждения материала для печати до +10°С.
6. Роботизированная медицинская система по п. 1, в которой датчик расстояния является оптическим датчиком или лазерным датчиком.
7. Роботизированная медицинская система по п. 1, характеризующаяся тем, что вычислительный модуль выполнен с возможностью расчета траектории печати на основе полученных данных и ее построения с учетом проецирования 2D траектории на 3D-поверхность.
8. Роботизированная медицинская система по п. 1, характеризующаяся тем, что вычислительный модуль выполнен с возможностью построения траектории с использованием метода аппроксимации криволинейной поверхности с помощью точек.
9. Роботизированная медицинская система по п. 1, характеризующаяся тем, что выполнена с возможностью расчета траектория печати так, чтобы в результате печати на поверхности дефекта образовалась решетка из материала для печати, форма которой конгруэнтна форме дефекта.
10. Роботизированная медицинская система по п. 1, характеризующаяся тем, что выполнена с возможностью задавать параметры ячейки решетки, формируемой в результате печати, оператором системы путем их введения в вычислительный модуль при подготовке системы к печати.
11. Роботизированная медицинская система по любому из пп. 1-10, характеризующаяся тем, что выполнена с возможностью расчета траектории печати так, что сначала формируется слой, покрывающий всю поверхность дефекта кожи, а затем слой за слоем формируются следующие слои, каждый из которых покрывает всю поверхность дефекта кожи, до тех пор, пока дефект кожи не будет заполнен на всю глубину.
12. Роботизированная медицинская система по п. 1, характеризующаяся тем, что толщина филамента, формируемого соплом шприца, составляет 0,1-1,5 мм.
13. Роботизированная медицинская система по п. 1, характеризующаяся тем, что выполнена с возможностью задавать параметры толщины филамента, формируемого соплом шприца, и количества слоев печати оператором системы путем их введения в вычислительный модуль при подготовке к печати.
14. Роботизированная медицинская система по п. 1, характеризующаяся тем, что вычислительный модуль выполнен с возможностью контроля и обеспечения минимизации угла между нормалью к поверхности дефекта кожи и осью диспенсера.
15. Роботизированная медицинская система по п. 1, характеризующаяся тем, что на каждой оси роботизированной руки установлен датчик определения поворота текущего звена относительно предыдущего, выполненный с возможностью передачи данных на контроллер манипулятора и на вычислительный модуль.
16. Роботизированная медицинская система по п. 1, характеризующаяся тем, что рабочий орган включает по меньшей мере два диспенсера, один из которых предназначен для экструзии гидрогеля, а другой - для дискретной печати тканевыми сфероидами.
17. Роботизированная медицинская система по п. 16, характеризующаяся тем, что выполнена с возможностью поочередной экструзии - сначала гидрогеля, а затем - тканевых сфероидов, которые наносятся в поры гидрогеля.
18. Роботизированная система по п. 1, характеризующаяся тем, что выполнена с возможностью бесконтактного измерения расстояния между носиком сопла шприца, который в данный момент используется для печати, и поверхностью дефекта с частотой 50 Гц.
19. Роботизированная система по п. 1, характеризующаяся тем, что материал для печати представляет собой лечебный материал для нанесения на открытую кожную рану.
20. Роботизированная медицинская система по п. 1, характеризующаяся тем, что дополнительно содержит систему компьютерного зрения, установленную на манипуляторе.
21. Роботизированная медицинская система по п. 20, в которой система компьютерного зрения представлять собой стереосистему из 2-х камер, работающую по принципу стереоскопии, или камеру в комбинации лазерным паттерном для освещения, работающую на основе использования структурированного света.
22. Манипулятор для 3D-биопечати, выполненный в виде коллаборативной роботизированной руки с по меньшей мере 5-ю степенями свободы, в котором к фланцу роботизированной руки прикреплен рабочий орган, включающий
- по меньшей мере один диспенсер, обеспечивающий возможность как выдавливания, так и всасывания наносимого материала для печати с помощью шагового двигателя диспенсера, при этом диспенсер имеет шток, в наконечник которого вкручен поршень сменного шприца с соплом,
- охлаждающую систему, выполненную с возможностью обеспечения охлаждения и поддержания заданной температуры материала для печати в по меньшей мере одном шприце,
- модуль позиционирования, закрепленный с помощью фланцев на диспенсере, состоящий из двух поворотных механизмов, выполненных с возможностью перемещения диспенсера вдоль поверхности дефекта, и линейного механизма перемещения для перемещения диспенсера вдоль оси диспенсера, которая перпендикулярна поверхности печати, для корректировки траектории движения рабочего органа при печати,
- блок управления, закрепленный на диспенсере, содержащий контроллер управления модулем позиционирования, драйвер управления шаговым двигателем диспенсера, драйвер управления охлаждающей системой,
- по меньшей мере, один датчик расстояния, направленный на сопло.
23. Манипулятор по п. 22, характеризующийся тем, что в нем использован один 6-осевой силомоментный датчик, установленный на фланце манипулятора.
24. Манипулятор по п. 22, характеризующийся тем, что охлаждающая система содержит радиатор, кулер, элементы Пельтье.
25. Манипулятор по п. 23, характеризующийся тем, что охлаждающая система включает цилиндрический с внутренним отверстием, охватывающим шприц, вставляемый в диспенсер, модуль Пельтье, одна сторона которого прилегает к металлической части, конгруэнтной поверхности внутреннего отверстия и охлаждающей шприц, а другая - к радиатору для оттока тепла, причем к радиатору прикреплен вентилятор.
26. Манипулятор по п. 22, характеризующийся тем, что датчик расстояния является оптическим датчиком или лазерным датчиком.
| US 20200238024 A1, 30.07.2020 | |||
| US 20220043422 A1, 10.02.2022 | |||
| US 20210007778 A1, 14.01.2021 | |||
| US 11254901 B2, 22.02.2022 | |||
| БИОПРИНТЕР | 2014 |
|
RU2558290C1 |
Авторы
Даты
2024-03-07—Публикация
2023-08-16—Подача