Изобретение относится к биологии, экологии, сельскому хозяйству, в частности к исследованиям биоматериалов и учету животных при изучении миграционной активности животных, а также к разработке методов оценки эффективности вакцинации, дератизации и управления численностью отдельных биологических видов с использованием меченых кормовых приманок.
Известно, что массовое неизбирательное самомечение животных является хорошо зарекомендовавшим себя подходом как в фундаментальных исследованиях (изучение миграционных процессов) (см. Толкачев О.В. Расселение малой лесной мыши (Sylvaemus uralensis Pallas, 1811) и рыжей полевки (Clethrionomys glareolus Schreber, 1780) в условиях фрагментированного ландшафта // Сибирский экологический журнал, 2016. №1. С. 137-147. DOI: 10.15372/SEJ20160114) так и при решении практических задач, как для оценки полноты потребления дикими видами приманки с вакциной или ядом (Slate D., Algeo Т.Р., Nelson К.М., Chipman R.B., Donovan D., Blanton J.D., Niezgoda M., Rupprecht C.E. Oral Rabies Vaccination in North America: Opportunities, Complexities, and Challenges // PLoS Neglected Trop Diseases, 2009. V.3. No. 12. P. 1-9. (E549). DOI: 10.1371/journal.pntd.0000549). Подход подразумевает экспонирование приманки с веществом-биомаркером, после потребления которого особи целевого вида получают метку, позволяющую отличать их от прочих. В зависимости от используемого маркера выделяется соответствующее число методов, из которых к наиболее распространенным можно отнести антибиотики тетрациклинового ряда и родамин В (Rhodamine В).
Исторически первым является тетрациклиновый метод (Crier J.K. Tetracyclines as a fluorescent marker in bones and teeth of rodents, The Journal of Wildlife Management, 1970, Vol. 34. No. 4. P. 829-834. DOI: 10.2307/3799151), подразумевающий добавление в приманку тетрациклина или его дериватов. Вещества этой группы связываются с кальцием в момент его депонирования в костных структурах, что обнаруживается посредством эффекта желтой флуоресценции под действием ультрафиолета (Milch R.A., Rail D.P., Tobie J.E. Bone Localization of the Tetracyclines // Journal of the National Cancer Institute, 1957. Vol. 19. No. 1. P. 87-93. PMID: 13502708). Хотя метод доказал свою эффективность, он, тем не менее, имеет три серьезных недостатка:
1) Ограничение в выборе объектов исследования. Подходят только виды, имеющие постоянно растущие костные структуры либо только особи, чей рост не окончен (например, резцы грызунов);
2) Ограничение по сроку наблюдения (в случае с грызунами - 40-50 дней, т.к. метка исчезает по мере роста и стачивания зуба);
3) Необходимость убивать животное для проверки наличия метки. Известен также родаминовый метод (Fisher P. Review of Using Rhodamine В as a Marker for Wildlife Studies // Wildlife Society Bulletin, 1999. V. 27. No. 2. P. 318-329.), но он к настоящему моменту разработан не полностью и почти не применяется на практике. Системная метка формируется за счет связывания родамина со структурами тела животного, содержащими кератин.
Родамин В. [81-88-9]. C28H31ClN2O3. (М.м. 479,0). N-[6-(Диэтиламино)-9-(2-карбоксифенил)-3H-ксантен-3-илиден] диэтиламмония хлорид. Кристаллы зеленого цвета или порошок, используемые как не пищевой краситель широкого спектра действия (Государственная фармакопея РФ (издание X111), 2015. Том 1. с. 1312).
Методика его применения (Fisher P., Algar D Sinagra J. Use of Rhodamine В as a systemic bait marker for feral cats (Felis catus) // Wildlife Research, 1999. V. 26. P. 281-285. DOI: 10.1071/WR98041) к настоящему моменту разработана не полностью, поэтому применяется на практике контроля миграции животных ограниченно.
Выявление родаминовой метки обычно проводится с помощью флуоресцентной/люминесцентной УФ микроскопии взятых образцов от животного. Алгоритм детекции в этом случае следующий: объект, помещенный на предметный столик микроскопа, облучается УФ светом с длиной волны 510-560 нм (в зависимости от модели прибора). Если объект содержит следы родамина (метку), то наблюдатель видит оранжевое свечение (флуоресценция с соответствующей длиной волны). Необходимая для этого узкоспециализированная техника весьма дорогая. В то же время, полевые зоологи, которым и адресован данный способ, как правило, таких приборов не имеют. Распространенный в настоящее время протокол предполагает взятие нескольких проб (волосков) из шкуры и/или вибрисс животного с последующим просмотром под люминесцентным УФ микроскопом. При этом известно, что рост волос идет неравномерно на различных участках тела. При изучении млекопитающих детекция родаминовой метки с использованием флуоресцентной микроскопии по общепринятой в настоящее время методике предусматривает довольно длительную и трудоемкую процедуру подготовки образцов. Общепринятый протокол подразумевает использование предметных и покровных стекол, иммерсионного масла, изопропилового спирта и специального клея для подготовки препаратов к просмотру. Один препарат включает пять волосков животного. Вся процедура вместе с сушкой занимает не менее недели. Анализ всего волосяного покрова особи не практикуется, в первую очередь, из-за высокой трудоемкости и большого расхода материалов. Серьезным его ограничением является техническая невозможность осматривать на предмет наличия метки биологические макрообъекты. Невозможно осмотреть поверхность тела всего меченого зверька целиком, так как он не может быть помещен на предметный столик прибора. Серьезность проблемы особенно очевидна при изучении сравнительно крупных животных, таких как дикий кот (Johnston M.J., Shaw M.J., Robley A., Schedvin N.K. Bait uptake by feral cats on French island, Victoria // Australian Mammalogy, 2007. V. 29. No. 1. P. 77-84. DOI: 10.1071/AM07009) или барсук (Southey A.K., Sleeman D.P., Gormley E. Sulfadimethoxine and Rhodamine В as oral biomarkers for European badgers (Melesmeles) II Journal of wildlife diseases, 2002. Vol. 38. No. 2. P. 378-384. PMID: 12038137). Между тем осмотр всего тела животного является необходимым условием для надежного обнаружения системной метки.
Известно также, что при прохождении луча зеленого лазера (диаметром 0,7-1,0 мм) через водные растворы родамина Б, наблюдается оранжево-красная флуоресценция, видимая невооруженным глазом (см. Родамин В и лазер. // Химия и химики. №6. 2011). Однако при простом освещении узким лучом зеленого лазера меченых биологических образцов без дополнительных условий системная метка родамина не видна из-за высокой интенсивности зеленого излучения и малых концентраций родамина в биологических объектах.
Задачей изобретения является разработка упрощенного, более эффективного быстрого универсального гуманного способа детекции системной родаминовой метки на биологическом объекте in vivo или при вскрытии, не требующего специальной подготовки, больших затрат материальных ресурсов и времени при возможности осматривать как мелкое, так и крупное животное, потребившее кормовую приманку с родамином В, в том числе и в полевых условиях при минимуме оборудования и без использования дорогостоящих аппаратов и устройств.
Задача решается тем, что для выявления (детекции) родаминовой метки на животном после поедания им кормовой приманки с родамином В, используют портативный зеленый лазер (лазерную указку) с рассеивающей насадкой в качестве источника волны возбуждения (длина волны - 532±20 нм) и оранжевое стекло (например, ОС-14) или прозрачный оранжевый пластик в качестве светофильтра на объективе или окуляре. Кормовая приманка включает в свой состав от 0,05 до 0,1% родамина В по массе, а наличие следов препарата обнаруживают посредством эффекта желтой или оранжевой флуоресценции при наблюдении в темноте и при сумеречном освещении in vivo или при вскрытии, при чем пятно рассеянного луча зеленого лазера используют диаметром 3-10 см при расстоянии до объекта исследования от 3 до 50 см с использованием оранжевого светофильтра.
В кормовой контролируемой приманке для осуществления способа в качестве действующего вещества и одновременно предупредительного красителя, окрашивающего приманку в цвет «фуксии», используется Родамин В (чда) из расчета 800 мг/кг кормовой основы, в качестве которой для мелких млекопитающих применяется крупа «Геркулес», при этом образцы приманки изготовляют массой 2-3 г в сухом виде, методом влажного перемешивания и сушки с использованием в качестве аттрактанта нерафинированного подсолнечного масла.
Хотя системная метка при использовании предлагаемого способа в большинстве случаев видна невооруженным глазом, для повышения надежности диагностики и комфорта исследователя рекомендуется применять простые модели микроскопов или увеличительное стекло (увеличение 1,5-5) при осмотре мелких животных или небольших образцов. При необходимости по той же схеме проводят фото- и видеосъемку объектов детекции. Параметры способа, такие как диаметр светового пятна, расстояние до объекта контроля, тип светофильтра, подобраны опытным путем в лаборатории и проверены на практике.
Соответствующие исследования были выполнены на примере мелких млекопитающих. Разработана и опробована на практике кормовая контролируемая приманка на основе хлопьев «Геркулес», которая характеризуются широкой доступностью и дешевизной и подходит в качестве субстрата (основы) для родамина. Опытным путем подобраны необходимые концентрации биомаркера, способы введения в субстрат и количество приманки на единицу площади, что необходимо для достижения полноты мечения родамином В при проведении опытов в естественных условиях.
Приготовление приманки происходит следующим образом. В хлопья геркулеса точно известного веса всыпать порошок Родамина В (чда) из расчета 800 мг/кг. Далее залить кипятком и тщательно перемешать. Получившуюся кашеобразную массу выложить на поддон или противень, разровнять и разметить с помощью шпателя или аналогичного инструмента на части равного размера с таким расчетом, чтобы после сушки масса кусочка составлял 2-3 г. Сушить в сушильном шкафу или в духовке при температуре 80°С в течение восьми часов. Высушенную приманку разделить на кусочки по сделанным ранее насечкам и не более чем за сутки до мечения обработать нерафинированным подсолнечным маслом с помощью бытового распылителя, периодически перемешивая. Приманку распределить по участкам мечения в виде сети с пятиметровыми ячейками.
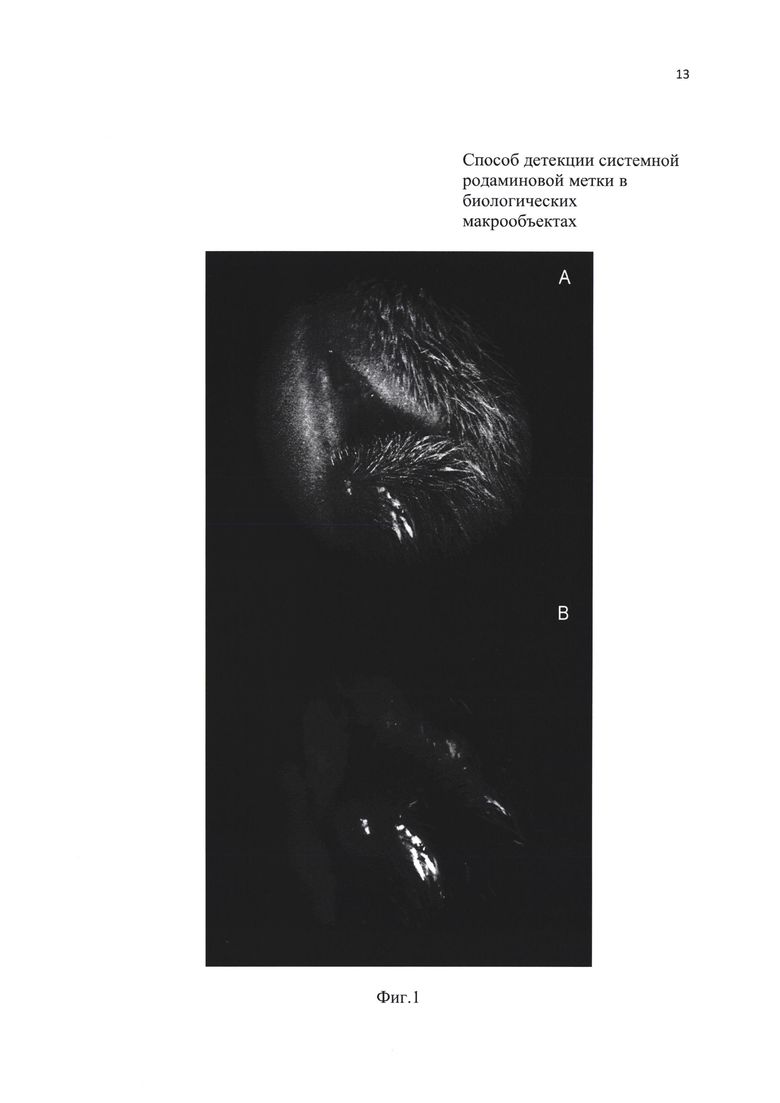
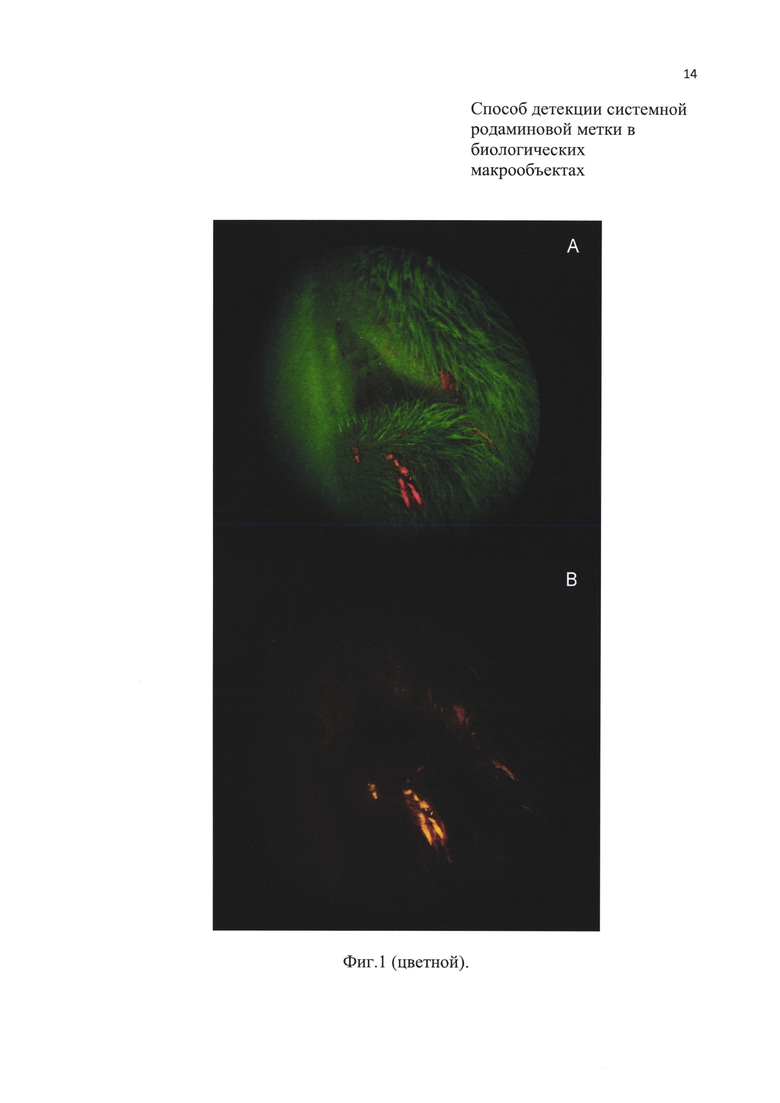
На Фиг. 1. Представлено фото области рта малой лесной мыши (Sylvaemus uralensis) со следами недавнего поедания приманки с родамином В (результат проверки способа в естественной природной среде). Вид в рассеянном свете зеленого лазера с оранжевыми фильтрами на объективе с разным светопропусканием (А, В).
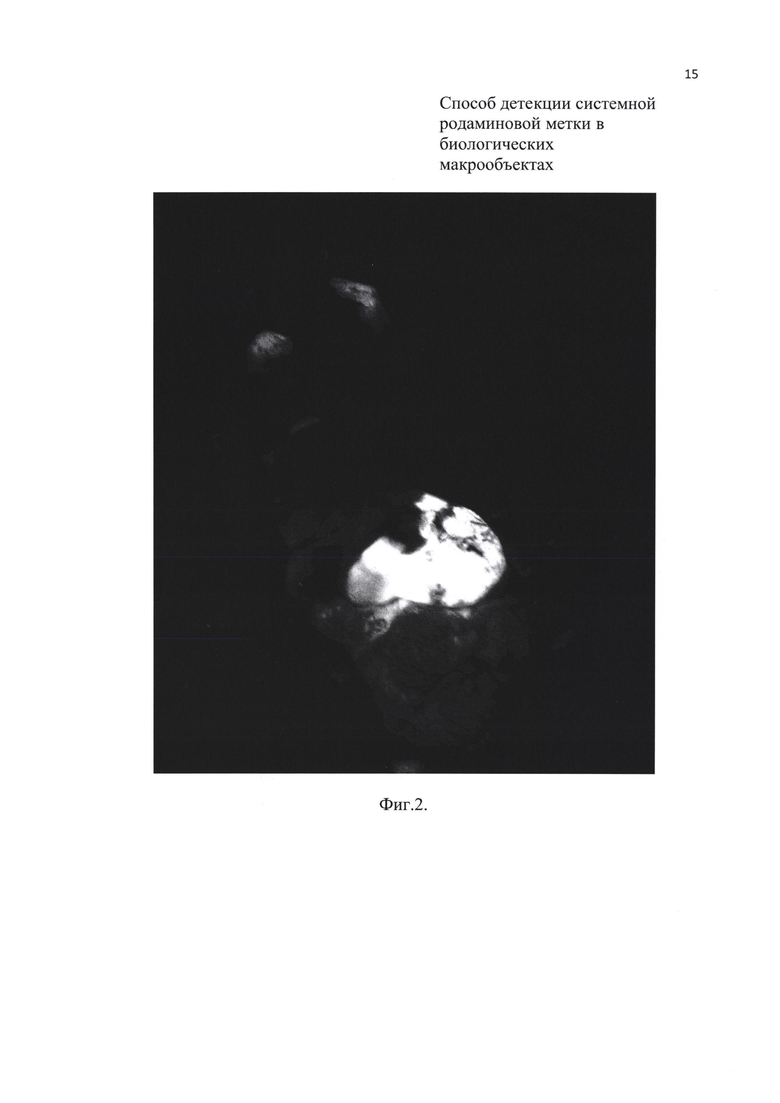
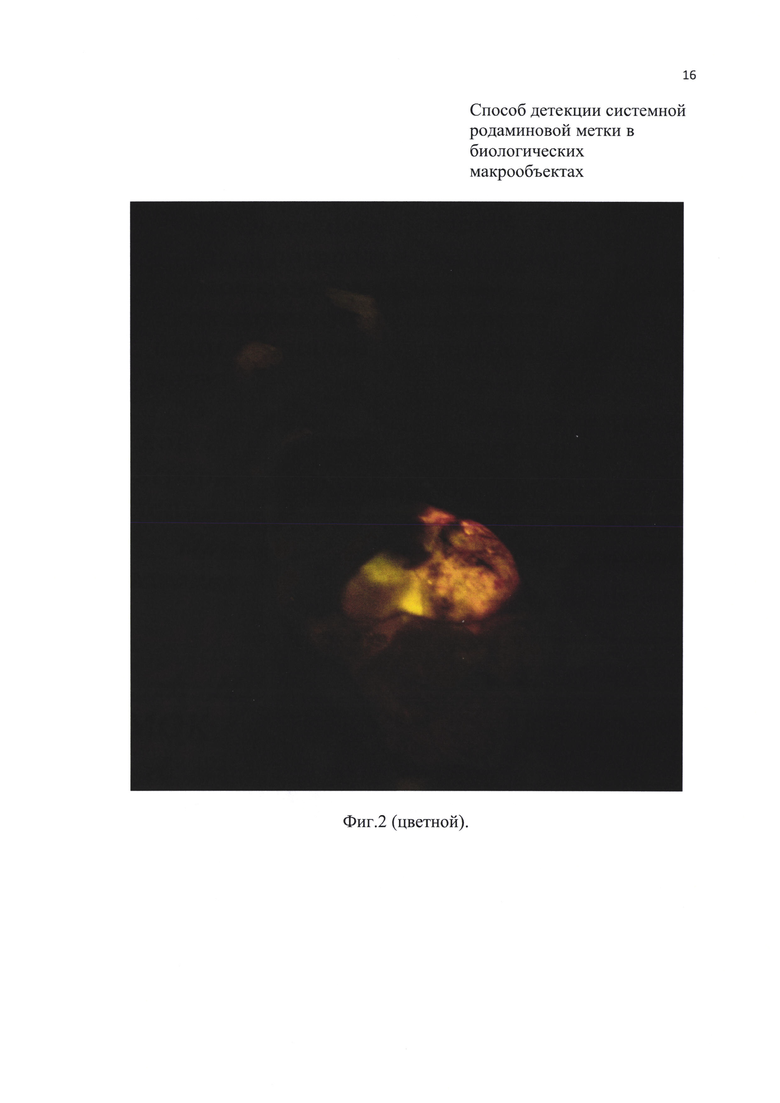
Фиг. 2. Свечение передних лап и внутренних органов мыши, меченной родамином В (при вскрытии).
Испытание и исследования показали, что использование рассеивателя и оранжевого фильтра между объектом и глазом наблюдателя (или объективом фото, видеокамеры) является необходимым и усиливающим условием способа. Эмпирическим путем было установлено, что наилучшие результаты дают фильтры, через которые родаминовая метка выглядит светло-желтой, а не оранжевой, как при использовании некоторых специализированных микроскопов (см., например, Mohr К., Leirs Н., Katakweba A., Machang'u R. Monitoring rodents movements with a biomarker around introduction and feeding foci in an urban environment in Tanzania // African Zoology, 2007. Vol. 42. No. 2. P. 294-298. DOI: 10.3377/1562-7020(2007)42[294:MRMWAB]2.0.CO;2). Необходимого четкого эффекта можно добиться подбором используемого фильтра (Фиг.1). Флуоресценция оранжевого цвета наблюдается при использовании однослойных фильтров, но их диагностическая ценность оказалась невысокой, из-за «засветки» интенсивным излучением лазера. Последний также требует установки рассеивателя из матового белого стекла или тонкой белой пластмассы на лазере для получения достаточно большого и сплошного светового пятна (диаметром 3-10 см) при расстоянии 3-50 см от объекта, поскольку тонкий лазерный луч не пригоден для выявления родаминовой метки в макрообъектах.
Очевидно, что стоимость вышеописанного комплекта (портативный зеленый лазер, рассееватель и оранжевый фильтр) меньше, чем у флуоресцентных/люминесцентных УФ микроскопов. В таком виде предложенный родамино-лазерный способ контроля мечения становится доступным для специалиста-зоолога, пожелавшего его использовать. Кроме того, предложенный способ можно применять в полевых условиях, что часто бывает важным для зоологов и проблематично в случае со специализированным УФ микроскопом. Полевое применение по предлагаемой схеме облегчается еще и тем, что облученная зеленым лазером метка хорошо видна не только в полной темноте, но и при сумеречном освещении.
Принципиальным моментом является тот факт, что предлагаемый способ детекции метки значительно надежнее и эффективнее общепринятого. В ходе апробации предлагаемого метода на мышевидных грызунах было обнаружено, что площадь, на которой проявляется видимая метка, обычно составляет менее 50% поверхности тела, а расположение флуоресцирующих участков во всех случаях индивидуально. Вибриссы считаются более надежным индикатором (Weerakoon М.К., Price С.J., Banks Р.В. Hair Type, Intake, and Detection Method Influence Rhodamine В Detectability // The Journal of Wildlife Management, 2013. Vol. 77. No. 2. P. 306-312. DOI: 10.1002/jwmg.459.), однако в ходе полевых исследований были выявлены случаи, когда метка проявлялась на шерсти, но отсутствовала на вибриссах. При этом срок удержания метки в вибриссах не превышает 50 дней, в отличие от шерсти и подшерстка. Поэтому существует вероятность ошибки при использовании общепринятой процедуры с отбором небольших проб волос, тогда как предлагаемый способ позволяет просматривать всю поверхность тела животного, включая вибриссы и когти, что повышает надежность диагностики.
Предлагаемый способ позволяет осматривать и внутренние органы в случаях, когда проводится вскрытие животных (Фиг. 2) (что не делается при использовании флуоресцентных УФ микроскопов). Как показали исследования, этот вариант является наиболее надежным при детекции метки в период между поеданием приманки с родамином и формированием системной метки (обычно, первые несколько дней после начала мечения).
Одним из важных преимуществ мечения родамином считается возможность выявлять метку in vivo, что имеет значение, как при изучении редких видов, так и по общим соображениям гуманизма. При этом проанализировать всю шерсть животного с использованием общепринятой процедуры невозможно. В таких случаях предлагаемый способ делает процедуру детекции метки еще менее инвазивной, поскольку позволяет осматривать все животное целиком без выдергивания волосков и/или вибрисс.
Предлагаемый способ не предполагает использования расходных материалов. Полный осмотр одного животного занимает обычно 1-5 минут.
Дополнительным применением разработанного способа детекции родаминовой метки может быть изучение закономерностей роста волос у животных (скорость роста и частота смены фаз роста/покоя на различных участках тела, особенности процесса линьки у различных видов, соотношение общих закономерностей и индивидуальных особенностей роста волос и т.п.). В ходе лабораторных опытов и полевых экспериментов с грызунами было обнаружено, что метка чаще проявляется на нижней (вентральной) стороне тела.
Таким образом, новизной способа является то, что для детекции родаминовой метки на животном, потребившем предложенную кормовую приманку с родамином В, используют облучение животного рассеянным лучом портативного зеленого лазера с длинной волны - 532±20 нм и оранжевый фильтр, которые применяются по новому назначению с неочевидным эффектом в виде четкого визуального контроля меток на биологических объектах посредством эффекта светло-желтой или оранжевой флуоресценции, наблюдаемой в темноте или при сумеречном освещении in vivo или при вскрытии, в том числе и в полевых условиях, и у крупных животных.
Предложенный способ технически осуществим, работоспособен и может быть рекомендован для практического применения в исследованиях для детекции родаминовых меток в экстерьере или интерьере животных, а также в других биологических макрообъектах, в том числе и в полевых условиях, облегчая условия работы экологов и биологов, помогая в борьбе с грызунами в сельском хозяйстве.
Список литературы по ссылкам
1. Государственная фармакопея РФ (издание XIII), 2015. Том 1. С.1312.
2. Толкачев О.В. Расселение малой лесной мыши (SylvaemusuralensisVaWas, 1811) и рыжей полевки (ClethrionomysglareolusSchreber, 1780) в условиях фрагментированного ландшафта // Сибирский экологический журнал, 2016. №1. С.137-147. DOI: 10.15372/SE J20160114.
3. Fisher P. Review of Using Rhodamine В as a Marker for Wildlife Studies // Wildlife Society Bulletin, 1999. V.27. No.2. P.318-329.
4. Fisher P., Algar D Sinagra J. Use of Rhodamine В as a systemic bait marker for feral cats (Feliscatus) II Wildlife Research, 1999. V.26. P.281-285. DOI: 10.1071/WR98041.
5. Johnston M.J., Shaw M.J., Robley A., Schedvin N.K. Bait uptake by feral cats on French island, Victoria // Australian Mammalogy, 2007. V.29. No.l. P.77-84. DOI: 10.1071/AM07009.
6. Mohr K., Leirs H., Katakweba A., Machang'u R. Monitoring rodents movements with a biomarker around introduction and feeding foci in an urban environment in Tanzania // African Zoology, 2007. Vol.42. No.2. P.294-298. DOI: 10.3377/1562-7020(2007)42[294:MRMWAB]2.0.CO;2.
7. Slate D., Algeo T.P., Nelson K.M., Chipman R.B., Donovan D., Blanton J.D., Niezgoda M., Rupprecht C.E. Oral Rabies Vaccination in North America: Opportunities, Complexities, and Challenges // PLoS Neglected Trop Diseases, 2009. V.3. No. 12. P.l-9. (E549). DOI: 10.1371/journal.pntd.0000549.
8. Southey A.K., Sleeman D.P., Gormley E. Sulfadimethoxine and Rhodamine В as oral biomarkers for European badgers (Melesmeles) II Journal of wildlife diseases, 2002. Vol.38. No.2. P.378-384. PMID: 12038137.
9. Spurr E.B. Rhodamine В as a systemic hair marker for assessment of bait acceptance by stoats {Mustelaermined) II New Zealand Journal of Zoology, 2002. V.29. No.3. P.187-194. DOI: 10.1080/03014223.2002.9518302.
10. Weerakoon M.K., Price C.J., Banks P.B. Hair Type, Intake, and Detection Method Influence Rhodamine В Detectability // The Journal of Wildlife Management, 2013. Vol.77. No.2. P.306-312. DOI: 10.1002/jwmg.459.
Изобретение относится к биологии, экологии, сельскому хозяйству, в частности к исследованиям биоматериалов и учету животных при изучении миграционной активности. Способ детекции системной родаминовой метки в мелких млекопитающих включает использование кормовых приманок с препаратом родамин B в количестве от 0,05 до 0,10 мас.% и выявление флуоресцирующей метки родамина B путем облучения мелких млекопитающих лучом портативного зеленого лазера с длиной волны 532±20 нм. При этом для регистрации флуоресценции используют оранжевый светофильтр, а наличие следов препарата родамин B обнаруживают посредством эффекта желтой или оранжевой флуоресценции при наблюдении в темноте или сумеречном освещении. Изобретение позволяет быстро и эффективно осуществлять детекцию системной родаминовой метки in vivo или при вскрытии животных, а также не требует специальной подготовки и больших затрат материальных ресурсов и времени. 4 ил.
Способ детекции системной родаминовой метки в мелких млекопитающих, включающий использование кормовых приманок с препаратом родамин В (Rhodamine В) с последующим выявлением следов препарата методом флуоресценции при облучении мелких млекопитающих активирующими лучами заданного спектра, отличающийся тем, что кормовая приманка содержит в своем составе от 0,05 до 0,10% по массе препарата родамина В, для выявления флуоресцирующей метки родамина В используют облучение мелких млекопитающих рассеянным лучом портативного зеленого лазера с длиной волны 532±20 нм, а наличие следов препарата обнаруживают посредством эффекта желтой или оранжевой флуоресценции при наблюдении в темноте или сумеречном освещении in vivo или при вскрытии, причем для регистрации флуоресценции используют оранжевый светофильтр.
| FISHER P | |||
| et al | |||
| Use of Rhodamine B as a systemic bait marker for feral cats (Felis catus) / Wildlife Research, 1999, V.26, pp.281-285 | |||
| САДЫКОВ О.Ф | |||
| и др | |||
| Динамика Численности Мелких Млекопитающих / Наука, Москва, 1992, стр.191 | |||
| LINDSEY G.D | |||
| et al | |||
| Rhodamine B: A Systemic Fluorescent Marker for Studying Mountain Beavers (Aplodontia rufa) and Other Animals / Northwest Science, 1983, V.57, pp.16-21 | |||
| BAGASRA A | |||
| et al | |||
| Tracking invasive rat movements with a systemic biomarker / New Zeland Journal of Ecology, 2016, V.40, pp.267-272 | |||
| CAGNACCI F | |||
| et al | |||
| Long-lasting Systemic Bait Markers for Eurasian Badgers / Journal of Wildlife Diseases, 2006, V.42, pp.892-896. |
Авторы
Даты
2018-03-26—Публикация
2016-05-31—Подача