Область техники, к которой относится изобретение
Изобретение относится к области медицины, в частности к радионуклидной диагностике очагов воспаления, и может быть использовано в т.ч. для диагностики очагов воспаления у пациентов с лихорадкой неясного генеза, включая пациентов с сосудистыми протезами и больных после трансплантации органов.
Уровень техники
Из уровня техники известны различные способы диагностики очагов воспаления различной локализации с помощью сцинтиграфии с меченными in vitro аутологичными лейкоцитами.
Из уровня техники известен способ диагностики очагов воспаления с помощью сцинтиграфии (Никомед Амершам. Руководство пользователя «Изображение лейкоцитов в действии» // никомед Амершам, перевод с английского. - 1998 г. - 35 с.), включающий мечение лейкоцитов in vitro агентом 99m-Тс-Эксаметазим для диагностики определения инфекционных областей и оценки воспалительных процессов, не связанных с инфекцией. Для реализации способа сначала в два 60 мл негепаринизированных пластиковых шприца набирают по 9 мл кислото-цитрато-декстрозы, затем по 51 мл венозной крови пациента из кубитальной вены. Далее в пять из шести подготовленных универсальных пробирок вводят по 2 мл Гексана и по 20 мл крови во все шесть пробирок. После чего смешивают содержимое каждой пробирки с помощью переворачивания. С помощью стерильной иглы вскрывают пузырь на поверхности каждой пробирки. Затем пять из шести пробирок оставляют на 30-60 мин для образования осадка. Пробирку 6 с 20 мл крови центрифугируют при 2000 g в течение 10 мин для образования плазмы, не содержащей клеток. По истечении времени из пробирок 1-5 извлекают надосадочную жидкость и переносят в равных объемах в 3 чистые универсальные пробирки и центрифугируют их при 150 g 5 мин. Затем переносят всю надосадочную жидкость в чистые универсальные пробирки. Одну из пробирок центрифугируют при 2000 g в течение 10 мин с образованием плазмы, не содержащей клеток. Далее вводят во флакон 500 МБк 99mТехнеций-Эксаметазим объемом 5 мл и немедленно добавляют лейкоциты из второй пробирки. Смесь инкубируют в течение 10 мин при комнатной температуре, осторожно поворачивая. Затем смешивают содержимое пробирок путем ее переворачивания, центрифугируют при 150 g 5 мин и извлекают с сохранением всей надосадочной жидкости. После чего повторно суспензируют меченые лейкоциты, переносят меченые лейкоциты в пластиковый негепаринизированный шприц и измеряют радиоактивность. Полученный препарат вводят пациенту для проведения исследований и выявления очага воспаления.
Однако известный способ предполагает наличие специальных пробирок и многократные манипуляции, что повышает риск контаминации препарата крови.
Известен также способ сцинтиграфии с лейкоцитами, меченными 99mTc-теоксимом (99mTc-церетеком), который предполагает забор 50 мл крови также в пробирки, двухкратное отмывание лейкоцитов 9% раствором NaCl (Национальное руководство по радионуклидной диагностике, Томск 2010, Том 2, с. 306-307).
Однако объем 50 мл крови не достаточен для достоверного определения очага воспаления. Кроме того, применение раствора NaCl снижает пролиферативные свойства лейкоцитов, входящих в состав радиофармпрепарата.
Известен способ топической диагностики воспалительных заболеваний сердца (Патент RU 2136218, МПК: A61B 8/13), согласно которому забирают 300 мл крови, центрифугированием выделяют смесь лейкоцитов, в которую добавляют 4 мл РФП (липофильный комплекс 99mTc-НМРАО), полученного путем добавления элюата 99mTc (активностью 13,5 mCu из генератора 99-молибден/99m-технеций) во флакон, содержащий 0,5 мг НМРАО и 7,5 мкг двухвалентного олова. Флакон помещают в защитный свинцовый контейнер. Элюат 99mTc-пертехнетата получают не ранее 2 ч перед приготовлением РФП. Смесь лейкоцитов с РФП осторожно смешивают, инкубируют в течение 10 мин при комнатной температуре, после чего центрифугируют при 150 g в течение 5 мин. Супернатант полностью удаляют, осадок разводят в 5 мл плазмы и вводят внутривенно больному. Через 20-24 ч проводят томосцинтиграфическое исследование области сердца. Затем, не меняя положения больного, ему вводят 0,5 mCu 201-Tl-хлорида или 10 мCu 99mTc-технетрила и вновь выполняют томосцинтиграфию той же области сердца соответственно на энергетическом пике 201-Tl или 99mTc. На полученной томосцинтиграмме очерчивают контуры сердца, после чего сопоставляют ее с исходной, полученной на энергетическом пике 99mTc после внутривенного введения больному 99mTc-НМРАО. Сопоставление этих томосцинтиграмм дает точное расположение воспалительных очагов в области сердца.
Однако данный способ имеет высокий риск контаминации крови и предназначен для поиска очагов воспаления именно в области сердца.
Наиболее близким к заявляемому является способ диагностики гнойно-воспалительных процессов (Патент RU 2290952, МПК: A61K 49/04, A61B 6/00), согласно которому у пациента забирают 50 мл венозной крови, оставляют в шприце для оседания эритроцитов в течение 45 мин с последующим отделением более тяжелой эритроцитарной массы от плазмы и лейкоцитарной взвеси. Все манипуляции с кровью осуществляют в стерильных условиях. Полученную таким образом взвесь лейкоцитов в плазме центрифугируют в течение 10 мин при 1000 об/мин. После отделения лейкоцитов от плазмы (полученный надосадок) к лейкоцитам добавляется приготовленный заранее РФП - 99mTc-Технефит, Приготовление 99mTc-Технефита осуществляется добавлением во флакон с реагентом в асептических условиях 5 мл 99mTc-элюата из генератора активностью 740 МБк (при необходимости предварительно проводят разбавление элюата изотоническим раствором хлористого натрия (NaCl) до требуемой активности). Один флакон реагента используют для исследования одного пациента. Инкубация лейкоцитов с коллоидным препаратом осуществляют при температуре 37°C в течение 45 мин. После инкубации лейкоцитарную взвесь однократно отмывают для очищения от несвязавшегося с клетками крови РФП путем центрифугирования и удаления надосадка, после чего реинъецируют меченые лейкоциты в сосудистое русло. Сцинтиграфию выполняют через 45-90 мин после внутривенного введения РФП с использованием низкоэнергетического коллиматора с энергией (140 кэВ) в планарном режиме с набором импульсов до 150000-300000. Далее выполняют диагностику гнойно-воспалительного процесса посредством качественной оценки накопления меченых лейкоцитов в предполагаемой зоне воспаления путем визуального определения области повышенной аккумуляции РФП.
Однако используя на практике указанный метод, не удается получить полного разделения клеточного пула на клеточные элементы (лейкоцитов с тромбоцитами от эритроцитов), что вносит погрешность при анализе полученных сцинтиграмм. Кроме того, режим центирифугирования клеточной суспензии с использованием в качестве отмывающего препарата физраствора приводит к изменению функциональных свойств клеток крови и, как следствие, снижению проникновения их в очаг воспаления, что, в свою очередь, приводит к недостоверному результату (регистрируется повышенное накопление в легких и печени, что может быть причиной ложноположительных и ложноотрицательных результатов и свидетельствует о некачественно проведенной метке лейкоцитов).
Раскрытие изобретения
Задачей изобретения является создание более эффективного и информативного способа диагностики очагов воспаления. Особенно важно это при использовании изобретения для исследования пациентов с сосудистыми протезами и пациентов, постоянно получающих иммуносупрессивную терапию после трансплантации органов. Получаемый препарат содержит примесь тромбоцитов, которые, как известно, участвуют в питании сосудистой стенки и их адгезия в очаге воспаления повышается, что способствует более четкой сцинтиграфической визуализации.
Техническим результатом, на достижение которого направлено заявляемое изобретение, является повышение достоверности определения очагов воспаления (получение более объективных результатов исследования) за счет использования препарата клеток крови, характеризующегося отсутствием свободной радиоактивности и примесей меченых аутоэритроцитов, при сохранении функциональных свойств клеточных элементов. Кроме того, дополнительное центрифугирование и отмывание плазмой клеток крови при приготовлении препарата позволяет снизить лучевую нагрузку на пациента не менее чем в 2 раза. Полученный заявляемым способом препарат при его использовании в полиорганной сцинтиграфии для выявления очагов воспаления у пациентов с лихорадкой неясного генеза снижает количество ложноположительных результатов.
Кроме того, способ позволяет получать больший объем радиофармпрепарата (из 250-400 мл цельной крови) с применением строенных стерильных пакетов типа Гемакон, что позволяет получать более объективные данные при проведении сцинтиграфии и снижает риск контаминации (инфицирования).
Таким образом, получаемый клеточный пул достаточен для четкой визуализации одного (или нескольких) очагов воспаления. Снижается количество ложноположительных результатов, которые возможны при наличии примесей (меченых аутоэритроцитов и несвязанного 99mTc-пертехнетата).
Поставленная задача решается тем, что способ приготовления препарата клеток крови для использования при полиорганной сцинтиграфии для выявления у пациента очагов воспаления включает забор крови не менее 250-400 мл в первый стерильный пакет, который подвергают центрифугированию (первый этап центрифугирования) со скоростью g 200 (800 об/мин) в течение времени, необходимого для осаждения эритроцитов, после чего с помощью плазмоэкстрактора обогащенную лейкоцитами надосадочную плазму переводят во второй пакет и осуществляют центрифугирование второго пакета (второй этап центрифугирования) со скоростью g 530 (1300 об/мин) в течение времени, необходимого для получения лейкотромбослоя. Первый пакет с эритроцитами отпаивают (отделяют) от остальных пакетов и реинфузируют внутривенно пациенту, образовавшуюся надосадочную плазму во втором пакете переводят с помощью плазмоэкстрактора в третий пакет, предназначенную для отмывания уже после проведения метки. Далее в клеточную массу добавляют РФП (99mTc-теоксим или 99mTc-церетек) в количестве 3-5 мл, инкубируют в течение 8-10 мин, и добавляют плазму из третьего пакета в количестве 10-20 мл, с последующим центрифугированием второго пакета с полученной клеточной массой (третий этап центрифугирования) со скоростью g 1162 (2000 об/мин) в течение 10 мин. Это необходимо для отделения меченных аутолейкоцитов от свободной активности - РФП, не связавшегося с лейкоцитами и примесью тромбоцитов, которую удаляют. В оставшиеся меченые аутолейкоциты добавляют оставшуюся плазму из третьего пакета и ресуспендируют с получением радиофармпрепарата, который затем вводят пациенту с последующим проведением полиорганной сцинтиграфии.
Центрифугирование на первом этапе осуществляют в течение 10 минут, на втором этапе - 7 минут, на третьем этапе - 10 минут.
Краткое описание чертежей
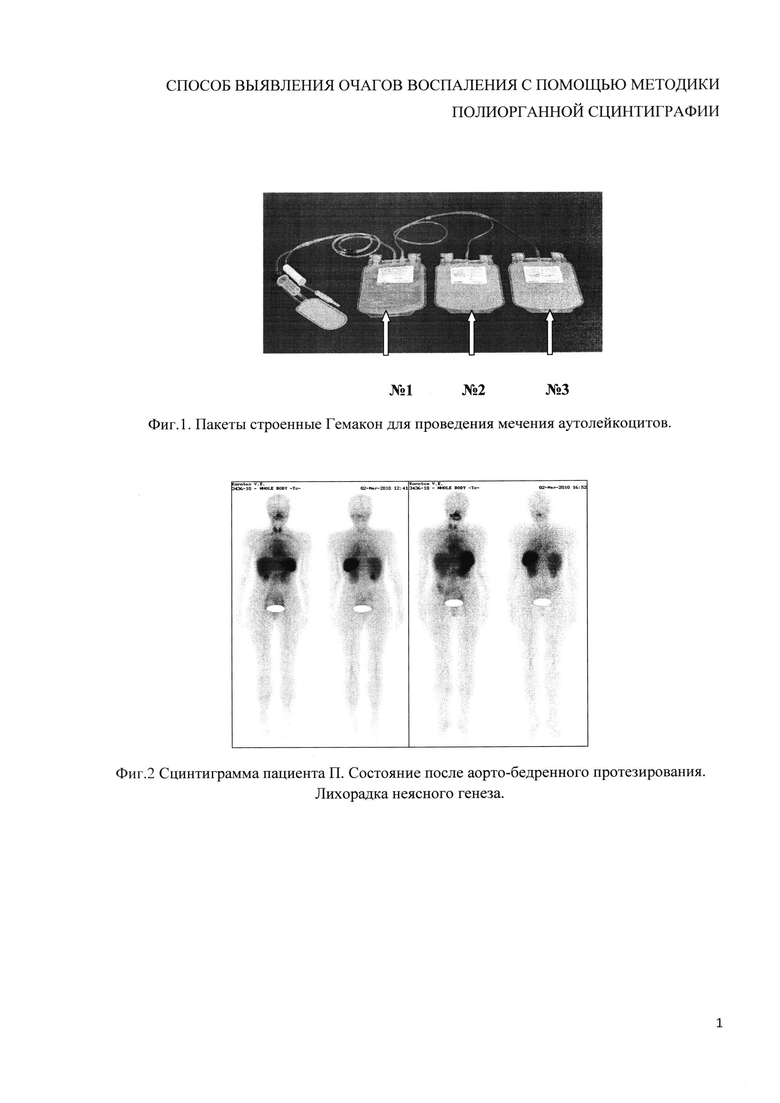
Изобретение поясняется чертежами, где на фиг. 1 представлено устройство для проведения мечения аутолейкоцитов и сбора радиоактивной плазмы после отмывания (пакеты Гемакон), позициями на фиг. 1 обозначены: 1 - пакет с исходной цельной кровью, 2 - пакет, предназначенный для размещения обогащенной лейкоцитами плазмы после центрифугирования, в котором также осуществляется мечение 99mTc-теоксимом (99mTc-церетеком), 3 - пакет для размещения плазмы. На фиг. 2-10 представлены сцинтиграммы различных пациентов, которым было проведено исследование с использованием или без использования заявляемого изобретения. В частности, на фиг. 4, 7-10 представлены сцинтиграммы, полученные с использованием заявляемого изобретения, на фиг. 2, 3, 5, 6 - с использованием стандартного протокола.
Осуществление изобретения
Заявляемый способ осуществляют с помощью системы из трех герметично соединенных между собой контейнеров, где первый контейнер выполнен объемом 500 мл, второй - объемом 300 мл, третий - объемом 300 мл, выполненных герметичными, обеспечивающих минимизацию контакта размещаемого в них содержимого с внешней средой. В частности, для реализации изобретения могут быть использованы строенные контейнеры Гемакон (www.delrus.com/index.php?part_name) (фиг. 1).
Ниже представлено более подробное описание способа приготовления препарата клеток крови для использования в сцинтиграфии для выявления очагов воспаления.
1. Получение концентрата лейкоцитов из плазмы.
Цельную венозную кровь в объеме 250-400 мл забирают в стерильный пакет №1 из «строенных» пакетов типа Гемакон и подвергают двухкратному центрифугированию. Первое центрифугирование проводят в режиме g 200 (800 об/мин) в течение 10 мин, обеспечивающее осаждение эритроцитов. Далее, полученную плазму, обогащенную лейкоцитами, с помощью плазмоэкстрактора, не нарушая целостность пакета, переносят через соединительную трубку в пакет №2 и повторно центрифугируют в режиме - g 530 (1300 об/мин) в течение 7 мин. Надосадочную плазму, образовавшуюся в пакете №2 после центрифугирования, также посредством плазмоэкстрактора и замкнутой системы переносят в пакет №3. Аутоэритроциты, которые остались в пакете №1, возвращают пациенту, а полученную бесклеточную плазму из пакета №3 используют в качестве субстрата для ресуспендирования клеток в пакете №2.
2. Мечение лейкоцитов.
Для мечения лейкоцитов используют элюат 99mTc-пертехнетата (не позднее 24 часов после предыдущего элюирования) активностью 500-800 МБк, объемом 3-5 мл, который соединяют с лиофилизатом теоксима или церетека (в количестве 0,5 мг действующего вещества Эксаметазима), рекомендованном для стандартного применения, с последующим добавлением в аутолейкоциты (пакет №2). В пакете №2 осуществляют мечение оставшихся аутолейкоцитов путем введения 99mTc-теоксима (99Тс-церетека). Полученную смесь инкубируют при комнатной температуре в течение 8-10 мин, осторожно поворачивая клеточную суспензию для предотвращения осаждения клеток.
3. По завершении инкубации в пакет №2 добавляют 10-20 мл плазмы из пакета №3 и центрифугируют в режиме g 1162 (2000 об/мин) в течение 10 мин, для осаждения меченых клеток. После центрифугирования из пакета №2 удаляют (утилизируют) с помощью плазмоэкстрактора надосадочную жидкость, содержащую несвязаный 99mTc-теоксим и 99mTc-пертехнетат (бесклеточную меченую плазму). Далее оставшейся частью плазмы из пакета №3 ресуспендируют меченые 99mTc-теоксим-аутолейкоциты или 99mTc-церетек-аутолейкоциты (содержимое пакета №2) с получением препарата, которые затем реинфузируют пациенту для проведения сцинтиграфии. Реинфузия (внутривенно, капельно) пациенту проводится не позднее, чем через 1 ч от начала процедуры мечения.
4. Оценка эффективности мечения проводят путем определения радиоактивности удаленной надосадочной части (растворимых соединений) и полученного препарата (РФП). Эффективность мечения определяют по формуле:
Радиоактив-ть в осадке/(радиоактив-ть осадка+радиоактив-ть в надосадочной жид-ти)*100
Достаточная эффективность мечения составляет от 40% до 80%. Если результат <40% проводят дальнейший контроль качества (микроскопическое исследование или тест на жизнеспособность клеток).
5. После этого визуально оценивают РФП на наличие сгустков, скоплений фибрина.
6. После реинфузии меченых 99mTc-теоксим-аутолейкоцитов (99mTc-церетек-аутолейкоцитов) проводят радионуклидное исследование по представленному ниже протоколу.
Протокол записи. Полиорганную сцинтиграфию в режиме «Whole body» и ОФЭКТ (однофотонная эмиссионная компьютерная сцинтиграфия) зон выявленного очага (областей подозрительных на наличие очага) выполняют через 1, 3, 6, 18 и 24 часа. Желательно проводить первую запись непосредственно после введения РФП для определения легочного транзита. При необходимости исследование расширяют проведением компьютерной томографии для определения топографии и распространенности выявленного очага.
Всего с помощью заявляемого способа был обследован 51 пациент с лихорадкой неясного генеза и подозрением на локальный воспалительный процесс (23 пациента после сосудистого протезирования, 16 пациентов после трансплантации почки и 2 после трансплантации печени, 10 пациентов после протезирования клапанов). Верификация результатов исследования осуществлялась с помощью гистологического анализа послеоперационного материала. Данные сцинтиграфии сопоставлялись с результатами компьютерной томографии, наблюдениями в катамнезе. Получено 43 истинно положительных результата, 7 истинно отрицательных, 1 ложно положительный результат (ложно отрицательных результатов получено не было).
Ниже представлены примеры реализации настоящего изобретения - получения препарата клеток крови и выявления очагов воспаления с помощью методики полиорганной сцинтиграфии с использованием полученного препарата.
Пример 1. Путем забора цельной крови в объеме 400 мл и центрифугирования в режиме g 200 (800 об/мин) и перевода надосадочной плазмы в пакет №2 получено 300 мл обогащенной лейкоцитами плазмы. После второго центрифугирования - g 530 (1300 об/мин) получено 100 мл лейкотромбослоя и 200 мл плазмы. После проведения мечения и реинфузии клеток 1 мл указанного меченого клеточного пула предоставлен для анализа в клинико-диагностическую лабораторию, где получены следующие результаты (клинический анализ №360 от 23.10.2013: Гемоглобин 0,0 г/л, эритроциты 0,03×1012/л, лейкоциты 2,7×109/л, тромбоциты 181×109/л. Кроме того, проведен подсчет общего количества лейкоцитов - 6125 кл/мкл и среди них мертвых клеток 5,7%. При проведении полиорганной сцинтиграфии накопления в слизистой желудка и щитовидной железе зарегистрировано не было, что свидетельствует об отсуствии свободной активности в приготовленном РФП (меченные 99mTc-теоксим-аутолейкоциты).
Ниже в Примерах 2-8 представлены результаты сцинтиграфии, которая проводилась с применением препарата, приготовленного по стандартной методике (Патент RU 2136218, МПК: A61B 8/13) и с помощью препарата, полученного заявляемым способом.
Пример 2 (фиг. 2). Пациенту П. после аорто-бедренного протезирования с лихорадкой неясного генеза была проведена метка аутолейкоцитов и полиорганная сцинтиграфия. Исследование проводилось по ранее известному протоколу. Получены изображения очагов гиперфиксации РФП в проекции ротоглотки, щитовидной железы, аорты и магистральных сосудов. Достоверно определить очаг гиперфиксации (воспаления) не представляется возможным.
Пример 3 (фиг. 3). Пациенту Д. после бифуркационного аорто-бедренного протезирования с лихорадкой неясного генеза была проведена сцинтиграфия. Исследование проводилось препаратом, приготовленным по стандартной методике. На сцинтиграмме отмечается активное включение в полостях сердца, в области дуги аорты и магистральных сосудах. Достоверно определить очаг гиперфиксации не представляется возможным.
Пример 4 (фиг. 4). Пациенту Е. после бифуркационного аорто-бедренного протезирования с лихорадкой неясного генеза была проведена сцинтиграфия. Исследование выполнено с использованием препарата, приготовленного заявляемым способом. Получены сцинтиграфические признаки очаговой лейкоцитарной инфильтрации в области левой бранши дистального анастомоза бифуркационного аорто-бедренного протеза.
Пример 5 (фиг. 5 и фиг. 6). Пациенту В. с ожогом пламенем 2-3 АБ ст. 65% п.т. (3Б ст. 15% п.т.) лица, шеи, ушных раковин, грудной клетки, передней брюшной стенки, спины, ягодиц, плеч, предплечий, костей, бедер, голеней, стоп была выполнена сцинтиграфия (фиг. 5). Пациент находился в состоянии шока. Состояние после некрэктомии, аутодермопластики. Исследование проводили препаратом, приготовленным по стандартной методике, что привело к получению изображения очагов гиперфиксации в проекции ротоглотки, щитовидной железы и участка ткани в области верхней трети средостения. Возникло предположение, что это не воспалительный очаг, а участок эктопированной ткани щитовидной железы (ложноположительный результат). Для подтверждения этого пациенту проведена сцинтиграфия щитовидной железы с элюатом технеция. Полученные результаты представлены на сцинтиграмме пациента (фиг. 6) в режиме ОФЭКТ, на которых визуализируется очаг гиперфиксации в проекции верхнего средостения (участок эктопированной ткани щитовидной железы), который при проведении исследования с мечеными аутолейкоцитами был ошибочно расценен как воспалительный.
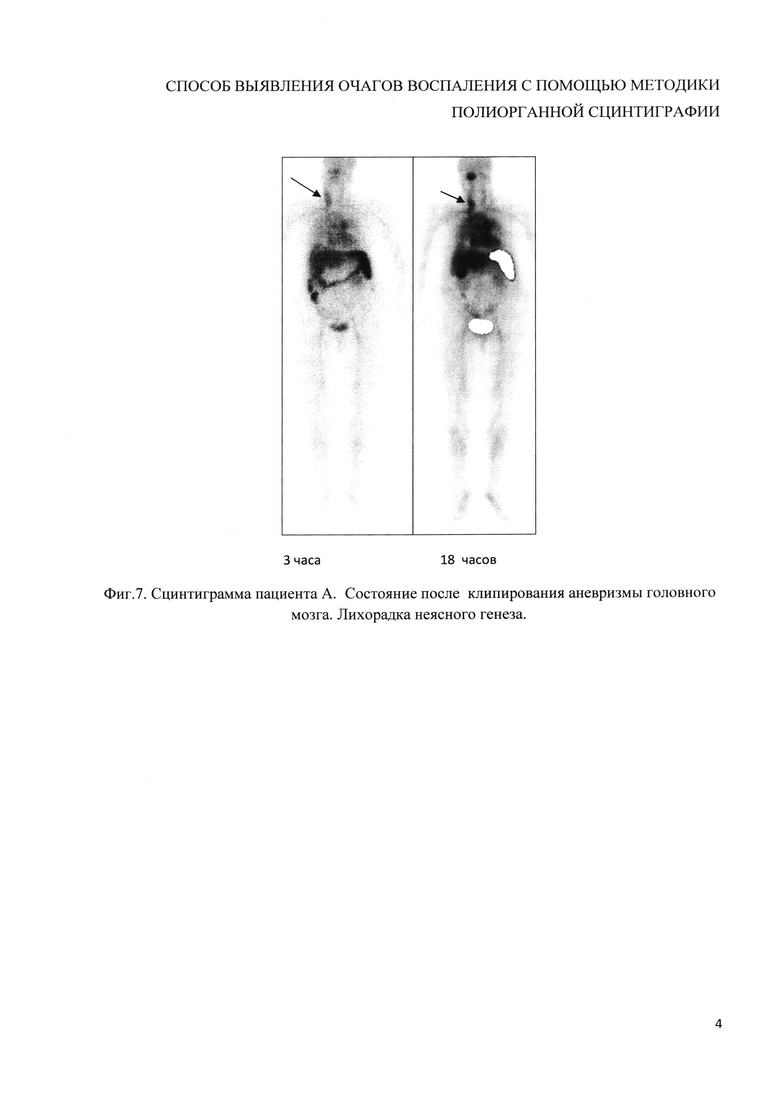
Пример 6 (фиг. 7). Пациенту А. после клипирования аневризмы головного мозга с лихорадкой неясного генеза была проведена сцинтиграфия. Исследование выполнено с использованием препарата, приготовленного заявляемым способом. Получено изображение физиологического распределения меченых аутолейкоцитов и очагов гиперфиксации РФП в проекции ротоглотки и левой яремной вены. Данные очаги являются воспалительными, что доказано клинически.
Пример 7 (фиг. 8). Пациенту К. после трансплантации почки с лихорадкой неясного генеза была проведена сцинтиграфия. Исследование выполнено с использованием препарата, приготовленного заявляемым способом. Получены сцинтиграфические данные очага воспаления в проекции левой яремной вены.
Пример 8 (фиг. 9 и фиг. 10). Пациенту Г. состояние после нефротрансплантатэктомии справа по поводу утраты функции почечного трансплантата (мочевой затек, инфицирование). Больной был переведен на программный гемодиализ, иммуносупрессивная терапия отменена, несмотря на это у пациента лихорадка неясного генеза. Для выявления очага воспаления была проведена полиорганная сцинтиграфия. Исследование выполнено с использованием препарата, приготовленного заявляемым способом. Получены сцинтиграфические данные (фиг. 9) очаговой лейкоцитарной инфильтрации в области ложа удаленного почечного трансплантата, с распространением на мягкие ткани передней брюшной стенки. На фиг. 10 представлены сцинтиграммы данного пациента в режиме ОФЭКТ, на которых визуализируется очаг гиперфиксации в проекции ложа удаленного почечного трансплантата с распространением лейкоцитарной инфильтрации на переднюю брюшную стенку.
Результаты проведенных исследований показали, что обследование пациентов, проведенное по заявляемому протоколу, позволяет, во-первых, получить достоверную визуализацию очагов воспаления и физиологического распределения меченых аутолейкоцитов, во-вторых, снизить риск контаминации крови, т.к. все манипуляции проводятся в замкнутой системе пакетов Гемакон, в-третьих, уменьшить число ложноположительных результатов (которые возможны из-за примеси аутоэритроцитов и свободной активности), в-четвертых снизить суммарную дозу облучения на пациента (на 40-50%) за счет отмывания плазмой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ СТЕПЕНИ УДЕРЖАНИЯ КЛЕТОЧНОГО ПРЕПАРАТА В ПРЕДЕЛАХ ЦЕЛЕВОГО ОРГАНА ПРИ ВНУТРИОРГАННОМ ВВЕДЕНИИ С ИСПОЛЬЗОВАНИЕМ РАДИОНУКЛИДНОГО МЕТОДА | 2022 |
|
RU2809526C2 |
| СПОСОБ МЕЧЕНИЯ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ IN VITRO КОМПЛЕКСНЫМ СОЕДИНЕНИЕМ | 2019 |
|
RU2708458C2 |
| СРЕДСТВО И СПОСОБ ДИАГНОСТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ | 2005 |
|
RU2290952C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ИШЕМИЕЙ НИЖНИХ КОНЕЧНОСТЕЙ | 2021 |
|
RU2759478C1 |
| СПОСОБ ТОПИЧЕСКОЙ ДИАГНОСТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ СЕРДЦА | 2003 |
|
RU2244515C2 |
| СПОСОБ ТОПИЧЕСКОЙ ДИАГНОСТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ СЕРДЦА | 1998 |
|
RU2136218C1 |
| СПОСОБ ДИАГНОСТИКИ ВЫРАЖЕННОСТИ И РАСПРОСТРАНЕННОСТИ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У БОЛЬНЫХ ТУБЕРКУЛЕЗОМ ДЕТЕЙ | 2022 |
|
RU2823857C2 |
| Применение радиофармацевтической композиции с использованием меченых аутологичных лейкоцитов для визуализации местных лучевых поражений методом однофотонной эмиссионной томографии | 2018 |
|
RU2708088C2 |
| РАДИОНУКЛИДНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ДИСФУНКЦИИ ПЕЧЕНИ ПОСЛЕ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ | 2019 |
|
RU2718294C1 |
| Способ оценки результатов остеосцинтиграфии у пациентов с метастатическим поражением костей скелета | 2022 |
|
RU2791402C1 |




Изобретение относится к области медицины, а именно, к радионуклидной диагностике и может быть использовано для выявления очагов воспаления с помощью методики полиорганной сцинтиграфии. Проводят забор крови не менее 250-400 мл в первый стерильный пакет, который подвергают центрифугированию со скоростью 800 об/мин в течение времени, необходимого для осаждения эритроцитов. Переводят во второй пакет полученную в первом пакете обогащенную лейкоцитами надосадочную плазму. Осуществляют центрифугирование содержимого второго пакета со скоростью 1300 об/мин в течение времени, необходимого для получения аутолейкоцитов. Далее надосадочную плазму из второго пакета переводят в третий пакет, а эритроциты из первого пакета внутривенно возвращают пациенту. Добавляют радиофармпрепарат (РФП) в количестве 3-5 мл в аутолейкоциты, оставшиеся во втором пакете. Полученную клеточную взвесь инкубируют в течение 8-10 мин. К ней добавляют плазму из третьего пакета в количестве 10-20 мл с последующим центрифугированием второго пакета с полученной клеточной взвесью со скоростью 2000 об/мин в течение времени, необходимого для отделения меченых аутолейкоцитов от свободного РФП, не связавшегося с лейкоцитами. Удаляют свободный РФП из второго пакета. Добавляют в оставшиеся меченые аутолейкоциты остатки плазмы из третьего пакета и ресуспендируют с получением препарата, который вводят пациенту для проведения полиорганной сцинтиграфии. Способ обеспечивает повышение достоверности определения очагов воспаления, то есть получение более объективных результатов исследования, за счет использования препарата клеток крови, характеризующегося отсутствием свободной радиоактивности и примесей меченых аутоэритроцитов, при сохранении функциональных свойств клеточных элементов, а также качественной оценки накопления меченых лейкоцитов в предполагаемой зоне воспаления путем визуального и количественного определения области повышенной аккумуляции РФП. 1 з.п.ф-лы, 10 ил., 8 пр.
1. Способ выявления очагов воспаления с помощью полиорганной сцинтиграфии, включающий:
забор крови не менее 250-400 мл в первый стерильный пакет, который подвергают центрифугированию со скоростью 800 об/мин в течение времени, необходимого для осаждения эритроцитов,
после чего полученную в первом пакете обогащенную лейкоцитами надосадочную плазму переводят во второй пакет и осуществляют его центрифугирование со скоростью 1300 об/мин в течение времени, необходимого для получения аутолейкоцитов,
после чего надосадочную плазму из второго пакета переводят в третий пакет, а эритроциты из первого пакета внутривенно возвращают пациенту,
далее в аутолейкоциты, оставшиеся во втором пакете, добавляют РФП в количестве 3-5 мл, инкубируют в течение 8-10 мин, и добавляют плазму из третьего пакета в количестве 10-20 мл с последующим центрифугированием второго пакета с полученной клеточной взвесью со скоростью 2000 об/мин в течение времени, необходимого для отделения меченых аутолейкоцитов от свободного РФП, не связавшегося с лейкоцитами, который удаляют, а в оставшиеся меченые аутолейкоциты добавляют оставшуюся плазму из третьего пакета и ресуспендируют с получением препарата, который вводят пациенту для проведения полиорганной сцинтиграфии,
вывод о наличии очагов воспаления делают посредством качественной оценки накопления меченых лейкоцитов в предполагаемой зоне воспаления путем визуального и количественного определения области повышенной аккумуляции РФП.
2. Способ по п. 1, характеризующийся тем, что в качестве РФП используют 99mTc-теоксим или 99mTc-церетек.
| Фадеев Н.П | |||
| и др | |||
| Возможности сцинтиграфии с мечеными аутолейкоцитами в обнаружении очагов воспаления и нагноения | |||
| // Вестник рентгенологии и радиологии | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| СРЕДСТВО И СПОСОБ ДИАГНОСТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ | 2005 |
|
RU2290952C1 |
| СПОСОБ ДИАГНОСТИКИ ГНОЙНОГО ВОСПАЛЕНИЯ | 2000 |
|
RU2171691C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НЕСПЕЦИФИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА | 2004 |
|
RU2261656C1 |
| Notopoulos A | |||
| et al | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| A single center experience | |||
| // Hell J Nucl Med | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Basu S | |||
| et al | |||
| Functional imaging of inflammatory diseases using nuclear medicine techniques | |||
| // Semin Nucl Med | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Mota L.G | |||
| et al | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2018-03-28—Публикация
2017-06-26—Подача