Настоящее изобретение относится к новому способу биологического контроля присутствия амеб рода Naegleria и, в частности, видов Naegleria fowleri и их быстрого размножения.
Naegleria fowleri (N.f.) представляет собой свободноживущую амебу, принадлежащую к семейству Vahlkampfiidae. У человека эта амеба отвечает за серьезное патологическое заболевание, которое, к счастью, является крайне редким (235 случаев выявлено в 2007 году): первичный амебный менингоэнцефалит (РАМ) (Cervantes-Sandoval I, 2008; Kemble SK, 2012; TW, 2010; Su MY, 2013). Заражение этими свободноживущими амебами имеет катастрофический прогноз примерно через неделю и требует лечения антибиотиками в течение нескольких недель (Su MY, 2013). Против этой инфекции не существует действительно эффективного лечения; к счастью, заболевание встречается крайне редко и для запуска РАМ требуется сочетание определенных условий. В настоящее время эти конкретные условия, а также необходимый прививочный материал до сих пор остаются неизвестными. Однако оказалось, что некоторые лекарственные средства и антибиотики влияют на развитие инфекции, такие как амфотерицин В, рифампицин и миконазол, которые в комбинации доказали свою эффективность на 2 или 3 индивидуумах. В 1992 году в литературе сообщалось только о 7 случаях выживания после РАМ (Gautam PL, 2012) и только очень молодых субъектов в возрасте от 2 до 14 лет, у которых в результате лечения и инфекции возникли более или менее серьезные неврологические осложнения. Соответственно, показатель выживаемости даже более низкий, чем для инфекции вирусом Эбола. Таким образом, мониторинг и контроль этой свободноживущей амебы является чрезвычайно важной задачей.
В целом известно, что Naegleria fowleri имеет повсеместное распространение в окружающей среде (Martinez AJ, 1997), так как эта амеба была выделена из почвы, речной воды и озерной воды (Jamerson М, 2009) или промышленных сточных вод и биопленок (Goudot S, 2012; S.A. Huws, 2005), характерно, что она связана с другими свободноживущими амебами. Многие потенциально патогенные бактерии, включая Legionella pneumophila, выработали механизмы выживания и размножения внутри свободноживущих амеб (Huang SW, 2010; De Jonckheere, 2011). Кроме того, было показано, что атомные электростанции значительно влияют на развитие амебы Naegleria fowleri посредством нагрева речной воды на несколько градусов. Действительно, амеба Naegleria fowleri является теплолюбивой, при этом температура, при которой происходит ее развитие, составляет от 25°C до 45°C (Visvesvara GS, 2007).
Компания EDF, которая управляет более 11 атомными электростанциями во Франции, количественно оценила риск, связанный с уровнем обнаруженных в воде Naegleria fowleri. Для лучшего понимания этого риска Департамент исследований и разработки (Department of Studies and Research) и Департамент медицинских исследований (Department of Medical Studies) компании EDF провели количественную оценку риска смерти от РАМ во время купания в зависимости от концентрации в воде Naegleria fowleri. Этот риск может подразделяться следующим образом:
риск 1 купания = вероятность вдыхания через нос «n» Naegleria fowleri во время купания в воде, в которой присутствует Naegleria fowleri при концентрации «с» (10 мл воды, вдыхаемой через нос, на одно купание),
умноженный на вероятность смерти при вдыхании «n» Naegleria fowleri (моделирование на основе данных о животных).
При выборе логнормальной модели, которая дает самые низкие оценки и которая хорошо согласуется с фактическими данными (США, Австралия, Новая Зеландия), были получены следующие риски.
Риск концентрации для количества n N.f. в воде для купания:
1 Naegleria fowleri / литр, риск = 10-8, то есть одна смерть на 100 миллионов купаний;
10 Naegleria fowleri / литр, риск 1,45 × 10-7, то есть одна смерть на 7 миллионов купаний;
100 Naegleria fowleri / литр, риск = 1,45 × 10-6, то есть одна смерть на 140000 купаний;
1000 Naegleria fowleri / литр, риск = 1,34 × 10-3, то есть одна смерть на 746 купаний.
В соответствии с рекомендациями Высшего совета здравоохранения Франции (Conseil superieur d'hygiene publique de France, CSHPF) [French High Council for Public Hygiene], в случае превышения предельного значения, равного 100 Naegleria fowleri (N.f.) на литр, должен быть введен запрет на купание (смотри, в частности, мнение CSHPF 4 мая 2004 года относительно результатов антиамебной терапии с использованием монохлорамина, проводимой в 2003 году компанией EDF на атомных электростанциях (CNPE) Bugey, Chooz, Dampierre, Golfech и Nogent).
В связи с этим авторы изобретения совершенно неожиданно продемонстрировали, что амебы рода Willaertia magna (W.m.) уничтожают свободноживущие амебы Naegleria fowleri. Этот биоцидный эффект подтверждается уже продемонстрированной способностью Willaertia magna уничтожать другие бактериальные агенты, такие как бактерии Legionella pneumophila, Pseudomonas и Listeria (Bodennec Jacques, 2006).
Таким образом, настоящее изобретение, прежде всего, относится к способу контроля пролиферации Naegleria, в частности Naegleria fowleri, в котором используются простейшие рода Willaertia, предпочтительно Willaertia magna. Способы в соответствии с изобретением не включают способы лечения человека или животного. В способе согласно изобретению это, как правило, поток газа или жидкости, который обрабатывают простейшими рода Willaertia и, в частности, видами Willaertia magna. Но это также может быть твердой поверхностью.
Способ согласно изобретению находит конкретное применение в дезинфекции канализационной воды или промышленных водораспределительных сетей, контуров охлаждения промышленных предприятий, например, ядерного типа или сетей кондиционирования воздуха. Указанный способ можно использовать для контроля образования биопленок в водопроводных трубах или на поверхностях, которые могут находиться или могут не находиться в контакте с продуктами питания для человека или животных.
Простейшие могут быть непосредственно добавлены к воде или жидкостям, циркулирующим по трубам или сетям, подлежащим обработке. Также возможно их распыление, например, в форме водного раствора аэрозоля в промышленных сетях, дымоходах, на предприятиях и на промышленных поверхностях, которые следует дезинфицировать.
Преимущественно простейшие, используемые в контексте изобретения, соответствуют штамму, депонированному 21 августа 2006 года под номером РТА 7824 в АТСС, или штамму, депонированному 21 августа 2006 года под номером РТА 7825 в АТСС, причем эти два штамма были депонированы по поручению Centre National de la Recherche Scientifique (CNRS) [Французского национального центра научных исследований] - 3 rue Michel Ange - 75794 PARIS CEDEX 16 / France и UNIVERSITE LYON 1 CLAUDE BERNARD [Lyon 1 Claude Bernard University] - 43 Boulevard du 11 Novembre 1918 - 69622 VILLEURBANNE Cedex / France.
Простейшие, принадлежащие к роду Willaertia, соответствующие штамму, депонированному под номером РТА 7824 в АТСС, или штамму, депонированному под номером РТА 7825 в АТСС, являются неотъемлемой частью изобретения. Упомянутые депонированные штаммы также описаны в публикации РСТ в международной заявке WO 2008/043969.
Таким образом, такие простейшие могут быть использованы в дезинфицирующих средствах, в частности, предназначенных для уничтожения амеб Naegleria fowleri и для контроля пролиферации и контаминации Naegleria fowleri.
С другой стороны, настоящее изобретение относится к дезинфицирующему средству, содержащему простейшие рода Willaertia и, в частности, видов Willaertia magna. Простейшие, соответствующие штамму, депонированному под номером РТА 7824 в АТСС, или штамму, депонированному под номером РТА 7825 в АТСС, будут предпочтительны. Преимущественно дезинфицирующее средство согласно изобретению находится в форме водного раствора или суспензии, например, в дистиллированной воде. Дезинфицирующее средство может быть представлено в распыляемой форме, как, например, аэрозоль или любое другое средство применения.
Активность простейших рода Willaertia и, в частности, видов Willaertia magna в отношении ингибирования быстрого размножения Naegleria fowleri была продемонстрирована авторами изобретения путем сравнения репликации Naegleria fowleri в присутствии и в отсутствие рода Willaertia и, в частности, видов Willaertia magna. Авторы изобретения также показали уникальную природу ингибирования родом Willaertia magna роста этих Naegleria fowleri путем использования других видов свободноживущей амебы, Acanthamoeba, в качестве контрольного штамма, который не вызывает ингибирования роста Naegleria fowleri.
Учитывая, что при отсутствии терапевтического или профилактического лечения Naegleria fowleri риск смертности для человека составляет более чем 95% менее чем через неделю, данное изобретение является важным научным достижением в отношении контроля этого амебного эпидемического заболевания с нейтральным воздействием на окружающую среду и на человека. Действительно, регламент ЕС No. 1271/2008 на сегодняшний день признает, что штамм Willaertia magna не относится к классу опасных, и не ссылается на какую-либо опасность или рекомендацию по соблюдению осторожности в отличие от используемого в настоящее время монохлорамина.
Кроме того, настоящее изобретение относится к применению дезинфицирующего средства в соответствии с изобретением и/или простейших рода Willaertia и, в частности, видов Willaertia magna, и простейших, соответствующих штамму, депонированному под номером РТА 7824 в АТСС, или штамму, депонированному под номером РТА 7825 в АТСС, в качестве биоцида против Naegleria.
Следующие далее примеры представлены в целях иллюстрации изобретения, но не носят ограничительного характера.
1. МАТЕРИАЛЫ И МЕТОДЫ
1.1. Используемые штаммы
- Амебы: используемые штаммы принадлежат трем различным видам амеб:
 Naegleria fowleri (АТСС 30809);
Naegleria fowleri (АТСС 30809);
 Acanthamoeba castellanii (АТСС 30010);
Acanthamoeba castellanii (АТСС 30010);
 Willaertia magna (штаммы, депонированные в АТСС под номерами РТА 7824 и РТА 7825).
Willaertia magna (штаммы, депонированные в АТСС под номерами РТА 7824 и РТА 7825).
Эти три штамма культивировали аксенически в присутствии 10% фетальной телячьей сыворотки на среде SCGYEM (среда, содержащая сыворотку, казеин, глюкозу, дрожжевой экстракт), распределенной по пробиркам GREINER™ в количестве 3 мл на пробирку. Для поддержания культуры вегетативные формы пересевали каждые 8-9 дней. Для совместных культур использовали субкультуры возрастом от 3 до 4 дней так, чтобы имелись трофозоиты непосредственно в фазе экспоненциального роста.
Среду SCGYEM получали, как указано ниже:

2,5 мл NaOH (1N) и затем Na2HPO4 и KH2PO4 добавляли в 900 мл дистиллированной воды. Смесь слегка нагревали на плите и постепенно добавляли казеин при перемешивании на магнитной мешалке. После растворения казеина вводили глюкозу и дрожжевой экстракт.
После полного растворения смесь последовательно фильтровали на стекловолокне (SARTORIUS SM 6513400) и затем на мембране 1 мкм (WHATMAN 7190 004). Аликвоты среды затем помещали в стеклянные бутылки. Бутылки стерилизовали в автоклаве в течение 20 минут при 120°C. Перед окончательным использованием и розливом среды стерильно добавляли фетальную телячью сыворотку под вытяжным шкафом с ламинарным потолком в количестве 10% от конечного объема.
1.2. Приготовление маточных суспензий амеб Willaertia masna и Naegleria fowleri
Исходные суспензии амеб (маточной суспензии) готовили с использованием 4 колб (Т-175 мл), содержащих аксеническую культуру каждой амебы, культивированной в среде SCGYEM. Эти маточные суспензии амеб Naegleria fowleri, Acanthamoeba и Willaertia magna собирали в конце экспоненциальной фазы роста, как правило, через 4-5 дней после начала культивирования.
Для повышения концентрации собранных амеб колбы опускали в ледяную ванну на 5-10 минут и затем перемешивали вручную, чтобы собрать как можно больше амеб.
Содержимое этих 4 колб объединяли для подсчета количества амеб в суспензии в счетной камере Тома ([С]/мл).
Амебные суспензии переносили в 50 мл пробирку типа FALCON® для удаления культуральной среды SCGYEM путем центрифугирования при 1500g в течение 10 минут. Амебный осадок, образованный после первого центрифугирования, дважды споласкивали путем отмывания стерильной дистиллированной водой и центрифугировали при 1500g в течение 10 минут. После 2 отмывок конечный осадок поглощали 40 мл стерильной воды.
1.3. Демонстрация биоцидного действия Willaertia magna в отношении Naegleria fowleri (штамм АТСС 30809)
Совместное культивирование амеб проводили в колбах Т-25 мл, содержащих 10 мл стерильной среды PAS (Page's Amoeba Saline). Колбы, содержащие совместную культуру амеб, инокулировали в количестве 1×105 Willaertia magna/мл и 1×105 Naegleria fowleriluii из аксенических амебных суспензий, подсчитанных ранее на гемоцитометре Малассе. Инфестацию Willaertia magna амебами Naegleria fowleri проводили при фиксированном отношении Naegleria fowleri / Willaertia magna, равном 1. Колбы Т-25 мл инкубировали в инкубаторе при 30°C.
Среду PAS получали следующим образом:


Растворы 1 и 2 стерильно фильтровали с использованием фильтра 0,22 мкм. Для получения 1 литра среды PAS: добавляли 5,0 мл раствора 1 и 5,0 мл раствора 2, затем доводили объем до 1 литра стерильной дистиллированной водой.
Контрольные монокультуры амеб Willaertia magna и Naegleria fowleri культивировали отдельно в колбах Т-25 мл в 10 мл стерильной среды PAS.
Колбы инокулировали в количестве 1×105 Willaertia magna/мл для контроля Willaertia magna и 1×105 Naegleria fowleri/мл для контроля Naegleria fowleri из аксенических суспензий амебных, подсчитанных ранее на гемоцитометре Малассе. Контрольные колбы Т-25 мл инкубировали в инкубаторе при 30°C.
Каждый режим выполняли в трех повторах. Каждый подсчет на гемоцитометре Малассе повторяли 5 раз. Эксперимент повторяли три (3) раза в течение периода, составляющего 3 месяца.
Гибель амеб Naegleria fowleri и Willaertia magna в совместной культуре и в контрольных колбах определяли следующим образом.
Концентрации амеб контролировали в течение 120 часов после инфестации Naegleria fowleri. В каждый временной интервал (через 3 часа и затем каждые 24 часа) отбирали образцы из колб, содержащих совместную культуру и контроль, и изучали на предмет клеточного роста двух амеб и на предмет их морфологического и динамического состояния. Для каждой колбы проводили следующие исследования:
- Амебы подсчитывали непосредственно в счетной камере Малассе.
- Через 120 часов низкий уровень амеб Naegleria fowleri более не позволил произвести достоверный подсчет в счетной камере Малассе, поэтому совместно использовали метод наиболее вероятного количества (Most Probable Number, MPN). Этот метод, широко используемый для подсчета количества амеб, имеет преимущество, которое заключается в более высокой точности, а также способности различать цельные и живые амебы от амеб, которые являются цельными, но погибшими.
2. РЕЗУЛЬТАТЫ
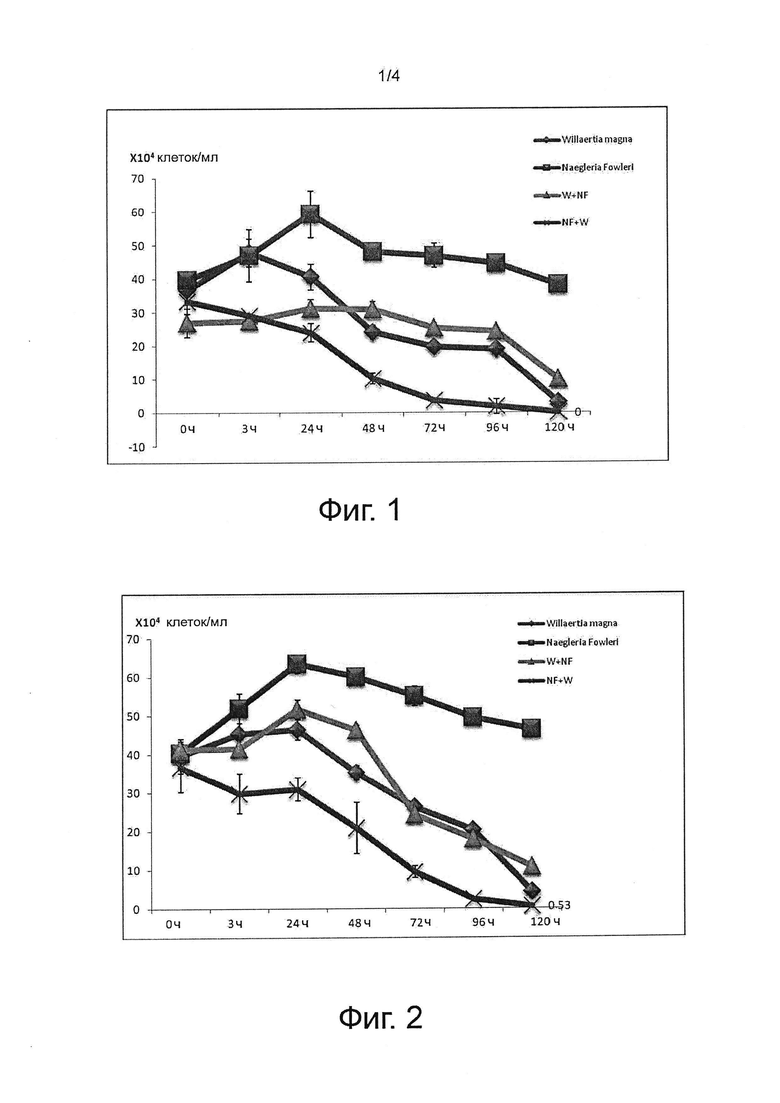
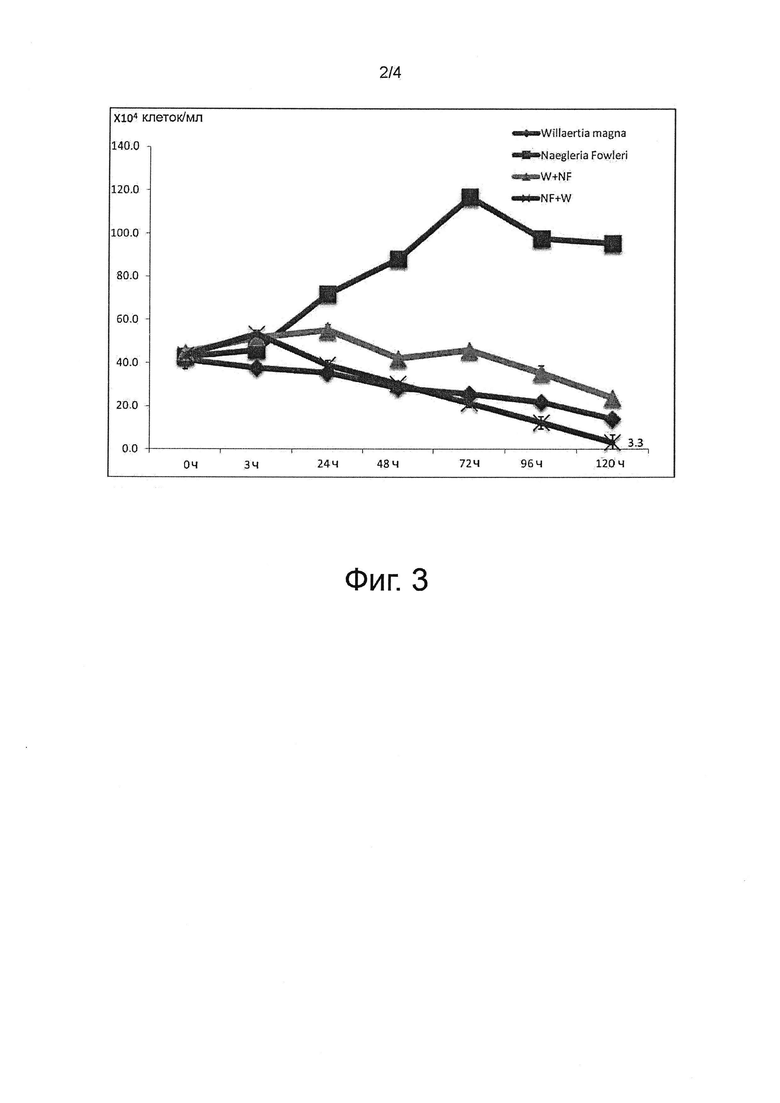
На фиг. 1, 2 и 3 показаны эксперименты, проведенные на совместных культурах (Willaertia magna / Naegleria fowleri) и контрольных монокультурах амеб.
На фигурах показана спонтанная эволюция соответствующих популяций амеб Willaertia magna и Naegleria fowleri после совместного культивирования при начальном отношении Willaertia / Naegleria, равном 1, по сравнению с эволюцией соответствующих популяций амеб в монокультуре.
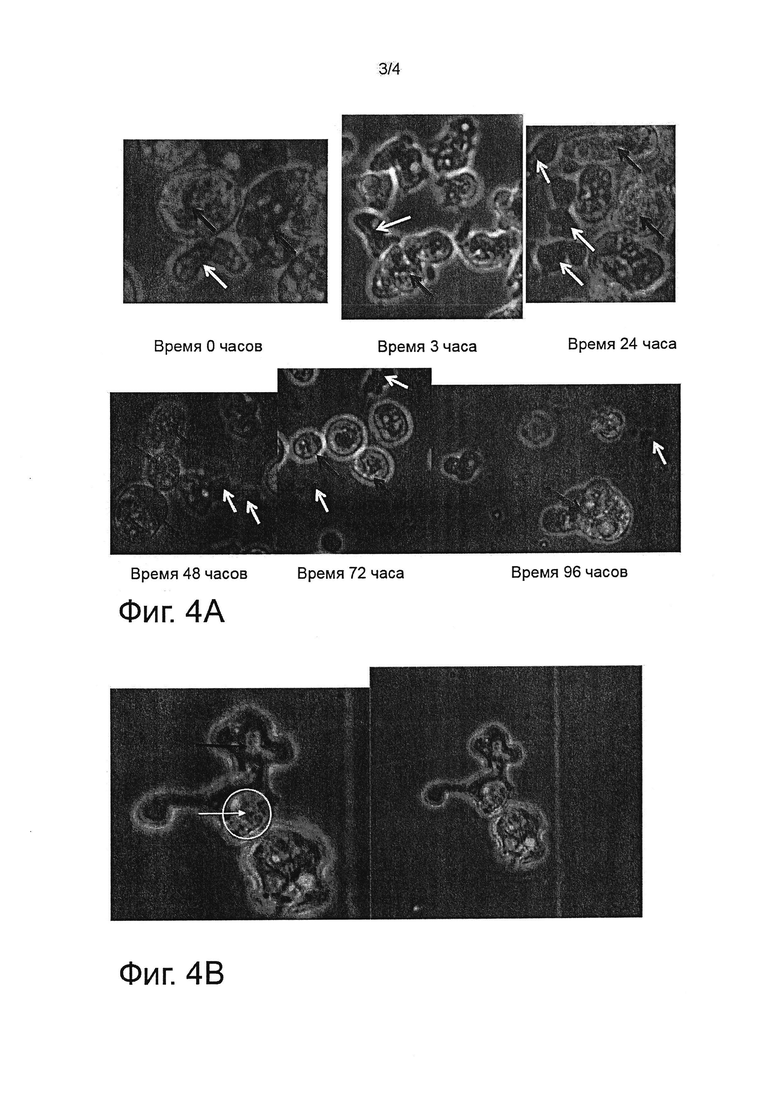
На фиг. 4а и 4b показано физиологическое состояние амеб Naegleria fowleri в динамике по времени в присутствии амеб Willaertia magna. На фиг. 4а представлены изображения быстрого физиологического разложения Naegleria fowleri в совместных культурах с Willaertia magna. На фиг. 4b представлено изображение, иллюстрирующее феномен «поцелуй смерти» Willaertia magna в отношении Naegleria fowleri.
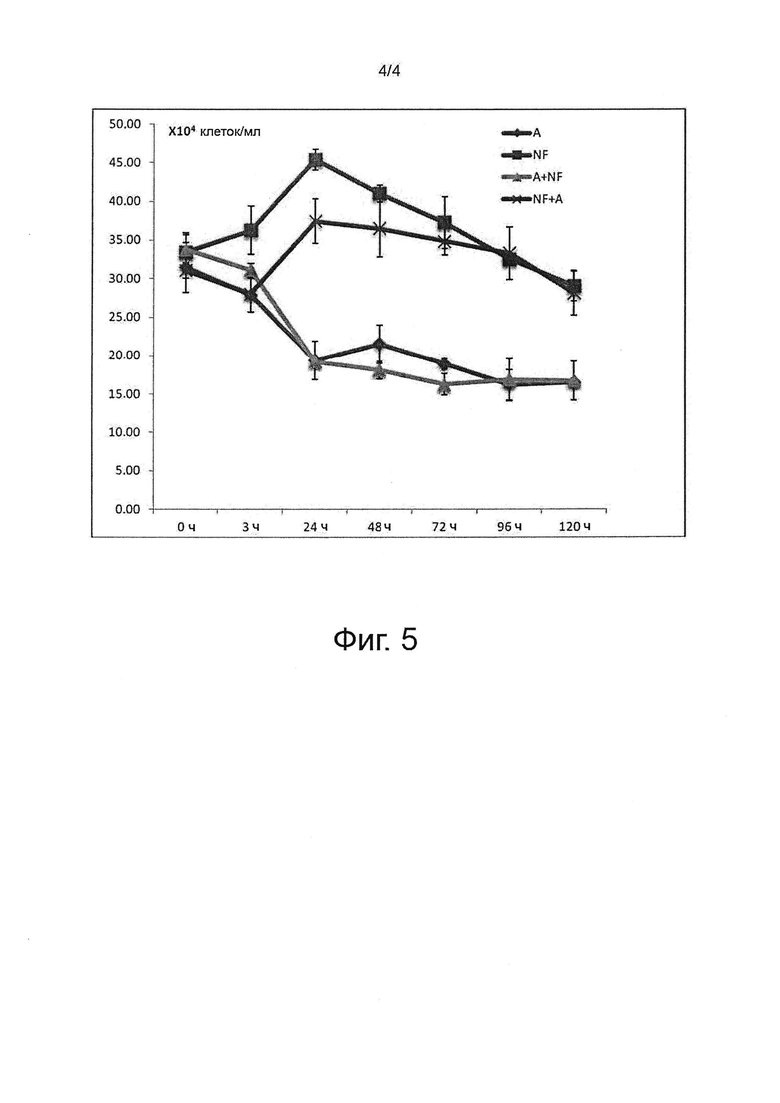
На фиг. 5 показан эксперимент на совместной культуре (Acanthamoeba castelanii/Naegleria fowleri) и контрольных монокультурах амеб.
На фиг. 1, 2 и 3 кривая с точками в виде ромба (♦), называемая Willaertia magna, описывает измеренную концентрацию только Willaertia magna в культуре в стерильной среде PAS.
Кривая с точками в виде квадрата (■), называемая Naegleria fowleri, описывает измеренную концентрацию только Naegleria fowleri в культуре в стерильной среде PAS.
Кривая с точками в виде треугольника (Δ), называемая W+NF, описывает измеренную концентрацию Willaertia magna в совместной культуре с Naegleria fowleri в стерильной среде PAS.
Кривая с точками в виде креста (X), называемая NF+W, описывает измеренную концентрацию Naegleria fowleri в совместной культуре с Willaertia magna в стерильной среде PAS.
Данные выражены в виде концентрации цельных клеток на миллилитр (мл), подсчитанной в счетной камере Малассе.
На фиг. 4а черные стрелки указывают на присутствие Willaertia magna и белые стрелки - на присутствие Naegleria fowleri, которые являются цельными или частями.
На фиг. 4b черные стрелки указывают на присутствие Willaertia magna и белые стрелки - на присутствие Naegleria fowleri. Белый круг обозначает контуры клетки Naegleria fowleri. Этот феномен «поцелуй смерти» описывается в литературе (Berke G. Source Department of Cell Biology, 1995) как контакт, который обеспечивает проникновение гранзима, индуцируя апоптоз в клетке-мишени.
На фиг. 5 кривая А, состоящая из точек в виде ромба (♦), представляет монокультуру Acanthamoeba castellanii.
Кривая А+NF, состоящая из точек в виде треугольника (Δ), представляет концентрацию Acanthamoeba castellanii в совместной культуре с Naegleria fowleri.
Кривая NF, состоящая из точек в виде квадрата (■), представляет монокультуру Naegleria fowleri.
Кривая NF+А, состоящая из точек в виде крестика (X), представляет концентрацию Naegleria fowleri в совместной культуре с Acanthamoeba castellanii.
2.1. Willaertia magna полностью ингибирует рост Naegleria fowleri
Как показано кривыми с точками в виде крестов на фиг. 1, 2 и 3, представляющими эволюцию Naegleria fowleri в совместной культуре с Willaertia magna, очень быстро, примерно через 24 часа, происходит открепление, как показано на кривой для популяции Naegleria fowleri. Это уменьшение популяции Naegleria fowleri наблюдается только в присутствии Willaertia magna. Все контрольные кривые (кривые с точками в виде квадратов) в экспериментах 1, 2 и 3 (фиг. 1, 2 и 3) показывают повышение уровня Naegleria fowleri в монокультуре через 24 часа. Более того, через 24 часа уровень Naegleria fowleri в монокультуре фактически удваивается.
Примечательно, что исследование под микроскопом подтверждает важное морфологическое изменение в Naegleria fowleri в совместной культуре с Willaertia magna уже через 24 часа (фиг. 4). Физиологическое состояние клетки Naegleria fowleri изменяется от распространенной трофозоитной формы до нагруженной формы, которая является более круглой, но все еще сходной с цистической формой. Внутренняя полость клетки Naegleria fowleri становится непрозрачной, маскируя внутренние вакуоли, признак роста амеб. Размер клеток Naegleria fowleri в присутствии Willaertia magna уменьшается в два раза по сравнению с их размером в монокультуре уже через 3 часа совместного культивирования (фиг. 4а). Способ уничтожения амеб Willaertia magna основан на фагоцитозе. На фиг. 4b показано, что в первые 24 часа феномен ингибирования сходен с «поцелуем смерти». Фагоцитоз Naegleria fowleri под действием Willaertia magna безусловно происходит, но только через 25 часов совместного культивирования, что подтверждается присутствием Willaertia magna, содержащих Naegleria fowleri в этих фагосомах (данные не представлены).
Все проведенные эксперименты демонстрируют максимальное ингибирующее действие с полным уничтожением Naegleria fowleri через 120 часов. Подсчет в счетной камере Малассе через 120 часов позволяет определить количество клеток Naegleria fowleri, которые присутствуют и являются цельными, но не позволяет провести различие между погибшими и живыми клетками. Двойное считывание на агаре NNA (неомицин+налидиксоновая кислота) + E.coli позволяет подсчитать только живые клетки Naegleria fowleri трофозоитной и/или цистической форм.
В таблице ниже указана концентрация амеб (Naegleria fowleri), полученная путем подсчета в счетной камере Малассе и с использованием метода MPN. Аликвоту совместной культуры Willaertia magna и Naegleria fowleri, отобранную из каждой колбы экспериментов 1, 2 и 3 (смотри фиг. с 1 по 3) через 120 часов после инфицирования, инокулировали на агар NNA, покрытый слоем E.coli.
Определение концентрации каждого вида проводили путем подсчета зон, обнаруженных на чаше и указанных в таблице MPN, с выведением оттуда концентрации амеб.
Nf=Naegleria fowleri
W.m=Willaertia magna
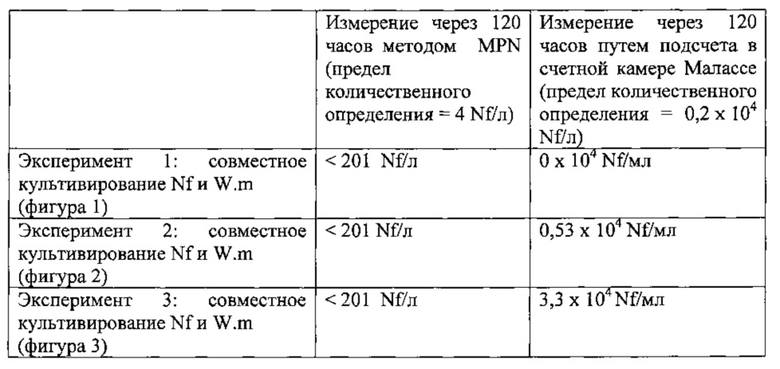
Данная таблица подтверждает отсутствие зон Naegleria fowleri на агаре NNA, что указывает на отсутствие живых Naegleria fowleri в цистической или трофозоитной форме через 120 часов.
Авторы изобретения продемонстрировали, что другие виды амеб не имеют такого неожиданного характера биоцидного действия в отношении рода Naegleria и, в частности, видов Naegleria fowleri, которым обладают Willaertia magna.
Как показано на фиг. 5, совместное культивирование амеб рода Acanthamoeba castellanii и Naegleria fowleri не оказывает какого-либо влияния на соответствующую концентрацию этих двух видов по сравнению с их концентрацией, измеренной в монокультуре. На этой фигуре показано отсутствие реципрокного действия другого рода амеб, типа Acanthamoeba, на эволюцию популяции Naegleria fowleri во время совместного культивирования этих двух амеб.
Амебы Willaertia magna является единственными, способными ингибировать рост амеб Naegleria и, в частности, виды Naegleria fowleri.
Литература
1. Bodennec Jacques, Pernin Pierre, Dey Rafick. Novel method for biologically combating the proliferation of Legionella pneumophila, and novel disinfecting agent containing amoebic protozoa of the Willaertia genus. France Brevet 2906968. 12 10 2006.
2. Cervantes-Sandoval I, Serrano-Luna J, Garcia-Latorre E, Tsutsumi V, Shibayama M. "Characterization of brain inflammation during primary amoebic meningoencephalitis". Parasitol Int, 57 (2008): 307 el3.
3. De Jonckheere. "Origin and evolution of the worldwide distributed pathogenic amoeboflagellate Naegleria fowleri". Infect Genet Evol. 11, n° (7) (Oct; 2011): 1520-8.
4. Gautam PL, Sharma S, Puri S, Kumar R, Midha V, Bansal R. "A rare case of survival from primary amebic meningoencephalitis". Indian J Crit Care Med. 16, n° (1) (Jan. 2012): 34-6.
5. Goudot S, Herbelin P, Mathieu L, Soreau S, Banas S, Jorand F. "Growth dynamic of Naegleria fowleri in a microbial freshwater biofilm". Water res. 46, n° (13) (Sep. 2012): 3958-66.
6. Huang SW, Hsu BM. "Survey of Naegleria and its resisting bacteria-Legionella in hot spring water of Taiwan using molecular method". Parasitol Res. 106, n° (6) (May 2010): 1395-402.
7. Jamerson M, Remmers K, Cabral G, Marciano-Cabral F. "Survey for the presence of Naegleria fowleri amebae in lake water used to cool reactors at a nuclear power generating plant". Parasitol Res. 104, n° (5) (Apr; 2009): 969-78.
8. Kemble SK, Lynfield R, DeVries AS et al. "Fatal Naegleria fowleri infection acquired in Minnesota: possible expanded range of a deadly thermophilic organism". Clin Infect Dis 54 (2012): 805-809.
9. Martinez AJ, Visvesvara GS. "Free-living, amphizoic and opportunistic amebas". Brain Pathol. 7, n° (1) (Jan; 1997): 583-98. Review.
10. S.A. Huws, A.J. McBain and P. Gilbert. "Protozoan grazing and its impact upon population dynamics in biofilm communities". Journal of Applied Microbiology 2005, 98, 238-244 98 (2005): 238-244.
11. Su MY, Lee Shyu LY, Lin WC, Hsiao PC, Wang CP, Ji DD, Chen KM, Lai SC. "A fatal case of Naegleria fowleri menigoencephalitis in Taiwan". Korean J parasitol. 51, n° (2) (April 2013): 203-206.
12. TW, Heggie. "Swimming with death: Naegleria fowleri infections in recreational waters". Travel Med Infect Dis 8 (2010): 201-206.
13. Visvesvara GS, Moura H, Schuster FL. "Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea". FEMS Immunol Med Microbiol 50 (2007): 1-26.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БИОЛОГИЧЕСКОГО КОНТРОЛЯ PSEUDOMONAS | 2012 |
|
RU2575999C2 |
| СПОСОБ БИОЛОГИЧЕСКОГО КОНТРОЛЯ ЛИСТЕРИЙ | 2012 |
|
RU2575998C1 |
| НЕТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ПРОСТЕЙШИХ ИЗ РОДА WILLAERTIA В КАЧЕСТВЕ ФУНГИСТАТИКА И/ИЛИ ФУНГИЦИДА | 2018 |
|
RU2770017C2 |
| Штамм Bacillus mojavensis Lhv-97, обладающий фунгицидной и бактерицидной активностью | 2017 |
|
RU2648163C1 |
| Штамм Trichoderma atrobrunneum, обладающий антибактериальной активностью в отношении Bacillus anthracis | 2019 |
|
RU2710783C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СЛИЗИ НА ЖАБРАХ РЫБ | 2016 |
|
RU2709758C2 |
| СПОСОБ ОБНАРУЖЕНИЯ БАКТЕРИЙ PASTEURELLA TREHALOSI И/ИЛИ MANNHEIMIA HAEMOLYTICA У ДОМАШНЕЙ ПТИЦЫ (ВАРИАНТЫ) | 2002 |
|
RU2430967C2 |
| НАБОР РЕКОМБИНАНТНЫХ ФЛУОРЕСЦЕНТНЫХ ШТАММОВ БАКТЕРИЙ ВИДА YERSINIA PESTIS АНТИЧНОГО БИОВАРА ОСНОВНОГО ПОДВИДА И АЛТАЙСКОГО БИОВАРА ЦЕНТРАЛЬНОАЗИАТСКОГО ПОДВИДА ДЛЯ ИНДИКАЦИИ ВОЗБУДИТЕЛЯ ЧУМЫ В ЭКСПЕРИМЕНТАЛЬНЫХ ОБРАЗЦАХ | 2020 |
|
RU2769790C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ 2-МЕТИЛХИНОКСАЛИНА (ВАРИАНТЫ) | 2000 |
|
RU2213777C2 |
| Штамм актиномицета Streptomyces pratensis - продуцент антибиотиков, используемый для защиты овощных культур от мягкой гнили, вызываемой фитопатогенными бактериями Pectobacterium caratovorum | 2022 |
|
RU2798572C1 |
Группа изобретений относится к биотехнологии. Предложены способ контроля пролиферации Naegleria fowleri и применение дезинфицирующего агента. Способ включает добавление штамма Willaertia magna, депонированного под номером РТА 7824 в АТСС, или штамма Willaertia magna, депонированного под номером РТА 7825 в АТСС, в поток жидкости или газа или на твердую поверхность. Дезинфицирующий агент содержит штамм Willaertia magna, депонированный под номером РТА 7824 в АТСС, или штамм Willaertia magna, депонированный под номером РТА 7825 в АТСС, в форме водного раствора или суспензии, применяемого в качестве биоцидного средства против Naegleria fowleri для обработки потока газа или жидкости или твердой поверхности. Изобретения обеспечивают контроль пролиферации и контаминации Naegleria fowleri. 2 н. и 3 з.п. ф-лы, 5 ил., 1 табл.
1. Способ контроля пролиферации Naegleria fowleri, включающий стадию добавления штамма Willaertia magna, депонированного под номером РТА 7824 в АТСС, или штамма Willaertia magna, депонированного под номером РТА 7825 в АТСС, в поток жидкости или газа или на твердую поверхность, контролируя тем самым пролиферацию Naegleria fowleri в указанном потоке газа, жидкости или на твердой поверхности.
2. Способ по п. 1, отличающийся тем, что он предназначен для дезинфекции канализационной воды или промышленных водораспределительных сетей, контуров охлаждения промышленных предприятий или атомных электростанций, или сетей кондиционирования воздуха, или промышленных поверхностей.
3. Способ по любому из пп. 1, 2, отличающийся тем, что указанный способ предназначен для контроля образования биопленок в водопроводах или на поверхностях, которые могут находиться или могут не находиться в контакте с пищевыми продуктами для человека или животных.
4. Применение дезинфицирующего агента, соответствующего штамму Willaertia magna, депонированному под номером РТА 7824 в АТСС, или штамму Willaertia magna, депонированному под номером РТА 7825 в АТСС, в качестве биоцидного средства против Naegleria fowleri, которым обрабатывают поток газа или жидкости или твердую поверхность.
5. Применение по п. 4, отличающееся тем, что дезинфицирующий агент представлен в форме водного раствора или суспензии.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| ANTHONY L | |||
| NEWSOME, WALTER E | |||
| WILHELM, "Inhibition of Naegleria fowleri by microbial iron-chelating agents: ecological implications" // Applied and Environmental Microbiology, 1983, Vol.45, N2, р.665-668 | |||
| БУТВИЛОВСКИЙ В.Э | |||
| И ДР., Медицинская паразитология (материалы к элективному курсу): Учеб.-метод | |||
| пособие, Минск: БГМУ, 2011, с.21-23. | |||
Авторы
Даты
2018-04-02—Публикация
2014-10-22—Подача