Настоящее изобретение относится к композиции для лечения слизи на жабрах рыб. В частности, настоящее изобретение относится к композиции для повышения вязкости слизи на жабрах рыб. Настоящее изобретение также относится к композиции для повышения содержания полисахарида в слизи. Лечение слизи представляет собой терапевтическое или профилактическое лечение амебного заболевания жабр у рыб. Амебное заболевание жабр вызывает морская амеба, в частности амебное заболевание жабр вызывает Paramoeba perurans. Рыба может представлять собой лососевидную рыбу, такую как атлантический лосось (Salmo salar) или радужная форель (Onchorhynchus mykiss).
Амебное заболевание жабр (АЗЖ) представляет собой одну из наиболее значимых проблем, с которой сталкивается мировое морское сельскохозяйственное разведение лососеобразных рыб. Оно встречается у многих видов рыб, как культивируемых, так и диких, включая морского леща, палтуса, аю, макрель и пинагора. Об этом заболевании сообщалось в Австралии в 1984, и с тех пор оно было обнаружено на Западном побережье Соединенных Штатов, в Ирландии (1995), Шотландии и Норвегии с 2006 и Чили (2007). Вспышки заболевания обычно случаются с позднего лета до ранней зимы при температуре воды выше 10°С, однако в последнее время оно является предметом беспокойства в течение круглого года.
Возбудителем АЗЖ является Paramoeba perurans, ранее называемая Neoparamoeba perurans, свободноживущая и условно-паразитическая амеба, и оно может быть летальным, если оставлять его без лечения. По оценке оно составляет вплоть до 20% от суммарных издержек производства в плане лечения, уменьшения роста рыб и смертности рыб. P. perurans представляет собой морскую амебу. P. perurans представляет собой внеклеточный паразит, принадлежащий к типу Flabellinea.
Факторы риска заболевания включают высокую соленость, более высокую температуру воды (теплая вода), высокую плотность зарыбления, взвеси органических веществ в воде и повреждение жабр в более раннем периоде.
Клинически АЗЖ вызывает анорексию (уменьшение потребления пищи), угнетение дыхания, воспаление жаберной крышки и летаргию. В макроскопической картине на поверхности жабр можно наблюдать выпуклые слизистые участки цвета от белого к серому. Присутствие этой амебы часто связано с продукцией избытка слизи в жабрах. Микроскопически данное заболевание характеризуется эпителиальной гиперплазией (увеличением числа эпителиальных клеток) и сращением пластинок с мукозной метаплазией. По мере прогрессирования заболевания воспалительные клетки (нейтрофилы и макрофаги) прибывают в отечные участки поражений. Иногда можно наблюдать эозинофильные гранулоциты в кровеносных сосудах, окружающих филаментальный хрящ. На поздних стадиях развития заболевания происходит эпителиальная гипертрофия и эпителиальное расслаивание на поверхности поражений, с вовлечением мукоидных клеток, уменьшение количества хлоридных клеток и образование межпластинчатых везикул, которые могут содержать амеб.
Диагноз ставят на основании микроскопического исследования свежих жаберных пластин или зафиксированного в парафине образца ткани жабр и/или на основании специфического ПЦР-анализа на присутствие P. perurans.
Ранее, до P. perurans предполагали, что возбудителем АЗЖ является Paramoeba pemaquidensis. P. pemaquidensis часто обнаруживается в жабрах вместе с P. perurans как часть смешанной инфекции. Считают, что реакция амеб на воздействие вредных или токсических веществ сходна только среди амеб одного и того же семейства или группы. Амебы имеют одинаковы механизм, по которому они сворачиваются и втягивают свои ложноножки в неблагоприятной окружающей среде.
Несмотря на то, что исследования проводились более 30 лет, не существует вакцин или лекарственных средств, разрешенных для лечения АЗЖ. Современные методы лечения включают купание либо в пресной воде (2-3 ч при солености менее 4 промилле) или в ванне с перекисью водорода (1000-1400 промилле H2O2 в течение 20-30 минут). Ванну с перекисью водорода, как правило, не применяют выше 15-16°С, и применяют с осторожностью при температуре в интервале 12/13°С - 15/16°С.
Было исследовано множество химических терапевтических средств для введения с кормом и с купанием, для достижения более эффективного выведения амеб из жабр. Пероральная добавка как с левамизолом, так и глюканами не оказывала значимого эффекта на уровень смертности. В совместном исследовании пероральное введение этилового эфира L-цистеина (LCEE) за две недели до введения провокационной пробы значительно задерживало прогрессирование связанной с АЗЖ патологии жабр (Roberts SD, Powell MD. 2005. Oral L-cysteine ethyl ester (LCEE) reduces amoebic grill disease (AGD) in Atlantic salmon Salmo salar. Dis Aquat Org, 66(1):21-28). Было обнаружено, что LCEE снижает вязкость слизи у атлантического лосося. Предполагали, что лечение пресной водой также снижает вязкость слизи за счет образования трещин на слизи и облегчения ее схождения с кожи (Roberts SD. 2004. Improving the treatment of amoebic grill disease in salmonids with soft freshwater и the mucolytic drug L-cysteine ethyl ester. PhD thesis, University of Tasmania, Launceston.) Лечение свежей водой и лечение с помощью LCEE имеют в целом положительный клинический эффект на АЗЖ, и их объединяет то, что вязкость слизи снижается.
Битионол, противопротозойное лекарственное средство (не установлен максимальный остаточный уровень (МОУ) ни для одного вида животных, служащего источником продуктов питания), который применяли с кормом в количестве 25 мг/кг, продемонстрировал задержку и снижение выраженности связанных с АЗЖ поражений. Ионофоры: салиномицин, лазалоцид и мадурамицин, которые применяли по отдельности в in vitro лечении купанием в количестве 10 мг/л, значительно снижали количество амеб. Тем не менее, при их тестировании в лечении с кормом, эти ионофоры снижали процентную долю пластинок с поражениями, по сравнению с рыбами, получавшими контрольный корм, лишь на 7 день после провокационной пробы P. perurans. На 14 и 21 дни после провокационной пробы различий не было.
Тонкий слой слизи присутствует на жабрах и коже рыб и представляет собой первый физический барьер защиты против передающихся через воду патогенов. Кроме того, слизь выполняет функции в дыхании, ионной и осмотической регуляции, репродукции, коммуникации, экскреции и устойчивости к заболеваниям. Защитная функция слизи представляет собой совместный результат ее механических и биохимических свойств. Слизь в основном секретируется мукоидными клетками в эпидермисе. Помимо улавливания и смыва патогенов, слизь содержит широкий спектр веществ, который могут воздействовать на патогены. Слизь в основном состоит из воды и гликопротеинов. Кроме того, было описано множество компонентов, включая ряд компонентов врожденного иммунитета, таких как лектины, пентраксины, лизоцимы, протеолитические ферменты, щелочная фосфатаза, С-реактивный белок, комплемент и противомикробные пептиды, а также иммуноглобулины, которые присутствуют в слизи.
Недавно были описаны изменения в белковом составе в жаберной слизи у лососей, инфицированных P. perurans. Это подтверждается гистологическими данными жаберных поражений, связанных с АЗЖ, в том, что присоединение амеб к участкам эпителия с высоким количеством мукоидных клеток снижено. АЗЖ-поражения поздних стадий состоит в чешуении поверхностного эпителия и различном привлечении мукоидных клеток к поверхности поражений, что может свидетельствовать об оборонительной стратегии, применяемой для отторжения и/или разрушения или изоляции амеб из пораженной ткани. Сращение чешуек снижает общую площадь поверхности, доступной для колонизации амеб. Ферменты и/или другие вещества, секретируемые мукоидными клетками, могут влиять на приток и присоединение амеб к этим участкам. (Adams MB, Ellard K, Nowak BF. 2004. Gross pathology and its relationship with histopathology of amoebic grill disease (AGD) in farmed Atlantic salmon, Salmo salar L. J Fish Dis, 27(3): 151-61; Adams MB, Nowak BF. 2003. Amoebic grill disease: sequential pathology in cultured Atlantic salmon, Salmo salar L. J Fish Dis, 26(10): 601-614.)
В патентной публикации ЕР 1234508 раскрыто применение L-аргинина отдельно или в комбинации с ибупрофеном для профилактического лечения кокцидоза у сельскохозяйственных птиц. Возбудителями кокцидоза являются некоторые виды Eimeria. Eimeria spp. представляют собой внутриклеточных паразитов, принадлежащих к типу Sporozoa или Apicomplexa. Eimeria spp. поражают эпителиальные клетки, выстилающие пищеварительный тракт, и клетки связанных с ним гландов.
Целью настоящего изобретения является устранение или уменьшение по меньшей мере одного из недостатков предшествующего уровня техники, или по меньшей мере предложить эффективную альтернативу предшествующего уровня техники.
Данная цель достигается благодаря признакам, которые подробно раскрыты в описании ниже, а также в ниже следующей формуле изобретения.
Настоящее изобретение определено независимым пунктом патентной формулы. Зависимые пункты определяют преимущественные воплощения настоящего изобретения.
Описанные ниже результаты показывают, что добавление в рацион аргинина в количестве более 3 процентов от общего количества корма для рыб улучшает выживаемость у рыб, инфицированных АЗЖ. Это важно для мировой морской лососевой аквакультуры в том, что эффективная диета может помочь минимизировать связанные с АЗЖ издержки за счет более низких показателей смертности, поддержания показателей роста, а также, возможно, менее частых процедур купания.
В первом аспекте настоящее изобретение относится более конкретно к композиции для лечения слизи на жабрах рыб с целью терапевтического или профилактического лечения амебного заболевания жабр у рыб, включающей экструдированный корм для рыб с добавлением аргинина; указанный корм для рыб включает белок, связующее вещество, жиры, витамины и минералы; и общее содержание аргинина в корме для рыб составляет по меньшей мере 3,0% (масс. %) от общей массы корма.
Такой корм для рыб можно изготавливать экструзией, при этом экструдируемую массу подвергают тепловой обработке, а экструдат представляет собой пористый материал, чтобы абсорбировать и удерживать существенное количество добавленных жидких жиров. Общее количество жира в окончательно подготовленном корме для рыб может быть ниже, чем 25%, он может составлять 25% и он может быть выше, чем 25%, например 30%, 35% и даже 40% от общей массы корма для рыб. Пшеничный крахмал и другие другое растительное сырье, такое как конские бобы, выступают в качестве связующего вещества для поддержки формы и целостности корма для рыб. Можно применять и другие связующие вещества.
Лечение слизи может включать повышение вязкости слизи. Лечение слизи может включать повышение содержания полисахарида в слизи.
Амебное заболевание жабр может быть вызвано морской амебой. Рыба может представлять собой лососевидную рыбу, такую как атлантический лосось или радужная форель. Амебное заболевание жабр может быть вызвано инфицированием по меньшей мере одной из амеб Paramoeba perurans syn. Neoaramoeba perurans и Paramoeba pemaquidensis, syn. Neoparamoeba pemaquidensis.
Указанный корм для рыб может быть для профилактического и/или терапевтического лечения амебного заболевания жабр у рыб. Указанный корм для рыб может быть для профилактического и/или терапевтического лечения инфицирования рыб морской амебой. Указанный корм для рыб может быть для профилактического и/или терапевтического лечения инфицирования по меньшей мере одной из амеб Paramoeba perurans syn. Neoparamoeba perurans и Paramoeba pemaquidensis, syn. Neoparamoeba pemaquidensis.
Профилактическое и/или терапевтическое лечение можно осуществлять путем кормления лососевидной рыбы кормом с добавлением аргинина через 6 недель после перемещения лососевидной рыбы из пресной воды в морскую воду. Указанный корм для рыб может быть для профилактического и/или терапевтического лечения инфицирования по меньшей мере одной амеб Paramoeba perurans syn. Neoparamoeba perurans и Paramoeba pemaquidensis, syn. Neoparamoeba pemaquidensis.
Также описано применение аргинина для лечения слизи на жабрах рыб для терапевтического или профилактического лечения амебного заболевания жабр у рыб. Аргинин можно добавлять в корм для рыб в количестве, достаточном для повышения общего содержания аргинина в корме для рыб до уровня по меньшей мере 3% (масс. %) от общей массы корма.
Амебная инфекция может быть вызвана по меньшей мере оной из амеб Paramoeba perurans syn. Neoparamoeba perurans и Paramoeba pemaquidensis, syn. Neoparamoeba pemaquidensis. Рыба может представлять собой лососевидную рыбу. Начинать кормление рыб кормом для рыб по настоящему изобретению можно после перемещения рыб из пресной воды в морскую воду. Начинать кормление рыб кормом для рыб по настоящему изобретению можно через 6 недель после перемещения рыб из пресной воды в морскую воду.
Далее описаны примеры предпочтительных воплощений.
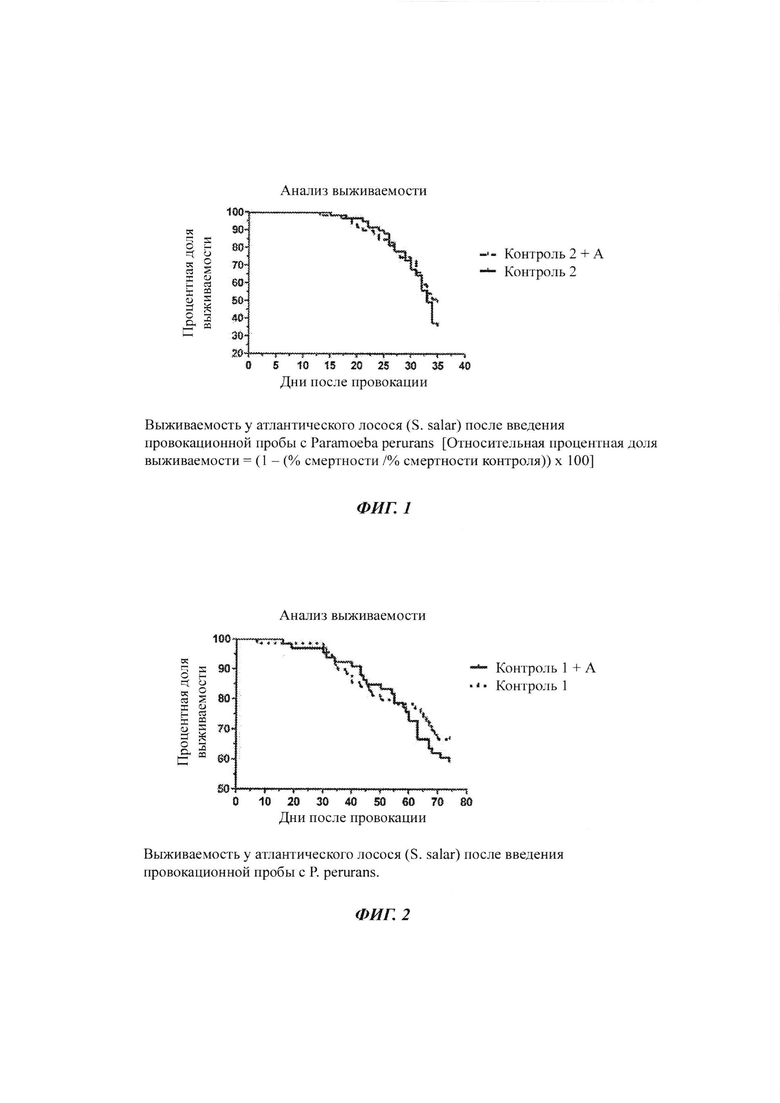
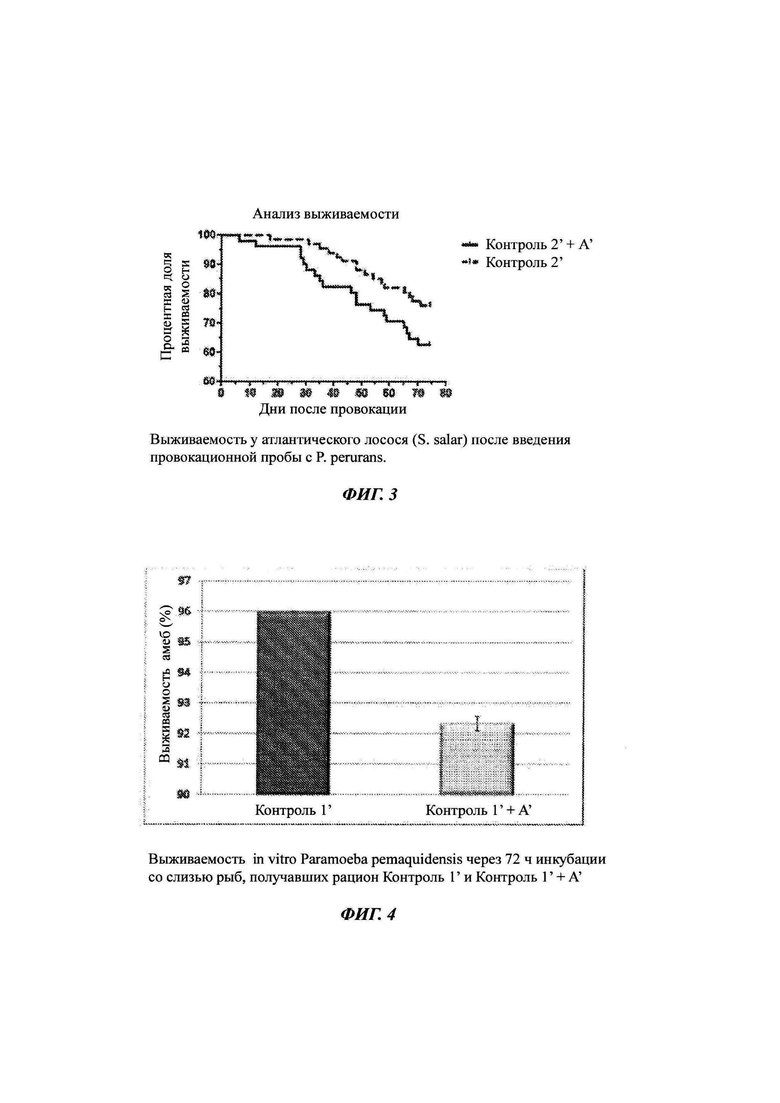
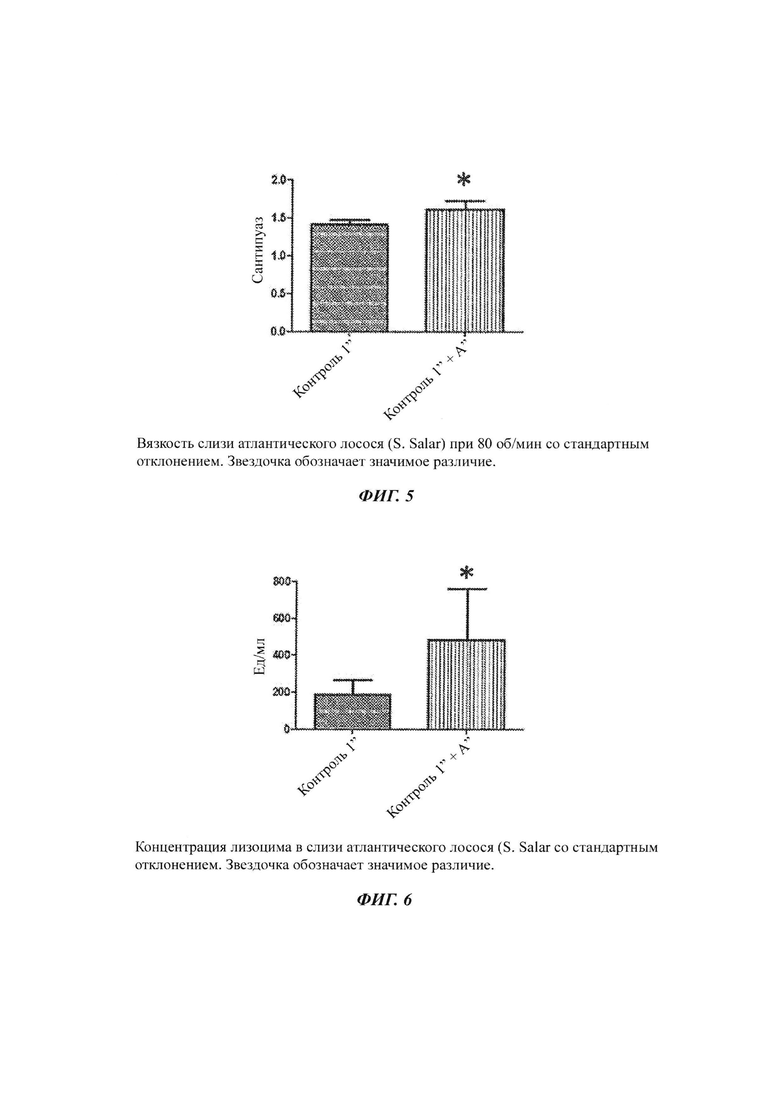
Фиг. 1-3: выживаемость у атлантического лосося после введения провокационной пробы с амебой Paramoeba perurans в различных исследованиях;
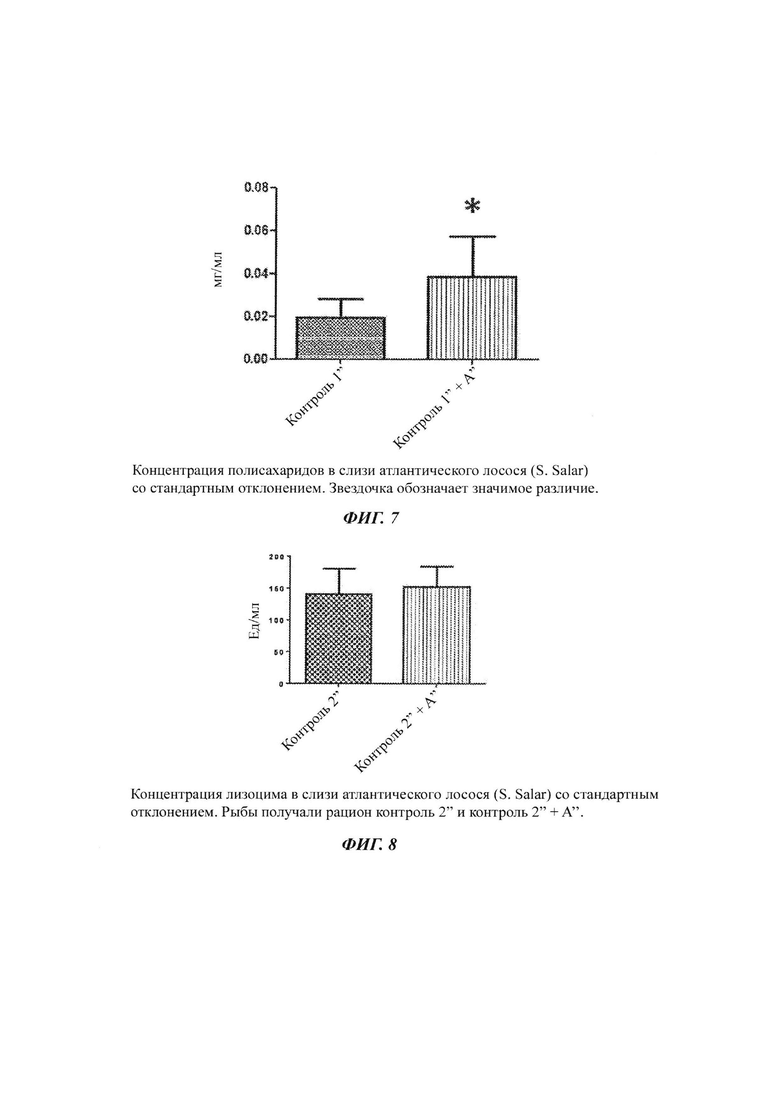
Фиг. 4: in vitro выживаемость Paramoeba pemaquidensis после 72 ч инкубации со слизью рыб;
Фиг. 5: вязкость слизи атлантического лосося;
Фиг. 6: концентрация лизоцима в слизи атлантического лосося;
Фиг. 7: концентрация полисахаридов в слизи атлантического лосося;
Фиг. 8: концентрация лизоцима в слизи атлантического лосося;
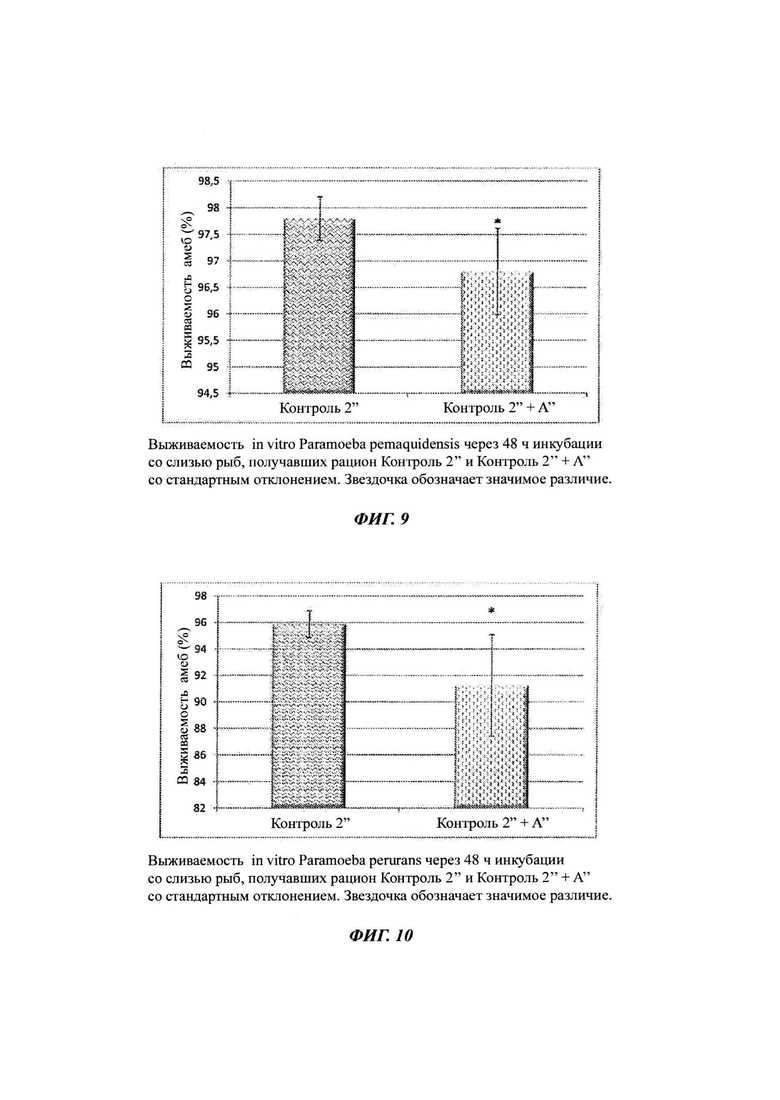
Фиг. 9: in vitro выживаемость Paramoeba pemaquidensis через 48 ч инкубации со слизью рыб; и
Фиг. 10: in vitro выживаемость Paramoeba perurans через 48 ч инкубации со слизью рыб.
Пример 1
Проводили исследование с атлантическим лососем (S. salar) в течение 65 дней в резервуарах объемом 250 л, содержащих морскую воду с соленостью 35 промилле и при температуре воды 16°С. Содержали по 30 рыб на резервуар со средним весом 121 г в начале исследования, по два резервуара на каждый тип рациона.
Рыб акклиматизировали и содержали на контрольном рационе в течение пяти недель до начала 65-дневного периода исследования, затем им давали либо контрольный рацион, либо исследуемый рацион до окончания исследования. Контрольный рацион, называемый также контрольный корм, Контроль 2, включал пшеницу, пшеничный глютен, кормовую муку для Северо-Атлантических рыб, концентрат соевого белка, рапсовое масло, жир североатлантических рыб (North Atlantic fish oil), астаксантин, витамины и минералы. Контрольный рацион получали путем варочной экструзии, и он состоял из 26,5% жиров, 50,1% белка и 5,7% воды и представлял собой пример имеющегося на рынке корма для рыб. Исследуемый рацион, также называемый исследуемый корм, Контроль 2 + А, имел тот же состав, что и корм Контроль 2, но с добавлением аргинина в количестве 1,0%. Аргинин добавляли в виде сухого порошка в кормовую смесь перед варочной экструзией. Рассчитанный суммарный уровень аргинина в корме Контроль 2 составлял 2,61% от основного вещества.
P. perurans собирали от атлантического лосося, которого содержали в инфицированном резервуаре способами, описанными в литературе (Morrison RN, Crosbie РВВ, Nowak BF. 2004: The induction of laboratory-based amoebic grill disease revisited. J. Fish Dis, 27, 445-449). Через четыре недели кормления экспериментальным рационом рыбам вводили провокационную пробу общей дозой 500 клеток на литр P. perurans на протяжении серии дней (0, 8, 9, 10, 12 и 16 день после инфицирования). В целях осуществления провокации циркуляцию воды останавливали во всех резервуарах, и в каждый водоем добавляли амеб с помощью поливальника, в котором содержалось дополнительные 7 л морской воды, для гарантии равномерного распределения амеб в резервуаре. Поток воды восстанавливали через 1,5-2 ч.
Исследование оканчивали, когда в контрольной группе была достигнута смертность 60%. Средний вес рыб на момент окончания исследования составлял 192 г. Присутствие P. perurans в выборке с летальным исходом было подтверждено количественным ПЦР-анализом (полимеразная цепная реакция) и гистологией.
Как показано на Фиг. 1, рыбы, которым давали исследуемый рацион Контроль 2 + А, имели 19% относительную процентную долю выживаемости, по сравнению с рыбами, получавшими контрольный рацион. Относительную процентную долю выживаемости рассчитывали следующим образом:

На Табл. 1 показано, что исследуемый рацион был эффективен в снижении смертности, вызванной АЗЖ, по сравнению с рыбами, получавшими контрольный рацион.

Пример 2
Проводили исследование с атлантическим лососем (S. salar) в течение 144 дней в резервуарах на 250 л, содержащих морскую воду с соленостью 35 промилле и при температуре 16°С.Содержали по 30 рыб на резервуар со средним весом 171 г на момент начала исследования, по три резервуара на каждый тип рациона.
Рыб акклиматизировали и держали на контрольном рационе в течение четырех недель, затем им давали либо контрольный рацион, либо исследуемый рацион до окончания исследования. Контрольный рацион, называемый также контрольный корм, Контроль 1, включал пшеницу, пшеничный глютен, кормовую муку из жмыха подсолнечного семени, корм для Северо-Атлантических рыб, концентрат соевого белка, конские бобы, рапсовое масло, рыбий жир Notrh Atlantic fish oil, астаксантин, витамины и минералы. Контрольный рацион изготавливали варочной экструзией, он состоял из 24,2% жиров, 49,9% белка, 5,3% золы и 6,3% воды и представлял собой пример имеющегося в продаже корма для рыб. Исследуемый рацион, называемый также исследуемый корм, Контроль 1 + А, имел такой же состав, как и корм Контроль 2, но с добавлением аргинина в количестве 0,58%. Аргинин добавляли в виде сухого порошка в кормовую смесь перед варочной экструзией. Анализ показал, что рацион Контроль 1 содержал 2,92% аргинина от содержания основного вещества, в то время как корм Контроль 1 + А для исследуемой группы содержал 3,24% аргинина от содержания основного вещества.
P. perurans собирали от атлантического лосося, которого содержали в инфицированном резервуаре, способами, описанными Morrison et al. Через четыре недели после кормления экспериментальным рационом, рыбам вводили провокационную пробу суммарной дозой 500 клеток на литр P. perurans в течение двух дней. Ввиду низкого уровня смертности, которое наблюдалось при введении провокационной пробы, вводили также дополнительную дозу амеб (50 клеток/л Р. Perurans) на день 55 после провокации. В целях осуществления провокации циркуляцию воды останавливали во всех резервуарах, и в каждый водоем добавляли амеб с помощью поливальника, в котором содержалось дополнительные 7 л морской воды, для гарантии равномерного распределения амеб в резервуаре. Поток воды восстанавливали через 1,5-2 ч.
Исследование завершали, когда в контрольной группе была достигнута смертность 40%. Средний вес рыб на момент окончания исследования составлял 391 г. Присутствие P. perurans в выборке с летальным исходом было подтверждено количественным ПЦР-анализом и гистологией.
Как показано на Фиг. 2, рыбы, получавшие исследуемый рацион, Контроль 1 + А, имели 19% относительную выживаемость, по сравнению с рыбами, получавшими корм Контроль 1.
В Табл. 2 показано, что исследуемый рацион был эффективен для снижения смертности, обусловленной АЗЖ, по сравнению с рыбами, получавшими рацион Контроль 1.

Пример 3.
Проводили исследование с атлантическим лососем (S. salar) в течение 144 дней в резервуарах на 250 л, содержащих морскую воду с соленостью 35 промилле и при температуре 16°С. Содержали по 30 рыб на резервуар со средним весом 179 г на момент начала исследования, по три резервуара на каждый тип рациона.
Рыб акклиматизировали и держали на контрольном рационе в течение четырех недель, затем им давали либо контрольный рацион, либо исследуемый рацион до окончания исследования. Контрольный рацион, называемый также контрольный корм, Контроль 2', включал пшеницу, пшеничный глютен, кормовую муку из жмыха подсолнечного семени, корм для Северо-Атлантических рыб, концентрат соевого белка, конские бобы, рапсовое масло, рыбий жир Notrh Atlantic fish oil, астаксантин, витамины и минералы. Контрольный рацион изготавливали варочной экструзией, и он состоял из 24,3% жиров, 47,7% белка, 5,6% золы и 7,1% воды и представлял собой пример имеющегося в продаже корма для рыб. Исследуемый рацион, называемый также исследуемый корм, Контроль 2'+А', имел такой же состав, как корм Контроль 2', но с добавлением аргинина в количестве 0,58%. Аргинин добавляли в виде сухого порошка в кормовую смесь перед варочной экструзией. Анализ показал, что корм Контроль 2' содержал 2,75% аргинина от содержания основного вещества, в то время как корм Контроль 2'+А' для тестовой группы содержал 3,30% аргинина от содержания основного вещества.
P. perurans собирали от атлантического лосося, которого содержали в инфицированном резервуаре способами, описанными в литературе Morrison et al. Через четыре недели после кормления экспериментальным кормом, рыбам вводили провокационную пробу суммарной дозой 500 клеток на литр P. perurans в течение двух дней. В виду низкого уровня смертности, который наблюдался при введении провокационной пробы, была введена также дополнительная доза амеб (50 клеток/л P. perurans) в день 55 после провокации. В целях осуществления провокации циркуляцию воды останавливали во всех резервуарах, и в каждый водоем добавляли амеб с помощью поливальника, в котором содержалось дополнительные 7 л морской воды, для гарантии равномерного распределения амеб в резервуаре. Поток воды восстанавливали через 1,5-2 ч.
Исследование завершали, когда в контрольной группе была достигнута смертность 40%. Средний вес рыб на момент окончания исследования составлял 422 г.Присутствие P. perurans в выборке с летальным исходом было подтверждено количественным ПЦР-анализом и гистологией.
Как показано на Фиг. 3, рыбы, получавшие Контроль 2' + А', имели 36% относительную выживаемость, по сравнению с рыбами, получавшими корм Контроль 2'. Рыбы, получавшие рацион Контроль 2' + А', имели значительно более высокую выживаемость, по сравнению с рыбами, получавшими рацион Контроль 2, при уровне значимости 0,1% (логарифмический ранговый критерий Кокса-Мантеля, Р=0,09).
В Табл. 3 показано, что исследуемый рацион был эффективен для снижения смертности, обусловленной АЗЖ, по сравнению с рыбами, получавшими рацион Контроль 2'.

Пример 4.
Проводили исследование с атлантическим лососем (S. salar) в течение 37 дней в резервуарах диаметром один метр, содержащих морскую воду с соленостью 32,9-34,0 промилле. Температура воды варьировалась от 11,8 до 12,1°С. Количество рыб на резервуар составляло 40, со средним весом 132 г на момент начала исследования, по три резервуара на каждый тип рациона.
Контрольный рацион, называемый также контрольный корм, Контроль 1', включал пшеницу, пшеничный глютен, кормовую муку из жмыха подсолнечного семени, корм для Скандинавских рыб, концентрат соевого белка, рапсовое масло, рыбий жир Notrh Atlantic fish oil, астаксантин, витамины и минералы. Контрольный рацион изготавливали варочной экструзией, и он состоял из 23,2% жиров, 48,0% белка, 11,1% золы и 4,9% воды и представлял собой пример имеющегося в продаже корма для рыб. Исследуемый рацион, называемый также исследуемый корм, Контроль 1' + А', имел такой же состав, как корм Контроль 1'. В партиях по 12,5 кг корма Контроль 1' наносили поверхностный слой с 1% аргинина в течение 90 секунд в промышленном смесителе для хлеба, после чего добавляли рыбий жир Nordic fish oil 0,05% и продолжали смешивать еще в течение 30 секунд.
В конце исследования вес рыб составлял 156 г.
Протокол для культивирования образцов слизи от рыб
Забор образцов слизи. Кожную слизь собирали индивидуально следующим образом: помещали каждую рыбу на пластиковый пакет, осторожно оборачивали пакет вокруг рыбы и со скольжением выталкивали рыбу из пакета. Полученную слизь немедленно подвергали быстрой заморозке в жидком азоте и хранили при -80°С до проведения анализа. Собирали кожную слизь вместо жаберной слизи, потому что было невозможно собрать достаточное количество жаберной слизи от каждой рыбы для анализа вязкости, лизоцима и полисахаридов. В литературе описано, что кожная и жаберная слизь имеют сходные характеристики по анализируемым свойствам, и изменения в кожной слизи отражают изменения в жаберной слизи.
Подготовка слизи. Все образцы слизи оттаивали и использовали только однократно, повторного использования после размораживания избегали, поскольку на активность указанных веществ или иммунологических компонентов в слизи могут влиять циклы разморозки-оттаивания. В зависимости от вязкости образца слизи, образец слизи использовали в том виде, как он есть. Если образец слизи был очень вязкий, такой образец слизи кратковременно центрифугировали в течение 1 мин при 1000g для осаждения клеток. Полученный супернатант использовали для анализа.
Инкубация с амебами. Все образцы слизи разбавляли 1:1 с культивированными амебами вида Paramoeba pemaquidensis. Амеб наблюдали и тестировали на выживаемость через 4-5 ч, 24 ч, 48 ч и через 6-9 дней. Более сильный эффект в слизи часто наблюдали через несколько дней воздействия.
Окрашивание на жизнеспособность. Амеб окрашивали флюоресцентными красителями пропидиум иодид, красные - мертвые клетки, и флюоресцеин диацетат, зеленые - живые клетки, для окраски на жизнеспособность, по протоколу, предложенному Yokoyama et al. (Journal of Fish Diseases 1997, 20 (4), 281-286) с измененным временем инкубации, составлявшем только 5 минут. Как вариант, амеб окрашивали красителем нейтральный красный, который окрашивает лизосомы в живых клетках (Chazotte, 2010, Imaging: A Laboratory Manual (ed. Yuste). CSHL Press, Cold Spring Harbor, Нью-Йорк, США). Подсчет проводили в трипликатах для 100 клеток на каждую концентрацию или на индивидуальный образец слизи рыбы.
Выживаемость амеб уменьшалась с 96 до 92 процентов при инкубации 72 ч в слизи, собранной от рыб, получавших корм Контроль 1' + А', как показано на Фиг. 4.
Пример 5
Проводили исследование с атлантическим лососем (S. salar) в течение 34 дней в резервуарах диаметром один метр, содержащих морскую воду с соленостью 34,1-34,2 промилле. Температура воды варьировалась от 11,5 до 11,8°С. Содержали по 20 рыб на каждый водоем, со средним весом 379 г на момент начала исследования, по одному водоему на каждый тип рациона.
Контрольный рацион, называемый также контрольный корм, Контроль 1'', включал пшеницу, пшеничный глютен, кормовую муку из жмыха подсолнечного семени, корм для Северо-Атлантических рыб, концентрат соевого белка, конские бобы, рапсовое масло, рыбий жир Notrh Atlantic fish oil, астаксантин, витамины и минералы. Контрольный рацион изготавливали путем варочной экструзии, и он состоял из 24,2% жиров, 49,9% белка и 6,3% воды и 5,3% золы и представлял собой пример имеющегося в продаже корма для рыб. Исследуемый рацион, называемый также исследуемый корм, Контроль 1'' + А'', имел такой же состав, как и корм Контроль 1'', но с добавлением аргинина в количестве 0,58%. Аргинин добавляли в кормовую смесь в виде сухого порошка перед варочной экструзией. Измеренный общий уровень в корме Контроль 1'' составлял 2,92% от содержания основного вещества, а в исследуемом рационе Контроль 1'' + А'' он составлял 3,24% от содержания основного вещества.
В конце исследования вес рыб составлял в среднем 470,5 г. Кожную слизь собирали индивидуально, помещая каждую рыбу на пластиковый пакет, осторожно оборачивали пакет вокруг рыбы и выталкивая рыбу скольжением из пакета. Полученную слизь немедленно подвергали быстрой заморозке в жидком азоте и хранили при -80°С до проведения анализа. Собирали кожную слизь вместо жаберной слизи, потому что было невозможно собрать достаточное количество жаберной слизи от каждой рыбы для анализа вязкости, лизоцима и полисахаридов. В литературе описано, что кожная и жаберная слизь имеют сходные характеристики по анализируемым свойствам, и изменения в кожной слизи отражают изменения в жаберной слизи.
Вязкость слизи анализировали на вискозиметре Brookfield DV3T с системой «конус/плита». Слизь центрифугировали при 4000 об/мин в течение 4 минут и измеряли вязкость в 0,5 мл в прозрачной слизи, свободной от частиц, при 80 об/мин и 12°С.
Активность лизоцима измеряли на ридере для планшетов Varioskan Flash. Добавляли 250 мкл суспензии Micrococcus lysodeikticus в 0,4 М натрий-фосфатного буфера при рН 5,8 к 5 мкл прозрачной, свободной от частиц слизи, и отслеживали абсорбцию в течение 30 минут. Снижение абсорбции 0,001 в минуту принимали за единицу активности лизоцима.
Количество полисахарида измеряли на ридере для планшетов Varioskan Flash. Смешивали 25 мкл прозрачной, свободной от частиц слизи с 60 мкл 2,5% фенола в воде и 150 мкл концентрированной серной кислоты, затем инкубировали в течение 20 минут при 100°С. После охлаждения до комнатной температуры измеряли абсорбцию и рассчитывали концентрацию по стандартам, содержащим глюкозу.
На Фиг. 5 показана вязкость слизи при 80 оборотов в минуту (об/мин). Слизь была значительно гуще у рыб в исследуемой группе, получавшей корм Контроль 1'' + А'', чем у рыб в контрольной группе, получавшей корм Контроль 1'' (Р 0,0001, двухвыборочный t-критерий для независимых выборок).
Состав слизи от рыб из исследуемой группы, получавшей корм Контроль 1'' + А'', значительно отличался от состава слизи в контрольной группе, получавшей корм Контроль 1''. Концентрация лизоцима в слизи была значительно выше в исследуемой группе, получавшей корм Контроль 1'' + А'', чем в контрольной группе, получавшей корм Контроль 1'' (Р=0,0005, двухвыборочный t-критерий для независимых выборок), как показано на Фиг. 6. Концентрация полисахаридов была значительно выше в исследуемой группе, получавшей корм Контроль 1'' + А'' (Фиг. 7).
Пример 6
Проводили исследование с атлантическим лососем (S. salar) в течение 41 дней в резервуарах диаметром один метр, содержащих морскую воду с соленостью 33,6-34,6 промилле. Воды температура варьировалась от 11,9°С до 12,3°С. Содержали по 30 рыб на резервуар со средним весом 322 г на момент начала исследования, по два резервуара на каждый тип рациона.
Контрольный рацион, называемый также контрольный корм, Контроль 2'', включал пшеницу, пшеничный глютен, корм для Северо-Атлантических рыб, концентрат соевого белка, конские бобы, рапсовое масло, рыбий жир Notrh Atlantic fish oil, кормовую муку из жмыха подсолнечного семени, астаксантин, витамины и минералы. Контрольный рацион изготавливали варочной экструзией, и он состоял из 25,8% жиров, 45,0% белка, 7,3% воды и 5,7% золы и представлял собой пример имеющегося в продаже корма для рыб. Исследуемый рацион, называемый также исследуемый корм, Контроль 2'' + А'', имел такой же состав, как корм Контроль 2'', но с добавлением аргинина в количестве 0,86% в кормовую смесь в виде сухого порошка перед экструзией. Измеренный общий уровень аргинина в корме Контроль 2'' составлял 2,63% от содержания основного вещества, в исследуемом рационе Контроль 2'' + А'' он составлял 3,14% от содержания основного вещества.
В конце исследования вес рыб составлял 545 г. Кожную слизь собирали от каждой особи, как описано в Примере 4.
Активность лизоцима в собранной слизи измеряли, как описано в Примере 4. На Фиг. 8 показано, что концентрация лизоцима в слизи была выше в исследуемой группе, получавшей корм Контроль 2'' + А'', чем в контрольной группе, получавшей корм Контроль 2''.
Инкубация с амебами. Все образцы слизи разбавляли 1:1 с культивированными амебами либо вида Paramoeba pemaquidensis, либо вида Paramoeba perurans. Амеб наблюдали и тестировали на выживаемость через 4-5 ч, 24 ч, 48 ч и 72 ч.
Окрашивание на жизнеспособность проводили, как описано в Примере 4. Выживаемость P. pemaquidensis значимо снижалась с 97,8 до 96,8% (Р=0,011, двухвыборочный t-критерий для независимых выборок) через 48 ч инкубации, а выживаемость P. perurans значимо снижалась с 95,9 до 91,2% (Р=0,004, двухвыборочный t-критерий для независимых выборок) через 48 ч инкубации в слизи, собранной от рыб, получавших корм Контроль 2'' + А'', как показано на Фиг. 9 и 10, соответственно.
Кроме того, выживаемость P. pemaquidensis снижалась с 96,6 до 91,8% через 72 ч инкубации, а выживаемость P. perurans снижалась с 92,1 до 90,2% через 72 ч инкубации в слизи, собранной от рыб, получавших корм Контроль 2'' + А''.
Следует отметить, что выше описанные воплощения являются иллюстрацией, но не ограничением настоящего изобретения, и что специалисты в данной области техники способны разработать множество альтернативных воплощений, не выходя за рамки объема приложенной формулы настоящего изобретения. В формуле изобретения любые ссылочные позиции, помещенные в скобки, не следует рассматривать как ограничение конкретного пункта формулы. Применение глагола "включать" и его спряжений не исключает присутствие элементов или стадий, отличных от тех, которые указанный в данном пункте формулы. Форма единственного числа для элемента не исключает присутствие множества таких элементов.
Сам факт того, что указаны конкретные единицы измерений в различающихся зависимых пунктах формулы изобретения, не указывает на то, что не могут быть использованы комбинации этих единиц измерений в целях преимущества.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОРМ ДЛЯ РЫБЫ И СПОСОБ ДЛЯ СМОЛТИФИКАЦИИ И ПРЕДУПРЕЖДЕНИЯ ДЕСМОЛТИФИКАЦИИ ЛОСОСЕВЫХ И ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГЕМОРРАГИЧЕСКОГО СИНДРОМА СМОЛТА (ГСС) У ЛОСОСЕВЫХ | 2015 |
|
RU2708168C2 |
| КОРМОВАЯ ДОБАВКА ДЛЯ РЫБ | 2005 |
|
RU2310338C2 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНВАЗИОННЫХ ЗАБОЛЕВАНИЙ РЫБ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНВАЗИОННЫХ ЗАБОЛЕВАНИЙ РЫБ | 2000 |
|
RU2259837C2 |
| КОРМОВАЯ ДОБАВКА | 2010 |
|
RU2525002C2 |
| Корм для подращивания смолта атлантического лосося | 1991 |
|
SU1784152A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КОРМА ДЛЯ РАННЕЙ МОЛОДИ ЛОСОСЕВЫХ РЫБ | 2007 |
|
RU2366265C1 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ РАСТИТЕЛЬНЫЙ ИЛИ РЫБИЙ ЖИР, И СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ НЕОКИСЛЯЮЩИЕСЯ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ ЖИРНЫХ КИСЛОТ | 2005 |
|
RU2388490C2 |
| Способ лечения паразитарных болезней рыб | 2023 |
|
RU2819872C1 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕЛКОВЫЙ МАТЕРИАЛ И СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ НЕОКИСЛЯЮЩИЕСЯ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ ЖИРНЫХ КИСЛОТ | 2005 |
|
RU2394598C2 |
| Способ лечения паразитарных болезней рыб | 2023 |
|
RU2819870C1 |
Изобретение относится к ветеринарии, в частности к композиции для лечения или профилактики амебного заболевания жабр у лососевидной рыбы. Композиция характеризуется тем, что она представляет собой экструдированный корм для рыб с добавлением аргинина. Причем корм включает белок, связующее вещество, жиры, витамины и минералы, а суммарное содержание аргинина в корме для рыб составляет по меньшей мере 3,0% (масс. %) от общей массы корма. Использование изобретения позволит лечить и профилактировать амебные заболевания жабр у рыб. 4 з.п. ф-лы, 10 ил., 3 табл., 6 пр.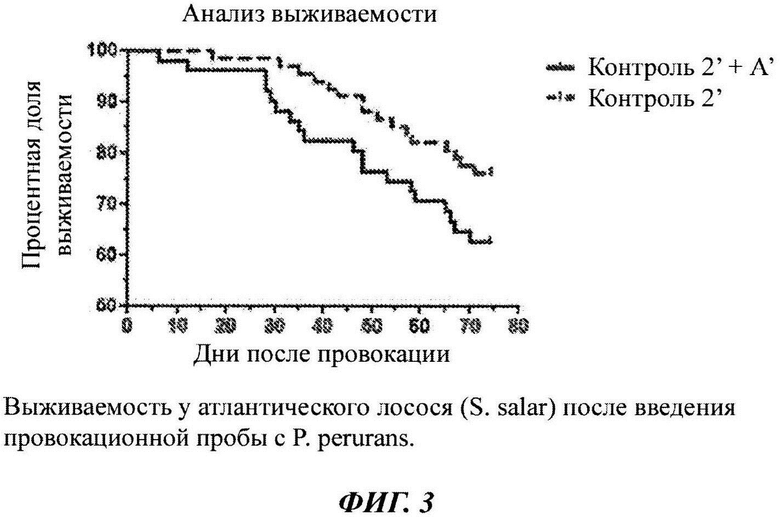
1. Композиция для лечения или профилактики амебного заболевания жабр у лососевидной рыбы, характеризующаяся тем, что она представляет собой экструдированный корм для рыб с добавлением аргинина; причем корм включает белок, связующее вещество, жиры, витамины и минералы, а суммарное содержание аргинина в корме для рыб составляет по меньшей мере 3,0% (масс. %) от общей массы корма.
2. Композиция по п. 1, отличающаяся тем, что она повышает вязкость слизи.
3. Композиция по п. 1 или п. 2, отличающаяся тем, что она повышает содержание полисахарида в слизи.
4. Композиция по любому из пп. 1-3, отличающаяся тем, что амебное заболевание жабр вызвано морской амебой.
5. Композиция по любому из пп. 1-4, отличающаяся тем, что амебное заболевание жабр вызвано инфицированием по меньшей мере одной из амеб Paramoeba perurans syn. Neoparamoeba perurans и Paramoeba pemaquidensis syn. Neoparamoeba pemaquidensis.
| WO 2010087715 A1, 05.08.2010 | |||
| Отбойное устройство | 1984 |
|
SU1234508A1 |
| MORKORE et al.: "Optimalt for som gir fast filet", NOFIMA REPORT, December 2010 (2010-12-01), стр | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| PLISETSKAYA E.M | |||
| и др.: "Effects of injected and dietary | |||
Авторы
Даты
2019-12-19—Публикация
2016-08-01—Подача