Данная заявка подана 28 августа 2013, как международная заявка на патент по процедуре РСТ, и заявляет приоритет предварительной заявки на патент США №61/695,949, поданной 31 августа 2012, и заявки на патент США №13/842,906, поданной 15 марта 2013, описания которых включены в данный документ в виде ссылки во всей своей полноте.
УРОВЕНЬ ТЕХНИКИ
Представленное изобретение в целом касается широкого диапазона концентраций препаратов антитела к рецептору анти-пролактина, которые являются, главным образом, изоосмотическими и обладают низкой вязкостью, включая препараты, которые являются приемлемыми для подкожного и общего инъекционного введения.
Пролактин (PRL) представляет собой полипептидный гормон, состоящий из 199 аминокислот. PRL относится к гормону роста (GH), плацентарному лактогенному (PL) семейству полипептидных гормонов и синтезируются в лактотрофных клетках гипофиза и в различных внегипофизных тканях, таких как лимфоциты, эпителиальные клетки молочной железы, миометрий и предстательная железа. Два разных промотора регулируют гипофизный и внегипофизный синтез PRL (BioEssays 28: 1051-1055 (2006)).
PRL связывается с рецептором PRL (PRLR), одинарным трансмембранным рецептором, принадлежащим к классу 1 надсемейства цитокиновых рецепторов (Endocrine Reviews 19: 225-268 (1998)). PRLR существует в трех различных изоформах, короткой, длинной и промежуточной форме, которые могут отличаться по длине своих цитоплазматических хвостов. При лигадном связывании, последовательный процесс приводит к активации PRLR. PRL взаимодействует посредством своего сайта связывания 1 с одной молекулой PRLR и затем посредством своего сайта связывания 2 привлекает вторую молекулу рецептора, что приводит к активному димеру PRLR.
Димеризация PRLR приводит к преобладающей активации JAK/STAT (Янус-киназы/преобразователей сигнала и активаторов транскрипции) пути. При димеризации рецептора, JAK (преимущественно JAK2), связанные с рецептором, трансфосфорилируют и активируют друг друга. Кроме того, PRLR также фосфорилируется и может связываться с SH2-доменом, содержащим белки, такие как STAT. Связанные рецепторами STAT, впоследствии фосфорилируются, отделяются от рецептора и перемещаются в ядро, где они стимулируют транскрипцию генов-мишеней. Кроме того, активация Ras-Raf-MAPK пути и активация цитоплазматической src киназы с помощью PRLR были описаны (для обзора Endocrine Reviews 19: 225-268 (1998)).
Роль PRLR-опосредованной передачи сигнала была исследована в контексте доброкачественного новообразования эндометрия. В одном исследовании профиль экспрессии гена PRLR в эндометриоидных образцах и эутопическом эндометрии от эндометрия пациентов анализировали (Acta Obstet Gynecol Scand 81: 5-10, 2002) во время средней-поздней пролиферативной фазы менструального цикла. Показано, что мРНК PRLR присутствовала в эутопическом эндометрии у 79% проанализированных пациентов с эндометриозом, в то время как он отсутствовал в эндометриоидных патологических изменениях у 86% пациентов с эндометриозом. Эти данные свидетельствовали о возможной дифференциальной регуляции экспрессии PRLR между нормальной и эндометриоидной тканью. Тем не менее, из этих данных экспрессии не может быть сделан вывод, что ингибирование PRLR может представлять собой подходящую терапию эндометриоза - особенно, поскольку не было установлено, что PRLR экспрессируется в эндометриоидный патологических изменениях (Acta Obstet Gynecol Scand 81: 5-10 (2002)).
Антитела, которые направлены против рецептора пролактина (PRLR), в том числе анти-PRLR моноклональные антитела (aPRLR mAbs), разрабатываются с целью блокирования функции PRLR. Одним таким aPRLR mAb является IgG2 анти-PRLR mAb, который разрабатывается для негормонального лечения пациентов с эндометриозом.
Антитела могут вводить пациентам с помощью внутривенной, внутримышечной, и/или подкожной инъекции. Для обеспечения соблюдения пациентом режима и схемы лечения, желательно, чтобы дозированные формы внутримышечной и подкожной инъекции были изотоническими и включали небольшие объемы инъекции (<2 мл на место инъекции). Для уменьшения объема инъекции и обеспечения эффективной дозы, антитела часто вводят в широком диапазоне концентраций, от 1 мг/мл до 150 мг/мл, включая высокие концентрации в пределах диапазона от 20 мг/мл до 150 мг/мл.
Несмотря на то, что в настоящее время на рынке продуктов лекарственных средств на основе антитела используют, как жидкие, так и лиофилизированные дозированные формы, лиофилизированные формы используют чаще для продуктов лекарственных средств на основе антитела, имеющие высокие концентрации белка. Препарат с высокой концентрацией антитела может преподносить много проблем во время фармацевтической разработки, особенно для жидкого препарата. Для препаратов, в которых концентрация антитела находится вблизи предела их эффективной растворимости, разделение фаз может происходить посредством осаждения, гелеобразования и/или кристаллизации. При высокой концентрации белка, стабильность антитела может стать проблематичной в связи с образованием растворимых и нерастворимых белок-белковых агрегатов. Высококонцентрированные препараты антитела часто обладают высокой вязкостью, которая создает трудности для технологического процесса, такого как ультрафильтрация и стерильная фильтрация, и для инъекции дозированного раствора. И при высоких концентрациях антитела, которые являются желательными для препаратов, предназначенных для внутримышечного или подкожного введения, требуются пропорционально высокие концентрации стабилизаторов, таких как сахароза и хлорид натрия, чтобы достичь долговременной белковой стабильности. Получающиеся в результате гипертонические растворы часто вызывают боль от инъекции из-за повреждения ткани. Таким образом, часто является желательным сбалансировать количество стабилизаторов для стабильности и осмоляльности препарата с высокой концентрацией белка.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представленное изобретение раскрывает жидкие и лиофилизированные препараты анти-PRLR антитела с широким диапазоном концентраций анти-PRLR антитела, которые являются фактически изотоническими и имеют низкую вязкость, и которые не содержат никакой другой соли помимо органической соли или неорганической соли, которую используют с целью буферизации препарата.
Препараты анти-PRLR антитела, представленные в данном документе, содержат от приблизительно 0 мМ до приблизительно 70 мМ гистидина; от приблизительно 50 м.д. до приблизительно 300 м.д. неионного поверхностно-активного вещества такого как, например, полисорбат (Tween®) 80 и/или полисорбат (Tween®) 20; от приблизительно 34 мМ до приблизительно 292 мМ сахара или сахарного спирта, такого как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 270 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл анти-PRLR антитела, включая aPRLR-специфическое IgG2 моноклональное антитело (mAb), при рН от приблизительно рН 5,0 до приблизительно рН 6,5.
Каждый из описанных в настоящее время препаратов антитела не содержит фактически никакой другой соли помимо органической соли или неорганической соли, которую используют с целью буферизации препарата. Это позволяет добавление альтернативных стабилизаторов, чтобы поддерживать изоосмотичность препарата (то есть, осмоляльность, которая находится в диапазоне от приблизительно 240 ммоль/кг до приблизительно 380 ммоль/кг), что, таким образом, способствует более высокой степени соблюдения пациентом режима и схемы лечения.
Каждый из описанных в настоящее время препаратов антитела имеет низкую вязкость, которая находится в диапазоне от приблизительно 1 до приблизительно 8 мПа*сек при 22°С-23°С, что способствует легкости технологического процесса, такой как, например, улучшенная ультрафильтрация и стерильная фильтрация, а также инъекции препарата антитела через иглу шприца во время введения.
Композиции, раскрытые в данном документе, стабилизируют антитела, в частности анти-PRLR антитела, включая анти-PRLR IgG2 антитела, при высоких концентрациях белка в жидкой форме или в лиофилизированной форме.
ОПИСАНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как описано выше, представленное изобретение предусматривает препараты анти-PRLR антитела, которые стабилизируют анти-PRLR антитело в широком диапазоне концентраций в жидкой форме или в лиофилизированной форме при предназначенных условиях хранения. Препараты, описанные в данном документе, включают один или более фармацевтически приемлемых ексципиентов или стабилизаторов, и содержатся в буферной среде при приемлемом рН и фактически являются изоосмотическими с физиологическими жидкостями. Для системного введения, инъекция представляет собой один возможный путь введения, включая внутримышечную, внутривенную, внутрибрюшинную и подкожную инъекцию.
Из-за их низкой вязкости, описанные на данный момент препараты анти-PRLR антитела могут быть легко простерилизованы посредством, например, ультрафильтрации и стерильной фильтрации, и могут быть введены пациенту путем инъекции, включая как внутривенную, так и подкожную инъекцию. Более того, так как они фактически являются изоосмотическими, описанные на данный момент препараты анти-PRLR антитела снижают повреждение ткани или другие неблагоприятные физиологические эффекты, и тем самым достигают благоприятной переносимости у пациента и повышения соблюдения пациентом режима и схемы лечения.
Препараты, описанные в данном документе, характеризуются фактическим отсутствием добавленной соли, за исключением органической соли или неорганической соли, которую используют, чтобы буферировать препарат, которая обеспечивает широкие возможности для повышения концентраций других стабилизаторов, таких как сахароза, в тоже время, сохраняя осмоляльность препарата для улучшенной переносимости in vivo и, следовательно, повышенного соблюдения пациентом режима и схемы лечения. Кроме того, низкая вязкость описанных на данный момент препаратов позволяет удобное выполнение технологического процесса, включая ультрафильтрацию и стерильную фильтрацию, и инъекции раствора продукта лекарственного средства через иглу.
С целью интерпретирования данного описания будут применяться следующие определения. В случае, когда какое-либо определение, представленное ниже, конфликтует с обычным применением такого слова в каком-либо другом документе, включая какой-либо другой документ, включенный в данный документ в качестве ссылки, определение, представленное ниже, будет всегда обеспечивать цели интерпретирования данного описания и связанной с ним формулы изобретения, за исключением, когда противоположное значение явно предназначено (например, в документе, где термин первоначально используют).
Всякий раз, когда это уместно, термины, использованные в единственном числе, также будут включать множественное число, и наоборот. Использование неопределенного артикля "а" в данном документе означает "один или более", если не указано иное, или, где использование "один или более" явно не соответствует. Использование "или" означает "и/или", если не указано иное. Использование "содержат," "содержит," "содержащий," "включают," "включает" и "включющий", являются взаимозаменяемыми и не должны рассматриватся как ограничение. Термин "такой как" также не предназначен рассматриватся как ограничение. Например, термин "включая" будет означать "включая, но не ограничиваясь этим." Более того, когда описание одного или более вариантов осуществления использует термин "содержащий," квалифицированный специалист в данной области техники должен понимать, что, в некоторых конкретных случаях, вариант осуществления или варианты осуществления могут быть альтернативно описаны, с использованием выражения "состоящий фактически из" и/или "состоящий из".
Как используется в данном документе, термин "вязкость" касается сопротивления жидкого препарата течению, такому как при инъекции с использованием иглы шприца во время введения пациенту. Измерения вязкости могут быть сделаны, используя способ конуса и пластины с элементом Пельтье, установленного при определенной температуре, такой как 22°С-23°С, как описано в данном документе. Как правило, хорошо определенный градиент напряжения сдвига применяют для жидкого препарата и измеряют полученную в результате скорость сдвига. Вязкость представляет собой соотношение напряжения сдвига к скорости сдвига. Как используется в данном документе, вязкость выражают в единицах мПа*сек. при 22°С-23°С, где 1 мПа*сек = 1 сантипуаз. Высокая концентрация, низкая вязкость, фактически изоосмотических препаратов, раскрытых в данном документе, как правило, характеризуются тем, что имеют вязкость, которая находится в диапазоне от 1 до 8 мПа*сек при 22°С-23°С.
Как используется в данном документе, термин "осмоляльность" касается измерения концентрации растворенного вещества, определенной как количество молей растворенного вещества на кг. раствора. Желаемый уровень осмоляльности может быть достигнут путем добавления одного или более стабилизаторов, таких как сахар или сахарный спирт, включая маннит, декстрозу, глюкозу, трегалозу и/или сахарозу. Дополнительные стабилизаторы, которые являются приемлемыми для обеспечения осмоляльности, описаны в литературе, такой как руководство Pharmaceutical Excipients (Fourth Edition, Royal Pharmaceutical Society of Great Britain, Science & Practice Publishers) или Remingtons: The Science and Practice of Pharmacy (Nineteenth Edition, Mack Publishing Company).
Как используется в данном документе, термин "приблизительно" касается +/- 10% предусмотренного значения единицы. Как используется в данном документе, термин "фактически" касается качественного состояния демонстрирования полной или приблизительной степени характеристики или интерисующего свойства. Квалифицированному специалисту в области биологических наук будет понятно, что биологические и химические явления редко, если даже достигают или предупреждают абсолютный результат из-за многих изменяемых факторов, которые влияют на исследование, получение и хранение биологических и химических композиций и веществ, и из-за погрешностей свойственных способам, приборам и оборудованию, используемому в исследовании, получении и хранении биологических и химических композиций и веществ. Термин фактически, таким образом, используют в данном документе, чтобы охватить потенциальный недостаток завершенности свойственной многим биологическим и химическим явлениям.
Как используется в данном документе, термины "изоосмотический" и "изотонический" используются взаимозаменяемо с терминами "фактически изоосмотический" и "фактически изотонический" и касаются препаратов, которые характеризуются наличием осмотического давления, которое является таким же, как или, по меньшей мере, фактически эквивалентным осмотическому давлению другого раствора, которое достигается препаратами, в которых общая концентрация растворенных веществ, включая как проницаемые, так и непроницаемые растворенные вещества, в препарате является такой же как или, по меньшей мере, фактически эквивалентной общему количеству растворенных веществ в другом растворе. Таким образом, несмотря на то, что квалифицированным специалистом в данной области техники будет принято во внимание, что "изоосмотические" и "изотонические" препараты, которые используются для введения in vivo, как правило, имеют осмоляльность находящуюся в диапазоне от приблизительно 270 ммоль/кг до приблизительно 310 ммоль/кг, с точки зрения высокой концентрации, низкой вязкости препаратов, согласно представленному изобретению, термины "изоосмотический," "изотонический," "фактически изоосмотический" и "фактически изотонический" используются взаимозаменяемо по отношению к препаратам, имеющим осмоляльность, которая находится в диапазоне от приблизительно 240 ммоль/кг до приблизительно 380 ммоль/кг, или от приблизительно 270 ммоль/кг до приблизительно 370 ммоль/кг, или от приблизительно 300 ммоль/кг до приблизительно 330 ммоль/кг.
На данный момент раскрытые, с высокой концентрацией, низкой вязкостью, фактически изоосмотические препараты анти-PRLR антитела содержат от приблизительно 0 мМ до приблизительно 70 мМ гистидина; от приблизительно 50 м.д. до приблизительно 300 м.д. неионного поверхностно-активного вещества, такого как, например, полисорбат (Tween®) 80 и/или полисорбат (Tween®) 20; от приблизительно 34 мМ до приблизительно 292 мМ сахара или сахарного спирта, такого как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 270 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл анти-PRLR антитела при рН от приблизительно рН 5,0 до приблизительно рН 6,5. Препараты, раскрытые в данном документе, демонстрируют вязкость, которая находится в диапазоне от приблизительно 1 до приблизительно 8 мПа*сек при 22°С-23°С и осмоляльность, которая находится в диапазоне от приблизительно 240 до приблизительно 380 ммоль/кг.
В данных препаратах, гистидин представляет собой буферный агент, который могут использовать для поддержания рН препарата от приблизительно рН 5,0 до приблизительно рН 6,5, или от приблизительно рН 5,5 до приблизительно рН 6,0, такого как приблизительно рН 5,0, приблизительно рН 5,5, приблизительно рН 6,0 или приблизительно рН 6,5.
Сахара или сахарный спирт, такой как маннит, декстроза, глюкоза, трегалоза и/или сахароза, используются по отдельности или в комбинации и как криопротектор, так и как стабилизатор анти-PRLR антитела в жидких препаратах, а также во время лиофилизации.
Неионные поверхностно-активные вещества, такие как полисорбаты, включая полисорбат 20 и полисорбат 80; полиоксамеры, включая полоксамер 184 и 188; плюрониловые® полиолы; и другие этилен/полипропилен блок-сополимеры, стабилизируют анти-PRLR антитело во время технологического процесса и хранения за счет снижения межфазного взаимодействия и предотвращения адсорбции антитела.
Аргинин представляет собой солюбилизатор белка и, кроме того, стабилизатор, который снижает агрегацию антитела и другого белка, такую как агрегацию анти-PRLR антитела, и другую возможную деструкцию. Метионин представляет собой антиоксидант, который предотвращает окисление антитела во время технологического процесса и хранения.
Сахара и неорганические соли, как правило, используются в качсестве стабилизаторов белка; однако, как сахара, так и неорганические соли, кроме того, являются эффективными агентами тоничности. Если препарат требует высокую концентрацию одного или более Сахаров, чтобы стабилизировать анти-PRLR антитело, то концентрация неорганической соли должна быть нулевой или сохраняться очень низкой для того, чтобы поддерживать осмоляльность препарата такой, чтобы уменьшить боль от инъекции при введении.
Как используется в данном документе, термин "соль" касается неорганических солей, которые включают хлорид натрия (NaCl), сульфат натрия (Na2SO4), тиоцианат натрия (NaSCN), хлорид магния (MgCl), сульфат магния (MgSO4), тиоцианат аммония (NH4SCN), сульфат аммония ((NH4)2SO4), хлорид аммония (NH4Cl), хлорид кальция (CaCl2), сульфат кальция (CaSO4), хлорид цинка (ZnCl2) и тому подобное, или их комбинаций. Препараты анти-PRLR антитела, раскрытые в данном документе, характеризуются фактическим отсутствием добавленной соли и, следовательно, обозначаются в данном документе как бессолевые препараты антитела. Квалифицированным специалистам в данной области техники должно быть понятно, что присутствие неорганических солей в препаратах, раскрытых на данный момент, которые вводятся при регулировании рН, не считаются такими, которые являются добавленными солями. Такие неорганические соли, которые вводятся при регулировании рН, если присутствуют в препарате в соответствии с представленным изобретением, не должны превышать концентрацию приблизительно 2 мМ.
Как используется в данном документе, термин "поверхностно-активное вещество" включает неионные поверхностно-активные вещества, включая, без ограничения, полисорбаты, такие как полисорбат 20 или 80, и полиоксамеры, такого как полоксамер 184 или 188, плюрониловые® полиолы и другие этилен/полипропилен блок-сополимеры. Количества поверхностно-активных веществ, эффективные для обеспечения стабильной высокой концентрации анти-PRLR антитела в препаратах, как правило, находится в диапазоне от 50 м.д. до 300 м.д. Использование неионных поверхностно-активных веществ дает возможность препаратам подвергаться напряжению сдвига и напряжению поверхности, не вызывая при этом денатурацию анти-PRLR антитела, и, кроме того, снижает адсорбцию на поверхностях во время технологического процесса и хранения. Препараты, раскрытые в данном документе, включают, без ограничения, препараты, содержащие одно или более неионное(ых) поверхностно-активное(ых) вещество(в), включая, например, один или более полисорбат(ов), такой(их) как полисорбат 20 или 80; один или более полиоксамеров, таких как полоксамер 184 или 188; плюрониловых® полиолов; и/или один или более этилен/полипропилен блок-сополимер(ов). Проиллюстрированными в данном документе являются препараты, содержащие полисорбат, такой как полисорбат 20 (Tween® 20) или полисорбат 80 (Tween® 80).
Как используется в данном документе, термин "антитело" касается класса белков, которые, как правило, известны как иммуноглобулины. Антитела включают полноразмерные моноклональные антитела (mAb), такие как IgG2 моноклональные антитела, которые включают Fe области иммуноглобулина. Термин антитело также включает биспецифические антитела, диатела, одноцепочечные молекулы и фрагменты антитела, такого как Fab, F(ab')2 и Fv.
Как используется в данном документе, термин "анти-PRLR антитело" касается антитела, имеющего специфичность связывания по отношению к человеческому PRLR белку, а также фрагментам и вариантам человеческого PRLR белка. Анти-PRLR антитела, представленные в данном документе, могут представлять собой IgG2 антитела и включают анти-PRLR IgG2 моноклональные антитела, такие как химерные, гумманизированные и полностью человеческие анти-PRLR IgG2 моноклональные антитела. Анти-PRLR моноклональные антитела, включая полноразмерные антитела и связывающие антиген их фрагменты и варианты, которые являются приемлемыми для использования в препаратах, раскрытых в данном документе, представлены в РСТ заявках на патент №№ WO/2011/069799, WO/2011/069798, WO/2011/069797, WO/2011/069796, WO/2011/069795 и WO/2011/069794, каждая из которых включена в данный документ в виде ссылки во всей своей полноте.
"Моноклональные антитела" характеризуются наличием специфичности по отношению к одной антигенной детерминанте. Моноклональные антитела могут, например, быть получены по способу гибридомы, описанному Kohler and Milstein, Nature 256: 495 (1975) или с использованием способов рекомбинантного ДНК, таких как те, которые описаны в патенте США №4,816,567. Моноклональные антитела также могут быть выделены из библиотек фазового дисплея, используя методики, такие как описанные в Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991).
Моноклональные антитела включают "химерные моноклональные антитела", в которых часть тяжелой и/или легкой цепи включает последовательности от антител, полученных из одного вида, в то время как остальная часть антитела, включая Fc область, включает последовательности от антител, полученных из второго вида, и второй вид может быть человеком. Смотри, например, патент США №4,816,567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984).
Моноклональные антитела, кроме того, включают "гумманизированные моноклональные антитела", в которых одну или более областей, определяющих комплементарность (CDR) последовательности тяжелой и/или легкой цепи от антител, полученных из одного вида, заменяют на одну или более CDR последовательности тяжелой и/или легкой цепи из антител, полученных из второго вида, и второй вид может быть человеком. Процесс "гуманизации" обычно применяют к моноклональным антителам, разработанным для введения людям. Смотри, например, Riechmann et al., Nature 332(6162): 323-27 (1988) и Queen et al., Proc. Natl. Acad. Sci. USA 86(24): 10029-33 (1989).
Моноклональные антитела, кроме того, включают "полностью человеческие моноклональные антитела", в которых полные последовательности тяжелой и легкой цепи получают из последовательностей антитела человека. Полностью человеческие моноклональные антитела могут быть получены по технологиям фагового дисплея и могут быть выделены из генетически сконструированных мышей, чтобы экспрессировать спектр антитела человека. Смотри, например, McCafferty et al., Nature 348(6301): 552-554 (1990), Marks et al., J. Mol. Biol. 222(3): 581-597 (1991), и Carmen and Jermutus, Brief Funct. Genomic Proteomic 1(2): 189-203 (2002).
Как используется в данном документе, термин "фармацевтически эффективное количество" препарата анти-PRLR антитела касается количества препарата, которое обеспечивает терапевтический эффект в схеме введения. Препараты с высокой концентрацией анти-PRLR антитела, раскрытые в данном документе, как правило, включают анти-PRLR антитело в концентрации, которая находится в диапазоне от приблизительно 1 мг/мл до приблизительно 150 мг/мл, или от приблизительно 2 мг/мл до приблизительно 120 мг/мл, или от приблизительно 5 мг/мл до приблизительно 100 мг/мл, или от приблизительно 7,5 мг/мл до приблизительно 60 мг/мл. В некоторых аспектах концентрация анти-PRLR антитела в данных препаратах составляет приблизительно 2 мг/мл, или приблизительно 7,5 мг/мл, или приблизительно 20 мг/мл, или приблизительно 50 мг/мл, или приблизительно 60 мг/мл. Такие препараты, как правило, вводят в объеме, меньше, чем приблизительно 2 мл, или приблизительно 1,5 мл, или приблизительно 1 мл, или приблизительно 0,5 мл на место инъекции для подкожной инъекции.
В определенных аспектах, препарат анти-PRLR антитела содержит приблизительно 30 мМ гистидина, приблизительно 100 м.д. полисорбата 80, приблизительно 292 мМ сахарозы, приблизительно 20 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 10 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 80 м.д. полисорбата 80, приблизительно 234 мМ сахарозы, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. полисорбата 80, приблизительно 234 сахарозы, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. полисорбата 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 10 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. полисорбата 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 10 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 200 м.д. полисорбата 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 10 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 70 мМ гистидина, приблизительно 80 м.д. полисорбата 80, приблизительно 200 мМ сахарозы, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 10 мМ до приблизительно 50 мМ аргинина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 80 м.д. полисорбата 80, приблизительно 292 мМ сахарозы, приблизительно 10 мМ аргинина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до приблизительно 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 70 мМ гистидина, приблизительно 80 м.д. полисорбата 80, приблизительно 176 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 30 мМ лизина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. готового полисорбата 80, приблизительно 234 мМ сахарозы, приблизительно 30 мМ аргинина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 80 м.д. готового полисорбата 80, приблизительно 234 мМ сахарозы, приблизительно 20 мМ аргинина, приблизительно 150 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 80 м.д. готового полисорбата 80, приблизительно 205 мМ сахарозы, приблизительно 20 мМ аргинина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидин, приблизительно 80 м.д. готового полисорбата 80, приблизительно 205 мМ сахарозы, приблизительно 20 мМ аргинина, приблизительно 2 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидин, приблизительно 80 м.д. готового полисорбата 80, приблизительно 205 сахарозы, приблизительно 20 мМ аргинина, приблизительно 1 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. приблизительно полисорбата 80, приблизительно 205 трегалозы, приблизительно 20 мМ аргинина, приблизительно 2 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина. В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 75 м.д. приблизительно полисорбата 80, приблизительно 205 трегалозы, приблизительно 20 мМ аргинина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В родственных аспектах, препарат анти-PRLR антитела, кроме того, содержит от приблизительно 0 мМ до 10 мМ метионина.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 234 мМ сахарозы, приблизительно 80 м.д. полисорбата 80, приблизительно 30 мМ аргинина, приблизительно 5 мМ метионина, приблизительно 7,5 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5, например, рН 5,5.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 234 мМ сахарозы, приблизительно 80 м.д. полисорбата 80, приблизительно 30 мМ аргинина, приблизительно 5 мМ метионина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5, например, рН 5,5.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 234 мМ сахарозы, приблизительно 75 м.д. Tween 80, приблизительно 30 мМ аргинина, приблизительно 10 мМ метионина, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5, например, рН 5,5.
В других аспектах препарат анти-PRLR антитела содержит приблизительно 10 мМ гистидина, приблизительно 263 мМ сахарозы, приблизительно 80 м.д. полисорбата 80, приблизительно 60 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5, например, рН 6,0.
Таким образом, представленное изобретение предусматривает препараты анти-PRLR mAb, включая препараты анти-PRLR IgG2 mAb, в которых анти-PRLR mAb является растворимым при высоких концентрациях белка. Анти-PRLR mAb в препаратах, раскрытых в данном документе, остаются растворимыми при концентрациях от приблизительно 1 мг/мл до приблизительно 150 мг/мл, и остаются стабильными в изоосмотических условиях хранения, и демонстрируют пониженную вязкость по сравнению с доступными в настоящее время препаратами антитела.
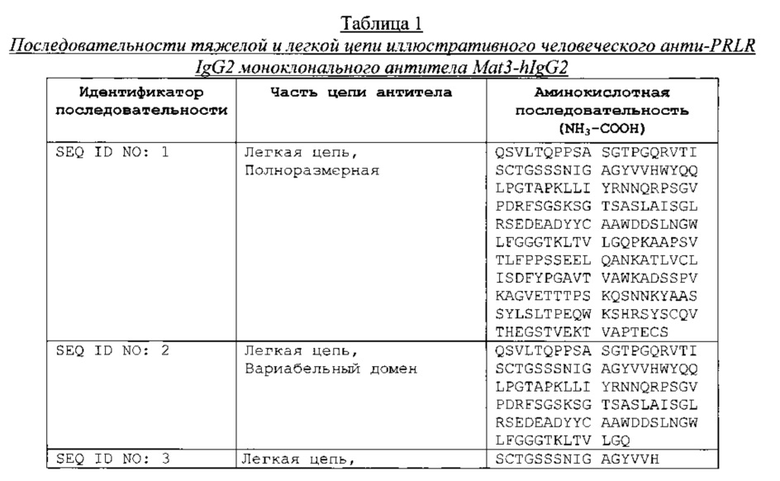
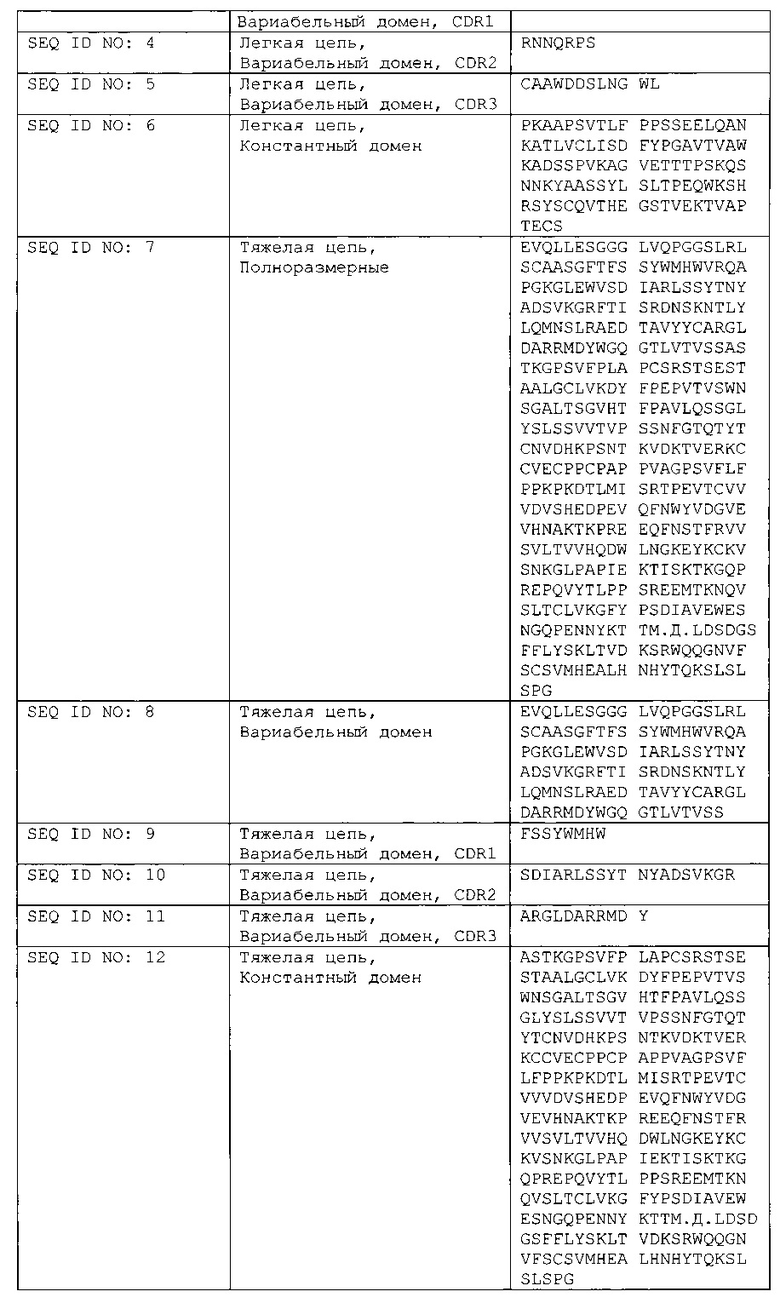
Анти-PRLR антитело, имеющее легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 1, и тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 7, представляет собой IgG2 антитело блокирующее пролактиновый рецептор (PRLR). Анти-PRLR антитела могут предотвратить появление или прогрессирование эндометриоза посредством блокирования PRLR, таким образом, преодолевая неполноценности эндометриальных путей. Высокая концентрация, бессолевых препаратов анти-PRLR антитела, представленных в данном документе, можно вводить пациентам с помощью внутривенной инъекции, или подкожной инъекции, или другими инъекционными способами.
Как часть представленного изобретения, стабильность анти-PRLR антител подвергается влиянию ексципиентов. Стабильность анти-PRLR антитела возрастает с уменьшением концентраций NaCl в определенном диапазоне рН. Кроме того, положительно заряженные аминокислоты, такие как аргинин и лизин, могут улучшать стабильность анти-PRLR антитела, а также на агрегацию анти-PRLR антитела сильно влияет рН. Агрегация антитела в растворах возрастает с увеличением рН. Оптимальный рН для стабилизирования анти-PRLR антител, представленных в данном документе, находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5 или от приблизительно рН 5,5 до приблизительно рН 6,0, таком как приблизительно рН 5,0, приблизительно рН 5,5, приблизительно рН 6,0 или приблизительно рН 6,5.
Предусмотренными в данном документе являются препараты анти-PRLR антител, в которых анти-PRLR антитела включают IgG2 антитела, включая человеческие IgG2 моноклональные анти-PRLR антитела, имеющие последовательность легкой цепи и последовательность тяжелой цепи, представленную в одной или более из РСТ заявок на патент №№ WO/2011/069799, WO/2011/069798, WO/2011/069797, WO/2011/069796, WO/2011/069795 и WO/2011/069794.
Антитела, которые могут быть подходяще использованы в препаратах анти-PRLR антител, описанных в данном документе, иллюстрируются Mat3-hIgG2 антителом, представленным в таблице 1, которое было получено из библиотеки фагового дисплея Biolnvent Phage Display (Lund, Sweden) и затем модифицировано на уровне генов зародышевого типа и оптимизировано по последовательности для аффинности, активности, межвидовой перекрестной реактивности и технологичности.
Fab часть содержит лямбда легкую цепь (VL: DPL3 зародышевая линия; CL: Mcg-/Kern-/Oz-изотип) и VH DP47-зародышевую структурную область тяжелой цепи. Антитело было переформатировано в человеческий IgG2 от IgG2m (n-) аллотипа с тяжелой цепью с недостающим С-терминальным лизином. Потенциальный сайт деамидирования присутствует в CDR3 в аминокислотном положении 98 легкой цепи, и был оставлен неизмененным в данном антителе. Стандартный сайт N-гликозилирования IgG2 присутствует в N294 тяжелой цепи.
Таким образом, представленное изобретение предусматривает препараты анти-PRLR mAb, включая препараты анти-PRLR IgG2 mAb, в которых анти-PRLR mAb является растворимым при высоких концентрациях белка. Как правило, анти-PRLR mAb в препаратах, раскрытых в данном документе, остаются растворимыми в концентрациях от приблизительно 1 мг/мл до приблизительно 150 мг/мл, и остаются стабильными в изоосмотических условиях хранения, и демонстрируют пониженную вязкость по сравнению с доступными в настоящее время препаратами антитела.
Анти-PRLR антитело, имеющее последовательность легкой цепи и последовательность тяжелой цепи, представленную в перечне последовательностей, которые прилагаются к данному документу и к одной или более из РСТ публикаций заявок на патент №№ WO/2011/069799 (U.S. 2013/0129739), WO/2011/069798 (U.S. 2013/0022606), WO/2011/069797 (U.S. 2012/0315276), WO/2011/069796 (U.S. 2013/0171147), WO/2011/069795 и WO/2011/069794 (U.S. 2012/0321632), может представлять собой IgG2 антитело, которое блокирует активность пролактинового рецептора. Анти-PRLR антитела могут предупреждать появление или прогрессирование эндометриоза путем блокирования PRLR, таким образом, преодолевая неполноценности эндометриальных путей. Широкий диапазон концентрации белка, включая высокую концентрацию препарата анти-PRLR антител, представленный в данном документе, может быть введен пациентам посредством внутривенной инъекции, внутримышечной инъекции или подкожной инъекции.
Представленное изобретение, кроме того, предусматривает способы негормонального лечения эндометриоза у пациента, которые включают введение пациенту терапевтически эффективного количества одного или более препаратов, описанных в данном документе. Например, предусмотренными являются способы негормонального лечения эндометриоза у пациента, которые включают введение пациенту терапевтически эффективного количества препарата антитела (aPRLR Ab) к рецептору анти-пролактина, включая препарат aPRLR-специфического IgG2 моноклонального антитела (mAb), который содержит от приблизительно 0 мМ до приблизительно 70 мМ гистидина; от приблизительно 50 м.д. до приблизительно 300 м.д. полисорбата (Tween®) 80 и/или полисорбата (Tween®) 20; от приблизительно 34 мМ до приблизительно 292 мМ сахарозы; от приблизительно 0 мМ до приблизительно 50 мМ аргинина, от приблизительно 0 мМ до приблизительно 50 мМ лизина, от приблизительно 0 мМ до приблизительно 270 мМ глицина или аланина, от приблизительно 0 мМ до приблизительно 10 мМ метионина, и от приблизительно 1 мг/мл до приблизительно 150 мг/мл анти-PRLR антитела при рН, который находится в диапазоне от приблизительно рН 5,0 до приблизительно рН 6,5. В, по меньшей мере, одном аспекте данных способов, препарат анти-PRLR антитела может вводиться внутривенно. В других аспектах данных способов, препарат анти-PRLR антитела может вводиться подкожно. В других аспектах данных способов, препарат анти-PRLR антитела может вводиться внутримышечно.
В соответствии с некоторыми аспектами данных способов негормонального лечения эндометриоза у пациента, анти-PRLR антитело представляет собой человеческое анти-PRLR IgG2 моноклональное антитело, такое как, например, человеческое анти-PRLR IgG2 моноклональное антитело, которое содержит последовательность легкой цепи и последовательность тяжелой цепи, представленную в одной или более из РСТ публикаций заявок на патент №№ WO/2011/069799, WO/2011/069798, WO/2011/069797, WO/2011/069796, WO/2011/069795 и WO/2011/069794.
Аспекты представленного изобретения, кроме того, могут быть поняты в свете следующих примеров, которые не должны быть истолкованы как такие, которые ограничивают каким-либо образом пределы представленного замысла.
ПРИМЕРЫ
Пример 1
Влияние концентрации NaCl и рН на опалесценцию растворов антитела
Данный пример раскрывает влияние концентрации соли (NaCl) и рН на агрегацию растворов, содержащих анти-PRLR человеческое моноклональное антитело, которое содержит последовательность легкой цепи и последовательность тяжелой цепи, представленную в одной или более из РСТ публикаций заявок на патент №№ WO/2011/069799, WO/2011/069798, WO/2011/069797, WO/2011/069796, WO/2011/069795 и WO/2011/069794. Опалесценцию растворов оценивают посредством визуального наблюдения, чтобы быстро оценить влияния концентраций соли и рН на aPRLR mAb растворы. Никакого осаждения не наблюдается после 2 месяцев при 5°С и 25°С у препарата в отсутствие соли при рН 5,5-6,5.
Растворы без хлорида натрия при рН от 5,0 до 6,5 рекомендуются для раскрытых на данный момент препаратов анти-PRLR антитела.
Не будучи связанными какой-либо теорией, полагают, что пониженная стабильность в терминах опалесценции или агрегации препаратов анти-PRLR mAb с высокой концентрацией NaCl происходит в результате нейтрализации положительных зарядов на аргининовых боковых цепях анти-PRLR mAb. Фазовое поведение aPRLR mAb при различных рН с воздействием моновалентной соли (NaCl) объясняет, почему достигаются стабильные, растворимые, бессолевые и с фактической изоосмоляльностью препараты aPRLR mAb.
При рН ниже PI, таком как рН 5-6,5, анти-PRLR антитело имеет общий положительный заряд. Отталкивание положительных зарядов на поверхности такого анти-PRLR антитела вполне вероятно предупреждает ассоциацию белок-белок между индивидуальными молекулами и, таким образом, значительно увеличивает растворимость. Предполагается, что анион (Cl-) соли связывается с группой гуанидиния на аргининовых боковых цепях на поверхности анти-PRLR антитела, чтобы нейтрализовать положительные заряды, которые повышают белок-белковые взаимодействия и, следовательно, вызывают более низкую растворимость и опалесценцию раствора. По сдвигу рН до 5,0-6,5, бессолевые препараты, которые описаны в данном документе, разработаны для достижения повышенной растворимости антитела и стабильности. В отсутствие соли, концентрация других стабилизаторов, таких как сахароза, может быть увеличена до >150 мМ и <300 мМ без снижения осмоляльности.
Пример 2. Препараты анти-PRLR антитела
Фактически изоосмотическую высокую концентрацию анти-PRLR Ab в препаратах получают без NaCl. Данные препараты используют высокие концентрации сахарозы, чтобы способствовать стабилизированию анти-PRLR Ab.
Замороженное анти-PRLR антитело размораживают и формулируют в соответствии с составами, представленными в таблице 2. Препараты получают и стерильно фильтруют через фильтр 0,22 мкм и стерильно заполняют во флаконы из ампульного стекла, и закупоривают резиновыми пробками.
В отсутствие NaCl и в присутствии сахарозы или трегалозы от 34 мМ до 292 мМ, и полисорбата 80 (50-300 м.д.), и при рН 5,0-6,5, положительно заряженные аминокислоты, такие как аргинин (10-50 мМ), могут эффективно препятствовать агрегации aPRLR Ab.


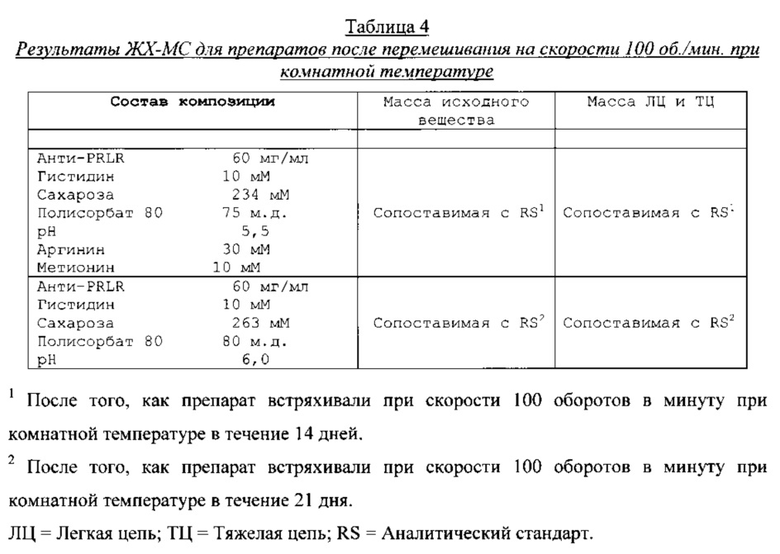
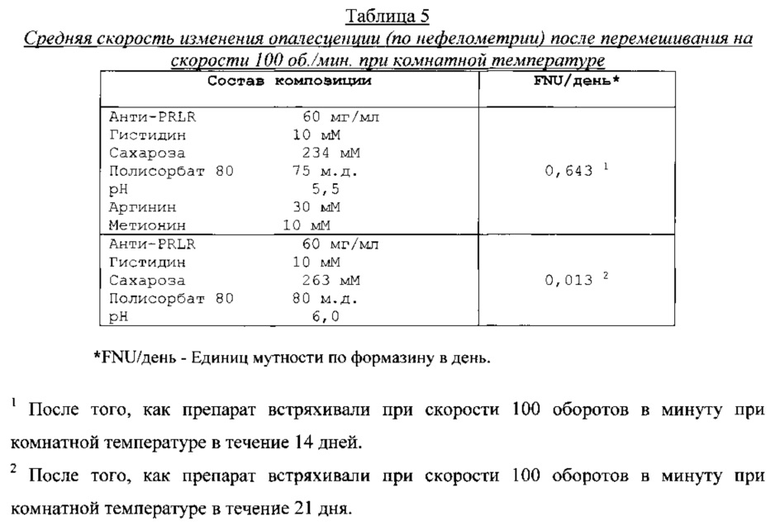
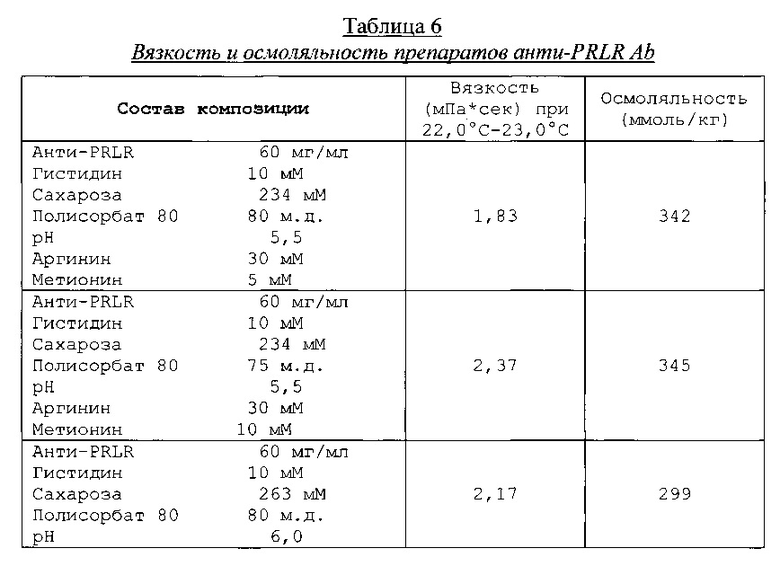
Типичные представители препаратов анти-PRLR mAb анализировали, используя эксклюзионную высокоэффективную жидкостную хроматографию (ВЭЖХ) для агрегации и деградации белка, ЖХ-МС (жидкостная хроматография-масс-спектрометрия) для структурных изменений aPRLR (гликирования и окисления), вискозиметр для измерения вязкости, и прибор для измерения осмотической концентрации раствора для измерения осмоляльности. Результаты анализа эксклюзионной ВЭЖХ по агрегации белка представлены в таблице 3, результаты нефелометрического анализа по опалесценции представлены в таблице 4, результаты анализа ЖХ-МС по структурным изменениям aPRLR представлены в таблице 5, и результаты анализа по вязкости и осмоляльности представлены в таблице 6.

| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ АНТИТЕЛА И БЕЛКА | 2013 |
|
RU2678097C2 |
| СОДЕРЖАЩИЕ АНТИТЕЛА СОСТАВЫ | 2012 |
|
RU2665810C2 |
| Препараты однодоменных антигенсвязывающих молекул | 2013 |
|
RU2683861C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛ К CD38 ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2020 |
|
RU2838165C1 |
| СОСТАВЫ АНТИТЕЛ К RSV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807524C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ДУОКАРМИЦИН | 2016 |
|
RU2687237C1 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2671481C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИ-PD-1/HER2 БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2829156C2 |
| СОСТАВ АНТИТЕЛА | 2015 |
|
RU2743681C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
































Группа изобретений относится к медицине и касается препарата анти-PRLR антитела для негормонального лечения эндометриоза, содержащего гистидин, неионное поверхностно-активное вещество, сахар, выбранный из маннита, декстрозы, глюкозы, трегалозы и сахарозы, аргинин, метионин, анти-PRLR антитело. Где указанный препарат анти-PRLR антитела имеет рН, который находится в диапазоне от рН 5,0 до рН 6,5, где указанный препарат анти-PRLR по существу свободен от неорганической соли, и где указанное анти-PRLR антитело представляет собой человеческое IgG2 моноклональное антитело. Группа изобретений также касается применения указанного препарата анти-PRLR антитела для негормонального лечения эндометриоза. Группа изобретений обеспечивает создание препаратов с высокой концентрацией антитела к рецептору анти-пролактина, которые при этом являются фактически изоосмотическими и имеют низкую вязкость. 2 н. и 15 з.п. ф-лы, 6 табл., 2 пр.
1. Препарат анти-PRLR антитела для негормонального лечения эндометриоза, который содержит:
a) от 10 мМ до 70 мМ гистидина;
b) от 75 ч. на млн до 100 м.д. неионного поверхностно-активного вещества;
c) от 88 мМ до 292 мМ сахара, выбранного из маннита, декстрозы, глюкозы, трегалозы и сахарозы;
d) от 10 мМ до 30 мМ аргинина;
e) от 5 мМ до 10 мМ метионина;
f) от 7.5 мг/мл до 150 мг/мл анти-PRLR антитела;
где указанный препарат анти-PRLR антитела имеет рН, который находится в диапазоне от рН 5,0 до рН 6,5, где указанный препарат анти-PRLR по существу свободен от неорганической соли, отличной от органической соли или неорганической соли, которая буферирует указанный препарат, и где указанное анти-PRLR антитело представляет собой человеческое IgG2 моноклональное антитело, содержащее тяжелую цепь и легкую цепь, причем аминокислотная последовательность указанной тяжелой цепи соответствует SEQ ID NO: 7, а аминокислотная последовательность указанной легкой цепи соответствует SEQ ID NO: 1.
2. Препарат анти-PRLR антитела по п. 1, где указанный анти-PRLR препарат по существу свободен от неорганической соли, выбранной из группы, состоящей из хлорида натрия (NaCl), сульфата натрия (Na2SO4), тиоцианата натрия (NaSCN), хлорида магния (MgCl), сульфата магния (MgSO4), тиоцианата аммония (NH4SCN), сульфата аммония ((NH4)2SO4), хлорида аммония (NH4Cl), хлорида кальция (CaCl2), сульфата кальция (CaSO4) и хлорида цинка (ZnCl2).
3. Препарат анти-PRLR антитела по п. 1, где указанный препарат имеет вязкость, которая находится в диапазоне от 1 до 8 мПа⋅сек при 22-23°С.
4. Препарат анти-PRLR антитела по п. 1, где указанный препарат имеет осмоляльность, которая находится в диапазоне от 240 до 380 ммоль/кг.
5. Препарат анти-PRLR антитела по п. 1, где указанное неионное поверхностно-активное вещество представляет собой полисорбат, выбранный из полисорбата 20 и полисорбата 80.
6. Препарат анти-PRLR антитела по п. 1, где указанный сахар представляет собой сахарозу.
7. Препарат анти-PRLR антитела по п. 1, содержащий от 10 мМ до 30 мМ аргинина.
8. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 30 мМ гистидина,
b) 100 ч. на млн полисорбата 80,
c) 292 мМ сахарозы,
d) 30 мМ аргинина,
e) 10 мМ метионина и
f) 20 мг/мл анти-PRLR антитела.
9. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 70 мМ гистидина,
b) 80 ч. на млн полисорбата 80,
c) 200 мМ сахарозы,
d) 30 мМ аргинина,
e) 10 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
10. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 75 ч. на млн полисорбата 80,
c) 292 мМ сахарозы,
d) 10 мМ аргинина,
e) 10 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
11. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 75 ч. на млн полисорбата 80,
c) 234 мМ сахарозы,
d) 30 мМ аргинина,
e) 10 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
12. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 75 ч. на млн полисорбата 80,
c) 234 мМ сахарозы,
d) 30 мМ аргинина,
e) 10 мМ метионина и
f) 7,5 мг/мл анти-PRLR антитела.
13. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 80 ч. на млн полисорбата 80,
c) 205 мМ сахарозы,
d) 20 мМ аргинина,
e) 10 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
14. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 234 мМ сахарозы,
c) 80 ч. на млн полисорбата 80,
d) 30 мМ аргинина,
e) 5 мМ метионина и
f) 7,5 мг/мл анти-PRLR антитела.
15. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 234 мМ сахарозы,
c) 80 ч. на млн полисорбата 80,
d) 30 мМ аргинина,
e) 5 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
16. Препарат анти-PRLR антитела по п. 1, содержащий:
a) 10 мМ гистидина,
b) 234 мМ сахарозы,
c) 75 ч. на млн полисорбата 80,
d) 30 мМ аргинина,
e) 10 мМ метионина и
f) 60 мг/мл анти-PRLR антитела.
17. Применение препарата анти-PRLR антитела по п. 1 для негормонального лечения эндометриоза, где указанное применение включает введение пациенту терапевтически эффективного количества препарата анти-PRLR антитела, содержащего от 10 мМ до 70 мМ гистидина, от 75 ч. на млн до 100 ч. на млн полисорбата 80, от 88 мМ до 292 мМ сахарозы, от 10 мМ до 30 мМ аргинина, от 5 мМ до 10 мМ метионина, от 7,5 мг/мл до 150 мг/мл антитела при рН от рН 5,0 до рН 6,5, где указанный препарат анти-PRLR антитела по существу свободен от неорганической соли, причем указанный препарат анти-PRLR антитела вводят внутривенно, подкожно или внутримышечно.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2018-04-02—Публикация
2013-08-28—Подача