Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №61/553916, поданной 31 октября 2011 г., полное содержание которой включено в настоящий документ посредством ссылки.
Область техники
Описаны составы, содержащие антитело к IL-13, включая в себя фармацевтические составы и способы применения таких составов.
Список последовательностей
Настоящая заявка содержит список последовательностей, который был подан в формате ASCII через EFS-Web и полностью включен в настоящий документ посредством ссылки. Указанная копия ASCII, созданная 4 октября 2012 г., имеет название P4786R1W.txt, и размер ее составляет 22776 байт.
Уровень техники
Интерлейкин (IL)-13 представляет собой плейотропный цитокин Т-хелперных клеток 2 подкласса (Th2). Предположили, что IL13 может играть намного более значительную роль, чем другие цитокины Th2 в эффекторных функциях, связанных с симптомами бронхиальной астмы (Corry, Curr. Opin. Immunol., 11: 610 (1999)). Были описаны гуманизированные антитела к IL-13. Смотрите, например, международную патентную публикацию №2005/062967, Одно конкретное антитело к IL13, лебрикизумаб, клинически исследовали для лечения пациентов с плохо поддающейся контролю бронхиальной астмой. Определенные результаты этих исследований были описаны в Corren et al., N Engi J Med 365(12): 1088-98 (2011).
Поскольку белки, включающие в себя антитела, больше по размеру и намного сложнее традиционных органических и неорганических лекарственных средств (например, они обладают множественными функциональными группами в дополнение к сложным трехмерным структурам), то получение составов таких белков связано с определенными проблемами. Чтобы белок оставался биологически активным, состав должен сохранить интактной конформационную целостность по меньшей мере сердцевинной последовательности аминокислот белка, в то же время защищая множественные функциональные группы белка от деградации. Пути деградации белков могут включать в себя химическую нестабильность (например, любой процесс, который предусматривает модификацию белка путем образования или расщепления связей, приводящих к новому химическому соединению) или физическую нестабильность (например, изменения в структуре белка более высокого порядка). Химическая нестабильность может представлять собой результат деамидирования, рацемизации, гидролиза, окисления, бета-отщепления или дисульфидного обмена. Физическая нестабильность может являться результатом, например, денатурации, агрегации, осаждения или адсорбции. Три наиболее распространенных пути деградации белка представляют собой агрегацию, деамидирование и окисление белка. Cleland et al Critical Reviews in Therapeutic Drug Carrier Systems 10(4): 307-377 (1993).
Высококонцентрированные (например, >100 мг/мл) жидкие составы антител необходимы, например, для таких путей терапевтического введения или терапевтических применений, при которых целесообразны небольшие объемы лекарственного продукта, например, для подкожной инъекции. Тем не менее, высококонцентрированные составы антител связаны с многочисленными сложностями и проблемами. Такой проблемой является нестабильность вследствие образования твердых частиц. В случае восстановленных жидких составов указанная проблема была решена посредством применения поверхностно-активных веществ (например, полисорбата), но поверхностно-активные вещества в некоторых случаях считаются неподходящими для жидких составов, поскольку они осложняют последующую обработку. Более того, поверхностно-активные вещества дополнительно не снижают повышенную вязкость, являющуюся результатом многочисленных межмолекулярных взаимодействий, обусловленных макромолекулярной природой антител.
Хотя было показано, что поверхностно-активные вещества существенно снижают степень образования твердых частиц белков, они не решают проблему повышенной вязкости, которая затрудняет обращение с концентрированными составами антител и их введение. Антитела склонны к образованию вязких растворов при высокой концентрации вследствие своей макромолекулярной природы и способности к межмолекулярным взаимодействиям. Более того, в качестве стабилизаторов зачастую используются фармацевтически приемлемые сахара. Такие сахара могут усиливать межмолекулярные взаимодействия, тем самым увеличивая вязкость состава. Составы с высокой вязкостью трудно произвести, набрать в шприц и ввести подкожно. Приложение усилия в обращении с вязкими составами приводит к избыточному вспениванию, которое может привести к денатурации и инактивации активных биологических средств.
Были описаны определенные составы для высококонцентрированных антител. Смотрите, например, международные патентные публикации №№2006/065746 и 2002/30463. Указанные публикации конкретно не описывают высококонцентрированные антитела к IL13.
Крайне предпочтительно было бы получить составы, содержащие антитело к IL-13, характеризующиеся увеличенной стабильностью и низкой вязкостью при высоких концентрациях антитела. Составы высококонцентрированных антител, характеризующиеся такими свойствами, были бы чрезвычайно предпочтительными для определенных путей введения, например, для подкожного введения. Предусмотренные в настоящем документе составы направлены на решение указанных потребностей и предоставляют другие применимые преимущества.
Все цитируемые в настоящем документе ссылки, включающие в себя патентные заявки и публикации, полностью включены с любой целью посредством ссылки в настоящий документ.
Сущность изобретения
Композиции согласно настоящему изобретению основаны, по меньшей мере частично, на открытии того, что описанное в настоящем документе антитело к IL13 антитело, лебрикизумаб, может быть введено в состав в высокой концентрации (>100 мг/мл) в гистидиновом буфере, содержащем полиол и поверхностно-активное вещество, и что такой состав высококонцентрированных антител характеризуется низкой вязкостью, увеличенной физической и химической стабильностью и сохраняет активность. Композиции или составы согласно настоящему изобретению применимы, например, для лечения бронхиальной астмы и других легочных нарушений, таких как идиопатический фиброз легких и определенные аллергические, аутоиммунные и другие воспалительные нарушения. Кроме того, такой состав может быть упакован в описанные в настоящем документе устройства для подкожного введения с поддержанием, например, стабильности продукта и других требуемых признаков.
Соответственно, согласно одному аспекту предусматривается состав, содержащий антитело к IL13. Согласно определенным вариантам осуществления концентрация антитела в составе составляет по меньшей мере 100 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл. Согласно одному варианту осуществления концентрация антитела составляет 150 мг/мл.
Согласно другому аспекту состав содержит буфер на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ. Согласно определенным вариантам осуществления состав содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ, а концентрация поверхностно-активного вещества в составе составляет 0,01% и 0,1%. Согласно определенным вариантам осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно определенным вариантам осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл или 150 мг/мл. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6.
Согласно другому аспекту состав содержит антитело к IL13 в буфере на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ, и концентрация антитела в составе составляет по меньшей мере 100 мг/мл. Согласно определенным вариантам осуществления состав дополнительно содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ, и концентрация поверхностно-активного вещества в составе составляет 0,01% - 0,1%. Согласно одному варианту осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно одному варианту осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и при этом концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления состав характеризуется вязкостью, составляющей меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл. Согласно одному варианту осуществления концентрация антитела составляет 150 мг/мл.
Согласно другому аспекту предусматривается состав, содержащий антитело к IL-13, характеризующееся увеличенной стабильностью. Согласно определенным вариантам осуществления концентрация антитела составляет по меньшей мере 100 мг/мл, и вязкость составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL-13 является стабильным по меньшей мере в течение одного года при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным по меньшей мере в течение двух лет при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным в течение трех лет при 5°С. Согласно одному варианту осуществления антитело к IL13 является стабильным в течение по меньшей мере четырех недель при 25°С, или по меньшей мере 8 недель при 25°С, или по меньшей мере 12 недель при 25°С, или в течение 26 недель при 4°С. Согласно одному варианту осуществления состав содержит буфер на основе ацетата гистидина, рН 5,4-6,0, и концентрация ацетата гистидина в буфере составляет 5 мМ - 40 мМ. Согласно одному варианту осуществления состав дополнительно содержит полиол и поверхностно-активное вещество, и концентрация полиола в составе составляет 100 мМ - 200 мМ и концентрация поверхностно-активного вещества в составе составляет 0,01% - 0,1%. Согласно одному варианту осуществления полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20. Согласно одному варианту осуществления буфер на основе ацетата гистидина характеризуется рН 5,7, и концентрация ацетата гистидина в буфере составляет 20 мМ, и концентрация сахарозы в составе составляет 175 мМ, и концентрация полисорбата 20 составляет 0,03%. Согласно одному варианту осуществления концентрация антитела составляет 125 мг/мл или 150 мг/мл. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6.
Согласно другому аспекту предусматривается состав, содержащий антитело к IL13, характеризующееся увеличенной стабильностью в буфере на основе 20 мМ ацетата гистидина, рН 5,7, 175 мМ сахарозы, 0,03% полисорбата 20. Согласно одному варианту осуществления концентрация антитела в составе составляет 125 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления концентрация антитела в составе составляет 150 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3, и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
Согласно дополнительному аспекту предусматривается изделие, содержащее устройство для подкожного введения. Согласно определенным вариантам осуществления устройство для подкожного введения доставляет пациенту постоянную дозу антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 37,5 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 75 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 125 мг антитела к IL13. Согласно одному варианту осуществления постоянная доза составляет 150 мг антитела к IL13. Согласно определенным вариантам осуществления антитело к IL13 представляет собой лебрикизумаб. Антитело к IL13 в устройстве для подкожного введения вводят в состав в буфере и других описанных выше вспомогательных веществах так, чтобы оно было предоставлено в стабильном фармацевтическом составе. Согласно определенным вариантам осуществления устройство для подкожного введения представляет собой предварительно наполненный шприц, содержащий стеклянный цилиндр, шток поршня, содержащий ограничитель хода поршня, и иглу. Согласно определенным вариантам осуществления устройство для подкожного введения дополнительно содержит защитный колпачок для иглы и необязательно защитное устройство для иглы. Согласно определенным вариантам осуществления объема состава, содержащегося в предварительно наполненном шприце, составляет 0,3 мл, 1 мл, 1,5 мл или 2,0 мл. Согласно определенным вариантам осуществления игла представляет собой несъемную иглу с типом заточки острия 3В или 5В. Согласно определенным вариантам осуществления игла характеризуется калибром (G) от 25G до 30G и составляет от 1/2 дюйма в длину до 5/8 дюйма в длину. Согласно одному варианту осуществления устройство для подкожного введения содержит предварительно наполненный шприц объемом 1,0 мл из боросиликатного стекла с низким содержанием вольфрама (тип I) и тонкостенную несъемную иглу из нержавеющей стали, калибра 27G, длиной 1/2 дюйма, с типом заточки острия 5В. Согласно определенным вариантам осуществления устройство для подкожного введения содержит твердый защитный колпачок для иглы. Согласно определенным вариантам осуществления твердый защитный колпачок для иглы содержит состав на основе резины с низким содержанием цинка. Согласно одному варианту осуществления защитный колпачок для иглы является твердым и содержит эластомерный компонент, FM27/0, и твердый полипропиленовый защитный колпачок. Согласно определенным вариантам осуществления шток поршня содержит резиновый ограничитель хода поршня. Согласно определенным вариантам осуществления резиновый ограничитель хода поршня содержит в своем составе резину 4023/50 и этилентетрафторэтиленовое (ETFE) покрытие FluroTec®. Согласно определенным вариантам осуществления устройство для подкожного введения содержит защитное устройство для иглы. Иллюстративные защитные устройства для иглы включают в себя без ограничения Ultrasafe Passive® Needle Guard X100L (Safety Syringes, Inc.) и Rexam Safe n SoundTM (Rexam).
Согласно другому аспекту предусматривается способ лечения бронхиальной астмы у пациента. Согласно определенным вариантам осуществления способ предусматривает введение пациенту эффективного количества любого из описанных выше составов. Согласно определенным вариантам осуществления эффективное количество составляет 0,3 мл, 0,5 мл, 1 мл или 2 мл или приблизительно 0,3 мл, приблизительно 0,5 мл, приблизительно 1 мл или приблизительно 2 мл. Согласно другому аспекту предусматривается способ лечения идиопатического фиброза легких у пациента. Согласно определенным вариантам осуществления способ предусматривает введение пациенту эффективного количества любого из описанных выше составов. Согласно определенным вариантам осуществления эффективное количество составляет 0,5 мл, 1 мл или 2 мл, или приблизительно 0,5 мл, приблизительно 1 мл или приблизительно 2 мл.
Согласно другому аспекту предусматриваются способы подкожного введения состава, содержащего антитело к IL13. Такие способы предусматривают подкожное введение любого из описанных выше составов антитела к IL13. Согласно определенным вариантам осуществления способы предусматривают устройство для подкожного введения согласно любому из описанных выше устройств.
Краткое описание чертежей
На фигуре 1 показана скорость деградации мономера антитела к IL13 в неделю в зависимости от рН, как описано в примере 1.
На фигуре 2 показаны показатели увеличения мутности раствора при 350 нм растворов антитела к IL13 в зависимости от рН в ходе хранения при 30°С, как описано в примере 1.
На фигуре 3 показаны изменения низкомолекулярных (LMW) растворимых фрагментов и высокомолекулярных (HMW) агрегатов, измеренные с помощью CE-SDS (капиллярного электрофореза в присутствии додецилсульфата натрия) в невосстанавливающих условиях в ходе хранения при 30°С в зависимости от рН, как описано в примере 1.
На фигуре 4 показаны скорости образования кислотных вариантов (AV) и основного варианта (пик 1) (BV) при 30°С в зависимости от рН, как описано в примере 1. Скорость образования отличающихся зарядом вариантов выражают как отношение %/неделя, показанное на вертикальной оси.
На фигуре 5 показаны скорости образования основного варианта (пик 2) (BV2) и потери главного пика (МР) при 30°С в зависимости от рН, как описано в примере 1. Скорость образования отличающихся зарядом вариантов выражают как отношение %/неделя, показанное на вертикальной оси.
На фигуре 6 показаны реологические характеристики антитела к IL13 в зависимости от концентрации антитела и рН раствора, как описано в примере 1. Вязкость раствора выражают в единицах сантипуаз (сП) при 25°С, показанных на вертикальной оси.
На фигуре 7 показаны реологические характеристики различных моноклональных антител в широком диапазоне концентраций, как описано в примере 1. Вязкость раствора выражают в единицах сантипуаз (сП) при 25°С, показанных на вертикальной оси.
На фигуре 8 показано количественное определение характеристик внешнего вида растворов антитела к IL13 и антитела к CD20 в зависимости от концентрации с использованием нефелометрии под углом 90°, как описано в примере 1.
На фигуре 9 показаны измерения мутности (А350) для растворов антител к IL13 и к CD20 в зависимости от концентрации моноклональных антител (mAb), как описано в примере 1.
На фигуре 10 показана мутность раствора антитела к IL13 в зависимости от концентрации и рН, как описано в примере 1.
На фигуре 11 показано количество невидимых невооруженным глазом твердых частиц в растворах антитела к IL13 и антитела к CD20 в зависимости от концентрации mAb, как описано в примере 1.
На фигуре 12 показаны измерения нефелометрического, турбидиметрического и статического светорассеяния 125 мг/мл раствора антитела к IL13, как описано в примере 1.
На фигуре 13 обобщенно представлена температурная зависимость опалесценции раствора при различных условиях рН для антитела к IL13 в концентрации 125 мг/мл и 204 мг/мл, как описано в примере 1.
На фигуре 14 обобщенно представлены пики температурного перехода плавления, наблюдаемые для двух частично разделенных пиков в капиллярной ДСК (дифференциальной сканирующей калориметрии) в зависимости от композиции состава антитела к IL13 и рН раствора, как описано в примере 1.
На фигуре 15 обобщенно представлены измеренные осмотические вторые вириальные коэффициенты (Вз) для антитела к IL13 в зависимости от рН раствора с образцами в простых буферах, как указано и измерено в диапазоне 0,1-1,0 мг/мл, как описано в примере 1.
На фигуре 16 показаны измеренные осмотические вторые вириальные коэффициенты для антитела к IL13 в зависимости от композиции состава и рН в диапазоне 1,0-10 мг/мл, как описано в примере 1.
На фигуре 17 показана зависимость измеренной интенсивности статического светорассеяния от концентрации для каждого из антитела к IL13 и антитела к CD20 по сравнению с моделью твердой сферы (HS), как описано в примере 1.
На фигуре 18 показаны данные статического светорассеяния для антитела к IL13 в зависимости от рН состава, представленные в виде средних молекулярных масс, наблюдаемых при концентрациях до 200 мг/мл, как описано в примере 1.
На фигуре 19 показаны средние молекулярные массы антител к IL13 и к CD20 в растворе при высоких концентрациях до 200 мг/мл, как описано в примере 1.
На фигуре 20 показана сдвиговая вязкость, измеренная для антитела к IL13 и антитела к CD20 при соответствующих условиях получения состава при 25°С, как описано в примере 1.
Подробное описание изобретения
Если не указано иное, использованные в настоящем документе технические или научные термины имеют такие же значения, которые являются в большинстве случаев понятными для специалиста в настоящей области техники, к которой принадлежит настоящее изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994), and March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992) представляет специалисту в настоящей области техники общее руководство в отношении многих используемых в настоящей заявке терминов.
Некоторые определения
В целях интерпретации настоящего описания будут применяться следующие определения, и используемые в форме единственного числа термины по возможности также будут включать в себя форму множественного числа и наоборот. В том случае, если какое-либо из представленных ниже определений противоречит какому-либо включенному в настоящий документ посредством ссылки документу, представленное ниже определение должно иметь преимущественное значение.
Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на формы множественного числа, если иное не продиктовано контекстом. Таким образом, например, ссылка на "белок" или "антитело" включает в себя многочисленные белки или антитела, соответственно; ссылка на "клетку" включает в себя смеси клеток и подобное.
Термин "фармацевтические состав" относится к препарату, находящемуся в такой форме, которая обеспечивает эффективное проявление биологической активности активного ингредиента, и которая не содержит дополнительных компонентов, являющихся неприемлемо токсическими для субъекта, которому будет введен состав. Такие составы являются стерильными. "Фармацевтически приемлемые" вспомогательные вещества (инертные носители, добавки) представляют собой те, которые могут быть целесообразно введены млекопитающему-субъекту для обеспечения эффективной дозы используемого активного ингредиента.
"Стерильный" состав является асептическим или свободным или по существу свободным от каких-либо живых микроорганизмов и их спор.
"Замороженный" состав представляет собой состав при температуре ниже 0°С. Как правило, замороженный состав не является ни высушенным заморозкой, ни составом, подвергшимся предварительной или последующей лиофилизации. Согласно определенным вариантам осуществления замороженный состав содержит замороженное лекарственное вещество для хранения (в контейнере из нержавеющей стали) или замороженный лекарственный продукт (в конечной форме флакона).
"Стабильный" состав представляет собой состав, в котором белок по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. Согласно определенным вариантам осуществления состав по существу сохраняет свою физическую и химическую стабильность, а также свою биологическую активность при хранении. Период хранения, как правило, выбирают на основании предусмотренного срока годности состава.
Используемый в настоящем документе термин состав с "увеличенной стабильностью" означает состав, в котором белок по существу сохраняет свою физическую стабильность, химическую стабильность и биологическую активность при хранении при 5°С в течение одного года или больше. Согласно определенным вариантам осуществления хранение происходит при 5°С в течение двух лет или больше. Согласно определенным вариантам осуществления хранение происходит при 5°С в течение до трех лет.
Белок "сохраняет свою физическая стабильность" в фармацевтическом составе, если он не демонстрирует никаких признаков агрегации, осаждения и/или денатурации или очень незначительную агрегацию, осаждение и/или денатурацию при визуальном исследовании цвета и/или прозрачности, или что измеряют с помощью УФ светорассеяния или эксклюзионной хроматографии.
Белок "сохраняет свою химическую стабильность" в фармацевтическом составе, если химическая стабильность в указанный момент времени является такой, чтобы белок рассматривался как все еще сохраняющий свою биологическую активность, определенную ниже. Химическую стабильность можно оценить путем обнаружения и количественного определения химически измененных форм белка. Химическое изменение может включать в себя модификацию размера (например, усечение), которую можно оценить с использованием, например, эксклюзионной хроматографии, SDS-PAGE (электрофореза в полиакриламидном геле с использованием додецилсульфата натрия) и/или ионизации лазерной десорбцией с использованием матрицы/времяпролетной масс-спектрометрии (MALDI/TOF MS). Другие типы химического изменения включают в себя изменение заряда (например, возникающее в результате деамидирования), которое можно оценить, например, с помощью ионообменной хроматографии или капиллярного изоэлектрического фокусирования (icIEF).
Антитело "сохраняет свою биологическую активность" в фармацевтическом составе, если биологическая активность антитела в указанный момент времени находится в пределах приблизительно 10% (в пределах ошибок при анализе) от биологической активности, проявляемой в момент времени, когда был получен фармацевтический состав, что определяют, например, в анализе связывания антигена или анализе эффективности.
В настоящем документе термин "биологическая активность" моноклонального антитела относится к способности антитела связываться с антигеном. Термин может дополнительно включать в себя связывание антитела с антигеном и являющийся результатом этого измеряемый биологический ответ, который может быть измерен in vitro или in vivo. Такая активность может являться антагонистической или агонистической.
"Деамидированное" моноклональное антитело представляет собой моноклональное антитело, в котором один или несколько аспарагиновых остатков были дериватизированы, например, до аспарагиновой кислоты или изоаспарагиновой кислоты.
Антитело, которое является "подверженным деамидированию", представляет собой антитело, содержащее один или несколько остатков, которые, как было обнаружено, предрасположены к деамидированию.
Антитело, которое является "подверженным агрегации", представляет собой антитело, которое, как было показано, агрегирует с другой(ими) молекулой(ами) антитела, особенно при замораживании и/или перемешивании.
Антитело, которое является "подверженным фрагментации", представляет собой антитело, которое, как было показано, расщепляется на два или больше фрагментов, например, в его шарнирной области.
Под "снижением деамидирования, агрегации или фрагментации" подразумевается предотвращение или снижение уровня деамидирования, агрегации или фрагментации относительно моноклонального антитела, введенного в состав при другом значении рН или в другом буфере.
Антитело, которое вводят в состав, является по существу чистым и желательно по существу гомогенным (например, не содержащим белки-примеси и т.д.). "По существу чистое" антитело означает композицию, содержащую по меньшей мере приблизительно 90% по весу антитела, из расчета общего веса композиции, или по меньшей мере приблизительно 95% по весу. "По существу гомогенное" антитело означает композицию, содержащие по меньшей мере приблизительно 99% по весу антитела, из расчета общего веса композиции.
Под термином "изотонический" подразумевают, что представляющий интерес состав характеризуется по существу таким же осмотическим давлением, как и кровь человека. Изотонические составы, как правило, будут характеризоваться осмотическим давлением приблизительно 250-350 мОсм. Изотоничность можно измерить, например, с использованием парового или криоскопического осмометра.
Используемый в настоящем документе термин "буфер" относится к забуференному раствору, который препятствует изменениям в рН за счет действия своих компонентов кислотно-основных конъюгатов.
"Гистидиновый буфер" представляет собой буфер, содержащий ионы гистидина. Примеры гистидиновых буферов включают в себя хлорид гистидина, ацетат гистидина, фосфат гистидина, сульфат гистидина, сукцинат гистидина и т.д. Согласно одному варианту осуществления гистидиновый буфер представляет собой ацетат гистидина. Согласно одному варианту осуществления буфер на основе ацетата гистидина получают путем титрования L-гистидина (свободным основанием, твердым веществом) с уксусной кислотой (жидкостью). Согласно определенным вариантам осуществления гистидиновый буфер или буфер на основе ацетата гистидина характеризуется рН 4,5-6,5. Согласно определенным вариантам осуществления гистидиновый буфер или буфер на основе ацетата гистидина характеризуется рН 5,4-6,0. Согласно одному варианту осуществления буфер характеризуется рН 5,6. Согласно одному варианту осуществления буфер характеризуется рН 5,7. Согласно одному варианту осуществления буфер характеризуется рН 5,8.
В настоящем документе "поверхностно-активное вещество" относится к поверхностно-активному средству, как правило, неионному поверхностно-активному веществу. Примеры поверхностно-активных веществ в настоящем документе включают в себя полисорбат (например, полисорбат 20 и полисорбат 80); полоксамер (например, полоксамер 188); тритон; додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарил-сульфобетаин; лаурил-, миристил-, линолеил- или стеарил-саркозин; линолеил-, миристил- или цетил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропил-диметиламин; натрийметилкокоил- или динатрийметилолеил-таурат; и серия MONAQUAT™ (Mona Industries, Inc., Paterson, N.J.); полиэтилгликоль, полипропилгликоль и сополимеры этиленгликоля и пропиленгликоля (например, плюроники, PF68 и т.д.); и т.д. Согласно одному варианту осуществления поверхностно-активное вещество представляет собой полисорбат 20.
"Консервант" представляет собой соединение, которое может быть необязательно включено в состав для существенного снижения деятельности в нем бактерий, таким образом, облегчая получение, например, состава для многократного использования. Примеры возможных консервантов включают в себя октадецилдиметилбензиламмонийхлорид, гексаметонийхлорид, бензалконийхлорид (смесь алкилбензилдиметиламмонийхлоридов, в которых алкильные группы представляют собой соединения с длинной цепью) и бензетонийхлорид. Другие типы консервантов включают в себя такие ароматические спирты, как фенольный, бутиловый и бензиловый спирт, такие алкилпарабены, как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и m-крезол. Согласно одному варианту осуществления консервант в настоящем документе представляет собой бензиловый спирт.
"Полиол" представляет собой вещество с многочисленными гидроксильными группами и включает в себя сахара (восстанавливающие и невосстанавливающие сахара), сахарные спирты и сахарные кислоты. Полиол может быть необязательно включен в состав. Согласно определенным вариантам осуществления полиолы в настоящем документе характеризуются молекулярной массой, составляющей меньше чем приблизительно 600 кДа (например, в диапазоне от приблизительно 120 до приблизительно 400 кДа). "Восстанавливающий сахар" представляет собой сахар, который содержит гемиацетальную группу, которая может восстанавливать ионы металла или ковалентно реагировать с лизином и другими аминогруппами в белках, а "невосстанавливающий сахар" представляет собой сахар, у которого нет описанных свойств восстанавливающего сахара. Примеры восстанавливающих Сахаров представляют собой фруктозу, маннозу, мальтозу, лактозу, арабинозу, ксилозу, рибозу, рамнозу, галактозу и глюкозу. Невосстанавливающие сахара включают в себя сахарозу, трегалозу, сорбозу, мелезитозу и раффинозу. Маннит, ксилит, эритрит, треит, сорбит и глицерин представляют собой примеры сахарных спиртов. В отношении сахарных кислот, они включают в себя L-глюконат и его металлические соли. Если необходимо, чтобы состав был стабилен при замораживании-оттаивании, полиол, как правило, представляет собой полиол, который не кристаллизируется при температурах замораживания (например, -200°С), в результате чего он дестабилизирует антитело в составе. Согласно одному варианту осуществления полиол представляет собой невосстанавливающий сахар. Согласно одному такому варианту осуществления невосстанавливающий сахар представляет собой сахарозу.
Используемый в настоящем документе термин "бронхиальная астма" относится к сложному нарушению, характеризующемуся изменчивыми и повторяющимися симптомами, обратимой (например, с помощью бронходилататора) обструкцией дыхательных путей и гиперреактивностью бронхов, которая может быть связана с предрасполагающим воспалением или не связана с ним. Примеры бронхиальной астмы включают в себя чувствительную к аспирину/вызванную аспирином бронхиальную астму, атопическую бронхиальную астму, тяжелую бронхиальную астму, легкую бронхиальную астму, бронхиальную астму в средней - тяжелой форме, кортикостероидную нативную бронхиальную астму, хроническую бронхиальную астму, устойчивую к кортикостероидам бронхиальную астму, рефракторную к кортикостероидам бронхиальную астму, недавно диагностированную и нелеченную бронхиальную астму, бронхиальную астму вследствие курения, бронхиальную астму, не поддающуюся контролю с помощью кортикостероидов и другие виды бронхиальной астмы, упомянутые в J Allergy Clin Immunol (2010) 126(5): 926-938.
Используемый в настоящем документе термин "лечение" относится к клиническому вмешательству в попытке изменить естественное течение жизни подлежащего лечению индивидуума, и может быть проведено либо до, либо при развитии клинической патологии. Требуемые эффекты лечения включают в себя без ограничения профилактику возникновения или рецидива заболевания или его состояния или симптома, облегчение состояния или симптома заболевания, снижение любых прямых или косвенных патологических последствий заболевания, снижение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и достижение ремиссии или улучшение прогноза.
"Эффективное количество" средства относится к количеству, эффективному для достижения требуемого терапевтического или профилактического результата, в необходимых дозах и в течение необходимых периодов времени. "Терапевтически эффективное количество" терапевтического средства может варьировать в зависимости от таких факторов, как болезненное состояние, возраст, пол и масса тела индивидуума и способности антитела вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, в котором благоприятные эффекты преобладают над любыми токсическими или неблагоприятными эффектами терапевтического средства.
"Индивидуум", "субъект" или "пациент" представляет собой позвоночное. Согласно определенным вариантам осуществления позвоночное представляет собой млекопитающее. Млекопитающие включают в себя без ограничения приматов (включая в себя людей и не относящихся к человеку приматов) и грызунов (например, мышей и крыс). Согласно определенным вариантам осуществления млекопитающее представляет собой человека.
"Медикамент" представляет собой активное лекарственное средство для лечения заболевания, нарушения и/или состояния.
"Антитела" (Ab) и "иммуноглобулины" (Ig) относятся к гликопротеинам со сходными структурными характеристиками. При этом антитела проявляют связывающую специфичность по отношению к специфическому антигену, а иммуноглобулины включают в себя как антитела, так и другие антителоподобные молекулы, у которых, как правило, отсутствует антигенная специфичность. Полипептиды последнего типа, например, производятся на низких уровнях лимфатической системой и на высоких уровнях миеломами.
Термины "антитело" и "иммуноглобулин" используются взаимозаменяемо в самом широком смысле и включают в себя моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, моновалентные антитела, мультивалентные антитела, мультиспецифические антитела (например, биспецифические антитела при условии, что они проявляют необходимую биологическую активность) и могут также включать в себя определенные фрагменты антител (подробнее описанные в настоящем документе). Антитело может быть химерным, человеческим, гуманизированным и/или представлять собой антитело с созревшей аффинностью.
Термины "полноразмерное антитело", "интактное антитело" и "полное антитело" используются в настоящем документе взаимозаменяемо для обозначения антитела в своей по существу интактной форме, а не для обозначения фрагментов антител, описанных ниже. В частности, термины относятся к антителу с тяжелыми цепями, которые содержат Fc-область.
Термин "фрагмент антитела" содержит часть интактного антитела, предпочтительно содержащую его антигенсвязывающую область. Примеры фрагменты антител включают в себя без ограничения фрагменты Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител; и образованные из фрагментов антител мультиспецифические антитела.
Обработка антител папаином дает в результате два идентичных антигенсвязывающих фрагмента, имеющих название "Fab"-фрагменты, каждый с одним антигенсвязывающим сайтом, и оставшийся "Fc"-фрагмент, чье название отражает его способность легко кристаллизироваться. Обработка пепсином дает в результате F(ab')2-фрагмент, который содержит два антигенкомбинирующих сайта и все еще способен к перекрестному связыванию с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенсвязывающий сайт. Согласно одному варианту осуществления двухцепочечные Fv-фрагменты состоят из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесном, нековалентном соединении. Совместно шесть CDR из Fv обеспечивают антигенсвязывающую специфичность антителу. Тем не менее, даже отдельный вариабельный домен (или половина Fv, содержащая только три CDR, специфических для антигена) характеризуется способностью распознавать и связывать антиген, хотя и с меньшей аффинностью, чем полный сайт связывания.
Fab-фрагмент содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов вставкой нескольких остатков на карбокси-конце СН1-домена тяжелой цепи, включающей в себя один или несколько цистеиновых остатков из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение для Fab', в котором остаток(ки) цистеина константных доменов несут свободную тиольную группу. F(ab')2-фрагменты антитела изначально получали в виде пар Fab'-фрагментов с шарнирными цистеинами между ними. Также известны другие химические способы связывания фрагментов антитела.
Используемый в настоящем документе термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных, например, встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Таким образом, определение "моноклональное" указывает на характер антитела как не являющегося смесью отдельных антител. Согласно определенным вариантам осуществления такое моноклональное антитело, как правило, включает в себя антитело, содержащее полипептидную последовательность, которая связывается с мишенью, причем связывающую мишень полипептидную последовательность получают с помощью способа, который предусматривает отбор одной связывающейся с мишенью полипептидной последовательности из множества полипептидных последовательностей. Например, способ отбора может представлять собой отбор уникального клона из множества таких клонов, как пул гибридомных клонов, фаговых клонов или клонов рекомбинантной ДНК. Следует понимать, что выбранная связывающаяся с мишенью последовательность может быть дополнительно изменена, например, для улучшения аффинности к мишени, для гуманизации связывающейся с мишенью последовательности, для улучшения ее продукции в клеточной культуре, для снижения ее иммуногенности in vivo, для получения мультиспецифического антитела и т.д., и что антитело, содержащее измененную связывающуюся с мишенью последовательность, также представляет собой моноклональное антитело согласно настоящему изобретению. В отличие от препаратов поликлональных антител, которые, как правило, включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против одной детерминанты на антигене. Кроме их специфичности, препараты моноклональных антител являются предпочтительными в том отношении, что они, как правило, не содержат примесей других иммуноглобулинов.
Определение "моноклональное" указывает на характер антитела как антитела, полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, подлежащие использованию согласно настоящему изобретению моноклональные антитела могут быть получены с помощью разнообразных техник, предусматривающих, например, способ на основе гибридом (например, Kohler et al., Nature, 256: 495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., в: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способы на основе рекомбинантной ДНК (смотрите, например, патент США №4816567), технологии на основе фагового дисплея (смотрите, например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immmol. Methods 284(1-2): 119-132(2004) и технологии получения человеческих или человекоподобных антител в животных, которые содержат части или все локусы иммуноглобулина человека или гены, кодирующие последовательности иммуноглобулина человека (смотрите, например, международные патентные публикации WO 98/24893; WO 96/34096; WO 96/33735; WO 91/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7: 33 (1993); патенты США №№5545807; 5545806; 5569825; 5625126; 5633425; 5661016; Marks et al., Bio. Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Моноклональные антитела в настоящем документе, в частности, включают в себя "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида, или принадлежащих конкретному классу или подклассу антител, наряду с тем, что оставшаяся(иеся) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям в антителах, полученных из другого вида, или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют необходимую биологическую активность (патент США №4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6855-9855 (1984)).
"Нативные антитела" относятся к встречающимся в природе молекулам иммуноглобулина с различными структурами. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины, составляющие приблизительно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными связями. От N- к С-концу, каждая тяжелая цепь содержит вариабельную область (VH), также имеющую название вариабельный тяжелый домен или вариабельный домен тяжелой цепи, за которым следует три константных домена (СН1, СН2 и СН3). Аналогично, от N- к С-концу, каждая легкая цепь содержит вариабельную область (VL), также называемую вариабельный легкий домен или вариабельный домен легкой цепи, за которым следует константный легкий домен (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, имеющих название каппа (κ) и лямбда (λ), на основании аминокислотной последовательности ее константного домена.
Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, характеризуются сходными структурами, причем каждый домен содержит четыре консервативных каркасных области (FR) и три гипервариабельных области (HVR). (Смотрите, например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Один домен VH или VL может быть достаточным для обеспечения антигенсвязывающей специфичности. Более того, антитела, связывающие конкретный антиген, могут быть выделены с использованием домена VH или VL из антитела, которое связывает антиген, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. Смотрите, например, Portolano et al., J. Immunol, 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из не относящихся к человеку HVR и аминокислотные остатки из FR человека. Согласно определенным вариантам осуществления гуманизированное антитело будет содержать по существу все по меньшей мере из одного и, как правило, двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют HVR у не относящегося к человеку антитела, и все или по существу все FR соответствуют FR у антитела человека. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из антитела человека. "Гуманизированная форма" антитела, например, не относящегося к человеку антитела, относится к антителу, которое подверглось гуманизации.
Используемый в настоящем документе термин "гипервариабельная область", или "HVR,", относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или образуют структурно определенные петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, H2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из "определяющих комплементарность областей" (CDR), причем последние характеризуются самой высокой вариабельностью последовательности и/или вовлечены в распознавание антигена. Иллюстративные гипервариабельные петли находятся на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (Н3). (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987).) Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) находятся на аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35В в H1, 50-65 в H2, и 95-102 в Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).) За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат "определяющие специфичность остатки", или "SDR", которые представляют собой остатки, которые контактируют с антигеном. SDR содержатся в областях CDR, имеющих название сокращенные-CDR, или a-CDR. Иллюстративные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-Н3) находятся на аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35В в H1, 50-58 в H2 и 95-102 в Н3. (Смотрите Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008).) Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, FR-остатки) нумеруют в настоящем документе согласно Kabat et al., ранее.
"Антитело человека" представляет собой антитело, которое содержит аминокислотную последовательность, соответствующую таковой у антитела, произведенного человеком и/или полученного с использованием любой из раскрытых в настоящем документе техник для получения человеческих антител. Такие техники включают в себя скрининг таких полученных от человека комбинаторных библиотек, как библиотеки фагового дисплея (смотрите, например. Marks et al., J. Mol. Biol., 222: 581-597 (1991) и Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991)); использование клеточных линий миеломы человека и мышино-человеческих гетеромиеломных клеточных линий для получения моноклональных антител человека (смотрите, например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.55-93 (Marcel Dekker, Inc., New York, 1987); и Boemer et al., J. Immunol., 147: 86 (1991)); и получение моноклональных антител в трансгенных животных (например, мышах), которые способны производить полный репертуар человеческих антител при отсутствии продукции эндогенных иммуноглобулинов (смотрите, например, Jakobovits et al., Proc. Natl. Acad. Sci USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255 (1993); Bruggermann et al., Year in Immunol., 1: 33 (1993)). Указанное определение антитела человека специально исключает гуманизированное антитело, содержащее антигенсвязывающие остатки от не относящиеся к человеку животного.
Антитело "с созревшей аффинностью" относится к антителу с одним или несколькими изменениями в одной или нескольких CDR в нем, приводящими к улучшению аффинности антитела к антигену, по сравнению с исходным антителом, которое не обладает таким(и) изменением(ями). Согласно одному варианту осуществления антитело с созревшей аффинностью характеризуется наномолярными или даже пикомолярными аффинностями к целевому антигену. Антитела с созревшей аффинностью получают с помощью известных в настоящей области техники процедур. В статье Marks et al, Bio/Technology 10: 779-783 (1992) описано созревание аффинности с помощью перестановки доменов VH и VL. Случайный мутагенез HVR и/или каркасных остатков описан в: Barbas et al. Proc Nat. Acad. Sci. USA 91: 3809-3813 (1994); Schier et al. Gene 169: 147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226: 889-896 (1992).
"Блокирующее антитело" или "антитело-антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. Определенные блокирующие антитела или антитела-антагонисты частично или полностью ингибируют биологическую активность антигена.
Термин "класс" антитела относится к типу константного домена или константной области, который содержится в его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются а, δ, ε, γ и μ, соответственно.
Используемый в настоящем документе термин "антитело к IL13", также имеющее название лебрикизумаб, означает гуманизированное антитело IgG4, которое связывается с IL13 человека. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2) и CDR-H3 (SEQ ID NO.; 3). Согласно одному варианту осуществления антитело к IL13 содержит три CDR легкой цепи, CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5), и CDR-L3 (SEQ ID NO.: 6). Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи и три CDR легкой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2), CDR-H3 (SEQ ID NO.: 3), CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5), и CDR-L3 (SEQ ID NO.: 6). Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи, VH, с аминокислотной последовательностью, выбранной из SEQ ID NO. 7 и 8. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи, VL, с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи, VH, с аминокислотной последовательностью, выбранной из SEQ ID NO. 7 и 8, и вариабельную область легкой цепи, VL, с аминокислотной последовательность SEQ ID N0.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 или SEQ ID NO.: 11 или SEQ ID NO.: 12 или SEQ ID NO.: 13. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID N0.: 14. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью, выбранной из SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, и SEQ ID NO.: 13, и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Антитела к IL13 дополнительно описаны в международной патентной публикации №2005/062967.
"Выделенная" биологическая молекула, такая как нуклеиновая кислота, полипептид или антитело, представляет собой биологическую молекулу, которая была идентифицирована и отделена и/или извлечена по меньшей мере из одного компонента ее естественного окружения.
Ссылка на "приблизительно" в отношении значения или параметра в настоящем документе включает в себя (и описывает) варианты осуществления, которые направлены на указанное значение или параметр как таковой. Например, описание, относящееся к "приблизительно X", включает в себя описание "X."
Термин "устройство для подкожного введения" относится к устройству, которое приспособлено или разработано для введения лекарственного средства, например, терапевтического антитела, или фармацевтического состава подкожным путем. Иллюстративные устройства для подкожного введения включают в себя без ограничения шприц, включающий в себя предварительно наполненный шприц, устройство для инъекции, инфузионный насос, шприц-ручку, безыгольное устройство и аппликационную систему доставки. Устройство для подкожного введения вводит определенный объем фармацевтического состава, например, приблизительно 1,0 мл, приблизительно 1.25 мл, приблизительно 1,5 мл, приблизительно 1,75 мл или приблизительно 2,0 мл.
Используемый термин "листок-вкладыш" или этикетка относится к инструкциям, обычно вкладываемым в коммерческие упаковки терапевтических продуктов или лекарственных средств, которые содержат информацию о показаниях, применении, дозировании, введении, противопоказаниях, других терапевтических продуктах, подлежащих комбинации с продуктом из упаковки, и/или предупреждениях, касающихся применения таких терапевтических продуктов или лекарственных средств и т.д.
"Набор" представляет собой любое изделие (например, упаковку или контейнер), содержащее по меньшей мере один реагент, например, лекарственное средство для лечения бронхиальной астмы или другого легочного нарушения. Согласно определенным вариантам осуществления стимулируют продвижение изделия, распространяют или продают изделие в виде единого компонента для проведения способов по настоящему изобретению.
"Целевая аудитория" представляет собой группу людей или учреждение, по отношению к которым или к которой проводят стимулирование продвижения конкретного лекарственного средства или предусмотрено такое стимулирование, например, с помощью маркетинга или рекламы, особенно для конкретных применений, способов лечения или назначений, например, отдельные пациенты, совокупность пациентов, читатели газет, медицинской литературы и журналов, телезрители или Интернет-пользователи, радиослушатели или интернет-слушатели, врачи, фармацевтические компании и т.д.
Термин "образец сыворотки" относится к любому образцу сыворотки, полученному от индивидуума. Способы получения сывороток от млекопитающих хорошо известны в настоящей области техники.
Термин "цельная кровь" относится к любому образцу цельной крови, полученному от индивидуума. Как правило, цельная кровь содержит все компоненты крови, например, клеточные компоненты и плазму. Способы получения цельной крови от млекопитающих хорошо известны в настоящей области техники.
"Количество" или "уровень" биомаркера, связанного с увеличенной клинической эффективностью для пациента, страдающего от определенного заболевания или нарушения, или прогностического в отношении ответа на конкретное терапевтическое средство или схему лечения, представляет собой обнаруживаемый уровень в биологическом образце. Эти показатели можно измерить способами, известными специалисту в настоящей области техники, а также раскрытыми в настоящем документе. Оцененный уровень экспрессии или количество биомаркера может использоваться для определения ответа или ожидаемого ответа на лечение или терапевтическое средство.
Термин "уровень экспрессии", как правило, относится к количеству аминокислотного продукта или белка в биологическом образце. "Экспрессия", как правило, относится к процессу, посредством которого кодируемая генами информация превращается в структуры, присутствующие и функционирующие в клетке. Следовательно, используемый в настоящем документе термин "экспрессия" гена может относиться к транскрипции в полинуклеотид, трансляции в белок или даже посттрансляционной модификации белка.
Бронхиальная астма и другие заболевания легких и определенные аллергические, аутоиммунные и другие воспалительные заболевания
Бронхиальную астму описывают как хроническое заболевание легких, которое включает в себя воспаление, гиперреактивность и обструкцию дыхательных путей. Физиологически гиперреактивность дыхательных путей подтверждается сниженным потоком воздуха в бронхах после бронхопровокационной пробы с помощью метахолина или гистамина. Другие триггеры, которые провоцируют обструкцию дыхательных путей, включают в себя холодный воздух, физические упражнения, вирусную инфекцию верхних дыхательных путей, сигаретный дым и респираторные аллергены. Бронхиальная провокационная проба с помощью аллергена вызывает немедленное опосредованное иммуноглобулином Е (IgE) заболевание ранней фазы в бронхиальных дыхательных путях, за которым у многих пациентов следует опосредованная IgE реакция поздней фазы со снижением потока воздуха в бронхах в течение 4-8 часов. Ранний ответ вызван острым высвобождением таких воспалительных веществ, как гистамин, PGD¬2¬, лейкотриен, триптаза и фактор активации тромбоцитов (PAF), тогда как поздний ответ вызван de novo синтезированными провоспалительными цитокинами (например, TNFα, IL4, IL13) и хемокинами (например, МСР-1 и MIP-1α) (Busse et al. In: Allergy: Principles and Practice, Ed. Middleston, 1173 (1998)). У страдающих хронической бронхиальной астмой пациентов персистирующие легочные симптомы опосредованы повышенной реакцией Th2-клеток. Полагают, что Th2-цитокины играют жизненно важную роль в заболевании (Larche et al., J. Allergy Clin. Immunol., 111: 450 (2003)), в частности, IL13 и IL4 производятся Th2-клетками с NK-фенотипом (NKT) в дыхательных путях, как показано в модели бронхиальной астмы у грызунов (Akbari et al., Nature Med., 9: 582 (2003)). Макропатология астматических дыхательных путей проявляется в гиперинфляции легких, гипертрофии гладких мышц, утолщении ретикулярного слоя, отеке слизистой оболочки, отторжении эпителиальных клеток, разрушении клеток реснитчатого эпителия и гиперсекреции слизистых желез. На микроскопическом уровне бронхиальная астма характеризуется присутствием повышенных количеств эозинофилов, нейтрофилов, лимфоцитов и плазмоцитов в бронхиальных тканях, бронхиальных секретах и слизи. Сначала происходит рекрутинг лейкоцитов из кровотока в дыхательные пути с помощью активированных CD4+ Т-лимфоцитов. Активированные Т-лимфоциты также управляют высвобождением медиаторов воспаления из эозинофилов, тучных клеток и лимфоцитов. Кроме того, Th2-клетки производят IL4, IL5, IL9 и IL13. IL4 совместно с IL13 передает сигнал о переключении с IgM на IgE-антитела.
Перекрестное сшивание мембраносвязанных молекул IgE аллергеном приводит к дегрануляции тучных клеток, высвобождению гистамина, лейкотриенов и других медиаторов, которые удерживают воспаление дыхательных путей. IL5 активирует рекрутинг и активацию эозинофилов. Активированные тучные клетки и эозинофилы также производят свои цитокины, которые содействуют сохранению воспаления. Эти повторяющиеся циклы воспаления в легких с повреждением тканей легких с последующим восстановлением могут приводить к долговременным структурным изменениям ("ремоделированию") дыхательных путей.
Бронхиальную астму средней тяжести в настоящее время лечат с помощью ежедневного ингалируемого противовоспалительного кортикостероида или такого ингибитора тучных клеток, как кромолин натрия или недокромил вместе с ингалируемым бета-2-агонистом при необходимости (3-4 раза в день) для облегчения симптомов приступа или вызванной аллергеном или упражнениями бронхиальной астмы. Кромолин натрия и недокромил блокируют бронхоспазм и воспаление, но указанные лекарственные средства, как правило, эффективны только для бронхиальной астмы, которая связана с аллергенами или физическими упражнениями и, как правило, только для страдающих астмой подростков. Ингалируемые кортикостероиды улучшают воспаление, гиперреактивность и обструкцию дыхательных путей и снижают количество острых приступов. Тем не менее, необходим по меньшей мере месяц до того, как эффекты станут видимыми и до одного года для того, чтобы произошло существенное улучшение. Наиболее частые побочные эффекты представляют собой охриплость и грибковая инфекция ротовой полости, т.е. кандидоз. Сообщалось о более серьезных побочных эффектах, например, частичной адренальной супрессии, ингибировании роста и сниженном формировании костей, но только при применении высоких доз. Беклометазон, триамцинолон и флунизолид, вероятно, характеризуются аналогичной эффективностью; тогда как будесонид и флутиказон являются более эффективными и по имеющимся данным характеризуются меньшими системными побочными эффектами.
Даже пациенты с легкой формой заболевания демонстрируют воспаление дыхательных путей, включающее в себя инфильтрацию слизи и эпителия с активированными Т-клетками, тучными клетками и эозинофилами. Т-клетки и тучные клетки высвобождают цитокины, стимулирующие рост и созревание эозинофилов и продукцию антител IgE, и они, в свою очередь, увеличивают проницаемость капилляров, разрушают эпителий и стимулируют нейронные рефлексы и слизисто-секреторные железы. Результатом является гиперреактивность дыхательных путей, бронхоконстрикция и гиперсекреция, которые проявляются в свистящем дыхании, кашле и одышке.
Традиционно бронхиальную астму лечили пероральными и ингалируемыми бронходилататорами. Эти средства помогают снять симптомы бронхиальной астмы, но никак не воздействуют на лежащее в их основе воспаление. Признание в последние десять лет важности воспаления в этиологии бронхиальной астмы привело к увеличенному использованию кортикостероидов, но многие пациенты продолжают страдать от неконтролируемой бронхиальной астмы.
Кроме бронхиальной астмы, другие заболевания, которые можно лечить составами согласно настоящим изобретениям, включают в себя аллергию, аутоиммунное заболевание или другие воспалительные заболевания. Другие аллергические заболевания включают в себя аллергический ринит, атопический дерматит, пищевую аллергию и крапивницу; иммунноопосредованные кожные заболевания включают в себя буллезные кожные заболевания, мультиформную эритему и контактный дерматит; аутоиммунное заболевание включает в себя псориаз, ревматоидный артрит, ювенильный хронический артрит; воспалительное заболевание кишечника (т.е. язвенный колит, болезнь Крона); другие связанные с IL13 заболевания, включают в себя идиопатическую интерстициальную пневмонию, метаплазию бакаловидных клеток, такие воспалительные и фиброзные заболевания легких, как кистозный фиброз, глютензависимая энтеропатия и болезнь Уиппла; такие иммунологические заболевания легких, как эозинофильная пневмония, идиопатический фиброз легких и гиперчувствительный пневмонит; хроническое обструктивное легочное заболевание, инфекция РСВ (респираторно-синцитиальный вирус), увеит, склеродермия, остеопороз и лимфома Ходжкина.
Идиопатический фиброз легких (IPF) представляет собой нарушение, подлежащее лечению составами согласно настоящему изобретению. IPF представляет собой рестриктивное легочное заболевание, характеризующееся прогрессирующим интерстициальным фиброзом паренхимы легких, поражающее приблизительно 100000 больных в США (Raghu et al., Am J Respir Crit Care Med 174: 810-816 (2006)). Указанный интерстициальный фиброз, связанный с IPF, приводит к прогрессирующей потере функции легких, приводящей к смерти вследствие дыхательной недостаточности у большинства пациентов. Медиана выживаемости с момента постановки диагноза составляет 2-3 лет (Raghu et al., Am J Respir Crit Care Med 183: 788-824 (2011)). Этиология и ключевые молекулярные и патофизиологические стимулирующие факторы IPF являются неизвестными. Единственным видом лечения, показавшим пролонгированную выживаемость у пациентов с IPF, является трансплантация легких (Thabut et al., Annals of internal medicine 151: 767-774 (2009)). Тем не менее, трансплантация легких сопровождается значительной патологией, не все пациенты с IPF представляют собой подходящих кандидатов для трансплантации легких, также имеет место относительная нехватка подходящих легких от доноров. Несмотря на многочисленные попытки на сегодняшний день ни один вид легочной терапии не продемонстрировал существенно пролонгированную выживаемость в рандомизированном, плацебо-контролируемом интервенционном испытании у пациентов с IPF, хотя некоторые терапевтические воздействия, как оказалось, замедлили скорость снижения легочной функции у некоторых пациентов (Raghu et al., Am JRespir Crit Care Med 183: 788-824 (2011); Richeldi et al., The New England J. of Med. 365: 1079-1087 (2011)).
Хотя прогноз для всех пациентов с IPF является неблагоприятным, в развитии заболевания проявляется значительная гетерогенность (Raghu et al., Am J Respir Crit Care Med 183: 788-824 (2011)). Некоторые пациенты проявляют относительно медленное течение, утрачивая функцию легких с относительно постоянной скоростью в течение до 10 лет или больше, наряду с тем, что другие пациенты испытывают более быстрое снижение функции легких, умирая в течение года или двух после постановки диагноза. Кроме того, некоторые пациенты страдают от острых приступов заболевания, как правило, характеризующихся внезапным резким снижением легочной функции. Как правило, эти пациенты не полностью восстанавливаются после острого приступа и зачастую умирают в течение приступа или вскоре после него. Указанная гетерогенность в развитии заболевания указывает на то, что различные пациенты с IPF могут характеризоваться различными патофизиологическими факторами, лежащими в основе своего заболевания, которые могут быть в различной степени чувствительными к таким молекулярно-нацеленным терапевтическим средствам, как составы согласно настоящему изобретению.
Эозинофильное воспаление связано с разнообразными болезнями, как аллергическими, так и неаллергическими (Gonlugur (2006) Immunol. Invest. 35(1): 29-45). Воспаление представляет собой регенеративный ответ живой ткани на повреждение. Характеристикой воспалительных реакций является накопление лейкоцитов в поврежденной ткани под действием определенных химических средств, производимых в самой ткани. Эозинофильные лейкоциты накапливаются при большом разнообразии состояний, таких как аллергические нарушения, гельминтные инфекции и новообразования (Kudlacz et al., (2002) Inflammation 26: 111-119). Эозинофильные лейкоциты, компонент иммунной системы, представляют собой защитные элементы слизистых поверхностей. Они реагируют не только на антигены, но и на паразитов, химические соединения и травму.
Тканевая эозинофилия имеет место при таких кожных заболеваниях, как экзема, пузырчатка обыкновенная, острая крапивница и токсический эпидермальный некролиз, а также при атопическом дерматите ([Rzany et al., 1996]). Эозинофилы накапливаются в ткани и пустых белковых гранулах при опосредованных IgE аллергических кожных реакциях ([Nielsen et al., 2001]). Эозинофилы совместно с тучными клетками, вероятно, вызывают воспаление суставов (Miossec et al., 1997). Эозинофильное воспаление в некоторых случаях сопровождает травму сустава. Эозинофилия синовиальной жидкости может быть связана с такими заболеваниями, как ревматоидный артрит, паразитарное заболевание, гиперэозинофильный синдром, боррелиоз Лайма и аллергические процессы, а также с гемартрозом и артрографией ([Atanes et al., 1996]). Эозинофильное воспаление также может поражать кости ([Yetiser et al., 2002]). Примеры эозинофильного заболевания мышц включают в себя эозинофильный перимиозит, эозинофильный полимиозит и фокальный эозинофильный миозит ([Lakhanpal et al., 1988]). Поражающие скелетные мышцы эозинофильные воспаления могут быть связаны с паразитарными инфекциями или лекарственными средствами или признаками некоторых системных нарушений гиперэозинофилии (например, идиопатического гиперэозинофильного синдрома и синдрома эозинофилии-миалгии. Эозинофилы участвуют в воспалительном ответе на эпитопы, распознаваемые аутоиммунными антителами ([Engineer et al., 2001]). Заболевания соединительной ткани могут приводить к нейтрофильным, эозинофильным или лимфоцитарным воспалениям сосудов ([Chen et al., 1996]). Эозинофилия тканей и периферической крови может происходить при активных ревматических заболеваниях. Повышение уровней ЕСР в сыворотке при анкилозирующем спондилите, разновидности заболевания соединительной ткани, указывает на то, что эозинофилы также вовлечены в лежащий в его основе процесс (Feltelius et al., 1987). При гранулематозе Вегенера в редких случаях могут присутствовать пульмонарные узелки, выпот в плевральную полость и эозинофилия периферической крови ([Krupsky et al., 1993]).
Эозинофилия периферической крови, составляющая по меньшей мере 400/мм3, может возникать в 7% случаев системного склероза, 31% случаев очаговой склеродермии и 61% случаев эозинофильного фасциита ([Falanga and Medsger, 1987]). Склеродермия приводит к воспалительному процессу, очень сходному с нервным сплетением Мейснера и нервным сплетением Ауэрбаха, и оно состоит из тучных клеток и эозинофильных лейкоцитов в желудочно-кишечном тракте. Производимые эозинофилами нейротоксины могут вносить вклад в нарушение моторной функции желудочно-кишечного тракта, что происходит при склеродермии ([de Schryver Kecskemeti and Clouse, 1989]).
Эозинофилы могут сопровождать очаговую ([Varga and Kahari, 1997]) или системную ([Bouros et al., 2002]) пролиферацию соединительной ткани. Они могут провоцировать фиброз путем ингибирования распада протеогликанов в фибробластах ([Hemnas et al., 1992]), и фибробласты опосредуют выживаемость эозинофилов путем секреции GM-CSF ([Vancheri et al., 1989]). Эозинофилы можно обнаружить в тканях носовых ([Bacherct et al., 2001]), бронхиальных ([Arguelles and Blanco, 1983]) и желудочно-кишечных полипов ([Assarian and Sundareson, 1985]). Аналогично, эозинофилы могут быть локализованы в воспалительных псевдоопухолях (миофибробластической опухоли). Эозинофилы зачастую сопровождают воспалительные псевдоопухоли в глазничной области, в этом случае состояние может имитировать отек Квинке или аллергический риноконъюнктивит ([Li et al., 1992]).
Эозинофильное воспаление можно обнаружить при травме тканей (например, в результате операции или повреждения). Эозинофильное воспаление также может быть связано с сердечно-сосудистыми заболеваниями (например, эозинофильным миокардитом, эозинофильным коронарным артериитом, ишемической болезнью сердца, острым инфарктом миокарда, разрывом сердца). Некротические воспалительные процессы также могут включать в себя Эозинофильное воспаление (полимиозит, расслоение стенки коронарной артерии, некротизирующие повреждения при болезни нейро-Бехчета, деменцию, ишемический инсульт).
Определенные терапевтические средства
В настоящем документе предусматривается терапевтическое средство для лечения бронхиальной астмы и других заболеваний легких. Согласно одному варианту осуществления терапевтическое средство представляет собой антитело к IL13, также имеющее название лебрикизумаб. Лебрикизумаб представляет собой антитело IgG4. Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2) и CDR-H3 (SEQ ID NO.: 3). Согласно одному варианту осуществления антитело к IL13 содержит три CDR легкой цепи, CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5) и CDR-L3 (SEQ ID NO.: 6). Согласно одному варианту осуществления антитело к IL13 содержит три CDR тяжелой цепи и три CDR легкой цепи, CDR-H1 (SEQ ID NO.: 1), CDR-H2 (SEQ ID NO.: 2), CDR-H3 (SEQ ID NO.: 3), CDR-L1 (SEQ ID NO.: 4), CDR-L2 (SEQ ID NO.: 5) и CDR-L3 (SEQ ID NO.: 6). Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи, VH, с аминокислотной последовательностью, выбранной из SEQ ID NO. 7 и 8. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область легкой цепи, VL, с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит вариабельную область тяжелой цепи, VH, с аминокислотной последовательностью, выбранной из SEQ ID NO. 7 и 8, и вариабельную область легкой цепи, VL, с аминокислотной последовательностью SEQ ID NO.: 9. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 или SEQ ID NO.: 11 или SEQ ID NO.: 12 или SEQ ID NO.: 13. Согласно одному варианту осуществления антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Согласно одному варианту осуществления антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью, выбранной из SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12 и SEQ ID NO.: 13, и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14. Антитела к IL13 дополнительно описаны в международной патентной публикации №2005/062967.
Согласно другому аспекту антитело к IL-13 содержит последовательность вариабельного домена тяжелой цепи (VH) с идентичностью последовательности по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по отношению к аминокислотной последовательности SEQ ID NO.: 8. Согласно определенным вариантам осуществления последовательность VH с идентичностью по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к IL-13, содержащее указанную последовательность, сохраняет способность связываться с IL-13 человека. Согласно определенным вариантам осуществления в общем от 1 до 10 аминокислот были подвергнуты замене, вставке и/или делеции в SEQ ID NO.: 8. Согласно определенным вариантам осуществления замены, вставки или делеции находятся в областях за пределами CDR (т.е. в FR). Необязательно антитело к IL13 содержит последовательность VH в SEQ ID NO.: 8, включая в себя посттрансляционные модификации указанной последовательности.
Согласно другому аспекту предусматривается антитело к IL-13, причем антитело содержит вариабельный домен легкой цепи (VL) с идентичностью последовательности по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по отношению к аминокислотной последовательности SEQ ID NO.: 9. Согласно определенным вариантам осуществления последовательность VL с идентичностью по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к IL-13, содержащее указанную последовательность, сохраняет способность связываться с IL-13. Согласно определенным вариантам осуществления в общем от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции в SEQ ID NO.: 9. Согласно определенным вариантам осуществления замены, вставки или делеции находятся в областях за пределами CDR (т.е. в FR). Необязательно антитело к IL-13 содержит последовательность VL в SEQ ID NO.: 9, включая в себя посттрансляционные модификации указанной последовательности.
Согласно другому варианту осуществления антитело к IL-13 содержит область VL с идентичностью последовательности по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по отношению к аминокислотной последовательности SEQ ID NO.: 9, и область VH с идентичностью последовательности по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по отношению к аминокислотной последовательности SEQ ID NO.: 8.
Определенные молекулярные биомаркеры
В определенных случаях биомаркеры, например, сывороточные биомаркеры, определяют количественно в биологическом образце, полученном от пациента, в виде средних значений выбранных для лечения с помощью заданного терапевтического средства. В заявках на выдачу патента США №№61/459760, 61/465425, 61/484650 и 61/574485 ("Diagnosis and Treatments Related to TH2 Inhibition") описан анализ определения периостина и способы отбора пациентов для лечения с помощью описанных в настоящем документе составов антитела к IL13.
Общие техники для получения составов
Содержащие антитела к IL13 составы могут быть получены и проанализированы с использованием определенных вспомогательных веществ и техник, известных с настоящей области техники и дополнительно описанных в настоящем документе. Согласно определенным вариантам осуществления антитело, подлежащее включению в состав, не было подвергнуто предварительной лиофилизации, и представляющий интерес состав в настоящем документе представляет собой водный состав. Согласно определенным вариантам осуществления антитело представляет собой полноразмерное антитело. Согласно одному варианту осуществления антитело в составе представляет собой такой фрагмент антитела, как F(ab')2, причем в этом случае могут нуждаться в решении проблемы, которые могут не возникать в отношении полноразмерного антитела (такие как усечение антитела до Fab). Терапевтически эффективное количество антитела, присутствующего в составе, определяют, принимая во внимание, например, необходимые объемы дозы и способ(ы) введения. Приблизительно 0,1 мг/мл - приблизительно 250 мг/мл, или приблизительно 10 мг/мл - приблизительно 200 мг/мл или приблизительно 50 мг/мл - приблизительно 175 мг/мл представляет собой иллюстративную концентрацию антитела в составе. Согласно одному варианту осуществления антитело к IL13 вводят в состав в концентрации 125 мг/мл. Согласно одному варианту осуществления антитело к IL13 вводят в состав в концентрации 150 мг/мл.
Получают водный состав, содержащий антитело в рН-забуференном растворе. Согласно определенным вариантам осуществления буфер характеризуется рН в диапазоне приблизительно 4,5 - приблизительно 6,5. Согласно определенным вариантам осуществления рН находится в диапазоне рН от 5,0 до 6,0, или в диапазоне рН от 5,25 до 5,75, или в диапазоне рН от 5,3 до 5,6. Согласно определенным вариантам осуществления согласно настоящему изобретению состав характеризуется рН 5,6 или приблизительно 5,6. Согласно определенным вариантам осуществления согласно настоящему изобретению состав характеризуется рН 5,7 или приблизительно 5,7. Согласно определенным вариантам осуществления согласно настоящему изобретению состав характеризуется рН 5,8 или приблизительно 5,8. Примеры буферов, которые будут контролировать рН в пределах указанного диапазона, включают в себя ацетатные (например, ацетат гистидина, ацетат аргинина, ацетат натрия), сукцинатные (такие как сукцинат гистидина, сукцинат аргинина, сукцинат натрия), глюконатные, цитратные буферы и буферы на основе других органических кислот и их комбинации. Концентрация буфера может составлять приблизительно 1 мМ - приблизительно 600 мМ в зависимости, например, от буфера и необходимой изотоничности состава. Согласно определенным вариантам осуществления состав содержит гистидин в концентрации приблизительно 5 мМ - 40 мМ. Согласно одному варианту осуществления буфер представляет собой 20 мМ ацетата гистидина, рН 5,7. Согласно определенным вариантам осуществления буфер представляет собой 20 мМ сукцината гистидина, рН 5,7.
К составу антитела необязательно может быть добавлено поверхностно-активное вещество. Иллюстративные поверхностно-активные вещества включают в себя такие неионные поверхностно-активные вещества, как полисорбаты (например, полисорбаты 20, 80 и т.д.) или полоксамеры (например, полоксамер 188). Количество добавленного поверхностно-активного вещества является таким, чтобы оно снижало агрегацию введенного в состав антитела и/или минимизировало образование твердых частиц в составе и/или снижало адсорбцию. Например, поверхностно-активное вещество может присутствовать в составе в количестве приблизительно 0,001% - приблизительно 0,5%, или приблизительно 0,005% - приблизительно 0,2%, или приблизительно 0,01% - приблизительно 0,1%. Согласно одному варианту осуществления поверхностно-активное вещество представляет собой полисорбат 20, присутствующий в составе в количестве 0,03%.
Согласно одному варианту осуществления состав содержит вышеупомянутые средства (например, антитело, буфер и поверхностно-активное вещество) и по существу не содержит один или несколько таких консервантов, как бензиловый спирт, фенол, m-крезол, хлорбутанол и бензетония Cl. Согласно одному варианту осуществления состав не содержат консервант. Согласно варианту осуществления консервант может быть включен в состав, в частности, когда состав представляет собой многодозовый состав. Концентрация консерванта может находиться в диапазоне приблизительно 0,1% - приблизительно 2% или приблизительно 0,5% - приблизительно 1%. Один или несколько других фармацевтически приемлемых носителей, вспомогательных веществ или стабилизаторов, таких как описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980) могут быть включены в состав при условии, что они не оказывают неблагоприятного воздействия на необходимые характеристики состава. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксическими для реципиентов в используемых дозировках и концентрациях и включают в себя дополнительные буферные средства; совместные растворители; антиоксиданты, включающие в себя аскорбиновую кислоту и метионин; такие хелатирующие средства, как EDTA; комплексы с металлами (например, Zn-белковые комплексы); такие биоразлагаемые полимеры, как сложные полиэфиры; и/или солеобразующие противоионы.
Наряду с тем, что различные описания хелаторов в настоящем документе часто уделяют большое внимание EDTA, следует понимать, что согласно настоящему изобретению также предусматриваются другие хелаторы ионов металлов. Хелаторы ионов металлов хорошо известны специалистам в настоящей области техники и включают в себя без ограничения аминополикарбоксилаты, EDTA (этилендиаминтетрауксусную кислоту), EGTA (этиленгликоль-бис(бета-аминоэтиловый эфир)-N,N,N',N'-тетрауксусную кислоту), NTA (нитрилотриуксусную кислоту), EDDS (этилендиаминдисукцинат), PDTA (1,3-пропилендиаминтетрауксусную кислоту), DTPA (диэтилентриаминпентауксусную кислоту), ADA (бета-аланиндиуксусную кислоту), MGCA (метилглициндиуксусную кислоту) и т.д. Кроме того, некоторые варианты осуществления в настоящем документе предусматривают хелаторы фосфонаты/фосфоновую кислоту. Согласно определенным вариантам осуществления состав содержит метионин.
Регулирующие тоничность средства, которые в некоторых случаях называют "стабилизаторы", присутствуют для регуляции или поддержания тоничности жидкой композиции. При использовании в отношении таких больших, заряженных биомолекул, как белки и антитела, их часто называют "стабилизаторы", поскольку они могут взаимодействовать с заряженными группами аминокислотных боковых цепей, тем самым снижая возможность для меж- и внутримолекулярных взаимодействий. Регулирующие тоничность средства могут присутствовать в любом количестве от 0,1% до 25% по весу или от 1 до 5% с учетом относительных количеств других ингредиентов. Регулирующие тоничность средства включают в себя многоатомные сахарные спирты, трехатомные сахарные спирты или сахарные спирты более высокого порядка, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
Дополнительные стабилизаторы включают в себя широкий спектр вспомогательных веществ, функции которых находятся в диапазоне от объемообразующих средств до усилителей растворимости, до средств, препятствующих денатурации или прикреплению к стенке контейнера. Стабилизаторы могут присутствовать в диапазоне от 0,1 до 10000 частей на вес активного белка или антитела. Типичные стабилизаторы включают в себя: многоатомные сахарные спирты (перечисленные выше); такие аминокислоты, как аланин, глицин, глутамин, аспарагин, гистидин, аргинин, лизин, орнитин, лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; такие органические сахара или сахарные спирты, как сахароза, лактоза, лактит, трегалоза, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миоинозитоза, миоинозит, галактоза, галактит, глицерин, циклиты (например, инозит), полиэтиленгликоль; такие серосодержащие восстанавливающие средства, как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; такие низкомолекулярные белки, как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или другие иммуноглобулины; такие гидрофильные полимеры, как пполивинилпирролидон; моносахариды (например, ксилоза, манноза, фруктоза, глюкоза; дисахариды (например, лактоза, мальтоза, сахароза); такие трисахариды, как раффиноза; и такие полисахариды, как декстрин или декстран.
Неионные поверхностно-активные вещества или детергенты (также известные как "смачивающие средства") присутствуют для содействия в солюбилизации терапевтического средства, а также для защиты терапевтического белка от вызванной перемешиванием агрегации, которые также позволяют подвергать состав воздействию касательного напряжения в поверхностном слое, не вызывая при этом денатурацию активного терапевтического белка или антитела. Неионные поверхностно-активные вещества присутствуют в диапазоне приблизительно 0,05 мг/мл - приблизительно 1,0 мг/мл, предпочтительно приблизительно 0,07 мг/мл - приблизительно 0,2 мг/мл.
Подходящие неионные поверхностно-активные вещества включают в себя полисорбаты (20, 40, 60, 65, 80 и т.д.), полоксамеры (184, 188 и т.д.), полиолы Pluronic®, Triton®, простые моноэфиры полиоксиэтиленсорбитана (Tween®-20, Tween®-80 и т.д.), лауромакрогол 400, полиоксил 40 стеарат, полиоксиэтиленовое гидрогенизованное касторовое масло 10, 50 и 60, глицеринмоностеарат, сложный эфир жирной кислоты и сахарозы, метилцеллюлозу и карбоксиметилцеллюлозу. Применимые анионные детергенты включают в себя натрийлаурилсульфат, диоктилнатрийсульфосукцинат и диоктилнатрийсульфонат. Катионные детергенты включают в себя бензалконийхлорид или бензетонийхлорид.
Различные аналитические техники для измерения стабильности белка доступны в настоящей области техники и обзорно представлены, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Согласно определенным вариантам осуществления состав является стабильным при приблизительно 40°С в течение по меньшей мере приблизительно 2-4 недель, и/или стабильный при приблизительно 5°С в течение по меньшей мере 3 месяцев, и/или стабильный при приблизительно 5°С в течение по меньшей мере шести месяцев, и/или стабильный при приблизительно 5°С в течение по меньшей мере 12 месяцев и/или стабильный при приблизительно -20°С в течение по меньшей мере 3 месяцев или по меньшей мере 1 года. Согласно определенным вариантам осуществления состав является стабильным при приблизительно 25°С в течение по меньшей мере 6 месяцев и/или стабильный при приблизительно 25°С в течение 12 месяцев, и/или стабильный при приблизительно 5°С в течение 6 месяцев, и/или стабильный при приблизительно 5°С в течение 12 месяцев, и/или стабильный при приблизительно -20°С в течение по меньшей мере 6 месяцев, и/или стабильный при приблизительно -20°С в течение по меньшей мере 12 месяцев, и/или стабильный при 5°С или -20°С в течение по меньшей мере двух лет. Согласно определенным вариантам осуществления состав является стабильным после замораживания (например, до -70°С) и оттаивания состава, например, после 1, 2 или 3 циклов замораживания и оттаивания. Стабильность можно качественно и/или количественно оценить с помощью разнообразия различных путей, включающих в себя оценку образования агрегатов (например, с использованием эксклюзионной хроматографии, путем измерения мутности и/или путем визуального исследования); путем оценки гетерогенности заряда с использованием катионообменной хроматографии, капиллярного изоэлектрического фокусирования (icIEF) или капиллярного зонального электрофореза; анализ амино-концевой или карбокси-концевой последовательности; анализ масс-спектрометрии; анализ SDS-PAGE для сравнения восстановленного и интактного антитела; анализ на основе пептидной карты (например, трипсиновый анализ или LYS-C); оценку биологической активности или антигенсвязывающей функции антитела и т.п. Нестабильность может включать в себя любое одно или несколько из следующего: агрегация, деамидирование (например, деамидирование Asn), окисление (например, окисление Met), изомеризация (например, изомеризация Asp), усечение/гидролиз/фрагментация (например, фрагментация шарнирной области), образование сукцинимида, неспаренный(е) цистеин(ы), N-концевое удлинение, С-концевой процессинг, различия в гликозилировании и т.д.
Составы для использования во введении in vivo должны быть стерильными. Это легко осуществить путем фильтрации через стерильные фильтрационные мембраны, перед или после получения состава.
Терапевтическое средство может быть введено в соответствии с такими известными способами, как внутривенное введение, в виде болюсной или непрерывной инфузии в течение определенного периода времени, внутримышечным, интраперитонеальным, интрацереброспинальным, подкожным, интраартикулярным, интрасиновиальным, интратекальным, пероральным, местным или ингаляционным путями. Необязательно, введение может быть проведено посредством инфузии с мининасосом с использованием различных коммерчески доступных устройств.
Состав в настоящем документе также может при необходимости содержать больше одного активного соединения для конкретного подлежащего лечению показания, предпочтительно активные соединения с комплементарными активностями, которые не оказывают неблагоприятного воздействия друг на друга. Альтернативно или дополнительно, композиция может содержать цитотоксическое средство, цитокин или ингибирующее рост средство. Такие молекулы соответствующим образом присутствуют в комбинации в количествах, эффективных для предусмотренной цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, с помощью техник коацервации или путем полимеризации на границе раздела фаз, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и поли-(метилметакрилата), соответственно, в коллоидных системах доставки лекарственного средства (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие техники раскрыты в Remington's Pharmaceutical Sciences 18-е изд., ранее.
Могут быть получены препараты замедленного высвобождения. Подходящие примеры препаратов замедленного высвобождения включают в себя полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, причем матрицы находятся в форме изделий определенной формы, например, пленок или микрокапсул. Примеры матриц замедленного высвобождения включают в себя сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагающийся этиленвинилацетат, такие разлагающиеся сополимеры молочной кислоты и гликолевой кислоты, как LUPRON DEPOTTM (инъекционные микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролидацетата), и поли-0-(-)-3-гидроксимасляную кислоту. Микроинкапсуляция рекомбинантных белков для замедленного высвобождения была успешно проведена с гормоном роста человека (rhGH), интерфероном- (rhIFN-), интерлейкином-2 и MN rpg 120. Johnson et al., Nat. Med. 2: 795-799 (1996); Yasuda et al., Biomed. Ther. 27: 1221-1223 (1993); Нога et al., Bio/Technology 8: 755-758 (1990); Cleland, "Design and Production of Single Immunization Vaccines Using Polylactide Polyglycolide Microsphere Systems," в Vaccine Design: The Subunit and Adjuvant Approach, Powell and Newman, eds., (Plenum Press: New York, 1995), pp. 439-462; международные патентные публикации №№ WO 97/03692; WO 96/40072; WO 96/07399 и патент США №5654010.
Составы замедленного высвобождения для этих белков могут быть разработаны с использованием сополимера молочной и гликолевой кислот (PLGA) вследствие его биосовместимости и широкого диапазона свойств биоразложения. Продукты разложения PLGA, молочная и гликолевая кислоты, могут быстро подвергаться выведению из организма человека. Более того, способность к разложению указанного полимера может быть отрегулирована от месяцев до нескольких лет в зависимости от его молекулярной массы и состава. Lewis, "Controlled release of bioactive agents from lactide/glycolide polymer", в Biodegradable Polymers as Drug Delivery Systems (Marcel Dekker; New York, 1990), M. Chasin and R. Langer (Eds.) pp. 1-41.
Наряду с тем, что такие полимеры, как этиленвинидацетат и сополимер молочной и гликолевой кислот обеспечивают высвобождение молекул в течение 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени. Если инкапсулированные антитела остаются в организме в течение длительного периода времени, они могут денатурировать или агрегировать в результате воздействия влажности при 37°С, приводя к потере биологической активности и возможным изменениям иммуногенности. В зависимости от вовлеченного механизма могут быть выработаны рациональные стратегии для стабилизации. Например, если было обнаружено, что механизмом агрегации является образование межмолекулярных S-S связей посредством тио-дисульфидного взаимообмена, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, контроля влагосодержания, использования соответствующих добавок и разработки специфических композиций на основе полимерных матриц.
Для получения раскрытых в настоящем документе составов белков или антител также могут использоваться липосомальные или протеноидные композиции. Смотрите патенты США №№4925673 и 5013556.
Стабильность описанных в настоящем документе белков и антител может быть усилена посредством применения нетоксических "растворимых в воде солей поливалентных металлов". Примеры включают в себя Са2+, Mg2+, Zn2+, Fe2+, Fe3+, Cu2+, Sn2+, Sn4+, Al2+ и Al3+. Иллюстративные анионы, которые могут образовывать растворимые в воде соли с перечисленными выше катионами поливалентных металлов, включают в себя анионы, образованные из неорганических кислот и/или органических кислот. Такие растворимые в воде соли характеризуются растворимостью в воде (при 20°С), составляющей по меньшей мере приблизительно 20 мг/мл, альтернативно по меньшей мере приблизительно 100 мг/мл, альтернативно по меньшей мере приблизительно 200 мг/мл.
Подходящие неорганические кислоты, которые могут использоваться для образования "растворимых в воде солей поливалентных металлов", включают в себя соляную, уксусную, серную, азотную, тиоциановую и фосфорную кислоту. Подходящие для применения органические кислоты включают в себя алифатическую карбоновую кислоту и ароматические кислоты. Алифатические кислоты в пределах настоящего определения могут быть определены как насыщенные или ненасыщенные С2-9 карбоновые кислоты (например, алифатические моно-, ди- и три-карбоновые кислоты). Например, иллюстративные монокарбоновые кислоты в пределах настоящего определения включают в себя насыщенные С2-9 монокарбоновые кислоты: уксусную, пропионовую, масляную, валериановую, капроновую, энантовую, каприловую, пеларгоновую и каприновую, и ненасыщенные С2-9 монокарбоновые кислоты: акриловую, пропиоловую, метакриловую, кротоновую и изокротоновую кислоты. Иллюстративные дикарбоновые кислоты включают в себя насыщенные С2-9 дикарбоновые кислоты: малоновую, сукциновую, глутаровую, адипиновую и пимелиновую, тогда как ненасыщенные С2-9 дикарбоновые кислоты включают в себя малеиновую, фумаровую, цитраконовую и мезаконовую кислоты. Иллюстративные трикарбоновые кислоты включают в себя насыщенные С2-9 трикарбоновые кислоты: трикарбаллиловую и 1,2,3-бутантрикарбоновую кислоту. Кроме того, карбоновые кислоты согласно настоящему определению также могут содержать одну или две гидроксильных группы для образования гидроксикарбоновых кислот. Иллюстративные гидроксикарбоновые кислоты включают в себя гликолевую, молочную, глицериновую, тартроновую, яблочную, винную и лимонную кислоту. Ароматические кислоты в пределах настоящего определения включают в себя бензойную и салициловую кислоту.
Широко используемые растворимые в воде соли поливалентных металлов, которые могут применяться для содействия в стабилизации инкапсулированных полипептидов согласно настоящему изобретению, включают в себя, например: (1) металлические соли неорганических кислот галогенидов (например, хлорид цинка, хлорид кальция), сульфаты, нитраты, фосфаты и тиоцианаты; (2) металлические соли алифатических карбоновых кислот (например, ацетат кальция, ацетат цинка, пропионат кальция, гликолят цинка, лактат кальция, лактат цинка и тартрат цинка); и (3) металлические соли ароматических карбоновых кислот бензоатов (например, бензоат цинка) и салицилаты.
Согласно определенным вариантам осуществления антитело к IL13 вводят с использованием, например, устройства для самоинъекции, автоматического инъекционного устройства или другого устройства, разработанного для самостоятельного введения. Согласно определенным вариантам осуществления антитело к IL13 вводят с использованием устройства для подкожного введения. Различные устройства для самоинъекции и устройства для подкожного введения, включающие в себя автоматические инъекционные устройства, известны в настоящей области техники и являются коммерчески доступными. Иллюстративные устройства включают в себя без ограничения предварительно наполненные шприцы (такие как BD HYPAK SCF®, READYFILL™ и STERIFILL SCF™ от Becton Dickinson; сополимерные предварительно наполненные шприцы CLEARSHOT™ от Baxter; и предварительно наполненные шприцы Daikyo Seiko CRYSTAL ZENITH®, доступные от West Pharmaceutical Services); такие одноразовые шприцы-ручки, как BD Pen от Becton Dickinson; устройства со сверхострой иглой и микроиглой (такие как INJECT-EASE™ и микроинфузионные устройства от Becton Dickinson; и Н-РАТСН™, доступный от Valeritas), а также безыгольные инъекционные устройства (такие как BIOJECTOR® и IJECT®, доступны от Bioject; и SOF-SERTER® и аппликационные устройства, доступные от Medtronic). Определенные варианты осуществления устройств для подкожного введения дополнительно описаны в настоящем документе. Предусматриваются совместные составы или совместные введения с помощью таких устройств для самоинъекции или устройств для подкожного введения антитела к IL13 по меньшей мере со вторым терапевтическим соединением.
Рекомбинантные способы
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, описанных в патенте США №4816567. Согласно одному варианту осуществления предусматривается выделенная нуклеиновая кислота, кодирующая описанное в настоящем документе антитело к IL13. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). Согласно дополнительному варианту осуществления предусматривается один или несколько векторов (например, векторов экспрессии), содержащих такую нуклеиновую кислоту. Согласно дополнительному варианту осуществления предусматривается клетка-хозяин, содержащая такую нуклеиновую кислоту. Согласно одному такому варианту осуществления клетка-хозяин содержит (например, была трансформирована с): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. Согласно одному варианту осуществления клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клеткой YO, NSO, Sp20). Согласно одному варианту осуществления предусматривается способ получения антитела к IL13, причем способ предусматривает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую представленное выше антитело, при условиях, подходящих для экспрессии антитела, и необязательно выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела к IL13, нуклеиновую кислоту, кодирующую, например, описанное выше антитело, выделяют и вводят в один или несколько векторов для дополнительного клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделить и секвенировать с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают в себя описанные в настоящем документе прокариотические или эукариотические клетки. Например, антитела могут быть произведены в бактериях, в частности, когда гликозилирование и Fc-эффекторная функция не являются необходимыми. Для экспрессии фрагментов антител и полипептидов в бактериях, смотрите, например, патенты США №№5648237, 5789199 и 5840523. (Смотрите также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, описывающую экспрессию фрагментов антител в Е.coli). После экспрессии антитело может быть выделено из бактериальной клеточной массы в растворимой фракции и может быть дополнительно очищено.
Кроме прокариот, такие эукариотические микроорганизмы, как мицелиальные грибы или дрожжи, являются подходящими для клонирования или экспрессии хозяевами для кодирующих антитело векторов, включая в себя штаммы грибов и дрожжей, чьи пути гликозилирования были "гуманизированы", приводя к продукции антитела с частично или полностью человеческим паттерном гликозилирования. Смотрите Gemgross, Nat. Biotech. 22: 1409-1414 (2004), и Li et al., Nat. Biotech. 24: 210-215 (2006).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают в себя клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут использоваться совместно с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также используются культуры растительных клеток. Смотрите, например, патенты США №№5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIESTM для получения антител в трансгенных растениях).
В качестве хозяев также могут использоваться клетки позвоночных. Например, могут применяться клеточные линии млекопитающих, которые адаптированы для роста в суспензии. Другие примеры применимых относящихся к млекопитающим клеточных линий-хозяев представляют собой линию клеток почки обезьяны С VI, трансформированную с помощью SV40 (COS-7); линию эмбриональных клеток почки человека (клетки 293 или 293, описанные, например, в Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки новорожденного хомяка (ВНК); клетки Сертоли мыши (клетки ТМ4, описанные, например, в Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени серой крысы (BRL ЗА); клетки легких человека (W138); клетки печени человека (Нер G2); клетки опухоли молочной железы мышей (ММТ 060562); клетки TR1, описанные, например, в Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982); клетки MRC 5; и клетки FS4. Другие применимые относящиеся млекопитающим клеточные линии-хозяева включают в себя клетки яичника китайского хомяка (СНО), включающие в себя клетки DHFR-СНО (Uriaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); и такие миеломные клеточные линии, как YO, NSO и Sp2/0. Для обзора определенных относящихся к млекопитающим клеточных линий-хозяев, подходящих для получения антител, смотрите, например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
Анализы
Представленные в настоящем документе антитела к IL13 могут быть идентифицированы, подвергнуты скринингу или охарактеризованы в отношении их физических/химических свойств и/или биологических активностей различными известными в настоящей области техники анализами.
Анализы связывания и другие анализы
Согласно одному аспекту антитело к IL13 исследуют в отношении его антигенсвязывающей активности, например, с помощью таких известных способов, как ELISA, вестерн-блоттинг и т.д.
Согласно другому аспекту конкурентные анализы могут использоваться для идентификации антитела, которое конкурирует с антителом к IL13 за связывание с IL13. Согласно определенным вариантам осуществления такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается лебрикизумаб или другое антитело к IL13, указанное в настоящем документе. Подробные иллюстративные способы картирования эпитопа, с которым связывается антитело, предусматриваются в Morris (1996) "Epitope Mapping Protocols," в Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
В иллюстративном конкурентном анализе иммобилизованный IL13 инкубируют в растворе, содержащем первое меченое антитело, которое связывается с IL13 (например, лебрикизумаб), и второе немеченое антитело, которое необходимо исследовать в отношении его способности конкурировать с первым антителом за связывание с IL13. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный IL13 инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации при условиях, допускающих связывание первого антитела с IL13, избыток несвязанного антитела удаляют и измеряют количество метки, связанной с иммобилизованным IL13. Если количество метки, связанной с иммобилизованным IL13, значительно снижается в исследуемом образце относительно контрольного образца, это указывает на то, что второе антитело конкурирует с первым антителом за связывание с IL13. Смотрите Harlow and Lane (1988) Antibodies: A Laboratory Manual ch. 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
Анализы активности
Согласно одному аспекту предусматриваются анализы для идентификации антител к IL-13 с биологической активностью. Биологическая активность может включать в себя, например, активность при бронхиальной астме. Также предусматриваются антитела с такой биологической активностью in vivo и/или in vitro. Согласно определенным вариантам осуществления антитело согласно настоящему изобретению исследуют в отношении такой биологической активности.
Изделия и наборы
Предусматривается изделие, которое содержит состав и предоставляет инструкции для его применения. Изделие содержит контейнер. Подходящие контейнеры включают в себя, например, бутылки, флаконы (например, двухкамерные флаконы), шприцы (такие как одно- или двухкамерные шприцы) и тест-пробирки. Контейнер может быть изготовлен из различных материалов, таких как стекло или пластик. Контейнер содержит в себе состав, и этикетка на контейнере или прилагаемая к нему может содержать указания для восстановления и/или применения. Этикетка может дополнительно указывать на то, что состав применим или предназначен для подкожного введения. Контейнер, содержащий в себе состав, может представлять собой флакон для многократного применения, который позволяет выполнять повторные введения (например, 2-6 введений) восстановленного состава. Изделие может дополнительно содержать второй контейнер, содержащий подходящий разбавитель (например, BWFI). При смешивании разбавителя и лиофилизированного состава конечная концентрация белка в восстановленном составе, как правило, будет составлять по меньшей мере 50 мг/мл. Изделие может дополнительно включать в себя другие материалы, необходимые с коммерческой и потребительской точек зрения, включая в себя другие буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши с инструкциями по применению.
Согласно определенным вариантам осуществления предусматривается изделие, содержащее устройство для подкожного введения, которое доставляет пациенту постоянную дозу антитела к IL13, причем постоянная доза составляет, например, без ограничения 37,5 мг, 75 мг, или 125 мг или 150 мг. Согласно определенным вариантам осуществления антитело к IL13 представляет собой лебрикизумаб. Антитело к IL13 в устройстве для подкожного введения составляют в буфере, например, гистидине с рН 5,7, и другими вспомогательными веществами, например, сахарозой и полисорбатом, так, чтобы обеспечивался стабильный фармацевтический состав. Согласно определенным вариантам осуществления устройство для подкожного введения представляет собой предварительно наполненный шприц, содержащий стеклянный цилиндр с иглой и необязательно защитный колпачок для иглы, а также необязательно защитное устройство для иглы. Согласно определенным вариантам осуществления содержащийся в шприце объем составляет 0,5 мл, 1 мл, 1,5 мл или 2,0 мл или приблизительно 0,5 мл, приблизительно 1 мл, приблизительно 1,5 мл или приблизительно 2,0 мл. Согласно определенным вариантам осуществления игла представляет собой несъемную иглу с типом заточки острия 3В или 5В. Согласно определенным вариантам осуществления игла характеризуется калибром от 25G до 30G. Согласно определенным вариантам осуществления длина иглы составляет от 1/2 дюйма до 5/8 дюйма. Согласно одному варианту осуществления устройство для подкожного введения содержит предварительно наполненный шприц объемом 1,0 мл из боросиликатного стекла с низким содержанием вольфрама (тип I) и тонкостенную несъемную иглу из нержавеющей стали с типом заточки острия 5 В, калибром 27G, длиной 1/2 дюйма. Согласно определенным вариантам осуществления устройство для подкожного введения содержит твердый защитный колпачок для иглы. Согласно определенным вариантам осуществления твердый защитный колпачок для иглы содержит состав на основе резины, характеризующийся низким содержанием цинка, например, FM27/0 (Daetwyler), и содержит твердый полипропиленовый защитный колпачок. Согласно определенным вариантам осуществления шток поршня содержит резиновый ограничитель хода поршня. Согласно определенным вариантам осуществления резиновый ограничитель хода поршня содержит в своем составе резину 4023/50 и этилентетрафторэтиленовое (ETFE) покрытие FluroTec® (West Pharmaceutical Services, Inc.). Согласно определенным вариантам осуществления устройство для подкожного введения содержит защитное устройство для иглы. Иллюстративные защитные устройства для иглы включают в себя без ограничения Ultrasafe Passive® Needle Guard X100L (Safety Syringes, Inc.) и Rexam Safe n Sound™ (Rexam).
Дополнительные устройства, подходящие для подкожной доставки, включают в себя, например, без ограничения такое инъекционное устройство, как устройства INJECT-EASE™ и GENJECT™; такой инфузионный насос, как ACCU-CHECK™; такой шприц-ручку, как GENPEN™; такое безыгольное устройство, как MEDDCTOR™ и BIOJECTOR; устройство для автоматической инъекции и подкожную аппликационную систему доставки.
Наборы, как правило, будут содержать описанный выше контейнер и один или несколько других контейнеров, содержащих материалы, необходимые с коммерческой и потребительской точек зрения, включающих в себя буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши с инструкциями по применению. Этикетка может находиться на контейнере для указания на то, что композиция применяется для конкретной терапии.
ПРИМЕРЫ
Далее представлены примеры составов и способов согласно настоящему изобретению. Следует понимать, что другие различные варианты осуществления могут быть осуществлены на практике, принимая во внимание представленное выше общее описание.
Пример 1
Материалы и способы
Процедуры получения материалов и образцов
За исключением антитела к IL13, которое представляет собой гуманизированное моноклональное антитело IgG4, все другие используемые в описанных ниже экспериментах антитела представляли собой гуманизированные моноклональные антитела IgG1. Моноклональные антитела экспрессировали в клеточных линиях яичника китайского хомяка (СНО) и очищали с помощью серии стадий стандартной хроматографии, включающей в себя способы хроматографии с использованием белка А и ионообменной хроматографии. Очищенные антитела получали в виде концентрированных растворов из тангенциальной проточной фильтрации с добавленными буферами и стабилизаторами растворов. Они представляют собой маточные растворы антител, используемые в качестве исходных материалов для описанных ниже исследований.
Эти исходные материалы маточных mAb хранили при 2-8°С до дальнейшего использования. Дополнительное получение растворов mAb предусматривало диализ против буфера с низкой ионной силой и фильтрацию через 0,22 мкм модифицированные PVDF (поливинилиденфторидные) фильтры (Millipore Steriflip, Millipore Corp., MA) для удаления крупных твердых частиц. Как правило, после диализа получали концентрации mAb, составляющие 140-150 мг/мл. Для получения более высоких концентраций mAb 10 мл mAb концентрировали с помощью концентраторов Amicon YM30 Centriprep (Millipore Corp, MA) с центрифугированием при 2700 об/мин. Конечные концентрации mAb в подвергнутых диализу и концентрированию с использованием центрифугирования препаратов определяли с использованием гравиметрических разведении и коэффициентов поглощения при 280 нм (А280) и измерения УФ поглощения при 280 нм с использованием Agilent диодно-матричного спектрофотометра модели 8453 с кварцевой кюветой с длиной оптического пути 1 см. Коэффициенты экстинкции определяли путем количественного аминокислотного анализа.
Растворы моноклональных антител для экспериментов по светорассеянию получали в 20 мл сцинтилляционных флаконах в концентрациях 0,5-275 мг/мл путем гравиметрического разведения известных концентраций стокового раствора в вытяжном шкафу с ламинарным потоком. Все сцинтилляционные флаконы аккуратно очищали деионизированой водой и высушивали в потоке отфильтрованного сжатого газообразного азота. Перед добавлением растворов белка все буферные растворы и растворы реагентов дополнительно фильтровали через 0,10 мкм фильтры Whatman Anotop 25. После получения или разведения образцов растворы mAb перемешивали до гомогенности и оставляли до достижения температурного и химического равновесия при контролируемой комнатной температуре в течение 2 часов. Растворы белка центрифугировали при комнатной температуре в течение 20-30 минут при 3000 об/мин для удаления из растворов случайной пыли и пузырьков перед использованием для светорассеяния. Растворы с более высокими концентрациями (mAb>170 мг/мл) центрифугировали более длительно, пока сигнал светорассеяния не показывал минимальный шум. Наружные поверхности сцинтилляционных флаконов слегка покрывали силиконовым маслом для снижения нежелательного рассеяния из-за дефектов в поверхности флаконов. Пполученные согласно приведенному выше описанию образцы непосредственно помещали в прибор для измерения светорассеяния.
Определение В2 с помощью многоуглового светорассеяния
В получении образца для светорассеяния использовали 20 мл флаконы с покрытыми Teflon® крышками с диафрагмой, которые очищали с помощью воды MilliQ и высушивали в потоке отфильтрованного газообразного азота. Образцы различных концентраций получали путем отбора соответствующего объема маточного раствора mAb при приблизительно 80 мг/мл, разведения его до приблизительно 8 мг/мл с соответствующим буфером и затем проводя конечное разведение с помощью 20 мл отфильтрованного через 0,2 мкм фильтр буфера. В общем восемь концентраций белка (0,05-1,1 мг/мл mAb) для каждого условия буфера уравновешивали в течение 14-18 часов при комнатной температуре перед началом измерений. Все измерения проводили в виде серии растворов увеличивающихся концентраций белка, причем каждый эксперимент проводили в трех параллелях. Дегазатор для растворителя и изократический насос Agilent (Agilent, Palo Alto, CA) с 25 мм Millipore (Millipore, Billerica, MA) фильтром для растворителя (PVDF, 0,1 мкм) использовали со скоростью непрерывного потока, составляющей 0,5 мл/мин. Введение образца проводили автоматизированно с помощью Gilson GX281 (Gilson, Inc., Middleton WI) жидкостного манипулятора, оснащенного 2 мл петлевым дозатором и встроенным микрофильтром Wyatt Technology Deutschland с 0,1 мкм мембраной из 10 мМ PVDF. Измерения концентрации и светорассеяния проводили последовательно с помощью ультрафиолетового детектора Agilent MWD, проводящего измерения при 280 нм, за которым следует 18-угловой детектор EOS MALS (Wyatt Technology Corporation, Santa Barbara, CA) с усилением, сниженным до 21х. Данные получали и обрабатывали в программе Astra™ 4.90.07 (WTC) с дополнительным анализом, проведенным с помощью экспортирования результатов срезов. Графики K*c/R(θ=0)/K*c/ или 1/MWapp в зависимости от концентрации с подгонкой данных к линейной регрессии дают наклон = 2В2 и отрезок 1/Mw0, усредненную молекулярную массу при бесконечном разведении.
Многоугловое статическое светорассеяние при высокой концентрации (SLS)
18-угловой детектор светорассеяния Dawn EOS с 30 мВт твердотельным лазером (λ=690 нм) от Wyatt Technology (Santa Barbara, CA) использовали для всех измерений статического светорассеяние с охлаждаемым водой температурным регулятором Peltier, установленным на 23°С. Прибор калибровали с помощью 99,9% толуола (квалификации «для хроматографии»). Для типичного эксперимента с использованием сцинтилляционного флакона установку коэффициента усиления детектора на 1х использовали для всех фотодиодов, при фиксированных углах 38° - 148°. Поскольку радиус инерции (Rg) антитела к CD11a меньше 10 нм, разбавленный раствор (1-2 мг/мл) антитела к CD11a использовали при каждой концентрации соли для нормирования угловой зависимости фотодиодов по отношению к 90° детектору с использованием фотодиодного коэффициента усиления детектора, установленного на 21х, в конце каждого эксперимента. Измерение интенсивности статического светорассеяния проводили в зависимости от концентрации mAb от 0,5 мг/мл до 275 мг/мл и в зависимости от концентрации NaCl (0-600 мМ). Данные рассеяния для каждого образца/флакона собирали в течение интервала, составляющего 5-10 минут, с частотой сбора данных, составляющей 12 сигналов в минуту. Программное обеспечение Astra 4.90.07 (Wyatt Technology Corporation, Santa Barbara, CA) использовали для получения и обработки данных статического светорассеяния со значением dn/dc, составляющем 0,185, применяемым для расчетов, которые могут экспортировать в виде результатов срезов. Дополнительный анализ и расчеты с экспортированными результатами проводили в Microsoft Excel, Origin v7.5 и MATLAB R14. Для данных светорассеяния при высоких концентрациях зачастую легче интерпретировать результаты в формате MWapp в зависимости от концентрации mAb, где увеличения молекулярной массы соответствовали присутствию концентрационно зависимой обратимой самоассоциации. (Смотрите, например, Scherer, Т. М., et al. The Journal of Physical Chemistry В 114(40): 12948-12957 (2010); Minton, A.P., J Pharm Sci 96(12): 3466-9 (2007); Minton, A.P. Biophysical Journal 93(4): 1321-1328 (2007).
Оценка мутности с помощью УФ спектроскопии
Мутности исследуемых растворов белка из экспериментов по светорассеянию при высоких концентрациях и растворов белка из эксперимента по скринингу рН (каждый из которых дополнительно описан ниже) измеряли при окружающей температуре с использованием спектрофотометра Agilent 8453. Мутность рассчитывали как средний коэффициент поглощения света при длине волны 350 нм, когда сумму значений коэффициента поглощения света в диапазоне длин волн от 340 нм до 360 нм с 5 нм шагом нарастания делили на 5. Измерения растворов белков проводили в кварцевой кювете небольшого объема с 1 см длиной оптического пути. Также регистрировали коэффициент поглощение при 690 нм.
Определение характеристик температуры плавления (Tm) с помощью капиллярной дифференциальной сканирующей калориметрии (ДСК)
Температурную конформационную стабильность белка оценивали с использованием капиллярного дифференциального сканирующего калориметра MicroCal. mAb разводили до 1 мг/мл в буфере. 500 мкл белка и соответствующий ему буфер загружали в 96-луночный планшет. Отслеживали теплоемкость с повышением температуры от 15 до 95°C с частотой сканирования 60°С/ч. VPViewer 2000 Cap DSC использовали для получения данных и программу анализа данных ДСК MicroCal, LLC использовали для анализа данных. Смотрите Yadav, S. et al., J Pharm Sci. 99(3): 1152-68 (2010).
Нефелометрия
Нефелометрические измерения проводили с использованием прибора лабораторного нефелометра НАСН (модель 2100AN IS) с 90° детекцией интенсивности рассеянного излучения. Детектор калибровал с помощью стандартного маточного раствора с 4000 формазиновых нефелометрических единиц мутности (NTU), с относительной концентрацией стандарта мутности 0-0,5. Образцы помещали в кюветы и измеряли в двойной параллели зарегистрированное среднее NTU образца.
Реология
Вязкости образцов измеряли с помощью реометра MCR300 (Anton Paar, Ashland, VA) с использованием измерительной системы типа конус-плита. Образцы загружали на нижний измерительный планшет и достигали температурного равновесия при 25°С. Ловушку растворителя использовали для предотвращения испарения растворителя. Образец проходил через два цикла скоростей сдвига (каждый цикл включает в себя наращивание от 10 с-1 до 1000 с-1, удержание на уровне 1000 с-1 в течение 1 мин, снижение от 1000 с-1 до 10 с-1). Между циклами присутствует один 1-минутный период покоя. Зарегистрированное значение представляет собой среднее от двух циклов скоростей сдвига одного образца при 1000 с-1. Планка погрешностей представляет стандартное отклонение от двух экспериментов в единицах миллипаскаль-секунда (мПа*с). Образец находился при сдвиговом напряжении в течение 2 минут в общем при 1000 с-1. Мы выбрали 1000 с-1, поскольку вязкость является относительно независимой от скоростей сдвига в этом диапазоне (200 с-1 < скорость сдвига < 2000 с-1). Различие в значении вязкости между двумя аликвотами одного образца составляло в пределах ±0,5 мПа при 1000 с-1. Длительность измерения при каждой скорости сдвига оптимизировали с использованием программного обеспечения US200 (Anton Paar, Ashland, VA).
Определение температуры помутнения
Для системы, которая подвергается разделению двух жидких фаз (LLPS), снижение температуры приводит к образованию капель одной жидкой фазы в другой фазе. Температура, при которой образуются эти капли, называется температурой помутнения, и ее можно экспериментально определить либо с помощью микроскопии, либо путем мониторинга пропускаемости раствора. Согласно описанным в настоящем документе экспериментам температуру помутнения определяют путем мониторинга потери пропускаемости при 600 нм в зависимости от температуры в спектрофотометре Aviv 14DS (Aviv Biomedical, Lakewood, NJ). 5 мм квадратную кювету заполняли приблизительно 0,6 мл раствора антитела. Температуру уменьшали от 25°С до 0°С с шагом 0,5°C с использованием термоэлектрического охладителя. Образец уравновешивали в течение 10 минут при каждой температуре перед регистрацией пропускания. За температуру помутнения принимали температуру, при которой % пропускаемости снижался до 50% от исходного значения (Asherie, 2004). Те для фазового разделения антитела к IL13 при различных концентрациях белка и в различных исследуемых растворах измеряли с использованием спектрофотометра Aviv Biomedical модели 14S UV-Vis. Данные зависимости коэффициента пропускания в процентах от температуры собирали с помощью температурного сканирования от 25°С до 0°С с размером шага - 0,5°С, временем установления равновесия 600 секунд и длиной волны 600 нм. Измерения растворов белка проводили в кварцевой кювете с 1 см длиной оптического пути.
Эксклюзионная хроматография
Эксклюзионную хроматографию использовали для подсчета агрегатов и фрагментов. В указанном анализе использовали TSK G3000 SWXLTM, 7,8 Х 300 мм колонку и проводили исследование на системе для ВЭЖХ HP 1100TM при 25°С. Образцы разбавляли до 2 мг/мл с помощью подвижной фазы и объем пробы составлял 25 мкл. Подвижная фаза представляла собой 0,2 М K2HPO4, 0,25 М KCl, при рН 6,2 и белок элюировали при скорости равномерного потока, составляющей 0,5 мл/мин в течение 30 минут. Коэффициент поглощения элюента подвергали мониторингу при 280 нм. Интеграцию выполняли с использованием программного обеспечения HP CHEMSTATIONM™.
Капиллярное изоэлектрическое фокусирование (icIEF)
Образцы анализировали с использованием icIEF для подсчета стабильных образцов заряженных (кислотных и основных) вариантов антитела к IL13. В указанном способе использовали покрытый фторуглеродом капилляр (Convergent Bioscience) в анализаторе iCE280 (Convergent Bioscience) с микроинъектором PrinCE. Растворы анолита и католита приобретали у GE Healthcare Biosciences; растворы маркеров pI приобретали у Convergent Bioscience).
Капиллярный электрофорез с использованием додецилсульфата натрия (СЕ-SDS)
CE-SDS проводили с использованием системы для капиллярного электрофореза Beckman P/ACE MDQ или РА800, с возможностью контролировать температуру в капилляре от 20 до 40±2°С, с детектором LIF при возбуждении при 488 нм.
Анализ эффективности антитела к IL13
Биологическую активность или эффективность растворов антитела к IL13 оценивали с использованием анализа клеточной культуры, в котором измеряли способность растворов антитела к IL13 ингибировать вызванную IL-13 экспрессию люциферазы в линии бронхиальных эпителиальных клеток человека, клетках L-Beas-2В (доступных от АТСС, АТСС № по каталогу CRL-9609™). Различные концентрации стандарта, контроля и образцов антитела к IL13 смешивали с фиксированной концентрацией IL-13 (например, rhu-IL13, Peprotech, № по кат. 200-13) и добавляли к 96-луночному планшету, засеянному клетками L-Beas-2B в концентрации 2×105 клеток/мл. После инкубации экспрессию люциферазы рассчитывали с использованием люминесцентного субстрата люциферазы согласно инструкциям производителя (система оценки люциферазы Bright-Glo™, Promega, № по кат. Е2620, Е2650 или Brite-Lite Plus, Perkin Elmer, № по кат. 6016761). Получали кривые разведения для каждого из растворов антитела и сравнивали их с эталонным материалом. Результаты выражали в относительных люминесцентных единицах (RLU). Величину относительной эффективности рассчитывали с использованием способа наименьших квадратов и программы параллельного анализа. Специфическую активность в % рассчитывали путем умножения величины относительной эффективности на специфическую активность эталонного материала.
Аминокислотные последовательности антитела к IL13 (лебрикизумаба)
В представленной ниже таблице показаны аминокислотные последовательности областей CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3 лебрикизумаба наряду с VH, VL, последовательностями тяжелой цепи и последовательностями легкой цепи. Как показано в таблице 1 ниже, VH и тяжелая цепь могут включать в себя N-концевой глутамин, а тяжелая цепь также может включать в себя С-концевой лизин. Как хорошо известно в настоящей области техники, N-концевые остатки глутамина могут образовывать пироглутамат, а С-концевые остатки лизина могут отсекаться в ходе процессов получения.

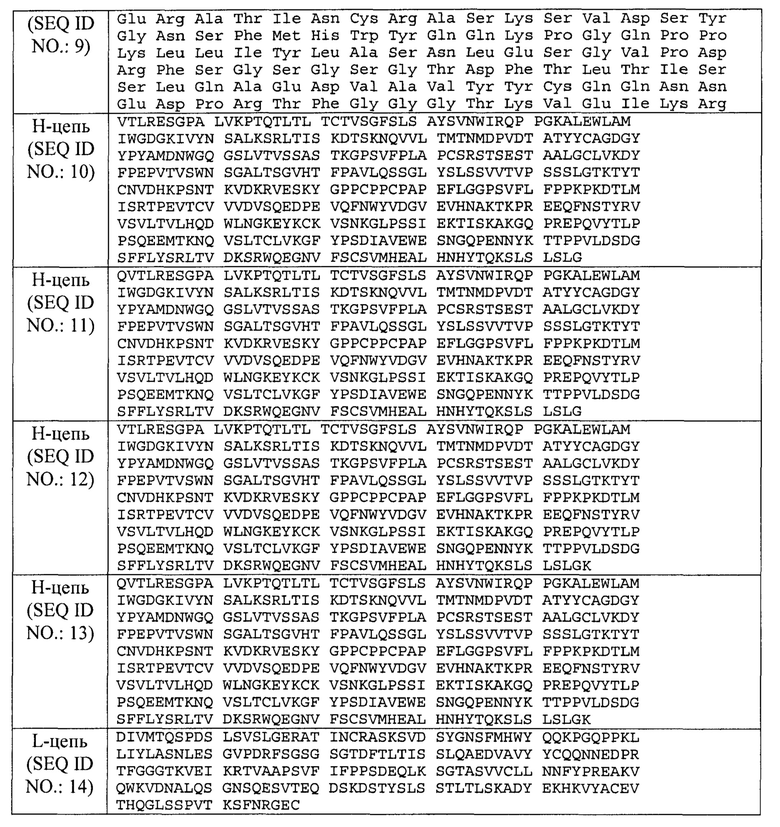
Результаты
Физическая и химическая стабильность составов антитела к IL13 при различном ЕН
Буферы с различными значениями рН получали с использованием или 20 мМ ацетата гистидина, или 20 мМ фосфата натрия, чтобы охватить диапазон рН 5,4-7,8. Буферы на основе ацетата гистидина охватывали диапазон рН 5,4-6,0, а буферы на основе фосфата натрия охватывал диапазон рН 6,6-7,8. Для каждого рН буфера следующие параметры поддерживали неизменными: концентрация антитела к IL13, составляющая 150 мг/мл, 175 мМ сахарозы и 0,3 мг/мл (0,03%) полисорбата 20.
Растворы антитела хранили во флаконах в течение периодов времени и при температурах, указанных в таблице 2 ниже. В различные моменты времени, обозначенные "X" в таблице 2, образцы анализировали с помощью различных способов для оценки физической стабильности, предусматривающих SEC, анализ определения мутности при A350 и CE-SDS в невосстанавливающих условиях, и способов для оценки химической стабильности, предусматривающих icIEF.
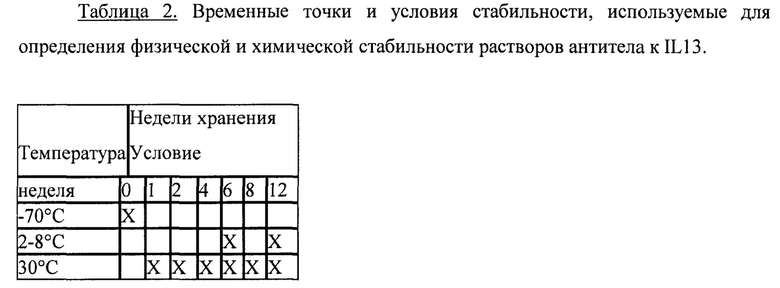
На фигуре 1 показана потеря мономера в процентах в неделю в буферах при указанном значении рН, определяемая с помощью SEC. Как показано на фиг. 1, потеря мономера в % была ниже в более низком диапазоне рН, чем в более высоком диапазоне рН, причем наименьший % потери мономера наблюдали при рН 5,7, показывая величину % потери мономера/неделя, составляющую 0,056.
В другом анализе физической стабильности измеряли изменения мутности (определяемые при A350) в течение определенного периода времени при 30°С в зависимости от рН. Как показано на фиг. 2, начальные значения мутности и изменения были выше для буферов с рН 5,4-6,0, чем в более высоких диапазонах рН. На фиг. 2, исходная мутность составляет A350=1/Т, где Т представляет собой интенсивность прошедшего через материал света при 350 нм с заданной длиной оптического пути, составляющей 1 см.
В третьем анализе физической стабильности измеряли увеличения низкомолекулярных (LMW) растворимых фрагментов и высокомолекулярных (HMW) агрегатов в растворах антитела к IL13 в течение шести недель хранения при 30°С в зависимости от рН. Как показано на фиг. 3, самые низкие скорости фрагментации и скорости агрегации наблюдались в более низком диапазоне рН, рН 5,4-6,6.
Химическую стабильность также оценивали с использованием icIEF для определения изменений в скорости образования кислотного и основного вариантов в течение времени при 30°С в зависимости от рН (фиг. 4) и изменений в скорости образования основного варианта и потери главного пика в течение времени при 30°С в зависимости от рН (фиг. 5). Как показано на фиг. 4, наименьшую скорость образования кислотного варианта наблюдали в низком диапазоне рН, а самую высокую - в высоком диапазоне рН, тогда как самую низкую скорость образования основного варианта (пика BV1) наблюдали в высоком диапазоне рН, а самую высокую - в низком диапазоне рН. Результаты, показанные на фиг. 5, указывают на то, что потеря главного пика была минимальной в диапазоне рН 5,4-6,0.
Для определения того, влияет ли значение рН на вязкость раствора, мы провели определение реологических характеристик различных концентраций антитела к IL13 (в диапазоне от 0 до 200 мг/мл антитела) при различных рН (в диапазоне рН 5,5-7,2). Каждый раствор содержал 175 мМ сахарозы и 0,3 мг/мл полисорбата 20. Результаты показаны на фиг. 6. Эти результаты показывают, что стабильный профиль вязкости поддерживался независимо от рН раствора для заданной концентрации антитела. В частности, результаты показали, что значение рН не оказывало воздействия на вязкость при повышенных концентрациях антитела.
Взятые в совокупности, представленные на фиг. 1-6 данные показывают, что наблюдался пологий градиент для большинства физических и химических изменений при рН 5,4-6,0. Следовательно, буфер на основе 20 мМ ацетата гистидина при рН 5,7 выбирали для последующих исследований и оценки состава.
Определение реологических характеристик растворов моноклональных антител в высоких концентрациях
Для исследования того, будет ли вязкость, наблюдаемая (<15 сП при 25°С)для антитела к IL13, введенного в состав в концентрации 150 мг/мл в 20 мМ ацетата гистидина при рН 5,7, 175 мМ сахарозы, 0,3 мг/мл полисорбата 20, как правило, наблюдаться для других различных антител, мы исследовали вязкость трех дополнительных антител в аналогичных составах в концентрации 150 мг/мл. Такой профиль вязкости, который наблюдали для антитела к IL13, является необходимым для получения антител в высокой концентрации и для определенных путей введения лекарственного средства, например, подкожной инъекции. Как показано на фиг. 7, антитело к IL13 сохраняло профиль вязкости, сходный с таковым для антитела к CD11a с вязкостью <15 сП при 25°С. Напротив, антитело к CD20 и антитело mAb-1 показали достаточно различные профили вязкости. Вязкость антитела к CD20 в концентрации 150 мг/мл составляла >15 сП при 25°С, тогда как mAb-1 не смогли ввести в состав в концентрации 150 мг/мл в указанном буфере вследствие значительных проблем с вязкостью, как можно увидеть на фиг. 7. На фиг. 7 показано, что вязкость mAb-1 в концентрации 125 мг/мл составляла >45 сП при 25°С. Соответственно, из представленных данных ясно видно, что различные антитела обладают различными реологическими характеристиками при введении в состав в концентрации 150 мг/мл в 20 мМ ацетата гистидина при рН 5,7, 175 мМ сахарозы, 0,3 мг/мл полисорбата 20.
Определение характеристик внешнего вида и опалесценции Мы определили характеристики внешнего вида и опалесценции состава антитела к IL13 по сравнению с составом антитела к CD20 с использованием нефелометрии при 90° и измерений мутности при A350. На фигуре 8 показано количественное определение внешнего вида составов двух различных антител в нефелометрических единицах мутности (NTU). На фиг. 8, R1, R2, R3 и R4 относятся к стандартным образцам, причем R4 характеризуется самой высокой степенью внешней опалесценции, а R1 характеризуется наименьшей степенью указанного показателя. Измерения мутности при А350 для антител к IL13 и CD20 показаны на фиг. 9. Как показано на фиг. 9, для каждого состава антител мутность повышалась с увеличением концентрации белка. Показанные на этих фигурах результаты демонстрируют, что два различных измерения внешнего вида двух антител характеризовались различными трендами, особенно при повышенных концентрациях белка вследствие различий в том, что в действительности измеряли. Данные также показывают, что тренды измерений согласуются между этими двумя антителами, которые, вероятно, характеризуются повышенной опалесценцией раствора.
Мы также исследовали концентрацию антитела к IL13 как функцию от концентрации и рН. Результаты показаны на фиг. 10. Растворы, показывающие самый высокий уровень мутности, находились вблизи изоэлектрической точки моноклонального антитела (pI).
Не связываясь с теорией, мы интерпретируем полученные результаты, чтобы показать, что коэффициент поглощения при длине волны 350 нм (мутность) снижался с увеличением концентрации белка вследствие поглощения света полосой поглощения белка с максимумом около 280 нм вследствие широкого хвоста указанного пика. Второй фактор, вносящий вклад в уменьшенную при A350 мутность в зависимости от концентрации растворов mAb, представлял собой нелинейное увеличение светорассеяния, снижающее общий проходящий через материал свет.
Кроме того, мы оценили количество невидимых невооруженным глазом твердых частиц в зависимости от концентрации mAb, и эти результаты показаны на фиг. 11. Не наблюдали видимого увеличения невидимых невооруженным глазом твердых частиц размером >2 мкм с помощью анализа твердых частиц способом затемнения света HIAC, указывая на то, что твердые частицы>2 мкм не вносят вклад в опалесценцию или мутность растворов антитела к IL13. На фигуре 12 показаны измерения нефелометрического, турбидиметрический и статического светорассеяния раствора антитела к IL13 в концентрации 125 мг/мл, когда растворы антитела фильтровали с уменьшающимся размером пор (до 0,1 мкм или 100 нм). Эти результаты, показанные на фигурах 11 и 12, совместно указывают на то, что внешний вид раствора антитела к IL13 и состава лекарственного продукта не определяется невидимыми невооруженным глазом или субмикронными твердыми частицами, вызывающими концентрационную зависимость светорассеяния.
Далее мы исследовали зависимость внешнего вида раствора от рН раствора в концентрации 125 мг/мл и 204 мг/мл. Внешний вид раствора оценивали с использованием температурного сканирования интенсивности прошедшего через материал света при 600 нм. Результаты показаны на фиг. 13 и указывают на то, что опалесценция раствора антитела к IL13, которая остается постоянной при снижающейся температуре, не была обусловлена такими критически важными явлениями, как разделение двух жидких фаз, где компоненты раствора характеризуются различной растворимостью и образуют две отдельные фазы различного состава. Это указывает на то, что на гомогенность раствора (фазовое разделение) в диапазоне типичных температур хранения и/или воздействия не оказывает влияния температура, несмотря на исходную опалесценцию/внешний вид раствора (при комнатной температуре).
Исследования термической стабильности (Tmelt)
Мы измеряли пики температурного перехода плавления для двух частично разделенных пиков в капиллярном дифференциальном сканирующем калориметре в зависимости от композиции состава и рН раствора. Результаты показаны на фиг. 14. Как показано на фиг. 14, максимум в поведении фазового перехода плавления для антитела к IL13 в зависимости от рН наблюдали в диапазоне рН 6,0-7,5. Преобладающее научно-обоснованное мнение состоит в том, что чем ниже происходит фазовый переход плавления, тем ниже предполагаемая физическая стабильность системы при хранении в течение любой длительности. Смотрите, например, Chi et al., Белок Science 12(5): 903-913 (2003); Chi et al., Pharmaceutical Research 20(9): 1325-1336 (2003); Goldberg et al., J. Pharm. Sciences 100(4): 1306-1315 (2011). Таким образом, показанные в настоящем документе данные о физической стабильности для состава антитела к IL13 (рН 5,7) были удивительными и неожиданными.
Коллоидная стабильность
Коллоидную стабильность измеряли с помощью статического светорассеяния с использованием разбавленных растворов антител (в диапазоне 0,10-1 мг/мл), а также светорассеяния при концентрациях антител, превышающих 200 мг/мл. Коллоидная стабильность относится к поведению раствора суспендированных в растворе макромолекул и позволяет исследовать равновесие, усредненные по времени взаимодействия между такими макромолекулами, как моноклональные антитела. Не связываясь с теорией, если взаимодействия являются силами отталкивания, то можно предположить, что состав раствора остается стабильным. Тем не менее, между растворенными молекулами возникают результирующие взаимодействия притяжения и, как правило, они связаны с фазовыми переходами и трудностями с растворимостью белка.
Мы измерили осмотические вторые вириальные коэффициенты (B2) для антитела к IL13 (в концентрациях в диапазоне от 0,1 до 1,0 мг/мл) в зависимости от рН раствора с образцами в простых буферах. Следует отметить, что на фигурах 15 и 16 значения выше 0 представляют собой положительные осмотические вторые вириальные коэффициенты, указывающие на результирующие взаимодействия отталкивания, а значения ниже 0 представляют собой отрицательные осмотические вторые вириальные коэффициенты, которые указывают на межмолекулярные взаимодействия притяжения. Данные на фиг. 15 показывают, что антитело к IL13 характеризовалось взаимодействиями притяжения во всем диапазоне рН, но при этом наиболее сильные взаимодействия притяжения возникали в диапазоне рН 5,5-6,5. Для результатов, показанных на фиг. 16, добавки для получения состава добавляли к растворам при различных значениях рН. Как видно на фиг. 16, измеренные осмотические вторые вириальные коэффициенты при рН 5,5-6,5 оставались отрицательными и, следовательно, отражающими силы притяжения. Измерения светорассеяния с помощью детектора многоуглового светорассеяния во всем диапазоне концентраций 1-200 мг/мл, экстраполирующие интенсивности на угол рассеяния 0, показаны на фиг. 17. Эти данные показали, что профиль интенсивности рассеянного света был в высокой степени сходным с таковым, наблюдаемым для нефелометра НАСН (сравните фиг. 8 с фиг. 17). Оба прибора измеряют интенсивность рассеянного света и, следовательно, рэлеевское рассеяние. Это рассеяние преобладает в растворах, свободных от твердых частиц, и оно вызвано небольшими флуктуациями в плотности и концентрации раствора, которые также зависят от взаимодействий между рассеивающими молекулами. Снижение интенсивности рассеянного света происходит, когда молекулы в возрастающей степени приходят в тесный контакт друг с другом, и их положения во времени/пространстве становятся взаимосвязанными, приводя к ослабляющей интерференции рассеянного света (смотрите, например, Bettelheim et al., Biophysical Journal 41(1): 29-33 (1983); Xia et al., Biophysical Journal 66(3_Pt_1): 861-872 (1994); и Xia et al., Biophysical Journal 41(1): 29-33 (1996). На фигуре 18 показаны данные зависимости статического светорассеяния для антитела к IL13 от рН состава. Данные на фиг. 18 представлены как средние молекулярные массы, наблюдаемые при концентрациях антитела до 200 мг/мл. Показанные на фиг. 18 данные указывают на коллоидные взаимодействия притяжения в диапазоне от слабых (рН 7,2) до (рН 6,5) и самоассоциацию антитела к IL13 во всем концентрационном диапазоне, относительно теоретического рассеяния для простой модели твердых сфер исключенного объема mAb (пунктирная линия на фиг. 18).
Как антитела к IL13, так и антитела к CD20 показали сопоставимые уровни мутности, вызванной коллоидными взаимодействиями притяжения и самоассоциацией mAb, как показано на фиг. 19. Удивительно, что коллоидные взаимодействия притяжения не проявлялись в виде высоких вязкостей (например, >15 сП в концентрации 150 мг/мл) или реологических трудностей с составом антитела к IL13, как показано на фиг. 20. Однако коллоидные взаимодействия антитела к CD20 действительно оказывали воздействие на реологию раствора, приводя в результате не только к опалесценции раствора (фиг. 8), но также к высоким значениям вязкости >15 сП при 25°С и в концентрации 150 мг/мл (фиг. 20).
Длительная физическая, химическая стабильность и стабильность эффективности
Для исследования длительной стабильности и эффективности антитело к IL13 вводили в состав в концентрации 125 мг/мл в 20 мМ ацетата гистидина при рН 5,7, 175 мМ сахарозы и 0,3 мг/мл полисорбата 20 и затем подвергали различным условиям хранения. Флаконы хранили либо при 5°С, либо при 25°С в течение нескольких недель, показанных в таблице 3 (до 156 недель при 5°С и до 26 недель при 25°С). Для каждой временной точки, показанной в таблице 3, образцы анализировали в отношении вешнего вида цвета и прозрачности (САС), рН и указанного параметра химической или физической стабильности. Кроме того, для каждой временной точки также оценивали биологическую активность (эффективность). Как показывают данные в таблице 3, антитело к IL13, введенное в состав в концентрации 125 мг/мл в 20 мМ ацетата гистидина при рН 5,7, 175 мМ сахарозы и 0,3 мг/мл полисорбата 20, сохраняло эффективность и показывало хорошую химическую и физическую стабильность при 5°С в течение полных 156 недель (трех лет) и при 25°С в течение полных 26 недель. Эти данные подтверждают то, что указанный состав сохраняет требуемые химические, физические характеристики и признаки эффективности антитела к IL13 в течение длительного периода времени.

Выводы
Мы показали, что антитело к IL13 было успешно введено в состав при рН и условиях раствора со вспомогательными веществами, которые стимулируют как длительную химическую, так и физическую стабильность, а также поддерживают эффективность. В частности, мы показали, что состав содержал антитело в концентрациях 100 мг/мл и выше, включающих в себя 125 мг/мл и 150 мг/мл, в 20 мМ ацетата гистидина при рН 5,7, 175 мМ сахарозы и 0,3 мг/мл полисорбата 20. Неожиданно мы обнаружили, что состав характеризовался необходимым профилем вязкости <15 сП при 25°С. Такой профиль вязкости является необходимым для производственной технологичности, а также для простоты введения, например, для подкожной инъекции, при которой высокая концентрация лекарственного продукта в небольшом объеме является оптимальной по некоторым причинам, включающим в себя комфорт пациента и его приверженность к лечению. Мы обнаружили, что другие антитела в таком же или сходном составе характеризовались нежелательным профилем вязкости >15 сП при 25°С, что подчеркивает невозможность прогнозирования профиля вязкости составов антитела к IL13.
Кроме того, два наиболее часто используемые критерия для выбора состава белка включают в себя термическую стабильность и коллоидную стабильность (See Chi et al., Protein Science 12(5): 903-913 (2003); Chi et al., Pharmaceutical Research 20(9): 1325-1336 (2003)). Термический анализ температур разворачивания антитела к IL13 в растворах указывает на то, что физическая стабильность при условиях рН 5,4-6,0 не будет оптимальной для физической стабильности состава антитела. Анализ коллоидной стабильности растворов антитела к IL13 также указывает на то, что условия получения состава в диапазоне рН 5,5-6,5 будут наименее желательными для поддержания низких скоростей агрегации. Также неожиданным, как показывают представленные в настоящем документе данные, было то, что введенное в состав при рН 5,7антитело к IL13 показало хорошую физическую стабильность в течение длительного периода времени при 5°С, а также при условиях ускоренной деградации. Также было неожиданным то, что стабильность продукта при указанных условиях превосходила стабильность, наблюдаемую при более высоких значениях рН, как физически, так и химически, даже при условии более низких температурных переходов плавления и коллоидной стабильности. Наряду с тем, что внешний вид (и мутность) составленного раствора антитела к IL13 был более опалецирующим при выбранных условиях получения состава, чем в определенных не выбранных условиях, молекулярные свойства и композиция состав сохраняли оптимальную стабильность как при условиях хранения в режиме реального времени, так и при условиях ускоренной деградации, сохраняли эффективность и обеспечивали необходимые реологические свойства раствора для доставки высоких концентраций лекарственного продукта в небольшом объеме.
Устройство для подкожного введения
Устройство для подкожного введения, содержащее предварительно наполненный шприц с иглой, плунжером с ограничителем хода поршня, защитным колпачком для иглы и защитным устройством для иглы для введения описанного выше состава антитела к IL13, выбирали путем оценки разнообразных коммерчески доступных компонентов. Например, оцененные компоненты включали в себя стеклянный цилиндрические, формованные шприцы с несъемной иглой, плунжеры и ограничители хода поршня, твердые защитные колпачки для иглы и защитные устройства для иглы.
Различные компоненты оценивали в различных комбинациях согласно известным специалисту в настоящей области техники способам в отношении эффектов на свойства состава, включающие в себя без ограничения стабильность и другие факторы, которые необходимо учитывать, такие как комфорт пациента и его приверженность к лечению, которые включают в себя такие факторы, как величина калибра иглы и внутреннего диаметра иглы, на время инъекции и силы трения скольжения, когда состав характеризуется определенными описанными в настоящем документе показателями вязкости. Эти исследования привели нас к выбору в качестве оптимального устройства для подкожного введения для введения лебрикизумаба, соедржащегося в составе в высокой концентрации, как описано в настоящем документе, предварительно наполненный шприц объемом 1,0 мл из боросиликатного стекла с низким содержанием вольфрама (тип I) и тонкостенную несъемную иглу из нержавеющей стали с типом заточки острия 5 В, калибра 27G, длиной 1/2 дюйма, с твердым защитным колпачком для иглы, содержащим в своем составе FM27/0 (Daetwyler) и твердый полипропилен защитный колпачок. Кроме того, шток поршня содержал резиновый ограничитель хода поршня, содержащий в своем составе резину 4023/50 и этилентетрафторэтиленовое (ETFE) покрытие FluroTec® (West Pharmaceutical Services, Inc.). Устройство для подкожного введения также содержало защитное устройство для иглы, Ultrasafe Passive® Needle Guard X100L (Safety Syringes, Inc.). Подробное описанное выше устройство для подкожного введения далее называется предварительно наполненный шприц с несъемной иглой или "SIN PFS."
Чтобы продемонстрировать сопоставимую стабильность лекарственного продукта лебрикизумаба во флаконе с выбранным SIN PFS, мы оценили лекарственное вещество GMP (надлежащей производственной практики), которым заполнили вручную 2 ее флакона или 1 мл SIN PFS при 40°С/окружающей относительной влажности. Мы оценивали скорости деградации, которые характеризовались изменениями в мономере, измеренными с помощью эксклюзионной хроматографии (SEC), а также изменениями в главном пике в процентах, измеренными с помощью капиллярного изоэлектрического фокусирования (ICIEF) и капиллярного электрофореза с использованием додецилсульфата натрия (CE-SDS).
Эти исследования показали, что после хранения при 40°С в течение 4 недель не наблюдали никаких существенных различий в снижении в мономере, измеренном с помощью SEC, между флаконами и SIN PFS (при этом каждый показал 0,6%-0,9% снижение) или в снижении в главном пике в процентах (каждый показал 18-21% снижение, измеренное с помощью ICIEF и 0,9%-1,5% снижение, измеренное CE-SDS). Кроме того, хроматографические профили были сопоставимы друг с другом и никаких новых пиков не наблюдали в образцах SIN PFS по сравнению с образцами во флаконах.
Наблюдались небольшие различия в скоростях деградации (0,5%-0,6% повышение высокомолекулярных соединений для флакона по сравнению с 0,8% увеличением высокомолекулярных соединений для SIN PFS через 4 недели при 40°С). Предположили, что небольшое различие маловероятно повлияет на качество продукта в ходе хранения в режиме реального времени.
Соответственно, мы делаем вывод, что описанные выше данные показывают, что стабильность лекарственного продукта лебрикизумаба в высокой концентрации, введенного, как описано выше, в состав во флаконах, сопоставима со стабильностью в выбранном описанном выше SIN PFS.
Некоторые ссылки
Akers, M.J. et al. (2002) "Formulation Development of Protein Dosage Forms", Development and Manufacture of Protein Pharmaceuticals, pgs. 47-127.
Bettelheim, F.A. and E,L. Siew (1983). "Effect of change in concentration upon lens turbidity as predicted by the random fluctuation theory." Biophysical Journal 41(1): 29-33.
Burckbuchler, V.; Mekhloufi, G.; Giteau, A.P.; Grossiord, J.L.; Huille, S.; Agnely, F. EurJPharm Biopharm 2010, 76, 351.
Chi, E.Y., S. Krishnan, et al. (2003). "Roles of conformational stability and colloidal stability in the aggregation of recombinant human granulocyte colony-stimulating factor." Protein Science 12(5): 903-913.
Chi, E.Y., S. Krishnan, et al. (2003). "Physical stability of proteins in aqueous solution: Mechanism and driving forces in normative protein aggregation." Pharmaceutical Research 20(9): 1325-1336.
Development and Optimization of Protein Formulation DSC Application Note, available at www(dot)microcalorimetry(dot)com (October 31, 2011).
Goldberg, D.S. et al. (April 2011). "Formulation Development of Therapeutic Monoclonal Antibodies Using High-Throughput Fluorescence and Static Light Scattering Techniques: Roll of Conformational and Colloidal Stability", Journal of Pharm. Sciences, 100, (4): pgs. 1306-1315.
Jezek, J.; Rides, M.; Derham, B.; Moore, J.; Cerasoli, E.; Simler, R.; Perez-Ramirez, B. Advanced Drug Delivery Reviews 2011, 63, 1107.
Le Brun, V. et al. (2010): "A critical evaluation of self-interaction chromatography as a predictive tool for the assessment of protein-protein interactions in protein formulation development: A case study of a therapeutic monoclonal antibody", European Journal of Pharmaceutics and Biopharmaceutics, 75, pgs. 16-25.
Mason, B.D. et al. (2011). "Opalescence of an IgG2 Monoclonal Antibody Solution as it Relates to Liquid-Liquid Phase Separation", Journal of Pharm,. Sciences, 100, pgs. 4587-4596.
Minton, A.P. (2007). "The effective hard particle model provides a simple, robust, and broadly applicable description of nonideal behavior in concentrated solutions of bovine serum albumin and other nonassociating proteins." J Pharm Sci 96(12): 3466-9.
Minton, A.P. (2007). "Static Light Scattering from Concentrated Protein Solutions, I: General Theory for Protein Mixtures and Application to Self-Associating Proteins." Biophvsical Journal 93(4): 1321-1328.
Nishi, H.; Miyajima, M.; Wakiyama, N.; Kubota, K.; Hasegawa, J.; Uchiyama, S.; Fukui, K. JBiosci Bioeng20ll, 112, 326.
Nishi, H.; Miyajima, M.; Nakagami, H.; Noda, M.; Uchiyama, S.; Fukui, K. Pharmaceutical Research 2010, 27, 1348.
Saito, S.; Hasegawa, J.; Kobayashi, N.; Kishi, N.; Uchiyama, S.; Fukui, K. Pharm Res 2012,29, 397.
Salinas, B.A. et al. (Jan. 2010). "Understanding and Modulating Opalescence and Viscosity in a Monoclonal Antibody Formulation", Journal of Pharm. Sciences, 99 (I): pgs, 82-93.
Saluja, A.; Badkar, A.V.; Zeng, D.L.; Nema, S.; Kalonia, D.S. Journal of Pharmaceutical Sciences 2006, 95, 1967.
Scherer, T.M., J. Liu, et al. (2010). "Intermolecular Interactions ofIgGI Monoclonal Antibodies at High Concentrations Characterized by Light Scattering." The Journal of Physical Chemistry B 114(40): 12948-12957.
Sukumar, M. et al. (July 2004): "Opalescent Appearance of an IgGI Antibody at High Concentrations and Its Relationship to Noncovalent Association", Pharm. Research, 21 (7) pgs. 1087-1093.
Volkin, D.B. et al. (2002) "Preformulation Studies as an Essential Guide to Formulation Development and Manufacture of Protein Pharmaceuticals", Development and Manufacture of Protein Pharmaceuticals, 14, 1-46.
Xia, J.Z., T. Aerts, et al. (1994). "Light scattering by bovine alpha-crystallin proteins in solution: hydrodynamic structure and interparticle interaction." Biophysical Journal 66(3_Pt_1): 861-872.
Xia, J.Z., Q. Wang, S. Tatarkova, T. Aerts, J. Clauwaert (1996). "Structural basis of eye lens transparency: light scattering by concentrated solutions of bovine alpha-crystallin proteins " Biophysical Journal 71(5): 2815-2822.
Yadav, S., J. Liu, et al. (2009). "Specific interactions in high concentration antibody solutions resulting in high viscosity." J Pharm Sci.
Yadav, S.; Shire, S.J.; Kalonia, D.S. Journal of Pharmaceutical Sciences 2010, 99, 4812.
Yadav, S.; Sreedhara, A.; Kanai, S.; Liu, J.; Lien, S.; Lowman, H.; Kalonia, D.S.; Shire, S. J. Pharmaceutical Research 2011, 28, 1750.
Yadav, S.; Liu, J.; Shire, S. J.; Kalonia, D.S. Journal of Pharmaceutical Sciences 2010,99,1152.
Yadav, S.; Shire, S.J.; Kalonia, D.S. Journal of Pharmaceutical Sciences 2012, 101, 998.
Yadav, S.; Shire, S.J.; Kalonia, D.S. Pharmaceutical Research 2011, 28, 1973.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2671481C2 |
| СОСТАВ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2019 |
|
RU2806628C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2010 |
|
RU2565809C2 |
| СОСТАВЫ НА ОСНОВЕ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ К IL-4/IL-13 | 2014 |
|
RU2690850C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА С ПОВЫШЕННОЙ СТАБИЛЬНОСТЬЮ | 2015 |
|
RU2684703C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛ К CD38 ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2020 |
|
RU2838165C1 |
| СОСТАВЫ АНТИТЕЛ К RSV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807524C2 |
| Составы на основе антитела к CD19 | 2017 |
|
RU2748024C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ПРОГРАММИРУЕМОЙ СМЕРТИ PD-1 ЧЕЛОВЕКА И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ ЛЕЧЕНИЯ | 2012 |
|
RU2633509C2 |
















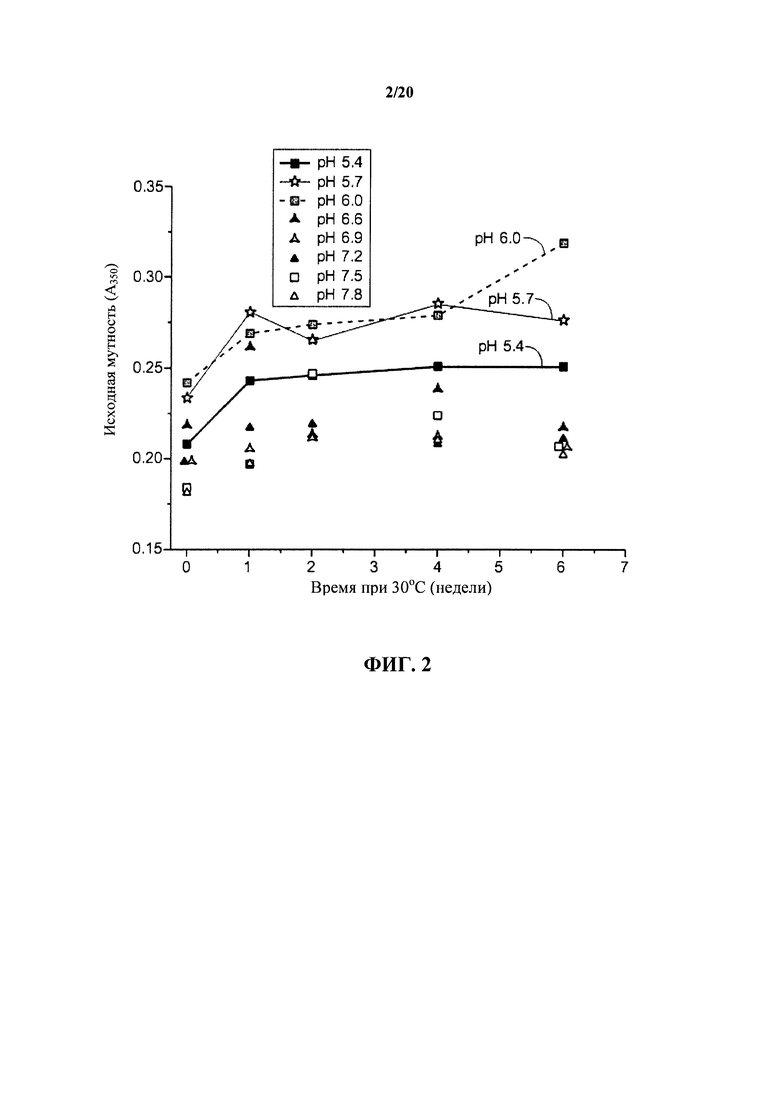
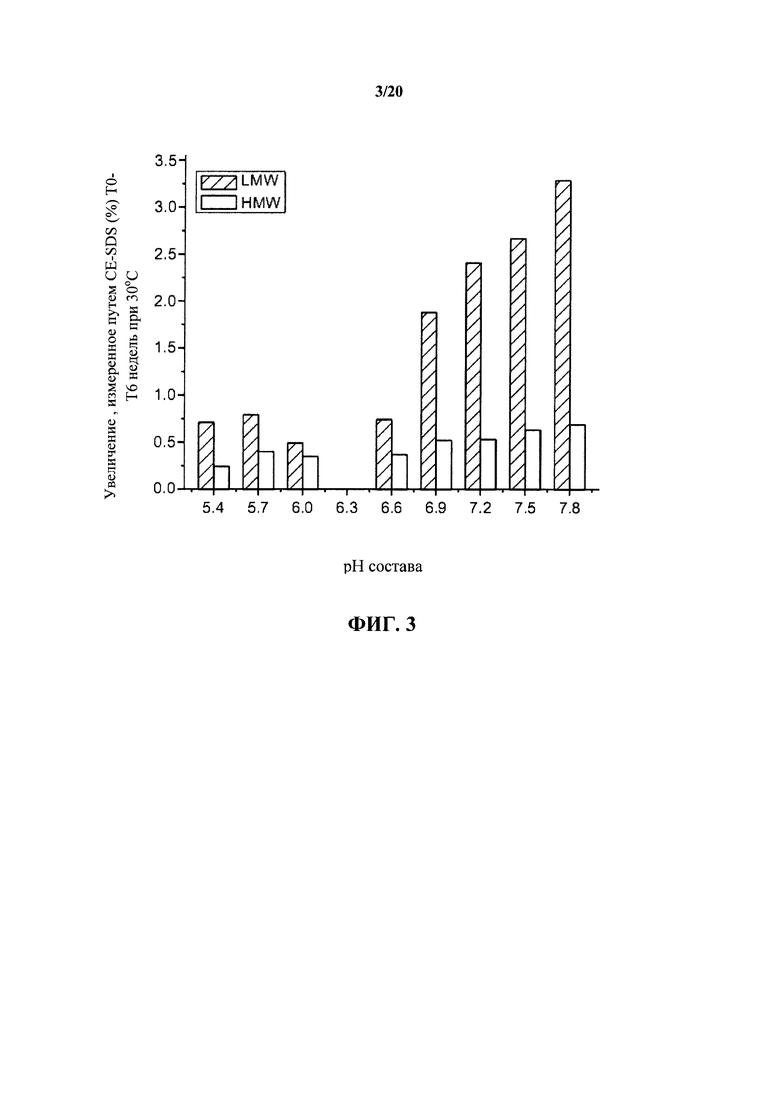
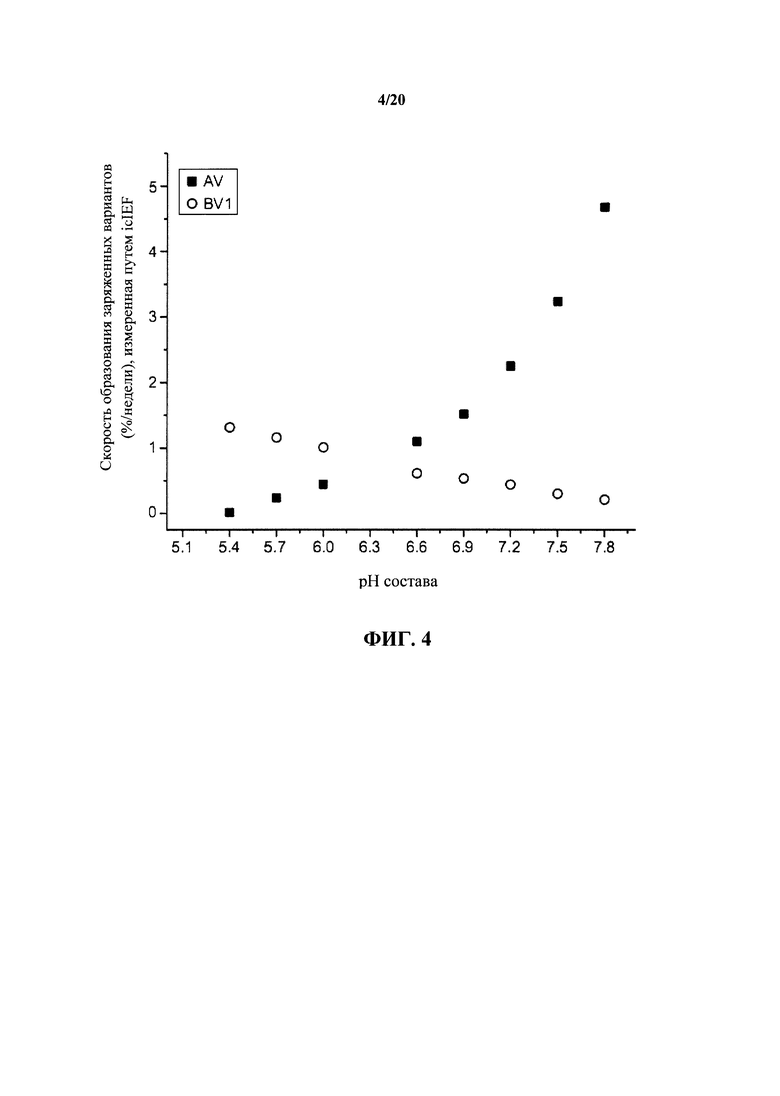
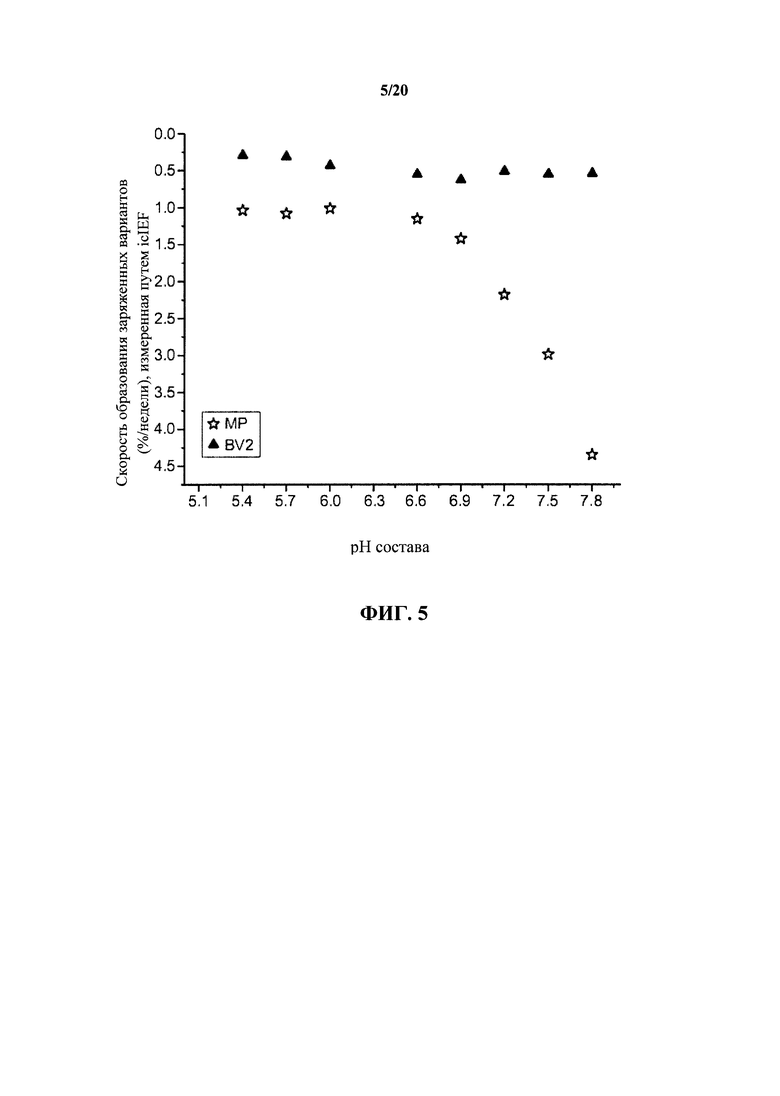
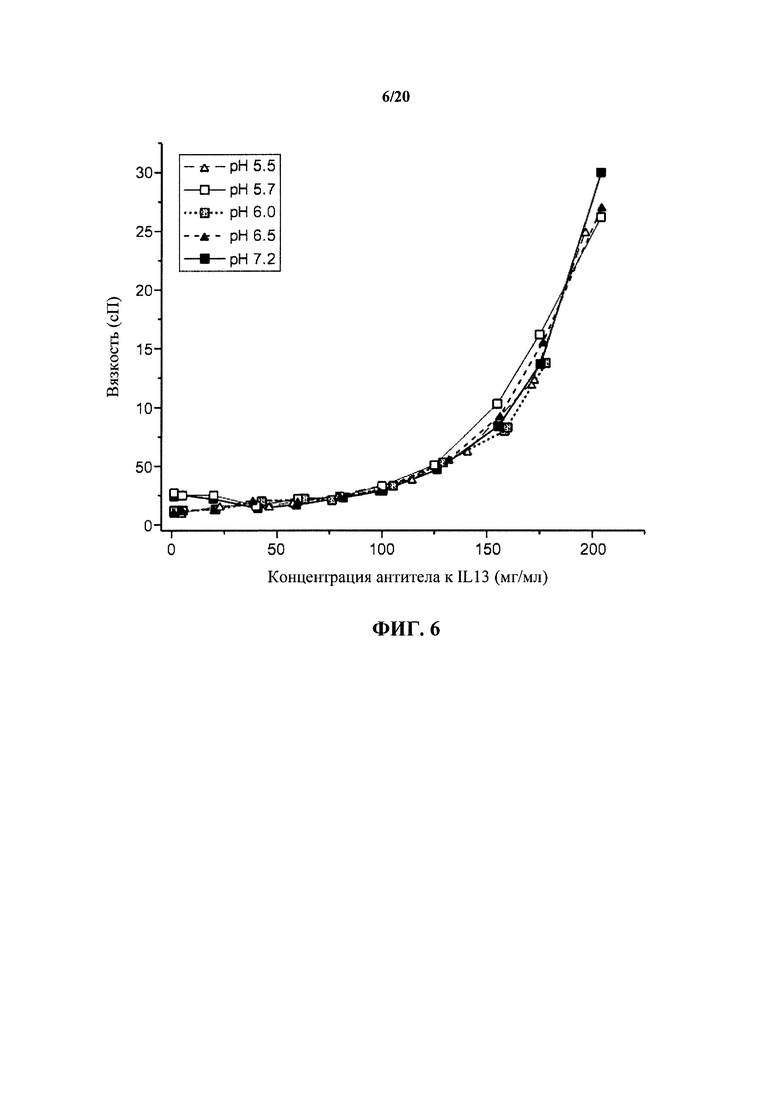
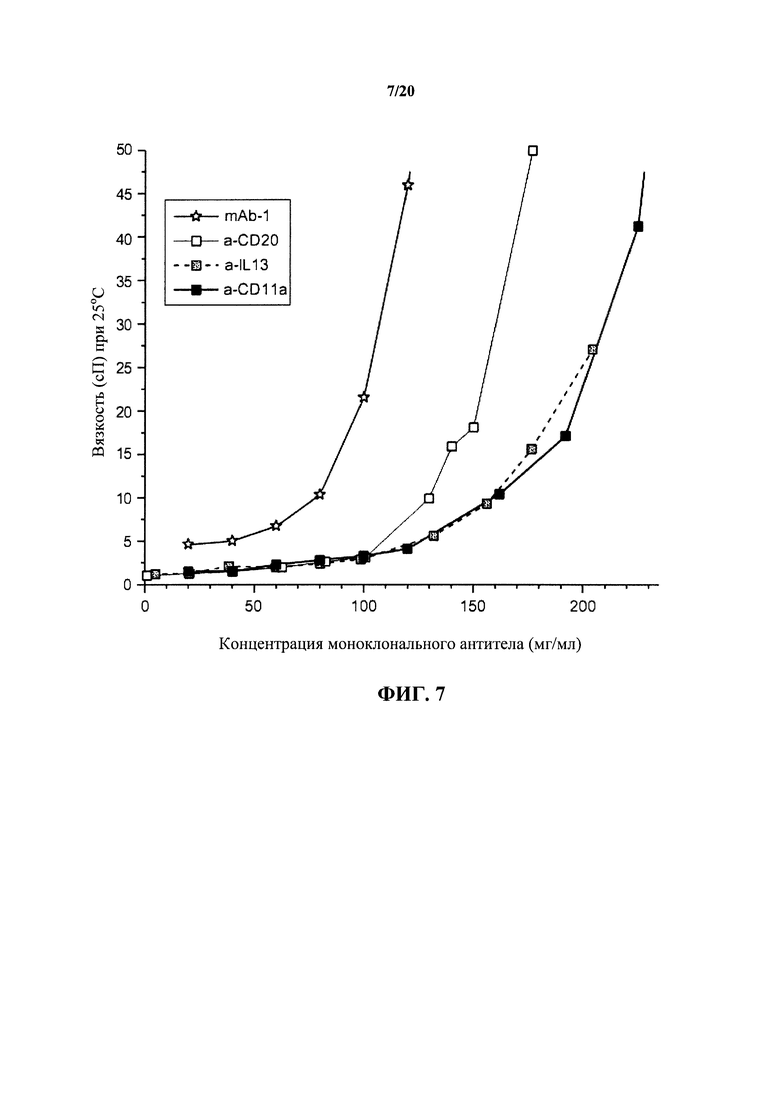
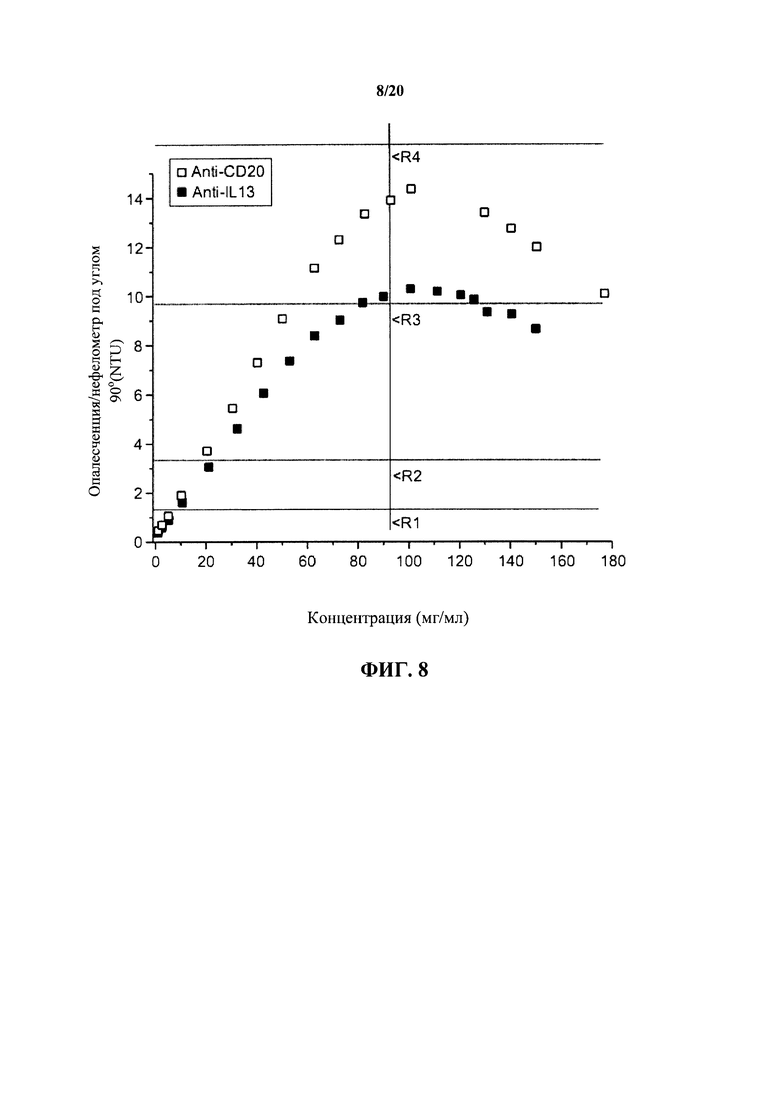
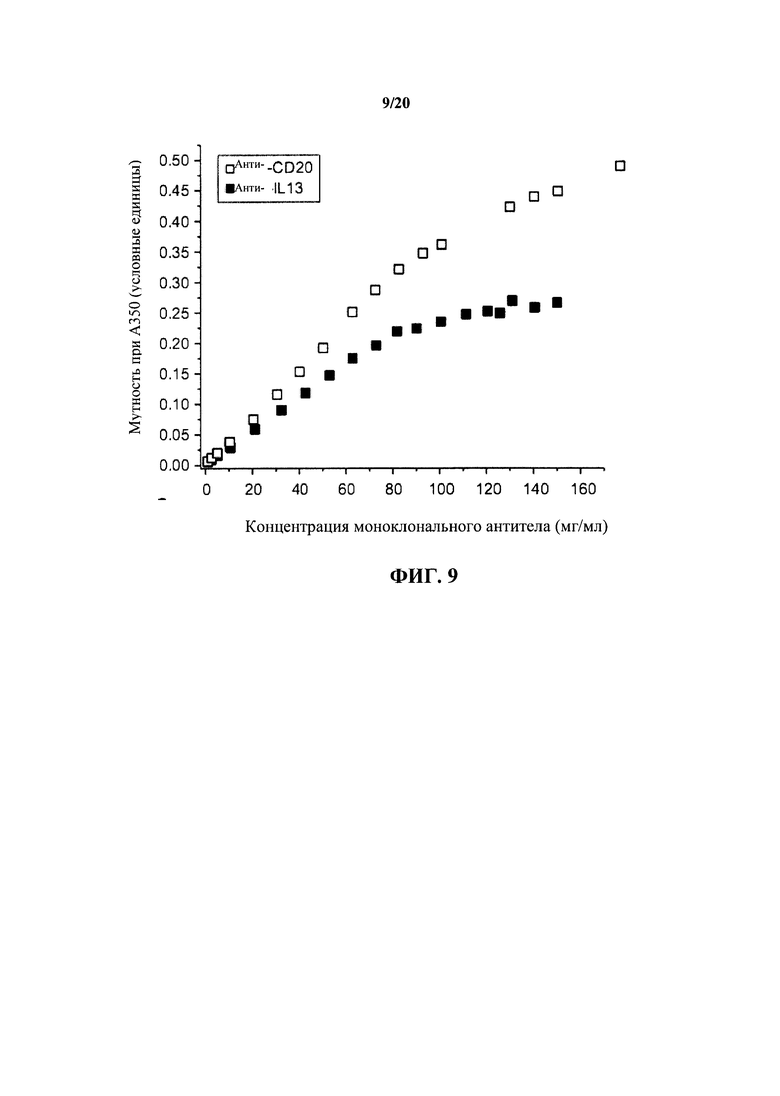

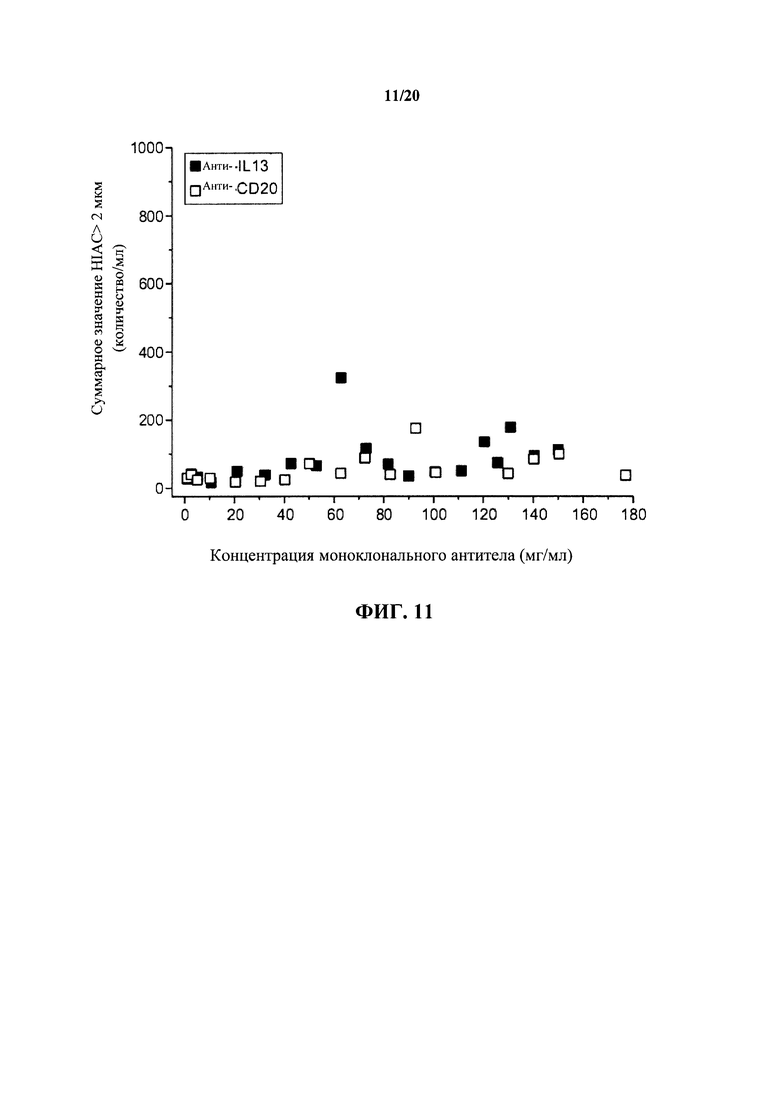
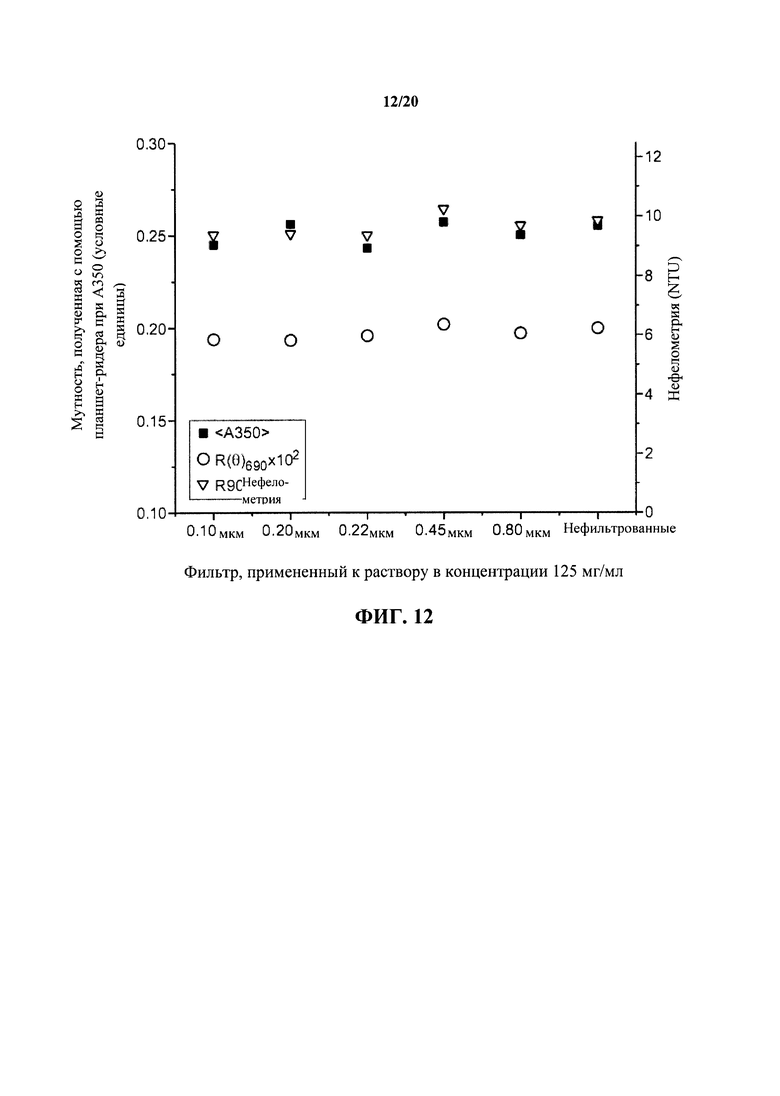
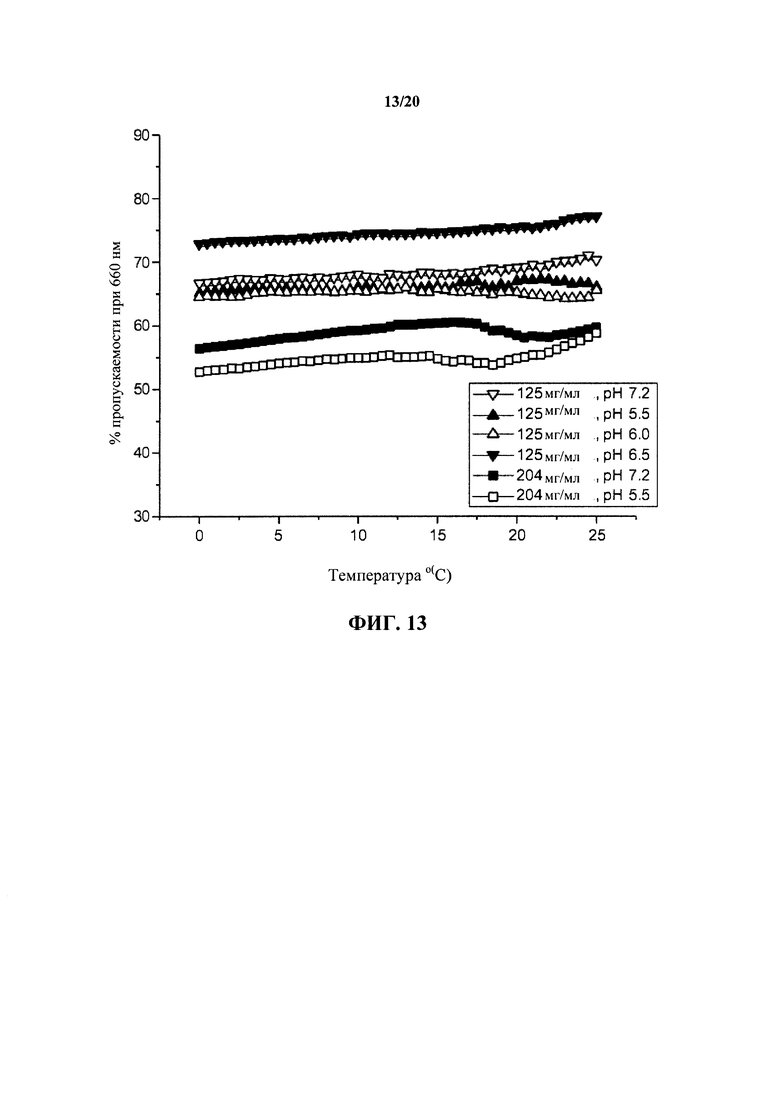
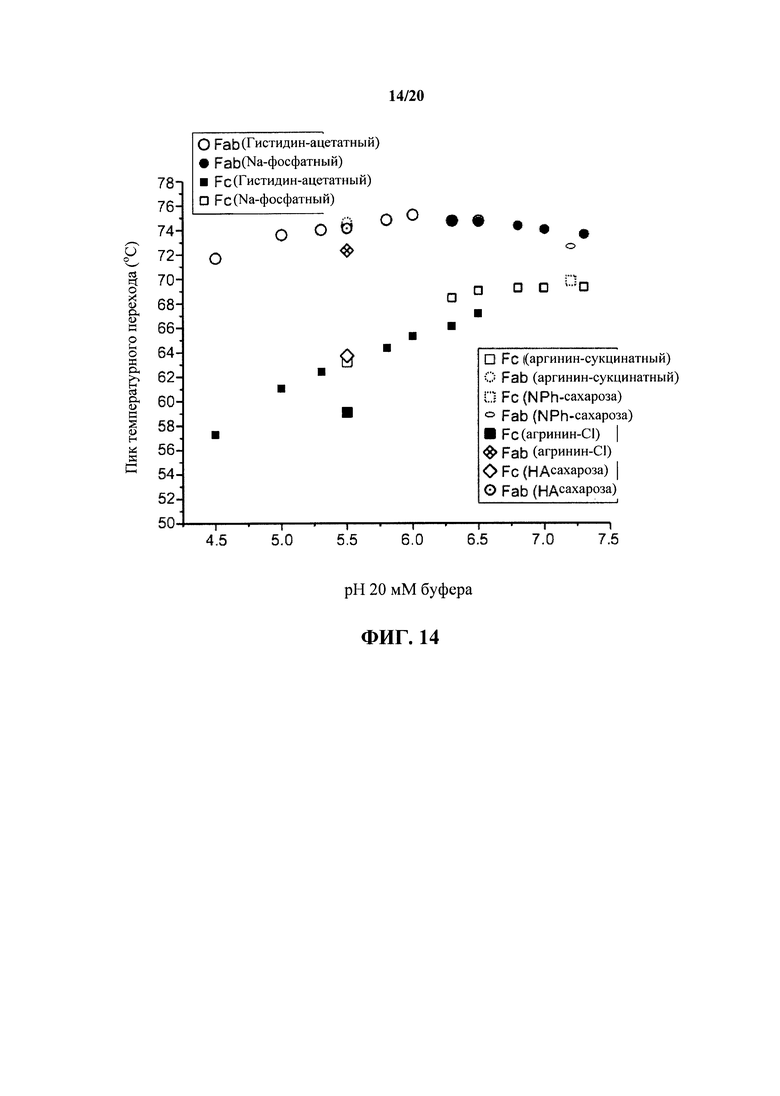
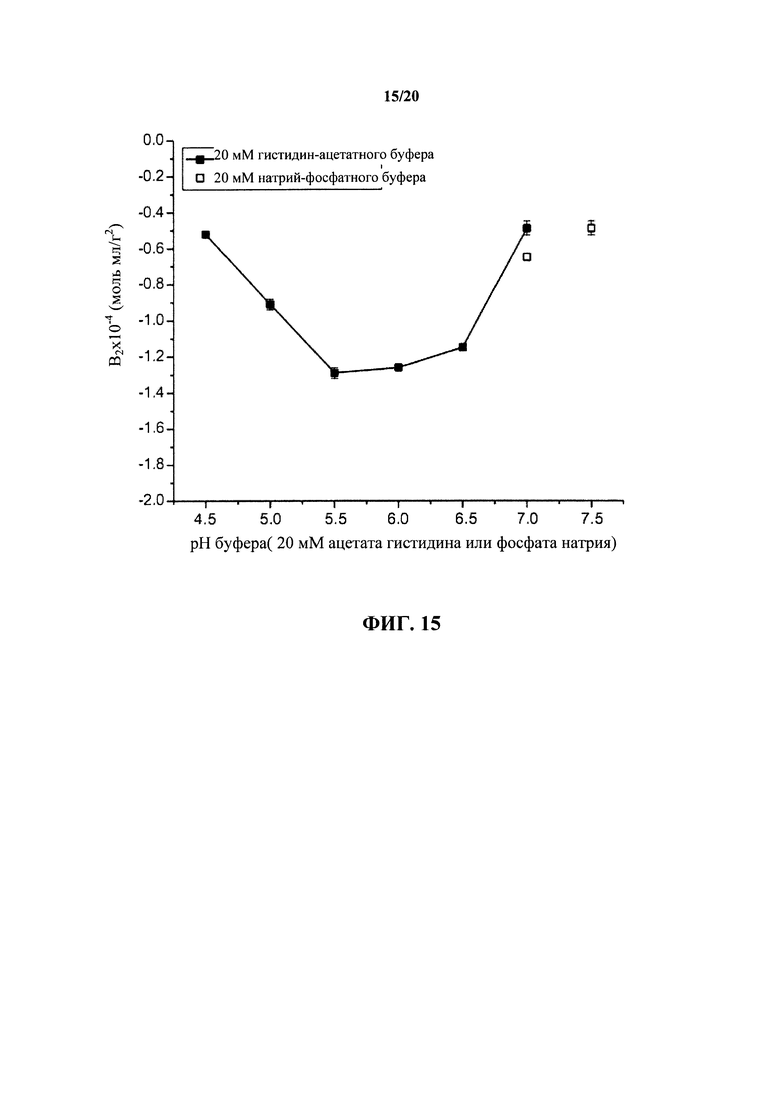
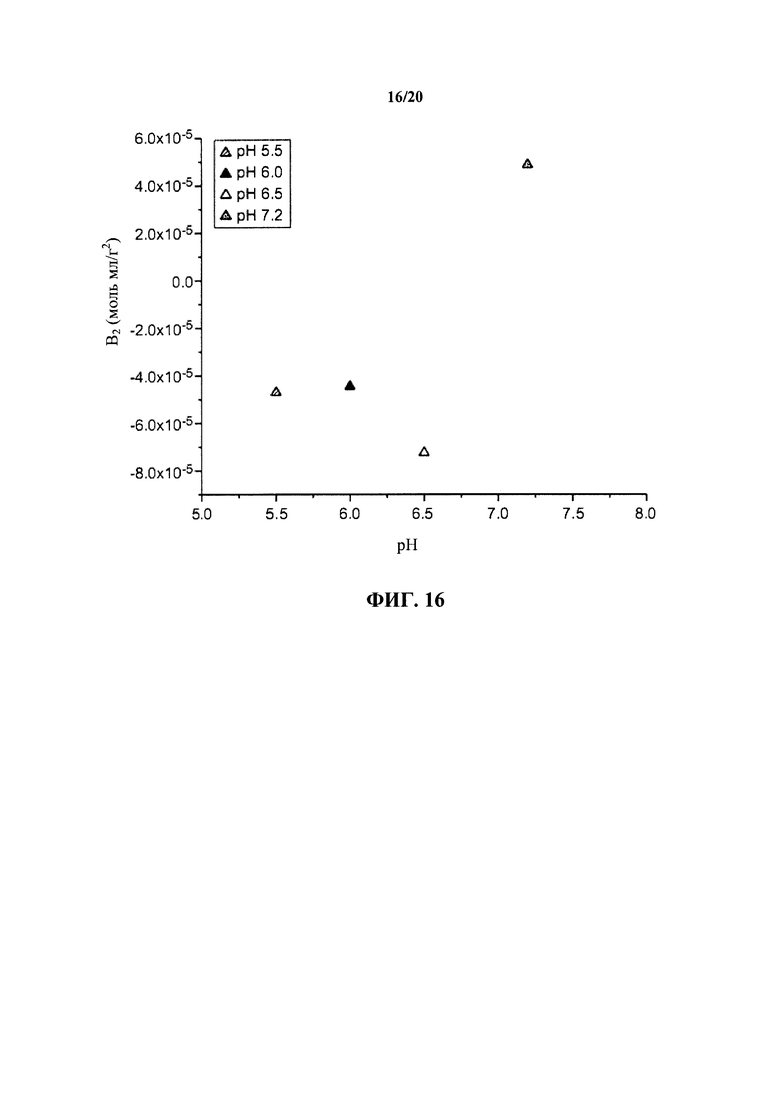
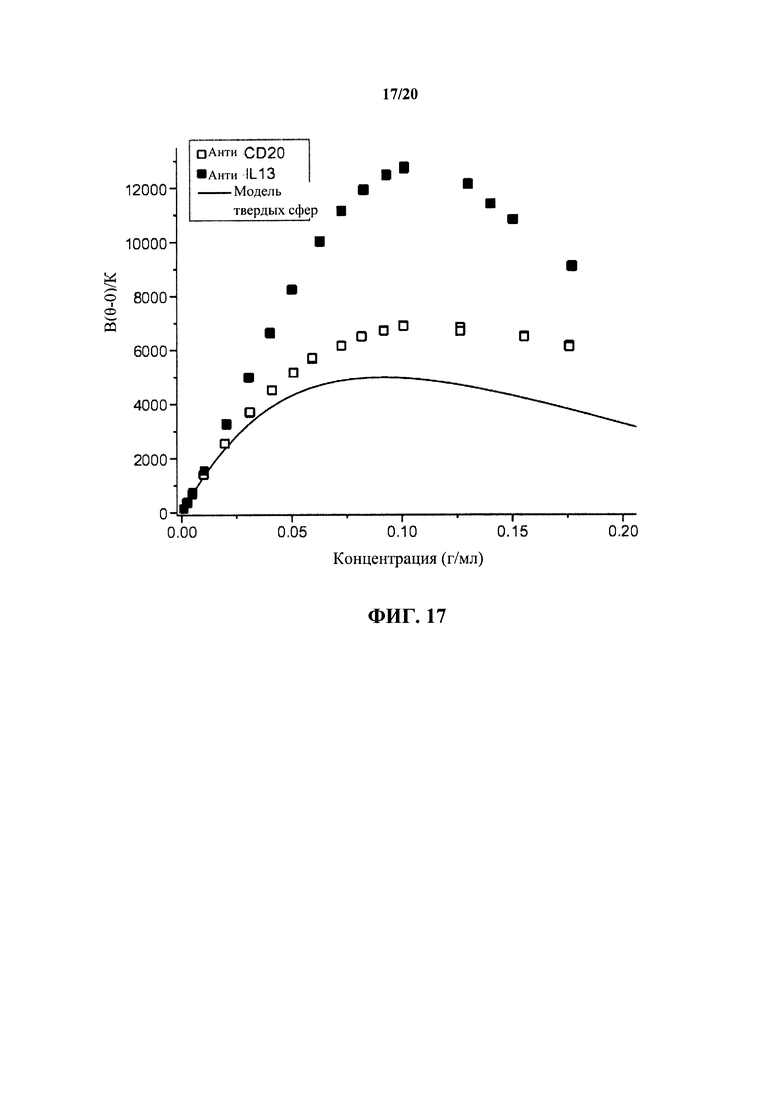
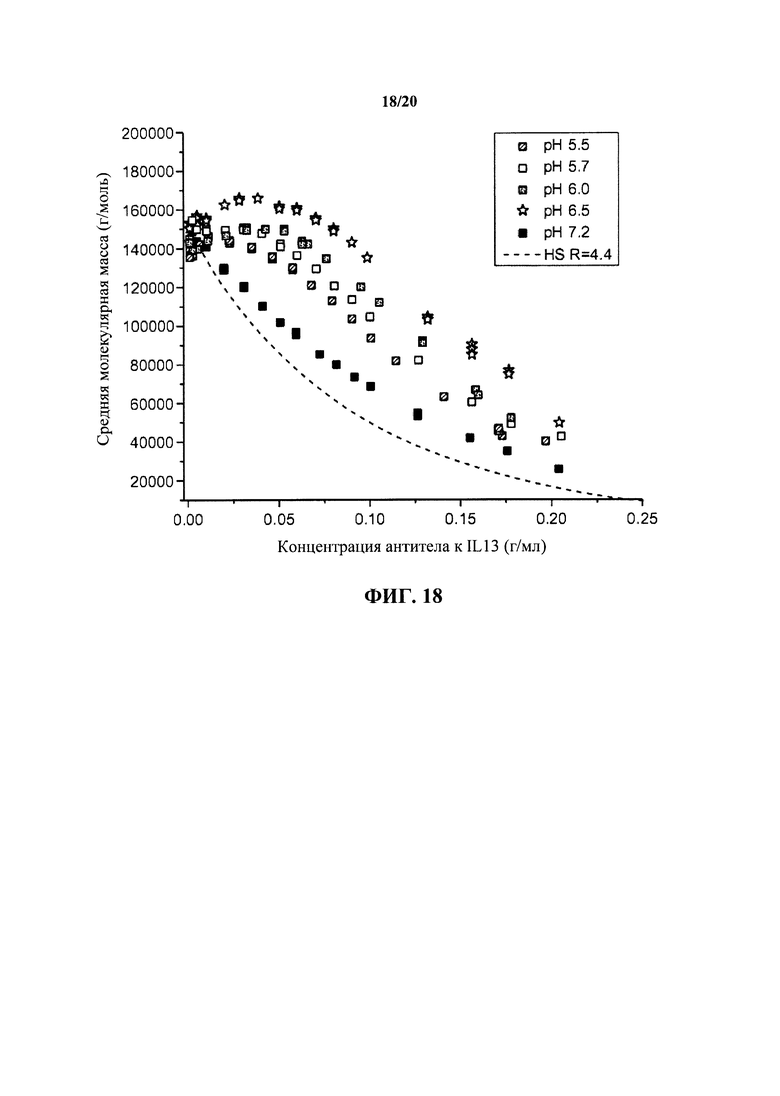
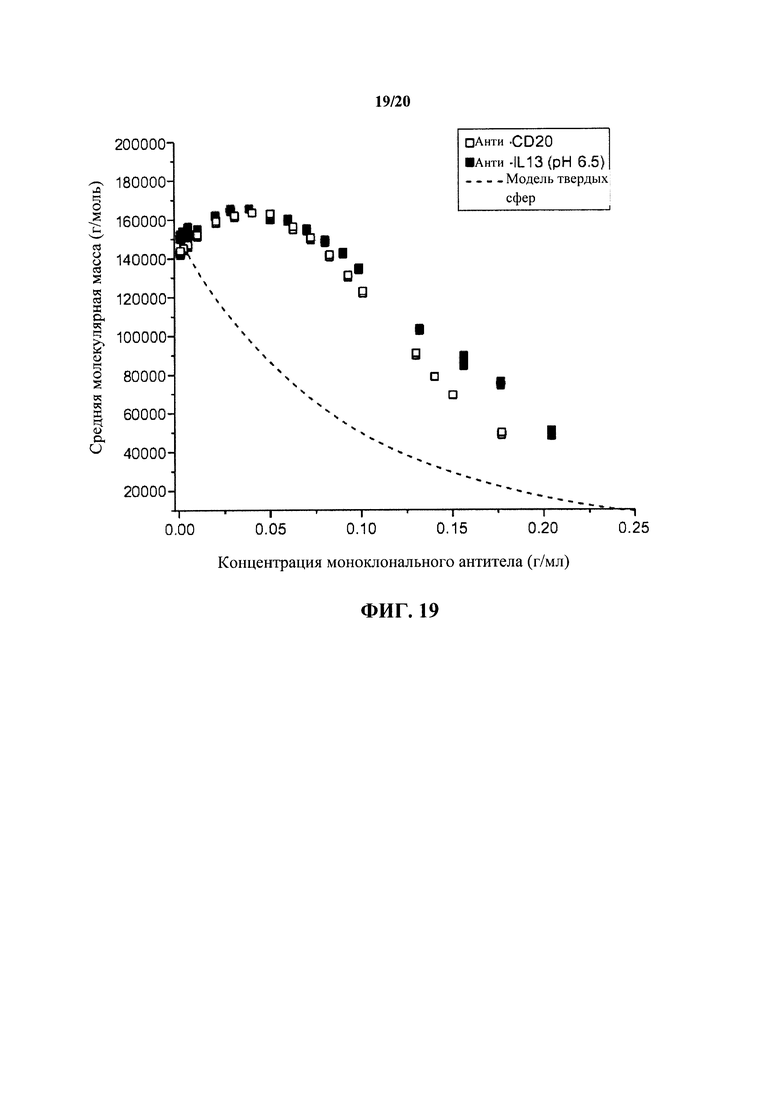
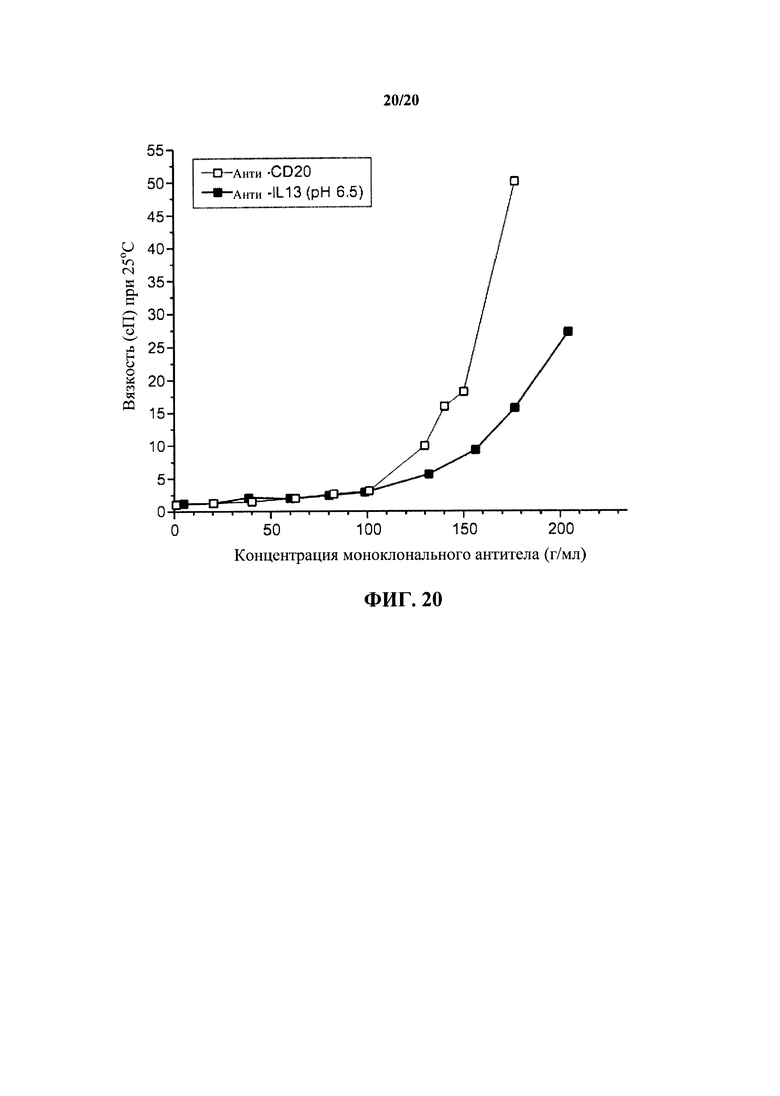
Изобретение относится к области биохимии, в частности к составу, содержащему антитело к IL13, поверхностно-активное вещество и буфер на основе ацетата гистидина, для лечения аллергического, аутоиммунного или воспалительного заболевания или нарушения. Также раскрыт набор для лечения пациента, содержащий указанный состав. Изобретение позволяет эффективно лечить аллергическое, аутоиммунное или воспалительное заболевание или нарушение. 7 н. и 53 з.п. ф-лы, 20 ил., 3 табл., 1 пр.
1. Состав, содержащий антитело к IL13, полиол, поверхностно-активное вещество и буфер на основе ацетата гистидина, рН 5,4-6,0, причем концентрация антитела в составе составляет по меньшей мере 100 мг/мл, концентрация ацетата гистидина в буфере составляет 5-40 мМ, концентрация полиола в составе составляет 100-200 мМ, концентрация поверхностно-активного вещества в составе составляет 0,01-0,1% и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С, в котором антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3 и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6, и где указанный состав предназначен для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение.
2. Состав по п. 1, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7.
3. Состав по п. 1, в котором антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
4. Состав по п. 2, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10.
5. Состав по п. 3, в котором антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
6. Состав по п. 1, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
7. Состав по п. 6, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
8. Состав по п. 1, в котором концентрация антитела составляет 125 мг/мл.
9. Состав по п. 1, в котором концентрация антитела составляет 150 мг/мл.
10. Состав по п. 1, в котором полиол представляет собой сахарозу и поверхностно-активное вещество представляет собой полисорбат 20.
11. Состав по п. 10, в котором буфер на основе ацетата гистидина характеризуется рН 5,7 и концентрация ацетата гистидина в буфере составляет 20 мМ, и при этом концентрация сахарозы в составе составляет 175 мМ и концентрация полисорбата 20 составляет 0,03%.
12. Состав по п. 11, в котором концентрация антитела составляет 125 мг/мл.
13. Состав по п. 11, в котором концентрация антитела составляет 150 мг/мл.
14. Состав, содержащий антитело к IL13 в буфере на основе ацетата гистидина, полиол, поверхностно-активное вещество, рН 5,4-6,0, причем концентрация ацетата гистидина в буфере составляет 5-40 мМ и при этом концентрация антитела в составе составляет по меньшей мере 100 мг/мл, концентрация полиола в составе составляет 100-200 мМ, концентрация поверхностно-активного вещества в составе составляет 0,01-0,1%, в котором антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3 и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6, и где указанный состав предназначен для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение.
15. Состав по п. 14, в котором полиол представляет собой сахарозу и поверхностно-активное вещество представляет собой полисорбат 20.
16. Состав по п. 15, в котором буфер на основе ацетата гистидина характеризуется рН 5,7 и концентрация ацетата гистидина в буфере составляет 20 мМ, и при этом концентрация сахарозы в составе составляет 175 мМ и концентрация полисорбата 20 составляет 0,03%.
17. Состав по п. 16, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7.
18. Состав по п. 16, в котором антитело к IL13 содержит вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
19. Состав по п. 17, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10.
20. Состав по п. 18, в котором антитело к IL13 содержит легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
21. Состав по п. 16, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
22. Состав по п. 21, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
23. Состав по п. 16, который характеризуется вязкостью меньше 15 сантипуаз (сП) при 25°С.
24. Состав по п. 14, в котором концентрация антитела составляет 125 мг/мл.
25. Состав по п. 14, в котором концентрация антитела составляет 150 мг/мл.
26. Состав, содержащий антитело к IL-13, полиол, поверхностно-активное вещество с увеличенной стабильностью, причем концентрация антитела составляет по меньшей мере 100 мг/мл, концентрация полиола в составе составляет 100-200 мМ, и концентрация поверхностно-активного вещества в составе составляет 0,01-0,1% и вязкость составляет меньше 15 сантипуаз (сП) при 25°С, в котором антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO: 3 и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6, и где указанный состав предназначен для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение.
27. Состав по п. 26, в котором антитело к IL-13 является стабильным в течение по меньшей мере одного года при 5°С.
28. Состав по п. 27, в котором антитело к IL-13 является стабильным в течение по меньшей мере двух лет при 5°С.
29. Состав по п. 28, в котором антитело к IL13 является стабильным в течение трех лет при 5°С.
30. Состав по п. 26, в котором антитело к IL13 является стабильным в течение по меньшей мере четырех недель при 25°С, или по меньшей мере 8 недель при 25°С, или по меньшей мере 12 недель при 25°С, или в течение 26 недель при 4°С.
31. Состав по п. 26, содержащий буфер на основе ацетата гистидина, рН 5,4-6,0, причем концентрация ацетата гистидина в буфере составляет 5-40 мМ.
32. Состав по п. 26, в котором полиол представляет собой сахарозу, и поверхностно-активное вещество представляет собой полисорбат 20.
33. Состав по п. 32, в котором буфер на основе ацетата гистидина характеризуется рН 5,7 и концентрация ацетата гистидина в буфере составляет 20 мМ, и при этом концентрация сахарозы в составе составляет 175 мМ и концентрация полисорбата 20 составляет 0,03%.
34. Состав по п. 33, в котором концентрация антитела составляет 125 мг/мл.
35. Состав по п. 33, в котором концентрация антитела составляет 150 мг/мл.
36. Состав, содержащий антитело к IL13 с увеличенной стабильностью, буфер на основе 20 мМ ацетата гистидина, рН 5,7, 175 мМ сахарозы, 0,03% полисорбата 20, причем концентрация антитела в составе составляет 125 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С, и при этом антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3 и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO.: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6, и где указанный состав предназначен для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение.
37. Состав по п. 36, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
38. Состав по п. 37, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
39. Состав, содержащий антитело к IL13 с увеличенной стабильностью, буфер на основе 20 мМ ацетата гистидина, рН 5,7, 175 мМ сахарозы, 0,03% полисорбата 20, причем концентрация антитела в составе составляет 150 мг/мл, и вязкость состава составляет меньше 15 сантипуаз (сП) при 25°С, и при этом антитело к IL13 содержит три CDR тяжелой цепи, CDR-H1 с аминокислотной последовательностью SEQ ID NO.: 1, CDR-H2 с аминокислотной последовательностью SEQ ID NO.: 2 и CDR-H3 с аминокислотной последовательностью SEQ ID NO.: 3 и три CDR легкой цепи, CDR-L1 с аминокислотной последовательностью SEQ ID NO: 4, CDR-L2 с аминокислотной последовательностью SEQ ID NO.: 5 и CDR-L3 с аминокислотной последовательностью SEQ ID NO.: 6, и где указанный состав предназначен для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение.
40. Состав по п. 39, в котором антитело к IL13 содержит вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO.: 7 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO.: 9.
41. Состав по п. 40, в котором антитело к IL13 содержит тяжелую цепь с аминокислотной последовательностью SEQ ID NO.: 10 и легкую цепь с аминокислотной последовательностью SEQ ID NO.: 14.
42. Состав по любому из пп. 1-41, где указанное аллергическое, аутоиммунное или воспалительное заболевание или нарушение представляет собой астму.
43. Состав по п. 42, где эффективное количество составляет 0,3 мл, 1 мл или 2 мл или приблизительно 0,3 мл, приблизительно 1 мл или приблизительно 2 мл.
44. Состав по любому из пп. 1-41, где указанное аллергическое, аутоиммунное или воспалительное заболевание или нарушение представляет собой идиопатический фиброз легких.
45. Состав по п. 44, где эффективное количество составляет 0,3 мл, 1 мл или 2 мл или приблизительно 0,3 мл, приблизительно 1 мл или приблизительно 2 мл.
46. Состав по любому из пп. 1-41, 43 или 45, где антитело к IL13 представляет собой лебрикизумаб.
47. Набор для применения в лечении пациента, у которого диагностировано аллергическое, аутоиммунное или воспалительное заболевание или нарушение, включающий состав по любому из пп. 1-46 и устройство для подкожного введения.
48. Набор по п. 47, в котором устройство для подкожного введения содержит автоматическое инъекционное устройство.
49. Набор по п. 47 или 48, в котором устройство для подкожного введения содержит предварительно наполненный шприц.
50. Набор по п. 49, в котором предварительно наполненный шприц содержит стеклянный цилиндр, иглу и защитный колпачок для иглы.
51. Набор по п. 50, дополнительно содержащий шток поршня и ограничитель хода поршня.
52. Набор по п. 51, дополнительно содержащий защитное устройство для иглы.
53. Набор по любому из пп. 50. 51, в котором стеклянный цилиндр содержит в своем составе боросиликатное стекло и содержит приблизительно 0,3 мл, приблизительно 1,0 мл или приблизительно 2,0 мл состава.
54. Набор по п. 51, в котором ограничитель хода поршня содержит в своем составе резину 4023/50 и этилентетрафторэтиленовое покрытие.
55. Набор по любому из пп. 50-52, 54, в котором игла представляет собой несъемную тонкостенную иглу из нержавеющей стали, калибра 27G, длиной 1/2 дюйма и с типом заточки острия 5В.
56. Набор по любому из пп. 50-52, 54, в котором защитный колпачок для иглы является твердым и содержит эластомерный компонент, FM27/0, и твердый полипропиленовый защитный колпачок.
57. Набор по любому из пп. 47-48, 50-52 или 54, где антитело к IL13 представляет собой лебрикизумаб.
58. Способ подкожного введения состава, содержащего антитело к IL13, включающий применение набора по любому из пп. 47-57.
59. Способ по п. 58, включающий состав по любому из пп. 1-46.
60. Способ по любому из пп. 58, 59, где антитело к IL13 представляет собой лебрикизумаб.
| US 20080160014 A1 от 03.07.2008 | |||
| WO 2005062967 A2 от 14.07.2005 | |||
| WO 2010102241 A1 от 10.09.2010 | |||
| КОМПОЗИЦИЯ ДЛЯ ИММУНИЗАЦИИ (ВАРИАНТЫ), СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ ЭОЗИНОФИЛЬНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2319503C2 |
Авторы
Даты
2018-09-04—Публикация
2012-10-30—Подача