Изобретение относится к медицине, а именно к анестезиологии и реаниматологии, и может быть использовано для определения исхода острого деструктивного панкреатита (ОДП).
В настоящее время ОДП остается одной из проблемных областей неотложной абдоминальной хирургии. Несмотря на применение в лечении ОДП современных детоксикационных технологий, разработку новых методов хирургических вмешательств, совершенствование медикаментозной терапии данная патология характеризуется высокой летальностью [1, 10].
Известен способ прогнозирования возникновения, клинического течения и исхода острого алкогольного панкреатита, заключающийся в том, что из крови больных с острым алкогольным панкреатитом выделяют ДНК и методом полимеразной цепной реакции исследуют мутации генов GSTM1 и GSTT1 [5]. При обнаружении «нулевого» генотипа GSTM1 или «нулевого» генотипа GSTT1 прогнозируют развитие деструктивной формы алкогольного панкреатита, а при обнаружении сочетания «нулевых» генотипов по генам GSTM1 и GSTT1 прогнозируют развитие тотального поражения поджелудочной железы. Данный метод осуществляет прогноз только для больных острым алкогольным панкреатитом и с невысокой степенью точности (80%).
Известен способ прогнозирования исхода деструктивного панкреатита, заключающийся в том, что из сыворотки крови больного готовят образец для инфракрасного спектрального анализа, проводят инфракрасную спектроскопию образца с регистрацией спектров поглощения в области 1200-1000 см-1 и на основании полученных значений показателей по уравнению логистической регрессионной модели определяют вероятность неблагоприятного исхода острого деструктивного панкреатита [4].
Недостатком данного способа является сложность в исполнении.
Наиболее близким по технической сущности к предлагаемому способу является способ прогноза вероятности неблагоприятного исхода панкреонекроза в послеоперационном периоде, заключающийся в том, что у больных панкреонекрозом в до- и послеоперационном периодах оценивают параметры перекисной резистентности эритроцитов и при регистрации спада интенсивности хемилюминесценции эритроцитов до 61,3±9,4 и менее на фоне увеличения светосуммы до 814,6±53,8 мВ⋅с и более к третьим суткам послеоперационного периода прогнозируют неблагоприятный исход [3].
Недостатком известного способа является то, что для осуществления прогноза у больных панкреонекрозом в до- и послеоперационном периоде производят забор крови из вены несколько раз. Кроме того, прогноз осуществляется с помощью лабораторных данных, полученных в течение трех суток, что, в связи с быстрым течением заболевания, является слишком долгим.
Задачей изобретения является раннее прогнозирование (в первые сутки после установки диагноза) исхода острого деструктивного панкреатита.
Поставленную задачу осуществляют за счет того, что в течение первых суток после постановки диагноза ОДП в нейтрофилах венозной крови больных с помощью биолюминесцентного метода определяют активность ферментов: НАДФ-зависимой глутаматдегидрогеназы и активность НАДФН-зависимой глутаматдегидрогеназы, после чего рассчитывают соотношение активностей дегидрогеназ. При значении полученного показателя меньше 0,035 прогнозируют неблагоприятный исход ОДП, а при значении показателя равном или больше 0,035 прогнозируют благоприятный исход ОДП.
Значение 0,035 получено опытным путем на основании сопоставления значений рассчитываемого соотношения активности НАДФ-зависимой глутаматдегидрогеназы к активности НАДФН-зависимой глутаматдегидрогеназы и данных последующего наблюдения за клиническим состоянием больных ОДП. Значение соотношения активности НАДФ-зависимой глутаматдегидрогеназы к активности НАДФН-зависимой глутаматдегидрогеназы ниже 0,035 свидетельствует о превалировании оттока субстратов с энергетических процессов на реакции аминокислотного обмена, что, соответственно, приведет к снижению интенсивности биоэнергетических процессов в клетках и их функциональной реактивности.
Нейтрофилы представляют собой высокореактивное звено в иммунной системе. Они первыми мобилизуются в очаг воспаления, от их фагоцитарной активности во многом зависит эффективность противомикробной защиты организма [7, 8, 9]. Воспринимая многочисленные сигналы о дестабилизации внутренней среды, нейтрофилы модулируют свои функции, нацеленные на ее восстановление. Активированные нейтрофилы сами становятся мощными эффекторами пусковых и регуляторных механизмов каскадных реакций, обеспечивающих развитие воспаления. Это связано с тем, что нейтрофилы способны не только в качестве эффекторов продуцировать цитотоксические молекулы, но и как регуляторные клетки синтезировать широкий спектр различных цитокинов [7, 8]. Доказано, что функциональная активность нейтрофилов в значительной степени определяются уровнем активности их метаболических процессов [7, 6]. НАДФ- и НАДФН-зависимая глутаматдегидрогеназа (НАДФГДГ и НАДФН-ГДГ соответственно, КФ 1.4.1.4) осуществляет окислительное дезаминирование L-глутаминовой кислоты. Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта - иминоглутаровой кислоты, после чего происходит спонтанный гидролиз с образованием аммиака и α-кетоглутаровой кислоты. Ферментативные реакции глутаматдегидрогеназ обратимые, соответственно аммиак в присутствии НАДФН и α-кетоглутаровой кислоты может участвовать в синтезе глутамата. Глутаматдегидрогеназа - один из наиболее изученных олигомерных ферментов азотистого метаболизма с молекулярной массой 312000, который состоит из 6 субъединиц. Фермент проявляет свою активность только в мультимерной форме. Данная особенность характеризует аллостерический механизм регуляции глутаматдегидрогеназы и определяет данный фермент как регуляторный в системе аминокислотного обмена [2].
Способ выполняется следующим образом.
У больных в первые сутки после постановки диагноза ОДП забирают венозную кровь в количестве 2 мл из локтевой вены свободным током в пробирки с гепарином. Нейтрофилы выделяют из цельной гепаринизированной крови центрифугированием в двойном градиенте плотности фиколл-урографина: ρ=1,077 г/см3 - для отделения лимфоцитов, ρ=1,119 г/см3 - для выделения нейтрофилов. Подсчитывают количество нейтрофилов, например, в камере Горяева. При контроле морфологического состава лейкоцитарных взвесей определяют чистоту выхода нейтрофилов, которая составляет не менее 97%. 1 млн выделенных клеток используют для определения активности НАДФГДГ и НАДФН-ГДГ нейтрофилов одним из известных способов, например биолюминесцентным [6]. Для этого суспензию выделенных нейтрофилов, содержащую клетки в количестве 1,0 млн/мл, разрушают путем осмотического лизиса с добавлением дистиллированной воды (1:5 по объему) и 1,0-2,0 мМ дитиотреитола. Затем непосредственно определяют активность НАДФГДГ и НАДФН-ГДГ. Для этого в 150 мкл инкубационной смеси, содержащей соответствующий субстрат и кофактор, вносят 50 мкл суспензии разрушенных нейтрофилов. Конкретные значения концентраций субстратов и коферментов, а также рН среды для определяемых ферментов представлены в таблице 1.

Необходимо отметить, что в инкубационную смесь для определения активности НАДФН-ГДГ дополнительно вносят NH4Cl в концентрации 5,0 мМ.
После инкубации исследуемых проб при 37°С (в течение 30 минут для НАДФГДГ и 5 минут для НАДФН-ГДГ) к 200 мкл инкубационной смеси добавляют 50 мкл флавинмононуклеотида (ФМН) в концентрации 1,5×10-5М, 50 мкл 0,0005% миристинового альдегида и 10 мкл ферментативной системы НАДН:ФМНоксидоредуктаза-люцифераза (все реактивы биолюминесцентной системы разводят в 0,1 М К+, Nа+-фосфатном буфере с рН 7,0). После смешивания биолюминесцентных реактивов и инкубационной пробы с помощью биохемилюминометра, например марки «БЛМ-3607», измеряют свечение. Учитывая, что в клетках имеется определенное количество субстратов для течения различных метаболических реакций, в том числе и катализируемых исследуемыми ферментами, определяют показатели, условно названные «субстратный фон ферментов». Определяют в тех же условиях, что и для вышеперечисленных дегидрогеназ, но в инкубационную смесь вместо соответствующего субстрата вносят буфер.
В результате измерения свечения на биолюминометре получают относительные значения активности исследуемых ферментов. Чтобы получить абсолютные значения активности строят графики зависимости интенсивности биолюминесценции от концентрации НАДФН (калибровочный график). Для этого 200 мкл стандартного раствора НАДФН в диапазоне 10-9 - 10-4 М вносят в кюветы биолюминометра, содержащие ФМН, миристиновый альдегид и НАД(Ф)Н:ФМНоксидоредуктазу-люциферазу в концентрациях, указанных выше, после чего производят измерение интенсивности биолюминесценции. В связи с широким диапазоном рН буферов, используемых для определения дегидрогеназной активности, а также рН-зависимостью биолюминесценции ферментативной системы из светящихся бактерий, калибровочные графики строят для каждого рН буфера.
Активность ферментов рассчитывают по формуле:
А=Δ[С]×V/Т,
где А - активность фермента, Е на 1×104 нейтрофилов (1E=1 мкмоль/мин [2]);
Δ[С] - разница концентраций НАДН или НАДФН в пробах «фермент» и «фон фермента», мкмоль;
V - объем пробы, мл;
Т - время инкубации, мин.
Затем рассчитывают отношение активности НАДФ-зависимой глутаматдегидрогеназы к активности НАДФН-глутаматдегидрогеназы. При значении соотношения ниже 0,035 прогнозируют неблагоприятный исход заболевания, при равном 0,035 или выше - благоприятный исход ОДП.
Данный способ апробирован на 25 больном ОДП.
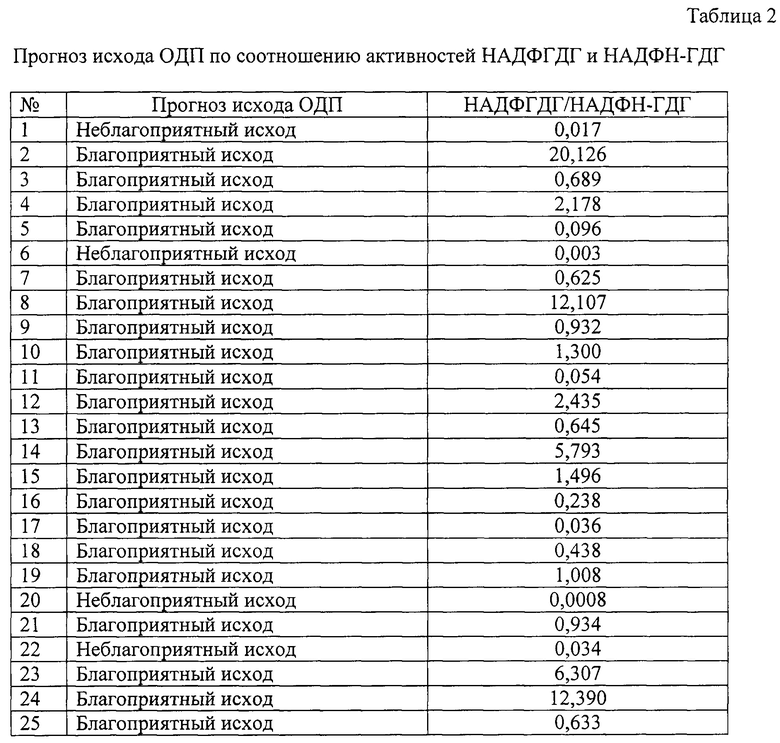
По результатам обследования больных ОДП по заявленному способу установлено, что из 25 больных ОДП у 21 (84%) прогнозировался благоприятный исход заболевания. У этих больных величина соотношения активностей НАДФГДГ и НАДФН-ГДГ составила 0,036-20,126 (выше 0,035). У 4 (16%) больных ОДП прогнозировался неблагоприятный исход заболевания, величина соотношения активностей НАДФГДГ и НАДФН-ГДГ составила 0,0008-0,034 (ниже 0,035). По результатам дальнейшего клинического наблюдения установлено совпадение прогноза в 100% случаев.
Клинический пример 1.
Больной Д., 34 года (история болезни №24957) доставлен скорой помощью в МБУЗ ГКБСМП им. Н.С. Карповича г. Красноярска с клиникой острого панкреатита. Из анамнеза известно, что болеет в течение 2-х суток. В анализах лейкоцитоз 15,6×109/л, мочевина 12,3 ммоль/л, амилаза крови 2410 Ед/л (норма до 100 Ед/л), амилаза мочи 16340 Ед/л (норма до 500 Ед/л). На УЗИ брюшной полости признаки ОДП.
Проведено исследование заявленным способом. В первые сутки после постановки диагноза ОДП в нейтрофилах периферической крови больного биолюминесцентным методом определены активности НАДФ-зависимой глутаматдегидрогеназы и НАФДН-глутаматдегидрогеназы. Соотношение активностей дегидрогеназ составило 0,238 (выше 0,035). Прогноз: благоприятный исход.
В условиях ПИТ хирургического отделения проводилась консервативная терапия: инфузионная, спазмолитики, секретолитики, НПВС, антибиотики. Через 48 часов терапии клинически состояние не улучшилось, появилась перитонеальная симптоматика.
Больному в экстренном порядке произведена лапароскопия. На лапароскопии выявлены признаки жирового панкреонекроза, распространенный ферментативный перитонит. Произведено санация, дренирование сальниковой сумки и брюшной полости.
В послеоперационном периоде в течение 7 дней в условиях ОРИТ проводилась инфузионная, антибактериальная, симптоматическая терапия, секретолитики. Затем, по стабилизации состояния, больной переведен в хирургическое отделение, где консервативная терапия продолжена.
Послеоперационный период без осложнений. Больной выписан на 21-е сутки в удовлетворительном состоянии на амбулаторное лечение у хирурга по месту жительства.
Клинический пример 2.
Больной Г., 54 года (история болезни №18433) доставлен скорой помощью в МБУЗ ГКБСМП им. Н.С. Карповича г. Красноярска с клиникой ОДП. Из анамнеза известно, что болеет в течение 5-и суток. Диагноз подтвержден лабораторно, данными УЗИ. Клинически имеется перитонеальная симптоматика.
Проведено исследование заявленным способом. В первые сутки после постановки диагноза ОДП в нейтрофилах периферической крови больного биолюминесцентным методом определены активности НАДФ-зависимой глутаматдегидрогеназы и НАФДН-глутаматдегидрогеназы. Соотношение активностей дегидрогеназ составило 0,036 (выше 0,035). Прогноз: благоприятный исход.
Больному в экстренном порядке произведена лапароскопия. При лапароскопии выявлен смешанный панкреонекроз, диффузный ферментативный перитонит. Произведено санация, дренирование сальниковой сумки и брюшной полости. Несмотря на проводимую интенсивную терапию состояние больного без положительной динамики. На 6-е сутки госпитализации по клиническим и лабораторным данным, результатам МСКТ брюшной полости течение заболевания осложнилось правосторонней забрюшинной флегмоной с признаками инфицирования.
Больной оперирован в экстренном порядке. На операции выявлен геморрагический панкреонекроз головки и тела поджелудочной железы, распространенный ферментативный перитонит. Произведена холецистостомия, оментобурсостомия, санация, дренирование брюшной полости, люмботомия справа, дренирование забрюшинного пространства.
В послеоперационном периоде в течение 14 дней в условиях ОРИТ проводилась инфузионная, антибактериальная, симптоматическая терапия, перевязки. Затем консервативная терапия продолжена в хирургическом отделении. Послеоперационный период без осложнений. Больной выписан на 42-е сутки в удовлетворительном состоянии на амбулаторное лечение у хирурга по месту жительства.
Клинический пример 3.
Больная X., 40 лет (история болезни №12673) доставлена скорой помощью в МБУЗ ГКБСМП им. Н.С. Карповича г. Красноярска с клиникой ОДП. Из анамнеза известно, что болеет в течение 3-х суток. Диагноз подтвержден лабораторно, данными УЗИ.
Проведено исследование заявленным способом. В первые сутки после постановки диагноза ОДП в нейтрофилах периферической крови больного биолюминесцентным методом определены активности НАДФ-зависимой глутаматдегидрогеназы и НАФДН-глутаматдегидрогеназы. Соотношение активностей дегидрогеназ составило 0,003 (ниже 0,035). Прогноз: неблагоприятный исход.
В условиях ПИТ хирургического отделения проводилась консервативная терапия: инфузионная, спазмолитики, секретолитики, НПВС, антибиотики. Через 7 суток терапии клинически состояние не улучшилось, развилась клиника инфицированного панкреонекроза. По данным МСКТ брюшной полости не исключается абсцесс сальниковой сумки, двухсторонняя забрюшинная флегмона.
Больной в экстренном порядке произведена лапаротомия. На операции выявлен субтотальный смешанный панкреонекроз, абсцесс сальниковой сумки, двухсторонняя забрюшинная флегмона. Произведена холецистостомия, некрсеквестрэктомия, оментобурсостомия, санация, дренирование сальниковой сумки, брюшной полости, двухсторонняя люмботомия, дренирование забрюшинного пространства.
В послеоперационном периоде в условиях ОРИТ проводилась инфузионная, антибактериальная, симптоматическая терапия, перевязки. Послеоперационный период на 14-е сутки после операции осложнился кровотечением из сальниковой сумки. Произведена ревизия сальниковой сумки, гемостаз. Несмотря на проводимую терапию состояние больной прогрессивно ухудшалось, нарастала полиорганная недостаточность. На 27-е сутки госпитализации констатирована смерть.
Клинический пример 4.
Больной Н., 59 лет (история болезни №11612) доставлен скорой помощью в МБУЗ ГКБСМП им. Н.С. Карповича г. Красноярска с клиникой ОДП. Из анамнеза известно, что болеет в течение 6 дней. Диагноз подтвержден лабораторно, данными УЗИ.
Проведено исследование заявленным способом. В первые сутки после постановки диагноза ОДП в нейтрофилах периферической крови больного биолюминесцентным методом определены активности НАДФ-зависимой глутаматдегидрогеназы и НАФДН-глутаматдегидрогеназы. Соотношение активностей дегидрогеназ составило 0,034 (ниже 0,035). Прогноз: неблагоприятный исход.
Больному в экстренном порядке произведена лапароскопия. При лапароскопии выявлен жировой панкреонекроз, диффузный ферментативный перитонит. Произведено санация, дренирование сальниковой сумки и брюшной полости.
Несмотря на проводимую интенсивную терапию в условиях ОРИТ состояние больного без положительной динамики. На 8-е сутки госпитализации по клиническим, лабораторным данным, результатам МСКТ брюшной полости у больного развился инфицированный панкреонекроз, левосторонняя забрюшинная флегмона.
Больной в экстренном порядке оперирован. На операции выявлен некротический парамезоколит, диффузный гнойный перитонит. Произведена некрсеквестрэктомия, резекция поперечно-ободочной кишки с выведением трансверзостомы, санация, дренирование брюшной полости, люмботомия слева, дренирование забрюшинного пространства. Через 48 часов произведена программированная санация брюшной полости.
В послеоперационном периоде в условиях ОРИТ проводилась инфузионная, антибактериальная, симптоматическая терапия, перевязки. Несмотря на проводимую терапию состояние больного прогрессивно ухудшалось, нарастала полиорганная недостаточность. На 19-е сутки госпитализации констатирована смерть.
Технический результат предлагаемого способа:
- возможность раннего прогноза неблагоприятного исхода ОДП (в течение первых суток после постановки диагноза);
- инвазивное вмешательство ограничено однократным забором из вены малого объема крови (2 мл);
- высокий уровень достоверности прогноза - 100%.
Таким образом, способ информативен, отвечает современным требованиям к методам лабораторной диагностики, позволяет своевременно осуществить прогноз неблагоприятного исхода ОДП и может быть рекомендован для применения в клинической практике.
Источники информации
1. Байчоров Э.Х., Греясов В.И., Гагуа А.К., Чугуевский В.М., Евтихов P.M. Острый деструктивный панкреатит. Москва: Литтерра, 2015. 200 с.
2. Биохимия. Под ред. Е.С. Северина (2009), ГЭОТАР-Медиа, М., 768 с.
3. Патент 2398520 РФ. Способ прогноза вероятности неблагоприятного исхода панкреонекроза в послеоперационном периоде / Цедрик Н.И., Теплякова О.В., Винник Ю.С., Филина Н.Г. Опубл. 10.09.2010.
4. Патент №2277243 РФ. Способ прогнозирования исхода деструктивного панкреатита / Петров М.С., Гордецов А.С. Опубл. 27.05.2006.
5. Патент №2312348 РФ. Способ прогнозирования риска возникновения, клинического течения и исхода острого алкогольного панкреатита / Рукосуева М.А., Первова О.В., Черданцев Д.В., Винник Ю.С., Маркова Е.В., Зотова Н.В., Снытко Е.В. Опубл. 10.12.2007.
6. Савченко А.А. Определение активности NAD(Р)-зависимых дегидрогеназ в нейтрофильных гранулоцитах биолюминесцентным методом // Бюллетень экспериментальной биологии и медицины. - 2015. - Т. 159, №5. - С. 656-660.
7. Савченко А.А., Здзитовецкий Д.Э., Борисов А.Г. Иммунометаболические нарушения при распространенном гнойном перитоните. - Новосибирск: Наука, 2013. - 142 с.
8. Савченко А.А., Здзитовецкий Д.Э., Борисов А.Г., Лузан Н.А. Хемилюминесцентная активность нейтрофильных гранулоцитов и уровни концентрации цитокинов у больных с распространенным гнойным перитонитом // Цитокины и воспаление. - 2013. - Т. 12, №1-2. - С. 115-119.
9. El-Benna J., Hurtado-Nedelec M., Marzaioli V., Marie J.C., Gougerot-Pocidalo M.A., Dang P.M. Priming of the neutrophil respiratory burst: role in host defense and inflammation // Immunol. Rev. - 2016. - Vol. 273, №1. - P. 180-193.
10. Vinokurov M.M., Saveliev V.V., Gogolev N.M., Yalynskya T.V. Immunomodulation and treatment of acute destructive pancreatitis in a multidisciplinary surgical hospital // Wiad. Lek. - 2015. - Vol. 68, №4. - P. 582-586.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА РАСПРОСТРАНЕННОГО ГНОЙНОГО ПЕРИТОНИТА | 2012 |
|
RU2498300C1 |
| СПОСОБ ПРОГНОЗА ПРОГРЕССИРОВАНИЯ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ У БОЛЬНЫХ ПОСТИНФАРКТНЫМ КАРДИОСКЛЕРОЗОМ | 2014 |
|
RU2554808C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ОСТРОГО ЭНДОМЕТРИТА ПОСЛЕ МЕДИЦИНСКОГО АБОРТА | 2010 |
|
RU2452377C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ГЕМОРРАГИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ ХИМИОТЕРАПИИ У БОЛЬНЫХ ОСТРЫМИ ЛЕЙКОЗАМИ | 2006 |
|
RU2324190C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОБОСТРЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА С У ДЕТЕЙ ПОДРОСТКОВОГО ВОЗРАСТА | 2009 |
|
RU2412444C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПОВТОРНЫХ ЦЕРЕБРОВАСКУЛЯРНЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ В СОЧЕТАНИИ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2010 |
|
RU2425640C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ПЕРЕНЕСЕННОГО ОСТРОГО ИНФАРКТА МИОКАРДА С ПОДЪЕМОМ СЕГМЕНТА ST У БОЛЬНЫХ С ТРЕВОЖНО-ДЕПРЕССИВНЫМИ РАССТРОЙСТВАМИ | 2015 |
|
RU2593791C1 |
| СПОСОБ ДИАГНОСТИКИ АСПИРИНОРЕЗИСТЕНТНОСТИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2007 |
|
RU2348041C1 |
| Способ прогнозирования формирования развернутой астматической триады у больных полипозным риносинуситом после полипотомии | 2018 |
|
RU2679414C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СОСТОЯНИЯ НОВОРОЖДЕННЫХ ОТ ЖЕНЩИН С ГЕСТОЗОМ РАЗЛИЧНОЙ СТЕПЕНИ ТЯЖЕСТИ | 2009 |
|
RU2421732C2 |
Изобретение относится к медицине и предназначено для определения исхода острого деструктивного панкреатита (ОДП). У больных с ОДП в первые сутки после постановки диагноза в нейтрофилах венозной крови больных с помощью биолюминесцентного метода определяют активности НАДФ- и НАДФН-зависимой глутаматдегидрогеназы, после чего рассчитывают соотношение активностей дегидрогеназ. При значении соотношения ниже 0,035 прогнозируют неблагоприятный исход заболевания, при равном 0,035 или выше - благоприятный исход ОДП. Способ позволяет в ранний период заболевания определить риск неблагоприятного исхода. 2 табл., 4 пр.
Способ прогнозирования исхода острого деструктивного панкреатита (ОДП), включающий исследование крови, отличающийся тем, что в течение первых суток после постановки диагноза ОДП в нейтрофилах венозной крови больных с помощью биолюминесцентного метода определяют активность ферментов: НАДФ-зависимой глутаматдегидрогеназы и активность НАДФН-зависимой глутаматдегидрогеназы, после чего рассчитывают соотношение активностей дегидрогеназ и при значении полученного показателя меньше 0,035 прогнозируют неблагоприятный исход ОДП, а при значении показателя, равном или больше 0,035, прогнозируют благоприятный исход ОДП.
| СПОСОБ ДИАГНОСТИКИ ДИСФУНКЦИИ СФИНКТЕРА ОДДИ ФУНКЦИОНАЛЬНОГО ТИПА ПОСЛЕ ХОЛЕЦИСТЭКТОМИИ | 2009 |
|
RU2416802C1 |
| Устройство для автоматического пуска электрических двигателей | 1945 |
|
SU70972A1 |
| ОКОРОКОВ А.Н | |||
| и др., Диагностика болезней внутренних органов, Москва, Мед | |||
| Лит., 2000, с | |||
| Приспособление для регистрации колебаний почвы | 1922 |
|
SU475A1 |
| WOODS KE et al, Endoscopic retrograde cholangiopancreatography associated pancreatitis: A 15-year review | |||
| World J Gastrointest Endosc | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Устройство для отыскания металлических предметов | 1920 |
|
SU165A1 |
Авторы
Даты
2018-04-18—Публикация
2016-12-23—Подача