Изобретение относится к области сельского хозяйства и может быть использовано в селекции и агрохимии для оценки неспецифической устойчивости зерновых культур и оценки эффективности агрохимических средств.
Абиотические стрессы, действующие на первых этапах органогенеза при переходе роста в темноте к росту на свету, приводят к торможению роста проростков, замедлению формирования хлорофилловых пигментов, увеличению содержания малонового диальдегида (МДА), продукта перекисного окисления липидов мембран, повреждающих их структурно-функциональную целостность. Фотосинтетический аппарат растений является наиболее чувствительной к абиотическим стрессам системой, изменение содержания хлорофиллов и каротиноидов наблюдается при действии всех стрессовых факторов, что является частью адаптивного ответа растения. Изменение пигментного состава происходит для оптимизации продукционного процесса и защиты от свободных радикалов. При действии стресса в период формирования генеративных органов наблюдается редукция цветковых зачатков, изменение содержания фотосинтетических пигментов, накопление МДА, торможение скорости поглощения корнями азота нитратов и его включения в белки надземных органов, что приводит к снижению продуктивности.
Известен способ оценки засухоустойчивости растений. В основе способа лежит определение степени накопления свободного пролина в листьях десятисуточных проростков в процессе воздействия на них водного стресса, которая выражается в виде индексов устойчивости (RU 2229214).
Известен способ оценки стрессоустойчивости растений при выращивании замоченных семян и разделении проростков на группы растений. При этом определяют антиоксидантную активность растений без стрессового воздействия, в остальных - после стрессового воздействия по ингибированию радикалов 1.1-дифенил-2-пикрилгидразила растительной тканью. По разности антиоксидантной активности до и после стрессовых воздействий определяют стрессовую устойчивость (RU 2412585).
Известны лабораторные методы определения устойчивости растений к различным стрессовым факторам, в основе которых лежит учет всхожести семян при неблагоприятных воздействиях, скорость роста первичного корня, время наступления плазмолиза, активность ферментов и др. (Диагностика устойчивости растений к стрессовым воздействиям. / Под ред. Г.В. Удовенко, ВИР. - Л., 1988) (взят за прототип). Способ осуществляется следующим образом. Для опыта отбирают здоровые, нормально выполненные семена, имеющие всхожесть не менее 75-85%. Проращивание семян проводят в чашках Петри, которые предварительно моют и помещают в них стерилизованную фильтровальную бумагу. Проращивают семена в термостатах, где можно создавать постоянную температуру. Для распределения образцов по группам устойчивости семена проращивают на одной концентрации, выбор ее зависит от особенностей репродукции семян. Семена раскладывают в чашки Петри по 25-50 штук в каждую. В каждую чашку наливают по 5 мл раствора сахарозы (опыт) или воды (контроль) для зерновых. Чашки помещают на пять суток в термостат при температуре 20-21°С, а затем проводят подсчет проросших семян. Процент прорастания определяется количеством семян, давших корешок самой минимальной длины.
Процент проросших семян (Р) определяют следующим образом: среднее на чашку число проросших в контроле семян принимают за 100%, среднее число семян, проросших в растворе сахарозы (а), выражают в процентах от числа семян, проросших в контроле (b).
Р=(a/b)100%.
Чем выше процент прорастания семян в растворе сахарозы, тем более засухоустойчив образец.
Параллельно для каждой партии изучаемых образцов необходимо дать оценку сортам-классификаторам, хотя бы одному - высокоустойчивому по полевым испытаниям. Наличие сортов-классификаторов позволяет правильно распределить образцы по относительной устойчивости на группы.
Известные способы требуют или большое количество микро- и макроэлементов, или отличаются низкой объективностью, разработаны для снижения негативного влияния одного из видов стрессов.
Данное изобретение основывается на наличии общей неспецифической реакции растений - накоплении активных форм кислорода и развитии окислительного стресса - при действии любых абиотических стрессов: засухи, засолении, УФ-радиации, гербицидов, затоплении, что позволило предположить существование единого способа оценки их негативного влияния.
На растения зерновых культур воздействуют универсальным индуктором инициации окислительного стресса - дикватом, моделируя действие разных видов стрессоров, с последующей оценкой неспецифического адаптивного потенциала. В качестве показателей устойчивости определяют: содержание фотосинтетических пигментов и малонового диальдегида, характеризующего уровень свободно-радикального окисления.
Предлагаемый способ дает возможность моделировать различные виды стрессов путем воздействия на растения единым стрессором на разных этапах развития растений, позволяет оценить адаптивный потенциала зерновых культур при стрессовом воздействии.
Техническим результатом является разработка способа одновременного определения адаптивности зерновых культур к широкому спектру стрессовых нагрузок.
Сущность предложенного способа заключается в следующем.
Семена растений проращивают в рулонной культуре. Фильтровальную бумагу стерилизуют при прокаливании, нарезают на полосы шириной 15 и 5 см. Семена растений в количестве 75 штук раскладывают на фильтровальную бумагу и покрывают полосой бумаги шириной 5 см. Каждую полосу сворачивают в рулон и помещают в стакан, содержащий 75 мл воды, и ставят в термостат с температурой 20-21°C. Через двое суток часть рулонов с проросшими семенами оставляют расти на воде - контрольный вариант (без стрессового воздействия), остальные переносят в стрессовые условия - раствор диквата с концентрацией 0,2 мМ на трое суток. Затем пятидневные проростки выдерживают на свету 45 минут и определяют содержание фотосинтетические пигментов и малоновый диальдегид, и по разности фотосинтетических пигментов и/или МДА в контроле и после стрессового воздействия оценивают адаптивный потенциал исследуемой культуры.
Для определения содержания фотосинтетических пигментов в листьях растений отбирают растительные пробы (Гавриленко и др., 1975). Навески из листьев по 0,2 г, измельченные ножницами, помещают в фарфоровую ступку и растирают с 25 мл 90% ацетоном. Для количественного определения экстракт наливают в кювету (d=1 см) спектрофотометра. Вторая кювета заполняется чистым растворителем. Кювету помещают в кюветную камеру спектрофотометра (Helios Omega UV-VIS) и определяют оптическую плотность (D) при длинах волн, соответствующую максимум определяемых пигментов.
Содержание хлорофилла определяют по формуле Вернера (90% ацетон):
Са=12,21D663-2,81D646;
Cb=20,13D646-5,03D663,
где Ca, Cb - концентрация хлорофиллов a, b, мг/л.
Затем вычисляют содержание пигментов в растительном материале, мг/г сырой массы:
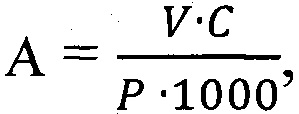
где С - концентрация пигментов, мг/л; V - объем вытяжки, мл (25 мл); Р - навеска растительного материала, г.
Уровень свободно радикальных процессов оценивают по накоплению МДА, содержание которого определяют по реакции с тиобарбитуровой кислотой на спектрофотометре (Полесская и др., 2006).
Содержание МДА (мМ/г сырой массы) определяют по формуле:
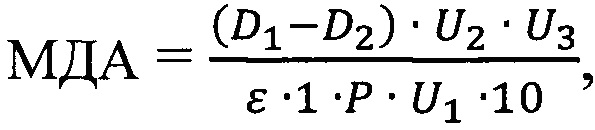 где
где
U1 - объем гомогената, взятый на определение, мл;
U2 - конечный объем смеси, мл; U3 - общий объем смеси, мл;
Р - навеска, г; l - длина кюветы, см;
ε - коэффициент экстинкции 156 мМ-1⋅см-1;
10 коэффициент перевода.
контрольного варианта (без стрессового воздействия), тем больше повреждений в растениях под действием стресса и ниже стрессоустойчивость растений.
Пример 1. Для определения универсальности действия индуктора окислительного стресса были проведены исследования по изучению влияния различных видов стрессоров на растения ярового ячменя.
В лабораторном эксперименте растения ярового ячменя (Hordeum vulgare L.) сорта Hyp выращивали в темноте в рулонной культуре первые двое суток на воде, затем на растворах стрессоров - сахарозы (осмотический стресс), NaCl, Cd(NO3)2, диквата. Физиологический статус проростков оценивали после выдерживания на свету.
Влияние осмотического, солевого стрессов, действие кадмия и диквата оценивалось по изменению напряженности стрессовых факторов по накоплению МДА и состоянию пигментного комплекса.
Неспецифическая адаптация, развивающаяся при любом стрессовом воздействии, выражается в развитии окислительного стресса, который приводит к нарушению и повреждению липидов мембран и накоплению продукта их распада - МДА. МДА рассматривают как критерий интенсивности протекания перекисного окисления липидов (ПОЛ) и повреждения мембран.
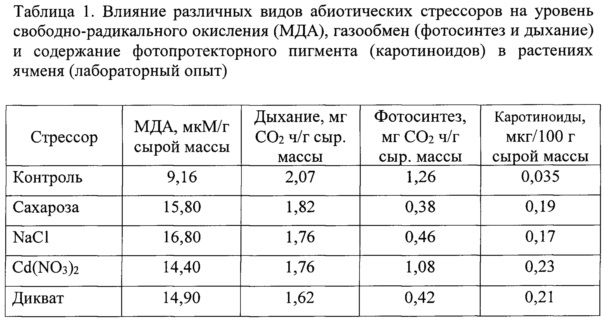
В оптимальных условиях ПОЛ поддерживается на постоянном уровне, благодаря многоуровневой антиоксидантной защите. Смещение равновесия является ответом на стрессовое воздействие. Прорастание семян, переход с роста в темноте к росту на свету сопровождается активизацией процесса свободно-радикального окисления и высокими значениями МДА (табл. 1). Поэтому в период деэтиоляции, при переходе с роста в темноте, к росту на свету, обнаруживается значительное количество МДА, который является продуктом перекисного окисления липидов мембран и служит показателем окислительного стресса.
Таким образом, в проведенном эксперименте показано, что все виды стрессоров привели к резкому возрастанию содержания МДА в листьях ярового ячменя. Анализ полученных однотипных результатов указывает на единый качественный характер изменения под влиянием разнотипных стрессов. Это свидетельствует о том, что использование диквата, индуктора окислительного стресса, позволяет объективно оценить неспецифическую устойчивость растений.
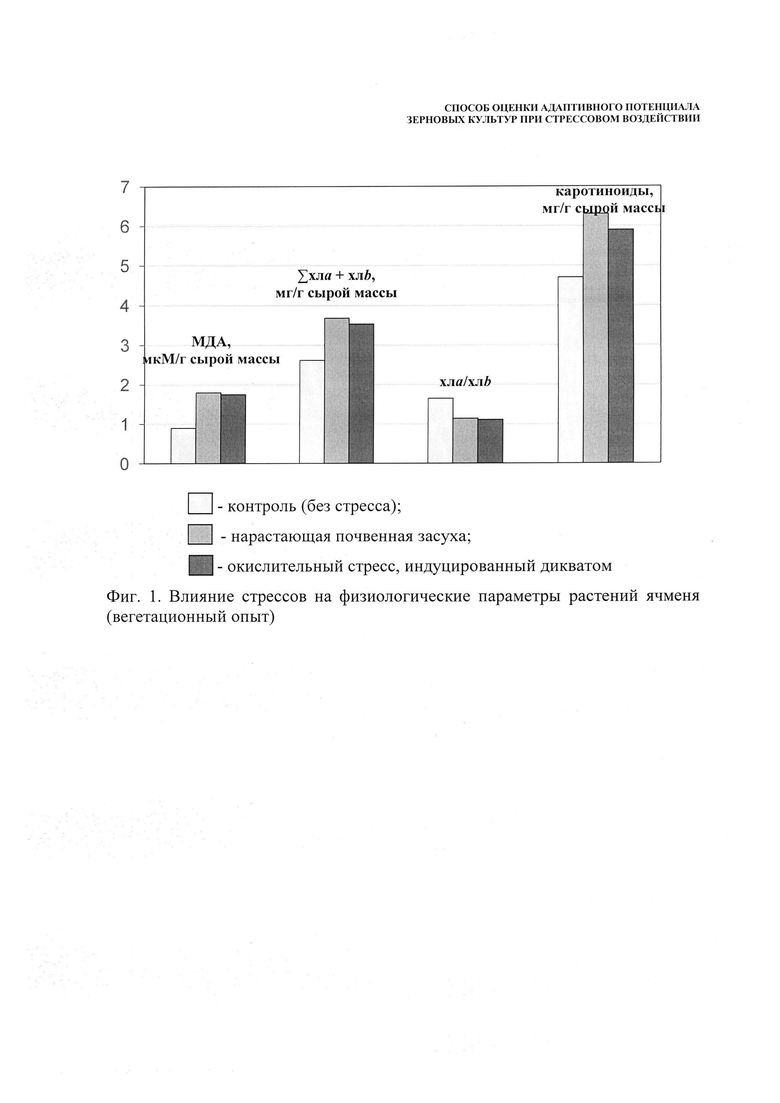
Пример 2. Для подтверждения полученной в лабораторном опыте закономерности был проведен вегетационный опыт с яровым ячменем сорта Нур. Моделировали почвенную засуху на VI этапе органогенеза, критическом по отношению к водообеспеченности, и в аналогичном варианте в это же время с поливными водами вносили дикват. При достижении растениями влажности устойчивого завядания в обоих вариантах и в контроле (без стресса) отбирали растительные пробы для диагностики функционального состояния растений.
Вегетационные опыты проводили в почвенной культуре на дерново-подзолистой среднесуглинистой почве со средней обеспеченностью основными элементами питания (гумус 2,3%; Р2О5, K2О - IV класс). Почву известковали по полной дозе Нг.
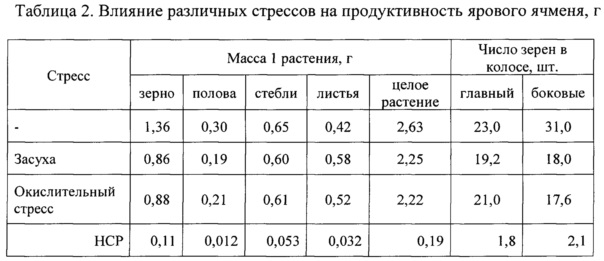
Установлено, что под влиянием окислительного стресса, развившемся в растениях при действии почвенной засухи и применении диквата как индукторов инициации окислительного стресса, возросло содержание малонового диальдегида, показателя напряженности стрессов. При действии обоих стрессоров уровень свободно-радикальных процессов увеличился в два раза (фиг. 1). При этом увеличилась сумма хлорофиллов a и b за счет возрастания содержания хлорофилла b. При действии стрессов антенная светособирающая функция хлорофилла b переходит в протекторную. Хлорофилл b перехватывает АФК, избыточная генерация которых наблюдается при стрессах и предохраняет липиды мембран от повреждения. Было отмечено и повышение содержания каротиноидов, также выполняющих антиоксидантную функцию. Низкомолекулярные антиоксиданты каротиноиды тушат возбужденное состояние хлорофилла и синглетный кислород и рассеивают избыточную энергию в тепло. Каротиноиды рассматривают как первичную защиту фотосинтетического аппарата от генерируемых при его работе АФК. Под действием обоих стрессов отмечалась одинаковая степень развития окислительного стресса, одинаковый характер развития защитных реакций и, соответственно, одинаковая депрессия продуктивности ячменя. Масса зерна с одного растения уменьшалась на 36,8 и 35,3% при действии диквата и засухи. В обоих вариантах депрессия продуктивности обусловлена снижением озерненности колоса (табл. 2).
Таким образом, установленная в лабораторных и вегетационном опытах неспецифическая адаптация на действие различных абиотических стрессов обуславливает правомерность использования диквата как индуктора развития окислительного стресса, является основой для разработки общих принципов диагностики физиологического состояния растений и приемов повышения адаптивного потенциала зерновых культур.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ СТРЕССОУСТОЙЧИВОСТИ ЗЕРНОВЫХ КУЛЬТУР | 2018 |
|
RU2703022C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ РАПСА К ИНТЕНСИВНОМУ ХЛОРИДНОМУ ЗАСОЛЕНИЮ | 2015 |
|
RU2603091C2 |
| Способ определения устойчивости сортов сои к длительному переувлажнению и затоплению почвы | 2022 |
|
RU2798527C1 |
| Способ повышения продуктивности растений картофеля эпибрассинолидом в оптимальных условиях и при хлоридном засолении | 2023 |
|
RU2821570C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ РАСТЕНИЙ КАРТОФЕЛЯ В ОПТИМАЛЬНЫХ И СТРЕССОВЫХ УСЛОВИЯХ ВЫРАЩИВАНИЯ | 2019 |
|
RU2711577C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ РАПСА К ИНТЕНСИВНОМУ ХЛОРИДНОМУ ЗАСОЛЕНИЮ | 2013 |
|
RU2522519C1 |
| Способ предпосевной одноразовой обработки семян вики посевной (Visia sativa L.) | 2022 |
|
RU2790383C1 |
| СПОСОБ ОТБОРА ХОЗЯЙСТВЕННО-ЦЕННЫХ ФОРМ ЗЕРНОВЫХ КУЛЬТУР | 1992 |
|
RU2068635C1 |
| Способ ранней диагностики устойчивости сортов мягкой яровой пшеницы к совместному действию возбудителя корневой гнили злаков Bipolaris sorokiniana Shoem. и хлоридного засоления | 2023 |
|
RU2829355C2 |
| СПОСОБ ПОВЫШЕНИЯ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ТКАНЕЙ РАСТЕНИЙ | 2011 |
|
RU2454864C1 |
Изобретение относится к области сельского хозяйства, в частности к селекции и агрохимии. Способ оценки адаптивного потенциала ярового ячменя при стрессовом воздействии, включающий проращивание семян в рулонной культуре в термостате на воде, далее часть двухдневных проростков исследуемой культуры переносят на 0,2 мМ раствор диквата и в 5-дневных проростках, после выдерживания на свету в течение 45 минут, определяют фотосинтетические пигменты и малоновый диальдегид (МДА) как показатели устойчивости к стрессовому воздействию и по разности фотосинтетических пигментов и/или МДА в контроле и после стрессового воздействия оценивают адаптивный потенциал исследуемой культуры. Способ обеспечивает одновременное определение адаптивности зерновой культуры ячменя к широкому спектру стрессовых нагрузок. 1 ил., 2 табл., 2 пр.
Способ оценки адаптивного потенциала ярового ячменя при стрессовом воздействии, включающий проращивание семян в рулонной культуре в термостате на воде, далее часть двухдневных проростков исследуемой культуры переносят на 0,2 мМ раствор диквата и в 5-дневных проростках, после выдерживания на свету в течение 45 минут, определяют фотосинтетические пигменты и малоновый диальдегид (МДА) как показатели устойчивости к стрессовому воздействию и по разности фотосинтетических пигментов и/или МДА в контроле и после стрессового воздействия оценивают адаптивный потенциал исследуемой культуры.
| ОСИПОВА Л.В | |||
| и др | |||
| Повышение адаптивного потенциала ячменя ярового (Hordeum vulgare L.) при действии абиотического стресса //Проблемы агрохимии и экологии, N3, 2016, с.48-51 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ОТНОСИТЕЛЬНОЙ УСТОЙЧИВОСТИ СОРТОВ ЯЧМЕНЯ И ПШЕНИЦЫ К ОБЫКНОВЕННОЙ КОРНЕВОЙ ГНИЛИ ЗЛАКОВ | 1999 |
|
RU2188538C2 |
| Способ удобрения почвы | 1924 |
|
SU4149A1 |
| СПОСОБ ОЦЕНКИ СТРЕССОУСТОЙЧИВОСТИ РАСТЕНИЙ | 2009 |
|
RU2412585C1 |
| СПОСОБ ОЦЕНКИ СОЛЕУСТОЙЧИВОСТИ РАСТЕНИЙ | 2001 |
|
RU2181240C1 |
Авторы
Даты
2018-04-19—Публикация
2017-03-07—Подача