Изобретение относится к биотехнологии и может быть использовано в сельском хозяйстве при химической защите растений на открытом грунте или в сооружениях защищенного грунта; при химической защите растений от неблагоприятных факторов.
Засоление почв является ключевой негативной проблемой, приводящей к снижению продуктивности агро- и биоценозов, падению биоразнообразия и, как следствие, к значительным экономическим потерям (1. Kuznetsov Vl.V., Shevyakova N.I., 2010). Из имеющихся в России 194 млн га сельскохозяйственных угодий 43 млн га (22%) засоленные и осолонцованные (2. Ходяков Е.А., Мелихов В.В., Кузнецов П.И., 2010). Площади сельскохозяйственных угодий, подвергнутых засолению, с каждым годом будут только увеличиваться.
Рапс является ценной масличной культурой; практическое использование рапса довольно широко - пищевая, металлургическая, мыловаренная, кожевенная и текстильная отрасли промышленности. По пищевым и кормовым достоинствам рапс превосходит многие сельскохозяйственные культуры (3. http://mcx-consult.ru/page2009072009). В последнее время особый интерес рапсовое масло привлекает как источник биодизеля (4. Pokotylo I.V., Kretynin S.V., Khripach V.A., Ruelland E., Blume Ya.B., Kravets V.S., 2014). Повышение интенсивности засоления посевных площадей и относительно низкая солеустойчивость рапса делают его идеальной моделью для изучения путей повышения устойчивости растений к хлоридному засолению.
Стероидные гормоны растений - брассиностероиды (БС) оказывают всестороннее влияние на развитие растений в процессе их онтогенеза, от активации прорастания семян до задерживания старения растений. Известно, что они изменяют активность ферментов, мембранный потенциал, активируют синтез белков и нуклеиновых кислот, изменяют состав аминокислот и жирных кислот, вызывают сдвиги в гормональном балансе других эндогенных гормонов, тем самым стимулируя удлинение и деление клеток (5, 6. Friedrichsen and Chory, 2001; Fridman and Savaldi-Goldstein, 2013). Эти сдвиги на клеточном уровне отражаются на растении усилением роста и повышением продуктивности (7-9. Ковганко, 1991; Khripach et al, 2003; Choudhary et al., 2012). Среди многочисленных функциональных особенностей брассиностероидов особое место занимает их способность повышать устойчивость ряда растений к неблагоприятным температурам, высокому содержанию в почве тяжелых металлов, избыточному засолению и др. (10, 11. Bajguz and Hayat, 2009; Fariduddin et al., 2014).
Показано, что опрыскивание растений перца раствором эпибрассинолида (ЭБЛ) при хлоридном засолении способствует частичному восстановлению ростовых показателей и снижению утечки электролитов через мембрану (12. Houimli S.M., Denden M., Mouhandes B.D., 2010, способ-аналог 1).
Среди недостатков способа-аналога 1 можно выделить использование высокой концентрации эпибрассинолида (ЭБЛ) 0,5 мг/л (что соответствует 1 мкМ) при незначительной интенсивности засоления 4 г/л NaCl (68 мМ). Действие NaCl и ЭБЛ на растения перца приведено только по ростовым показателям, утечке электролитов, содержанию хлорофиллов и пролина. Ряд других показателей, отражающий физиологическое состояние растений при засолении, не учитывают.
В физиологии растений обычно определяют протекторный эффект гормона при его совместном действии с повреждающим фактором. Имеются немногочисленные работы, в которых предпринимаются попытки более фундаментального подхода для выяснения гормональной регуляции физиологических процессов при стрессе у растений. Установлено, что гормональная предобработка растений ячменя (Hordeum vulgare L. сорт Golden Promis) жасмоновой кислотой приводит к снижению негативного воздействия солевого стресса (13. Walia H., Wilson C., Condamine P., Liu X., Ismail A.M., Close T.J., 2007, способ аналог 2). Проростки ячменя в возрасте 8 суток обрабатывали жасмоновой кислотой (12 мкМ), через два дня растения ячменя подвергали действию NaCl (150 мМ); часть растений фиксировали на 14, 21 и 28 сутки и оценивали гомеостаз ионов, интенсивность фотосинтеза и экспрессию генов, регулирующих солеустойчивость растений.
Основной недостаток способа-аналога 2 заключается в том, что жасмоновая кислота - неустойчивый гормон растений, молекула которого начинает распадаться при температуре выше 25°С, кроме того, он легко переходит в летучую форму метил жасмонат, что затрудняет контроль над используемой концентрацией вещества. Действующая концентрация жасмоновой кислоты, используемая в способе-аналоге 2, очень высокая (12 мкМ); кроме того, стоит отметить дороговизну препарата. Интенсивность засоления (150 мМ) незначительна, тем более что ячмень относят к солеустойчивым растениям.
Известно протекторное действие на растения рапса стероидных гормонов растений - 24-эпибрассинолида к повреждающему действию хлоридного засоления (14. Пат. RU 2514641. Способ стабилизации транскрипции хлоропластных генов рапса в условиях хлоридного засоления, 2014). Преимущество 24-эпибрассинолида перед жасмоновой кислотой состоит в стабильности молекулы, которая характеризуется высокой степенью устойчивости в широком диапазоне температур и не переходит в летучую форму. Растения рапса культивируют на жидкой питательной среде в течение трех недель, последующие две недели растения подвергают хлоридному засолению 125 мМ с однократным внесением в раствор в начале засоления 24-эпибрассинолида в концентрации 0,01 мкМ. Показано, что протекторное действие гормона выражается в снижении отрицательного воздействия засоления на фотосинтетический аппарат растений за счет стабилизации транскрипции хлоропластных генов. Способ принят за прототип.
Основной недостаток способа-прототипа заключается в том, что он обеспечивает устойчивость растений рапса к хлоридному засолению сравнительно низкой концентрации NaCl (125 мМ), а такая степень засоления не вызывает существенных экономических потерь. В то же время используемая концентрация действующего вещества относительно высока и составляет 0,01 мкМ. Защитный эффект гормона выявлен только в отношении фотосинтетического аппарата растений рапса; учет других показателей, важных для конечной продуктивности растений, не приводится. К существенному недостатку способа-прототипа можно отнести и то, что не определен временной фактор гормональной обработки - до, во время или после действия солевого стресса.
Задачей изобретения является разработка экономичного способа повышения устойчивости растений рапса к интенсивному хлоридному засолению, усиление протекторного эффекта гормональной обработки при повреждающем действии солевого стресса.
Поставленная задача решается тем, что через 4 недели культивирования в стандартных условиях на питательной среде Хогланда-Снайдера растения подвергают солевому стрессу путем недельного хлоридного засоления с концентрацией 175 мМ, при этом во время действия хлоридного засоления или сразу после его окончания в раствор вносят 24-эпибрассинолид в концентрации 10-10 М.
Сущность изобретения состоит в снижении стрессового влияния интенсивного хлоридного засоления на растения рапса воздействием экологически чистого фитогормона - 24-эпибрассинолида малой концентрации.
В способе по изобретению растения рапса подвергаются воздействию более высокой концентрации хлорида натрия, чем в прототипе: концентрация NaCl на 50 мМ выше используемой в способе-прототипе; а концентрация вещества с выраженным протекторным действием (24-эпибрассинолида) мала и составляет 10-10 М, что в 100 раз ниже, чем в способе-прототипе, обеспечивая экономическую выгоду предложенного способа. Кроме того, при разработке способа по изобретению исследованы несколько вариантов стресс-защитного действия 24-эпибрассинолида - до действия стрессора; во время действия стрессора и после действия стрессора, и предложен наиболее эффективный вариант.
Для 24-эпибрассинолида характерна высокая биологическая активность (15. Ефимова М.В., Хасан Ж., Холодова В.П., Кузнецов Вл.В., 2012). Активное использование брассиностероидов в качестве принципиально новых препаратов сельскохозяйственного назначения обусловлено их экологической безопасностью и способностью снижать накопление нитратов, тяжелых металлов и радионуклидов (16. Khripach V.A., Zhabinskii V.N., Karnachuk R.A., 2004). Особый практический интерес к брассиностероидам обусловлен, как уже говорилось выше, их способностью повышать продуктивность растений в норме и при стрессе. Однако из уровня техники не известно, каким способом необходимо обрабатывать растения, чтобы достичь максимального результата в условиях действия неблагоприятных факторов, в частности, при засолении (17. Gomes M.M.A., 2011).
В приведенной ниже таблице представлена подробная схема опыта, направленного на выявление защитного действия 24-эпибрассинолида на разных этапах стрессорного ответа. После недельного культивирования рапса в перлите на дистиллированной воде и 3-недельного выращивания растений рапса на жидкой питательной среде Хогланда-Снайдера в питательную среду добавляют NaCl и 24-эпибрассинолид в различных вариантах временного воздействия. Варианты 1-4 - без засоления, варианты 5-8 - с засолением. Протекторное действие 24-эпибрассинолида на растения рапса при интенсивном хлоридном засолении в зависимости от способа воздействия иллюстрируется чертежами. Возраст растений везде составляет 7 недель.
На фиг. 1 и 2 показано влияние 24-эпибрассинолида (10-10 М ЭБЛ) на рост побегов рапса и на листовую поверхность одного растения рапса на разных этапах солевого стресса. На оси абсцисс представлена последовательность воздействия на 4-х недельные растения; продолжительность каждой обработки составляла одну неделю (ПС - питательная среда).
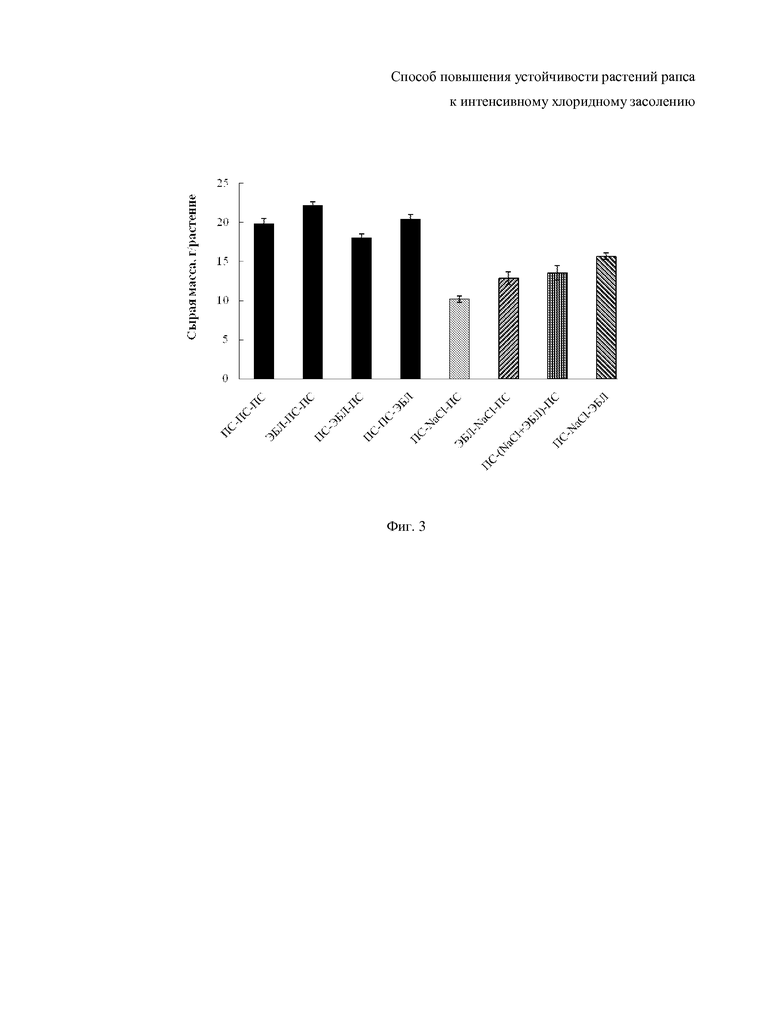
На фиг. 3 и 4 показана аккумуляция сырой и сухой массы надземной части растений рапса и влияние 24-эпибрассинолида (10-10 М ЭБЛ) на разных этапах солевого стресса. На оси абсцисс представлена последовательность воздействия на 4-х недельные растения; продолжительность каждой обработки составляла одну неделю (ПС питательная среда).
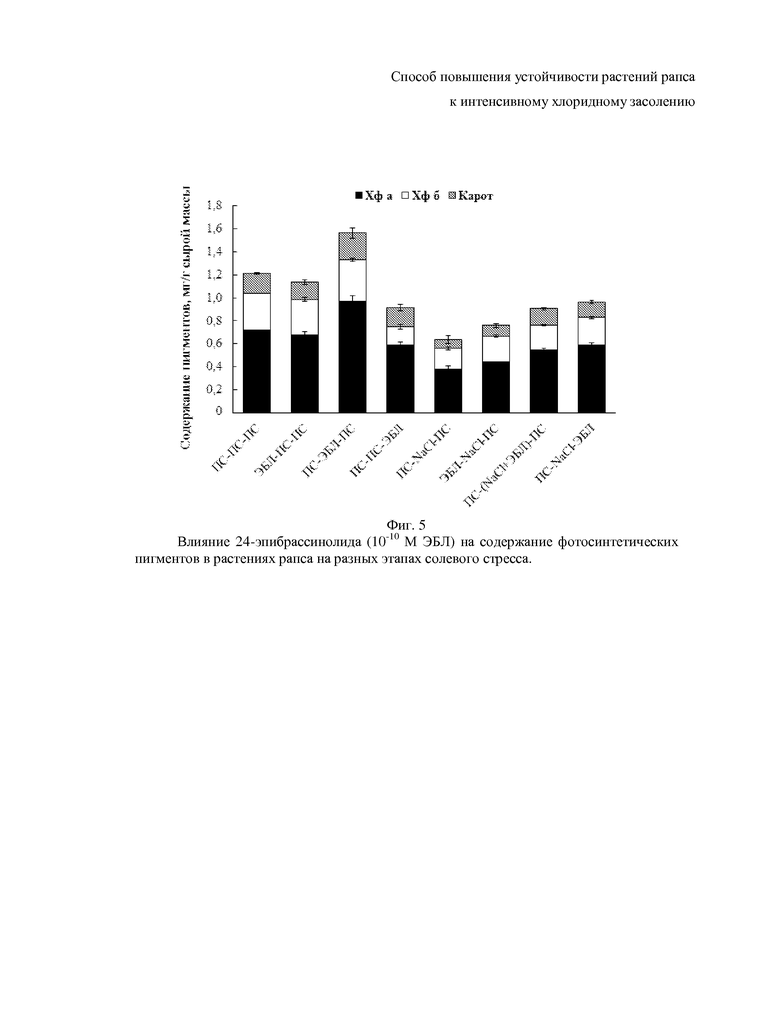
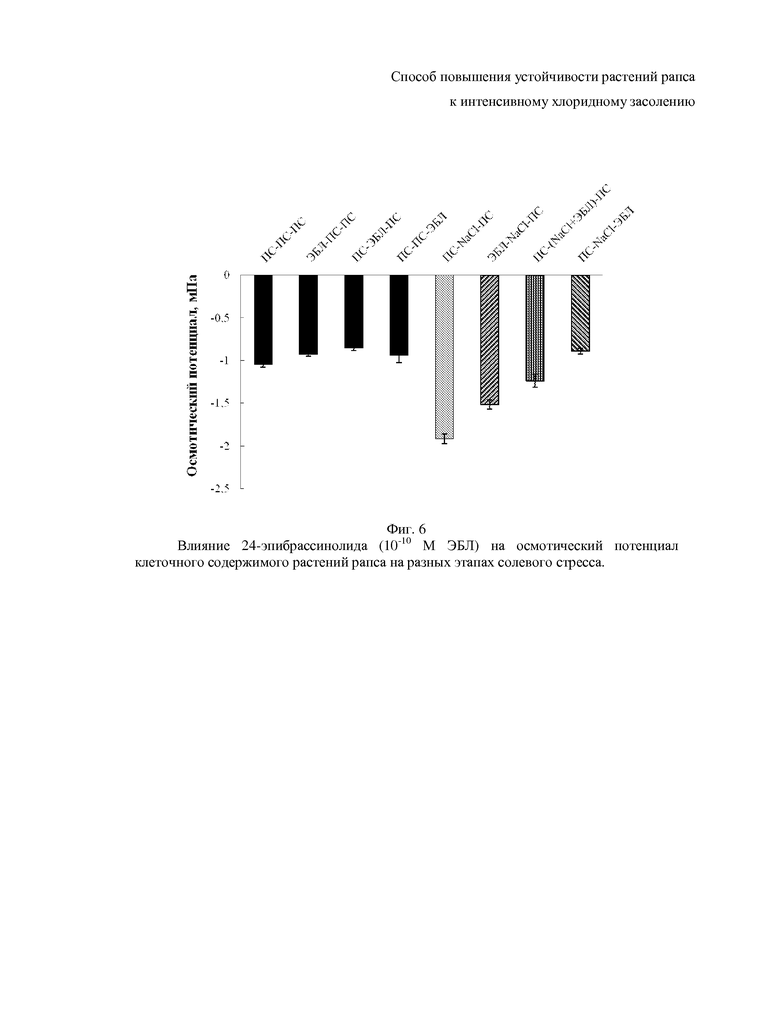
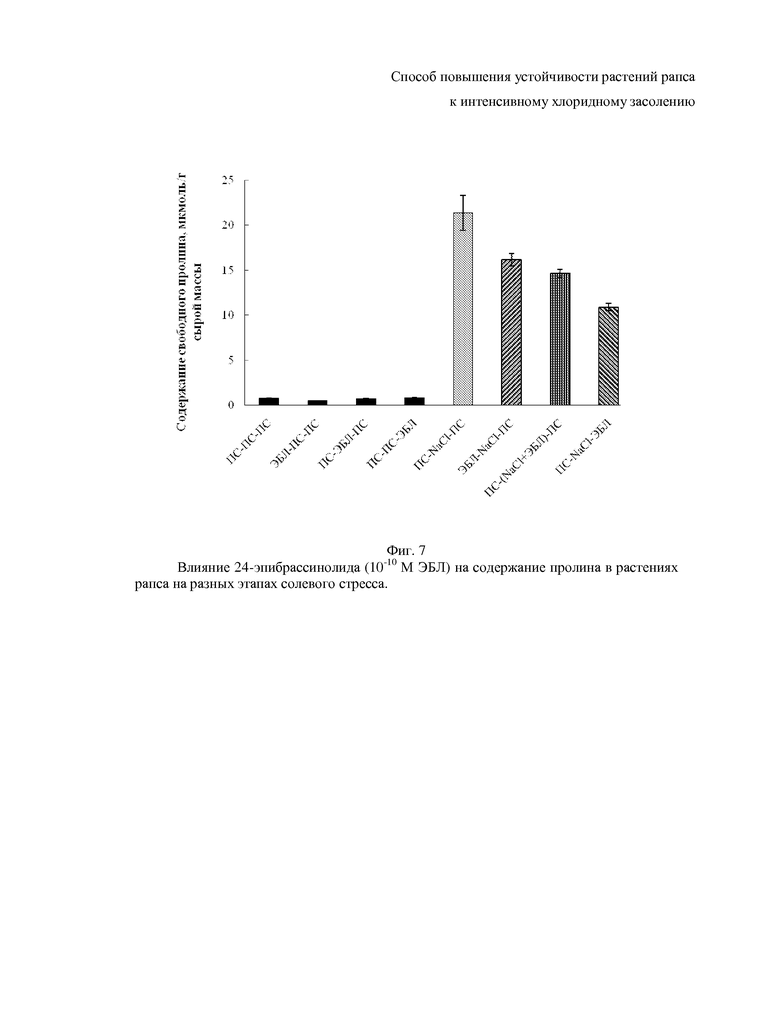
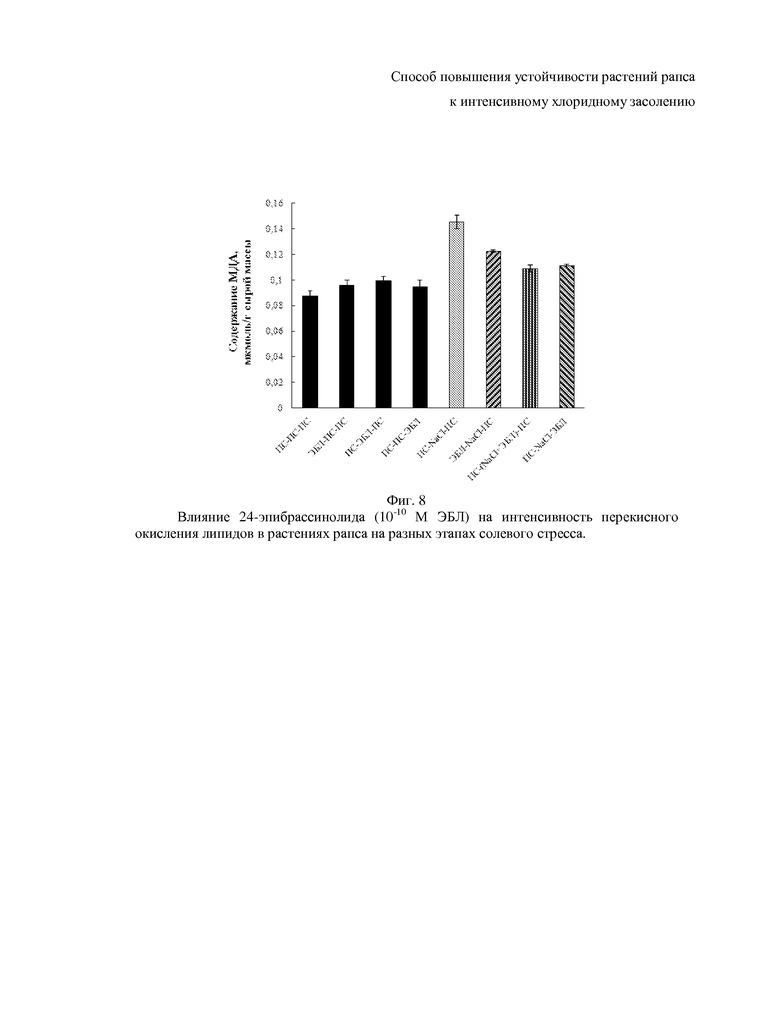
На фиг. 5-10 показаны гистограммы, отражающие физиологическое состояние растений рапса на основании следующих показателей фотосинтетических пигментов, осмотического потенциала, пролина, малонового диальдегида, общих растворимых фенолов и флавоноидов.
Реализация способа показана на примере, иллюстрирующем способность фитогормона 24-эпибрассинолида, в зависимости от способа воздействия, снимать негативный эффект засоления на ростовые и физиологические показатели растения.
Пример. Опыты проведены на растениях Brassica napus L. сорта Вестар. В опыте использовали растения рапса в возрасте 4-х недель. Изначально семена рапса проращивали в перлите на дистиллированной воде в течение 7 суток, после чего проростки переносили на жидкую питательную среду Хогланда-Снайдера (Hoagland, D.R. and Snyder, W.С., 1933) для культивирования в течение следующих 3 недель. Гормон ЭБЛ в концентрации 10-10 М добавляли либо до (5 неделя), либо во время (6 неделя), либо после (7 неделя) хлоридного засоления. На шестой неделе к растениям в питательную среду добавляли 175 мМ NaCl. Фиксацию растительного материала проводили после окончания указанных действий, когда возраст растений составлял 49 суток. Контрольные растения в течение всего эксперимента росли на стандартной среде Хогланда-Снайдера.
Как показал анализ (опыт и контроль), обработка рапса раствором ЭБЛ (10-10 М) одновременно с NaCl или на стадии восстановления в большей степени способствует стабилизации анализируемых физиологических показателей растений - фотосинтетических пигментов, уровня пролина, осмотического потенциала, интенсивности перекисного окисления липидов, общих растворимых фенолов, в том числе флавоноидов. Данные изменения, в конечном итоге, способствуют снижению отрицательного влияния засоления на фотосинтетический аппарат и дальнейшее развитие растений.
Свежую и сухую биомассу растительного материала оценивали гравиметрическим методом. Сухую массу определяли после фиксации материала при 90°С и его высушивания при 70°С до постоянного веса.
Для оценки уровня фотосинтетических пигментов листья рапса растирали в 96%-ном этаноле и центрифугировали (10 мин при 8000 об/мин, центрифуга MiniSpin "Eppendorf", Германия). Оптическую плотность пробы (супернатанта) оценивали на спектрофотометре Genesys 10 ThermoElectron (США). Концентрацию пигментов в спиртовой вытяжке рассчитывали согласно Lichtenthaler (18. Lichtenthaler Н.K. 1987).
Экстракцию и определение свободного пролина проводили по методу Bates (19. Bates L.S., Waldran R.P., Teare I.D., 1973).
Осмотический потенциал клеточного экссудата определяли на криоскопическом осмометре Osmomat 030 ("Gonotec", Германия) в соответствии с инструкцией производителя. Клеточный сок отжимали из размороженных образцов листьев растений.
Интенсивность ПОЛ оценивали спектрофотометрическим методом, основанным на образовании окрашенного комплекса - продукта малонового диальдегида (МДА) в реакции с тиобарбитуровой кислотой при нагревании (20. Buege J.A., Aust S.D., 1978).
Определение низкомолекулярных фенольных соединений проводили по методу Фолина-Дениса (21. Загоскина Н.В., Дубравина Г.А., Алявина А.К., Гончарук Е.А.,2003), содержание флавоноидов - по методу Gage (22. Gage T.B., Wendei S.H., 1950).
В качестве ключевых показателей ответа растений на солевое воздействие использовали такие интегральные показатели, как рост побегов в высоту, изменение листовой поверхности одного растения, накопление сырой и сухой биомассы. Как известно, рост растений в условиях водного дефицита, который индуцируется засолением, является одним из наиболее чувствительных физиологических процессов, что и явилось причиной выбора именно данных критериев ответа растений на солевой стресс.
Выбранный уровень интенсивного засоления (175 мМ NaCl) в 2.1 раза подавляет рост стебля растений рапса (фиг. 1, ПС-NaCl-ПС) и в такой же мере сокращает площадь листовой поверхности (фиг. 2). Сырая и сухая масса растений по сравнению с контролем уменьшается в 1,9 раза (фиг. 3 и 4). В оптимальных условиях выращивания растений экзогенный 24-эпибрассинолид практически не оказывает никакого воздействия на рост стебля, независимо от того, на каком этапе эксперимента его добавляют в питательную среду (фиг. 1). В отношении ряда других показателей (площади листовой поверхности, накопления сырой и сухой массы) эффективность воздействия определяется временем внесения ЭБЛ в питательную среду (фиг. 2-4). Так, если растения обрабатывали гормоном через 5 недель после прорастания семян (табл., вариант 3), то наблюдается незначительное ингибирование данных показателей по сравнению с другими вариантами обработки (табл., варианты 2 и 4) и контролем (табл., вариант 1). Предобработка растений ЭБЛ в течение 7 дней до стресса (табл., вариант 6) снижает последующее ингибирующее действие 175 мМ NaCl на ростовые показатели и накопление биомассы растений (фиг. 1-4). Добавление ЭБЛ в питательную среду во время солевого воздействия (табл., вариант 7) обнаруживает более выраженный защитный эффект, чем в предыдущем варианте. И, наконец, обработка растений гормоном после окончания солевого стресса (табл., вариант 8) сопровождается интенсивным восстановлением ростовых процессов и увеличением массы растений (фиг. 1-4).
Негативное воздействие NaCl проявляется не только на ростовых характеристиках, но и на содержании фотосинтетических пигментов (фиг. 5). Концентрация хлорофилла а, b и каротиноидов снижается в 1.9, 1.7 и 2.3 раза соответственно относительно контроля (фиг. 5). Предобработка ЭБЛ уменьшает отрицательное воздействие интенсивного засоления на фотосинтетический аппарат листьев рапса. Как показывает анализ результатов, наиболее сильный защитный эффект малых концентраций фитогормона проявляется в том случае, когда гормон действует во время или после сразу же солевого стресса (фиг. 5), что делает эти варианты осуществления способа предпочтительными.
Принципиально важным для поддержания оптимального водного статуса тканей растений при засолении является понижение их осмотического потенциала до уровня, способного обеспечить поток воды из среды в растение. При засолении осмотический потенциал тканей листьев снижается до величины -1.9 МПа, что на 0.9 МПа ниже по сравнению с листьями контрольных растений (фиг. 6). Внесение ЭБЛ в питательную среду почти не влияет на величину осмотического потенциала листьев. Добавление 24-эпибрассинолида в среду до действия стрессора или во время его действия частично снимает (на 0.4 и 0.7 МПа соответственно) NaCl-индуцированное падение осмотического потенциала содержимого клеток листьев рапса (фиг. 6). Использование гормона на этапе восстановления полностью снимает негативный эффект хлоридного засоления (фиг. 6).
Решающая роль в формировании осмотического потенциала принадлежит совместимым осмолитам - аминокислотам, сахарам, сахароспиртам и бетаинам (23 Kuznetsov V.V., Shevyakova N.I., 2006). Аминокислота пролин является самым распространенным совместимым осмолитом высших растений. Свободный пролин при стрессе обладает полифункциональным биологическим эффектом, проявляющимся в осморегуляторной, антиоксидантной и энергетической функциях; помимо этого пролин защищает макромолекулы, являясь химическим шапероном (24. Кузнецов Вл.В., Шевякова Н.И., 1999).
В листьях растений рапса контрольного варианта содержание пролина составляет около 0.8 мкмоль/г сырой массы, интенсивное хлоридное засоление способствует увеличению его концентрации в 27 раз (фиг. 7). Обработка ЭБЛ способствует значительному снижению эндогенного уровня пролина при засолении. Наибольший эффект отмечен при использовании гормона на этапе восстановления (фиг. 7). При формировании защитных механизмов на фоне хлоридного засоления важным является не только обеспечение растения высокой концентрацией совместимых осмолитов за короткий промежуток времени, но и сохранение энергетических ресурсов растения. Для реализации последнего необходимо сократить синтез пролина, а имеющийся пролин использовать в качестве энергетического источника, и активировать другие защитные системы растения. Кроме того, падение уровня пролина при засолении под действием 24-эпибрассинолида однозначно свидетельствует о том, что гормон снижает степень повреждения растений рапса хлористым натрием, поскольку пролин синтезируется в ответ на повреждение.
Одним из последствий действия засоления на растения является окислительный стресс, связанный, прежде всего, с нарушениями процессов фотосинтеза и дыхания (25. Schmitt Fr.-J., Renger G., Friedrich T., Kreslavski V.D., Zharmukhamedov S.K., Los D.A., Kuznetsov Vl.V., Allakhverdiev S.I., 2014). Для оценки интенсивности окислительного стресса в листьях рапса в условиях засоления была изучена степень проявления перекисного окисления липидов (ПОЛ), измеряемая по содержанию малонового диальдегида в реакции с тиобарбитуровой кислотой. Нами показано, что интенсивное засоление повышает уровень МДА на 66%, что свидетельствует о развитии окислительного стресса, тогда как внесение ЭБЛ снижает отрицательный эффект засоления (фиг. 8). Наиболее сильный защитный эффект ЭБЛ проявляется в том случае, когда гормон действует во время или после солевого стресса (фиг. 8). Скорее всего, подобный эффект вызывается брассиностероидами за счет регуляции накопления антиоксидантных соединений.
Выраженными антиоксидантными свойствами обладают низкомолекулярные фенольные соединения. Внесение ЭБЛ в среду достоверно не влияет ни на общее содержание низкомолекулярных фенольных соединений (фиг. 9), ни на содержание флавоноидов (фиг. 10) в растениях рапса. Напротив, при засолении содержание низкомолекулярных фенольных соединений, в том числе флавоноидов, возрастает в 1.6-1.8 раза над значениями контрольных растений (фиг. 9, 10). Экзогенный 24-эпибрассинолид снижает накопление низкомолекулярных фенольных соединений, вызыванное интенсивным засолением. Наиболее сильный защитный эффект ЭБЛ проявляется в том случае, когда гормон действовует во время или после солевого стресса, на стадии восстановления (фиг. 9, 10). При этом существенным признаком является то, что для получения описанных результатов достаточна концентрация раствора ЭБЛ на уровне 10-10 М.
Таким образом, экспериментально показано, что экзогенный 24-эпибрассинолид в очень малых концентрациях снижает отрицательное воздействие засоления на ростовые показатели, важные для конечной продуктивности растений, в том числе за счет стабилизации уровня фотосинтетических пигментов, аккумуляции пролина, регуляции осмотического потенциала и интенсивности перекисного окисления липидов, накопления общих растворимых фенолов. На основании этих результатов разработан способ повышения устойчивости растений рапса к интенсивному хлоридному засолению согласно заявленной формуле изобретения.
Техническим результатом является достижение протекторного эффекта при более высокой степени засоления и сниженном расходе гормонального препарата.
Использованные источники:
1. KuznetsovVl.V., Shevyakova N.I. Polyamines and plant adaptation to saline environments /Desert Plants. 2010. Heidelberg, Dordrecht, London, NewYork: Springer-Verlag.- P. 261-298.
2. Ходяков Е.А., Мелихов В.В., Кузнецов П.И. Оценка состояния, проблемы и перспективы развития орошаемых земель в России /2010 http://dssac.ru/knigi/node/89
3. http://mcx-consult.ru/page2009072009
4. Pokotylo I.V., Kretynin S.V., Khripach V.A., Ruelland E., Blume Ya.B., Kravets V.S. Influence of 24-epibrassinolide on lipid signalling and metabolism in Brassica napus //Plant Growth Regulation. 2014. Vol.73. Р. 9-17.
5. Friedrichsen D.M., Chory J. Steroid signaling in plants: from the cell surface to the nucleus //BioEssays. 2001. Vol.23. Р. 1028-1036.
6. Fridman Y.,Savaldi-Goldstein S. Brassinosteroids in growth control: How, when and where //Plant Sci.2013. Vol.209. Р. 24-31.
7. Ковганко Н.В. Брассиностероиды в растительном мире //Химия природных соединений. 1991. Т. 2. С. 159-173.
8. Khripach V.A., Zhabinskii V.N., Khripach N.B. New practical aspects of brassinosteroids and results of their ten-year agricultural use in Russia and Belarus /Brassinosteroids. Bioactivity and Crop Productivity. 2003. Hayat S., Ahmad A. Eds. Dordrecht: Kluwer. pp. 189-230.
9. Choudhary S.P., Yu J.Q., Yamaguchi-Shinozaki K., Shinozaki K., Lam-Son P.T. Benefits of brassinosteroid crosstalk //Trends in Plant Sci. 2012. Vol.17. Р. 594-605.
10. Bajguz A., Hayat S. Effects of brassinosteroids on the plant responses to environmental stresses //Plant Physiol. Biochem. 2009. Vol.47. Р. 1-8.
11. Fariduddin Q., Yusuf M., Ahmad I., Ahmad A. Brassinosteroids and their role in response of plants to abiotic stresses //Biol. Plant. 2014. Vol.58. Р. 9-17.
12. Houimli S.M., Denden M., Mouhandes B.D. Effects of 24-epibrassinolide on growth, chlorophyll, electrolyte leakage and proline by pepper plants under NaCl-stress //EurAsia J. BioSci. 2010. Vol.4. P. 96-104.
13. Walia H., Wilson C., Condamine P., Liu X., Ismail A.M., Close T.J. Large-scale expression profiling and physiological characterization of jasmonic acid-mediated adaptation of barley to salinity stress //Plant Cell Environ. 2007. Vol.30. Р. 410-421.
14. Пат. RU 2514641. Способ стабилизации транскрипции хлоропластных генов рапса в условиях хлоридного засоления, Ефимова М.В., Кузнецов В.В., Кузнецов Вл.В. Опубликовано: 27.04.2014.
15. Ефимова М.В., Хасан Ж., Холодова В.П., Кузнецов Вл.В. Влияние брассиностероидов на прорастание семян и рост рапса на начальных этапах онтогенеза при хлоридном засолении //Вестник РУДН. серия «Агрономия и животноводство». 2012. №3. С. 12-20.
16. Khripach V.A., Zhabinskii V.N., Karnachuk R.A. Chemical probes in biology /Science at the interface of brassinosteroids: a new role of steroids as biosignaling molecules. 2004. M.P. Schneider. Ed. Netherlands: Kluwer Academic Publishers. Vol.129. P. 153-167. NATO Science Series. 391 p.
17. Gomes M.M.A. Physiological effects related to brassinosteroid application in plants /Brassinosteroids: a class of plant hormone. 2011. S. Hayat, A. Ahmad. Eds. Springer Science+Business Media B.V. P. 193-242. p. 462.
18. Lichtenthaler H.K. Chlorophylls and carotenoids, the pigments of photosynthetic biomembranes /Methods Enzymology. 1987. Eds. R. Douce, L. Packer. New York: Academik. P. 350-382
19. Bates L.S., Waldran R.P., Teare I.D. Rapid determination of free proline for water stress studies //Plant Soil. 1973. Vol.39. P. 205-208.
20. Buege J.A., Aust S.D. Microsomal lipid peroxidation /Methods in Enzymology. 1978. Vol.52. P. 302-310.
21. Загоскина Н.В., Дубравина Г.А., Алявина А.К., Гончарук Е.А. Влияние ультрафиолетовой (УФ-Б) радиации на образование и локализацию фенольных соединений в каллусных культурах чайного растения //Физиология растений. 2003. Т. 50. С. 302-308.
22. Gage T.B., Wendei S.H. Quantitative determination of certain flavonol-3-glycosides //Anal. Chem. 1950. V. 22. P. 708-711.
23. Kuznetsov V.V., Shevyakova N.I. Stress responses of tobacco cells to high temperature and salinity. Proline accumulation and phosphorylation of polypeptides //Physiologia Plantarum. 2006.- Vol.100. P. 320-326.
24. Кузнецов Вл.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм, регуляция //Физиология растений. 1999. Т.46. С. 321-336.
25. Schmitt Fr.-J., Renger G., Friedrich T., Kreslavski V.D.,Zharmukhamedov S.K., Los D.A., Kuznetsov Vl.V., Allakhverdiev S.I. Reactive oxygen species: re-evaluation of generation, monitoring and role in stress-signaling in phototrophic organisms //Biochim. Biophys. Acta. 2014. V. 1837. P. 835-848.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ РАПСА К ИНТЕНСИВНОМУ ХЛОРИДНОМУ ЗАСОЛЕНИЮ | 2013 |
|
RU2522519C1 |
| СПОСОБ СТАБИЛИЗАЦИИ ТРАНСКРИПЦИИ ХЛОРОПЛАСТНЫХ ГЕНОВ РАПСА В УСЛОВИЯХ ХЛОРИДНОГО ЗАСОЛЕНИЯ | 2012 |
|
RU2514641C1 |
| Способ повышения продуктивности растений картофеля эпибрассинолидом в оптимальных условиях и при хлоридном засолении | 2023 |
|
RU2821570C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ РАПСА К ХЛОРИДНОМУ ЗАСОЛЕНИЮ | 2012 |
|
RU2515726C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ РАСТЕНИЙ КАРТОФЕЛЯ В ОПТИМАЛЬНЫХ И СТРЕССОВЫХ УСЛОВИЯХ ВЫРАЩИВАНИЯ | 2019 |
|
RU2711577C1 |
| СПОСОБ РЕГУЛИРОВАНИЯ КЛУБНЕОБРАЗОВАНИЯ И ПРОДУКТИВНОСТИ РАСТЕНИЙ КАРТОФЕЛЯ В УСЛОВИЯХ ГИДРОПОНИКИ | 2017 |
|
RU2660918C1 |
| СПОСОБ РЕГУЛЯЦИИ ТРАНСКРИПЦИИ ХЛОРОПЛАСТНЫХ ГЕНОВ ЯЧМЕНЯ (HORDEUM VULGARE) | 2011 |
|
RU2460279C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КЛЕТОЧНОЙ КУЛЬТУРЕ ATRAGENE SPECIOSA WEINM. (КНЯЖИК СИБИРСКИЙ) | 2009 |
|
RU2428473C2 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ НАКОПЛЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ СЕЛЬСКОХОЗЯЙСТВЕННЫМИ КУЛЬТУРАМИ | 1996 |
|
RU2119285C1 |
| Способ определения антистрессовой активности брассиностероидов | 1990 |
|
SU1750493A1 |






Изобретение относится к области биотехнологии. Изобретение представляет собой способ повышения устойчивости растений рапса к интенсивному хлоридному засолению, включающий обработку растений раствором биологически активного вещества, где через 5 недель культивирования в стандартных условиях на питательной среде Хогланда-Снайдера растения подвергают солевому стрессу путем недельного хлоридного засоления 175 мМ, при этом во время хлоридного засоления (на шестой неделе культивирования) или сразу после его окончания (на седьмой неделе культивирования) в раствор вносят 24-эпибрассинолид в концентрации 10-10 М, понижая тем самым уровень окислительного стресса и осмотического потенциала растения. Изобретение позволяет достичь протекторного эффекта при более высокой степени хлоридного засоления и снизить расход гормонального препарата. 10 ил., 1 табл.
Способ повышения устойчивости растений рапса к интенсивному хлоридному засолению, включающий обработку растений раствором биологически активного вещества, отличающийся тем, что через 5 недель культивирования в стандартных условиях на питательной среде Хогланда-Снайдера растения подвергают солевому стрессу путем недельного хлоридного засоления 175 мМ, при этом во время хлоридного засоления (на шестой неделе культивирования) или сразу после его окончания (на седьмой неделе культивирования) в раствор вносят 24-эпибрассинолид в концентрации 10-10 М, понижая тем самым уровень окислительного стресса и осмотического потенциала растения.
| ЖАЛАЛ АБДУ КАИД ХАСАН АЛЬМИКЛАФИ, Исследование стресс-протекторного действия брассиностероидов на растения рапса в условиях засоления, автореферат диссертации, Москва, 2014, с.3-22 | |||
| АЗИМОВ М.Л., Некоторые биохимические особенности устойчивых к Nacl растений картофеля in vitro и in vivo, автореферат диссертации, Душанбе, 2013, с.5-6 | |||
| СПОСОБ СТАБИЛИЗАЦИИ ТРАНСКРИПЦИИ ХЛОРОПЛАСТНЫХ ГЕНОВ РАПСА В УСЛОВИЯХ ХЛОРИДНОГО ЗАСОЛЕНИЯ | 2012 |
|
RU2514641C1 |
Авторы
Даты
2016-11-20—Публикация
2015-03-20—Подача