Область техники
Настоящее изобретение относится к выделенному полипептиду, выделенным молекулам нуклеиновых кислот, кодирующим полипептид микроцин S, и праймерам и зондам, гибридизирующимся с молекулами нуклеиновых кислот. Изобретение также относится к плазмидам и клеткам, включающим молекулы нуклеиновых кислот, антителу, связывающемуся с данным полипептидом, составам, а также способам продукции и использования полипептидов. Настоящее изобретение кроме того относится к медицинскому использованию для лечения или предотвращения микробных инфекций, функциональных расстройств желудочно-кишечного тракта или для лечения опухоли. Изобретение кроме того относится к способу сохранения пищи и способу раневого покрытия.
Предпосылки для создания изобретения
Микроцины - это синтезируемые на рибосомах антимикробные пептиды с низкой молекулярной массой. Синтез продуцируемых энтеробактериями, главным образом, Escherichia coli, микроцинов резко активируется в условиях стресса, таких как ограничение питательных веществ. Микроцины оказывают мощное антимикробное и антибактериальное действие против тесно связанных видов, что дает большое конкурентное преимущество в микрофлоре кишечника (Baquero, F., Bouanchaud, D., Martinez-Perez, M.С. & Fernandez, С. (1978) J Bacteriol 135, 342-347). Продуценты микроцина устойчивы к микроцину, который они продуцируют, что опосредовано по меньшей мере одним придающим устойчивость геном, расположенном в кластере генов. Большинство из 14 известных микроцинов кодированы плазмидой, но описаны также кодированные хромосомой антимикробные/антибактериальные пептиды. Пробиотический штамм Е. coli Nissle 1917 (EcN) продуцирует микроцины М и Н47 (Patzer, S.I., Baquero, М.R., Bravo, D., Moreno, F. & Hantke, K. (2003) Microbiology 149, 2557-2570). Пробиотики определены как живые микроорганизмы, которые при приеме в определенном количестве оказывают благотворное влияние на здоровье помимо присущего им базового питания. Механизмы, которые позволяют штамму быть пробиотиком, поняты плохо. Тем не менее антимикробная деятельность микроцинов может положительно влиять на интестинальный баланс. Предполагая отсутствие патогенных факторов, а также хорошо апробированную клиническую безопасность, штамм, продуцирующий микроцин, может четко соответствовать определению пробиотика. В противоположность энтеробактериальным микроцинам, содержащиеся в пище бактерии молочной кислоты продуцируют пептидные антибиотики, содержащие лантионин. Так называемые лантибиотики грамположительных бактерий уже используются для консервирования пищевых продуктов (Kuipers, A., Rink, R. & Moll, G.N. (2011) Prokaryotic Antimicrobial Peptides: From Genes to Applications (Springer Science+Business Media, Berlin). Еще двумя также обсуждающимися применениями бактериоцинов является их использование в качестве противоопухолевого агента (Hetz, С., Bono, М.R., Barros, L.F. & Lagos, R. (2002) Proc Natl Acad Sci USA99, 2696-2701) или в качестве альтернативы классическим антибиотикам при инфекционных заболеваниях (Dicks, L.М. Т., Heunis, Т.D.J., van Staden, D.A., Brand, A., Sutyak Noll, K. & Chikindas, M.L. (2011) Prokaryotic Antimicrobial Peptides: From Genes to Applications (Springer Science + Business Media, Berlin), Gillor, O., Kirkup, В.C. & Riley, M.A. (2004) Adv. Appl Microbiol 54, 129-146).
В течение десятилетий и в настоящее время лечение бактериальных инфекций главным образом основано на классических антибиотиках. Однако появление патогенов, устойчивых к этим классическим антибиотикам, является огромной проблемой. Следовательно, остающиеся варианты лечения ограничены еще больше. Это негативное влияние также заметно в других экономических важных отраслях промышленности, как, например, в пищевой промышленности.
Раскрытие изобретения
Техническая задача
Настоящее изобретение создано в свете известного уровня техники, описанного выше, и с учетом возрастающего спроса на новые антибактериальные и профилактические агенты для медицины и ветеринарии. Все большим вызовом является терапия штаммов бета-лактамаз (ESBL) расширенного спектра. Цель настоящего изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцин, который можно использовать в качестве альтернативы традиционным антибиотикам и, таким образом, для борьбы с патогенными микроорганизмами, которые являются продуцентами ESBL. В этом отношении цель настоящего изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцин, который можно использовать при лечении патогенных грамотрицательных бактерий, включая продуцирующие ESBL Е. coli, а также включая высоко вирулентный энтерогеморрагический штамм Е. coli (ЕНЕС), который является каузативным патогеном, недавно широко распространившимся в Германии (Frank, С., et al. (2011) N Engl J Med 10.1056/NEJMoal 106483; Mellmann, A., et al. (2011) PLoS ONE 6(7): e22751. doi: 10.1371). Клетки ЕНЕС высвобождают повышенные количества шига-токсинов при лечении определенными антибиотиками. Поэтому сообщалось, что пациентам противопоказано лечение антибиотиками. Новый полипептид микроцин должен быть эффективен для лечения и предотвращения инфекций, вызываемых ЕНЕС и энтеропатогенными Е. coli (ЕРЕС). Еще одна цель изобретения заключается в том, чтобы предложить новый антимикробный полипептид микроцен, который можно использовать для лечения функциональных нарушений желудочно-кишечного тракта, в частности синдрома раздраженной толстой кишки, у взрослых и детей. Еще одна цель изобретения заключается в том, чтобы предложить композиции, которые включают клетки нового полипептида микроцина, продуцирующие новый полипептид микроцин для упомянутого медицинского использования. Также цель настоящего изобретения заключается в том, чтобы предложить новый полипептид микроцин, который можно использовать для лечения рака, который можно использовать для консервирования пищевых продуктов и можно использовать для раневого покрытия.
Раскрытие изобретения
Для решения этой задачи настоящее изобретение в одном его аспекте относится к выделенному полипептиду, причем полипептид:
a) включает аминокислотную последовательность, которая по меньшей мере на 50% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7;
b) кодирован молекулой нуклеиновой кислоты, включающей нуклеотидную последовательность, которая по меньшей мере на 50% или больше идентична нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент;
c) кодирован молекулой нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая последовательность нуклеотидов любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях; или d) включает встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Более конкретно, описан выделенный полипептид, причем полипептид:
a) включает аминокислотную последовательность, которая по меньшей мере на 70% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид включает аминокислотную последовательность с антимикробной активностью;
b) кодирован молекулой нуклеиновой кислоты, включающей нуклеотидную последовательность, которая по меньшей мере на 70% или больше идентична нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент, причем нуклеотидная последовательность, включая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, причем нуклеотидная последовательность, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, и причем нуклеотидная последовательность, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 5 отвечает за продукцию полипептида с транспортной активностью для микроцина S;
c) кодирован молекулой нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая последовательность нуклеотидов любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент, в жестких условиях, причем нуклеотидная последовательность, включающая SEQ ID NO: 1 отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, причем нуклеотидная последовательность, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, и причем нуклеотидная последовательность, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и причем нуклеотидная последовательность, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S; или
d) включает встречающийся в природе аллельный вариант полипептида, включающего аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид включает аминокислотную последовательность с антимикробной активностью.
Термин "антимикробная активность" должен пониматься как антимикробная активность, вызванная микроцином, конкретно микроцином S.
В еще одном аспекте изобретения представлена выделенная молекула нуклеиновой кислоты, кодирующая полипептид микроцин S, причем упомянутая молекула нуклеиновой кислоты:
a) включает нуклеотидную последовательность, которая по меньшей мере на 50% или больше идентична любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплементу,
b) включает молекулу нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях;
c) включает нуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 50% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7; или
d) включает молекулу нуклеиновой кислоты, которая кодирует встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Более конкретно, описана выделенная молекула нуклеиновой кислоты, кодирующей полипептид микроцин S, полипептид с аутоиммунной активностью микроцина S или полипептид с транспортной активностью для микроцина S, причем упомянутая молекула нуклеиновой кислоты:
a) включает нуклеотидную последовательность, которая по меньшей мере на 70% или больше идентична любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплементу, причем молекула нуклеиновой кислоты, включающая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, молекула нуклеиновой кислоты, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и молекула нуклеиновой кислоты, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S;
b) включает молекулу нуклеиновой кислоты, которая гибридизирует нуклеотидную последовательность, комплементарную нуклеотидной последовательности, включая нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент в жестких условиях, причем молекула нуклеиновой кислоты, включающая SEQ ID NO: 1, отвечает за продукцию полипептида по меньшей мере с антимикробной активностью или аутоиммунной активностью микроцина S или транспортной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 2, отвечает за продукцию полипептида с антимикробной активностью, молекула нуклеиновой кислоты, включающая SEQ ID NO: 3, отвечает за продукцию полипептида с аутоиммунной активностью микроцина S, молекула нуклеиновой кислоты, включающая SEQ ID NO: 4, отвечает за продукцию полипептида с транспортной активностью для микроцина S, и молекула нуклеиновой кислоты, включающая SEQ ID NO: 5, отвечает за продукцию полипептида с транспортной активностью для микроцина S;
c) включает нуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 70% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид имеет антимикробную активность; или
d) включает молекулу нуклеиновой кислоты, которая кодирует встречающийся в природе аллельный вариант полипептида, включающий аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, причем полипептид имеет антимикробную активность.
В разных аспектах изобретение относится к плазмиде, включающей молекулу нуклеиновой кислоты согласно изобретению, и к клетке включающей молекулу нуклеиновой кислоты, и/или полипептид, и/или плазмиду согласно изобретению.
Изобретение также направлено на антитело, которое селективно связывается с полипептидом согласно изобретению.
В еще одном аспекте изобретение относится к композиции, включающей:
a) полипептид согласно изобретению и/или
b) клетку согласно изобретению.
Также раскрыты полипептид, клетка и композиция изобретения для использования для лечения или профилактики.
В одном аспекте полипептид, клетка и композиция изобретения предназначены для использования для лечения или профилактики микробных инфекций, причем, предпочтительно, микробная инфекция включает инфекции с энтеропатогенной и/или энтерогеморрагической Е. coli (ЕРЕС, ЕНЕС), или, предпочтительно, микробная инфекция включает гемолитико-уремический синдром (HUS), предпочтительно энтеропатический гемолитико-уремический синдром.
В еще одном аспекте полипептид, клетка и композиция изобретения предназначены для использования при лечении желудочно-кишечных нарушений, предпочтительно функциональных желудочно-кишечных нарушений.
В еще одном аспекте полипептид, клетка и композиция изобретения предназначены для использования при лечении опухоли.
Изобретение предлагает способ продукции полипептида изобретения, причем способ включает:
использование молекулы нуклеиновой кислоты, праймера или зонда нуклеиновой кислоты, плазмиды или клетки согласно изобретению, или
синтез полипептида изобретения посредством способов синтеза пептида в жидкой фазе или твердой фазе.
Выделенные полипептиды согласно изобретению могут быть получены упомянутым способом продукции полипептида.
В одном дополнительном аспекте предложен способ in vitro для идентификации бактерий, которые чувствительны к микроцину S, причем способ включает использование полипептида, молекулы нуклеиновой кислоты, праймера или зонда нуклеиновой кислоты, клетки, антитела или композиции согласно изобретению.
Изобретение также относится к способу консервирования пищевых продуктов, причем способ включает:
добавление в пищевой продукт по меньшей мере одного вида натурального антимикробного агента, причем агентом является:
a) полипептид согласно изобретению,
b) клетка согласно изобретению и/или
c) композиция согласно изобретению.
В еще одном аспекте изобретение относится к способу раневого покрытия, причем рану покрывают:
a) полипептидом согласно изобретению и/или
b) композицией согласно изобретению.
Благоприятные эффекты изобретения
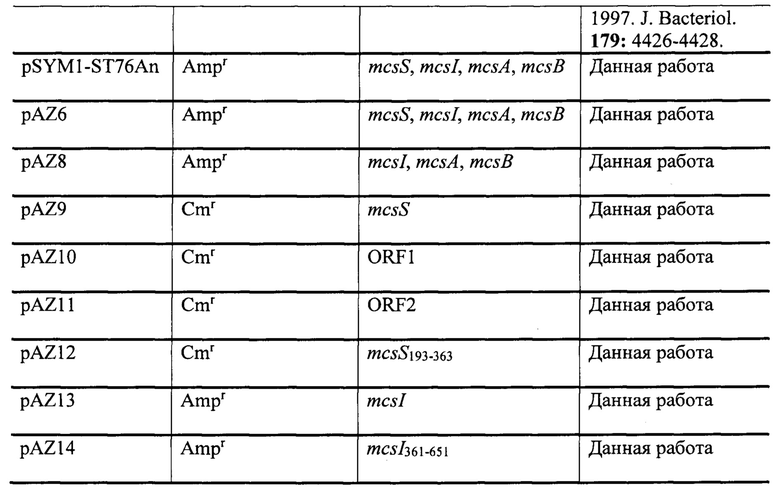
Таким образом, авторы настоящего изобретения идентифицировали полипептид микроцин S, который является новым, ранее не описанным микроцином, нуклеотидная и аминокислотная последовательность которого уникальна. Гены, которые отвечают за эффекты микроцина S, идентифицированы, и их эффекты функционально охарактеризованы. Авторы изобретения неожиданно обнаружили что, в противоположность большинству классических бета-лактамных антибиотиков, микроцин S проявляет ингибирующий эффект в отношении ЕНЕС, включая штамм, вызывающий продуцирующий ESBL О104:Н4, а также О128:Н2 и изолят О157:Н7 ЕНЕС (Фиг. 5). Таким образом, также было обнаружено, что микроцин S эффективен при лечении энтерогеморрагической инфекции Е. coli (ЕНЕС) и энтеропатогенной инфекции Е. coli (ЕРЕС). Поэтому микроцин S можно использовать в качестве альтернативы традиционным антибиотикам для борьбы с патогенными микроорганизмами. Кроме того, возможно использование для консервирования пищевых продуктов, и настоящее изобретение этим завершено. Также было обнаружено, что генный кластер микроцина S (MccS) (SEQ ID NO: 1) E. coli G3/10, кодированный плазмидой pSYM1 (Фиг. 1), состоит из четырех кластерных генов mcsS (SEQ ID NO: 2), mcsI (SEQ ID NO: 3), mcsA (SEQ ID NO: 4) и mcsB (SEQ ID NO: 5). Поскольку E. coli G3/10 является хорошо апробированным пробиотиком, используемым, например, для лечения желудочно-кишечных нарушений, микроцин S необязательно должен быть очищен от этого штамма. MccS должен быть выгодно эффективен in vivo.
Преимущества заключаются в том, что микроцин S не токсичен, не может вызывать аллергию, и патогенным микробам трудно развить устойчивость к нему.
Другие признаки и преимущества изобретения будут очевидны из последующего подробного описания и из формулы изобретения.
Краткое описание чертежей
Фиг. 1 - векторная карта мегаплазмиды pSYM1, кодирующей оперон MccS.
Фиг. 2 - схематическое изображение аминокислотной последовательности гена mcsS, кодирующего прекурсор микроцина S (верхняя панель). Возможный лидерный пептид подчеркнут.Звездочки указывают Cys, вероятно вовлеченный в формирование дисульфидной связи, типичной для микроцинов класса II. Генный кластер микроцина S MccS (нижняя панель) на мегаплазмиде pSYM1 состоит из четырех кластерных генов mcsS, mcsI, mcsA и mcsB.
На Фиг. 3 показана эффективность адгезии ЕРЕС Е2348/69 в эпителиальных клетках кишечника человека после предварительной инкубации со штаммами MDS42 и G4/9 (дикого типа) Е. coli и соответствующими мутантами комплементации плазмиды. Значение использованной звездочки: *р≤0,01.
На Фиг. 4 показана эффективность адгезии ЕРЕС Е2348/69 дикого типа и мутантов, комплементированных плазмидой, к эпителиальным клеткам кишечника человека после предварительной инкубации с разными штаммами, экспрессирующими и не экспрессирующими микроцин. Значение использованных звездочек: *р≤0,01, **р≤0,05, pAZ8 [mcsA, mcsB, mcsI], pAZ13 [mcsI], pAZ14 [mcsI, усечен].
На Фиг. 5 показана эффективность адгезии штаммов O157:Н7 (А), ЕНЕС О104:Н4 серотипа 86-24 ЕНЕС, выделенных в Дрездене (В) и O104:Н4 (С) и O128:Н2 (D) ЕНЕС, выделенных во Франкфурте (на Одере) в эпителиальные клетки кишечника человека после предварительной инкубации с EcN или Е. coli G3/10. Значение использованной звездочки: *р≤0,01 по сравнению с отрицательным контролем.
На Фиг. 6 показаны результаты скрининга mcsS с использованием мультиплексной ПЦР и гена recA в качестве контроля ингибирования.
Краткое описание листинга последовательностей
SEQ ID NO: 1 - нуклеотидная последовательность оперона микроцина S Е. coli G3/10.
SEQ ID NO: 2 - нуклеотидная последовательность гена mcsS Е. coli G3/10.
SEQ ID NO: 3 - нуклеотидная последовательность гена mcsI Е. coli G3/10.
SEQ ID NO: 4 - нуклеотидная последовательность гена mcsA E. coli G3/10.
SEQ ID NO: 5 - нуклеотидная последовательность гена mcsB E. coli G3/10.
SEQ ID NO: 6 - аминокислотная последовательность прекурсорного полипептида микроцина S Е. coli G3/10, включающего лидерную последовательность.
SEQ ID NO: 7 - аминокислотная последовательность полипептида микроцин S Е. coli G3/10 без лидерного пептида.
SEQ ID NO: 8-26 - олигонуклеотидные праймеры, использованные для амплификации генов, содержащихся в опероне или зондах микроцина S (SEQ ID NO: 1) для скрининга на ген mcsS (SEQ ID NO: 2), кодирующий полипептид микроцин S.
Подробное описание изобретения
Определения
Если не определено иное, все технические и научные термины, использованные в настоящем документе, имеют такое же значение, которое обычно понимается специалистом в области, к которой относится изобретение. В случае противоречия настоящее описание, включая определения, имеет преимущество.
Артикли "a", "an" или "the" относятся к слову "один" или "несколько" при использовании в настоящем документе, т.е. это означает "один", "по меньшей мере один" или "один или больше". Например, термин "клетка" может относиться к одной клетке, а также к некоторому множеству клеток.
Термин "включать" также включает варианты осуществления, причем термин "включает" означает "состоит из".
Используемый в настоящем документе термин "идентичность" молекулы аминокислоты или молекулы нуклеиновой кислоты эквивалентен термину "гомология" молекулы аминокислоты или молекулы нуклеиновой кислоты.
Фраза "строгие условия" относится к условиям, в которых зонд молекулы нуклеиновой кислоты будет гибридизироваться с ее мишенью - последовательностью молекул нуклеиновой кислоты, обычно в сложной смеси молекул нуклеиновой кислоты, но не с другими последовательностями. Строгие условия зависят от последовательности и отличаются при разных обстоятельствах. Более длинные последовательности гибридизируются специфически при повышенных температурах. Параметры гибридизации нуклеиновой кислоты можно найти в справочных материалах, излагающих такие способы, например, в публикации "Молекулярное клонирование: лабораторное руководство", Дж. Сэмбрук и др. (J. Sambrook, et al.), eds., Second Edition, Cold Spring Harbor Laboratory Press, Колд-Спринг Харбор, штат Нью-Йорк, 1989, или "Текущие протоколы в молекулярной биологии", Ф.М Осубель и др. (F.M. Ausubel, et al.), eds., John Wiley & Sons, Inc., Нью-Йорк. В общем, строгие условия выбирают так, чтобы они были приблизительно на 5-10°С ниже температуры плавления (Tm) для конкретной последовательности при определенной ионной силе рН. Tm является температурой (при определенной ионной силе, рН, и ядерной концентрации), при которой 50% зондов, комплементарных мишени, гибридизируются с последовательностью-мишенью при равновесии (поскольку последовательности-мишени присутствуют в избытке, при Tm, 50% зондов заняты при равновесии). Строгими условиями будут те, при которых концентрация соли составляет меньше приблизительно 1,0 М иона натрия, обычно приблизительно от 0,01 до 1,0 М концентрации иона натрия (или других солей) при рН 7,0-8,3, и температура составляет по меньшей мере приблизительно 30°С для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°С для длинных зондов (например, больше чем 50 нуклеотидов). Строгие условия Также могут быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид. Для гибридизации высокой строгости положительный сигнал приблизительно по меньшей мере в два раза, а предпочтительно в 10 раз превышает фоновую гибридизацию. Примеры гибридизации высокой строгости или строгих условий гибридизации включают: 50% формамида, 5 х SSC и 1% SDS, инкубированных при 42°С или 5 х SSC и 1% SDS, инкубированных при 65°С с промывкой в 0,2 х SSC и 0,1% SDS при 65°С.
Используемый здесь термин "подобная микроцину активность" полипептида означает, что полипептид имеет сильную антимикробную/антибактериальную активность против тесно связанных видов. Кроме того, это означает, что продуценты микроцина устойчивы к микроцину, который они продуцируют, что опосредовано по меньшей мере одним придающим устойчивость геном, расположенным в одном генном кластере.
Используемый здесь термин "плазмида" относится к молекуле нуклеиновой кислоты, способной реплицироваться в клетке, и с которой может быть оперативно связана другая молекула нуклеиновой кислоты, чтобы вызвать репликация прикрепленного сегмента. Плазмиды, способные направлять экспрессию структурного гена, несущего информацию по целевому полипептиду, здесь названы "экспрессирующими плазмидами".
Используемая здесь фраза "оперативно связанная" означает, что молекула нуклеиновой кислоты изобретения прикреплена к плазмиде так, что экспрессия структурного гена, сформированного молекулой нуклеиновой кислоты, находится под контролем плазмиды.
Термин "регуляторная последовательность" должна включать промоторы, энхансеры и другие элементы управления экспрессией (например, сигналы полиаденилирования).
Термин "конъюгативная плазмида" относится к плазмиде, которая может передаваться от одной клетки другой во время конъюгации.
Используемые здесь термины "трансформация" и "трансфекция" относятся к разным признанным в данной области способам введения инородной нуклеиновой кислоты (например, ДНК) в клетку-хозяин, включая совместное осаждение с фосфатом кальция или хлоридом кальция, трансфекцию, опосредованную DEAE-декстраном, липофекцию или электропорацию.
Используемый здесь термин "пробиотик" относится к живым микроорганизмам, которые после приема в определенном количестве, оказывают благоприятное влияние на здоровье помимо присущей им базовой функции питания.
Используемая здесь "фармацевтическая композиция" относится к препарату из одного или больше активных ингредиентов, описанных в настоящем документе, т.е., полипептиду согласно изобретению (или его фармацевтически приемлемой соли) или клетке согласно изобретению, с другими химическими компонентами, такими как физиологически и фармацевтически приемлемыми носителями и наполнителями. Назначение фармацевтической композиции заключается в том, чтобы облегчить введение соединения в организм.
Ниже, фразы "физиологически приемлемый носитель" и "фармацевтически приемлемый носитель", которые могут использоваться взаимозаменяемо, относятся к носителю или разбавителю, который не вызывает значительного раздражения в организме и не снижает биологическую активность и свойства принимаемого соединения. Одним из ингредиентов, включаемых в фармацевтически приемлемый носитель, может быть, например, полиэтиленгликоль (ПЭГ), биосовместимый полимер с широким диапазоном растворимости в органических и водных средах (Mutter et al. (1979).
Термин "наполнитель" здесь относится к инертному веществу, добавляемому к фармацевтической композиции, чтобы далее облегчить введение активного ингредиента. Примеры наполнителей, но без ограничения, включают карбонат кальция, фосфат кальция, разные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Используемый здесь термин "лечение" относится к профилактике, излечению, изменению в благоприятную сторону, уменьшению, ослаблению, минимизации, подавлению или остановке вредных эффектов процесса заболевания.
Используемый здесь термин "пациент" относится к объекту, который может получить выгоду от настоящего изобретения, такому как животное или млекопитающее (например, собака, кошка, овца, свинья, лошадь, корова, человек), предпочтительно пациентом является человек.
Термин "функциональное нарушение желудочно-кишечного тракта" охватывает ряд идиопатических нарушений, которые влияют на разные части желудочно-кишечного тракта.
Полипептиды
Полипептид микроцин S настоящего изобретения отличается его аминокислотной последовательностью и новыми функциональными свойствами. Полипептиды могут быть выделены с использованием способов, известных в данной области. То есть, встречающийся в природе или продуцированный рекомбинантно полипептид микроцин S может быть выделен из клеток или тканей по подходящей схеме очистки с использованием стандартных способов очистки белков. Однако полипептиды микроцин S могут встречаться в природе в клетке или могут быть продуцированы способами рекомбинантной ДНК или альтернативно рекомбинантной экспрессии, и полипептид микроцин S может быть синтезирован химическим путем с использованием стандартных способов синтеза. Здесь полипептид микроцин S классифицирован как микроцин Е. coli, который может быть фенотипически охарактеризован и назван как микроцин S. На Фиг. 2 в верхней панели показана аминокислотная последовательность прекурсора микроцина S. Двойной глициновый лидерный пептид подчеркнут. Звездочки указывают цистеины, возможно вовлеченные в формирование дисульфидной связи, типичной для микроцинов класса И. Аминокислотная последовательность показывает богатый глицином пептид с двойным сайтом расщепления глицина. В описанных здесь способах могут быть использованы полипептиды, имеющие аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7, или биологически активные варианты полипептидов, имеющих аминокислотную последовательность SEQ ID NO: 6 или SEQ ID NO: 7.
Поэтому в одном предпочтительном варианте осуществления полипептид включает аминокислотную последовательность, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или аминокислотной последовательности SEQ ID NO: 7.
Для определения процента идентичности двух аминокислотных последовательностей или двух нуклеинокислотных последовательностей эти последовательности выравнивают для целей оптимального сравнения (например, зазоры могут быть введены в одну или обе из первой и второй аминокислотной или нуклеинокислотной последовательности для оптимального выравнивания).
В одном предпочтительном варианте осуществления полипептид кодирован молекулой нуклеиновой кислоты, включающей или состоящий из нуклеотидной последовательности, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична нуклеотидной последовательности, включающей нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемент.
Затем сравнивают остатки в соответствующих положениях, и если положение в одной последовательности занимает тот же остаток, что и в соответствующем положении в другой последовательности, то молекулы идентичны в этом положении. Процент идентичности между двумя последовательностями поэтому является функцией числа идентичных положений в двух последовательностях (т.е. % идентичности = число идентичных положений / совокупное число положений × 100). Процент идентичности между двумя последовательностями является функцией числа идентичных положений в последовательностях с учетом числа пробелов и длины каждого пробела, которые введены для оптимального выравнивания двух последовательностей.
Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено с использованием математического алгоритма. Неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Карлина и Альшуля (Karlin and Altschul) (1990) Proc. Natl. Acad. Sci. USA 87:2264, с модификацией от 1993 г., Proc. Natl. Acad. Sci. USA 90:5873. Такой алгоритм введен в программы NBLAST и XBLAST (версия 2.0) Альтшуля и др. (1990) J. Mol. Biol. 215:403. Поиски нуклеотидов в BLAST могут быть выполнены с оценкой по программе NBLAST = 100, длина слова = 12, чтобы получить нуклеотидные последовательности, гомологичные молекулам нуклеиновой кислоты изобретения. Поиски белков в BLAST могут быть выполнены в программе XBLAST, оценка = 50, длина слова = 3, чтобы получить аминокислотные последовательности, гомологичные молекулам белков изобретения. Для получения выравниваний с пробелами для целей сравнения можно использовать программу Gapped BLAST, которая описана Альтшулем и др., (1997) Nucleic Acids Research 25(17):3389. При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). Смотрите http://www.ncbi.nlm.nih.gov. Еще одним предпочтительным неограничивающим примером алгоритма, используемого для сравнения последовательностей, является алгоритм Майерса и Миллера (Myers and Miller), CABIOS (1989). Такой алгоритм включен в программу ALIGN (версия 2.0 или 2.0U), которая является частью пакета программ для выравнивания последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно использовать таблицу массовых остатков РАМ120, штраф на длину пробела 12 и штраф на пробел 4. В данной области известны другие алгоритмы для анализа последовательностей, которые включают ADVANCE и ADAM, описанные у Торелли и Роботти (Torelli and Robotti) (1994) Comput. Appl. Biosci. 10:3; и FASTA, описанный у Пирсона и Липмена (Pearson and Lipman) (1988) Proc. Natl. Acad. Sci. USA 85:2444.
В еще одном варианте осуществления полипептид имеет подобную микроцину антимикробную, антибактериальную или противоопухолевую активность. Полипептид является бактериальным полипептидом, предпочтительно бактериальным микроцином S. Кроме того, полипептид ингибирует адгезию бактерий к эпителиальным клеткам кишечника человека. То есть необходимо понимать, что полипептид обеспечивает антимикробную/антибактериальную активность против тесно связанных видов, при этом полипептид не развивает антимикробную/антибактериальную активность против своего продуцента, который имеет устойчивость к микроцину, который он продуцирует. Поэтому полипептид ингибирует адгезию тесно связанных видов бактерий к эпителиальным клеткам кишечника человека.
Предпочтительно, полипептид получают из штамма Е. coli, более предпочтительно из Е. coli G3/10. В других вариантах осуществления Е. coli G3/10 является Е. coli G3/10 DSM 16443.
Кроме того, предпочтительно, чтобы полипептид был биоразлагаемым.
Молекулы нуклеиновых кислот
Геном пробиотического штамма Е. coli G3/10 был полностью секвенирован с использованием технологии "пиросеквенирования" и затем автоматически аннотирован и далее отредактирован вручную.
E. coli G3/10 имеет геном 4935403 пар оснований и шесть плазмид размером от 1,3 т.п.н. до 50 т.п.н. 40 т.п.н. из 50 т.п.н. плазмиды pSYM1 почти полностью идентичны (гомология 99%) с pMAS2027 из уропатогенной Е. coli (Ong, С.L., Beatson, S.А., McEwan, A.G. & Schembri, M.A. (2009) Appl Environ Microbiol 75, 6783-6791). Остальные 10 т.п.н. содержат рамки считывания без гомологии или с низкой гомологией с нуклеотидом и аминокислотными последовательностями, депонированными в базах данных NCBI и ExPASy. Четыре из этих генов несут информацию по полностью новому, ранее не описанному микроцину Е. coli Класса На, включая иммунную и транспортную систему. Этот генный кластер микроцина S (SEQ ID NO: 1), состоящий из четырех кластерных генов mcsS (SEQ ID NO: 2), mcsI (SEQ ID NO: 3), mcsA (SEQ ID NO: 4) и mcsB (SEQ ID NO: 5) был выделен. Этот микроцин был охарактеризован фенотипически и назван микроцином S. Двумя экспортгенами MccS являются mcsA и mcsB (Фиг. 2). Ген mcsA является членом семейства гемолизинов HlyD Е. coli и показывает небольшую гомологию с белком секреции колицина cvaA. Ген mcsB кодирует АВС-транспортер двумя участками трансмембранных доменов и одним пептидазным доменом. Оба экспортгена MccS, которыми являются mcsA и mcsB, несут информацию по полипептидам, которые отвечают за транспорт микроцина S из клеточной, в частности бактериальной цитоплазмы во внеклеточное пространство.
Молекула нуклеиновой кислоты настоящего изобретения, например, молекула нуклеиновой кислоты, имеющая нуклеотидную последовательность любой одной из SEQ ID NO: 1-5 или любой одной из SEQ ID NO: 8-26 или ее части, может быть выделена с использованием стандартных способов молекулярной биологии и заложенной в ней информации о последовательности. Например, при использовании всей или части нуклеинокислотной последовательности любой одной из SEQ ID NO: 1-5 или любой одной из SEQ ID NO: 8-26 в качестве гибридизационного зонда, молекулы нуклеиновых кислот микроцина S могут быть выделены с использованием стандартных способов гибридизации и клонирования (например, как сказано у Сэмбрука, Дж. и др., Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989).
Нуклеиновая кислота изобретения может быть амплифицирована с использованием кДНК, мРНК или, альтернативно, геномной ДНК, в качестве шаблона и подходящих олигонуклеотидных праймеров согласно стандартным способам амплификации ПЦР. Другие подходящие праймеры описаны ниже. Амплифицированную таким образом нуклеиновую кислоту можно клонировать в подходящий вектор и характеризовать путем анализа последовательности ДНК. Кроме того, олигонуклеотиды, соответствующие нуклеотидным последовательностям микроцина S, могут быть получены стандартным способами синтеза, например, путем использования автоматизированного синтезатора ДНК.
В одном предпочтительном варианте осуществления молекула нуклеиновой кислоты включает или состоит из нуклеотидной последовательности, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплементу.
В еще одном варианте осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, которая кодирует полипептид, включающий или состоящий из аминокислотной последовательности, которая по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или больше идентична аминокислотной последовательности SEQ ID NO: 6 или аминокислотной последовательности SEQ ID NO: 7.
В еще одном варианте осуществления молекула нуклеиновой кислоты кодирует бактериальный полипептид, предпочтительно бактериальный микроцин S.
Предпочтительно, молекулу нуклеиновой кислоты получают из штамма Е. coli, более предпочтительно из Е. coli G3/10. В одном варианте осуществления молекула нуклеиновой кислоты получена из Е. coli G3/10 DSM 16443.
Праймер или зонд нуклеиновой кислоты
Нуклеотидная последовательность, определенная из клонирования генов микроцина S, учитывает создание зондов и праймеров, предназначенных для использования в амплификации гена микроцина S изобретения и/или идентификации генов микроцина S в других видах.
Следовательно, изобретение кроме того предлагает молекулы нуклеиновой кислоты в качестве праймеров или зондов, которые включают последовательность, которая гибридизируется с молекулой нуклеиновой кислоты согласно изобретению в жестких условиях. Такой праймер или зонд нуклеиновой кислоты включает последовательность по меньшей мере из 15 последовательных оснований.
Праймер или зонд нуклеиновой кислоты обычно включает по существу очищенный олигонуклеотид.
В одном предпочтительном варианте осуществления праймер или зонд нуклеиновой кислоты гибридизируется по меньшей мере приблизительно с 12 или 15, предпочтительно приблизительно 20 или 25, более предпочтительно приблизительно 30, 35, 40, 45, 50, 55, 60, 65, 75 или 100 последовательными нуклеотидами смысловой последовательности любой одной из SEQ ID NO: 1, 2, 3, 4 или 5, или ее комплемента, или встречающегося в природе аллельного варианта или мутанта любой одной из SEQ ID NO: 1, 2, 3, 4 или 5. В одном варианте осуществления праймер или зонд нуклеиновой кислоты гибридизирует нуклеотидную последовательность любой одной из SEQ ID NO: 1, 2, 3, 4 или 5 или ее комплемента в жестких условиях.
В более предпочтительном варианте осуществления праймер или зонд нуклеиновой кислоты включает по меньшей мере одну из SEQ ID NO: 8 - SEQ ID NO: 26. Последовательности типичных праймеров или зондов нуклеиновых кислот показаны в таблице 1.


Праймеры или зонды нуклеиновых кислот согласно изобретению используются для амплификации или скрининга молекулы нуклеиновой кислоты согласно изобретению.
Следовательно, молекулы нуклеиновой кислоты или ее части могут быть амплифицированы, например, путем ПЦР или другого способа амплификации, хорошо известного в данной области техники, и амплифицированные молекулы нуклеиновой кислоты или их части могут быть секвенированы способами, известными в данной области техники. Полимеразная цепная реакция (ПЦР) является способом амплификации нуклеиновых кислот, включая денатурацию, отжиг и синтез нуклеиновых кислот, и во время отжига происходит гибридизация зонда и нуклеиновой кислоты-мишени. Условия для ПЦР могут быть изменены согласно степени гомологии между зондом и нуклеиновой кислотой-мишенью. Если температуру отжига повысить при заданных условиях ПЦР, выход неспецифических продуктов гибридизации уменьшается, когда температура отжига понижена, выход неспецифических продуктов гибридизации повышается. Смотрите, например, J. Sambrook и David W. Russell: Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, (2000).
Раскрытые здесь зонды также можно использовать для детекции молекул нуклеиновой кислоты изобретения в разных типах клеток. Например, праймеры или зонды нуклеиновых кислот согласно изобретению могут быть использованы для скрининга молекулы нуклеиновой кислоты согласно изобретению с использованием мультиплексной ПЦР. Мультиплексная ПЦР позволяет одновременно амплифицировать разные гены, которые предназначены для амплификации, в одной реакции. То есть, наборы разных праймеров, которые способны амплифицировать соответствующие последовательности-мишени, помещают в один реактор, и амплификации, последовательностей-мишеней выполняют одновременно за одну реакцию ПЦР (смотрите, например, Wittwer С.Т., et al., Real-time multiplex PCR assays. Methods 25(4): 430-442, (2001); Markoulatos P., et al., Multiplex PCR: rapid DNA cycling in a conventional thermal cycler. J. Clin. Lab. Anal. 17(4): 108-112, (2003); O. Henegariu, et al., Multiplex PCR: Critical Parameters и Step-by-Step Protocol. BioTechniques 23: 504-511, (1997); и Markoulatos P., et al., Multiplex polymerase chain reaction: a practical approach. J. Clin. Lab. Anal. 16(1): 47-51, (2002).
Плазмиды
Плазмиды являются одним типом векторов, который относится к кольцевой петле двухцепочечной ДНК, в которую могут быть литерованы дополнительные сегменты ДНК. Определенные плазмиды способны к автономной репликации в клетке-хозяине, в которой они находятся или в которую они введены (например, бактериальные плазмиды, имеющие бактериальное происхождение репликации, и эписомальные векторы млекопитающих). Более того, определенные плазмиды способны направлять экспрессию генов, с которыми они оперативно связаны. Такие векторы называются в настоящем документе "экспрессирующими плазмидами".
E.coli G3/10 имеет шесть плазмид с размером от 1,3 т.п.н. до 50 т.п.н.. 40 т.п.н. из 50 т.п.н. плазмиды, называемые pSYM1 (Фиг. 1) почти полностью идентичны (гомология 99%) pMAS2027 из уропатогенной Е. coli. Остальные 10 т.п.н. содержат рамки считывания без гомологии или с низкой гомологией с нуклеотидной и аминокислотной последовательностями, депонированными в базах данных NCBI и ExPASy. Четыре из этих генов несут информацию по полностью новому, ранее не описанному микроцину Класса IIa Е. coli, включая иммунную и транспортную систему. Этот генный кластер микроцина S (SEQ ID NO: 1), состоящий из четырех кластерных генов mcsS (SEQ ID NO: 2), mcsI (SEQ ID NO: 3), mcsA (SEQ ID NO: 4) и mcsB (SEQ ID NO: 5), был выделен.
Следовательно, плазмида может включать молекулу нуклеиновой кислоты изобретения. В одном предпочтительном варианте осуществления плазмида является экспрессирующей плазмидой.
Экспрессирующие плазмиды изобретения включают нуклеиновую кислоту изобретения в форме, подходящей для экспрессии молекулы нуклеиновой кислоты в клетке, что означает, что встречающиеся в природе или рекомбинантные экспрессирующие векторы включают одну или более регуляторных последовательностей, выбираемых на основании клеток-хозяев, которые будут использоваться для экспрессии, которая оперативно связана с экспрессируемой нуклеинокислотной последовательностью.
Соответственно, также предпочтительно, чтобы регуляторный элемент плазмиды был оперативно связан с молекулой нуклеиновой кислоты изобретения.
В еще одном варианте осуществления плазмида является конъюгативной плазмидой.
Плазмиды, использованные в настоящем документе, показаны в таблице 2.

Клетки
Клеткой может быть клетка-хозяин, которая может быть любой прокариотической или эукариотической клеткой. Например, полипептид микроцин S может быть экспрессирован в бактериальных клетках, таких как Е. coli, которые здесь предпочтительны, или клетках насекомых, дрожжей или клетках млекопитающего (таких как клетки яичника китайского хомяка (СНО) или клетках COS). Другие подходящие клетки-хозяева известны специалистам в данной области техники.
Плазмидная ДНК может быть встречающейся в природе в клетках или может быть введена в прокариотические или эукариотические клетки путем обычной трансформации или трансфекции. Подходящие способы трансформации или трансфекции клеток-хозяев можно найти в публикации Сэмбрука и др. (Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989) и других лабораторных руководствах.
Поэтому настоящее изобретение также относится к клетке, включающей молекулу нуклеиновой кислоты настоящего изобретения, и/или полипептид по п. 1 и/или плазмиду настоящего изобретения.
Молекула нуклеиновой кислоты может быть интегрирована в геном клетки изобретения (клетки изобретения) или, предпочтительно, в плазмиду в клетке изобретения.
Предпочтительно, чтобы клеткой изобретения являлась бактериальная клетка. Например, клеткой является клетка Е. coli, предпочтительно от Е. coli DSM 17252, наиболее предпочтительно клетка Е. coli G3/10.
Клеткой изобретения также может быть рекомбинантная клетка-хозяин.
В одном предпочтительном варианте осуществления клеткой изобретения является пробиотическая клетка. Тогда клетка имеет антимикробную, антибактериальную или противоопухолевую активность. Следует понимать, что клетка развивает антимикробную активность против тесно связанных видов, при этом клетка не развивает антимикробную активность против ее продуцента, который устойчив к микроцину и который его продуцирует.
Как таковая, клетка изобретения ингибирует адгезию бактерий к эпителиальным клеткам кишечника человека.
Клетки, которые в естественном виде включают нуклеиновые кислоты, полипептиды или плазмиды изобретения и которые специфически не находятся в выделенной форме, исключены из формулы изобретения настоящей заявки.
Антитела
Иммуноген микроцин S обычно используют для приготовления антител путем иммунизации подходящего пациента (например, кролика, козы, мыши или другого млекопитающего) с помощью иммуногена. Подходящий иммуногенный препарат может содержать, например, встречающийся в природе или рекомбинантно экспрессированный полипептид микроцин S или химически синтезированный пептид микроцин S. Препарат также может включать адъювант, такой как полный или неполный адъювант Фрейнда, или подобный иммуностимулирующий агент. Иммунизация подходящего пациента с помощью иммуногенного препарата микроцина S вызывает реакцию поликлонального антитела к микроцину S. Такие способы известны в данной области.
Следовательно, поликлональные антитела к микроцину S могут быть приготовлены как сказано выше, путем иммунизации подходящего пациента с помощью иммуногена микроцин S. По желанию, молекулы антитела, направленные против полипептида микроцина S, могут быть выделены из млекопитающего (например, из крови) и затем очищены известными способами, такими как хроматография белка А, чтобы получить фракцию IgG. Через подходящее время после иммунизации, например, когда титры антитела к микроцину S наибольшие, клетки, продуцирующие антитело, могут быть получены от пациента и использованы для приготовления моноклональных антител стандартными способами, такими как гибридомный способ, впервые описанный Колером и Мильштейном (Kohler and Milstein) (1975) Nature 256:495-497 (также смотрите, Brown et al. (1981) J. Immunol 127:539-46; Brown et al. (1980) J. Biol. Chem. 255:4980-83; Yeh et al. (1976) Proc. Natl. Acad. Sci. USA 76:2927-31; Yeh et al. (1982) Int. J. Cancer 29:269-75), более поздний гибридомный способ с В-клетками человека (Kozbor et al. (1983) Immunol. Today 4:72), гибридомный способ с EBV (вирус Эпштейна-Барра) (Cole et al. (1985) Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96) или триомные способы. Также хорошо известен способ продукции гибридом моноклональных антител (смотрите Kenneth, R.Н. in Monoclonal Antibodies: A New Dimension In Biological Analyses, Plenum Publishing Corp., New York, New York (1980); Lerner, E.A. (1981) Yale J. Biol. Med. 54:387-402; Getter, M.L. et al. (1977) Somatic Cell Genet., 3:231-36). Вкратце, бессмертную линию клеток (обычно миелома) гибридизируют с лимфоцитами (обычно спленоцитами) от млекопитающего, иммунизированного иммуногеном микроцина S, как сказано выше, и выполняют скрининг супернатантов культуры полученных гибридомных клеток для идентификации гибридомы, продуцирующей моноклональное антитело, которое специфически связывается с полипептидом микроцином S.
Соответственно, в вариантах осуществления настоящее изобретение также направлено на антитела, которые селективно связываются с полипептидом, которым является полипептид микроцин S. В виду хорошо обоснованного принципа иммунологической перекрестной реактивности, настоящее изобретение поэтому предусматривает антигенно связанные варианты полипептида SEQ ID NO: 6 или SEQ ID NO: 7. "Антигенно связанным вариантом" является полипептид, который включает по меньшей мере шесть аминокислотных остатков частей последовательности полипептида SEQ ID NO: 6 или SEQ ID NO: 7 и который способен индуцировать молекулы антител, которые вступают в иммунную реакцию с полипептидом SEQ ID NO: 6 или SEQ ID NO: 7. Антитела могут быть синтетическими, моноклональными или поликлональными и могут быть получены способами, которые хорошо известны в данной области техники.
Композиции и фармацевтические композиции
Полипептид микроцин S или даже клетка изобретения могут быть введены в композицию или фармацевтическую композицию, которая подходит для приема. Соответственно, настоящее изобретение предусматривает композицию, включающую полипептид согласно изобретению или клетку согласно изобретению.
В еще одном предпочтительном варианте осуществления композиция является водной композицией.
В еще одном варианте осуществления композиция имеет антимикробную, антибактериальную или противоопухолевую активность. Тогда композиция ингибирует адгезию бактерий к эпителиальным клеткам кишечника человека.
В одном предпочтительном варианте осуществления композиция является пробиотической композицией. Предпочтительно, пробиотическая композиция включает смесь пробиотических микроорганизмов, предпочтительно Е. coli DSM 17252. Например, композиция включает клетки и/или автолизаты по меньшей мере одного из Е. coli G1/2 (DSM 16441), G3/10 (DSM 16443), G4/9 (DSM 16444), G5 (DSM 16445), G6/7 (DSM 16446) и G8 (DSM 16448) или их смесь. Композиция может содержать автолизаты, а также клетки в количестве от 3,00×106 до 2,25×108 клеток на 1 мл, предпочтительно 1,5-4,5×107 клеток на 1 мл. Предпочтительно, композиция включает автолизаты, а также клетки бактерий Е. coli и другие добавки. Соответственно, изобретение предлагает пробиотическую композицию, включающую по меньшей мере один из штаммов бактерий Е. coli G1/2 (DSM 16441), G3/10 (DSM 16443), G4/9 (DSM 16444), G5 (DSM 16445), G6/7 (DSM 16446) и G8 (DSM 16448), т.е., один из вышеупомянутых штаммов или любой штамм бактерий, выбранный способом изобретения, при этом композиция включает по меньшей мере 1 штамм, предпочтительно от 2 до 3 штаммов, более предпочтительно от 2 до 4 штаммов, даже более предпочтительно от 2 до 5 штаммов и наиболее предпочтительно от 2 до 6 штаммов, и где каждый из штаммов присутствует в композиции в пропорции от 0,1% до 99,9%, предпочтительно от 1% до 99%, более предпочтительно от 10%) до 90%). В одном предпочтительном варианте осуществления композиция включает по меньшей мере один из штаммов изобретения вместе с другим штаммом или смесь штаммов, причем смесь включает предпочтительно от 2 до 6 штаммов, более предпочтительно от 2 до 4 штаммов, наиболее предпочтительно от 2 до 3 штаммов, и причем каждый из штаммов присутствует в композиции в пропорции от 0,1% до 99,9%, предпочтительно от 1% до 99%, более предпочтительно от 10%) до 90%). Пробиотические композиции изобретения предпочтительно находятся в лиофилизованной форме, в замороженной форме или даже мертвые. В одном предпочтительном варианте осуществления пробиотическая композиция включает один или больше пробиотических микроорганизмов и носитель, который служит для транспорта этого одного или нескольких пробиотических микроорганизмов в желудочно-кишечный тракт, причем носитель может включать модифицированный или немодифицированный устойчивый крахмал в форме крахмалов с высоким содержанием амилозы или их смеси. Носитель выступает в качестве среды роста или поддержания микроорганизмов в желудочно-кишечном тракте, так что пробиотические микроорганизмы защищены во время прохода в толстую кишку или другие участки желудочно-кишечного тракта.
В одном предпочтительном варианте осуществления композиция также может быть фармацевтической композицией. Тогда фармацевтическая композиция также включает фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать терапевтически эффективное количество полипептида или клетки и один или несколько адъювантов, наполнителей, носителей и/или разбавителей. Приемлемые разбавители, носители и наполнители обычно не оказывают неблагоприятного влияния на гомеостаз пациента (например, электролитический баланс). Приемлемые носители включают биосовместимые, инертные или биоабсорбируемые соли, буферные агенты, олиго- или полисахариды, полимеры, агенты, улучшающие вязкость, консерванты и т.д. Другие подробности о способах подготовки состава и приема фармацевтических композиций можно найти, например, в публикации REMINGTON'S PHARMACEUTICAL SCIENCES (Maack Publishing Co., Easton, Pa.).
Примеры добавок включают глюкозу, лактозу, сахарозу, маннитол, крахмал, целлюлозу или производные целлюлозы, стеарат магния, стеариновую кислоту, сахаринат натрия, тальк, карбонат магния и т.д. Примерами добавок, которые могут быть добавлены для получения желательного цвета, вкуса, стабильности, буферной способности, дисперсии или других известных желательных признаков, являются красный оксид железа, силикагель, лаурилсульфат натрия, диоксид титана, пищевые белые чернила и т.д. Сходные разбавители можно использовать для изготовления прессованных таблеток.
В некоторых вариантах осуществления в композиции также могут быть включены дополнительные активные соединения.
Фармацевтические композиции изобретения готовят так, чтобы они были совместимы с намеченным способом приема. Примеры способов приема включают, например, парентеральный, внутривенный, интрадермальный, подкожный, пероральный, трансдермальный (топикальный), трансмукозальный и ректальный.
Растворы или суспензии, используемые для парентерального, интрадермального или подкожного применений могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физраствор, фиксированные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулировки тонуса, такие как соляная кислоты или гидроксид натрия. Парентеральный препарат может быть помещен в ампулы, одноразовые шприцы или флаконы из стекла или пластика для нескольких доз.
В композициях, подходящих для инъекций, используют стерильные водные растворы (если они растворимы в воде) или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсий для немедленного приема. Подходящие носители для внутривенного введения включают физраствор, бактериостатическую воду, Cremophor EL™ (BASF, Парсиппани, штат Нью-Джерси) или фосфатный буферный раствор (PBS). Во всех случаях композиция должна быть стерильной и должны быть текучей до такой степени, чтобы ее можно было легко ввести шприцем. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерол, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и подходящие их смеси. Надлежащая текучесть может поддерживаться, например, путем использования покрытия, такого как лецитин, для поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто разными антибактериальными и антигрибковыми агентами, например, парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимерозаль и т.д. Во многих случаях будет предпочтительным включить изотонные агенты, например, сахара, полиспирты, такие как маннитол, сорбитол, хлорид натрия в композицию. Пролонгированное впитывание композиций для инъекций может быть достигнуто путем включения в композицию агента, который задерживает впитывание, например, моностеарата алюминия и желатина.
Для перорального введения можно использовать форму капсул, жидкости, таблеток, пилюль или состав с пролонгированным высвобождением.
Пероральные композиции обычно включают инертный разбавитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для перорального терапевтического приема активное соединение может быть дополнено наполнителями и использовано в форме таблеток, пастилок или капсул. Пероральные композиции также могут быть приготовлены с жидким носителем, причем соединение в жидком носителе применяется перорально и выдыхается, отхаркивается или проглатывается. Фармацевтически совместимые связующие агенты и/или адъюванты могут быть включены в композицию. Пероральная композиция может содержать любые из следующих ингредиентов или соединений подобного характера: соль, такая как хлорид натрия или сульфат магния, сульфат магния ⋅ 7 Н2О, хлорид калия, хлорид кальция, такой как хлорид кальция ⋅ 2 Н2О, хлорид магния, такой как хлорид магния ⋅ 6 Н2О, очищенная вода, связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегратор, такое как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или Sterotes; регулятор сыпучести, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовая добавка, такая как перечная мята, метилсалицилат или добавка с вкусом апельсина.
Для приема путем ингаляции соединения подаются в форме аэрозольного спрея из контейнера под давлением или раздаточного устройства, которое содержит подходящий вытеснитель, например, газ, такой как диоксид углерода, или распылитель.
Системный прием также может осуществляться трансмукозально или трансдермально. Для трансмукозального или трансдермального приема в составе используют пенетранты, подходящие для барьера, который необходимо преодолеть. Такие пенетранты широко известны в данной области и включают, например, для трансмукозального приема, детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальный прием может быть осуществлен посредством использования назальных спреев или свеч. Для трансдермального приема активные соединения вводят в мази, бальзамы, гели или кремы, которые широко известны в данной области.
Соединения также могут быть приготовлены в форме свечей (например, с известными основами, такими как масло какао и другие глицериды) или клизм для ректальной доставки.
В одном варианте осуществления активные соединения приготовлены с носителями, которые будут защищать соединение от быстрого удаления из организма, для контролируемого высвобождения и включают импланты и системы микрокапсулированной доставки. Могут быть использованы биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полилактид. Способы приготовления таких составов известны специалистам в данной области. Материалы также могут быть получены коммерческим путем от компаний Alza Corporation и Nova Pharmaceuticals, Inc. Липосомные суспензии (включая липосомы, нацеленные на инфицированные клетки с моноклональными антителами к вирусным антигенам) также могут быть использованы в качестве фармацевтически приемлемых носителей. Они могут быть приготовлены способами, известными специалистам в данной области, например, которые описаны в патенте США №4,522,811.
Особенно предпочтительно изготавливать пероральные композиции в форме разовых доз для легкости приема и единообразия дозировки. Используемый здесь термин "форма разовых доз" относится к физически раздельным единицам, подходящим в качестве разовых доз для пациента, проходящего лечение; каждая единица содержит определенное количество активного соединения, которое рассчитано так, чтобы давать желательный терапевтический эффект, вместе с требуемым фармацевтическим носителем. Спецификация для форм разовых доз изобретения диктуется и прямо зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и ограничений, присущих приготовлению соединений, таких как активное соединение для лечения пациентов.
В альтернативном варианте осуществления композиция может быть веществом для дезинфекции поверхностей. Следовательно, использование композиции для дезинфекции поверхностей также предусмотрено настоящим документом.
В одном предпочтительном варианте осуществления дезинфицирующая композиция кроме того включает, в соответствующих случаях, поверхностно-активное вещество или смесь вещества, ароматических веществ, адъювантов и связующих.
В еще одном варианте осуществления дезинфицирующая композиция кроме того включает связующее и, по выбору, ароматические и подкрашивающие вещества и адъюванты, такие как вещества для умягчения воды, наполнители и т.д., и доступна в форме жидкости, таблеток или гранул.
Предпочтительно, дезинфицирующая композиция безопасна для пищевых продуктов.
Дезинфицирующая композиция кроме того защищает от патогенных микробов, устойчивых к антибиотикам.
Набор
Также предлагаются наборы, включающие в одном или нескольких контейнерах терапевтически или профилактически эффективное количество композиции изобретения. По выбору, набор может включать инструкции для выполнения намеченного медицинского использования, как оно здесь раскрыто, или для выполнения предложенных способов.
Медицинское использование полипептида, клетки, композиций и набора
Поскольку полипептид, клетка и композиция проявляют антимикробную, антибактериальную или противоопухолевую активность, изобретение кроме того относится к их медицинскому использованию для терапии или профилактики.
Более конкретно, они могут быть использованы для лечения или профилактики микробных инфекций. Кроме того, они используются для лечения и профилактики желудочно-кишечных нарушений, например, нарушений функции желудочно-кишечного тракта, в одном варианте осуществления для лечения и профилактики диареи.
В одном предпочтительном варианте осуществления микробная инфекция включает инфекции, вызываемые энтеропатогенной и/или энтерогеморрагической Е. coli (ЕРЕС, ЕНЕС). В еще одном варианте осуществления микробная инфекция включает гемолитико-уремический синдром (HUS), предпочтительно энтеропатический гемолитико-уремический синдром. Изобретение, однако, не ограничено заболеваниями, вызываемыми ЕРЕС или ЕНЕС, но также включает лечение или профилактику заболеваний, вызываемых другими микроорганизмами, ответственными за такие желудочно-кишечные нарушения как диарея, например, Salmonella spec, Shigella spec, и Yersinia spec.
В одном предпочтительном варианте осуществления микробная инфекция включает энтерогеморрагическую инфекцию Е. coli (ЕНЕС), то есть штамм начала энтерогеморрагической Е. coli О104:Н4 или любой другой ЕНЕС, восприимчивой к микроцину S. В еще одном предпочтительном варианте осуществления микробная инфекция включает шига-токсин, продуцирующий инфекцию Е. coli. Шига-токсин, продуцирующий Е. coli, может быть энтерогеморрагической Е. coli. Помимо других вирулентных факторов, шига-токсины (Stx 1; Six 2; Stx 1,2) ответственны за тяжелую диарею, часто с кровью, и наступление гемолитического уремического синдрома. Клетки ЕНЕС высвобождают шига-токсины при лечении определенными антибиотиками. Поэтому лечение пациентов антибиотиками считается противопоказанным. При лечении микробной инфекции с использованием полипептида, клетки или композиции изобретения продукцию шига-токсина можно ингибировать.
В других вариантах осуществления микробная инфекция включает энтеропатогенную инфекцию Е. coli.
В вариантах осуществления микробная инфекция включает инфекцию семейства энтеробактерий, продуцирующих бета-лактамазы расширенного спектра. Предпочтительно, микробная инфекция включает Е. coli, продуцирующие бета-лактамазы расширенного спектра.
В вариантах осуществления полипептид, клетка или композиция изобретения ингибируют микробы, вызывающие микробную инфекцию, в пропорции 1:1000, предпочтительно 1:500, более предпочтительно 1:100, даже более предпочтительно 1:50, наиболее предпочтительно 1:20 или даже 1:1-1:10.
В альтернативном варианте осуществления полипептид, клетка, композиция изобретения или набор изобретения предназначены для использования при лечении функциональных нарушений желудочно-кишечного тракта, предпочтительно синдрома раздраженной толстой кишки. Предпочтительно использовать их при лечении взрослых и детей.
В еще одном альтернативном варианте осуществления полипептид, клетка, композиция или набор предназначены для использования при лечении опухоли. Они способны, даже и в разной степени, ингибировать рост опухолевых клеток. Предпочтительно, полипептид микроцин S может индуцировать апоптоз в клеточных линиях человека. Например, полипептид, молекула нуклеиновой кислоты, клетка или композиция согласно изобретению могут быть применены к пациенту с использованием вышеуказанных путем приема, например, внутривенно. Полипептид, молекула нуклеиновой кислоты или клетка могут накапливаться в опухоли. При введении клетки изобретения она может накапливаться в опухоли и продуцировать полипептид согласно изобретению. Полипептид также может быть экспрессирован из молекулы нуклеиновой кислоты изобретения или высвобожден из композиции. Микроцин S может быть помещен под контроль активного промотора опухоли. Полипептид, клетку или композицию вводят пациентам в биологически совместимой форме, подходящей для фармацевтического приема.
Полипептид, клетка, композиция или набор должны индуцировать значительные уровни апоптоза в опухолевых клетках, при этом не оказывая влияния на нормальные клеточные системы.
Неограничивающие примеры заболеваний или нарушений, которые можно лечить или профилактировать с использованием полипептида, клетки, композиции или набора, включают опухоли в общем, в частности колоректальный рак, рак печени, глиомы, нейробластомы, чешуйчатоклеточную карциному головы и шеи, лимфоидные опухоли, рак простаты, рак мочевого пузыря, рак груди, рак плевры и брюшины.
В некоторых вариантах осуществления, описанных в настоящем документе, полипептид, клетка или композиция могут быть введены пациенту, например, парентерально, внутривенно, интрадермально, подкожно, перорально, трансдермально (топикально), трансмукозально и ректально, предпочтительно перорально.
Полипептид, клетка или композиция могут быть введены пациенту в фармацевтически эффективном количестве. Введение фармацевтически эффективного количества полипептида, клетки или композиции настоящего изобретения определяется как количество, эффективное в дозах и в течение периодов времени, необходимых для достижения желательного результата. Например, фармацевтически эффективное количество полипептида, клетки или композиции может меняться в зависимости от таких факторов как состояние заболевания, возраст, пол и вес пациента и способности полипептида, клетки или композиции вызывать желательную реакцию у пациента. Режим дозировки может быть скорректирован, чтобы обеспечить оптимальную терапевтическую реакцию. Например, несколько разделенных доз можно принимать ежедневно, или же доза может быть уменьшена пропорционально предписаниям по терапевтической ситуации.
Для оптимизации эффективности терапии полипептид микроцин S вводят в разных дозах в разные моменты времени.
Пациенту может быть назначена одна фармацевтически эффективная доза или несколько фармацевтически эффективных доз, например, 2, 3, 4, 5, 6, 7 или больше. Более конкретно, пациенту может быть назначена одна фармацевтически эффективная доза 2, 3, 4, 5, 6, 7 или больше раз в сутки.
Более конкретно, предмет изобретения может быть назначен в дозе 5-15 капель водной композиции. Более предпочтительно должна быть назначена доза 10 капель. В таком варианте осуществления 1 мл содержит приблизительно 14 капель.
Фармацевтически эффективное количество (т.е. фармацевтически эффективная доза) составляет приблизительно от 0,001 до 30 мг/кг массы тела, предпочтительно приблизительно от 0,01 до 25 мг/кг массы тела, более предпочтительно приблизительно от 0,1 до 20 мг/кг массы тела и даже более предпочтительно приблизительно от 1 до 10 мг/кг, от 2 до 9 мг/кг, от 3 до 8 мг/кг, от 4 до 7 мг/кг или от 5 до 6 мг/кг массы тела.
Прием нескольких доз может быть разделен интервалами в несколько часов, суток, недель или месяцев. В других вариантах осуществления они вводятся по меньшей мере один раз, два раза или три раза в сутки в воде во время приема пищи, предпочтительно три раза в сутки в воде во время приема пищи.
По выбору, они могут быть введены пациенту в течение ограниченного периода времени и/или в ограниченном числе доз. Например, в некоторых вариантах осуществления введение пациенту может быть прекращено (т.е., дальнейшего приема не предусмотрено) в течение, например, одного года, шести месяцев, одного месяца или двух недель. Например, предусмотренное ведение может быть прекращено через шесть месяцев. При хронических заболеваниях может быть необходимо увеличить этот период на срок до шести месяцев.
В некоторых вариантах осуществления доза может быть увеличена через 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 1 недели, 2 недель, 3 недель, 4 недель или больше. Доза, назначаемая пациенту, может быть увеличена до 15-25 капель, более предпочтительно до 20 капель водной композиции.
Для детей они могут быть назначены в пероральной форме, по 5-15 капель водной композиции. Более предпочтительно, ребенку необходимо назначить 10 капель. В других вариантах осуществления их назначают ребенку по меньшей мере 1 раз, 2 раза или три раза в сутки в воде во время приема пищи, предпочтительно 1 раз в день в воде во время приема пищи.
Во всех видах медицинского использования вариантов осуществления полипептид, клетка, композиция или набор изобретения должны назначаться в начале лечения взрослому 10 капель 3 раза в сутки в воде во время приема пищи, и через 1 неделю дозу увеличивают до 20 капель взрослому и 10 капель ребенку 1 раз в сутки в воде во время приема пищи.
Способ изготовления полипептида микроцина S
Полипептиды настоящего изобретения могут быть натурально очищенным продуктом или продуктом химического синтеза, или могут быть получены рекомбинантными способами из прокариотической или эукариотической клетки-хозяина (например, путем посева клеток бактерий, дрожжей, высших растений, насекомых и млекопитающих на культуру).
Более конкретно, клетка изобретения, такая как прокариотическая или эукариотическая клетка-хозяин в культуре, может быть использована для продукции (т.е. экспрессии) полипептида микроцина S. Соответственно, изобретение кроме того предлагает способы продукции полипептида микроцина S с использованием клеток изобретения.
Здесь рассмотрен способ продукции полипептида микроцина S. Такой способ включает: использование молекулы нуклеиновой кислоты, праймера или зонда нуклеиновой кислоты, плазмиды или клетки согласно изобретению, или синтез полипептида согласно изобретению способами синтеза пептидов в жидкой фазе или твердой фазе.
В одном предпочтительном варианте осуществления способ включает следующие этапы:
i) предоставление клетки, включающей молекулу нуклеиновой кислоты изобретения или плазмиду изобретения,
ii) культивирование клетки в условиях, которые позволяют экспрессировать полипептид из молекулы нуклеиновой кислоты.
В одном предпочтительном варианте осуществления способ кроме того включает этап (iii) извлечения продуцированного полипептида.
Таким образом, упомянутым способом можно получить выделенный полипептид изобретения.
В некоторых вариантах осуществления полипептиды микроцина S продуцируются встречающимися в природе клетками или, альтернативно, способами рекомбинантной ДНК. Например, молекула нуклеиновой кислоты, кодирующая полипептид микроцин S, может быть уже кодирована плазмидой или может быть введена в плазмиду, например, экспрессирующую плазмиду. С использованием плазмиды молекула нуклеиновой кислоты может быть введена в клетку рекомбинантными способами. При экспрессии в клетке последняя, предпочтительно, культивирована в условиях, позволяющих экспрессию полипептида микроцина S. Полипептид микроцин S может быть, по желанию, извлечен из клеточной суспензии. Используемый здесь термин "извлекать" означает, что полипептид микроцин S удаляют из тех компонентов клетки или клеточной среды, в которых он присутствует перед извлечением. Извлечение может включать один или несколько этапов повторной укладки или очистки. Буферы и способы для индуцирования укладки денатурированного полипептида микроцина S известны в данной области.
Полипептиды, входящие в объем настоящего изобретения, могут быть синтезированы с использованием стандартных способов синтеза в жидкой фазе или на твердой фазе, известных в данной области (смотрите, например, R. В. Merrifield (1963). "Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide". J. Am. Chem. Soc. 85 (14): 2149-2154). Таким образом, полипептид изобретения может быть продуцированным путем конденсации частичным пептидом или аминокислотой. Если частичный пептид или аминокислота имеет защитную группу, последнюю отсоединяют после продукции полипептида изобретения. Синтез на твердой фазе, т.е., смоле, начинается с аминокислот или пептидов, α-аминогруппы и функциональные группы боковых цепей которых защищены подходящим образом. Их конденсируют на смоле согласно последовательности полипептида изобретения разными способами конденсации, которые известны как таковые. В конце серии реакций пептид или защищенный пептид удаляют с смолы и удаляют защитные группы, чтобы получить целевой полипептид. Например, твердофазный синтез начинают с карбокситерминального конца пептида с использованием защищенной аминокислоты. Защитные группы ВОС или FMOC могут быть использованы для всех аминогрупп, даже если подходят другие защитные группы. Например, BOC-lys-OH может быть этерифицирована до хлорметилированных полистирольных подложек. Полистирольная подложка предпочтительно является сополимером стирола с, приблизительно, 0,5-2% дивинилбензола в качестве сшивающего агента, который делает полистирольный полимер полностью нерастворимым в определенных органических растворителях. Смотрите: Stewart et al., Solid-Phase Peptide Synthesis (1969), W.H. Freeman Co., San Francisco; и Merrifield, J. Am. Chem. Soc. (1963) 85:2149-2154. Эти и другие способы синтеза пептидов также раскрыты в патентах США №3,862,925; 3,842,067; 3,972,859 и 4,105,602.
Для синтеза полипептидов можно использовать ручные или автоматические способы, применяя, например, синтезатор пептидов 403А компании Applied Biosystems (Фостер-сити, штат Калифорния) или автоматический синтезатор пептидов SAM II компании Biosearch (Biosearch, Inc., Сан-Рафаэль, штат Калифорния), следуя инструкциям, предоставляемым изготовителем.
Способ консервирования пищевых продуктов
Изобретение также относится к способу консервирования пищевых продуктов, причем способ включает:
добавление к пищевому продукту по меньшей мере одного вида натурального антимикробного агента, где агентом является:
a) полипептид согласно изобретению,
b) клетка согласно изобретению и/или
c) композиция согласно изобретению.
Поскольку грамположительные и грамотрицательные бактерии почти всегда присутствуют вместе с пищевых продуктах, полипептиды, молекулы нуклеиновой кислоты, клетки или композиции в пределах объема настоящего изобретения показывают эффективность в отношении бактерий, например, Salmonella, Escherichia coli, Klebsiella, Pseudomonas или Listeria. Более конкретно, такие бактерии как Salmonella typhimurium, другие виды Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Bacteroides gingivalis, Listeria monocytogenes и другие.
Следует понимать, что агент добавляют в количестве, достаточном для ингибирования загрязняющих бактерий.
Предпочтительно, полипептид, молекула нуклеиновой кислоты, клетка или композиция, добавленные к пищевому продукту, создают защитный эффект. В одном варианте осуществления полипептид, клетка или композиция не влияют на потребление пищи. Например, они безвкусные и нетоксичные для людей и животных.
Следовательно, полипептиды, молекулы нуклеиновой кислоты, клетка или композиции в пределах объема настоящего изобретения конкретно подходят для контроля и предотвращения загрязнения сырья, готовой пищи и напитков бактериальными патогенами и другими загрязняющими микроорганизмами. Их можно использовать в сочетании с пищевым продуктом, который восприимчив к росту бактерий или разложению. Потенциальное использование в отношении пищевых продуктов включает обработку мяса, особенно мяса птицы, яиц, сыра, молочных продуктов, фруктов, продуктов растительного происхождения, зерна и зерновых продуктов, консервов, заправок для салатов, ферментированных напитков и морепродуктов, таких как рыба, и многих других пищевых продуктов. Примеры молочных продуктов включают, но без ограничения, сыр, молоко, сливки и ферментированные молочные продукты, такие как йогурт. Примеры мяса включают, например, ветчину, говядину, салями, курицу и индейку, включая целые части и изготовленные из них обработанные мясные продукты. Другие пищевые продукты включают обработанные продукты, включая готовое к употреблению блюда, закуски и мясо, овощные салаты, майонез, заправки (включая заправки для салатов), соусы и приправы, макаронные изделия, супы, пищевые масла, рыбу и рыбопродукты, яичные продукты, напитки, асептически упакованные продукты, а также смеси вышеупомянутого. Другое использование, связанное с пищевыми продуктами, включает обработку упаковок и соответствующего оборудования. Другое использование включает применение в качестве консерванта, например, для плавленого сыра, сливок, молока, молочных продуктов и для очистки птицы, рыбы, мяса или овощей.
Полипептиды, молекулы нуклеиновой кислоты, клетка или композиции настоящего изобретения можно использовать путем смешивания с пищевым продуктом и/или нанесения на него, но их можно наносить на поверхность твердых пищевых продуктов путем окунания, промывки или распыления или путем применения к внутренней части таких продуктов, например, путем инъекции. Они могут быть нанесены как маринад, панировка, тертая заправка, глазурь, смесь красителей и т.д. или как ингредиент для смешивания и включения в пищевой продукт. В других аспектах полипептиды, молекулы нуклеиновой кислоты, клетка или композиции могут быть помещены в непрямой контакт с поверхностью пищи путем нанесения композиции на упаковку, такую как коробка или пленка, с последующим приложением упаковки к поверхности продукта, чтобы композиция вступила в контакт с внешней поверхностью пищи. Оптимальное количество будет зависеть от конкретного пищевого продукта и способа, используемого для нанесения композиции на пищевой продукт или его поверхность, но оно может быть определено простыми экспериментами.
Преимущества заключаются в том, что полипептиды, клетка или композиции настоящего изобретения легко перевариваются, нетоксичные, не могут вызывать аллергии, и патогенным микробам трудно развить к ним устойчивость.
Способ идентификации бактерий, которые чувствительны к полипептиду микроцину S
Изобретение кроме того относится к способу in vitro для идентификации бактерий, которые чувствительны к полипептиду микроцину S. В таком способе можно использовать полипептид, молекулу нуклеиновой кислоты, праймер или зонд нуклеиновой кислоты, клетку, антитело или композицию изобретения.
В одном варианте осуществления способ включает этап введения патогенных бактерий, вызывающих микробную инфекцию в контакт с полипептидом, молекулой нуклеиновой кислоты, праймером или зондом нуклеиновой кислоты, клеткой или композицией изобретения, при этом снижение эффективности адгезии клетки к эпителиальным клеткам кишечника (энтероцитам) указывает на чувствительность клетки к микроцину S.
Следует понимать, что микроцин S может быть добавлен к патогенным бактериям в форме полипептида изобретения. Однако, также может быть добавлена молекула нуклеиновой кислоты изобретения, которая может экспрессировать микроцин S. Также можно добавить клетку изобретения, которая продуцирует микроцин S. В заключение, к патогенным бактериям может быть добавлена композиция изобретения, включающая микроцин S.
В одном предпочтительном варианте осуществления способ включает следующие этапы:
предоставление первого набора клеток;
предварительная инкубация первого набора клеток с полипептидом, молекулой нуклеиновой кислоты, клеткой, антителом или композицией изобретения; предоставление второго набора клеток;
инфицирование первого набора клеток и второго набора клеток патогенными бактериями, вызывающими микробную инфекцию;
измерение эффективности адгезии первого набора клеток и второго набора клеток;
сравнение эффективности адгезии первого набора клеток с эффективностью адгезии второго набора клеток,
причем, если эффективность адгезии первого набора клеток ниже чем эффективность адгезии второго набора клеток, то клетки первого набора чувствительны к микроцину S.
Снижение эффективности адгезии первого набора клеток по сравнению с соответствующей системой второго набора клеток, в который микроцин S не был добавлен в форме полипептида, молекулы нуклеиновой кислоты, клетки или композиции изобретения, указывает на чувствительность первого набора клеток к микроцину S.
В предпочтительных вариантах осуществления клетки первого набора и второго набора являются эпителиальными клетками кишечника человека.
В одном предпочтительном варианте осуществления способ in vitro для идентификации бактерий является модифицированным тестом диффузии на агаре. На первом этапе бактерии, вызывающие микробную инфекцию, наносят на культуральный планшет. На втором этапе диск из фильтровальной бумаги пропитывают полипептидом, молекулой нуклеиновой кислоты, праймером или зондом нуклеиновой кислоты, клеткой, антителом или композицией изобретения. Затем фильтровальную бумагу помещают на поверхность агара на культуральном планшете.
В результате этого микроцин S диффундирует с фильтровальной бумаги в агар. Устанавливают градиент концентрации, причем концентрация микроцина S наибольшая рядом с диском и снижается с увеличением расстояния от диска.
Если микроцин S эффективен против бактерий при определенной концентрации, то колонии не будут расти, когда концентрация на агаре больше или равна эффективной концентрации. Это является зоной ингибирования. Таким образом, размер зоны ингибирования является мерой эффективности соединения: чем больше чистая область вокруг диска из фильтровальной бумаги, тем более эффективно соединение.
Способ нанесения раневого покрытия
В пределах объема изобретения предложен способ нанесения покрытия на раневый материал, согласно которому покрытие осуществляют:
a) полипептидом согласно изобретению и/или
b) композицией согласно изобретению.
Поскольку новый полипептид микроцин S настоящего изобретения проявляет антимикробное действие, его можно использовать для раневого покрытия. Следует понимать, что раневые покрытия для групп пациентов, например, пациентов с ожогами первой и второй степени, предпочтительны. Такие пациенты нуждаются в защите от бактериальных инфекций. В одном предпочтительном варианте осуществления раневое покрытие является антисептическим. В более предпочтительном варианте осуществления антисептическими покрытиями являются пластыри или бинты. В вариантах осуществления материал раневого покрытия обеспечивает защиту от Pseudomonas aeruginosa - патогена, связанного с ожоговыми ранами.
Примеры
Пример 1: Штаммы бактерий и условия роста
Штаммы бактерий, использованные в настоящем документе, перечислены в таблице 3.



Пример 2: Идентификация кодирующего микроцин генного кластера в Е. coli G3/10
Геномы шести штаммов Е. coli: Е. coli G1/2, G3/10, G4/9, G5, G6/7 и G8 были секвенированы. Аннотация не вскрыла известного микроцина в геноме Е. coli G3/10. Е. coli G3/10 содержит большую конъюгативную плазмиду pSYM1 (Фиг. 1) с размером 50,6 т.п.н. Эта плазмида на 99% идентична плазмиде pMAS2027 изолята уропатогенной Е. coli. Более того, она содержит вставленный фрагмент 10 т.п.н., но анализ BLAST показал только неохарактеризованные и неназванные гены. Для идентификации источника бактерицидного действия была сделана попытка освободить штамм Е. coli G3/10 от его мегаплазмиды pSYM1. Несмотря на выполнение многих обычных процедур лечения, например, митомицином С или тепловой обработкой, штамм удалить не удалось. Поэтому плазмида pSYM1 была перенесена в Е. coli G4/9 путем конъюгации. Чтобы позволить скрининг конъюгатов, сначала в pSYM1 интегрировали кассету устойчивости к ампициллину, что дало pSYM1-ST76An. Полученная Е. coli G4/9 pSYM1-ST76An была способна значительно ингибировать адгезию ЕРЕС (Фиг. 3). Был сделан вывод, что плазмида pSYM1 несет в себе гены, которые ответственны за проявленный эффект. Фрагмент 4,7 т.п.н. плазмиды pSYM1 был клонирован в pBR322, что дало плазмиду pAZ6, которая затем была трансформирована в Е. coli G4/9. Плазмида pAZ6 позволяет Е. coli G4/9 значительно ингибировать эффективность адгезии ЕРЕС (Фиг. 3), указывая, что фрагмент 4,7 т.п.н. pSYM1 отвечает за эффект ингибирования адгезии ЕРЕС Е. coli G3/10 (Фиг. 2). Анализ BLAST автоматически аннотированных открытых рамок считывания показал небольшие гомологии с охарактеризованными белками или семействами белков, указывая на взаимоотношение с оперонами, кодирующими микроцины. Тем не менее сам микроцин остался невыявленным. Три гена mcsl, mcsA и mcsB были клонированы в pBR322, что дало pAZ8. Небольшие открытые рамки считывания перед этим опероном (Фиг. 2), которые возможно являются генами, кодирующими микроцин, были клонированы в pACYC184 и субклонированы в Е. coli G4/9 pAZ8. Этим этапом было облегчено раздельное кодирование плазмидой вероятных белков микроцина и микроцинахелпера. Только Е. coli G4/9, содержащий плазмиды pAZ8 и pAZ9 значительно ингибировал адгезию ЕРЕС, тогда как G4/9 pAZ8 влияет на адгезию ЕРЕС подобно G4/9 дикого типа (Фиг. 3). Небольшой ген mcsS кодирует микроцин, который был назван микроцином S.
Пример 3: Определение функциональных характеристик микроцина S и объяснение его ау то иммунитета
Адгезия бактерий является очень важным первым этапом многих инфекционных заболеваний. Поэтому испытательная система, количественно определяющая ингибирование адгезии к эпителиальным клеткам кишечника человека, подходит для демонстрации положительного эффекта для организма-хозяина. В первом эксперименте сливающиеся монослои клеток САСО-2 или LOVO предварительно инкубировали с испытываемыми штаммами бактерий EcN, Е. coli G3/10, Е. coli G4/9 или Е. coli G4/9 pAZ6 при множественности заражения (MOI) 100:1 Е. coli к клеткам-хозяевам. После двух часов инкубации клетки промыли и инфицировали бактериями ЕРЕС Е2348/69, используя MOI 100:1 ЕРЕС к клеткам-хозяевам. Е. coli G3/10 и Е. coli G4/9 pAZ6 были способны ингибировать адгезию ЕРЕС подобно EcN. Ингибирование адгезии EcN, как было показано, зависит от активности штаммов микроцинов. Эффективность адгезии в %, выразили как адгезию ЕРЕС относительно адгезии без предварительной инкубации (отрицательный контроль), которую установили как 100%. Данные являются средними ± СО из по меньшей мере трех раздельных экспериментов в дублирующих лунках. На Фиг. 4 показана эффективность адгезии ЕРЕС Е2348/69 дикого типа и комплементированных плазмидой мутантов, транспортирующих mcsI к эпителиальным клеткам кишечника человека после предварительной инкубации с разными экспрессирующими (Е. coli G3/10, G4/9 pAZ6 и EcN) и не экспрессирующими (Е. coli G4/9) микроцин штаммами. В результате, mcsI мог быть бесспорно идентифицирован как аутоиммунный ген микроцина S.
Пример 4; Влияние на энтерогеморрагические Е. coli
Энтерогеморрагические Е. coli сцепляются с эпителиальными клетками кишечника. Во втором эксперименте сливающиеся монослои клеток LOVO предварительно инкубировали с бактериальными испытываемыми штаммами при множественности заражения (MOI) 100:1 Е. coli к клеткам-хозяевам. Проверяли влияние EcN и Е. coli G3/10. После двух часов инкубации клетки промыли и инфицировали ЕНЕС при MOI 100:1 ЕНЕС к клеткам-хозяевам. Три изолята ЕНЕС проверили как индикаторные штаммы, используя анализ адгезии in vitro. Мы использовали связанный с HUS серотип ЕНЕС 86-24 О157:Н7 и два разных изолята штамма ЕНЕС О104:Н4, а также изолят ЕНЕС О128:Н2 от пациента. Поскольку изоляты ЕНЕС О104:Н4 являются продуцентами ESBL, медицинское лечение ограничено. Эффективность адгезии в % выражена как адгезия ЕНЕС относительно адгезии без предварительной инкубации (отрицательный контроль), которая была установлена как 100%. Эти данные являются средними ± СО из трех раздельных экспериментов в дублирующих лунках. Адгезию ЕНЕС ингибировали только бактерии Е. coli G3/10, что указывает на другой механизм действия МссМ/Н47 от EcN и MccS от Е. coli G3/10. На Фиг. 5 показана эффективность адгезии штаммов ЕНЕС серотипа 86-24 О157:Н7 (А), ЕНЕС О104:Н4, выделенных в Дрездене (В) и ЕНЕС О104:Н4 (С) и О128:Н2 (D), выделенных во Франкфурте (на Одере), к эпителиальным клеткам кишечника человека после предварительной инкубации с EcN или Е. coli G3/10.
Пример 5: Скрининг на ген MccS микроцина S в разных бактериях Е. coli и других энтеробактериях
Последовательность микроцина S неизвестна в базах данных нуклеотидов и аминокислот. Скрининг на генный кластер MccS был выполнен в штаммах Е. coli (38), Shigella (2) и Salmonella (2) с использованием мультиплексной ПЦР и гена recA в качестве контроля ингибирования. Испытываемыми штаммами были обычные лабораторные штаммы, человеческие клинические изоляты и ветеринарные изоляты разного происхождения. Ген McsS не смоги обнаружить в любом из 42 проверенных человеческих и ветеринарных изолятов, а также лабораторных штаммов. Результаты показаны на Фиг. 6.
| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИАЛЬНЫЕ ФАКТОРЫ ВИРУЛЕНТНОСТИ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2465331C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2415150C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2512525C2 |
| ВЕКТОРЫ ДЛЯ МНОЖЕСТВЕННОЙ ГЕННОЙ ЭКСПРЕССИИ | 2008 |
|
RU2462513C2 |
| РЕКОМБИНАНТНАЯ ЭКСПРЕССИЯ ДЕФЕНСИНОВ В МИЦЕЛИАЛЬНЫХ ГРИБАХ | 2006 |
|
RU2404990C2 |
| ФУКОЗИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННЫХ ОЛИГОСАХАРИДОВ | 2018 |
|
RU2818835C2 |
| ПРОТИВОМИКРОБНЫЕ ПОЛИПЕПТИДЫ ИЗ PSEUDOPLECTANIA NIGRELLA | 2002 |
|
RU2336278C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2636455C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2583289C2 |
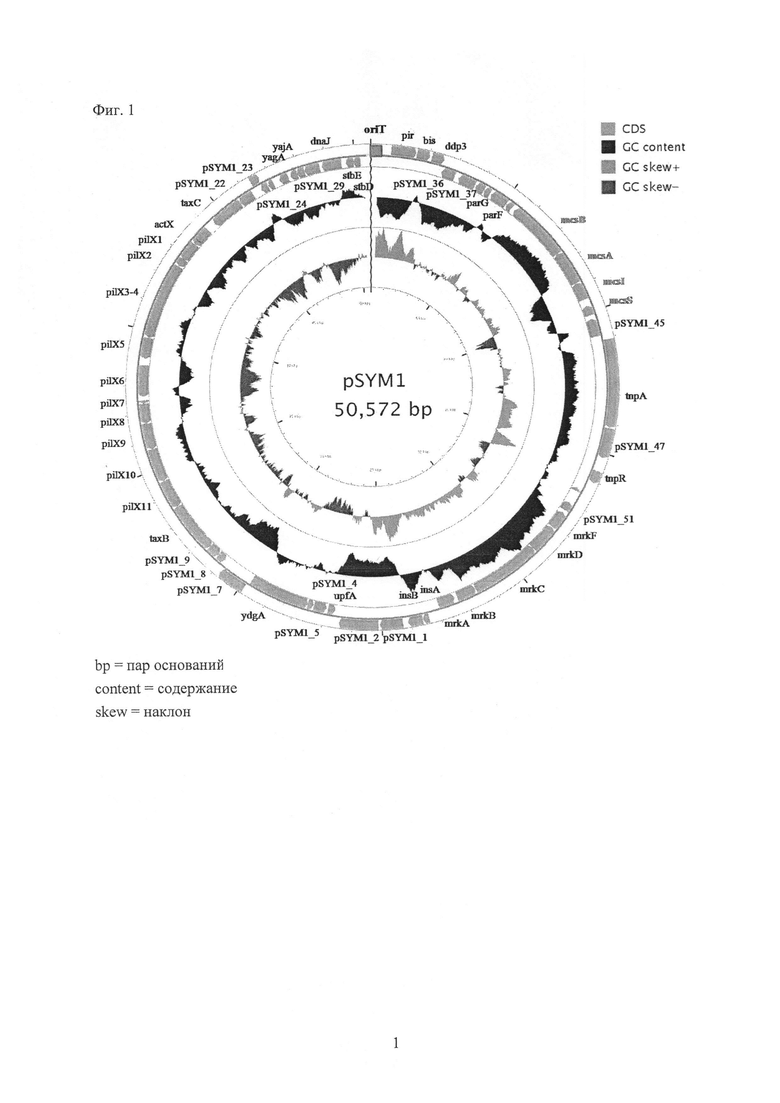
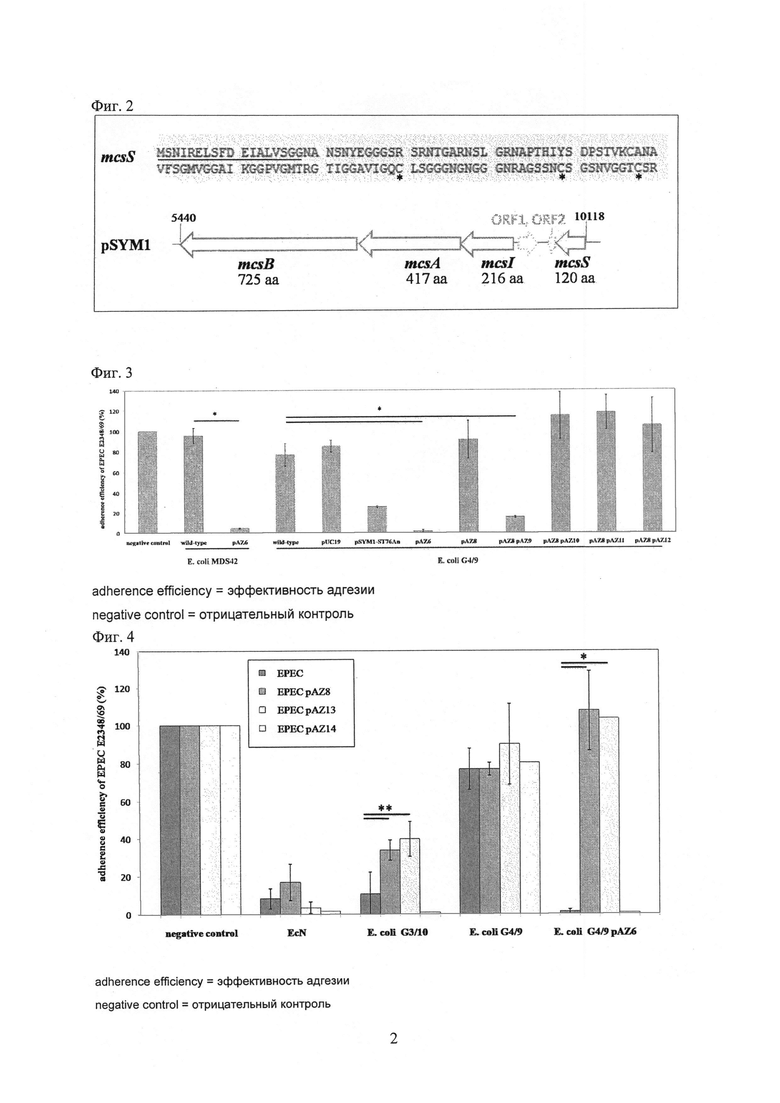
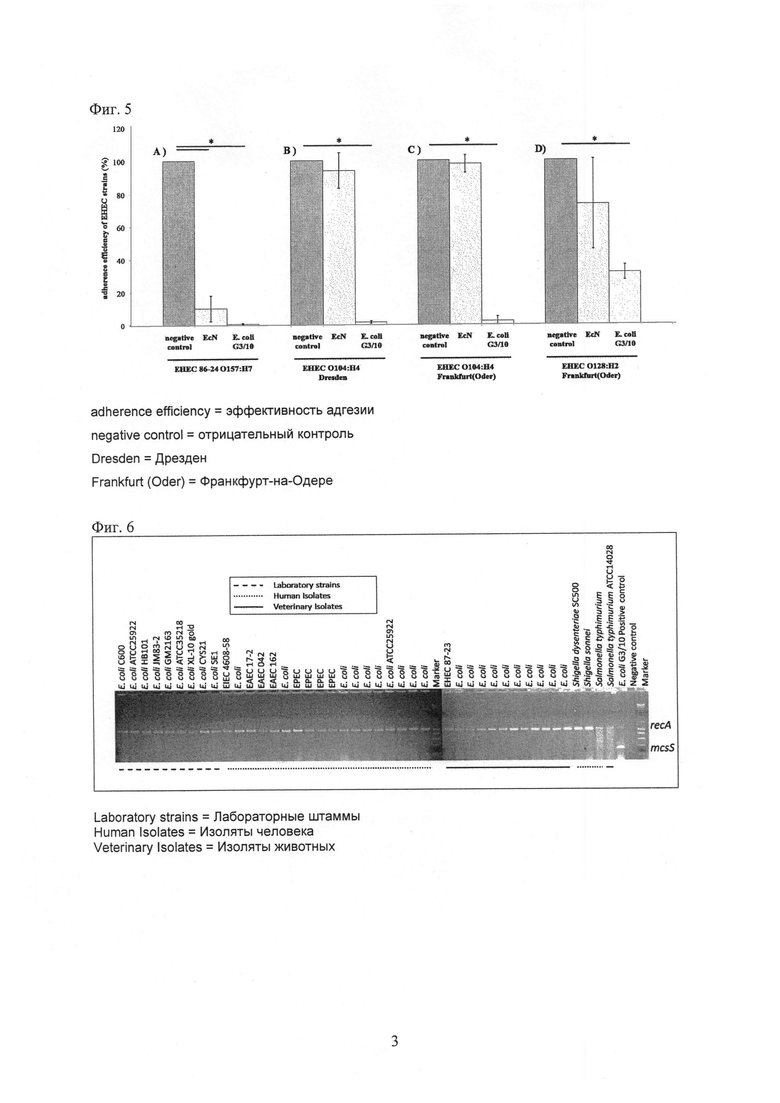
Настоящее изобретение относится к биохимии, генной инженерии и биотехнологии, в частности к новым полипептидам с антимикробной активностью в отношении энтерогеморрагических бактерий вида Escherichia coli. Указанные полипептиды предназначены для медицинского использования, дезинфекции поверхностей, консервирования пищевых продуктов и для покрытия перевязочного материала. Изобретение также относится к способу получения указанных полипептидов и к композициям, содержащим указанные полипептиды. Настоящее изобретение позволяет получать новые полипептиды с антимикробной активностью в отношении энтерогеморрагических бактерий. 10 н. и 18 з.п. ф-лы, 6 ил., 3 табл., 5 пр.
1. Выделенный полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli, предназначенный для медицинского использования, для дезинфекции поверхностей, для консервирования пищевых продуктов и для покрытия перевязочного материала, отличающийся тем, что полипептид включает аминокислотную последовательность, которая по меньшей мере на 80% или больше идентична аминокислотной последовательности SEQ ID NO: 6.
2. Выделенный полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli, предназначенный для медицинского использования, для дезинфекции поверхностей, для консервирования пищевых продуктов и для покрытия перевязочного материала, отличающийся тем, что полипептид кодирован молекулой нуклеиновой кислоты, которая по меньшей мере на 80% или больше идентична нуклеотидной последовательности SEQ ID NO: 3 или комплементарной ей нуклеотидной последовательности, и нуклеотидной последовательности SEQ ID NO: 2 или комплементарной ей нуклеотидной последовательности, причем нуклеотидная последовательность SEQ ID NO: 3 кодирует полипептид с активностью собственной устойчивости к микроцину S, а нуклеотидная последовательность SEQ ID NO: 2 кодирует полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli.
3. Выделенный полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli, предназначенный для медицинского использования, для дезинфекции поверхностей, для консервирования пищевых продуктов и для покрытия перевязочного материала, отличающийся тем, что полипептид кодирован молекулой нуклеиновой кислоты, которая по меньшей мере на 80% или больше идентична нуклеотидной последовательности SEQ ID NO: 4 или комплементарной ей нуклеотидной последовательности, и нуклеотидной последовательности SEQ ID NO: 2 или комплементарной ей нуклеотидной последовательности, причем нуклеотидная последовательность SEQ ID NO: 4 кодирует полипептид с транспортной активностью для микроцина S, а нуклеотидная последовательность SEQ ID NO: 2 кодирует полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli.
4. Выделенный полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli, предназначенный для медицинского использования, для дезинфекции поверхностей, для консервирования пищевых продуктов и для покрытия перевязочного материала, отличающийся тем, что полипептид кодирован молекулой нуклеиновой кислоты, которая по меньшей мере на 80% или больше идентична нуклеотидной последовательности SEQ ID NO: 5 или комплементарной ей нуклеотидной последовательности, и нуклеотидной последовательности SEQ ID NO: 2 или комплементарной ей нуклеотидной последовательности, причем нуклеотидная последовательность SEQ ID NO: 5 кодирует полипептид с транспортной активностью для микроцина S, а нуклеотидная последовательность SEQ ID NO: 2 кодирует полипептид с антимикробной активностью в отношении энтерогеморрагических Escherichia coli.
5. Полипептид по любому из пп. 1-4 для использования в терапии или профилактике.
6. Полипептид по любому из пп. 1-4 для использования при лечении или профилактике микробных инфекций.
7. Полипептид по п. 6, причем микробная инфекция включает инфекции энтерогеморрагическими бактериями Е. coli (ЕНЕС).
8. Полипептид по п. 6 для использования при лечении или профилактике микробных инфекций, связанных с гемолитико-уремическим синдромом (HUS).
9. Полипептид по любому из пп. 1-8 для использования при лечении или профилактике нарушений желудочно-кишечного тракта или функциональных нарушений желудочно-кишечного тракта.
10. Полипептид по любому из пп. 1-8 для использования при лечении опухоли.
11. Клетка-хозяин для экспрессии полипептида по любому из пп. 1-10, включающая молекулу нуклеиновой кислоты, кодирующую полипептид по любому из пп. 1-10.
12. Клетка по п. 11 для использования в терапии или профилактике.
13. Клетка по п. 11 для использования при лечении или профилактике микробных инфекций.
14. Клетка по п. 11 для использования при лечении или профилактике нарушений желудочно-кишечного тракта или функциональных нарушений желудочно-кишечного тракта.
15. Клетка по п. 11 для использования при лечении опухоли.
16. Антимикробная композиция с антимикробной активностью в отношении энтерогеморрагических Escherichia coli, предназначенная для медицинского использования, для дезинфекции поверхностей, для консервирования пищевых продуктов и для покрытия перевязочного материала, включающая:
a) полипептид по любому из пп. 1-10 в фармацевтически эффективном количестве; и/или
b) клетку по любому из пп. 11-15 в фармацевтически эффективном количестве.
17. Композиция по п. 16, отличающаяся тем, что композиция является фармацевтической композицией, кроме того, включающей фармацевтически приемлемый носитель.
18. Композиция по п. 16, отличающаяся тем, что композиция содержит терапевтически эффективное количество полипептида или клетки и один или несколько адъювантов, наполнителей, носителей и/или разбавителей.
19. Композиция по п. 16 для использования в терапии или профилактике.
20. Композиция по п. 16 для использования при лечении или профилактике микробных инфекций.
21. Композиция по п. 16, отличающаяся тем, что композиция является дезинфицирующим средством для поверхностей.
22. Композиция по п. 16 для использования при лечении или профилактике нарушений желудочно-кишечного тракта или функциональных нарушений желудочно-кишечного тракта.
23. Композиция по п. 16 для использования при лечении опухоли.
24. Способ продукции полипептида по любому из пп. 1-10, причем способ включает:
i) предоставление клетки по любому из пп. 11-15;
ii) культивирование клетки в условиях, которые позволяют экспрессировать полипептид по любому из пп. 1-10.
25. Способ по п. 24, кроме того, включающий этап (iii) извлечения продуцированного полипептида.
26. Способ in vitro для идентификации бактерий, которые чувствительны к микроцину S, причем способ включает контакт полипептида по любому из пп. 1-10, или клетки по любому из пп. 11-15, или композиции по любому из пп. 16-23 с патогенной бактерией, вызывающей микробную инфекцию, отличающийся тем, что снижение эффективности адгезии патогенной бактерии, вызывающей микробную инфекцию, к эпителиальным клеткам кишечника указывает на чувствительность указанной патогенной бактерии к микроцину S.
27. Способ консервирования пищевых продуктов, причем способ включает:
добавление к пищевому продукту по меньшей мере одного натурального агента с антимикробной активностью в отношении энтерогеморрагических Escherichia coli,
отличающийся тем, что агентом является
a) полипептид по любому из пп. 1-10,
b) клетка по любому из пп. 11-15 и/или
c) композиция по любому из пп. 16-23.
28. Способ покрытия перевязочного материала, отличающийся тем, что перевязочный материал покрывают:
a) полипептидом по любому из пп. 1-10 и/или
b) композицией по любому из пп. 16-23.
| ПЛАЗМИДА P74, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ МИКРОЦИНА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI, ОБЛАДАЮЩИЙ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1633817A3 |
| ПРОБИОТИК ЛАКТОМИКРОЦИКОЛ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ВЫРАЩИВАНИЯ И ОТКОРМА БРОЙЛЕРНОЙ ПТИЦЫ | 2004 |
|
RU2268925C2 |
| VAN DE VIJVER P | |||
| et al | |||
| Synthetic microcin C analogs targeting different aminoacyl-tRNA synthetases | |||
| J | |||
| Bacteriol., 2009 | |||
| НОВИКОВА М.В | |||
| Биосинтез микроцина С и механизмы устойчивости клеток к антибиотику | |||
| Автореферат диссертации, Москва, 2009. | |||
Авторы
Даты
2018-04-19—Публикация
2012-08-13—Подача