Настоящее изобретение относится к новым фукозилтрансферазам и их применению для получения фукозилированных олигосахаридов.
Предшествующий уровень техники
К настоящему времени идентифицировано приблизительно 200 различающихся по структуре олигосахаридов грудного молока (НМО). Основой указанных НМО является дисахарид лактоза, и они несут дополнительные остатки моносахаридов, в основном N-ацетил-глюкозамина, фукозы, сиаловой кислоты и галактозы. Концентрация и состав НМО в грудном молоке варьирует среди индивидов и в течение периода лактации от 20 г/л в молозиве до 5-10 г/л в зрелом молоке.
Молоко женщин, относящихся к так называемому "секреторному фенотипу", имеет высокое содержание α-1,2-фукозилированных НМО. У этих женщин экспрессируется ген FUT2, кодирующий так называемую "фукозилтрансферазу 2". Самыми распространенными НМО у них в молоке являются 2'-фукозиллактоза (2'-FL; Fuc(α1-2)Gal(β1-4)Glc) и лакто-N-фукопентаоза-I (LNFP-I; Fuc(α1-2)Gal(β1-3)GlcNAc(β1 -3)Gal(β1-4)Glc).
Олигосахариды грудного молока не перевариваются при прохождении через кишечник младенцев. Благодаря своему постоянному присутствию в кишечнике младенца они оказывают благотворное влияние на детей. Более конкретно, показано, что НМО являются пребиотиками, поскольку они служат источником углерода для симбиотических микроорганизмов рода Bifidobacterium, Bacteroides и Lactobacillus. Таким образом, НМО поддерживают размножение этих микроорганизмов в кишечнике младенцев.
Олигосахариды грудного молока также непосредственно ослабляют колонизацию кишечника младенца патогенами, поскольку они предотвращают адгезию указанных патогенов к гликановым структурам на поверхности слизистой оболочки кишечника. НМО действуют как ловушка ввиду их структурного сходства с гликанами поверхности эпителиальной ткани и ингибируют инвазию патогенов, снижая тем самым риск инфицирования.
Показано, что альфа-1,2-фукозилированные НМО защищают от инфекций, вызываемых Campylobacter jejuni, возбудителем большинства распространенных случаев бактериальной диареи. α-1,2-Фукозилированные НМО также связаны с защитой от диареи, вызываемой термостабильным токсином Escherichia coli. Кроме того, риск инфицирования диарея-опосредующими калицивирусами снижается благодаря высокому содержанию α-1,2-фукозилированных НМО в грудном молоке. НМО, в особенности фукозилированный НМО лакто-N-фукопентаоза V (LNFP-V; Gal(β1-3)GlcNAc(β1-3)Gal(β1-4)[Fuc(α1-3)]Glc), связывается(ются) с углевод-связывающим сайтом токсина А из Clostridium difficile, являющегося наиболее типичной причиной нозокомиальной диареи. Таким образом, НМО, по-видимому, предотвращают взаимодействие токсина А из С.difficile с клеточными рецепторами. Кроме того, адгезия Pseudomonas aeruginosa к клеткам эпителиальной ткани значительно ингибировалась 2'-FL и 3-фукозиллактозой (3-FL; Gal(β1-4)[Fuc(α1-3)]Glc). Связывание норовирусов (Норфолк-подобных вирусов, NLV), являющихся основной причиной острого гастроэнтерита, с антигенами гистогрупп крови предотвращается под действием α-1,2-фукозилированных НМО, а также α-1,3-фукозилированных НМО. Это указывает на способность этих НМО ингибировать связывание капсида норовируса с гликанами рецепторов хозяина.
Ввиду известных полезных свойств НМО и в особенности фукозилированных НМО желательным является разработка экономически целесообразного способа их синтеза. Описаны биотехнологические способы получения НМО с использованием бактерий, метаболизм которых был модифицирован. Описаны различные фукозилтрансферазы для получения фукозилированных олигосахаридов с использованием генетически модифицированных бактерий.
В случае получения 2'-фукозиллактозы (2'-FL) описаны α-1,2-фукозилтрансферазы WbgL из Е. coli O126 и FucT2 из Helicobacter pylori (ЕР 2 479 263 В1), α-1,2-фукозилтрансферазы WbIA из Vibrio cholerae O22, FutD из Н. bilis АТСС (Американская коллекция типовых культур) 437879, FutE из Н, cinaede CCUG (Коллекция культур университета Гетенбурга) 18818, FutN из Bacteroides vulgatus АТСС 8482, FutO из Bacteroides ovatus АТСС 8483, WbgN из Е. coli O55:Н7, Bft1 и Bft3 из Bacteroides fragilis NCTC (Национальная коллекция типовых культур) 9343 (WO 2014/018596 А2) и α-1,2-фукозилтрансферазы FucT2 из Н. pylori для синтеза сахаридов антигенов системы Льюиса Y и Льюиса В (US 6670160 В2).
В случае получения 3-фукозиллактозы описаны α-1,3-фукозилтрансфераза Amuc из Akkermansia muciniphila и FucT6 и FucT7 из Bacteroides fragilis (ЕР 2 439 264 А1), α-1,3-фукозилтрансфераза FutA из Н. pylori (US 2014/0120611 А1). Помимо этого в WO 2016/040531 А1 описывается α-1,3-фукозилтрансфераза CafC из В. nordii CL02T12C05 для синтеза 3-фукозиллактозы и лактодифукотетраозы и CafD из Н. hepaticus АТСС 51449 для получения LNnFP-III (лакто-N-неофукопентаоза-III).
Однако в данной области техники известно, что гликозилтрансферазы, в том числе фукозилтрансферазы, могут сильно различаться с точки зрения кинетики, субстратной специфичности, аффинности к донорным субстратам и акцепторным молекулам, стабильности и растворимости. Кроме того, выбор фукозилтрансферазы для опосредования желаемой реакции фукозилирования существенно влияет на конечный выход желаемого фукозилированного олигосахарида. Например, из WO 2014/018596 А1 понятно, что бактерия Е. coli, продуцирующая WbgL, синтезировала 2'-FL и также была способна синтезировать лактодифукотетраозу (LDFT), в то время как Е. coli, продуцирующая WbsJ из Е. coli или WbIA из V. cholerae, была способна стимулировать синтез 2'-FL, но не синтезировала LDFT.
Помимо этого получение более сложных фукозилированных олигосахаридов, таких как фукозилированные тетрасахариды, фукозилированные пентасахариды, фукозилированные гексасахариды или даже фукозилированные гептасахариды, известно только в мелком масштабе.
Ввиду этих недостатков существует потребность в дополнительных фукозилтрансферазах, характеризующихся более быстрой кинетикой, более высокой аффинностью к нуклеотидным донорам Сахаров и/или разнообразными специфичностями к акцепторным молекулам. Имеется особая потребность в фукозилтрансферазах, которые можно использовать в промышленном производстве сложных фукозилированных олигосахаридов грудного молока, т.е. в фукозилтрансферазах, которые способны к фукозилированию три-, тетра-, пента- или даже гексасахаридов и/или обладают активностью, достаточной для получения коммерчески целесообразных количеств желаемого фукозилированного олигосахарида.
В попытке разрешить эту проблему авторы изобретения провели поиск в базах данных для белков и базам данных для нуклеотидных последовательностей на предмет данных, относящихся к еще неизвестным фукозилтрансферазам. Предполагаемые фукозилтрансферазы, полученные благодаря совпадениям, которые были обнаружены в результате поисков в базах данных, анализировали на предмет фукозилтрансферазной активности у соответствующих полипептидов. На основе этого подхода были идентифицированы пока неизвестные фукозилтрансферазы, которые в качестве акцепторной молекулы для фукозилирования используют лактотетраозу.
Краткое описание сущности изобретения
Предложены новые фукозилтрансферазы, происходящие из бактериальных клеток. Для проявления своей фукозилтрансферазной активности указанные фукозилтрансферазы в качестве акцепторной молекулы используют лактотетраозу. Указанные новые фукозилтрансферазы можно использовать для синтеза фукозилированных олигосахаридов, основу которых составляют LNT (лакто-N-тетраоза) и/или LNnT (лакто-N-неотетраоза).
Согласно первому аспекту предложен способ получения фукозилированных олигосахаридов, при этом для получения указанного фукозилированного олигосахарида используют генетически модифицированную клетку. Указанная генетически модифицированная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, которая способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза.
Согласно второму аспекту предложена генетически модифицированная клетка для применения в способе получения фукозилированных олигосахаридов. Указанная генетически модифицированная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, которая способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза.
Согласно третьему аспекту предложена молекула рекомбинантной нуклеиновой кислоты для экспрессии гетерологичной фукозилтрансферазы при накоплении в клетке, при этом указанная фукозилтрансфераза способна катализировать переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза.
Согласно четвертому аспекту предложены фукозилтрансферазы, способные переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза.
Согласно пятому аспекту предложено применение фукозилтрансферазы, способной переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза, для получения фукозилированных олигосахаридов.
Согласно шестому аспекту предложен способ получения фукозилированных олигосахаридов с использованием биокатализа in vitro, в котором используют фукозилтрансферазу, при этом указанная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу.
Согласно седьмому аспекту предложены фукозилированные олигосахариды, получаемые способом по первому аспекту или способом по шестому аспекту.
Согласно восьмому аспекту предложено применение фукозилированных олигосахаридов по седьмому аспекту для приготовления пищевой композиции.
Согласно девятому аспекту предложена пищевая композиция, содержащая по меньшей мере один фукозилированный олигосахарид по седьмому аспекту.
Краткое описание графических материалов
На Фиг. 1 показано схематичное представление плазмидной карты экспрессирующего вектора pINT-malE-fucT-zeo, который использовали для гетерологичной экспрессии нуклеотидных последовательностей, кодирующих предполагаемые фукозилтрансферазы, в Е. coli .
На Фиг. 2 показаны хроматограммы анализов посредством жидкостной хроматографии/масс-спектрометрии (LC/MS) для фукозилированных продуктов 1 типа (с коровой структурой: Gal(β1,3)GlcNAc) и 2 типа (с коровой структурой: Gal(β1,4)GlcNAc).
На Фиг. 2а показаны хроматограммы для фукозилированных производных LNT и LNnT.
На Фиг. 2b показаны хроматограммы для смеси LNFP-III и LNnFP-V, которые синтезировали в реакциях in vitro с использованием экстрактов клеток, содержащих гетерологично экспрессированную фукозилтрансферазу из В. fragilis, т.е. FucT109 (верхняя панель), по сравнению с хроматограммами для стандартов сахаров.
На Фиг. 3 показано схематичное представление метаболических путей для получения фукозилированных олигосахаридов, основу которых составляют лакто-N-тетраоза и лакто-N-неотетраоза, в Е. coli.
На Фиг. 4 показаны результаты анализов культуральных супернатантов штаммов Е. coli, продуцирующих лакто-N-фукопентаозу, содержащих pINT-malE-fucT109-zeo, с использованием тонкослойной хроматографии (TLC).
На Фиг. 5 показана гистограмма, которая демонстрирует получение внеклеточной LNFP-I с применением Е. coli (штамма №993) после интегрирования в хромосому разных генов fucT.
На Фиг. 6 показана гистограмма, которая демонстрирует получение LNFP-I с применением Е. coli (штамма №1772), используя глюкозы в качестве источника углерода в процессе ферментации в объеме 1 л.
На Фиг. 7 показан график, иллюстрирующий расщепление LNT-2 (лакто-N-триоза-2) и лактозы под действием гидролаз, экспрессируемых в штамме Е. coli №1886.
На Фиг. 8 показан результат тонкослойной хроматографии, иллюстрирующий время-зависимое расщепление LNT под действием (β-1,3-галактозидазы Bga42A.
Подробное описание
Согласно первому аспекту предложен способ получения фукозилированных олигосахаридов, включающий стадии:
a) предоставления по меньшей мере одной генетически модифицированной клетки, которая генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, при этом указанная гетерологичная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, причем указанной акцепторной молекулой является лактотетраоза;
b) культивирования по меньшей мере одной генетически модифицированной клетки в присутствии по меньшей мере одного источника углерода и в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата на акцепторную молекулу; и
c) факультативного выделения фукозилированного олигосахарида.
В способе по первому аспекту предложена генетически модифицированная клетка. Термин "генетически модифицированная", использованный в данном описании, относится к модификации генетической основы клетки с использованием методов молекулярной биологии. Модификация генетической основы клетки может включать перенос генов в пределах видовых границ и/или через видовые границы, вставку, делетирование, замену и/или модификацию нуклеотидов, триплетов, генов, открытых рамок считывания, промоторов, энхансеров, терминаторов и других нуклеотидных последовательностей, опосредующих и/или регулирующих генную экспрессию. Модификация генетической основы клетки направлена на создание генетически модифицированного организма, обладающего особыми желаемыми свойствами. Генетически модифицированные клетки могут содержать один или более генов, которых нет в нативной (не модифицированной генетически) форме клетки. Методы введения молекул экзогенной нуклеиновой кислоты и/или вставки молекул экзогенной нуклеиновой кислоты (рекомбинантной, гетерологичной) в структуру, несущую наследственную информацию клетки, с целью вставки, делетирования или изменения нуклеотидной последовательности структуры, несущей генетическую информацию клетки, известны специалисту в данной области техники. Генетически модифицированные клетки могут содержать один или более генов, которые имеются в нативной форме клетки, причем указанные гены модифицируют и повторно вводят в клетку искусственным способом. Термин "генетически модифицированный" также охватывает клетки, которые содержат молекулу нуклеиновой кислоты, являющуюся эндогенной для данной клетки, и которая модифицирована без извлечения молекулы нуклеиновой кислоты из этой клетки. Такие модификации включают модификации, осуществляемые с использованием замещения генов, сайт-специфических мутаций и связанных с ними методов.
Генетически модифицированная клетка представляет собой прокариотическую клетку или эукариотическую клетку. Соответствующие клетки включают клетки дрожжей, бактерий, архебактерий, клетки грибов, клетки насекомых, клетки растений и клетки животных, включая клетки млекопитающих (как например, клетки и клеточные линии человека).
В дополнительном и/или альтернативном воплощении прокариотическая клетка представляет собой бактериальную клетку, предпочтительно выбранную из рода, выбранного из группы, состоящей из Bacillus, Lactobacillus, Lactococcus, Enterococcus, Bifidobacterium, sporolactobacillus spp., Micromonospora spp., Micrococcus spp., Rhodococcus spp.и Pseudomonas. Подходящими бактериальными видами являются Bacillus subtilis, Bacillus licheniformis, Bacillus coagulans, Bacillus thermophilus, Bacillus laterosporus, Bacillus megaterium, Bacillus mycoides, Bacillus pumilus, Bacillus lentus, Bacillus cereus, Bacillus circulans, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium bifidum, Citrobacter freundii, Clostridium cellulolyticum, Clostridium ljungdahlii, Clostridium autoethanogenum, Clostridium acetobutylicum, Corynebacterium glutamicum, Enterococcus faecium, Enterococcus thermophiles, Escherichia coli, Erwinia herbicola (Pantoea agglomerans), Lactobacillus acidophilus, Lactobacillus salivarius, Lactobacillus plantarum, Lactobacillus helveticus, Lactobacillus delbrueckii, Lactobacillus rhamnosus, Lactobacillus bulgaricus, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus casei, Lactobacillus reuteri, Lactobacillus jensenii, Lactococcus lactis, Pantoea citrea, Pectobacterium carotovorum, Proprionibacterium freudenreichii, Pseudomonas fluorescens, Pseudomonas aeruginosa, Streptococcus thermophiles и Xanthomonas campestris.
В дополнительном и/или альтернативном воплощении эукариотическая клетка представляет собой клетку дрожжей, клетку насекомых, клетку растений или клетку млекопитающих. Дрожжевая клетка предпочтительно выбрана из группы, состоящей из Saccharomyces sp., в частности, Saccharomyces cerevisiae, Saccharomycopsis sp., Pichia sp., в частности, Pichia pastoris, Hansenula sp., Kluyveromyces sp., Yarrowia sp., Rhodotorula sp, и Schizosaccharomyces sp.
Генетически модифицированная клетка модифицирована методами генетической инженерии с возможностью экспрессировать гетерологичную фукозилтрансферазу. Термин "гетерологичный", использованный в данном описании, относится к нуклеотидной последовательности, молекуле нуклеиновой кислоты или полипептиду, которая(ый) является чужеродной(ым) для клетки или организма, т.е. к нуклеотидной последовательности, молекуле нуклеиновой кислоты или полипептиду, которая(ый) не встречается в природе в указанной клетке или указанном организме. "Гетерологичная последовательность", или "гетерологичная нуклеиновая кислота", или "гетерологичный полипептид", как использовано в данном описании, означает все только что перечисленное, которое происходит из источника, чужеродного для данной конкретной клетки хозяина (например, другого вида) или, если происходит из того же источника, то является модифицированной(ым) по сравнению со своей исходной формой. Таким образом, гетерологичная нуклеиновая кислота, функционально связанная с промотором, происходит из источника, отличающегося от того, из которого происходит промотор, или, в случае происхождения из того же источника, является модифицированной по сравнению с ее первоначальной формой. Гетерологичная последовательность может быть стабильно введена в геном клетки микроорганизма-хозяина посредством, например, трансфекции, трансформации, конъюгирования или трансдукции, в результате чего клетка хозяина становится генетически модифицированной. Могут быть применены методы, которые будут зависеть от клетки хозяина и подлежащей введению последовательности. Специалисту в данной области известны различные методы, и они описаны, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989). Соответственно, "гетерологичный полипептид" представляет собой полипептид, который не встречается в природе в данной клетке, и "гетерологичная фукозилтрансфераза" представляет собой фукозилтрансферазу, которая не встречается в природе в данной клетке.
Термин "фукозилтрансфераза", использованный в данном описании, относится к полипептидам, которые способны катализировать перенос остатка фукозы с донорного субстрата на акцепторную молекулу. Донорным субстратом для переноса остатка фукозы на акцепторную молекулу обычно является гуанозин-дифосфат-L-фукоза (ГДФ-L-фукоза). Подходящие акцепторные молекулы для остатков фукозы включают олигосахариды, гликопептиды, гликопротеины и гликолипиды. Обычно, остаток фукозы переносится, например, на остаток N-ацетилглюкозамина, остаток N-ацетилгалактозамина, остаток галактозы, остаток фукозы, остаток сиаловой кислоты или остаток глюкозы олигосахаридной или сахаридной группировки гликопротеина или гликолипида. Также понятно, что термин "фукозилтрансфераза", использованный в данном описании, охватывает функциональные варианты указанной новой фукозилтрансферазы, функциональные фрагменты указанных фукозилтрансфераз и функциональные фрагменты указанных функциональных вариантов. Термин "функциональный" указывает на то, что указанные варианты и фрагменты также способны катализировать перенос остатка фукозы с донорного субстрата на акцепторную молекулу, т.е. они могут обладать фукозилтрансферазной активностью.
Термин "функциональный фрагмент", использованный в данном описании, относится к укороченному полипептиду по сравнению с природной фукозилтрансферазой, и при этом данный фрагмент способен обладать той же фукозилтрансферазной активностью, что и природный полипептид, из которого происходит указанный фрагмент.
Термин "функциональный вариант", использованный в данном описании, относится к полипептиду, который способен обладать той же фукозилтрансферазной активностью, что и природный полипептид, из которого происходит указанное производное, но который имеет измененную аминокислотную последовательность по сравнению с природным полипептидом.
Гетерологичная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу. Термин "способна к чему-либо" применительно к гетерологичной фукозилтрансферазе относится к фукозилтрансферазной активности гетерологичной фукозилтрансферазы и к тому, что для проявления ферментативной активности гетерологичной фукозилтрансферазы необходимы подходящие реакционные условия. В отсутствие подходящих реакционных условий гетерологичная фукозилтрансфераза не проявляет своей ферментативной активности, но сохраняет свою ферментативную активность и проявляет свою ферментативную активность при восстановлении подходящих реакционных условий. Подходящие реакционные условия включают наличие подходящего донорного субстрата, наличие подходящих акцепторных молекул, наличие важных кофакторов, таких как, например, одновалентные или двухвалентные ионы, значение рН в соответствующем диапазоне, подходящую температуру и тому подобное. Нет необходимости в удовлетворении всем без исключения оптимальным значениям факторов, влияющих на ферментативную реакцию, катализируемую гетерологичной фукозилтрансферазой, но реакционные условия должны быть такими, чтобы гетерологичная фукозилтрансфераза проявляла свою ферментативную активность. Соответственно, термин "способна к чему-либо" исключает любые условия, при которых ферментативная активность гетерологичной фукозилтрансферазы необратимо нарушена, а также исключено воздействие на гетерологичную фукозилтрансферазу любого из таких условий. Напротив, термин "способна к чему-либо" означает, что фукозилтрансфераза является ферментативно активной, т.е. проявляет свою фукозилтрансферазную активность, если обеспечиваются подходящие реакционные условия (когда обеспечиваются все требования, необходимые для проявления фукозилтрансферазой своей ферментативной активности).
Фукозилтрансферазы могут способствовать образованию α-1,2-, α-1,3-, α-1,4- или α-1,6-гликозидных связей между остатком фукозы и группировкой сахаридов в акцепторной молекуле. Соответственно, термин "альфа-1,2-фукозилтрансфераза" относится к гликозилтрансферазе, которая катализирует перенос фукозы с донорного субстрата на акцепторную молекулу с образованием альфа-1,2-связи между остатком фукозы и остатком сахарида акцепторной молекулы. Термин "альфа-1,3-фукозилтрансфераза" относится к гликозилтрансферазе, которая катализирует перенос фукозы с донорного субстрата на акцепторную молекулу с образованием альфа-1,3-связи между остатком фукозы и остатком сахарида акцепторной молекулы. Термин "альфа-1,4-фукозилтрансфераза" относится к гликозилтрансферазе, которая катализирует перенос фукозы с донорного субстрата на акцепторную молекулу с образованием альфа-1,4-связи между остатком фукозы и остатком сахарида акцепторной молекулы; и термин "альфа-1,6-фукозилтрансфераза" относится к гликозилтрансферазе, которая катализирует перенос фукозы с донорного субстрата на акцепторную молекулу с образованием альфа-1,6-связи между остатком фукозы и остатком сахарида акцепторной молекулы.
Термин "донорный субстрат" применительно к переносу остатка фукозы с донорного субстрата на акцепторную молекулу относится к молекуле, содержащей остаток фукозы, при этом указанная молекула используется гетерологичной фукозилтрансферазой в качестве источника фукозы, которая должна быть перенесена на конкретную акцепторную молекулу. Обычно донорным субстратом является ГДФ-фукоза.
Термин "акцепторная молекула", использованный в данном описании, относится к молекуле, которая получает остаток фукозы от донорного субстрата в результате проявления ферментативной активности гетерологичной фукозилтрансферазы. Использованный в данном описании термин "акцепторная молекула" более конкретно относится к молекуле, состоящей из сахаридной группировки или содержащей ее. Если не указано иное, термин "акцепторная молекула", использованный в данном описании, относится к лактотетраозе.
Гетерологичная фукозилтрансфераза способна переносить остаток фукозы на лактотетраозу как акцепторную молекулу. Термин "лактотетраоза", использованный в данном описании, относится к тетрасахариду, т.е. олигосахариду, состоящему из 4 моносахаридных остатков, при этом тетрасахарид содержит лактозный мотив (Gal(β1,4)Glc) на своем редуцирующем конце.
В одном из воплощений лактотетраоза выбрана из группы, состоящей из лакто-N-тетраозы (LNT; Gal(β1,3)GlcNAc(β1,3)Gal(β1,4)Glc) и лакто-N-неотетраозы (LNnT; Gal(β1,3)GlcNAc(β1,4)Gal(β1,4)Glc). Ферментативная активность гетерологичной фукозилтрансферазы способствует получению фукозилированного олигосахарида, более конкретно фукозилированной лактотетраозы, т.е. лактофукопентаозы. Указанная лактофукопентаоза представляет собой пентасахарид предпочтительно выбранный из группы, состоящей из лакто-N-фукопентаозы I (LNFP-I), лакто-N-неофукопентаозы I (LNnFP-I), лакто-N-фукопентаозы II (LNFP II), лакто-N-неофукопентаозы III (LNnFP-III), лакто-N-фукопентаозы V (LNFP-V) и лакто-N-неофукопентаозы V (LNnFP-V).
Полипептиды, которые были идентифицированы в геноме различных видов бактерий и которые способны проявлять фукозилтрансферазную активность для переноса остатка фукозы с донорного субстрата на лактотетраозу, показаны в таблице 1.

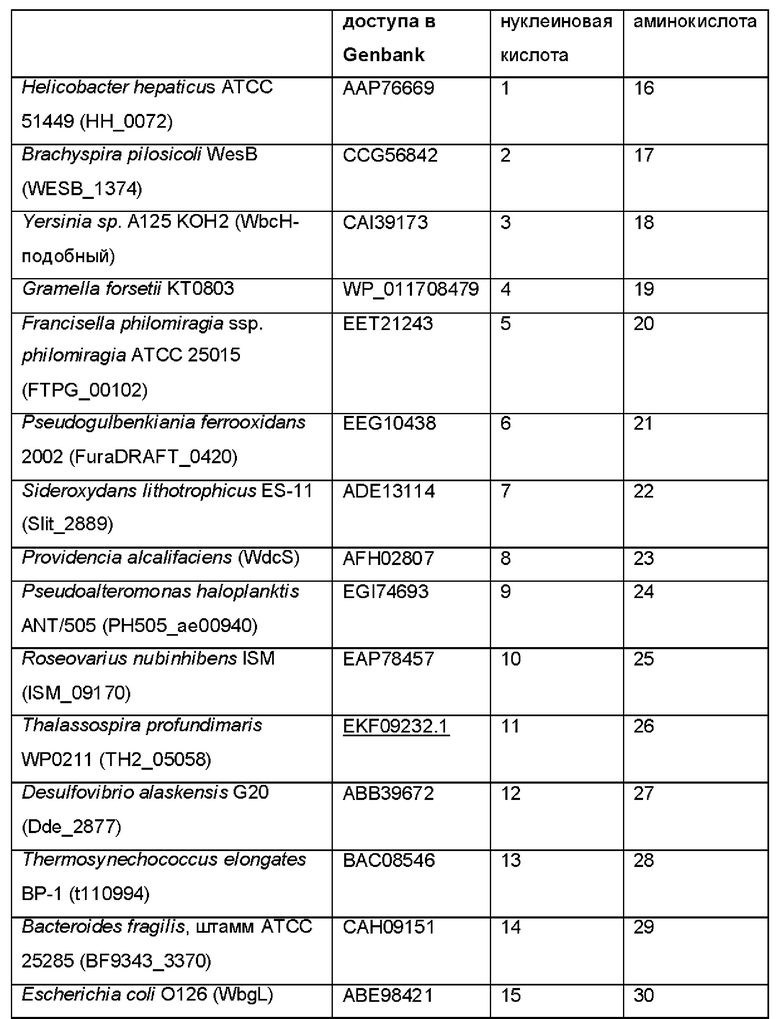
Таблица 1. Фукозилтрансферазы, способные переносить остаток фукозы с донорного субстрата на лактотетраозу. Аминокислотные (аа) последовательности фукозилтрансфераз, используемых в разделе Примеры, и нуклеотидные (nt) последовательности, кодирующие указанные аминокислотные последовательности и используемые для экспрессии фукозилтрансфераз в соответствии с разделом
Примеры приводятся в последних двух колонках данной таблицы посредством указания соответствующих им SEQ ID NO.
Таким образом, в дополнительном и/или альтернативном воплощении гетерологичная фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: +-30, функциональных вариантов полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30, и функциональных вариантов функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30. Таким образом, гетерологичная фукозилтрансфераза выбрана из группы полипептидов, представленных любой из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO:21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO:24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, функциональных вариантов полипептидов, представленных любой из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, и функциональных вариантов функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30.
В дополнительном и/или альтернативном воплощении гетерологичная фукозилтрансфераза кодируется молекулой нуклеиновой кислоты, содержащей
1) нуклеотидную последовательность, которая представлена любой из SEQ ID NO: 1-15;
2) нуклеотидную последовательность, имеющую идентичность последовательности, составляющую по меньшей мере 80% с одной из нуклеотидных последовательностей, которая представлена любой из SEQ ID NO: 1-15, предпочтительно по всей длине последовательности;
3) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая представлена любой из SEQ ID NO: 16-30;
4) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая имеет по меньшей мере 80% идентичности с любой из аминокислотных последовательностей, представленных любой из SEQ ID NO: 16-30;
5) нуклеотидную последовательность, кодирующую функциональный фрагмент любого из полипептидов, соответствующих 3) и 4); или
6) при этом молекула нуклеиновой кислоты гибридизуется с комплементарной цепью молекулы нуклеиновой кислоты, соответствующей 1), 2), 3), 4) или 5), в жестких условиях.
Выражение "SEQ ID NO: 1-15" относится к группе, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15.
"Гибридизация в жестких условиях" относится, например, к: гибридизации в 4 × SSC (растворе хлорида натрия/цитрата натрия) при 65°С и к последующим многократным промывкам в 0,1 × SSC при 65°С в течение в общей сложности примерно 1 часа. Менее жесткими условиями гибридизации являются, например: гибридизация в 4х SSC при 37°С и последующие многократные промывки в 1х SSC при комнатной температуре. "Жесткие условия гибридизации" также могут означать: гибридизацию при 68°С в 0,25 М растворе фосфата натрия, рН 7,2, с 7% (масс/об.) SDS (додецилсульфат натрия), 1 мМ EDTA (этилендиаминтетерауксусная кислота) и 1% (масс/об.) BSA (бычий сывороточный альбумин) в течение 16 часов и последующую двукратную промывку с использованием 2xSSC и 0,1% (масс/об.) SDS при 68°С.
Нуклеотидная последовательность, кодирующая гетерологичную фукозилтрансферазу, может быть представлена в виде линейной молекулы нуклеиновой кислоты или кольцевой молекулы нуклеиновой кислоты. Дополнительно и/или альтернативно, нуклеотидная последовательность, кодирующая гетерологичную фукозилтрансферазу, может быть представлена в виде внехромосомной молекулы нуклеиновой кислоты либо может быть интегрирована в являющую(ие)ся хромосомой(ами) молекулу(ы) нуклеиновой кислоты или по меньшей мере в одну из являющихся хромосомой молекул нуклеиновой кислоты, при этом указанная являющаяся хромосомой молекула нуклеиновой кислоты может быть линейной или кольцевой (бактериальной хромосомой) молекулой нуклеиновой кислоты.
По меньшей мере одну генетически модифицированную клетку культивируют в присутствии по меньшей мере одного источника углерода.
Использованный в данном описании термин "культивирование" означает выращивание клетки в среде ферментации и в условиях, допускающих получение желаемого(ых) фукозилированного(ых) олигосахарида(ов) и подходящих для его(их) получения. Специалисту в данной области техники будут легко доступны несколько подходящих сред ферментации и условий для культивирования клеток после прочтения описания данного изобретения с учетом технической и экспертной квалификации этого специалиста.
В дополнительном и/или альтернативном воплощении по меньшей мере один источник углерода выбран из группы, состоящей из глицерина, сахарозы, глюкозы, галактозы, фруктозы, мелассы, лактозы, ксилозы, целлюлозы, пирувата, сукцината, синтетического оксида углерода и любого другого источника углерода и энергии, который может быть метаболизирован генетически модифицированной клеткой с получением желаемого фукозилированного олигосахарида. В этом контексте следует понимать, что в качестве источника углерода для проведения ферментации можно использовать любые другие, предпочтительно недорогие субстраты, и специалист в данной области техники легко сможет использовать источник углерода, подходящий в рамках настоящего изобретения, чтобы выращивать микроорганизм для крупномасштабного получения желаемого моносахарида. В предпочтительном воплощении получения фукозилированных олигосахаридов в среду ферментации подают лактозу, в частности, если генетически модифицированная клетка не в состоянии синтезировать лактозу сама. В дополнительном и/или альтернативном воплощении получения фукозилированных олигосахаридов в среду ферментации подают фукозу, в частности, если генетически модифицированная клетка не в состоянии синтезировать фукозу сама. Подача фукозы в среду ферментации может усилить внутриклеточный синтез ГДФ-фукозы благодаря использованию пути утилизации фукозы или системы утилизации фукозы.
По меньшей мере одну генетически модифицированную клетку культивируют в условиях, которые подходят для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата на акцепторную молекулу под действием гетерологичной фукозилтрансферазы. Для получения фукозилированного олигосахарида по меньшей мере одну генетически модифицированную клетку культивируют в среде ферментации, в которой предусмотрено наличие достаточных количеств питательных веществ, чтобы по меньшей мере одна клетка была метаболически активной, вследствие чего экспрессируется гетерологичная фукозилтрансфераза и вследствие чего в клетке обеспечивается наличие достаточных количеств донорного субстрата и акцепторных молекул для проявления ферментативной активности гетерологичной фукозилтрансферазы. Для соответствия условиям, подходящим для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата на акцепторную молекулу с использованием активности своей гетерологичной фукозилтрансферазы, среда ферментации должна иметь, среди прочего, подходящую температуру, подходящее значение рН, подходящее количество кислорода, растворенного в среде ферментации, а также подходящую осмолярность. Подходящие значения могут варьировать и зависят от типа клетки, которую культивируют. Подходящие значения могут быть легко определены специалистом в данной области.
В дополнительном и/или альтернативном воплощении культивирование по меньшей мере одной генетически модифицированной клетки в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата гетерологичной фукозилтрансферазы на акцепторную молекулу, включает стадию подачи экзогенной лактозы в среду ферментации в процессе культивирования по меньшей мере одной генетически модифицированной клетки. Это позволяет по меньшей мере одной генетически модифицированной клетке усваивать указанную экзогенно подаваемую лактозу для эндогенного синтеза лактотетраозы. Указанная эндогенно синтезированная лактотетраоза далее может служить в качестве акцепторного субстрата для гетерологичной фукозилтрансферазы.
В дополнительном и/или альтернативном воплощении культивирование по меньшей мере одной генетически модифицированной клетки в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата гетерологичной фукозилтрансферазы на акцепторную молекулу, включает эндогенный синтез лактозы по меньшей мере одной генетически модифицированной клеткой. В одном из воплощений эндогенный синтез лактозы может происходить вследствие природной способности генетически модифицированной клетки синтезировать лактозу. Дополнительно и/или альтернативно, эндогенный синтез лактозы осуществляется при участии сверхэкспрессирующей гетерологичной β-1,4-галактозилтрансферазы в генетически модифицированной клетке. Таким образом, генетически модифицированная клетка также генетически модифицирована с возможностью сверхэкспрессировать, по сравнению с генетически немодифицированной клеткой-предшественником, ген указанной гетерологичной β-1,4-галактозилтрансферазы. Ген указанной гетерологичной β-1,4-галактозилтрансферазы кодирует β-1,4-галактозилтрансферазу, которая катализирует образование лактозы из галактозы и глюкозы. Примеры подходящих β-1,4-галактозилатрансфераз выбраны из группы, состоящей из Pm 1141 из Pasteurella multocida (№ доступа АЕС04686) и Lex1 из Aggregatibacter aphrophilus NJ8700 (№ доступа АК965832).
В дополнительном и/или альтернативном воплощении культивирование по меньшей мере одной генетически модифицированной клетки в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата гетерологичной фукозилтрансферазы на акцепторную молекулу, включает стадию подачи лакто-N-триозы-2 (LNT-2) в среду ферментации в процессе культивирования по меньшей мере одной генетически модифицированной клетки, при этом по меньшей мере одна указанная генетически модифицированная клетка содержит (1) β-1,3-галактозилтрансферазу или β-1,4-галактозилтрансферазу и (2) α-1,2- и/или α-1,3-фукозилтрансферазу в качестве гликозилтрансферазы. LNT-2 представляет собой трисахарид, который может быть получен с достаточной эффективностью. Подача LNT-2 в среду ферментации позволяет по меньшей мере одной генетически модифицированной клетке усваивать указанную экзогенно подаваемую LNT-2 в качестве предшественника для эндогенного синтеза LNT или LNnT, которые в свою очередь могут служить в качестве акцепторных молекул для гетерологичной фукозилтрансферазы.
Согласно дополнительному и/или альтернативному воплощению способа получения фукозилированного олигосахарида, способ, включающий стадию культивирования по меньшей мере одной генетически модифицированной клетки, представляет собой способ непрерывной ферментации или способ периодической ферментации, предпочтительно способ периодической ферментации с подпиткой.
Таким образом, в соответствии с воплощением, где культивирование представляет собой способ непрерывной ферментации, то есть способ, согласно которому в среду ферментации в ходе стадии культивирования генетически модифицированной клетки непрерывно добавляют по меньшей мере один источник углерода, и согласно которому в процессе ферментации непрерывно извлекают среду ферментации. В результате постоянного добавления источника углерода в ходе стадии культивирования осуществляется постоянное и эффективное продуцирование олигосахарида.
В соответствии с воплощением, где культивирование представляет собой способ периодической ферментации, используют закрытую систему культивирования с определенным составом питательных веществ в начале ферментации и определенными значениями температуры, давления, условиями аэрации и другими условиями для оптимизации роста. В процессе ферментации не производят ни добавления питательных веществ, ни удаления продуктов жизнедеятельности в ходе культивирования клеток.
Под периодической ферментацией с подпиткой понимают прием, когда одно или более чем одно питательное вещество (субстрат) подают (доставляют) в биореактор в процессе культивирования, и при котором продукт(ы) остаются в биореакторе до конца цикла или при котором по меньшей мере одну порцию среды ферментации, включающей клетки и продукт(ы), извлекают из биореактора в ходе процесса ферментации. Порции среды ферментации можно извлекать из биореактора несколько раз и/или через разные интервалы времени в ходе процесса ферментации.
В дополнительном и/или альтернативном воплощении способ получения фукозилированного олигосахарида включает извлечение желаемого фукозилированного олигосахарида из культуры продуцирующей клетки. Использованный в данном описании термин "извлечение" означает выделение, сбор, очистку, отбор или иное отделение олигосахарида, продуцируемого микроорганизмом хозяина по изобретению, от культуры микроорганизма хозяина. Термин "очистка", использованный в данном описании, относится к удалению по меньшей мере существенного количества примесей и нежелательного соединения. Указанные примеси и нежелательные соединения (нежелательные побочные продукты) представляют собой клетки, ионы и соли, другие сахариды, отличающиеся от желаемой лактофукопентаозы, например, моносахариды, дисахариды, трисахариды, тетрасахариды, в особенности лактотетраозы, и другие пентасахариды, отличающиеся от желаемой лактофукопентаозы.
В дополнительном и/или альтернативном воплощении извлечение и/или очистка фукозилированного олигосахарида включает стадию, выбранную из группы, состоящей из (1) кристаллизации фукозилированного олигосахарида из раствора указанного фукозилированного олигосахарида и (2) распылительной сушки фукозилированного олигосахарида. Эти стадии обеспечивают получение фукозилированного олигосахарида в кристаллической или аморфной форме.
В дополнительном и/или альтернативном воплощении для извлечения или очистки желаемых фукозилированных олигосахаридов применяют по меньшей мере одну гликозидазу, при этом по меньшей мере одну гликозидазу используют для расщепления мешающих и/или нежелательных примесей или побочных продуктов, неиспользованных исходных субстратов и промежуточных продуктов, образуемых в процессе получения желаемого олигосахарида. При использовании по меньшей мере одной гликозидазы достигают того, что, например, метаболизму могут быть подвергнуты другие (олиго)сахариды, отличающиеся от желаемого фукозилированного олигосахарида, при этом другие (олиго)сахариды продуцируются по меньшей мере в одной генетически модифицированной клетке или продуцируются по меньшей мере одной генетически модифицированной клеткой в ходе синтеза желаемого фукозилированного олигосахарида, и при этом другие олигосахариды мешают осуществлению стадии очистки желаемого олигосахарида.
По меньшей мере одна гликозидаза может быть либо добавлена извне в среду ферментации по окончании процесса ферментации, либо эндогенно синтезирована по меньшей мере одной генетически модифицированной клеткой.
Добавление в среду ферментации по меньшей мере одной гликозидазы имеет преимущество, если генетически модифицированная клетка не синтезирует одну или более гликозидаз, например, ввиду того, что эндогенные гены генетически модифицированной клетки, кодирующие указанные одну или более гликозидаз, делетированы, или что экспрессия эндогенных генов, кодирующих указанные одну или более гликозидаз, нарушена.
В одном из воплощений, где в среду ферментации добавляют по меньшей мере одну гликозидазу, по меньшей мере одна гликозидаза продуцируется по меньшей мере одной другой клеткой, отличающейся от генетически модифицированной клетки, для получения фукозилированного олигосахарида, и по меньшей мере одну другую указанную клетку дополнительно добавляют в среду ферментации для экспрессии гена(ов), кодирующего (их) по меньшей мере одну гликозидазу.
В этом воплощении по меньшей мере одна гликозидаза, экспрессируемая по меньшей мере одной другой клеткой, представляет собой либо природную гликозидазу указанной одной другой клетки, либо гетерологичную гликозидазу, при этом указанная другая клетка стабильно трансфицирована с возможностью экспрессировать гетерологичную гликозидазу, и при этом экспрессия гетерологичной гликозидазы в этой другой клетке является индуцибельной. Предпочтительно, чтобы гетерологичная гликозидаза кодировалась нуклеотидной последовательностью, которая стабильно интегрирована в геном по меньшей мере одной другой клетки.
Это воплощение особенно подходит в способе непрерывной ферментации для получения фукозилированного олигосахарида, где, например, для проведения ферментации предусмотрено наличие двух отдельных сосудов или контейнеров, при этом один сосуд/контейнер используется для осуществления реакции синтеза олигосахарида, а второй сосуд/контейнер в основном применяется для культивирования клеток, которые экспрессируют гетерологичную гликозидазу.
В дополнительном и/или альтернативном воплощении по меньшей мере одна гликозидаза, экспрессируемая по меньшей мере одной другой клеткой, представляет собой внутриклеточную гликозидазу. Так, по меньшей мере одна гликозидаза, экспрессируемая по меньшей мере одной клеткой, находится внутри указанной по меньшей мере одной клетки. Таким образом, указанная по меньшей мере одна другая клетка захватывает нежелательные примеси, побочные продукты, неиспользованные исходные субстраты и/или промежуточные продукты, образуемые в процессе получения желаемого олигосахарида, вследствие чего захваченные соединения расщепляются под действием по меньшей мере одной внутриклеточной гликозидазы.
В альтернативном воплощении, по меньшей мере одна гликозидаза, экспрессируемая по меньшей мере одной другой клеткой, секретируется по меньшей мере одной другой клеткой в среду ферментации. Затем нежелательные примеси, побочные продукты, неиспользованные исходные субстраты и/или промежуточные продукты, образуемые в процессе получения желаемого олигосахарида, расщепляются в среде ферментации. Это воплощение имеет преимущество в том случае, когда по меньшей мере одна другая клетка не способна захватывать нежелательные примеси, побочные продукты, неиспользованные исходные субстраты и/или промежуточные продукты, образуемые в процессе получения желаемого олигосахарида.
В предпочтительном воплощении гликозидаза катализирует расщепление лактозы. Подходящей гликозидазой для расщепления лактозы является β-1,4-галактозидаза LacZ из Е. coli. Подходящей гликозидазой для гидролиза LNT-2, промежуточного продукта, является β-N-ацетилгексозаминидаза BbhI из Bifidobacterium bifidum JCM1254. Подходящей гликозидазой для гидролиза промежуточного продукта LNT, является β-1,3-галактозидаза Bga42A из Bifidobacterium longum subsp.infantis.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка, которая также продуцирует по меньшей мере одну гликозидазу, или по меньшей мере одна другая клетка, продуцирующая по меньшей мере одну гликозидазу, экспрессирует по меньшей мере одну гликозидазу в результате внешнего воздействия, например, посредством вызванной изменением температуры экспрессии или посредством индуцированной субстратом экспрессии. Это означает, что экспрессия по меньшей мере одной гликозидазы подавляется в ходе синтеза желаемого фукозилированного олигосахарида и может быть индуцирована, например, посредством изменения температуры или в результате добавления индуктора, такого как IPTG (изопропил-β-D-тиогалактозид), в конце процесса ферментации. Экспрессия гликозидазы будет индуцирована после того, как будет образовано достаточное и/или по существу максимальное количество олигосахарида в ходе культивирования генетически модифицированной клетки. После этого экспрессированные гликозидазы будут расщеплять нежелательные промежуточные сахариды, субстраты и т.д., в результате чего среда по существу не будет содержать промежуточных сахаридов или субстратов, которые в противном случае препятствовали бы очистке или усложняли бы очистку желаемого олигосахарида. Несколько подходящих средств для индуцибельной экспрессии известны из предшествующего уровня техники (см., например, Sambrook и др., 1989, выше), и специалист будет способен применить средство, соответственно подходящее для желаемого олигосахарида.
Под термином "регулируемый" в контексте настоящего изобретения применительно к гену обычно понимается ген, транскрипцию которого можно регулировать требуемым образом, например, подавлять или активировать, т.е. количество синтезированного белка, кодируемого регулируемым геном, отличается, например, в результате ослабления/подавления или активации, от случая нерегулируемого гена.
В дополнительном воплощении, моносахариды, образующиеся в результате расщепления нежелательных промежуточных сахаридов, субстратов и т.д., могут метаболизироваться генетически модифицированной клеткой.
Согласно второму аспекту предложена генетически модифицированная клетка для получения фукозилированного олигосахарида или для применения в способе его получения. Указанная генетически модифицированная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, которая способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза.
Термин "генетически модифицированная", использованный в данном описании применительно к клетке хозяина, указывает на то, что клетка-хозяин реплицирует молекулу гетерологичной или рекомбинантной нуклеиновой кислоты и/или экспрессирует пептид или белок, кодируемый данной гетерологичной нуклеотидной последовательностью (т.е. нуклеотидной последовательностью, "чужеродной для указанной клетки"). Генетически модифицированные клетки могут содержать гены, которые не обнаруживаются в клетке нативной (нерекомбинантной) формы. Генетически модифицированные клетки также могут содержать гены, обнаруживаемые в клетке нативной формы, при этом такие гены модифицируют и повторно вводят в клетку искусственным способом. Термин также охватывает клетки, которые содержат молекулу нуклеиновой кислоты, эндогенную по отношению к клетке, которая модифицирована без удаления нуклеиновой кислоты из данной клетки; такие модификации включают модификации, осуществляемые с использованием замещения генов, сайт-специфических мутаций и связанных с ними методов. Соответственно, "рекомбинантный полипептид" представляет собой полипептид, который продуцирован генетически модифицированной клеткой.
Соответственно, под выражением "генетически модифицированная клетка" понимается клетка, которая была трансформирована или трансфицирована.
Таким образом, нуклеотидные последовательности, использованные в настоящем изобретении, могут, например, содержаться в векторе, которым должны быть стабильно трансформированы/трансфицированы клетки микроорганизма хозяина, или который иным образом должен быть введен в клетки микроорганизма хозяина.
Способы создания "рекомбинантной ДНК", включая выделение, синтез, очистку и амплификацию генетического материала, используемые для трансформации или трансфекции выбранных клеток хозяина, известны специалисту в данной области техники. Так, общеизвестно, как осуществить трансфекцию клеток с использованием "гибридной" вирусной или кольцевой плазмидной ДНК, включающей в себя выбранные экзогенные (т.е. чужеродные или "гетерологичные") нуклеотидные последовательности. Эти методики, известные в данной области техники, включают создание вектора для трансфекции посредством ферментативного расщепления кольцевой вирусной или плазмидной ДНК с образованием линейных цепей ДНК. Выбранные цепи чужеродной ДНК, обычно содержащие последовательности, кодирующие желаемый белковый продукт, получают в линейной форме, применяя точно те же/аналогичные ферменты. Линейную вирусную или плазмидную ДНК инкубируют с чужеродной ДНК в присутствии осуществляющих лигирование ферментов, способных осуществлять процесс реконструирования и образовывать "гибридные" векторы, содержащие выбранный сегмент экзогенной ДНК, "сплайсированный" в вирусную или кольцевую ДНК-плазм иду.
Генетически модифицированной клеткой является прокариотическая клетка или эукариотическая клетка. Соответствующие клетки включают клетки дрожжей, бактерий, архебактерий, грибов, клетки насекомых, клетки растений и клетки животных, в том числе клетки млекопитающих (как например, клетки и линии клеток человека).
В дополнительном и/или альтернативном воплощении прокариотическая клетка представляет собой бактериальную клетку, предпочтительно выбранную из рода, выбранного из группы, состоящей из Bacillus, Lactobacillus, Lactococcus, Enterococcus, Bifidobacterium, Sporolactobacillus spp., Micromonospora spp., Micrococcus spp., Rhodococcus spp.и Pseudomonas. Подходящими видами бактерий являются Bacillus subtilis, Bacillus licheniformis, Bacillus coagulans, Bacillus thermophilus, Bacillus laterosporus, Bacillus megaterium, Bacillus mycoides, Bacillus pumilus, Bacillus lentus, Bacillus cereus, Bacillus circulans, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium bifidum, Citrobacter freundii, Clostridium cellulolyficum, Clostridium ljungdahlii, Clostridium autoethanogenum, Clostridium acetobutylicum, Corynebacterium glutamicum, Enterococcus faecium, Enterococcus thermophiles, Escherichia coli, Erwinia herbicola (Pantoea agglomerans), Lactobacillus acidophilus, Lactobacillus salivarius, Lactobacillus plantarum, Lactobacillus helveticus, Lactobacillus delbrueckii, Lactobacillus rhamnosus, Lactobacillus bulgaricus, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus casei, Lactobacillus reuteri, Lactobacillus jensenii, Lactococcus lactis, Pantoea citrea, Pectobacterium carotovorum, Proprionibacterium freudenreichii, Pseudomonas fluorescens, Pseudomonas aeruginosa, Streptococcus thermophiles и Xanthomonas campestris.
В дополнительном и/или альтернативном воплощении эукариотическая клетка представляет собой клетку дрожжей, клетку насекомых, клетку растений или клетку млекопитающих. Дрожжевая клетка предпочтительно выбрана из группы, состоящей из Saccharomyces sp., в частности, Saccharomyces cerevisiae, Saccharomycopsis sp., Pichia sp., в частности, Pichia pastoris, Hansenula sp., Kluyveromyces sp., Yarrowia sp., Rhodotorula sp.и Schizosaccharomyces sp.
Генетически модифицированная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, способную переносить остаток фукозы с донорного субстрата на акцепторную молекулу, представляющую собой лактотетраозу. В дополнительном и/или альтернативном воплощении гетерологичная фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных вариантов полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30, и функциональных вариантов функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30.
В дополнительном и/или альтернативном воплощении гетерологичная фукозилтрансфераза кодируется молекулой нуклеиновой кислоты, содержащей
1) нуклеотидную последовательность, которая представлена любой из SEQ ID NO: 1-15;
2) нуклеотидную последовательность, имеющую идентичность последовательности, составляющую по меньшей мере 80% с одной из нуклеотидных последовательностей, которая представлена любой из SEQ ID NO: 1-15, предпочтительно по всей длине последовательности;
3) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая представлена любой из SEQ ID NO: 16-30;
4) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая имеет по меньшей мере 80% идентичности с любой из аминокислотных последовательностей, представленных любой из SEQ ID NO: 16-30;
5) нуклеотидную последовательность, кодирующую функциональный фрагмент любого из полипептидов, соответствующих 3) и 4); или
6) при этом молекула нуклеиновой кислоты гибридизуется с комплементарной цепью молекулы нуклеиновой кислоты, соответствующей 1), 2), 3), 4) или 5), в жестких условиях.
Нуклеотидная последовательность, кодирующая гетерологичную фукозилтрансферазу, может быть представлена в виде линейной или кольцевой внехромосомной молекулы нуклеиновой кислоты в генетически модифицированной клетке, либо может быть интегрирована в являющуюся хромосомой молекулу нуклеиновой кислоты клетки, при этом указанная являющаяся хромосомой молекула нуклеиновой кислоты может быть линейной или кольцевой (бактериальной хромосомой) молекулой нуклеиновой кислоты.
Генетически модифицированная клетка способна осуществлять синтез ГДФ-фукозы, которая необходима для реакции, катализируемой гетерологичный полипептидом, способным проявлять фукозилтрансферазную активность для переноса остатка фукозы с донорного субстрата на лактотетраозу с получением желаемого фукозилированного олигосахарида, поскольку ГДФ-фукоза служит в качестве донорного субстрата для остатка фукозы, переносимого на лактотетраозу под действием гетерологичной фукозилтрансферазы. Таким образом, в одном из воплощений генетически модифицированная клетка также генетически модифицирована с возможностью обладать способностью повышенного продуцирования внутриклеточной ГДФ-фукозы по сравнению с данной клеткой до проведения ее генетической модификации.
В дополнительном и/или альтернативном воплощении предоставление внутриклеточного запаса ГДФ-фукозы для получения фукозилированных олигосахаридов достигается благодаря тому, что генетически модифицированная клетка также генетически модифицирована таким образом, что в указанной клетке экспрессируется или сверхэкспрессируется ген, кодирующий бифункциональную фукозокиназу/L-фукозо-1-фосфат-гуанилтрансферазу (Fkp), предпочтительно ген, кодирующий бифункциональную фукозокиназу/L-фукозо-1-фосфат-гуанилтранеферазу (Fkp) из Bacteroides fragilis (№ доступа AY849806), которая способна катализировать превращение L-фукозы в ГДФ-фукозу. Для получения желаемого фукозилированного олигосахарида предпочтительно, чтобы в процессе ферментации клеток осуществлялось поступление L-фукозы к генетически модифицированной клетке.
В дополнительном и/или альтернативном воплощении ГДФ-фукоза для синтеза желаемого фукозилированного олигосахарида может быть взята из собственного клеточного метаболизма ГДФ-фукозы с использованием "пути de novo". Чтобы увеличить запас ГДФ-фукозы внутри клетки посредством "пути de novo", генетически модифицированная клетка также должна быть генетически модифицирована с возможностью экспрессировать или сверхэкспрессировать, по сравнению с данной клеткой до подвергания ее генетической модификации, по меньшей мере один из генов, кодирующих фосфоманномутазу, маннозо-1-фосфат-гуанозилтрансферазу, ГДФ-маннозо-4,6-дегидратазу и ГДФ-L-фукозосинтазу. В предпочтительном воплощении данная клетка генетически модифицирована с возможностью сверхэкспресировать все четыре из указанных генов.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка также генетически модифицирована с возможностью демонстрировать усиленный импорт экзогенной L-фукозы через свою клеточную мембрану. Предпочтительно, генетически модифицированная клетка также генетически модифицирована с возможностью экспрессировать или сверхэкспрессировать, по сравнению с клеткой-предшественником до подвергания ее генетической модификации, одну нуклеотидную последовательность, выбранную из группы, состоящей из нуклеотидных последовательностей, кодирующих главный переносчик, осуществляющий облегченный транспорт, FucP из Е. coli MG1655 (№ доступа AIZ90162), нуклеотидных последовательностей, кодирующих функциональные варианты главного переносчика, осуществляющего облегченный транспорт, FucP из £. со//, нуклеотидных последовательностей, кодирующих функциональные фрагменты главного переносчика, осуществляющего облегченный транспорт, FucP из E. coli, и нуклеотидных последовательностей, кодирующих функциональные варианты функциональных фрагментов главного переносчика, осуществляющего облегченный транспорт, FucP из Е. coli. Экспрессия или сверхэкспрессия главного переносчика, осуществляющего облегченный транспорт, FucP, его функциональных вариантов и/или функциональных фрагментов в генетически модифицированной клетке усиливает поглощение клеткой экзогенной L-фукозы через ее клеточную мембрану.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка также генетически модифицирована с возможностью предотвращать истощение запаса ГДФ-фукозы внутри клетки. В одном из воплощений клетка генетически модифицирована так, что экспрессия гена, кодирующего фермент WcaJ, который катализирует первую стадию синтеза колановой кислоты, нарушена или инактивирована, предпочтительно так, что ген WcaJ по меньшей мере частично удален из генетической информации клетки, или так, что нуклеотидная последовательность гена WcaJ изменена, вследствие чего транскрипция гена, кодирующего WcaJ, невозможна. Согласно дополнительному и/или альтернативному подходу нуклеотидная последовательность гена, кодирующего WcaJ, была изменена, вследствие чего ферментативно неактивный полипептид кодируется измененным геном WcaJ, например, так, что в открытую рамку считывания введен стоп-кодон, что приводит к экспрессии укороченного варианта WcaJ, представляющего собой нефункциональный фрагмент, или так, что нуклеотидная последовательность гена WcaJ изменена таким образом, что полипептид, кодируемый указанным измененным геном WcaJ, отличается от WcaJ дикого типа в одном или более чем одном аминокислотном остатке, что делает полученный полипептид ферментативно неактивным.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка также генетически модифицирована так, что гены fucl и/или fucK, кодирующие L-фукозоизомеразу и L-фукулозокиназу, соответственно, удалены, нуклеотидная последовательность генов fucl и/или fucK изменена, чтобы необратимо инактивировать ферментативную активность соответствующего(их) полипептида(ов), или так, что экспрессия генов fucl и/или fucK нарушена. Аннулирование внутриклеточного синтеза Fucl и/или FucK устраняет катаболизм фукозы в соответствующей клетке, тем самым повышая количество фукозы, которая будет доступна для образования ГДФ-фукозы.
В дополнительном воплощении генетически модифицированная клетка также генетически модифицирована таким образом, что данная клетка (1) не экспрессирует один или несколько полипептидов, которые расщепляют внутри клетки один или несколько предшественников желаемого фукозилированного олигосахарида, предполагаемого для получения, или (2) экспрессирует один или несколько полипептидов, имеющих измененную аминокислотную последовательность и/или длину, по сравнению со своим встречающимся в природе гомологом, для оказания негативного воздействия на активность такого фермента, который расщепляет внутри клетки один или несколько предшественников желаемого фукозилированного олигосахарида, предполагаемого для получения.
Термин "предшественник", использованный в данном описании применительно к желаемым фукозилированным олигосахаридам, относится к соединениям, представляющим собой промежуточные соединения в пути биосинтеза желаемого фукозилированного олигосахарида, предполагаемого для получения. Эти промежуточные соединения включают эндогенные соединения, т.е. соединения, которые продуцируются и могут естественным образом присутствовать в клеткехозяина, даже когда их синтез в клетке бактерии-хозяина усиливается в результате генетической модификации хозяина.
Кроме того, в дополнительном и/или альтернативном воплощении генетически модифицированная клетка генетически модифицирована так, что она не содержит ферментативно активной β-галактозидазы.
Кроме того, в дополнительном и/или альтернативном воплощении генетически модифицированная клетка генетически модифицирована так, что у нее отсутствует функциональный ген LacZ или что она содержит функциональный ген LacZ, экспрессия которого строго регулируется и который не экспрессируется в процессе ферментации для получения фукозилированного олигосахарида.
Дополнительно и/или альтернативно, генетически модифицированная клетка также генетически модифицирована так, что данная клетка не содержит полипептидов или не экспрессирует полипептиды, обладающих(ие) ферментативной активностью, заключающейся в гидролизе другого, нежели лактоза, предшественника желаемого фукозилированного олигосахарида, например, LNT-2, LNT или LNnT, либо более крупных производных LNT и LNnT. С этой целью генетически модифицированная клетка также генетически модифицирована таким образом, что геном данной клетки не содержит нуклеотидную последовательность, кодирующую полипептид, способный катализировать гидролиз другого указанного предшественника желаемого фукозилированного олигосахарида, или так, что экспрессия генов, кодирующих такие белки, регулируется таким образом, что они не экспрессируются в процессе ферментации для получения фукозилированного олигосахарида.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка содержит по меньшей мере одну нуклеотидную последовательность, кодирующую полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность. Генетически модифицированная клетка по этому воплощению способна экспрессировать полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность.
Предпочтительно, генетически модифицированная клетка экспрессирует указанный полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность. Более предпочтительно, указанная генетически модифицированная клетка содержит полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность. Предпочтительно, указанная по меньшей мере одна нуклеотидная последовательность, кодирующая полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность, представляет собой гетерологичную нуклеиновокислотную последовательность, т.е. представляет собой нуклеотидную последовательность, не существующую в природе в не подвергнутом генетической модификации предшественнике генетически модифицированной клетки. Благодаря экспрессии полипептида, способного проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность, в клетке хозяина может осуществляться присоединение N-ацетилглюкозамина к акцепторному субстрату лактозе, когда указанный полипептид обладает своей β-1,3-N-ацетилглюкозаминилтрансферазной активностью, тем самым внутри клетки образуется LNT-2.
В дополнительном и/или альтернативном воплощении полипептидом, способным проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность в отношении переноса N-ацетилглюкозамина на лактозу, является β-1,3-N-ацетилглюкозаминилтрансфераза, которая может быть выбрана из группы, состоящей из LgtA из Neisseria meningitidis МС58 (№ доступа NP_274923) и β-1,3-N-ацетилглюкозаминилтрансферазы из Pasteurella multocida subsp.Multocida, штамма HN06 (№ доступа PMCN06_0022).
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка содержит по меньшей мере одну нуклеотидную последовательность, кодирующую полипептид, способный проявлять β-1,3-галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность. Генетически модифицированная клетка по этому воплощению может экспрессировать полипептид, способный проявлять β-1,3- галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность. Предпочтительно, генетически модифицированная клетка экспрессирует указанный полипептид, способный проявлять β-1,3-галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность. Более предпочтительно, указанная генетически модифицированная клетка содержит полипептид, способный проявлять β-1,3-галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность. Предпочтительно, указанная по меньшей мере одна нуклеотидная последовательность, кодирующая полипептид, способный проявлять β-1,3-галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность, представляет собой гетерологичную нуклеиновокислотную последовательность, т.е. представляет собой нуклеотидную последовательность, не существующую в природе в не подвергнутом генетической модификации предшественнике генетически модифицированной клетки. Благодаря экспрессии полипептида, способного проявлять β-1,3-галактозилтрансферазную активность или β-1,4-галактозилтрансферазную активность, в генетически модифицированной клетке может осуществляться галактозилирование LNT-2 с образованием внутри клетки LNT или LNnT, соответственно.
В дополнительном и/или альтернативном воплощении полипептид, способный проявлять β-1,3-галактозилтрансферазную активность для галактозилирования LNT-2 с получением LNT, представляет собой β-1,3-галактозилтрансферазу, выбранную из группы, состоящей из β-1,3-галактозилтрансферазы WbdO, происходящей из Salmonella entehca (№ доступа AY730594), и β-1,3-галактозилтрансферазы, кодируемой геном, выбранным из группы, состоящей из wbgO из Е. coli O55:Н7 (№ доступа BAG 11838), furA из Lutiella nitroferrum (FuraDRAFT_0419), и функциональных фрагментов указанных β-1,3-галактозилтрансфераз.
В дополнительном и/или альтернативном воплощении полипептид, способный проявлять β-1,4-галактозилтрансферазную активность для галактозилирования LNT-2 с получением LNnT, представляет собой β-1,4-галактозилтрансферазу, выбранную из группы, состоящей из LgtB из Neisseria meningitidis (№ доступа AAF42257), Lex1 из Aggregatibarter aphrophilus NJ8700 (№ доступа YP_003008647), GaIT из Kingella denitriUcans ATCC 33394 (№ доступа HMPREF9098_2407), GatD из Pasteurella multocida M1404 (№ доступа GQ444331), GalT из Bacterioidis fragilis NCTC9343 (№ доступа BF9343_0585), IsgD из Haemophilus influenza (№ доступа AAA24981), GalT из Helicobacter pylori (№ доступа AB035971) и функциональных фрагментов указанных р-1,4-галактозилтрансфераз.
Для внутриклеточного синтеза LNT или LNnT либо их более крупных производных в генетически модифицированной клетке необходимы УДФ-галактоза (УДФ означает уридиндифосфат) и УДФ-N-ацетилглюкозамин.
Наличие внутриклеточной УДФ-галактозы в генетически модифицированной клетке может быть обеспечено путем подачи галактозы в генетически модифицированную клетку, при этом клетки культивируют в среде ферментации, которая содержит галактозу. Галактоза поглощается клеткой, фосфорилируется до галактозо-1-фосфата и затем превращается в УДФ-галактозу. Гены, кодирующие полипептиды, несущие ферментативные активности, которые необходимы для этих реакций, хорошо известны.
В дополнительном и/или альтернативном воплощении внутриклеточный запас УДФ-галактозы также можно обеспечить путем включения собственного метаболизма клетки, и механизм собственного метаболизма клетки может быть улучшен посредством генетической модификации клетки, в результате чего, например, данная клетка будет сверхэкспрессировать УДФ-галактозо-4'-эпимеразу или сверхэкспрессировать УДФ-галактозо-4'-эпимеразу в сочетании с глюкозо-1-фосфат-1-уридинилтрансферазой.
Наличие внутриклеточного УДФ-N-ацетилглюкозамина в генетически модифицированной клетке также можно обеспечить путем включения собственного метаболизма клетки для получения УДФ-N-ацетилглюкозамина. Чтобы увеличить внутриклеточный запас УДФ-N-ацетилглюкозамина в генетически модифицированной клетке, данная клетка может быть генетически модифицирована таким образом, что один или несколько генов, кодирующих L-глутамин:D-фруктозо-6-фосфат-аминотрансферазу, фосфоглюкозаминмутазу, фосфоглюкомутазу и N-ацетилглюкозамин-1-фосфат-уридилтрансферазу/глюкозамин-1-фосфат-ацетилтрансферазу, сверхэкспрессированы.
В дополнительном и/или альтернативном воплощении клетка генетически модифицирована таким образом, что катаболизм N-ацетилглюкоза мина в генетически модифицированной клетке устранен. В результате устранения клеточного катаболизма N-ацетилглюкозамина повышается внутриклеточный уровень УДФ-N-ацетилглюкозамина, доступного для внутриклеточного синтеза N-ацетилглюкозамина.
В дополнительном и/или альтернативном воплощении генетически модифицированная клетка для применения в синтезе сложных фукозилированных НМО способна инкорпорировать лактозу через свою клеточную мембрану для накопления лактозы в качестве исходного вещества для получения желаемого фукозилированного олигосахарида. Ввиду этого, клетка может экспрессировать эндогенный ген, кодирующий пермеазу лактозы. В дополнительном и/или альтернативном воплощении клетка генетически модифицирована с возможностью содержать и экспрессировать гетерологичный ген пермеазы лактозы, в частности, если в природе данная клетка не содержит и не экспрессирует ген, кодирующий пермеазу лактозы.
В дополнительном и/или альтернативном воплощении наличие лактозы для получения желаемого фукозилированного олигосахарида обеспечивается посредством внутриклеточного синтеза лактозы такой клеткой. Предпочтительно это достигается тем, что данная клетка экспрессирует эндогенный или рекомбинантный ген, кодирующий β1-4-галактозилтрансферазу, при этом указанная β1-4-галактозилтрансфераза способна переносить галактозную группировку УДФ-галактозы на молекулу глюкозы. Такая β1-4-галактозилтрансфераза может быть выбрана из Pm1141 из Pasteurella multocida (№ доступа: АЕС04686) или Lex1 из Aggregatibacter aphrophilus NJ8700 (№ доступа YP_003008647).
Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная клетка содержит
(1) β-1,3-N-ацетилглюкозаминилтрансферазу,
(2) β-1,3-галактозилтрансферазу или β-1,4-галактозилтрансферазу; и
(3) α-1,2- и/или α-1,3-фукозилтрансферазу.
В другом воплощении, где генетически модифицированную клетку культивируют для получения фукозилированного олигосахарида, при этом в среду ферментации добавляют LNT-2 в качестве предшественника акцепторной молекулы, генетически модифицированная клетка содержит
(1) β-1,3-галактозилтрансферазу или β-1,4-галактозилтрансферазу; и
(2) α-1,2- и/или α-1,3-фукозилтрансферазу в качестве гликозилтрансферазы.
Согласно третьему аспекту предложены молекулы рекомбинантной нуклеиновой кислоты для экспрессии гетерологичной фукозилтрансферазы в генетически модифицированной клетке. Термин "молекула нуклеиновой кислоты" относится к одно- или двухцепочечной макромолекуле из дезоксирибонуклеотидных единиц или макромолекуле из рибонуклеотидных единиц и содержит скрученную макромолекулу из дезоксирибонуклеотидных единиц или макромолекулу из рибо нуклеотидных единиц, содержащую один или несколько известных аналогов либо существующих в природе или полученных синтетическим путем нуклеотидов.
Молекула рекомбинантной нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую фукозилтрансферазу, выбранную из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных вариантов полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30, и функциональных вариантов функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30.
В дополнительном и/или альтернативном воплощении нуклеотидная последовательность, кодирующая фукозилтрансферазу, выбрана из группы, состоящей из:
1) нуклеотидной последовательности, представленной любой из SEQ ID NO: 1-15;
2) нуклеотидной последовательности, имеющей идентичность последовательности, составляющую по меньшей мере 80% с одной из нуклеотидных последовательностей, представленных любой из SEQ ID NO: 1-15, предпочтительно по всей длине последовательности;
3) нуклеотидной последовательности, кодирующей полипептид, имеющий аминокислотную последовательность, которая представлена любой из SEQ ID NO: 16-30;
4) нуклеотидной последовательности, кодирующей полипептид, имеющий аминокислотную последовательность, которая имеет по меньшей мере 80% идентичности с любой из аминокислотных последовательностей, представленных любой из SEQ ID NO: 16-30;
5) нуклеотидной последовательности, кодирующей функциональный фрагмент любого из полипептидов, соответствующих 3) и 4); и
6) молекулы нуклеиновой кислоты, которая гибридизуется с комплементарной цепью молекулы нуклеиновой кислоты, соответствующей 1), 2), 3), 4) или 5), в жестких условиях.
В объем настоящего изобретения под этими терминами также включены полиморфные варианты, аллели, мутанты и межвидовые гомологи нуклеиновых кислот/полинуклеотидов и полипептидов, имеющих аминокислотную последовательность, обладающую идентичностью по аминокислотной последовательности более чем примерно на 60%, 65%, 70%, 75%, 80%, 85%, 90%, предпочтительно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% либо более высоким значением идентичности по аминокислотной последовательности, предпочтительно в пределах участка по меньшей мере примерно из 25, 50, 100, 200, 500 или более аминокислот, с полипептидом, аналогичным одной из аминокислотных последовательностей среди SEQ ID NO: 16-30.
"Вариант(ы)" как термин, использованный в данном описании, относится к полинуклеотиду или полипептиду, который отличается от референсного полинуклеотида или полипептида, соответственно, но сохраняет необходимые (ферментативные) свойства референсного полинуклеотида или полипептида. Типичный вариант полинуклеотида отличается по нуклеотидной последовательности от другого, референсного полинуклеотида. Изменения в нуклеотидной последовательности варианта могут менять или не менять аминокислотную последовательность полипептида, кодируемую референсным полинуклеотидом. Результатом изменений нуклеотидной последовательности могут быть аминокислотные замены, добавления, делеции, слияния и укорочения в полипептиде, кодируемом референсной последовательностью, как будет рассмотрено ниже. Типичный вариант полипептида отличается по аминокислотной последовательности от другого, референсного полипептида. Как правило, набор различий ограничен, поэтому последовательности референсного полипептида и варианта в целом очень схожи и во многих участках идентичны. Аминокислотные последовательности варианта и референсного полипептида могут различаться одной или несколькими заменами, одним или несколькими добавлениями, делециями в любой комбинации. Замененным или встроенным аминокислотным остатком может быть или не быть остаток, кодируемый генетическим кодом. Вариант полинуклеотида или полипептида может существовать в природе, как например, аллельный вариант, или он может представлять собой вариант, о существовании которого в природе не известно. Неизвестные в природе варианты полинуклеотидов и полипептидов могут быть созданы методами мутагенеза, методами прямого синтеза и другими методами с использованием рекомбинантной технологии, известными специалистам в данной области техники.
В молекуле рекомбинантной нуклеиновой кислоты нуклеотидная последовательность, кодирующая фукозилтрансферазу, ее функциональный вариант, функциональный фрагмент фукозилтрансферазы или функциональный вариант функционального фрагмента, функционально связана по меньшей мере с одной нуклеотидной последовательностью, которая опосредует и/или регулирует экспрессию фукозилтрансферазы, ее варианта или фрагмента, при условии, что данная молекула рекомбинантной нуклеиновой кислоты присутствуете клетке.
Термин "функционально связанный", использованный в данном описании, относится к функциональной связи между контрольной последовательностью экспрессии нуклеиновой кислоты (такой как промотор, оператор, энхансер, регулятор, ряд сайтов связывания транскрипционных факторов, терминатор транскрипции, сайт связывания рибосомы) и второй нуклеотидной последовательностью, причем данная контрольная последовательность экспрессии оказывает влияние на транскрипцию и/или трансляцию нуклеиновой кислоты, соответствующей второй нуклеотидной последовательности. Соответственно, термин "промотор" обозначает последовательности ДНК, которые обычно "предшествуют" гену в полимерной молекуле ДНК и предоставляют сайт инициации транскрипции в матричную РНК (мРНК). "Регуляторные" последовательности ДНК, обычно также расположенные "вверх по течению от" гена (т.е. предшествующие гену) в указанной полимерной молекуле ДНК, связывают белки, которые определяют частоту (или степень) инициации транскрипции. Совместно именуемые как "промоторная/регуляторная" или "контрольная" последовательность ДНК, эти последовательности, которые предшествуют выбранному гену (или серии генов) в функциональной полимерной молекуле ДНК, действуют совместно в отношении определения того, будет ли происходить транскрипция (и возможно экспрессия) гена. Последовательности ДНК, которые "следуют" за геном в полимерной молекуле ДНК и обеспечивают наличие сигнала терминации транскрипции в мРНК, называются последовательностями "терминатора" транскрипции.
Для получения полипептидов по изобретению может быть использовано большое разнообразие экспрессирующих систем. Такие системы включают, среди прочих, векторы на основе хромосом, эписом и вирусов, например, векторы, происходящие из бактериальных плазмид, из бактериофагов, из транспозонов, из эписом дрожжей, из инсерционных элементов, из хромосомных элементов дрожжей, из вирусов, и векторы, происходящие из их комбинаций, как например, векторы, происходящие из генетических элементов плазмид и бактериофагов, таких как космиды и фагмиды. Конструкции экспрессирующих систем могут содержать контрольные участки, которые регулируют, а также вызывают экспрессию. Как правило, в этом отношении для экспрессии могут быть использованы любая система или вектор, подходящие для сохранения, увеличения количества или экспрессии полинуклеотидов и для синтеза полипептида в клетке хозяина. Соответствующую последовательность ДНК можно встроить в экспрессирующую систему любым из множества хорошо известных и рутинных методов, таких как, например, приведенные в работе Sambrook и др., выше. Соответственно, молекула нуклеиновой кислоты, подходящая для экспрессии гетерологичной фукозилтрансферазы в генетически модифицированной клетке, выбрана из группы, состоящей из плазмид, фагмид, космид, искусственных бактериальных хромосом (ВАС) и искусственных хромосом дрожжей (YAC).
Согласно четвертому аспекту предложены фукозилтрансферазы, способные переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза.
Фукозилтрансферазы имеют бактериальное происхождение. Фукозилтрансферазы можно использовать для синтеза фукозилированных олигосахаридов, предпочтительно сложных фукозилированных НМО на основе лактозы, LNT и/или LNnT или других олигосахаридов. Фукозилированным олигосахаридом является лактофукопентаоза.
Фукозилтрансферазы способны переносить остаток фукозы с донорного субстрата, предпочтительно ГДФ-фукозы, на акцепторную молекулу. В предпочтительном воплощении акцепторной молекулой является лактотетраоза, предпочтительно LNT и/или LNnT.
В дополнительном и/или альтернативном воплощении фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных вариантов полипептидов, представленных любой из SEQ ID NO: 16-30, функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30, и функциональных вариантов функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 16-30.
Не было описано, что фукозилтрансферазы, которые представлены любой из последовательностей с SEQ ID NO: 16-30, являются фукозилтрансферазами, способными переносить остаток фукозы с донорного субстрата на лактотетраозу как на акцепторный субстрат. Новые фукозилтрансферазы, которые представлены любой из последовательностей с SEQ ID NO: 16-27, ранее даже не были описаны как собственно фукозилтрансферазы, т.е. несмотря на их акцепторной молекулы.
Фукозилтрансферазы, описанные в данной заявке ранее, можно использовать для получения сложных фукозилированных олигосахаридов либо способом ферментации с применением цельных клеток, например, как описано в данной заявке ранее, либо посредством биокатализа in vitro. Поэтому, согласно пятому аспекту предложено применение по меньшей мере одной из фукозилтрансфераз, способных переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза, для получения фукозилированного олигосахарида.
В дополнительном и/или альтернативном воплощении фукозилтрансферазы, описанные в данной заявке ранее, используют для синтеза сложных фукозилированных НМО методом биокатализа in vitro.
Использование по меньшей мере одной из новых фукозилтрансфераз в способе биокатализа in vitro включает добавление подходящего донорного субстрата, содержащего остаток фукозы, предпочтительно ГДФ-фукозы, и подходящей акцепторной молекулы по меньшей мере к одной из новых фукозилтрансфераз в растворителе и в условиях, подходящих для переноса с участием фукозилтрансферазы остатка фукозы с донорного субстрата на акцепторную молекулу, в результате чего осуществляется синтез фукозилированного олигосахарида. Предпочтительно, подходящая акцепторная молекула представляет собой лактотетраозу, более предпочтительно LNT или LNnT. При использовании лактотетраозы в качестве акцепторной молекулы продуктом реакции с участием фукозилтрансферазы в реакции биокатализа in vitro является лактофукопентаоза. Указанной лактофукопентаозой предпочтительно является один из пентасахаридов, выбранный из группы, состоящей из лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-неофукопентаозы III, лакто-N-фукопентаозы V и лакто-N-неофукопентаозы V.
Согласно шестому аспекту предложен способ получения фукозилированных олигосахаридов, предпочтительно фукозилированных олигосахаридов грудного молока, более предпочтительно, сложных олигосахаридов грудного молока, наиболее предпочтительно лактофукопентаозы, методом биокатализа in vitro, в котором используют фукозилтрансферазу, при этом указанная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу.
В одном из воплощений биокатализа in vitro данный способ включает стадии
a) предоставления фукозилтрансферазы, способной переносить остаток фукозы с донорного субстрата на акцепторную молекулу, в реакционную смесь;
b) приведения в контакт указанной фукозилтрансферазы с донорным субстратом, содержащим остаток фукозы, и акцепторной молекулой, при этом указанной акцепторной молекулой является лактотетраоза, для синтеза фукозилированного олигосахарида.
Это воплощение предусматривает предоставление в реакционную смесь фукозилтрансферазы. Термин "фукозилтрансфераза", использованный в данном описании, также включает в себя функциональные варианты, функциональные фрагменты указанной фукозилтрансферазы и функциональный вариант фрагментов фукозилтрансферазы, при этом "функциональный" означает, что указанные варианты и фрагменты могут обладать фукозилтрансферазной активностью, как описано в данной заявке ранее.
Способ по этому воплощению дополнительно включает приведение во взаимодействие компонентов данной смеси в условиях, подходящих для осуществления переноса остатка фукозы с донорного субстрата, предпочтительно ГДФ-фукозы, на акцепторную группировку акцепторной молекулы, при этом указанной акцепторной молекулой предпочтительно является лактотетраоза.
В дополнительном воплощении способ биокатализа in vitro дополнительно включает последующую очистку и/или последующее выделение фукозилированной акцепторной молекулы из реакционной смеси.
Согласно седьмому аспекту предложены фукозилированные олигосахариды, получаемые методом ферментации с применением цельных клеток или методом биокатализа in vitro, как описано в данной заявке ранее.
В одном из воплощений фукозилированный олигосахарид представляет собой олигосахарид грудного молока. Отдельными олигосахаридами грудного молока являются 2'-фукозиллактоза, 3-фукозиллактоза, 2',3-дифукозиллактоза, 3-фукозил-3'-сиалиллактоза, 3-фукозил-6'-сиалиллактоза, лакто-N-фукопентаоза I, лакто-N-неофукопентаоза III, лакто-N-фукопентаоза V, лакто-N-неофукопентаоза I, лакто-N-неофукопентаоза V, лакто-N-дифукозилгексаоза I, лакто-N-дифукозилгексаоза II, фукозил-лакто-N-сиалилпентаоза b, фукозил-лакто-N-сиалилпентаоза с, лакто-N-неодифукогексаоза I, дисиалил-лакто-N-фукопентаоза V и фукозил-пара-лакто-N-гексаоза IV. Структуры отдельных олигосахаридов грудного молока показаны в Таблице 2.
В одном из воплощений фукозилированный олигосахарид, который может быть получен с применением фукозилтрансферазы, описанной в данной заявке ранее, выбран из группы, состоящей из пентасахаридов, предпочтительно выбранных из группы, состоящей из лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-неофукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы V.
Несмотря на то, что лактофукопентаозы, упомянутые в предыдущем абзаце, представляют собой продукты прямой реакции ферментативного действия фукозилтрансферазы, описанной в данной заявке ранее, указанные лактофукопентаозы могут подвергаться дальнейшей обработке. Например, указанные лактофукопентаозы могут быть предложены в качестве акцепторных молекул для других гликозилтранефераз, поэтому полученные гексаозы, например, гексаозы из Таблицы 2, и гептаозы также можно рассматривать как фукозилированные олигосахариды, которые могут быть получены с применением фукозилтрансфераз, описанных в данной заявке. Кроме того, можно предусмотреть, чтобы фукозилтрансферазы также можно было использовать при получении трисахаридов и/или тетрасахаридов, таких как те, которые указаны в Таблице 2.

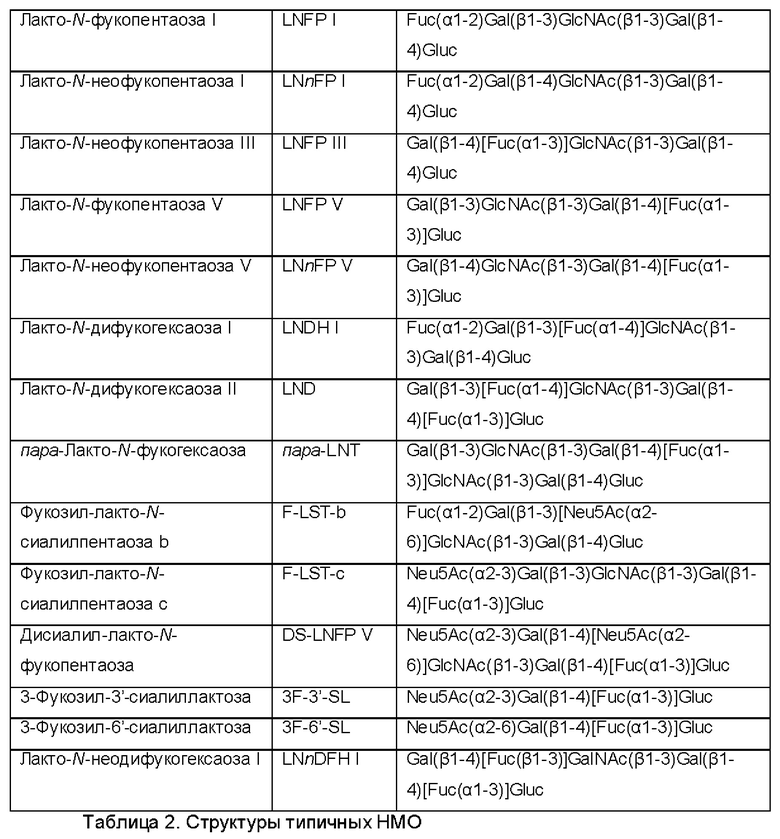
Согласно восьмому аспекту предложено применение фукозилированного олигосахарида, получаемого методом ферментации с применением цельных клеток или методом биокатализа in vitro, как описано в данной заявке ранее, для приготовления пищевой композиции. Указанная пищевая композиция содержит по меньшей мере один фукозилированный олигосахарид, полученный способом, описанным в данной заявке ранее.
Таким образом, согласно девятому аспекту предложена пищевая композиция, содержащая по меньшей мере один фукозилированный олигосахарид, полученный способом, описанным в данной заявке ранее. По меньшей мере один фукозилированный олигосахарид представляет собой лактофукопентаозу. По меньшей мере одна лактофукопентаоза в пищевой композиции выбрана из группы, состоящей из лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-неофукопентаозы III, лакто-N-фукопентаозы V и лакто-N-неофукопентаозы V.
В дополнительном воплощении пищевая композиция выбрана из группы, состоящей из лекарственных композиций, композиций для грудных детей и пищевых добавок.
Пищевая композиция может быть представлена в жидкой форме или в твердой форме, включая, но не ограничиваясь этим, порошки, гранулы, хлопья и пеллеты.
Настоящее изобретение будет описано применительно к конкретным воплощениям и со ссылкой на графические материалы, однако данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины "первый", "второй" и тому подобное в описании и в формуле изобретения используются для различения схожих элементов и необязательно для описания последовательности либо во времени, либо в пространстве, либо при ранжировании, либо для описания любым другим образом. Следует понимать, что используемые таким образом термины являются взаимозаменяемыми при соответствующих обстоятельствах, и что воплощения изобретения, описанные в данной заявке, могут работать в других последовательностях, чем изложено или проиллюстрировано в данном описании.
Нужно отметить, что термин "содержащий", использованный в формуле изобретения, не следует интерпретироваться как термин, ограниченный перечисленными ниже средствами; он не исключает другие элементы или стадии. Таким образом, его следует интерпретировать как термин, конкретизирующий наличие указанных признаков, целых чисел, стадий или компонентов, которые упомянуты, но не исключающий наличия или добавления одного или нескольких других признаков, целых чисел, стадий или компонентов либо их групп. Таким образом, объем выражения "устройство, содержащее средства А и В" не следует ограничивать устройствами, состоящими только из компонентов А и В. Применительно к настоящему изобретению это означает, что единственными релевантными компонентами данного устройства являются А и В.
Упоминание по всему этому описанию "одного из воплощений" или "какого-либо воплощения" означает, что по меньшей мере в одно воплощение настоящего изобретения включены конкретный признак, конкретная структура или конкретное характерное свойство, описанные вместе с данным воплощением. Таким образом, случаи появления в различных местах по всему данному описанию фраз "в одном из воплощений" или "в воплощении" не обязательно относятся, но могут относиться, все к одному и тому же воплощению. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или нескольких воплощениях, как будет очевидно специалисту средней квалификации в данной области техники из этого описания.
Аналогичным образом, должно быть очевидно, что в описании типичных воплощений изобретения различные признаки изобретения иногда сгруппированы вместе в одном воплощении, на одном чертеже или его описании с целью оптимизации описания и помощи в понимании одного или более чем одного из различных аспектов изобретения. Этот способ описания, однако, не следует интерпретировать как отражение намерения, что заявляемое изобретение требует большего количества признаков, чем явно указанные в каждом пункте формулы изобретения. Скорее, как отражено следующей далее формулой изобретения, аспекты изобретения заключаются не во всех признаках одного описанного выше воплощения. Таким образом, формула изобретения, приведенная после подробного описания, тем самым явно включена в это подробное описание, причем каждый пункт формулы изобретения существует сам по себе как отдельное воплощение данного изобретения.
Кроме того, хотя некоторые воплощения, описанные в данной заявке, включают в себя некоторые, но не другие признаки, включенные в другие воплощения, подразумевается, что комбинации признаков различных воплощений находятся в пределах объема изобретения и образуют различные воплощения, как будет понятно специалистам в данной области техники. Например, в приведенной далее формуле изобретения любое из заявляемых воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данной заявке как способ или комбинация элементов способа, который может быть реализован с использованием процессора компьютерной системы или другого средства выполнения функции. Таким образом, процессор с необходимыми инструкциями для выполнения такого способа или элемента способа образует средство для осуществления способа или элемента способа. Кроме того, описанный в данной заявке элемент воплощения устройства представляет собой пример средства для осуществления функции, выполняемой элементом с целью осуществления изобретения.
В описании и графических материалах, представленных в данной заявке, приведены многочисленные конкретные подробности. Однако очевидно, что воплощения изобретения могут быть осуществлены на практике без этих конкретных подробностей. В других случаях общеизвестные способы, структуры и методы не показаны подробно, чтобы не затруднять понимание этого изобретения.
Теперь данное изобретение будет описано посредством подробного описания нескольких воплощений изобретения. Очевидно, что в соответствии со знаниями специалистов в данной области техники могут быть созданы другие воплощения изобретения без отклонения от истинной сущности или технического учения изобретения, при этом изобретение ограничено только условиями прилагаемой формулы изобретения.
Пример 1. Идентификация фукозилтрансфераз, фукозилирующих лакто-N-тетраозу и лакто-N-неотетраозу
Проводили обзор базы данных GenBank на предмет предполагаемых фукозилтрансфераз, кодируемых в геноме бактерий различных видов. Благодаря этому подходу выявили сто двадцать пять предполагаемых фукозилтрансфераз, которые ранее не были аннотированы как фукозилтрансферазы.
Гены, кодирующие предполагаемые фукозилтрансферазы (fucT), были оптимизированы по кодонам для экспрессии в Е. coli, и их приобретали у GenScript Cooperation (Piscataway, USA). Гены фукозилтрансфераз субклон провали путем сиквенс-независимого безлигазного клонирования (SLIC) в вектор pINT-malE-zeo вниз по течению от гена malE, кодирующего мальтоза-связывающий белок (МВР) и позволяющего синтезировать слитый с МВР белок (Фиг. 1), с использованием праймеров 2700 и 2702 для амплификации генов fucT и праймеров 2701 и 2703 для амплификации pINT-malE-zeo (использованные олигонуклеотидные праймеры приведены в Таблице 3).
Гены fucT экспрессировали в Е. coli ER 2508 (New England Biolabs, Ipswich, USA). Гены, кодирующие альфа-1,2-фукозилтрансферазы wbgL из Е. coli O126 и fucT2Hp из Helicobacter pylori, также были оптимизированы по кодонам для экспрессии в Е. coli , их также приобретали у GenScript Cooperation и клонировали с использованием сайтов для Ncol и BamH1 в вектор pACYC (Novagen, Merck, Darmstadt, Germany) под транскрипционный контроль промотора Т7. WbgL и fucT2Hp амплифицировали, используя олигонуклеотиды 141 и 142 и 143 и 144, соответственно. Вектор, а также продукты ПЦР (полимеразная цепная реакция) амплификации подвергали расщеплению с использованием эндонуклеаз рестрикции Ncol и BamH1 и лигировали. Отбирали трансформанты E.coli на хлорамфениколе. WbgL и fucT2HP экспрессировали в Е. coli BL21(DE3) ΔlacZ (использованные в этой работе бактериальные штаммы приведены в Таблице 4).

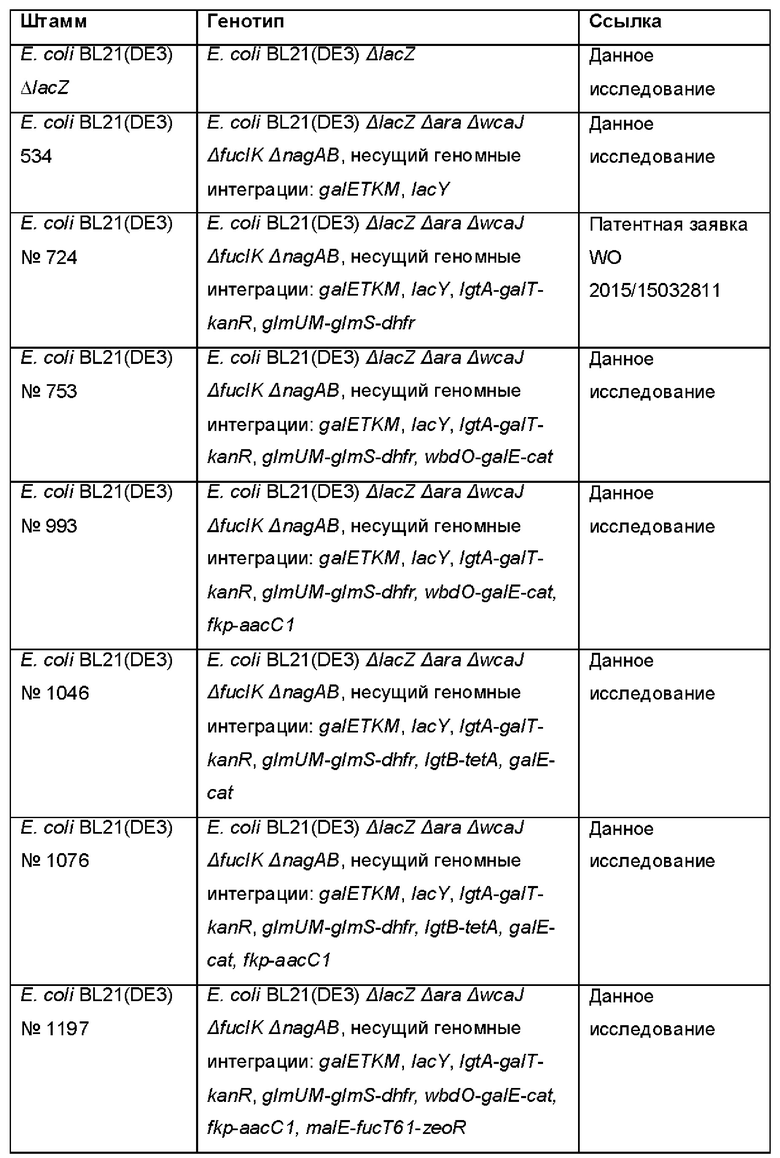
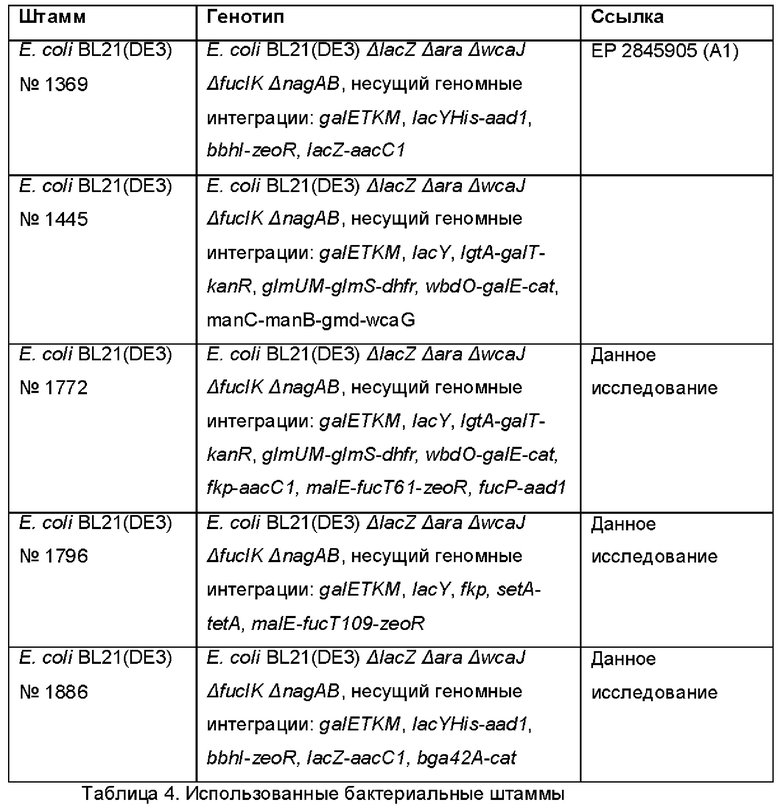
Штамм Е. coli ER 2508, содержащий плазмиды pINT-malE-fucT-zeo, выращивали на питательной среде 2YT (двукратный дрожжевой экстракт-триптон) (Sambrook и др., 1989, выше), содержащей ампициллин (100 мкг/мл) и зеоцин (40 мкг/мл), до значения оптической плотности при 600 нм (OD600 нм), составляющего 0,3, после чего индуцировали экспрессию генов malE-fucT, добавляя ангидротетрациклин (200 мкг/мл). Штамм Е. coli BL21(DE3) ΔlacZ, несущий pACYC-wbgL или pACYC-fucT2Hp, выращивали на питательной среде 2YT, содержащей хлорамфеникол (34 мкг/мл). После достижения OD600 нм, равной 0,3, экспрессию индуцировали 0,3 мМ IPTG. По окончании 16 ч инкубации при 30°С клетки собирали центрифугированием.
Клетки вскрывали механически, используя стеклянные шарики. Бесклеточные экстракты экспрессирующих клонов, содержащие белок в одинаковой концентрации, инкубировали в течение 22 ч при 37°С в 100 мкл смеси реагентов для анализов фукозилтрансферазной активности. Такие смеси реагентов для анализов содержали 5 мМ ГДФ-L-фукозу, 5 мМ LNT или LNnT и 1 мМ АТФ в 20 мМ Трис/HCI, рН 7,4, с 200 мМ NaCI.
Образование фукозилированной LNT или LNnT определяли посредством тонкослойной хроматографии (TLC), используя TLC-пластинки с силикагелем (Silica Gel 60 F254 (Merck KGaA, Darmstadt, Germany)). В качестве подвижной фазы использовали смесь бутанол:ацетон:уксусная кислота:H2O (35/35/7/23 (об./об./об./об.)). Для обнаружения разделяемых веществ TLC-пластинки пропитывали реагентом на основе тимола (0,5 г тимола, растворенного в 95 мл этанола с добавлением 5 мл серной кислоты) и нагревали.
Кроме того, образование продукта отслеживали и его идентификацию выполняли с использованием масс-спектрометрии. Масс-спектрометрический анализ проводили, применяя режим мониторинга множественных реакций (MRM), с использованием системы детектирования на основе жидкостного хромато-масс-спектрометра с тройным квадруполем (LC Triple-Quadrupole MS) (LC-MS 8050 от Shimadzu) (Shimadzu Corporation, Kyoto, Japan). В квадруполе 1 (Q1) осуществляется отбор и анализ родительских ионов, фрагментация происходит в ячейке соударений с использованием аргона в качестве инициирующего столкновительную диссоциацию газа (CID gas), отбор фрагментированных ионов производится в квадруполе 3 (Q3). В Таблице 5 приведены отобранные переходы и значения энергии соударений (СЕ) для промежуточных соединений и метаболитов конечного продукта. Хроматографическое разделение лактозы, LNT-II, LNT и вариантов LNFP после разбавления культурального супернатанта, не содержащей частиц биокаталитической реакционной смеси или неочищенного экстракта, соответственно, 1:50 или 1:100 в H2O (со степенью чистоты для LC/MS), выполняли на колонке для HPLC XBridge Amide (3,5 мкм; 2,1 × 50 мм (Waters, USA)). Перед проведением анализов с использованием LC/MS проводили подготовку образцов, применяя фильтрование (размер пор 0,22 мкм) и очищая твердофазной экстракцией на ионообменной матрице (Strata ABW, Phenomenex). Система HPLC состоит из автосэмплера Nexera Х2 SIL-30ACMP от Shimadzu, функционирующего при 8°С, насоса LC-20AD от Shimadzu и термостата для колонок СТО-20АС от Shimadzu, который функционировал при 35°С (Shimadzu Corporation, Kyoto, Japan). Подвижная фаза состояла из смеси ацетонитрил:H2O с 0,1% (об./об.) гидроксида аммония. Образец объемом 1 мкл вводили в прибор; хроматографическое разделение проводили в течение 5,00 мин при скорости потока 300 мкл/мин. Все метаболиты анализировали с использованием метода MRM в режиме отрицательной ионизации электрораспылением (ESI). Для работы использовали масс-спектрометр с единичным разрешением. Энергию соударений, задаваемое смещение (pre bias) для Q1 и Q3 оптимизировали индивидуально для каждого аналита. Методы количественного определения выполняли с использованием имеющихся в продаже стандартов (Carbosynth, Compton, UK и Elicityl, Crolles, France).
Варианты LNFP, основанные на фукозилировании промежуточной лакто-N-тетраозы (LNT), могут быть идентифицированы с использованием хроматографического разделения (2,4 мин в случае LNFP-I и 2,5 мин в случае LNFP-V). Незначительно различающиеся времена удерживания обусловлены различием в типе фукозилирования LNT (альфа-1,2-фукозилирование галактозы в случае LNFP-I; альфа-1,4-фукозилирование N-ацетилглюкозамина в случае LNFP-II и альфа-1,3-фукозилирование глюкозы в случае LNFP-V). Помимо этого, их можно идентифицировать на основании соответствующей им картины переходов (см. Таблицу 5), исходя из специфических картин фрагментации, связанных с положением места фукозилирования.
Варианты LNnFP, основанные на различии в положении фукозилирования (альфа-1,2-фукозилирование галактозы в случае LNnFP-I, альфа-1,3-фукозилирование N-ацетилглюкозамина в случае LNnFP-III и глюкозы в случае LNnFP-V) промежуточной лакто-N-неотетраозы (LNnT), могут быть идентифицированы с использованием хроматографического разделения (Фиг. 2а). Помимо этого, их можно идентифицировать на основании соответствующей им картины переходов (см. Таблицу 5), исходя из специфических картин фрагментации, связанных с положением места фукозилирования.
LNnFP-III и LNnFP-V характеризуются лишь незначительным различием во времени удерживания, составляющим 0,1 мин. Анализ ферментативных реакций in vitro с использованием α-1,3-фукозилтрансферазы FucT109 продемонстрировал наличие смеси LNnFP-III и LNnFP-V (см. Фиг. 2b).
В Таблице 6 суммированы данные для фукозилтрансфераз, протестированных в отношении получения фукопентаоз и обнаруженных продуктов биокаталитических реакций в случае использования LNT и LNnT в качестве гликанового субстрата, соответственно.
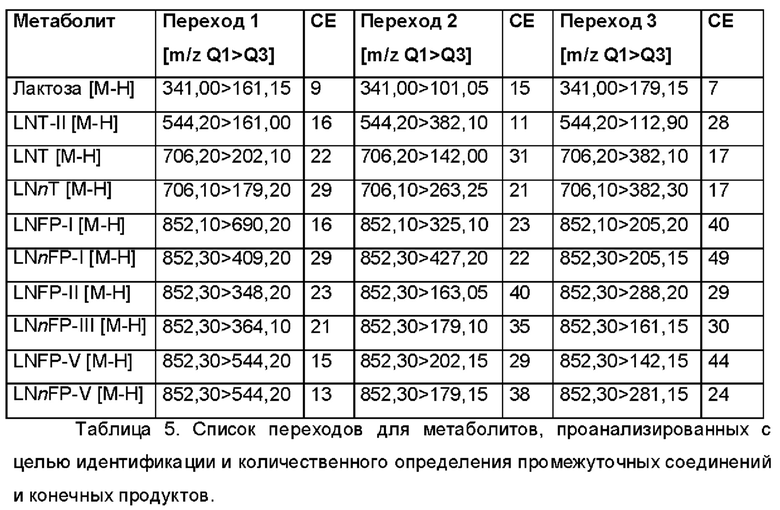
Пример 2. Разработка штамма Е. coli, продуцирующего лакто-N-триозу II Для конструирования штамма, продуцирующего лакто-N-триозу II (LNT-2), использовали Escherichia coli BL21(DE3). Конструирование пути обмена веществ включало мутагенез и делетирование определенных генов, соответственно, и интегрирование в геном гетерологичных генов. Гены lacZ и araA инактивировали посредством мутагенеза с использованием ошибочно спаривающихся олигонуклеотидов.
Делетирование участков генома осуществляли в соответствии со способом Datsenko и Warner. Чтобы предотвратить внутриклеточное расщепление N-ацетилглюкозамина, гены, кодирующие N-ацетилглюкозамин-6-фосфат-деацетилазу (nagA) и глюкозамин-6-фосфат-дезаминазу (nagB), были делетированы из генома штамма BL21 (DE3) Е. coli. Также были делетированы гены wzxC-wcaJ. Ген wcaJ кодирует УДФ-глюкоза:ундекапренилфосфат-глюкозо-1-фосфат-трансферазу, катализирующую первую стадию синтеза колановой кислоты. Помимо этого, удаляли гены fucl и fucK, кодирующие L-фукозоизомеразу и L-фукулозокиназу, соответственно.
Интегрирование в геном гетерологичных генов выполняли посредством транспозиции. Для транспозиции использовали либо транспозазу EZ-Tn5™ (Epicenter, USA) для интегрирования фрагментов линейной ДНК, либо высокоактивную С9-мутантную форму транспозазы mariner Himar1. Чтобы получить EZ-Tn5 транспосомы, представляющий интерес ген вместе с маркером устойчивости к антибиотикам, фланкированным FRT-сайтами, амплифицировали, используя праймеры 1119 и 1120; полученный ПЦР-продукт нес на обоих концах состоящие из 19 пар оснований (п.о.) мозаичные концы - сайты распознавания для транспозазы EZ-Tn5. Для интегрирования с использованием транспозазы Himarl представляющие интерес экспрессирующие конструкции (опероны) аналогичным образом клонировали вместе с маркером устойчивости к антибиотикам, фланкированным FRT-сайтами, в вектор pEcomar. Вектор pEcomar кодирует высокоактивную С9-мутантную форму транспозазы mariner Himarl под контролем арабинозного индуцибельного промотора ParaB. Экспрессируемый фрагмент <Ptet-IacY-FRT-aaaW-FRT> (SEQ ID NO: 31) интегрировали посредством использования транспозазы EZ-Tn5. После успешного интегрирования гена импортера лактозы LacY из Е. coli K12 TG1 (№ доступа ABN72583) ген устойчивости удаляли из стрептомицин-устойчивых клонов под действием рекомбиназы FLP (флиппазы), кодируемой плазмидой. Штамм, полученный в результате этих модификаций, был назван штаммом №534. Ген N-ацетилглюкозамин-гликозилтрансферазы IgtA из Neisseria meningitidis МС58 (№ доступа NP_274923) был оптимизирован по кодонам для экспрессии в Е. coli и получен методом синтеза генов. Вместе с геном galT, кодирующим галактозо-1-фосфат-уридилилтрансферазу из Е. coli K-12 substr. MG1655 (№ доступа NP_415279), который получали аналогичным образом методом синтеза генов, выполняли встраивание гена IgtA посредством транспозиции (SEQ ID NO: 32) с использованием плазмиды pEcomar-IgtA-gaIT. Для усиления синтеза УДФ-N-ацетилглюкозамина de novo гены, кодирующие L-глутамин:D-фруктозо-6-фосфат-аминотрансферазу (glmS), фосфоглюкозамин-мутазу из Е. coli K-12 substr. MG1655 (glmM) и N-ацетилглюкозамин-1-фосфат-уридилтрансферазу/глюкозамин-1-фосфат-ацетилтрансферазу (glmU) из Е. coli K12 substr. MG1655 (№№ доступа NP_418185, NP_417643, NP_418186, соответственно), были оптимизированы по кодонам и получены методом синтеза генов. Оперон glmUM клонировали под контролем конститутивного тетрациклинового промотора Ptet, тогда как glmS клонировали под контролем конститутивного промотора PT5. Транспозонную кассету <Ptet-g/mUM-PT5-glmS-FRT-dhfr-FRT> (SEQ ID NO: 33; dhfr означает дигидрофолатредуктазу), фланкированную инвертированными концевыми повторами, специфично распознаваемыми mariner-подобным элементом транспозазы Himarl, встраивали из pEcomar-glmUM-glmS, получая продуцирующий лакто-N-триозу 2 штамм (№724). Штамм Е. coli BL21(DE3) использовали в качестве исходного штамма-хозяина для разработки продуцирующего штамма Е. coli.
Пример 3. Конструирование штамма Е. coli с целью скрининга фукозилтрансфераз in vivo для получения фукозилированной LNT
Ген 1,3-галактозилтрансферазы wbdO из Salmonella salamae (№ доступа AAV34525) был оптимизирован по кодонам для экспрессии в Е. coli и получен путем синтеза компанией GenScript Cooperation. Ген galE амплифицировали, основываясь на геномной ДНК из Е. coli K12. Оба гена встраивали в виде транспозона <Ptet-wbdOcoPT5galE-FRT-cat-FRT> (SEQ ID NO: 34) в штамм №724 посредством транспозиции с использованием плазмиды pEcomar-wbdO-galE. Полученный штамм представляет собой штамм №753. Для усиления поступления ГДФ-фукозы бифункциональную фукозокиназу/L-фукозо-1-фосфат-гуанилтранеферазу (fkp) из Bacteroides fragilis (№ доступа AY849806), катализирующую превращение L-фукозы в ГДФ-фукозу, сверхэкспрессировали в штамме Е. coli BL21 (DE3). Слияние гена fkp (который изначально амплифицировали, основываясь на геномной ДНК из Bacteroides fragilis (АТСС 25285D)), вместе с расположенным перед ним промотором Ptet, с геном устойчивости к гентамицину, фланкированным lox-сайтами, осуществляли, используя присоединение посредством ПЦР с перекрывающимися праймерами (SOE-ПЦР) и праймеры 1119 и 1120; полученный транспозон EZ-Tn5 <Ptet-fkp-lox-аасС1-lox> (SEQ ID NO: 35) интегрировали в штамм E.coli BL21(DE3) с применением транспозазы EZ-Tn5™, получая штамм №993. Альтернативно, чтобы осуществить синтез ГДФ-L-фукозы de novo, гены, кодирующие фосфоманномутазу (тапВ), маннозо-1-фосфат-гуанозилтрансферазу (тапС), ГДФ-маннозо-4,6-дегидратазу (gmd) и ГДФ-L-фукозо-синтазу (wcaG) из Е. coli K12 DH5α, сверхэкспрессировали в штамме E.coli BL21(DE3); оперон manCB помещали под контроль конститутивного промотора Ptet, оперон gmd, wcaG транскрибируется, также начиная с конститутивного промотора PT5. Транспозонную кассету <Ptet- manCB-PT5-gmd, wcaG-FRT-aacC1-FRT> (SEQ ID NO: 36), включающую в себя ген аасС1, придающий бактериальному хозяину устойчивость к гентамицину, фланкировали инвертированными концевыми повторами, специфично распознаваемыми mariner-подобным элементом транспозазы Himarl. Кассету встраивали в геном штамма №753 из плазмиды pEcomar C9-manCB-gmd, wcaG-аасС1, получая штамм №1445.
Пример 4. Конструирование штамма Е. coli с целью скрининга фукозилтрансфераз in vivo для получения фукозилированной LNnT
Ген β-1,4-галактозилтрансферазы IgtB из Neisseria meningitidis (№ доступа AAF42257) был оптимизирован для экспрессии в Е. coli и получен путем синтеза компанией GenScript Cooperation. Вместе с геном устойчивости к тетрациклину, фланкированным FRT-сайтами, его встраивали в виде транспозона <PT5-lgtB-FRT-tetA-FRT> (SEQ ID NO: 37) в штамм №724 посредством транспозиции с использованием плазмиды pEcomar-lgtB. Ген galE амплифицировали, основываясь на геномной ДНК из Е. coli K12, и осуществляли слияние посредством SOE-ПЦР с промотором Ptet и геном устойчивости к хлорамфениколу. Используя праймеры, которые образуют состоящие из 19 п. о. мозаичные концы - сайты распознавания для транспозазы EZ-Tn5 (праймеры 2194 и 2235), конструировали EZ-транспозон <Ptet-galE-FRT-cat-FRT>, предназначенный для интегрирования в штамм Е. coli BL21(DE3), получая штамм №1046. Альтернативно, в штамм №724 интегрировали ген β-1,4-галактозилтрансферазы 1ех1 из Aggregatibacter aphrophilus NJ8700 (№ доступа YP_003008647), полученный путем синтеза и оптимизированный по кодонам для Е. coli. Осуществляли сияние гена 1ех1 с геном malE, кодирующим мальтоза-связывающий белок (МВР), получая слитую с N-конца конструкцию МВР с Lex1. Слитую конструкцию malE-lex1 интегрировали совместно с galE (SEQ ID NO: 38) под транскрипционный контроль промотора Ptet посредством транспозиции с применением pEcomar-malE-lex1-galE-cat. Используя EZ-фрагмент EZ-Tn5 <Ptet- fkp-FRT-aacC1-FRT> (см. пример 3), ген, кодирующий фукозокиназу/L-фукозо-1-фосфат-гуанилтрансферазу (fkp) из Bacteroides fragilis, интегрировали в хромосому штамма №1046, получая штамм №1076.
Пример 5. Скрининг in vivo фукозилтрансфераз, фукозилирующих LNT и LNnT
Среда с минеральными солями, использованная для культивирования штаммов с целью синтеза фукопентаоз, содержала: NH4H2PO4 - 7 г/л, K2HPO4 - 7 г/л, KOH - 2 г/л, лимонную кислоту - 0,3 г/л, MgSO4 × 7H2O - 2 г/л и CaCl2 × 6H2O - 0,015 г/л, вместе с раствором микроэлементов из расчета 1 мл/л (содержащим лимоннокислое аммиачное железо - 54,4 г/л, MnCl2 × 4H2O - 9,8 г/л, CoCl2 × 6H2O - 1,6 г/л, CuCl2 × 2H2O - 1 г/л, Н3BO3 - 1,9 г/л, ZnSO4 × 7H2O - 9 г/л, Na2MoO4 × 2H2O -1,1 г/л, Na2SeO3 - 1,5 г/л, NiSO4 × 6H2O - 1,5 г/л).
Для получения фукозилированных пентасахаридов in vivo с использованием штаммов №993 или №1445 для LNT и №1076 для LNnT в качестве субстратов FucT, соответственно, применяли плазмиды pINT-malE-fucT-zeo. Содержащие плазмиды штаммы выращивали в 20 мл среды с минеральными солями (MS) с 2% глюкозы в качестве источника углерода, ангидротетрациклином (200 нг/мл) в качестве индуктора генной экспрессии и антибиотиками ампициллином (100 мкг/мл) и зеоцином (20 мкг/мл). Бактерии культивировали при 30°C в разделенных перегородками встряхиваемых колбах до значения OD600 нм, равного 0,3, после чего добавляли 3 мМ лактозу и 2 мМ L-фукозу для получения производных с использованием штаммов №993 и №1076 и 3 мМ лактозу для получения производных с использованием штамма №1445.
После культивирования в течение промежутка времени от 24 ч до 72 ч клетки собирали центрифугированием, один раз промывали в физиологическом растворе (0,9% (масс/об.) NaCl), ресуспендировали в физиологическом растворе в объеме от 150 мкл до 200 мкл (в зависимости от размера осадка после центрифугирования) и вскрывали механически, используя стеклянные шарики. После извлечения клеточного дебриса получали прозрачный супернатант.Детектирование образования фукозилированной LNT проводили, анализируя внутриклеточные метаболиты посредством TLC; результаты суммированы в Таблице 6. Для того, чтобы проанализировать образование LNFP-V под действием FucT109 из Bacteroides fragilis NTCT 9343, которая секретируется в культуральный супернатант, интактные клетки центрифугировали и супернатант подвергали анализу с использованием TLC (Фиг. 4). На Фиг. 4 показан результат TLC-анализа культуральных супернатантов продуцирующих лакто-N-фукопентаозу штаммов Е. coli, содержащих pINT-malE-fucT109-zeo. Детектирование LNFP-V в супернатанте после культивирования штаммов, экспрессирующих продукт слитого гена malE-fucT109, осуществляют путем сравнения скорости миграции с таковой для очищенного стандарта сахара. Стандарты Сахаров: линия 1: лактоза; линия 2: LNT-2; линия 3: LNT+LNFP-V; линия 4: LNT. Линия 5: образец супернатанта после культивирования штамма №993, линия 6: образец супернатанта после культивирования штамма №993 с plNT-malE-fucT109-zeo, линия 7: образец супернатанта после культивирования штамма №1445, линия 8: образец супернатанта после культивирования штамма №1445 с plNT-malE-fucT109-zeo.
Пример 6. Синтез LNFP-I ферментативным способом Интегрирование генов fucT в производные штамма Е. coli BL21(DE3)
Используя штамм №993 в качестве хозяина, в хромосому интегрировали гены, кодирующие фукозилтрансферазы FucT41 (Gramella forsetii KT0803, № доступа WP_011708479), FucT 48 (Francisella philomiragia ssp.philomiragia ATCC 25015, № доступа EET21243.1), FucT49 (Pseudogulbenkiania ferrooxidans, № доступа EEG10438.1), FucT54 (Sideroxydans lithotrophicus ES-11, № доступа ADE13114.1), FucT61 (Pseudoalteromonas haloplanktis ANT/505, № доступа EGI74693.1), FucT66 (Roseovarius nubinhibens ISM, № доступа EAP78457.1) и FucT69 (Thalassospira profundimaris WP0211, № доступа EKF09232.1). Слитый ген malE-fucT вместе с предшествующим ему промотором Ptet и геном устойчивости к зеоцину амплифицировали с использованием праймеров 1119 и 1120, применяя плазмиды pINT-malE-fucT-zeo в качестве матриц; транспозонную кассету EZ-Tn5 <Ptet-malE-fucT-zeo> встраивали в штамм Е. coli BL21(DE3), используя транспозазу EZ-Tn5™
Штаммы, несущие интегрированный элемент malE-fucT, выращивали в 96-луночных планшетах в 200 мкл MS-среды, содержащей 2% глюкозы и зеоцин (20 мкг/мл), при 30°С со встряхиванием. Через 24 ч культивирования по 50 мкл культур переносили в 400 мкл свежей MS-среды с 2% глюкозы, зеоцином (20 мкг/мл), 3 мМ лактозой и 2 мМ L-фукозой. Через 48 ч культивирования супернатанты культур анализировали посредством LC/MS. Результаты для разных генов FucT показаны на Фиг. 5, при этом значения величины ошибки показывают стандартное отклонение для пяти отдельных культур одного и того же штамма. В экспрессирующем fucT61 штамме (№1197) достигали самого высокого титра LNFP-I по сравнению со штаммами, несущими другие интегрированные элементы (Фиг. 5).
Конструирование пути импорта фукозы для получения LNFP-I
Усиленного продуцирования LNFP-I штаммом 1197 достигали в результате интегрирования главного переносчика, осуществляющего облегченный транспорт, FucP из Е. coli MG1655 (№ доступа AIZ90162). Ген FucP вместе с расположенным перед ним промотором Ptet и геном устойчивости к стрептомицину амплифицировали с использованием праймеров 1119 и 1120 (<Ptet-fucP-FRT-aad1-FRT>, SEQ ID NO: 39) и интегрировали в хромосому посредством транспозиции с использованием транспозазы EZ Тп5™. Штамм, содержащий fucT61 и fucP, получил название штамма №1772.
При выращивании штаммов №1197 и №1772 в 96-луночных планшетах в MS-среде с 2% глюкозы в качестве источника углерода в присутствии 3 мМ лактозы и 2 мМ L-фукозы концентрация LNFP-I, зафиксированная в супернатанте штамма №1772, оказалась в два раза больше таковой, обнаруженной в супернатанте штамма №1197.
Получение LNFP-I путем ферментации
Пилотную ферментацию штамма №1 772 проводили при 30°С в ферментере емкостью 3 л, содержащем 1 л MS-среды. В эту среду перед инокулированием добавляли 2% глюкозы и NH4Cl (2,5 г/л); ферментацию осуществляли без добавления антибиотиков. Значение рН поддерживали постоянным при 7,0 путем титрования 10%-ным раствором аммиака. В ферментер высевали культуры из встряхиваемых колб по достижении значения OD600 нм. равного 0,1. При значении OD600 нм, равном примерно 10, добавляли 1 мМ лактозу и 1 мМ L-фукозу; подпитку этими двумя субстратами в дозах 1-2 мМ осуществляли многократно в соответствии со скоростями роста и продуцирования. При исчерпании порции глюкозы в количестве 2% подачу глюкозы для подпитки осуществляли непрерывно из 50%-ного концентрированного раствора глюкозы. Через 87 ч культивирования значение OD600 нм в культуральной смеси достигало 185. С использованием LC/MS-анализа было установлено, что концентрация LNFP-I в культуральном супернатанте составляла 4,3 г/л. В супернатанте в качестве побочных продуктов-сахаров обнаруживали лактозу, LNT-2 и LNT (Фиг. 6). На приведенном на Фиг. 6 графике показано получение LNFP-I в Е. coli (штамм №1772) в ходе ферментации в объеме 1 л с использованием глюкозы в качестве источника углерода. Концентрации продуктов измеряли в культуральном супернатанте после ферментации в течение 87 ч. Помимо LNFP-I (4,3 г/л) в супернатанте обнаруживали лактозу (13,11 г/л), LNT-2 (4,6 г/л) и LNT (1,1 г/л).
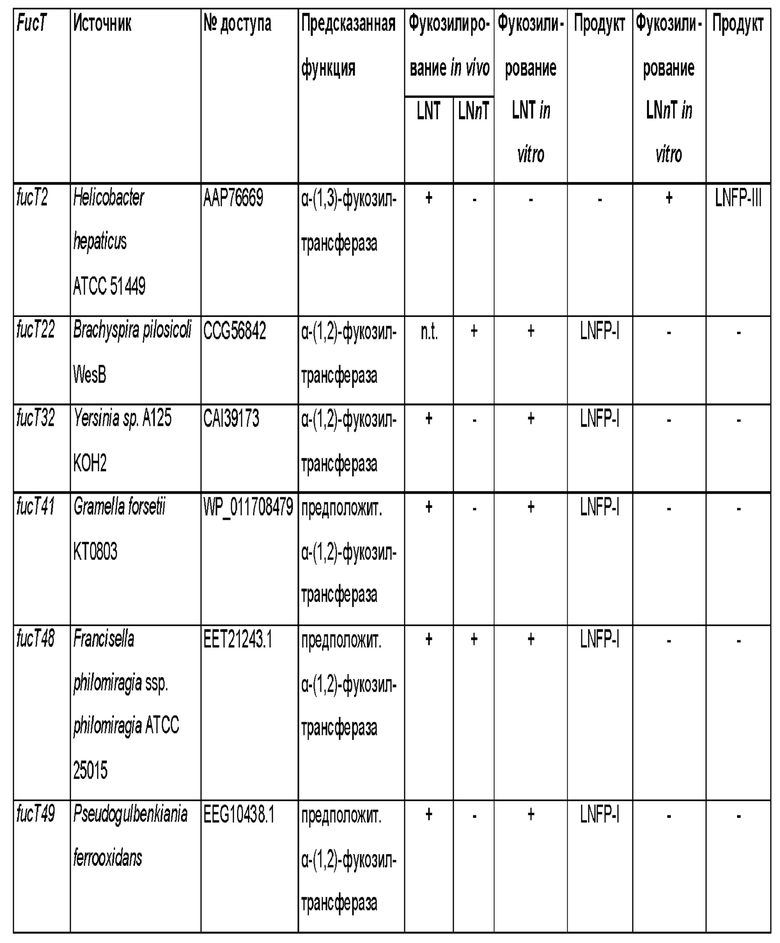
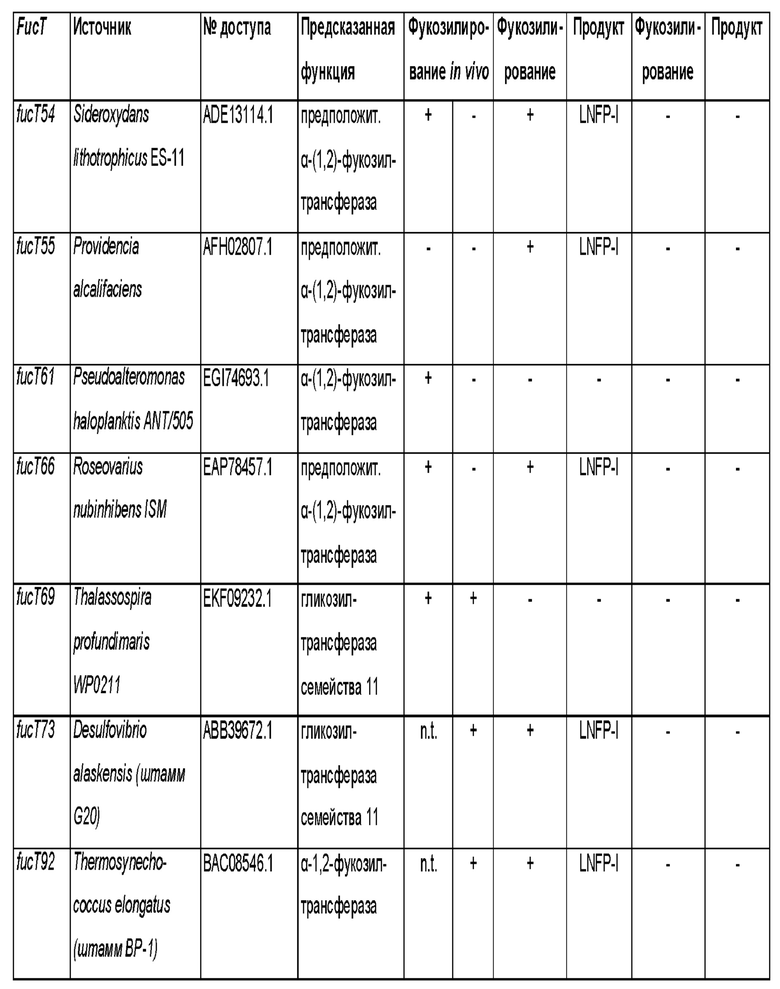
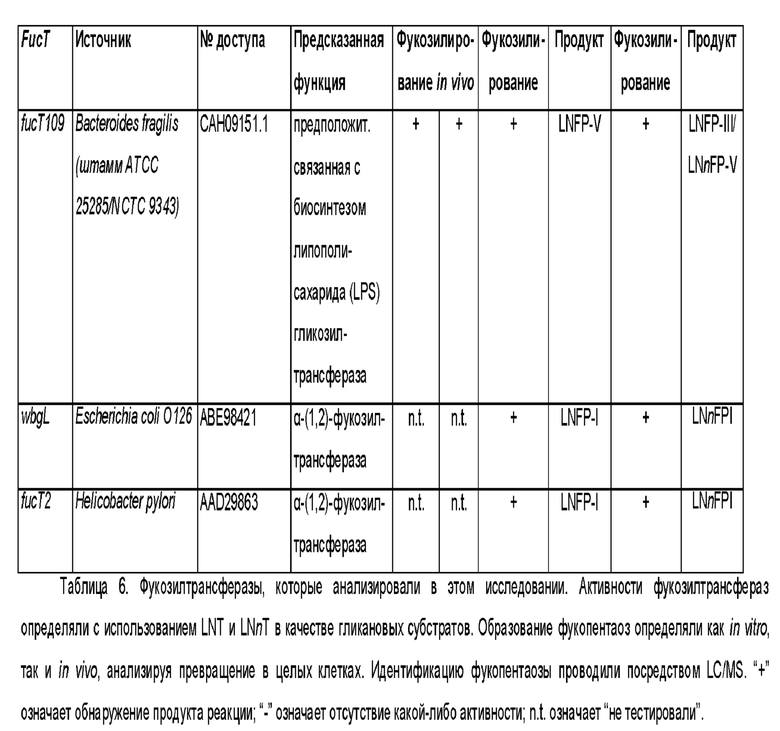
Расщепление побочных продуктов
Чтобы облегчить отделение желаемого продукта LNFP-I от побочных продуктов -лактозы, LNT-2 и LNT, эти сахара можно подвергнуть ферментативному расщеплению, и полученные продукты расщепления метаболизируются штаммами Е. coli.
β-1,4-Галактозидазы, например, LacZ из Е. coli, эффективно расщепляют лактозу до D-глюкозы и D-галактозы. Эти два моносахарида метаболизируются штаммами Е. coli, в которых экспрессируется функциональный gal-оперон.
β-N-Ацетилгексозаминидаза Bbhl из Bifidobacterium bifidum JCM1254 с высокой специфичностью и эффективностью катализирует гидролиз LNT-2 до N-ацетилглюкозамина и лактозы.
β-1,3-Галактозидаза Bga42A из Bifidobacterium longum subsp.infantis специфично катализирует гидролиз LNT до галактозы и LNT-2.
Конструирование штамма Е. coli для расщепления побочных продуктов
Штамм Escherichia coli BL21(DE3) №534 использовали для конструирования штамма со способностью к расщеплению с целью извлечения LNFP-I из супернатанта после ферментативного получения без побочных продуктов-сахаров.
Функциональный оперон galETKM вместе с его природным промотором амплифицировали на основе геномной ДНК из E.coli K12, используя олигонуклеотиды 6473 и 6474, с получением фрагмента, который содержит состоящие из 19 п. о. мозаичные 5'-концы - сайты распознавания для транспозазы EZ-Tn5. Фрагмент <galETKM> (SEQ ID NO: 40) интегрировали в геном штамма Е. coli с использованием транспозазы EZ-Tn5™. Клоны с корректно интегрированными элементами отбирали на агаре Мак-Конки (Difco, Sparks, USA), содержащем 1% галактозы, они проявлялись в виде колоний красного цвета после инкубирования в течение 36 ч при 37°С.
Ген, кодирующий β-N-ацетилгексозаминидазу Bbhl из Bifidobacterium bifidum JCM1254, был получен путем синтеза и оптимизирован по кодонам для экспрессии в E. coli. Ген Bbhl под транскрипционным контролем промотора Ptet и ген, придающий хозяину устойчивость к зеоцину (<Ptet-bbhl-zeo>(SEQ ID NO: 41)), интегрировали из плазмиды pEcomar-bbhl-zeo с использованием транспозазы Himarl.
Чтобы обеспечить полную активность β-1,4-галактозидазы, lacZ из Е. coli BL21(DE3) (№ доступа АМ946981) клонировали под транскрипционный контроль конститутивного промотора Ptet. Вместе с геном устойчивости к гентамицину аасС1 фрагмент <Ptet-lacZ-FRT-aacC1-FRT> (SEQ ID NO: 42) амплифицировали с использованием праймеров 1119 и 1120 и интегрировали посредством транспозиции с применением EZ Tn5, получая штамм №1369.
Гены β-1,3-галактозидазы Bga42A из Bifidobacterium longum subsp.infantis были оптимизированы по кодонам для Е. coli и получены путем синтеза. Ген Bga42A под транскрипционным контролем промотора Ptet и ген cat, придающий хозяину устойчивость к хлорамфениколу (<Ptet-bga42A-cat> (SEQ ID NO: 43)), интегрировали с использованием транспозазы EZTn5. Штамм, экспрессирующий все три гена гидролаз, обозначен как штамм №1886.
Эффективного расщепления лактозы и LNT-2 достигали посредством добавления культуры штамма №1886 к продуцирующей LNFP-I культуре штамма №1772. Чтобы продемонстрировать расщепление LNT-2 и лактозы под действием LacZ и Bbhl, культуру штамма №1886, выращиваемую в MS-среде с глюкозой в качестве источника углерода, добавляли в объемном соотношении 1:40 к культуре штамма №1772, выращиваемой в MS-среде с глюкозой в присутствии лактозы и L-фукозы, для получения LNFP-I.
На Фиг. 7 показано расщепление лактозы и LNT-2 под действием гидролаз, экспрессируемых в штамме Е. coli №1886. Растущую культуру штамма Е. coli №1886 добавляли к культуре штамма Е. coli №1772, который продуцирует LNFP-I в качестве основного продукта и LNT и LNT-2 в качестве побочных продуктов. Через 10 ч инкубирования в культуральном супернатанте практически не оставалось LNT-2 и лактозы. Метаболиты отмечены следующим образом: кружки: лактоза, квадраты: LNT-2, треугольники: LNFP-I, крестики: LNT. Расщепление LNT-2 и лактозы за 10 ч прошло почти до полного их исчезновения, в то время как LNFP-I и LNT не расщеплялись клетками штамма №1886. Поскольку штамм №1886 содержит активный galETKM-оперон, моносахариды - глюкоза и галактоза, получающиеся в результате гидролиза лактозы, полностью метаболизируются.
Гидролаза Bga42A не проявляет активности вне клеток. Однако, когда клетки штамма №1886, выращенные на MS-среде с глюкозой в качестве источника углерода, вскрывали механически, была продемонстрирована гидролитическая активность Bga42A в отношении LNT, как показано на Фиг. 8, на котором приведен результат тонкослойной хроматографии. Образцы, содержащие клеточный лизат из штамма Е. coli №1886 (линия 1: без фермента, линии 2-6: по 100 мкг белка) и 5 мМ LNT в 20 мМ буфере на основе фосфата натрия, рН 7, инкубировали в течение периода времени до 120 минут включительно (линия 1: 120 мин, линия 2: 0 мин, линия 3: 15 мин, линия 4: 30 мин, линия 5: 60 мин, линия 6: 120 мин) при 30°С и затем фермент инактивировали нагреванием при 95°С в течение 5 минут.
На Фиг. 8 показан гидролиз LNT и полученных продуктов расщепления LNT-2 и лактозы в бесклеточном экстракте штамма №1886.





























































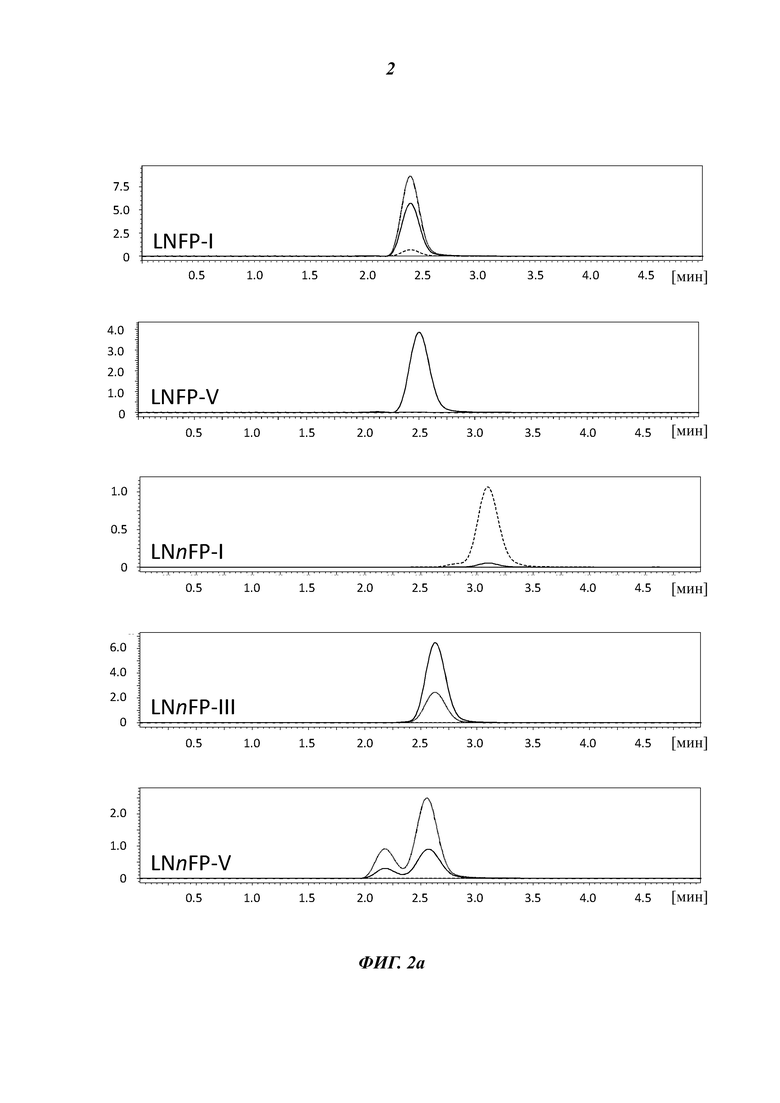
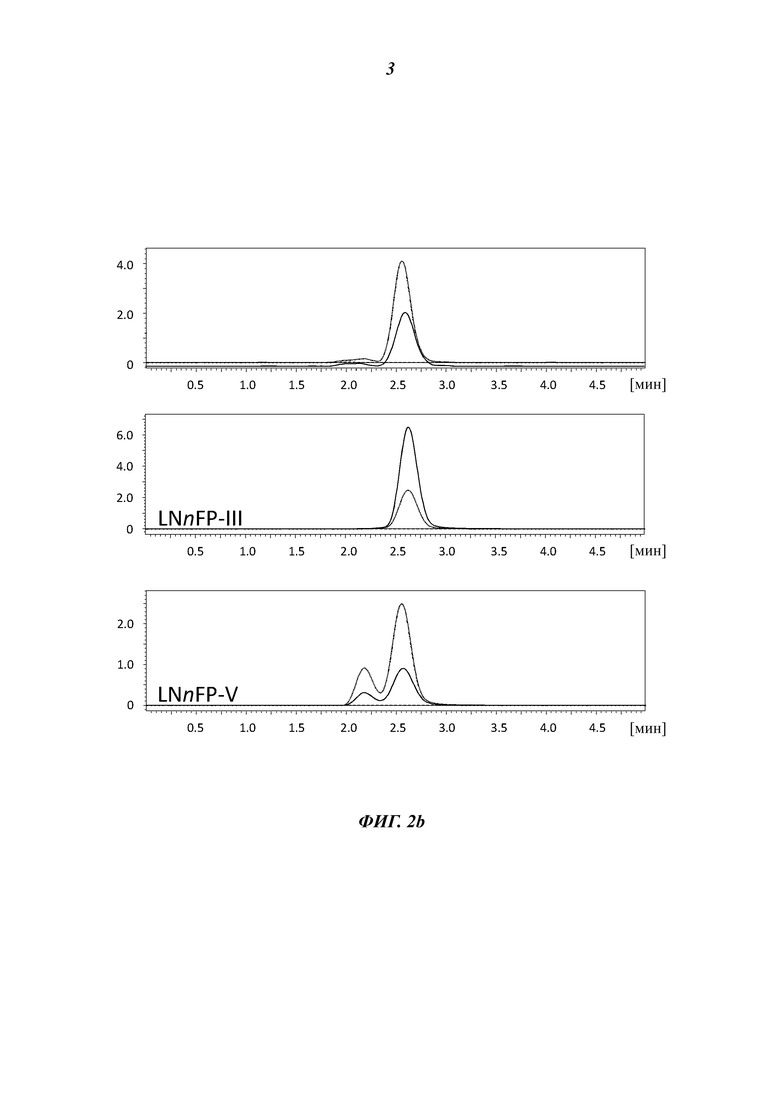
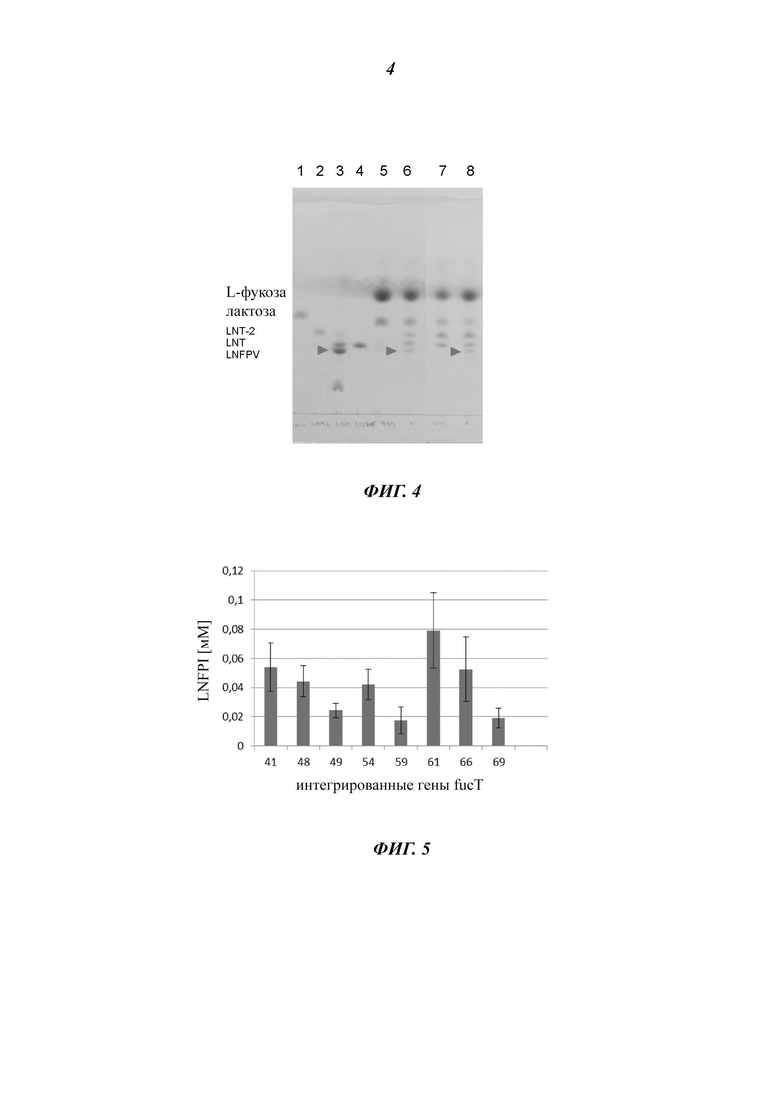
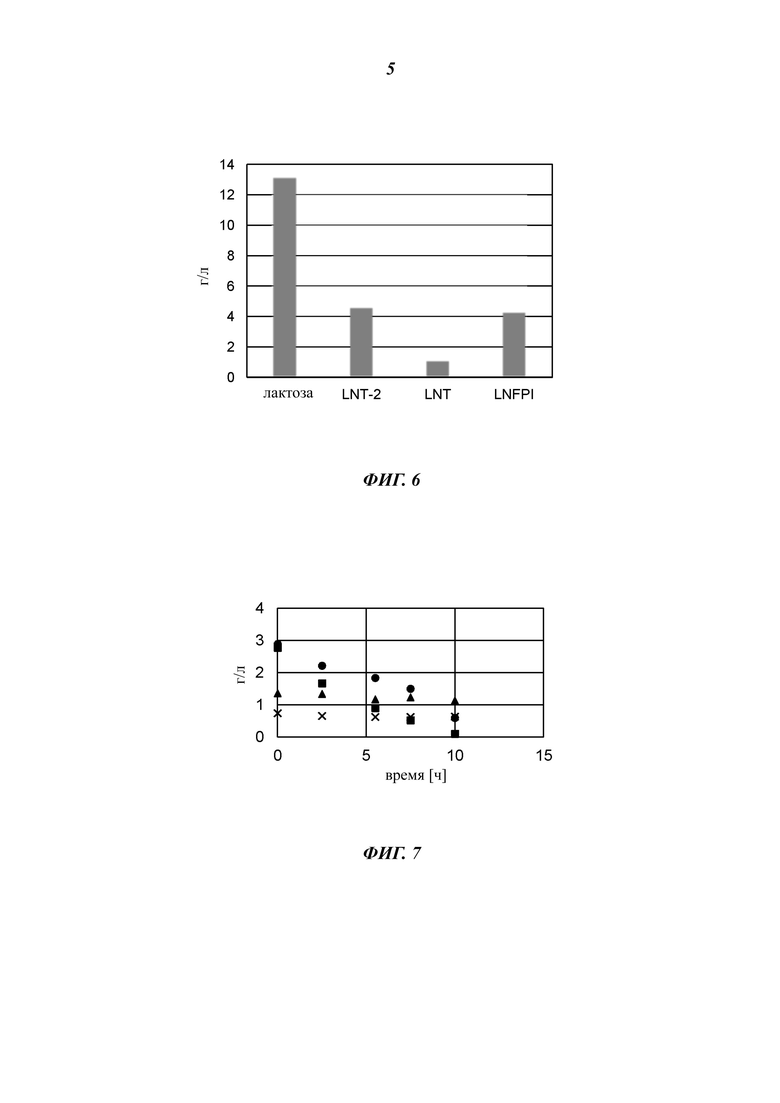
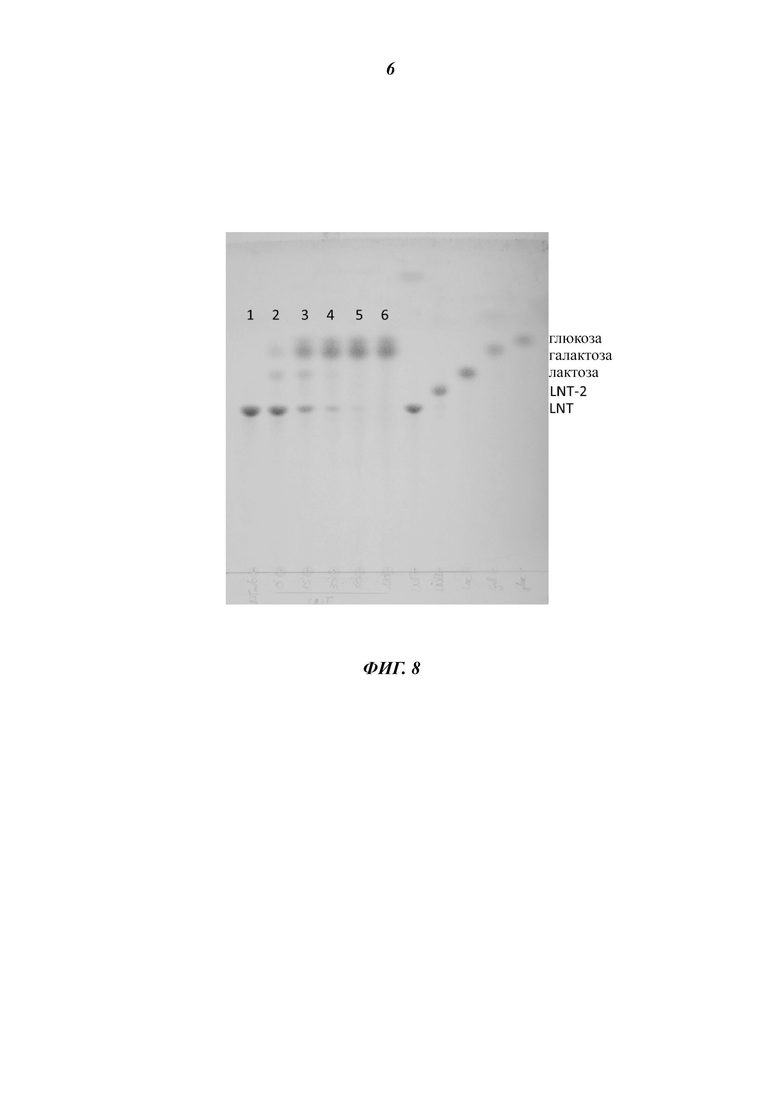
Изобретение относится к биотехнологии и представляет собой способ получения фукозилированного олигосахарида, включающий следующие стадии: a) предоставление по меньшей мере одной генетически модифицированной клетки, которая экспрессирует полипептид, способный проявлять β-1,3-N- ацетилглюкозаминилтрансферазную активность для переноса N-ацетилглюкозамина на лактозу, экспрессирует полипептид, способный проявлять β-1,3-галактозилтрансферазную или β-1,4-галактозилтрансферазную активность, приводящую к образованию LNT или LNnT, и указанная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, причем указанная гетерологичная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза, выбранная из LNT или LNnT; где гетерологичная фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 17-30, и функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 17-30; b) культивирование указанной по меньшей мере одной генетически модифицированной клетки в присутствии по меньшей мере одного источника углерода и в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата на акцепторную молекулу; и c) факультативно, выделение указанного фукозилированного олигосахарида. Изобретение позволяет получать фукозилированные олигосахариды с высокой степенью эффективности. 2 н. и 7 з.п. ф-лы, 8 ил., 6 табл., 6 пр.
1. Способ получения фукозилированного олигосахарида, включающий следующие стадии:
a) предоставление по меньшей мере одной генетически модифицированной клетки, которая экспрессирует полипептид, способный проявлять β-1,3-N- ацетилглюкозаминилтрансферазную активность для переноса N-ацетилглюкозамина на лактозу, экспрессирует полипептид, способный проявлять β-1,3-галактозилтрансферазную или β-1,4-галактозилтрансферазную активность, приводящую к образованию LNT или LNnT, и указанная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, причем указанная гетерологичная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза, выбранная из LNT или LNnT;
где гетерологичная фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 17-30, и функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 17-30;
b) культивирование указанной по меньшей мере одной генетически модифицированной клетки в присутствии по меньшей мере одного источника углерода и в условиях, подходящих для того, чтобы по меньшей мере в одной генетически модифицированной клетке осуществлялся перенос остатка фукозы с донорного субстрата на акцепторную молекулу; и
c) факультативно, выделение указанного фукозилированного олигосахарида.
2. Способ по п.1, где гетерологичная фукозилтрансфераза кодируется молекулой нуклеиновой кислоты, содержащей
1) нуклеотидную последовательность, которая представлена любой из SEQ ID NO: 2-15;
2) нуклеотидную последовательность, имеющую идентичность последовательности, составляющую по меньшей мере 80% с одной из нуклеотидных последовательностей, которая представлена любой из SEQ ID NO: 2-15, предпочтительно по всей длине последовательности;
3) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая представлена любой из SEQ ID NO: 17-30;
4) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая имеет по меньшей мере 80% идентичности с любой из аминокислотных последовательностей, представленных любой из SEQ ID NO: 17-30;
5) нуклеотидную последовательность, кодирующую функциональный фрагмент любого из полипептидов в соответствии с 3) и 4); или
6) где молекула нуклеиновой кислоты гибридизуется с комплементарной цепью молекулы нуклеиновой кислоты в соответствии с 1), 2), 3), 4) или 5) в жестких условиях.
3. Генетически модифицированная клетка для получения фукозилированного олигосахарида, где указанная клетка экспрессирует полипептид, способный проявлять β-1,3-N-ацетилглюкозаминилтрансферазную активность для переноса N-ацетилглюкозамина на лактозу, экспрессирует полипептид, способный проявлять β-1,3-галактозилтрансферазную или β-1,4-галактозилтрансферазную активность, приводящую к образованию LNT или LNnT, и указанная клетка генетически модифицирована с возможностью экспрессировать гетерологичную фукозилтрансферазу, причем указанная гетерологичная фукозилтрансфераза способна переносить остаток фукозы с донорного субстрата на акцепторную молекулу, при этом указанной акцепторной молекулой является лактотетраоза, причем указанная гетерологичная фукозилтрансфераза выбрана из группы, состоящей из полипептидов, представленных любой из SEQ ID NO: 17-30, и функциональных фрагментов полипептидов, представленных любой из SEQ ID NO: 17-30.
4. Генетически модифицированная клетка по п. 3, где гетерологичная фукозилтрансфераза кодируется молекулой нуклеиновой кислоты, содержащей
1) нуклеотидную последовательность, которая представлена любой из SEQ ID NO: 2-15;
2) нуклеотидную последовательность, имеющую идентичность последовательности, составляющую по меньшей мере 80% с одной из нуклеотидных последовательностей, которые представлены любой из SEQ ID NO: 2-15, предпочтительно по всей длине последовательности;
3) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая представлена любой из SEQ ID NO: 17-30;
4) нуклеотидную последовательность, кодирующую полипептид, имеющий аминокислотную последовательность, которая имеет по меньшей мере 80% идентичности с любой из аминокислотных последовательностей, представленных любой из SEQ ID NO: 17-30;
5) нуклеотидную последовательность, кодирующую функциональный фрагмент любого из полипептидов в соответствии с 3) и 4); или
6) где молекула нуклеиновой кислоты гибридизуется с комплементарной цепью молекулы нуклеиновой кислоты в соответствии с 1), 2), 3), 4) или 5) в жестких условиях.
5. Генетически модифицированная клетка по п. 3 или 4, где клетка генетически модифицирована с возможностью иметь повышенную способность к внутриклеточному
продуцированию ГДФ-фукозы по сравнению с данной клеткой до подвергания ее генетической модификации, причем данная клетка предпочтительно генетически модифицирована 1) с возможностью экспрессировать ген, кодирующий бифункциональную фукозокиназу/L-фукозо-1-фосфат-гуанилтрансферазу, катализирующую образование ГДФ-фукозы из L-фукозы, или 2) с возможностью сверхэкспрессировать по меньшей мере один из генов, кодирующих фосфоманномутазу, маннозо-1-фосфат-гуанозилтрансферазу, ГДФ-маннозо-4,6-дегидратазу и ГДФ-L-фукозосинтазу.
6. Генетически модифицированная клетка по любому из пп. 3-5, где клетка генетически модифицирована с возможностью демонстрировать усиленный импорт экзогенной L-фукозы через свою клеточную мембрану, причем данная клетка предпочтительно также генетически модифицирована с возможностью экспрессировать или сверхэкспрессировать, по сравнению с клеткой-предшественником до подвергания ее генетической модификации, одну нуклеотидную последовательность, выбранную из группы, состоящей из нуклеотидных последовательностей, кодирующих главный переносчик, осуществляющий облегченный транспорт, FucP из E. coli, нуклеотидных последовательностей, кодирующих функциональные варианты главного переносчика, осуществляющего облегченный транспорт, FucP из E. coli, нуклеотидных последовательностей, кодирующих функциональные фрагменты главного переносчика, осуществляющего облегченный транспорт, FucP из E. coli, и нуклеотидных последовательностей, кодирующих функциональные варианты функциональных фрагментов главного переносчика, осуществляющего облегченный транспорт, FucP из E. coli.
7. Генетически модифицированная клетка по любому из пп. 3-6, где клетка также генетически модифицирована с возможностью предотвращать истощение внутриклеточного запаса ГДФ-фукозы, предпочтительно так, что экспрессия клеточного гена, кодирующего WcaJ, который катализирует первую стадию синтеза колановой кислоты, нарушена или инактивирована, или так, что нуклеотидная последовательность гена, кодирующего WcaJ, изменена, вследствие чего ферментативно неактивный полипептид кодируется измененным геном WcaJ.
8. Генетически модифицированная клетка по любому из пп. 3-7, где клетка также генетически модифицирована так что гены fucI и/или fucK, кодирующие L-фукозоизомеразу и L-фукулозокиназу, соответственно, удалены, нуклеотидная последовательность генов fucI и/или fucK изменена для необратимой инактивации ферментативной активности соответствующего(их) полипептида(ов), или так что экспрессия генов fucI и/или fucK нарушена.
9. Генетически модифицированная клетка по любому из пп. 3-8, где клетка также генетически модифицирована с возможностью иметь повышенную способность синтезировать одно или более из CMP-N-ацетилнейраминовой кислоты, УДФ-N-ацетилглюкозамина и УДФ-галактозы, по сравнению с данной клеткой до подвергания ее генетической модификации, причем предпочтительно, чтобы указанная повышенная способность к продуцированию УДФ-N-ацетилглюкозамина, УДФ-галактозы и, более предпочтительно, CMP-N-ацетилнейраминовой кислоты включала сверхэкспрессию одного или более генов, кодирующих белки, имеющие активности L-глутамин:D-фруктозо-6-фосфатаминотрансферазы, N-ацетилглюкозамин-1-фосфат-уридилтрансферазы/глюкозамин-1-фосфат-ацетил-трансферазы, фосфоглюкозаминмутазы, УДФ-галактозо-4'-эпимеразы, фосфоглюкомутазы, глюкозо-1-фосфат-уридилилтрансферазы, глюкозамин-6-фосфат-ацетилтрансферазы, N-ацетилглюкозамин-2-эпимеразы, УДФ-N-ацетилглюкозамин-2-эпимеразы, фосфоенолпируват-синтетазы, синтазы сиаловых кислот, пермеазы сиаловых кислот, синтетазы CMP-сиаловых кислот.
| WO 2016040531 A1, 17.03.2016 | |||
| RU 2013138474 A, 27.02.2015 | |||
| СИНТЕЗ ФУКОЗИЛИРОВАННЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2584599C2 |
Авторы
Даты
2024-05-06—Публикация
2018-07-06—Подача