Данное изобретение относится к рекомбинантному вектору, сконструированному для независимой экспрессии множественных нуклеотидных последовательностей, представляющих интерес, которые получены от одного и того же организма или от близкородственных организмов. Данное изобретение относится к области технологии рекомбинантных нуклеиновых кислот для экспрессии множественных нуклеотидных последовательностей, проявляющих гомологию друг с другом, в различных, как прокариотических, так и эукариотических, системах in vitro или у субъекта животного или человека для терапевтических или профилактических целей. Настоящее изобретение особенно полезно в области иммунотерапии, в частности для лечения или предупреждения патологических состояний, вызванных инфекционными организмами, такими как папилломавирус и вирус гепатита.
Технология рекомбинантных ДНК дала возможность экспрессировать нуклеотидные последовательности в культивируемых клетках-хозяевах или в живых организмах. Несколько плазмидных ДНК и вирусных векторов создано и применено для разнообразных целей, включая вакцинацию, генотерапию, иммунотерапию и экспрессию в культивируемых клетках. Векторы, такие как аденовирусные и поксвирусные векторы, обладают тем преимуществом, что они вмещают большую клонирующую емкость с потенциалом экспрессии множественных нуклеотидных последовательностей в широком диапазоне клеток-хозяев. Экспрессия множественных нуклеотидных последовательностей может обладать преимуществом в целях улучшения терапевтической эффективности, обеспечиваемой кодируемыми полипептидами (например, комбинирования гуморального и клеточного иммунитета). Вероятнее, вместо получения множества рекомбинантных векторов, сконструированных отдельно для экспрессии каждой из желаемых нуклеотидных последовательностей, было бы предпочтительно получение одного рекомбинантного вектора, по меньшей мере для упрощения стадий получения и официального разрешения.
Например, в отношении папилломавирусных инфекций представляла бы интерес экспрессия иммуногенных полипептидов от нескольких генотипов папилломавирусов с целью расширения или усиления иммунного ответа хозяина, особенно у субъекта, подверженного риску множественных инфекций, например HPV-16 и HPV-18. Однако нуклеотидные последовательности, кодирующие такие иммуногенные полипептиды, высоко гомологичны между родственными генотипами HPV. Например, последовательности HPV-16 E6 и HPV-18 E6, которые проявляют общую гомологию 63% на нуклеотидном уровне, тем не менее содержат конкретные участки очень высокой гомологии выше 75%, что может подвергать риску экспрессию генов HPV-16 и HPV-18 с одного вектора.
Кроме того, при экспрессии полипептидов вирусного происхождения гомологичные нуклеотидные последовательности могут также возникать в связи с организацией вирусного генома в целом. Достаточно часто вирус использует одну и ту же нуклеотидную последовательность для кодирования двух различных белков посредством таких биологических механизмов, как внутренняя инициация трансляции или сдвиг рамки считывания, то есть одна и та же последовательность ДНК транслируется более чем в одну рамку считывания. Например, в геноме HPV-16 соседние гены Е1 и Е2 перекрываются на 59 нуклеотидов, которые транслируются в различных рамках считывания. Иными словами, 59 последних нуклеотидов гена Е1 перекрываются с первыми 59 нуклеотидами гена Е2.
Однако ожидают, что присутствие гомологичных последовательностей в векторе отрицательно влияет на его стабильность, в частности во время стадий продуцирования вектора, приводя к потере генных последовательностей вследствие событий рекомбинации, которые происходят между гомологичными последовательностями. Таким образом, в экспрессию генов HPV-16 Е1 и Е2 в одном векторе вовлечено присутствие общего участка из 59 нуклеотидов, что может потенциально привести к событиям гомологичной рекомбинации и, в конечном счете, к потере последовательностей, содержащихся между гомологичными последовательностями Е1 и Е2. Такие нежелательные события гомологичной рекомбинации могут также происходить при экспрессии последовательностей генов HPV-16 и HPV-18 в одном и том же векторе. Эта проблема нестабильности может сделать штамм вектора неприменимым, в частности для клинических испытаний на человеке.
Для решения этой проблемы в WO 92/16636 предложена вставка в рекомбинантный вектор гомологичных нуклеотидных последовательностей в противоположной ориентации по отношению друг к другу, чтобы, таким образом, уменьшить вероятность событий рекомбинации. Однако данная стратегия была описана в связи с вектором на основе вируса осповакцины, а не для других рекомбинантных векторов, таких как аденовирусы. Кроме того, расположение в противоположной ориентации не всегда возможно вследствие возможной промоторной интерференции и особенностей конструкции.
В данной области техники существует необходимость в создании рекомбинантных векторов, способных к экспрессии в клетке-хозяине или субъекте-хозяине нуклеотидных последовательностей, полученных от одного и того же или от близкородственных организмов, которые в нативном окружении содержат высоко гомологичные участки. Настоящее изобретение решает задачу обеспечения новой стратегии, предназначенной для минимизации вероятности событий рекомбинации, путем изменения любой или обеих гомологичных нуклеотидных последовательностей, используя вырожденность генетического кода, чтобы сделать их менее гомологичными, чем до модификации, при этом не изменяя или значительно не изменяя кодируемую аминокислотную последовательность. Настоящее изобретение позволяет преодолеть разрушительный эффект гомологичной рекомбинации, которая может происходить между гомологичными последовательностями, особенно во время стадий продуцирования вектора, и приводить к потере нуклеотидных последовательностей, содержащихся между ними. Обнаружено, что вектор по настоящему изобретению удивительно эффективен при экспрессии папилломавирусных генов Е1 и Е2, которые в нативном окружении имеют общий 100% гомологичный участок из 59 нуклеотидов, и удивительно стабилен во время стадий продуцирования вектора. Также обнаружено, что вектор по настоящему изобретению удивительно эффективен при экспрессии генов Е6 и Е7, полученных от близкородственных генотипов HPV-16 и HPV-18.
Данная техническая задача решена в результате разработки решений, определенных в формуле изобретения.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения станут очевидными на основании приведенного ниже описания предпочтительных на данный момент воплощений изобретения. Эти воплощения приведены в целях раскрытия.
Соответственно, в первом аспекте в настоящем изобретении предложен вектор, содержащий по меньшей мере первую молекулу нуклеиновой кислоты, кодирующую первый полипептид, и вторую молекулу нуклеиновой кислоты, кодирующую второй полипептид, где:
- указанные первая и вторая молекулы нуклеиновой кислоты получены соответственно от первой и второй нативных нуклеиново-кислотных последовательностей, которые проявляют процент гомологии примерно 80% или выше, чем 80%, на протяжении участка из 40 или большего числа непрерывных нуклеотидов, и
- указанная первая молекула нуклеиновой кислоты и/или указанная вторая молекула нуклеиновой кислоты, содержащаяся в векторе, модифицирована таким образом, чтобы снизить указанный процент гомологии до значения менее чем 75%.
Как используют здесь на протяжении всей заявки, термины в единственном числе используют в том смысле, что они означают "по меньшей мере один", "по меньшей мере первый", "один или более чем один" или "множество" соединений или стадий, на которые ссылаются, если контекст не требует иного. Например, термин "клетка" включает множество клеток, включающее их смесь.
Термин "и/или" при использовании здесь включает значение "и", "или" и "все или любая другая комбинация элементов, связанных указанным термином". Например, "первая молекула нуклеиновой кислоты и/или вторая молекула нуклеиновой кислоты" означает либо первую молекулу нуклеиновой кислоты, либо вторую молекулу нуклеиновой кислоты, либо обе, первую и вторую, молекулы нуклеиновой кислоты.
Термин "примерно" или "приблизительно", как используют здесь, означает значение в пределах 5%, предпочтительно в пределах 4% и более предпочтительно в пределах 2% от данного значения или интервала.
Как используют здесь, при использовании для определения продуктов, композиций и способов, термин "содержащий" предназначен для обозначения того, что эти продукты, композиции и способы включают компоненты или стадии, на которые ссылаются, но не исключают другие. "Состоящий по существу из" означает включение других компонентов или стадий любой существенной значимости. Таким образом, композиция, состоящая по существу из перечисленных компонентов, не должна исключать следовые примеси и фармацевтически приемлемые носители. "Состоящий из" означает исключение более чем следовых элементов других компонентов или стадий. Например, полипептид "состоит из" аминокислотной последовательности, когда этот полипептид не содержит никаких аминокислот, кроме перечисленной аминокислотной последовательности. Полипептид "состоит по существу из" аминокислотной последовательности, когда такая аминокислотная последовательность присутствует вместе только с небольшим количеством дополнительных аминокислотных остатков, типично от примерно 1 до примерно 50 или около того, дополнительных остатков. Полипептид "содержит" аминокислотную последовательность, когда эта аминокислотная последовательность составляет по меньшей мере часть конечной аминокислотной последовательности полипептида. Такой полипептид может иметь от нескольких до нескольких сотен дополнительных аминокислотных остатков. Такие дополнительные аминокислотные остатки могут среди прочего играть роль в транспортировке полипептида, способствовать продуцированию или очистке полипептида; продлевать время полужизни. То же может быть применимо к нуклеотидным последовательностям.
Как используют здесь, "вектор" может представлять собой любой агент, способный к доставке и экспрессии по меньшей мере первой и второй молекул нуклеиновой кислоты в клетке-хозяине или субъекте-хозяине. Вектор может быть экстрахромосомным (например, эписомным) или интегративным (для включения в хромосомы хозяина), автономно или неавтономно реплицирующимся, многокопийным или низкокопийным, двунитевым или однонитевым, незащищенным или в комплексе с другими молекулами (например, векторы в комплексе с липидами или полимерами с образованием структур в виде частиц, таких как липосомы, липоплексы или наночастицы, векторы, упакованные в вирусный капсид, и векторы, иммобилизованные на твердофазных частицах, и т.д.). Определение термина "вектор" также охватывает векторы, которые модифицированы таким образом, что дают возможность предпочтительной направленности в конкретную клетку-хозяина. Характерным признаком направленных векторов является присутствие на их поверхности лиганда, способного распознавать и связывать клеточный и экспонированный на поверхности компонент, такой как маркер, специфичный для клетки (например, HPV-инфицированной клетки), тканеспецифичный маркер или опухолеспецифичный маркер. Лиганд может быть генетическим путем встроен в полипептид, присутствующий на поверхности вектора (например, аденовирусный файбер-протеин, пентон, pIX, как описано в WO 94/10323 и WO 02/96939 или продукт гена р14 вируса осповакцины, как описано в ЕР 1146125).
В контексте настоящего изобретения термины "нуклеиновая кислота", "молекула нуклеиновой кислоты", "полинуклеотид" и "нуклеотидная последовательность" используют взаимозаменяемо и определяют полимер любой длины либо из полидезоксирибонуклеотидных (ДНК), либо полирибонуклеотидных (РНК) молекул, либо любой их комбинации. Это определение охватывает одно- или двунитевые, линейные или кольцевые, природные или синтетические полинуклеотиды. Кроме того, такие полинуклеотиды могут содержать не встречающиеся в природе нуклеотиды (например, метилированные нуклеотиды и нуклеотидные аналоги, такие как описаны в US 5525711, US 4711955 или ЕРА 302175), а также химические модификации (например, см. WO 92/03568; US 5118672) с целью повышения стабильности нуклеиновой кислоты in vivo, усиления ее доставки или снижения скорости клиренса из субъекта-хозяина. Если они присутствуют, модификации могут быть приданы до или после полимеризации.
Термины "полипептид", "пептид" и "белок" используют здесь взаимозаменяемо для отнесения к полимерам из аминокислотных остатков, которые содержат 9 или более аминокислотных остатков, связанных посредством пептидных связей. Этот полимер может быть линейным, разветвленным или циклическим. В контексте данного изобретения "полипептид" может включать аминокислоты, которые представляют собой L стереоизомеры (природную форму) или D стереоизомеры, и могут включать аминокислоты, иные чем 20 распространенных в природе аминокислот, такие как [бета]-аланин, орнитин или метионина сульфоксид, или аминокислоты, модифицированные на одной или более чем одной альфа-аминогруппе, альфа-карбоксильной группе или боковой цепи, например, путем прибавления метила, формила, ацетила, гликозила, фосфорила и тому подобного. В качестве общего указания, если аминокислотный полимер является длинным (например, более чем 50 аминокислотных остатков), на него предпочтительно ссылаются как на полипептид или белок. Как следствие, "пептид" относится к фрагменту из аминокислот в количестве от примерно 9 до примерно 50 аминокислот в длину. В контексте изобретения пептид предпочтительно включает выбранную область природного (или нативного) белка, например его иммуногенный фрагмент, содержащий эпитоп.
Термин "полипептид", как определено здесь, охватывает как нативные, так и модифицированные полипептиды. Термин "нативный", как используют здесь, относится к материалу, выделенному из источника в природе, в отличие от материала, искусственно модифицированного или измененного человеком в лаборатории. Например, нативный полипептид кодируется геном, который присутствует в геноме организма или клетки дикого типа. Напротив, модифицированный полипептид кодируется молекулой нуклеиновой кислоты, которая модифицирована в лаборатории таким образом, чтобы отличаться от нативного полипептида, например, путем инсерции, делеции или замены одной или более чем одной аминокислоты или любой комбинации этих возможностей. Когда рассматривают несколько модификаций, они могут касаться последовательных остатков и/или не последовательных остатков. Примеры модификаций, рассматриваемые настоящим изобретением, могут приводить в результате к изменениям биологической активности, проявляемой нативным полипептидом. Аминокислоты, которые являются критическими для данной биологической активности, можно идентифицировать рутинными способами, такими как структурный и функциональный анализ, и специалист в данной области техники может легко определить тип мутации(й), который способен снизить или прекратить такую биологическую активность. Такие модификации можно осуществить с помощью рутинных методик, таких как сайт-направленный мутагенез. Альтернативно можно получить синтетическую молекулу нуклеиновой кислоты, кодирующую модифицированный полипептид, путем химического синтеза в автоматизированном процессе (например, сборки из перекрывающихся синтетических олигонуклеотидов, как описано в прилагаемом разделе примеров).
Термин "полученный", как используют здесь, относится к материалу, который обнаружен, выделен, очищен или имеет происхождение из источника в природе. "Выделенный" означает извлеченный из его природной окружающей среды. "Очищенный" означает, что он по существу свободен по меньшей мере от одного другого компонента, с которым он естественно связан. "Имеет происхождение" означает одну или более чем одну модификацию по сравнению с нативным материалом (в частности, мутации, такие как замены, делеции и/или инсерции). Методики выделения, очистки и модификации являются рутинными в данной области техники и зависят от материала, который нужно получить (например, клонирование молекулы нуклеиновой кислоты можно осуществить из источника в природе путем использования фермента рестрикции, с помощью ПЦР или путем химического синтеза).
Как используют здесь, термин "гомология" обычно выражен в виде процента и означает нуклеотидные последовательности, которые сохраняют данную степень идентичности друг с другом на протяжении участка по меньшей мере из 40 последовательных нуклеотидов (например, примерно 40, 45, 50, 55, 57, 58, 59, 60, 70 или даже большего числа последовательных нуклеотидов). "По меньшей мере 80%" относится приблизительно к 80% или более чем 80% (например, к любому значению после 80%, преимущественно по меньшей мере 85%, желательно по меньшей мере 87%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 97% вплоть до 100% гомологии последовательности). "Менее чем 75%" относится к любому значению ниже 75, например, приблизительно 74, 72, 70, 68, 65, 62, 60% или даже менее. Процент гомологии между двумя нуклеотидными последовательностями является функцией числа идентичных положений, общих для последовательностей, учитывая число гэпов, которые необходимо ввести для оптимального выравнивания, и длину каждого гэпа. В данной области техники доступны различные компьютерные программы и математические алгоритмы для определения процента идентичности между нуклеотидными последовательностями, такие как пакет программ GCG Wisconsin и программа Basic Local alignment Search Tool (BLAST), которая публично доступна в Национальном центре биотехнологической информации (NCBI) и описана в печатных изданиях (например, Altschul et al., 1990, J. Mol. Biol. 215, 403-410).
В качестве исходной точки выравнивание последовательности между первой и второй молекулами нуклеиновой кислоты перед модификацией можно использовать с целью выявления одного или более чем одного участка из 40 или большего числа непрерывных нуклеотидов, которые имеют процент гомологии 80% или выше чем 80%, то есть "гомологичного" участка(ов). В конкретном воплощении паттерн использования кодона первой молекулы нуклеиновой кислоты, либо второй молекулы нуклеиновой кислоты, либо обеих, первой и второй, молекул нуклеиновой кислоты модифицируют (например, за счет тенденции к вырождению паттерна использования кодона) по меньшей мере в указанном участке(ах) из 40 или большего числа (например, приблизительно 40, 45, 50, 55, 57, 58, 59, 60, 70 или даже более) непрерывных нуклеотидов, так чтобы снизить процент гомологии до значения менее чем 75% (например, приблизительно 74, 72, 70, 68, 65, 62, 60% или даже менее).
Если каждый из остатков метионина и триптофана кодируется уникальным триплетом нуклеиновой кислоты (то есть кодоном), то для кодирования других 18 аминокислот могут быть использованы различные кодоны (вырожденность генетического кода). Например, аминокислоты кодируются кодонами, как описано ниже: аланин (Ala или А) кодируется кодонами GCA, GCC, GCG и GCU; цистеин (С или Cys) кодонами UGC и UGU; аспарагиновая кислота (D или Asp) кодонами GAC и GAU; глутаминовая кислота (Е или Glu) кодонами GAA и GAG; фенилаланин (F или Phe) кодонами UUC и UUU; глицин (G или Gly) кодонами GGA, GGC, GGG и GGU; гистидин (Н или His) кодонами САС и CAU; изолейцин (I или Ile) кодонами AUA, AUC и AUU; лизин (K или Lys) кодонами ААА и AAG; лейцин (L или Leu) кодонами UUA, UUG, CUA, CUC, CUG и CUU; метионин (М или Met) кодоном AUG; аспарагин (N или Asn) кодонами ААС и AAU; пролин (Р или Pro) кодонами ССА, ССС, CCG и CCU; глутамин (Q или Gln) кодонами САА и CAG; аргинин (R или Arg) кодонами AGA, AGG, CGA, CGC, CGG и CGU; серин (S или Ser) кодонами AGC, AGU, UCA, UCC, UCG и UCU; треонин (Т или Thr) кодонами АСА, АСС, ACG и ACU; валин (V или Val) кодонами GUA, GUC, GUG и GUU; триптофан (W или Trp) кодоном UGG и тирозин (Y или Tyr) кодонами UAC и UAU.
Снижение процента гомологии в одном или более чем одном гомологичном участке, присутствующем в указанных первой и второй молекулах нуклеиновой кислоты, может быть достигнуто путем использования преимущества вырожденности генетического кода и модификации паттерна использования кодона в первой молекуле нуклеиновой кислоты и/или во второй молекуле нуклеиновой кислоты. Модификацию паттерна использования кодона обычно проводят путем замены одного или более чем одного "нативного" кодона другим кодоном(ами). Например, замена Arg-кодирующего кодона AGA Arg-кодирующим кодоном CGC снизит гомологию в 2 из 3 положений этого кодона. Нет необходимости в вырожденности всех нативных кодонов, поскольку гомология может быть значительно снижена при частичной замене. Кроме того, модификацию паттерна использования кодона можно осуществить на протяжении всей молекулы нуклеиновой кислоты, либо можно ограничить гомологичным участком(ами), присутствующими до модификации. Желательно в контексте изобретения вырожденность осуществляют в первой молекуле нуклеиновой кислоты и ограничивают гомологичным участком(ами). Предпочтительно паттерн использования кодона модифицируют на нуклеотидном уровне, и модификации являются молчащими на аминокислотном уровне, то есть, когда это возможно, каждый "нативный" кодон заменяют кодоном, кодирующим ту же аминокислоту, так что такие модификации не транслируются в кодируемом полипептиде. Более предпочтительно, когда это возможно, паттерн использования кодона модифицируют таким путем, что гомологичные участки между первой и второй молекулами нуклеиновой кислоты ограничены до числа последовательных нуклеотидов менее 9 или 8, преимущественно до числа последовательных нуклеотидов менее 7, предпочтительно до числа последовательных нуклеотидов менее 6 и более предпочтительно до числа последовательных нуклеотидов менее 5. Модификацию паттерна использования кодона можно создать с помощью ряда путей, известных специалистам в данной области техники, таких как сайт-направленный мутагенез (например, используя систему мутагенеза in vitro Sculptor™ производства Amersham, Les Ullis, France), ПЦР мутагенез, перестановка в ДНК, а также с помощью методик химического синтеза (результатом которых, например, является синтетическая молекула нуклеиновой кислоты).
Когда вектор согласно изобретению содержит более чем две молекулы нуклеиновой кислоты, тогда любую молекулу нуклеиновой кислоты, содержащуюся в векторе и полученную из нативной нуклеиново-кислотной последовательности, которая проявляет процент гомологии приблизительно 80% или выше чем 80% на протяжении участка из 40 или большего числа непрерывных нуклеотидов по меньшей мере с одной другой нативной нуклеиново-кислотной последовательностью, из которой получена другая молекула нуклеиновой кислоты, можно модифицировать таким образом, чтобы снизить процент гомологии до значения менее чем 75%, таким образом, чтобы ни одна пара молекул нуклеиновой кислоты, содержащихся в векторе, не могла содержать участок из 40 или большего числа последовательных нуклеотидов, проявляющих процент идентичности выше, чем 75%.
Выравнивание последовательности между каждой парой нативных последовательностей, из которых получены молекулы нуклеиновой кислоты, можно использовать с целью выявления одного или более чем одного участка, проявляющего процент гомологии 80% или выше чем 80%. Затем последовательность одной или более чем одной из нативных последовательностей модифицируют, в частности путем вырождения использования кодона, таким образом, чтобы снизить процент гомологии, по меньшей мере в гомологичных участках, до значения менее чем 75%. В конечном счете, ни одна молекула нуклеиновой кислоты, содержащаяся в векторе, не должна содержать участок из 40 или большего числа (например, 45, 50, 55, 57, 58, 59, 60, 70 или даже более) последовательных нуклеотидов, проявляющий процент идентичности выше, чем 75%, с любой другой молекулой нуклеиновой кислоты, содержащейся в указанном векторе.
Как упомянуто выше, полипептид, кодируемый молекулами нуклеиновой кислоты, содержащимися в векторе, может иметь или не иметь такую же аминокислотную последовательность, как нативный полипептид. В частности, в дополнение к мутациям для вырождения использования кодона, таким образом, чтобы снизить гомологию, по меньшей мере в гомологичных участках молекул нуклеиновой кислоты, содержащихся в векторе, указанные молекулы нуклеиновой кислоты, содержащиеся в векторе, могут также включать дополнительные мутации, приводящие или не приводящие в результате к модификации аминокислотной последовательности кодируемого полипептида.
Вектор по изобретению охватывает как вирусные, так и невирусные (например, плазмидные ДНК) векторы. Подходящие невирусные векторы включают плазмиды, такие как pREP4, pCEP4 (Invitrogene), pCI (Promega), pCDM8 (Seed, 1987, Nature 329, 840), pVAX и pgWiz (Gene Therapy System Inc.; Himoudi et al., 2002, J. Virol. 76, 12735-12746). "Вирусный вектор" используют здесь в соответствии с его значением, принятым в данной области техники. Он относится к любому вектору, который содержит по меньшей мере один элемент вирусного происхождения, включая полноразмерный вирусный геном, его участок или модифицированный вирусный геном, как описано ниже, а также вирусные частицы, образованные им (например, вирусный вектор, упакованный в вирусный капсид с образованием инфекционных вирусных частиц). Вирусные векторы по изобретению могут быть репликационно-компетентными, либо могут быть генетически повреждены таким образом, что являются репликационно-дефектными или иметь нарушенную репликацию. Термин "репликационно-компетентный", как используют здесь, охватывает репликационно-селективные и условно-репликационные вирусные векторы, которые сконструированы генно-инженерным путем таким образом, чтобы лучше или селективно реплицироваться в специфичных клетках-хозяевах (например, в опухолевых клетках). Вирусные векторы могут быть получены из ряда различных вирусов, и особенно из вируса, выбранного из группы, состоящей из ретровируса, аденовируса, аденоассоциированного вируса (AAV), поксвируса, вируса герпеса, вируса кори и пенистого вируса.
В одном воплощении вектор по изобретению представляет собой аденовирусный вектор (обзор см. в "Adenoviral vectors for gene therapy", 2002, Ed D. Curiel and J. Douglas, Academic Press). Он может иметь происхождение от любого аденовируса человека и животных. Любой серотип или подгруппу можно использовать в контексте изобретения. Можно более конкретно указать подгруппу А (например, серотипы 12, 18 и 31), подгруппу В (например, серотипы 3, 7, 11, 14, 16, 21, 34 и 35), подгруппу С (например, серотипы 1, 2, 5 и 6), подгруппу D (например, серотипы 8, 9, 10, 13, 15, 17, 19, 20, 22-30, 32, 33, 36-39 и 42-47), подгруппу Е (серотип 4) и подгруппу F (серотипы 40 и 41). Особенно предпочтительными являются человеческие аденовирусы 2 (Ad2), 5 (Ad5), 6 (Ad6), 11 (Ad11), 24 (Ad24) и 35 (Ad35). Такой аденовирус доступен из Американской коллекции типовых клеточных культур (АТСС, Rockville, Md.) и является предметом различных публикаций, в которых описаны его последовательность, организация и способы продуцирования, что дает возможность специалистам в данной области техники использовать его (см., например, US 6133028; US 6110735; WO 02/40665; WO 00/50573; EP 1016711; Vogels et al., 2003, J. Virol. 77, 8263-8271).
Аденовирусный вектор по настоящему изобретению может быть репликационно-компетентным. Различные примеры репликационно-компетентных аденовирусных векторов легко доступны специалистам в данной области техники (см., например, Hernandez-Alcoceba et al., 2000, Human Gene Ther. 11, 2009-2024; Nemunaitis et al., 2001, Gene Ther. 8, 746-759; Alemany et al., 2000, Nature Biotechnology 18, 723-727; WO 00/24408; US 5,998,205, WO 99/25860, US 5698443, WO 00/46355, WO 00/15820 и WO 01/36650).
Альтернативно аденовирусный вектор по изобретению может быть репликационно-дефектным (дефектным по репликации) (см., например, WO 94/28152). Предпочтительными репликационно-дефектными аденовирусными векторами являются E1-дефектный (например, US 6136594 и US 6013638) с делецией Е1, продолжающейся приблизительно от положений 459-3328 или приблизительно от положений 459-3510 (со ссылкой на последовательность человеческого аденовируса типа 5, раскрытую в GeneBank под номером по каталогу М 73260 и в Chroboczek et al., 1992, Virol. 186, 280-285). Клонирующую емкость и безопасность можно дополнительно улучшить путем делетирования дополнительного участка(ов) аденовирусного генома (например, в заменимой области Е3 или в других незаменимых областях Е2, Е4, как описано в Lusky et al., 1998, J. Virol 72, 2022-2032).
Первая и вторая молекулы нуклеиновой кислоты могут быть независимо встроены в любой локализации аденовирусного вектора по изобретению, как описано в Chartier et al. (1996, J. Virol. 70, 4805-4810), и независимо расположены в смысловой и/или антисмысловой ориентации относительно естественного направления транскрипции области вставки. Например, обе они могут быть встроены при замещении области Е1 или альтернативно одну встраивают при замещении области Е1, а другую при замещении области Е3.
В другом воплощении вектор по изобретению представляет собой поксвирусный вектор (см., например, Сох et al. in "Viruses in Human Gene Therapy" Ed J. М. Hos, Carolina Academic Press). Он может быть получен из любого члена семейства Poxviridae, в частности птичий вирус (например, ALVAC, как описано в WO 95/27780), вирус оспы кур (например, TROVAC, как описано в Paoletti et al., 1995, Dev. Biol. Stand. 84, 159-163) или вирус осповакцины, где последний предпочтителен. Пригодный вирус осповакцины может быть выбран из группы, состоящей из копенгагенского штамма (Goebel et al., 1990, Virol. 179, 247-266 и 517-563; Johnson et al., 1993, Virol. 196, 381-401), штамма Уайетт, NYVAC (см. WO 92/15672 и Tartaglia et al., 1992, Virology 188, 217-232) и высоко аттенуированного модифицированного штамма Анкара (MVA) (Mayr et al., 1975, Infection 3, 6-16). Такие векторы и способы получения описаны в различных документах, доступных специалистам в данной области техники (например, Paul et al., 2002, Cancer gene Ther. 9, 470-477; Piccini et al., 1987, Methods of Enzymology 153, 545-563; US 4769330; US 4772848; US 4603112; US 5100587 и US 5179993). Первая и вторая молекулы нуклеиновой кислоты, используемые в настоящем изобретении, предпочтительно встроены в несущественный локус поксвирусного генома с той целью, чтобы рекомбинантный поксвирус оставался жизнеспособным и инфекционным. Несущественные области представляют собой некодирующие межгенные области или любой ген, для которого инактивация и делеция значительно не нарушают рост, репликацию или инфекцию вируса. Можно также рассматривать вставку в незаменимый вирусный локус при условии, что дефектная функция обеспечивается in trans в процессе продуцирования вирусных частиц, например, путем использования хелперной клеточной линии, несущей комплементирующие последовательности, соответствующие делегированным в поксвирусном геноме.
При использовании копенгагенского вируса осповакцины по меньшей мере первую и вторую молекулы нуклеиновой кислоты предпочтительно встраивают в ген тимидинкиназы (tk) (Hruby et al., 1983, Proc. Natl. Acad. Sci USA 80, 3411-3415; Weir et al., 1983, J. Virol. 46, 530-537). Однако другие сайты инсерции также пригодны, например ген гемагглютинина (Guo et al., 1989, J. Virol. 63, 4189-4198), в локус K1L в гене u (Zhou et al., 1990, J. Gen. Virol. 71, 2185-2190) или при левом конце генома вируса осповакцины, где в литературе описано разнообразие спонтанных или сконструированных генно-инженерным путем делеций (Altenburger et al., 1989, Archives Virol. 105, 15-27; Moss et al. 1981, J. Virol. 40, 387-395; Panicali et al., 1981, J. Virol. 37, 1000-1010; Perkus et al., 1989, J. Virol. 63, 3829-3836; Perkus et al, 1990, Virol. 179, 276-286; Perkus et al., 1991, Virol. 180, 406-410).
При использовании MVA по меньшей мере первую и вторую молекулы нуклеиновой кислоты можно независимо встраивать в любую из идентифицированных делеций I-VII, которые имеют место в геноме MVA (Antoine et al., 1998, Virology 244, 365-396), а также в локусе в D4R, но предпочтительна инсерция в делецию II и/или III (Meyer et al., 1991, J. Gen. Virol. 72, 1031-1038; Sutler et al., 1994, Vaccine 12, 1032-1040).
При использовании вируса оспы кур, хотя можно рассматривать инсерцию в ген тимидинкиназы, по меньшей мере первую и вторую молекулы нуклеиновой кислоты предпочтительно встраивают в межгенную область, расположенную между ОРС 7 и 9 (см., например, ЕР 314569 и US 5180675).
В другом воплощении изобретения по меньшей мере первая и вторая молекулы нуклеиновой кислоты независимо кодируют полипептид, способный к обеспечению терапевтической или защитной активности у субъекта, проявляющего патологическое состояние или склонного к нему. Термин "субъект", как используют здесь, относится к позвоночному, в частности к члену видов млекопитающих и особенно домашних животных, сельскохозяйственных животных, спортивных животных и приматов, включая людей. Такой полипептид предпочтительно выбран из группы, состоящей из иммуногенных полипептидов и противоопухолевых полипептидов.
"Иммуногенный" полипептид относится к полипептиду, способному к индукции, стимуляции, развитию или усилению иммунной системы у субъекта, в котором он экспрессируется. Такой иммунный ответ может быть либо гуморальным, либо клеточным, либо и гуморальным, и клеточным. Гуморальный ответ вызывает продуцирование антител против обсуждаемого полипептида, тогда как клеточный ответ вызывает ответ Т-хелперных клеток и/или CTL, и/или стимуляцию продуцирования цитокинов. Типично иммуногенное свойство полипептида можно оценить либо in vitro, либо in vivo с помощью ряда анализов, которые являются стандартными в данной области техники (общее описание методик, доступных для оценки возникновения и активации иммунного ответа, см., например, в последнем издании Coligan et al., Current Protocols in Immunology; ed J Wiley & Sons Inc, National Institute of Health). Например, обнаружение может быть колориметрическим, флуорометрическим или радиоактивным, и пригодные методики включают ЭЛАЙЗА, Вестерн-блоттинг, радиоиммунологические анализы и анализы иммунопреципитации. Измерение клеточного иммунитета можно осуществить путем измерения профилей цитокинов, секретируемых активированными эффекторными клетками, включая клетки, имеющие происхождение от CD4+ и CD8+ Т-клеток (например, количественного определения клеток, продуцирующих ИФНg, с помощью ELIspot), путем определения статуса активации иммунных эффекторных клеток (например, анализы пролиферации Т-клеток на основании классического анализа захвата [3H]тимидина), путем анализа на антиген-специфичные Т-лимфоциты у сенсибилизированного субъекта (например, пептид-специфичного лизиса в анализе цитотоксичности). Иммуногенное свойство полипептида можно также оценить в подходящих животных моделях с помощью ELIspot, аналитических методик, основанных на тетрамерах, или других стандартных методик анализа Т-клеточно-опосредованного иммунитета. Пригодные иммуногенные полипептиды могут быть получены из вируса гепатита В (HBV) (например, S, preS2 или preS1-полипептид, как описано в ЕР 414374; ЕР 304578 или ЕР 198474); вируса гепатита С (HCV) (например, Core (С), гликопротеин оболочки Е1, Е2, неструктурный полипептид NS2, NS3, NS4 или NS5 или любая их комбинация); вируса иммунодефицита человека (ВИЧ) (например, gp120 или gp160) и папилломавируса (как проиллюстрировано здесь ниже).
"Противоопухолевый" полипептид относится к полипептиду, способному обеспечить супрессию или абсолютное сокращение распространения опухолевых клеток. Противоопухолевое свойство полипептида можно определить в соответствующих животных моделях или у субъекта, подлежащего лечению, на основании снижения действительного размера опухоли за период времени. Ряд способов можно использовать для оценки размера опухоли, включая радиологические способы (например, однофотонную и позитронную эмиссионную компьютерную томографию; см. в общем "Nuclear Medicine in Clinical Oncology", Winkler, C. (ed.), Springer-Verlag, New York, 1986), способы, в которых используют общепринятые реагенты визуализации (например, галлия-67 цитрат), иммунологические способы (например, радиоактивно меченное моноклональное антитело, направленное на специфичные опухолевые маркеры), а также ультразвуковые способы исследования (см. "Ultrasonic Differential Diagnosis of Tumors", Kossoff and Fukuda (eds.), Igaku-Shoin, New York, 1984). Альтернативно противоопухолевое свойство полипептида можно определить на основании снижения присутствия опухолевого маркера. Примеры включают ПСА (простатоспецифический антиген) для обнаружения рака простаты и РЭА (раковоэмбриональный антиген) для обнаружения рака прямой и ободочной кишки и некоторых раков молочной железы. Кроме того, противоопухолевое свойство полипептида можно определить в подходящей животной модели, например, используя мышь, которой инъецировали репрезентативную клеточную линию рака человека. После развития пальпируемых опухолей мышам инъецируют вектор по изобретению, а затем проводят мониторинг сниженной скорости опухолевого роста и повышенной выживаемости. Кроме того, рад способов in vitro можно использовать для предсказания ингибирования опухоли in vivo. Пригодные противоопухолевые полипептиды включают опухоль-ассоциированные антигены (ТАА), такие как MUC-1 (WO 92/07000; Acres et al, 2005, Exp. Rev. Vaccines 4(4)), BRCA-1, BRCA-2 (Palma et al., 2006, Critical Reviews in Oncology/haematology 27, 1-23), раковоэмбриональный антиген РЭА (Conroy et al., 1995, Gene Ther; 2, 59-65), MAGE (WO 99/40188; De Plaen et al., 1994, Immunogenetics 40, 360-369), MART-1, gp 100 (Bakker et al., 1994, J. Exp. Med. 179, 1005-9), PRAME, BAGE, Lage (также известный как NY Eos 1) SAGE, HAGE (WO 99/53061), GAGE (Robbins and Kawakami, 1996, Current Opinions in Immunol. 8, 628-36) и простатоспецифический антиген (ПСА) (Ferguson, et al., 1999, Proc. Natl. Acad. Sci. USA. 96, 3114-9; WO 98/12302, WO 98/20117 и WO 00/04149), а также вирусные полипептиды из вирусов, обладающих опухолеиндуцирующим потенциалом (например, папилломавируса).
В другом воплощении изобретения по меньшей мере первая и вторая молекулы нуклеиновой кислоты получены от одного и того же организма или от близкородственных организмов.
Как используют здесь, термин "организм" охватывает как микроорганизмы, предпочтительно обладающие патогенным потенциалом, так и высшие эукариоты. Термином "микроорганизм" обозначают грибы, бактерии, простейших и вирусы. Репрезентативные примеры вирусов включают без ограничения ВИЧ (ВИЧ-1 или ВИЧ-2), человеческие вирусы герпеса (например, HSV1 или HSV2), цитомегаловирус (CMV), вирус Эпштейна-Барра (EBV), вирусы гепатита (например, вирус гепатита A (HAV), HBV, HCV и вирус гепатита Е), флавивирусы (например, вирус желтой лихорадки), вирус ветряной оспы (VZV), парамиксовирусы, респираторно-синцитиальные вирусы, вирусы парагриппа, вирус кори, вирусы гриппа и папилломавирусы (как определено выше). Репрезентативные примеры пригодных бактерий включают без ограничения Neisseria (например, N. gonorrhea и N. meningitidis); Bordetella (например, В. pertussis, В. parapertussis и В. bronchiseptica), Mycobacteria (например, М. tuberculosis, M. bovis, M. leprae, М. avium, M. paratuberculosis, M. smegmatis); Legionella (например, L. pneumophila); Escherichia (например, энтеротоксические Е. coli, энтерогеморрагические Е. coli, энтеропатогенные Е. coli); Shigella (например, S. sonnei, S. dysenteriae, S. flexnerii); Salmonella (например, S. typhi, S. paratyphi, S. choleraesuis, S. enteritidis); Listeria (например, L. monocytogenes); Helicobacter (например, H. pylori); Pseudomonas (например, P. aeruginosa); Staphylococcus (например, S. aureus, S. epidermidis); Enterococcus (например, Е. faecalis, Е. faecium); Bacillus (например, В. anthracis); Corynebacterium (например, С. diphtheriae) и Chlamydia (например, С. trachomatis, С. pneumoniae, С. psittaci). Репрезентативные примеры паразитов включают без ограничения Plasmodium (например, Р. falciparum); Toxoplasma (например, Т. gondii); Leshmania (например, L. major); Pneumocystis (например, Р. carinii) и Schisostoma (например, S. mansoni). Репрезентативные примеры грибов включают без ограничения Candida (например, С. albicans) и Aspergillus. Высшие эукариоты предпочтительно представляют собой млекопитающих, включая людей.
"Один и тот же организм" определяет организмы, которые имеют происхождение от общего предка и проследовали один и тот же путь эволюции. Репрезентативные примеры включают различные изоляты вирусов, имеющих один и тот же серотип или генотип. Например, два изолята HPV-16 классифицируют в данной категории. "Близкородственные организмы" определяют организмы, которые имеют происхождение от общего предка, но претерпели дивергенцию в ходе эволюции. Репрезентативные примеры включают вирусы, имеющие различные серотипы или генотипы. Например, HPV-16 и HPV-18 классифицируют в данной категории.
В предпочтительном воплощении организм, для которого получают по меньшей мере первую и вторую молекулы нуклеиновой кислоты, представляет собой папилломавирус, и каждая кодирует папилломавирусный полипептид. "Папилломавирус" можно определить как вирус, который принадлежит к подсемейству Papillomavirinae, и этот термин охватывает как папилломавирус животных видов, имеющих происхождение не от человека, включая, но не ограничиваясь ими, крупный рогатый скот, лошадей, кроликов, овец, собак, не человекообразных приматов и грызунов, так и человеческий папилломавирус (HPV). К настоящему времени идентифицировано более чем 100 генотипов HPV (Van Ranst et al., 1992, J. Gen. Virol. 73, 2653; De Villiers et al., 2004, Virology 324, 17-27), которые классифицированы на серотипы "низкого" (LR) и "высокого риска" (HR) в зависимости от их онкогенного потенциала. LR HPV вызывает доброкачественные опухоли у инфицированных субъектов, тогда как HR несет высокий риск злокачественного прогрессирования.
Далее даны общие сведения о папилломавирусах. Папилломавирусы обладают двунитевой кольцевой ДНК примерно из 7900 пар оснований, которая окружена белковым капсидом (см., например, Pfister, 1987, in The papovaviridae: The Papillomaviruses, Salzman and Howley edition, Plenum Press, New York, p. 1-38). Их геном состоит из трех функциональных областей, областей раннего (Е), позднего (L) и длительного контроля (LCR). LCR содержат транскрипционные регуляторные последовательности, такие как энхансеры и промоторы. Поздняя область кодирует структурные белки L1 и L2, соответственно, большой и малый капсидные белки, тогда как ранняя область кодирует регуляторные белки (Е1-Е7), обнаруженные преимущественно в ядре, которые регулируют вирусную репликацию, транскрипцию и клеточную трансформацию. Более конкретно белок Е1 представляет собой ДНК-связывающий фосфопротеин с АТФ-зависимой геликазной активностью (Desaintes and Demeret, 1996, Semin. Cancer Biol. 7, 339-347; Wilson et al., 2002, Virus Gene 24, 275-290). Белок Е2 представляет собой многофункциональный ДНК-связывающий фосфопротеин, который регулирует транскрипцию вирусных генов и контролирует репликацию ДНК (Bechtold et al., 2003, J. Virol. 77, 2021-8). Е4-кодируемый белок связывает и прерывает сеть цитоплазматического кератина и играет роль в созревании вируса. Функция белка Е5 является все еще спорной, и его экспрессия часто утрачена в процессе интеграции вируса в хромосомы хозяина. Е6 и Е7-кодируемые генные продукты генотипов HR HPV вовлечены в онкогенную трансформацию инфицированных клеток (Kanda et al., 1988, J. Virol. 62, 610-3; Vousden et al., 1988, Oncogene Res. 3, 1-9; Bedell et al., 1987, J. Virol. 61, 3635-40), преимущественно посредством связывания этих вирусных белков с продуктами клеточного гена опухолевой супрессии р53 и ретинобластомы (Rb), соответственно (обзор в Howley, 1996, Papillomaviruses and their replication, p. 2045-2076. In B.N. Fields, D.M. Knipe and P.M. Howley (ed), Virology, 3rd ed. Lippincott-Raven Press, New York, N.Y.). Аминокислотные остатки, вовлеченные в связывание нативного полипептида HPV-16 Е6 с р53, четко определены от остатков 118-122 (+1 представляет собой первый остаток Met) или от остатков 111-115, начиная от предпочтительно используемого второго остатка Met (Crook et al., 1991, Cell 67, 547-556), и остатки, вовлеченные в связывание нативного полипептида HPV-16 E7 с Rb, локализованы от остатка 21 до 26 (Munger et al., 1989, EMBO J.8, 4099-4105; Heck et al., 1992, Proc. Natl. Acad. Sci. USA 89,4442-4446).
Предпочтительно по меньшей мере первую и вторую молекулы нуклеиновой кислоты независимо получают из папилломавируса высокого риска, выбранного из группы, состоящей из HPV-16, HPV-18, HPV-30, HPV-31, HPV-33, HPV-35, HPV-39, HPV-45, HPV-51, HPV-52, HPV-56, HPV-58, HPV-59, HPV-66, HPV-68, HPV-70 и HPV-85.
"Папилломавирусный полипептид", как используют здесь, относится к известному в данной области техники полипептиду, кодируемому молекулой нуклеиновой кислоты, полученной из папилломавирусного генома/источника. Как определено выше в связи с термином "полипептид", "папилломавирусный полипептид" охватывает нативные, модифицированные папилломавирусные полипептиды и их пептиды. Источники папилломавируса включают без ограничения биологические образцы (например, биологические образцы, тканевые срезы, биоптат и тканевые культуры, собранные от субъекта, который подвергнут воздействию папилломавируса), культивируемые клетки (например, клетки CaSki, доступные в АТСС), а также рекомбинантные материалы, доступные в депозитных учреждениях, в коммерческих каталогах или описанные в литературе. Нуклеотидные последовательности ряда папилломавирусных геномов и аминокислотные последовательности кодируемых полипептидов описаны в литературе и доступны в специализированных базах данных, например, Genbank. В качестве общей информации, геном HPV-16 описан в Genbank под номерами по каталогу МС_01526 и K02718; HPV-18 под NC_001357 и Х05015; HPV-31 под J04353; HPV-33 под М12732; HPV-35 под NC_001529; HPV-39 под NC_001535; HPV-45 под Х74479; HPV-51 под NC_001533; HPV-52 под NC_001592; HPV-56 под Х74483; HPV-58 под D90400; HPV-59 под NC_001635; HPV-68 под Х67160 и М73258; HPV-70 под U21941; и HPV-85 под AF131950.
Папилломавирусный полипептид(ы), кодируемый первой и/или второй молекулой(ами) нуклеиновой кислоты, может представлять собой ранний, поздний или любую их комбинацию. Ранние папилломавирусные полипептиды включают Е1, Е2, Е4, Е5, Е6 и Е7, тогда как поздние полипептиды могут представлять собой L1 или L2. Нуклеотидные и аминокислотные последовательности ранних и поздних полипептидов подавляющего большинства папилломавирусных серотипов описаны в литературе, доступной специалистам в данной области техники.
Желательно, чтобы по меньшей мере первая и вторая молекулы нуклеиновой кислоты независимо кодировали ранний полипептид, выбранный из группы, состоящей из Е1, Е2, Е6 и Е7. В целях иллюстрации аминокислотные последовательности нативных полипептидов HPV-16 Е1, Е2, Е6 и Е7 приведены соответственно в SEQ ID NO: 1-4. Однако настоящее изобретение не ограничено этими последовательностями, приведенными в качестве примеров. Действительно, нуклеотидные и аминокислотные последовательности могут варьировать между различными изолятами папилломавируса, и эта естественная генетическая изменчивость включена в объем изобретения, как и неприродная модификация(и), такая как описано ниже. Примерная иллюстрация пригодных модифицированных папилломавирусных полипептидов приведена здесь ниже (например, в SEQ ID NO: 5-8 и 64-65), однако, в пределах, достижимых специалистами в данной области техники, находится адаптация, описанная здесь (например, к полипептидам, имеющим происхождение от других папилломавирусных генотипов, на основании сравнения последовательности).
Пригодные папилломавирусные полипептиды Е1 для применения в настоящем изобретении охватывают мутанты, которые являются дефектными по стимуляции вирусной репликации, то есть их способность стимулировать вирусную репликацию статистически значимо ниже, чем таковая для соответствующего нативного полипептида Е1 (например, менее чем 75%, преимущественно менее чем 50%, предпочтительно менее чем 10% и более предпочтительно менее чем 5%). В качестве общего руководства, домен, ответственный за стимуляцию вирусной репликации, локализован в центральном участке Е1 (например, Hugues and Romanos, 1993, Nucleic Acids Res.21, 5817-23). Репрезентативные примеры репликационно-дефектных полипептидов Е1 описаны в литературе, доступной специалистам в данной области техники, например, в Yasugi et al. (1997, J. Virol 71, 5942-51). Предпочтительная модификация в контексте изобретения включает замену остатка Gly в положении 482 HPV-16 Е1 полипептида другим остатком (предпочтительно остатком Asp) (например, см. SEQ ID NO: 5) или замену остатка Gly в положении 489 HPV-18 Е1 полипептида другим остатком (предпочтительно остаток Asp (например, см. SEQ ID NO: 6).
Пригодные полипептиды Е2 для применения в изобретении охватывают мутанты, которые дефектны по активностям транскрипционной активации и/или репликации по сравнению с нативным полипептидом Е2 (например, менее чем 75%, преимущественно менее чем 50%, предпочтительно менее чем 10% и более предпочтительно менее чем 5%). В качестве общего руководства, домен, ответственный за транскрипционную активацию и стимуляцию репликации, локализован в N-концевом участке Е2 (Seedorf et al., 1985, Virology, 145, 181-185; Kennedy et al., 1991, J. Virol. 65, 2093-2097; Cole et al., 1987, J. Mol. Biol. 193, 599-608; McBride et al., 1989, Proc. Natl. Acad. Sci. USA, 86, 510-514), и снижение или отсутствие репликации и транскрипционных активностей Е2 можно легко определить, используя стандартные способы (см., например, Sakai et al., 1996, J. Virol. 70, 1602-1611). Пригодные дефектные мутанты Е2 для применения в настоящем изобретении описаны в литературе, доступной специалистам в данной области техники, например, в Demeret et al. (1995, Nucleic Acids Res. 23, 4777-4784), Sakai et al. (1996, J. Virol. 70, 1602-1611), Brokaw et al. (1996, J. Virology 70, 23-29) и Ferguson et al. (1996, J. Virology 70, 4193-4199). Предпочтительные модификации в контексте изобретения включают замену остатка Glu в положении 39 HPV-16 Е2 предпочтительно остатком Ala (E39A) и/или замену остатка Не в положении 73 предпочтительно остатком Ala (I73A) (например, см. SEQ ID NO: 7). В целях иллюстрации остатки Glu и Ile в положениях 39 и 73 HPV-16 Е2 соответствуют, соответственно, остаткам Glu и Ile в положениях 43 и 77 HPV-18 Е2 (например, см. SEQ ID NO: 8).
Пригодные полипептиды Е6 для применения в изобретении охватывают не онкогенные мутанты, которые дефектны по связыванию с продуктом клеточного гена опухолевого супрессора р53. Репрезентативные примеры не онкогенных полипептидов Е6 описаны, например, в Pim et al. (1994, Oncogene 9, 1869-1876) и Crook et al. (1991, Cell 67, 547-556). Предпочтительные модификации в данном контексте включают делецию в HPV-16 E6 остатков 118-122 (CPEEK) (например, см. SEQ ID NO: 64) или делецию в HPV-18 E6 остатков 113-117 (NPAEK).
Пригодные полипептиды Е7 для применения в изобретении охватывают не онкогенные мутанты, которые дефектны по связыванию с продуктом клеточного гена опухолевого супрессора Rb. Репрезентативные примеры не онкогенных полипептидов Е7 описаны, например, в Munger et al. (1989, EMBO J. 8, 4099-4105), Heck et al. (1992, Proc. Natl. Acad. Sci. USA 89, 4442-4446) и Phelps et al. (1992, J. Virol. 66, 2148-2427). Предпочтительные модификации в данном контексте включают делецию в HPV-16 Е7 остатков 21-26 (DLYCYE) (например, см. SEQ ID NO: 65) или делецию в HPV-18 Е7 остатков 24-28 (DLLCH).
Кроме того, полипептиды (например, папилломавирусные полипептиды), кодируемые по меньшей мере первой и/или второй молекулами нуклеиновой кислоты, могут дополнительно содержать дополнительные модификации, которые полезны для процессинга, стабильности и/или растворимости кодируемых полипептидов, например, супрессию потенциального сайта(ов) расщепления, супрессию потенциального сайта(ов) гликозилирования и/или презентацию на поверхности экспрессирующих клеток. Например, кодируемый полипептид(ы) могут включать пригодные сигналы для заякоривания в плазматической мембране экспрессирующих клеток. Действительно, ранее показано, что мембранная презентация дает возможность улучшить презентацию ГКС класса I и/или ГКС класса II, приводящую в результате к усилению распознавания иммунной системой хозяина (см., например, WO 99/0388). Поскольку нативные ранние папилломавирусные полипептиды (Е1, Е2, E6 и Е7) представляют собой ядерные белки (хотя типичный сигнал ядерной локализации не мог быть четко идентифицирован), могла бы быть полезной их направленная доставка к плазматической мембране с целью улучшения их иммуногенного потенциала и, следовательно, их терапевтической эффективности у субъекта-хозяина.
Эффективная мембранная презентация полипептида на поверхности экспрессирующей клетки-хозяина может быть достигнута путем гибридизации полипептида с сигнальным пептидом и пептидом, обеспечивающим заякоривание в мембране. Такие пептиды известны в данной области техники. Кратко, сигнальные пептиды обычно присутствуют при N-конце презентируемых на мембране или секретируемых полипептидов и инициируют их прохождение в эндоплазматический ретикулум (ЭР). Они содержат от 15 до 35 по существу гидрофобных аминокислот, которые затем удаляются специфичной ЭР-локализованной эндопептидазой с образованием зрелого полипептида. Пептиды, обеспечивающие заякоривание в мембране, обычно являются в высокой степени гидрофобными по природе и служат для заякоривания полипептидов в клеточной мембране (см., например, Branden and Tooze, 1991, in Introduction to Protein Structure p.202-214, NY Garland). Выбор сигнальных и обеспечивающих заякоривание в мембране пептидов, которые можно использовать в контексте настоящего изобретения, широк. Они могут быть независимо получены из любого секретируемого или заякориваемого в мембране полипептида (например, из клеточных или вирусных полипептидов), таких как гликопротеин вируса гидрофобии, гликопротеин оболочки вируса ВИЧ или белок F вируса кори, либо могут быть синтетическими. Предпочтительным сайтом инсерции сигнального пептида является сайт при N-конце ниже кодона инициации трансляции по ходу транскрипции, а сайтом инсерции пептида, обеспечивающего заякоривание в мембране, является С-конец, например, непосредственно выше стоп-кодона против хода транскрипции. При необходимости можно использовать линкерный пептид для соединения сигнального пептида и/или пептида, обеспечивающего заякоривание в мембране, с кодируемым полипептидом.
Репрезентативные примеры заякоренных в мембране и дефектных полипептидов Е1, пригодных для применения в изобретении, приведены в SEQ ID NO: 5 (определение полипептида HPV-16 SS-E1*-TMR, проиллюстрированного в разделе примеров) и в SEQ ID NO: 6 (определение полипептида HPV-18 SS-E1*-TMF, проиллюстрированного в разделе примеров). Репрезентативные примеры заякоренных в мембране и дефектных полипептидов Е2, пригодных для применения в изобретении, приведены в SEQ ID NO: 7 (определение полипептида HPV-16 SS-E2*-TMR, проиллюстрированного в разделе примеров) и в SEQ ID NO: 8 (определение полипептида HPV-18 SS-E2*-TMR, проиллюстрированного в разделе примеров). Репрезентативные примеры заякоренных в мембране и не онкогенных полипептидов Е6 и Е7, пригодных для применения в изобретении, приведены соответственно в SEQ ID NO: 64 (определение полипептида HPV-16 SS-E6*-TMF, проиллюстрированного в разделе примеров) и в SEQ ID NO: 65 (определение полипептида HPV-16 SS-E7*-TMR, проиллюстрированного в разделе примеров).
В особенно предпочтительном воплощении по меньшей мере первая молекула нуклеиновой кислоты и вторая молекула нуклеиновой кислоты кодируют два различных папилломавирусных полипептида, полученных от одного и того же серотипа HPV.
В предпочтительном аспекте данного воплощения первая молекула нуклеиновой кислоты кодирует полипептид Е1, а вторая молекула нуклеиновой кислоты кодирует полипептид Е2, или наоборот. Желательно Е1 и Е2-кодирующие молекулы нуклеиновой кислоты получены от HPV-16 или от HPV-18. Предпочтительно первая молекула нуклеиновой кислоты кодирует полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 5, либо по существу состоящий, либо состоящий из нее, а вторая молекула нуклеиновой кислоты кодирует полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 7, либо по существу состоящий, либо состоящий из нее. Альтернативно первая молекула нуклеиновой кислоты кодирует полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 6, либо по существу состоящий, либо состоящий из нее, а вторая молекула нуклеиновой кислоты кодирует полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 8, либо по существу состоящий, либо состоящий из нее.
В нативном окружении (например, в геноме HPV-16 или HPV-18) 3' участок E1-кодирующей последовательности перекрывает 5' участок Е2-кодирующей последовательности на 59 нуклеотидов. Ожидают, что присутствие этих на 100% гомологичных 59 нуклеотидов отрицательно влияет на стабильность вектора, экспрессирующего обе Е1 и Е2-кодирующие молекулы нуклеиновой кислоты. Между этими общими участками может происходить гомологичная рекомбинация и приводить к потере нуклеотидных последовательностей, содержащихся между ними.
В соответствии с настоящим изобретением 100% гомология между перекрывающимся участком из 59 нуклеотидов, присутствующая до модификации в Е1 и Е2-кодирующих молекулах нуклеиновой кислоты, может быть снижена до значения менее чем 75% путем вырождения паттерна использования кодона в одной из молекул нуклеиновой кислоты. Репрезентативный пример вырожденных последовательностей приведен в SEQ ID NO: 9, в которой гомология в Е1/Е2 перекрывающихся 59 нуклеотидов снижена до 69% (как проиллюстрировано на фиг.1), и предпочтительный вектор по изобретению, кодирующий полипептиды HPV-16 Е1 и Е2, включает нуклеотидную последовательность, показанную в SEQ ID NO: 9. Та же стратегия может быть применена к перекрывающемуся участку, присутствующему в HPV-18 Е1 и Е2-кодирующих последовательностях. Такие вырожденные последовательности могут быть введены в E1-кодирующую первую молекулу нуклеиновой кислоты при замещении нативных перекрывающихся 59 нуклеотидов (например, SEQ ID NO: 10 и 11, соответственно).
Соответственно, предпочтительный вектор по изобретению включает первую молекулу нуклеиновой кислоты, содержащую нуклеотидная последовательность, показанную в SEQ ID NO: 10 (которая кодирует полипептид HPV-16 E1 SEQ ID NO: 5), либо по существу состоящую, либо состоящую из нее, и вторую молекулу нуклеиновой кислоты, содержащую нуклеотидная последовательность, показанную в SEQ ID NO: 12 (которая кодирует полипептид HPV-16 Е2 SEQ ID NO: 7), либо по существу состоящую, либо состоящую из нее. Другой предпочтительный вектор по изобретению включает первую молекулу нуклеиновой кислоты, содержащую нуклеотидная последовательность, показанную в SEQ ID NO: 11 (которая кодирует полипептид HPV-18 E1 SEQ ID NO: 6), либо по существу состоящую, либо состоящую из нее, и вторую молекулу нуклеиновой кислоты, содержащую нуклеотидная последовательность, показанную в SEQ ID NO: 13 (которая кодирует полипептид HPV-18 Е2 SEQ ID NO: 8), либо по существу состоящую, либо состоящую из нее. Более предпочтительно вектор по изобретению представляет собой MVA вектор, первая (E1-кодирующая) молекула нуклеиновой кислоты помещена под контролем промотора 7.5K вируса осповакцины, и вторая (Е2-кодирующая) молекула нуклеиновой кислоты помещена под контролем промотора H5R вируса осповакцины, и обе, первая и вторая, молекулы нуклеиновой кислоты встроены в делецию III указанного вектора MVA.
Изобретение также относится к вектору, содержащему первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E1, вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е2, третью молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E1, и четвертую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е2, где указанная первая, вторая, третья и четвертая молекулы нуклеиновой кислоты не содержат участок из 40 или большего числа непрерывных нуклеотидов, проявляющих процент гомологии 75% или выше чем 75%. Предпочтительно указанный полипептид HPV-16 E1 содержит аминокислотную последовательность, показанную в SEQ ID NO: 5, указанный полипептид HPV-16 Е2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 7, указанный полипептид HPV-18 E1 содержит аминокислотную последовательность, показанную в SEQ ID NO: 6 и/или указанный полипептид HPV-18 Е2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 8.
В нативном окружении HPV-16 и HPV-18 E1-кодирующие последовательности содержат несколько участков из 40 или большего числа непрерывных нуклеотидов, проявляющих процент гомологии 80% или выше чем 80%. То же верно в отношении HPV-16 и HPV-18 Е2-кодирующих последовательностей. Кроме того, соседние Е1 и Е2-кодирующие последовательности перекрываются на протяжении участка приблизительно из 59 нуклеотидов в геномах HPV-16 и HPV-18. В этой связи рекомендуют модифицировать последовательности HPV-18 Е1 и Е2-кодирующих молекул нуклеиновой кислоты таким образом, чтобы снизить гомологию с их HPV-16 двойниками до значения менее чем 75%, особенно в гомологичных участках, общих для обоих серотипов. Для этой цели нуклеотидные последовательности генов HPV-16 и HPV-18 Е1 и Е2 могут быть выровнены, и могут быть сконструированы модификации на нуклеотидном уровне, таким образом, чтобы снизить гомологию по меньшей мере до 8, 7, 6 или предпочтительно 5 последовательных нуклеотидов. Кроме того, последовательность HPV-18 Е1 может быть дополнительно модифицирована, чтобы снизить гомологию до значения менее чем 75% с участком из 59 нуклеотидов, перекрывающим 5' конец последовательности HPV-18 Е2. Предпочтительно частоту использования кодонов модифицируют, но модификации не транслируются на аминокислотном уровне, за исключением создания модификаций, как определено здесь, например, с получением в результате дефектных ферментативных функций. Репрезентативные примеры "вырожденных" HPV-18 Е1- и HPV-18 Е2-кодирующих нуклеотидных последовательностей, которые можно пригодно использовать в качестве третьей и четвертой молекул нуклеиновой кислоты, приведены в SEQ ID NO: 11 и SEQ ID NO: 13, соответственно. Предпочтительный вектор по изобретению включает первую молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 10 (кодирующую полипептид HPV-16 Е1, показанный в SEQ ID NO: 5), либо по существу состоящую, либо состоящую из нее, вторую молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 12 (кодирующую полипептид HPV-16 Е2, показанный в SEQ ID NO: 7), либо по существу состоящую, либо состоящую из нее, третью молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 11 (кодирующую полипептид HPV-18 Е1, показанный в SEQ ID NO: 6), либо по существу состоящую, либо состоящую из нее, и четвертую молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 13 (кодирующую полипептид HPV-18 Е2, показанный в SEQ ID NO: 8), либо по существу состоящую, либо состоящую из нее. Предпочтительно вектор представляет собой вектор MVA, первая, вторая, третья и четвертая молекулы нуклеиновой кислоты встроены в делецию III вектора MVA, первая и третья (E1-кодирующие) молекулы нуклеиновой кислоты помещены в противоположной ориентации, каждая под контролем промотора р7.5K вируса осповакцины, а вторая и четвертая (Е2-кодирующие) молекулы нуклеиновой кислоты помещены в противоположной ориентации, каждая под контролем промотора pH5R вируса осповакцины.
В другом особенно предпочтительном воплощении по меньшей мере первая молекула нуклеиновой кислоты и вторая молекула нуклеиновой кислоты кодируют один и тот же полипептид, полученный от близкородственных организмов, например близкородственных серотипов HPV, таких как HPV-16, HPV-18, HPV-33 и/или HPV-52.
В первом аспекте данного воплощения один и тот же полипептид, полученный от близкородственных организмов, предпочтительно представляет собой полипептид Е2. Кодируемые полипептиды Е2 предпочтительно модифицированы таким образом, что являются заякоренными в мембране и дефектными по вирусной репликации, как определено здесь. В нативном окружении Е2-кодирующие последовательности различных генотипов проявляют высокую степень гомологии на нуклеотидном уровне, в частности в наиболее консервативных участках. Ожидают, что присутствие этих гомологичных последовательностей отрицательно влияет на стабильность вектора, совместно экспрессирующего два или более чем два (например, 3, 4 или даже большее число) гена Е2, например, гены Е2 от HR HPV, таких как HPV-16, HPV-18, HPV-33 и HPV-52. Между этими последовательностями гомологичных генов может происходить гомологичная рекомбинация и приводить к потере нуклеотидных последовательностей, содержащихся между ними, и, следовательно, к инактивации генов.
В соответствии с настоящим изобретением молекулы нуклеиновой кислоты, кодирующие полипептиды Е2, включенные в вектор по изобретению, могут быть модифицированы путем вырождения паттерна использования кодона таким образом, чтобы снизить гомологию до значения менее чем 75%, особенно в высокогомологичных участках. Репрезентативные примеры вырожденных молекул нуклеиновой кислоты, кодирующих полипептиды Е2, приведены в SEQ ID NO: 13, 66, 67, 68 и 69. Более конкретно SEQ ID NO: 13 кодирует презентированный на мембране и дефектный по репликации полипептид HPV-18 Е2, нуклеотидная последовательность которого сконструирована таким образом, чтобы снизить гомологию с его Е2-кодирующими двойниками менее чем до 8 или 7 последовательных нуклеотидов. SEQ ID NO: 66 и 67 обе кодируют дефектный по репликации полипептид HPV-33 E2 (он является, кроме того, презентированным на мембране в SEQ ID NO: 67), нуклеотидные последовательности которого сконструированы таким образом, чтобы снизить гомологию с его Е2-кодирующими двойниками менее чем до 8 или 7 последовательных нуклеотидов. SEQ ID NO: 68 и 69 обе кодируют дефектный по репликации полипептид HPV-52 E2 (он является, кроме того, презентированным на мембране в SEQ ID NO: 69), нуклеотидные последовательности которого сконструированы таким образом, чтобы снизить гомологию с его Е2-кодирующими двойниками менее чем до 8 или 7 последовательных нуклеотидов. Однако настоящее изобретение не ограничено этими примерными последовательностями, и альтернативные варианты вырожденных молекул нуклеиновой кислоты, кодирующих папилломавирусные полипептиды E2, как определено выше, могут быть сконструированы по этому принципу.
Предпочтительный вектор по изобретению содержит первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, как определено здесь (например, презентированный на мембране и дефектный по репликации полипептид E2, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 7), вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, как определено здесь (например, презентированный на мембране и дефектный по репликации полипептид E2, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 8), третью молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2, как определено здесь (например, презентированный на мембране и дефектный по репликации полипептид E2, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 70), и четвертую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2, как определено здесь (например, презентированный на мембране и дефектный по репликации полипептид E2, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 71). Более предпочтительно первая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 12, или по существу состоит из нее; вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 13, или по существу состоит из нее; третья молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 67, или по существу состоит из нее, и/или четвертая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 69, или по существу состоит из нее. Более предпочтительно вектор по изобретению представляет собой вектор MVA, и четыре Е2-кодирующие молекулы нуклеиновой кислоты встроены в делецию III. Даже более предпочтительно первая и вторая молекулы нуклеиновой кислоты каждая находятся под контролем промотора H5R вируса осповакцины и помещены в обращенной ориентации, тогда как третья и четвертая молекулы нуклеиновой кислоты каждая находятся под контролем промотора р7.5K вируса осповакцины и помещены в обращенной ориентации.
В другом аспекте данного воплощения один и тот же полипептид, полученный от близкородственных организмов, предпочтительно представляет собой полипептид Е6, полипептид Е7 или оба полипептида Е6 и Е7. Е6 и Е7 могут экспрессироваться независимо или в виде гибридного полипептида. Кодируемые полипептиды Е6 и/или Е7 предпочтительно модифицированы таким образом, что являются заякоренными на мембране и не онкогенными, как определено здесь.
В нативном окружении нативные последовательности Е6 HPV-16 и HPV-18 имеют 63% гомологии на нуклеотидном уровне, тогда как нативные последовательности Е7 HPV-16 и HPV-18 являются на 57% гомологичными друг с другом. Однако в обоих случаях нативные последовательности HPV-16 и HPV-18 имеют несколько общих участков из 40 или большего числа нуклеотидов, которые проявляют 80% или выше чем 80% гомологии (см. фиг.2). Ожидают, что присутствие этих гомологичных участков отрицательно влияет на стабильность вектора, совместно экспрессирующего гены Е6 и/или Е7 HPV-16 и HPV-18. Между этими участками может происходить гомологичная рекомбинация и приводить к потере нуклеотидных последовательностей, содержащихся между ними, и, следовательно, к инактивации генов.
В соответствии с настоящим изобретением молекулы нуклеиновой кислоты, кодирующие полипептиды HPV-16 и/или HPV-18 Е6 и Е7, могут быть модифицированы путем вырождения паттерна использования кодона таким образом, чтобы снизить гомологию до значения менее чем 75%, особенно в гомологичных участках. Репрезентативный пример вырожденной молекулы нуклеиновой кислоты, кодирующей полипептид HPV-18 Е6, приведен в SEQ ID NO: 14, а репрезентативный пример вырожденной модифицированной молекулы нуклеиновой кислоты, кодирующей полипептид HPV-18 Е7, приведен в SEQ ID NO: 15. Более конкретно SEQ ID NO: 14 и SEQ ID NO: 15 сконструированы таким образом, чтобы снизить гомологию с HPV-16 двойниками менее чем до 8, 7, 6 или предпочтительно 5 последовательных нуклеотидов, кодируя при этом заякоренные в мембране и не онкогенные полипептиды HPV-18 Е6 и Е7. Однако альтернативные варианты вырожденных молекул нуклеиновой кислоты, кодирующих папилломавирусные полипептиды Е6 и/или Е7, как определено выше, могут быть сконструированы по этому принципу.
Предпочтительный вектор по изобретению включает первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е6, как определено здесь (например, заякоренный в мембране и не онкогенный), и вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е6, как определено здесь (например, заякоренный в мембране и не онкогенный), где вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 14, или по существу состоит из нее. Другой предпочтительный вектор по изобретению включает первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е7, как определено здесь (например, заякоренный в мембране и не онкогенный), и вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е7, как определено здесь (например, заякоренный в мембране и не онкогенный), где вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 15, или по существу состоит из нее. Более предпочтительно вектор по изобретению представляет собой вектор MVA, первая молекула нуклеиновой кислоты помещена под контролем промотора 7.5K вируса осповакцины, а вторая молекула нуклеиновой кислоты помещена под контролем промотора H5R вируса осповакцины, и обе, первая и вторая, молекулы нуклеиновой кислоты встроены в делецию III указанного вектора MVA.
Изобретение также относится к вектору, включающему первую молекулу нуклеиновой кислоты, кодирующую гибрид полипептида HPV-16 Е6 с полипептидом HPV-16 Е7, и вторую молекулу нуклеиновой кислоты, кодирующую гибрид полипептида HPV-18 Е6 с полипептидом HPV-18 Е7, где указанные первая и вторая молекулы нуклеиновой кислоты не содержат участок из 40 или большего числа непрерывных нуклеотидов, проявляющих процент гомологии приблизительно 75% или выше чем 75%.
Изобретение также относится к вектору, включающему первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е6, вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е6, третью молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 Е7, и четвертую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 Е7, где указанные первая, вторая, третья и четвертая молекулы нуклеиновой кислоты не содержат участок из 40 или большего числа непрерывных нуклеотидов, проявляющих процент гомологии приблизительно 75% или выше чем 75%. Предпочтительно вторая молекула нуклеиновой кислоты содержит SEQ ID NO: 14, по существу состоит или состоит из нее, и/или четвертая молекула нуклеиновой кислоты содержит SEQ ID NO: 15, по существу состоит или состоит из нее. Более предпочтительно вектор по изобретению представляет собой вектор MVA, первая и вторая молекулы нуклеиновой кислоты помещены в обращенной ориентации, каждая под контролем промотора 7.5K вируса осповакцины, а третья и четвертая молекулы нуклеиновой кислоты помещены в обращенной ориентации, каждая под контролем промотора H5R вируса осповакцины, и первая, вторая, третья и четвертая молекулы нуклеиновой кислоты встроены в делецию III указанного вектора MVA.
В другом аспекте в настоящем изобретении также предложена по существу изолированная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, показанную в любой из SEQ ID NO: 9, 10, 11, 12, 13, 14, 15, 66, 67, 68 или 69, либо по существу состоящая, либо состоящая из нее.
В другом воплощении изобретения первая и вторая и, если присутствуют, третья и четвертая молекулы нуклеиновой кислоты, содержащиеся в векторе по изобретению, находятся в форме, пригодной для экспрессии кодируемых полипептидов в клетке-хозяине или субъекте-хозяине, что означает, что они помещены под контролем регуляторных последовательностей, необходимых для их экспрессии.
Как используют здесь, термин "регуляторные последовательности" относится к любой последовательности, которая дает возможность экспрессии, вносит вклад в нее или модулирует экспрессию молекулы нуклеиновой кислоты в данной клетке-хозяине, включая репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию, стабильность и/или транспорт нуклеиновой кислоты или одного из ее производных (то есть мРНК) в клетке-хозяине. В контексте настоящего изобретения регуляторные последовательности "оперативно сцеплены" с молекулой нуклеиновой кислоты, которую нужно экспрессировать, то есть они помещены в функциональных взаимоотношениях, которые дают возможность экспрессии в клетке-хозяине или субъекте-хозяине. Такие регуляторные последовательности хорошо известны в данной области техники (см., например, Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego). Специалистам в данной области техники должно быть понятно, что выбор регуляторных последовательностей может зависеть от таких факторов, как тип вектора, клетка-хозяин, желаемый уровень экспрессии и т.д.
Промотор имеет особую важность, и настоящее изобретение охватывает использование конститутивных промоторов, которые направляют экспрессию молекул нуклеиновой кислоты во многих типах клеток-хозяев, и тех, которые направляют экспрессию только в некоторых клетках-хозяевах (например, тканеспецифические регуляторные последовательности) или в ответ на специфичные события или эндогенные факторы (например, температуру, пищевую добавку, гормон или другой лиганд). Пригодные промоторы для конститутивной экспрессии в эукариотических системах включают как вирусные промоторы, такие как промотор SV40, немедленно-ранний промотор или энхансер цитомегаловируса (CMV) (Boshart et al., 1985, Cell 41, 521-530), ранний и поздний промоторы аденовируса, промотор тимидинкиназы (TK) вируса простого герпеса (HSV)-1 и ретровирусные длинные концевые повторы (например, ДКП MoMuLV и вируса саркомы Рауса (RSV)), так и клеточные промоторы, такие как промотор фосфоглицерокиназы (PGK) (Hitzeman et al., 1983, Science 219, 620-625; Adra et al., 1987, Gene 60, 65-74). Подходящие промоторы, применимые для направления экспрессии молекул нуклеиновой кислоты в поксвирусном векторе, включают промоторы 7.5K, H5R, TK, р28, р11 или K1L вируса осповакцины. Альтернативно можно использовать синтетический промотор, такой как описаны Chakrabarti et al. (1997, Biotechniques 23, 1094-1097), Hammond et al. (1997, J. Virological Methods 66, 135-138) и Kumar and Boyle (1990, Virology 179, 151-158), а также химерные промоторы между ранним и поздним поксвирусными промоторами.
Индуцибельные промоторы подлежат регуляции экзогенно обеспечиваемыми соединениями и включают без ограничения цинк-индуцибельный промотор металлотионеина (МТ) (Me Ivor et al., 1987, Mol. Cell Biol. 7, 838-848), индуцируемый дексаметазоном (Dex-индуцибельный) промотор вируса опухоли молочной железы мыши (MMTV), промоторную систему Т7 полимеразы (WO 98/10088), промотор экдизона насекомых (No et al., 1996, Proc. Natl. Acad. Sci. USA 93, 3346-3351), тетрациклин-репрессируемый промотор (Gossen et al., 1992, Proc. Natl. Acad. Sci. USA 89, 5547-5551), тетрациклин-индуцибельный промотор (Kim et al., 1995, J. Virol. 69, 2565-2573), RU486-индуцибельный промотор (Wang et al., 1997, Nat. Biotech. 15, 239-243 и Wang et al., 1997, Gene Ther. 4, 432-441), рапамицин-индуцибельный промотор (Magari et al., 1997, J. Clin. Invest. 100, 2865-2872) и промоторы lac, TRP и ТАС из Е. coli.
Регуляторные последовательности, применяемые в контексте настоящего изобретения, могут быть также тканеспецифическими, чтобы направлять экспрессию молекул нуклеиновой кислоты в конкретных тканях, где желательна терапевтическая польза. Пригодные промоторы могут быть взяты из генов, которые преимущественно экспрессируются в опухолевых клетках. Такие гены можно идентифицировать, например, с помощью дисплея и сравнительной геномной гибридизации (см., например, US 5759776 и 5776683).
Специалистам в данной области техники должно быть понятно, что регуляторные элементы, контролирующие экспрессию молекул нуклеиновой кислоты, содержащихся в векторе по изобретению, могут, кроме того, включать дополнительные элементы для правильной инициации, регуляции и/или терминации транскрипции (например, поли-А последовательности терминации транскрипции), транспорта мРНК (например, последовательности сигнала ядерной локализации), процессинга (например, сигналы сплайсинга), стабильности (например, интроны и некодирующие 5' и 3' последовательности) и трансляции (например, трехчастные лидерные последовательности, сайты связывания рибосом, последовательности Шайна-Дальгарно и т.д.) в клетке-хозяине или субъекте-хозяине.
В другом аспекте в настоящем изобретении предложены инфекционные вирусные частицы, содержащие вышеописанный вектор. Здесь не предприняты попытки подробно описать различные способы, известные для получения инфекционных вирусных частиц. Типично такие вирусные частицы получают способом, включающим стадии (а) введения вирусного вектора в подходящую клеточную линию, (б) культивирования этой клеточной линии в пригодных условиях, чтобы дать возможность продуцирования указанной инфекционной вирусной частицы, выделения продуцируемой инфекционной вирусной частицы из культуры указанной клеточной линии и, возможно, очистки указанной выделенной инфекционной вирусной частицы.
Когда вирусный вектор является дефектным, инфекционные частицы обычно продуцируют в комплементационной клеточной линии или посредством использования хелперного вируса, который восполняет in trans нефункциональные вирусные гены. Например, пригодные клеточные линии для комплементации Е1-делетированных аденовирусных векторов включают клетки 293 (Graham et al., 1997, J. Gen. Virol. 36, 59-72), клетки PER-C6 (Fallaux et al., 1998, Human Gene Ther. 9, 1909-1917) и клетки HER96. Клетками, подходящими для размножения поксвирусных векторов, являются клетки птиц, и более предпочтительно первичные эмбриональные фибробласты цыпленка (CEF), препарированные из куриных эмбрионов, полученных из оплодотворенных яиц. Клетки-продуценты можно культивировать в общепринятых ферментерах, колбах и чашках Петри при подходящих условиях температуры, pH и содержания кислорода.
Инфекционные вирусные частицы можно выделить из надосадочной жидкости культуры или из клеток после лизиса. Их можно дополнительно очистить в соответствии со стандартными методиками (хроматографии, ультрацентрифугирования, как описано, например, в WO 96/27677, WO 98/00524, WO 98/22588, WO 98/26048, WO 00/40702, EP 1016700 и WO 00/50573).
В другом аспекте в настоящем изобретении предложены клетки-хозяева, содержащие вышеописанные молекулы нуклеиновой кислоты, векторы или инфекционные вирусные частицы. Термин "клетка-хозяин", как используют здесь, определяет любую клетку, которая может быть или является реципиентом вектора или инфекционной вирусной частицы по данному изобретению, и потомство таких клеток. Этот термин следует понимать в широком смысле, как охватывающий изолированные клетки, группу клеток, а также конкретную организацию клеток, например, в ткани или органе. Такие клетки могут представлять собой первичные, трансформированные или культивируемые клетки.
Клетки-хозяева в контексте изобретения включают прокариотические клетки (например, Escherichia coli, Bacillus, Listeria), низшие эукариотические клетки, такие как дрожжи (например, Saccharomyces cerevisiae, Saccharomyces pombe или Pichia pastoris) и другие эукариотические клетки, такие как клетки насекомых, растений и высшие эукариотические клетки при особом преимуществе клеток млекопитающих (например, человеческие или не человеческие клетки). Репрезентативные примеры пригодных клеток-хозяев включают, но не ограничены ими, клетки ВНК (почек детенышей хомячка), клетки MDCK (линия клеток почек собак Мадин-Дарби), клетки CRFK (линия клеток почек кошки Крэнделла), клетки CV-1 (линия клеток почек африканской зеленой мартышки), клетки COS (например, COS-7), клетки яичника китайского хомячка (СНО), клетки мыши NIH/3T3, клетки HeLa и клетки Vero. Термин "клетка-хозяин" также охватывает комплементирующие клетки, способные к комплементации по меньшей мере одной дефектной функции репликационно-дефектного вектора по изобретению (например, аденовирусного вектора), такие как перечислены выше.
Клетки-хозяева можно использовать для продуцирования рекомбинантными способами полипептидов, кодируемых молекулами нуклеиновой кислоты, содержащимися в векторах или инфекционных частицах по изобретению. Такие методики хорошо известны в данной области техники (см., например, Ausubel, Current Protocols in Molecular Biology, John Wiley, 1987-2002; и последнее издание Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press).
В другом аспекте в настоящем изобретении предложена композиция, содержащая вышеописанные молекулы нуклеиновой кислоты, вектор, инфекционную вирусную частицу или клетку-хозяина (также называемые здесь "активным агентом") или любую их комбинацию. Преимущественно композиция представляет собой фармацевтическую композицию, которая содержит терапевтически эффективное количество активного агента(ов) и фармацевтически приемлемый носитель.
Термин "фармацевтически приемлемый носитель", как используют здесь, подразумевает включение любых и всех носителей, растворителей, разбавителей, эксципиентов, адъювантов, дисперсионных сред, покрытий, антибактериальных и противогрибковых агентов и агентов, замедляющих всасывание, и тому подобного, совместимых с фармацевтическим введением. Как используют здесь, "терапевтически эффективное количество" представляет собой дозу, достаточную для облегчения одного или более чем одного симптома, обычно связанного с патологическим состоянием, желаемым для лечения или предупреждения у субъекта. Что касается профилактического применения, этот термин означает дозу, достаточную для предупреждения или для задержки установления патологического состояния у субъекта. Например, терапевтически эффективное количество может представлять собой такое количество, которое достаточно для индукции или усиления иммунного ответа у субъекта, подлежащего лечению, или такое количество, которое достаточно для временного ослабления, облегчения, стабилизации, обратного развития, замедления или задержки прогрессирования патологического состояния (например, уменьшения размера или регрессии повреждения или опухоли у субъекта, обратного развития вирусной инфекции у инфицированного субъекта).
Желательно композиция по изобретению содержит один или более чем один носитель и/или разбавитель, нетоксичный при применяемой дозировке и концентрации. Такой носитель и/или разбавитель предпочтительно выбран из тех, которые обычно применяют для изготовления препаратов композиций либо в форме однократной дозы, либо в форме многократных доз для системного введения или введения в слизистую оболочку. Пригодный носитель может представлять собой растворитель, дисперсионную среду, которые содержат, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное), растительное масло или их пригодные смеси. Разбавитель предпочтительно является изотоническим, гипотоническим или слабо гипертоническим и имеет относительно низкую ионную силу. Репрезентативные примеры пригодных разбавителей включают стерильную воду, физиологический солевой раствор (например, хлорид натрия), раствор Рингера, растворы глюкозы, трегалозы или сахарозы, раствор Хэнкса и другие водные физиологически сбалансированные солевые растворы (см., например, самое современное издание Remington: The Science and Practice of Pharmacy, A. Gennaro, Lippincott, Williams & Wilkins). pH композиции по изобретению соответствующим образом доводят и забуферивают, чтобы она была пригодна для применения у людей или животных, предпочтительно при физиологическом или слегка основном pH (между приблизительно pH 7,5 и приблизительно pH 9, при особом предпочтении для pH приблизительно 8 или 8,5). Пригодные буферы включают фосфатный буфер (например, ФСБ), бикарбонатный буфер и/или Трис буфер.
Композиция по изобретению может находиться в различных формах, например, в замороженной, твердой (например, в сухой порошкообразной или лиофилизированной форме) или жидкой (например, водной). Твердая композиция активного агента(ов) с любым дополнительным желаемым ингредиентом(ами) может быть получена из ее заранее стерилизованного фильтрованием раствора, подвергнутого вакуумной сушке и лиофилизации. Ее можно, если желательно, хранить в стерильной ампуле, готовой к восстановлению добавлением пригодного носителя перед применением.
Препарат особенно предпочтительной композиции (особенно когда активный агент представляет собой аденовирусный вектор) готовят в 1 М сахарозе, 150 мМ NaCl, 1 мМ MgCl2, 54 мг/л Твин 80, 10 мМ Трис pH 8,5. Препарат другой предпочтительной композиции готовят в растворе 10 мг/мл маннита, 1 мг/мл ЧСА (человеческого сывороточного альбумина), 20 мМ Трис, pH 7,2 и 150 мМ NaCl. Такие препараты особенно пригодны для сохранения стабильности композиции по изобретению в течение периода по меньшей мере два месяца при температуре либо замораживания (например, -70°C, -40°C, -20°C), либо охлаждения (например, 4°C).
Композиция может также содержать один или более чем один фармацевтически приемлемый эксципиент для обеспечения желаемых фармацевтических или фармакодинамических свойств, включая, например, модификацию или поддержание pH, осмомолярность, вязкость, прозрачность, цвет, стерильность, стабильность, высвобождение или всасывание у субъекта человека или животного. Репрезентативные примеры стабилизирующих компонентов включают полисорбат 80, L-аргинин, поливинилпирролидон, трегалозу и полимеры, такие как полиэтиленгликоль, которые можно использовать для получения желаемых свойств растворимости, стабильности и времени полужизни (Davis et al., 1978, Enzyme Eng. 4, 169-173; Burnham et al., 1994, Am. J. Hosp. Pharm. 51, 210-218). Агенты, усиливающие вязкость, включают натрийкарбоксиметилцеллюлозу, сорбит и декстран. Композиция может также содержать вещества, известные в данной области техники как способствующие проницаемости или транспорту через барьер слизистой оболочки или в конкретный орган. Например, композиция, пригодная для вагинального введения, может, в конечном счете, включать один или более чем один усилитель всасывания, полезный для увеличения размера пор мембран слизистых оболочек.
Кроме того, композиция по изобретению может содержать один или более чем один адъювант, пригодный для системного введения или введения в слизистую оболочку у людей. Термин "адъювант" означает соединение, обладающее способностью к усилению иммунного ответа на конкретный антиген. Адъювант может быть доставлен в сайт антигена или вблизи него. Усиление гуморального иммунитета типично проявляется значительным повышением (обычно более чем в 10 раз) титра антител, вызванных на антиген. Усиление клеточного иммунитета можно измерить, например, с помощью кожного теста, анализа Т-клеточной цитотоксичности, анализа ELIspot на ИФНg или ИЛ-2. Предпочтительно адъювант, применимый в изобретении, способен к стимуляции иммунитета к активному агенту, в частности, посредством toll-подобных рецепторов (TLR), таких как TLR-7, TLR-8 и TLR-9. Репрезентативные примеры полезных адъювантов включают без ограничения квасцы, эмульсию минерального масла, такую как полный и неполный адъювант Фрейнда (IFA), липополисахарид или его производное (Ribi et al., 1986, Immunology and Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, p407-19), сапонины, такие как QS21 (Sumino et al., 1998, J.Virol. 72, 4931-9; WO 98/56415), соединения имидазохинолина, такие как Imiquimod (Suader, 2000, J. Am Acad Dermatol. 43, S6-S11), производное 1Н-имидазо(4,5-с)хинолон-4-амина (Aldara™) и родственное соединение (Smorlesi, 2005, Gene Ther. 12, 1324-32), цитозинфосфатгуанозиновые олигонуклеотиды, такие как CpG (Chu et al., 1997, J. Exp. Med. 186: 1623; Tritel et al., 2003, J. Immunol. 171: 2358-2547) и катионные пептиды, такие как IC-31 (Kritsch et al., 2005, J. Chromatogr. Anal. Technol. Biomed. Life Sci. 822, 263-70).
Молекулу нуклеиновой кислоты, вектор, инфекционную частицу или композицию по изобретению можно вводить с помощью разнообразных путей введения, включая системное, местное введение и введение в слизистую оболочку. Системное введение можно осуществлять любыми путями, например, путем подкожной, внутрикожной, внутримышечной, внутривенной, внутрибрюшинной, внутрисосудистой, внутриартериальной инъекции. Инъекции можно проводить общепринятыми шприцами и иглами или любыми другими подходящими устройствами, доступными в данной области техники. Введение в слизистую оболочку можно осуществлять пероральным, назальным, интратрахеальным, внутрилегочным, интравагинальным или интраректальным путем. Местное введение можно проводить с использованием чрескожных средств (например, пластыря и тому подобного). Внутримышечное или подкожное введение особенно предпочтительно вирусными векторами и инфекционными частицами в качестве активного агента.
Подходящая дозировка может варьировать в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного активного агента, возраст, состояние здоровья и масса субъекта; патологические состояние(я), подлежащее лечению, природа и степень симптомов, вид сопутствующего лечения, частота лечения, необходимость в предупреждении или терапии и/или желаемый эффект. Дозировку также следует вычислять в зависимости от конкретного выбранного пути введения. Дополнительное уточнение вычислений, необходимых для определения подходящей дозировки для лечения, рутинно проводит практикующий врач в свете релевантных обстоятельств. В качестве общего руководства, пригодная дозировка для аденовирусных частиц варьирует от примерно 105 до примерно 1013 ИЕ (инфекционных единиц), желательно от примерно 107 до примерно 1012 ИЕ и предпочтительно от примерно 108 до примерно 1011 ИЕ. Пригодная дозировка для MVA частиц варьирует от примерно 104 до примерно 1010 БОЕ (бляшкообразующих единиц), желательно от примерно 105 до примерно 109 БОЕ и предпочтительно от примерно 106 до примерно 5×108 БОЕ. Векторные плазмиды можно вводить в дозах между 10 мкг и 20 мг и предпочтительно между 100 мкг и 2 мг.
Кроме того, введение может иметь место в однократной дозе или альтернативно в многократных дозах в соответствии со стандартными протоколами, дозировками и режимами с периодичностью несколько часов, суток и/или недель. Кроме того, введение можно осуществлять путем болюсной инъекции или непрерывной инфузии. Например, субъекта можно лечить по меньшей мере двумя (например, от 2 до 10) введениями вышеописанной молекулы нуклеиновой кислоты, вектора, инфекционной частицы или композиции. Предпочтительно первую серию введений проводят последовательно в пределах периода времени, варьирующего от нескольких суток до 4 недель, с последующей второй серией введений (например, одного или двух введений), проводимой в пределах от одного до 6 месяцев после последнего введения первой серии. Период времени между каждым из введений второй серии может составлять от нескольких суток до 4 недель. В предпочтительном воплощении первая серия введений включает три последовательных введения с недельным интервалом, а вторая серия включает одно введение в пределах от 4 до 6 месяцев после первой серии. В качестве общего руководства, при применении вектора MVA предпочтительным путем введения является подкожный путь при дозе частиц MVA, содержащей между 106 и 5×108 БОЕ.
Молекулу нуклеиновой кислоты, вектор, инфекционную частицу, клетку-хозяина или композицию по изобретению можно вводить субъекту для лечения или предупреждения ряда патологических состояний, включая генетические заболевания, врожденные заболевания и приобретенные заболевания. Настоящее изобретение также относится к применению молекулы нуклеиновой кислоты, вектора, инфекционной частицы, клетки-хозяина или композиции по изобретению для изготовления лекарства, предназначенного для лечения или предупреждения таких патологических состояний. Оно особенно пригодно для лечения или предупреждения инфекционных заболеваний (например, вирусных и/или бактериальных инфекций), раков и иммунодефицитных заболеваний. Термин "рак", как используют здесь, охватывает любое злокачественное состояние, которое является результатом нежелательной клеточной пролиферации, включая диффузные или локализованные опухоли, метастазы, злокачественные полипы и предраковые повреждения (например, неоплазию).
Инфекционные заболевания, которые рассматривают в контексте изобретения, охватывают любое состояние, обусловленное инфекцией патогенным микроорганизмом, как описано выше. Раки, которые рассматривают в контексте изобретения, включают без ограничения глиобластому, саркому, меланому, мастоцитому, карциному, а также рак молочной железы, рак простаты, рак яичка, рак яичника, рак эндометрия, рак шейки матки (в частности, обусловленный папилломавирусной инфекцией), рак легкого (например, включающий гигантоклеточный, мелкоклеточный, чешуйчато-клеточный и аденокарциномы), рак почки, рак мочевого пузыря, рак печени, рак ободочной кишки, анальный рак, рак поджелудочной железы, рак желудка, желудочно-кишечный рак, рак полости рта, рак гортани, рак головного мозга и ЦНС, рак кожи (например, меланому и не меланому), рак крови (лимфомы, лейкозы, в частности, если они развились в твердой массе), рак кости, ретинобластому и рак щитовидной железы.
В предпочтительном воплощении изобретение применяют для превентивной или лечебной терапии состояния, обусловленного инфекцией папилломавируса (особенно HR HPV), такого как устойчивая инфекция, предраковые и раковые повреждения. "Устойчивая инфекция" относится к бессимптомной фазе папилломавирусной инфекции у инфицированного субъекта, у которого не достигнута эрадикация вируса. Типично клинические признаки не наблюдают. Примеры предраковых повреждений включают без ограничения интраэпителиальную неоплазию низкой, средней или высокой степени, которая может быть обнаружена в различных тканях, такая как ИЦН (интраэпителиальная цервикальная неоплазия), интраэпителиальная неоплазия вульвы (ИНВ), анальная интраэпителиальная неоплазия (АИН), интраэпителиальная неоплазия пениса (ИНП) и вагинальная интраэпителиальная неоплазия (ВИН). Примеры злокачественных повреждений включают без ограничения карциному шейки матки, анальную карциному, рак влагалища, рак пениса и рак полости рта. Молекула нуклеиновой кислоты, вектор, инфекционная частица, клетка-хозяин или композиция по изобретению, которые кодируют папилломавирусные полипептиды, в частности, предназначены для лечения предраковых повреждений, особенно повреждений ИНЦ 2/3, или раковых повреждений, особенно карциномы шейки матки. В другом воплощении изобретение также можно применять для превентивной или лечебной терапии состояния, обусловленного инфекцией вируса гепатита (например, HBV или HCV), такой как устойчивая инфекция, хронический или острый гепатит и рак печени.
Активный агент можно применять отдельно или, если желательно, в сочетании с общепринятыми терапевтическими воздействиями (например, облучением, химиотерапией и/или операцией). Общепринятые терапевтические воздействия добавляют субъекту животного или человека в соответствии со стандартными протоколами, используя стандартные агенты, дозировки и режимы, и такие воздействия можно осуществлять до, во время и/или после введения активного агента(ов) по изобретению. Например, для лечения состояний, обусловленных инфекцией HCV, способ или применение по изобретению предпочтительно сочетают, например, с ингибиторами протеазы (например, с ингибиторами сериновой протеазы, такими как VX950 фирмы Vertex), ингибиторами полимеразы, ингибиторами геликазы, антифибротиками, нуклеозидными аналогами, агонистами TLR, миРНК, антисмысловыми олигонуклеотидами, антителами анти-HCV, иммуномодуляторами, терапевтическими вакцинами и противоопухолевыми агентами, общепринято применяемыми при лечении HCV-обусловленных гепатокарцином (например, с адриамицином или смесью адриамицина, липиодола и спонгеля, обычно вводимыми путем химиоэмболизации в печеночную артерию). Особенно пригодная комбинация включает лечение пэгилированным ИФН-α (ИФН-α2а или ИФН-α2b) и/или рибавирином, предпочтительно в течение периода от 24 до 48 до введения активного агента(ов) по изобретению. Для лечения состояний, обусловленных папилломавирусной инфекцией, способ или применение по изобретению можно сочетать с абляционными процедурами, такими как электрохирургическая эксцизия петлей. Способ или применение согласно изобретению можно также осуществлять в сочетании с иммуностимулятором(амии), таким как цитокины (например, ИЛ-2, ИЛ-7, ИЛ-15, ИЛ-18, ИЛ-21, ИФНg) или продукты "суицидальных" генов (например, тимидинкиназа HSV-1, описанная Caruso et al., 1993, Proc. Natl. Acad. Sci. USA 90, 7024-28; FCU-1, описанный в WO 99/54481), либо вектор(ы), экспрессирующий такой полипептид(ы).
В другом воплощении способ применения по изобретению осуществляют в соответствии с терапевтическим воздействием примирования - усиления, который включает несколько введений примирующей композиции(й) и бустер-композиции(й). Типично в примирующей и бустер-композиции используют различные носители, которые включают или кодируют по меньшей мере один общий антигенный домен. Способ или применение по изобретению может включать от одного до десяти введений примирующей композиции с последующими введениями бустер-композиции в количестве от одного до десяти. Желательно интервалы инъекции составляют от одних суток до двенадцати месяцев. Предпочтительный режим воздействия включает три или четыре последовательных введения примирующей композиции, независимо разделенных периодом времени, варьирующим от 3 до 10 суток (например, неделей), с последующим одним или двумя введениями бустер-композиции через период от одной до нескольких недель после последнего введения примирующей композиции. Кроме того, примирующую и бустер-композицию можно вводить в один и тот же сайт или в чередующиеся сайты одним и тем же путем или различными путями введения. Например, композиции на основе полипептида можно вводить путем введения в слизистую оболочку, тогда как композиции на основе векторов предпочтительно инъецируют, например, подкожной инъекцией для вектора MVA, внутримышечной инъекцией для ДНК плазмиды и для аденовирусного вектора. Вектор, инфекционную частицу или композицию по изобретению можно применять либо для примирования, либо для усиления, либо и для примирования, и для усиления иммунного ответа у субъекта, подлежащего лечению. В одном воплощении примирование осуществляют плазмидным вектором по изобретению, а усиление осуществляют инфекционной частицей вируса осповакцины по изобретению. В другом воплощении примирование осуществляют аденовирусной инфекционной частицей по изобретению, а усиление осуществляют инфекционной частицей вируса осповакцины по изобретению. Еще в одном другом воплощении примирование осуществляют инфекционной частицей вируса осповакцины по изобретению, а усиление осуществляют аденовирусной инфекционной частицей по изобретению.
Изобретение описано иллюстративно, и должно быть понятно, что использованная терминология предназначена для того, чтобы быть по природе описательной вероятнее, чем ограничивающей. Очевидно, что множество модификаций и вариаций настоящего изобретения возможно в свете вышеизложенных положений. Следовательно, должно быть понятно, что в пределах объема прилагаемой формулы изобретения изобретение можно применять на практике путем, отличным от конкретно описанного здесь.
Все цитируемые выше описания патентов, публикаций и доступов в базы данных конкретно включены здесь путем ссылки в их полном объеме в той степени, как если бы каждый индивидуальный патент, публикация или доступ были конкретно и индивидуально указаны для включения путем ссылки.
Подписи к графическим материалам
На фиг.1 проиллюстрировано выравнивание последовательностей (А) между 59 нуклеотидами, присутствующими (а) на конце нативных последовательностей HPV-16 E1 и (б) в начале нативных последовательностей HPV-16 E2 и (Б) между 59 нуклеотидами, присутствующими (а) на конце нативных последовательностей HPV-16 E1 или в начале нативных последовательностей HPV-16 E2 и (б) SEQ ID NO: 9.
На фиг.2 проиллюстрировано выравнивание последовательностей (А) между HPV-16 и HPV-18 Е6-кодирующими последовательностями и (Б) между HPV-16 Е6-кодирующими последовательностями и SEQ ID NO: 14.
Приведенные ниже примеры служат для иллюстрации настоящего изобретения.
ПРИМЕРЫ
Нижеописанные конструирования осуществляют в соответствии с общими методиками генной инженерии и молекулярного клонирования, подробно описанными в Maniatis et al. (1989, Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor NY), или в соответствии с рекомендациями фирмы-изготовителя, когда используют коммерческий набор. Методики ПЦР амплификации известны специалистам в данной области техники (см., например, PCR protocols - A guide to methods and applications, 1990, published by Innis, Gelfand, Sninsky and White, Academic Press). Рекомбинантные плазмиды, несущие ген устойчивости к ампициллину, реплицируют в E. coli С600 (Stratagene), BJ5183 (Hanahan, 1983, J. Mol. Biol. 166, 557-580) и NM522 на агаре или в жидкой среде с добавлением 100 мкг/мл антибиотика. Конструирование рекомбинантных вирусов осповакцины осуществляют в соответствии с общепринятой технологией в данной области техники в документах, цитируемых выше, и в Mackett et al. (1982, Proc. Natl. Acad. Sci. USA 79, 7415-7419) и Mackett et al. (1984, J. Virol. 49, 857-864). Селективный ген gpt (ксантингуанинфосфорибозилтрансферазы) E. coli (Falkner and Moss, 1988, J. Virol. 62, 1849-1854) используют для облегчения отбора рекомбинантных вирусов осповакцины.
Пример 1: Конструирование вектора MVA, экспрессирующего гены HPV-16 Е1 и Е2 (MVATG17410)
а) Конструирование рекомбинантного вектора MVA, кодирующего ген HPV-16 Е2 (MVATG 17408)
Клонирование гена HPV16 Е2
Нуклеотидные последовательности, кодирующие HPV-16 Е2, клонировали из геномной ДНК, выделенной из клеток CaSki (ATCC CRL-1550). Ген Е2 амплифицировали, используя праймеры OTG16809 (SEQ ID NO: 16) и OTG16810 (SEQ ID NO: 17). Полученный в результате фрагмент переваривали BamHI и EcoRI и встраивали в pGEX2T (Amersham Biosciences), рестрицированный теми же ферментами, с получением pTG17239. Секвенирование клонированного гена Е2 показало пять мутаций по сравнению с последовательностью прототипа HPV16 Е2 (описанной в Genbank NC-01526). Две мутации были молчащими, а три не молчащие мутации (T210I, S219P, K310T) корректировали, используя набор для сайт-направленного мутагенеза QuickChange (Stratagene), с получением pTG17268.
Модификация полипептида HPV-16 Е2
Нуклеотидные последовательности Е2, включенные в pTG17268, модифицировали путем сайт-направленного мутагенеза в целях создания варианта HPV-16 Е2 (Е39А и I73A), обозначенного Е2*. Более конкретно репликационную функцию Е2 прекращали посредством замены остатка Glu в положении 39 на Ala, а функцию трансактивации прекращали посредством замены остатка Ile в положении 73 на Ala. Полученная в результате плазмида pTG17318 содержит модифицированные последовательности, кодирующие HPV-16 Е2*.
HPV-16 Е2* дополнительно модифицировали путем гибридизации при его N-конце сигнальным пептидом, и при его С-конце последовательностями заякоривания в мембране, имеющими происхождение из гликопротеина вируса гидрофобии (штамм PG; Genbank ay009097), для прямой презентации HPV-16 Е2* в экспрессирующих клетках-хозяевах на поверхности плазматической мембраны. Нуклеотидные последовательности (SEQ ID NO: 12), кодирующие презентируемый на мембране дефектный вариант Е2, обозначенные SS-E2*-TMR, были заново собраны с помощью тройной ПЦР, используя приведенные ниже праймеры: OTG17500 (SEQ ID NO: 18), OTG17501 (SEQ ID NO: 19), OTG17502 (SEQ ID NO: 20), OTG17503 (SEQ ID NO: 21), OTG17504 (SEQ ID NO: 22) и OTG17505 (SEQ ID NO: 23). Заново собранная последовательность была встроена в вектор, представляющий собой производное pBS (Stratagene), с получением pTG17360, a затем клонирована в плазмиде для переноса в вирус осповакцины по ходу транскрипции от промотора pH5R (Rosel et al., 1986, J Virol. 60, 436-449) с получением в результате pTG17408.
Плазмида для переноса сконструирована таким образом, чтобы дать возможность инсерции нуклеотидной последовательности, которую нужно переносить, путем гомологичной рекомбинации в делецию III генома MVA. Она является производным от плазмиды pTG1E (описанной в Braun et al., 2000, Gene Ther. 7, 1447-57), в которой были клонированы фланкирующие последовательности (BRG3 и BRD3), окружающие делецию III MVA, которые были получены путем ПЦР из ДНК MVATGN33.1 (Sutter and Moss, 1992, Proc. Natl. Acad. Sci. USA 89, 10847-51). Плазмида для переноса также содержит гибрид между усиленным геном зеленого флуоресцентного белка Aequorea victoria (ген eGFP, выделен из pEGP-C1, Clontech) и геном ксантингуанинфосфорибозилтрансферазы Escherichia coli (ген gpf) под контролем синтетического раннего и позднего промотора вируса осповакцины p11K7.5 (любезно предоставленного R. Wittek, University of Lausanne). Синтез ксантингуанинфосфорибозилтрансферазы обеспечивает образование бляшек рекомбинантным GPT+ MVA в селективной среде, содержащей микофеноловую кислоту, ксантин и гипоксантин (Falkner et al., 1988, J. Virol. 62, 1849-54), и eGFP обеспечивает визуализацию рекомбинантных бляшек MVA. Селективный маркер eGPP-GPT помещают между двумя гомологичными последовательностями в одинаковой ориентации. Когда достигается клональная селекция, селективный маркер легко элиминируют путем нескольких пассажей без селекции, дающих возможность роста рекомбинантного eGPP-GPF- MVA.
Конструирование рекомбинантного MVA, экспрессирующего ген HPV-16 SS-E2*-TMR
Получение вируса MVATG17408 осуществляли с помощью гомологичной рекомбинации в первичных эмбриональных фибробластах цыпленка (CEF), инфицированных MVATGN33.1 (при МИ (множественности инфекции 0,1 БОЕ/клетка) и трансфецировали pTG17408 (в соответствии со стандартной кальций-фосфатной преципитацией ДНК). Селекцию вируса проводили с помощью трех раундов очистки бляшек в присутствии селективной среды, содержащей микофеноловую кислоту, ксантин и гипоксантин. Как упомянуто выше, затем селективный маркер элиминировали с помощью пассажа в неселективной среде. Отсутствие контаминации исходным MVA проверяли с помощью ПЦР.
Анализ экспрессии Е2 проводили с помощью Вестерн-блоттинга. CEF инфицировали MVATG17408 при МИ 0,2, и через 24 часа клетки собирали. Вестерн-блот-анализ проводили с использованием коммерческого моноклонального антитела анти-Е2 TVG271 (Abcam). Была обнаружена экспрессия белка с кажущейся молекулярной массой 55 кДа, тогда как теоретическая молекулярная масса E2*-TMR составляет 48,9 кДа. После обработки клеточных экстрактов эндогликозидазой F наблюдали уменьшение размера рекомбинантного белка, что позволяет предположить, что полипептид Е2* TMR, экспрессируемый с MVATG17408, является N-гликозилированным.
б) Конструирование рекомбинантного MVA, кодирующего ген HPV-16 Е1, вырожденный в участке, перекрывающемся с геном HPV-16 Е2 (MVATG17409)
Нуклеотидные последовательности, кодирующие полипептид HPV-16 Е1, клонировали из ДНК клеток CaSki (ATCC CRL-1550). Более конкретно ген Е1 амплифицировали в виде двух частей Е1а (nt 1-1102) и E1b (nt 1001-1950). Праймеры OTG16811 (SEQ ID NO: 24) и OTG 16814 (SEQ ID NO: 25) использовали для амплификации фрагмента Е1а, который переваривали BamHI и EcoRI и встраивали в плазмиду pGEX2T, рестрицированную теми же ферментами, с образованием pTG17240. Фрагмент E1b был получен с использованием OTG16813 (SEQ ID NO: 26) и OTG16812 (SEQ ID NO: 27) и переварен BamHI и EcoRI, после чего встроен в pGEX2T с получением в результате pTG17241. Секвенирование показало 4 мутации по сравнению с последовательностью прототипа HPV-16 Е1 (описанной в Genbank NC-01526). Одна мутация была молчащей, а три не молчащие мутации, присутствующие в Е1а (K130Q, N185T и T220S), корректировали путем сайт-направленного мутагенеза. Затем полноразмерный ген Е1 собирали заново путем клонирования скорректированного фрагмента Е1а в плазмиде pTG17241, переваренной BsrGI и EcoRI. Полученная в результате плазмида была названа pTG17289.
В геноме HPV-16 последние 59 нуклеотидов гена Е1 идентичны первым 59 нуклеотидам гена Е2. Чтобы избежать проблемы нестабильности во время стадий продуцирования Е1 и Е2-кодирующего вектора MVA данный участок E1-кодирующих последовательностей был модифицирован путем модификаций использования кодона таким образом, чтобы снизить гомологию последовательности с Е2-кодирующей последовательностью. Вырожденная последовательность (SEQ ID NO: 9) была получена путем амплификации 3' конца гена Е1 с использованием вырожденных праймеров OTG17408 (SEQ ID NO: 28) и OTG17409 (SEQ ID NO: 29). Амплифицированный фрагмент переваривали NsiI и BglII и встраивали в плазмиду pTG17289, переваренную теми же ферментами, с получением pTG17340.
Вырожденные последовательности HPV-16 Е1 также подвергали мутированию путем сайт-направленного мутагенеза с целью прекращения репликационной функции кодируемого полипептида Е1 путем замены остатка Gly в положении 482 HPV-16 Е1 остатком Asp (G482D; также обозначен здесь Е1*) с получением в результате pTG17373.
Последовательности HPV-16 E1deg* также были модифицированы таким образом, чтобы направлять экспрессию кодируемого полипептида к поверхности плазматической мембраны клетки путем гибридизации с сигнальным пептидом и пептидом заякоривания в мембране, имеющим происхождение от гликопротеина вируса гидрофобии (изолята ERA; описанного в Genbank № М38452). Последовательность SS-E1deg*-TMR (SEQ ID NO: 10) восстанавливали с помощью тройной ПЦР с использованием приведенных ниже праймеров OTG17560 (SEQ ID NO: 30), OTG17561 (SEQ ID NO: 31), OTG17562 (SEQ ID NO: 32), OTG17563 (SEQ ID NO: 33), OTG17564 (SEQ ID NO: 34) и OTG17565 (SEQ ID NO: 35). Полученный в результате фрагмент встраивали в вектор, представляющий собой производное pBS (Stratagene), с получением pTG17404. Затем последовательность SS-E1deg*-TMR клонировали в плазмиде для переноса в вирус осповакцины по ходу трансляции от промотора р7.5K (Cochran et al., 1985, J. Virol. 54, 30-7) с получением pTG 17409.
Получение вирусов MVATG17409 осуществляли в CEF путем гомологичной рекомбинации, как описано выше.
в) Конструирование рекомбинантного MVA, кодирующего гены HPV-16 E1 и E2 (MVATG17410)
Последовательность SS-E1deg*-TMR под контролем промотора р7.5K выделяли из pTG17409 и встраивали в pTG17408 с получением pTG17410.
Получение вирусов MVATG17410 осуществляли в CEF путем гомологичной рекомбинации, как описано выше.
Пример 2: Конструирование вектора MVA, кодирующего гены HPV-18 E1 и E2 (MVATG17582)
Гены HPV-18 E1 и Е2 были восстановлены в виде синтетических генов, и олигонуклеотиды были сконструированы таким образом, чтобы (i) снизить процент гомологии между гомологичными участками, общими для нативных последовательностей HPV-16 и HPV-18, до значения менее чем 75% (последовательности генов HPV-16 и HPV-18 E1 и Е2 были выровнены, и олигонуклеотиды сконструированы таким образом, чтобы снизить гомологию до числа последовательных нуклеотидов менее 5) (ii) снизить гомологию до значения менее 75% между участком из 59 нуклеотидов, присутствующим и на 3' конце нативной последовательности HPV-18 E1, и на 5' последовательности HPV-18 Е2, и (ii) ввести мутации, прекращающие ферментативные функции продукта гена HPV-18 E1 и Е2 (E1: G489D, Е2: Е43А и 177А).
Последовательность HPV-18 degE1* была восстановлена путем сборки 50 олигонуклеотидов и клонирована в векторе pBS с получением pTG 17473. Затем последовательность E1 была гибридизована с клонированными сигнальными последовательностями белка F вируса кори (SS-18E1deg*-TMF) с помощью тройной ПЦР, используя праймеры OTG15315 (SEQ ID NO: 36), OTG17881 (SEQ ID NO: 37), OTG17882 (SEQ ID NO: 38), OTG17883 (SEQ ID NO: 39), OTG17884 (SEQ ID NO: 40) и OTG17885 (SEQ ID NO: 41). Полученный в результате фрагмент (SEQ ID NO: 11) был клонирован в векторе для переноса MVA под контролем промотора р7.5K с получением pTG17521.
Последовательность HPV-18 degE2* была восстановлена путем сборки 26 олигонуклеотидов и клонирована в векторе pBS с получением pTG17498. Гибридизацию с сигнальным пептидом и пептидом заякоривания в мембране гликопротеина вируса гидрофобии (штамм ERA; Genbank № М38452) осуществляли с помощью тройной ПЦР, используя праймеры OTG17875 (SEQ ID NO: 42), OTG17876 (SEQ ID NO: 43), OTG17877 (SEQ ID NO: 44), OTG17878 (SEQ ID NO: 45), OTG17879 (SEQ ID NO: 46) и OTG17880 (SEQ ID NO: 47). Кассету SS-18E2*-TMR встраивали в плазмиду для переноса MVA по ходу трансляции от промотора pH5R с получением pTG17552. Наконец, кассету p7.5K-SS-E1deg*-TMF выделяли из pTG17521 и встраивали в pTG17552 с получением pTG17582.
Получение рекомбинантных MVATG 17521, MVATG 17552 и MVATG 17582 осуществляли, как описано выше.
Пример 3: Конструирование поливалентного вектора MVA, экспрессирующего гены HPV-16 и HPV-18 Е1 и Е2 (MVATG17583)
Кассету p7.5K-SS-18E1deg*-TMF и кассету pH5R-SS-18E2*-TMR вводили в ptG17410 (содержащую кассету p7.5K-SS-16E1deg*-TMR и pH5R-SS-16E2*-TMR), и полученная в результате плазмида для переноса была названа pTG17583. Получение MVATG17583 осуществляли, как описано выше.
Пример 4: Конструирование поливалентного рекомбинантного вируса, экспрессирующего гены HPV16 и HPV18 Е6 и Е7
MVATG 16327 представляет собой рекомбинантный вирус MVA, экспрессирующий заякоренные в мембране и не онкогенные варианты полипептидов HPV-16 и HPV-18 Е6 и Е7. Нуклеотидные последовательности Е6 и Е7 были подвергнуты мутированию с целью элиминации их онкогенных свойств (Е6* и Е7*) и были гибридизованы с последовательностями, кодирующими соответствующие сигнальный пептид и пептид заякоривания в мембране (E6*tm, E7*tm). Более конкретно HPV-18 Е7* гибридизовали соответственно при его N- и С-концах с сигнальным пептидом и пептидом заякоривания в мембране гликопротеина F вируса кори, тогда как HPV-16 Е6*, HPV-16 Е7* и HPV-18 Е6* гибридизовали с сигнальным пептидом и пептидом заякоривания в мембране, имеющими происхождение от гликопротеина вируса гидрофобии. Кроме того, нуклеотидные последовательности HPV-18 Е6 и Е7 были дополнительно модифицированы путем модификации использования кодона таким образом, чтобы уменьшить гомологию с их двойниками HPV16. Для этой цели последовательности нативных генов HPV16 и HPV18 выравнивали и осуществляли вырождение кодонов для снижения гомологии до числа последовательных нуклеотидов менее 5. В векторе обе последовательности HPV-16 и HPV-18 Е6 помещают под контролем промотора р7.5K в противоположной ориентации друг с другом, тогда как последовательности HPV-16 и HPV-18 Е7 направлены промотором H5R, и все экспрессионные кассеты встраивают в область делеции III генома MVA genome.
а) Конструирование экспрессионной кассеты HPV-16 E7*tm
Ген HPV-16 E7 был выделен из клеток Caski и модифицирован таким образом, чтобы кодировать не онкогенный и презентируемый на мембране полипептид E7 (16E7*tmR), как описано в WO 99/03885. Не онкогенные мутации осуществляли путем делеции аминокислотных остатков 21-26 (ΔDLYCYE), а презентацию на мембране путем гибридизации мутированной последовательности E7* соответственно при ее 5' и 3' концах с последовательностями, кодирующими сигнальный пептид и пептид заякоривания в мембране, клонированными из гликопротеина вируса гидрофобии (штамм ERA; номер по каталогу Genbank М38452). Полученную в результате последовательность клонировали под контролем раннего - позднего промотора pH5R (Rosel et al., 1986. J. Virol. 60, 436-9), и кассету вводили в вектор, являющийся производным pBS, с получением PTG16161.
б) Клонирование экспрессионных кассет HPV-16 E6*tm и HPV-18 E6*tm
Ген HPV-16 Е6 был выделен и модифицирован таким образом, чтобы кодировать не онкогенный и презентируемый на мембране полипептид Е6, как описано в WO 99/03885. Не онкогенные мутации осуществляли путем делеции аминокислотных остатков 118-122 (ΔCPEEK), а презентацию на мембране путем гибридизации мутированной последовательности Е6* соответственно при ее 5' и 3' концах с последовательностями, кодирующими сигнальный пептид и пептид заякоривания в мембране, клонированными из гликопротеина вируса гидрофобии (штамм PG; номер по каталогу Genbank ay009097). Это осуществляли путем инсерции мутированной последовательности Е6* в вектор, содержащий последовательности сигнального пептида и пептида заякоривания в мембране, разделенные сайтом BamHI, с получением в результате pTG16097.
Синтетическая последовательность HPV-18 Е6 была получена путем сборки олигонуклеотидов OTG15174 (SEQ ID NO: 48), OTG15175 (SEQ ID NO: 49), OTG15176 (SEQ ID NO: 50), OTG15177 (SEQ ID NO: 51), OTG15178 (SEQ ID NO: 52), OTG15179 (SEQ ID NO: 53), OTG15180 (SEQ ID NO: 54) и OTG15181 (SEQ ID NO: 55). Эти олигонуклеотиды были сконструированы таким образом, чтобы ввести делецию кодонов, кодирующих аминокислотные остатки 113-117 (не онкогенная мутация ΔNPAEK), а также для вырождения использования кодона с целью снижения гомологии с геном HPV-16 Е6 (вырожденная последовательность). Затем полученную в результате синтетическую последовательность гибридизовали соответственно при ее 5' и 3' конце с последовательностями, кодирующими сигнальный пептид и пептид заякоривания в мембране, имеющими происхождение от гена гликопротеина вируса гидрофобии, с получением последовательности, показанной в SEQ ID NO: 14, с получением в результате pTG16160. Последовательности HPV-16 E6*tmR и HPV-18 degE6*tmR были встроены в противоположной ориентации, каждая под контролем промотора р7.5K. Затем кассеты вводили в pTG16161 с получением pTG16215.
в) Клонирование экспрессионной кассеты HPV-18 E7*tmF
Синтетическая последовательность HPV-18 Е7 была получена путем сборки олигонуклеотидов OTG14773 (SEQ ID NO: 56), OTG14774 (SEQ ID NO: 57), OTG14775 (SEQ ID NO: 58), OTG14776 (SEQ ID NO: 59), OTG14777 (SEQ ID NO: 60) и OTG14778 (SEQ ID NO: 61). Эти олигонуклеотиды были сконструированы таким образом, чтобы ввести делецию кодонов, кодирующих аминокислотные остатки 24-28 (не онкогенная мутация ΔDLLCH), а также для вырождения использования кодона с целью снижения гомологии с геном HPV-16 Е7 (вырожденная последовательность). Затем полученную в результате синтетическую последовательность гибридизовали соответственно при ее 5' и 3' конце с последовательностями, кодирующими сигнальный пептид и пептид заякоривания в мембране, клонированными из гена белка F вируса кори (описаны в ЕР 0305229). Полученную в результате последовательность (SEQ ID NO: 15) клонировали под контролем промотора pH5R, и кассету вводили в вектор, являющийся производным pBS, с получением pTG16015.
г) Конструирование плазмиды для переноса pTG 16327
Плазмида для переноса pTG6019 (описана в Примере 2 WO 99/03885) содержит гомологичные последовательности, фланкирующие делецию III MVA. Она была модифицирована, как описано ниже. Синтетический полилинкер, полученный путем гибридизации праймеров OTG15040 (SEQ ID NO: 62) и OTG15041 (SEQ ID NO: 63), вводили в плазмиду pTG6019, переваренную BamHI и SacI, с получением в результате pTG16007. Фрагмент SacI-SacI, содержащий экспрессионную кассету, кодирующую gpt E. coli, помещенный под контролем раннего - позднего промотора pH5R, выделяли из pTG14033 (описана в Примере 2 ЕР 1146125) и вводили в pTG16007, переваренную SacI, с получением pTG16093. Синтез ксантингуанинфосфорибозилтрансферазы обеспечивает образование бляшек рекомбинантными GPT+ MVA в селективной среде, содержащей микофеноловую кислоту, ксантин и гипоксантин (Falkner et al., 1988. J.Virol. 62, 1849-54). Селективный маркер GPT помещают между двумя гомологичными последовательностями в одинаковой ориентации. Когда достигается клональная селекция, селективный маркер легко элиминируют путем нескольких пассажей без селекции, давая возможность роста рекомбинантного GPT- MVA.
Фрагмент HindIII-SmaI, содержащий экспрессионную кассету HPV-18 degE7*TMF, выделяли из pTG16015 и вводили в pTG16093, переваренную теми же ферментами, с получением pTG16105. С другой стороны, pTG16215 переваривали SalI и EcoRI, обрабатывали ДНК полимеразой Т4, и полученный в результате фрагмент, содержащий экспрессионные кассеты HPV-16 E7*tmR, HPV-16 E6*tmR и HPV-18 degE6*TMR, вводили в pTG16105, переваренную SmaI, с получением в результате pTG16327 (фиг.2).
д) Получение MVATG16327
Получение MVATG16327 осуществляли путем гомологичной рекомбинации в первичных эмбриональных фибробластах цыпленка (CEF). Для этой цели pTG16327 трансфецировали в соответствии со стандартной кальций-фосфатной преципитацией ДНК в CEF, предварительно инфицированные MVATGN33.1 при МИ 0,1 БОЕ/клетка. Вирусную селекцию проводили путем трех раундов очистки бляшек на CEF в присутствии селективной среды, содержащей микофеноловую кислоту, ксантин и гипоксантин. Затем селективный маркер элиминировали путем пассажа в неселективной среде. Отсутствие контаминации исходным MVA проверяли с помощью ПЦР.
Анализ экспрессии генов проводили с помощью Вестерн-блоттинга. CEF инфицировали MVATG16327 при МИ 0,2, и через 24 часа клетки собирали. Вестерн-блот-анализ проводили, используя поликлональные антитела кролика против белков HPV-16 и HPV-18 Е6 и Е7, соответственно. Результаты показывают, что все полипептиды HPV были правильно экспрессированы с MVATG16327.
е) Исследование генетической стабильности MVATG16327
Пять пассажей MVATG16327 проводили на CEF, инфицированных при МИ 10-2 БОЕ/клетка и 10-4 БОЕ/клетка, генетическую стабильность оценивали на 100 вирусных клонах, выделенных из 5го пассажа исследуемой исходной культуры. Использовали два способа: ПЦР амплификацию для определения структуры экспрессионных кассет и обнаружение антигена с помощью Вестерн-блоттинга. Результаты ПЦР анализа показали, что 99% клонов содержали интересующие экспрессионные кассеты. Иммунологическое обнаружение показало, что 97% клонов экспрессировали четыре антигена: полипептиды HPV-16 и HPV-18 E6*tm и E7*tm.
Эти анализы показали, что 97% клонов, имеющих происхождение от MVATG16327, были однородными после пяти пассажей, что указывает на хорошую генетическую стабильность данной конструкции.
Пример 5: Конструирование поливалентного вектора MVA, экспрессирующего гены HPV-16, HPV-18, HPV-33 и HPV-52 E2
Синтетический ген, кодирующий полипептид HPV-33 E2, был синтезирован фирмой Geneart (Regensburg, Germany). Эта синтетическая последовательность была сконструирована таким образом, чтобы (i) снизить процент гомологии до значения менее чем 75% с генами E2 из HPV-16, HPV-18 и HPV-52 (если возможно, гомологичные участки уменьшают менее чем до 6 последовательных нуклеотидов) и (ii) ввести мутации, прекращающие ферментативные функции продукта гена HPV-33 (Е39А и I73A).
Затем последовательность HPV-33 degE2* гибридизовали с нуклеотидной последовательностью, кодирующей сигнальный пептид и пептид заякоривания в мембране гликопротеина вируса гидрофобии (штамм ERA, Genbank № М38452). Это осуществляли с помощью тройной ПЦР, используя праймеры OTG18962 (SEQ ID NO: 72), OTG 18963 (SEQ ID NO: 73), OTG18964 (SEQ ID NO: 74), OTG18965 (SEQ ID NO: 75), OTG18966 (SEQ ID NO: 76) и OTG18967 (SEQ ID NO: 77). Полученный в результате фрагмент (SEQ ID NO: 67), кодирующий полипептид SS-33degE2*-TMR, клонировали в векторе для переноса MVA под контролем промотора р7.5K, и вирусные частицы получали, как описано выше.
Синтетический ген, кодирующий полипептид HPV-52 E2, был синтезирован фирмой Geneart (Regensburg, Germany). Эта синтетическая последовательность была сконструирована таким образом, чтобы (i) снизить процент гомологии до значения менее чем 75% с генами E2 из HPV-16, HPV-18 и HPV-33 (гомологичные участки предпочтительно уменьшают менее чем до 6 последовательных нуклеотидов) и (ii) ввести мутации, прекращающие ферментативные функции продукта гена HPV-52 (Е39А и I73A).
Затем синтетическую последовательность HPV-52 E2*deg гибридизовали с нуклеотидной последовательностью, кодирующей сигнальный пептид и пептид заякоривания в мембране, белка F вируса кори (с получением SS-52E2*deg-TMF) с помощью тройной ПЦР, используя праймеры OTG18968 (SEQ ID NO: 78), OTG18969 (SEQ ID NO: 79), OTG18970 (SEQ ID NO: 80), OTG18971 (SEQ ID NO: 81), OTG18972 (SEQ ID NO: 82) и OTG18973 (SEQ ID NO: 83).
Полученный в результате фрагмент (SEQ ID NO: 69), кодирующий полипептид SS-52E2*deg-TMF, встраивали в плазмиду для переноса MVA по ходу трансляции от промотора р7.5K, и вирусные частицы получали, как описано выше.
Кассету pH5R-SS-18E2*-TMR, кодирующую презентируемый на мембране и ферментативно дефектный полипептид HPV-18 E2 (выделенную из pTG17552), кассету p7.5K-SS-33degE2*-TMR, кодирующую презентируемый на мембране и ферментативно дефектный полипептид HPV-33 E2, и кассету p7.5K-SS-52degE2*-TMF, кодирующую презентируемый на мембране и ферментативно дефектный полипептид HPV-52 E2, вводили в плазмиду pTG17408 (содержащую кассету pH5R-SS-16E2*-TMR), и вирусные частицы получали, как описано выше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИДЫ Е2 ПАПИЛЛОМАВИРУСА, ПРИМЕНЯЕМЫЕ ДЛЯ ВАКЦИНАЦИИ | 2008 |
|
RU2482189C2 |
| ТЕЛОМЕРАЗНАЯ ОБРАТНАЯ ТРАНСКРИПТАЗА ПТИЦ | 2007 |
|
RU2415867C2 |
| ЭКСПРЕССИРУЮЩИЙ ВЕКТОР (ВАРИАНТЫ) | 1995 |
|
RU2177999C2 |
| ИММОРТАЛИЗОВАННАЯ КЛЕТОЧНАЯ ЛИНИЯ ПТИЦ | 2008 |
|
RU2475536C2 |
| Мутантные полимеразы вируса гепатита В | 2012 |
|
RU2625021C2 |
| ВАКЦИНЫ ПРОТИВ HPV | 2012 |
|
RU2644201C2 |
| КОМПОЗИЦИЯ ВАКЦИНЫ | 2014 |
|
RU2684211C2 |
| РЕКОМБИНАНТНАЯ ВИРУСНАЯ ВАКЦИНА | 2007 |
|
RU2453335C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, АССОЦИИРОВАННОГО С ИНФЕКЦИЕЙ HPV | 2013 |
|
RU2636003C2 |
| КОНСТРУКЦИИ ГОМОДИМЕРНЫХ БЕЛКОВ | 2011 |
|
RU2624041C2 |































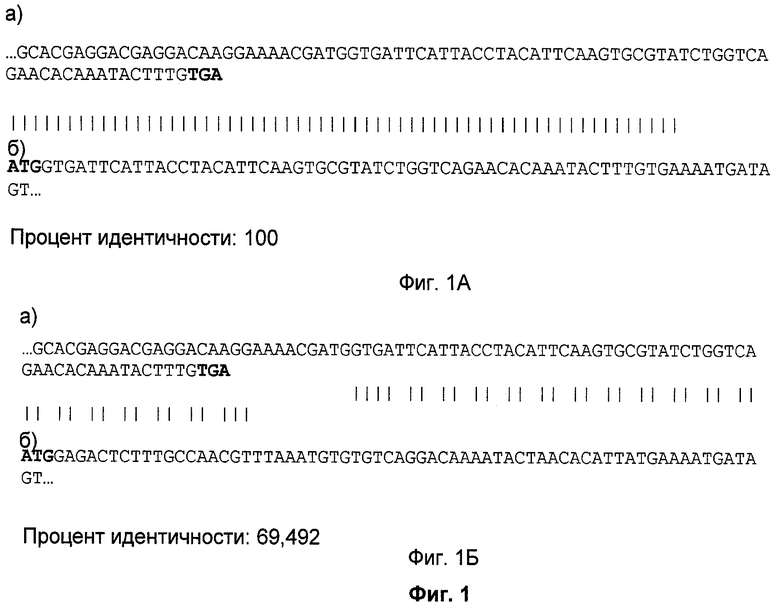


Настоящее изобретение относится к области генетической инженерии и может быть использовано в медицине. Предложен вектор для независимой экспрессии по меньшей мере двух молекул нуклеиновой кислоты, которые кодируют один и тот же или различные полипептиды близкородственных серотипов папилломавируса (HPV) и которые в природе содержат последовательности, имеющие идентичность по меньшей мере 80% на участках протяженностью не менее 40 последовательных нуклеотидов. При включении в вектор указанные молекулы модифицируют таким образом, чтобы снизить процент идентичности между последовательностями до значения менее 75% и уменьшить размер участков гомологии до числа последовательных нуклеотидов менее 8. Изобретение также относится к клетке-хозяину, включающей предложенные векторные конструкции для множественной экспрессии полипептидов HPV, а также к фармацевтическим композициям для превентивной или лечебной терапии состояний, обусловленных инфекцией папилломавируса, которые содержат вектор или трансформированные этим вектором клетки-хозяева. 6 н. и 26 з.п. ф-лы, 4 ил., 5 пр.
1. Вектор для множественной генной экспрессии, содержащий по меньшей мере первую молекулу нуклеиновой кислоты, кодирующую первый полипептид, и вторую молекулу нуклеиновой кислоты, кодирующую второй полипептид, где
- указанные первая и вторая молекулы нуклеиновой кислоты получены соответственно из первой и второй нативных нуклеиново-кислотных последовательностей, которые проявляют процент гомологии приблизительно 80% или выше чем 80% на протяжении участка из 40 или большего числа непрерывных нуклеотидов,
- указанная первая молекула нуклеиновой кислоты и/или указанная вторая молекула нуклеиновой кислоты, включенные в вектор, модифицированы таким образом, чтобы снизить указанный процент гомологии до значения менее чем 75%,
- паттерн использования кодона модифицирован таким образом, что гомологичные участки между первой и второй молекулами нуклеиновой кислоты ограничены менее чем 8 последовательными нуклеотидами, и
где указанная первая молекула нуклеиновой кислоты и указанная вторая молекула нуклеиновой кислоты кодируют по меньшей мере один и тот же полипептид, полученный из близкородственных серотипов HPV.
2. Вектор по п.1, где паттерн использования кодона первой молекулы нуклеиновой кислоты, либо второй молекулы нуклеиновой кислоты, либо обеих, первой и второй, молекул нуклеиновой кислоты модифицирован по меньшей мере в указанном гомологичном участке(ах) из 40 или большего числа непрерывных нуклеотидов таким образом, чтобы снизить процент гомологии до значения менее чем 75%.
3. Вектор по п.2, где паттерн использования кодона модифицирован на нуклеотидном уровне и указанные модификации являются молчащими на аминокислотном уровне.
4. Вектор по п.1, где паттерн использования кодона модифицирован таким образом, что гомологичные участки между первой и второй молекулами нуклеиновой кислоты ограничены менее чем 5 последовательными нуклеотидами.
5. Вектор по п.1, где указанный вектор представляет собой аденовирусный вектор.
6. Вектор по п.5, где указанный аденовирусный вектор является дефектным по репликации.
7. Вектор по п.1, где указанный вектор представляет собой поксвирусный вектор.
8. Вектор по п.7, где указанный поксвирусный вектор получен из вируса осповакцины, выбранного из группы, состоящей из копенгагенского штамма, штамма Уайетт, NYVAC и высоко аттенуированного модифицированного штамма Анкара (MVA).
9. Вектор по любому из пп.1-8, где первая и вторая молекулы нуклеиновой кислоты независимо получены от папилломавируса высокого риска, выбранного из группы, состоящей из HPV-16, HPV-18, HPV-30, HPV-31, HPV-33, HPV-35, HPV-39, HPV-45, HPV-51, HPV-52, HPV-56, HPV-58, HPV-59, HPV-66, HPV-68, HPV-70 и HPV-85.
10. Вектор по п.9, где указанный один и тот же полипептид, полученный от близкородственных организмов, выбран из группы, состоящей из E1, E2, E6 и E7.
11. Вектор по п.10, где указанный один и тот же полипептид, полученный от близкородственных организмов, представляет собой полипептид E2.
12. Вектор по п.11, где близкородственные серотипы HPV представляют собой HPV-16, HPV-18, HPV-33 и/или HPV-52.
13. Вектор по п.12, где указанный вектор включает первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E2, вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E2, третью молекулу нуклеиновой кислоты, кодирующую полипептид HPV-33 E2, и четвертую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-52 E2.
14. Вектор по п.13, где указанный полипептид HPV-16 E2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 7, указанный полипептид HPV-18 E2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 8, указанный полипептид HPV-33 E2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 70, и указанный полипептид HPV-52 E2 содержит аминокислотную последовательность, показанную в SEQ ID NO: 71.
15. Вектор по п.14, где указанная первая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 12; указанная вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 13; указанная третья молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 67, и указанная четвертая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 69.
16. Вектор по п.10, где указанный один и тот же полипептид, полученный от близкородственных организмов, представляет собой полипептид E6, полипептид Е7 или оба полипептида E6 и Е7.
17. Вектор по п.16, где указанная первая молекула нуклеиновой кислоты кодирует полипептид HPV-16 E6 и указанная вторая молекула нуклеиновой кислоты кодирует полипептид HPV-18 E6, где указанная вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 14.
18. Вектор по п.16, где указанная первая молекула нуклеиновой кислоты кодирует полипептид HPV-16 E7 и указанная вторая молекула нуклеиновой кислоты кодирует полипептид HPV-18 E7, где указанная вторая молекула нуклеиновой кислоты содержит нуклеотидную последовательность, показанную в SEQ ID NO: 15.
19. Вектор по п.17 или 18, где указанный вектор представляет собой вектор MVA, первая молекула нуклеиновой кислоты помещена под контролем промотора 7.5 К вируса осповакцины, вторая молекула нуклеиновой кислоты помещена под контролем промотора H5R вируса осповакцины и обе, первая и вторая, молекулы нуклеиновой кислоты встроены в делецию III указанного вектора MVA.
20. Вектор по п.16, где указанный вектор включает первую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E6, вторую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E6, третью молекулу нуклеиновой кислоты, кодирующую полипептид HPV-16 E7, и четвертую молекулу нуклеиновой кислоты, кодирующую полипептид HPV-18 E7, где указанные первая, вторая, третья и четвертая молекулы нуклеиновой кислоты не содержат участок из 40 или большего числа непрерывных нуклеотидов, проявляющих процент гомологии 75% или выше чем 75%.
21. Вектор по п.1, где по меньшей мере одна из указанных первой и второй молекул нуклеиновой кислоты выбрана из SEQ ID NO; 10, 11, 12, 13, 14, 15, 66, 67, 68 и 69.
22. Клетка-хозяин для продуцирования рекомбинантным путем множественных полипептидов, содержащая вектор по любому из пп.1-21.
23. Фармацевтическая композиция для превентивной или лечебной терапии состояния, обусловленного инфекцией папилломавируса, содержащая терапевтически эффективное количество вектора по любому из пп.1-21 и фармацевтически приемлемый носитель.
24. Фармацевтическая композиция по п.23, где указанная композиция содержит один или более чем один адъювант, пригодный для системного введения или введения в слизистую оболочку у людей.
25. Фармацевтическая композиция по п.24, где указанный адъювант представляет собой соединение имидазохинолина.
26. Фармацевтическая композиция для превентивной или лечебной терапии состояния, обусловленного инфекцией папилломавируса, содержащая терапевтически эффективное количество клетки-хозяина по п.22 и фармацевтически приемлемый носитель.
27. Фармацевтическая композиция по п.26, где указанная композиция содержит один или более чем один адъювант, пригодный для системного введения или введения в слизистую оболочку у людей.
28. Применение вектора по любому из пп.1-21 или композиции по любому из пп.23-25 для изготовления лекарства, предназначенного для лечения или предупреждения состояния, обусловленного инфекцией папилломавируса.
29. Применение по п.28, где состояние, обусловленное инфекцией папилломавируса, выбрано из устойчивой инфекции, предраковых и раковых повреждений.
30. Применение по п.28 или 29, где указанное применение осуществляют в соответствии с режимом терапевтического воздействия примирования и усиления, и где указанный вектор или композицию применяют либо для примирования, либо для усиления, либо и для примирования, и для усиления иммунного ответа у субъекта.
31. Применение клетки-хозяина по п.22 или композиции по любому из пп.26 и 27 для изготовления лекарства, предназначенного для лечения или предупреждения состояния, обусловленного инфекцией папилломавируса.
32. Применение по п.31, где состояние, обусловленное инфекцией папилломавируса, выбрано из устойчивой инфекции, предраковых и раковых повреждений.
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| MACLEAN J | |||
| et al | |||
| J | |||
| of General Virology | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| CHEUNG J | |||
| et al | |||
| Vaccine | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2012-09-27—Публикация
2008-01-29—Подача