Настоящее изобретение относится к биохимии, конкретнее, к биологически активным пептидам, которые являются специфическими ингибиторами клатрина и могут найти применение в медицине и фармакологии в качестве препаратов для профилактики или лечения различных заболеваний и физиологических состояний, чувствительных к ингибированию клатрина или для которых ингибирование клатрина необходимо.
Термин «клатрин», который используется в настоящем описании, означает внутриклеточный белок, который является основным компонентом оболочки окаймленных пузырьков, образующихся при рецептор-опосредованном эндоцитозе [McMahon, Boucrot, 2011]. В классическом варианте клатрин состоит из трех тяжелых цепей (~190 kDa), каждая из которых тесно связана с легкой цепью (~25 kDa). Тяжелые цепи кодируются двумя генами: на хромосоме 17 (тяжелая цепь С17) и на хромосоме 22 (тяжелая цепь С22). Последняя представлена в основном в мышцах, тогда как С17 представлена в клатрине всех клеток. Однако, обе тяжелые цепи имеют высокую степень гомологии (95% совпадения аминокислотной последовательности) и функционально равнозначны [Hood, Royle, 2009]. В результате полимеризации клатрин формирует замкнутую трехмерную сеть, напоминающую сферу, при размере клатриновых везикул около 100 нм. После образования везикулы и отрыва везикулы от мембраны (под действием ГТФазы динамина) клатриновая оболочка быстро диссоциирует и клатрин может повторно использоваться для эндоцитоза и экзоцитоза. Процесс стимулируется в результате взаимодействия лиганда со специфическим рецептором [McMahon, Boucrot. 2011]. Принципиально важно, что выключение активности тяжелой цепи клатрина влечет за собой потерю активности целого клатринового комплекса [Haar ter, Harrison, Kirchhausen, 2000]. В результате клатринового эндоцитоза в клетку попадают не только рецепторы, но и другие метаболиты: гормоны, нейромедиаторы, всевозможные белки [Most и др., 2003]. Также в результате клатринового эндоцитоза в клетку попадают различные патогенные агенты, такие, как вирусы, токсины и симбиотические микроорганизмы. Например, нейротоксины ботулизма и нейротоксин столбняка являются бактериальными белками, которые вызывают два тяжелых заболевания: столбняк и ботулизм. Их действие зависит от интернализации нейротоксинов через эндоцитоз в нервные окончания [Pellett и др., 2015].
Известны различные препараты, которые являются ингибиторами клатрина. Все они обладают теми или иными недостатками, которые сужают возможности их применения в медицине.
В частности, известны синтетические препараты, имеющие в своей основе соединения, которые могут связываться с терминальным доменом клатрина по меньшей мере с одной или несколькими аминокислотами: Ile 52, Ile 62, Ile 80, Phe 91 и/или Ile 93, (WO 2013010218 A9; Robertson и др., 2014). Существенным недостатком этих соединений является отсутствие специфичности [Willox, Sahraoui, Royle, 2014].
Также известен ингибитор клатрина в виде пептида Thr-Pro-Val-Leu-Glu-Thr-Pro-Lys-Leu-Leu-Leu-Trp (JP 2009250552 A). Однако в этом случае предложенная 12-членная последовательность является ингибитором не прямого действия, а первоначально ингибирует связывание с клатрином белка GRP78, которому присущи функции, не связанные с клатрином. Поэтому недостатком этого соединения также является отсутствие специфичности. Кроме того, предложенная последовательность состоит исключительно из природных L-аминокислот и, следовательно, чувствительна к эндопептидазам. что ограничивает возможность ее использования in vivo.
С целью устранения отмеченных недостатков экспериментальным путем было установлено, что синтетические пептиды с ненаркотическим типом анальгетического действия, защищенные нами ранее патентами РФ 2508295, US 9260482 (РСТ WO/2013/141750, 2013), эффективные при различных способах введения (субокципитальном, внутримышечном, интраназальном и внутривенном) на различных моделях тонической и острой боли, являются специфическими ингибиторами клатрина.
Ранее нами было показано, что разработанные пептидные последовательности не влияют на кальциевый обмен по тесту связывания с тетрациклином, не обладают иммунным действием, не образуют фибриллы в растворе, устойчивы при хранении, и являются дешевыми в изготовлении и использовании (патент РФ 2508295).
Задача, на решение которой направлено предлагаемое изобретение, состоит в расширении ассортимента эффективных средств, являющихся специфическими ингибиторами клатрина, не имеющих побочных эффектов и получаемых простым синтезом. Поставленная задача решается тем, что
Для достижения поставленного результата предлагаются синтетические пептиды общей формулы (I) [SEQ ID NO: 1]
 ,
,
где: XDL - отсутствие аминокислоты или L-Tyr,
XDL1 - одна из аминокислот: L-Leu, L-Ala или D-Ala,
XDL2 - одна из аминокислот: L-His, D-His, L-Ala или D-Ala,
XDL3 - одна из аминокислот: L-Gln, L-Ala или D-Ala;
R2 - ОМе или NH2,
или пептиды - ретроинверсии формулы (I), имеющие обратную последовательность аминокислот с заменой L-формы аминокислот на D-форму и D-формы аминокислот на L-форму, общей формулы (II) [SEQ ID NO: 2]
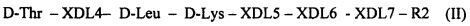 ,
,
где: XDL4 - одна из аминокислот: D-Gln, D-Ala или L-Ala;
XDL5 - одна из аминокислот: D-His, L-His, D-Ala или L-Ala,
XDL6 - одна из аминокислот: D-Leu, D-Ala или L-Ala,
XDL7 - отсутствие аминокислоты или D-Tyr,
R2 - ОМе или NH2,
или пролекарство или физиологически приемлемые соли или сольваты вышеназванных пептидов в качестве специфических ингибиторов клатрина.
Предлагается также способ профилактики или лечения заболевания или состояния у животного, включающий введение эффективного количества синтетических пептидов общей формулы (I) [SEQ ID NO: 1] или общей формулы (II) [SEQ ID NO: 2] или пролекарства или физиологически приемлемой соли или сольвата вышеназванных пептидов, или фармацевтической композиции, содержащей вышеназванные пептиды, как специфических ингибиторов клатрина.
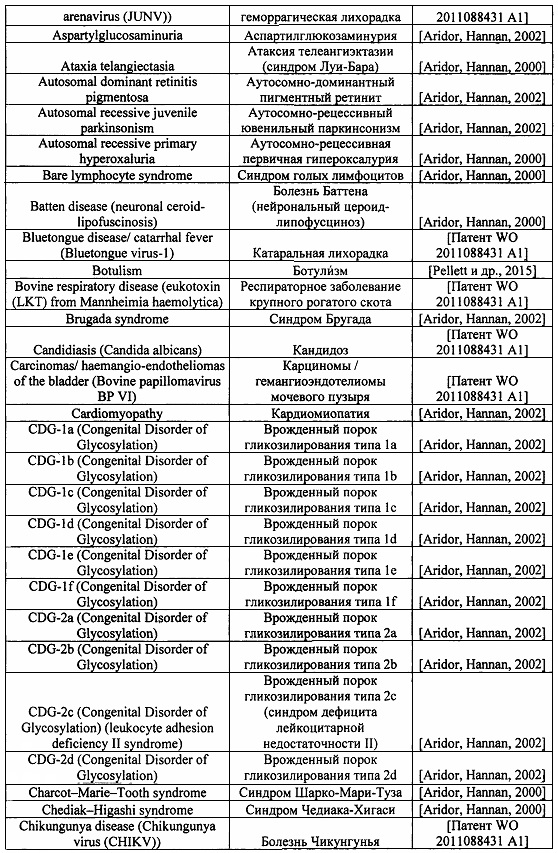
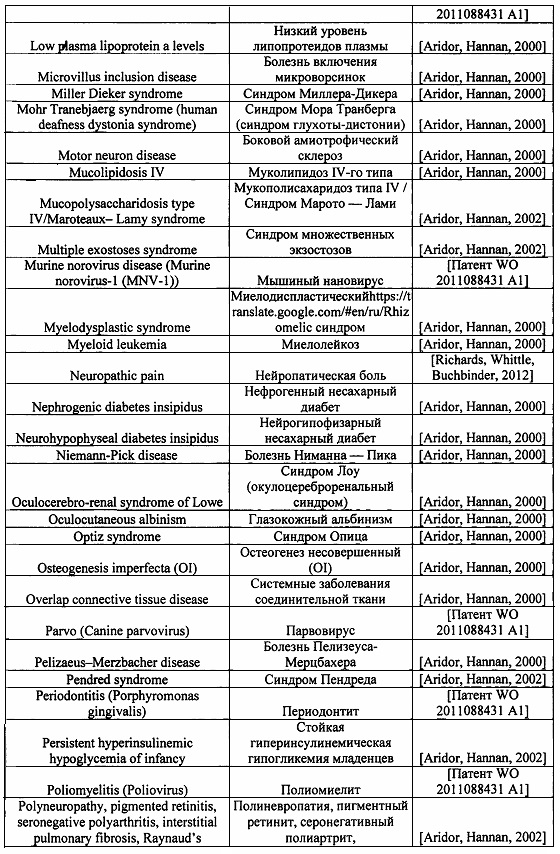
Перечень заболеваний, при которых ингибирование функции клатрина имеет ключевую роль, представлен в нижеследующей таблице 1.





Сущность изобретения заключается в том, что экспериментальным путем было установлено, что заявляемые пептиды, имеющие простую структуру (что облегчает их получение химическим путем), являются специфическими ингибиторами клатрина.
Термин «ингибитор клатрина», который используется в настоящем описании, и его вариации, означает соединение, которое взаимодействует с клатрином, и, по меньшей мере, частично ингибирует функциональную активность клатрина в клатрино-опосредованном эндоцитозе (СМЕ), который может быть выражен снижением СМЕ и/или уровнем СМЕ в клетках. Таким образом, ингибирование клатрина в соответствии с изобретением может быть полным или частичным ингибированием функциональной активности клатрина.
Клатрин-опосредованный эндоцитоз (СМЕ) важен не только для переноса метаболитов в клетку, но и при передаче сигналов клетками, а ингибирование функции клатрина имеет применение в профилактике или лечении различных заболеваний и состояний. Список болезней, при которых ингибирование функции клатрина имеет ключевую роль, опубликован ранее в работах [Aridor, Hannan, 2002; Aridor, Hannan, 2000], содержание которых включено в настоящее описание посредством ссылки во всей их полноте.
В частности, ингибиторы функции клатрина могут найти применение при многих заболеваниях в центральной нервной системе, включая: болезнь Альцгеймера [Harold и др., 2009], болезнь Паркинсона [Edvardson и др., 2012], эпилепсии [Casillas-Espinosa, Powell,  , 2012]. Примером нового противоэпилептического средства, действующего по механизму ингибирования процессов, связанных с клатрином, является леветирацетам (Keppra™) [Nowack и др., 2011].
, 2012]. Примером нового противоэпилептического средства, действующего по механизму ингибирования процессов, связанных с клатрином, является леветирацетам (Keppra™) [Nowack и др., 2011].
Ингибирование клатрин - опосредуемого эндоцитоза путем блокирования клатрина приводит к сокращению синаптической передачи, уменьшая доступность синаптических везикул, что может применяться для профилактики или лечения боли. Например, противосудорожные препараты, такие как фенитоин и габапентин, очень эффективны при лечении нейропатической боли [Richards, Whittle, Buchbinder, 2012]. Эти лекарственные средства действуют посредством изменения процесса передачи синаптических везикул, то есть ингибирование СМЕ путем блокирования клатрина может остановить или ограничить передачу сигналов боли и тем самым уменьшить или улучшить ощущение боли.
Также вызывают особый интерес данные о том, что одна из мутаций в тяжелой цепи клатрина приводит к редкому заболеванию у людей - потерю болевой и тактильной чувствительности [Nahorski и др., 2015], и то, что интенсивность воспалительных и, как следствие, болевых реакций находится в зависимости от тяжелой цепи клатрина [Escobar и др., 2006; Kim, Sorg, Arrieumerlou, 2011].
В самом деле, профилактика или лечение любого физиологического расстройства, которое может быть осуществлено путем ингибирования СМЕ, как описано здесь, прямо охватывается настоящим изобретением.
Также весьма значимым является возможность подавления ингибиторами клатрина избыточной клеточной пролиферации при раковых заболеваниях. Несколько известных в настоящее время ингибиторов, взаимодействующих с митотическими белками, на данный момент находятся на стадии доклинических или клинических исследованиях в качестве средств для лечения рака. Антимитотические эффекты этих ингибиторов могут быть частично обусловлены косвенным блокированием клатрином митотических функции [Booth и др., 2011].
Следовательно, ингибиторы клатрина являются не только полезными молекулярными инструментами для разгадывания роли клатрина в митотическом цикле, но, по крайней мере, в некоторых вариантах, могут применяться в качестве ангимитотических соединений для лечения рака и клеточно-пролиферативных патологий. В этой связи нужно отметить, что многие рецепторы фактора роста (например, EGF-R) также требуют клатрин-опосредованного эндоцитоза (СМЕ) для интернализации и поддержания клеточной активности. Блокирование СМЕ предотвращает пролиферацию клеток в этих случаях и является дополнительным доказательством противораковой и противо-пролиферативной активности ингибиторов клатрина [Smith и др., 2013].
Также ингибирование СМЕ в соответствии с одним или несколькими вариантами осуществления изобретения является важным для разработки средств, предотвращающих проникновение в клетки, в том числе головного мозга, ряда патогенных вирусов, а также всевозможных токсинов, включая пептидные, которые проникают в клетку путем эндоцитоза. К числу таких вирусов и токсинов относятся (но не исчерпывается ими): дифтерия, лейкотоксин (LKT), хламидии, токсин сибирской язвы, золотистый стафилококк, кандидоз, пародонтит, аденовирус, вирус африканской чумы свиней, вирус лихорадки денге, заирский эболавирус (геморрагическая лихорадка Эбола), вирус гепатита В, вирус гепатита С, связанный с саркомой Капоши вирус герпеса, вирус иммунодефицита человека (ВИЧ), вирус гриппа и другие. Например, механизм действия наиболее активных соединений, направленных на предотвращение инфекцирования вирусом Эбола, связан с блокировкой адгезии вирусов на поверхности клетки, или с подавлением их эндоцитоза в клетку [Anantpadma и др., 2016; Aleksandrowicz и др., 2011; Piccini, Castilla, Damonte, 2015].
Таким образом, примеры конкретных заболеваний и состояний, для которых настоящее изобретение находит применение для профилактики или лечения, включают, но не ограничиваются ими, клеточно-пролиферативные заболевания и состояния, мультифокальную лейкоэнцефалопатию, поликистозные заболевания почек, заболевания, связанные с β-амилоидом (такие, как болезнь Альцгеймера), нейродегенеративные расстройства, нейропсихиатрические расстройства, психотические расстройства, психозы, биполярные расстройства, шизофрению, аберрантное нерегулируемое возбуждение нейронов, судороги, нейропатическую боль, мигрень, а также все заболевания и состояния, опосредованные или иным образом связанные с передачей синаптического сигнала с вовлечением процессов СМЕ (например, таких как эпилепсия) или с нарушением рециркуляции клеточных везикул. Также, как указано выше, ингибирование СМЕ в соответствии с одним или несколькими вариантами осуществления изобретения может также быть полезным для предотвращения проникновения ряда патогенных агентов в клетки и, таким образом, быть полезным в профилактике или лечении заболеваний или состояний, связанных с этим.
Все пептиды заявленного семейства обладают ранее показанным анальгетическим действием (см. РСТ WO/2013/141750) и являются специфическими ингибиторами клатрина.
Описание поясняется следующими рисунками:
рис. 1 - хроматограмма пептида (шестичленная последовательность);
рис. 2 - элюирование белковой фракции;
рис. 3 - мажорные белковые соединения;
рис. 4 - многоцветный белковый профиль для определения примерных масс при проведении гель-электрофореза (Thermo Fisher Scientific) (взято с официального сайта компании «Thermo Fisher Scientific)) / [Электронный ресурс]. - Режим доступа: URL: https://www.thermofisher.com/order/catalog/product/26634, дата обращения: 17.03.2017).
Синтез пептидов осуществляли методами пептидной химии, твердофазным методом с использованием L и D аминокислот.
Пример 1. Синтез пептида L-Leu-D-His-L-Lys-L-Leu-L-Gln-L-Thr-NH2 (Пептид №7 SEQ ID N0:1).
Пептид L-Leu-D-His-L-Lys-L-Leu-L-Gln-L-Thr-NH2 получали методом автоматического твердофазного синтеза по Fmoc-схеме на полимере Ринка (Rink Amide Resin, 0,6 ммоль амино-групп на 1 г полимера) с использованием DCC/HOBt (N,N'-дициклогексилкарбодиимид/1-гидроксибензотриазол) метода активации аминокислот. Деблокирование производили путем обработки раствором piperidine/DMF (пиперидин/N,N-диметилформамид) (1:4) в течении 7 минут. Защиту групп боковых цепей производили следующими группами: tBu (трет-бутиловый эфир) для тирозина, треонина, Trt (тритил или трифенилметил) для глутамина и для гистидина, Вое (т-бутилоксикарбонил) для лизина. Пептиды отщепляли от полимера и деблокировали смесью TFA/H2O/EDT (трифторуксусная кислота/вода/1,2-этандитиол) (90:5:5). Очистку пептидов проводили путем обратнофазовой ВЭЖХ (колонка С18), элюент - ацетонитрил - вода (0,1М дигидрофосфата калия) в соотношении 6:4. Пептиды были охарактеризованы с помощью масс-спектрометра. Чистоту пептида проверяли также ВЭЖХ, колонка Waters DeltaPak C18 3,9*150 мм 5u 100А; раствор A: 0,1% TFA в 100% воде/MeCN; скорость потока - 1 мл/мин; длина волны детектирования - 230 нм (рис. 1).
Пример 2. Проверка активности синтезированных пептидов как специфических ингибиторов клатрина.
В основу эксперимента положена методика аффинной хроматографии, где в качестве неподвижной фазы выступает пептидная молекула, закрепленная на специальной матрице. В качестве подвижной фазы выступает экстракт головного мозга крысы. Белковая фракция, специфически связавшаяся с молекулой пептида, в дальнейшем подвергается фракционированию путем электрофореза и непосредственно детектированию отдельных белковых молекул.
Аффинный сорбент готовили следующим образом: матрицей для сорбента являлась бромциан активированная сефароза 4В (Sigma-Aldrich). растворенная в 1 мМ соляной кислоте (HCl). Для проведения исследований о возможности связывания клатрина с пептидом, а именно для посадки пептида на носитель (сефарозу) было необходимо ввести спейсер. Задача «спейсера» - пространственно разделить носитель (сефарозу) и собственно пептидную молекулу для создания условий взаимодействия исследуемого пептида и белков экстракта мозга. Такое использование «спейсера» достаточно часто встречается при проведении аффиной сорбции. Природа «спейсеров» весьма разнообразна [Day, Hashim, 1984; Lowe, 1977;  и др., 2012]. Использовали «спейсер», состоящий из двух аминокислотных остатков (Asp-Asp). Введение дипептида проходило в фосфатном буфере (рН 7,8-8,0).
и др., 2012]. Использовали «спейсер», состоящий из двух аминокислотных остатков (Asp-Asp). Введение дипептида проходило в фосфатном буфере (рН 7,8-8,0).
Исследуемый пептид растворяли в бидистиллированной воде и добавляли к аффинному сорбенту при строгом контроле рН, брали 5 мг пептида на 1 мл сорбента. «Сшивку» вели при температуре 4°С в течении 12 часов. По окончании процесса «сшивки» тщательно отмывали не связавшийся продукт многократным промыванием ацетатным буфером с рН 5,0 и бикарбонатным буфером рН 9,0.
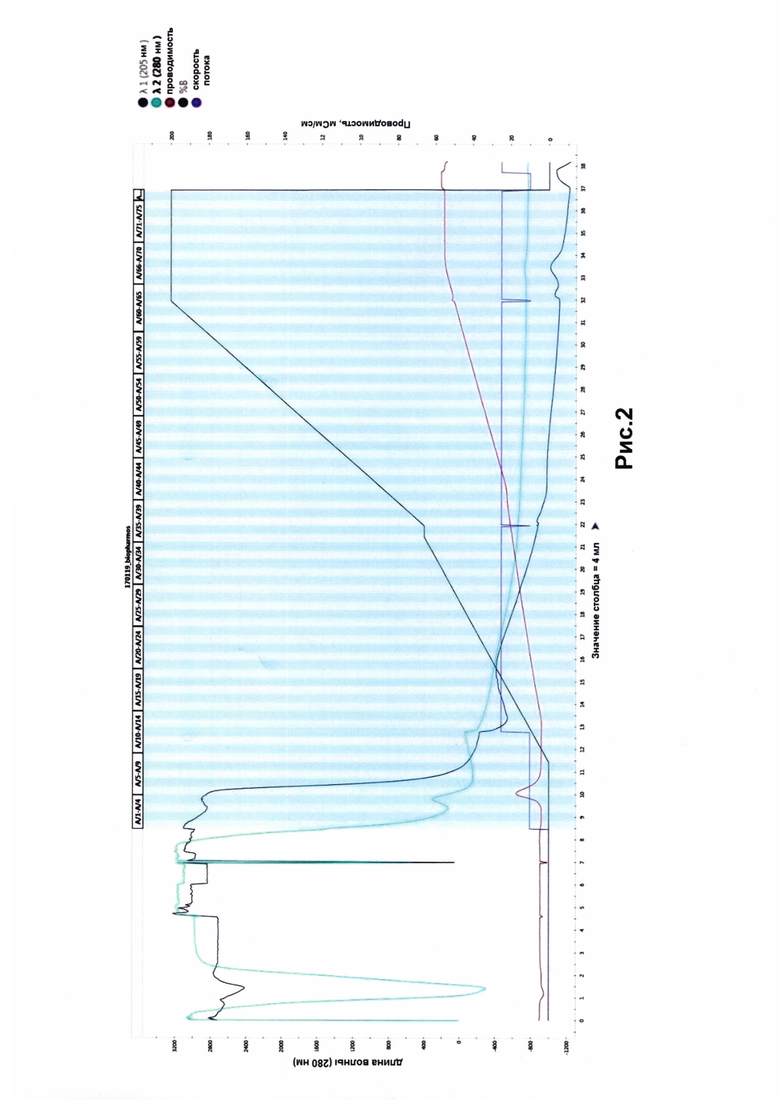
Для получения препаратов коры головного мозга крыс брали животных - крыс породы Вистар, самцов, массой около 300 г.Животных декапитировали, на холоду выделяли кору головного мозга. Полученные образцы помещали в жидкий азот, где измельчали до состояния мелкодисперсного порошка. Далее образец переносили в 10 мМ ТРИС-буфер рН 7,6 с 0,3 М сахарозой (Helicon), 1 мМ CaCl2 (Sigma-Aldrich) и 10 мМ MgCl2 (Sigma-Aldrich). Далее полученный гомогенат на холоду центрифугировали при 15000 об/мин в течении 20 минут. Аффинную сорбцию проводили в течение 24 часов при 4°С на шейкере с супернатантом, полученным после центрифугирования препаратов коры головного мозга. Далее сорбент переносили на колонку (Bio-Rad) и отмывали от неспецифически связанного белка. Отмывку проводили ТРИС-буфером при рН 7,6 без сахарозы. Вымывание белка контролировали при помощи хроматографа BioRad NGC Discovery. Элюцию смотрели при λ=280 им. Затем белок отмывали ТРИС-буфером, рН 7,6, содержащим NaCl. Количество соли давалось согласно градиенту от 0,05 М до 0,5 М. Детекция проводилась при длине волны 280 нм, скорость потока 0,1 мл/мин. На рис. 2 видно наличие двух пиков с 32 по 34 минуты, которые свидетельствуют о наличии белковой фракции, специфически связавшейся с молекулой пептида.
Белковая фракция, специфически связавшаяся с молекулой пептида, в дальнейшем подвергается фракционированию путем электрофореза и непосредственно детектированию отдельных белковых молекул.
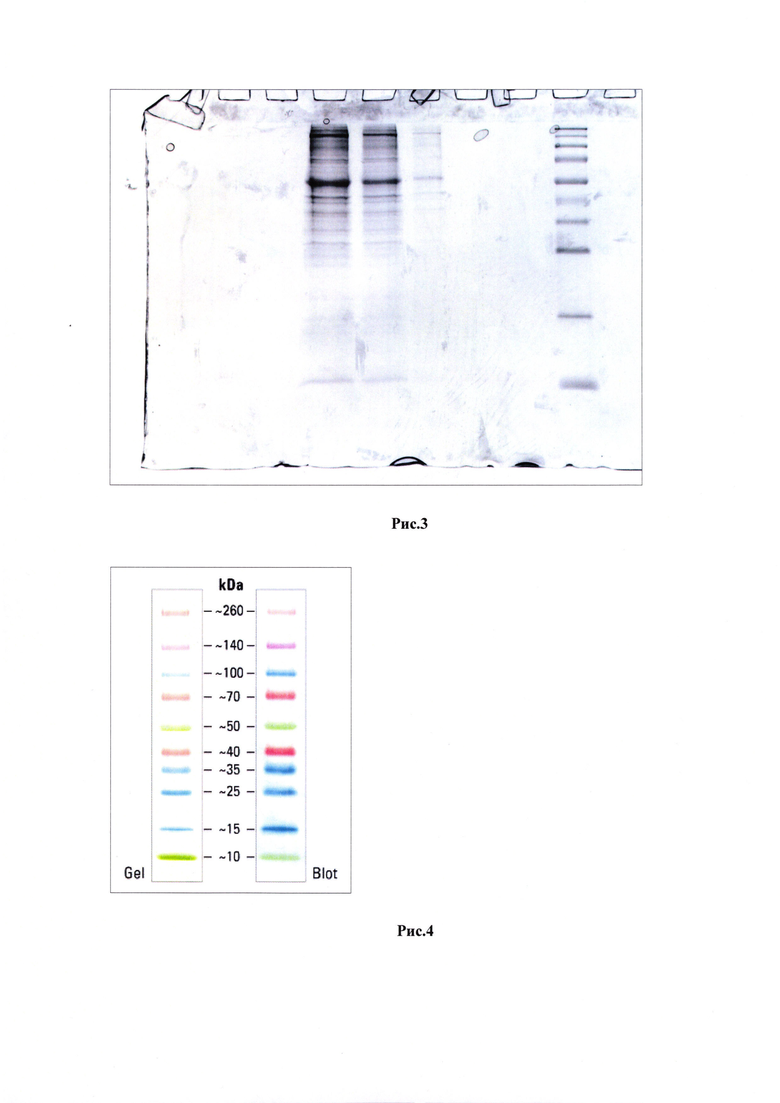
Электрофорез проводили в PAAG-геле. Использовали концентрированную фракцию в количествах: 1, 5 и 10 мкл. Наносили маркер Spectra (Spectra™ Multicolor Broad Range Protein Ladder). На рис. 3 отчетливо видны два мажорных белковых соединения, справа нанесен маркер, слева - исследуемая фракция в трех концентрациях. Для идентификации были вырезаны три полоски, соответствующие маркерным массам 260. 50 и 10 кДа. Для определения масс использовали контрольный рисунок из руководства производителя (рис. 4).
Идентификацию форезных пятен производили при помощи масс-спектрометрии. Хромато-масс-спектрический анализ проводился на триптических пептидах, выделенных из вырезанных кусучков геля с белком после триптинизации (обработки ферментом трипсином). Затем была проведена хромато-масс-спектрометрия этого раствора пептидов, после чего происходит идентификация пептидных последовательностей по базам данных. После идентификации результаты были валидизированы при помощи процедуры автовадилизации. Пептидные последовательности трипсина служат качественным контролем. Для проверки идентификации интересующих пятен производится поиск по базам данных млекопитающих. Верхнее пятно, соответствующее массе в приделах от 140 кДа до 260 кДа было идентифицировано как тяжелая цепь клатрина по 13 пептидным последовательностям. Поскольку ранее было установлено и доказано обезболивающее действие исследуемых пептидов, а ингибирование СМЕ путем блокирования клатрина может остановить или ограничить передачу сигналов боли, был сделан вывод, что исследуемые пептиды являются специфическими ингибиторами тяжелой цепи клатрина.
Следует отметить, что элюция (отделение) тяжелой цепи клатрина от пептида происходило при высоких значениях градиента, что свидетельствует о существенной аффинности пептида к тяжелой цепи клатрина.
Следовательно, настоящее изобретение может быть использовано также как метод выделения тяжелой цепи клатрина. При этом метод выделения является существенно более простым, чем общепринятые [Riddelle-Spencer,  , 1997]. Поэтому предложенный метод может найти применения для препаративного выделения тяжелой цепи клатрина для молекулярно-биологических исследований и нанотехнологии [Santos dos и др.. 2011].
, 1997]. Поэтому предложенный метод может найти применения для препаративного выделения тяжелой цепи клатрина для молекулярно-биологических исследований и нанотехнологии [Santos dos и др.. 2011].
Таким образом, техническим результатом предлагаемого изобретения является простота и дешевизна синтеза предложенных пептидов, являющихся специфическими ингибиторами клатрина, а также отсутствие у них ненужной иммунологической активности и других побочных эффектов, что позволяет рассматривать их в качестве основы для создания безопасных лекарственных средств, являющихся специфическими ингибиторами клатрина и получаемых простым синтезом.
СПИСОК ЛИТЕРАТУРЫ
L McMahon Н.Т., Boucrot Е. Molecular mechanism and physiological functions of clathrin-mediated endocytosis //Nat Rev Mol Cell Biol. 2011. T. 12. №8. C. 517-533.
2. Hood F.E., Royle S.J. Functional equivalence of the clathrin heavy chains CHC17 and CHC22 in endocytosis and mitosis //J. Cell Sci. 2009. T. 122. №13. C. 2185-2190.
3. McMahon H.T., Boucrot E. Molecular mechanism and physiological functions of clathrin-mediated endocytosis//Nat Rev Mol Cell Biol. 2011. T. 12. №8. C. 517-533.
4. Haar E. ter. Harrison S.C., Kirchhausen T. Peptide-in-groove interactions link target proteins to the beta-propeller of clathrin. // Proc. Natl. Acad. Sci. U.S.A. 2000. T. 97. №3. C. 1096-100.).
5. Most P. и др. Extracellular S100A1 Protein Inhibits Apoptosis in Ventricular Cardiomyocytes via Activation of the Extracellular Signal-regulated Protein Kinase 1/2 (ERK1/2) // J. Biol. Chem. 2003. T. 278. №48. C. 48404-48412.
6. Pellett S. и др. Botulinum neurotoxins can enter cultured neurons independent of synaptic vesicle recycling // PLoS One. 2015. T. 10. №7. C. 1-17.
7. Патент WO 2013010218 A9. Inhibition of clathrin / Volker H.. Robinson P., Mccluskey А. Опубл. 24.01.2013.
8. Robertson M.J. и др. Synthesis of the Pitstop family of clathrin inhibitors. // Nat. Protoc. 2014. T. 9. C. 1592-606.).
9. Willox A.K., Sahraoui Y.M.E., Royle S.J. Non-specificity of Pitstop 2 in clathrin-mediated endocytosis. // Biol. Open. 2014. T. 3. №5. C. 326-31.
10. Патент JP 2011093852 A. Clathrin-bonding peptide derivative / Kitahara H. и др. Опубл. 12.05.2011.
11. PCT WO/2013/141750 "Synthetic peptides with a non-narcotic type of analgesic effect", 2013
12. Патент РФ 2508295 Синтетические пептиды с ненаркотическим типом анальгетического действия / Власов Г.П.. Котин A.M. / Бюл. - 2013 - №27.
13. Aridor М., Hannan L. a. Traffic jams II: an update of diseases of intracellular transport. // Traffic. 2002. T. 3. №11. C. 781-790.
14. Aridor M., Hannan L.A. Traffic Jam: A Compendium of Human Diseases that Affect Intracellular Transport Processes // Traffic. 2000. Т. 1. №11. C. 836-851.
15. Harold D. и др. Genome-Wide Association Study Identifies Variants at CLU and PICALM Associated with Alzheimer's Disease, and Shows Evidence for Additional Susceptibility Genes // Nat. Genet. 2009. T. 41. №10. C. 1088-1093.
16. Edvardson S. и др. A deleterious mutation in DNAJC6 encoding the neuronal-specific clathrin-uncoating Co-chaperone auxilin, is associated with juvenile parkinsonism // PLoS One. 2012. T. 7. №5. C. 4-8.
17. Casillas-Espinosa P.M., Powell K.L.,  T.J. Regulators of synaptic transmission: roles in the pathogenesis and treatment of epilepsy. // Epilepsia. 2012. T. 53 Suppl 9. C. 41-58.
T.J. Regulators of synaptic transmission: roles in the pathogenesis and treatment of epilepsy. // Epilepsia. 2012. T. 53 Suppl 9. C. 41-58.
18. Nowack А. и др. Levetiracetam reverses synaptic deficits produced by overexpression of sV2A // PLoS One. 2011. T. 6. №12. C. 1-8.
19. Richards B.L., Whittle S.L., Buchbinder R. Neuromodulators for pain management in rheumatoid arthritis. // Cochrane database Syst. Rev. 2012. Т. 1. №1. C. CD008921.
20. Nahorski M.S. и др. A novel disorder reveals clathrin heavy chain-22 is essential for human pain and touch development // Brain. 2015. T. 138. №8. C. 2147-2160.
21. Escobar G.A. и др. Clathrin heavy chain is required for TNF-induced inflammatory signaling // Surgery. 2006. T. 140. №2. C. 268-272.) (Kim M.L., Sorg I., Arrieumerlou C. Endocytosis-independent function of clathrin heavy chain in the control of basal NF-κВ activation // PLoS One. 2011. T. 6. №2.
22. Booth D.G. и др. A TACC3/ch-TOG/clathrin complex stabilises kinetochore fibres by inter-microtubule bridging. // EMBO J. 2011. T. 30. №5. C. 906-19.
23. Smith С.М. и др. Inhibition of clathrin by pitstop 2 activates the spindle assembly checkpoint and induces cell death in dividing HeLa cancer cells. // Mol. Cancer. 2013. T. 12. C. 4.
24. Anantpadma M. и др. Large-Scale Screening and Identification of Novel Ebola Virus and Marburg Virus Entry Inhibitors // 2016. T. 60. №8. C. 4471-4481.
25. Aleksandrowicz P. и др. Ebola virus enters host cells by macropinocytosis and clathrin-mediated endocytosis // J. Infect. Dis. 2011. T. 204. № SUPPL. 3. C. 957-967.
26. Piccini L.E., Castilla V., Damonte E.B. Dengue-3 virus entry into vero cells: Role of clathrin-mediated endocytosis in the outcome of infection // PLoS One. 2015. T. 10. №10. C. 1-17.
27. Day E.D., Hashim G.A. Affinity purification of two populations of antibodies against format determinants of synthetic myelin basic protein peptide S82 from S82-AH- and S82-CH-Sepharose 4B columns. // Neurochem. Res. 1984. T. 9. №10. C. 1453-65.
28. Lowe C.R. Immobilised lipoamide dehydrogenase. 2. Properties of the enzyme immobilised to agarose through spacer molecules of various lengths. // Eur. J. Biochem. 1977. T. 76. №2. C. 401-9.
29.  M.C. и др. Recombinant protein purification using complementary peptides as affinity tags // N. Biotechnol. 2012. T. 29. №2. C. 206-210.
M.C. и др. Recombinant protein purification using complementary peptides as affinity tags // N. Biotechnol. 2012. T. 29. №2. C. 206-210.
30. Официальный сайт компании «Thermo Fisher Scientific» / [Электронный ресурс]. - Режим доступа: URL: https://www.thermofisher.com/order/catalog/product/26634 (дата обращения: 17.03.2017).
31. Riddelle-Spencer K.S.,  T.J. Purification of clathrin heavy and light chain from Dictyostelium discoideum. // Protein Expr. Purif. 1997. Т. 11. №3. C. 250-6.
T.J. Purification of clathrin heavy and light chain from Dictyostelium discoideum. // Protein Expr. Purif. 1997. Т. 11. №3. C. 250-6.
32. Santos T. dos и др. Effects of transport inhibitors on the cellular uptake of carboxylated polystyrene nanoparticles in different cell lines. // PLoS One. 2011. T. 6. №9. C. e24438.







Изобретение относится к биотехнологии и химико-фармацевтической промышленности. Предложено применение синтетических пептидов в качестве специфических ингибиторов клатрина. Синтетические пептиды представляют собой пептид общей структуры (I): XDL - XDL1 - XDL2 - L-Lys - L-Leu - XDL3 - L-Thr - R2 [SEQ ID NO: 1] или пептид - ретроинверсия структуры (I), имеющий обратную последовательность аминокислот с заменой L-формы аминокислот на D-форму и D-формы аминокислот на L-форму, общей структуры (II): D-Thr - XDL4 - D-Leu - D-Lys - XDL5 - XDL6 - XDL7 - R2 [SEQ ID NO: 2], где значения XDL1-7 представлены в формуле. Предложенные пептиды обладают высокой аффинностью к тяжелой цепи клатрина и могут быть использованы для выделения тяжелой цепи клатрина, а также для создания новых лекарственных средств, являющихся специфическими ингибиторами клатрина. 4 ил., 1 табл., 2 пр.
Применение синтетического пептида общей формулы (I) [SEQ ID NO: 1]
XDL - XDL1 - XDL2 - L-Lys - L-Leu - XDL3 - L-Thr - R2 (I),
где XDL - отсутствие аминокислоты или L-Tyr,
XDL1 - одна из аминокислот: L-Leu, L-Ala или D-Ala,
XDL2 - одна из аминокислот: L-His, D-His, L-Ala или D-Ala,
XDL3 - одна из аминокислот: L-Gln, L-Ala или D-Ala;
R2 - ОМе или NH2,
или пептида - ретроинверсии формулы (I), имеющего обратную последовательность аминокислот с заменой L-формы аминокислот на D-форму и D-формы аминокислот на L-форму, общей формулы (II) [SEQ ID NO: 2]
D-Thr - XDL4 - D-Leu - D-Lys - XDL5 - XDL6 - XDL7 - R2 (II),
где XDL4 - одна из аминокислот: D-Gln, D-Ala или L-Ala;
XDL5 - одна из аминокислот: D-His, L-His, D-Ala или L-Ala,
XDL6 - одна из аминокислот: D-Leu, D-Ala или L-Ala,
XDL7 - отсутствие аминокислоты или D-Tyr,
R2 - ОМе или NH2,
в качестве специфического ингибитора клатрина.
| СИНТЕТИЧЕСКИЕ ПЕПТИДЫ С НЕНАРКОТИЧЕСКИМ ТИПОМ АНАЛЬГЕТИЧЕСКОГО ДЕЙСТВИЯ | 2012 |
|
RU2508295C2 |
| ROGACHEVSKII S.V | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| PATKINA N.A | |||
| et al | |||
| "Studies of the analgesic activity of calcitonin fragments", PHARMACEUTICAL CHEMISTRY JOURNAL, 1994, v.28, no.10, p.728-731 | |||
| WO 2013010218 A1, 24.01.2013 | |||
| WO 2011088431 A1, 21.07.2011. | |||
Авторы
Даты
2018-04-19—Публикация
2017-04-07—Подача