Область техники, к которой относится изобретение
Изобретение относится к области медицины, фармакологии, биотехнологии, генной инженерии, генной терапии, а именно к доставке в клетки ДНК и РНК с терапевтической, диагностической и исследовательской целью.
Уровень техники
В развитии технологий генной терапии слабым местом остается обеспечение эффективной доставки генетических конструкций на основе ДНК и/или РНК внутрь клетки.
В настоящее время развивается целый ряд подходов, направленных как на повышение эффективности доставки генетических конструкций в клетки, так и обеспечение возможности их целенаправленной доставки только в определенные клетки и ткани.
Методы доставки генов в клетки млекопитающих
Плазматические мембраны клеток являются надежным барьером для проникновения чужеродных нуклеиновых кислот - РНК либо ДНК, если, конечно, нуклеиновые кислоты не находятся в вирусных частицах или не захватываются фагоцитирующими клетками. В некоторых случаях все же удается сделать мембрану временно проницаемой для ДНК и РНК, изменяя физическое состояние мембраны (текучесть, целостность). Возможность осуществления таких изменений зависит от ряда факторов: метаболической активности клеток, запаса энергетических веществ, способности к фагоцитозу, стадии жизненного цикла клеток.
Если полинуклеотидные последовательности не способны самостоятельно проникать в клетки через плазматическую мембрану, то относительно низкомолекулярные олигодезоксинуклеотиды (ОДН), возможно, составляют исключение. Механизм проникновения ОДН в клетки млекопитающих до конца не изучен, хотя предполагают, что ОДН поглощаются клетками сочетанием адсорбционного эндоцитоза и пиноцитоза, которые отчасти активируются путем связывания ОДН с рецептороподобными белками поверхности клеток широкого спектра тканей (Gewirtz A. M. et al., 1996). Большая часть попавших в клетки ОДН в конечном итоге оказывается в эндосомно/лизосомных везикулах и там гидролизуется ферментами.
В целом, большую роль в развитии методов генотерапии играет разработка средств и способов переноса "лечащих" генов (в составе векторов экспрессии) в организм, которые должны обеспечить высокую эффективность доставки генетических конструкций, их избирательное попадание в те или иные клетки и ткани, стабильное функционирование трансгенов в клетках при минимальных побочных эффектах: токсическом, воспалительном, иммуногенном и, возможно, мутагенном и онкогенном (Culver K. W., 1994). Кроме того, должны быть учтены и такие факторы, как экономичность создания и использования средств доставки.
Методы доставки генов в соматические и половые клетки млекопитающих в зависимости от условий обращения с клетками могут быть классифицированы как методы переноса in vitro, ex vivo и in vivo (Culver K. W., 1994). В первом случае (in vitro) доставку гена проводят в культивируемые клетки или ткани млекопитающих, чаще всего в экспериментальных целях, когда мишенью воздействия являются нормальные, мутантные или патологически измененные клетки. Во втором случае (ех vivo) перенос осуществляют в кратковременно культивируемые in vitro клетки, взятые из организма, и после подтверждения факта доставки в них "лечащего" гена клетки возвращают в организм экспериментального животного, донора или больного человека для достижения лечебного эффекта. В третьем случае (in vivo} направленный перенос генов с той же целью проводят непосредственно в клетки или ткани (мишени) живого организма.
Другая классификация наиболее распространенных средств доставки векторов экспрессии в клетки основана на способе переноса:
1. Вирусные (рекомбинантные аденовирусы, ретровирусы, аденоассоциированные вирусы, вирусы группы герпеса и осповакцины).
2. Невирусные биологические (липосомы, катионные липиды; поликатионы; вирусные оболочки, молекулярные конъюгаты; микросферы).
3. Физико-химические, физические (кальций-фосфатная трансформация клеток in vitro, электропорация, баллистическая процедура, микрокапиллярная инъекция).
Перенос генов с помощью рекомбинантных вирусов
Для переноса in vivo можно использовать рекомбинантные ретровирусы, аденовирусы, аденоассоциированные вирусы и вирусы герпеса. Доставка "лечащих" генов в составе рекомбинантных ретровирусов хронологически является одним их первых успешных опытов генотерапии человека. Разрабатываются проекты лечения, по которым ретровирусные частицы инъецируют in vivo с доставкой непосредственно в определенные ткани и органы (представленные пролиферирующими клетками). Кроме того, в некоторых случаях в организм больного инокулируют продуцирующие ретровирус "пакующие" клетки, например, интракраниально (стереотактически) в случае злокачественных опухолей головного мозга. К недостаткам ретровирусного переноса генов следует отнести возникающую при случайной встройке в хромосомы провируса опасность выключения экспрессии жизненно важных генов или активации онкогенов (Temin Н. М., 1990). Кроме того, по не вполне ясным причинам, ретровирусные векторы экспрессии со временем инактивируются, хотя и продолжают сохраняться в интегрированном с хромосомной ДНК виде.
Наиболее эффективны в доставке «лечащих» генов в организм млекопитающих рекомбинантные аденовирусы, поскольку инфекционный титр такого вируса может достигать 1010 БОЕ/мл; кроме того, аденовирусы обладают широкой тропностью к различным тканям, а при попадании в клетки их генетический материал вместе с "лечащим" геном перемещается в клеточные ядра, где сохраняется от двух недель до нескольких месяцев (Rosenfeld М. A. et al., 1991). "Лечащий" ген замещает в вирусном геноме область ранних генов аденовируса, вследствие чего такой вирус в клетках теряет способность к размножению и некоторое время спустя разрушается. К недостаткам переноса генов в составе аденовирусов относятся определенная токсичность дефектных вирусных частиц, способных продуцировать некоторые ранние вирусоспецифические белки в организме, и, кроме того, их высокая иммуногенность, что затрудняет повторные курсы лечения. Для снижения токсичности и иммуногенности разрабатывают серии аденовирусных векторов нового поколения, лишенных уже целого ряда вирусных генов (Fisher K. J. et al., 1996), что позволяет избежать синтеза вирусоспецифических белков после доставки "лечащего" гена в организм. В этом случае развитие иммунных реакций задержано и происходит лишь при повторных инъекциях аденовируса. Вирусные частицы вводят в организм внутривенными инъекциями или в виде аэрозоля в дыхательные пути для лечения наследственных дефектов дыхательного эпителия. В частности, для лечения больных муковисцидозом (наследственный дефект гена CFTR) в дыхательные пути пациента в виде аэрозоля вводят рекомбинантный аденовирус, содержащий вектор экспрессии гена CFTR (Zabner J. et al., 1993; Harvey В. G. et al., 1999; Lerondel S. et al., 2001; Davies J. C., 2002; Griesenbach U. et al., 2002; Gaden F. et al., 2004). Разрабатываются проекты по переносу "лечащих" генов в составе рекомбинантных вирусов других видов: аденоассоциированных вирусов (Nomura S. et al., 2004; Tietge U. J. et al., 2004; Oka K. et al., 2001; Kozarsky K. F. et al., 1996; Kobayashi K. et al., 1996; Kozarsky K. F. et al., 1994; Kozarsky K. et al., 1993; Flotte Т. R., 2004), вирусов простого герпеса (Coffin R. S. et al., 1996a; Weir J. P. et al., 1996; Coffin R. S. et al., 1996b; Wang M. et al., 1998; Wolfe D. et al., 2004; Niranjan A. et al., 2004; Goss J. R. et al., 2004; Cao B. et al., 2004; Goins W. F. et al., 2004), вируса осповакцины (Guo Z. S. et al., 2004; Di N. M. et al., 2003; Walther W. et al., 2000).
Аденоассоциированный вирус доставляет гены (небольшого размера) в одну из хромосом (19-ю) человека. К преимуществам такой доставки относят относительную легкость последующего удаления вирусного вектора из клеточной ДНК путем коинфекции клеток-мишеней вирусом-хелпером. Ограничением векторов, приготовленных на основе аденоассоциированых вирусов, является относительно низкая вместимость их капсиды для полинуклеотидов - около 5 т.п.н., что делает невозможным перенос крупноразмерных клеточных генов. Недавно появилось сообщение о разработке гибридного вектора, в котором репликативная форма рекомбинантного аденоассоциированного вируса упакована в капсид аденовируса. Емкость такого вектора оказывается существенно выше при сохранении сайт-специфической интегративной способности, присущей аденоассоциированным вирусам (Goncalves M. A. et al., 2004).
Рекомбинантные герпесвирусы рекомендуется использовать для доставки "лечащих" генов в клетки нервной ткани, в ядрах которых герпесвирусный геном способен длительно сохраняться в латентном состоянии (в виде эписомы) (Flotte Т. R., 2004; Coffin R. S. et al., 1996; Weir J. P. et al., 1996; Coffin R. S. et al., 1996; Wang M. et al., 1998; Gregorevic P. et al., 2004; Gruchala M. et al., 2004). Рекомбинантные вирусы вакцины (геном которых локализуется в цитоплазме) используют для процедуры молекулярного вакцинирования организма продуктами экспрессии чужеродных генов (Walther W. et al., 2000; Di N. M. et al., 2003; Guo Z. S. et al., 2004).
Невирусные системы переноса генов
Голая плазмидная ДНК быстро деградирует под действием нуклеаз плазмы, что является серьезным препятствием при проведении трансфекций (Hashida M. et al., 1996; Crook K. et al., 1996). Эта проблема частично решается конденсацией ДНК позитивно зараженными молекулами, что защищает ДНК от действия нуклеаз (Sandgren S. et al., 2004; Wiethoff C.M. and Middaugh C.R., 2003; Luo D. and Saltzman W.M., 2000). He менее важная задача для невирусных систем - облегчение преодоления плазматической мембраны. Основным путем проникновения в клетку ДНК с помощью невирусных систем доставки является эндоцитоз. В большинстве случаев проникновение идет за счет клатрин- и кавеолин-независимого эндоцитоза, а также клатрин-независимого и адсорбционного эндоцитоза (Takei K. et al., 2001; Nichols B.J. et al., 2001). В некоторых типах клеток проникновение реализуется по механизму макропиноцитоза или фагоцитоза для достаточно крупных частиц (Apodaca G., 2001) (рис.2-11).
Впервые невирусные средства доставки были применены более 20 лет назад. Системы доставки генетических векторов должны выполнять несколько функций: связываться с доставляемым генетическим материалом, упаковывая ДНК и обеспечивая не только проникновение сквозь мембрану, но и защиту ДНК как до попадания в клетку, так и непосредственно после трансфекции, обеспечивая выход из лизосомных компартментов, сохранение в цитоплазме и транслокацию в ядро клетки. Преодоление не только плазматической мембраны, но и избежание лизосомной деградации введенной ДНК является весьма сложной задачей.
Известно, физиологические концентрации солей и белков в сыворотке крови существенно влияют на физико-химические свойства невирусных носителей и часто приводят к снижению или полной потере их свойств, что на данный момент сильно ограничивает применение таких систем in vivo (Molas M. et al., 2003; Ignatovich I. et al., 2003). В настоящее время ведутся активные исследования по разработке невирусных средств доставки, эффективных in vivo.
Катионные липиды
Первая удачная трансфекция с использованием катионных липидов (липоплекс) была проведена в 1987 году (Feigner P.L. et al. 1987). С тех пор этот метод нашел широкое применение не только в исследовательских целях, но и в клинических протоколах (Nabel G.J. et al., 1990). Его использование является относительно безопасным и простьм методом для локальной доставки в низких дозах (Li S. et al., 2000).
Основным компонентом мембран липосом являются фосфолипиды. Кроме того, для стабилизации частиц во внеклеточной среде в состав вводят 40-50 мол. % холестерина. Тропность липосом к клеткам разных типов зависит от заряда, который можно изменять варьированием фосфолипидного состава и различными добавками (Ropert С.1999).
Взаимодействие ДНК с катионными липосомами - это самопроизвольный процесс, инициирующийся ДНК-опосредованным слиянием липосом и крупномасштабной липидной реаранжировкой. Однако при образовании ДНК-липосомного комплекса не происходит конденсации ДНК (Li S. et al., 2000, Zuidam N. J. and Barenholz Y., 1998).
ДНК-липосомный комплекс относительно легко проникает в клетки в результате электростатической адсорбции позитивно заряженной мембраны липосом с плазматической мембраной эукаротической клетки или идет с участием эндоцитоза (Li S, et al., 2000; Zuidam N. J. et al., 1998; Smith R. M. and Wu G. Y. 1999). В ряде случаев существенную роль в проникновении комплексов ДНК с катионными липидами в нефагоцитирующие культивируемые клетки млекопитающих играет клатрин-опосредованный эндоцитоз (Zuhom I. S. et al., 2002). Молекулы клеточной поверхности, отвечающие за взаимодействие с липоплексом, еще не полностью изучены, однако известно, что важную роль в этом процессе играют протеогликаны клеточной поверхности (Scherman D. et al., 1998, Singh M., 1999).
Возможность применения катионных липидов не зависит от пролиферативной активности клеток, благодаря чему липоплекс может использоваться для трансформации неделящихся или медленно пролиферирующих клеток (Zuidam N. J. et al., 1998). Недостатком этого метода является деградация значительной части чужеродной ДНК под действием лизосомных гидролаз, а также токсичность при использовании в высоких дозах (Erbacher P. et al., 1996). Освобождение из эндосомальных компартментов в большинстве случаев достигается за счет повреждения мембраны эндосомы путем замещения части липидных компонентов между мембранами липосомы и эндосомы (Хи Y. and Szoka F. С., 1996). В соответствии с данной моделью анионные липиды эндосомальной везикулы взаимодействуют с катионными липидами липосом по «флип-флоп» механизму, обеспечивая частичное слияние мембран и высвобождение ДНК. С этим хорошо согласуются данные об увеличении эффективности трансфекции при добавлении к комплексам катионные липиды-ДНК нейтральных DOPE липидов, облегчающих слияние мембран (Hui S. et al., 1996; Farhood H. et al., 1995).
Молекулярные конъюгаты
Молекулярные конъюгаты представляют собой поликатионы, в большинстве случаев ковалентно сцепленные с лигандами клеточных рецепторов (Fajac I. et al., 2000). По сравнению с катионными липидами молекулярные конъюгаты более эффективно конденсируют ДНК в компактные структуры, что увеличивает стабильность комплексов и, в ряде случаев, способствует ядерной локализации переносимых генетических конструкций (Rudolph С. et al., 2000). В настоящее время создано и активно используется несколько различных типов молекулярных конъюгатов, на основе таких поликатионов как поли-L-лизин, полиэтиленимин и другие (Nolan G.P. et al., 1998; Kost T.A., 1999; Fajac I. et al., 2000; Rudolph C. et al., 2000).
Поликатионы легко ассоциируют с ДНК в растворе благодаря электростатическим взаимодействиям позитивно заряженных аминогрупп и отрицательно заряженных фосфатных групп ДНК. Размер формирующегося комплекса в значительной степени зависит от используемого лиганда (Rudolph С.et al., 2000). Как правило, образуется структура с диаметром менее 80-100 нм (Fajac I. et al., 2000), что позволяет использовать такой комплекс для доставки ДНК в различные типы клеток, т.к. большинство их имеют размер первичных эндосомальных компартметов 100-120 нм. (Cristano R.J. et al., 1995). Комплекс ДНК-конъюгат избирательно связывается клеточными рецепторами, с помощью лигандного участка конъюгата и переносится внутрь клетки рецептор-опосредованным эндоцитозом (Smith R.M., 1999; Gottschalk S. et al., 1996, Zeiphati 0. et al., 1998). В качестве лигандов к поверхностным клеточным рецепторам часто используют молекулы аксиалогликопротеинов, инсулина, трансферрина, эпидермального ростового фактора и др. белков, а также низкомолекулярные соединения (гликозидные остатки и др.) (Yanagihara K. et al., 2000).
Главное ограничение, возникающее при использовании поликатионных носителей - это быстрая инактивация и исчезновение из кровеносного русла при системном введении, что объясняется двумя основными причинами - агрегацией и абсорбцией белками сыворотки в условиях in vivo (Dash P.R. et al., 1999; Ogris M. et al., 1999).
При образовании комплекса электростатические взаимодействия между молекулой ДНК и поликатионным носителем приводят к образованию частицы, имеющей нейтральный заряд, что позволяет частицам легко агрегировать в водных растворах. Для снижения агрегации комплексов и их инактивации при добавлении в культуральную среду или системном введении в организм используют следующие подходы: «стерическую стабилизацию», добавляя молекулы полимера, в частности, полиэтиленгликоля (ПЭГ), предохраняющие от слипания, к которым в большинстве случаев присоединены лиганды, обеспечивающие специфическое взаимодействие с клеточными рецепторами. Еще один подход к повышению устойчивости комплексов - «электростатическая стабилизация». В этом случае образующиеся комплексы обладают положительным или отрицательным зарядом, что блокирует их слипание за счет электростатического отталкивания (Molas M. et al., 2003). Такие системы приобретают большую стабильность в присутствии солевых растворов и белков сыворотки (Ahn С.Н. et al., 2002; Oupicky D. et al., 2002). Аналогичные системы используются не только для поликатионных носителей (Ahn et al., 2002; Harada-Shiba et al., 2002; Oupicky et al., 2002), но также для систем на основе катионных липидов (Kamps et al., 2000; Ng et al., 2000; Carrion et al., 2001; Bendas et al., 2003).
Комплекс ДНК-конъюгат, не имеющий никаких молекулярных сигналов, попадая в клетку, существует в ней непродолжительное время (24-48 ч) и разрушается в лизосомах (Subramanian А. et al., 1999, Cristano R.J. et al., 1995). В связи с этим многие конъюгаты часто содержат молекулярные сигналы дестабилизации эндосомных мембран (такие как амфипатические пептиды вирусного происхождения, способные при снижении рН дестабилизировать эндосомы и способствовать выходу комплексов ДНК-конъюгат в цитоплазму) или (и) сигналы ядерной транслокации, что способствует проникновению чужеродной ДНК в ядро и сохранению ее в виде эписом продолжительное время (Colin М. et al., 2000, Yanagihara K. et al., 2000).
Некоторые молекулярные конъюгаты могут использоваться без применения дополнительных эндосомодестабилизирующих компонентов. Показано, что лизосомоопосредованная деградация комплексов ДНК с конъюгатами, синтезированными на основе полиэтиленимина, существенно ниже, чем при использовании в качестве поликатиона поли-L-лизина. По-видимому, отмеченное обстоятельство связано с буферными свойствами полиэтиленимина (Li S., Huang L. 2000, Nguyen H-K., et al., 2000). Точный механизм, обеспечивающий освобождение ДНК из эндосомных компартментов, недостаточно исследован, однако по мнению некоторых авторов основан на буферизации содержимого лизосом за счет иминогрупп полиэтиленимина, и на действии иминогрупп в качестве протонных акцепторов (эффект «протонной губки») (Kichler et al., 2001). Остается не ясным, вызывает ли ингибирование созревания эндосом непосредственное повреждение их мембраны и освобождение комплекса из поздних эндосом, или повышает вероятность выхода их содержимого за счет затягивания созревания эндосом, хотя, возможно, на практике реализуются обе эти гипотезы (Molas М. et al., 2003).
Существует большое число работ, в которых тестируются различные стратегии, увеличивающие эффективность освобождения комплексов из эндосомных компартментов, как за счет ингибирования деградации, так и за счет введения специфических доменов обеспечивающих дестабилизацию везикул (например некоторые порообразующие пептиды) (Yessine M-A. and Leroux J.-C., 2004.). Например использование хлорокина с различными комплексами ДНК/поликатион, в том числе поли-Ь-лизином и полиэтиленамином, обеспечивает увеличение рН и, как следствие, ингибирует гидролитическую активность лизомных энзимов (Gotten М. et al., 1990; Fajac I. et al., 2000; Zanta M.A. et al., 1997).
Несмотря на значительное увеличение эффективности трансфекции, применение агентов, повреждающих эндосомы, в значительной степени нарушает работу клетки, ингибируя рециркуляцию рецепторов на плазматическую мембрану и оказывая сильный токсический эффект (Molas М. et al., 2003).
К недостаткам существующих молекулярных конъюгатов, синтезированных, в основном, на основе поли-L-лизина или полиэтиленимина, следует отнести их токсичность, что ограничивает использование комплексов в высоких концентрациях (Gottschalk S. et al., 1996), а так же недостаточно высокую эффективность доставки экзогенной ДНК.
Весьма перспективным представляется применение для синтеза молекулярных конъюгатов низкомолекулярных лигандов и катионных носителей. По сравнению с белковьми молекулами, использование низкомолекулярных соединений позволяет повысить соотношение лиганд / ДНК, а так же существенно снизить размеры формируемого комплекса. Последнее является чрезвычайно важным, т.к. компактные комплексы (с диаметром 10-30 нм) способны самостоятельно проникать в ядро, что способствует длительной и эффективной экспрессии гена интереса (Erbacher P. et al., 1996).
Таким образом, из всех существующих на сегодняшний день невирусных способов доставки генов в организм млекопитающих, только молекулярные конъюгаты потенциально удовлетворяют одному из важных критериев для разработки систем переноса генов в опухолевые клетки человека - обеспечивать адресную доставку ДНК в клетки-мишени.
Лиганды трансферринового рецептора
Невирусная генотерапия заживления поверхностных повреждений млекопитающих предполагает создание молекулярных конъюгатов, способных эффективно доставлять гены митогенных факторов роста в клетки тканей, непосредственно окружающих места повреждений, прежде всего, в фибробласты кожи. Удачным кандидатом на роль рецептора, связывающего комплексы ДНК/конъюгат и обеспечивающиго их интернализацию клетками, является рецептор трансферрина.
Рецептор трансферрина человека активно изучается в качестве модели рецептор-опосредованного эндоцитоза (Thorstensen K. and Romslo I., 1993; Ponka P. and Lok C. N., 1999), как маркер пролиферации клеток (Ponka P. and Lok С.N., 1999; Inoue Т. et al., 1993) и как мишень для доставки в клетки различных фармакологических препаратов (Jones A. R. and Shusta E. V., 2007). Он представляет собой димер из двух идентичных трансмембранных гликопротеинов с молекулярной массой 95 кД, сцепленных ковалентно за счет межмолекулярных дисульфидных связей. Основная часть железа, поступающего в клетки, поглощается с участием рецептора трансферрина. Лигандом для рецептора трансферрина является трансферрин - внеклеточный транспортный белок с молекулярной массой 80 кД, способный эффективно связывать четыре иона Fe3+ (Ponka P. and Lok С.N., 1999). Особенностью трансферрина является изменение конформации при взаимодействии с ионами железа, что, как считается, является критичным для взаимодействия с рецептором (Ponka P. and Lok С.N., 1999). Экспрессия рецептора трансферрина происходит во всех клетках и тканях организма, но уровень экспрессии в разных тканях варьирует (Davies M. et al., 1981; Enns С.А., 1982). Максимальная экспрессия наблюдается в активно пролиферирующих клетках (10000-100000 молекул на клетку), тогда как неделящиеся клетки содержат всего несколько молекул рецепторов (Inoue T. et al., 1993).
Широкое распространение получило использование конъюгатов на основе трансферрина для доставки в клетки различных фармакологических препаратов. В частности, в литературе имеются сообщения об успешной доставке в опухолевые клетки цитотоксического агента доксорубицина, ковалентно сцепленного с трансферрином (Yeh С.J. G. and Faulk W. P., 1984; Barabas K. et al., 1992; Sizensky J. A. et al., 1992; Berczi A. et al., 1993a; Berczi A. et al., 1993b), доставки в клетки сплавленных белков, представляющих собой трансферрин, сцепленный с терапевтическими полипептидами (АН S. А. et al., 1999а; All S. A. et al., 1999b), переносе генов с помощью молекулярных конъюгатов трансферрин-полилизин в различные культивируемые клетки млекопитающих (Wagner E. et al., 1991; Strydom S. et al., 1993; Taxman D. J. et al., 1993; Schwarzenberger P. et al., 2001). В целях генотерапии трансферрин используется не только в составе молекулярных конъюгатов с полилизином, но и в комплексе с катионными липидами (Penacho N. et al., 2008), в составе наночастиц на основе катионных липидов и др. (Abela R. А. et al., 2008). Особенностью всех выше перечисленных систем переноса генов является использование в качестве лиганда природного трансферрина. Этот подход имеет существенные недостатки. Во-первых, результирующий комплекс ДНК/конъюгат обладает большим размером (более 100 нм), что затрудняет выход ДНК из эндосом и перенос в ядро (см. выше). Во-вторых, афинность взаимодействия трансферрина с рецептором очень сильно зависит от насыщения трансферрина ионами железа, что затрудняет получение транфекционно активных комплексов конъюгат-ДНК. Вместе с тем, в литературе имеется сообщение об обнаружении методом фагового дисплея пептидных лигандов, способных высокоаффинно взаимодействовать с рецептором трансферрина и индуцировать его интернализацию (Lee J. H. et al., 2001).
В последние годы появилось множество публикаций о свойствах пептидов HAIYPRH и THRPPMWSPVWP. Данные пептиды были обнаружены сразу в нескольких лабораториях, использующих фаговую библиотеку гептапептидов. Показано наличие у данных пептидов различных свойств, в том числе способность к интернализации в клетку в качестве лиганда рецептора трансферрина.
Показана возможность связывания с мышцами целого ряда пептидов, в том числе и HAIYPRH (US Patent 6,329,501 - Methods and compositions for targeting compounds to muscle, 2001)
В серии патентов и публикаций группы авторов показано использование пептида HAIYPRH и THRPPMWSPVWP для доставки в клетки различных агентов.
В патенте (US Patent 6743893 - Receptor-mediated uptake ofpeptides that bind the human transfemn receptor) описываются свойства этих двух пептидов, HAIYPRH и THRPPMWSPVWP, но патентуется только THRPPMWSPVWP. Он рассматривается в качестве лиганда трансферринового рецептора, обеспечивающего путем интернализации доставку в клетку различных агентов, таких как антигены, химиотерапевтические вещества, различные метки (флуоресцирующие или имеющие окраску). Однако в формуле данного патента отсутствует пункт о доставке в клетку ДНК или РНК, не кодирующих последовательность THRPPMWSPVWP для целей генной терапии.
В другом патенте (US 2008166293 - RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRED RECEPTOR, 2008-07-10) показано, что открыты два пептида (HAIYPRH и THRPPMWSPVWP), способных связываться и интернализироваться с помощью трансферринового рецептора человека (hTfR). Когда эти пептиды слиты с другими молекулами, то такой слитый продукт поглощается клетками, экспрессирующими hTfR. В качестве таких молекул, которые могут быть доставлены в клетку, рассматриваются пептиды, белки, антигены, химиотерапевтические вещества, противоопухолевые агенты, визуализируемые или радиоизотопные метки, липосомы, в том числе содержащие вторичные агенты. При этом в данном патенте авторы указывают на то, что пептид HAIYPRH не препятствует связыванию трансферрина с его рецептором, а также постулируют связывание данного пептида в другом участке рецептора, чем трансферрин, что косвенно свидетельствует в пользу того, что доставка различных агентов в клетку с помощью данного пептида, возможно, не опосредована рецептором трансферрина. Эти данные ставят под сомнение предыдущие патенты данных авторов, в которых настаивается на именно рецептор-опосредованном поглощении пептида HAIYPRH и связанных с ним агентов. Кроме того, в формуле данного патента отсутствует пункт о доставке в клетку ДНК или РНК для целей генной терапии.
В одном из патентов (СА 2449412, COLLAWAN J., MOORE В., LEE J., JEFFREY. RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRIN RECEPTOR 2002-06-06) показана возможность использования пептидов HAIYPRH и THRPPMWSPVWP для доставки слитых с ними молекул в клетки, экспрессирующие рецептор трансферрина (hTfR) путем интернализации связавшегося с рецептором пептида. Патентуется данный пептид, слитый с любьм другим белком или пептидом, с химиотерапевтическим агентом, флуоресцирующей или другого типа меткой, антигеном, а также нуклеотидной последовательностью, кодирующей этот пептид, в том числе и слитый с другими пептидами. В этом патенте не приводится использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
В другом патенте (USPTO Patent Application 20080166293, Receptor-mediated uptake of peptides that bind the human transferrin receptor) предлагается использовать пептиды HAIYPRH и THRPPMWSPVWP для доставки в клетку пептидов, белков, химиотерапевтических агентов, противоопухолевых агентов, визуализируемых маркеров и изотопов. Не предлагается использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
Предлагается использовать пептиды HAIYPRH и THRPPMWSPVWP для доставки в клетку пептидов, белков, химиотерапевтических агентов, флуоресцирующих маркеров (WO/2002/044329, RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRIN RECEPTOR). He предлагается использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
Особенностью патента (US Patent Application 20060193778 - Receptor-mediated uptake of peptides that bind the human transferrin receptor) является то, что постулируется доставка с помощью пептида HAIYPRH молекулы ДНК, кодирующей пептид HAIYPRH.
Показана возможность использования данных пептидов THRPPMWSPVWP и HAIYPRH в ряде конструкций для доставки молекул нуклеиновых кислот через клеточные мембраны и гемато-энцефалический барьер (US Patent Application 20050222009 - Dual phase - PNA conjugates for the delivery of PNA through the blood brain barrier, патент WO/2005/035550). Однако в данном патенте рассматриваются только комплексы на основе ковалентных связей, в том числе и с использованием линкерных молекул. Молекулы нуклеиновой кислоты, которые входят в эти комплексы, ограничены размером 100 пар нуклеотидов, пептиды HAIYPRH и THRPPMWSPVWP рассматриваются исключительно как специфические лиганды для рецептора. В качестве нуклеиновой кислоты рассматривается ДНК, кДНК, РНК и т.п. В качестве поликатионной половины рассматриваются пептиды, однако последовательности рецептор-связывающего пептида и поликатионного пептида в данном патенте разделены пространственно молекулами другого типа (нуклеиновыми кислотами, гидрофобными молекулами). Т.е. не рассматривается в качестве пептида доставки единая пептидная молекула, состоящая из последовательности HAIYPRH и поликатионного пептида. Кроме того, в данном изобретении не применяется пептид ядерной локализации для доставки конструкций в клеточное ядро.
Во всех этих патентах не приводятся условия формирования комплексов ДНК-пептид для целей генной терапии.
Схожие характеристики и у другого патента этой группы авторов (US Patent Application 20080038349 - Peptide-Pna Chimera Targeting Inducible Nitric Oxide Synthetase).
Авторы еще одного патента (US Patent Application 20070231300 - COVALENT CONJUGATES BETWEEN ENDOPEROXIDES AND TRANSFERRIN AND LACTOFERRIN RECEPTOR-BINDING AGENTS) предлагают использовать пептидные последовательности HAIYPRH и THRPPMWSPVWP для доставки в клетки гидропероксидов.
Во всех этих патентах не приводятся условия формирования комплексов ДНК-пептид для целей генной терапии.
Раскрытие изобретения
Приведенные выше недостатки вирусных векторов обусловили повышение значимости разработки невирусных систем переноса в клетки нуклеиновых кислот (НК) - ДНК и РНК. В качестве такой системы невирусного переноса ДНК и РНК в клетку нами были разработаны молекулярные конъюгаты, представляющие собой пептиды, состоящие из двух частей.
Одна часть является лигандом для клеточных рецепторов и представлена одной из двух пептидных последовательностей - SEQ ID NO 1 и SEQ ID NO 2. Данные последовательности обеспечивают связывание с клеточными рецепторами с последующей интернализацией. По имеющимся данным связывание происходит с рецептором трансферрина, хотя, возможно, не только с ним. Преимуществом использования клеточного рецептора трансферрина является его высокая экспрессия на пролиферирующих клетках, которая может достигать 10000-100000 молекул на клетку, что в значительной мере определяет эффективность доставки в клетку генотерапевтических конструкций, связанных с лигандом данного рецептора. Однако использование для целей генной терапии в качестве лиганда природного трансферрина имеет существенные недостатки, описанные выше. Используемые же нами пептидные последовательности обнаружены методом фагового дисплея пептидных лигандов, способных высокоаффинно взаимодействовать с рецептором трансферрина и индуцировать его интернализацию. Причем последние данные свидетельствуют о том, что данные пептиды не препятствуют связыванию трансферрина с его рецептором, что свидетельствует о связывании их в другом участке рецептора, отличном от участка связывания с трансферрином (US 2008166293, 2008). Это косвенно также может свидетельствовать в пользу того, что доставка различных агентов в клетку с помощью данного пептида, возможно, не опосредована не только рецептором трансферрина.
Другая часть разработанных нами молекулярных конъюгатов - поликатионная. Она представлена пептидной последовательностью модифицированного сигнала ядерной локализации Т-антигена вируса SV40 (SEQ ID NO 3).
Поликатионы взаимодействуют ассоциируют с ДНК в растворе благодаря электростатическим связям позитивно заряженных аминогрупп и отрицательно заряженных фосфатных групп ДНК. Обычно формируются структуры с диаметром менее 80-100 нм (Fajac I. et al., 2000), что позволяет использовать такой комплекс для доставки нуклеиновых кислот в различные типы клеток, т.к. большинство их имеют размер первичных эндосомальных компартметов 100-120 нм. (Cristano R.J. et al., 1995).
Таким образом, поликатионная часть разработанных нами молекулярных конъюгатов обеспечивает их связывание с нуклеиновьми кислотами (ДНК или РНК) и транспортировку последних в ядро клетки. Лигандная же часть служит для рецептор-опосредованной интернализации комплекса, обеспечивая таким образом его проникновение в клетку.
Осуществление изобретения
В работе использовали реактивы для пептидного синтеза и производные аминокислот (Sigma Chemical Co., Fisher Scientific, Bachem, США; Reanal, Венгрия; Saxon Biochemicals GMBH, Германия), 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометил полимер (Gl Biochem, Китай). Диметилформамид перед использованием перегоняли в вакууме и хранили над молекулярными ситами 4 Å. Индивидуальность производных аминокислот контролировали методом ТСХ на пластинках Merck F 254 (Германия) в следующих системах растворителей: 1% аммиак-втор-бутиловый спирт, 1:3 (А); хлороформ-метанол, 9:2 (Б); хлороформ-метанол-уксусная кислота, 90:7:3 (В). Визуализацию хроматограмм проводили УФ облучением при 254 нм и методом обугливания в серной кислоте.
Твердофазный синтез пептидов проводили на полуавтоматическом синтезаторе NPS-4000 (Neosystem Laboratoires, Франция).
Анализ полученных пептидов методом ВЭЖХ проводили с использованием хроматографа System Gold (Beckman, США) на колонках Zorbax 300SB-C18 (4.6×150 мм, 5 мкм) для аналитической хроматографии и Discovery С18 (10×250 мм, 5 мкм) для препаративной. Условия хроматографии: УФ-детекция при 230 нм, градиент ацетонитрила в 0.1% H3PO4 при скорости потока 1 мл/мин для аналитической и градиент ацетонитрила в 0.1% TFA при скорости потока 5 мл/мин для препаративной хроматографии. Аминокислотный анализ проводили на анализаторе "Microtechna" T339M (Чехословакия) после гидролиза пептидов 6 н. HCl при 110°С в течение 24 ч. Масс-спектры регистрировали на времяпролетном масс-рефлектроне МХ-5303 с источником ионов типа "Электроспрей".
Использованные в работе пептиды синтезировали на 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометил-полимере с содержанием аминогрупп 0.5 ммоль/г. Для защиты боковой функции Ser, Thr и Tyr использовали But-группу, для Arg - Pbf, для Lys и Trp - ВОС, для His - Trt. В качестве временной Nα-защиты служила Fmoc-группировка.
Наращивание пептидной цепи проводили на полуавтоматическом пептидном синтезаторе NPS-4000 (Neosystem Laboratoires, Франция) по следующему протоколу для каждого цикла: 1). CH2Cl2 (1 мин); 2). DMF (1 мин); 3). 20% пиперидин/DMF (2 и 8 мин); 4). DMF (3×1 мин); 5). Изопропиловый спирт (3×1 мин); 6). DMF (3×1 мин); 7). Реакция конденсации (2 ч); 8). DMF (2 x 1 мин); 9). CH2Cl2 (1 мин).
Для конденсации использовали четырехкратные избытки активированных 1-оксибензотриазоловых эфиров соответствующих Fmoc-аминокислот, полученных in situ (по 1 экв. Fmoc-аминокислоты, DIC и HOBt, перемешивание в DMF при 0°С, 30 мин). По окончании реакции проводили тест на полноту ацилирования. При необходимости повторной конденсации использовали следующий протокол:
а). DMF (1 мин); б). 5% DIEA/DMF (1 и 2 мин), после чего стадии 6) - 9) повторяли.
В случае неполного прохождения реакции конденсации при ее повторении 1-2 раза, непрореагировавшие группировки ацетилировали (после промывки CH2Cl2 к пептидил-полимеру добавляли 10 экв. уксусного ангидрида, 10 экв. 10% DIEA/CH2Cl2 и перемешивали в течение 10 мин).
Отщепление синтезированных пептидов от полимера с одновременным деблокированием проводили действием смеси TIS: Н2О: TFA (2.5: 2.5: 95; 5 мл/0.5 г смолы) в течение 2 ч. Реакционную смесь разбавляли охлажденным эфиром и осадок отфильтровывали на фильтре Шотта. Пептид отделяли от полимера растворением в TFA и повторно осаждали эфиром. Выпавший продукт отфильтровывали, промывали эфиром и высушивали в вакууме. Дальнейшую очистку проводили с помощью обращенно-фазовой ВЭЖХ.
Аминокислотные составы и молекулярные массы, вычисленные из данных масс-спектрометрии, для всех синтезированных пептидов соответствовали теоретическим значениям.
Плазмида pCMVluc, представляющая собой вектор экспрессии гена-маркера luc (кодирует люциферазу светляка) под контролем промотора ранних генов цитомегаловируса человека, сконструирована методами генной инженерии (Игнатович И. А. и др., 2002; Ignatovich I. A. et al., 2003).
Формирование комплексов ДНК с молекулярными конъюгатами проводили в фосфатно-солевом буфере (PBS) при различном соотношении зарядов ДНК и пептида в реакционной среде согласно (Игнатович И.А. и др., 2002). Выявление зависимости устойчивости комплексов ДНК/конъюгат от ионной силы реакционной смеси проводили, вводя в реакцию необходимые количества NaCl. Образование комплексов ДНК/конъюгат контролировали методом гель-ретардации в агарозном геле. В экспериментах по определению чувствительности ДНК в составе комплексов к ДНКазе I ("Fermentas", Литва) после завершения комплексообразования в реакционную среду (30 мкл) добавляли MgCl2 до концентрации 3 мМ и 3 ед. ДНКазы I (из расчета 1 ед. ДНКазы I на 1 мкг ДНК) и проводили инкубацию при 37°С в течение 30 минут. Анализ обработанных ДНКазой комплексов проводили методом гель-ретардации. Изучение стехиометрии комплексов ДНК/конъюгат проводили, как описано ранее (Ignatovich I. A. et al., 2003). Комплексы ДНК с конъюгатами готовили в насыщающих избытках пептида с последующей очисткой от несвязавшегося пептида ультрафильтрацией с использованием центрифугирования на конусах Centricon YM-10 ("Millipore"). Количество пептида, входящее в состав комплекса, определяли обратным титрованием гепарином.
Трансфекцию клеток HepG2 и VH10 препаратами комплексов pCMVluc/NLS-TSF7 и pCMVluc/NLS-TSF12 выполняли, как описано ранее (Диже Э.Б. и др., 2006). Клетки высевали с плотностью 10 клеток/см на чашки Петри (диаметром 30 мм) и выращивали до состояния 60-70% монослоя в среде DMEM с добавлением 10% эмбриональной сыворотки телят («Биолот», Россия) при 37°C в атмосфере 5% CO2. Комплексы ДНК/пептид с разными соотношениями зарядов ДНК и пептида готовили из расчета 12 мкг ДНК на чашку Петри в 500 мкл PBS. При добавлении к клеткам в среду вводили CaCl2 до концентрации до 20 мМ. После инкубации клеток с комплексами в течение 2 ч клетки отмывали от неинтернализовавшихся комплексов раствором гепарина (58 мкг/мл в PBS), и инкубировали в среде DMEM с 10% сывороткой 24 ч.
Активность люциферазы измеряли с использованием коммерческой системы оценки активности люциферазы производства компании Promega (Luciferase Assay System, кат. номер Е4030) в соответствии с протоколом производителя. Измерения люминесценции производили на люминометре «Turner Biosystem 20/20». Определение концентрации белка в клеточных лизатах проводили по методу Брэдфорд. Активность люциферазы выражали в относительных световых единицах (RLU), представляющих собой число вспышек в минуту в расчете на 1 мг тотального белка клеточных экстрактов. Фоновые значения люминесценции не превышали 120 RLU.
Апробация разработанной системы переноса генов на лабораторных животных была проведена на модели лечения ран как с использованием плазмиды с люциферазой, так и с использованием терапевтической плазмиды, кодирующей синтетический ген инсулин-подобного фактора роста I типа (IGF-1), разработанных нами ранее (заявка №2007124538/20(026721)). В работе использовали мышей линии DBA-2 в возрасте 6 недель (получены из питомника «Рапполово» РАМН). Перед нанесением ран кожа экспериментальных животных подготавливалась - удалялся волосяной покров. Резаные раны наносились с помощью хирургического скальпеля на глубину 2 мм, захватывая подлежащую мышечную ткань, в области нижней части спины. Колотые раны наносились путем десяти уколов инсулиновым шприцем в нижнюю часть спины. Инъекции экспериментальных препаратов наносились инсулиновым шприцем в виде 10 уколов в область раны. Плазмидная ДНК и комплексы плазмидной ДНК с молекулярным конъюгатом вводились в количестве 50 мкг ДНК на мышь в 100 мкл PBS, содержащем до 20 мМ CaCl2. Для измерения люциферазной активности на 3-й день после переноса мышам pCMVluc животных умерщвляли и вырезали участок тканей, включая рану. Для постановки эксперимента использовалось 100 мг ткани каждого животного. Образцы гомогенизировали в буфере Reporter Lysis Buffer ("Promega", США, кат. номер Е3971), замораживали и центрифугировали 3 мин при 10000 g. Супернатант использовали для измерения люциферазной активности и концентрации белка, как описано выше.
Оценку экспрессии синтетического гена IGF-1 проводили на первые, третьи и седьмые сутки после переноса мышам pCMVIGF-1 методом RealTime RT-PCR. Образцы тканей получали, как описано выше, и использовали для выделения РНК. В качестве отрицательного контроля использовали мышей, не обработанных pCMVIGF-1. Выделение РНК из тканей осуществляли с использованием набора «TRI Reagent» производства фирмы «Sigma», США, по инструкции изготовителя. На 100 мг клеток использовали 2 мл лизирующего раствора «TRI Reagent». Концентрацию РНК определяли спектрофотометрически. Выделенная РНК была обработана ДНКазой 1. Отсутствие контаминации выделенной РНК плазмидой проверялось методом PCR с использованием праймеров к гену IGF-1. Синтез кДНК проводили с помощью набора Revert Aid® First Strand cDNA Synthesis Kit (производства фирмы «Fermentas», Литва). Для измерения относительного содержания мРНК применяли метод ПЦР в реальном времени с использованием SYBR GREEN (SYBR Green Supermix ("Bio-Rad", США). Все образцы нормировались по уровню экспрессии гена «домашнего хозяйства» β-актина. Реакцию проводили с использованием термоциклера IQ5 ("Bio-Rad", США), предварительный анализ данных осуществляли с использованием прилагающегося программного обеспечения. Эффективность амплификации определяли по внешней стандартной кривой с использованием серии разведении образца 5 нг, 10 нг, 30 нг, 50 нг. Рассчитанная эффективность амплификации для используемых праймеров составила 0.98 усл. ед. В качестве отрицательного контроля использовалась реакция без добавления ДНК. Нормализацию данных проводили по количеству ткани, концентрации РНК и кДНК. Расчеты проводили методом ΔCt, по формуле R=(1+E)ΔCt, где Ct - пороговый цикл, ΔCt=Ct(Mod)norm - Ct(Nat)norm, E - эффективность амплификации, R - увеличение количества продукта ПЦР после п циклов.
Измерение площади раны на теле экспериментальных животных осуществлялось с помощью фотографирования пораженного участка. Анализ фотографического материала выполняется с помощью системы компьютерного анализа изображений ImageTool for Windows (version 2,0, USA) согласно основным принципам стереологии в морфометрии.
Были синтезированы два молекулярных конъюгата, отличающихся лигандной частью - NLS-TSF-7 (SEQ ID NO 4) и NLS-TSF-12 (SEQ ID NO 5):
1. NLS-TSF-7: H-Pro-Lys-Lys-Lys-Arg-Lys-Val-β-Ala-His-Ala-Ile-Tyr-Pro-Arg-His-NH2.
2. NLS-TSF-12: H-Pro-Lys-Lys-Lys-Arg-Lys-Val-β-Ala-Thr-His-Arg-Pro-Pro-Met-Trp-Ser-Pro-Val-Trp-Pro-NH2.
Молекулярная масса NLS-TSF-7 составляет 1828.26 (средняя масса); 1827.12 (моноизотопная); NLS-TSF-12 - средняя молекулярная масса 2426.00, моноизотопная - 2424.38. На рис.1 представлены результаты масс-спектроскопического анализа NLS-TSF-12 (а) и NLS-TSF-7 (б). Молекулярные массы, вычисленные из данных масс-спектрометрии, для обоих конъюгатов соответствовали теоретическим значениям. В качестве катионной составляющей оба синтезированных молекулярных конъюгата содержали модифицированный сигнал ядерной локализации Т-антигена вируса SV-40 (NLS-пептид). Выбор NLS-пептида был обусловлен нашими предыдущими исследованиями. Ранее мы детально изучили характер комплексообразования плазмидной ДНК с катионными пептидами K8 и Tat и исследовали механизмы интернализации таких комплексов клетками млекопитающих (Ignatovich I. et al., 2003; Диже Э.Б. и др., 2006). Было установлено, что основной путь поглощения клетками комплексов ДНК с катионными пептидами - адсорбционный эндоцитоз. Адсорбционный эндоцитоз - неспецифичный процесс, который не зависит от присутствия на поверхности клеток каких-либо рецепторов. При разработке системы адресной доставки ДНК в клетки млекопитающих поглощение комплексов ДНК с молекулярными конъюгатами адсорбционным эндоцитозом будет приводить к снижению тканеспецифичности переноса. В предварительных исследованиях показано, что, несмотря на эффективное связывание с плазмидной ДНК с последующей ее компактизацией, пептид NLS оказался не способен доставлять ДНК в культивируемые клетки человека (клетки гепатомы человека HepG2, фибробласты кожи человека, клетки нейробластомы человека Sk-N-SH). Таким образом, выбор NLS-пептида для создания конъюгата обусловлен его свойством связывать нуклеиновые кислоты и обеспечивать доставку комплекса в ядро клетки. Изучение условий формирования комплексов ДНК/конъюгат представлено на рис.2. Показаны результаты гель-ретардации комплексов плазмидной ДНК pCMVluc с молекулярными конъюгатами NLS-TSF-7 и NLS-TSF-12. Оба пептида эффективно связывали плазмидную ДНК при изотонических значениях ионной силы реакционной среды.
На рис.3 представлена зависимость эффективности комплексообразования от ионной силы реакционной среды. Установлено, что оба молекулярных конъюгата не стабильны при ионной силе раствора, превышающей 300 мМ. Несмотря на одинаковые катионные части, NLS-TSF-7 оказался более стабильным, чем NLS-TSF-12, что, по всей видимости, объясняется большей плотностью положительного заряда в случае NLS-TSF-7 (молекулярная масса положительного заряда 304,71) по сравнению с NLS-TSF-12 (молекулярная масса положительного заряда 404,3).
Стехиометрию комплексов ДНК/конъюгат исследовали путем очистки комплексов, приготовленных в присутствии насыщающих количеств пептидов (десятикратный избыток по зарядам), от несвязавшегося пептида методом ультрафильтрации. В результате был выделен комплекс, содержащий в своем составе насыщающие количества пептида. Известно, что гепарин, являясь более сильным полианионом, чем ДНК, способен вытеснять ее из комплекса с поликатионами (Xu Y. et al., 1996; Ramsey E. et al., 2002). Определение содержания ДНК в выделенном комплексе проводили спектрофотометрически после его полного разрушения избытком гепарина. Содержание пептида в исследуемом комплексе определяли обратным титрованием гепарином. С этой целью построили калибровочную кривую зависимости количества гепарина, достаточного для полного разрушения комплексов ДНК/конъюгат, от содержания пептида в реакционной среде при формировании комплексов (рис.4а). Установлено, что максимально возможное содержание NLS-TSF-7 в комплексах соответствует 1.5-кратному избытку положительных зарядов NLS-TSF-7 относительно отрицательных зарядов ДНК. В случае с NLS-TSF-12 максимально возможное содержание конъюгата в комплексах соответствует 1.3-кратному избытку положительных зарядов (рис.4б). Аналогичные результаты были получены нами ранее для комплексов ДНК с ТАТ-пептидом (Ignatovich I. et al., 2003) и K8 (Диже Э.Б. и др., 2006).
Взаимодействие ДНК с поликатионами приводит к ее компактизации и, как следствие, защите от нуклеаз (Niidome Т. et al., 1997; Liu G. et al., 2001). Более того, степень компактизации ДНК в комплексах прямо коррелирует с ее чувствительностью к нуклеазам. На рис.5 представлены результаты обработки комплексов ДНК/конъюгат, приготовленных при разных соотношениях зарядов ДНК и пептида, ДНКазой I. Как и ожидалось, увеличение содержания пептида в реакционной среде приводит к большей защите ДНК от деградации. ДНК в составе комплексов, приготовленных при соотношении отрицательных зарядов ДНК к положительным зарядам пептида 1:1 (электрически нейтральные комплексы), лишь частично защищена от деградации (рис.4-5, дорожка 4). Полная устойчивость к действию ДНКазы I наблюдается только в комплексах, приготовленных при соотношении зарядов меньше чем 1:1.5. Полученные данные хорошо согласуются с результатами изучения стехиометрии комплексов ДНК/конъюгат (рис.4).
Оценка чувствительности комплексов ДНК/конъюгат к ДНКазе I позволила определить еще один важный параметр комплексообразования - кооперативность взаимодействий ДНК - поликатион. Возможны две модели комплексообразования. В случае кооперативного взаимодействия отрицательно заряженные комплексы ДНК/поликатион обладают большим сродством к свободному поликатиону, чем несвязанная ДНК. Поэтому при соотношении зарядов ДНК и поликатиона больше чем 1:1 (избыток ДНК) реакционная среда будет содержать смесь электрически нейтральных (или обладающих небольшим положительным зарядом) комплексов и свободных молекул ДНК. При некооперативном характере взаимодействий молекулы поликатиона распределяются среди молекул ДНК случайным статистическим образом, в результате реакционная среда будет содержать более-менее однородную смесь комплексов, причем их заряд будет определяться исходными соотношениями ДНК и поликатиона (Liu G. et al., 2001). При кооперативном характере взаимодействий ДНК с поликатионом обработка ДНКазой I комплексов, приготовленных при соотношении зарядов больше чем 1:1, приведет, с одной стороны, к полной деградации несвязанной ДНК, содержащейся в реакционной среде, а с другой стороны, к полной защите ДНК, образовавшей комплексы с поликатионом. В случае некооперативного взаимодействия обработка ДНКазой I отрицательно заряженных комплексов приведет к частичной деградации всей ДНК, причем размер продуктов деградации будет увеличиваться по мере увеличения содержания поликатиона в комплексах. Зависимость устойчивости ДНК в составе комплексов с NLS-TSF-7 к действию ДНКазы I от соотношения зарядов ДНК и пептида соответствует некооперативному характеру взаимодействий (рис.5).
Демонстрация способности синтезированных молекулярных конъюгатов NLS-TSF7 и NLS-TSF12 к эффективной компактизации плазмидной ДНК с образованием полиэлектролитных комплексов позволила перейти к решению следующей задачи - изучению факторов, влияющих на эффективность проникновения таких комплексов в клетки млекопитающих, экспрессирующих рецепторы трансферрина. Клетки гепатомы человека HepG2 и фибробласты человека VH10 трансфецировали комплексами pCMVluc/NLS-TSF7 и pCMVluc/NLS-TSF12. Оба комплекса оказались трансфекционно активными. Более того, высокие избытки свободных молекулярных конъюгатов (50х) приводили к подавлению уровня трансфекции, что свидетельствует о роли трансфериновых рецепторов в связывании комплексов ДНК/конъюгат с поверхностью клетки (рис.6). При этом молекулярный конъюгат NLS-TSF7 обеспечивал более высокий уровень трансфекции клеток по сравнению с NLS-TSF12 (~ в 2.5 раза) (рис.6). На рисунке приведены результаты люциферазного теста, демонстрирующие влияние различных факторов на эффективность трансфекции клеток HepG2. В случае с фибробластами были получены сходные результаты (данные не представлены). В предыдущих работах мы показали стимулирующую роль свободных катионных пептидов Tat и K8 в интернализации коплексов ДНК с катионными пептидами. В тех же условиях свободные пептиды не оказывали существенного влияния на эффективность трансфекции клеток комплексами ДНК с молекулярными конъюгатами, содержащими в качестве лигандной составляющей синтетические аналоги люлиберинов. Представлялось интересным провести аналогичные исследования в отношении комплексов ДНК с NLS-TSF7 и NLS-TSF12. Установлено, что умеренные избытки свободных конъюгатов в культуральной среде не оказывают существенного влияния на уровень трансфекции клеток. В этом отношении они проявляют сходство с молекулярными конъюгатами на основе синтетических аналогов люлиберина. По-видимому, это сходство объясняется общим механизмом интернализации комплексов - рецептор-опосредованным эндоцитозом, в отличие от комплексов ДНК с катионными пептидами Tat и K8, где основную роль в интернализации играет адсорбционный эндоцитоз (Ignatovich I. A. et al., 2003; Диже Э.Б. и др., 2006; Ефремов А.М. и др., 2009).
Роль эндоцитоза в трансфекции клеток комплексами ДНК с молекулярными конъюгатами NLS-TSF7 и NLS-TSF12 проверяли в экспериментах, проведенных в отсутствие ионов Са2+.
Известно, что как рецептор-опосредованный, так и адсорбционный эндоцитоз угнетается в отсутствие ионов Са2+. Установлено, что удаление CaCl2 из культуральной среды приводит к практически полному подавлению уровня экспрессии переносимого гена при использовании обоих конъюгатов (рис.6).
Еще одним важным фактором, существенно влияющим на эффективность трансфекции клеток полиэлектролитными комплексами, является присутствие в культуральной среде белков сыворотки крови. Ранее мы показали, что трансфекция клеток комплексами ДНК с катионным пептидом Tat и с молекулярными конъюгатами на основе аналогов люлиберина в присутствии белков сыворотки крови приводит к существенному снижению уровня экспрессии перенесенного гена (Ignatovich I. А. et al., 2003; Ефремов А.М. и др., 2009). Это может иметь решающее значение при разработке систем переноса генов in vivo. Аналогичные эксперименты были проведены и с молекулярными конъюгатами NLS-TSF7 и NLS-TSF12. Установлено, что введение при трансфекции клеток в культуральную среду 10% эмбриональной коровьей сыворотки (FCS) приводило к падению уровня экспрессии перенесенного гена (рис.6). Интересно отметить, что в присутствии сыворотки уровень трансфекции клеток комплексами ДНК с NLS-TSF12 оказался выше, чем в случае комплексов ДНК с NLS-TSF7, несмотря на то, что в отсутствие сыворотки наблюдалась обратная ситуация. Это обстоятельство необходимо учитывать в дальнейших разработках невирусных систем переноса генов на основе синтезированных молекулярных конъюгатов. Например, для системы регенеративной генотерапии поверхностных повреждений тканей млекопитающих более оптимальным представляется молекулярный конъюгат NLS-TSF7, тогда как в случае работ по переносу генов, требующих системного введения препаратов в кровяное русло, NLS-TSF12 может оказаться предпочтительнее.
Были проведены исследования способности комплексов плазмидной ДНК с разработанными молекулярными конъюгатами NLS-TSF7 проникать в клетки in vivo, что может быть использовано для целей генной терапии или диагностики. В качестве модели использовали поверхностные раны тканей мышей линии DBA-2 (самцы, 6 недель). Комплексы pCMVluc/NLS-TSF7 (соотношение зарядов 1:1) вводили либо в кожу здоровых мышей (10 уколов вокруг площади ~60 мм2), либо обкалывали рану сходной площади. Количество комплексов составляло 50 мкг ДНК на мышь. Контрольной группе мышей проводили инъекции такого же количества свободной плазмиды pCMVluc. Перед экспериментом кожа экспериментальных животных подготавливалась - удалялся волосяной покров. Раны наносились с помощью хирургического скальпеля на глубину 2 мм, захватывая подлежащую мышечную ткань, в области нижней части спины. Через 5 суток после инъекций мыши умерщвлялись, область кожи вблизи уколов использовалась для получения лизатов, в которых оценивали активность люциферазы. Результаты представлены на рис.7. Использование при инъекциях комплексов pCMVluc/NLS-TSF7 приводило к возрастанию люциферазной активности более чем в 100 раз по сравнению с инъекциями свободной ДНК. Существенной разницы между инъекциями здоровым животным и животным с резаными ранами отмечено не было (рис.7). Таким образом, синтезированный молекулярный конъюгат NLS-TSF7 способен эффективно переносить гены в поверхностные ткани млекопитающих.
Нижеследующий пример дан для цели иллюстрирования одного из вариантов воплощения изобретения и не призван в чем бы то ни было ограничить настоящее изобретение.
Пример 1
Была выполнена апробация разработанных молекулярных конъюгатов в комплексе с ДНК для целей генной терапии на модели регенерационной генотерапии на лабораторных животных. Проверка способности комплексов ДНК с молекулярным конъюгатом NLS-TSF7 проникать в клетки поверхностных тканей мышей была проведена на мышах линии DBA-2 (самцы, 6 недель). С этой целью мышам с повреждениями поверхностных тканей был с помощью молекулярного конъюгата NLS-TSF7 был осуществлен перенос разработанного нами ранее вектора экспрессии синтетического гена, кодирующего инсулин-подобный фактор роста I типа человека pCMVIGF-1s (заявка №2007124538/20(026721). Для эксперимента использовались мыши линии DBA-2 возраста 6 недель (самцы). Перед нанесением ран кожа экспериментальных животных подготавливалась - удалялся волосяной покров. Раны наносились с помощью хирургического скальпеля на глубину 2 мм, захватывая подлежащую мышечную ткань, в области нижней части спины. По характеру повреждения эти раны классифицируются как «резаные». Инъекции экспериментальных препаратов наносились инсулиновым шприцем в виде 10 уколов в каждую рану. В эксперименте было сформировано 4 группы животных. В каждой группе по 10 мышей. Опытные группы инъецировали либо свободной pCMVIGF-1s или комплексами pCMVIGF-1s/NLS-TSF7 (соотношение зарядов 1:1). Инъекции проводили десятикратно в области, окружающие рану. Для инъекций использовали 50 мкг ДНК на мышь в 100 мкл PBS, содержащем 4 мМ CaCl2. Контрольные группы получали инъекции плазмидной ДНК с делетированным промотором (pAIGF-1s) и свободный NLS-TSF7. На 3, 5 и 7 сутки по две мыши из каждой группы умерщвляли и из областей, прилегающих к ране, выделяли РНК, которую использовали для количественной оценки экспрессии IGF-1 методом RealTime RT-PCR. Результаты приведены на рис.8. Уровень экспрессии гена IGF-1 на 3 и 5 сутки после начала эксперимента был выше от 64 до 128 раз при инъекциях комплексов pCMVIGF-1s/NLS-TSF7 по сравнению с инъекциями свободной pCMVIGF-1s. В контрольных группах, инъецированных плазмидой с делегированным промотором или свободным молекулярным конъюгатом NLS-TSF7, экспрессии IGF-1 зарегистрировано не было. Полученные данные подтверждают ранее полученные результаты о высокой эффективности молекулярного конъюгата NLS-TSF7 при доставке генов в поверхностные ткани млекопитающих.
Оценку скорости регенерации проводили, измеряя площади ран на 7, 10, 14 и 21 сутки после начала эксперимента.
Результаты суммированы в таблице 1. На рис.9 приведены фотографии мышей на 14 сутки после начала эксперимента, инъецированные свободным NLS-TSF7 и комплексами pCMVIGF-1s/NLS-TSF7. Инъекции как свободной pCMVIGF-1s, так и комплексов pCMVIGF-1s/NLS-TSF7 приводили к существенному ускорению процесса заживления раны по сравнению с контрольными группами. Через 14 суток после начала эксперимента у мышей, инъецированных комплексами pCMVIGF-1s/NLS-TSF7, происходило полное заживление раны, тогда как в контрольных группах площадь раны составляла около 10 мм2 (~17% от исходного размера) (табл.1). Более того, у мышей, инъецированных комплексами pCMVIGF-1s/NLS-TSF7, на 10 сутки после начала эксперимента размер раны был в два раза ниже, чем у мышей, инъецированных свободной плазмидой, и в 4 раза ниже, чем у контрольных групп. Полученные результаты свидетельствуют о высокой эффективности разработанной системы доставки генов для целей генной терапии, в том числе регенерационной генотерапии поверхностных повреждений млекопитающих.
Литературные ссылки
1. Диже Э.Б., Игнатович И.А., Буров С.В., Похвощева А.В., Акифьев Б.Н., Ефремов А.М., Перевозчиков А.П., Орлов С.В. 2006. Комплексы ДНК с катионными пептидами: условия формирования и факторы, влияющие на эффективность проникновения в клетки млекопитающих. Биохимия 71:1659-1667.
2. Духовлинов И.В., Иванов И.А. Заявка №2007124538/20(026721). Фармацевтическая композиция для генной терапии заболеваний, требующих стимуляции регенераторных процессов, включая повреждения тканей человека различной этиологии, на основе синтетического модифицированного гена инсулиноподобного фактора роста человека 1 (IFG-1).
3. Ефремов А.М., Буглаева А.О., Орлов С.В., Буров С.В., Игнатович И.А., Диже Э.Б., Шавва В.С., Перевозчиков А.П. 2009. Перенос генетических конструкций через трансплацентарный барьер в зародыши мыши. Онтогенез 40, в печати.
4. Игнатович И.А., Диже Э.Б, Акифьев Б.Н., Буров С.В., Боярчук Е.А., Перевозчиков А.П. 2002. Доставка «суицидного» гена тимидинкиназы вируса герпеса в комплексе с катионным пептидом в клетки гепатомы человека in vitro. Цитология 44:455-462.
5. Abela R. A., Qian J., Xu L., Lawrence T. S., Zhang М. 2008. Radiation improves gene delivery by a novel transferrin-lipoplex nanoparticle selectively in cancer cells. Cancer Gene Ther., May 16.
6. Ahn C. Н., Chae S. Y., Bae Y. Н., Kirn S. W. 2002. Biodegradable poly(ethylenimme) forplasmid DNA delivery. J. Controlled Release 80:273-82.
7. Ali S. A., Joao Н. C., Hammerschmid F., Eder J., Steinkasserer A. 1999a. Transferrin trojan horses as a rational approach for the biological delivery of therapeutic peptide domains. J. Biol. Chem., 274:24066-24073.
8. Ali S. A., Joao Н. C., Hammerschmid F., Eder J., Steinkasserer A. 1999b. An antigenic HIV-1 peptide sequence engineered into the surface structure of transferrin does not elicit an antibody response. FEBS Lett., 459:230-232.
9. Andrianaivo F., Lecocq М., Wattiaux-De Coninck S., Wattiaux R., and Jadot М. 2004. Hydrodynamics-based transfection of the liver: entrance into hepatocytes of DNA that causes expression takes place very early after injection. J Gene Med 6:877-883.
10. Apodaca G. 2001. Endocytic traffic in polarized epithelial cells: role of the actin and microtubule cytoskeleton. Traffic 2: 149-151.
11. Barabas K., Sizensky J. A., Faulk W. P. 1992. Transferrin conjugates ofadriamycin are cytotoxic without intercalating nuclear-DNA. J. Biol. Chem., 267:9437-9442.
12. Bendas G., Rothe U., Scherphof G. L., Kamps J. A. 2003. The influence of repeated injections on pharmacokinetics and biodistribution of different types ofsterically stabilized immunoliposomes, Biochim. Biophys. Acta 1609:63-70.
13. Berczi A., Ruthner M., Szuts V., Fritzer M., Schweinzer E., Goldenberg H. 1993. Influence of conjugation of doxorubicin to transferrin on the iron uptake by K562-cells via receptor-mediated endocytosis, Eur. J. Biochem., 213:427-436.
14. Berczi A., Barabas K., Sizensky J. A., Faulk W. P. 1993. Adriamycin conjugates of human transferrin bind transferrin receptors and kill K562 and HL-60-cells. Arch. Biochem. Biophys., 300:356-363.
15. Budker V., Budker Т., Zhang G., Subbotin V., Loomis A., and Wolff J. A. 2000. Hypothesis: naked plasmid DNA is taken up by cells in vivo by a receptor-mediated process. JGeneMed 2:76-88.
16. Cao В. and Huard J. 2004. Gene transfer to skeletal muscle using herpes simplex virus-based vectors. Methods Mol Biol 246:301-308.
17. Carrion С., Domingo J. C., de Madariaga M. A. 2001. Preparation of longcirculating immunoliposomes using PEG-cholesterol conjugates: effect of the spacer arm between PEG and cholesterol on liposomal characteristics. Chem. Phys. Lipids 113:97-110.
18. Chen H. Y., Zhu H. Z., Lu В., Xu X., Yao J. H., Shen Q., and Xue J. L. 2004. Enhancement of naked FIX minigene expression by chloroquine in mice. Acta Pharmacol Sin 25:570-575.
19. Coffin R. S., Howard M. K., Cumming D. V., Dollery C. M., McEwan J„, Yellon D. M., Marber M. S., MacLean A. R., Brown S. M., and Latchman D. S. 1996a. Gene delivery to the heart in vivo and to cardiac myocytes and vascular smooth muscle cells in vitro using herpes virus vectors. Gene Ther 3:560-566.
20. Coffin R. S., MacLean A. R., Latchman D. S., and Brown S. M. 1996b. Gene delivery to the central and peripheral nervous systems of mice using HSV1 ICP34.5 deletion mutant vectors. Gene Ther 3:886-891.
21. Colin M., Maurice M., Trugnan G., Kornprobst M., Harbottle R. P., Knight A., Cooper R. G., Miller A. D., Capeau J., Coutelle C., Brahimi-Horn M. C. 2000. Cell delivery, intracellular trafficking and expression of an integrin-mediated gene transfer vector in tracheal epithelial cells. Gene Ther. 7:139-152.
22. Cotten M., Laengle-Rouault F., Kirlappos H., Wagner E., Mechtler K., Zenke M., Beug H., Birnstiel M. L. 1990. Transferrin-polycation mediated introduction of DNA into human leukemic cells: stimulation by agents that affect survival of transfected DNA or modulate transferrin receptor levels. Proc. Natl. Acad. Sci. U. S. A. 87:4033-4037.
23. Cristano R. J., Roth J. A. 1995. Molecular conjugates: a targeted gene delivery vector for molecular medicine. J. Mol. Med. 73:479-486.
24. Crook K., McLachlan G., Stevenson B. J., Porteous D. J. 1996. Plasmid DNA molecules complexed with cationic liposomes are protected from degradation by nucleuses and shearing by aerosolisation. Gene Ther. 3:834-839.
25. Culver K. W. 1994. Gene Therapy, Handbook for Phisicians. M.-A. Liebert Publ.
26. Dash P. R., Read M. L., Barrett L. В., Wolfert M. A., Seymour L. W. 1999. Factors affecting blood clearance and in vivo distribution of polyelectrolyte complexes for gene delivery. Gene Ther. 6:643-650.
27. Davies J. C. 2002. New therapeutic approaches for cystic fibrosis lung disease. J R Soc Med 95:58-67.
28. Davies M, Parry J. E., Sutcliffe R.G. 1981. Examination of different preparations of human placental plasma membrane for the binding of insulin, transfemn and immunoglobulins. J. Reprod. Fertil., 63:315-324.
29. Di N. M., Carlo-Stella C., Anichini A., Mortarini R., Guidetti A., Tragni G., Gallino F., Del V. M., Ravagnani F., Morelli D., Chaplin P., Arndtz N., Sutter G., Drexler I., Parmiani G., Cascinelli N., and Gianni A. M. 2003. Clinical protocol. Immunization of patients with malignant melanoma with autologous CD34(+) cell-derived dendritic cells transduced ex vivo with a recombinant replication-deficient vaccinia vector encoding the human tyrosinase gene: a phase I trial. Hum Gene Ther 14:1347-1360.
30. Enns C. A., Suomalainen H. A., Gebhardt J. E., Schroder J., Sussman H. H. 1982. Human transfemn receptor: expression of the receptor is assigned to chromosome 3. Proc. Natl. Acad. Sci. USA, 79:3241-3245.
31. Erbacher P., Bousser M., Raimond J., Monsigny M., Midoux P., Roche A. C. 1996. Gene transfer by DNA / Glycosylated polylysine complexes into Human monocyte-derived macrophages. Human Gene Ther. 7:721-729.
32. Fajac I., Allo J. C., Souil E., Merten M., Pichon C., Figarella C., Monsigny M., Briand P., Midoux P. 2000. Histidylated polylysine as a synthetic vector for gene transfer into immortalized cystic fibrosis airway surface and airway gland serous cells. J. Gene Med. 2:368-378.
33. Farhood H., Serbina N., Huang L. 1995. The role ofdioleoyl phosphatidylethanolamine in cationic liposome mediated gene transfer. Biochim. Biophys. Acta 1235:289-295.
34. Felgner P. L., Gadek T. R., Holm M., Roman R., Chan H. W., Wenz M., Northrop J. P., Ringold G. M., Danielsen M. 1987. Lipofection: A highly efficient, lipid mediated DNA-transfection procedure. Proc. Natl. Acad. Sci. U. S. A. 84:7413-7417.
35. Fisher K. J., Choi H., Burda J., Chen S. J., and Wilson J. M. 1996. Recombinant adenovirus deleted of all viral genes for gene therapy of cystic fibrosis. Virology 217:11-22.
36. Flotte T. R. 2004. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther 11:805-810.
37. Gaden F., Franqueville L., Magnusson M. K., Hong S. S., Merten M. D., Lindholm L., and Boulanger P. 2004. Gene transduction and cell entry pathway of fiber-modified adenovirus type 5 vectors carrying novel endocytic peptide ligands selected on human tracheal glandular cells. J Virol 78:7227-7247.
38. Gewirtz A. M., Stein C. A., and Glazer P. M. 1996. Facilitating oligonucleotide delivery: helping antisense deliver on its promise. Proc Natl Acad Sci U S A 93:3161-3163.
39. Glasspool-Malone J., Steenland P. R., McDonald R. J., Sanchez R. A., Watts T. L., Zabner J., and Malone R. W. 2002. DNA transfection of macaque and murine respiratory tissue is greatly enhanced by use ofanuclease inhibitor. J Gene Med 4:323-322.
40. Goins W. F., Wolfe D., Krisky D. M., Bai Q., Burton E. A., Fink D. J., and Glorioso J. C. 2004. Delivery using herpes simplex virus: an overview. Methods Mol Biol 246:257-299.
41. Goncalves M. A., van der Velde I., Knaan-Shanzer S., Valerio D., and de Vries V. A. 2004. Stable transduction of large DNA by high-capacity adeno-associated virus/adenovirus hybrid vectors. Virology 321:287-296.
42. Goss J. R., Natsume A., Wolfe D., Mata M., Glorioso J. C., and Fink D. J. 2004. Delivery of herpes simplex virus-based vectors to the nervous system. Methods Mol Biol 246:309-322.
43. Gottschalk S., Sparrow J. Т., Hauer J., Mims M. P., Leiand F. E., Woo S. L., Smith L. C. 1996. A novel DNA-peptide complex for efficient gene transfer and expression in mammalian cells. Gene Ther 3:448-457.
44. Gregorevic P., Blankinship M. J., Alien J. M., Crawford R. W., Meuse L., Miller D. G., Russell D. W., and Chamberlain J. S. 2004. Systemic delivery of genes to striated muscles using adeno- associated viral vectors. Nat Med 10:828-834.
45. Griesenbach U., Ferrari S., Geddes D. M., and Alton E. W. 2002. Gene therapy progress and prospects: cystic fibrosis. Gene Ther 9:1344-1350.
46. Gruchala M., Bhardwaj S., Pajusola K., Roy H., Rissanen Т. Т., Kokina I., Kholova I., Markkanen J. E., Rutanen J., Heikura Т., Alitalo K., Bueler H., and Yla-Herttuala S. 2004. Gene transfer into rabbit arteries with adeno-associated virus and adenovirus vectors. J Gene Med 6:545-554.
47. Guo Z. S. and Bartlett D. L. 2004. Vaccinia as a vector for gene delivery. Expert Opin BiolTher 4:901-917.
48. Harada-Shiba M., Yamauchi K., Harada A., Takamisawa I., Shimokado K., Kataoka K. 2002. Polyion complex micelles as vectors in gene therapy-pharmacokinetics and in vivo gene transfer. Gene Ther. 9:407-414.
49. Harvey В. G., Leopold P. L., Hackett N. R., Grasso T. M., Williams P. M., Tucker A. L., Kaner R. J., Ferns В., Gonda I., Sweeney T. D., Ramalingam R., Kovesdi I., Shak S., and Crystal R. G. 1999. Airway epithelial CFTR mRNA expression in cystic fibrosis patients after repetitive administration of a recombinant adenovirus. J Clin Invest 104:1245-1255.
50. Hashida M., Mahato R. I., Kawabata K., Miyao Т., Nishikawa M., Takakura Y. 1996. Pharmacokinetics and targeted delivery of proteins and genes, J. Control. Release 41:91-97.
51. Herweijer H., Zhang G., Subbotin V. M., Budker V., Williams P., and Wolff J. A. 2001. Time course of gene expression after plasmid DNA gene transfer to the liver. J Gene Med 3:280-291.
52. Hui S. W., Langner M., Zhao Y. L., Ross P., Hurley E., Chan K. 1996. The role of helper lipids in cationic liposome-mediated gene transfer. Biophys. J. 71:590-599.
53. Ignatovich I. A., Dizhe E. В., Pavlotskaya A. V., Akifiev B. N., Burov S. V., Orlov S. V., Perevozchikov A. P. 2003. Complexes of plasmid DNA with basic domain 47-57 of the HIV-1 Tat protein are transferred to mammalian cells by endocytosis-mediated pathways. J Biol Chem 278:42625-42636.
54. Inoue Т., Cavanaugh P. G., Steck P. A., Brunner N. and Nicolson G. L. 1993. Differences in transferrin response and numbers of transferrin receptors in rat and human mammary carcinoma lines of different metastatic potentials. J. Cell Physiol., 156:212-217.
55. Jones A. R. and Shusta E. V. 2007. Blood-Brain Barrier Transport of Therapeutics via Receptor-Mediation. Pharmaceutical Research, 24(9):1759-1771.
56. Kamps J. A., Koning G. A., Velinova M. J., Morselt H. W., Wilkens M., Gorter A., Donga J., Scherphof G. L. 2000. Uptake of long-circulating immunoliposomes, directed against colon adenocarcinoma cells, by liver metastases of colon cancer. J. Drug Target. 8:235-245.
57. Kichler A., Leborgne С., Coeytaux E., Danos 0. 2001. Polyethyleniminemediated gene delivery: a mechanistic study, J. Gene Med. 3:135-44.
58. Kobayashi K., Oka K., Forte Т., Ishida В., Teng В., Ishimura-Oka K., Nakamuta M., and Chan L. 1996. Reversal of hypercholesterolemia in low density lipoprotein receptor knockout mice by adenovirus-mediated gene transfer of the very low density lipoprotein receptor. J Biol Chem 271:6852-6860.
59. Kost Т. А. 1999. Expression vectors and delivery systems: Tools for determining gene function and gene therapy. Cur. Opin. Biotech. 10:409-410.
60. Kozarsky K., Grossman M., and Wilson J. M. 1993. Adenovirus-mediated correction of the genetic defect in hepatocytes from patients with familial hypercholesterolemia. Somat Cell Mol Genet 19:449-458.
61. Kozarsky K. F., Jooss K., Donahee M., Strauss J. F., and Wilson J. M. 1996. Effective treatment of familial hypercholesterolaemia in the mouse model using adenovirus-mediated transfer of the VLDL receptor gene. Nat Genet 13:54-62.
62. Kozarsky K. F., McKinley D. R., Austin L. L., Raper S. E., Stratford-Perricaudet L. D., and Wilson J. M. 1994. In vivo correction of low density lipoprotein receptor deficiency in the Watanabe heritable hyperlipidemic rabbit with recombinant adeno viruses. J Biol Chem 269:13695-13702.
63. Kwakye-Berko F. and Meshnick S. R. 1989. Binding of chloroquine to DNA. Mol Biochem Parasitol 35:51-55.
64. Lecocq M., Andrianaivo F., Warnier M. Т., Wattiaux-De Coninck S., Wattiaux R., and Jadot M. 2003. Uptake by mouse liver and intracellular fate ofplasmid DNA after a rapid tail vein injection of a small or a large volume. J Gene Med 5:142-156.
65. Lee J. H., Engler J. A., Collawn J. F., Moore B. A. 2001. Receptor mediated uptake of peptides that bind the human transferring receptor. Eur. J. Biochem., 268:2004-2012.
66. Lerondel S., Vecellio N. L., Faure L., Sizaret P. Y., Sene C., Pavirani A., Diet P., and Le P. A. 2001. Gene therapy for cystic fibrosis with aerosolized adeno virus- CFTR: characterization of the aerosol and scintigraphic determination of lung deposition in baboons. J Aerosol Med 14:95-105.
67. Li S., Huang L. 2000. Nonviral gene therapy: promises and challenges. Gene Ther, 7:31-34.
68. Liu F., Song Y., and Liu D. 1999. Hydrodynamics-based transfection in animals by systemic administration ofplasmid DNA. Gene Ther 6:1258-1266.
69. Liu G., Molas M., Grossmann G. A., Pasumarthy M., Perales J. C., Cooper M. J., Hanson R. W. Biological properties of poly-L-lysine-DNA complexes generated by cooperative binding of the polycation. 2001. J. Biol. Chem. 276:34379-34387.
70. Luo D., Saltzman W. M. 2000. Synthetic DNA delivery systems. Nat. Biotechnol. 18:33-37.
71. Molas M., Gomez-Valades A. G., Vidal-Alabro A., Miguel-Turu M., Bermudez J., Bartrons R., Perales J. C. 2003. Receptor-mediated gene transfer vectors: progress towards genetic pharmaceuticals. Cur. Gene Ther. 3:468-485.
72. Nabel E. G., Plautz G., Nabel G. J. 1990. Site-specific gene expression in vivo by direct gene transfer into the arterial wall. Science 250:997-1000.
73. Nagy A., Schally A.V., Armatis P., Szepeshazi K., Halmos G., Kovacs M., Zarandi M., Groot K., Miyazaki M., Jungwirth A., and Horvath J. 1996. Cytotoxic analogs of luteinizing hormone-releasing hormone containing doxorubicin or 2-pyrrolinodoxorubicin, a derivative 500-1000 times more potent. Proc. Natl. Acad. Sci. USA. 93:7269-7273.
74. Niidome Т., Ohmori N., Ichinose A., Wada A., Mihara H., Hirayama Т., and Aoyagi H. 1997. Binding of cationic alpha-helical peptides to plasmid DNA and their gene transfer abilities into cells. J. Biol. Chem. 272:15307-15312.
75. Niranjan A., Wolfe D., Fellows W., Goins W. F., Glorioso J. C., Kondziolka D., and Lunsford L. D. 2004. Gene transfer to glial tumors using herpes simplex virus. Methods Mol Biol 246:323-337.
76. Nichols В. J., Lippincott-Schwartz J. 2001. Endocytosis without clathrin coats. Trends Cell Biol. 11:406-412.
77. Nguyen H-K., Lemieux Р., Vinogradov S. V., Gebhart C. L., Guerin N., Paradis G., Bronich T. K, Alakhov V. Y., Kabanov A. V. 2000. Evaluation of polyether-polyethyleneimine graft copolymers as gene transfer agents. Gene Ther. 7:126-138.
78. Nolan G. P., Shatzman A. R 1998. Expression vectors and delivery systems. Cur. Opin. Biotech. 9:447-450.
79. Nomura S., Merched A., Nour E., Dicker C., Oka K., and Chan L. 2004. Low-density lipoprotein receptor gene therapy using helper- dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 20:1540-1548.
80. Ogris M., Brunner S., Schuller S., Kircheis R. and Wagner E. 1999. PEGylated DNA/transferrin-PEl complexes: reduced interaction with blood components, extended circulation in blood and potential for systemic gene delivery. Gene Ther. 6:595-605.
81. Oka K., Pastore L., Kirn I. H., Merched A., Nomura S., Lee H. J., Merched-Sauvage M., Arden-Riley C., Lee В., Finegold M., Beaudet A., and Chan L. 2001. Long-term stable correction of low-density lipoprotein receptor- deficient mice with a helper- dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation 103:1274-1281.
82. Oupicky D., Ogris M., Howard K. A., Dash P. R., Ulbrich K., Seymour L. W. 2002. Importance of lateral and steric stabilization of polyelectrolyte gene delivery vectors for extended systemic circulation. Mol. Ther. 5:463-472.
83. Penacho N., Filipe A., Simoes S., Pedroso de Lima M. C. 2008. Transferrin-associated lipoplexes as gene delivery systems: relevance of mode of preparation and biophysical properties. J. Membr. Biol., 221(3): 141-152.
84. Ponka P. and Lok C. N. 1999. The transferrin receptor: role in health and disease. Int. J. Biochem. Cell BioL, 31: 1111-1137.
85. Ramsay E., Gumbleton M. 2002. Polylysine and polyomithine gene transfer complexes: a study of complex stability and cellular uptake as a basis for their differential in-vitro transfection efficiency. J. Drug Target. 10:1-9.
86. Ropert C. 1999. Liposomes as a gene delivery system. Braz. J. Med. Biol. Res. 32:163-169.
87. Rosenfeld M. A., Siegfried W., Yoshimura K., Yoneyama K., Fukayama M., Stier L. E., Paakko P. K., Gilardi P., Stratford-Perricaudet L. D., and Perricaudet M. 1991. Adeno virus-mediated transfer of a recombinant alpha 1- antitrypsin gene to the lung epithelium in vivo. Science 252:431-434.
88. Rossmanith W., Chabicovsky M., Herkner K., and Schulte-Hermann R. 2002. Cellular gene dose and kinetics of gene expression in mouse livers transfected by high-volume tail-vein injection of naked DNA. DNA Cell Biol 21:847-853.
89. Rudolph C., Lausier J., Naundorf S., Miiller R. H., Rosenecker J. 2000. In vivo gene delivery to the lung using polyethylenimine and fractured polyamidoamine dendrimers. Journal of Gene Medicine 2:269-278.
90. Sandgren S., Wittrup A., Cheng F., Jonsson M., Ekiund E., Busch S., Belting M. 2004. The human antimicrobial peptide LL-37 transfers extracellular DNA plasmid to the nuclear compartment of mammalian cells via lipid rafts and proteoglycan-dependent endocytosis. J. Biol. Chem. 279:17951-17956.
91. Scherman D., Bessodes M., Cameron В., Herscovici J., Hofland H., Pitard В., Soubrier F., Wils P., Crouzet J. 1998. Application oflipids and plasmid design for gene delivery to mammalian cells. Cur. Opin. Biotechnol. 9:480-485.
92. Schwarzenberger P., Huang W., Oliver P., Osidipe Т., Theodossiou C., Kolls J. K. 2001. Poly-L-lysine-based molecular conjugate vectors: a high efficiency gene transfer system for human progenitor and leukemia cells. Am. J. Med. Sci., 321(2):129-136.
93. Singh M. 1999. Transferrin as a targeting ligand for liposomes and anticancer drugs. Curr. Pharm.Des. 5: 443-451.
94. Sizensky J. A., Barabas K., Faulk W. P. 1992. Characterization of the anti-cancer activity oftransferrin-adriamycin conjugates. Am. J. Reprod. Immunol., 27:163-166.
95. Smith R. M., Wu G. Y. 1999. Hepatocyte-directed gene delivery by receptor-mediated endocytosis. Semin. Liver Dis. 19: 83-92.
96. Strydom S., Van Jaarsveld P., Van Helden E., Ariatti M., Hawtrey A. 1993. Studies on the transfer of DNA into cells through use of avidin-polylysine conjugates complexed to biotinylated transferrin and DNA. J. Drug Target., 1(2): 165-174.
97. Subramanian A., Ranganathan P., Diamond S. L. 1999. Nuclear targeting peptide scaffolds for lipofection ofnondividing mammalian cells. Nat. Biotechnol. 17:873-877.
98. Takei K., Haucke V. 2001. Clathrin-mediated endocytosis: membrane factors pull the trigger. Trends Cell Biol. 11:385-391.
99. Taxman D. J., Lee E. S., Wojchowski D. M. 1993. Receptor-targeted transfection using stable maleimido-transferrin/thio-poly-L-lysine conjugates. Anal. Biochem., 213(1):97-103.
100. Тешт H. M. 1990. Safety considerations in somatic gene therapy of human disease with retro virus vectors. Hum Gene Ther 1:111-123.
101. Thorstensen K. and Romslo I. 1993. The transferrin receptor: its diagnostic value and its potential as therapeutic target., Scand. J. Clin. Lab Invest. 53:113-120.
102. Tietge U. J., Cichon G., Buttner C., Genschel J., Heeren J., Gielow P., Grewe N., Dogar M., Beisiegel U., Manns M. P., Lochs H., Burchert W., and Schmidt H. H. 2004. A sensitive noninvasive method for monitoring successful liver-directed gene transfer of the low-density lipoprotein receptor in Watanabe hyperlipidemic rabbits in vivo. Gene Ther 11:574-580.
103. Wagner E., Gotten M., Mechtler K., Kirlappos H., Birnstiel M. L. 1991. DNA-binding transferrin conjugates as functional gene-delivery agents: synthesis by linkage of polylysine or ethidium homodimer to the transferrin carbohydrate moiety. Bioconjug. Chem,2(4):226-231.
104. Wang M., Rancourt C., Navarro J. G., Krisky D., Marconi P., Oligino Т., Alvarez R. D., Siegal G. P., Glorioso J. C., and Curiel D. T. 1998. High-efficacy thymidine kinase gene transfer to ovarian cancer cell lines mediated by herpes simplex virus type 1 vector. Gynecol Oncol 71:278-287.
105. Walther W. and Stein U. 2000. Viral vectors for gene transfer: a review of their use in the treatment of human diseases. Drugs 60:249-271.
106. Weir J. P., Dacquel E. J., and Aronovitz J. 1996. Herpesvirus vector-mediated gene delivery to human monocytes. Hum Gene Ther 7:1331-1338.
107. Wiethoff С.M., Middaugh С.R. 2003. Barriers to nonviral gene delivery. J. Pharm. Sci. 92:203-217.
108. Wolfe D., Wechuck J. В., Krisky D. M., GoffJ. P., Goins W. F., Ozuer A., Epperly M. E., Greenberger J. S., Fink D. J., and Glorioso J. C. 2004. Delivery of herpes simplex virus-based vectors to stem cells. Methods Mol Biol 246:339-352.
109. Xu Y., Szoka F. C. Jr. 1996. Mechanism ofDNA release from cationic liposome/DNA complexes used in cell transfection. Biochemistry 35:5616-5623.
110. Yanagihara K., Cheng H., Cheng P-W. 2000. Effects of epidermal growth factor, transfemn, insulin on lipofection efficiency in human lung carcinoma cells. Cancer Gene Ther. 7:59-65.
111. Yeh C. J. G.and Faulk W. P. 1984. Killing of human-tumor cells in culture with adriamycin conjugates of human transferrin. Clin. Immunol. Immunopathol. 32:1-11.
112. Yessine M. -A., Leroux J. -C. 2004. Membrane-destabilizing polyanions: interaction with lipid bilayers and endosomal escape of biomacromolecules. Advanced Drug Delivery Rev. 56:999-1021.
113. Zabner J., Couture L. A., Gregory R. J., Graham S. M., Smith A. E., and Welsh M. J. 1993. Adeno virus-mediated gene transfer transiently corrects the chloride transport defect in nasal epithelia of patients with cystic fibrosis. Cell 75:207-216.
114. Zanta M. A., Boussif 0., Adib A., Behr J. P. 1997. In vitro gene delivery to hepatocytes with galactosylated polyethylenimine, Bioconjug. Chem. 8:839-844.
115. Zeiphati O., Uyechi L., Barren L. G., Szoka F. C. 1998. Effect of serum components on the physico-chemical properties of cationic lipid r oligonucleotide complexes and on their interactions with cells. Biochimica et Biophysica Acta 1390:119-133.
116. Zhang G., Budker V., Williams P., Subbotin V., and Wolff J. A. 2001. Efficient expression of naked dna delivered intraarterially to limb muscles of nonhuman primates. Hum Gene Ther 12:427-438.
117. Zhang G., Budker V., and Wolff J. A. 1999. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther 10:1735-1737.
118. Zhang G., Gao X., Song Y. K., Vollmer R., Stolz D. В., Gasiorowski J. Z., Dean D. A., and Liu D. 2004. Hydroporation as the mechanism of hydrodynamic delivery. Gene Ther 11:675-682.
119. Zuhorn I. S., Kalicharan R., Hoekstra D. 2002. Lipoplex-mediated transfection of mammalian cells occurs through the cholesterol-dependent clathrin-mediated pathway of endocytosis. J. Biol. Chem. 277:18021-18028.
120. Zuidam N. J., Barenholz Y. 1998. Electrostatic and structural properties of complexes involving plasmid DNA and cationic lipids commonly used for gene delivery. Biochimica et Biophysica Acta 1368:115-128.
В таблице приведены средние значения площади раны (в мм2) в экспериментальных и контрольных группах мышей: pCMVIGF-1s - мыши, инъецированные свободным вектором экспрессии инсулин-подобного фактора роста I типа человека; pCMVIGF-1s/NLS-TSF7 - мыши, инъецированные комплексами pCMVIGF-1s/NLS-TSF7; pΔIGF-1s - мыши, инъецированные свободным вектором экспрессии инсулин-подобного фактора роста I типа человека с делегированным промотором; NLS-TSF7 - мыши, инъецированные свободным молекулярным конъюгатом NLS-TSF7.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЯРНЫЙ КОНЪЮГАТ НА ОСНОВЕ СИНТЕТИЧЕСКИХ АНАЛОГОВ ЛЮЛИБЕРИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА ДОСТАВКИ ДНК В КЛЕТКИ ГОРМОН-ЧУВСТВИТЕЛЬНЫХ ОПУХОЛЕЙ (ВАРИАНТЫ) | 2007 |
|
RU2377247C2 |
| Способ получения плазмидной ДНК в составе полимерных наносфер для доставки | 2022 |
|
RU2817116C1 |
| НОСИТЕЛЬ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ В КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ РЕЦЕПТОР CXCR4 | 2012 |
|
RU2522810C1 |
| УЛУЧШЕННЫЕ ПОЛИЭТИЛЕНИМИНОВЫЕ ПОЛИЭТИЛЕНГЛИКОЛЕВЫЕ ВЕКТОРЫ | 2015 |
|
RU2771104C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ЖИВОТНЫХ | 1996 |
|
RU2108714C1 |
| Способ усиления направленного редактирования гена CXCR4 в CD4-лимфоцитах человека в целях создания резистентности клеток к ВИЧ-1 | 2021 |
|
RU2779300C1 |
| МОДУЛЬНЫЙ МОЛЕКУЛЯРНЫЙ КОНЪЮГАТ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2529034C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОКОНЪЮГАТОВ НА ОСНОВЕ ПОЛИКАТИОНОВ, ПРИГОДНЫХ ДЛЯ ТРАНСПОРТИРОВКИ В ОРГАНИЗМ РАЗЛИЧНЫХ ВИДОВ АКТИВНЫХ ВЕЩЕСТВ | 2000 |
|
RU2250782C2 |
| СПОСОБ НАПРАВЛЕННОЙ ДОСТАВКИ ДНК В ОПУХОЛЕВЫЕ И СТВОЛОВЫЕ КЛЕТКИ | 2008 |
|
RU2408607C2 |
| Клеточная линия PSCA-CAR-YT, обладающая поверхностной экспрессией химерных антигенных рецепторов и проявляющая цитотоксическую активность по отношению к PSCA-позитивным раковым клеткам человека | 2018 |
|
RU2712901C1 |

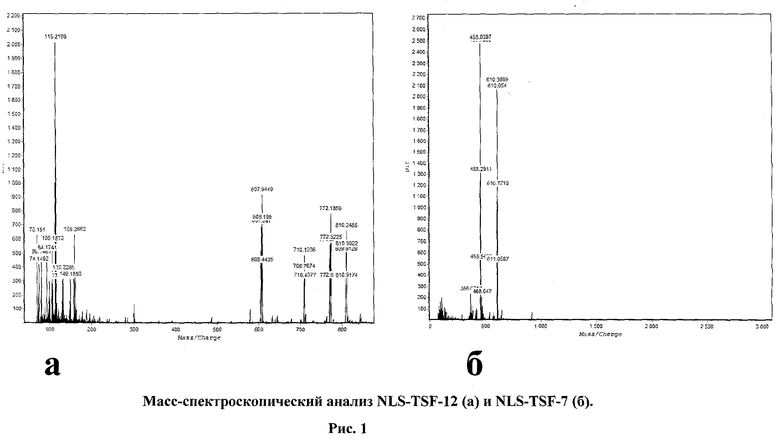

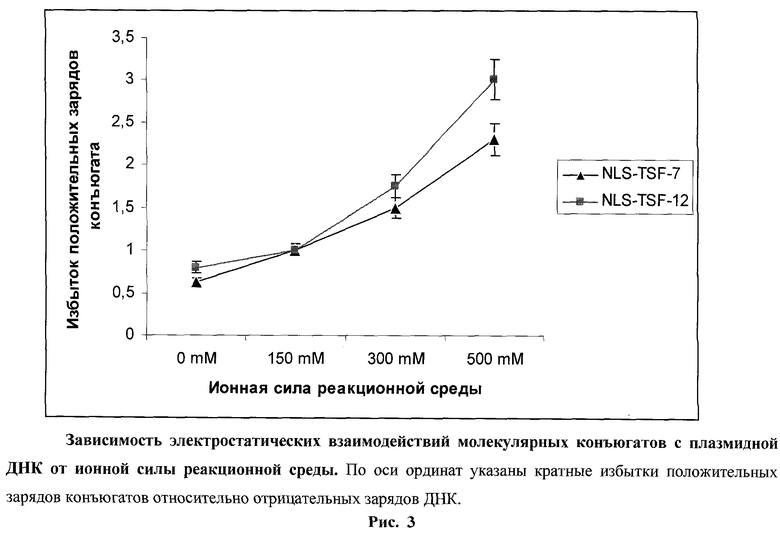

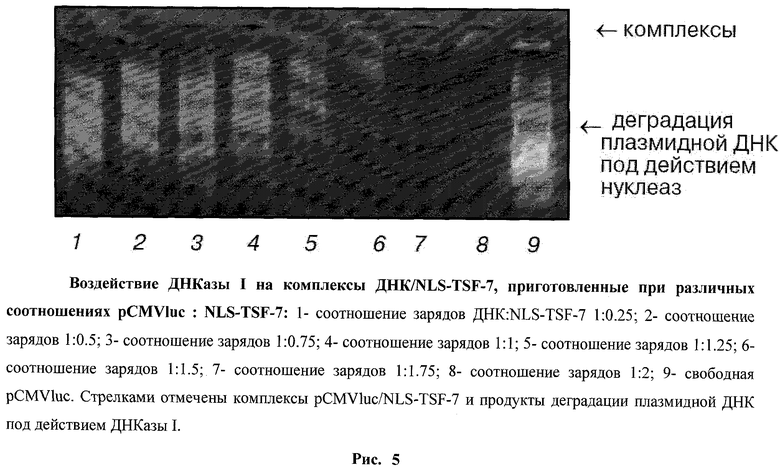
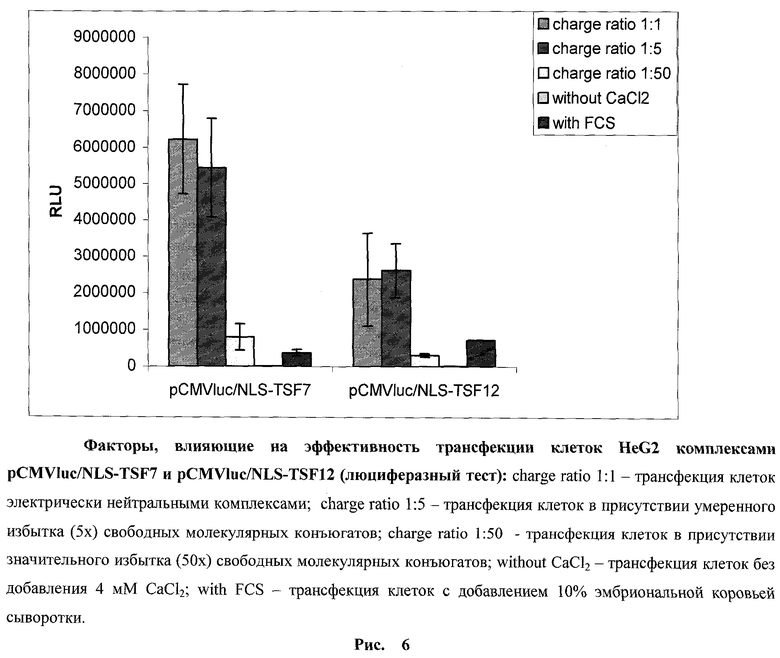
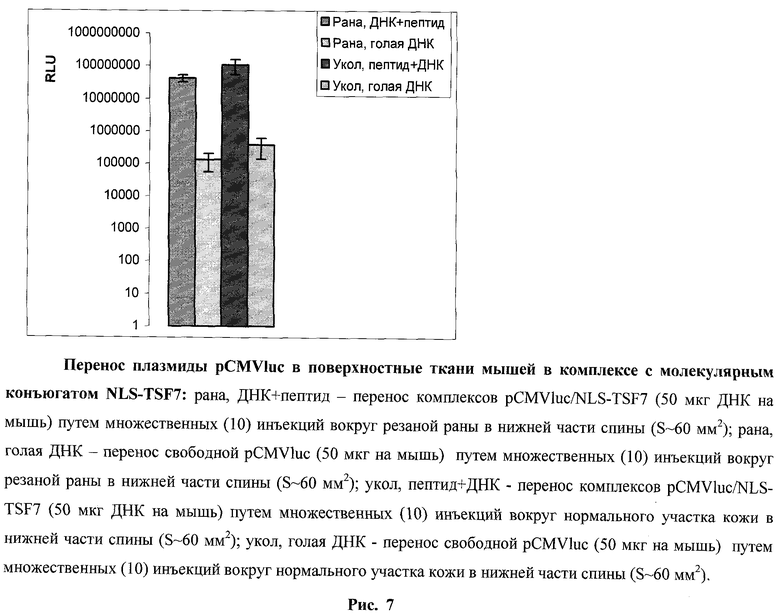
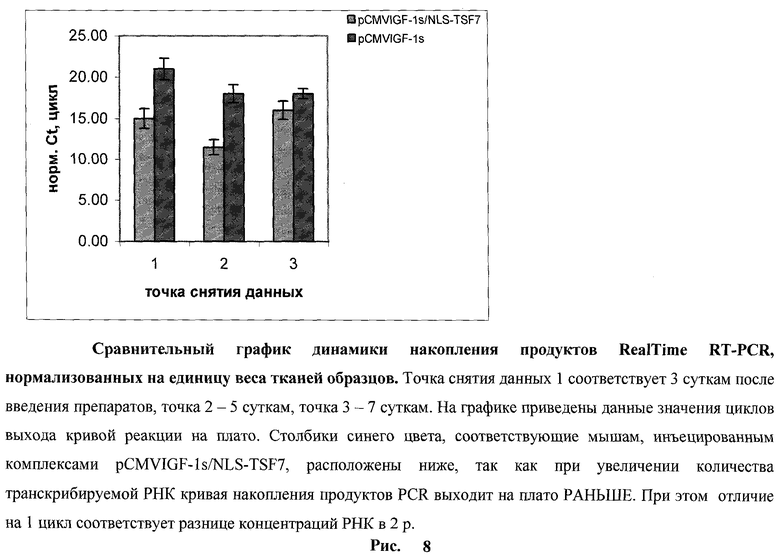
Настоящее изобретение относится к биотехнологии и представляет собой молекулярные конъюгаты, способные связываться с нуклеиновыми кислотами (ДНК или РНК) для доставки их в клетки млекопитающего, экспрессирующие рецепторы трансферрина. Указанные молекулярные конъюгаты состоят из поликатионной последовательности, представленной модифицированным сигналом ядерной локализации Т-антигена вируса SV40, и лиганда. В качестве лигандов клеточных рецепторов используется одна их двух последовательнсотей - HAIYPRH или THRPPMWSPVWP. Комплексы молекулярного конъюгата и нуклеиновой кислоты используют для получения препаратов для генной терапии или диагностики различных заболеваний. Для получения указанных комплексов растворы нуклеиновой кислоты и молекулярного конъюгата сливают при соотношении зарядов в реакционной среде от 1:0,63 и менее и используют для комплексообразования растворов с ионной силой менее 300 мМ. Настоящее изобретение позволяет повысить эффективность доставки генетических конструкций в клетки. 8 н. и 4 з.п. ф-лы, 8 ил., 1 табл., 1 пр.
1. Молекулярный конъюгат с аминокислотной последовательностью SEQ ID NO:4, способный связываться с нуклеиновой кислотой (ДНК или РНК) для доставки ее в клетку млекопитающего, экспрессирующую рецепторы трансферрина, состоящий из поликатионной последовательности и лиганда, в котором поликатионная последовательность представлена модифицированным сигналом ядерной локализации Т-антигена вируса SV40 и имеет аминокислотную последовательность SEQ ID NO:3, а лиганд имеет аминокислотную последовательность SEQ ID NO:1.
2. Молекулярный конъюгат с аминокислотной последовательностью SEQ ID NO:5, способный связываться с нуклеиновой кислотой (ДНК или РНК) для доставки ее в клетку млекопитающего, экспрессирующую рецепторы трансферрина, состоящий из поликатионной последовательности и лиганда, в котором поликатионная последовательность представлена модифицированным сигналом ядерной локализации Т-антигена вируса SV40 и имеет аминокислотную последовательность SEQ ID NO:3, а лиганд имеет аминокислотную последовательность SEQ ID NO:2.
3. Комплекс молекулярного конъюгата по п.1 с нуклеиновой кислотой (ДНК или РНК), предназначенный для трансфекции клеток млекопитающих, экспрессирующих рецепторы трансферрина.
4. Комплекс молекулярного конъюгата по п.2 с нуклеиновой кислотой (ДНК или РНК), предназначенный для трансфекции клеток млекопитающих, экспрессирующих рецепторы трансферрина.
5. Комплекс молекулярного конъюгата по п.3 или 4, отличающийся тем, что нуклеиновая кислота представлена плазмидой.
6. Препарат для генной терапии или диагностики, состоящий из комплекса молекулярного конъюгата с нуклеиновой кислотой по п.4 в количестве 0,1 мкг (в пересчете на содержание нуклеиновой кислоты) и фармацевтически приемлемого носителя, обеспечивающего стабильность комплекса, предназначенный для доставки в клетки млекопитающих, экспрессирующие рецепторы трансферрина, нуклеиновых кислот, кодирующих терапевтические гены или маркерные гены для целей диагностики.
7. Препарат для генной терапии или диагностики, состоящий из комплекса молекулярного конъюгата с нуклеиновой кислотой по п.5 в количестве 0,1 мкг (в пересчете на содержание нуклеиновой кислоты) и фармацевтически приемлемого носителя, обеспечивающего стабильность комплекса, предназначенный для доставки в клетки млекопитающих, экспрессирующие рецепторы трансферрина, нуклеиновых кислот, кодирующих терапевтические гены или маркерные гены для целей диагностики.
8. Препарат для генной терапии по п.6 или 7, отличающийся тем, что используется для регенеративной генной терапии.
9. Препарат для генной терапии по п.8, отличающийся тем, что нуклеиновая кислота кодирует инсулиноподобный фактор роста I типа человека.
10. Препарат по п.8 или 9, характеризующийся использованием в его составе раствора CaCl2 в концентрации 20 мМ.
11. Способ формирования комплекса по п.3 или 4, заключающийся на первой стадии в слиянии растворов молекулярного конъюгата и нуклеиновой кислоты с последующей очисткой образовавшихся комплексов от несвязавшегося молекулярного конъюгата ультрафильтрацией на второй стадии и затем на третьей стадии - добавлении раствора CaCl2.
12. Способ формирования комплекса по п.3 или 4, характеризующийся на стадии слияния растворов нуклеиновой кислоты и молекулярного конъюгата соотвествующим соотношением зарядов в реакционной среде от 1:0,63 и меньше и использованием для комплексообразования растворов с ионной силой меньше 300 мМ.
| WAGNER E., et al., Transferrin-polycation conjugates as carrier for DNA uptake into cell, Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, May 1990, Vol.87, pp.3410-3414 | |||
| LEE JAE H., et al., Receptor mediated uptake of peptides that bind the human transferring receptor, Eur | |||
| J | |||
| Biochem., 268, 2001, pp.2004-2012 | |||
| Запорный кран для трубопроводов | 1930 |
|
SU20425A1 |
Авторы
Даты
2014-12-27—Публикация
2009-07-08—Подача