Настоящее изобретение относится к области вакцинации, прежде всего к противораковым вакцинам.
Иммунная система может распознавать и в определенной степени элиминировать опухолевые клетки, однако уровень указанного противоопухолевого ответа часто является низким и неэффективным. Усиление этого слабого противоопухолевого ответа с помощью терапевтической вакцинации уже давно является целью противораковой терапии. Таким образом, модуляция иммунной системы с целью повышения иммунных ответов представляет собой перспективный терапевтический подход в онкологии, и ее можно объединять со стандартными методами ухода за больными.
Многообещающие результаты доклинических исследований и успехи в клинических испытаниях продемонстрировали, что активная иммунизация является безопасным и реальным путем лечения некоторых типов рака. Опубликованы данные об индукции иммунных ответов, опосредуемых опухольспецифическими цитотоксическими Т-лимфоцитами (CTL), с использованием различных подходов, включая вакцины на основе модифицированных опухолевых клеток, пептидные вакцины, рекомбинантные вирусные векторы, вакцины на основе ДНК, белка или дендритных клеток. Однако противоопухолевый иммунитет, опосредуемый CTL, только в редких случаях коррелирует с регрессом опухолей, и лишь несколько проектов достигли фазы III клинических испытаний.
В целом, к настоящему времени для противораковых вакцин продемонстрирована очень ограниченная клиническая эффективность. Так, известно, что к концу 2011 г. из 30000 проводимых клинических испытаний противораковых вакцин только 19 достигли фазы III испытаний (Global Data, 2012). Среди них, Neu Vax, пептидная вакцина для рака молочной железы, Stimuvax, вакцина на основе липосом для немелкоклеточной карциномы легкого (NSCLC) и рака молочной железы, TG4010, вакцина на основе вируса коровьей оспы для NSCLC, и GSK 1572932 A, липосома с адъювантом для NSCLC. Эти четыре противораковые вакцины основаны на различных технологиях и общим для них является то, что каждая из них направлена на один единственный антиген.
Терапевтические противораковые вакцины можно разделять на две принципиальные категории: персонализированные (аутологичные) и стандартизированные вакцины, и их дополнительно классифицируют в зависимости от технологической платформы. Современные персонализированные вакцины включают вакцины на основе опухолевого лизата, а также вакцину на основе дендритных клеток (далее в контексте настоящего описания обозначена как вакцина на основе клеток). В последнем случае для загрузки антигена можно использовать либо введение опухолевых лизатов в импульсном режиме, либо трансфекцию с помощью РНК, экстрагированной из опухолей. В этом случае антигены являются специфическими для опухоли или ассоциированы с ней, но не являются строго определенными. Дендритные клетки можно вносить также с определенными антигенами либо с помощью обработки в импульсном режиме пептидом, либо с использованием белка, такого как простатическая кислая фосфатаза (РАР), который применяли для создания вакцины Provenge®. Однако процесс производства этих терапевтических агентов на основе клеток требует больших временных затрат и является трудоемким, и при этом трудно обеспечивать и поддерживать стандарты качества. Иммуномониторинг сопряжен с дополнительными сложностями. Кроме того, большая часть аутологичных противораковых вакцин не позволяют идентифицировать или количественно оценивать антигены, которые следует контролировать, в отличие от имеющих заданный состав и стандартизованных вакцин.
В отличие от терапии на основе клеток (АРС, Т-клетки, CAR, лизаты) субъединичные вакцины (белок или пептиды) позволяют разрабатывать стандартизованную вакцину с использованием более простого процесса получения и с улучшенной в значительной степени воспроизводимостью от партии к партии, которую можно вводить широкому кругу пациентов. Кроме того, антигены являются полностью определенными, что позволяет улучшать иммуномониторинг и снижать риск нежелательных явлений, связанных с компонентом вакцины.
Различные подходы, которые оценивали в доклинических и клинических исследованиях, включают вакцины на основе коротких пептидов (Slingluff C.L., Jr., The present and future of peptide vaccines for cancer: single or multiple, long or short, alone or in combination? Cancer journal 17(5), 2011, cc. 343-350), вакцины на основе длинных пептидов (Melief C.J., van der Burg S.H., Immunotherapy of established (pre)malignant disease by synthetic long peptide vaccines, Nature reviews Cancer 8(5), 2008, cc. 351-360) и на основе белков. В отличие от вакцин на основе длинных пептидов и белков вакцины на основе коротких пептидов обладают очень коротким временем полужизни и могут оказывать отрицательное воздействие на иммунный ответ.
Терапевтическую противораковую вакцину вводят страдающим раком пациентам для усиления способности их иммунной системы распознавать и уничтожать опухолевые клетки. Основной целью подхода на основе терапевтической противораковой вакцины является создание Т-клеток-киллеров (которые обозначают также как цитотоксические Т-лимфоциты), специфических для опухолевых клеток. Для этого, а также для достижения сильного иммунного ответа вакцина должна содержать также антиген или антигенный эпитоп, который также присутствует в опухоли и который требуется доставлять к антигенпрезентирующим клетками (АРС), прежде всего дендритным клеткам (DC), для инициации противоракового иммунитета. DC процессируют эти опухолевые антигены в небольшие пептиды, которые презентируются на поверхности клеток, экспрессирующих молекулы ГКГС класса I или ГКГС класса II, Т-клеткам. Пептиды, которые затем распознаются Т-клетками и тем самым индуцируют их стимуляцию, называются эпитопами. Презентация молекулами ГКГС класса I и ГКГС класса II обеспечивает активацию двух классов Т-клеток, цитотоксических CD8+-Т-лимфоцитов (CTL) и хелперных CD4+-Т-клеток (Th) соответственно. Кроме того, для полной активации помимо распознающих антиген Т-клеток требуется второй сигнал, костимулирующий сигнал, который является неспецифическим для антигена и образуется в результате взаимодействия между костимулирующими молекулами, экспрессируемыми на поверхности АРС, и Т-клеткой. Таким образом, двумя основными требованиями, предъявляемыми к эффективной терапевтической противораковой вакцине, является (I) специфичность опухолевых антигенов и (II) способность эффективно доставлять их к DC.
Таким образом, в совокупности для индукции опухольспецифического иммунного ответа требуется три основные стадии: (I) антиген должен быть доставлен к дендритным клеткам, которые должны процессировать его до эпитопов, (II) дендритные клетки должны получать соответствующий активирующий сигнал и (III) активированные загруженные опухолевым антигеном дендритные клетки должны генерировать опосредуемые Т-клетками иммунные ответы в лимфоидных органах.
Поскольку опухолевые клетки могут ускользать от надзора иммунной системы с помощью понижающей регуляции экспрессии индивидуальных антигенов (пассивное ускользание от иммунологического надзора), то доставка имеющего несколько эпитопов антигена (полиэпитопный антиген) должна обеспечивать преимущество. Так, вакцины на основе белков обеспечивают доставку полиэпитопного антигена к антигенпрезентирующим клеткам (АРС), таким как дендритные клетки (DC), без ограничения рестрикции по единичному аллелю ГКГС. Другим путем усиления является долговременная презентация эпитопа, описанная в настоящее время для дендритных клеток, загруженных белками (van Montfoort N., Camps M.G., Khan S., Filippov D.V., Weterings J.J., Griffith J.M. и др., Antigen storage compartments in mature dendritic cells facilitate prolonged cytotoxic T lymphocyte cross-priming capacity. Proceedings of the National Academy of Sciences of the United States of America 106(16), 2009, cc. 6730-6735). Кроме того, для белков требуется поглощение и процессирование DC для достижения ограниченной (рестрикированной) по ГКГС презентации пристствующих в них эпитопов. Это снижает риск индукции периферической толерантности, которая обнаружена после вакцинации короткими пептидами, которые не обладают такими строгими требованиями к процессированию (Toes R.E., Offringa R., Blom R.J., Melief С.J., Kast W.M., Peptide vaccination can lead to enhanced tumor growth through specific T-cell tolerance induction. Proceedings of the National Academy of Sciences of the United States of America 93(15), 1996, cc. 7855-7860).
Однако большинство растворимых белков, как правило, расщепляются в эндолизосомах и слабо перекрестно презентируются на молекулах ГКГС класса I и поэтому обладают слабой иммуногенностью в отношении CD8+-Т-клеточных ответов (Rosalia R.A., Quakkelaar E.D., Redeker A., Khan S., Camps M., Drijfhout J.W. и др., Dendritic cells process synthetic long peptides better than whole protein, improving antigen presentation and T-cell activation. European journal of immunology 43(10), 2013, cc. 2554-2565). Кроме того, хотя зрелые DC являются более эффективными, чем незрелые DC, в отношении примирования и вызывания Т-клеточных ответов (Apetoh L., Locher С., Ghiringhelli F., Kroemer G., Zitvogel L., Harnessing dendritic cells in cancer. Semin Immunol. 23, 2011, cc. 42-49), они утрачивают способность эффективно поглощать экзогенные антигены, в частности антигены, рестриктированные по ГКГС класса II (Banchereau J., Steinman R.M., Dendritic cells and the control of immunity. Nature, 392, 1998, cc. 245-252). В результате, на обработанные в импульсном режиме пептидами DC в качестве вакцин накладывается несколько ограничений.
Например, расщепление пептидов, быстрый круговорот молекул ГКГС класса I и диссоциация пептида из молекул ГКГС класса I в процессе получения и инъекции DC/пептидов могут приводить к короткому времени полужизни комплексов ГКГС класса I/пептид на поверхности DC, что приводит к слабым Т-клеточным ответам.
Для повышения эффективности доставки вакцины на основе белка предложено применение проникающих в клетку пептидов для внутриклеточной доставки раковых пептидов в DC (Wang R.F., Wang H.Y., Enhancement of antitumor immunity by prolonging antigen presentation on dendritic cells. Nat Biotechnol. 20, 2002, cc. 149-156). Проникающие в клетку пептиды (СРР) представляют собой пептиды, состоящие из 8-40 остатков, которые обладают способностью пересекать клеточную мембрану и проникать в большинство типов клеток (Copolovici D.M., Langel K., Eriste Е., Langel U., Cell-penetrating peptides: design, synthesis, and applications. ACS nano 8(3), 2014, cc. 1972-1994, Milletti F., Cell-penetrating peptides: classes, origin, and current landscape. Drug Discov Today, 2012). Альтернативно этому, их обозначают также как домен трансдукции белка (PTD), что отражает их источник в виде встречающихся в естественных условиях белков. Несколько эффективных СРР идентифицировано из белков, включая белок Tat вируса иммунодефицита человека, белок VP22 вируса герпеса простого и фактор роста фибробластов (Berry С.С. Intracellular delivery of nanoparticles via the HIV-1 tat peptide. Nanomedicine. 3, 2008, cc. 357-365; Deshayes S., Morris M.C., Divita G., Heitz F., Cell-penetrating peptides: Tools for intracellular delivery of therapeutics. Cell Mol Life Sci. 62, 2005, cc. 1839-1849; Edenhofer F. Protein transduction revisited: Novel insights into the mechanism underlying intracellular delivery of proteins. Curr Pharm Des. 14, 2008, cc. 3628-3636; Gupta В., Levchenko T.S., Torchilin V.P., Intracellular delivery of large molecules and small particles by cell-penetrating proteins and peptides. Adv Drug Deliv Rev. 57, 2005, cc. 637-651; Torchilin V.P., Recent approaches to intracellular delivery of drugs and DNA and organelle targeting. Annu Rev Biomed Eng. 8, 2006, cc. 343-375). Установлено, что Т-клеточная активность, обусловленная DC/TAT-TRP2, оказалась в 3-10 раз выше, чем активность, индуцированная DC/TRP2 (Wang H.Y., Fu Т., Wang G., Gang Z., Donna M.P.L, Yang J.C., Restifo N.P., Hwu P., Wang R.F., Induction of CD4+ T cell-dependent antitumor immunity by TAT-mediated tumor antigen delivery into dendritic cells. J Clin Invest. 109, 2002a, cc. 1463-1470).
Для повышения уровня костимулирующих молекул на DC и для усиления ответа иммунной системы на антигены-мишени можно применять адъюванты. Адъюванты могут решать эту задачу, имитируя сохраненные микробные компоненты, которые в естественных условиях распознаются иммунной системой. Они включают, например, липополисахарид (LPS), компоненты оболочек бактериальных клеток и нуклеиновые кислоты, такие как двухцепочечная РНК (dsРНК), одноцепочечная РНК (ssРНК) и ДНК, содержащая неметилированный CpG-динуклеотид. Их присутствие может повышать врожденный иммунный ответ на антиген. Кроме того, указанный адъювант может усиливать скорее адаптивный иммунный ответ, связанный с CTL и типом поляризованных Th1, чем гуморальный иммунный ответ, приводящий к выработке антител. Изучены различные адъюванты, из них для применения на человеке одобрено лишь ограниченное количество. Они включают квасцы, MPL (монофосфорил-липид А) и ASO4 (квасцы и MPL), применяемые в США, и MF59 (эмульсия типа масло-в-воде), ASO4, липосомы, применяемые в Европе (Lim Y.T., Vaccine adjuvant materials for cancer immunotherapy and control of infectious disease. Clin Exp Vaccine Res, 4(1), 2015, cc. 54-58).
В настоящее время в качестве многообещающего класса адъювантов рассматриваются лиганды Толл-подобного рецептора (TLR) (Baxevanis C.N., I.F. Voutsas и О.Е. Tsitsilonis, Toll-like receptor agonists: current status and future perspective on their utility as adjuvants in improving anticancer vaccination strategies. Immunotherapy, 5(5), 2013, cc. 497-511). Так, в важных исследованиях, направленных на разработку противораковых вакцин, в композиции вакцин включали различные агонисты TLR, такие как TLR-3 (поли I:C), TLR-4 (монофосфорил-липид A; MPL), TLR-5 (флагеллин), TLR-7 (имиквимод) и TLR-9 (CpG) (Duthie M.S., Windish H.P., Fox С.В., Reed S.G., Use of defined TLR ligands as adjuvants within human vaccines. Immunol Rev. 239, 2011, cc. 178-196). Типы сигналов и цитокинов, продуцируемых иммунными клетками после стимуляции TLR, контролируют дифференцировку CD4+-Т-клеток в Th1, Th2, Th17 и Treg-клетки. Стимуляция иммунных клеток, таких как DC и Т-клетки, большинством адъювантов на основе TLR приводит к выработке провоспалительных цитокинов и усиливает ответы Th1 и CD8+-Т-клеток (Manicassamy S., Pulendran В., Modulation of adaptive immunity with Toll-like receptors. Semin Immunol. 21, 2009, cc. 185-193).
Конъюгация вакцин с лигандом TLR представляет собой привлекательный подход, который обладает несколькими преимуществами по сравнению с неконъюгированными вакцинами, включая (I) предпочтительное поглощение иммунными клетками, экспрессирующими TLR, (II) повышенный иммунный ответ и (III) пониженный риск индукции периферической толерантности. Фактически, все антигенпрезентирующие клетки, загруженные антигеном, должны одновременно активироваться. Различные группы исследователей, изучавшие этот подход с использованием различных лигандов TLR, главным образом связывали их химическим путем с вакциной на основе пептида или белка (Zom G.G., Khan S., Filippov D.V., Ossendorp F., TLR ligand-peptide conjugate vaccines: toward clinical application. Adv Immunol. 114, 2012, cc. 177-201). Поскольку химическое связывание с пептидом легко осуществлять, то наиболее изученные лиганды TLR, предназначенные для конъюгации с вакциной, представляли собой агонисты TLR2 Pam2Cys и Pam3Cys (Fujita Y. и H. Taguchi, Overview and outlook of Toll-like receptor ligand-antigen conjugate vaccines. Ther Deliv, 3(6), 2012, cc. 749-760).
Кроме того, в настоящее время обнаружены модуляторы иммунных контрольных точек (чекпойнтов) в качестве новых мишеней для противораковой иммунотерапии, что продемонстрировано для разрешенных в последние время для продажи Yervoy® (ипилимумаб; фирма Bristol Myers Squibb), Opdivo® (ниволумаб; фирма Bristol Myers Squibb) и Keytruda® (пембролизумаб; фирма Merck). Иммунные контрольные точки представляют собой молекулы в иммунной системе, в частности, на некоторых иммунных клетках, которые должны быть активированы (стимулирующие или костимулирующие молекулы контрольных точек) или инактивированы (ингибирующие молекулы контрольных точек) для начала иммунного ответа. Многие иммунные контрольные точки регулируются путем взаимодействий между парами: специфический рецептор и лиганд. Часто рак защищает сам себя от иммунной системы путем использования указанных контрольных точек во избежание атаки иммунной системы.
В частности, определенного внимания заслуживают два рецептора контрольных точек CTLA-4 и PD-1. CTLA-4, PD-1 и их лиганды являются представителями семейства CD28-B7 молекул контрольных точек, обеспечивающих совместную передачу сигналов, которые играют важную роль на всех стадиях Т-клеточных функций и функций других клеток.
Рецептор PD-1 экспрессируется на поверхности активированных Т-клеток и других иммунных клеток, таких как В-клетки. Его лиганды (PD-L1 и PD-L2) экспрессируются на поверхности антигенпрезентирующих клеток, таких как дендритные клетки или макрофаги, и других иммунных клеток. Связывание PD-L1 или PD-L2 с PD1 запускает сигнал в Т-клетке, который в значительной степени «выключает» Т-клетку или ингибирует ее. В непатологических условиях указанное взаимодействие препятствует атакующему действию Т-клеток на другие клетки в организме. Однако раковые клетки часто имеют преимущество в указанной системе и экспрессируют высокие уровни PD-L1 на их поверхности. Таким образом, раковые клетки могут «выключать» Т-клетки, экспрессирующие PD-1, и тем самым подавлять противораковый иммунный ответ. Ингибиторы PD1 и/или их лигандов, такие как ингибирующие/антагонистические моноклональные антитела, направленные против PD1 или его лигандов, могут усиливать иммунный ответ против раковых клеток и поэтому являются перспективными для лечения различных видов раков. Примеры ингибирующих/антагонистических моноклональных антител против PD1, одобренных в настоящее время, включают Opdivo® (ниволумаб; фирма Bristol Myers Squibb) и Keytruda® (пембролизумаб; фирма Merck). Другие ингибиторы пути PD1, которые в настоящее время находятся на фазе II и/или III клинических испытаний, включают пидилизумаб (ингибирующее PD1 МАт; фирма CureTech/Medivation), дурвалумаб (ингибирующее PD-L1 МАт; фирма MedImmune/AstraZeneca) и атезолимаб (ингибирующее PD-L1 МАт; фирма Roche).
Yervoy® (ипилимумаб; фирма Bristol Myers Squibb), другой разрешенный модулятор иммунных контрольных точек, представляет собой ингибирующее/антагонистическое моноклональное антитело против ассоциированного с цитотоксическими Т-лимфоцитами антигена 4 (CTLA-4). CTLA4 экспрессируется также на поверхности активированных Т-клеток, а его лиганды экспрессируются на поверхности профессиональных антигенпрезентирующих клеток. Предполагается, что CTLA-4 регулирует раннюю пролиферацию Т-клеток при иммунном ответе, прежде всего в лимфатических узлах, и воздействует на функционирование регуляторных Т-клеток. Другой ингибитор CTLA-4, находящийся в настоящее время на фазе II клинических испытаний, представляет собой, например, тремелимумаб (фирма MedImmune/AstraZeneca).
Установлено, что противораковые иммунотерапии с применением модуляторов контрольных точек, в частности ингибиторов контрольных точек, обладала очень высокой эффективностью в отношении по меньшей мере подгруппы индивидуумов («респондеры»). Однако у многих пациентов не обнаружен ответ на модуляторы контрольных точек, и даже в популяции респондеров ответ не всегда был полным или оптимальным.
Таким образом, для повышения эффективности желательным является совместное ингибирование путей PD1 и CTLA4. Так, комбинированная терапия с использованием ниволумаба и ипилимумаба одобрена FDA в 2015 г. для лечения пациентов с BRAF V600 дикого типа, т.е. нерезектабельной или метастатической меланомы. Кроме того, в последние годы получены данные об успешном проведении фазы 1b испытания комбинации дурвалумаба и тремелимумаба в отношении немелкоклеточного рака легких (Antonia, Scott и др., Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study; Lancet Oncol. 5 февраля 2016 г., pii: S1470-2045(15)00544-6. doi: 10.1016/S1470-2045(15)00544-6 [опубликовано в Интернете до официального издания (Epub ahead of print)]).
Однако комбинация модуляторов контрольных точек друг с другом оказывает направленное воздействие только на эндогенный опухольспецифический иммунитет, в частности, поскольку не включает опухольспецифические антигены. Другой стратегией лечения рака является объединение модулятора контрольных точек с вакциной, содержащей описанный выше антиген или антигенный эпитоп, что обеспечивает специфичность в отношении конкретной опухоли. Комбинация модулятора контрольных точек и вакцины, содержащей антиген или антигенный эпитоп, может усиливать или пролонгировать противоопухолевый ответ у индивидуума. Кроме того, комбинация вакцины, содержащей антиген или антигенный эпитоп, с модулятором контрольных точек может усиливать или пролонгировать воздействия модулятора контрольных точек, что обеспечивает ответ индивидуума на модулятор контрольных точек или обеспечивает снижение токсичности или дозы модулятора контрольных точек. Например, модулятор контрольных точек может удалять «иммунный тормоз» перед нажатием «педали акселератора лечения» путем введения вакцины.
Таким образом, существует потребность в разработке комбинированных терапий для инициации или повышения эффективности модуляторов контрольных точек как для респондеров, так и нереспондеров. Для этой цели требуется комбинация модулятора контрольных точек с эффективной вакциной. Однако установлено, что большинство изученных к настоящему времени противораковых вакцин обладают лишь ограниченной эффективностью. Одним из объяснений этого является отсутствие терапии, с помощью которой можно одновременно (I) стимулировать опосредуемый цитотоксическими полиэпитопными Т-клетками иммунитет, (II) индуцировать Th-клетки и (III) повышать иммунологическую память. Эти три параметра являются существенными для создания эффективного длительного противоопухолевого иммунитета. Так, CTL, специфические в отношении различных эпитопов, могут обеспечивать деструкцию многих раковых клеток в гетерогенной опухолевой массе и избегания увеличения вариантов без антигена (ускользание опухоли от иммунологического надзора). Th-клетки участвуют в поддержании длительного клеточного иммунитета, и инфильтрация опухолей Th-клетками также является важной стадией рекрутмента и функции CD8+-CTL. Иммунологическая память является важной для защиты от рецидива опухоли.
В свете вышесказанного, в основу настоящего изобретения была положена задача преодолеть указанные выше недостатки современных противораковых вакцин и разработать комбинацию модулятора иммунных контрольных точек и комплекса, содержащего проникающий в клетку пептид, карго-молекулу и агонист TLR, для применений в противораковой иммунотерапии, которая представляет собой более эффективную вакцину, прежде всего противораковую вакцину, обладающую улучшенной противоопухолевой активностью. Таким образом, настоящее изобретение относится к комбинированной терапии для инициации, обеспечения, усиления или улучшения противоракового иммунного ответа, в частности, которая обеспечивает, усиливает или улучшает ответ индивидуума или опухоли на модуляторы контрольных точек.
Эта цель достигается с помощью изложенного ниже объекта изобретения и прилагаемой формулы изобретения.
Хотя настоящее изобретение описано подробно ниже, должно быть очевидно, что настоящее изобретение не ограничено конкретными методологиями, протоколами и реагентами, указанными в настоящем описании, и они могут варьироваться. Также должно быть очевидно, что применяемая в контексте описания терминология не направлена на ограничение объема настоящего изобретения, который определяется только прилагаемой формулой изобретения. Если не указано иное, то все технические и научные понятия, применяемые в контексте настоящего описания, имеют значения, общепринятые и очевидные обычному специалисту в данной области.
Ниже описаны элементы настоящего изобретения. Эти элементы перечислены с помощью конкретных вариантов осуществления изобретения, однако следует понимать, что их можно объединять любым образом и в любом количестве с созданием дополнительных вариантов осуществления изобретения. Различные описанные примеры и предпочтительные варианты осуществления изобретения не должны рассматриваться, как ограничивающие объем настоящего изобретения, они предназначены только для пояснения описанных вариантов осуществления изобретения. Должно быть очевидно, что настоящее описание предназначено для подтверждения вариантов осуществления изобретения и включает варианты осуществления изобретения, которые поясняют описанные варианты осуществления изобретения с любым количеством описанных и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех указанных элементов в настоящей заявке, должны рассматриваться как подпадающие под объем настоящего описания, если из контекста не следует иное.
В настоящем описании и в представленной ниже формуле изобретения, если из контекста не требуется иное, понятие «содержат» и его грамматические формы, такие как «содержит» и «содержащий», следует рассматривать, как включающие указанного представителя, указанное целое число или указанную стадию, но не исключающие любого другого неуказанного представителя, любое другое неуказанное целое число или любую другую неуказанную стадию. Понятие «состоят из» является конкретным вариантом понятия «содержат», при этом исключается любой другой неуказанный представитель, любое другое неуказанное целое число или любая другая неуказанная стадия. В контексте настоящего изобретения понятие «содержат» включает понятие «состоят из». Таким образом, под понятие «содержащий» подпадает также «включающий», а также «состоящий», например, композиция, «содержащая» X может содержать только X или может иногда включать дополнительный элемент, например, X+Y.
Упоминание в контексте настоящего описания понятия в единственном числе относится также и к множественному числу (особенно в контексте формулы изобретения), если в настоящем описании не указано иное или если это явно противоречит контексту. Упоминание диапазонов величин в контексте настоящего описания должно служить только в качестве метода сокращенной ссылки индивидуально на каждую отдельную величину, подпадающую под диапазон. Если специально не указано иное, то каждое индивидуальное значение включено в описание, как если бы оно было индивидуально указано в настоящем описании. Спецификация не ограничена никаким языком, применяемым для указания не заявляемого элемента, важного для воплощения изобретения на практике.
Понятие «практически» не исключает «полностью», например, композиция, «практически свободная» от Y, может представлять собой композицию полностью свободную от Y. При необходимости понятие «практически» можно опускать в описании изобретения.
Понятие «примерно» касательно численного значения х обозначает х±10%.
Комбинация модулятора контрольных точек и комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и пептидный агонист TLR, для применения в медицине
Первым объектом настоящего изобретения является комбинация
(I) модулятора иммунных контрольных точек и (II) комплекса, содержащего:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс (т.е. проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR), ковалентно связаны,
предлагаемая для применения в медицине.
Ниже компоненты комбинации, предназначенной для применения согласно настоящему изобретению, т.е. модулятор иммунных контрольных точек и комплекс, содержащий проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, и их предпочтительные варианты описаны подробно. Следует понимать, что (I) в предпочтительно варианте осуществления изобретения комбинация, предлагаемая для применения согласно настоящему изобретению, содержит предпочтительный вариант модулятора иммунных контрольных точек; (II) в предпочтительно варианте осуществления изобретения комбинация, предлагаемая для применения согласно настоящему изобретению, содержит предпочтительный вариант комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR; и (III) в более предпочтительном варианте осуществления изобретения комбинация, предлагаемая для применения согласно настоящему изобретению, содержит предпочтительный вариант модулятора иммунных контрольных точек и предпочтительный вариант комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR.
Модулятор иммунных контрольных точек
В контексте настоящего описания (т.е. во всей настоящей заявке) понятие «модулятор иммунных контрольных точек (который обозначают также как «модулятор контрольных точек) относится к молекуле или к соединению, которая/которое модулирует (например, полностью или частично снижает, ингибирует, взаимодействует с, активирует, стимулирует, повышает, усиливает или поддерживает) функцию одной или нескольких молекул контрольных точек. Таким образом, модулятор иммунных контрольных точек может представлять собой «ингибитор иммунных контрольных точек» (который обозначают также как «ингибитор контрольных точек» или «ингибитор») или «активатор иммунных контрольных точек» (который обозначают также как «активатор контрольных точек» или «активатор»). «Ингибитор иммунных контрольных точек» (который обозначают также как «ингибитор контрольных точек» или «ингибитор») полностью или частично снижает, ингибирует, взаимодействует с или негативно модулирует функцию одной или нескольких молекул контрольных точек. «Активатор иммунных контрольных точек» (который обозначают также как «активатор контрольных точек» или «активатор») полностью или частично активирует, стимулирует, повышает, усиливает, поддерживает или положительно модулирует функцию одной или нескольких молекул контрольных точек. Модуляторы иммунных контрольных точек, как правило, обладают способностью модулировать (I) аутотолерантность (толерантность к «своему) и/или (II) амплитуду и/или продолжительность иммунного ответа. Предпочтительно модулятор иммунных контрольных точек, применяемый согласно настоящему изобретению, модулирует функцию одной или нескольких человеческих молекул контрольных точек и, таким образом, является «модулятором человеческих контрольных точек». Предпочтительно модулятор иммунных контрольных точек является активатором или ингибитором одной или нескольких молекул иммунных контрольных точек, выбранных из CD27, CD28, CD40, CD122, CD137, ОХ40, GITR, ICOS, A2AR, В7-Н3, В7-Н4, BTLA, CD40, CTLA-4, IDO, KIR, LAG3, PD-1, TIM-3, VISTA, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, GITR, TNFR и/или FasR/DcR3; или активатором или ингибитором одного или нескольких их лигандов.
Молекулы контрольных точек представляют собой молекулы, такие как белки, как правило, участвующие в путях иммунного ответа, и, например, регулируют активацию Т-клеток, пролиферацию Т-клеток и/или функцию Т-клеток. Таким образом, функция молекул контрольных точек, которая модулируется (например, полностью или частично снижается, ингибируется, подвергается взаимодействию с, активируется, стимулируется, повышается, усиливается или поддерживается) с помощью модуляторов контрольных точек, как правило, представляет собой (регуляцию) активацию Т-клеток, пролиферацию Т-клеток и/или функцию Т-клеток. Таким образом, молекулы иммунных контрольных точек регулируют и поддерживают аутотолерантность и продолжительность, и амплитуду физиологических иммунных ответов. Многие молекулы иммунных контрольных точек принадлежат к семейству B7:CD28 или к суперсемейству рецептора фактора некроза опухолей (TNFR) и путем связывания специфических лигандов активируют сигнальные молекулы, для которых характерен рекрутмент в цитоплазматический домен (см. Susumu Suzuki и др.: Current status of immunotherapy. Japanese Journal of Clinical Oncology, 2016: doi: 10.1093/jjco/hyv201 [Epub ahead of print]; см., в частности, таблицу 1).
В течение последнего десятилетия анализировали роль семейства В7 и были идентифицированы новые представители и новые функции этих важных регулирующих Т-клетки молекул (Greenwald R.J., G.J. Freeman и А.Н. Sharpe, The В7 family revisited. Annu Rev Immunol, 23, 2005, cc. 515-548). Семейство B7:CD28 содержит представителей, наиболее часто применяемых в настоящее время при исследованиях иммунных контрольных точек. После изучения исходных и сложных механизмов CTLA-4 - В7-1/В7-2 исследовали представляющую большой интерес пару PD-1 - B7-H1(PDL1)/B7-DC(PD-L2), для которой обнаружено наличие ассоциации со многими имеющими иммунологическое и клиническое значение микроокружениями опухолей (Zou W. и L. Chen, Inhibitory B7-family molecules in the tumour microenvironment. Nat Rev Immunol, 8(6), 2008, cc. 467-477). Другим представителем этого семейства является ICOS-ICOSL/B7-H2, идентифицированный в этот же период времени. Другие представители этого семейства включают В7-Н3 (Chapoval А.I. и др., В7-Н3: a costimulatory molecule for Т cell activation and IFN-gamma production. Nat Immunol, 2(3), 2001, cc. 269-274) и B7-H4 (Sica G.L. и др., B7-H4, a molecule of the B7 family, negatively regulates T cell immunity. Immunity, 18(6), 2003, cc. 849-861), однако к настоящему времени еще не идентифицированы лиганды обоих рецепторов. При этом, известна роль В7-Н3 в противоопухолевом иммунитете (Loos М. и др., B7-h3 and its role in antitumor immunity. Clin Dev Immunol, 2010, 2010, c. 683875) и его роль в ускользании опухоли от иммунологического надзора (Hofmeyer K.A., A. Ray и X. Zang, The contrasting role of B7-H3. Proc Natl Acad Sci US A, 05(30), 2008, cc. 10277-10278), а также его сверхэкспрессия на стадии многих запущенных раков (Zou W. и L. Chen, Inhibitory B7-family molecules in the tumour microenvironment. Nat Rev Immunol, 8(6), 2008, cc. 467-477), в том числе колоректального рака (Sun J. и др., Clinical significance and regulation of the costimulatory molecule B7-H3 in human colorectal carcinoma. Cancer Immunol Immunother, 59(8), 2010, cc. 1163-1171), что позволяет предположить необходимость осуществления исследования в этом направлении. Аналогично этому, В7-Н4 в настоящее время включен в цикл исследований в качестве возможного агента, который воздействует на ускользание опухоли от иммуннологического надзора и противоопухолевый ответ (Dangaj D. и N. Scholler, Blocking the В7-Н4 pathway with novel recombinant antibodies усиливатьs T cell-mediated antitumor responses. Oncoimmunology, 2(8), 2013, c. e25913; Dangaj D. и др., Novel recombinant human b7-h4 antibodies overcome tumoral immune escape to potentiate T-cell antitumor responses. Cancer Res, 73(15), 2013, cc. 4820-4829) или взаимодействует с многими киназными путями (Wang X. и др., В7-Н4 Treatment о/Т Cells Inhibits ERK,]NK, р38, and AKT Activation. PLoS One, 7(1), 2012, с. e28232). Результатом повышенного внимания к этому агенту являются опубликованные данные о конъюгате антитела к В7-Н4-лекарственного средства, предназначенном для лечения рака молочной железы (Leong S.R. и др., An anti-b7-h4 antibody-drug conjugate for the treatment of breast cancer. Mol Pharm, 12(6), 2015, cc. 1717-1729).
CD28 конститутивно экспрессируется почти на всех человеческих CD4+-T-клетках и примерно на половине всех CD8-Т-клеток. Связывание с его двумя лигандами, представляющими собой CD80 (В7-1) и CD86 (В7-2), которые экспрессируются на дендритных клетках, вызывает Т-клеточную экспансию. Костимулирующая молекула контрольной точки CD28 конкурирует с ингибирующей молекулой контрольной точки CTLA4 за одни и те же лиганды CD80 и CD86 (см. Buchbinder Е. I. и Desai A., CTLA-4 and PD-1 Pathways - Similarities, Differences and Implications of Their Inhibition; American Journal of Clinical Oncology, 39(1), 2016, cc. 98-106).
Ассоциированный с цитотоксическими Т-лимфоцитами белок 4 (CTLA4; который обозначают также как CD152) является гомологом CD28 с существенно более высокой аффинностью к В7. Аналогично CD28 лигандами CTLA-4 являются CD80 (В7-1) и CD86 (В7-2). Однако в отличие от CD28 связывание CTLA4 с В7 не продуцирует стимулирующий сигнал, но препятствует костимулирующему сигналу, который в норме обеспечивается CD28. Кроме того, связывание CTLA4 с В7, вероятно, продуцирует даже ингибирующий сигнал, противодействующий симулирующим сигналам, которые образуются при связывании CD28:B7 и TCR:ГКГС. CTLA-4 рассматривается к качестве «лидера» ингибирующих иммунных контрольных точек, поскольку он останавливает развитие потенциально аутореактивных Т-клеток на начальной стадии активации наивных Т-клеток, как правило, в лимфатических узлах (Buchbinder Е.I. и Desai A.: CTLA-4 and PD-1 Pathways: Similarities, Differences and Implications of Their Inhibition; American Journal of Clinical Oncology, 39(1), 2016, cc. 98-106). Предпочтительные ингибиторы контрольной точки CTLA4 включают моноклональные антитела Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и тремелимумаб (фирма Pfizer/MedImmune). Другие предпочтительные ингибиторы CTLA-4 включают антитела к CTLA4, описанные в WO 2001/014424, WO 2004/035607, US 2005/0201994 и ЕР 1212422 В1. Дополнительные предпочтительные антитела к CTLA-4 описаны в US 5811097, US 5855887, US 6051227, US 6984720, WO 01/14424, WO 00/37504, US 2002/0039581 и US 2002/086014. Другие предпочтительные антитела к CTLA-4, которые можно применять в контексте настоящего изобретения, включают, например, антитела, описанные в WO 98/42752; US 6682736 и US 6207156; у Hurwitz и др., Proc. Natl. Acad. Sci. USA, 95(17), 1998, cc. 10067-10071; Camacho и др., J. Clin. Oncology, 22(145), 2004, реферат №2505 (антитело CP-675206); Mokyr и др., Cancer Res., 58, 1998, cc. 5301-5304, в US 5977318, US 6682736, US 7109003 и US 7132281.
Рецептор программируемой клеточной гибели 1 (PD1) имеет два лиганда PD-L1 (который обозначают также как В7-Н1 и CD274) и PD-L2 (который обозначают также как B7-DC и CD273). Путь PD1 регулирует активированные ранее Т-клетки на более поздних стадиях иммунного ответа, прежде всего в периферических тканях. Преимущество направленного воздействия на PD1 обусловлено тем, что он может восстанавливать иммунную функцию в микроокружении опухоли. Предпочтительные ингибиторы пути PD1 включают Opdivo® (ниволумаб; фирма Bristol Myers Squibb), Keytruda® (пембролизумаб; фирма Merck), дурвалумаб (фирма MedImmune/AstraZeneca), MEDI4736 (фирма AstraZeneca; см. WO 2011/066389 А1), атезолизумаб (MPDL3280A, фирма Roche/Genentech; см. US 8217149 В2), пидилизумаб (СТ-011; фирма CureTech), MEDI0680 (АМР-514; фирма AstraZeneca), авелумаб (Merck), MSB-0010718C (фирма Merck), PDR001 (фирма Novartis), BMS-936559 (фирма Bristol Myers Squibb), REGN2810 (фирма Regeneron Pharmaceuticals), MIH1 (фирма Affymetrix), AMP-224 (фирма Amplimmune, GSK), BGB-A317 (фирма BeiGene) и ламбролизумаб (например, описанный как hPD109A и его гуманизированные производные h409A11, h409A16 и h409A17 в WO 2008/156712; у Hamid и др., N. Engl. J. Med. 369, 2013, cc. 134-144).
Индуцибельный костимулятор Т-клеток (ICOS; который обозначают также как CD278) экспрессируется на активированных Т-клетках. Его лигандом является ICOSL (В7-Н2; CD275), который экспрессируется главным образом на В-клетках и дендритных клетках. По-видимому, указанная молекула является важной для эффекторной функции Т-клеток.
В7-Н3 (который обозначают также как CD276) первоначально описан в качестве костимулирующей молекулы, но в настоящее время рассматривается в качестве коингибитора. Предпочтительным ингибитором контрольной точки В7-H3 является моноклональное антитело эноблитузумаб (MGA271; фирма MacroGenics; см. US 2012/0294796 А1) с оптимизированной Fc-областью.
В7-Н4 (который обозначают также как VTCN1) экспрессируется опухолевыми клетками и ассоциированными с опухолью макрофагами и играет роль в ускользании опухоли от иммунологического надзора. Предпочтительными ингибиторами В7-Н4 являются антитела, описанные у Dangaj D. и др., Cancer Research 73(15), 2013, cc. 4820-4829 и в таблице 1, и в соответствующем описании, представленном у Jenessa В. Smith и др., В7-Н4 as а potential target for immunotherapy for gynecologic cancers: A closer look. Gynecol Oncol 134(1), 2014, cc. 181-189. Другие предпочтительные примеры ингибиторов В7-Н4 включают антитела к человеческому В7-Н4, описанные, например, в WO 2013/025779 А1 и WO 2013/067492 А1, или растворимые рекомбинантные формы В7-Н4, такие, как описанные в US 2012/0177645 А1.
Суперсемейство TNF содержит, в частности 19 лигандов белков, связывающихся с 29 цитокиновыми рецепторами. Они участвуют во многих физиологических ответах, таких как апоптоз, воспаление или выживание клеток (Croft М., С.A. Benedict и C.F. Ware, Clinical targeting of the TNF and TNFR superfamilies. Nat Rev Drug Discov, 12(2), 2013, cc. 147-168). Эти повсеместно встречающиеся воздействия делают представителей суперсемейства TNF очень привлекательными для разработки лекарственных средств (более 60 лекарственных средств на основе представителей семейства TNF находились в разработке в 2013 г. (Croft М., С.A. Benedict и C.F. Ware, Clinical targeting of the TNF and TNFR superfamilies. Nat Rev Drug Discov, 12(2), 2013, cc. 147-168)), но в то же время с ними связаны трудности, обусловленные возможными нивелирующими обратными действиями (Aggarwal В.В., Signalling pathways of the TNF superfamily: a double-edged sword. Nat Rev Immunol, 3(9), 2003, cc. 745-756). В публикации Croft M., C.A. Benedict и C.F. Ware, Clinical targeting of the TNF and TNFR superfamilies. Nat Rev Drug Discov, 12(2), 2013, cc. 147-168 предложено уделять первостепенное внимание девяти рецепторам для индикации рака: TNFRSF4 (OX40/0X40L), TNFRSFS (CD40L/CD40), TNFRSF7 (CD27/CD70), TNFRSF8 (CD30/CD30L), TNFRSF9 (4-1BB/4-1BBL), TNFRSF10 (TRAILR/TRAIL)), TNFRSF12 (FN14/TWEAK), TNFRSF13 (BAFFRTACI/APRIL-BAFF) и TNFRSF18 (GITR/GITRL) (Avogadri F. и др., Modulation of CTLA-4 and GITR/or cancer immunotherapy. Curr Top Microbiol Immunol, 344, 2011, cc. 211-244; Naidoo J., D.B. Page и J.D. Wolchok, Immune modulation for cancer therapy. Br J Cancer, 111(12), 2014, cc. 2214-2219). Дополнено применение указанного перечня для иммунотерапий (Bremer Е., Targeting of the tum or necrosis factor receptor superfamily for cancer immunotherapy. ISRN Oncol, 2013, c. 371854), путем включения Fas-лиганда и TNFRSF1 (TNFα/TNFR). Кроме того, путь аттенюатора В- и Т-лимфоцитов (BTLA)/медиатора проникновения вируса герпеса (HVEM) можно рассматривать в качестве мишени для усиления иммунных ответов, что аналогично блокаде CTLA-4 (Croft М., С.A. Benedict и C.F. Ware, Clinical targeting of the TNF and TNFR superfamilies. Nat Rev Drug Discov,12(2), 2013, cc. 147-168). Таким образом, в контексте настоящего изобретения предпочтительными для применения для лечения и/или предупреждения рака являются такие модуляторы контрольных точек, которые модулируют одну или несколько молекул контрольных точек, выбранных из TNFRSF4 (OX40/0X40L), TNFRSFS (CD40L/CD40), TNFRSF7 (CD27/CD70), TNFRSF9 (4-1BB/4-1BBL), TNFRSF18 (GITR/GITRL), FasR/DcR3/Fas-лиганд, TNFRSF1 (TNFα/TNFR), BTLA/HVEM и CTLA4.
ОХ40 (который известен также как CD134 или TNFRSF4) способствует экспансии эффекторных Т-клеток и Т-клеток памяти, но также обладает способностью подавлять дифференцировку и активность регуляторных Т-клеток и регулировать производство цитокинов. Лигандом ОХ40 является OX40L (который обозначают также как TNFSF4 или CD252). ОХ40 кратковременно экспрессируется после контакта с Т-клеточным рецептором и для него характерна повышающая регуляция лишь на только что активированных антигеном Т-клетках в воспалительных повреждениях. Предпочтительные модуляторы контрольных точек в случае ОХ40 включают MEDI6469 (фирма MedImmune/AstraZeneca), MEDI6383 (фирма MedImmune/AstraZeneca), MEDI0562 (фирма MedImmune/AstraZeneca), MOXR0916 (RG7888; фирма Roche/Genentech) и GSK3174998 (фирма GSK).
CD40 (который обозначают также как TNFRSF5) экспрессируется широким разнообразием клеток иммунной системы, включая антигенпрезентирующие клетки. Его лиганд представляет собой CD40L, который называют также CD154 или TNFSF5, он кратковременно экспрессируется на поверхности активированных CD4+-Т-клеток. Передача сигналов CD40 «лицензирует» созревание дендритных клеток и тем самым запускает активацию и дифференцировку Т-клеток. Однако CD40 может экспрессироваться также на опухолевых клетках. Таким образом, стимуляция/активация CD40 у страдающих раком пациентов может оказывать благоприятное или вредное действие. По этой причине создавали обладающие стимулирующим и ингибирующим действием модуляторы указанной иммунной контрольной точки (Sufia Butt Hassan, Jesper Freddie  , Barbara Nicola Olsen и Anders Elm Pedersen, Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104). Предпочтительные примеры модуляторов контрольной точки CD40 включают (I) агонистические антитела к CD, описанные у Sufia Butt Hassan, Jesper Freddie
, Barbara Nicola Olsen и Anders Elm Pedersen, Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104). Предпочтительные примеры модуляторов контрольной точки CD40 включают (I) агонистические антитела к CD, описанные у Sufia Butt Hassan, Jesper Freddie  , Barbara Nicola Olsen и Anders Elm Pedersen: Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104, такие как дацетузумаб (SGN-40), CP-870893, FGK 4.5/FGK 45 и FGK115, предпочтительно дацетузумаб, и (II) антагонистические антитела к CD, описанные у Sufia Butt Hassan, Jesper Freddie
, Barbara Nicola Olsen и Anders Elm Pedersen: Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104, такие как дацетузумаб (SGN-40), CP-870893, FGK 4.5/FGK 45 и FGK115, предпочтительно дацетузумаб, и (II) антагонистические антитела к CD, описанные у Sufia Butt Hassan, Jesper Freddie  , Barbara Nicola Olsen и Anders Elm Pedersen: Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104, такие как лукатумумаб (HCD122, CHIR-12.12). В случае CD40 дополнительные предпочтительные модуляторы иммунной контрольной точки включают SEA-CD40 (фирма Seattle Genetics), ADC-1013 (фирма Alligator Biosciences), APX005M (фирма Apexigen Inc) и RO7009789 (фирма Roche).
, Barbara Nicola Olsen и Anders Elm Pedersen: Anti-CD40-mediated cancer immunotherapy: an update of recent and ongoing clinical trials, Immunopharmacology and Immunotoxicology, 36:2, 2014, cc. 96-104, такие как лукатумумаб (HCD122, CHIR-12.12). В случае CD40 дополнительные предпочтительные модуляторы иммунной контрольной точки включают SEA-CD40 (фирма Seattle Genetics), ADC-1013 (фирма Alligator Biosciences), APX005M (фирма Apexigen Inc) и RO7009789 (фирма Roche).
CD27 (который обозначают также как TNFRSF7) поддерживает антигенспецифическую экспансию наивных Т-клеток и играет важную роль в создании Т-клеток памяти. CD27 является также маркером памяти В-клеток. Кратковременная доступность его лиганда CD70 (который обозначают также как TNFSF7 или CD27L) на лимфоцитах и дендритных клетках регулирует активность CD27. Кроме того, известно, что костимуляция CD27 подавляет функцию эффекторных Th17-клеток. В случае CD27 предпочтительным модулятором иммунной контрольной точки является варлилумаб (фирма Celldex). В случае CD70 предпочтительные модуляторы иммунной контрольной точки включают ARGX-110 (фирма arGEN-X) и SGN-CD70A (фирма Seattle Genetics).
CD137 (который обозначают также как 4-1ВВ или TNFRSF9) является представителем семейства рецептора фактора некроза опухолей (TNF) и с ним в очень значительной степени ассоциирована костимулирующая активность в отношении активированных Т-клеток. В частности, передача сигналов CD137 (через его лиганд CD137L, известный также как TNFSF9 или 4-1BBL) приводит к пролиферации Т-клеток и защищает Т-клетки, в частности, CD8+-Т-клетки, от индуцированной активации гибели клеток. В случае CD137 предпочтительные модуляторы контрольной точки включают PF-05082566 (фирма Pfizer) и урелумаб (фирма BMS).
Глюкокортикоид-индуцированный родственный TNFR-семейству ген (GITR, известный также как TNFRSF18) способствует Т-клеточной экспансии, включая экспансию Treg. Лиганд для GITR (GITRL, TNFSF18) экспрессируется главным образом на антигенпрезентирующих клетках. Установлено, что антитела к GITR усиливают противоопухолевый ответ из-за потери стабильности линии дифференцировки Treg. В случае GITR предпочтительные модуляторы контрольной точки включают BMS-986156 (фирма Bristol Myers Squibb), TRX518 (фирма GITR Inc) и MK-4166 (фирма Merck).
Другой предпочтительной молекулой контрольной точки, которую следует модулировать, является BTLA. Аттенюатор В- и Т-лимфоцитов (BTLA; который обозначают также как CD272) экспрессируется главным образом CD8+-T-клетками, при этом поверхностная экспрессия BTLA постепенно подвергается понижающей регуляции в процессе дифференцировки человеческих CD8+-Т-клеток при переходе от наивного к эффекторному клеточному фенотипу. Однако опухольспецифические человеческие CD8+-Т-клетки экспрессируют высокие уровни of BTLA. Экспрессия BTLA индуцируется в процессе активации Т-клеток, и экспрессия BTLA сохраняется на Th1-клетках, но не на Th2-клетках. Подобно PD1 и CTLA4 BTLA взаимодействует с гомологом В7, таким как В7Н4. Однако в отличие от PD-1 и CTLA-4 для BTLA характерно ингибирование Т-клеток посредством взаимодействия с рецепторами семейства фактора некроза опухолей (TNF-R), а не только с семейством В7 рецепторов клеточной поверхности. BTLA является лигандом для суперсемейства фактора некроза опухолей (рецептора), представителя 14 (TNFRSF14), который обозначают также как медиатор проникновения вируса герпеса (HVEM; Herpesvirus Entry Mediator, который обозначают также как CD270). Комплексы BTLA-HVEM являются негативными регуляторами Т-клеточных иммунных ответов. Предпочтительными ингибиторами BTLA являются антитела, указанные в таблице 1 у Alison Crawford и Е. John Wherry, редакционная статья: Therapeutic potential of targeting BTLA. Journal of Leukocyte Biology 86, 2009, cc. 5-8, в частности, человеческие антитела. Другие предпочтительные в этом контексте антитела, которые блокируют взаимодействие человеческого BTLA с его лигандом, описаны в WO 2011/014438, например, «4С7» описанное в WO 2011/014438.
Другое семейство молекул контрольных точек включает молекулы контрольных точек, которые относятся к двум основным классам молекул главного комплекса гистосовместимости (ГКГС) (молекулы ГКГС класса I и класса II). Их функцией является запуск ответа иммунной системы через соответствующие им пути; Ig-подобный рецептор-киллер (KIR), специфический для класса I, и ген активации лимфоцитов-3 (LAG-3), специфический для класса II, по-видимому, открывают новые иммунотерапевтические стратегии лечения страдающих раком пациентов (Hemon Р. и др., МНС class II engagement by its ligand LAG-3 (CD223) contributes to melanoma resistance to apoptosis. J Immunol, 186(9), 2011, cc. 5173-5183; Thielens A., E. Vivier и F. Romagne, NK cell MHC class I specific receptors (KIR): from biology to clinical intervention. Curr Opin Immunol, 24(2), 2012, cc. 239-245).
Иммуноглобулинподобный рецептор клеток-киллеров (KIR) представляет собой рецептор, специфический для молекул ГКГС класса I, присутствующий на естественных клетках-киллерах. Примером ингибитора KIR является моноклональное антитело лирилумаб (IPH 2102; фирма Innate Pharma/BMS; см. US 8119775 В2 и Benson и др., Blood 120, 2012, cc. 4324-4333).
Передача сигналов гена активации лимфоцитов-3 (LAG3, который обозначают также как CD223) приводит к подавлению иммунного ответа путем воздействия на Treg, а также прямого действия на CD8+-Т-клетки. Предпочтительным примером ингибитора LAG3 является моноклональное антитело к LAG3 BMS-986016 (фирма Bristol-Myers Squibb). Другие предпочтительные примеры ингибитора LAG3 включают LAG525 (фирма Novartis), IMP321 (фирма Immutep) и LAG3-Ig, описанный в WO 2009/044273 А2 и у Brignon и др., Clin. Cancer Res. 15, 2009, cc. 6225-6231, а также мышиные или гуманизированные антитела, блокирующие человеческий LAG3 (например, IMP701, описанное в WO 2008/132601 А1), или полностью человеческие антитела, блокирующие человеческий LAG3 (например, описанные в ЕР 2320940 А2).
Другим путем, связанным с молекулами контрольных точек, является путь TIM-3/GAL9. Т-клеточный иммуноглобулиновый домен и муциновый домен 3 (TIM-3, который обозначают также как HAVcr-2) экспрессируются на активированных человеческих CD4+-Т-клетках и регулируют цитокины, выделяемые Th1 и Th17. TIM-3 действует в качестве негативного регулятора функции Th1/Tc1 путем запуска клеточной гибели посредством взаимодействия с его лигандом галектином-9 (GAL9). TIM-3 представляет собой специфическую для поверхности Т-клеток-хелперов типа 1 молекулу, которая регулирует индукцию периферической толерантности. Так, в современном исследовании продемонстрировано, что антитела к TIM-3 могут существенно усиливать противоопухолевый иммунитет (Ngiow S.F. и др., Anti-TIM3 antibody promotes Т cell IFN-gammamediated antitumor immunity and suppresses established tumors. Cancer Res, 71(10), 2011, cc. 3540-3551). Предпочтительные примеры ингибиторов TIM-3 включают антитела, мишенью которых является человеческий TIM3 (например, описанные в WO 2013/006490 А2) или, в частности, блокирующее антитело к человеческому TIM3 F38-2E2, описанное у Jones и др., J Exp Med. 205 (12), 2008, cc. 2763-2779.
В последние годы предложена новая мишень, обозначенная как СЕАСАМ1 (родственная карциноэмбриональному антигену молекула клеточной адгезии 1), поскольку в современных исследованиях продемонстрирована роль представителей семейства СЕАСАМ в модуляции иммунных ответов, ассоциированных с раком (Huang Y.H. и др., СЕАСАМ1 regulates TIM-3-mediated tolerance and exhaustion. Nature, 517(7534), 2015, cc. 386-390; Gray-Owen S.D. и R.S. Blumberg, CEACAM1: contact-dependent control of immunity. Nat Rev Immunol, 6(6), 2006, cc. 433-446). В случае СЕАСАМ1 предпочтительным модулятором контрольной точки является СМ-24 (фирма сСАМ Biotherapeutics).
Другой новой молекулой иммунной контрольной точки является GARP, которая играет роль в способности опухолей ускользать от надзора иммунной системы пациента. В настоящее время в клинических испытания для кандидата (ARGX-115) продемонстрировано представляющее интерес действие. Таким образом, ARGX-115 является предпочтительным модулятором контрольной точки GARP.
Кроме того, различные группы исследователей продемонстрировали, что другой молекулой контрольной точки, которая может являться мишенью для противораковой терапии, является фосфатидилсерин (который обозначают также как "PS") (Creelan B.C., Update on immune checkpoint inhibitors in lung cancer. Cancer Control, 21(1), 2014, cc. 80-89; Yin Y. и др., Phosphatidylserine-targeting antibody induces M1 macrophage polarization and promotes myeloid-derived suppressor cell differentiation. Cancer Immunol Res, 1(4), 2013, cc. 256-268). В случае фосфатидилсерина (PS) предпочтительным модулятором контрольной точки является бавитуксимаб (фирма Peregrine).
Другим путем, связанным с контрольными точками, является CSF1/CSF1R (Zhu Y. и др., CSF1/CSF1R Blockade Reprograms Tumor-Infiltrating Macrophages and Improves Response to T-cell Checkpoint Immunotherapy in Pancreatic Cancer Models. Cancer Research, 74(18), 2014, cc. 5057-5069). Предпочтительные модуляторы контрольной точки CSF1R включают FPA008 (фирма FivePrime), IMC-CS4 (фирма Eli-Lilly), PLX3397 (фирма Plexxicon) и RO5509554 (фирма Roche).
Кроме того, изучена роль рецептора естественных клеток-киллеров CD94/NKG2A в карциноме шейки матки (Sheu B.C. и др., Up-regulation of inhibitory natural killer receptors CD94/NKG2A with suppressed intracellular perforin expression of tumor infiltrating CD8+ T lymphocytes in human cervical carcinoma. Cancer Res, 65(7), 2005, cc. 2921-2929) и лейкозе (Tanaka J. и др., Cytolytic activity against primary leukemic cells by inhibitory NK cell receptor (CD94/NKG2A)-expressing T cells expanded from various sources of blood mononuclear cells. Leukemia, 19(3), 2005, cc. 486-489). Предпочтительным модулятором контрольной точки NKG2A является IPH2201 (фирма Innate Pharma).
Другой предпочтительной молекулой контрольной точки является IDO, фермент индоламин-2,3-диоксигеназа из кинуренинового пути (Bal, H.J. и др., Indoleamine 2,3-dioxygenase-2; a new enzyme in the kynurenine pathway. Int J Biochem Cell Biol, 41(3), 2009, cc. 467-471). Индоламин-2,3-диоксигеназа (IDO) представляет собой фермент, участвующий в катаболизме триптофана, который обладает способностью ингибировать иммунный ответ. Известно, что IDO подавляет Т- и NK-клетки, участвует в создании и активирует Treg и клетки-супрессоры миелоидного происхождения и усиливает ангиогенез опухолей. Для IDO1 характерна сверхэкспрессия при многих типах рака, и установлена его способность обеспечивать ускользание опухолевых клеток от иммунной системы (Liu X. И др., Selective inhibition of ID01 effectively regulates mediators of antitumor immunity. Blood, 115(17), 2010, cc. 3520-3530; Ino K. и др., Inverse correlation between tumoral indoleamine 2,3-dioxygenase expression and tumor-infiltrating lymphocytes in endometrial cancer: its association with disease progression and survival. Clin Cancer Res, 14(8), 2008, cc. 2310-2317) и способствовать развитию хронических опухолей при индукции местным воспалением (Muller A.J. и др., Chronic inflammation that facilitates tumor progression creates local immune suppression by inducing indoleamine 2,3 dioxygenase. Proc Natl Acad Sci US A, 105(44), 2008, cc. 17073-17078). Предпочтительные ингибиторы IDO включают экзигуамин А, эпакадостат (INCB024360; фирма InCyte), индоксимод (фирма NewLink Genetics), NLG919 (фирма NewLink Genetics/Genentech), GDC-0919 (фирма NewLink Genetics/Genentech), F001287 (фирма Flexus Biosciences/BMS) и малые молекулы, такие как 1-метилтриптофан, частности, 1-метил-[D]-триптофан и ингибиторы IDO, перечисленные в таблице 1 у Sheridan С, IDO inhibitors move center stage in immune-oncology; Nature Biotechnology 33, 2015, cc. 321-322.
Другой предпочтительной молекулой контрольной точки, которую можно модулировать, является также представитель кинуренинового пути метаболизма: TDO (триптофан-2,3-диоксигеназа). В нескольких исследованиях уже продемонстрированы свойства, представляющие интерес с точки зрения участия TDO в противораковом иммунитете и аутоиммунитете (Garber K., Evading immunity: new enzyme implicated in cancer. J Natl Cancer Inst, 104(5), 2012, cc. 349-352; Platten M., W. Wick и B.J. Van den Eynde, Tryptophan catabolism in cancer: beyond !DO and tryptophan depletion. Cancer Res, 72(21):, 2012, cc. 5435-5440; Platten M. и др., Cancer Immunotherapy by Targeting IDO1/TDO and Their Downstream Effectors. Front Immunol, 5, 2014, c. 673).
Другой предпочтительной молекулой контрольной точки, которую можно модулировать, является A2AR. Рецептор аденозина А2А (A2AR) рассматривается в качестве важной контрольной точки в противораковой терапии, поскольку в микроокружении опухоли, как правило, присутствуют относительно высокое концентрации аденозина, который активирует A2AR. Указанная передача сигналов создает иммунную петлю отрицательной обратной связи в иммунном микроокружении опухоли (см. обзор Robert D. Leone и др., A2aR antagonists: Next generation checkpoint blockade for cancer immunotherapy. Computational and Structural Biotechnology Journal 13, 2015, cc. 265-272). Предпочтительные ингибиторы A2AR включают истрадефиллин, PBS-509, ST1535, ST4206, тозаденант, V81444, преладенант, випаденант, SCH58261, SYN115, ZM241365 и FSPTP.
Другой предпочтительной молекулой контрольной точки, которую можно модулировать, является VISTA. V-доменный иммуноглобулиновый (Ig) супрессор активации Т-клеток (VISTA; который обозначают также как C10orf54) экспрессируется прежде всего на гематопоэтических клетках, при этом устойчивая экспрессия VISTA на лейкоцитах внутри опухолей может обеспечивать осуществляемую VISTA эффективную блокаду в широком диапазоне солидных опухолей. Предпочтительным ингибитором VISTA является JNJ-61610588 (фирма ImmuNext), антитело к VISTA, которое в настоящее время проходит фазу 1 клинического испытания.
Другой молекулой иммунной контрольной точки является CD122. CD122 представляет собой бета-субъединицу рецептора интерлейкина-2. CD122 повышает пролиферацию эффекторных CD8+-Т-клеток.
Наиболее предпочтительные примеры молекул контрольных точек включают молекулы «CTLA4-пути» и «PD1-пути», в которые входят CTLA4 и его лиганды CD80 и CD86, а также PD1 и его лиганды PD-L1 и PD-L2 (более подробно CTLA4- и PD-1-пути, а также и их дополнительные компоненты описаны у Buchbinder Е.I. и Desai A., CTLA-4 and PD-1 Pathways - Similarities, Differences and Implications of Their Inhibition; American Journal of Clinical Oncology, 39(1), 2016, cc. 98-106). В целом, предпочтительные молекулы контрольных точек включают CD27, CD28, CD40, CD122, CD137, ОХ40, GITR, ICOS, A2AR, B7-H3, B7-H4, BTLA, CD40, CTLA-4, IDO, KIR, LAG3, PD-1, TIM-3, VISTA, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, GITR, TNFR и/или FasR/DcR3, а также, в частности, их лиганды.
Молекулы иммунных контрольных точек ответственны за костимулирующие или ингибирующие взаимодействия с Т-клеточными ответами. Таким образом, молекулы контрольных точек можно подразделять на (I) (ко-)стимулирующие молекулы контрольных точек и (II) ингибирующие молекулы контрольных точек. Как правило, (ко-)стимулирующие молекулы контрольных точек действуют позитивно касательно сигнала Т-клеточного рецептора (TCR), индуцированного антигенной стимуляцией, а ингибирующие молекулы контрольных точек негативно регулируют TCR-сигнал. Примеры (ко-)стимулирующих молекул контрольных точек включают CD27, CD28, CD40, CD122, CD137, ОХ40, GITR и ICOS. Примеры ингибирующих молекул контрольных точек включают CTLA4, а также PD1 и его лиганды PD-L1 и PD-L2; и A2AR, В7-Н3, В7-Н4, BTLA, IDO, KIR, LAG3, TIM-3, VISTA, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, TNFR и FasR/DcR3.
Предпочтительно модулятор иммунных контрольных точек представляет собой активатор (ко-)стимулирующей молекулы контрольной точки или ингибитор ингибирующей молекулы контрольной точки или их комбинацию. Таким образом, модулятор иммунных контрольных точек более предпочтительно представляет собой (I) активатор CD27, CD28, CD40, CD122, CD137, ОХ40, GITR и/или ICOS или (II) ингибитор A2AR, В7-Н3, В7-Н4, BTLA, CD40, CTLA-4, IDO, KIR, LAG3, PD-1, PDL-1, PD-L2, TIM-3, VISTA, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, TNFR и/или FasR/DcR3.
Как описано выше, известен ряд модуляторов (ингибиторов/активаторов) CD27, CD28, CD40, CD122, CD137, ОХ40, GITR, ICOS, A2AR, В7-Н3, В7-Н4, CTLA-4, PD1, PDL-1, PD-L2, IDO, LAG-3, BTLA, TIM3, VISTA, KIR, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, TNFR и/или FasR/DcR3, и некоторые из них уже проходят клинические испытания или даже одобрены. На основе указанных известных модуляторов иммунных контрольных точек можно разрабатывать в (ближайшем) будущем альтернативные модуляторы иммунных контрольных точек. В частности, известные модуляторы предпочтительных иммунных контрольных точек можно применять в немодифицированном виде или можно использовать их аналоги, в частности, химерные, гуманизированные или человеческие формы антител.
Более предпочтительно модулятор иммунной контрольной точки представляет собой ингибитор ингибирующей молекулы контрольной точки (но предпочтительно не является ингибитором стимулирующей молекулы контрольной точки). Таким образом, еще более предпочтительно модулятор иммунной контрольной точки является ингибитором A2AR, В7-Н3, В7-Н4, BTLA, CTLA-4, IDO, KIR, LAG3, PD-1, PDL-1, PD-L2, TIM-3, VISTA, СЕАСАМ1, GARP, PS, CSF1R, CD94/NKG2A, TDO, TNFR и/или DcR3 или их лигандов.
Предпочтительно также модулятор иммунной контрольной точки представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки (но предпочтительно не является активатором ингибирующей молекулы контрольной точки). Таким образом, более предпочтительно модулятор иммунной контрольной точки является активатором CD27, CD28, CD40, CD122, CD137, ОХ40, GITR и/или ICOS или их лигандов.
Еще более предпочтительно модулятор иммунной контрольной точки является модулятором пути CD40, пути IDO, пути CTLA-4 и/или пути PD-1. В частности, модулятор иммунной контрольной точки предпочтительно является модулятором CD40, CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO, более предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO или активатором CD40, еще более предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4, PD-L1, PD-1 и/или IDO и наиболее предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4 и/или PD-1.
Еще более предпочтительно модулятор иммунной контрольной точки является модулятором пути CD40, пути IDO, пути LAG3, пути CTLA-4 и/или пути PD-1. В частности, модулятор иммунной контрольной точки предпочтительно является модулятором CD40, LAG3, CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO, более предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4, PD-L1, PD-L2, PD-1, LAG3 и/или IDO или активатором CD40, еще более предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4, PD-L1, PD-1, LAG3 и/или IDO, еще более предпочтительно модулятор иммунной контрольной точки является ингибитором LAG3, CTLA-4 и/или PD-1 и наиболее предпочтительно модулятор иммунной контрольной точки является ингибитором CTLA-4 и/или PD-1.
Таким образом, модулятор контрольной точки можно выбирать из известных модуляторов пути CD40, пути CTLA-4 или пути PD-1. Предпочтительно модулятор контрольных точек можно выбирать из известных модуляторов пути CD40, пути LAG3, пути CTLA-4 или пути PD-1. Предпочтительные ингибиторы пути CTLA-4 и пути PD-1 включают моноклональные антитела Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и тремелимумаб (фирма Pfizer/MedImmune), а также Opdivo® (ниволумаб; фирма Bristol Myers Squibb), Keytruda® (пембролизумаб; фирма Merck), дурвалумаб (фирма MedImmune/AstraZeneca), MEDI4736 (фирма AstraZeneca; см. WO 2011/066389 A1), MPDL3280A (фирма Roche/Genentech; см. US 8217149 В2), пидилизумаб (СТ-011; фирма CureTech), MEDI0680 (АМР-514; фирма AstraZeneca), MSB-0010718C (фирма Merck), MIH1 (фирма Affymetrix) и ламбролизумаб (например, обозначенный как hPD109A и его гуманизированные производные h409A11, h409A16 и h409A17, описанные в WO 2008/156712; у Hamid и др., N. Engl. J. Med. 369, 2013, cc. 134-144). Более предпочтительные ингибиторы контрольных точек включают ингибиторы CTLA-4 Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и тремелимумаб (фирма Pfizer/MedImmune), а также ингибиторы PD-1 Opdivo® (ниволумаб; фирма Bristol Myers Squibb), Keytruda® (пембролизумаб; фирма Merck), пидилизумаб (СТ-011; фирма CureTech), MEDI0680 (АМР-514; фирма AstraZeneca), АМР-224 и ламбролизумаб (например, обозначенный как hPD109A и его гуманизированные производные h409A11, h409A16 и h409A17, описанные в WO 2008/156712; у Hamid и др., N. Engl. J. Med. 369, 2013, cc. 134-144). Как описано выше, предпочтительным примером ингибитора LAG3 является моноклональное антитело к LAG3 BMS-986016 (фирма Bristol-Myers Squibb). Другие предпочтительные примеры ингибитора LAG3 включают LAG525 (фирма Novartis), IMP321 (фирма Immutep) и LAG3-Ig, описанные в WO 2009/044273 А2 и у Brignon и др., Clin. Cancer Res. 15, 2009, cc. 6225-6231, а также мышиные или гуманизированные антитела, блокирующие человеческий LAG3 (например, IMP701, описанный в WO 2008/132601 А1), или полностью человеческие антитела, блокирующие человеческий LAG3 (например, описанные в ЕР 2320940 А2).
Предпочтительно модулятор иммунных контрольных точек не представляет собой модулятор CD40. В частности, предпочтительно модулятор иммунных контрольных точек не представляет собой лиганд CD40. Предпочтительно также модулятор иммунных контрольных точек не представляет собой антитело к CD40.
В контексте настоящего изобретения предпочтительно применяют более одного модулятора иммунных контрольных точек (например, ингибитора контрольных точек), в частности, применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек (например, ингибиторов контрольных точек), предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек (например, ингибиторов контрольных точек), более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек (например, ингибиторов контрольных точек), еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек (например, ингибиторов контрольных точек) и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек (например, ингибиторов контрольных точек). Так, «различные» модуляторы иммунных контрольных точек (например, ингибиторы контрольных точек) означает, в частности, что они модулируют (например, ингибируют) пути различных молекул контрольных точек.
Предпочтительно ингибитор пути PD-1 объединяют с ингибитором пути CTLA-4. Например, как описано выше, комбинированная терапия на основе ниволумаба (антитело к PD1) и ипилимумаба (антитело к CTLA4) одобрена FDA в 2015 г. для лечения пациентов с BRAF V600 дикого типа, т.е. нерезектабельной или метастатической меланомы. Кроме того, в последние годы получены данные об успешном проведении фазы 1b испытания комбинации дурвалумаба и тремелимумаба в отношении немелкоклеточного рака легких (Antonia, Scott и др., Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study; Lancet Oncol. 5 февраля 2016 г.. pii: S1470-2045(15)00544-6. doi: 10.1016/S1470-2045(15)00544-6, (Epub ahead of print)). Таким образом, предпочтительными комбинациями модуляторов иммунных контрольных точек пути PD-1 и пути CTLA-4 являются (I) ниволумаб (антитело к PD1) и ипилимумаб (антитело к CTLA4) или (II) дурвалумаб (MEDI4736; антитело к PD-L1) и тремелимумаб (антитело к CTLA4). Предпочтительными являются также их комбинации, например, ниволумаба (антитело к PD1) и тремелимумаба (антитело к CTLA4) или дурвалумаба (MEDI4736; антитело к PD-L1) и ипилимумаба (антитело к CTLA4).
Другие предпочтительные комбинации по меньшей мере двух различных модуляторов иммунных контрольных точек в контексте настоящего изобретения могут содержать комбинацию, выбранную из (I) комбинации ингибитора KIR и ингибитора CTLA-4, такой как лирилумаб/ипилимумаб; (II) комбинации ингибитора KIR и ингибитора пути PD-1, такого как ингибитор PD-1, например, лирилумаб/ниволумаб; (III) комбинации ингибитора LAG3 и ингибитора пути PD-1, такого как ингибитор PD-1 или ингибитор PD-L1, например, описанной у Woo и др., Cancer Res. 72, 2012, cc. 917-927 или у Butler N. S. и др., Nat Immunol. 13, 2011, cc. 188-195), и предпочтительные примеры указанной комбинации включают ниволумаб/BMS-986016 и PDR001/LAG525; (IV) комбинации модуляторов контрольных точек, направленных против ICOS, и ингибитора CTLA-4, например, описанной у Fu и др., Cancer Res. 71, 2011, cc. 5445-5454; (V) комбинации модуляторов контрольных точек, которые модулируют 4-1ВВ, и ингибиторов CTLA-4, описанной у Curran и др., PLoS One 6(4), 2011, el 9499); (VI) комбинации модуляторов контрольных точек, направленных против PD1 и CD27, такой как ниволумаб/варлилумаб и атезолизумаб/варлилумаб; (VII) комбинации модуляторов контрольных точек, направленных против ОХ40 и CTLA-4, такой как MEDI6469/тремелимумаб; (VIII) комбинации модуляторов контрольных точек, направленных против ОХ40 и PD-1, такой как MEDI6469/MEDI4736, MOXR0916/MPDL3280A, MEDI6383/MEDI4736 и GSK3174998/пембролизумаб; (IX) комбинации модуляторов контрольных точек, направленных против PD-1 и 4-1ВВ, такой как ниволумаб/урелумаб, пембролизумаб/PF-05082566 и авелумаб/PF-05082566; (X) комбинации модуляторов контрольных точек, направленных против PD-1 и IDO, такой как ипилимумаб/индоксимод, пембролизумаб/INCB024360, MEDI4736/ INCB024360, MPDL3280A/GDC-0919 и атезолизумаб/INCB024360; (XI) комбинации модуляторов контрольных точек, направленных против PD-1 и CSF1R, такой как пембролизумаб/PLX3397, ниволумаб/FPA008 и MPDL3280A/RO5509554; (XII) комбинации модуляторов контрольных точек, направленных против PD-1 и GITR, такой как ниволумаб/BMS-986156 и пембролизумаб/MK-4166; (XIII) комбинации модуляторов контрольных точек, направленных против PD-1 и CD40, такой как MPDL3280A/RO7009789; (XIV) комбинации модуляторов контрольных точек, направленных против PD-1 и В7-Н3, такой как пембролизумаб/MGA271; (XV) комбинации модуляторов контрольных точек, направленных против CTLA-4 и В7-Н3, такой как ипилимумаб/MGA271, и (XVI) комбинации модуляторов контрольных точек, направленных против KIR и 4-1ВВ, такой как лирилумаб/урелумаб.
Наиболее предпочтительно комбинация модулятора иммунных контрольных точек и комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, предлагаемая для применения согласно настоящему изобретению, содержит по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1. Примеры указанной предпочтительной комбинации включают комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и Opdivo® (ниволумаб; Bristol Myers Squibb), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и Keytruda® (пембролизумаб; фирма Merck), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и дурвалумаба (фирма MedImmune/AstraZeneca), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и MEDI4736 (фирма AstraZeneca; см. WO 2011/066389 A1), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и MPDL3280A (фирма Roche/Genentech; см. US 8217149 В2), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и пидилизумаба (СТ-011; фирма CureTech), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и MEDI0680 (AMP-514; фирма AstraZeneca), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и MSB-0010718C (фирма Merck), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и MIH1 (фирма Affymetrix), комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и AMP-224, комбинацию Yervoy® (ипилимумаб; фирма Bristol Myers Squibb) и ламбролизумаба, комбинацию тремелимумаба (фирма Pfizer/MedImmune) и Opdivo® (ниволумаб; фирма Bristol Myers Squibb), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и Keytruda® (пембролизумаб; фирма Merck), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и дурвалумаба (фирма MedImmune/AstraZeneca), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и MEDI4736 (фирма AstraZeneca; см. WO 2011/066389 А1), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и MPDL3280A (фирма Roche/Genentech; см.. US 8217149 В2), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и пидилизумаба (СТ-011; фирма CureTech), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и MEDI0680 (АМР-514; фирма AstraZeneca), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и MSB-0010718С (фирма Merck), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и MIH1 (фирма Affymetrix), комбинацию тремелимумаба (фирма Pfizer/MedImmune) и АМР-224 и комбинацию тремелимумаба (фирма Pfizer/MedImmune) и ламбролизумаба.
В контексте настоящего изобретения предпочтительно также применяют более одного модулятора иммунных контрольных точек (например, ингибитора контрольных точек) одного и того же пути контрольных точек, в частности, применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 модуляторов контрольных точек (например, ингибиторов контрольных точек) одного и того же пути контрольных точек, предпочтительно применяют 2, 3, 4 или 5 модуляторов контрольных точек (например, ингибиторов контрольных точек) одного и того же пути контрольных точек, более предпочтительно применяют 2, 3 или 4 модулятора контрольных точек (например, ингибитора контрольных точек) одного и того же пути контрольных точек, еще более предпочтительно применяют 2 или 3 модулятора контрольных точек (например, ингибитора контрольных точек) одного и того же пути контрольных точек и наиболее предпочтительно применяют 2 модулятора иммунных контрольных точек (например, ингибитора контрольных точек) одного и того же пути контрольных точек. Предпочтительными путями контрольных точек, подлежащих модулированию, являются путь PD-1, путь CTLA-4, путь CD40 или путь IDO, более предпочтительно путь PD-1, путь CTLA-4 или путь CD40 и еще более предпочтительно путь PD-1 или путь CTLA-4. Например, комбинацию MEDI4736 и MEDI0680 можно применять для модуляции, в частности, ингибирования пути PD-1.
В контексте настоящего изобретения модуляторы иммунных контрольных точек могут относиться к любому типу молекулы или агента, если они полностью или частично снижают, ингибируют, взаимодействуют с, активируют, стимулируют, повышают, усиливают или поддерживают функцию одной или нескольких молекул контрольных точек, описанных выше. В частности, модулятор иммунных контрольных точек связывается с одной или несколькими молекулами контрольных точек, такими как белки контрольных точек или их предшественники, например, на уровне ДНК или РНК, модулируя тем самым (например, полностью или частично снижая, ингибируя, взаимодействуя с, активируя, повышая, усиливая или поддерживая) функцию одной или нескольких молекул контрольных точек, описанных выше. Предпочтительными модуляторами иммунных контрольных точек являются олигонуклеотиды, siРНК, shРНК, рибозимы, молекулы антисмысловых РНК, иммунотоксины, низкомолекулярные ингибиторы и антитела или их антигенсвязывающие фрагменты (например, блокирующие молекулы контрольных точек, антагонисты или агонисты молекул контрольных точек).
Предпочтительно модулятор иммунных контрольных точек представляет собой олигонуклеотид. Указанный олигонуклеотид предпочтительно применяют для снижения уровня экспрессии белка, в частности, снижения уровня экспрессии белков контрольных точек, таких как описанные выше рецепторы или лиганды контрольных точек. Олигонуклеотиды представляют собой короткие молекулы ДНК или РНК, как правило, состоящие из 2-50 нуклеотидов, предпочтительно из 3-40 нуклеотидов, более предпочтительно из 4-30 нуклеотидов и еще более предпочтительно из 5-25 нуклеотидов, например, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов. Олигонуклеотиды, как правило, создают в лаборатории путем твердофазного химического синтеза. Олигонуклеотиды могут быть одноцепочечными или двухцепочечными, однако, в контексте настоящего изобретения олигонуклеотид предпочтительно является одноцепочечным. Более предпочтительно олигонуклеотид, являющийся модулятором контрольной точки, представляет собой антисмысловой олигонуклеотид. Антисмысловые олигонуклеотиды представляют собой одноцепочечные ДНК или РНК, которые являются комплементарными выбранной последовательности, в частности, последовательности, выбранной из последовательности ДНК или РНК (или ее фрагмента) белка контрольной точки. Антисмысловую РНК, как правило, применяют для предупреждения трансляции белка с цепей матричной РНК, например, мРНК белка контрольной точки, путем связывания с мРНК. Антисмысловую ДНК, как правило, применяют для таргетинга специфической комплементарной (кодирующей или некодирующей) РНК. Если имеет место связывание, то указанный гибрид ДНК/РНК может расщепляться ферментом RHКазой Н. Кроме того, морфолиновые антисмысловые олигонуклеотиды можно применять для «выключения» (нокдауна) гена у позвоночных животных. Например, Kryczek с соавторами в 2006 г. (Kryczek I, Zou L, Rodriguez P, Zhu G, Wei S, Mottram P и др., B7-H4 expression identifies a novel suppressive macrophage population in human ovarian carcinoma. J Exp Med. 203, 2006, cc. 871-81) создали В7-Н4-специфический морфолиновый агент, который специфически блокировал экспрессию В7-Н4 в макрофагах, приводя к повышенной пролиферации Т-клеток и уменьшению объемов опухолей у мышей со специфическими для ассоциированного с опухолью антигена (ТАА) Т-клетками.
Предпочтительно модулятор иммунных контрольных точек представляет собой siРНК. Малая интерферирующая РНК (siРНК), которую иногда обозначают как короткая интерферирующая РНК или обеспечивающая молчание РНК, относится к классу двухцепочечных молекул РНК, которые, как правило, состоят из 20-25 пар оснований. В пути РНК-интерференции (РНКi) siРНК влияет на экспрессию специфических генов, таких как гены, кодирующие белки контрольных точек, с помощью комплементарных нуклеотидных последовательностей. Функции siРНК, приводящие к расщеплению мРНК после транскрипции, приводят к отсутствию трансляции. Трансфекцию экзогенной siРНК можно применять для нокдауна гена, однако действие может быть лишь кратковременным, прежде всего в быстро делящихся клетках. Для преодоления этого можно применять, например, модификацию РНК или использовать экспрессирующий вектор для siРНК. Последовательность siРНК можно модифицировать также для интродукции короткой петли между цепями. Образовавшийся транскрипт представляет собой короткую РНК, образующую шпильку (shРНК, которую обозначают также как «малая РНК, образующая шпильку»), которую можно процессировать в функциональную siРНК с помощью фермента Dicer в ее обычный формат. shРНК является предпочтительным медиатором РНКi благодаря ее относительно небольшой скорости расщепления и метаболизма. Таким образом, модулятор иммунных контрольных точек предпочтительно представляет собой shРНК. Для применения shРНК, как правило, требуется экспрессионный вектор, например, плазмида или вирусный или бактериальный вектор.
Предпочтительно модулятор иммунных контрольных точек представляет собой иммунотоксин. Иммунотоксины представляют собой химерные белки, которые содержат таргетирующий фрагмент (такой как антитело), мишенью которого, как правило, является антиген на определенной клетке, такой как раковая клетка, связанный с токсином. В контексте настоящего изобретения предпочтительным является иммунотоксин, содержащий таргетирующий фрагмент, мишенями которого является молекула контрольной точки. Когда иммунотоксин связывается с клеткой, несущей антиген, например, молекулу контрольной точки, то он поглощается посредством эндоцитоза, и затем токсин может убивать клетку. Иммунотоксины предпочтительно содержат (модифицированное) антитело или фрагмент антитела, связанный с токсином (его фрагментом). Для соединения можно применять методы, хорошо известные в данной области, и аналогичные методы, указанные в настоящем описании, для соединения компонентов комплекса. Таргетирующая область иммунотоксина, как правило, содержит Fab-фрагмент антитела, мишенями которого является специфический тип клеток. Токсин, как правило, представляет собой цитотоксин, такой как белок, имеющий происхождение из бактериального или растительного белка, из которого встречающийся в естественных условиях связывающий домен удален, что позволяет таргетирующему фрагменту иммунотоксина направлять токсин к антигену на клетке-мишени. Однако иммунотоксины могут содержать также таргетирующий фрагмент, отличный от антитела или фрагмента антитела, такой как фактор роста. Например, рекомбинантные слитые белки, содержащие токсин и фактор роста, также обозначают как рекомбинантные иммунотоксины.
Предпочтительно модулятор иммунных контрольных точек представляет собой низкомолекулярное лекарственное средство (которое обозначают также как «низкомолекулярный ингибитор»). Низкомолекулярное лекарственное средство представляет собой органическое соединение с небольшой молекулярной массой (вплоть до 900 Да), которое, как правило, взаимодействует с биологическим процессом (регулирует его). В контексте настоящего изобретения низкомолекулярное лекарственное средство, являющееся модулятором иммунных контрольных точек, представляет собой органическое соединение с молекулярной массой, не превышающей 900 Да, которое полностью или частично снижает, ингибирует, взаимодействует с или негативно модулирует функцию одной или нескольких молекул контрольных точек, описанных выше. Верхний предел молекулярной массы, составляющий 900 Да, обеспечивает возможность быстрой диффузии через клеточные мембраны и оральную биодоступность. Более предпочтительно молекулярная масса низкомолекулярного лекарственного средства, представляющего собой модулятор иммунных контрольных точек, составляет не более 500 Да. Например, различные известные в данной области антагонисты A2AR представляют собой органические соединения с молекулярной массой менее 500 Да.
Наиболее предпочтительно модулятор иммунных контрольных точек представляет собой антитело или его антигенсвязывающий фрагмент, в частности, антитела или их антигенсвязывающие фрагменты, которые связываются с рецепторами иммунных контрольных точек, или антитела, которые связываются с лигандами рецепторов иммунных контрольных точек. Предпочтительно указанные антитела или их антигенсвязывающие фрагменты являются агонистами или антагонистами рецепторов иммунных контрольных точек или лигандов рецепторов иммунных контрольных точек. Примеры модуляторов контрольных точек, относящихся к типу антител, включают описанные выше одобренные в настоящее время модуляторы иммунных контрольных точек, а именно, Yervoy® (ипилимумаб; фирма Bristol Myers Squibb), Opdivo® (ниволумаб; фирма Bristol Myers Squibb) и Keytruda® (пембролизумаб; фирма Merck), и другие антитела к рецепторам контрольных точек или лигандам рецепторов контрольных точек, которые описаны выше.
В контексте настоящего описания понятие «антитело» включает различные формы антител, предпочтительно моноклональные антитела, включая (но, не ограничиваясь только ими) полные антитела, фрагменты антител, человеческие антитела, химерные, гуманизированные антитела и генетически сконструированные антитела (варианты антител или мутантные антитела), если они сохраняют характерные свойства, предлагаемые в изобретении, это означает, что антитело (или его антигенсвязывающий фрагмент) модулирует (например, полностью или частично, снижает, ингибирует, взаимодействует с, активирует, стимулирует, повышает, усиливает или поддерживает) функцию одной или нескольких молекул контрольных точек, описанных выше. В частности, антитело (или его антигенсвязывающий фрагмент) опосредует указанную функцию путем связывания с молекулой контрольной точки. Таким образом, антитело (или его антигенсвязывающий фрагмент) предпочтительно представляет собой «блокирующее» антитело (или его антигенсвязывающий фрагмент), в частности, «антагонистическое» антитело (или его антигенсвязывающий фрагмент), или «агонистическое» антитело (или его антигенсвязывающий фрагмент). В частности, понятие «антитело» включает, если не указано иное, как гликозилированные, так и негликозилированные иммуноглобулины любого изотипа или подкласса (предпочтительно IgG) или его антигенсвязывающую область, которая конкурирует с интактным антителом за специфическое связывание. Предпочтительные примеры антител включают моноклональные антитела, биспецифические антитела, миниантитела (минибоди), доменные антитела, синтетические антитела, миметики антител, химерные антитела, гуманизированные антитела, человеческие антитела, слияния антител, конъюгаты антител, одноцепочечные антитела, производные антител, аналоги антител и их фрагменты соответственно. Если не указанное иное, то понятие «антитело» включает в дополнение к антителам, которые содержат две полноразмерные тяжелые цепи и две полноразмерные легкие цепи, их производные, варианты и фрагменты. В некоторых случаях «антитело» может включать меньшее количество цепей. Особенно предпочтительными являются человеческие или гуманизированные моноклональные антитела и/или рекомбинантные антитела, прежде всего рекомбинантные человеческие моноклональные антитела. Наиболее предпочтительными являются человеческие антитела IgG-типа.
В контексте настоящего описания подразумевается, что понятие «человеческое антитело» включает антитела, которые имеют вариабельные и константные области, полученные из последовательностей иммуноглобулинов зародышей линии человека. Человеческие антитела хорошо известны в данной области (van Dijk, М.А. и van de Winkel, J.G., Curr. Opin. Chem. Biol. 5, 2001, cc. 368-374). Человеческие антитела можно получать также в трансгенных животных (например, мышах), которые способны после иммунизации продуцировать полный спектр человеческих антител или отобранные антитела в отсутствии производства эндогенного иммуноглобулина. Перенос массива генов иммуноглобулинов зародышевой линии человека в указанных мышей с мутантной зародышевой линией приводит к производству человеческих антител после контрольного заражения антигеном (см., например, Jakobovits А. и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 2551-2555; Jakobovits А. и др., Nature 362, 1993, cc. 255-258; Bruggemann M. и др., Year Immunol. 7, 1993, c. 3340). Человеческие антитела можно получать также в фаговых дисплейных библиотеках (Hoogenboom Н.R. и Winter G., J. Mol. Biol. 227, 1992, cc. 381-388; Marks J.D. и др., J. Mol. Biol. 222, 1991, cc. 581-597). Для получения человеческих моноклональных антител можно применять также методы, описанные у Cole с соавторами и Boerner с соавторами (Cole и др., Monoclonal Antibodies and Cancer Therapy, изд-во Alan R. Liss, 1985, c. 77; и Boerner P. и др., J. Immunol. 147, 1991, cc. 86-95). В контексте настоящего описания понятие «человеческое антитело» включает также модифицированные антитела, например, в вариабельной области, для создания свойств, предлагаемых в изобретении.
В контексте настоящего описания подразумевается, что понятие «рекомбинантное антитело» включает все антитела, которые получают, экспрессируют, создают или выделяют с использованием методов рекомбинации, например, антитела, выделенные из клетки-хозяина, такой, например, как СНО-клетка, или из животного (например, мыши), которое является трансгенным, например, по генам иммуноглобулинов человека, или антитела, которые экспрессируют с использованием рекомбинантного экспрессионного вектора, которым трансфектируют клетку-хозяина. Таким образом, рекомбинантные антитела представляют собой антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинации, такие как (I) антитела, выделенные из животного (например, мыши), трансгенного по генам иммуноглобулина человека, или из полученной из него гибридомы, (II) антитела, выделенные из клетки-хозяина, трансфектированной для экспрессии антитела, например, из трансфектомы, (III) антитела, выделенные из комбинаторной библиотеки рекомбинантных антител, и (IV) антитела, полученные, экспрессированные, созданные или выделенные с помощью любых других методов, включая сплайсинг последовательностей генов иммуноглобулинов или других последовательностей ДНК. Указанные антитела могут иметь вариабельные и константные области, происходящие из последовательностей иммуноглобулинов зародышевой линии двух различных видов животных. Предпочтительно применяют также антитела, подвергнутые мутагенезу in vitro (или, когда применяют животное, трансгенное по последовательностям иммуноглобулина человека, соматическому мутагенезу in vivo), при этом, аминокислотные последовательности VH- и VL-областей указанных антител могут представлять собой последовательности, которые хотя получены и родственны последовательностям VH и VL зародышевой линии конкретного вида (например, человека), могут не существовать в естественных условиях в спектре антител зародышевой линии этого вида in vivo. Рекомбинантные антитела могут иметь вариабельные и константные области в реаранжированной форме и/или, например, могут иметь некоторые мутации, которые не встречаются в природе.
В контексте настоящего описания понятия «антигенсвязывающий фрагмент», «фрагмент» и «фрагмент антитела» применяют взаимозаменяемо для обозначения любого фрагмента антитела, предлагаемого в изобретении, который сохраняет специфическую связывающую активность антитела, предлагаемого в изобретении. Примеры фрагментов антител включают (но, не ограничиваясь только ими) одноцепочечное антитело, Fab, Fab', F(ab')2, Fv или scFv. Фрагменты антител, предлагаемых в изобретении, можно получать из антител методами, которые включают расщепление ферментами, такими как пепсин или папаин, и/или путем расщепления дисульфидных связей посредством химического восстановления. Альтернативно этому, фрагменты антител можно получать путем клонирования и экспрессии частей последовательностей тяжелых и/или легких цепей. «Фрагменты» включают (но, не ограничиваясь только ими) Fab-, Fab'-, F(ab')2- и Fv-фрагменты. Под объем изобретения подпадают также одноцепочечные Fv-фрагменты (scFv), полученные из тяжелых и легких цепей антитела, предлагаемого в изобретении. Например, изобретение включает scFv, содержащий CDR из антитела, предлагаемого в изобретении. К ним относятся также мономеры и димеры тяжелых или легких цепей, однодоменные тяжелые цепи антител, однодоменные легкие цепи антител, а также одноцепочечные антитела, например, одноцепочечный Fv, в котором вариабельные домены тяжелых и легких цепей сцеплены пептидным линкером. Фрагменты антител, предлагаемых в изобретении, могут характеризоваться одновалентными или многовалентными взаимодействиями и входить в различные описанные выше структуры. Например, молекулы scFv можно синтезировать с получением трехвалентного «триабоди» или четырехвалентного «тетрабоди». Молекулы scFv могут включать домен Fc-области, что приводит к образованию двухвалентных миниантител. Кроме того, последовательности, предлагаемые в изобретении, могут являться компонентом мультиспецифических молекул, в которых мишенью последовательностей, предлагаемых в изобретении, является молекула контрольной точки, а другие области молекулы связываются с другими мишенями. Примеры молекулы включают (но, не ограничиваясь только ими) биспецифический Fab2, триспецифический Fab3, биспецифический scFv и диабоди (димерные антитела) (Holliger и Hudson, Nature Biotechnology 9, 2005, cc. 1126-1136). Хотя в описании изобретения, включая формулу изобретения, в некоторых случаях понятие может относиться исключительно к антигенсвязывающему(им) фрагменту(ам), фрагменту(ам) антител, варианту(ам) и/или производному(ым) антител, должно быть очевидно, что понятие «антитело» или «антитело, предлагаемое в изобретении» включает все категории антител, а именно: антигенсвязывающий(ие) фрагмент(ы), фрагмент(ы) антител, вариант(ы) и производное(ые) антител. Кроме того, понятие «антитело» в контексте настоящего описания включает как антитела, так и их антигенсвязывающие фрагменты.
Предпочтительно модуляторы иммунных контрольных точек, которые применяют в комбинации, предлагаемой в настоящем изобретении, представляют собой антитела или их антигенсвязывающие фрагменты, которые могут частично или полностью блокировать путь PD-1 (например, они могут являться частичными или полными антагонистами пути PD-1), в частности, PD-1, PD-L1 или PD-L2, более предпочтительно антитело может частично или полностью блокировать PD-1 (например, они могут являться частичными или полными антагонистами PD-1). Такие антитела или их антигенсвязывающие фрагменты включают антитела к PD-1, человеческие антитела к PD-1, мышиные антитела к PD-1, антитела к PD-1 млекопитающих, гуманизированные антитела к PD-1, моноклональные антитела к PD-1, поликлональные антитела к PD-1, химерные антитела к PD-1, антитела к PD-L1, антитела к PD-L2, аднектины к PD-1, доменные антитела к PD-1, одноцепочечные фрагменты к PD-1, фрагменты тяжелых цепей к PD-1 и фрагменты легких цепей к PD-1. Например, антитело к PD-1 может представлять собой антигенсвязывающий фрагмент. Предпочтительно антитело к PD-1 должно обладать способностью связываться с человеческим PD-1 и частично или полностью блокировать активность PD-1 (например, они могут являться частичными или полными антагонистами PD-1), тем самым частично снижая функцию иммунных клеток, экспрессирующих PD-1.
Предпочтительно модуляторы иммунных контрольных точек, которые применяют в комбинации, предлагаемой в настоящем изобретении, представляют собой антитела или их антигенсвязывающие фрагменты, которые могут частично или полностью блокировать путь CTLA-4 (например, они могут являться частичными или полными антагонистами пути CTLA-4). Такие антитела или их антигенсвязывающие фрагменты включают антитела к CTLA4, человеческие антитела к CTLA4, мышиные антитела к CTLA4, антитела к CTLA4 млекопитающих, гуманизированные антитела к CTLA4, моноклональные антитела к CTLA4, поликлональные антитела к CTLA4, химерные антитела к CTLA4, MDX-010 (ипилимумаб), тремелимумаб, антитела к CD28, аднектины к CTLA4, доменные антитела к CTLA4, одноцепочечные фрагменты к CTLA4, фрагменты тяжелых цепей к CTLA4 и фрагменты легких цепей к CTLA4. Например, антитело к CTLA4 может представлять собой антигенсвязывающий фрагмент. Предпочтительно антитело к CTLA4 должно обладать способностью связываться с человеческим CTLA4 и частично или полностью блокировать активность CTLA4 (например, они могут являться частичными или полными антагонистами CTLA4), тем самым частично снижая функцию иммунных клеток, экспрессирующих CTLA4.
Комплекс, содержащий проникающий в клетку пептид, по меньшей один антиген или антигенный эпитоп
Помимо описанного выше модулятора иммунных контрольных точек комбинация, предлагаемая для применения согласно настоящему изобретению, содержит комплекс, содержащий:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), т.е. проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, ковалентно связаны. Ниже касательно указанного комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, которые ковалентно связаны, используют понятие «комплекс» или «комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению».
Указанный комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, обеспечивает одновременно (I) стимуляцию опосредуемого полиэпитопной цитотоксической Т-клеткой иммунитета, (II) индукцию Th-клеток и (III) усиление иммунологической памяти. Таким образом, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой эффективную вакцину, в частности, с улучшенной противоопухолевой активностью.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой полипептид или белок, в частности, рекомбинантный полипептид или рекомбинантный белок, предпочтительно рекомбинантный слитый белок или рекомбинантный слитый полипептид. Понятие «рекомбинантный» в контексте настоящего описания (т.е. в тексте настоящей заявки) обозначает, что субстанция (в настоящем описания полипептид или белок) не встречается в естественных условиях. Таким образом, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, который представляет собой рекомбинантный полипептид или рекомбинантный белок, как правило, содержит компоненты а)-в), в котором компоненты а)-в) имеют различное происхождение, т.е. не встречаются в естественных условиях в такой комбинации.
В контексте настоящего изобретения, т.е. в контексте настоящего описания, понятия «пептид», «полипептид», «белок» и вариации этих понятий относятся к пептиду, олигопептиду, олигомеру или белку, включая слитый белок, соответственно, содержащему по меньшей мере две аминокислоты, сцепленные друг с другом предпочтительно с помощью обычной пептидной связи, или альтернативно этому, с помощью модифицированной пептидной связи, такой, например, как связь в изостерических пептидах. Пептид, полипептид или белок может состоять из L-аминокислот и/или D-аминокислот. Предпочтительно пептид, полипептид или белок либо (полностью) состоит из L-аминокислот, либо (полностью) состоит из D-аминокислот, образуя тем самым «ретро-инвертированные пептидные последовательности». Понятие «ретро-инвертированные (пептидные) последовательности» относится к изомеру линейной пептидной последовательности, в которой направление последовательности является обратным (реверсированным) и хиральность каждого аминокислотного остатка изменена на противоположную (является инвертированной) (см., например, Jameson и др., Nature, 368, 1994, cc. 744-746; Brady др., Nature, 368, 1994, cc. 692-693). В частности, понятия «пептид», «полипептид», «белок» включают также «пептидомиметики», которые обозначают пептидные аналоги, содержащие непептидные структурные элементы, указанные пептиды обладают способностью имитировать или антагонизировать биологическое(ие) действие(я) встречающегося в естественных условиях родительского пептида. У пептидомиметика отсутствуют классические характеристики пептида, такие как расщепляемые ферментами пептидные связи. В частности, пептид, полипептид или белок может содержать аминокислоты, отличные от тех 20 аминокислот, которые определяются генетическим кодом, в дополнение к указанным аминокислотам, или он может состоять из аминокислот, отличных от тех 20 аминокислот, которые определяются генетическим кодом. В частности, в контексте настоящего изобретения пептид, полипептид или белок может также состоять из аминокислот, модифицированных с помощью естественных процессов, таких как процессы пост-трансляционного созревания, или с помощью химических процессов, которые хорошо известны специалисту в данной области. Такие модификации подробно описаны в литературе. Эти модификации могут затрагивать любую область полипептида: пептидный скелет, аминокислотную цепь или даже карбокси- или аминоконцы. В частности, пептид или полипептид может быть разветвлен в результате убиквитинизации или может быть циклическим с разветвлением или без разветвления. Такой тип модификации может являться результатом естественных или искусственных посттрансляционных процессов, которые хорошо известны специалисту в данной области. Понятия «пептид», «полипептид», «белок» в контексте настоящего изобретения включают, в частности, также модифицированные пептиды, полипептиды и белки. Например, модификации пептида, полипептида или белка могут включать ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное связывание с нуклеотидом или нуклеотидным производным, ковалентное связывание с липидом или липидным производным, ковалентное связывание с фосфатидилинозитом, ковалентное или нековалентное перекрестное сшивание, циклизацию, образование дисульфидной связи, деметилирование, гликозилирование, включая пэгилирование, гидроксилирование, йодизацию, метилирование, миристоилирование, окисление, протеолитические процессы, фосфорилирование, пренилирование, рацемизацию, сенелоилирование, сульфатирование, присоединение аминокислот, такое как аргинилирование, или убиквитинизацию. Указанные модификации подробно описаны в литературе (Proteins Structure and Molecular Properties, 2-ое изд., под ред. Т.Е. Creighton, New York, 1993; Post-translational Covalent Modifications of Proteins, под ред. В.С. Johnson, изд-во Academic Press, New York, 1983; Seifter и др., Analysis for protein modifications and nonprotein cofactors, Meth. Enzymol. 182, 1990, cc. 626-646, и Rattan и др., Protein Synthesis: Post-translational Modifications and Aging, Ann NY Acad Sci, 663, 1992, cc. 48-62). Таким образом, понятия «пептид», «полипептид», «белок» предпочтительно включают, например, липопептиды, липопротеинаы, гликопептиды, гликопротеины и т.п.
Однако в наиболее предпочтительном варианте осуществления изобретения комплекс, указанный в настоящем описании, представляет собой «классический» пептид, полипептид или белок, где «классический» пептид, полипептид или белок, как правило, состоит из аминокислот, выбранных из 20 аминокислот, определяемых генетическим кодом, которые сцеплены друг с другом с помощью обычной пептидной связи.
Если комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой полипептид или белок, то предпочтительно он содержит по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90, более предпочтительно по меньшей мере 100, по меньшей мере 110, еще более предпочтительно по меньшей мере 120, по меньшей мере 130, наиболее предпочтительно по меньшей мере 140 или наиболее предпочтительно по меньшей мере 150 аминокислотных остатков.
Компонент а) - Проникающий в клетку пептид
СРР позволяет эффективно доставлять, т.е. транспортировать и загружать, в частности, по меньшей мере один антиген или антигенный эпитоп в антигенпрезентирующие клетки (АРС), в частности, в дендритные клетки (DC), что в результате обеспечивает механизм процессирования антигена дендритными клетками.
Понятие «проникающие в клетку пептиды» («СРР»), как правило, применяют для обозначения коротких пептидов, которые обладают способностью транспортировать различные типы карго-молекул («полезный груз») через плазматическую мембрану и в результате облегчать поглощение клетками различных карго-молекул (от наночастиц до небольших химических молекул и крупных фрагментов ДНК). «Клеточная интернализация» карго-молекул, связанных с проникающим в клетку пептидом, как правило, означает транспорт карго-молекулы через плазматическую мембрану и проникновение таким образом карго-молекулы в клетку. Затем в зависимости от конкретных обстоятельств карго-молекула может высвобождаться в цитоплазму, направляться к внутриклеточной органелле или также презентироваться на клеточной поверхности. Способность проникать в клетку или интернализация проникающего в клетку пептида или комплекса, содержащего указанный проникающий в клетку пептид, предлагаемый в изобретении, можно оценивать стандартными методами, известными специалисту в данной области, включая проточную цитометрию или флуоресцентную микроскопию живых и фиксированных клеток, иммуноцитохимию клеток, трансдуцированных указанным пептидом или комплексом, и Вестерн-блоттинг.
Проникающие в клетку пептиды, как правило, имеют аминокислотную композицию, которая либо содержит в высоком относительном количестве положительно заряженные аминокислоты, такие как лизин или аргинин, либо имеют последовательность, которая содержит чередующуюся схему расположения полярных/заряженных аминокислот и неполярных, гидрофобных аминокислот. Указанные два типа структур обозначают как поликатионные или амфипатические соответственно. Проникающие в клетку пептиды имеют различные размеры, аминокислотные последовательности и заряды, но все СРР обладают общим свойством, представляющим собой способность к транслокации через плазматическую мембрану и облегчение доставки различных карго-молекул в цитоплазму или в органеллу клетки. В настоящее время теории транслокации СРР основаны на трех основных механизмах проникновения: непосредственное проникновение через мембрану, опосредуемое эндоцитозом проникновение и транслокация посредством образования транзиторной структуры. Трансдукция СРР относится к области, требующей дальнейшего исследования. Известно, что проникающие в клетку пептиды нашли многочисленные применения в медицине в качестве агентов, доставляющих лекарственные средства, при лечении различных заболеваний, включая рак, и ингибиторов вирусов, а также контрастных агентов для мечения и визуализации клеток.
Как правило, проникающие в клетку пептиды (СРР) представляют собой пептиды, состоящие из 8-50 остатков, которые обладают способностью пересекать клеточную мембрану и проникать в большинство клеточных типов. Альтернативно этому, их обозначают также как домен трансдукции белка (PTD), что отражает их источник в виде встречающихся в естественных условиях белков. Frankel и Pabo одновременно с Green и Lowenstein описали способность транс-активирующего активатора транскрипции из вируса иммунодефицита человека 1 (HIV-TAT) проникать в клетки (Frankel A.D. и C.O. Pabo, Cellular uptake of the tat protein from human immunodeficiency virus. Cell, 55(6), 1988, cc. 1189-1193). В 1991 г. описана трансдукция в нервные клетки гомеодомена Antennapedia (ДНК-связывающий домен) из Drosophila melanogaster (Joliot А. и др., Antennapedia homeobox peptide regulates neural morphogenesis. Proc Natl Acad Sci USA, 88(5), 1991, cc. 1864-1868). В 1994 г. охарактеризован первый 16-мерный пептид СРР, обозначенный как пенетратин, который имеет аминокислотную последовательность RQIKIYFQNRRMKWKK (SEQ ID NO: 1), из третьей спирали гомеодомена Antennapedia (Derossi D. и др., The third helix of the Antennapedia homeodomain translocates through biological membranes. J Biol Chem, 269(14), 1994, cc. 10444-10450), после чего в 1998 г. идентифицирован минимальный домен ТАТ, имеющий аминокислотную последовательность YGRKKRRQRRR (SEQ ID NO: 2), необходимый для трансдукции белков (Vives Е., P. Brodin и В. Lebleu, A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem, 272(25), 1997, cc. 16010-16017). В течение двух последних десятилетий описано множество пептидов различного происхождения, включая вирусные белки, например, VP22 (Elliott G. и P.  Intercellular trafficking and protein delivery by a herpesvirus structural protein. Cell, 88(2), 1997, cc. p. 223-233) и белок ZEBRA (Rothe R. и др., Characterization of the cell-penetrating properties of the Epstein-Barr virus ZEBRA trans-activator. J Biol Chem, 285(26), 2010, cc. 20224-20233), или из ядов, например, мелиттин (Dempsey С.Е., The actions of melittin on membranes. Biochim Biophys Acta, 1031(2), 1990, cc. 143-161), мастопоран (Konno K. и др., Structure and biological activities of eumenine mastoparan-AF (EMP-AF), a new mast cell degranulating peptide in the venom of the solitary wasp (Anterhynchium flavomarginatum micado). Toxicon, 38(11), 2000, cc. 1505-1515), маурокальцин (Esteve Е. и др., Transduction of the scorpion toxin maurocalcine into cells. Evidence that the toxin crosses the plasma membrane. J Biol Chem, 280(13), 2005, cc. 12833-12839), кротамин (Nascimento F.D. и др., Crotamine mediates gene delivery into cells through the binding to heparan sulfate proteoglycans. J Biol Chem, 282(29), 2007, cc. 21349-21360) или буфорин (Kobayashi S. и др., Membrane translocation mechanism of the antimicrobial peptide buforin 2. Biochemistry, 43(49), 2004, cc. 15610-15616). Созданы также синтетические CPP, включая полиаргинин (R8, R9, R10 и R12) (Futaki S. и др., Arginine-rich peptides. An abundant source of membrane-permeable peptides having potential as carriers for intracellular protein delivery. J Biol Chem, 276(8), 2001, cc. 5836-5840) или транспортан (Pooga M. и др., Cell penetration by transportan. FASEB J, 12(1), 1998, cc. 67-77). Любые из описанных выше CPP можно применять в качестве проникающего в клетку пептида, т.е. компонента а), в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению. В частности, компонент а), т.е. СРР, в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать минимальный домен ТАТ, который имеет аминокислотную последовательность YGRKKRRQRRR (SEQ ID NO: 2). В частности, компонент а), т.е. СРР, в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать пенетратин, который имеет аминокислотную последовательность RQIKIYFQNRRMKWKK (SEQ ID NO: 1).
Intercellular trafficking and protein delivery by a herpesvirus structural protein. Cell, 88(2), 1997, cc. p. 223-233) и белок ZEBRA (Rothe R. и др., Characterization of the cell-penetrating properties of the Epstein-Barr virus ZEBRA trans-activator. J Biol Chem, 285(26), 2010, cc. 20224-20233), или из ядов, например, мелиттин (Dempsey С.Е., The actions of melittin on membranes. Biochim Biophys Acta, 1031(2), 1990, cc. 143-161), мастопоран (Konno K. и др., Structure and biological activities of eumenine mastoparan-AF (EMP-AF), a new mast cell degranulating peptide in the venom of the solitary wasp (Anterhynchium flavomarginatum micado). Toxicon, 38(11), 2000, cc. 1505-1515), маурокальцин (Esteve Е. и др., Transduction of the scorpion toxin maurocalcine into cells. Evidence that the toxin crosses the plasma membrane. J Biol Chem, 280(13), 2005, cc. 12833-12839), кротамин (Nascimento F.D. и др., Crotamine mediates gene delivery into cells through the binding to heparan sulfate proteoglycans. J Biol Chem, 282(29), 2007, cc. 21349-21360) или буфорин (Kobayashi S. и др., Membrane translocation mechanism of the antimicrobial peptide buforin 2. Biochemistry, 43(49), 2004, cc. 15610-15616). Созданы также синтетические CPP, включая полиаргинин (R8, R9, R10 и R12) (Futaki S. и др., Arginine-rich peptides. An abundant source of membrane-permeable peptides having potential as carriers for intracellular protein delivery. J Biol Chem, 276(8), 2001, cc. 5836-5840) или транспортан (Pooga M. и др., Cell penetration by transportan. FASEB J, 12(1), 1998, cc. 67-77). Любые из описанных выше CPP можно применять в качестве проникающего в клетку пептида, т.е. компонента а), в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению. В частности, компонент а), т.е. СРР, в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать минимальный домен ТАТ, который имеет аминокислотную последовательность YGRKKRRQRRR (SEQ ID NO: 2). В частности, компонент а), т.е. СРР, в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать пенетратин, который имеет аминокислотную последовательность RQIKIYFQNRRMKWKK (SEQ ID NO: 1).
Различные СРР, которые можно использовать в качестве проникающего в клетку пептида, т.е. компонента а), в комплексе, входящем в композицию, предлагаемую для применения согласно настоящему изобретению, описаны также в обзоре Milletti F., Cell-penetrating peptides: classes, origin, and current landscape. Drug Discov Today 17, (15-16), 2012, cc. 850-860). Другими словами, CPP, описанные у Milletti F., Cell-penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860, можно применять в качестве проникающего в клетку пептида, т.е. компонента а), в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению. Они включают, в частности, катионные СРР, амфипатические СРР и гидрофобные СРР, а также СРР, полученные из гепаран-, РНК- и ДНК-связывающих белков, (см. таблицу 1 у Millett, F., Cell-penetrating peptides penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860), СРР, полученные из сигнальных пептидов (см. таблицу 2 у Milletti, F., Cell-penetrating peptides: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860), СРР, полученные из антимикробных пептидов (см. таблицу 3 у Millett, F., Cell-penetrating peptides penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860), СРР, полученные из вирусных белков (см. таблицу 4 у Millett, F., Cell-penetrating peptides penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860), СРР, полученные из различных природных белков (см. таблицу 5 у Millett, F., Cell-penetrating peptides penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860), а также сконструированные СРР и СРР, полученные из пептидных библиотек (см. таблицу 6 у Millett, F., Cell-penetrating peptides penetrating: classes, origin, and current landscape. Drug Discov Today 17 (15-16), 2012, cc. 850-860).
Предпочтительно проникающий в клетку пептид, который содержится в комплексе,
I) имеет длину аминокислотной последовательности указанного пептида, составляющую в целом 5-50 аминокислот, предпочтительно в целом 10-45 аминокислот, более предпочтительно в целом 15-45 аминокислот; и/или
II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена белка ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или вариант последовательности указанного фрагмента.
Таким образом, предпочтительно проникающий в клетку пептид, который входит в комплекс,
I) имеет длину аминокислотной последовательности указанного пептида, составляющую в целом 5-50 аминокислот, предпочтительно в целом 10-45 аминокислот, более предпочтительно в целом 15-45 аминокислот; и
II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена белка ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или вариант последовательности указанного фрагмента.
Указанные предпочтительные СРР описаны в WO 2014/041505.
Понятие «ZEBRA» (которое имеет также обозначения Zta, Z, ЕВ 1 или BZLF1), как правило, обозначает основанный на «лейциновой молнии» (bZIP) активатор транскрипции вируса Эпштейна-Барра (EBV). Минимальный домен ZEBRA, который обладает способностью проникать в клетку, идентифицирован в виде домена, простирающегося от остатка 170 до остатка 220 ZEBRA. Аминокислотная последовательность ZEBRA представлена в NCBI, код доступа YP_401673, и содержит 245 аминокислотных остатков, указанных в SEQ ID NO: 3:

(SEQ ID NO: 3 - аминокислотная последовательность ZEBRA (встречающаяся в естественных условиях последовательность из вируса Эпштейна-Барра (EBV)) (YP_401673)).
В настоящее время описано, что СРР из вирусного белка ZEBRA трансдуцирует карго-белки через биологические мембраны как путем (I) непосредственной транслокации, так и путем (II) опосредуемого липидным рафтом (плотом) эндоцитоза (Rothe R., Liguori L., Villegas-Mendez A., Marques В., Grunwald D., Drouet E. и др. Characterization of the cell-penetrating properties of the Epstein-Barr virus ZEBRA trans-activator. The Journal of biological chemistry 285(26), 2010, cc. 20224-20233). При создании настоящего изобретения высказано предположение о том, что эти два механизма проникновения должны усиливать ограниченную по ГКГС класса I и II презентацию карго-антигенов как CD8+-, так и CD4+-Т-клеткам соответственно. Таким образом, указанный СРР может доставлять полиэпитопные пептиды к дендритным клеткам (DC), и затем усиливать активацию CTL и Th-клеток и противоопухолевую функцию. Таким образом, указанный СРР может эффективно доставлять комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, к антигенпрезентирующим клеткам (АРС) и приводить к ограниченной по ГКГС класса I и II презентации полиэпитопных антигенов.
В контексте настоящего изобретения понятие «ГКГС класса I» обозначает один из двух основных классов молекул главного комплекса гистосовместимости. Молекулы ГКГС класса I (которые обозначают также как «ГКГС I») обнаружены на каждой имеющей ядро клетке организма. Функция ГКГС класса I состоит в презентации эпитопа цитотоксическим клеткам (CTL). У людей молекулы ГКГС класса I состоят из двух полипептидных цепей, α- и β2-микроглобулина (b2m). Только α-цепь является полиморфной и кодируется геном HLA, а b2m-субъединица не является полиморфной и кодируется геном бета-2 микроглобулина. В контексте настоящего изобретения понятие «ГКГС класса II» означает другой основной класс молекул главного комплекса гистосовместимости. Молекулы ГКГС класса II (которые обозначают также как ГКГС II») обнаружены только в небольшом количестве специализированных клеточных типов, включая макрофаги, дендритные клетки и В-клетки, которые все относятся к антигенпрезентирующим клеткам (АРС).
Предпочтительно вариант последовательности фрагмента минимального домена ZEBRA, описанного выше, характеризуется, в частности по всей длине, идентичностью аминокислотной последовательности, составляющей по меньшей мере 70%, по меньшей мере 75%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, наиболее предпочтительно по меньшей мере 99%, с аминокислотной последовательностью фрагмента минимального домена ZEBRA, описанного выше, без аннулирования способности проникающего в клетку пептида проникать в клетку. В частности, под «фрагментом» минимального домена ZEBRA, описанного выше, предпочтительно подразумевается его укороченная последовательность, т.е. аминокислотная последовательность, укороченная на N-конце, С-конце и/или внутри последовательности по сравнению с аминокислотной последовательностью нативной последовательности. Кроме того, указанный «фрагмент» минимального домена ZEBRA предпочтительно в целом состоит из 5-50 аминокислот, предпочтительно в целом состоит из 10-45 аминокислот, более предпочтительно в целом состоит из 15-45 аминокислот.
Таким образом, понятие «вариант последовательности» в контексте настоящего изобретения, т.е. в настоящей заявке, относится к любому изменению в референс-последовательности. Понятие «вариант последовательности» включает варианты нуклеотидной последовательности и варианты аминокислотной последовательности. Предпочтительно референс-последовательность представляет собой любую из последовательностей, указанную в «Таблице последовательностей и номеров SEQ ID» (Перечень последовательностей), т.е. SEQ ID NO: 1 - SEQ ID NO: 47. Предпочтительно вариант последовательности характеризуется, в частности по всей длине последовательности, идентичностью последовательности, составляющей по меньшей мере 70%, по меньшей мере 75%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, еще более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, наиболее предпочтительно по меньшей мере 99%, с референс-последовательностью, где идентичность последовательности рассчитывают указанным ниже методом. В частности, вариант последовательности сохраняет специфическую функцию референс-последовательности. Идентичность последовательности рассчитывают с помощью описанного ниже метода. В частности, вариант аминокислотной последовательности имеет измененную последовательность, в которой одна или несколько аминокислот в референс-последовательности удалена(ы) или заменена(ы), или одна или несколько аминокислот встроена(ы) в последовательность аминокислотной референс-последовательности. В результате изменений вариант аминокислотной последовательности имеет аминокислотную последовательность, которая по меньшей мере на 70%, по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 99%, идентична референс-последовательности. Например, варианты последовательностей, идентичные по меньшей мере на 90%, имеют не более 10 изменений, т.е. любую комбинацию делеций, инсерций или замен, на 100 аминокислот референс-последовательности.
В контексте настоящего изобретения подразумевается, что аминокислотная последовательность «характеризуется идентичностью последовательности», составляющей, например, по меньшей мере 95% с запрашиваемой аминокислотной последовательностью, предлагаемой в настоящем изобретении, означает, что последовательность рассматриваемой аминокислотной последовательности идентична запрашиваемой последовательности за исключением того, что рассматриваемая аминокислотная последовательность может включать вплоть до 5 аминокислотных изменений на каждые 100 аминокислот запрашиваемой аминокислотной последовательности. Другими словами, для получении аминокислотной последовательности, имеющей последовательность, идентичную по меньшей мере на 95% запрашиваемой аминокислотной последовательности, вплоть до 5% (5 из 100) аминокислотных остатков в рассматриваемой последовательности можно встраивать или заменять на другую аминокислоту или изымать путем делеций, предпочтительно в соответствии с приведенными выше определениями вариантов или фрагментов. Это же, естественно, применимо также к сходству нуклеотидных последовательностей.
Для (аминокислотных или нуклеотидных) последовательностей, не имеющих точного соответствия, «% идентичности» первой последовательности можно определять относительно второй последовательности. В целом, эти две последовательности, подлежащие сравнению, выравнивают для получения максимальной корреляции между последовательностями. Это может включать встраивание «брешей» в любую одну или обе последовательности для повышения степени выравнивания. Затем можно определять % идентичности по всей длине каждой из сравниваемых последовательностей (так называемое глобальное выравнивание), что наиболее пригодно для последовательностей одинаковой или сходной длины, или для более коротких определенных длин (так называемое локальное выравнивание), что наиболее пригодно для последовательностей неодинаковой длины.
Методы сравнения идентичности и гомологии двух или большего количества последовательностей хорошо известны в данной области. Процент идентичности двух последовательностей можно определять, например, с помощью математического алгоритма. Предпочтительным примером математического алгоритма, который можно применять, является (но, не ограничиваясь только ими) алгоритм, описанный у Karlin и др., PNAS USA, 90, 1993, cc. 5873-5877. Указанный алгоритм интегрирован в семейство программ BLAST, например, программу BLAST или NBLAST (см. также Altschul и др., J. Mol. Biol. 215, 1990, cc. 403-410 или Altschul и др., Nucleic Acids Res, 25, 1997, cc. 3389-3402), доступные через домашнюю страницу NCBI в Интернете ncbi.nlm.nih.gov), и FASTA (Pearson, Methods Enzymol. 183, 1990, cc. 63-98; Pearson и Lipman, Proc. Natl. Acad. Sci. U. S. A 85, 1988, cc. 2444-2448.). С помощью указанных программ можно идентифицировать последовательности, идентичные в определенной степени другим последовательностям. Кроме того, программы доступны в Wisconsin Sequence Analysis Package, версия 9.1 (Devereux и др., Nucleic Acids Res., 1984, cc. 387-395), например, программы BESTFIT и GAP, которые можно применять для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии или идентичности между двумя полипептидными последовательностями. В BESTFIT применяют алгоритм «локальной гомологии», предложенный Smith и Waterman, J. Mol. Biol. 147, 1981, cc. 195-197.), и этот алгоритм позволяет находить наилучшую единичную область сходства между двумя последовательностями.
Более предпочтительно фрагменты проникающего в клетку пептида, предлагаемого в изобретении, или их варианты, описанные выше, сохраняют также способность пептида презентировать карго-молекулу, такую как антигены или антигенные эпитопы, на поверхности клетки в контексте молекул ГКГС класса I и/или ГКГС класса II. Способность проникающего в клетку пептида или комплекса, содержащего указанный проникающий в клетку пептид, презентировать карго-молекулу, такую как антигены или антигенные эпитопы на поверхности клетки, такой как антигенпрезентирующая клетка, в контексте молекул ГКГС класса I и/или ГКГС класса II можно оценивать стандартными методами, известными специалисту в данной области, включая оценку способности стимулировать пролиферацию и/или функцию ограниченных по ГКГС CD4+ - или CD8+ -Т-клеток, обладающих специфичностью в отношении этих эпитопов.
Предпочтительным является проникающий в клетку пептид, который
I) имеет длину аминокислотной последовательности указанного пептида, составляющую в целом 5-50 аминокислот, предпочтительно в целом 10-45 аминокислот, более предпочтительно в целом 15-45 аминокислот; и/или
II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеций и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или вариант указанного фрагмента,
предпочтительно содержит аминокислотную последовательность, имеющую по меньшей мере одну консервативную аминокислотную замену по сравнению с референс-последовательностью, это означает, что данный аминокислотный остаток заменен на остаток, имеющий сходные физико-химические характеристики.
Как правило, замены одной или нескольких аминокислот, присутствующих в аминокислотной референс-последовательности, должны представлять собой консервативные замены. Примеры консервативных замен включают замену одного алифатического остатка на другой, например, замену друг на друга Ile, VaI, Leu или Ala, или замены одного полярного остатка на другой, например, замены друг на друга Lys и Arg; Glu и Asp или Gln и Asn. Хорошо известны и другие указанные консервативные замены, например, замены полных областей, имеющих сходные гидрофобные свойства (Kyte и Doolittle, 1J. Mol. Biol. 157(1), 1982, cc. 105-132). Замены одной или нескольких L-аминокислот на одну или несколько D-аминокислот могут рассматриваться в качестве консервативных замен в контексте настоящего изобретения. Примеры аминокислотных замен представлены ниже в таблице 1:

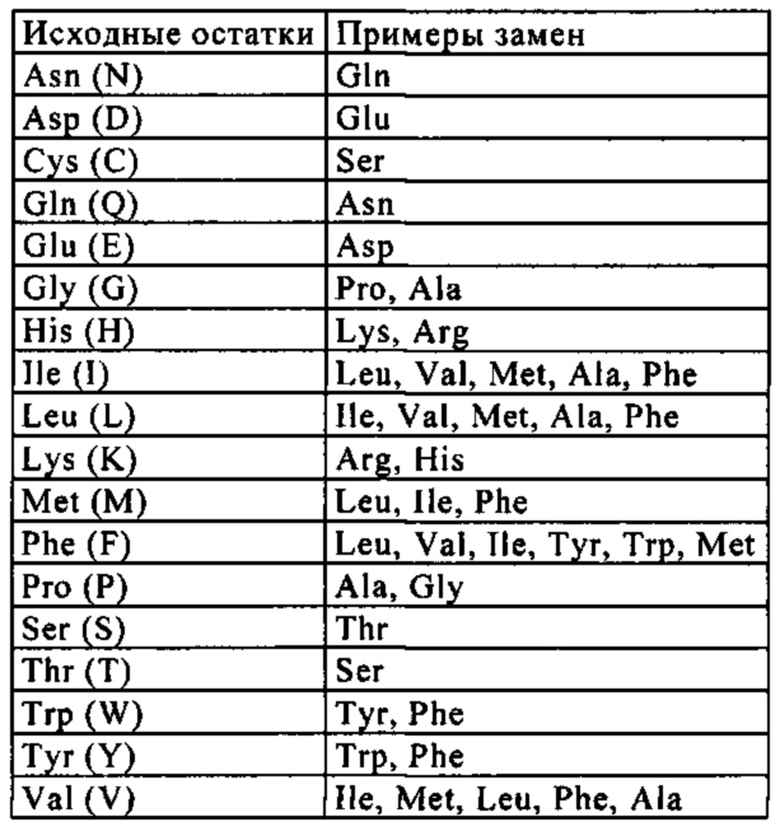
В наиболее предпочтительном варианте предпочтительным является проникающий в клетку пептид, который
I) имеет длину аминокислотной последовательности указанного пептида, составляющую в целом 5-50 аминокислот, предпочтительно в целом 10-45 аминокислот, более предпочтительно в целом 15-45 аминокислот; и/или
II) имеет аминокислотную последовательности, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или вариант указанного фрагмента,
содержит замену Cys (С) на Ser (S) в положении, эквивалентном положению 189 в аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3.
Таким образом, предпочтительно, чтобы указанный предпочтительный проникающий в клетку пептид имел аминокислотную последовательность, содержащую последовательность следующей общей формулы (I):
X1X2X3X4X5X6X7X8X9X10X11SX13X14X15X16X17
в которой 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку,в которой
X1 обозначает K, R или Н, предпочтительно X1 обозначает K или R;
Х2 обозначает R, K или Н, предпочтительно Х2 обозначает R или K;
Х3 обозначает Y, W или F, предпочтительно Х3 обозначает Y, W или F;
Х4 обозначает K, R или Н, предпочтительно Х4 обозначает K или R;
Х5 обозначает N или Q;
Х6 обозначает R, K или Н, предпочтительно Х6 обозначает R или K;
Х7 обозначает V, I, М, L, F или А, предпочтительно Х7 обозначает V, I, М или L;
Х8 обозначает А, V, L, I или G, предпочтительно X8 обозначает А или G;
Х9 обозначает S или Т;
Х10 обозначает R, K или Н, предпочтительно Х10 обозначает R или K;
Х11 обозначает K, R или Н, предпочтительно Х11 обозначает K или R;
Х13 обозначает R, K или Н, предпочтительно Х13 обозначает R или K;
Х14 обозначает А, V, L, I или G, предпочтительно Х14 обозначает А или G;
Х15 обозначает K, R или Н, предпочтительно Х15 обозначает K или R;
Х16 обозначает F, L, V, I, Y, W или М, предпочтительно Х16 обозначает F, Y или W; и
Х17 обозначает K, R или Н, предпочтительно Х17 обозначает K или R.
Предпочтительно указанный пептид, полипептид или белок состоит либо (полностью) из L-аминокислот, либо (полностью) из D-аминокислот, образуя «ретро-инвертированные пептидные последовательности». Понятие «ретро-инвертированные (пептидные) последовательности» относится к изомеру линейной пептидной последовательности, в которой направление последовательности является обратным и хиральность каждого аминокислотного остатка изменена на противоположную (см., например, Jameson и др., Nature, 368, 1994, cc. 744-746; Brady др., Nature, 368, 1994, cc. 692-693).
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой X1 обозначает K.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х2 обозначает R.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х3 обозначает Y.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х4 обозначает K.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х5 обозначает N.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х6 обозначает R.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х7 обозначает V.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой X8 обозначает А.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х9 обозначает S.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х10 обозначает R.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х11 обозначает K.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х13 обозначает R.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х14 обозначает А.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х15 обозначает K.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой X16 обозначает F.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой Х17 обозначает K.
В конкретном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, как правило, описывается указанной выше общей формулой (I), в которой аминокислотный остаток в положении, эквивалентном положению 12 в общей формуле (I), представляет собой Ser (S).
Предпочтительно также предпочтительный проникающий в клетку пептид, который
I) имеет длину аминокислотной последовательности указанного пептида, составляющую в целом 5-50 аминокислот, предпочтительно в целом 10-45 аминокислот, более предпочтительно в целом 15-45 аминокислот; и/или
II) имеет аминокислотную последовательности, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или вариант указанного фрагмента,
содержит или состоит из аминокислотной последовательности, выбранной из группы, которая состоит из аминокислотных последовательностей SEQ ID NO: 4-13 или вариантов указанных последовательностей, которые не аннулируют способность указанного пептида проникать в клетку, предпочтительно из вариантов последовательности, в которой 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку.
СРР1 (Z11):
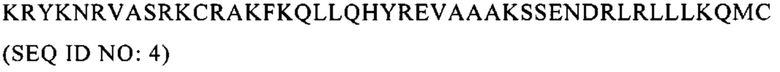
СРР2 (Z12):
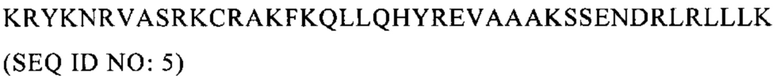
СРР3 (Z13):
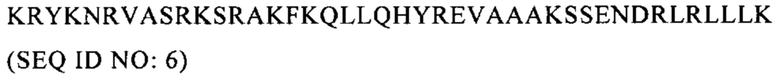
СРР4 (Z14):
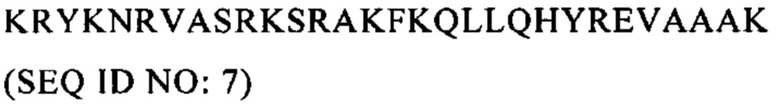
СРР5 (Z15):
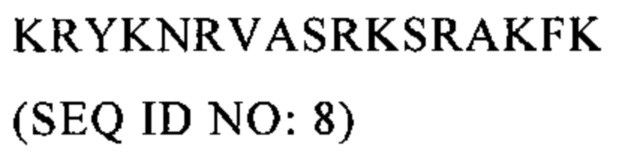
СРР6 (Z16):
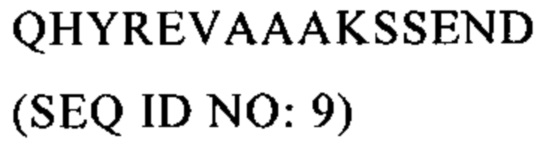
СРР7 (Z17):
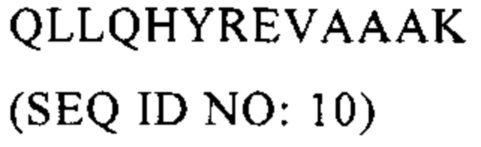
СРР8 (Z18):
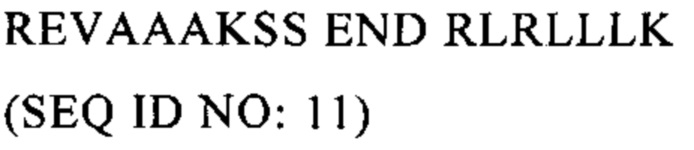
CPP9(Z19):

CPP10 (Z20):

Таким образом, особенно предпочтительным является проникающий в клетку пептид, который имеет аминокислотную последовательность SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18), или варианты этой последовательности, которые не аннулируют способность указанного пептида проникать в клетку, предпочтительно варианты последовательности, в которой 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку. Кроме того, более предпочтительным является проникающий в клетку пептид, который имеет аминокислотную последовательность, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13) или SEQ ID NO: 7 (CPP4/Z14) или вариантов указанной последовательности, которые не аннулируют способность указанного пептида проникать в клетку, предпочтительно из вариантов последовательности, в которой 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку. Кроме того, наиболее предпочтительным является проникающий в клетку пептид, который имеет аминокислотную последовательность, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13) или вариантов указанной последовательности, не аннулирующих способность указанного пептида проникать в клетку, предпочтительно вариантов последовательности, в которой 1, 2, 3, 4 или 5 аминокислот заменены, удалены путем делеции и/или добавлены без аннулирования способности указанного пептида проникать в клетку.
В одном из предпочтительных вариантов осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, имеет аминокислотную последовательность, которая содержит или состоит из SEQ ID NO: 6 (CPP3/Z13).
В другом предпочтительном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, имеет аминокислотную последовательность, которая содержит или состоит из SEQ ID NO: 7 (CPP4/Z14).
В другом предпочтительном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, имеет аминокислотную последовательность, которая содержит или состоит из SEQ ID NO: 8 (CPP5/Z15).
В другом предпочтительном варианте осуществления изобретения проникающий в клетку пептид, предлагаемый в изобретении, имеет аминокислотную последовательность, которая содержит или состоит из SEQ ID NO: 11 (CPP8/Z18).
Как должно быть очевидно специалисту в данной области, первичная аминокислотная последовательность проникающего в клетку пептида может быть подвергнута дополнительной пост-трансляционной модификации, такой как гликозилирование или фосфорилирование, без отклонения от объема изобретения.
В следующем варианте осуществления изобретения проникающий в клетку пептид необязательно дополнительно содержит помимо его аминокислотной последовательности, описанной выше, любой из следующих компонентов или любую комбинацию следующих компонентов:
(I) сигнал ядерной локализации (NLS). Такие сигналы хорошо известны специалисту в данной области и описаны у Nair и др., Nucleic Acids Res. 31(1), 2003, сс. 397-399),
(II) нацеливающий (таргетирующий) пептид, включая пептиды хоминга опухолей, такие как описанные у Kapoor и др., PLoS ONE 7(4), 2012, е35187) и перечисленные в in-http://crdd.osdd.net/raghava/tumorhope/general.php?
Предпочтительно проникающий в клетку пептид связан с антигеном или антигенным эпитопом и облегчает клеточную интернализацию указанного антигена или антигенного эпитопа.
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать один проникающий в клетку пептид или несколько проникающих в клетку пептидов. Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит не более пяти проникающих в клетку пептидов, более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит не более четырех проникающих в клетку пептидов, еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит не более трех проникающих в клетку пептидов, наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит не более двух проникающих в клетку пептидов, и наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит только один проникающий в клетку пептид.
Компонент б) - Антиген/антигенный эпитоп
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит в качестве компонента б) по меньшей мере один антиген или антигенный эпитоп.
В контексте настоящего описания «антиген» представляет собой субстанцию любой структуры, которая служит в качестве мишени для рецепторов, участвующих в адаптивном иммунном ответе, в частности, в качестве мишени для антител, Т-клеточных рецепторов и/или В-клеточных рецепторов. «Эпитоп», который называют также «антигенной детерминантой», представляет собой часть (или фрагмент) антигена, которая распознается иммунной системой, в частности, антителами, Т-клеточными рецепторами и/или В-клеточными рецепторами. Так, один антиген имеет по меньшей мере один эпитоп, т.е. один антиген имеет один или несколько эпитопов. В контексте настоящего изобретения понятие «эпитоп» применяют главным образом для обозначения Т-клеточных эпитопов, которые презентируются на поверхности антигенпрезентирующей клетки, где они связаны с главным комплексом гистосовметистимости (ГКГС). Т-клеточные эпитопы, которые презентируются молекулами ГКГС класса I, как правило, но не всегда, представляют собой пептиды, состоящие из 8-11 аминокислот, в то время как молекулы ГКГС класса II презентируют более длинные пептиды, как правило, но не всегда, состоящие из 12-25 аминокислот.
Предпочтительно в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, по меньшей мере один антиген или антигенный эпитоп выбран из группы, которая состоит из: (I) пептида, полипептида или белка, (II) полисахарида, (III) липида, (IV) липопротеина или липопептида, (V) гликолипида, (VI) нуклеиновой кислота и (VII) низкомолекулярного лекарственного средства или токсина. Таким образом, по меньшей мере один антиген или антигенный эпитоп может представлять собой пептид, белок, полисахарид, липид, их комбинацию, включающую липопротеины и гликолипиды, нуклеиновую кислоту (например, ДНК, siPHК, shPHК, антисмысловые олигонуклеотиды, ДНК-ловушка, плазмида), или низкомолекулярное лекарственное средство (например, циклоспорин А, паклитаксел, доксорубицин, метотрексат, 5-аминолевулиновая кислота), или любую их комбинацию, в частности, если в комплексе, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержится более одного антигена или антигенного эпитопа.
Очевидно, что по меньшей мере один антиген или антигенный эпитоп может содержать, например, по меньшей мере один, т.е. один или несколько пептидов, полипептидов или белков, связанных вместе, и/или по меньшей мере одну, т.е. одну или несколько нуклеиновых кислот, например, каждая из которых кодирует один пептид или полипептид. Кроме того, по меньшей мере один антиген или антигенный эпитоп может представлять собой комбинацию белка, липида и/или полисахарида, включая липопротеины и гликолипиды. Так, в частности, если комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит более одного антигена или антигенного эпитопа, то он может содержать более одного пептида, полипептида или белка, более одного полисахарида, более одного липида, более одного липопротеина, более одного гликолипида, более одной нуклеиновой кислоты, более одного низкомолекулярного лекарственного средства или токсина, или их комбинацию.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере один антиген или антигенный эпитоп, содержащий один или несколько эпитоп(ов), выбранный(ых) из ассоциированного с раком/опухолью антигена, специфического для рака/опухоли антигена и/или антигенного белка из патогена, включая антигенный белок из вирусов, бактерий, грибов, простейших и многоклеточных паразитов.
Более предпочтительно по меньшей мере один антиген или антигенный эпитоп содержит или состоит из (I) по меньшей мере одного эпитопа патогена и/или (II) по меньшей мере одного ракового/опухолевого эпитопа, в частности, по меньшей мере из одного опухолевого эпитопа. Наиболее предпочтительно по меньшей мере один антиген или антигенный эпитоп содержит или состоит по меньшей мере одного ракового/опухолевого эпитопа, в частности, по меньшей мере из одного опухолевого эпитопа.
Наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит только такой(ие) антиген(ы) или антигенный(ые) эпитоп(ы), который(ые) представляет(ют) собой ассоциированный(ые) с раком/опухолью антиген(ы), специфический(ие) для рака/опухоли антиген(ы) и/или раковый(ые)/опухолевый(ые) эпитоп(ы); в частности, представляющий(ие) собой ассоциированный(ые) с опухолью антиген(ы), специфический(ие) для опухоли антиген(ы) и/или опухолевый(ые) эпитоп(ы).
В контексте настоящего описания «раковый эпитоп» означает эпитоп из ассоциированного с раком антигена или из специфического для рака антигена. Соответственно «опухолевый эпитоп» означает эпитоп из ассоциированного с опухолью антигена или из специфического для опухоли антигена. Указанные эпитопы, как правило, являются специфическими (или ассоциированы с) для определенного типа рака/опухоли. Например, раковые/опухолевые эпитопы включают эпитопы глиомы. В частности, ассоциированные с раком/опухолью (также связанные с раком/опухолью) антигены представляют собой антигены, которые экспрессируются как на раковых/опухолевых клетках, так и на здоровых клетках. Соответственно такие антигены в норме присутствуют с рождения (или даже до рождения). Соответственно существует шанс, что у иммунной системы разовьется самотолерантность к таким антигенам. В отличие от этого, специфические для рака/опухоли антигены представляют собой антигены, которые экспрессируются специфически раковыми/опухолевыми клетками, но не здоровыми клетками. Специфические для рака/опухоли антигены включают, в частности, неоантигены. В целом, неоантигены представляют собой антигены, которые не присутствовали ранее и поэтому являются «новыми» для иммунной системы. Неоантигены, как правило, являются результатом соматических мутаций. Касательно раковых/опухолевых, специфических для рака/опухоли неоантигенов, то они, как правило, не присутствуют до развития рака/опухоли и специфические для рака/опухоли неоантигены, как правило, кодируются соматическими генными мутациями в раковых клетках/опухолевых клетках. Поскольку неоантигены являются новыми для иммунной системы, то считается, что риск самотолерантности к этим антигенам является существенно более низким, чем к ассоциированным с раком/опухолью антигенам. Однако каждый характерный для рака набор опухольспецифических мутаций, вероятно, является уникальным. Соответственно в контексте настоящего изобретения предпочтительно, чтобы указанные специфические для рака/опухоли антигены, в частности неоантигены, были идентифицированы у индивидуума с диагностированным раком с помощью методов, известных специалисту в данной области, например, путем секвенирования ракового генома. После идентификации соответствующие специфические для рака/опухоли неоантигены и/или эпитопы специфических для рака/опухоли неоантигенов применяют в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит один или несколько ассоциированных с раком/опухолью эпитопов и/или один или несколько ассоциированных с раком/опухолью антигенов (но предпочтительно не содержит специфические для рака/опухоли эпитопы). Предпочтительно также, чтобы комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержал один или несколько специфических для рака/опухоли эпитопов и/или один или несколько специфических для рака/опухоли антигенов (но предпочтительно не содержал ассоциированные с раком/опухолью эпитопы). Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно также предпочтительно содержать как (I) один или несколько ассоциированных с раком/опухолью эпитопов и/или один или несколько ассоциированных с раком/опухолью антигенов, так и (II) один или несколько специфических для рака/опухоли эпитопов и/или один или несколько специфических для рака/опухоли антигенов.
Приемлемые раковые/опухолевые эпитопы можно найти, например, в базах данных раковых/опухолевых эпитопов, например, у van der Bruggen P., Stroobant V., Vigneron N., Van den Eynde B. Peptide database: T cell-defined tumor antigens. Cancer Immun 2013; URL: http://www.cancerimmunity.org/peptide/, в которых человеческие опухолевые антигены, распознаваемые CD4+- или CD8+-T-клетками, классифицированы на 4 основные группы на основе схемы их экспрессии, или из базы данных «Tantigen» (TANTIGEN, версия 1.0, 1 декабря 2009 г., созданной Bioinformatics Core at Cancer Vaccine Center, Dana-Farber Cancer Institute; URL: http://cvc.dfci.harvard.edu/tadb/). Примеры раковых/опухолевых эпитопов включают, например, полученные из TRP2-эпитопы, эпитопы антигена гликопротеина 100 (gp100), ассоциированного с меланомой, эпитопы антигена гликопротеина 70 (gp70), эпитопы сурвивина, IEa-эпитопы, IL13rα2, Epha2 (эфриновый рецептор 2 типа А), их иммуногенные фрагменты и слияния указанных антигенов и/или фрагментов. Кроме того, примеры раковых/опухолевых эпитопов включают эпитопы неоантигенов, таких, например, как неоантиген из опухолевых клеток линии МС-38, описанный у Yadav и др., Nature, 515(7528), 27 ноября 2014 г., сс. 572-576. Как описано выше, неоантигены представляют собой антигены, которые полностью отсутствуют в геноме здорового человека. По сравнению с немутантными аутоантигенами неоантигены актуальные для контроля опухоли, поскольку на качество Т-клеточного пула, доступного для этих антигенов, не влияет центральная Т-клеточная толерантность. В частности, основой неоантигенов могут быть индивидуальные опухолевые геномы. Потенциальные неоантигены можно предсказывать методами, известными специалисту в данной области, такими как секвенирование ракового генома или технологии глубокого секвенирования, позволяющие идентифицировать мутации в кодирующей белок области (ракового) генома.
Конкретными примерами ассоциированных с раком/опухолью, в частности связанных с опухолью или тканеспецифических антигенов, которые можно применять в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, являются (но, не ограничиваясь только ими) следующие антигены: предстательная железа: простатспецифический антиген (PSA), простатспецифический мембранный антиген (PSMA), PAP, PSCA (PNAS 95(4), 1998, сс. 1735-1740), антиген муцина простаты (РМА) (Beckett и Wright, Int. J. Cancer 62, 1995, cc. 703-710), простаза, Her-2neu, SPAS-1; меланома: TRP-2, тирозиназа, Melan A/Mart-1, gplOO, В AGE, GAGE, ганглиозид GM2; молочная железа: Her2-neu, кинезин 2, ТАТА-элемент модулирующего фактора 1, опухолевый белок D52, MAGE D, ING2, HIP-55, TGF-1 антиапоптозный фактор, HOM-Mel-40/SSX2, эпителиальный антиген (LEA 135), антиген DF31MUC1 (Apostolopoulos и др., Immunol. Cell. Biol. 74, 1996, cc. 457-464; Pandey и др., Cancer Res. 55, 1995, cc. 4000-4003); яички: MAGE-1, HOM-Mel-40/SSX2, NY-ESO-1; ободочная кишка: EGFR, CEA; легкое: MAGE D, EGFR; яичник: Her-2neu; мочевой пузырь: переходно-клеточная карцинома (ТСС) (Jones и др., Anticancer Res. 17, 1997, cc. 685-687), некоторые формы рака: Epha2, Epha4, PCDGF, НААН, мезотелин; ЕРСАМ; NY-ESO-1, гликопротеин MUC1 и муцины NIUC10 р5 (особенно мутантные версии), EGFR; смешанная опухоль: ассоциированный с раком сывороточный антиген (CASA) и раковый антиген 125 (СА 125) (Kierkegaard и др., Gynecol. Oncol. 59, 1995, cc. 251-254), эпителиальный гликопротеин 40 (EGP40) (Kievit и др., Int. J. Cancer 71, 1997, cc. 237-245), антиген плоскоклеточной карциномы (SCC) (Lozza и др., Anticancer Res. 17, 1997, cc. 525-529), катепсин E (Mota и др., Am. J Pathol. 150, 1997, cc. 1223-1229), тирозиназа в меланоме (Fishman и др., Cancer 79, 1997, cc. 1461-1464), ядерный антиген клеток (PCNA) церебральных каверном (Notelet и др., Surg. Neurol. 47, 1997, cc. 364-370), ассоциированный с опухолью аутоантиген 35 kD в папиллярной тиреоидной карциноме (Lucas и др., Anticancer Res. 16, 1996, cc. 2493-2496), CDC27 (включая мутантную форму белка), антигены триозофосфатизомеразы, 707-АР, микобактериальный антиген А60 (Macs и др., J. Cancer Res. Clin. Oncol. 122, 1996, cc. 296-300), аннексии II, AFP, ART-4, BAGE, β-катенин/m, BCL-2, bcr-abl, bcr-abl p190, bcr-abl p210, BRCA-1, BRCA-2, CA 19-9 (Tolliver и  South Med. J. 90, 1997, cc. 89-90; Tsuruta и др., Urol. Int. 58, 1997, cc. 20-24), CAMEL, CAP-1, CASP-8, CDC27/m, CDK-4/m, CEA (Huang и др., Exper Rev. Vaccines 1, 2002, cc. 49-63), CT9, CT10, Cyp-B, Dek-cain, DAM-6 (MAGE-B2), DAM-10 (MAGE-B1), EphA2 (Zantek и др., Cell Growth Differ. 10, 1999, cc. 629-638; Carles-Kinch и др., Cancer Res. 62, 2002, cc. 2840-2847), EphA4 (Cheng и др., Cytokine Growth Factor Rev. 13, 2002, cc. 75-85), ассоциированный с опухолью антиген Томсена-Фриденрайха (Dahlenborg и др., Int. J Cancer 70, 1997, cc. 63-71), ELF2M, ETV6-AML1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7B, GAGE-8, GnT-V, gp100 (Zajac и др., Int. J Cancer 71, 1997, cc. 491-496), HAGE, HER2/neu, HLA-A*0201-R170I, HPV-E7, HSP70-2M, HST-2, hTERT, hTRT, iCE, ингибиторы апоптоза (например, сурвивин), антиген аденокарциномы KH-1 (Deshpande и Danishefsky, Nature 387, 1997, cc. 164-166), KIAA0205, K-ras, LAGE, LAGE-1, LDLR/FUT, MAGE-1, MAGE-2, MAGE-3, MAGE-6, MAGE-A1, MAGE-A2, MAGE-А3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, MAGE-B5, MAGE-B6, MAGE-C2, MAGE-C3, MAGE D, MART-1, MART-1/Melan-A (Kawakami и Rosenberg, Int. Rev. Immunol. 14, 1997, cc. 173-192), MC1R, MDM-2, миозин/m, MUC1, MUC2, MUM-1, MUM-2, MUM-3, нео-полиА-полимераза, NA88-A, NY-ESO-1, NY-ESO-1a (CAG-3), PAGE-4, PAP, протеиназа 3 (Molldrem и др., Blood 88, 1996, cc. 2450-2457; Molldrem и др., Blood 90, 1997, cc. 2529-2534), P15, p190, Pm1/RARα, PRAME, PSA, PSM, PSMA, RAGE, RAS, RCAS1, RU1, RU2, SAGE, SART-1, SART-2, SART-3, SP17, SPAS-1, TEL/AML1, TPI/m, тирозиназа, TARP, TRP-1 (gp75), TRP-2, TRP-2/INT2, WT-1 и альтернативно транслируемые белки NY-ESO-ORF2 и CAMEL, полученные из генов NY-ESO-1 и LAGE-1. В данной области хорошо известны многочисленные другие раковые антигены.
South Med. J. 90, 1997, cc. 89-90; Tsuruta и др., Urol. Int. 58, 1997, cc. 20-24), CAMEL, CAP-1, CASP-8, CDC27/m, CDK-4/m, CEA (Huang и др., Exper Rev. Vaccines 1, 2002, cc. 49-63), CT9, CT10, Cyp-B, Dek-cain, DAM-6 (MAGE-B2), DAM-10 (MAGE-B1), EphA2 (Zantek и др., Cell Growth Differ. 10, 1999, cc. 629-638; Carles-Kinch и др., Cancer Res. 62, 2002, cc. 2840-2847), EphA4 (Cheng и др., Cytokine Growth Factor Rev. 13, 2002, cc. 75-85), ассоциированный с опухолью антиген Томсена-Фриденрайха (Dahlenborg и др., Int. J Cancer 70, 1997, cc. 63-71), ELF2M, ETV6-AML1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7B, GAGE-8, GnT-V, gp100 (Zajac и др., Int. J Cancer 71, 1997, cc. 491-496), HAGE, HER2/neu, HLA-A*0201-R170I, HPV-E7, HSP70-2M, HST-2, hTERT, hTRT, iCE, ингибиторы апоптоза (например, сурвивин), антиген аденокарциномы KH-1 (Deshpande и Danishefsky, Nature 387, 1997, cc. 164-166), KIAA0205, K-ras, LAGE, LAGE-1, LDLR/FUT, MAGE-1, MAGE-2, MAGE-3, MAGE-6, MAGE-A1, MAGE-A2, MAGE-А3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, MAGE-B5, MAGE-B6, MAGE-C2, MAGE-C3, MAGE D, MART-1, MART-1/Melan-A (Kawakami и Rosenberg, Int. Rev. Immunol. 14, 1997, cc. 173-192), MC1R, MDM-2, миозин/m, MUC1, MUC2, MUM-1, MUM-2, MUM-3, нео-полиА-полимераза, NA88-A, NY-ESO-1, NY-ESO-1a (CAG-3), PAGE-4, PAP, протеиназа 3 (Molldrem и др., Blood 88, 1996, cc. 2450-2457; Molldrem и др., Blood 90, 1997, cc. 2529-2534), P15, p190, Pm1/RARα, PRAME, PSA, PSM, PSMA, RAGE, RAS, RCAS1, RU1, RU2, SAGE, SART-1, SART-2, SART-3, SP17, SPAS-1, TEL/AML1, TPI/m, тирозиназа, TARP, TRP-1 (gp75), TRP-2, TRP-2/INT2, WT-1 и альтернативно транслируемые белки NY-ESO-ORF2 и CAMEL, полученные из генов NY-ESO-1 и LAGE-1. В данной области хорошо известны многочисленные другие раковые антигены.
Предпочтительно раковый/опухолевый антиген или раковый /опухолевый эпитоп представляет собой рекомбинантный раковый/опухолевый антиген или рекомбинантный раковый/опухолевый эпитоп. Указанный рекомбинантный раковый/опухолевый антиген или рекомбинантный раковый/опухолевый эпитоп можно создавать путем интродукции мутаций, который изменяют (добавление, делеция или замена) конкретные аминокислоты во всей аминокислотной последовательности нативного ракового/опухолевого антигена или нативного ракового/опухолевого эпитопа. Интродукция мутаций не изменяет раковый/опухолевый антиген или раковый/опухолевый эпитоп столь сильно, чтобы его уже нельзя было применять в качестве универсального для видов млекопитающих и предпочтительно человека или собак, но изменяют его в достаточной степени, чтобы образовавшаяся аминокислотная последовательность нарушала толерантность или рассматривалась в качестве чужеродного антигена для создания иммунного ответа. Другим путем может являться создание консенсусного рекомбинантного ракового/опухолевого антигена или ракового/опухолевого эпитопа, аминокислотная последовательность которого идентична по меньшей мере на 85% и вплоть до 99% последовательности соответствующего нативного ракового/опухолевого антигена или нативного ракового/опухолевого эпитопа; предпочтительно идентичность последовательности составляет по меньшей мере 90% и вплоть до 98% и; более предпочтительно идентичность последовательности составляет по меньшей мере 93% и вплоть до 98%; или еще более предпочтительно идентичность последовательности составляет по меньшей мере 95% и вплоть до 98%. В некоторых случаях аминокислотная последовательность рекомбинантного ракового/опухолевого антигена или рекомбинантного ракового/опухолевого эпитопа идентична на 95%, 96%, 97%, 98% или 99% последовательности соответствующего нативного ракового/опухолевого антигена или нативного ракового/опухолевого эпитопа. Нативный раковый/опухолевый антиген представляет собой антиген, ассоциированный в норме с конкретным раком или конкретной раковой опухолью. В зависимости от ракового/опухолевого антигена консенсусная последовательность ракового/опухолевого антигена может присутствовать в видах млекопитающих или в подтипах видов или вирусных штаммах или серотипах. Некоторые раковые/опухолевые антигены не отличаются значительно от аминокислотной последовательности дикого типа ракового/опухолевого антигена. Вышеописанные подходы можно объединять так, чтобы конечный рекомбинантный раковый/опухолевый антиген или раковый/опухолевый эпитоп имел указанный выше процент сходства с аминокислотной последовательностью нативного ракового антигена. Однако предпочтительно аминокислотная последовательность эпитопа ракового/опухолевого антигена, указанного в настоящем описании, не является мутантной и, следовательно, является идентичной референс-последовательности эпитопа.
В контексте настоящего описания понятие «эпитоп патогена» означает эпитоп антигенного белка, антигенного полисахарида, антигенного липида, антигенного липопротеина или антигенного гликолипида из патогена, включая вирусы, бактерии, грибы, простейших и многоклеточных паразитов. Антигенные белки, полисахариды, липиды, липопротеины или гликолипиды из патогенов включают в контексте настоящего описания белки, полисахариды, липиды, липопротеины и гликолипиды соответственно из патогенов, ответственных за заболевания, которые могут являться мишенью для вакцинации, включая, например, амебиаз, сибирскую язву, язву Бурули (Mycobacterium ulcerans), ассоциированную с калицивирусом диарею, кампилобактериальную диарею, рак шейки матки (папилломатоз человека), ассоциированные с Chlamydia trachomatis болезни половой системы, холеру, геморрагическую лихорадку Крым-Конго, лихорадку Денге, дифтерию, геморрагическую лихорадку Эбола, диарею, связанную с энтеропатогенной кишечной палочкой (ЕТЕС), рак желудка (Helicobacter pylori), гонорею, болезни, ассоциированные со стафилококком группы А, болезни, ассоциированные со стафилококком группы В, пневмонию и инвазивное заболевание, связанное с Haemophilus influenzae В, диарею, связанную с вирусом гепатита А, гепатита В, гепатита С, гепатита Е, генитальные язвы, связанные с вирусом герпеса простого типа 2, ВИЧ/СПИД, болезнь, связанную с нематодами, грипп, японский энцефалит, лихорадку Ласса, лейшманиоз, лептоспироз, рак печени (гепатит В), рак печени (гепатит С), болезнь Лайма, малярию, геморрагическую лихорадку Марбург, корь, эпидемический паротит, назофарингеальный рак (вирус Эпштейна-Барра), менингит, связанный с Neisseria meningitidis, пневмонию, связанную с вирусом парагриппа, коклюш, чуму, полиомиелит, бешенство, пневмонию, связанную с респираторно-синцитиальным вирусом (RSV), лихорадку Рифт-Валли, диарею, связанную с ротавирусом, краснуху, шистосомоз, серьезный острый респираторный синдром (SARS), шигеллез, оспу, болезни, ассоциированные с Staphylococcus aureus, рак желудка (Helicobacter pylori), стрептококковую пневмонию и инвазивное заболевание, столбняк, клещевой энцефалит, трахому, туберкулез, туляремию, тифозную лихорадку, болезнь, ассоциированную с вирусом Западного Нила, желтую лихорадку.
Предпочтительно по меньшей мере один антиген или антигенный эпитоп должен презентироваться на клеточной поверхности в контексте ГКГС класса I и/или ГКГС класса II, и/или в контексте CD1, при этом презентация на клеточной поверхности в контексте ГКГС класса I и/или ГКГС класса II является предпочтительной. Понятие «презентация эпитопа в контексте ГКГС класса I» относится, в частности, к CD8+-эпитопу, расположенному в (пептидсвязывающей) бороздке молекулы ГКГС класса I на поверхности клетки. Понятие «презентация эпитопа в контексте ГКГС класса II» относится, в частности, к CD4+-эпитопу, расположенному в бороздке молекулы ГКГС класса II на поверхности клетки. Понятие «презентация эпитопа в контексте CD1» относится, в частности, к липидному эпитопу, расположенному в бороздке молекул кластера дифференцировки 1 на поверхности клетки.
Целесообразно, чтобы комплекс, входящий в комбинацию, предлагаемую для применения согласно изобретению, содержал проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп и обеспечивал транспорт и презентацию указанных эпитопов на клеточной поверхности антигенпрезентирующих клеток в контексте ГКГС класса I и ГКГС класса II, и поэтому его можно применять для вакцинации и иммунотерапии.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере один антиген или антигенный эпитоп, который представляет собой по меньшей мере один CD4+-эпитоп и/или по меньшей мере один CD8+-эпитоп.
Понятия «CD4+-эпитоп» или «CD4+-ограниченный эпитоп» в контексте настоящего описания означают эпитоп, распознаваемый CD4+-Т-клеткой, указанный эпитоп, в частности, состоит из фрагмента антигена, расположенного в бороздке молекулы ГКГС класса II. Единичный CD4+-эпитоп, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, предпочтительно состоит примерно из 12-25 аминокислот. Он может состоять, например, примерно из 8-25 аминокислот или примерно 6-100 аминокислот.
Понятия «CD8+-эпитоп» или «CD8+-ограниченный эпитоп» в контексте настоящего описания означают эпитоп, распознаваемый CD8+-Т-клеткой, указанный эпитоп, в частности, состоит из фрагмента антигена, расположенного в бороздке молекулы ГКГС класса I. Единичный CD8+-эпитоп, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, предпочтительно состоит примерно из 8-11 аминокислот. Он может состоять, например, примерно из 8-15 аминокислот или примерно 6-100 аминокислот.
Предпочтительно по меньшей мере один антиген может содержать или по меньшей мере один антигенный эпитоп может состоять из CD4+-эпитопа и/или CD8+-эпитопа, соответствующего антигенной(ым) детерминанте(ам) ассоциированного с раком /опухолью антигена, специфического для рака/опухоли антигена или антигенного белка из патогена. Более предпочтительно по меньшей мере один антиген может содержать или по меньшей мере один антигенный эпитоп может состоять из CD4+-эпитопа и/или CD8+-эпитопа, соответствующего антигенной(ым) детерминанте(ам) ассоциированного с раком/опухолью антигена или специфического для рака/опухоли антигена. Наиболее предпочтительно по меньшей мере один антиген может содержать или по меньшей мере один антигенный эпитоп может состоять из CD4+-эпитопа и/или CD8+-эпитопа, соответствующего антигенной(ым) детерминанте(ам) ассоциированного с опухолью антигена или специфического для опухоли антигена.
Предпочтительно также, чтобы комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержал по меньшей мере два антигена или антигенных эпитопа, где по меньшей мере один антиген или антигенный эпитоп содержит или состоит из CD4+-эпитопа и по меньшей мере один антиген или антигенный эпитоп содержит или состоит из CD8+-эпитопа. В настоящее время установлено, что Th-клетки (CD4+) играют основную роль в противоопухолевом иммунном ответе, участвуя как в «лицензировании» DC, так и в рекрутменте и поддержании CTL (CD8+) в области опухоли. Таким образом, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, который содержит по меньшей мере два антигена или антигенных эпитопа, где по меньшей мере один антиген или антигенный эпитоп содержит или состоит из CD4+-эпитопа и по меньшей мере один антиген или антигенный эпитоп содержит или состоит из CD8+-эпитопа, обеспечивает интегрированный иммунный ответ, позволяющий одновременно примировать CTL и Th-клетки, и поэтому является предпочтительным по сравнению с иммунитетом против только одного CD8+-эпитопа или только одного CD4+-эпитопа. Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать Еальфа-CD4+-эпитоп и gp100-CD8+-эпитоп.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере два антигена или антигенных эпитопа, где по меньшей мере два антигена или антигенных эпитопа содержат или состоят по меньшей мере из двух, например, 2, 3, 4, 5, 6, 7, 8, 9 или большего количества CD4+-эпитопов и/или по меньшей мере из двух, например, 2, 3, 4, 5, 6, 7, 8, 9 или большего количества CD8+-эпитопов. При этом, по меньшей мере два антигена или антигенных эпитопа предпочтительно представляют собой различные антигены или антигенные эпитопы, более предпочтительно по меньшей мере два антигена или антигенных эпитопа отличаются друг от друга, но относятся к одному типу опухоли. Полиантигенная вакцина должна (I) предотвращать избыточный рост вариантов без антигена, (II) таргетировать различные опухолевые клетки в гетерогенной опухолевой массе и (III) преодолевать вариабельность опухолей от пациента к пациенту. Таким образом, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, наиболее предпочтительно содержит по меньшей мере четыре антигена или антигенных эпитопа, в частности, по меньшей мере два CD8+-эпитопа и по меньшей мере два CD4+-эпитопа. Указанный комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, индуцирует синергетическую функциональную активность полиэпитопных CD8-CTL и CD4-Th-клеток в отношении опухолевых клеток и усиливает эффективность противоопухолевого иммунитета. Th-клетки участвуют также в поддержании длительного клеточного иммунитета, который обнаружен после вакцинации. Указанный комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, индуцирует поликлональные полиэпитопные иммунные ответы и многофункциональные CD8+- и CD4+-Т-клетки, и поэтому обладает эффективной противоопухолевой активностью.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере два антигена или антигенных эпитопа, более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере три антигена или антигенных эпитопа, еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере четыре антигена или антигенных эпитопа, еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере пять антигенов или антигенных эпитопов, наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере шесть антигенов или антигенных эпитопов. Антигены или антигенные эпитопы, входящие в комплекс, могут быть одинаковыми или различными, предпочтительно антигены или антигенные эпитопы, входящие в комплекс, отличаются друг от друга. Предпочтительно комплекс содержит по меньшей мере один CD4+-эпитоп и по меньшей мере один CD8+-эпитоп.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит более одного CD4+-эпитопа, например, два или большее количество CD4+-эпитопов из одного и того же антигена или из различных антигенов, и предпочтительно не содержит CD8+-эпитоп. Предпочтительно также комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит более одного CD8+-эпитопа, например, два или большее количество CD8+-эпитопов из одного и того же антигена или из различных антигенов, и предпочтительно не содержит CD4+-эпитоп. Однако наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит (I) по меньшей мере один CD4+-эпитоп, например, два или большее количество CD4+-эпитопов из одного и того же антигена или из различных антигенов, и (II) по меньшей мере один CD8+-эпитоп, например, два или большее количество CD8+-эпитопов из одного и того же антигена или из различных антигенов.
Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать gp100-CD8+-эпитоп, Еальфа-CD4+-эпитоп и дополнительный CD4+-эпитоп и дополнительный CD8+-эпитоп. Еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий gp100-CD8+-эпитоп и Еальфа-CD4+-эпитоп. Например, указанный полипептид или белок, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 14, или вариантов указанной последовательности, указанных выше:

SEQ ID NO: 14 (MAD5-карго-молекула, содержащая эпитопы OVA-CD4+, gp100-CD8+, Еальфа-CD4+ и OVA-CD8+).
Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать gp70-CD8+-эпитоп и/или gp70-CD4+-эпитоп. Еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий gp70-CD8+-эпитоп и/или gp70-CD4+-эпитоп. Например, указанный полипептид или белок, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 36, или из вариантов указанной последовательности, указанных выше:
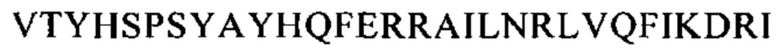
SEQ ID NO: 36 (Mad8-карго-молекула, содержащая эпитопы gp70-CD8+ и gp70-CD4+).
Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать по меньшей мере один эпитоп сурвивина, такой как CD8+-эпитоп сурвивина и/или CD4+-эпитоп сурвивина. Более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий CD8+-эпитоп сурвивина и/или CD4+-эпитоп сурвивина. Более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий более одного CD8+-эпитопа сурвивина и/или более одного CD4+-эпитопа сурвивина, например, два различных CD8+-эпитопа сурвивина. Например, указанный полипептид или белок, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 37, или из вариантов указанной последовательности, указанных выше:
SEQ ID NO: 37(Mad11-карго-молекула, содержащая CD8+-эпитоп 1 сурвивина и CD8+-эпитоп 2 сурвивина).
Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать по меньшей мере один эпитоп из неоантигена. Еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий эпитоп из неоантигена, такого как неоантиген из опухолевых клеток линии МС-38, идентифицированный Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576. Например, указанный полипептид или белок, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 38, или вариантов указанной последовательности, указанных выше:
SEQ ID NO: 38 (Mad9-карго-молекула, содержащая эпитоп из неоантигена, описанного у Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576). Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может предпочтительно содержать более одного, например, два или три эпитопа из неоантигенов. Еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать полипептид или белок, содержащий более одного, например, два или три эпитопа из неоантигенов, таких как неоантигены из опухолевых клеток линии МС-38, идентифицированные Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576. Например, указанный полипептид или белок, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 39, или вариантов указанной последовательности, указанных выше:
SEQ ID NO: 39 (Mad12-карго-молекула, содержащая эпитоп из неоантигена, описанного у Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576).
Предпочтительно по меньшей мере один антиген или антигенный эпитоп, содержащийся в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой пептид, полипептид или белок. Примеры антигена или антигенного эпитопа пептидной, полипептидной или белковой природы, которые можно применять в изобретении, включают раковые/опухолевые антигены или их антигенные эпитопы, аллергические антигены или их антигенные эпитопы, аутоиммунные аутоантигены или их антигенные эпитопы, антигены патогенов или их антигенные эпитопы, и антигены или их антигенные эпитопы из вирусов, предпочтительно из таких вирусов, как цитомегаловирус (CMV), ортопоксивирус натуральной оспы, ортопоксивирус белой оспы, парапоксивирус овец, вирус контагиозного моллюска, вирус герпеса простого 1, вирус герпеса простого 2, вирус герпеса В, варицелла-зостер вирус, вирус псевдобешенства, человеческий цитомегаловирус, человеческий вирус герпеса 6, человеческий вирус герпеса 7, вирус Эпштейна-Барра, человеческий вирус герпеса 8, вирус гепатита В, вирус лихорадки Чикунгунья, вирус лихорадки  рубивирус, вирус гепатита С, GB-вирус С, вирус Западного Нила, вирус Денге, вирус желтой лихорадки, вирус энцефаломиелита овец, вирус энцефалита Сент-Луис, вирус японского энцефалита В, вирус Повассан, FSME-вирус, SARS, SARS-ассоциированный короновирус, человеческий короновирус 229Е, человеческий короновирус Ос43, торовирус, человеческий Т-клеточный лимфотропный вирус типа I, человеческий Т-клеточный лимфотропный вирус типа II, ВИЧ (СПИД), т.е. вирус иммунодефицита человека типа 1 или вирус иммунодефицита человека типа 2, вирус гриппа, вирус Ласса, вирус лимфоцитарного хориомененгита, вирус Такарибе, вирус Хунин, вирус Мачупо, вирус болезни Борна, вирус Буньямвера, вирус калифорнийского энцефалита, вирус лихорадки Рифт-Валли, вирус флеботомной лихорадки, вирус Тоскана, вирус геморрагической лихорадки Крым-Конго, вирус Хазара, вирус Хасан, вирус Хантаан, вирус Сеул, вирус проспекта Хилл, вирус Пуумала, вирус Добрава-Белград, вирус Тула, вирус Син Номбре, Марбург-вирус озера Виктория, вирус Эбола Заир, вирус Эбола Судан, вирус Эбола Берег Слоновой Кости, вирус гриппа А, вирус гриппа В, вирус гриппа С, вирус парагриппа, малярийный паразит (Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae, Plasmodium knowlesi), Марбург-вирус, вирус кори, вирус эпидемического паротита, респираторно-сцинтиляционный вирус, человеческий метапневмовирус, индийский вирус везикулярного стоматита, вирус бешенства, вирус Мокола, вирус Дувенхаге, европейский лисавирус летучих мышей 1+2, австралийский лисавирус летучих мышей, аденовирус A-F, вирус папилломы человека, вирус кондиломы 6, вирус кондиломы 11, вирус полиомы, аденоассоциированный вирус 2, ротавирус, орбивирус, вирус оспы, включая вирус ветряной оспы и т.д., или антигены или антигенные эпитопы из лейшманий, трипаносом, амеб, бактерий и т.д., или можно выбирать из эпитопов или из вариантов указанных выше антигенов или антигенных эпитопов. Предпочтительно эпитопы, а также варианты антигенов, указанных выше, характеризуются гомологией или идентичностью последовательности, составляющей примерно 10%, в частности, по меньшей мере 10%, примерно 20%, в частности, по меньшей мере 20%, примерно 30%, в частности, по меньшей мере 30%, примерно 40%, в частности, по меньшей мере 40%, примерно 50%, в частности, по меньшей мере 50%, примерно 60%, в частности, по меньшей мере 60%, примерно 70%, в частности, по меньшей мере 70%, примерно 80%, в частности, по меньшей мере 80%, примерно 90%, в частности, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98%, с антигенами или последовательностями антигенов, представленными или описанными выше. В этом контексте определения эпитопов и вариантов соответствуют указанным выше.
рубивирус, вирус гепатита С, GB-вирус С, вирус Западного Нила, вирус Денге, вирус желтой лихорадки, вирус энцефаломиелита овец, вирус энцефалита Сент-Луис, вирус японского энцефалита В, вирус Повассан, FSME-вирус, SARS, SARS-ассоциированный короновирус, человеческий короновирус 229Е, человеческий короновирус Ос43, торовирус, человеческий Т-клеточный лимфотропный вирус типа I, человеческий Т-клеточный лимфотропный вирус типа II, ВИЧ (СПИД), т.е. вирус иммунодефицита человека типа 1 или вирус иммунодефицита человека типа 2, вирус гриппа, вирус Ласса, вирус лимфоцитарного хориомененгита, вирус Такарибе, вирус Хунин, вирус Мачупо, вирус болезни Борна, вирус Буньямвера, вирус калифорнийского энцефалита, вирус лихорадки Рифт-Валли, вирус флеботомной лихорадки, вирус Тоскана, вирус геморрагической лихорадки Крым-Конго, вирус Хазара, вирус Хасан, вирус Хантаан, вирус Сеул, вирус проспекта Хилл, вирус Пуумала, вирус Добрава-Белград, вирус Тула, вирус Син Номбре, Марбург-вирус озера Виктория, вирус Эбола Заир, вирус Эбола Судан, вирус Эбола Берег Слоновой Кости, вирус гриппа А, вирус гриппа В, вирус гриппа С, вирус парагриппа, малярийный паразит (Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae, Plasmodium knowlesi), Марбург-вирус, вирус кори, вирус эпидемического паротита, респираторно-сцинтиляционный вирус, человеческий метапневмовирус, индийский вирус везикулярного стоматита, вирус бешенства, вирус Мокола, вирус Дувенхаге, европейский лисавирус летучих мышей 1+2, австралийский лисавирус летучих мышей, аденовирус A-F, вирус папилломы человека, вирус кондиломы 6, вирус кондиломы 11, вирус полиомы, аденоассоциированный вирус 2, ротавирус, орбивирус, вирус оспы, включая вирус ветряной оспы и т.д., или антигены или антигенные эпитопы из лейшманий, трипаносом, амеб, бактерий и т.д., или можно выбирать из эпитопов или из вариантов указанных выше антигенов или антигенных эпитопов. Предпочтительно эпитопы, а также варианты антигенов, указанных выше, характеризуются гомологией или идентичностью последовательности, составляющей примерно 10%, в частности, по меньшей мере 10%, примерно 20%, в частности, по меньшей мере 20%, примерно 30%, в частности, по меньшей мере 30%, примерно 40%, в частности, по меньшей мере 40%, примерно 50%, в частности, по меньшей мере 50%, примерно 60%, в частности, по меньшей мере 60%, примерно 70%, в частности, по меньшей мере 70%, примерно 80%, в частности, по меньшей мере 80%, примерно 90%, в частности, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98%, с антигенами или последовательностями антигенов, представленными или описанными выше. В этом контексте определения эпитопов и вариантов соответствуют указанным выше.
Примеры антигенов или антигенных эпитопов, относящихся к категории пептида, полипептида или белка, включают комбинацию нескольких эпитопов глиомы, например, описанных у Novellino и др., Cancer Immunol Immunother, 54(3), 2005, сс. 187-207, Vigneron и др. Cancer Immun.13, 2013, с. 15). Однако индивидуальный комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать также только поднабор, т.е. один или несколько из всех указанных эпитопов глиомы. В таком случае предпочтительно различные комплексы, входящие в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержат различные поднаборы всех указанных эпитопов глиомы, так что, например, вакцина, предлагаемая в настоящем изобретении, содержащая указанные различные комплексы, содержит все указанные эпитопы глиомы, но распределенные в различные комплексы.
Кроме того, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать также по меньшей мере один антиген или антигенный эпитоп, где указанный антиген или антигенный эпитоп представляет собой полисахарид, липид, липопротеин и/или гликолипид, в частности, полисахаридный, липидный, липопротеиновый и/или гликолипидный эпитоп, который может, например, представлять собой эпитопы патогена, указанные в настоящем описании.
В частности, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать по меньшей мере один антиген или антигенный эпитоп, где указанный антиген или антигенный эпитоп представляет собой полисахаридный, липидный, липопротеиновый и/или гликолипидный эпитоп, включая антигены или антигенные эпитопы вирусов, бактерий, грибов, простейших и многоклеточных паразитов.
Предпочтительно указанные эпитопы должны презентироваться на клеточной поверхности в контексте ГКГС класса I и/или ГКГС класса II.
Предпочтительно указанные липидные эпитопы должны презентироваться на клеточной поверхности в контексте CD1 (кластер дифференцировки 1).
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может содержать по меньшей мере один антиген или антигенный эпитоп, где антиген или антигенный эпитоп представляет собой низкомолекулярное лекарственное средство или токсин.
Примеры карго-молекул, относящихся к категории низкомолекулярных лекарственных средств или токсинов, которые можно применять согласно изобретению, включают циклоспорин А, паклитаксел, доксорубицин, метотрексат, 5-аминолевулиновую кислоту, дифтерийный токсин, сунитиниб и молекулы, сведения о которых обобщены у De wit Amer, Neuro Oncol, 12(3), 2010, cc. 304-316).
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере один антиген или антигенный эпитоп, предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит более одного антигена или антигенного эпитопа, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее количество антигенов или антигенных эпитопов, более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит (по меньшей мере) два или три антигена или антигенных эпитопа, еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит (по меньшей мере) четыре или пять антигенов или антигенных эпитопов. Если в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержится более одного антигена или антигенного эпитопа, то очевидно, что указанный антиген или антигенный эпитоп, в частности, также ковалентно связан в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, например, с другим антигеном или антигенным эпитопом и/или с компонентом а), т.е. проникающим в клетку пептидом, и/или с компонентом в), т.е. пептидным агонистом TLR.
Различные антигены или антигенные эпитопы, входящие в комплекс, могут быть одинаковыми или различными. Предпочтительно различные антигены или антигенные эпитопы, входящие в комплекс, отличаются друг от друга, что приводит к образованию полиантигенного и/или полиэпитопного комплекса.
Кроме того, предпочтительно, чтобы более одного антигена или антигенного эпитопа, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее количество антигенов или антигенных эпитопов, располагались последовательно в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению. Это означает, в частности, что все антигены и/или антигенные эпитопы, входящие в комплекс, располагаются в виде участка, который не прерывается ни компонентом а), т.е. проникающим в клетку пептидом, ни компонентом в), т.е. пептидным агонистом TLR. Предпочтительно компонент а) и компонент в) расположены в комплексе, например, перед или после такого участка, состоящего из всех антигенов и/или антигенных эпитопов. Однако антигены и/или антигенные эпитопы, расположенные таким последовательным образом, могут соединяться друг с другом, например, с помощью спейсера или линкера, описанного ниже, который не является ни компонентом а), т.е. проникающим в клетку пептидом, ни компонентом в), т.е. пептидным агонистом TLR.
Однако в альтернативном варианте различные антигены и/или антигенные эпитопы могут располагаться также любым иным образом в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, например, когда компонент а) и/или компонент в) расположены между двумя или большим количеством антигенов и/или антигенных эпитопов, т.е. один или несколько антигенов и/или антигенных эпитопов расположены между компонентом а) и компонентом в) (или наоборот) и необязательно один или несколько антигенов и/или антигенных эпитопов расположены соответственно на другом конце компонента а) и/или компонента в).
Очевидно, что несколько различных антигенов или антигенных эпитопов, связанных с одним и тем же типом болезни, в частности, одним и тем же типом опухоли, целесообразно объединять в одном комплексе. Альтернативно этому, несколько различных антигенов или антигенных эпитопов, связанных с одним и тем же типом болезни, в частности, одним и тем же типом опухоли, можно подразделять на поднаборы различных антигенов или антигенных эпитопов, в частности, поднаборы, дополняющие друг друга в контексте определенного типа болезни, например, опухоли, которые входят в различные комплексы, при этом указанные различные комплексы, содержащие различные поднаборы, целесообразно вводить одновременно, например, в виде одной вакцины, индивидууму, который нуждается в этом.
Предпочтительно комплекс, предлагаемый в настоящем изобретении, содержит по меньшей мере один опухолевый эпитоп, представляющий собой эпитоп антигена, выбранного из группы, состоящей из ЕрСАМ, HER-2/neu, MUC-1, ТОММ34, RNF 43, KOC1, VEGFR, βhCG, сурвивина, СЕА, TGFβR2, р53, KRas, OGT, CASP5, СОА-1, MAGE, SART, IL13Rальфа2, CMV, EGFRvIII, EphA2, gp100, hTert, TRP-2, YKL-40, бревикана, нейролигина 4 и PTPRz1. Более предпочтительно комплекс, предлагаемый в настоящем изобретении, содержит по меньшей мере один опухолевый антиген, выбранный из группы, состоящей из ЕрСАМ, HER-2/neu, MUC-1, ТОММ34, RNF 43, KOC1, VEGFR, βhCG, сурвивина, СЕА, TGFβR2, р53, KRas, OGT, CASP5, СОА-1, MAGE, SART, IL13Rальфа2, CMV, EGFRvIII, EphA2, gp100, hTert, TRP-2, YKL-40, бревикана, нейролигина 4 и PTPRz1 или его фрагмента, варианта последовательности опухолевого антигена или варианта последовательности его фрагмента. Предпочтительно также комплекс, предлагаемый в настоящем изобретении, содержит по меньшей мере один опухолевый эпитоп, который представляет собой эпитоп антигена, выбранного из антигенов глиомы, описанных у Reardon D.A. и др., An update on vaccine therapy and other immunotherapeutic approaches for glioblastoma. Expert Rev Vaccines, 12(6), 2013, cc. 597-615.
В контексте настоящего описания «фрагмент» антигена содержит по меньшей мере 10 последовательно расположенных аминокислот антигена, предпочтительно по меньшей мере 15 последовательно расположенных аминокислот антигена, более предпочтительно по меньшей мере 20 последовательно расположенных аминокислот антигена, еще более предпочтительно по меньшей мере 25 последовательно расположенных аминокислот антигена и наиболее предпочтительно по меньшей мере 30 последовательно расположенных аминокислот антигена. «Вариант последовательности», указанный выше, означает вариант последовательности, имеющий (аминокислотную) последовательность, которая по меньшей мере на 70%, по меньшей мере на 75%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 99% идентична референс-последовательности. «Функциональный» вариант последовательности означает в контексте антигена/фрагмента антигена/эпитопа, что функция эпитопа(ов), например, входящего(их) в антиген (фрагмент), не нарушена или утрачена. Однако предпочтительно аминокислотная последовательность эпитопа(ов), например, входящего(их) в антиген (фрагмент), указанный в настоящем описании, не изменена в результате мутации и поэтому идентична референс-последовательности эпитопа.
Как описано выше, приемлемые раковые/опухолевые эпитопы указанных антигенов известны из литературы или их можно идентифицировать с использованием баз данных раковых/опухолевых эпитопов, например, описанных у van der Bruggen P., Stroobant V., Vigneron N., Van den Eynde B. Peptide database: T cell-defined tumor antigens. Cancer Immun, 2013; URL: http://www.cancerimmunity.org/peptide/, в которых человеческие опухолевые антигены, распознаваемые CD4+- или CD8+-Т-клетками классифицированы на 4 основные группы на основе схемы их экспрессии, или из базы данных «Tantigen» (TANTIGEN, версия 1.0, 1 декабря 2009 г., созданной Bioinformatics Core at Cancer Vaccine Center, Dana-Farber Cancer Institute; URL: http://cvc.dfci.harvard.edu/tadb/).
Компонент в) - Пептидный агонист TLR
В комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, пептидный агонист TLR обеспечивает повышенный направленный перенос вакцины к дендритным клеткам наряду с аутоиммуногенностью. Физическая связь пептидного агониста TLR с СРР и по меньшей мере одним антигеном или антигенным эпитопом в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, обеспечивает повышенный иммунный ответ путем одновременной стимуляции антигенпрезентирующих клеток, в частности дендритных клеток, которые интернализируют, метаболизируют и экспонируют антиген(ы).
В контексте настоящего изобретения «пептидный агонист TLR» представляет собой агонист Толл-подобного рецептора (TLR), т.е. он связывается с TLR и активирует TLR, в частности, приводя к биологическому ответу. Кроме того, пептидный агонист TLR представляет собой пептид, полипептид или белок, описанный выше. Предпочтительно пептидный агонист TLR содержит от 10 до 150 аминокислот, более предпочтительно от 15 до 130 аминокислот, еще более предпочтительно от 20 до 120 аминокислот, еще более предпочтительно от 25 до 110 аминокислот и наиболее предпочтительно от 30 до 100 аминокислот.
Толл-подобные рецепторы (TLR) представляют собой трансмембранные белки, характеризующиеся внеклеточным, трансмембранным и цитозольным доменами. Внеклеточные домены, содержащие богатые лейцином повторы (LRR) подковообразной формы, участвуют в распознавании стандартных молекулярных структур (паттернов) из разнообразных микробов. Толл-подобные рецепторы включают TLR 1-10. Соединения, обладающие способностью активировать TLR-рецепторы, и их модификации и производные, хорошо известны в данной области. TLR1 может активироваться бактериальными липопротеинами и их ацетилированными формами, TLR2 может в дополнение к указанному активироваться гликолипидами грамположительных бактерий, LPS, LPA, LTA, фимбриями, белками наружной мембраны, белками теплового шока из бактерий или из хозяина и липоарабиноманнанами микобактерий. TLR3 может актироваться dsPHK, в частности вирусного происхождения, или химическим соединением поли(LC). TLR4 может активироваться LPS, LTA грамотрицательных бактерий, белками теплового шока из хозяина или бактериального происхождения, белками покрытия или оболочки вирусов, таксолом или его производными, содержащими гиалуронан олигосахаридами и фиброненктинами. TLR5 может активироваться бактериальными флагеллами или флагеллином. TLR6 может активироваться липопротеинами микобактерий и чувствительным к тепловой обработке растворимым фактором стрептококков группы В (GBS- F) или модулинами стафилококков. TLR7 может активироваться имидазохинолинами. TLR9 может активироваться комплексами неметилированный CpG-ДНК или хроматин-IgG.
Предпочтительно пептидный агонист TLR, входящий в комплекс, который выходит в комбинацию, предлагаемую для применения согласно настоящему изобретению, является агонистом TLR1, 2, 4, 5, 6 и/или 10. TLR экспрессируются либо на клеточной поверхности (TLR1, 2, 4, 5, 6 и 10), либо на мембранах внутриклеточных органелл, таких как эндосомы (TLR3, 4, 7, 8 и 9). Известные встречающиеся в естественных условиях лиганды для эндосомальных рецепторов представляют собой молекулы на основе нуклеиновых кислот (за исключением TLR4). Экспрессируемые на клеточной поверхности TLR1, 2, 4, 5, 6 и 10 распознают молекулярные паттерны внеклеточных микробов (Monie Т.Р., Bryant С.Е. и др. Activating immunity: Lessons from the TLRs and NLRs. Trends Biochem. Sci. 34(11), 2009, cc. 553-561). TLR экспрессируются на нескольких клеточных типах, но фактически все TLR экспрессируются на DC, обеспечивая этим специализированным клеткам чувствительность ко всем возможным патогенам и сигналам опасности.
При этом TLR2, 4 и 5 конститутивно экспрессируются на поверхности DC. Таким образом, пептидный агонист TLR, содержащийся в комплексе, который выходит в комбинацию, предлагаемую для применения согласно настоящему изобретению, более предпочтительно представляет собой пептидный агонист TLR2, TLR4 и/или TLR5. Еще более предпочтительно пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4. Наиболее предпочтительно пептидный агонист TLR представляет собой пептидный агонист TLR4. Наиболее предпочтительно пептидный агонист TLR представляет собой пептидный агонист TLR, который является агонистом и TLR2, и TLR4. TLR2 может обнаруживать широкое разнообразие лигандов, полученных из бактерий, вирусов, паразитов и грибов. Специфичность лиганда часто определяют по взаимодействию TLR2 с другими TLR, такими как TLR1, 6 или 10, или не относящимися к TLR молекулами, такими как дектин-1, CD 14 или CD36. Образование гетеродимера с TLR1 позволят TLR2 идентифицировать триацильные липопротеины или липопептиды (мико)бактериального происхождения, такие как Pam3CSK4 и пептидогликан (PGA; Gay N.J. и Gangloff М., Structure and function of Toll receptors and their ligands. Annu. Rev. Biochem. 76, 2007, cc. 141-165; Spohn R., Buwitt-Beckmann U. и др., Synthetic lipopeptide adjuvants and Toll-like receptor 2-Structure-activity relationships. Vaccine 22(19), 2004, cc. 2494-2499). Гетеродимеризация TLR2 и 6 позволяет обнаруживать диацильные липопептиды и зимозан. Липополисахарид (LPS) и его производные являются лигандами для TLR4, а флагеллин для TLR5 (Bryant С.Е., Spring D.R. и др., The molecular basis of the host response to lipopolysaccharide. Nat. Rev. Microbiol. 8(1), 2010, cc. 8-14).
TLR2 взаимодействует с широким спектром обладающих структурным разнообразием лигандов, включая молекулы, экспрессируемые микробами и грибами. Идентифицировано множество агонистов TLR2, включая встречающиеся в естественных условиях и синтетические липопептиды (например, активирующий макрофаги липопептид Mycoplasma fermentas (MALP-2)), пептидогликаны (PG, например, из S. aureus), липополисахариды (LPS) из различных штаммов бактерий, полисахариды (например, зимозан), заякоренные гликозилфосфофатидилинозитолом структуры из грамположительных бактерий (например, липотейхоевая кислота (LTA) и липоарабиноманнан из микобактерий и липоманнаны из М. tuberculosis). Некоторые вирусные детерминанты могут также «запускаться» через TLR2 (Barbalat R., Lau L., Locksley R.M., Barton G.M. Toll-like receptor 2 on inflammatory monocytes induces type I interferon in response to viral but not bacterial ligands. Nat Immunol. 10(11), 2009, cc. 1200-1207). Бактериальные липопептиды являются структурными компонентами клеточных оболочек. Они состоят из ацилированного s-глицерилцистеинового остатка, с которым пептид может быть конъюгирован через цистеиновый остаток. Примеры агонистов TLR2, представляющих собой бактериальные липопептиды, включают MALP-2 и его синтетический аналог дипальмитоил-S-глицерилцистеин (Pam2Cys) или трипальмитоил-S-глицерилцистеин (Pam3Cys).
Множество лигандов взаимодействует с TLR4, включая монофосфорил-липид А из Salmonella minnesota R595 (MPLA), липополисахариды (LPS), маннаны (Candida albicans), гликоинозитолфосфолипиды (Trypanosoma), вирусные оболочечные белки (RSV и MMTV) и эндогенные антигены, включая фибриноген и белки теплового шока. Указанные агонисты TLR4 описаны, например, у Akira S., Uematsu S., Takeuchi О., Pathogen recognition and innate immunity. Cell. 124(4), 24 февраля 2006 г., cc. 783-801 или у Kumar H., Kawai Т., Akira S., Toll-like receptors and innate immunity. Biochem Biophys Res Commun. 388(4), 30 октября 2009 г., cc. 621-625. LPS, который обнаружен в наружных мембранах грамотрицательных бактерий, является наиболее широко изученным из лигандов TLR4. Приемлемые полученные из LPS пептидные агонисты TLR4 описаны, например, в WO 2013/120073 (А1).
TLR5 «запускается» областью молекулы флагеллина, экспрессируемой практически всеми подвижными бактериями. Так, флагеллин или пептиды или белки, полученные из флагеллина и/или вариантов или фрагментов флагеллина, также пригодны в качестве пептидных агонистов TLR, входящих в комплекс.
Таким образом, примеры пептидных агонистов TLR включают липопептидные агонисты TLR2 MALP-2, Pam2Cys и Pam3Cys или их модификации, различные формы LPS-агонистов TLR4, например, L3-LPS N. meningitidis дикого типа и мутантный пентаацилированный LpxL1-LPS, и агонист TLR5 флагеллин.
Однако предпочтительно, чтобы пептидный агонист TLR, входящий в комплекс, не представлял собой ни липопептид, ни липопротеин, ни гликопептид, ни гликопротеин, более предпочтительно, пептидный агонист TLR, входящий в комплекс, представляет собой классический пептид, полипептид или белок, указанный в настоящем описании.
Предпочтительным агонистом TLR2 является аннексии II или его иммуномодуляторный фрагмент, который подробно описан в WO 2012/048190 А1 и заявке на патент США 13/0331546, в частности, предпочтительными являются пептидный агонист TLR2, который содержит аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 7, описанную в WO 2012/048190 A1, или его фрагменты или варианты.
Таким образом, пептидный агонист TLR2, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 15 или варианта этой последовательности, описанного выше, является наиболее предпочтительным в качестве компонента в), т.е. в качестве по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
STVHEILCKLSLEGDHSTPPSAYGSVKPYTNFDAE SEQ ID NO: 15 (пептидный агонист TLR2 Anaxa).
Наиболее предпочтительным функциональным вариантом последовательности пептидного агониста TLR, имеющего SEQ ID NO: 15, является пептидный агонист TLR, представленный в SEQ ID NO: 47:
STVHEILSKLSLEGDHSTPPSAYGSVKPYTNFDAE SEQ ID NO: 47.
Таким образом, пептидный агонист TLR2, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 47 или варианта этой последовательности, описанного выше, является наиболее предпочтительным в качестве компонента в), т.е. в качестве по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
Касательно TLR4, то наиболее предпочтительными пептидными агонистами TLR, являются агонисты, которые соответствуют мотивам, которые связываются с TLR4, в частности, (I) пептиды, имитирующие встречающийся в естественных условиях лиганд LPS (RS01: Gln-Glu-Ile-Asn-Ser-Ser-Tyr и RS09: Ala-Pro-Pro-His-Ala-Leu-Ser), и (II) полученные из фибронектина пептиды. Клеточный гликопротеин фибронектин (FN) имеет множество изоформ, созданных из одного гена в результате альтернативного сплайсинга трех экзонов. Одна из этих изоформ представляет собой экстра-домен A (EDA), который взаимодействует с TLR4.
Другие приемлемые пептидные агонисты TLR содержат EDA-домен фибронектина или его фрагмент или вариант. Указанные приемлемые EDA-домены фибронектина или их фрагменты или варианты описаны в ЕР 1913954 В1, ЕР 2476440 A1, US 2009/0220532 A1 и WO 2011/101332 A1. Таким образом, пептидный агонист TLR4, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 40 или варианта этой последовательности, описанного выше, является наиболее предпочтительным в качестве компонента в), т.е. в качестве по меньшей мере одного пептидного агониста TLR, содержащегося в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению.

Кроме того, белок 1 высокомобильной группы (белок из группы ядерных негистоновых белков HMG) (HMGB1) и его пептидные фрагменты, как предполагается, могут являться агонистами для TLR4. Указанные полученные из HMGB1 пептиды описаны, например, в US 2011/0236406 A1.
Кроме того, агонист TLR, представленный в SEQ ID NO: 15, и агонист TLR, представленный в SEQ ID NO: 47, могут действовать в качестве агониста TLR4. Таким образом, пептидный агонист TLR4, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 15 или 47 или функционального варианта этой последовательности, является наиболее предпочтительным в качестве компонента в), т.е. в качестве по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит по меньшей мере один пептидный агонист TLR, предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит более одного пептидного агониста TLR, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более пептидных агонистов TLR, более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит (по меньшей мере) два или три пептидных агониста TLR, еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит (по меньшей мере) четыре или пять пептидных агонистов TLR. Если в комплексе содержится более одного пептидного агониста TLR, то, как должно быть очевидно, указанный пептидный агонист TLR также, в частности, ковалентно связан в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, например, с другим пептидным агонистом TLR и/или с компонентом а), т.е. проникающим в клетку пептидом, и/или с компонентом б), т.е. антигеном или антигенным эпитопом.
В наиболее предпочтительном варианте осуществления изобретения комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит один единственный пептидный агонист TLR. В частности, в указанном наиболее предпочтительном варианте осуществления изобретения комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит один единственный пептидный агонист TLR и в нем не присутствует никакой дополнительный компонент, обладающий свойствами агониста TLR, за исключением одного единственного указанного выше пептидного агониста TLR.
Различные пептидные агонисты TLR, входящие в комплекс, могут быть одинаковыми или различными. Предпочтительно различные пептидные агонисты TLR, входящие в комплекс, отличаются друг от друга.
Кроме того, предпочтительно, чтобы более одного антигена или антигенного эпитопа, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10 антигенов или антигенных эпитопов, или более одного пептидного агониста TLR, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10 агонистов TLR, располагались последовательно в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению. Это означает, в частности, что все пептидные агонисты TLR, входящие в комплекс, располагаются в виде участка, который не прерывается ни компонентом а), т.е. проникающим в клетку пептидом, ни компонентом б), т.е. по меньшей мере одним антигеном или антигенным эпитопом. Предпочтительно компонент а) и компонент б) располагаются в комплексе, например, до или после указанного участка из всех пептидных агонистов TLR. Однако пептидные агонисты TLR, расположенные таким последовательным образом, могут соединяться друг с другом, например, с помощью спейсера или линкера, описанного ниже, который не является ни компонентом а), т.е. проникающим в клетку пептидом, ни компонентом б), т.е. по меньшей мере одним антигеном или антигенным эпитопом.
Однако альтернативно этому различные пептидные агонисты TLR можно располагать также любым другим образом в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, например, с компонентом а) и/или компонентом б), расположенным между двумя или большим количеством пептидных агонистов TLR, т.е. с одним или большим количеством пептидных агонистов TLR, расположенных между компонентом а) и компонентом б) (или наоборот) и необязательно с одним или несколькими пептидными агонистами TLR, расположенными на соответствующем другом конце компонента а) и/или компонента б).
Должно быть очевидно, что может оказаться целесообразным, чтобы несколько различных пептидных агонистов TLR, активирующих одинаковые или различные TLR-рецепторы, входили в один комплекс. Альтернативно этому несколько различных пептидных агонистов TLR, активирующих одинаковые или различные TLR-рецепторы, можно подразделять на поднаборы различных пептидных агонистов TLR, активирующих одинаковые или различные TLR-рецепторы, которые входят в различные комплексы, при этом, указанные различные комплексы, содержащие различные поднаборы, целесообразно вводить одновременно, например, в виде одной вакцины, индивидууму, который нуждается в этом.
Соединение компонентов а), б) и в) в комплексе
В комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, компоненты а), б) и в) ковалентно связаны, т.е. связь между двумя из трех компонентов а), б) и в) в комплексе представляет собой ковалентную связь. Предпочтительно два из трех компонентов а), б) и в) комплекса (т.е. «первый» и «второй» компонент) ковалентно связаны друг с другом, а третий компонент из трех компонентов а), б) и в) ковалентно связан либо с первым компонентом из трех компонентов а), б) и в), либо со вторым компонентом из трех компонентов а), б) и в). Тем самым предпочтительно образуется линейная молекула. Однако также возможно, чтобы каждый из трех компонентов а), б) и в) был ковалентно связан с обоими другими компонентами из трех компонентов а), б) и в).
Понятие «ковалентное соединение» (также ковалентная связь) в контексте настоящего изобретения относится к химической связи, которая включает перекрытие («обобществление») электронных пар между атомами. «Ковалентное соединение» (также ковалентная связь) включает, в частности, стабильный баланс сил притяжения и отталкивания между атомами, когда они имеют общие электроны. Для многих молекул обобществление электронов позволяет каждому атому достигать состояния полной внешней оболочки, соответствующего стабильной электронной конфигурации. Ковалентное связывание включает много типов взаимодействий, включая, например, σ-связывание, π-связывание, связывание по типу металл-с-металлом, агонистические взаимодействия и трехцентровые двухэлектронные связи. Таким образом, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно обозначать также как «соединение», в частности, его можно обозначать как «молекула».
Предпочтительно в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, компоненты а), б) и в) ковалентно связаны путем химического сочетания любым приемлемым путем, известным в данной области, например, методами перекрестного сшивания. Однако следует учитывать тот факт, что многие известные методы химического перекрестного сшивания являются неспецифическими, т.е. они не направляют точку сочетания к какому-либо конкретному положению на компонентах а), б) и в). Таким образом, применяемые неспецифические перекрестносшивающие агенты могут атаковать функциональные сайты или стерически блокировать активные сайты, делая слитые компоненты комплекса биологически неактивными. Специалисту в данной области известно, как блокировать потенциально реактивные группы путем применения соответствующих защитных групп. Альтернативно этому, можно применять методики на основе сильного и универсального лигирования оксима и гидразона, которые представляют собой хемоселективные субстанции, пригодные для перекрестного сшивания компонентов а), б) и в). Указанная технология связывания описана, например, у Rose и др., JACS 116, 1994, с. 30.
Специфичность сочетания можно повышать путем прямого химического связывания с функциональной группой, которая встречается только один раз или несколько раз в компонентах а), б) и/или в), при этом функциональную группу можно перекрестно связывать с другой, присутствующей в компонентах а), б) или в). Так, например, можно применять тиольную группу цистеина, если только один остаток цистеина присутствует в конкретном компоненте а), б) или в) комплекса, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению. Так, например, если конкретный компонент а), б) или в) не содержит остатки лизина, то перекрестносшивающий реагент, специфический для первичных аминов, может быть селективным для аминоконца соответствующего компонента. Альтернативно этому, перекрестное сшивание можно осуществлять также через боковую цепь остатка глутаминовой кислоты, расположенного на N-конце пептида, в результате чего можно создавать амидную связь через ее боковую цепь. Таким образом, может оказаться целесообразным связывать остаток глутаминовой кислоты с N-концом конкретного компонента а), б) или в). Однако, если цистеиновый остаток подлежит интродукции в конкретный компонент а), б) или в), то предпочтительной является интродукция на N- или С-конец или вблизи него. Известны общепринятые методы для осуществления таких изменений аминокислотных последовательностей, основанные на модификациях конкретного компонента а), б) или в), либо путем добавления одной или нескольких дополнительных аминокислот, например, среди прочего, остатка цистеина, для транслоцирования последовательности, либо путем замены по меньшей мере одного остатка транслоцированной(ых) последовательности(ей), входящей(их) в соответствующий компонент. В случае, когда боковую цепь цистеина используют для целей сочетания, то конкретный компонент а), б) или в) предпочтительно имеет один остаток цистеина. Любой второй остаток цистеина предпочтительно не требуется и его можно необязательно заменять, когда он присутствует в соответствующем компоненте, который входит в комплекс. Когда остаток цистеина заменяют в исходной последовательности конкретного компонента а), б) или в), то, как правило, требуется минимизировать образовавшиеся изменения в укладке пептида соответствующего компонента. Изменения в укладке минимизируют, когда замена представляет собой химически и стерически сходную с цистеином замену. Так, серии является предпочтительной заменой для цистеина.
Сочетание двух из трех компонентов а), б) и в) можно осуществлять с помощью связывающего или конъюгирующего агента, используя стандартные связывающие реагенты для синтеза пептидов, такие как HOBt, HBTU, DICI, TBTU. Известно несколько агентов, осуществляющих межмолекулярное перекрестное сшивание, которые можно использовать, см. например. Means и Feeney, Chemical Modification of Proteins, изд-во Holden-Day, 1974, cc 39-43. Среди этих реагентов следует отметить, например, N-сукцинимидил-3-пиридилдитио)пропионат (SPDP) или N,N'-(1,3-фенилен)бисмалеимид; N,N'-этилен-бис(йодацетамид) или другой такой реагент, имеющий метиленовые мостики, содержащие 6-11 атомов углерода; и 1,5-дифтор-2,4-динитробензол. Другие перекрестносшивающие агенты, которые можно применять для этой цели, включают:  диметиладипимидат; фенол-1,4-дисульфонилхлорид; гексаметилендиизоцианат или диизотиоцианат или
диметиладипимидат; фенол-1,4-дисульфонилхлорид; гексаметилендиизоцианат или диизотиоцианат или 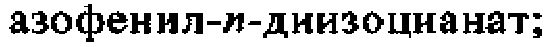 глутаровый альдегид и дисдиазобензидин. Перекрестносшивающие агенты могут быть гомобифункциональными, т.е. иметь две функциональные группы, которые подвергаются одинаковой реакции. Предпочтительным гомобифункциональным перекрестносшивающим агентом является бисмалеимидогексан (ВМН). ВМН содержит две малеимидные функциональные группы, которые взаимодействуют специфически с содержащими сульфгидрил соединениями в мягких условиях (рН 6,5-7,7). Две малеимидные группы соединены углеводородной цепью. Таким образом, ВМН можно применять для необратимого перекрестного сшивания белков (или полипептидов), которые содержат остатки цистеина. Перекрестносшивающие агенты могут быть также гетеробифункциональными. Гетеробифункциональные перекрестносшивающие агенты имеют две различные функциональные группы, например, амино-реактивную группу и тиол-реактивную группу, которые могут перекрестно сшивать два белка, имеющие свободные амины и тиолы соответственно. Примерами гетеробифункциональных перекрестеносшивающих агентов являются сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), сложный м-малеимидобензоил-N-гидроксисукцинимидиловый эфир (MBS) и
глутаровый альдегид и дисдиазобензидин. Перекрестносшивающие агенты могут быть гомобифункциональными, т.е. иметь две функциональные группы, которые подвергаются одинаковой реакции. Предпочтительным гомобифункциональным перекрестносшивающим агентом является бисмалеимидогексан (ВМН). ВМН содержит две малеимидные функциональные группы, которые взаимодействуют специфически с содержащими сульфгидрил соединениями в мягких условиях (рН 6,5-7,7). Две малеимидные группы соединены углеводородной цепью. Таким образом, ВМН можно применять для необратимого перекрестного сшивания белков (или полипептидов), которые содержат остатки цистеина. Перекрестносшивающие агенты могут быть также гетеробифункциональными. Гетеробифункциональные перекрестносшивающие агенты имеют две различные функциональные группы, например, амино-реактивную группу и тиол-реактивную группу, которые могут перекрестно сшивать два белка, имеющие свободные амины и тиолы соответственно. Примерами гетеробифункциональных перекрестеносшивающих агентов являются сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), сложный м-малеимидобензоил-N-гидроксисукцинимидиловый эфир (MBS) и 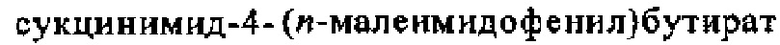 (SMPB) и аналог с удлиненной цепью MBS. Сукцинимидильная группа указанных перекрестносшивающих агентов взаимодействует с первичным амином, тиол-реактивный малеимид образует ковалентную связь с тиолом остатка цистеина. Поскольку перекрестносшивающие агенты часто обладают низкой растворимостью в воде, гидрофильный остаток, такой как сульфонатная группа, можно добавлять к перекрестносшивающему агенту для повышения его растворимости в воде. Сульфо-MBS и сульфо-SMCC являются примерами перекрестносшивающих агентов, модифицированных для растворимости в воде. Многие перекрестносшивающие агенты образуют конъюгат, который практически не расщепляется в условиях клетки. Таким образом, некоторые перекрестносшивающие агенты содержат ковалентную связь, такую как дисульфид, которая может расщепляться в условиях клетки. Например, реагент Траута, дитиобис(сукцинимидилпропионат) (DSP) и N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) являются хорошо известными расщепляемыми перекрестносшивающими агентами.
(SMPB) и аналог с удлиненной цепью MBS. Сукцинимидильная группа указанных перекрестносшивающих агентов взаимодействует с первичным амином, тиол-реактивный малеимид образует ковалентную связь с тиолом остатка цистеина. Поскольку перекрестносшивающие агенты часто обладают низкой растворимостью в воде, гидрофильный остаток, такой как сульфонатная группа, можно добавлять к перекрестносшивающему агенту для повышения его растворимости в воде. Сульфо-MBS и сульфо-SMCC являются примерами перекрестносшивающих агентов, модифицированных для растворимости в воде. Многие перекрестносшивающие агенты образуют конъюгат, который практически не расщепляется в условиях клетки. Таким образом, некоторые перекрестносшивающие агенты содержат ковалентную связь, такую как дисульфид, которая может расщепляться в условиях клетки. Например, реагент Траута, дитиобис(сукцинимидилпропионат) (DSP) и N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) являются хорошо известными расщепляемыми перекрестносшивающими агентами.
Применение расщепляемого перекрестносшивающего агента позволяет проникающему в клетку пептиду, по меньшей мере одному антигену или антигенному эпитопу и по меньшей мере одному пептидному агонисту TLR, которые образуют комплекс, отделяться друг от друга после их доставки в клетку-мишень. Для этой цели можно применять также прямую дисульфидную связь. Химическое перекрестное сшивание может включать также применение спейсерных плечей. Спейсерные плечи обеспечивают внутримолекулярную гибкость или позволяют регулировать внутримолекулярные расстояния между конъюгированными фрагментами и поэтому могут способствовать сохранению биологической активности. Спейсерное плечо может находиться в форме белкового (или полипептидного) фрагмента, который включает спейсерные аминокислоты, например, пролин. Альтернативно этому, спейсерное плечо может являться частью перекрестносшивающего агента, такого как «длинноцепочечный SPDP» (фирма Pierce Chem. Co., Рокфорд, шт. Иллинойс, каталожный №21651 Н). Многочисленные перекрестносшивающие агенты, включая описанные выше, поступают в продажу. Подробные инструкции по их применению доступны от коммерческих поставщиков. Более подробную информацию о перекрестном сшивании белков и получении конъюгатов, которые можно применять в контексте связывания компонентов а), б) и в), образующих комплекс, можно почерпнуть из: Wong, Chemistry of Protein Conjugation and Cross-Linking, изд-во CRC Press, 1991.
Перекрестносшивающие агенты для перекрестного сшивания пептида или белка включают, например, (I) агенты, обеспечивающие перекрестное сшивание по типу амин-амин, например, гомобифункциональные амино-специфические белковые перекрестносшивающие реагенты на основе реактивных группы сложного NHS-эфира и сложного имидоэфира для селективной конъюгации первичных аминов; доступны в виде коротких, длинных, расщепляемых, необратимых, проникающих через мембраны и находящихся на клеточной поверхности вариантов; (II) агенты, обеспечивающие перекрестное сшивание по типу сульфгидрил-углевод, например, перекрестносшивающие реагенты на основе реактивных групп малеимида и гидразида для конъюгации и образования ковалентных перекрестных связей; (III) агенты, обеспечивающие перекрестное сшивание по типу сульфгидрил-сульфгидрил, например, гомобифункциональные сульфгидрил-специфические перекрестносшивающие реагенты на основе реактивных групп малеимида или пиридилдитиола для избирательной ковалентной конъюгации тиолов белка и пептида (восстановленные цистеины) для образования стабильных тиоэфирных связей; (IV) фотореактивные перекрестносшивающие агенты, например, арилазид, диазирин и другие фотореактивные (активируемые светом) химические гетеробифункциональные перекрестносшивающие агенты для конъюгации белков, нуклеиновых кислот и других молекулярных структур, участвующих в образовании комплексов рецептор-лиганд посредством двухстадийной активации; (V) агенты, обеспечивающие перекрестное сшивание по типу амин-сульфгидрил, например, гетеробифункциональные перекрестносшивающие агенты для белков для конъюгации между первичным амином (лизин) и сульфгидрильными (цистеин) группами белков и других молекул; доступны со спейсерными плечами различной длины и типов; и (VI) агенты, обеспечивающие перекрестное сшивание по типу карбоксил-амин, например, перекрестносшивающие реагенты на основе карбодиимида, DCC и EDC (EDAC), для конъюгации карбоксильных групп (глутамат, аспартат, С-концы) с первичными аминами (лизин, N-концы), а также N-гидроксисукцинимид (NHS) для стабильной активации карбоксилатов для конъюгации с амином.
В целом, примеры перекрестносшивающих агентов, которые можно применять в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, включают сложный N-(α-малеимидоацетокси)сукцинимидиловый эфир, N-5-азидо-2-нитробензилоксисукцинимид, 1,4-бисмалеимидобутан, 1,4-бисмалеимидил-2,3-дигидроксибутан, бисмалеимидогексан, бисмалеимидоэтан, гидразид N-(β-малеимидопропионовой кислоты)×TFA, сложный N-(β-малеимидопропилокси)сукцинимидиловый эфир, 1,8-бисмалеимидодиэтиленгликоль, 1,11-бисмалеимидотриэтиленгликоль, бис(сульфосукцинимидил)суберат, бис(сульфосукцинимидил)глутарат-d0, бис(сульфосукцинимидил)-2,2,4,4-глутарат-d4, бис(сульфосукцинимидил)суберат-d0, бис(сульфосукцинимидил)-2,2,7,7-суберат-d4, бис(NHS)ПЭГ5, бис(NHS)ПЭГ9, бис(2-[сукцинимидоксикарбонилокси]этил)сульфон, N,N-дициклогексилкарбодиимид, 1-5-дифтор-2,4-динитробензол, диметиладипимидат×HCI, диметилпимелимидат×2HCI, диметилсуберимидат×2HCl, дисукцинимидилглутарат, дитиобис(скуцимидилпропионат) (реагент Ломанта), дисукцинимидилсуберат, дисукцинимидилтартрат, диметил-3,3'-дитиобиспропионимидат×2HCI, дитиобисмалеимидоэтан, 3,3'-дитиобис(сульфосукцинимидилпропионат), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, этиленгликоль-бис(сукцинимидилсукцинат), N-ε-малеимидокапроновую кислоту, гидразид N-(ε-малеимидокапроновой кислоты), сложный N-(ε-малеимидокапроилокси)сукцинимидиловый эфир, N-(γ-малеимидобутирилокси) сукцинимидиловый эфир, гидразид N-(κ-малеимидоундекановой кислоты), NHS-LC-диазирин, сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси(6-амидокапроат), сукцинимидил-6-(3'-[2-пиридилтио]пропионамидо)гексаноат, L-фото-лейцин, L-фото-метионин, сложный м-малеимидобензоил-N-гидроксисукцинимидиловый эфир, гидразид 4-(4-N-малеимидофенил)масляной кислоты×HCI, 2-[N2-(4-азидо-2,3,5,6-тетрафторбензоил)-N6-(6-биотинамидокапроил)-L-лизинил]этилметантиосульфат, 2-{N2-[N6-(4-азидо-2,3,5,6-тетрафторбензоил)-N6-(6-биотинамидокапроил)-L-лизинил]}этилметантиосульфат, N-гидроксисукцинимид, сложный N-гидроксисукцинимидиловый эфир этаназида, сложный N-гидроксисукцинимидиловый эфир тетраоксапентадеканазида, сложный N-гидроксисукцинимидиловый эфир додекаоксанонатриаконтаназида, NHS-фосфин, 3-(2-пиридилтио)пропионилгидразид, 2-пиридилдитиолтетраоксатетрадекан-N-гидроксисукцинимид, 2-пиридилдитиолтетраоксаоктатриаконтан-N-гидроксисукцинимид, 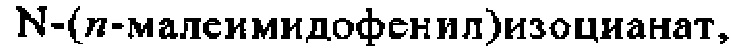 сукцинимидил-3-(бромацетамидо)пропионат, NHS-диазирин, NHS-SS-диазирин, N-сукцинимидилйодацетат, N-сукцинимидил(4-йодацетил)аминобензоат, сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат, NHS-ПЭГ2-малеимид, NHS-ПЭГ4-малеимид, NHS-ПЭГ6-малеимид, NHS-ПЭГ8-малеимид, NHS-ПЭГ12-малеимид, NHS-ПЭГ24-малеимид,
сукцинимидил-3-(бромацетамидо)пропионат, NHS-диазирин, NHS-SS-диазирин, N-сукцинимидилйодацетат, N-сукцинимидил(4-йодацетил)аминобензоат, сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат, NHS-ПЭГ2-малеимид, NHS-ПЭГ4-малеимид, NHS-ПЭГ6-малеимид, NHS-ПЭГ8-малеимид, NHS-ПЭГ12-малеимид, NHS-ПЭГ24-малеимид, 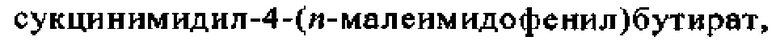 сукцинимидил-6-(β-малеимидопропионамидо)гексаноат, 4-сукцинимидилоксикарбонилметил-α-(2-пиридилдитио)толуол, сукцинимидил-(4-псорален-8-илокси)бутират, N-сукцинимидил-3-(2-пиридилдитио)пропионат, этиленгликоль-бис(сульфосукцинимидилсукцинат), сложный N-(ε-малеимидокапроилокси)сульфосукцинимидиловый эфир, сложный N-(γ-малеимидобутилокси)сульфосукцинимидиловый эфир, сложный N-(κ-малеимидоундеканоилокси)сульфосукцинимидиловый эфир, сульфо-NHS-LC-диазирин, сульфосукцинимидил-6-(3'-[2-пиридилдитио]пропионамидо)гексаноат, сложный м-малеимидобензоил-N-гидроксисульфосукцинимидиловый эфир, N-гидроксисукцинимид, сульфо-NHS-фосфин, сульфосукцинимидил-6-(4'-азидо-2'-нитрофениламино)гексаноат,
сукцинимидил-6-(β-малеимидопропионамидо)гексаноат, 4-сукцинимидилоксикарбонилметил-α-(2-пиридилдитио)толуол, сукцинимидил-(4-псорален-8-илокси)бутират, N-сукцинимидил-3-(2-пиридилдитио)пропионат, этиленгликоль-бис(сульфосукцинимидилсукцинат), сложный N-(ε-малеимидокапроилокси)сульфосукцинимидиловый эфир, сложный N-(γ-малеимидобутилокси)сульфосукцинимидиловый эфир, сложный N-(κ-малеимидоундеканоилокси)сульфосукцинимидиловый эфир, сульфо-NHS-LC-диазирин, сульфосукцинимидил-6-(3'-[2-пиридилдитио]пропионамидо)гексаноат, сложный м-малеимидобензоил-N-гидроксисульфосукцинимидиловый эфир, N-гидроксисукцинимид, сульфо-NHS-фосфин, сульфосукцинимидил-6-(4'-азидо-2'-нитрофениламино)гексаноат, 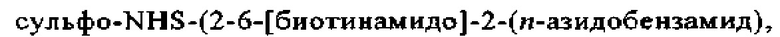 сульфо-NHS-диазирин, сульфо-NHS-SS-диазирин, сульфосукцинимидил(4-йодацетил)аминобензоат, сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат,
сульфо-NHS-диазирин, сульфо-NHS-SS-диазирин, сульфосукцинимидил(4-йодацетил)аминобензоат, сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, 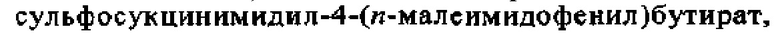 трис(2-малеимидоэтил)амин (трехфункциональный) и трис(сукцинимидиламинотриацетат) (трехфункциональный).
трис(2-малеимидоэтил)амин (трехфункциональный) и трис(сукцинимидиламинотриацетат) (трехфункциональный).
Связь между двумя из трех компонентов а), б) и в) в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, может быть прямой или косвенной, т.е. два компонента могут быть соединены непосредственно, или они могут быть связаны с помощью дополнительного компонента комплекса, например, спейсера или линкера.
Предпочтительно реализацией прямой связи является амидный мостик, если подлежащие связыванию компоненты имеют реактивные аминогруппы или карбоксигруппы. Более конкретно, если подлежащие связыванию компоненты представляют собой пептиды, полипептиды или белки, то предпочтительной является пептидная связь. Указанную пептидную связь, можно создавать с помощью химического синтеза, включающего оба подлежащих связыванию компонента (N-конец одного компонента и С-конец другого компонента), или ее можно создавать непосредственно путем белкового синтеза полной пептидной последовательности обоих компонентов, при этом оба (белок или пептид) компонента предпочтительно синтезируют на одной стадии. Указанные методы белкового синтеза включают (но, не ограничиваясь только ими), например, методы жидкофазного пептидного синтеза или методы твердофазного пептидного синтеза, например, методы твердофазного пептидного синтеза Меррифильда, твердофазной пептидный синтез с использованием t-Boc, твердофазной пептидный синтез с использованием Fmoc, твердофазной пептидный синтез на основе ВОР (гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония) и т.д. Альтернативно этому, предпочтительными являются сложноэфирные или простые эфирные связи.
Кроме того, в частности, если подлежащие связыванию компоненты представляют собой пептиды, полипептиды или белки, то связь можно осуществлять через боковые цепи, например, с помощью дисульфидного мостика. Дополнительные компоненты другой химической природы, например, по меньшей мере один антиген или антигенный эпитоп, если он не имеет пептидную природу, можно также присоединять к компонентам пептидной природы, например, к проникающему в клетку пептиду, по меньшей мере одному пептидному агонисту TLR и по меньшей мере одному антигену или антигенному эпитопу, если он имеет пептидную природу. Связь через боковую цепь предпочтительно должна базироваться на аминогруппах, тиольных или гидроксильных группах боковой цепи, например, представлять собой амидную или сложноэфирную или простую эфирную связь. Связь главной пептидной цепи с боковой пептидной цепью другого компонента может представлять собой также изопептидную связь. Изопептидная связь представляет собой амидную связь, которая не присутствует в главной цепи белка. Связь образуется между карбоксильным концом одного пептида или белка и аминогруппой остатка лизина на другом пептиде или белке (мишень).
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, может необязательно содержать спейсер или линкер, представляющие собой неиммунологические фрагменты, которые предпочтительно являются расщепляемыми и которые соединяют компонент а) и б) и/или компонент а) и в), и/или компонент б) и в), и/или соединяют последовательно расположенные антигены или антигенные эпитопы, и/или соединяют последовательно расположенные пептидные агонисты TLR, и/или соединяют последовательно расположенные проникающие в клетку пептиды, и/или которые могут быть помещены в С-концевую область компонентов б) и/или в). Линкер или спейсер предпочтительно могут обладать дополнительными функциональностями помимо способности связывать компоненты, предпочтительно являются расщепляемыми, более предпочтительно расщепляемыми в естественных условиях внутри клетки-мишени, например, расщепляемыми ферментами. Однако указанные другие функциональности не должны, включать, в частности, иммунологические функциональности. Примеры дополнительных функциональностей, в частности, касательно линкеров в слитых белках, представлены у Chen X. и др.: Fusion Protein Linkers: Property, Design and Functionality. Adv Drug Deliv Rev. 65(10), 2013, cc. 1357-1369, где описаны также, например, расщепляемые in vivo линкеры. Кроме того, у Chen X. и др., Fusion Protein Linkers: Property, Design and Functionality. Adv Drug Deliv Rev. 65(10), 2013, cc. 1357-1369 описаны также различные линкеры, например, гибкие линкеры и жесткие линкеры, и инструменты и базы данных для создания линкеров, которые можно применять в комплексах, или для создания линкера, который можно применять в комплексе.
Указанный спейсер может быть пептидным или непептидным, предпочтительно спейсер является пептидным. Предпочтительно пептидный спейсер состоит примерно из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, более предпочтительно примерно 1, 2, 3, 4 или 5 аминокислот. Аминокислотная последовательность пептидного спейсера может быть идентична последовательности N-концевой или С-концевой фланкирующей области любого из компонентов а), б) или в). Альтернативно этому, пептидный спейсер может состоять из не встречающихся в естественных условиях аминокислотных последовательностей, таких как аминокислотная последовательность, полученная в результате консервативных аминокислотных замен указанных встречающихся в естественных условиях фланкирующих областей, или последовательности известных расщепляемых протеазами сайтов, такие как сайт-мишень для энтерокиназы (аминокислотная последовательность: DDDK, SEQ ID NO: 16), сайт-мишень для фактора Ха (аминокислотная последовательностье: IEDGR, SEQ ID NO: 17), сайт-мишень для тромбина (аминокислотная последовательность: LVPRGS, SEQ ID NO: 18), сайт-мишень для протеазы TEV (аминокислотная последовательность: ENLYFQG, SEQ ID NO: 19), сайт-мишень для протеазы PreScission (аминокислотная последовательность LEVLFQGP, SEQ ID NO: 20), поликатионные аминокислоты, например, сайт-мишень для полиK, фурина (аминокислотная последовательность RX(R/K)R, SEQ ID NO: 21). В конкретном варианте осуществления изобретения пептидный спейсер не должен содержать никаких остатков Cys (С). В предпочтительном варианте осуществления изобретения линкерная последовательность содержит по меньшей мере 20%, более предпочтительно по меньшей мере 40% и еще более предпочтительно по меньшей мере 50% остатков Gly или β-аланина, например, GlyGlyGlyGlyGly (SEQ ID NO: 22), GlyGlyGlyGly (SEQ ID NO: 23), GlyGlyGly, CysGlyGly или GlyGlyCys и т.д. Специалист в данной области легко может выбирать и получать приемлемые линкерные последовательности. Они могут состоять из D- и/или L-аминокислот. Другие примеры пептидного спейсера включают аминокислотные последовательности EQLE (SEQ ID NO: 24) или TEWT (SEQ ID NO: 25), или любые их консервативные замены.
Непептидный спейсер может включать или может представлять собой сложный эфир, сложный тиоэфир и дисульфид.
В частности, комплекс, входящий в комбинацию, предлагаемую для применения согласно изобретению, может содержать спейсер или линкер, в частности, пептидный спейсер, расположенный между компонентами а) и б) и/или между компонентами а) и в), и/или между компонентами б) и в). Специалист в данной области может выбирать такой пептидный спейсер, чтобы он мог отщепляться с помощью присущего клетке механизма после интернализации комплекса, содержащего проникающий в клетку пептид и карго-молекулу.
Когда комплекс содержит несколько антигенов или антигенных эпитопов или когда комплекс содержит несколько пептидных агонистов TLR, то, как должно быть очевидно специалисту в данной области, каждый из антигенов или антигенных эпитопов и/или каждый из пептидных агонистов TLR, входящих в комплекс, могут быть либо непосредственно соединены друг с другом, либо связаны через спейсеры или линкеры, такие, например, как пептидный спейсер, состоящий из нескольких аминокислот. Альтернативно этому, когда комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, содержит несколько антигенов или антигенных эпитопов или когда комплекс содержит несколько пептидных агонистов TLR, то также является возможным, что некоторые антигены или антигенные эпитопы и/или некоторые пептидные агонисты TLR, входящие в комплекс, непосредственно связаны друг с другом, а некоторые другие антигены или антигенные эпитопы и/или некоторые другие пептидные агонисты TLR связаны через спейсеры или линкеры, такие, например, как пептидный спейсер, состоящий из нескольких аминокислот.
Например, два последовательно расположенных антигена или антигенных эпитопа или два последовательно расположенных пептидных агониста TLR, которые входят в комплекс, соединены друг с другом с помощью спейсеров, состоящих из встречающихся в естественных условиях фланкирующих областей указанных антигенов или антигенных эпитопов, или указанных пептидных агонистов TLR соответственно. Например, спейсер, применяемый для соединения первого антигена/антигенного эпитопа или первого пептидного агониста TLR со вторым антигеном/антигенным эпитопом или со вторым пептидным агонистом TLR соответственно, может состоять примерно из вплоть до 8 аминокислот, соответствующих примерно вплоть до 4 аминокислот N-концевой или С-концевой фланкирующей области первого антигена/антигенного эпитопа или первого пептидного агониста TLR, за которыми расположены примерно вплоть до 4 аминокислот N-концевой или С-концевой фланкирующей области второго антигена/антигенного эпитопа или второго пептидного агониста TLR. В настоящем изобретении в качестве иллюстрации спейсер, применяемый для соединения первого антигена/антигенного эпитопа или первого пептидного агониста TLR («антиген/эпитоп/пептидный агонист TLR 1») со вторым эпитопом («антиген/эпитоп/пептидный агонист TLR 2» состоит примерно из 8 аминокислот, соответствующих любой возможной следующей комбинации: от 0 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и 8 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2, до 8 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и до 0 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2, т.е. включая 1 фланкирующую аминокислоту антигена/эпитопа/пептидного агониста TLR 1 и 7 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2, 2 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 1 и 6 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2, 3 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 1 и 5 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2, 4 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 1 и 4 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 2, 5 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и 3 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 2, 6 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и 2 фланкирующие аминокислоты антигена/эпитопа/пептидного агониста TLR 2, 7 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и 1 фланкирующая аминокислота антигена/эпитопа/пептидного агониста TLR 2, 8 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 1 и 0 фланкирующих аминокислот антигена/эпитопа/пептидного агониста TLR 2. Должно быть очевидно, что 8 аминокислот в целом, образующих спейсер, который соединяет два последовательно расположенных антигена/эпитопа/пептидных агониста TLR, не является абсолютной величиной, и спейсер может состоять в целом, например, из 3 аминокислот, 4 аминокислот, 5 аминокислот, 6 аминокислот, 7 аминокислот, 9 аминокислот или 10 аминокислот. Аналогично этому, комбинации, эквивалентные указанным выше, могут также служить иллюстрацией изобретения в ситуации, когда спейсер состоит из менее чем 8 аминокислот или более чем из 8 аминокислот.
Согласно другой конкретной иллюстрации комплекса, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению, спейсер, применяемый для соединения первого антигена/антигенного эпитопа или первого пептидного агониста TLR («антиген/эпитоп/пептидный агонист TLR 1») со вторым антигеном/антигенным эпитопом или со вторым пептидным агонистом TLR соответственно («антиген/эпитоп/пептидный агонист TLR 2»), состоит, например, из 1, 2, 3, 4 или 5 аминокислот. Более конкретно, указанная спейсерная аминокислотная последовательность может соответствовать 4 аминокислотам N-концевой или С-концевой фланкирующей области антигена/эпитопа/пептидного агониста TLR 1 или антигена/эпитопа/пептидного агониста TLR 2. Спейсер, описанный выше, может также находиться в С-области последнего антигена/эпитопа/пептидного агониста TLR, входящего в комплекс.
Методы соединения двух из трех компонентов а), б) и в) подробно описаны в литературе, и они могут зависеть от природы по меньшей мере одного антигена или антигенного эпитопа. Например, соединение двух из трех компонентов а), б) и в) можно достигать посредством расщепляемых дисульфидных связей, получаемых в целом с помощью постадийного твердофазного синтеза или сочетания фрагментов в фазе раствора или на твердой фазе, стабильной амидной, тиазолидиновой, оксимовой и гидразиновой связи, дисульфидной связи, стабильной тиомалеимидной связи, пептидной связи (включая пептидные связи между аминокислотами слитого белка), или электростатических или гидрофобных взаимодействий.
Предпочтительно по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, а также любой необязательный спейсер или линкер, входящий в комплекс, имеют пептидную природу. Более предпочтительно все компоненты комплекса, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению, например, проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп, представляющий собой пептид, полипептид или белок, по меньшей мере один пептидный агонист TLR и необязательный пептидный линкер или спейсер, соединены в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, пептидной связью. Таким образом, наиболее предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой пептид, полипептид или белок, такой как слитый белок, например, рекомбинантный слитый белок.
В этом контексте комплекс, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44 или SEQ ID NO: 45; или комплекс, который содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из последовательностей SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 41, SEQ ID NO: 42. SEQ ID NO: 43, SEQ ID NO: 44 или SEQ ID NO: 45, является предпочтительным. Комплекс, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 45, или комплекс, который содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из последовательностей SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 45, является более предпочтительным. Комплекс, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 28, SEQ ID NO: 31, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 45, или комплекс, который содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из последовательностей SEQ ID NO: 28, SEQ ID NO: 31, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 or SEQ ID NO: 45 является еще более предпочтительным. Комплекс, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 45, или комплекс, который содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из последовательностей SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 45, является наиболее предпочтительным.


Расположение компонентов а), б) и в) в комплексе
Компоненты а), б) и в) могут располагаться в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, в любом порядке.
В частности, если более одного проникающего в клетку пептида и/или более одного антигена или антигенного эпитопа, и/или более одного пептидного агониста TLR содержатся в комплексе, то несколько проникающих в клетку пептидов могут располагаться не последовательным образом, т.е. по меньшей мере один антиген или антигенный эпитоп (компонент б)) и/или по меньшей мере один пептидный агонист TLR (компонент в)) могут прерывать участок из последовательно расположенных проникающих в клетку пептидов, и/или проникающие в клетку пептиды могут чередоваться с компонентом б) и/или компонентом в). Аналогично этому, несколько антигенов или антигенных эпитопов могут располагаться не последовательным образом, т.е. по меньшей мере один проникающий в клетку пептид (компонент а)) и/или по меньшей мере один пептидный агонист TLR (компонент в)) могут прерывать участок из последовательно расположенных антигенов или антигенных эпитопов, и/или антигены или антигенные эпитопы могут чередоваться с компонентом а) и/или компонентом в). Аналогично этому несколько пептидных агонистов TLR могут располагаться не обязательно последовательным образом, т.е. по меньшей мере один проникающий в клетку пептид (компонент а)) и/или по меньшей мере один антиген или антигенный эпитоп (компонент б)) могут прерывать участок из последовательно расположенных пептидных агонистов TLR, и/или пептидные агонисты TLR могут чередоваться с компонентом а) и/или компонентом б).
Однако предпочтительно, чтобы несколько проникающих в клетку пептидов располагались в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, последовательным образом и/или несколько антигенов или антигенных эпитопов располагались в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, последовательным образом, и/или несколько пептидных агонистов TLR располагались в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, последовательным образом. Это означает, в частности, что все единичные элементы определенного компонента, т.е. все проникающие в клетку пептиды, все антигены или антигенные эпитопы или все пептидные агонисты TLR, которые содержатся в комплексе, расположены в виде участка, который не прерывается любым из двух других компонентов. Предпочтительнее два других компонента располагаются в комплексе, например, до или после указанного участка из всех единичных элементов указанного конкретного компонента. Однако последовательно расположенные единичные элементы указанного конкретного компонента могут быть связаны друг с другом, например с помощью указанного в настоящем описании спейсера или линкера, который не является частью двух других компонентов.
Наиболее предпочтительно, чтобы каждый из компонентов а), б) и в) располагался последовательным образом.
Структурно каждый компонент а), б) и в), как правило, содержит одну главную цепь и по меньшей мере одну боковую цепь. Понятие «главная цепь» (синоним «каркасная цепь») в контексте настоящего изобретения относится к главной непрерывной цепи ковалентно связанных атомов в молекуле. Например, в пептидах, полипептидах и белках главная цепь (каркас), как правило, содержит альфа-атомы углерода и атомы азота, образующие аминокислоты, сцепленные пептидной связью. Каркас не включает боковые цепи. Понятие «боковая цепь» (синоним «концевая (висящая) цепь») в контексте настоящего изобретения относится к химической группе, присоединенной к коровой части молекулы, называемой «главной цепью» или каркасом. Например, в пептидах, полипептидах и белках боковые цепи, как правило, представляют собой (основные) части, образующие аминокислоты, которые присоединены к альфа-атомам углерода каркаса.
В комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, компоненты а), б) и в) могут быть ковалентно связаны через линкер или спейсер, указанный в настоящем описании, или они могут быть непосредственно ковалентно связаны. Вне зависимости от того, применяют ли спейсер или линкер для ковалентного связывания, в принципе существует четыре возможных типа соединения друг с другом двух из трех компонентов в комплексе, предлагаемом в настоящем изобретении, а именно:
(I) посредством связи главная цепь/главная цепь,
(II) посредством связи главная цепь/боковая цепь,
(III) посредством связи боковая цепь/главная цепь или
(IV) посредством связи боковая цепь/боковая цепь.
Предпочтительно все три компонента а), б) и в) соединяют посредством связи главная цепь/главная цепь, что позволяет получать, в частности, главную цепь комплекса, которая содержит главную цепь одного или нескольких проникающего(их) в клетку пептида(ов), главную цепь одного или нескольких антигена(ов) или антигенного(ых) эпитопа(ов) и главную цепь одного или несколько пептидного(ых) агониста(ов) TLR. Другими словами, главная цепь одного или нескольких проникающего(их) в клетку пептида(ов), главная цепь одного или нескольких антигена(ов) или антигенного(ых) эпитопа(ов) и главная цепь одного или нескольких пептидного(ых) агониста(ов) TLR образуют главную цепь комплекса, необязательно в сочетании с дополнительными компонентами, например, линкером(ами), спейсером(ами) и т.д. Таки образом, предпочтительными являются следующие расположения компонентов а), б) и в), в частности, если по меньшей мере один антиген или антигенный эпитоп представляет собой пептид, полипептид или белок, где указанные предпочтительные расположения представлены ниже в направлении N-конец → С-конец главной цепи комплекса и где все три компонента а), б) и в) связаны посредством связи главная цепь/главная цепь и необязательно могут быть соединены с помощью линкера, спейсера или другого дополнительного компонента:
(α) компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - компонент в) (по меньшей мере один пептидный агонист TLR);
(β) компонент в) (по меньшей мере один пептидный агонист TLR) - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп);
(γ) компонент а) (проникающий в клетку пептид) - компонент в) (по меньшей мере один пептидный агонист TLR) - компонент б) (по меньшей мере один антиген или антигенный эпитоп);
(δ) компонент в) (по меньшей мере один пептидный агонист TLR) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - компонент а) (проникающий в клетку пептид);
(ε) компонент б) (по меньшей мере один антиген или антигенный эпитоп) - компонент а) (проникающий в клетку пептид) - компонент в) (по меньшей мере один пептидный агонист TLR); или
(ζ) компонент б) (по меньшей мере один антиген или антигенный эпитоп) - компонент в) (по меньшей мере один пептидный агонист TLR) - компонент а) (проникающий в клетку пептид).
В частности, если все три компонента а), б) и в) связаны посредством связи главная цепь/главная цепь, то предпочтительно, чтобы по меньшей мере один антиген или антигенный эпитоп располагались на С-конце проникающего в клетку пептида, а проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно были сцеплены с помощью дополнительного компонента, например, линкера, спейсера, или с помощью по меньшей мере одного пептидного агониста TLR. Таким образом, это соответствует варианту расположения, указанному в вариантах (α), (β) и (γ) из числа описанных выше вариантов расположения, т.е. среди описанных выше вариантов расположения более предпочтительными являются (α), (β) и (γ).
Еще более предпочтительно по меньшей мере один антиген или антигенный эпитоп располагаются на С-конце проникающего в клетку пептида, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно сцеплены с помощью дополнительного компонента, например, линкера, спейсера, но не с помощью по меньшей мере одного пептидного агониста TLR. Таким образом, это соответствует варианту расположения, указанному в вариантах (α) и (β) из числа описанных выше вариантов расположения, т.е. среди описанных выше вариантов расположения еще более предпочтительными являются (α) и (β). Особенно предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, представляет собой рекомбинантный полипептид или рекомбинантный белок и компоненты а)-в) располагаются в направлении N-конец → С-конец главной цепи указанного комплекса в следующем порядке:
(α) компонент а) - компонент б) - компонент в); или
(β) компонент в) - компонент а) - компонент б),
где компоненты могут быть сцеплены с помощью дополнительного компонента, например, линкера или спейсера.
Наиболее предпочтительным является вариант расположения (α), в котором по меньшей мере один агонист TLR содержит или состоит по меньшей мере из одного агониста TLR2, например:
(α1) компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2;
(α2) компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2, один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4, и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5;
(α3) компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2, и один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4; или
(α4) компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2, и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5.
Альтернативно этому, в вариантах расположения, содержащих пептидный агонист TLR2, дополнительные пептидные агонисты TLR могут располагаться в комплексе в других положениях, например:
(α5) один или несколько пептидных агонистов TLR4, например 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2;
(α6) один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2; или
(α7) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4, и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2.
Наиболее предпочтительным является вариант расположения (β), в котором по меньшей мере один агонист TLR содержит или состоит по меньшей мере из одного агониста TLR4, например:
(β1) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп);
(β2) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4, один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2 и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп);
(β3) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4, и один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп); или
(β4) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4, и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп).
Альтернативно этому, в вариантах расположения, содержащих пептидный агонист TLR4, дополнительные пептидные агонисты TLR могут располагаться в комплексе в других положениях, например:
(β5) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2;
(β6) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5; или
(β7) один или несколько пептидных агонистов TLR4, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR4 - компонент а) (проникающий в клетку пептид) - компонент б) (по меньшей мере один антиген или антигенный эпитоп) - один или несколько пептидных агонистов TLR2, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR2, и один или несколько пептидных агонистов TLR5, например, 1, 2, 3, 4 или 5 пептидный(ых) агонист(ов) TLR5.
Альтернативно этому, только два из трех компонентов а), б) и в) соединяют посредством связи главная цепь/главная цепь в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению.
Например, компоненты а) и б) соединяют посредством связи главная цепь/главная цепь, получая тем самым следующее расположение компонентов а) и б) в комплексе, в направлении N-конец → С-конец главной цепи комплекса, при этом компоненты а) и б) необязательно могут быть сцеплены с помощью дополнительного компонента, например, линкера, спейсера и т.д.:
(1) проникающий в клетку пептид (а) - антиген/антигенный эпитоп (б); или
(2) антиген/антигенный эпитоп (б) - проникающий в клетку пептид (а).
В таком случае компонент в), т.е. по меньшей мере один пептидный агонист TLR, затем можно соединять посредством связи главная цепь/боковая цепь, посредством связи боковая цепь/главная цепь или посредством связи боковая цепь/боковая цепь либо с проникающим в клетку пептидом (а), либо с антигеном/антигенным эпитопом (б), либо, если он присутствует, с дополнительным компонентом типа спейсера или линкера, который может находиться, например, между проникающим в клетку пептидом (а) и антигеном/антигенным эпитопом (б). Это предусматривает следующие варианты расположения:
(I) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом а), т.е. главная цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью проникающего в клетку пептида;
(II) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом а), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с главной цепью проникающего в клетку пептида;
(III) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом а), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью проникающего в клетку пептида;
(IV) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом б), т.е. главная цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного антигена или антигенного эпитопа;
(V) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом б), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с главной цепью по меньшей мере одного антигена или антигенного эпитопа;
(VI) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом б), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного антигена или антигенного эпитопа;
(VII) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с линкером или спейсером, расположенным между компонентом а) и компонентом б), т.е. главная цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью линкера или спейсера, расположенного между компонентом а) и компонентом б);
(VIII) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с линкером или спейсером, расположенным между компонентом а) и компонентом б), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с главной цепью линкера или спейсера, расположенного между компонентом а) и компонентом б); или
(IX) компонент в) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с линкером или спейсером, расположенным между компонентом а) и компонентом б), т.е. боковая цепь по меньшей мере одного пептидного агониста TLR ковалентно связана - необязательно через спейсер или линкер - с боковой цепью линкера или спейсера, расположенного между компонентом а) и компонентом б).
Например, компоненты б) и в) соединяют посредством связи главная цепь/главная цепь, получая тем самым следующее расположение компонентов б) и в) в комплексе, в направлении N-конец → С-конец главной цепи комплекса, при этом компоненты б) и в) необязательно могут быть сцеплены с помощью дополнительного компонента, например, линкера, спейсера и т.д.:
(3) антиген/антигенный эпитоп (б) - пептидный агонист TLR (в); или
(4) пептидный агонист TLR (в) - антиген/антигенный эпитоп (б).
В таком случае компонент а), т.е. проникающий в клетку пептид, затем можно соединять посредством связи главная цепь/главная цепь, посредством связи боковая цепь/главная цепь или посредством связи боковая цепь/боковая цепь либо с антигеном/антигенным эпитопом (б), либо с пептидным агонистом TLR (в), либо, если он присутствует, с дополнительным компонентом типа спейсера или линкера, который может, например, находиться между антигеном/антигенным эпитопом (б) и пептидным агонистом TLR (в). Это предусматривает следующие варианты расположения:
(X) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом б), т.е. главная цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного антигена или антигенного эпитопа;
(XI) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом б), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с главной цепью по меньшей мере одного антигена или антигенного эпитопа;
(XII) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом б), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного антигена или антигенного эпитопа;
(XIII) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом в), т.е. главная цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного пептидного агониста TLR;
(XIV) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом в), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с главной цепью по меньшей мере одного пептидного агониста TLR;
(XV) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом в), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного пептидного агониста TLR;
(XVI) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с линкером или спейсером, расположенным между компонентом б) и компонентом в), т.е. главная цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью линкера или спейсера, расположенного между компонентом а) и компонентом б);
(XVII) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с линкером или спейсером, расположенным между компонентом б) и компонентом в), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с главной цепью линкера или спейсера, расположенного между компонентом б) и компонентом в); или
(XVIII) компонент а) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с линкером или спейсером, расположенным между компонентом б) и компонентом в), т.е. боковая цепь проникающего в клетку пептида ковалентно связана - необязательно через спейсер или линкер - с боковой цепью линкера или спейсера, расположенного между компонентом б) и компонентом в).
Например, компоненты а) и в) соединяют посредством связи главная цепь/главная цепь, получая тем самым следующее расположение компонентов а) и б) в комплексе, в направлении N-конец → С-конец главной цепи комплекса, при этом компоненты а) и в) необязательно могут быть сцеплены с помощью дополнительного компонента, например, линкера, спейсера и т.д.:
(5) проникающий в клетку пептид (а) - пептидный агонист TLR (в); или
(6) пептидный агонист TLR (в) - проникающий в клетку пептид (а).
В таком случае компонент б), т.е. по меньшей мере один антиген или антигенный эпитоп, затем можно соединять посредством связи главная цепь/главная цепь, посредством связи боковая цепь/главная цепь или посредством связи боковая цепь/боковая цепь либо с проникающим в клетку пептидом (а), либо с пептидным агонистом TLR (в), либо, если он присутствует, с дополнительным компонентом типа спейсера или линкера, который может, например, находиться между проникающим в клетку пептидом (а) и пептидным агонистом TLR (в). Это предусматривает следующие варианты расположения:
(XIX) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом а), т.е. главная цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью проникающего в клетку пептида;
(XX) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом а), т.е. боковая цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с главной цепью проникающего в клетку пептида;
(XXI) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом а), т.е. боковая цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью проникающего в клетку пептида;
(XXII) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с компонентом в), т.е. главная цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного пептидного агониста TLR;
(XXIII) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с компонентом в), т.е. боковая цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с главной цепью по меньшей мере одного пептидного агониста TLR;
(XXIV) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с компонентом в), т.е. боковая цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью по меньшей мере одного пептидного агониста TLR;
(XXV) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи главная цепь/боковая цепь с линкером или спейсером, расположенным между компонентом а) и компонентом в), т.е. главная цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью линкера или спейсера, расположенного между компонентом а) и компонентом в);
(XXVI) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/главная цепь с линкером или спейсером, расположенным между компонентом а) и компонентом в), т.е. боковая цепь по меньшей мере по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с главной цепью линкера или спейсера, расположенного между компонентом а) и компонентом в); или
(XXVII) компонент б) может быть соединен - необязательно через спейсер или линкер - посредством связи боковая цепь/боковая цепь с линкером или спейсером, расположенным между компонентом а) и компонентом в), т.е. боковая цепь по меньшей мере одного антигена или антигенного эпитопа ковалентно связана - необязательно через спейсер или линкер - с боковой цепью с линкера или спейсера, расположенного между компонентом а) и компонентом в).
Альтернативно этому, также можно в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, все три компонента а), б) и в) располагать посредством связи главная цепь/боковая цепь, связи боковая цепь/главная цепь или связи боковая цепь/боковая цепь, необязательно сцепленных с помощью дополнительного компонента, например, спейсера или линкера.
Предпочтительные комбинации предпочтительного модулятора иммунных контрольных точек и предпочтительного комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп
Как описано выше, предпочтительная комбинация, предлагаемая для применения согласно настоящему изобретению, содержит предпочтительный модулятор иммунных контрольных точек, указанный в настоящем описании. Кроме того, предпочтительная комбинация, предлагаемая для применения согласно настоящему изобретению, содержит предпочтительный комплекс, указанный в настоящем описании, который содержит (предпочтительный) проникающий в клетку пептид, по меньшей мере один (предпочтительный) антиген или антигенный эпитоп и по меньшей мере один (предпочтительный) пептидный агонист TLR.
Более предпочтительная комбинация, предлагаемая для применения согласно настоящему изобретению, содержит (I) предпочтительный модулятор иммунных контрольных точек, указанный в настоящем описании, и (II) предпочтительный комплекс, указанный в настоящем описании, который содержит (предпочтительный) проникающий в клетку пептид, по меньшей мере один (предпочтительный) антиген или антигенный эпитоп и по меньшей мере один (предпочтительный) пептидный агонист TLR. Ниже в предпочтительных вариантах осуществления изобретения описаны предпочтительные комбинации, предлагаемые для применения согласно настоящему изобретению.
В предпочтительной комбинации, предлагаемой для применения согласно настоящему изобретению, комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
а) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18), или вариантов последовательностей, указанных в настоящем описании, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид и предпочтительно содержит или состоит по меньше мере из одного ракового эпитопа или опухолевого эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4.
Кроме того, предпочтительно в комбинации, предлагаемой для применения согласно настоящему изобретению, модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-1 и/или IDO и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
Предпочтительно также в комбинации, предлагаемой для применения согласно настоящему изобретению, модулятор иммунных контрольных точек представляет собой модулятор CD40, LAG3, CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор LAG3, CTLA-4, PD-L1, PD-L2, PD-1 и/или IDO или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор LAG3, CTLA-4, PD-L1, PD-1 и/или IDO и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор LAG3, CTLA-4 и/или PD-1.
Например, в предпочтительной комбинации, предлагаемой для применения согласно настоящему изобретению,
комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
а) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18), или вариантов последовательностей, указанных в настоящем описании, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид и предпочтительно содержит или состоит по меньше мере из одного ракового эпитопа или опухолевого эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4; и
- модулятор иммунных контрольных точек представляет собой модулятор пути CD40, пути CTLA-4 и/или пути PD-1, в частности, модулятор иммунных контрольных точек представляет собой активатор CD40 или ингибитор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD-1, и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
Например, в предпочтительной комбинации, предлагаемой для применения согласно настоящему изобретению,
комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
а) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18), или вариантов последовательностей, указанных в настоящем описании, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид и предпочтительно содержит или состоит по меньше мере из одного ракового эпитопа или опухолевого эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4; и
- модулятор иммунных контрольных точек представляет собой модулятор пути CD40, пути CTLA-4, пути LAG3 и/или пути PD-1, в частности, модулятор иммунных контрольных точек представляет собой активатор CD40 или ингибитор CD40, LAG3, CTLA-4, PD-L1, PD-L2 и/или PD-1, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор LAG3, CTLA-4, PD-L1, PD-L2 и/или PD-1, и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор LAG3, CTLA-4 и/или PD-1.
В предпочтительной указанной в настоящем описании комбинации, предлагаемой для применения, в частности, в такой указанной выше предпочтительной комбинации, предлагаемой для применения, предпочтительно использовать более одного модулятора иммунных контрольных точек, например, ингибитора контрольных точек, в частности, использовать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, например ингибиторов контрольных точек, предпочтительно использовать 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, например ингибиторов контрольных точек, более предпочтительно использовать 2, 3 или 4 различных модулятора иммунных контрольных точек, например ингибитора контрольных точек, еще более предпочтительно использовать 2 или 3 различных модулятора иммунных контрольных точек, например, ингибитора контрольных точек, и наиболее предпочтительно использовать 2 различных модулятора иммунных контрольных точек, например, ингибитора контрольных точек.
Таким образом, предпочтительно применяют по меньшей мере (I) ингибитор пути CTLA-4, в частности ингибитор CTLA-4, и (II) ингибитор пути PD-1, в частности, ингибитор PD-1, PD-L1 или PD-L2; предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
Применение в медицине
Комбинация модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, указанного в настоящем описании, предназначена для применения в медицине.
Указанная комбинация модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, содержащего проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, указанного в настоящем описании, может инициировать или усиливать эффективность модуляторов контрольных точек. Кроме того, такая комбинация, указанная в настоящем описании, может одновременно (I) стимулировать опосредуемый полиэпитопной цитотоксической Т-клеткой иммунитет, (II) индуцировать Th-клетки и (III) усиливать иммунологическую память, создавая тем самым сильный, продолжительный (противоопухолевый) иммунитет. Иммунологическая память является важной для защиты от рецидива, в частности от рецидива опухоли. Таким образом, в целом, в настоящем изобретении предложена комбинация, указанная в настоящем описании, которая может инициировать, создавать усиливать или улучшать иммунный ответ, в частности, создавать усиливать или улучшать ответ индивидуума или опухоли на модуляторы иммунных контрольных точек.
Комбинацию, предлагаемую для применения согласно настоящему изобретению, можно использовать при различных заболеваниях. Предпочтительно комбинация, указанная в настоящем описании, предназначена для применения (для приготовления лекарственного средства) для предупреждения, лечения или стабилизации заболевания или нарушения, такого, которое можно лечить с помощью иммунотерапии, включая, например, разные виды рака, инфекционные заболевания, аутоиммунные нарушения, гематологические заболевания и отторжения трансплантатов. Таким образом, комбинация, указанная в настоящем описании, предназначена для применения с целью предупреждения, лечения или стабилизации заболевания или нарушения, предпочтительно, которое можно лечить с помощью иммунотерапии, включая, например, различные виды рака, инфекционные заболевания, аутоиммунные нарушения, гематологические заболевания и отторжения трансплантатов.
В контексте настоящего описания наиболее предпочтительно комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, применяют для предупреждения и/или лечения рака.
Подразумевается, что понятие «заболевание» в контексте настоящего изобретения, как правило, является синонимом и его применяют взаимозаменяемо с понятиями «нарушение» и «состояние» (в случае медицинского состояния), и во всех случаях отражает аномальное состояние организма человека или животного или одной из его частей, которое нарушает нормальное функционирование, оно, как правило, характеризуется различными признаками или симптомами, и приводит к тому, что человек или животное имеет пониженную продолжительность жизни или пониженное качество жизни.
Предпочтительные заболевания, подлежащие лечению и/или предупреждению путем применения комбинации модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, включают рак, гематологические нарушения, инфекционные заболевания, аутоиммунные нарушения и отторжение трансплантатов. При этом, предпочтительным является лечение и/или предупреждение рака и инфекционных заболеваний и более предпочтительным является лечение и/или предупреждение рака. В случае рака, предпочтительными являются злокачественная неоплазма головного мозга или злокачественная неоплазма лимфоидной ткани, гематопоэтической и родственной ткани, и более предпочтительной является глиобластома.
Предпочтительно комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять для (приготовления лекарственного средства, предназначенного для) профилактики, лечения и/или облегчения рака или опухолевых заболеваний, включая заболевания, вызываемые нарушенным апоптозом, предпочтительно выбранные из акустической невриномы, рака анального канала, астроцитомы, базалиомы, синдрома Бехчета, рака мочевого пузыря, бластом, рака кости, метастазов в головной мозг, опухолей головного мозга, рака головного мозга (глиобластом), рака молочной железы (карциномы молочной железы (carcinoma mamma)), лимфомы Беркитта, карциноидов, рака шейки матки, карциномы ободочной кишки, колоректального рака, карциномы тела матки, краниофарингеом, CUP-синдрома (синдром рака с невыявленным очагом), карциномы эндометрия, рака желчного пузыря, опухолей половых органов, включая различные виды рака мочеполового тракта, глиобластом, глиом, различных видов опухолей головы и шеи, гепатом, гистиоцитарной лимфомы, синдромов или лимфом Ходжкина и некоджкинских лимфом, опухолей гипофиза, рака кишечника, включая опухоли тонкой кишки и желудочно-кишечные опухоли, саркомы Капоши, рака почки, карцином почки, ларингеального рака или рака гортани, лейкозов, включая острый миелолейкоз (AML), эритролейкоз, острый лимфоидный лейкоз (ALL), хронический миелолейкоз (CML) и хронический лимфоцитарный лейкоз (CLL), опухоли века, рака печени, метастазов в печень, карцином легкого (= рак легкого = бронхиальная карцинома), мелкоклеточных карцином легкого и немелкоклеточных карцином легкого и аденокарцином легкого, лимфом, рака лимфатической системы, злокачественных меланом, карцином молочной железы (= рак молочной железы), медуллобластом, меланом, менингиом, грибовидного микоза, невриномы, обусловленной неопластическими заболеваниями, рака пищевода, карциномы пищевода (= рак пищевода), олигодендроглиомы, рака яичника (= карцинома яичника), карциномы яичника, карциномы поджелудочной железы (= рак поджелудочной железы), рака пениса, рака полового члена, фарингеального рака, опухоли гипофиза, плазмоцитомы, рака предстательной железы (= опухоли предстательной железы), ректальной карциномы, ректальных опухолей, рака почки, карцином почки, ретинобластомы, сарком, болезни Шнеебергера, рака кожи, например, меланомы или немеланомного рака кожи, включая базальноклеточные и плоскоклеточные карциномы, а также псориаз, пузырчатки обыкновенной, опухолей мягких тканей, спиналиомы, рака желудка, тестикулярного рака, рака глотки, тимомы, карциномы щитовидной железы, рака языка, рака мочеиспускательного канала, рака матки, вагинального рака, различных индуцируемых вирусом опухолей, таких, например, как индуцируемые вирусом папилломы карциномы (например, карциномы шейки матки = рак шейки матки), аденокарциномы, индуцируемые вирусом герпеса опухоли (например, лимфома Беркитта, индуцируемая EBV В-клеточная лимфома, карцинома шейки матки), индуцируемые вирусом гепатита В опухоли (печеночноклеточные карциномы), индуцируемые HTLV-1 и HTLV-2 лимфомы, рак вульвы, состояния, связанные с бородавками, или обусловленные ими, и т.д. В контексте настоящего описания понятия «терапия» и «терапевтический» предпочтительно относятся к достижению по меньшей мере определенного минимального физиологического воздействия после введения в живой организм. Например, физиологическое воздействие после введения «терапевтического» противоопухолевого соединения может заключаться в ингибировании роста опухоли или уменьшении размера опухоли, или предупреждении рецидива опухоли. Предпочтительно при лечении рака или неопластического заболевания следует рассматривать соединение, которое ингибирует рост опухоли или уменьшает размер опухоли, или предупреждает рецидив опухоли, как обладающее терапевтической эффективностью. Таким образом, понятие «противоопухолевое лекарственное средство» предпочтительно обозначает любое терапевтическое средство, обладающее терапевтическим действием в отношении опухоли, неопластического заболевания или рака.
Другие предпочтительные примеры раков, которые можно лечить с помощью комбинации модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, включают рак головного мозга, рак предстательной железы, рак молочной железы, рак яичника, рак пищевода, рак легкого, рак печени, рак почки, меланому, рак кишечника, карциному легкого, плоскоклеточную карциному головы и шеи, хронический миелолейкоз, колоректальную карциному, карциному желудка, карциному эндометрия, миелолейкоз, плоскоклеточную карциному легкого, острый лимфобластный лейкоз, острый миелогенный лейкоз, опухоль мочевого пузыря, промиелоцитарный лейкоз, немелкоклеточную карциному легкого и саркому. Наиболее предпочтительно комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, применяют для лечения колоректального рака.
Рак может представлять собой солидную опухоль, рак крови или рак лимфатической системы. Рак может быть неметастатическим или метастатическим.
Предпочтительно рак, который требуется предупреждать и/или лечить, представляет собой глиому, более предпочтительно высокоинвазивную мультиформную глиобластому (GBM). Глиомы наиболее часто образуют первичные опухоли головного мозга у взрослых, при этом мультиформная глиобластома (GBM) сопряжена с наиболее плохим прогнозом. Эта опухоль печально известна своей высокой инвазивностью и агрессивностью. В частности, комбинацию модулятора иммунных контрольных точек, указанного настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять в сочетании с существующими подходами к лечению глиомы, более конкретно высокоинвазивной GBM. Т-лимфоциты могут активно выявлять неопластические клетки в головном мозге, и они обладают потенциалом для безопасной элиминации конкретных опухолевых клеток без повреждения окружающих здоровых тканей.
Кроме того, комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять для (приготовления лекарственного средства, предназначенного для) профилактики, лечения и/или облегчения инфекционных заболеваний, предпочтительно вирусных, ретровирусных, бактериальных или протозойных инфекционных заболеваний. Такие инфекционные заболевания, как правило, выбирают из таких заболеваний, как СПИД, сибирская язва, японский энцефалит, бактериальные инфекционные заболевания, такие как выкидыш (воспаление предстательной железы), сибирская язва, аппендицит, боррелиоз, ботулизм, кампилобактериоз, вызываемый бактерией Camphylobacter, хламидиоз, вызываемый бактерией Chlamydia trachomatis (воспаление мочеиспускательного канала, конъюнктивит), холера, дифтерия, дованоз, эпиглоттит, тифозная лихорадка, газовая гангрена, гонорея, кроличья лихорадка, заболевание, вызываемое Heliobacter pylori, коклюш, паховый лимфогранулематоз, остеомиелит, болезнь легионеров, ветряная оспа, остроконечная кондилома, заболевание, вызываемое цитомегаловирусом (CMV), лихорадка Денге, весенний менингоэнцефалит (ESME), заболевание, вызываемое вирусом Эбола, простуда, инфекционная эритема (пятая болезнь), ящур, герпес простой типа I, герпес простой типа II, опоясывающий лишай, HSV, инфекционные заболевания, вызываемые паразитами, простейшими или грибами, такие как амебиаз, бильгарциоз, болезнь Шагаса, эхинококкоз, вызываемый цепнем Echinococcus, ботриоцефалез (рыбий солитер), отравление рыбой (сигуатера), лисий солитер, эпидермофития стопы, собачий цепень, кандидоз, дрожжевые грибковые пятна, чесотка, кожный лейшманиоз, лямблиоз (гиаргиаз), педикулез, онхоцеркоз (речная слепота), грибковые заболевания, бычий цепень, шистосомоз, свиной цепень, токсоплазмоз, трихомониаз, трипаносомиаз (сонная болезнь), висцеральный лейшманиоз, пеленочный (памперсный) дерматит или карликовый цепень, инфекционная эритема, грипп, саркома Капоши, лихорадка Ласса, лейшманиоз, проказа, листериоз, боррелиоз Лайма, малярия, инфекция, вызываемая вирусом Марбург, корь, менингит, включая бактериальный менингит, контагиозный моллюск, мононуклеоз, свинка, урогенитальный микоплазмоз, неонатальный сепсис (хориоамнионит), нома, инфекция, вызываемая вирусом Норволк, отит среднего уха, паратиф, железистая лихорадка Пфейффера, чума, пневмония, полио (полиомиелит, детская хромота), псевдокруп, бешенство, синдром Рейтера, пятнистая лихорадка Скалистых Гор, вызываемый сальмонеллой паратиф, вызываемый сальмонеллой тиф, SARS (тяжелый острый респираторный синдром), скарлатина, опоясывающий лишай, гепатит, оспа, мягкий шанкр, сифилис, столбняк, трехдневная лихорадка, триппер, болезнь цуцугамуши, туберкулез, тиф, вагинит (кольпит), вирусные заболевания, вызываемые цитомегаловирусом (CMV), ортопоксивирусом натуральной оспы, ортопоксивирусом белой оспы, парапоксивирусом овец, вирусом контагиозного моллюска, вирусом герпеса простого 1, вирусом герпеса простого 2, вирусом герпеса В, варицелла-зостер вирусом, вирусом псевдобешенства, человеческим цитомегаловирусом, человеческим вирусом герпеса 6, человеческим вирусом герпеса 7, вирусом Эпштейна-Барра, человеческим вирусом герпеса 8, вирусом гепатита В, вирусом лихорадки Чикунгунья, вирусом лихорадки О'Ньонг-Ньонг, рубивирусом, вирусом гепатита С, GB-вирусом С, вирусом Западного Нила, вирусом Денге, вирусом желтой лихорадки, вирусом энцефаломиелита овец, вирусом энцефалита Сент-Луис, вирусом японского энцефалита В, вирусом Повассан, FSME-вирусом, SARS, SARS-ассоциированным короновирусом, человеческим короновирусом 229Е, человеческим короновирусом Ос43, торовирусом, человеческим Т-клеточным лимфотропным вирусом типа I, человеческим Т-клеточным лимфотропным вирусом типа II, ВИЧ (СПИД), т.е. вирусом иммунодефицита человека типа 1 или вирусом иммунодефицита человека типа 2, вирусом гриппа, вирусом Лаоса, вирусом лимфоцитарного хориоменингита, вирусом Такарибе, вирусом Хунин, вирусом Мачупо, вирусом болезни Борна, вирусом Буньямвера, вирусом калифорнийского энцефалита, вирусом лихорадки Рифт-Валли, вирусом флеботомной лихорадки, вирусом Тоскана, вирусом геморрагической лихорадки Крым-Конго, вирусом Хазара, вирусом Хасан, вирусом Хантаан, вирусом Сеул, вирусом проспекта Хилл, вирусом Пуумала, вирусом Добрава-Белград, вирусом Тула, вирусом Син Номбре, Марбург-вирусом озера Виктория, вирусом Эбола Заир, вирусом Эбола Судан, вирусом Эбола Берег Слоновой Кости, вирусом гриппа А, вирусом гриппа В, вирусом гриппа С, вирусом парагриппа, вирусом кори, вирусом эпидемического паротита, респираторно-синцитиальным вирусом, человеческим метапневмовирусом, индийским вирусом везикулярного стоматита, вирусом бешенства, вирусом Мокола, вирусом Дувенхаге, европейским лиссавирусом летучих мышей 1+2, австралийским лиссавирусом летучих мышей, аденовирусами A-F, вирусом папилломы человека, вирусом кондиломы 6, вирусом кондиломы 11, вирусами полиомы, аденоассоциированным вирусом 2, ротавирусами или орбивирусами, вирусом оспы, включая вирус ветряной оспы (варицелла-зостер), и малярийными паразитами (Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae, Plasmodium knowlesi), вирусные инфекционные заболевания, такие как СПИД, инфекционные заболевания, такие как остроконечная кондилома, полые бородавки, лихорадка Денге, трехдневная лихорадка, вызываемые вирусом Эбола заболевания, простуда, весенний менингоэнцефалит (FSME), грипп, опоясывающий лишай, гепатит, герпес простой типа I, герпес простой типа II, опоясывающий герпес, грипп, японский энцефалит, лихорадка Лаоса, вызываемые вирусом Марбург заболевания, бородавки, лихорадка Западного Нила, желтая лихорадка и т.д.
Другие предпочтительные примеры инфекционных заболеваний включают заболевания, вызываемые вирусами, бактериями, грибами, простейшими и многоклеточными паразитами. К ним относятся, например, амебиаз, сибирская язва, язва Бурули (Mycobacterium ulcerans), ассоциированная с калицивирусами диарея, вызываемая бактерией Campylobacter диарея, рак шейки матки (человеческий вирус папиломы), ассоциированные с Chlamydia trachomatis заболевания половых органов, холера, геморрагическая лихорадка Крым-Конго, лихорадка Денге, дифтерия, геморрагическая лихорадка Эбола, энтеротоксигенная диарея, вызываемая Escherichia coli (ETEC), рак желудка (Helicobacter pylori), гонорея, заболевания, ассоциированные со стрептококками группы А, заболевания, ассоциированные со стрептококками группы В, вызываемые палочкой Haemophilus influenzae типа В пневмония и инвазивное заболевание, диарея при гепатите А, гепатите В, гепатите С, гепатите Е, вызываемые вирусом герпеса простого типа 2 язвы половых органов, ВИЧ/СПИД, анкилостомидоз, грипп, японский энцефалит, лихорадка Ласса, лейшманиоз, лептоспироз, рак печени (гепатит В), рак печени (гепатит С), болезнь Лайма, малярия, геморрагическая лихорадка Марбург, корь, свинка, рак носоглотки (вирус Эпштейна-Барра), вызываемый Neisseria meningitidis менингит, ассоциированная с парагриппом пневмония, коклюш, чума, полиомиелит, бешенство, вызываемая респираторным синцитиальным вирусом (RSV) пневмония, лихорадка Рифт-Валли, вызываемая ротавирусом диарея, краснуха, шистосомоз, тяжелый острый респираторный синдром (SARS), шигеллез, оспа, ассоциированные с Staphylococcus aureus заболевания, рак желудка (Helicobacter pylori), вызываемая стрептококками пневмония и инвазивное заболевание, столбняк, клещевой энцефалит, трахома, туберкулез, туляремия, тифозная лихорадка, ассоциированное с вирусом Западного Нила заболевание, желтая лихорадка.
Кроме того, комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять для (приготовления лекарственного средства, предназначенного для) профилактики, лечения и/или облегчения аутоиммунных нарушений, например, аутоиммунных заболеваний ЦНС, аутовоспалительных заболеваний, глютеновой болезни; синдрома Шегрена, системной красной волчанки и т.д. Как правило, аутоиммунные заболевания возникают вследствие аномального иммунного ответа организма на субстанции и ткани, которые в норме присутствуют в организме (аутоиммунитет). Заболевание может быть ограничено определенными органами (как, например, в случае аутоиммунного тиреоидита) или может затрагивать конкретную ткань в различных местах (как, например, в случае болезни Гудпасчера, которая может поражать базальную мембрану, как в легком, так и в почках). Аутоиммунные заболевания можно классифицировать по соответствующему типу гиперчувствительности: тип I (а именно, крапивница, индуцируемая аутологичной сывороткой), тип II, тип III или тип IV.
Примерами аутоиммунных заболеваний являются синдром Блау, буллезный пемфигоид, рак, болезнь Кастлемена, глютеновая болезнь, болезнь Шагаса, хроническая воспалительная демиелинизирующая полиневропатия, хронический рекуррентный многоочаговый остеомиелит, хроническая обструктивная болезнь легких, синдром Черджа-Стросса, рубцевой пемфигоид, синдром Когана, болезнь холодовых агглютининов, дефицит компонента 2 комплемента, контактный дерматит, черепной артериит, синдром CREST, болезнь Крона, синдром Кушинга, болезнь Деркума, герпетиформный дерматит, дерматомиозит, сахарный диабет типа 1, диффузный кожный системный склероз, синдром Дресслера, волчанка, дискоидная красная волчанка, экзема, острый диссеминированный энцефаломиелит (ADEM), болезнь Аддисона, агаммаглобулинемия, амиотрофический боковой склероз (обозначаемый также как болезнь Лу Герига; болезнь моторных нейронов), антифосфолипидный синдром анкилоизирующего спондилита, антисинтетазный синдром, атопический дерматит, аутоиммунная апластическая анемия, аутоиммунная кардиомиопатия, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунная болезнь внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунная периферическая невропатия, аутоиммунный панкреатит, аутоиммунный полиэндокринный синдром, аутоиммунный прогестероновый дерматит, аутоиммунная тромбоцитопеническая пурпура, аутоиммунная крапивница, аутоиммунный увеит, болезнь Бало/концентрический склероз Бало, болезнь Бехчета, болезнь Берже, энцефалит Бикерстаффа, эндометриоз, энтезит-ассоциированный артрит, эозинофильный гастроэнтерит, приобретенный буллезный эпидермолиз, эритробластомоз плода, синдром Эванса, фибродисплазия оссифицирующая, фиброзный альвеолит (или идиопатический легочный фиброз), гастрит, гломерулонефрит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, энцефалопатия Хашимото, тиреоидит Хашимото, пемфигоид беременных, гнойный гидраденит, гипогаммаглобулинемия, идиопатическая тромбоцитопеническая пурпура (аутоиммунная тромбоцитопеническая пурпура), IgA-нефропатия, глазной рубцовый пемфигоид, миозит с тельцами включения, ревматоидный артрит, хроническая воспалительная ревматическая лихорадка, демиелинизирующая полиневропатия, саркоидоз, палиндромный ревматизм, интерстициальный цистит, ювенильная идиопатическая шизофрения, PANDAS (педиатрический артрит, также известный как ювенильный аутоиммунный ревматоидный артрит), синдром Шмидта, нейропсихиатрическая болезнь Кавасаки, другая форма APS (антифосфолипидный синдром), синдром Шнитцлера, паранеопластический мозжечковый миастенический синдром, лейкоцитокластическая сывороточная болезнь, плоский лишай, синдром Шегрена, склерозирующий лишай, синдром Персонэйджа-Тэйнера, IgA-линейная болезнь, болезнь Стилла, пемфигоид обыкновенный (пузырчатка обыкновенная), люпоидный гепатит, аутоиммунный гепатит, синдром негнущегося человека, пернициозная анемия, подострый бактериальный эндокардит (SBE), синдром POEMS, красная волчанка, синдром Свита, симпатическая офтальмия, болезнь Меньера, системная волчанка, первичный билиарный цирроз, синдром Миллера-Фишера, артериит Такаясу, холангит, прогрессирующая воспалительная невропатия, болезнь Муха-Габермана, псориаз, псориатический артрит, гангренозная пиодермия, рассеянный склероз, чистая эритроцитарная аплазия, энцефалит Расмуссена, тяжелая миастения, поперечный миелит, феномен Рейно, микроскопический колит, язвенный колит, миозит, идиопатическое воспалительное заболевание кишечника (IBD), оптический нейромиелит, болезнь Девика и нейромиотония.
Кроме того, комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять для (приготовления лекарственного средства, предназначенного для) профилактики, лечения и/или облегчения гематологических нарушений, которые, как правило, представляют собой нарушения, влияющие главным образом на кровь. При этом предпочтительными являются гематологические злокачественные заболевания.
Примерами гематологических заболеваний являются миелоидные нарушения, включая гемоглобинопатии (врожденная аномалия молекулы гемоглобина или скорости синтеза гемоглобина), такие, например, как серповидно-клеточная болезнь, талассемия, метемоглобинемия; анемии (нехватка эритроцитов или гемоглобина), такие, например, как железодефицитная анемия, мегалобластная анемия, включая дефицит витамина В12, пернициозная анемия и фолатный дефицит, гемолитические анемии (разрушение эритроцитов), включая генетические нарушения мембраны RBC, такие, например, как наследственный сфероцитоз, наследственный эллиптоцитоз и врожденная дисэритропоэтическая анемия, генетические нарушения метаболизма RBC, такие как дефицит глюкозо-6-фосфатдегидрогеназы (G6PD) и дефицит пируваткиназы, иммуноопосредованная гемолитическая анемия (положительный результат прямого теста Кумба), такая как аутоиммунная гемолитическая анемия, включая аутоиммунную гемолитическую анемию с тепловыми антителами (такую как идиопатическая системная красная волчанка (SLE) и синдром Эванса (антитела к тромбоцитам и гемолитические антитела (антитела к антигенам эритроцитов))) и аутоиммунную гемолитическую анемию с холодовыми антителами (такую как идиопатический синдром холодовых гемагглютининов, инфекционный мононуклеоз и пароксизмальная холодовая гемоглобинурия), аллоиммунная гемолитическая анемия, включая гемолитическую болезнь новорожденных (HDN) (такую как Rh болезнь (Rh D), гемолитическая болезнь новорожденных АВО, гемолитическая болезнь новорожденных с анти-Kell антителами, Резус С гемолитическая болезнь новорожденных, Резус Е гемолитическая болезнь новорожденных, и заболевания, связанные с несовместимостью других групп крови (RhC, Rhe, Kid, Duffy, MN, P и др.)), лекарственно-индуцированная иммуноопосредованная гемолитическая анемия, включая индуцированную пенициллином (в высокой дозе) и метилдопой анемию, гемоглобинопатии (а именно, с нестабильным или кристаллическим гемоглобином), пароксизмальная ночная гемоглобинурия (редкое приобретенное клональное нарушение белков поверхности эритроцитов), прямое физическое повреждение RBC, включая микроангиопатическую гемолитическую анемию и вторичную, обусловленную искусственным(и) сердечным(и) клапаном(амии), апластическая анемия, такая как анемия Фанкони, анемия Даймонда-Блэкфена (наследственная чистая аплазия эритроцитов) и приобретенная чистая аплазия эритроцитов; снижение числа клеток, например, миелодиспластический синдром, миелофиброз, нейтропения (снижение числа нейтрофилов), агранулоцитоз, тромбастения Гланцманна и тромбоцитопения (снижение числа тромбоцитов), включая идиопатическую тромбоцитопеническую пурпуру (ITP), тромботическую тромбоцитопеническую пурпуру (ТТР) и индуцируемую гепарином тромбоцитопению (HIT); миелопролиферативные нарушения (повышенное количество клеток), такие, например, как истинная полицитемия (повышение количества клеток в целом), эритроцитоз (увеличение количества эритроцитов), лейкоцитоз (увеличение количества лейкоцитов), тромбоцитоз (увеличение количества тромбоцитов), и миелопролиферативное нарушение; коагулопатии (нарушения кровообращения и свертываемости крови), такие, например, как тромбоцитоз, рекуррентный тромбоз, диссеминированная внутрисосудистая коагуляция, нарушения свертывающих белков, включая гемофилию, такую как гемофилия А, гемофилия В (известная также как рождественская болезнь) и гемофилия С, болезнь фон Виллебранда, диссеминированная внутрисосудистая коагуляция, дефицит белка S и антифосфолипидный синдром, и нарушения тромбоцитов, включая тромбоцитопению, тромбастению Гланцманна и синдром Вискотта-Олдрича. Кроме того, примерами гематологических заболеваний являются также гематологические злокачественные нарушения, включая такие гематологические злокачественные нарушения, как, например, лимфомы, включая болезнь Ходжкина и неходжкинскую лимфому, такую как лимфома Беркитта, анапластическую крупноклеточную лимфому, лимфому из клеток маргинальной зоны селезенки, гепатоселезеночную Т-клеточную лимфому и ангиоиммунобластную Т-клеточную лимфому (AILT), миеломы, такие как множественная миелома, макроглобулинемия Вальденстрема и плазмацитома, лейкозы, такие как острый лимоцитарный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), острый миелогенный лейкоз (AML), хронический идиопатический миелофиброз (MF), хронический миелогенный лейкоз (CML), Т-клеточный пролимфоцитарный лейкоз (T-PLL), В-клеточный пролимфоцитарный лейкоз (B-PLL), хронический нейтрофильный лейкоз (CNL), волосатоклеточный лейкоз (HCL), Т-клеточный лейкоз из больших гранулярных лимфоцитов (T-LGL) и агрессивный NK-клеточный лейкоз. Кроме того, примерами гематологических заболеваний являются также гематологические заболевания смешанного типа, включая гемохроматоз, асплению, гиперспленизм, такой как болезнь Гоше, моноклональную гаммопатию неясного генеза, гемофагоцитарный лимфогистиоцитоз и синдром Темпи. Кроме того, примерами гематологических заболеваний являются также гематологические нарушения, вторичные относительно негематологических нарушений, включая анемию при хроническом заболевании, инфекционный мононуклеоз, сприд, малярию и лейшманиоз.
Кроме того, комбинацию модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, можно применять для (приготовления лекарственного средства, предназначенного для) профилактики, лечения и/или облегчения отторжения трансплантата, включая, например, реакции трансплантат-против хозяина. Отторжение трансплантата включает гиперострое отторжение, острое отторжение и хроническое отторжение трансплантата. Примеры отторжения трансплантата включают реакцию отторжения трансплантата кожи, почки, сердца, легкого, поджелудочной железы, печени, кровяной клетки, костного мозга, роговицы, оторванной в результате несчастного случая конечности, в частности пальцев, руки, ноги; лица, носа, кости, сердечного клапана, кровеносного сосуда или кишечника.
В целом, понятие «комбинация модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR» означает, что терапию на основе модулятора иммунных контрольных точек, указанного в настоящем описании, объединяют с терапией на основе комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR. Другими словами, если один компонент (модулятор контрольных точек или комплекс) не вводят, например, в тот же день, что и другой компонент (другой модулятор контрольных точек или комплекс), то схемы лечения ими, как правило, являются тесно связанными (переплетенными). Это означает, в контексте настоящего изобретения, что «комбинация» не должна включать начало терапии на основе одного компонента (модулятора контрольных точек или комплекса) после завершения терапии на основе другого компонента (другого модулятора контрольных точек или комплекса). При этом «завершенная» касательно терапии означает, в частности, что активный компонент не проявляет больше свои действия, т.е. «терапия» может, в частности, завершаться через несколько минут, часов или дней после последнего введения активного компонента, в зависимости от продолжительности действий активного компонента. Более конкретно, «связанная, переплетающаяся» схема лечения на основе модулятора контрольных точек и комплекса (и таким образом, на основе комбинации модулятора контрольных точек и комплекса) означает, что
(I) не каждое введение модулятора контрольных точек (и, следовательно осуществление полной терапии на основе модулятора контрольных точек) завершается более чем за 1 неделю (предпочтительно более чем за 3 дня, более предпочтительно более чем за 2 дня, еще более предпочтительно более чем за 1 день) до первого осуществления введения комплекса (и, следовательно осуществления полной терапии на основе комплекса); или
(II) не каждое введение комплекса (и, следовательно осуществление полной терапии на основе комплекса) завершается более чем за 1 неделю (предпочтительно более чем за 3 дня, более предпочтительно более чем за 2 дня, еще более предпочтительно более чем за 1 день) до осуществления первого введения модулятора контрольных точек (и, следовательно осуществления полной терапии на основе модулятора контрольных точек).
Например, при использовании комбинации модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, предлагаемую для применения согласно настоящему изобретению, один компонент (модулятор контрольных точек или комплекс) можно вводить один раз в неделю, а другой компонент (другой модулятор контрольных точек или комплекс) можно вводить один раз в месяц. В этом примере для использования «комбинации», как она понимается в настоящем изобретении, ежемесячно вводимый компонент должен вводиться один раз в ту же неделю, в которую вводят еженедельно вводимый другой компонент.
Как изложено выше, введение модулятора иммунных контрольных точек и/или комплекса, которые входят в комбинацию, предлагаемую для применения согласно настоящему изобретению, может подразумевать несколько последовательных введений, например, несколько инъекций. Таким образом, введение можно повторять по меньшей мере два раза, например один раз в качестве инъекций для первичной иммунизации, а затем в качестве бустерных инъекций.
В частности, модулятор иммунных контрольных точек и/или комплекс, которые входят в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно вводить многократно или постоянно. Модулятор иммунных контрольных точек и/или комплекс, которые входят в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно вводить многократно или постоянно в течение периода времени, составляющего по меньшей мере 1, 2, 3 или 4 недели; 2, 3, 4, 5, 6, 8, 10 или 12 месяцев; или 2, 3, 4 или 5 лет. Например, модулятор иммунных контрольных точек и/или комплекс, которые входят в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно вводить дважды в день, один раз в день, каждые два дня, каждые три дня, один раз в неделю, каждые две недели, каждые три недели, один раз в месяц или каждые два месяца. Например, комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно вводить дважды в день, один раз в день, каждые два дня, каждые три дня, один раз в неделю, каждые две недели, каждые три недели, один раз в месяц или каждые два месяца. Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно вводить многократно, например, один раз в неделю или (один раз) каждые две недели.
В комбинации модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, предлагаемой для применения согласно настоящему изобретению, модулятор иммунных контрольных точек и комплекс предпочтительно вводят примерно в одно и то же время.
В контексте настоящего описания понятие «примерно в одно и то же время» означает, в частности, одновременное введение или вариант, когда непосредственно после введения модулятора иммунных контрольных точек вводят комплекс, или вариант, когда непосредственно после введения комплекса вводят модулятор контрольных иммунных точек. Специалисту в данной области должно быть очевидно, что понятие «непосредственно после» включает время, необходимее для подготовки второго введения - в частности, время, необходимое для экспозиции и дезинфекции места второго введения, а также при необходимости подготовки «устройства для введения» (например, шприца, помпы и т.д.). Одновременное введение включает также вариант, когда периоды введения модулятора контрольной(ых) точки(ек) и комплекса перекрываются, или, например, вариант, когда один компонент (модулятор контрольных точек или комплекс) вводят в течение более длительного периода времени, например, 30 мин, 1 ч, 2 ч или более, например, путем инфузии, а другой компонент (модулятор контрольных точек или комплекс) вводят в определенный момент времени в течение указанного длительного периода. Введение модулятора иммунных контрольных точек и комплекса примерно в одно и то же время является особенно предпочтительным, если используют различные пути введения и/или введение в различные области.
Предпочтительно также при применении комбинации модулятора иммунных контрольных точек, указанного в настоящем описании, и комплекса, указанного в настоящем описании, который содержит проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, предлагаемой для применения согласно настоящему изобретению, модулятор иммунных контрольных точек и комплекс вводят последовательно. Например, модулятор иммунных контрольных точек предпочтительно вводят до введения комплекса. Предпочтительно также модулятор иммунных контрольных точек вводят после введения комплекса.
При последовательном введении промежуток времени между введением первого компонента (модулятор контрольных точек или комплекс) и введением второго компонента (другой модулятор контрольных точек и комплекс) предпочтительно не превышает одну неделю, более предпочтительно не превышает 3 дня, еще более предпочтительно не превышает 2 дня и наиболее предпочтительно не превышает 24 ч. Наиболее предпочтительно модулятор контрольных точек и комплекс вводят в один и тот же день, при этом промежуток времени между введением первого компонента (модулятор контрольных точек или комплекс) и введением второго компонента (другой модулятор контрольных точек и комплекс) предпочтительно не превышает 6 ч, более предпочтительно не превышает 3 ч, еще более предпочтительно не превышает 2 ч и наиболее предпочтительно не превышает 1 ч.
Предпочтительно модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят в терапевтически эффективном количестве. В контексте настоящего описания «терапевтически эффективное количество» означает количество, достаточное для облегчения симптомов заболевания или состояния, подлежащего лечению и/или профилактики симптомов заболевания или состояния, которые следует предотвращать. Другими словами «терапевтически эффективное количество» означает количество комплекса и/или модулятора контрольных точек, которое является достаточным для индукции положительной модификации заболевания или нарушения, т.е. количество комплекса и/или модулятора контрольных точек, которое вызывает биологический или медицинский ответ в требуемой/требуемом ткани, системе, животном или человеке. Понятие включает также количество комплекса и/или модулятора иммунных контрольных точек, достаточное для значительного снижения развития болезни, прежде всего снижения или ингибирования роста опухоли или инфекции, и тем самым вызывает требуемый ответ, в частности указанный ответ может представлять собой иммунный ответ против антигенов или антигенных эпитопов, которые входят в комплекс (т.е. «эффективное ингибирующее количество»). Однако в то же время «терапевтически эффективное количество» предпочтительно является достаточно малым, чтобы избегать серьезных побочных действий, т.е., другими словами, должно обеспечивать приемлемое соотношение между преимуществом и риском. Определение этих пределов, как правило, можно осуществлять с помощью приемлемых медицинских руководств. «Терапевтически эффективное количество» комплекса и/или модулятора контрольных точек, кроме того, может варьироваться в зависимости от конкретного состояния, подлежащего лечению, а также от возраста и физического состояния пациента, подлежащего лечению, веса тела, общего состояния здоровья, пола, диеты, продолжительно введения, скорости экскреции комбинации лекарственных средств, активности конкретных компонентов (модулятор контрольных точек и комплекс), серьезности состояния, продолжительности лечения, природы сопутствующей терапии, конкретного применяемого фармацевтически приемлемого носителя и аналогичных факторов, известных и применяемых лечащим врачом.
Таким образом, введение доз в виде однократных или многократных доз индивидууму варьируется в зависимости от различных факторов, включая фармакокинетические свойства, состояния и характеристики индивидуума (пол, возраст, вес тела, состояние здоровья, конституция), степень проявления симптомов, сопутствующее лечение, частота обработок и требуемый эффект.
Предпочтительно для лечения рака терапевтически эффективная доза комплекса, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению, составляет от примерно 0,001 до 10 мг, предпочтительно от примерно 0,01 до 5 мг, более предпочтительно от примерно 0,1 до 2 мг на инъекцию или от примерно 0,01 нмоля до 1 ммоля на инъекцию, в частности, от 1 нмоля до 1 ммоля на инъекцию, предпочтительно от 1 мкмоля до 1 ммоля на инъекцию. Предпочтительно также, если терапевтически эффективная доза комплекса, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению, составляет (на кг веса тела), в частности, при лечении рака, от примерно 0,01 до 100 мг/кг, предпочтительно от примерно 0,05 до 50 мг/кг, более предпочтительно от примерно 0,1 до 25 мг/кг, еще более предпочтительно от примерно 0,5 до 10 мг/кг и наиболее предпочтительно от примерно 1 до 5 мг/кг.
Предпочтительно терапевтически эффективная доза модулятора иммунных контрольных точек, входящего в комбинацию, предлагаемую для применения согласно настоящему изобретению, составляет (на кг веса тела), в частности, при лечении рака, от примерно 0,01 до 100 мг/кг, предпочтительно от примерно 0,05 до 50 мг/кг, более предпочтительно от примерно 0,1 до 25 мг/кг, еще более предпочтительно от примерно 0,5 до 10 мг/кг, еще более предпочтительно от примерно 1 до 5 мг/кг и наиболее предпочтительно от примерно 1 до 10 мг/кг.
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно применять, используя различные пути введения, например, системно или местно. Пути системного введения, в целом, включают, например, чрескожный, оральный и парентеральный пути, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции и/или интраназальный путь введения. Пути местного применения, в целом, включают, например, местное нанесение, но также и введение непосредственно в область поражения, например введение внутрь опухоли.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, применяют с помощью парентерального пути введения. Более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутривенным, внутриопухолевым, внутрикожным, подкожным, внутримышечным, внутриназальным или внутринодальным путем. Еще более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутривенно и/или подкожно. Также более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутрикожно и/или подкожно.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят с помощью одинакового пути введения, предпочтительно одинаковым парентеральным путем введения, более предпочтительно внутривенно или подкожно.
Однако более предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, применяют с использованием различных путей введения, предпочтительно различных парентеральных путей введения, более предпочтительно модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутривенно, а комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутриопухолевым, внутрикожным, подкожным, внутримышечным, внутриназальным или внутринодальным путем, предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят подкожно. Еще более предпочтительно модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят внутривенно, а комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, вводят подкожно или внутрикожно.
Комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, можно приготавливать в виде одной или различных композиций.
Предпочтительно комплекс, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, и модулятор иммунных контрольных точек, входящий в комбинацию, предлагаемую для применения согласно настоящему изобретению, приготавливают в виде различных композиций. При этом, для комплекса и для модулятора контрольных точек можно применять различные другие компоненты, например, различные наполнители. Кроме того, комплекс и модулятор иммунных контрольных точек можно применять с помощью различных путей введения, а дозы (в частности, соответствующие дозы) можно регулировать в зависимости от конкретных потребностей.
Однако предпочтительно также модулятор иммунных контрольных точек и комплекс приготавливать в виде одной композиции. Такая композиция, содержащая и модулятор иммунных контрольных точек, и комплекс, описана более подробно ниже («композиция, предлагаемая в настоящем изобретении»).
Вне зависимости от того, содержит ли композиция только модулятор иммунных контрольных точек (и не содержит комплекс), только комплекс (и не содержит модулятор контрольных точек) или содержит их обоих, указанная композиция может представлять собой фармацевтическую композицию и/или композицию вакцины.
В частности, указанная композиция, которая содержит только модулятор иммунных контрольных точек (и не содержит комплекс), только комплекс (и не содержит модулятор контрольных точек) или содержит их обоих, предпочтительно представляет собой (фармацевтическую) композицию, которая необязательно содержит фармацевтически приемлемый носитель и/или наполнитель или любой эксципиент, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области.
В качестве дополнительного ингредиента (фармацевтическая) композиция может содержать, в частности, фармацевтически приемлемый носитель и/или наполнитель. В контексте настоящего изобретения фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу фармацевтической композиции. Если (фармацевтическая) композиция находится в жидкой форме, то носитель должен, как правило, представлять собой свободную от пирогенов воду; изотонические соляные или забуференные (водные) растворы, например, забуференные фосфатом, цитратом и т.д. растворы. В частности, для инъекции (фармацевтической) композиции можно использовать воду или предпочтительно буфер, более предпочтительно водный буфер, содержащий натриевую соль, предпочтительно по меньшей мере 30 мМ натриевую соль, кальциевую соль, предпочтительно по меньшей мере 0,05 мМ кальциевую соль, и необязательно калиевую соль, предпочтительно по меньшей мере 1 мМ калиевую соль. Согласно предпочтительному варианту осуществления изобретения натриевая, кальциевая и необязательно калиевая соли могут находиться в форме их галогенидов, например, хлоридов, йодидов или бромидов, в форме их гидроксидов, карбонатов, бикарбонатов или сульфатов и т.д. Примеры натриевых солей включают (но, не ограничиваясь только ими), в частности, NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, примеры необязательных калиевых солей включают, в частности, KCl, KI, KBr, K2CO3, KHCO3, K2SO4, а примеры кальциевых солей включают, в частности, CaCl2, CaI2, CaBr2, СаСО3, CaSO4, Са(ОН)2. Кроме того, в буфере могут содержаться органические анионы вышеуказанных катионов. Согласно более предпочтительному варианту осуществления изобретения указанный выше буфер, который можно применять для целей инъекции, может содержать соль, выбранную из хлорида натрия (NaCl), хлорида кальция (CaCl2) и необязательно хлорида калия (KCl), при этом, помимо хлоридов могут присутствовать дополнительные анионы. CaCl2 можно заменять также другой солью типа KCl. Как правило, соли в буфере для инъекций присутствуют в концентрации по меньшей мере 30 мМ в случае хлорида натрия (NaCl), по меньшей мере 1 мМ в случае хлорида калия (KCl) и по меньшей мере 0,05 мМ в случае хлорида кальция (CaCl2). Буфер для инъекций может быть гипертоническим, изотоническим или гипотоническим относительно конкретной референс-среды, т.е. буфер может иметь более высокое, идентичное или более низкое содержание солей относительно конкретной референс-среды, при этом предпочтительно можно применять вышеуказанные соли в таких концентрациях, которые не приводят к повреждению клеток в результате осмоса или других зависящих от концентрации эффектов. Референс-среды представляют собой, например, жидкости, присутствующие в методах «in vivo», такие как кровь, лимфа, цитозольные жидкости или другие жидкости организма или, например, жидкости, которые можно использовать в качестве референс-сред в методах «in vitro», такие как обычные буферы или жидкости. Такие обычные буферы или жидкости известны специалистам в данной области. Предпочтительными в качестве жидкой основы являются соляной раствор (0,9% NaCl) и лактированный раствор Рингера.
Предпочтительно (фармацевтическая) композиция, которая содержит модулятор иммунной контрольной точки и/или комплекс, указанный в настоящем описании, дополнительно содержит аргинин, например, L-аргинин.
Однако в (фармацевтической) композиции можно применять также один или несколько совместимых твердых или жидких наполнителей или разбавителей, или капсулирующих соединений, которые можно использовать для введения индивидууму, подлежащему лечению. Понятие «совместимый» в контексте настоящего описания означает, что эти составляющие (фармацевтической) композиции можно смешивать с указанным выше комплексом, предлагаемым в настоящем изобретении, таким образом, что отсутствует взаимодействие, которое могло бы приводит к существенному снижению фармацевтической эффективности (фармацевтической) композиции в обычных условиях применения.
Фармацевтически приемлемые носители, наполнители и разбавители должны, естественно, иметь достаточно высокую степень чистоты и достаточно низкую токсичность для того, чтобы их можно было бы применять для введения индивидууму, подлежащему лечению. Некоторыми примерами соединений, которые можно применять в качестве фармацевтически приемлемых носителей, наполнителей или составляющих, являются сахара, такие, например, как лактоза, глюкоза и сахароза; крахмалы, такие, например, как кукурузный крахмал или картофельный крахмал; целлюлоза и ее производные, такие, например, как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы; порошкообразный трагакант; солод, желатин; жир; твердые вещества, обеспечивающие скольжение, такие, например, как стеариновая кислота, стеарат магния; сульфат кальция; растительные масла, такие, например, как арахисовое масло, масло из семян хлопчатника, кунжутное масло, оливковое масло, кукурузное масло и масло из теобромы (шоколадное дерево); полиолы, такие, например, полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота.
Как описано выше, (фармацевтическую) композицию можно вводить орально, парентерально, путем ингаляции спрея, местно, ректально, назально, трансбуккально, вагинально или с помощью имплантированного резервуара. В контексте настоящего описания понятие парентерально включает подкожную, внутривенную, внутримышечную, внутрисуставную, в синовиальную жидкость, надчревную, внутриоболочечную, внутрипеченочную, внутрь повреждения, внутричерепную, чрескожную, внутрикожную, внутрилегочную, внутрибрюшинную, внутрисердечную, внутриартериальную и подъязычную инъекцию или инфузию.
Предпочтительно (фармацевтическую) композицию можно вводить путем парентеральной инъекции, более предпочтительно путем подкожной, внутривенной, внутримышечной, внутрисуставной, в синовиальную жидкость, надчревной, внутриоболочечной, внутрипеченочной, внутрь повреждения, внутричерепной, чрескожной, внутрикожной, внутрилегочной, внутрибрюшинной, внутрисердечной, внутриартериальной и подъязычной инъекции или инфузии. Стерильные инъецируемые формы (фармацевтических) композиций могут представлять собой водную или маслянистую суспензию. Эти суспензии можно приготавливать с помощью методов, известных в данной области, с использованием приемлемых диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или инъецируемую суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, таком, например, как раствор в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые можно применять, следует упомянуть воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды, как правило, применяют стерильные нелетучие масла. Для этой цели можно применять мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицериды, можно применять в препаратах для инъекции в виде встречающихся в естественных условиях фармацевтически приемлемых масел, таких как оливковое масло или касторовое масло, прежде всего в виде их полиоксиэтилированных производных. Эти масляные растворы или суспензии могут содержать также спирт с длинной цепью в качестве разбавителя или диспергирующего агента, такой как карбоксиметилцеллюлоза, или аналогичные диспергирующие агенты, которые обычно применяют для приготовления фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Для приготовления (фармацевтической) композиции можно применять также другие общепринятые поверхностно-активные вещества, такие как Твины, Спаны и другие эмульгирующие агенты или усиливающие биологическую доступность средства, которые обычно применяют для производства фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Для внутривенной, кожной или подкожной инъекции или инъекции в область поражения действующее вещество должно предпочтительно находиться в форме приемлемого для парентерального введения водного раствора, свободного от пирогенов и имеющего приемлемую величину pH, изотоничность и стабильность. Специалисты в данной области могут приготавливать приемлемые растворы, используя, например, придающие изотоничность наполнители, такие как хлорид натрия для инъекций, раствор Рингера для инъекций, лактированный раствор Рингера для инъекций. Можно включать при необходимости консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки. Вне зависимости от того, применяют ли полипептид, пептид или молекулу нуклеиновой кислоты, другое фармацевтически приемлемое соединение, предлагаемое в изобретении, которое следует вводить индивидууму, введение предпочтительно осуществляют в «терапевтически эффективном количестве», которое является достаточным для оказания благоприятного воздействия на индивидуума. Фактически вводимое количество и скорость, и продолжительность введения должны зависеть от природы и серьезности состояния, подлежащего лечению.
(Фармацевтическую) композицию, указанную в настоящем описании, можно вводить также орально в виде любой приемлемой для орального введения лекарственной формы, включая (но, не ограничиваясь только ими) капсулы, таблетки, водные суспензии или растворы. В случае таблеток для орального применения общепринятые носители представляют собой лактозу и кукурузный крахмал. Как правило, добавляют также замасливатели, такие как стеарат магния. Для орального введения в форме капсулы приемлемыми разбавителями являются лактоза и безводный кукурузный крахмал. Когда для орального введения требуются водные суспензии, то действующее вещество, т.е. указанный выше предлагаемый в изобретении транспортер конъюгированной карго-молекулы, указанной выше, объединяют с эмульгирующими и суспендирующими агентами. При необходимости можно добавлять определенные подслащивающие вещества, корргиенты или красители.
(Фармацевтическую) композицию можно применять также местно, прежде всего, если мишень обработки включает области или органы, легко доступные для местного нанесения, например, в том числе при заболеваниях кожи или любой другой доступной эпителиальной ткани. Приемлемые местные препаративные формы легко приготавливать для каждой/каждого из указанных областей или органов. Для местного применения (фармацевтическую) композицию можно приготавливать в виде приемлемой мази, содержащей предлагаемую в изобретении иммуностимулирующую композицию, в частности ее компоненты, описанные выше, суспендированные или растворенные в одном или нескольких носителях. Носители для местного применения включают (но, не ограничиваясь только ими) минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующийся воск и воду. Альтернативно этому, (фармацевтическую) композицию можно приготавливать в форме приемлемого лосьона или крема. В контексте настоящего изобретения приемлемые носители включают (но, не ограничиваясь только ими) минеральное масло, сорбитанмоностеарат, полисорбат 60, сложные цетиловые эфиры воска, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
В этом контексте предписание лечения, например, выбор доз и т.д. при применении описанной выше (фармацевтической) композиции, как правило, находится в компетенции обычных практикующих специалистов и других врачей, и, как правило, при этом учитываются нарушение, подлежащее лечению, состояние индивидуального пациента, место введения, метод обработки и другие факторы, известные практикующему специалисту. Примеры упомянутых выше методик и протоколов можно почерпнуть из REMINGTON'S PHARMACEUTICAL SCIENCES, 160-е изд., под ред. Osol А., 1980.
Таким образом, (фармацевтическая) композиция, как правило, содержит в терапевтически эффективном количестве компоненты (фармацевтической) композиции, в частности, комплекс и/или модулятор контрольных точек. (Фармацевтическую) композицию можно применять для человека, а также в ветеринарной медицине, предпочтительно для лечения человека, в качестве фармацевтической композиции в целом, или в качестве вакцины.
(Фармацевтические) композиции, в частности, композиции вакцины, или препаративные формы, предлагаемые в изобретении, можно вводить в виде фармацевтической препаративной формы, которая может содержать комплекс, указанный в настоящем описании, и/или модулятор контрольных точек, указанный в настоящем описании, в любой форме, указанной в настоящем описании.
Понятия «фармацевтическая препаративная форма» и «фармацевтическая композиция» в контексте настоящего изобретения относятся, в частности, к препаратам, которые находятся в форме, обеспечивающей биологическую активность действующего(их) вещества(в), таким образом, чтобы оно(и) однозначно проявляло(и) эффективность, и которая не содержит дополнительный компонент, который может обладать токсичностью для индивидуумов, которым должна вводиться указанная препаративная форма.
В контексте настоящего изобретения «эффективность» лечения можно оценивать на основе изменений протекания заболевания в ответ на применение, предлагаемое в настоящем изобретении, или на способ, предлагаемый в настоящем изобретении. Например, эффективность лечения рака можно измерять по снижению объема опухоли и/или удлинению времени жизни без прогрессирования, и/или снижению риска рецидива после резекции первичного рака. Более конкретно, при раке, который лечат с помощью иммунотерапии, оценка эффективности может включать спектр клинических картин противоопухолевого ответа на иммунотерапевтические агенты с использованием новых критериев ответа на иммунотерапию (irRC), которые являются адаптацией критериев оценки ответа солидных опухолей (RECIST), и критериев Всемирной организации здравоохранения (ВОЗ) (J. Natl. Cancer Inst. 102(18), 2010, сс. 1388-1397). Эффективность предупреждения инфекционного заболевания в конечном счете оценивают с помощью эпидемиологических исследований человеческих популяций, которые часто коррелируют с титрами нейтрализующих антител в сыворотке, и по индукции многофункциональных патогенспецифических Т-клеточных ответов. Доклиническая оценка может включать устойчивость к инфекции после контрольного заражения инфекционным патогеном. Лечение инфекционного заболевания можно оценивать по ингибированию роста патогена или элиминации патогена (и, как следствие, отсутствию поддающегося обнаружению патогена), что коррелирует с патогенспефическими антителами и/или Т-клеточными иммунными ответами.
(Фармацевтические) композиции, в частности композиции вакцины, или препаративные формы, предлагаемые в изобретении, можно вводить также в виде фармацевтической препаративной формы, которая может содержать антигенпрезентирующие клетки, загруженные комплексом, указанным в настоящем описании, в любой указанной в настоящем описании форме. Вакцину и/или композицию, предлагаемую в настоящем изобретении, можно приготавливать также в виде фармацевтических композиций и их стандартных доз, в частности, в сочетании с общепринятыми адъювантами, иммуномодулирующим агентом, носителем, разбавителем или эксципиентом, которые описаны выше и будут описаны ниже, в такой форме их можно применять в виде твердых препаратов, таких как таблетки или заполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или заполненные ими капсулы, все предназначенные для орального применения, или в форме стерильных инъецируемых растворов для парентерального введения (включая подкожное и внутрикожное введение), которые вводят с помощью инъекции или непрерывной инфузии.
В контексте настоящего изобретения, в частности, в контексте (фармацевтической) композиции и вакцин, предлагаемых в настоящем изобретении, основой инъецируемых композиций, как правило, является инъецируемый стерильный физиологический раствор или забуференный фосфатом физиологический раствор, или другие инъецируемые носители, известные в данной области. Указанные (фармацевтические) композиции и их формы в виде стандартных доз могут содержать ингредиенты в общепринятых пропорциях, с добавлением дополнительных действующих веществ или ингредиентов или без них, и такие стандартные дозы могут содержать в любом пригодном эффективном количестве действующее вещество в соответствии с предполагаемым диапазоном суточных доз при применении.
Примеры приемлемых адъювантов и/или иммуномодулирующих агентов в контексте настоящего изобретения включают MPL® (фирма Corixa), минералы на основе алюминия, включая производные алюминия (как правило, называемые квасцами), ASO1-4, MF59, фосфат кальция, липосомы, Iscom, полиинозиновую-полицитидиловую кислоту (полиIC), включая ее стабилизированную форму поли-ICLC (фирма Hiltonol), CpG-олигодезоксинуклеотиды, колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), липополисахарид (LPS), монтанид, сополимер полилактида-полигликолида (PLG), флагеллин, сапонины коры мыльного дерева (QS21), аминоалкилглюкозамиды (например, RC529), два компонента антибактерильных пептидов с синтетическими олигодезоксинуклеотидами (например, IC31), имиквимод, резиквимод, иммуностимулирующие последовательности (ISS), монофосфорил-липид A (MPLA) и фибробласт-стимулирующий липопептид (FSL1).
Композиции, в частности, фармацевтические композиции и вакцины, предлагаемые в настоящем изобретении, могут представлять собой жидкие препаративные формы, включая (но, не ограничиваясь только ими) водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры. Композиции можно приготавливать также в виде безводного продукта, предназначенного для восстановления водой или другим пригодным наполнителем перед применением. Указанные жидкие препараты могут содержать добавки, включая (но, не ограничиваясь только ими) суспендирующие агенты, эмульгирующие агенты, неводные наполнители и консерванты. Суспендирующие агенты включают (но, не ограничиваясь только ими) сироп сорбита, метилцеллюлозу, сироп глюкозы/сахара, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия и гидрогенизированные съедобные жиры. Эмульгирующие агенты включают (но, не ограничиваясь только ими) лецитин, сорбитанмоноолеат и гуммиарабик. Консерванты включают (но, не ограничиваясь только ими) метил- или пропил-пара-гидроксибензоат и сорбиновую кислоту. Диспергирующие или смачивающие агенты включают (но, не ограничиваясь только ими) поли(этиленгликоль), глицерин, бычий сывороточный альбумин, Tween®, Span®.
Композиции, в частности, фармацевтические композиции и вакцины, предлагаемые в настоящем изобретении, можно приготавливать также в виде препарата в форме депо, который можно вводить путем имплантации или внутримышечной инъекции.
Композиции, в частности, фармацевтические композиции и вакцины, предлагаемые в настоящем изобретении, могут находиться в форме твердых композиций, которые могут иметь форму таблеток или лепешек, которые приготавливают общепринятым образом. Например, таблетки и капсулы для орального введения могут содержать общепринятые эксципиенты, включая (но, не ограничиваясь только ими) связывающие агенты, наполнители, замасливатели, разрыхлители и смачивающие агенты. Связывающие агенты включают (но, не ограничиваясь только ими) сироп, гуммиарабик, желатин, сорбит, трагакант, клейкое вещество из крахмала и поливинилпирродидон. Наполнители включают (но, не ограничиваясь только ими) лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция и сорбит. Замасливатели включают (но, не ограничиваясь только ими) стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль и кремнезем. Разрыхлители включают (но, не ограничиваясь только ими) картофельный крахмал и натрия гликолят крахмала. Смачивающие агенты включают (но, не ограничиваясь только им) лаурилсульфат натрия. На таблетки можно наносить покрытие с помощью известных в данной области методов.
Композиции, в частности, фармацевтические композиции и вакцины, предлагаемые в настоящем изобретении, можно вводить также в виде форм с замедленным высвобождением или систем для доставки лекарственных форм с замедленным высвобождением.
Кроме того, композиции, в частности, фармацевтические композиции и вакцины, предлагаемые в настоящем изобретении, можно адаптировать для доставки путем повторяющегося введения.
Дополнительные материалы, а также методы обработки препаративных форм и т.п., которые можно применять в контексте композиций, в частности, фармацевтических композиций и вакцин, предлагаемых в настоящем изобретении, или в контексте их получения, изложены в Remington's «The Science and Practice of Pharmacy», часть 5, 22-ое изд., изд-во University of the Sciences in Philadelphia, Lippincott Williams & Wilkins, 2012.
Набор, предлагаемый в настоящем изобретении
Следующим объектом настоящего изобретения является также набор, в частности состоящий из частей набор, который содержит
(I) модулятор иммунных контрольных точек и
(II) комплекс, содержащий:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR, где компоненты а)-в), входящие в комплекс, ковалентно связаны.
В частности, указанный набор, предлагаемый в настоящем изобретении, содержит (I) модулятор иммунных контрольных точек, указанный выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), и (II) комплекс, описанный выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению). Другими словами, предпочтительные варианты модулятора иммунных контрольных точек, описанные выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), также являются предпочтительными для набора, предлагаемого в настоящем изобретении. Соответственно предпочтительные варианты комплекса, описанные выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), также являются предпочтительными для набора, предлагаемого в настоящем изобретении.
Различные компоненты набора могут быть упакованы в один или несколько контейнеров. Указанные выше компоненты могут находиться в лиофилизированной или безводной форме или могут быть растворены в приемлемом буфере. Например, набор может содержать (фармацевтическую) композицию, содержащую модулятор иммунных контрольных точек, описанный выше, и (фармацевтическую) композицию, содержащую комплекс, описанный выше, например, каждую композицию в отдельном контейнере. Набор может содержать также (фармацевтическую) композицию, содержащую как модулятор иммунных контрольных точек, так и комплекс, описанные выше.
Набор может содержать также дополнительные реагенты, включая, например, консерванты, среды для роста и/или буферы для хранения и/или восстановления вышеуказанных компонентов, промывочные растворы и т.п.
Кроме того, состоящий из частей набор, предлагаемый в настоящем изобретении, необязательно может содержать инструкции по применению. Предпочтительно набор содержит также содержит листовку-вкладыш в упаковку или этикету с руководством по лечению заболевания, указанного в настоящем описании, например, рака, с помощью комбинации модулятора иммунных контрольных точек и комплекса.
Указанный набор можно применять предпочтительно в медицине, согласно указанному в настоящем описании методу, в частности применять для предупреждения и/или лечения указанного в настоящем описании рака.
Кроме того, в настоящем изобретении предложен также набор для вакцинации, предназначенный для лечения, предупреждения и/или стабилизации заболевания, например, рака или инфекционного заболевания, который содержит фармацевтическую композицию, содержащую модулятор иммунных контрольных точек, указанный в настоящем описании, и фармацевтическую композицию, в частности, вакцину, содержащую комплекс, указанный в настоящем описании (при этом фармацевтические композиции могут быть одинаковыми или различными), и инструкции по применению указанной фармацевтической композиции или указанной вакцины.
Композиция, предлагаемая в настоящем изобретении
Следующим объектом настоящего изобретения является также композиция, которая содержит
(I) модулятор иммунной контрольной точки и
(II) комплекс, содержащий:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR, где компоненты а)-в), входящие в комплекс, ковалентно связаны.
В частности, указанная композиция, предлагаемая в настоящем изобретении, содержит (I) модулятор иммунных контрольных точек, указанный выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), и (II) комплекс, описанный выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению). Другими словами, предпочтительные варианты модулятора иммунных контрольных точек, описанные выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), также являются предпочтительными для композиции, предлагаемой в настоящем изобретении. Соответственно предпочтительные варианты комплекса, описанные выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению), также являются предпочтительными для композиции, предлагаемой в настоящем изобретении.
Кроме того, предложена композиция, содержащая модулятор иммунных контрольных точек, описанный выше, и комплекс, описанный выше, и предпочтительные варианты указанной композиции, описанные выше (в контексте комбинации, предлагаемой для применения согласно настоящему изобретению). Должно быть очевидно, что такое же описание, в частности такие же предпочтительные варианты осуществления изобретения, которые описаны выше, соответственно применимы к композиции, указанной в настоящем описании.
Так, композиция предпочтительно содержит фармацевтически приемлемый носитель. Предпочтительные примеры указанного фармацевтически приемлемого носителя указаны выше.
Предпочтительно также композиция содержит по меньшей мере два различных комплекса. Кроме того, предпочтительная композиция содержит по меньшей мере два различных модулятора иммунных контрольных точек.
Указанную композицию можно предпочтительно применять в медицине, как указано в настоящем описании, в частности применять для предупреждения и/или лечения указанного в настоящем описании рака.
Кроме того, предпочтительно композиция представляет собой вакцину.
В контексте настоящего изобретения понятие «вакцина» относится к биологическому препарату, обусловливающему врожденный и/или адаптивный иммунитет, как правило, к конкретному заболеванию, предпочтительно раку. Так, вакцина поддерживает врожденный и/или адаптивный иммунный ответ иммунной системы индивидуума, подлежащего лечению. Например, антиген или антигенный эпитоп комплекса, предлагаемого в настоящем изобретении, как правило, обусловливает или поддерживает адаптивный иммунный ответ у пациента, подлежащего лечению, а пептидный агонист TLR комплекса, предлагаемого в настоящем изобретении, может обусловливать или поддерживать врожденный иммунный ответ.
Вакцина может содержать также указанные ниже фармацевтически приемлемые носитель, адъювант и/или наполнитель для предлагаемой в изобретении фармацевтической композиции. Согласно конкретному варианту вакцины выбор фармацевтически приемлемого носителя определяется в принципе тем путем, которым вводят предлагаемую в изобретении композицию, в частности, предлагаемую в изобретении вакцину. Предлагаемую в изобретении вакцину можно применять, например, системно или местно, как описано выше. Более предпочтительно вакцины можно вводить внутривенным, внутрикожным, подкожным или внутримышечным путем. Таким образом, вакцину предпочтительно приготавливать в жидкой (или иногда твердой) форме. Приемлемое количество вакцины, подлежащее введению, можно определять с помощью общепринятых экспериментов с использованием животных моделей. Такие модели включают (но, не ограничиваясь только ими) модели, созданные с использованием кроликов, овец, мышей, крыс, собак и приматов кроме человека. Предпочтительные стандартные лекарственные формы для инъекции включают стерильные растворы воды, физиологического раствора или их смеси. pH таких растворов следует доводить до примерно 7,4. Приемлемые носители для инъекции включают гидрогели, устройства для контролируемого или замеленного высвобождения, полимолочную кислоту и коллагеновые матриксы. Пригодные фармацевтически приемлемые носители для местного применения включают носители, которые пригодны для применения в лосьонах, кремах, гелях и т.п. Если предлагаемая в изобретении вакцина предназначена для орального введения, то таблетки, капсулы и т.п. являются предпочтительной стандартной лекарственной формой. Фармацевтически приемлемые носители для получения стандартных лекарственных форм, которые можно использовать для орального введения, хорошо известны из существующего уровня техники. Их выбор зависит от вторичных параметров, таких как вкус, стоимость и стабильность при хранении, которые не имеют решающего значения для целей настоящего изобретения, и выбор легко может сделать специалист в данной области.
Вакцина может содержать также дополнительно одну или несколько вспомогательных субстанций для дополнительного повышения иммуногенности. Тем самым предпочтительно достигается синергетическое действие предлагаемого в изобретении комплекса, указанного выше, и вспомогательной субстанции, которая необязательно может содержаться в предлагаемой в изобретении вакцине, описанной выше. В этой связи в зависимости от различных типов вспомогательных субстанций можно рассматривать различные механизмы. Например, соединения, которые способствуют созреванию дендритных клеток (DC), например, липополисахариды или TNF-альфа образуют первый класс приемлемых вспомогательных субстанций. В целом, в качестве вспомогательной субстанции можно применять любой агент, который влияет на иммунную систему по типу «сигнал опасности» (LPS, GP96 и т.д.), или цитокины, такие как GM-CSF, способствующие усилению и/или воздействию на мишень иммунного ответа, который вырабатывается в ответ на стимулирующий иммунитет адъювант, предлагаемый в изобретении. Наиболее предпочтительными вспомогательными субстанциями являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые дополнительно способствуют врожденному иммунному ответу, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, такие как hGH.
Другими добавками, которые можно включать в вакцину, являются эмульгаторы, такие, например, как Tween®; смачивающие агенты, такие, например, как лаурилсульфат натрия; красители; придающие вкус агенты, фармацевтические носители; агенты для формования таблеток; стабилизаторы; антиоксиданты; консерванты.
Предлагаемая в изобретении вакцина может содержать также любое дополнительное соединение, для которого известно наличие иммуностимулирующих свойств благодаря аффинности связывания (в качестве лигандов) с человеческими Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, или благодаря аффинности связывания (в качестве лигандов) с мышиными Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
Другим классом соединений, которые в этом контексте можно добавлять в вакцину, могут являться CpG-нуклеиновые кислоты, в частности CpG-РНК или CpG-ДНК. CpG-РНК или CpG-ДНК могут представлять собой одноцепочечную CpG-ДНК (ssCpG-ДНК), двухцепочечную CpG-ДНК (dsДНК), одноцепочечную CpG-РНК (ssCpG-РНК) или двухцепочечную CpG-РНК (dsCpG-РНК). CpG-нуклеиновая кислота предпочтительно находится в форме CpG-РНК, более предпочтительно в форме одноцепочечной CpG-РНК (ssCpG-РНК). CpG-нуклеиновая кислота предпочтительно содержит по меньшей мере одну или несколько (митогенную(ых)) динуклеотидную(ых) цитозин/гуаниновую(ых) последовательность(ей) (CpG-мотив(ы)). Согласно первой предпочтительной альтернативе по меньшей мере один CpG-мотив в этих последовательностях, в частности С (цитозин) и G (гуанин) CpG-мотива, является неметилированным. Все другие цитозины или гуанины, необязательно содержащиеся в этих последовательностях, могут быть метилированными, либо неметилированными. Однако согласно дополнительной предпочтительно альтернативе С (цитозин) и G (гуанин) CpG-мотива могут присутствовать также в метилированной форме.
Предпочтительно описанная выше (фармацевтическая) композиция, в частности вакцина, предназначена для применения для предупреждения и/или лечения заболеваний или нарушений, включающих, например, разные виды рака, гематологические нарушения, инфекционные заболевания, аутоиммунные нарушения и отторжения трансплантатов, предпочтительно рак.
Предпочтительно также является применение (фармацевтической) композиции, в частности вакцины, в способе лечения индивидуума, предпочтительно млекопитающего и наиболее предпочтительно человека, страдающего заболеванием или нарушением, прежде всего, нарушением, которое можно лечить с помощью иммунотерапии, такого как разные виды рака, инфекционные заболевания, аутоиммунные нарушения и отторжения трансплантатов.
Молекула нуклеиновой кислоты
Другим объектом настоящего изобретения является также молекула нуклеиновой кислоты, которая содержит полинуклеотид, кодирующий описанный выше модулятор иммунных контрольных точек, предлагаемый в настоящем изобретении, где модулятор иммунных контрольных точек представляет собой (поли)пептид или белок, и/или кодирующий описанный выше комплекс, предлагаемый в настоящем изобретении, где комплекс представляет собой (поли)пептид или белок, в частности, слитый (поли)пептид или слитый белок. Наиболее предпочтительно, нуклеиновая кислота (молекула) кодирует по меньшей мере приведенный в качестве примера в настоящем описании комплекс или функциональный вариант его последовательности. Таким образом, нуклеиновая кислота (молекула) наиболее предпочтительно содержит полинуклеотид, который кодирует аминокислотную последовательность, представленную в любой из SEQ ID NO: 26-32 или 41-45, или аминокислотную последовательность, идентичную по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из последовательностей SEQ ID NO: 26-32 или 41-45.
Примеры молекул нуклеиновых кислот и/или полинуклеотидов включают, например, рекомбинантный полинуклеотид, вектор, олигонуклеотид, молекулу РНК, такую как рРНК, мРНК, миРНК, siРНК или тРНК, или молекулу ДНК, такую как кДНК.
Понятие «вектор» относится к молекуле нуклеиновой кислоты, предпочтительно к рекомбинантной молекуле нуклеиновой кислоты, т.е. молекуле нуклеиновой кислоты, которая не встречается в естественных условиях. Вектор в контексте настоящего изобретения можно применять для включения или «укрытия» требуемой нуклеотидной последовательности. Указанные векторы могут представлять собой векторы для хранения, экспрессионные векторы, клонирующие векторы, векторы для переноса и т.д. Вектор для хранения представляет собой вектор, который обеспечивает удобное хранение молекулы нуклеиновой кислоты. Так, вектор может содержать последовательность, соответствующую, например, описанному выше требуемому комплексу, предлагаемому в настоящем изобретении, и/или последовательность, соответствующую, например, описанному выше модулятору иммунных контрольных точек, предлагаемому в настоящем изобретении. Экспрессионный вектор можно применять для получения продуктов экспрессии, таких как РНК, например, мРНК, или пептидов, полипептидов или белков. Например, экспрессионный вектор может содержать последовательности, необходимые для транскрипции участка последовательности вектора, такие как промоторная последовательность. Клонирующий вектор, как правило, представляет собой вектор, который содержит сайт клонирования, который можно использовать для включения нуклеотидных последовательностей в вектор. Клонирующий вектор может представлять собой, например, плазмидный вектор или вектор на основе бактериофага. Вектор для переноса может представлять собой вектор, пригодный для переноса молекул нуклеиновых кислот в клетки или организмы, например, вирусные векторы. Вектор в контексте настоящего изобретения может представлять собой, например, РНК-вектор или ДНК-вектор. Предпочтительно вектор представляет собой молекулу ДНК. Например, вектор в контексте настоящего описания содержит сайт клонирования, маркер для селекции, такой как фактор, обусловливающий устойчивость к антибиотикам, и последовательность, пригодную для размножения вектора, такую как сайт инициации репликации. Предпочтительно в контексте настоящего описания вектор представляет собой плазмидный вектор.
В частности, в настоящем изобретении предложен набор, содержащий
(I) молекулу нуклеиновой кислоты, которая содержит полинуклеотид, кодирующий модулятор иммунных контрольных точек, где модулятор иммунных контрольных точек представляет собой (поли)пептид или белок; и
(II) молекулу нуклеиновой кислоты, которая содержит полинуклеотид, кодирующий комплекс, где комплекс содержит:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где комплекс представляет собой (поли)пептид или белок, в частности, слитый (поли)пептид или слитый белок.
В указанном наборе, предлагаемом в настоящем изобретении, предпочтительные модуляторы иммунных контрольных точек представляют собой модуляторы, указанные в настоящем описании, и предпочтительные комплексы представляют собой комплексы, указанные в настоящем описании.
Кроме того, набор предпочтительно содержит также листовку-вкладыш в упаковку или этикету с руководством по экспрессии модулятора иммунных контрольных точек и комплекса и/или лечению рака с использованием комбинации модулятора иммунных контрольных точек и комплекса.
Указанный набор предпочтительно применять в медицине, например, применять для предупреждения и/или лечения рака.
Как описано выше, молекула(ы) нуклеиновой(ых) кислоты(т) в наборе предпочтительно выбирают из группы, состоящей из вектора, описанного выше, такого как экспрессионный вектор; молекулы РНК, такой как рРНК, мРНК, миРНК, siРНК или тРНК; или молекулы ДНК, такой как кДНК.
В наборе, предлагаемом в настоящем изобретении, модулятор иммунных контрольных точек и комплекс могут кодироваться одной и той же молекулой нуклеиновой кислоты или предпочтительно различными молекулами нуклеиновых кислот.
Таким образом, в настоящем изобретении предложена также молекула нуклеиновой кислоты, содержащая
(I) полинуклеотид, который кодирует модулятор иммунных контрольных точек, где модулятор иммунных контрольных точек представляет собой (поли)пептид или белок; и
(II) полинуклеотид, который кодирует комплекс, где комплекс содержит:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где комплекс представляет собой (поли)пептид или белок, в частности, слитый (поли)пептид или слитый белок.
В указанной молекуле нуклеиновой кислоты, предлагаемой в настоящем изобретении, предпочтительные модуляторы иммунных контрольных точек представляют собой модуляторы, указанные в настоящем описании, и предпочтительные комплексы представляют собой комплексы, указанные в настоящем описании.
Кроме того, молекулу нуклеиновой кислоты предпочтительно выбирают из группы, состоящей из вектора, описанного выше, такого как экспрессионный вектор; молекулы РНК, такой как рРНК, мРНК, миРНК, siРНК или тРНК; или молекулы ДНК, такой как кДНК. Например, молекула нуклеиновой кислоты может представлять собой экспрессионный вектор или молекулу РНК, например, молекулу мРНК, которая кодирует комплекс и ингибитор иммунных контрольных точек бицистронным образом.
Кроме того, в настоящем изобретении предложена также композиция, содержащая
(I) молекулу нуклеиновой кислоты, содержащую полинуклеотид, который кодирует модулятор иммунных контрольных точек, где модулятор иммунных контрольных точек представляет собой (поли)пептид или белок; и
(II) молекулу нуклеиновой кислоты, содержащую полинуклеотид, который кодирует комплекс, где комплекс содержит:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где комплекс представляет собой (поли)пептид или белок, в частности, слитый (поли)пептид или слитый белок.
В указанной композиции, предлагаемой в настоящем изобретении, предпочтительные модуляторы иммунных контрольных точек представляют собой модуляторы, указанные в настоящем описании, и предпочтительные комплексы представляют собой комплексы, указанные в настоящем описании.
Кроме того, молекулу(ы) нуклеиновой(ых) кислоты(т) предпочтительно выбирают из группы, состоящей из вектора, описанного выше, такого как экспрессионный вектор; молекулы РНК, такой как рРНК, мРНК, миРНК, siРНК или тРНК; или молекулы ДНК, такой как кДНК.
Композиция может содержать также дополнительные компоненты, например, описанные выше для (фармацевтической) композиции, предлагаемой в настоящем изобретении, которая содержит указанные в настоящем описании комплекс и/или ингибитор контрольных точек.
Способ и комбинированная терапия, предлагаемые в настоящем изобретении
Следующим объектом настоящего изобретения является способ лечения индивидуума, предпочтительно млекопитающего и наиболее предпочтительно человека, страдающего заболеванием или нарушением, прежде всего, нарушением, которое можно лечить с помощью иммунотерапии, таким как разные виды рака, инфекционные заболевания, аутоиммунные нарушения и отторжения трансплантатов, который включает введение индивидууму
(I) модулятора иммунных контрольных точек и
(II) комплекса, содержащего:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс, ковалентно связаны.
В частности, в настоящем изобретении предложен способ лечения рака путем инициации, усиления или пролонгирования противоопухолевого ответа у индивидуума, который нуждается в этом, включающий введение индивидууму
I) модулятора иммунных контрольных точек и
(II) комплекса, содержащего:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс, ковалентно связаны.
В более широком смысле изобретение можно применять для любого индивидуума, страдающего от любого заболевания или нарушения, в зависимости от специфичности, в частности, по меньшей мере одного антигена или антигенного эпитопа, содержащегося в комплексе, который входит в комбинацию, предлагаемую для применения согласно настоящему изобретению. В частности, терапевтический эффект указанного комплекса может проявляться в виде генерирования иммунного ответа, направленного против указанных антигенов или антигенных эпитопов, в частности, ответа, зависящего от CD4+-T-клеток-хелперов и/или цитотоксических CD8+-Т-клеток и/или ограниченного по молекулам ГКГС класса I и/или молекулам ГКГС класса II, а терапевтический эффект модулятора контрольных точек может обеспечивать или усиливать указанное действие комплекса.
Предпочтительно согласно изобретению индивидуумы представляют собой индивидуумов, страдающих раком, например, раком головного мозга, ободочной кишки, головы или шеи или раком шейки матки. Более предпочтительно согласно изобретению индивидуумы представляют собой индивидуумов, страдающих раком головного мозга, включая глиому.
Согласно настоящему изобретению индивидуумы предпочтительно подвергались хирургическому удалению опухоли.
Альтернативно этому, согласно настоящему изобретению индивидуумы представляют собой индивидуумов, которые страдают от инфекционного заболевания.
Следующим объектом настоящего изобретения является также комбинированная терапия, предназначенная для предупреждения и/или лечения рака, где комбинированная терапия включает введение
I) модулятора иммунных контрольных точек и
(II) комплекса, содержащего:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс, ковалентно связаны.
Предпочтительные варианты указанной комбинированной терапии включают предпочтительные варианты описанного выше комплекса, варианты описанных выше модуляторов контрольных точек и/или в более общем смысле предпочтительные варианты комбинации, предлагаемой для применения согласно настоящему изобретению. Набор, предлагаемый в настоящем изобретении, и (фармацевтическую) композицию, в частности вакцину, предлагаемую в настоящем изобретении, можно применять в комбинированной терапии, предлагаемой в настоящем изобретении. Индивидуумы, подлежащие лечению с использованием указанной комбинированной терапии, являются такими же, которые описаны в способах, предлагаемых в настоящем изобретении, а заболевания, которые можно предупреждать и/или лечить, являются такими же, которые указаны в настоящем описании в контексте комбинации, предлагаемой для применения согласно настоящему изобретению.
Краткое описание чертежей
Ниже представлено краткое описание прилагаемых чертежей. Чертежи предназначены для более подробной иллюстрации настоящего изобретения. Однако они никоим образом не предназначены для ограничения объема изобретения.
На чертежах показано:
на фиг. 1 - полученные в примере 1 данные о росте опухолей (А) и коэффициенте выживаемости (Б) для 7 мышей на группу (среднее ± (СКО). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область. Мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали дважды (d5 и d13) путем подкожной инъекции в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 5, 9 и 13 мышам из групп "анти-PD1" и "Z13Mad5Anaxa + анти-PD1". В качестве контроля изотипа вводили i.p. 200 мкг 2А3 в каждый из дней 5, 9 и 13 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". Размер опухолей определяли с помощью кронциркуля. *, р<0,05; **, р<0,01; ***, р<0,001, ****, р<0.0001;
на фиг. 2 - полученные в примере 2 данные о росте опухолей для 8 мышей на группу (среднее ± СКО). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область. Мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали дважды (d5 и d13) путем подкожной инъекции в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 5, 9 и 13 мышам из групп "анти-PD1" и "Z13Mad5Anaxa + анти-PD1". В качестве контроля изотипа вводили i.p. 200 мкг 2А3 в каждый из дней 5, 9 и 13 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". Размер опухолей определяли с помощью кронциркуля;
на фиг. 3 - полученные в примере 2 данные о проценте позитивных по мультимеру клеток (в % от CD8-Т-клеток) в области опухоли (инфильтрующие опухоль клетки, TIL) в различных экспериментальных группах (А) и о корреляции позитивных по мультмеру клеток (в % от CD8-Т-клеток) в области опухоли (TIL) с размером опухоли (Б). **, р<0,01; ***, р<0,001;
на фиг. 4 - полученные в примере 2 данные о проценте гранулоцитарных MDSC (супрессорные клетки миелодного происхождения) (в % от CD45+ CD11b+-клеток) в различных экспериментальных группах в селезенке (А) и TIL (Б). *, р<0,05; **, р<0,01; ***, р<0,001;
на фиг. 5 - полученные в примере 2 данные о корреляции гранулоцитарных MDSC (в % от CD45+ CD11b+-клеток) с размером опухоли в различных экспериментальных группах в селезенке (А) и TIL (Б);
на фиг. 6 - полученные в примере 3 данные о росте опухолей у мышей, обработанных антителом к PD1 и Z13Mad5Anaxa с использованием различных протоколов обработки. (А) Мышей обрабатывали антителом к PD1 и Z13Mad5Anaxa согласно протоколу, описанному в примере 1. (Б) Данные о росте опухолей у мышей, обработанных антителом к PD1 только после завершения вакцинации с помощью Z13Mad5Anaxa. ****, р<0,0001:
на фиг. 7 - полученные в примере 4 данные о проценте SIINFEKL-специфических CD8-Т-клеток в крови (А) и проценте SIINFEKL-специфических CD8-Т-клеток в BIL (инфильтрующие головной мозг лейкоциты). (Б). На фиг. 7В - данные о суммарном проценте SIINFEKL-специфических CD8-Т-клеток и BIL. Мышам линии C57BL/6 имплантировали интракраниально 5×105 опухолевых клеток Gl261-Quad в день 0. После имплантации опухолей мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали в дни 7 и 21 путем подкожной инъекция в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 7, 10, 14, 17 и 21 мышам из групп "анти-PD1" и "Z13Mad5Anaxa + анти-PD1". В качестве контроля изотипа 200 мкг МАт 2А3 вводили i.p. в каждый из дней 7, 10, 14, 17 и 21 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". Количество SIINFEKL-специфических CD8-Т-клеток определяли в крови и в инфильтрующих головной мозг лейкоцитах (BIL) в день 28 путем окрашивания мультимером (5-8 мышей на группу). *, р<0,05;
на фиг. 8 - полученные в примере 4 данные о проценте IFN-γ-продуцирующих клеток (% от CD8-Т-клеток) в BIL (А) и общем количестве продуцирующих IFN-γ и/или TNFα клеток (% от CD8-T-клеток) в BIL (Б) после стимуляции пептидом SIINFEKL в течение 6 ч. *, р<0,05; **, р<0,01;
на фиг. 9 - полученные в примере 5 данные о коэффициенте выживаемости мышей. Мышам линии C57BL/6 имплантировали интракраниально 5×105 опухолевых клеток Gl261-Quad в день 0. После имплантации опухолей мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали в дни 7, 21 и 35 путем подкожной инъекции в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 7, 10, 14, 17 и 21 мышам из группы "Z13Mad5Anaxa + анти-PD1". В качестве контроля изотипа 200 мкг МАт 2А3 вводили i.p. в каждый из дней 7, 10, 14, 17 и 21 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". В дни 7 и 21, в которые осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p. сразу после s.с.-введения Z13Mad5Anaxa. Мышей взвешивали ежедневно и умерщвляли, когда потеря веса составляла более 15%. *, р<0,05; **, р<0,01;
на фиг. 10 - полученные в примере 6 данные о количестве метастазов. Мышам линии C57BL/6 имплантировали i.v. 1×105 опухолевых клеток меланомы B16-OVA в день 0. После имплантации опухолей мышей из группы "Z13Mad5Anaxa + анти-PD1" ("вакцина + анти-PD1") вакцинировали в дни 0 и 10 путем подкожной инъекции в дозе 0,5 нмоля Z13Mad5Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 0, 3 и 7 мышам из групп "Z13Mad5Anaxa + анти-PD1" ("вакцина + анти-PD1") и "анти-PD1". В качестве контроля изотипа 200 мкг МАт 2А3 вводили i.p. в каждый из дней 0, 3 и 7 мышам из группы "изотип". Мышей умерщвляли в день 17 и выделяли легкие. В каждом легком подсчитывали количество локусов метастазирования. **, р<0,01 (непарный Т-критерий);
на фиг. 11 - полученные в примере 7 данные о росте опухолей при использовании модели опухоли EG7. Мышам линии C57BL/6 (5-6 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей из группы "Z13Mad5Anaxa + aCTLA4 ip" вакцинировали в дни 5 и 13 путем подкожного введения в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 100 мкг антитела к CTLA4 вводили i.p. в каждый из дней 5 и 13 мышам из групп "aCTLA4 ip" и "Z13Mad5Anaxa + aCTLA4 ip". Группе "Z13Mad5Anaxa + aCTLA4 ip" антитело вводили i.p. непосредственно после s.c.-обработки Z13Mad5Anaxa. В качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 в каждый из дней 5 и 13 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля. (А) Обобщение данных для всех экспериментальных групп. (Б) Размер опухолей у каждой мыши из контрольной группы. (В) Рост опухолей у каждой мыши из группы, обработанной только антителом к CTLA4. (Г) Рост опухолей у каждой мыши из группы Z13Mad5Anaxa + aCTLA4. **, р<0,01; ***, р<0,001;
на фиг. 12 - полученные в примере 8 данные о влиянии пути введения на рост опухолей, полученные с использованием модели опухоли EG7. Мышам линии C57BL/6 (5-6 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad5Anaxa + aCTLA4 ip" и "Z13Mad5Anaxa + aCTLA4 sc" вакцинировали в каждый из дней 5 и 13 путем подкожного введения в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 100 мкг антитела к CTLA4 вводили i.p. в каждый из дней 5 и 13 мышам из группы "Z13Mad5Anaxa + aCTLA4 ip" непосредственно после s.с.-обработки Z13Mad5Anaxa. В группе "Z13Mad5Anaxa + aCTLA4 sc" в каждый из дней 5 и 13 100 мкг антитела к CTLA4 вводили s.c. в ту же область, что и Z13Mad5Anaxa, через 1 ч после инъекции Z13Mad5Anaxa. В качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 в каждый из дней 5 и 13 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля. (А) Обобщение данных для всех экспериментальных групп. (Б) Размер опухолей у каждой мыши из контрольной группы. (В) Рост опухолей у каждой мыши из группы, обработанной только антителом к CTLA4. (Г) Рост опухолей у каждой мыши из группы Z13Mad5Anaxa + aCTLA4 sc. (Г) Рост опухолей у каждой мыши из группы Z13Mad5Anaxa + aCTLA4 ip. **, р<0,01;
на фиг. 13 - полученные в примере 9 данные о воздействии комбинации, содержащей комплекс, который включает проникающий в клетку пептид, различные антигены и пептидный агонист TLR, и ингибитор CTLA4, с использованием модели опухоли СТ26. Мышам линии BALB/c (5-6 мышей на группу) имплантировали s.c. 2×105 опухолевых клеток СТ26 в левую боковую область (день 0). После имплантации опухолей мышей из группы "Z13Mad8Anaxa + aCTLA4" вакцинировали в дни 3 и 9 путем подкожного введения в дозе 2 нмоля Z13Mad8Anaxa в правую боковую область и 100 мкг антитела к CTLA4 вводили i.p. в каждый из дней 3, 6 и 9 (в дни 3 и 9 непосредственно после s.c.-обработки Z13Mad8Anaxa). Контрольной группе мышей из группы, обозначенной "контроль", в качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 в каждый из дней 3, 6 и 9. Размер опухолей определяли с помощью кронциркуля;
на фиг. 14 - полученные в примере 10 данные о воздействии комбинации, содержащей комплекс, который включает проникающий в клетку пептид, различные антигены и пептидный агонист TLR, ингибитор PD1 и ингибитор CTLA4. Мышам линии BALB/c (5-6 мышей на группу) имплантировали s.c. 2×105 опухолевых клеток СТ26 в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad8Anaxa + aCTLA4" и "Z13Mad8Anaxa + aCTLA4/aPD1" вакцинировали в дни 3 и 9 путем подкожной инъекции в дозе 2 нмоля Z13Mad8Anaxa в правую боковую область. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 3, 6 и 9 мышам из групп "aCTLA4/aPD1" и "Z13Mad8Anaxa + aCTLA4/aPD1". 100 мкг антитела к CTLA4 вводили i.p. в каждый из дней 3, 6 и 9 группам "aCTLA4/aPD1", "Z13Mad8Anaxa + aCTLA4" и "Z13Mad8Anaxa + aCTLA4/aPD1". B дни 3 и 9, в которые осуществляли введение и Z13Mad8Anaxa и антител, антитела вводили i.p. непосредственно после s.c.-обработки Z13Mad8Anaxa. Контрольной группе мышей из группы, обозначенной "контроль", в качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 и 200 мкг 2А3 в каждый из дней 3, 6 и 9. Размер опухолей определяли с помощью кронциркуля. (А) Обобщение данных для всех экспериментальных групп. (Б) Размер опухолей у каждой мыши из контрольной группы. (В) Рост опухолей у каждой мыши из группы Z13Mad8Anaxa + aCTLA4. (Г) Рост опухолей у каждой мыши из группы Z13Mad8Anaxa + aCTLA4/aPD1;
на фиг. 15 - полученные в примере 10 данные о воздействии комбинации, содержащей комплекс, который включает проникающий в клетку пептид, различные антигены и пептидный агонист TLR, и агонист CD40. Мышей линии C57BL/6 (4 мыши на группу) вакцинировали в дни 0, 14, 28 и 42 путем подкожной инъекции в дозе 2 нмоля Z13Mad5Anaxa в правую боковую область. 100 мкг антитела к CD40 вводили s.c. в день 0 и дни 0 и 14 мышам из групп "Z13Mad5Anaxa + aCD40 at vac1" и "Z13Mad5Anaxa + aCD40 at vac1 и vac2" соответственно. (А) Процент позитивных по мультимеру клеток (в % от CD8-T-клеток) во всех экспериментальных группах. (Б) Процент позитивных по KLRG1 клеток среди позитивных по мультимеру клеток. Для всех групп обнаружено существенное различие по сравнению с наивной контрольной группой. *, р<0,05;
на фиг. 16 - полученные в примере 11 данные о (А) количестве продуцирующих IFN-γ SIINFEKL-специфических CD8-Т-клеток (Elispot-анализ) и (Б) результаты внутриклеточного окрашивания спленоцитов в отношении IFN-γ, CD107 и TNFα для SIINFEKL-специфических CD8-Т-клеток;
на фиг. 17 - полученные в примере 11 результаты FACS-анализа внутриклеточного окрашивания спленоцитов в отношении IFN-γ, CD107 и TNFα;
на фиг. 18 - полученные в примере 12 данные о росте опухолей для 7 мышей на группу (среднее ± СКО); *, р<0,05 EDAZ13Mad5 относительно контрольной группы (двусторонний дисперсионный анализ). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной (s.c.) инъекции в дозе 10 нмолей EDAZ13Mad5, EDAMad5, Mad5 или Mad5 и MPLA (доза, эквимолярная EDA) в правую боковую область. Размер опухолей определяли с помощью кронциркуля;
на фиг. 19 - полученные в примере 12 кривые роста индивидуальных опухолей (для каждой из 7 мышей на группу). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной (s.c.) инъекции в дозе 10 нмолей EDAZ13Mad5, EDAMad5, Mad5 или Mad5 и MPLA (доза, эквимолярная EDA). Размер опухолей определяли с помощью кронциркуля;
на фиг. 20 - полученная в примере 12 (А) кривая выживаемости для 7 мышей на группу; *, р<0,05 EDAZ13Mad5 относительно контрольной группы (логранговый критерий) и (Б) кривая выживаемости без прогрессирования опухоли для 7 мышей на группу; *, р<0,05 EDAZ13Mad5 относительно контрольной группы (логранговый критерий):
на фиг. 21 - полученные в примере 13 данные о воздействии комплексов, имеющих различные СРР, на иммунный ответ. Мышей линии C57BL/6 вакцинировали пять раз (Wk0, Wk2, Wk4, Wk6 и Wk8) путем s.c.-обработки либо в дозе 2 нмоля (А), либо 0,5 нмоля (Б) Z13Mad5Anaxa, Z14Mad5Anaxa или Z18Mad5Anaxa. У мышей брали кровь через 7 дней после 2-ой, 3-ей, 4-ой и 5-ой вакцинации и осуществляли окрашивание мультимером (один эксперимент с использованием 4 мышей на группу). *, р<0,05 для вакцинированных относительно наивных мышей в каждый момент времени за исключением Vac2 в случае вакцинированных Z18Mad5Anaxa мышей;
на фиг. 22 - полученные в примере 14 данные о воздействии комплексов, имеющих различные СРР, на CD8-Т-клетки в селезенке (А), дренирующих лимфатических узлах (Б) и костном мозге (В). Мышей линии C57BL/6 вакцинировали пять раз (Wk0, Wk2, Wk4, Wk6 и d Wk8) путем s.c.-обработки в дозе 2 нмоля Z13Mad5Anaxa или Z14Mad5Anaxa. Через 9 дней после 5-ой вакцинации мышей умерщвляли, выделяли органы и осуществляли окрашивание мультимером;
на фиг. 23 - полученные в примере 14 данные о воздействии комплексов, имеющих различные СРР, на Т-клетки в селезенке (ответ CD8-Т-клеток (А) и ответ CD4-Т-клеток (Б)). Мышей линии C57BL/6 вакцинировали пять раз (Wk0, Wk2, Wk4, Wk6 и Wk8) путем s.c.-обработки в дозе 2 нмоля Z13Mad5Anaxa или Z14Mad5Anaxa. (А) Через 9 дней после 5-ой вакцинации осуществляли Elispot-анализ клеток селезенки, стимулированных пептидом SIINFEKL OVACD8. (Б) Через 9 дней после 5-ой вакцинации осуществляли Elispot-анализ клеток селезенки, стимулированных пептидом OVACD4;
на фиг. 24 - полученные в примере 14 данные о воздействии комплексов, имеющих различные СРР, на эффекторную функцию CD8-T-клеток. Мышей линии C57BL/6 вакцинировали пять раз (Wk0, Wk2, Wk4, Wk6 и Wk8) путем s.c.-обработки в дозе 2 нмоля Z13Mad5Anaxa или Z14Mad5Anaxa. Через 9 дней после 5-ой вакцинации осуществляли внутриклеточное окрашивание клеток селезенки, стимулированных пептидом SIINFEKL OVACD8;
на фиг. 25 - полученные в примере 15 данные о воздействии комплексов, имеющих различные СРР, на рост опухолей (А) и коэффициенты выживаемости (Б). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем s.c-инъекции в дозе 0,5 нмоля Z13Mad5Anaxa или Z14Mad5Anaxa в правую боковую область. (А) Рост опухолей для 7 мышей на группу (среднее ± СКО); *, р<0,05; ****, р<0,0001 (двусторонний дисперсионный анализ в день 28). (Б) Кривая выживаемости для 7 мышей на группу. На графике представлена медиана выживаемости (m.s.). *, р<0,05; **, р<0,01; ***, р<0,001 (логранговый критерий);
на фиг. 26 - полученные в примере 16 данные о воздействии комплексов, имеющих различные СРР, на иммунный ответ. Мышей линии C57BL/6 вакцинировали три раза (Wk0, Wk2 и Wk4) путем s.c.-обработки либо в дозе 2 нмоля (А), либо 0,5 нмоля (Б) EDAZ13Mad5, EDAZ14Mad5 или EDAZ18Mad5. У мышей брали кровь через 7 дней после 3-ей вакцинации и осуществляли окрашивание мультимером (один эксперимент с 4 мышами на группу). *, р<0,05;
на фиг. 27 - полученные в примере 17 данные о воздействии EDAZ14Mad5 на рост опухолей (А) и коэффициенты выживаемости (Б). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем s.c.-инъекции в дозе 2 нмоля EDAZ14Mad5 в правую боковую область. Левая панель: рост опухолей для 7 мышей на группу (среднее ± СКО); **, р<0,01 (двусторонний дисперсионный анализ в день 27). Правая панель: кривая выживаемости для 7 мышей на группу. На графике представлена медиана выживаемости (m.s.);
на фиг. 28 - полученные в примере 18 данные о росте опухолей для 7 мышей на группу (среднее ± СКО). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной инъекции в дозе 10 нмолей AnaxZ13Mad5, Z13Mad5Anaxa, либо осуществляли совместную инъекцию Z13Mad5 + Pam3CSK4 (доза, эквимолярная Anaxa) в правую боковую область. Размер опухолей определяли с помощью кронциркуля. *, р<0,05; ***, р<0,001, ****, р<0,0001;
на фиг. 29 - полученные в примере 18 кривые роста индивидуальных опухолей (для каждой из 7 мышей в группе). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной инъекции (s.c.) в дозе 10 нмолей AnaxZ13Mad5, Z13Mad5Anaxa, либо осуществляли совместную инъекцию Z13Mad5 + Pam3CSK4 (доза, эквимолярная Anaxa) в правую боковую область. Размер опухолей определяли с помощью кронциркуля;
на фиг. 30 - полученная в примере 18 кривая выживаемости для 7 мышей на группу. Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной инъекции (s.c.) в дозе 10 нмолей AnaxZ13Mad5, Z13Mad5Anaxa, либо осуществляли совместную инъекцию Z13Mad5 + Pam3CSK4 (доза, эквимолярная Anaxa) в правую боковую область. Размер опухолей определяли с помощью кронциркуля. *, р<0,05, **, р<0,01, ****, р<0,0001 (логранговый критерий);
на фиг. 31 - полученные в примере 19 данные о росте опухолей для 7 мышей на группу (среднее ± СКО). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной инъекции в дозе 2 нмоля Hp91Z13Mad5, EDAZ13Mad5, Z13Mad5Anaxa, Z13Mad5EDA или Z13Mad5 и MPLA (доза, эквимолярная EDA) в правую боковую область. *, р<0,05; **, р<0,01; ***, р<0,001; ****, р<0,0001 (двусторонний дисперсионный анализ в день 23);
на фиг. 32 - полученные в примере 19 кривые роста индивидуальных опухолей (для каждой из 7 мышей в группе). Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и вакцинировали дважды (d5 и d13) путем подкожной инъекции (s.c.) в дозе 2 нмоля Hp91Z13Mad5, EDAZ13Mad5, Z13Mad5Anaxa, Z13Mad5EDA или Z13Mad5 и MPLA (доза, эквимолярная EDA) в правую боковую область;
на фиг. 33 - полученные в примере 19 кривые выживаемости для всех 7 мышей в группе. На графике представлена медиана выживаемости (m.s.). *, р<0,05; **, р<0,01 (логранговый критерий);
на фиг. 34 - полученные в примере 20 результаты количественной оценки SIINFEKL-специфических CD8-Т-клеток на модели глиобластомы Quad-Gl261. В целом, метод состоял в следующем: мышам линии C57BL/6 имплантировали i.e. 5×105 опухолевых клеток Gl261-Quad и вакцинировали дважды (d7 и d21) путем s.с.-инъекции в дозе 2 нмоля Z13Mad5Anaxa или 2 нмоля Z13Mad5 и 2 нмоля Anaxa. SIINFEKL-специфические CD8-Т-клетки количественно определяли в крови и в BIL в d28 путем окрашивания мультимером (7-16 мышей на группу);
на фиг. 35 - полученные в примере 20 данные о секреции цитокинов. В целом, метод состоял в следующем: мышам линии C57BL/6 имплантировали i.e. 5×105 опухолевых клеток Gl261-Quad и вакцинировали дважды (d7 и d21) путем s.c.-инъекции в дозе 2 нмоля Z13Mad5Anaxa или 2 нмоля Z13Mad5 и 2 нмоля Anaxa. Выделяли BIL и культивировали в течение 6 ч со зрелыми BMDC, загруженными или не загруженными пептидом SllNFEKL, в присутствии брефелдина А перед внутриклеточным окрашиванием цитокинов. Данные представлены в виде % от CD8-Т-клеток, секретирующих цитокин (7-16 мышей на группу);
на фиг. 36 - полученные в примере 21 результаты количественной оценки SIINFEKL-специфических CD8-Т-клеток у наивных мышей. В целом, метод состоял в следующем: мышей линии C57BL/6 вакцинировали один раз (день 0) путем s.с.-инъекции в дозе 2 нмоля Z13Mad5Anaxa (группа "Z13Mad5Anaxa") или 2 нмоля Z13Mad5 и 2 нмоля Anaxa (группа "Z13Mad5 + Anaxa"). SIINFEKL-специфические CD8-Т-клетки количественно оценивали в крови в d7 путем окрашивания мультимером (4-8 мышей на группу);
на фиг. 37 - полученные в примере 22 данные о росте опухолей (А) и коэффициенте выживаемости (Б) для 7 мышей на группу (среднее ± СКО). Мышам линии C57BL/6 имплантировали s.c. 2×105 опухолевых клеток МС-38 в левую боковую область. Мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали 3 раза (d3, d10 и d17) путем подкожной инъекции в дозе 2 нмоля Z13Mad12Anaxa в основание хвоста. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24, 27 и 31 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". Размер опухолей определяли с помощью кронциркуля. На каждой кривой роста опухолей представлено количество не имеющих опухолей мышей в каждой группе. *, р<0,05; **, р<0,01; ***, р<0,001;
на фиг. 38 - полученные в примере 22 кривые роста индивидуальных опухолей для 7 мышей в группе. Мышам линии C57BL/6 имплантировали s.c. 2×105 опухолевых клеток МС-38 в левую боковую область. Мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали 3 раза (d3, d10 и d17) путем подкожной инъекции в дозе 2 нмоля Z13Mad12Anaxa в основание хвоста. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24, 27 и 31 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". Размер опухолей определяли с помощью кронциркуля;
на фиг. 39 - полученные в примере 23 данные о росте опухолей (А) и коэффициенте выживаемости (Б) для 13-14 мышей на группу (среднее ± СКО). Мышам линии C57BL/6 имплантировали s.c. 2×105 опухолевых клеток МС-38 в область спины. Мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали 3 раза (d3, d10 и d17) путем подкожной инъекции в дозе 2 нмоля Z13Mad12Anaxa в основание хвоста. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24 и 27 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". Размер опухолей определяли с помощью кронциркуля. На каждой кривой роста опухолей представлено количество свободных от опухолей мышей в каждой группе. *, р<0,05; **, р<0,01; ***, р<0,001; ****, р<0,0001;
на фиг. 40 - полученные в примере 23 кривые роста индивидуальных опухолей для 13-14 мышей в группе. Мышам линии C57BL/6 имплантировали s.c. 2×105 опухолевых клеток МС-38 в область спины. Мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали 3 раза (d3, d10 и d17) путем подкожной инъекции в дозе 2 нмоля Z13Mad12Anaxa в основание хвоста. 200 мкг антитела к PD1 вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24 и 27 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". Размер опухолей определяли с помощью кронциркуля.
Примеры
Ниже представлены конкретные примеры, иллюстрирующие различные варианты осуществления и объекты изобретения. Однако объем настоящего изобретения не ограничен указанными в настоящем описании конкретными вариантами осуществления изобретения. Представленные ниже препараты и примеры даны с целью лучшего понимания изобретения специалистами в данной области и воплощения на практике настоящего изобретения. Однако объем настоящего изобретения не ограничен приведенными в качестве примера вариантами осуществления изобретения, которые представлены только с целью иллюстрации отдельных объектов изобретения, и под объем изобретения подпадают функционально эквивалентные методы. Так, специалистам в данной области из представленного выше описания, прилагаемых чертежей и описанных ниже примеров должны быть очевидны различные модификации изобретения в дополнение к указанным в настоящем описании. Все указанные модификации подпадают под объем прилагаемой формулы изобретения.
Пример 1: Воздействие комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей и коэффициент выживаемости
Для оценки эффективности комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, в отношении лечения рака использовали модель опухоли E.G7. E.G7 представляет собой OVA-трансфектант, полученный из клеточной линии тимомы EL4.
Для этой цели применяли "Z13Mad5Anaxa", представляющий собой указанный в настоящем описании комплекс, который содержит проникающий в клетку пептид, различные антигены и пептидный агонист TLR. В частности, "Z13Mad5Anaxa" представляет собой слитый белок, который содержит проникающий в клетку пептид "Z13", антигенную карго-молекулу "MAD5", содержащую эпитопы OVA-CD4+, gp100-CD8+, Ealpha-CD4+ и OVA-CD8+, и пептидный агонист TLR "Anaxa". Ниже представлена аминокислотная последовательность Z13Mad5Anaxa, в которой проникающий в клетку пептид "Z13" подчеркнут, а пептидный агонист TLR "Anaxa" выделен курсивом:

Мышам линии C57BL/6 (7 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали в дни 5 и 13, вводя подкожно в правую боковую область Z13Mad5Anaxa в дозе 2 нмоля,. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 5, 9 и 13 мышам из групп "анти-PD1" и "Z13Mad5Anaxa + анти-PD1". В качестве контроля изотипа вводили 200 мкг МАт 2А3 i.p. в каждый из дней 5, 9 и 13 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". В дни 5 и 13, когда осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p. непосредственно после s.c.-введения Z13Mad5Anaxa. Размер опухолей определяли с помощью кронциркуля.
Как продемонстрировано на фиг. 1, обработка только ингибитором PD1 или только Z13Mad5Anaxa приводила к существенному снижению объема опухолей (фиг. 1А) и повышала выживаемость (фиг. 1Б) по сравнению с контрольной группой ("изотип"). Однако комбинация их обоих, т.е. ингибитора PD1 и Z13Mad5Anaxa, приводила к наиболее выраженному положительному действию, а именно сильно снижала объем опухолей и сильно повышала коэффициенты выживаемости. Эти данные свидетельствуют о том, что комбинация терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa является более эффективной, чем терапия с использованием только антитела к PD1 или вакцинация с использованием только Z13Mad5Anaxa. Таким образом, эти результаты свидетельствуют о синергетическом действии терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa.
Пример 2: Воздействие комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на хоминг Т-клеток в область опухоли E.G7 и на MDSC
Для оценки воздействий комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на хоминг Т-клеток в области опухоли и на MDSC (супрессорные клетки миелодного происхождения), повторяли описанный выше эксперимент (пример 1) с использованием 8 мышей на группу, в день 22 мышей умерщвляли и осуществляли FACS-окрашивание для мониторинга OVA-специфического иммунного ответа и микроокружения опухоли в селезенке и TIL (инфильтрующие опухоль лимфоциты).
На фиг. 2 представлены данные о росте опухолей в экспериментальных группах (процедура эксперимента соответствовала методу, описанному в примере 1). И в этом случае обработка только ингибитором PD1 или только Z13Mad5Anaxa приводила к существенному снижению объема опухолей (фиг. 2) по сравнению с контрольной группой ("изотип"). Однако комбинация их обоих, т.е. ингибитора PD1 и Z13Mad5Anaxa, приводила к наиболее выраженному положительному действию, а именно сильно снижала объем опухолей и сильно повышала коэффициенты выживаемости. Таким образом, указанные данные согласуются с результатами, описанными в примере 1 (ср. фиг. 1А). Таким образом, эти данные подтвердили, что комбинация терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa является более эффективной, чем терапия с использованием только антитела к PD1 или вакцинация с использованием только Z13Mad5Anaxa, и они свидетельствуют о синергетическом действии терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa.
На фиг. 3 представлен процент позитивных по мультимеру клеток (в % от CD8-Т-клеток) в области опухоли (TIL) для различных экспериментальных групп (фиг. 3А) и данные о корреляции количества позитивных по мультимеру клеток (в % от CD8-Т-клеток) среди TIL с размером опухоли (фиг. 3Б). Эти данные демонстрируют, что антигенспецифические Т-клетки накапливаются в области опухолей у вакцинированных мышей. Наиболее низкий процент позитивных по мультимеру клеток обнаружен у контрольных мышей и мышей, обработанных только антителом к PD1 (группа "анти-PD1"). У мышей, вакцинированных Z13Mad5Anaxa, процент позитивных по мультимеру клеток существенно возрастал, при этом наиболее сильное и наиболее значительное повышение обнаружено у мышей, обработанных и Z13Mad5Anaxa, и антителом к PD1. Кроме того, обнаружена выраженная обратная корреляция между процентом позитивных по мультимеру клеток (в % от CD8-Т-клеток) и размером опухолей, т.е. чем больше процент позитивных по мультимеру клеток (в % от CD8-Т-клеток), тем меньше опухоли.
На фиг. 4 представлен процент гранулоцитарных MDSC (в % от CD45+CD11b+-клеток) в различных экспериментальных группах в селезенке (фиг. 4А) и TIL (фиг. 4Б). Наиболее высокий процент гранулоцитарных MDSC (в % от CD45+CD11b+-клеток) обнаружен в контрольной группе ("изотип") в периферии (селезенка) и в области опухолей (TIL). Существенно более низкие проценты гранулоцитарных MDSC (в % от CD45+CD11b+-клеток) обнаружены во всех других экспериментальных группах, при этом наиболее сильное и наиболее значительное снижение гранулоцитарных MDSC обнаружено у мышей, обработанных и Z13Mad5Anaxa, и антителом к PD1. На фиг. 5 продемонстрирована выраженная корреляция между процентом гранулоцитарных MDSC (в % от CD45+CD11b+-клеток) и размером опухолей для различных экспериментальных групп в селезенке (фиг. 5А) и TIL (фиг. 5Б).
В целом, полученные данные о Т-клетках и MDSC убедительно подтверждают наличие синергетического действия комбинации терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa, установленного в отношении роста опухолей и коэффициента выживаемости.
Пример 3: Влияние схемы обработки комбинацией ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей
Для оценки влияния схемы обработки комбинацией ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, в отношении лечения рака использовали модель опухоли E.G7.
Животным в первой экспериментальной группе "Z13Mad5Anaxa + анти-PD1" вводили ингибитор PD1 и Z13Mad5Anaxa, как описано в примере 1. В целом, метод состоял в следующем: мышам линии C57BL/6 (6-7 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей вакцинировали в дни 5 и 13 подкожно в правую боковую область, используя Z13Mad5Anaxa в дозе 2 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 5, 9 и 13. Соответствующей контрольной группе вводили i.p. 200 мкг МАт 2А3 в качестве контроля изотипа в каждый из дней 5, 9 и 13. В дни 5 и 13, когда осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p. сразу после s.c.-обработки Z13Mad5Anaxa.
Животным во второй экспериментальной группе "Z13Mad5Anaxa + анти-PD1" вводили ингибитор PD1 и Z13Mad5Anaxa согласно следующему методу: мышам линии C57BL/6 (6-7 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей вакцинировали в дни 5 и 13 подкожно в правую боковую область, используя Z13Mad5Anaxa в дозе 2 нмоля, также как в первой экспериментальной группе. Однако, в отличие от первой экспериментальной группы, второй экспериментальной группе 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 17 и 20. Другими словами, обработку антителом к PD1 начинали только после окончания обработки Z13Mad5Anaxa. Животным в соответствующей контрольной группе вводили i.p. 200 мкг МАт 2А3 в качестве контроля изотипа в каждый из дней 17 и 20.
Результаты представлены на фиг. 6, где на фиг. 6А представлены данные о росте опухолей в первой экспериментальной группе (протокол соответствует описанному в примере 1) и соответствующей контрольной группе, а на фиг. 6Б представлены данные о росте опухолей во второй экспериментальной группе (обработку антителом к PD1 начинали только после окончания обработки Z13Mad5Anaxa) и соответствующей контрольной группе. Как видно из фиг. 6, обработка согласно последнему протоколу, в котором обработку антителом к PD1 начинали только после окончания обработки Z13Mad5Anaxa, приводила к небольшому улучшению (небольшое снижение роста опухолей, ср. фиг. 6Б), в то время как «истинная комбинация» антитела к PD1 и Z13Mad5Anaxa (протокол соответствует описанному в примере 1, ср. фиг. 6А) приводила к значительно более сильному улучшению, т.е. выраженно снижала рост опухолей.
Указанные данные дополнительно подтвердили синергетическое действие терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad5Anaxa, установленное в описанных выше примерах, поскольку действие оказалось существенно более низким, когда терапию антителом к PD1 начинали только после завершения вакцинации с помощью Z13Mad5Anaxa.
Пример 4: Воздействия комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на хоминг Т-клеток в области опухоли на модели глиобластомы
Для изучения воздействий комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, использовали другую модель опухоли (отличную от модели E.G7, которую применяли в примерах 1-3), а именно, модель мышиной глиобластомы. Таким образом, Т-клеточный хоминг в области опухолей анализировали на мышах, несущих опухоли Gl261-Quad, которых вакцинировали дважды (неделя 1 и неделя 3 после имплантации опухолей) с использованием вакцины Z13Mad5Anaxa и обрабатывали или не обрабатывали антителом к PD1. На неделе 4 анализировали кровь и инфильтрующие головной мозг лейкоциты (BIL).
В частности, мышам линии C57BL/6 имплантировали интракраниально 5×105 опухолевых клеток Gl261-Quad в день 0. После имплантации опухолей мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали в дни 7 и 21 путем подкожной инъекции в правую боковую область, используя Z13Mad5Anaxa в дозе 2 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 7, 10, 14, 17 и 21 мышам из групп "анти-PD1" и "Z13Mad5Anaxa + анти-PD1". Для контроля вводили i.p. 200 мкг МАт 2А3 в качестве контроля изотипа в каждый из дней 7, 10, 14, 17 и 21 мышам из групп "изотип" и "Z13Mad5Anaxa + изотип". В дни 7 и 21, когда осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p. сразу после s.c.-обработки Z13Mad5Anaxa. Определяли количество SIINFEKL-специфических CD8-Т-клеток в крови и в инфильтрующих головной мозг лейкоцитах (BIL) в день 28 путем окрашивания мультимером (5-8 мышей на группу).
Результаты представлены на фиг. 7, где процент SIINFEKL-специфических CD8-T-клеток в крови представлен на фиг. 7А, а процент SIINFEKL-специфических CD8-Т-клеток в BIL представлен на фиг. 7Б. На фиг. 7В представлен суммарный процент SIINFEKL-специфических CD8-Т-клеток в крови и BIL. Как уже описано ранее, в крови обнаружена низкая частота встречаемости SIINFEKL-специфических CD8-Т-клеток. Однако в крови вакцинированных Z13Mad5Anaxa мышей, которых обрабатывали или не обрабатывали антителом к PD1, обнаружен более высокий процент SIINFEKL-специфических CD8-T-клеток. Во всех группах выявлено заметно более сильное накопление SIINFEKL-специфических CD8-T-клеток в BIL по сравнению с кровью. Важно отметить, что терапия с использованием антитела к PD1 могла повышать частоту специфических CD8-Т-клеток до 42% без вакцинации и даже до 61% при объединении с вакцинацией Z13Mad5Anaxa, что и в этом случае также позволяет предположить наличие синергетического действия вакцинации и терапии на основе антитела к PD1.
Кроме того, оценивали также процент продуцирующих цитокины клеток. Для этой цели внутриклеточные цитокины окрашивали после рестимуляции с помощью пептида SIINFEKL в течение 6 ч в присутствии брефелдина А (ингибитор транспорта белков (GolgiPlug), фирма BD Bioscences) в сочетании с МАт к IFN-γ (XMG1.2), фактором некроза опухолей (МР6-ХТ22) и соответствующих контролей изотипов (фирма BD Biosciences).
Результаты представлены на фиг. 8, где процент продуцирующих IFN-γ клеток (% от CD8-Т-клеток) представлен на фиг. 8А, а суммарный процент продуцирующих IFN-γ и/или TNFα клеток (% от CD8-Т-клеток) представлен на фиг. 8Б. Указанные данные продемонстрировали, что вакцинация с использованием только Z13Mad5Anaxa и обработка только антителом к PD1 приводили к повышенному проценту продуцирующих цитокины, в частности IFN-γ, клеток. Однако наиболее высокий процент продуцирующих цитокины, в частности IFN-γ, клеток четко выявлен у животных, которых обрабатывали комбинацией Z13Mad5Anaxa и антитела к PD1.
В целом, четко продемонстрированы наиболее сильные иммунные ответы SIINFEKL-специфических CD8-T-клеток в головном мозге несущих опухоли мышей с выраженной эффекторной функцией для животных, которых обрабатывали комбинацией Z13Mad5Anaxa и антитела к PD1. Указанные полученные на модели глиобластомы данные также свидетельствуют о наличии синергетического действия Z13Mad5Anaxa и антитела к PD1.
Пример 5: Воздействия комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на выживаемость на модели глиобластомы
Далее с помощью независимого эксперимента оценивали коэффициенты выживаемости мышей, обработанных комбинацией антитела к PD1 и Z13Mad5Anaxa на модели глиобластомы.
Для этой цели мышам линии C57BL/6 е имплантировали интракраниально 5×105 опухолевых клеток Gl261-Quad в день 0. После имплантации опухолей мышей из групп "Z13Mad5Anaxa + изотип" и "Z13Mad5Anaxa + анти-PD1" вакцинировали в дни 7, 21 и 35 путем подкожной инъекции в правую боковую область Z13Mad5Anaxa в дозе 2 нмоля. Мышам из группы "Z13Mad5Anaxa + анти-PD1" вводили i.p. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) в каждый из дней 7, 10, 14, 17 и 21. В качестве контроля изотипа мышам из групп "изотип" и "Z13Mad5Anaxa + изотип" вводили i.p. 200 мкг МАт 2А3 в каждый из дней 7, 10, 14, 17 и 21. В дни 7 и 21, когда осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p. сразу после s.c.-обработки Z13Mad5Anaxa. Мышей взвешивали ежедневно и умерщвляли, когда потеря веса составляла более 15%.
Результаты представлены на фиг. 9. Указанные результаты свидетельствуют о том, что терапевтическая вакцинация с использованием только Z13Mad5Anaxa является более эффективной по сравнению с контрольной группой, что характеризуется 10-дневным различием медианы выживаемости. И в этом случае также воздействия, т.е. увеличение коэффициента выживаемости, оказались наиболее сильными для комбинации антитела к PD1 и Z13Mad5Anaxa. В частности комбинированная терапия на основе антитела к PD1/Z13Mad5Anaxa позволяла контролировать рост глиобластомы.
В целом, комбинированная терапия на основе антитела к PD1 повышала эффект вакцинации с помощью Z13Mad5Anaxa. Как продемонстрировано в примере 4, комбинация Z13Mad5Anaxa и антитела к PD1 обладала способностью обеспечивать наиболее сильную секрецию цитокинов антигенспецифическими CD8-Т-клетками в головном мозге.
Пример 6: Воздействия комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на количество метастазов на модели легочных метастазов
В этом эксперименте для изучения воздействий комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, вновь использовали другую модель опухоли (отличную от модели E.G7, которую применяли в примерах 1-3, и модели глиобластомы, которую применяли в примерах 4 и 5).
Для этой цели мышам линии C57BL/6 имплантировали i.v. 1×105 опухолевых клеток меланомы B16-OVA в день 0. После имплантации опухолей мышей из групп "Z13Mad5Anaxa + анти-PD1" ("вакцина + анти-PD1") вакцинировали в дни 0 и 10 путем подкожной инъекции в правую боковую область Z13Mad5Anaxa в дозе 0,5 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 0, 3 и 7 мышам из групп "Z13Mad5Anaxa + анти-PD1" ("вакцина + анти-PD1") и "анти-PD1". В качестве контроля изотипа мышам из группы "изотип" вводили i.p. 200 мкг МАт 2А3 в каждый из дней 0, 3 и 7. В день 0, когда осуществляли введение и Z13Mad5Anaxa, и антитела, антитело вводили i.p.сразу после s.c.-обработки Z13Mad5Anaxa. Мышей умерщвляли в день 17 и выделяли легкие. В каждом легком подсчитывали количество локусов метастазирования. **, р<0,01 (непарный Т-критерий).
Результаты представлены на фиг. 10. Только комбинированная обработка с использованием антитела к PD1 и Z13Mad5Anaxa, но не обработка только антителом к PD1, приводила к существенному снижению количества метастазов. Таким образом, комбинированная обработка антителом к PD1 и Z13Mad5Anaxa обладала высокой эффективностью в отношении ингибирования развития метастазов меланомы в легком.
Пример 7: Воздействия комбинации ингибитора CTLA4 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей на модели EG7
Для изучения воздействий комбинации комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, с различными ингибиторами контрольных точек в настоящем эксперименте применяли ингибитор CTLA4.
Мышам линии C57BL/6 (5-6 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей из группы "Z13Mad5Anaxa + aCTLA4 ip" вакцинировали в дни 5 и 13 путем подкожного введения в правую боковую область Z13Mad5Anaxa в дозе 2 нмоля. Мышам из групп "aCTLA4 ip" и "Z13Mad5Anaxa + aCTLA4 ip" вводили i.p. 100 мкг антитела к CTLA4 9D9 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) в каждый из дней 5 и 13. В группе "Z13Mad5Anaxa + aCTLA4 ip" антитело вводили i.p. сразу после s.с.-обработки Z13Mad5Anaxa. В качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) в каждый из дней 5 и 13 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля.
Как продемонстрировано на фиг. 11, обработка только ингибитором CTLA4 не приводила к какому-либо воздействию на рост опухолей по сравнению с контрольной группой. Однако комбинация ингибитора CTLA4 и Z13Mad5Anaxa приводила к существенному уменьшению объема опухолей. Эти данные свидетельствуют о том, что комбинация терапии с использованием антитела к CTLA4 и вакцинации с использованием Z13Mad5Anaxa обладает эффективностью в отношении снижения роста опухолей, в то время как терапии на основе только антитела к CTLA4 не приводит к какому-либо действию.
Пример 8: Влияние пути введения модулятора иммунных контрольных точек на рост опухолей
Для изучения влияния пути введения модулятора иммунных контрольных точек в комбинированной терапии на основе комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, с модулятором контрольных точек применяли модель опухоли EG7.
Мышам линии C57BL/6 (5-6 мышей на группу) имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad5Anaxa + aCTLA4 ip" и "Z13Mad5Anaxa + aCTLA4 sc" вакцинировали в дни 5 и 13 путем подкожного введения в правую боковую область Z13Mad5Anaxa в дозе 2 нмоля. Мышам из группы "Z13Mad5Anaxa + aCTLA4 ip" вводили i.p. 100 мкг антитела к CTLA4 в каждый из дней 5 и 13 сразу после s.c.-обработки Z13Mad5Anaxa. В группе "Z13Mad5Anaxa + aCTLA4 sc" в каждый из дней 5 и 13 100 мкг антитела к CTLA4 вводили s.c. в ту же область, что и Z13Mad5Anaxa, через 1 ч после инъекции Z13Mad5Anaxa. В качестве контроля изотипа 100 мкг МАт МРС-11 вводили i.p. в каждый из дней 5 и 13 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля.
Как продемонстрировано на фиг. 12, наиболее выраженное действие комбинированной терапии на основе комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, с модулятором контрольных точек в отношении снижения роста опухолей достигалось в том случае, когда модулятор контрольных точек вводили внутрибрюшинно. Подкожное введение модулятора контрольных точек также приводило к снижению роста опухолей, однако действие было менее выраженным по сравнению с i.p.-введением.
Пример 9: Воздействия комбинации ингибитора CTLA4 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей на модели карциномы ободочной кишки СТ26
В этом эксперименте комбинацию ингибитора CTLA4 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, изучали на другой модели опухоли (отличной от модели E.G7, которую использовали в примерах 7 и 8).
Для этой цели применяли модель мышиной карциномы ободочной кишки СТ26 и создавали другой комплекс, содержащий проникающий в клетку пептид, различные антигены и пептидный агонист TLR ("Z13Mad8Anaxa"). Z13Mad8Anaxa отличается от Z13Mad5Anaxa (описанного в пример 1) антигенными карго-молекулами. В частности, "Z13Mad8Anaxa" представляет собой слитый белок, содержащий проникающий в клетку пептид "Z13", антигенную карго-молекулу "MAD8", которая содержит эпитопы CD8 и CD4 гликопротеина70, и пептидный агонист TLR "Anaxa". Ниже представлена аминокислотная последовательность Z13Mad8Anaxa, в которой проникающий в клетку пептид "Z13" подчеркнут, а пептидный агонист TLR обозначен курсивом:

Мышам линии BALB/c (7 мышей на группу) имплантировали s.c. 2×105 опухолевых клеток СТ26 в левую боковую область (день 0). После имплантации опухолей мышей из группы "Z13Mad8Anaxa + aCTLA4" вакцинировали в дни 3 и 9 путем подкожного введения в правую боковую область Z13Mad8Anaxa в дозе 2 нмоля и вводили i.p. 100 мкг антитела к CTLA4 9D9 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) в каждый из дней 3, 6 и 9 (в дни 3 и 9 сразу после s.с.-обработки Z13Mad8Anaxa). В контрольной группе в качестве контроля изотипа вводили i.p. 100 мкг МАт МРС-11 в каждый из дней 3, 6 и 9 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля.
Результаты представлены на фиг. 13. Указанные данные свидетельствуют о том, что комбинация ингибитора CTLA4 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, обладала способностью контролировать рост опухолей также и на модели раковой опухоли ободочной кишки СТ26.
Пример 10: Воздействия комбинации комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, с двумя различными модуляторами иммунных контрольных точек на рост опухолей
В этом эксперименте изучали воздействия комбинации комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, с двумя различными модуляторами иммунных контрольных точек, а именно ингибитором PD1 и ингибитором CTLA4. Целью настоящего эксперимента было решение вопроса о том, является ли комбинация, включающая (в дополнение к комплексу, содержащему проникающий в клетку пептид, различные антигены и пептидный агонист TLR) два различных модулятора контрольных точек, еще более эффективной, чем комбинация, включающая один модулятор контрольных точек.
Следует уделять внимание выбору соответствующей модели опухоли для того, чтобы избегать «проблемы нижней границы» («эффекта дна») и «проблемы верхней границы» («эффекта потолка»), поскольку требуется иметь возможность оценивать улучшения воздействия, такого, например, как уменьшение размера опухолей, при использовании комбинации с двумя модуляторами комбинации по сравнению с комбинацией, содержащей один модулятор контрольных точек, например, оценивать еще большее уменьшение объема опухолей. Для этой цели выбрана модель карциномы ободочной кишки СТ26.
Мышам линии BALB/c (5-6 мышей на группу) имплантировали s.c. 2×105 опухолевых клеток СТ26 в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad8Anaxa + aCTLA4" и "Z13Mad8Anaxa + aCTLA4/aPD1" вакцинировали в дни 3 и 9 путем подкожной инъекции в правую боковую область Z13Mad8Anaxa в дозе 2 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 3, 6 и 9 мышам из групп "aCTLA4/aPD1" и "Z13Mad8Anaxa + aCTLA4/aPD1". 100 мкг антитела к CTLA4 [обозначение Ат, поставщик] вводили i.p. в каждый из дней 3, 6 и 9 группам "aCTLA4/aPD1", "Z13Mad8Anaxa + aCTLA4" и "Z13Mad8Anaxa + aCTLA4/aPD1". В дни 3 и 9, когда осуществляли совместное введение Z13Mad8Anaxa и антител, антитела вводили i.p. сразу после s.с.-обработки Z13Mad8Anaxa. Контрольной группе вводили i.p. 100 мкг МАт МРС-11 в качестве контроля изотипа в каждый из дней 3, 6 и 9 мышам из группы "контроль". Размер опухолей определяли с помощью кронциркуля.
Результаты представлены на фиг. 14. Как продемонстрировано в примере 9, обработка комбинацией Z13Mad8Anaxa с ингибитором CTLA4 (но без дополнительного модулятора контрольных точек) приводила к снижению роста опухолей. Аналогично этому, обработка комбинацией модуляторов контрольных точек (антитело к CTLA4 и антитело к PD1), но без Z13Mad8Anaxa, также приводила к снижению роста опухолей. Однако комбинация всех трех составляющих, т.е. двух различных модуляторов контрольных точек и Z13Mad8Anaxa, приводила к наиболее выраженному улучшению, а именно, к сильному уменьшению объема опухолей. Таким образом, эти данные свидетельствуют о том, что комбинация всех трех компонентов, т.е. терапии с использованием антитела к PD1, терапии с использованием антитела к CTLA4 и вакцинации с использованием Z13Mad5Anaxa, является более эффективной, чем комбинация только двух компонентов. Эти результаты свидетельствуют о синергетическом действии терапии на основе антитела к PD1, терапии на основе антитела к CTLA4 и вакцинации Z13Mad5Anaxa.
Пример 11: Иммуногенность комбинации агониста CD40 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR
Для изучения потенциала комбинации комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, и в этом случае также с другим модулятором контрольных точек, в настоящем эксперименте применяли агонистическое антитело, мишенью которого является CD40.
Для этой цели наивных мышей линии C57BL/6 (4 мыши на группу) вакцинировали в дни 0, 14, 28 и 42 (недели 0, 2, 4 и 6) с помощью подкожного введения в правую боковую область Z13Mad5Anaxa в дозе 2 нмоля. 100 мкг антитела к CD40 FGK45 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили s.c. в день 0 мышам из группы "Z13Mad5Anaxa + aCD40 at vac1" и в дни 0 и 14 мышам из групп "Z13Mad5Anaxa + aCD40 at vac1 и vac2" (в те же дни, в которые осуществляли первую и вторую вакцинации). Антитело к CD40 вводили s.c. в ту же область, что и Z13Mad5Anaxa, через 1 ч после инъекции Z13Mad5Anaxa. У мышей брали кровь в дни 21, 35 и 49 (недели 3, 5 и 7) и осуществляли анализ селезенки на неделе 7. Осуществляли окрашивание мультимером клеток крови. Кроме того, оценивали также процент продуцирующих цитокины клеток в селезенке. Для этой цели внутриклеточные цитокины окрашивали после рестимуляции пептидом SIINFEKL в течение 6 ч в присутствии брефелдина A (GolgiPlug, фирма BD Bioscences) с помощью МАт к IFN-γ (XMG1.2), фактора некроза опухолей (МР6-ХТ22), CD107a (1D4B) и соответствующих контролей изотипов (фирма BD Biosciences).
На фиг. 15 представлены данные о проценте позитивных по мультимеру клеток (в % от CD8-Т-клеток) для различных экспериментальных групп (фиг. 15А) и проценте позитивных по KLRG1 клеток среди позитивных по мультимеру клеток (фиг. 15Б). Все группы существенно отличалась от наивной контрольной группы, что подтверждает иммуногенность Z13Mad5Anaxa. Однако в группах, которые дополнительно обрабатывали антителом к CD40, обнаружено еще больше позитивных по мультимеру клеток и позитивных по KLRG1 клеток, это явление было наиболее выраженным в группе, которую подвергали двум обработкам антителом к CD40. Эти результаты свидетельствуют о синергетическом действии комбинации агониста CD40 и Z13Mad5Anaxa в отношении иммуногенности.
Указанные данные подтверждают результаты, представленные на фиг. 16 и 17, касающиеся эффекторной функции OVA-специфических CD8-T-клеток, которые свидетельствуют о наиболее сильном увеличении продуцирующих цитокины клеток, когда вакцинацию с помощью Z13Mad5Anaxa объединяли с обработкой агонистическим антителом к CD40.
Пример 12: Эффективность комплекса, содержащего другой агонист TLR, на рост опухолей на стандартной модели опухоли EG.7-OVA
Целью настоящего исследования было изучение воздействия комплекса, указанного в настоящем описании, имеющего другой агонист TLR, а именно "EDA" вместо "Z13", на рост опухолей и выживаемость. В настоящем исследовании комплекс представлял собой слитый белок, содержащий проникающий в клетку пептид "Z13", белок "MAD5", который состоит из различных CD8+- и CD4+-эпитопов из различных антигенов, и пептидный агонист TLR4 "EDA". Таким образом, создавали слитый белок с пептидом EDA в N-концевом положении и различные контрольные конъюгированные белки без Z13 или EDA или без них обоих.
Так, создавали следующие конструкции, в которых аминокислотная последовательность проникающего в клетку пептида "Z13" подчеркнута, а пептидный агонист TLR "EDA" обозначен курсивом:
EDAZ13Mad5
Последовательность:

Молекулярная масса: 25057 Да.
Характеристики:
- Карго-молекула Mad5 содержит эпитопы OVACD4, gp100CD8, EalphaCD4 и OVACD8.
- Содержит агонист TLR EDA (Lasarte J.J. и др., The extra domain A from fibronectin targets antigens to TLR4-expressing cells and induces cytotoxic T cell responses in vivo. J Immunol, 178(2), 2007, cc. 748-756).
- Буфер для хранения: 50 мМ Трис-HCl, 150 мМ NaCl, 10% глицерина, 2 мМ ДТТ, 1М L-аргинин, рН 8.
- Уровень эндотоксинов: < 0,01 эндотоксиновых единиц (EU)/мкг.
Mad5
Последовательность:
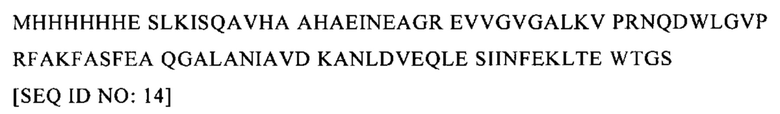
Молекулярная масса: 10154,6 Да
Характеристики:
- Карго-молекула Mad5 содержит эпитопы OVACD4, gp100CD8, ЕальфаCD4 и OVACD8.
- Буфер для хранения: 50 мМ Трис-HCl, 150 мМ NaCl, 10% глицерина, 2 мМ ДТТ, 0,5М L-аргинин, рН 8.
- Уровень эндотоксинов: 0,069 EU/мг.
EDAMad5
Последовательность 
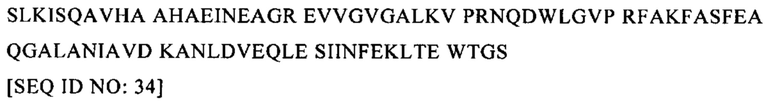
Молекулярная масса: 20017 Да
Характеристики:
- Карго-молекула Mad5 содержит эпитопы OVACD4, gp100CD8, ЕальфаСD4 и OVACD8.
- Буфер для хранения: 50 мМ Трис-HCl, 150 мМ NaCl, 10% глицерина, 2 мМ ДТТ, 0,5М L-аргинин, рН 8.
- Уровень эндотоксинов: 1,8 EU/мг.
Для оценки воздействия содержащей EDA конструкции белков на контроль роста опухолей была выбрана s.c.-модель клеток тимомы EG.7-OVA. Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область. После имплантации опухолей мышей вакцинировали в день 5 и 13, используя в дозе 10 нмолей одну из следующих конструкций (см. в примерах 1 и 2 описание конструкций): EDAZ13Mad5, EDAMad5, Mad5 или Mad5 и MPLA (доза, эквимолярная EDA) s.c. в правую боковую область. Размер опухолей определяли с помощью кронциркуля.
На фиг. 18 представлены данные о росте опухолей для 7 мышей на группу (среднее ± СКО); *, р<0,05 EDAZ13Mad5 относительно контрольной группы (двусторонний дисперсионный анализ). На фиг. 19 представлены кривые роста индивидуальных опухолей (для каждой из 7 мышей на группу). На фиг. 20А представлена кривая выживаемости для 7 мышей на группу; *, р<0,05 EDAZ13Mad5 относительно контрольной группы (логранговый критерий). На фиг. 20Б представлена кривая выживаемости без прогрессирования опухоли для 7 мышей на группу; *, р<0,05 EDAZ13Mad5 относительно контрольной группы (логранговый критерий):
Результаты свидетельствуют о том, что при использовании в терапевтическом режиме конструкция EDAZ13Mad5 представляла собой единственную белковую вакцину, позволяющую существенно контролировать рост опухолей по сравнению с контрольной группой, которая обеспечивала существенно улучшенную кривую выживаемости без прогрессирования опухоли и кривую выживаемости.
Таким образом, результаты позволяют предположить, что конструкция белка EDAZ13Mad5 представляет собой высокоэффективную вакцину для контроля роста опухолей в терапевтическом режиме.
Пример 13: Сравнение кинетики иммунных ответов при применении комплексов, содержащих различные проникающие в клетку пептиды
Для изучения воздействия различных СРР в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, использовали описанный выше слитый белок Z13Mad5Anaxa.
Дополнительно конструировали другие слитые белки, содержащие СРР, отличные от Z13, а именно: Z14 (SEQ ID NO: 7) или Z18 (SEQ ID NO: 11). Указанные слитые белки содержали также белок «MAD5», который состоит из различных CD8+- и CD4+-эпитопов из различных антигенов, и пептидный агонист TLR2 «Anaxa». Таким образом, создавали следующие дополнительные конструкции:
Z14Mad5Anaxa
Последовательность:

Z18Mad5 Anaxa
Последовательность:

Мышей линии C57BL/6 разделяли на 8 различных групп (по 4 мыши на группу): три группы, обрабатываемые либо Z13Mad5Anaxa, либо Z14Mad5Anaxa, либо Z18Mad5Anaxa в дозе 2 нмоля, и соответствующий им контроль, и три группы, обрабатываемые Z13Mad5Anaxa, Z14Mad5Anaxa или Z18Mad5Anaxa в дозе 0,05 нмоля, и соответствующий им контроль. Мышей вакцинировали пять раз (неделя 0, неделя 2, неделя 4, неделя 6 и неделя 8) s.c. У мышей брали кровь через 7 дней после 2-ой, 3-ей, 4-ой и 5-ой вакцинаций и осуществляли окрашивание мультимером (один эксперимент, 4 мыши на группу).
Результаты представлены на фиг. 21. Во всех группах, вакцинированных Z13Mad5Anaxa, Z14Mad5Anaxa или Z18Mad5Anaxa, обнаружен повышенный процент позитивных по мультимеру клеток по сравнению с контрольной группой (за исключением второй вакцинации Z18Mad5Anaxa). Эти результаты свидетельствуют о том, что комплексы, предлагаемые в настоящем изобретении, которые содержат различные проникающие в клетку пептиды, обладают способностью вызывать иммунный ответ при их применении в различных дозах.
Пример 14: Сравнение Т-клеточных иммунных ответов при применении комплексов, содержащих различные проникающие в клетку пептиды
Для более детального изучения CDS-T-клеточных иммунных ответов мышей линии C57BL/6 разделяли на три различные группы (по 3-4 мыши на группу): наивные, Z13Mad5Anaxa или Z14Mad5Anaxa.
Мышей линии C57BL/6 из Z13Mad5Anaxa-группы и Z14Mad5Anaxa-группы вакцинировали 5 раз (неделя 0, неделя 2, неделя 4, неделя 6 и неделя 8) s.c., используя в дозе 2 нмоля либо Z13Mad5Anaxa, либо Z14Mad5Anaxa. Через 9 дней после 5-ой вакцинации мышей умерщвляли, органы изымали и осуществляли окрашивание мультимером для определения процента SIINFEKL-специфических CD8-T-клеток в селезенке, костном мозге и дренирующих лимфатических узлах (паховых и подмышечных).
Результаты представлены на фиг. 22. У мышей, вакцинированных Z13Mad5Anaxa или Z14Mad5Anaxa, обнаружено сходное увеличение позитивных по мультимеру клеток, в частности, в селезенке и костном мозге, а также небольшое увеличение в дренирующих лимфатических узлах.
Для дополнительного изучения эффекторной функции CD8-Т-клеток после вакцинации комплексами с различными СРР, для тех же групп мышей, которые описаны выше, осуществляли Elispot-анализ клеток селезенки, стимулированных пептидом SIINFEKL-OVACD8 (SEQ ID NO: 35), через 9 дней после 5-ой вакцинации для количественного определения продуцирующих IFN-γ клеток.
Результаты представлены на фиг. 23А. У мышей, вакцинированных Z13Mad5Anaxa, обнаружено существенное увеличение продуцирующих IFN-γ клеток по сравнению с наивными мышами. У мышей, вакцинированных Z14Mad5Anaxa, также обнаружено увеличение продуцирующих IFN-γ клеток по сравнению с наивными мышами, однако увеличение оказалось незначимыми, что могло являться следствием небольшого количества мышей (3 мыши в обработанной Z14Mad5Anaxa группе).
Для изучения CD4-Т-клеточных ответов после вакцинации с использованием комплексов, содержащих различные СРР, для тех же групп мышей, которые описаны выше, осуществляли Elispot-анализ клеток селезенки, стимулированных пептидом SIINFEKL-OVACD4 (SEQ ID NO: 36), через 9 дней после 5-ой вакцинации для количественного определения продуцирующих IFN-γ клеток.
Результаты представлены на фиг. 23Б. У мышей, вакцинированных Z13Mad5Anaxa, обнаружено очень существенное повышение количества продуцирующих IFN-γ клеток по сравнению с наивными мышами. У мышей, вакцинированных Z14Mad5Anaxa, также обнаружено увеличение продуцирующих IFN-γ клеток по сравнению с наивными мышами, однако увеличение оказалось незначимыми, что могло являться следствием небольшого количества мышей (3 мыши в обработанной Z14Mad5Anaxa группе).
Кроме того, для описанных выше групп мышей осуществляли внутриклеточное окрашивание клеток селезенки, стимулированных пептидом SIINFEKL OVACD8 (SEQ ID NO: 35), для идентификации CD107a+IFN-γ+TNF-α+-клеток. Результаты представлены на фиг. 24. У мышей, вакцинированных Z13Mad5Anaxa или Z14Mad5Anaxa, обнаружено сходное увеличение CD107a+IFN-γ+TNF-α+-клеток.
Пример 15: Сравнение действия комплексов, содержащих различные проникающие в клетку пептиды, на рост опухолей и выживаемость на s.c.-модели EG.7-0VA
Для изучения воздействий комплексов, содержащих различные проникающие в клетку пептиды, на рост опухолей и выживаемость применяли s.с.-модель, созданную с использованием клеток EG.7-OVA. В d0 мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и разделяли на три различные группы (наивные, Z13Mad5Anaxa и Z14Mad5Anaxa). Мышей вакцинировали дважды в d5 и d13 после имплантации опухолей путем s.c.-инъекции, используя в дозе 0,5 нмоля Z13Mad5Anaxa или Z14Mad5Anaxa, в правую боковую область.
Результаты представлены на фиг. 25. Вакцинация Z13Mad5Anaxa или Z14Mad5Anaxa приводила к существенному снижению объемов опухолей по сравнению с контрольными мышами (фиг. 25А), а также к существенному повышению коэффициентов выживаемости по сравнению с контрольными мышами (фиг. 25Б). Эти результаты продемонстрировали, что оба комплекса, и Z13Mad5Anaxa и Z14Mad5Anaxa, обладали способностью существенно снижать рост опухолей и существенно пролонгировать выживаемость.
Пример 16: Сравнение иммунных ответов после вакцинации комплексами, содержащими различные проникающие в клетку пептиды
В этом эксперименте изучали воздействие различных СРР в комплексе, входящем в комбинацию, предлагаемую для применения согласно настоящему изобретению, при использовании комплекса с агонистом TLR «EDA». Для этого применяли описанный выше слитый белок EDAZ13Mad5.
Кроме того, дополнительно создавали другие слитые белки, которые содержали СРР, отличные от Z13, а именно: Z14 (SEQ ID NO: 7) или Z18 (SEQ ID NO: 11). Указанные слитые белки содержали также белок «MAD5», состоящий из различных CD8+- и CD4+-эпитопов из различных антигенов, и пептидный агонист TLR4 «EDA». Таким образом, дополнительно создавали следующие конструкции:
EDAZ14Mad5
Последовательность:

EDAZ18Mad5
Последовательность:

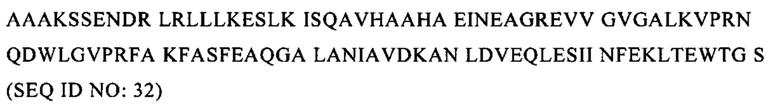
Мышей линии C57BL/6 разделяли на 8 различных групп (по 4 мыши на группу): три группы, которые обрабатывали либо EDAZ13Mad5, либо EDAZ14Mad5, либо EDAZ18Mad5 в дозе 2 нмоля, и соответствующий им контроль, и три группы, которые обрабатывали либо EDAZ13Mad5, EDAZ14Mad5, либо EDAZ18Mad5 в дозе 0,5 нмоля, и соответствующая им контрольная группа. Мышей вакцинировали три раза (неделя 0, неделя 2 и неделя 4) s.c. У мышей брали кровь через 7 дней после 2-ой и 3-ей вакцинаций и осуществляли окрашивание мультимером (один эксперимент с 4 мышами на группу).
Результаты представлены на фиг. 26. Во всех группах, вакцинированных EDAZ13Mad5, EDAZ14Mad5 или EDAZ18Mad5, обнаружен повышенный процент позитивных по мультимеру клеток по сравнению с контрольной группой. Эти результаты продемонстрировали, что комплексы, предлагаемые в настоящем изобретении, которые содержали различные проникающие в клетку пептиды, обладали способностью вызывать иммунный ответ в различных дозах.
Пример 17: Воздействие EDAZ14Mad5 на рост опухолей и выживаемость на s.с.-модели EG.7-OVA
Для изучения воздействия EDAZ14Mad5 на рост опухолей и выживаемость использовали s.c.-модель EG.7-OVA (см. в примере 12 и на фиг. 18-20 результаты исследования EDAZ13Mad5 на такой же модели).
В d0 мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область и разделяли на 2 группы (наивные и EDAZ14Mad5). Мышей вакцинировали дважды в d5 и d13 после имплантации опухолей путем s.c.-инъекции EDAZ14Mad5 в дозе 0,5 нмоля в правую боковую область.
Результаты представлены на фиг. 27. Аналогично EDAZ13Mad5 (см. пример 12, фиг. 18-20), вакцинация EDAZ14Mad5 приводила к существенному снижению объемов опухолей по сравнению с контрольными мышами (фиг. 27А), а также к существенному повышению коэффициентов выживаемости (фиг. 27Б). Указанные результаты продемонстрировали, что конструкция EDAZ14Mad5 обладала способностью существенно снижать рост опухолей и существенно пролонгировать выживаемость - аналогично EDAZ13Mad5 (см. пример 12, фиг. 18-20).
Пример 18: Повышенная эффективность слитой конструкции Z13Mad5Anaxa по сравнению с раздельным введением Z13Mad5 и агониста TLR
Для оценки воздействия конъюгированного агониста TLR "Anaxa" в конструкции Z13Mad5Anaxa (SEQ ID NO: 28) на контроль роста опухолей использовали стандартную модель опухоли, а именно, модель, полученную путем s.с.-имплантации клеток тимомы EG.7-OVA. Для сравнения использовали конструкцию "AnaxaZ13Mad5" (SEQ ID NO: 27; с N-концевым агонистом TLR "Anaxa" и С-концевой антигенной карго-молекулой "Mad5") и конструкцию "Z13Mad5" (SEQ ID NO: 46; без агониста TLR), последнюю конструкцию вводили в сочетании с отдельно вводимым агонистом TLR (Pam3CSK4).
Мышам линии C57BL/6 имплантировали s.c. 3×105 опухолевых клеток EG7-OVA в левую боковую область. После имплантации опухолей три группы по 7 мышей в каждой вакцинировали в правую боковую область в дни 5 и 13 путем подкожной инъекции (s.c.) в дозе 10 нмолей либо AnaxZ13Mad5 (группа 1), либо Z13Mad5Anaxa (группа 2), либо Z13Mad5 и Pam3CSK4 (доза, эквимолярная Anaxa; группа 3). Размер опухолей определяли с помощью кронциркуля. Результаты представлены на фиг. 28-30.
При применении в терапевтическом режиме белковые вакцины Z13Mad5Anaxa и AnaxaZ13Mad5 обладали более высокой эффективностью в отношении контроля роста опухолей по сравнению с контрольной группой, т.е. совместная инъекция Z13Mad5 и Pam3CSK обеспечивала существенно улучшенную кривую выживаемости. В частности, для Z13Mad5Anaxa и AnaxaZ13Mad5 была продемонстрирована существенно более высокая эффективность, чем для Z13Mad5 при введении отдельно от Pam3CSK4. Таким образом, результаты позволяют предположить, что конструкции белков Z13Mad5Anaxa и AnaxaZ13Mad5 являются многообещающими конъюгированными вакцинами для контроля роста опухолей при использовании в терапевтическом режиме.
Пример 19: Терапевтическое воздействие на рост опухолей - сравнение конструкций, содержащих различные агонисты TLR
Целью настоящего исследования было сравнение эффективности различных конструкций белковых вакцин, конъюгированных с различными агонистами TLR, а именно: EDAZ13Mad5 (SEQ ID NO: 26) и Z13Mad5Anaxa (SEQ ID NO: 28), в отношении контроля роста опухолей. Для этой цели мышам линии C57BL/6 имплантировали s.c. 3×105 клеток тимомы EG.7-OVA в левую боковую область согласно описанному ранее методу. Мышей (по 7 мышей на группу) вакцинировали s.c. в правую боковую область в дни 5 и 13, используя в дозе 2 нмоля либо EDAZ13Mad5, либо Z13Mad5Anaxa, либо используя совместную инъекцию Z13Mad5+MPLA (в дозе, эквимолярной EDA).
Результаты представлены на фиг. 31, 32 и 33. В этой экспериментальной схеме Z13Mad5Anaxa (SEQ ID NO: 28), EDAZ13Mad5 (SEQ ID NO: 26) и Z13Mad5 (SEQ ID NO: 46)+MPLA обладали сходной способностью обеспечивать существенный контроль роста опухолей. Кроме того, эти данные свидетельствуют о том, что Z13Mad5Anaxa является наиболее эффективной конструкцией касательно способности контролировать рост опухолей, а эффективность EDAZ13Mad5 несколько превышала эффективность Z13Mad5+MPLA при изучении с использованием указанной экспериментальной схемы.
Пример 20: Повышенная эффективность слитой конструкции Z13Mad5Anaxa по сравнению с Z13Mad5 и Anaxa на модели глиобластомы
Для изучения эффективности комплекса, предлагаемого в настоящем изобретении, была выбрана модель глиобластомы. Так, Z13Mad5Anaxa (SEQ ID NO: 28) вводили одной группе мышей, a Z13Mad5 (SEQ ID NO: 29) и Anaxa (SEQ ID NO: 15) вводили (совместно) другой группе мышей.
Т-клеточный хоминг в области опухоли анализировали у несущих опухоль мышей линии Gl261-Quad (7-16 мышей на группу), которых вакцинировали дважды, а именно: день 7 и день 21 после имплантации опухолей (день 0), используя вакцину Z13Mad5Anaxa в дозе 2 нмоля. Группу, вакцинированную и Z13Mad5, и Anaxa (в дозе, эквимолярной Z13Mad5Anaxa), применяли в качестве контроля. В целом, метод состоял в следующем: мышам линии C57BL/6 имплантировали i.c. (интракраниально) 5×105 опухолевых клеток Gl261-Quad и вакцинировали дважды (в d7 и d21 после имплантации) путем s.c.-инъекции Z13Mad5Anaxa в дозе 2 нмоля (группа 1) или Z13Mad5 в дозе 2 нмоля и Anaxa в дозе 2 нмоля (группа 2). В день 28 анализировали кровь и инфильтрующие головной мозг лейкоциты (BIL), при этом количественно оценивали SIINFEKL-специфические CD8-T-клетки в крови и BIL в d28 путем окрашивания мультимером (7-16 мышей на группу).
Результаты представлены на фиг. 34. Обнаружен существенно более высокий процент SIINFEKL-специфических CD8-Т-клеток в крови вакцинированных Z13Mad5Anaxa мышей по сравнению с мышами, вакцинированными раздельно и Z13Mad5, и Anaxa (фиг. 34А). Аналогично этому, обнаружено более выраженное накопление SIINFEKL-специфических CD8-Т-клеток в BIL у вакцинированных Z13Mad5Anaxa мышей по сравнению с мышами, вакцинированными по отдельности Z13Mad5 и Anaxa (фиг. 34Б, р = 0,0539).
Далее оценивали секрецию цитокинов. Для этого мышам линии C57BL/6 имплантировали i.c. 5×105 опухолевых клеток Gl261-Quad и вакцинировали дважды (d7 и 21) путем s.c.-инъекции Z13Mad5Anaxa в дозе 2 нмоля или Z13Mad5 в дозе 2 нмоля и Anaxa в дозе 2 нмоля. BIL выделяли и культивировали в течение 6 ч со зрелыми BMDC, загруженными или незагруженными пептидом SllNFEKL (SEQ ID NO: 35), в присутствии брефелдина А перед внутриклеточным окрашиванием цитокинов.
Результаты представлены на фиг. 35. В целом, более высокий уровень секреции цитокинов обнаружен для инфильтрующих головной мозг CD8-T-клеток у мышей, вакцинированных Z13Mad5Anaxa. В частности, существенно более высокий уровень секреции общего IFN-γ и IFN-γ и TNF-α вместе обнаружен для инфильтрующих головной мозг CD8-T-клеток у мышей, вакцинированных Z13Mad5Anaxa, по сравнению с мышами, вакцинированными по отдельности Z13Mad5 и Anaxa.
В совокупности эти результаты продемонстрировали, что вакцина Z13Mad5Anaxa (по сравнению с раздельным введением Z13Mad5 и Anaxa) обладала способностью вызывать более сильный иммунный ответ SIINFEKL-специфических CD8-Т-клеток в головном мозге несущих опухоли мышей с выраженной эффекторной функцией.
Полученные результаты свидетельствуют о том, что Z13Mad5Anaxa является эффективной в отношении генерирования высокого иммунного ответа инфильтрующих головной мозг SIINFEKL-специфических CD8-Т-клеток. Z13Mad5Anaxa также обладает способностью усиливать секрецию цитокинов антигенспецифическими CD8-Т-клетками в головном мозге.
Пример 21: Повышенная эффективность слитой конструкции Z13Mad5Anaxa по сравнению с Z13Mad5 и Anaxa при изучении на наивных мышах
Далее эффективность комплекса, предлагаемого в настоящем изобретении, изучали на наивных мышах. Для этого Z13Mad5Anaxa (SEQ ID NO: 28) вводили одной группе мышей, a Z13Mad5 (SEQ ID NO: 46) и Anaxa (SEQ ID NO: 15) вводили (совместно) другой группе мышей.
Мышей линии C57BL/6 из Z13Mad5Anaxa-группы и Z13Mad5 + Anaxa-группы вакцинировали однократно (неделя 0) путем s.c.-инъекции в дозе 2 нмоля Z13Mad5Anaxa (группа 1) или 2 нмоля Z13Mad5 и 2 нмоля Anaxa (группа 2). В день 14 анализировали кровь, оценивая количественно SIINFEKL-специфические CD8-Т-клетки в крови путем окрашивания мультимером (4-8 мышей на группу).
Результаты представлены на фиг. 36. Обнаружен существенно более высокий процент SIINFEKL-специфических CD8-Т-клеток в крови мышей, вакцинированных Z13Mad5Anaxa, по сравнению с мышами, вакцинированными Z13Mad5 и Anaxa по отдельности (фиг. 36).
В совокупности эти результаты продемонстрировали, что вакцина Z13Mad5Anaxa (по сравнению с введением Z13Mad5 и Anaxa по отдельности) обладала способностью вызывать более сильный периферический иммунный ответ SIINFEKL-специфических CD8-Т-клеток.
Пример 22: Воздействия комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей и коэффициент выживаемости на модели карциномы ободочной кишки
Для оценки эффективности комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, при лечении колоректального рака использовали модель опухоли МС-38. МС-38 представляет собой клеточную линию карциномы ободочной кишки.
Для этой цели получали конструкцию "Z13Mad12Anaxa", которая представляет собой комплекс, содержащий проникающий в клетку пептид "Z13", антигенную карго-молекулу «MAD12», которая содержит три неоантигена, описанные у Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576, из линии опухолевых клеток МС-38, и пептидный агонист TLR «Anaxa». Ниже представлена аминокислотная последовательность Z13Mad12Anaxa:

Мышам линии C57BL/6 (7 мышей, самки возрастом 7 недель) имплантировали s.c. 2×105 опухолевых клеток МС-38 в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали в день 3, день 10 и 17 путем подкожного введения в основание хвоста Z13Mad12Anaxa в дозе 2 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24, 27 и 31 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". В дни 10 и 17, когда осуществляли совместное введение и Z13Mad12Anaxa, и антитела к PD1 группе "Z13Mad 12Anaxa + анти-PD1", антитело вводили i.p. непосредственно после s.c.-обработки Z13Mad12Anaxa. Размер опухолей определяли с помощью кронциркуля.
Как продемонстрировано на фиг. 37 и 38, обработка только ингибитором PD1 или только Z13Mad12Anaxa приводила к существенному снижению объемов опухолей (фиг. 37А) и повышенной выживаемости (фиг. 37Б) по сравнению с контрольной группой. Однако комбинация их обоих, т.е. ингибитора PD1 и Z13Mad12Anaxa, приводила к наиболее выраженному улучшению, а именно, более сильному уменьшению объемов опухолей и сильному повышению коэффициентов выживаемости. Эти данные свидетельствуют о том, что комбинация терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad12Anaxa обладала более высокой эффективностью, чем терапия на основе только антитела к PD1 или вакцинация с использованием только Z13Mad12Anaxa. Кроме того, у всех мышей в контрольной группе обнаружены опухоли (0/7 свободных от опухолей мышей), в то время как в Z13Mad12Anaxa-группе 2 из 7 мышей оказались свободными от опухолей, а в анти-PD1-группе 3 из 7 мышей оказались свободными от опухолей. Важно отметить, что в группе "Z13Mad12Anaxa + анти-PD1" только у одной мыши обнаружены опухоли, т.е. у 6 из 7 мышей оказались свободными от опухолей. Это превышало суммарное количество свободных от опухолей мышей в Z13Mad12Anaxa-группе (2/7) и в анти-PD1-группе (3/7). В совокупности, эти результаты свидетельствуют о сильном синергетическом действии комбинации терапии на основе антитела к PD1 и вакцинации Z13Mad12Anaxa.
Пример 23: Воздействия комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, на рост опухолей и коэффициент выживаемости на модели карциномы ободочной кишки
При осуществлении опыта, описанного в примере 23, дополнительных по сравнению с примером 22 животных подвергали тестированию для увеличения размера различных экспериментальных групп, которые применяли в примере 22. Таким образом, экспериментальные результаты «включали» результаты, полученные для животных в примере 22, и результаты, полученные на дополнительных животных.
В целом, для оценки эффективности комбинации ингибитора PD1 и комплекса, содержащего проникающий в клетку пептид, различные антигены и пептидный агонист TLR, при лечении рака использовали модель опухоли МС-38. МС-38 представляет собой клеточную линию карциномы.
Получали конструкцию "Z13Mad12Anaxa", которая представляет собой комплекс, содержащий проникающий в клетку пептид "Z13", антигенную карго-молекулу «MAD12», которая содержит три неоантигена, описанные у Yadav и др. Nature. 515(7528), 27 ноября 2014 г., сс. 572-576, из линии опухолевых клеток МС-38, и пептидный агонист TLR «Anaxa». Ниже представлена аминокислотная последовательность Z13Mad12Anaxa:

Мышам линии C57BL/6 (13-14 мышей, самки возрастом 7 недель) имплантировали s.c. 2×105 опухолевых клеток МС-38 в левую боковую область (день 0). После имплантации опухолей мышей из групп "Z13Mad12Anaxa" и "Z13Mad12Anaxa + анти-PD1" вакцинировали в дни 3, 10 и 17 путем подкожного введения в основание хвоста Z13Mad12Anaxa в дозе 2 нмоля. 200 мкг антитела к PD1 RMP1-14 (фирма BioXcell, Вест Лебанон, шт. Нью-Гемпшир, США) вводили i.p. в каждый из дней 6, 10, 13, 17, 20, 24 и 27 мышам из групп "анти-PD1" и "Z13Mad12Anaxa + анти-PD1". В дни 10 и 17, когда осуществляли совместное введение и Z13Mad12Anaxa, и антитела к PD1 группе "Z13Mad12Anaxa + анти-PD1", антитело вводили i.p. непосредственно после s.c.-обработки Z13Mad12Anaxa. Размер опухолей определяли с помощью кронциркуля.
Как продемонстрировано на фиг. 39 и 40, обработка только ингибитором PD1 или только Z13Mad12Anaxa приводила к существенному снижению объемов опухолей (фиг. 39А) и повышенной выживаемости (фиг. 39Б) по сравнению с контрольной группой. Однако комбинация их обоих, т.е. ингибитора PD1 и Z13Mad12Anaxa, приводила к наиболее выраженному улучшению, а именно, более сильному уменьшению объемов опухолей и сильному повышению коэффициентов выживаемости. Следует отметить, что в "Z13Mad 12Anaxa + aPD1"-группе только у 3 мышей развились опухоли (в то время как 10 мышей оставались свободными от опухолей), в то время как в "aPD1"-группе и "Z13Mad12Anaxa"-группе у 8 из 10 мышей соответственно развились опухоли. В контрольной группе у всех мышей развились опухоли.
Указанные данные свидетельствуют о том, что комбинация терапии с использованием антитела к PD1 и вакцинации с использованием Z13Mad12Anaxa обладала более высокой эффективностью, чем терапия только на основе антитела к PD1 или вакцинация только Z13Mad12Anaxa. Таким образом, указанные результаты демонстрируют синергетическое действие терапии на основе антитела к PD1 и вакцинации Z13Mad12Anaxa.
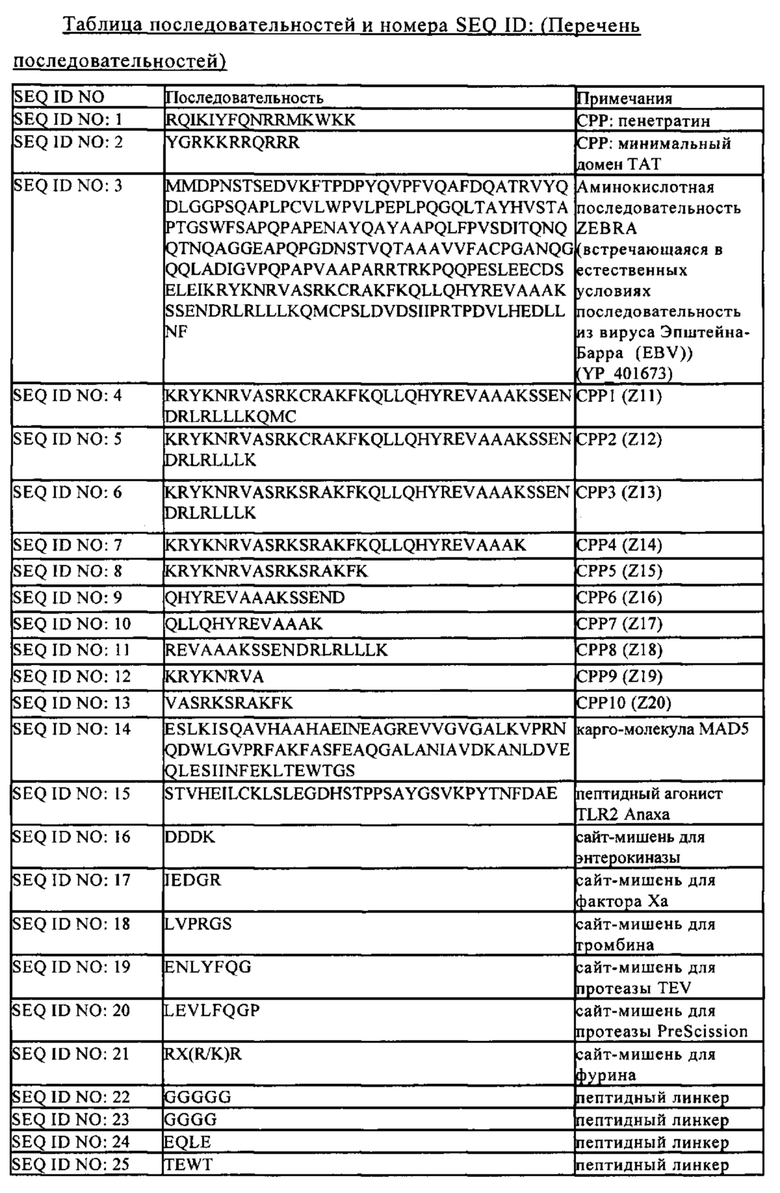

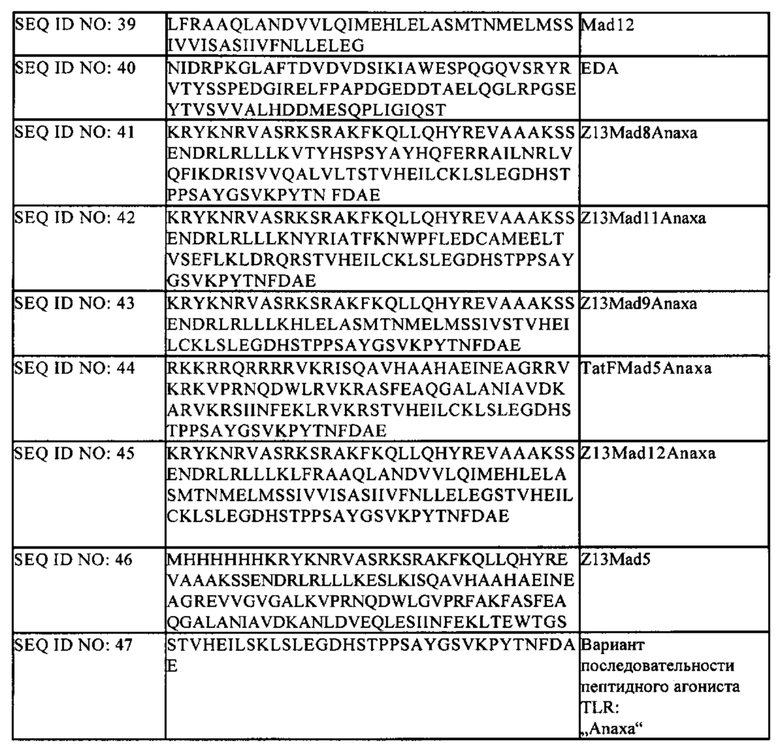
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АМАЛЬ ТЕРАПЬЮТИКС СА
<120> КОМБИНАЦИЯ МОДУЛЯТОРА ИММУННЫХ КОНТРОЛЬНЫХ ТОЧЕК И КОМПЛЕКСА, СОДЕРЖАЩЕГО
ПРОНИКАЮЩИЙ В КЛЕТКУ ПЕПТИД, КАРГО-МОЛЕКУЛУ И ПЕПТИДНЫЙ АГОНИСТ TLR, ДЛЯ
ПРИМЕНЕНИЯ В МЕДИЦИНЕ
<130> AM05P007WO2
<150> PCT/EP2016/000472
<151> 2016-03-16
<150> PCT/EP2016/070264
<151> 2016-08-26
<160> 47
<170> PatentIn version 3.5
<210> 1
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP: Penetratin
<400> 1
Arg Gln Ile Lys Ile Tyr Phe Gln Asn Arg Arg Met Lys Trp Lys Lys
1 5 10 15
<210> 2
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP: TAT minimal domain
<400> 2
Tyr Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg
1 5 10
<210> 3
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> ZEBRA amino acid sequence (natural sequence from Epstein - Barr
virus (EBV)) (YP_401673)
<400> 3
Met Met Asp Pro Asn Ser Thr Ser Glu Asp Val Lys Phe Thr Pro Asp
1 5 10 15
Pro Tyr Gln Val Pro Phe Val Gln Ala Phe Asp Gln Ala Thr Arg Val
20 25 30
Tyr Gln Asp Leu Gly Gly Pro Ser Gln Ala Pro Leu Pro Cys Val Leu
35 40 45
Trp Pro Val Leu Pro Glu Pro Leu Pro Gln Gly Gln Leu Thr Ala Tyr
50 55 60
His Val Ser Thr Ala Pro Thr Gly Ser Trp Phe Ser Ala Pro Gln Pro
65 70 75 80
Ala Pro Glu Asn Ala Tyr Gln Ala Tyr Ala Ala Pro Gln Leu Phe Pro
85 90 95
Val Ser Asp Ile Thr Gln Asn Gln Gln Thr Asn Gln Ala Gly Gly Glu
100 105 110
Ala Pro Gln Pro Gly Asp Asn Ser Thr Val Gln Thr Ala Ala Ala Val
115 120 125
Val Phe Ala Cys Pro Gly Ala Asn Gln Gly Gln Gln Leu Ala Asp Ile
130 135 140
Gly Val Pro Gln Pro Ala Pro Val Ala Ala Pro Ala Arg Arg Thr Arg
145 150 155 160
Lys Pro Gln Gln Pro Glu Ser Leu Glu Glu Cys Asp Ser Glu Leu Glu
165 170 175
Ile Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Cys Arg Ala Lys
180 185 190
Phe Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser
195 200 205
Ser Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Gln Met Cys Pro Ser
210 215 220
Leu Asp Val Asp Ser Ile Ile Pro Arg Thr Pro Asp Val Leu His Glu
225 230 235 240
Asp Leu Leu Asn Phe
245
<210> 4
<211> 45
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP1 (Z11)
<400> 4
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Cys Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Gln Met Cys
35 40 45
<210> 5
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP2 (Z12)
<400> 5
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Cys Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys
35 40
<210> 6
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP3 (Z13)
<400> 6
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys
35 40
<210> 7
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP4 (Z14)
<400> 7
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys
20 25 30
<210> 8
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP5 (Z15)
<400> 8
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys
<210> 9
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP6 (Z16)
<400> 9
Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser Glu Asn Asp
1 5 10 15
<210> 10
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP7 (Z17)
<400> 10
Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys
1 5 10
<210> 11
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP8 (Z18)
<400> 11
Arg Glu Val Ala Ala Ala Lys Ser Ser Glu Asn Asp Arg Leu Arg Leu
1 5 10 15
Leu Leu Lys
<210> 12
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP9 (Z19)
<400> 12
Lys Arg Tyr Lys Asn Arg Val Ala
1 5
<210> 13
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> CPP10 (Z20)
<400> 13
Val Ala Ser Arg Lys Ser Arg Ala Lys Phe Lys
1 5 10
<210> 14
<211> 85
<212> PRT
<213> Artificial Sequence
<220>
<223> MAD5 cargo
<400> 14
Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala His Ala Glu Ile
1 5 10 15
Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala Leu Lys Val Pro
20 25 30
Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala Lys Phe Ala Ser
35 40 45
Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn
50 55 60
Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu Thr
65 70 75 80
Glu Trp Thr Gly Ser
85
<210> 15
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> TLR2 peptide agonist Anaxa
<400> 15
Ser Thr Val His Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His
1 5 10 15
Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe
20 25 30
Asp Ala Glu
35
<210> 16
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> enterokinase target site
<400> 16
Asp Asp Asp Lys
1
<210> 17
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> factor Xa target site
<400> 17
Ile Glu Asp Gly Arg
1 5
<210> 18
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> thrombin target site
<400> 18
Leu Val Pro Arg Gly Ser
1 5
<210> 19
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> protease TEV target site
<400> 19
Glu Asn Leu Tyr Phe Gln Gly
1 5
<210> 20
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> PreScission protease target site
<400> 20
Leu Glu Val Leu Phe Gln Gly Pro
1 5
<210> 21
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> furin target site
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X may be any amino acid
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X is R or K
<400> 21
Arg Xaa Xaa Arg
1
<210> 22
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 22
Gly Gly Gly Gly Gly
1 5
<210> 23
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 23
Gly Gly Gly Gly
1
<210> 24
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 24
Glu Gln Leu Glu
1
<210> 25
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 25
Thr Glu Trp Thr
1
<210> 26
<211> 224
<212> PRT
<213> Artificial Sequence
<220>
<223> EDAZ13Mad5
<400> 26
Met His His His His His His Asn Ile Asp Arg Pro Lys Gly Leu Ala
1 5 10 15
Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu Ser Pro
20 25 30
Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser Pro Glu Asp
35 40 45
Gly Ile Arg Glu Leu Phe Pro Ala Pro Asp Gly Glu Asp Asp Thr Ala
50 55 60
Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr Thr Val Ser Val Val
65 70 75 80
Ala Leu His Asp Asp Met Glu Ser Gln Pro Leu Ile Gly Ile Gln Ser
85 90 95
Thr Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys
100 105 110
Phe Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser
115 120 125
Ser Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Glu Ser Leu Lys Ile
130 135 140
Ser Gln Ala Val His Ala Ala His Ala Glu Ile Asn Glu Ala Gly Arg
145 150 155 160
Glu Val Val Gly Val Gly Ala Leu Lys Val Pro Arg Asn Gln Asp Trp
165 170 175
Leu Gly Val Pro Arg Phe Ala Lys Phe Ala Ser Phe Glu Ala Gln Gly
180 185 190
Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn Leu Asp Val Glu Gln
195 200 205
Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu Thr Glu Trp Thr Gly Ser
210 215 220
<210> 27
<211> 169
<212> PRT
<213> Artificial Sequence
<220>
<223> AnaxaZ13Mad5
<400> 27
Met His His His His His His Ser Thr Val His Glu Ile Leu Cys Lys
1 5 10 15
Leu Ser Leu Glu Gly Asp His Ser Thr Pro Pro Ser Ala Tyr Gly Ser
20 25 30
Val Lys Pro Tyr Thr Asn Phe Asp Ala Glu Lys Arg Tyr Lys Asn Arg
35 40 45
Val Ala Ser Arg Lys Ser Arg Ala Lys Phe Lys Gln Leu Leu Gln His
50 55 60
Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser Glu Asn Asp Arg Leu Arg
65 70 75 80
Leu Leu Leu Lys Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala
85 90 95
His Ala Glu Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala
100 105 110
Leu Lys Val Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala
115 120 125
Lys Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
130 135 140
Asp Lys Ala Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe
145 150 155 160
Glu Lys Leu Thr Glu Trp Thr Gly Ser
165
<210> 28
<211> 169
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad5Anaxa
<400> 28
Met His His His His His His Lys Arg Tyr Lys Asn Arg Val Ala Ser
1 5 10 15
Arg Lys Ser Arg Ala Lys Phe Lys Gln Leu Leu Gln His Tyr Arg Glu
20 25 30
Val Ala Ala Ala Lys Ser Ser Glu Asn Asp Arg Leu Arg Leu Leu Leu
35 40 45
Lys Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala His Ala Glu
50 55 60
Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala Leu Lys Val
65 70 75 80
Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala Lys Phe Ala
85 90 95
Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala
100 105 110
Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu
115 120 125
Thr Glu Trp Thr Gly Ser Ser Thr Val His Glu Ile Leu Cys Lys Leu
130 135 140
Ser Leu Glu Gly Asp His Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val
145 150 155 160
Lys Pro Tyr Thr Asn Phe Asp Ala Glu
165
<210> 29
<211> 157
<212> PRT
<213> Artificial Sequence
<220>
<223> Z14Mad5Anaxa
<400> 29
Met His His His His His His Lys Arg Tyr Lys Asn Arg Val Ala Ser
1 5 10 15
Arg Lys Ser Arg Ala Lys Phe Lys Gln Leu Leu Gln His Tyr Arg Glu
20 25 30
Val Ala Ala Ala Lys Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala
35 40 45
Ala His Ala Glu Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly
50 55 60
Ala Leu Lys Val Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe
65 70 75 80
Ala Lys Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala
85 90 95
Val Asp Lys Ala Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn
100 105 110
Phe Glu Lys Leu Thr Glu Trp Thr Gly Ser Ser Thr Val His Glu Ile
115 120 125
Leu Cys Lys Leu Ser Leu Glu Gly Asp His Ser Thr Pro Pro Ser Ala
130 135 140
Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe Asp Ala Glu
145 150 155
<210> 30
<211> 146
<212> PRT
<213> Artificial Sequence
<220>
<223> Z18Mad5Anaxa
<400> 30
Met His His His His His His Arg Glu Val Ala Ala Ala Lys Ser Ser
1 5 10 15
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Glu Ser Leu Lys Ile Ser
20 25 30
Gln Ala Val His Ala Ala His Ala Glu Ile Asn Glu Ala Gly Arg Glu
35 40 45
Val Val Gly Val Gly Ala Leu Lys Val Pro Arg Asn Gln Asp Trp Leu
50 55 60
Gly Val Pro Arg Phe Ala Lys Phe Ala Ser Phe Glu Ala Gln Gly Ala
65 70 75 80
Leu Ala Asn Ile Ala Val Asp Lys Ala Asn Leu Asp Val Glu Gln Leu
85 90 95
Glu Ser Ile Ile Asn Phe Glu Lys Leu Thr Glu Trp Thr Gly Ser Ser
100 105 110
Thr Val His Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His Ser
115 120 125
Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe Asp
130 135 140
Ala Glu
145
<210> 31
<211> 212
<212> PRT
<213> Artificial Sequence
<220>
<223> EDAZ14Mad5
<400> 31
Met His His His His His His Asn Ile Asp Arg Pro Lys Gly Leu Ala
1 5 10 15
Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu Ser Pro
20 25 30
Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser Pro Glu Asp
35 40 45
Gly Ile Arg Glu Leu Phe Pro Ala Pro Asp Gly Glu Asp Asp Thr Ala
50 55 60
Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr Thr Val Ser Val Val
65 70 75 80
Ala Leu His Asp Asp Met Glu Ser Gln Pro Leu Ile Gly Ile Gln Ser
85 90 95
Thr Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys
100 105 110
Phe Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Glu
115 120 125
Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala His Ala Glu Ile Asn
130 135 140
Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala Leu Lys Val Pro Arg
145 150 155 160
Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala Lys Phe Ala Ser Phe
165 170 175
Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn Leu
180 185 190
Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu Thr Glu
195 200 205
Trp Thr Gly Ser
210
<210> 32
<211> 201
<212> PRT
<213> Artificial Sequence
<220>
<223> EDAZ18Mad5
<400> 32
Met His His His His His His Asn Ile Asp Arg Pro Lys Gly Leu Ala
1 5 10 15
Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu Ser Pro
20 25 30
Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser Pro Glu Asp
35 40 45
Gly Ile Arg Glu Leu Phe Pro Ala Pro Asp Gly Glu Asp Asp Thr Ala
50 55 60
Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr Thr Val Ser Val Val
65 70 75 80
Ala Leu His Asp Asp Met Glu Ser Gln Pro Leu Ile Gly Ile Gln Ser
85 90 95
Thr Arg Glu Val Ala Ala Ala Lys Ser Ser Glu Asn Asp Arg Leu Arg
100 105 110
Leu Leu Leu Lys Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala
115 120 125
His Ala Glu Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala
130 135 140
Leu Lys Val Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala
145 150 155 160
Lys Phe Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val
165 170 175
Asp Lys Ala Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe
180 185 190
Glu Lys Leu Thr Glu Trp Thr Gly Ser
195 200
<210> 33
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad8Anaxa
<400> 33
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Val Thr Tyr His Ser Pro
35 40 45
Ser Tyr Val Tyr His Gln Phe Glu Arg Arg Ala Ile Leu Asn Arg Leu
50 55 60
Val Gln Phe Ile Lys Asp Arg Ile Ser Val Val Gln Ala Leu Val Leu
65 70 75 80
Thr Ser Thr Val His Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp
85 90 95
His Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn
100 105 110
Phe Asp Ala Glu
115
<210> 34
<211> 182
<212> PRT
<213> Artificial Sequence
<220>
<223> EDAMad5
<400> 34
Met His His His His His His Asn Ile Asp Arg Pro Lys Gly Leu Ala
1 5 10 15
Phe Thr Asp Val Asp Val Asp Ser Ile Lys Ile Ala Trp Glu Ser Pro
20 25 30
Gln Gly Gln Val Ser Arg Tyr Arg Val Thr Tyr Ser Ser Pro Glu Asp
35 40 45
Gly Ile Arg Glu Leu Phe Pro Ala Pro Asp Gly Glu Asp Asp Thr Ala
50 55 60
Glu Leu Gln Gly Leu Arg Pro Gly Ser Glu Tyr Thr Val Ser Val Val
65 70 75 80
Ala Leu His Asp Asp Met Glu Ser Gln Pro Leu Ile Gly Ile Gln Ser
85 90 95
Thr Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala His Ala Glu
100 105 110
Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala Leu Lys Val
115 120 125
Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala Lys Phe Ala
130 135 140
Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala
145 150 155 160
Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu
165 170 175
Thr Glu Trp Thr Gly Ser
180
<210> 35
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> SIINFEKL OVACD8 peptide
<400> 35
Ser Ile Ile Asn Phe Glu Lys Leu
1 5
<210> 36
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Mad8
<400> 36
Val Thr Tyr His Ser Pro Ser Tyr Ala Tyr His Gln Phe Glu Arg Arg
1 5 10 15
Ala Ile Leu Asn Arg Leu Val Gln Phe Ile Lys Asp Arg Ile
20 25 30
<210> 37
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> Mad11
<400> 37
Asn Tyr Arg Ile Ala Thr Phe Lys Asn Trp Pro Phe Leu Glu Asp Cys
1 5 10 15
Ala Met Glu Glu Leu Thr Val Ser Glu Phe Leu Lys Leu Asp Arg Gln
20 25 30
Arg
<210> 38
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Mad9
<400> 38
His Leu Glu Leu Ala Ser Met Thr Asn Met Glu Leu Met Ser Ser Ile
1 5 10 15
Val
<210> 39
<211> 50
<212> PRT
<213> Artificial Sequence
<220>
<223> Mad12
<400> 39
Leu Phe Arg Ala Ala Gln Leu Ala Asn Asp Val Val Leu Gln Ile Met
1 5 10 15
Glu His Leu Glu Leu Ala Ser Met Thr Asn Met Glu Leu Met Ser Ser
20 25 30
Ile Val Val Ile Ser Ala Ser Ile Ile Val Phe Asn Leu Leu Glu Leu
35 40 45
Glu Gly
50
<210> 40
<211> 90
<212> PRT
<213> Artificial Sequence
<220>
<223> EDA
<400> 40
Asn Ile Asp Arg Pro Lys Gly Leu Ala Phe Thr Asp Val Asp Val Asp
1 5 10 15
Ser Ile Lys Ile Ala Trp Glu Ser Pro Gln Gly Gln Val Ser Arg Tyr
20 25 30
Arg Val Thr Tyr Ser Ser Pro Glu Asp Gly Ile Arg Glu Leu Phe Pro
35 40 45
Ala Pro Asp Gly Glu Asp Asp Thr Ala Glu Leu Gln Gly Leu Arg Pro
50 55 60
Gly Ser Glu Tyr Thr Val Ser Val Val Ala Leu His Asp Asp Met Glu
65 70 75 80
Ser Gln Pro Leu Ile Gly Ile Gln Ser Thr
85 90
<210> 41
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad8Anaxa
<400> 41
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Val Thr Tyr His Ser Pro
35 40 45
Ser Tyr Ala Tyr His Gln Phe Glu Arg Arg Ala Ile Leu Asn Arg Leu
50 55 60
Val Gln Phe Ile Lys Asp Arg Ile Ser Val Val Gln Ala Leu Val Leu
65 70 75 80
Thr Ser Thr Val His Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp
85 90 95
His Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn
100 105 110
Phe Asp Ala Glu
115
<210> 42
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad11Anaxa
<400> 42
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Asn Tyr Arg Ile Ala Thr
35 40 45
Phe Lys Asn Trp Pro Phe Leu Glu Asp Cys Ala Met Glu Glu Leu Thr
50 55 60
Val Ser Glu Phe Leu Lys Leu Asp Arg Gln Arg Ser Thr Val His Glu
65 70 75 80
Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His Ser Thr Pro Pro Ser
85 90 95
Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe Asp Ala Glu
100 105 110
<210> 43
<211> 94
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad9Anaxa
<400> 43
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys His Leu Glu Leu Ala Ser
35 40 45
Met Thr Asn Met Glu Leu Met Ser Ser Ile Val Ser Thr Val His Glu
50 55 60
Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His Ser Thr Pro Pro Ser
65 70 75 80
Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe Asp Ala Glu
85 90
<210> 44
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> TatFMad5Anaxa
<400> 44
Arg Lys Lys Arg Arg Gln Arg Arg Arg Arg Val Lys Arg Ile Ser Gln
1 5 10 15
Ala Val His Ala Ala His Ala Glu Ile Asn Glu Ala Gly Arg Arg Val
20 25 30
Lys Arg Lys Val Pro Arg Asn Gln Asp Trp Leu Arg Val Lys Arg Ala
35 40 45
Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala
50 55 60
Arg Val Lys Arg Ser Ile Ile Asn Phe Glu Lys Leu Arg Val Lys Arg
65 70 75 80
Ser Thr Val His Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His
85 90 95
Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe
100 105 110
Asp Ala Glu
115
<210> 45
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad12Anaxa
<400> 45
Lys Arg Tyr Lys Asn Arg Val Ala Ser Arg Lys Ser Arg Ala Lys Phe
1 5 10 15
Lys Gln Leu Leu Gln His Tyr Arg Glu Val Ala Ala Ala Lys Ser Ser
20 25 30
Glu Asn Asp Arg Leu Arg Leu Leu Leu Lys Leu Phe Arg Ala Ala Gln
35 40 45
Leu Ala Asn Asp Val Val Leu Gln Ile Met Glu His Leu Glu Leu Ala
50 55 60
Ser Met Thr Asn Met Glu Leu Met Ser Ser Ile Val Val Ile Ser Ala
65 70 75 80
Ser Ile Ile Val Phe Asn Leu Leu Glu Leu Glu Gly Ser Thr Val His
85 90 95
Glu Ile Leu Cys Lys Leu Ser Leu Glu Gly Asp His Ser Thr Pro Pro
100 105 110
Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe Asp Ala Glu
115 120 125
<210> 46
<211> 134
<212> PRT
<213> Artificial Sequence
<220>
<223> Z13Mad5
<400> 46
Met His His His His His His Lys Arg Tyr Lys Asn Arg Val Ala Ser
1 5 10 15
Arg Lys Ser Arg Ala Lys Phe Lys Gln Leu Leu Gln His Tyr Arg Glu
20 25 30
Val Ala Ala Ala Lys Ser Ser Glu Asn Asp Arg Leu Arg Leu Leu Leu
35 40 45
Lys Glu Ser Leu Lys Ile Ser Gln Ala Val His Ala Ala His Ala Glu
50 55 60
Ile Asn Glu Ala Gly Arg Glu Val Val Gly Val Gly Ala Leu Lys Val
65 70 75 80
Pro Arg Asn Gln Asp Trp Leu Gly Val Pro Arg Phe Ala Lys Phe Ala
85 90 95
Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala
100 105 110
Asn Leu Asp Val Glu Gln Leu Glu Ser Ile Ile Asn Phe Glu Lys Leu
115 120 125
Thr Glu Trp Thr Gly Ser
130
<210> 47
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> TLR peptide agonist: "Anaxa" sequence variant
<400> 47
Ser Thr Val His Glu Ile Leu Ser Lys Leu Ser Leu Glu Gly Asp His
1 5 10 15
Ser Thr Pro Pro Ser Ala Tyr Gly Ser Val Lys Pro Tyr Thr Asn Phe
20 25 30
Asp Ala Glu
35
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИЯ МОДУЛЯТОРА ИММУННЫХ КОНТРОЛЬНЫХ ТОЧЕК И КОМПЛЕКСА, СОДЕРЖАЩЕГО ПРОНИКАЮЩИЙ В КЛЕТКУ ПЕПТИД, КАРГО-МОЛЕКУЛУ И ПЕПТИДНЫЙ АГОНИСТ TLR, ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ | 2017 |
|
RU2769314C1 |
| СЛИТАЯ КОНСТРУКЦИЯ, СОДЕРЖАЩАЯ ПРОНИКАЮЩИЙ В КЛЕТКУ ПЕПТИД, ПОЛИЭПИТОП И ПЕПТИДНЫЙ АГОНИСТ TLR, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2807135C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2782261C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО И СПОСОБ ЕГО ОЦЕНКИ | 2019 |
|
RU2803148C2 |
| Вирусный вектор | 2020 |
|
RU2799418C1 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2020 |
|
RU2838161C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ PD-1 И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2803460C2 |
| БИФУНКЦИОНАЛЬНЫЕ СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2019 |
|
RU2806747C2 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ЯИЧНИКА | 2020 |
|
RU2832172C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2733985C2 |
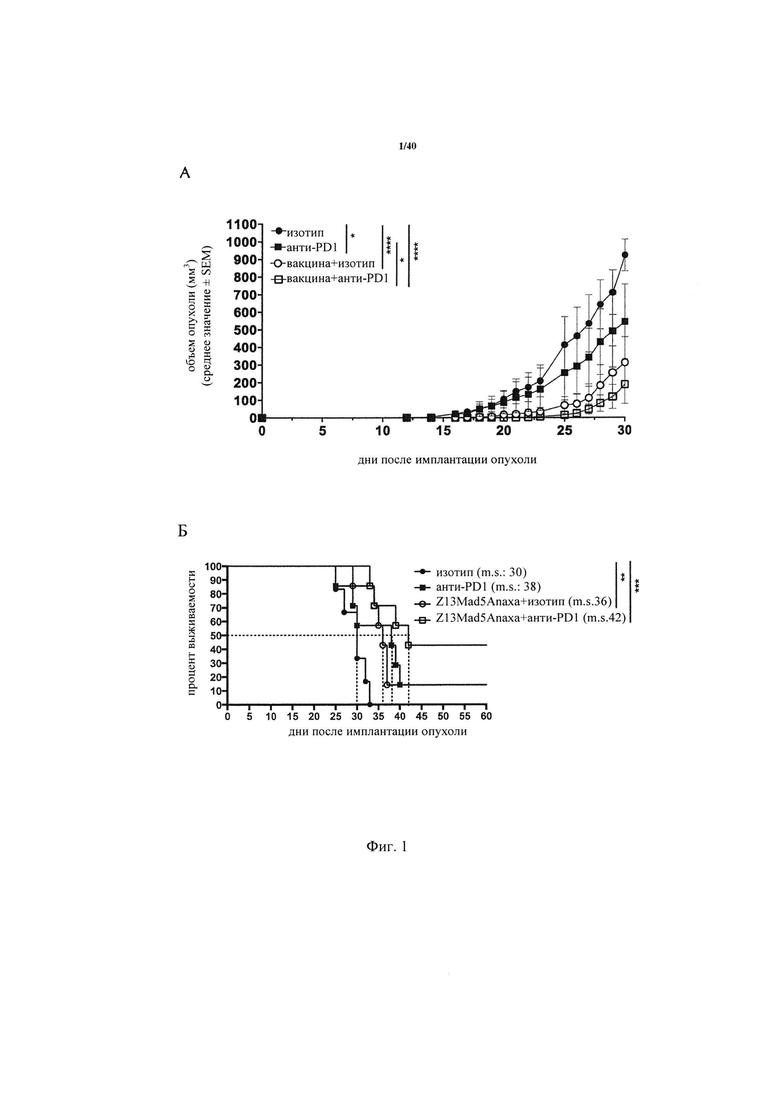
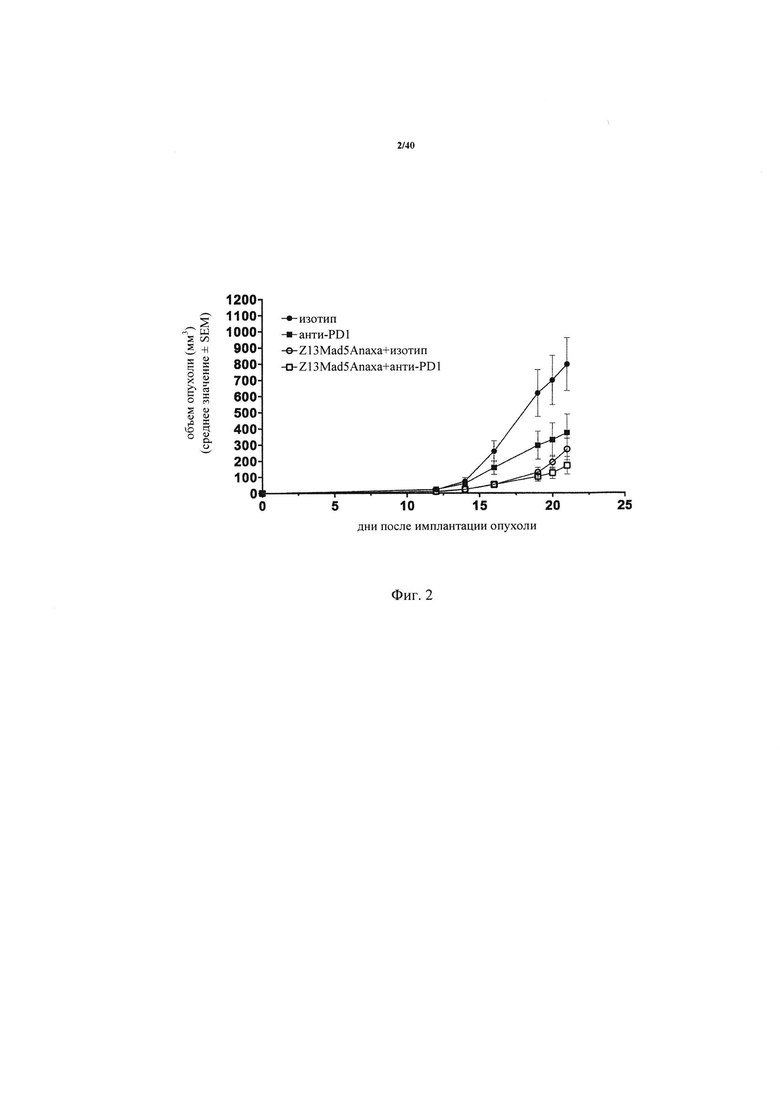
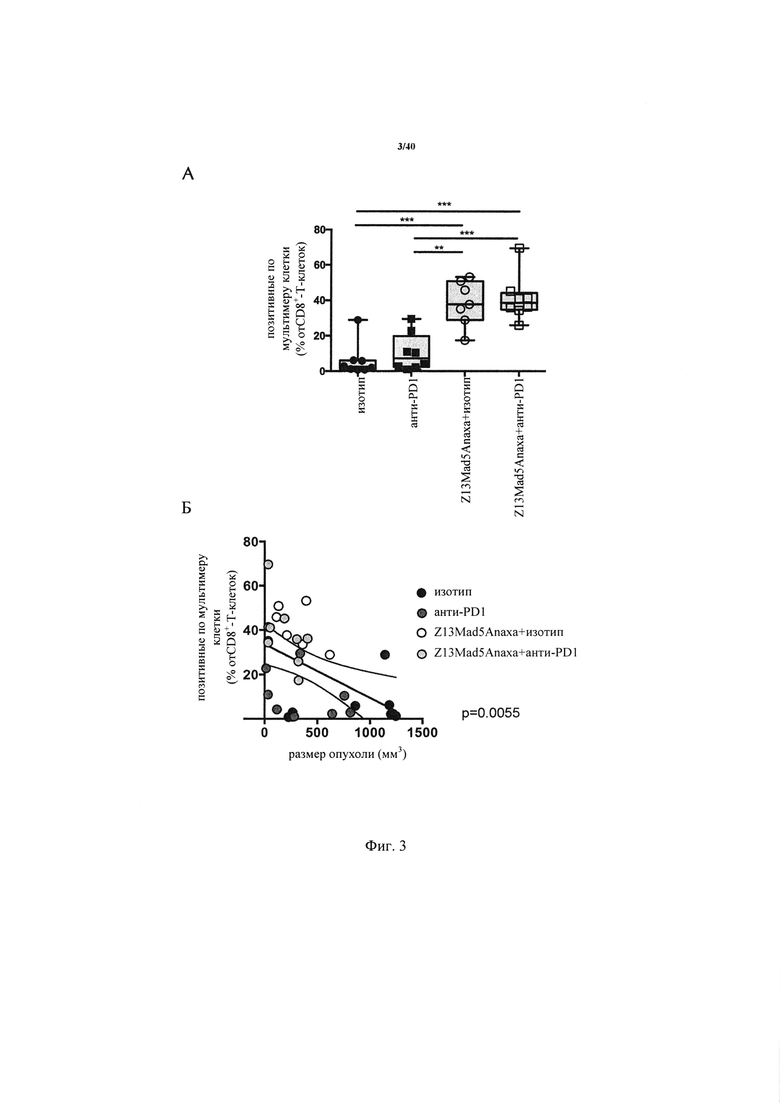
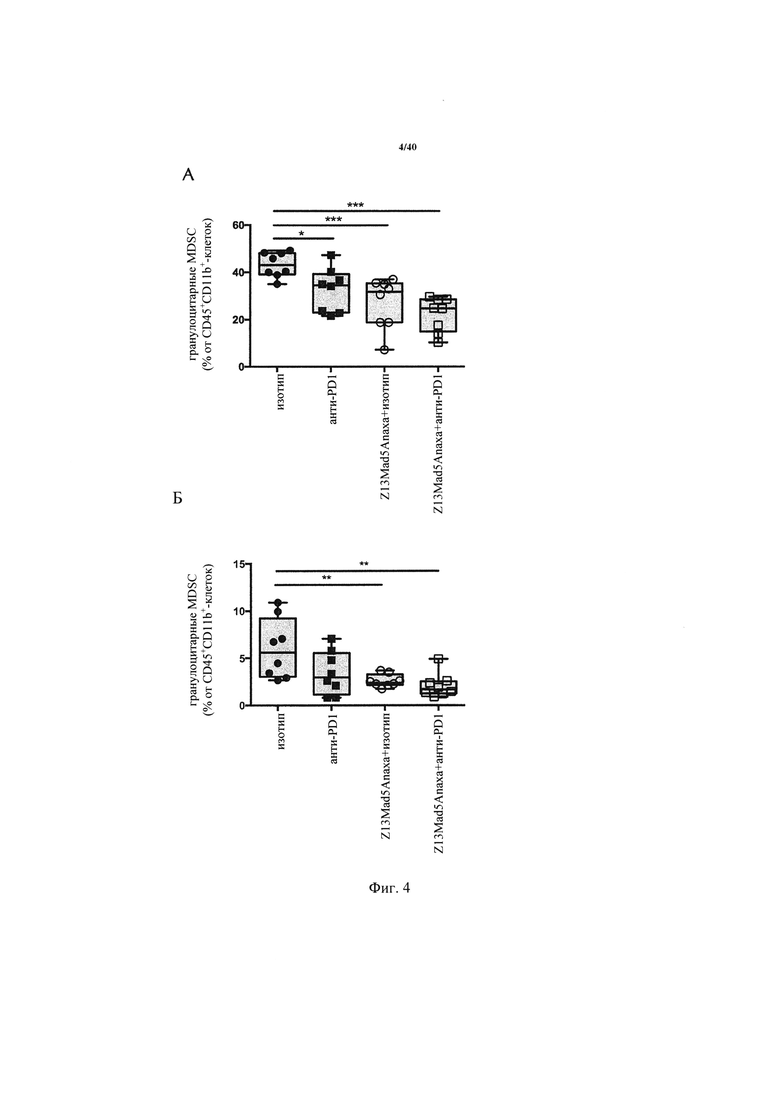
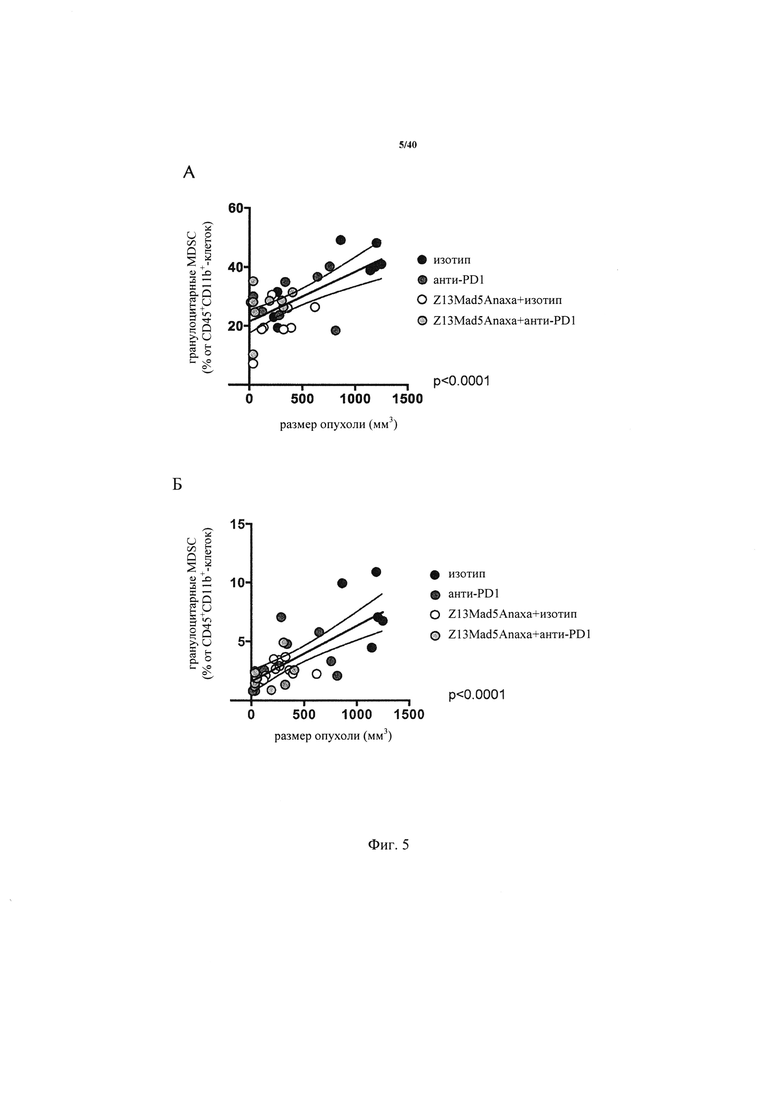
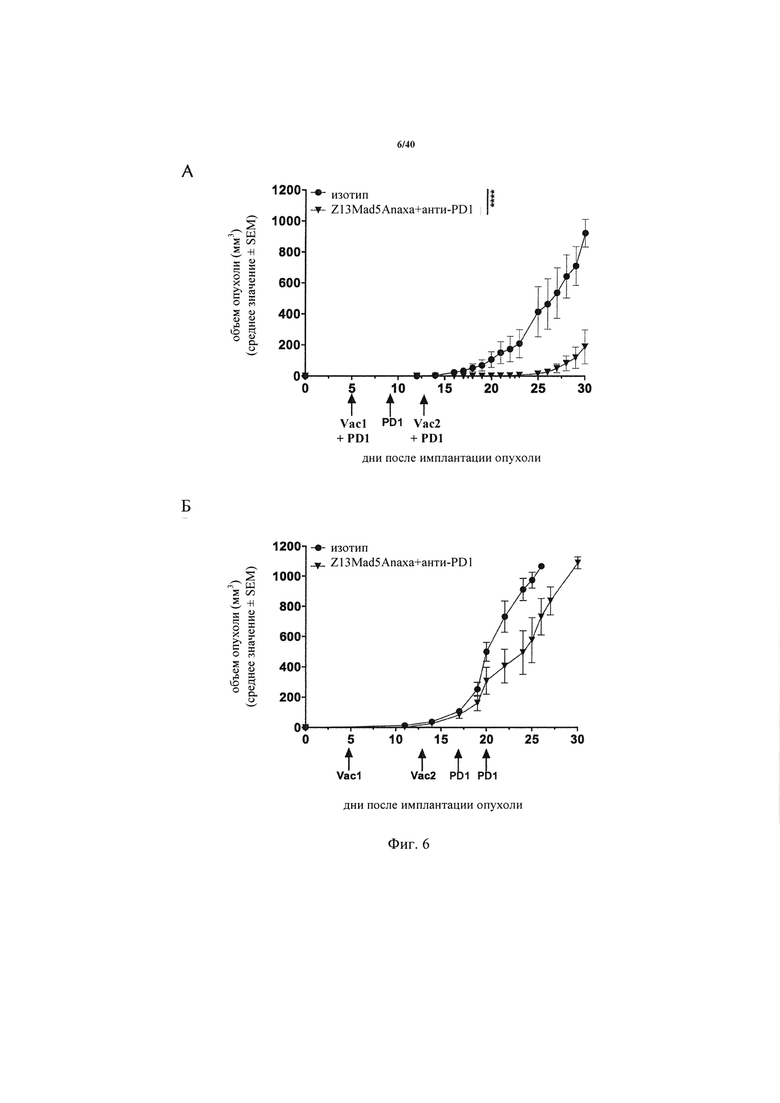
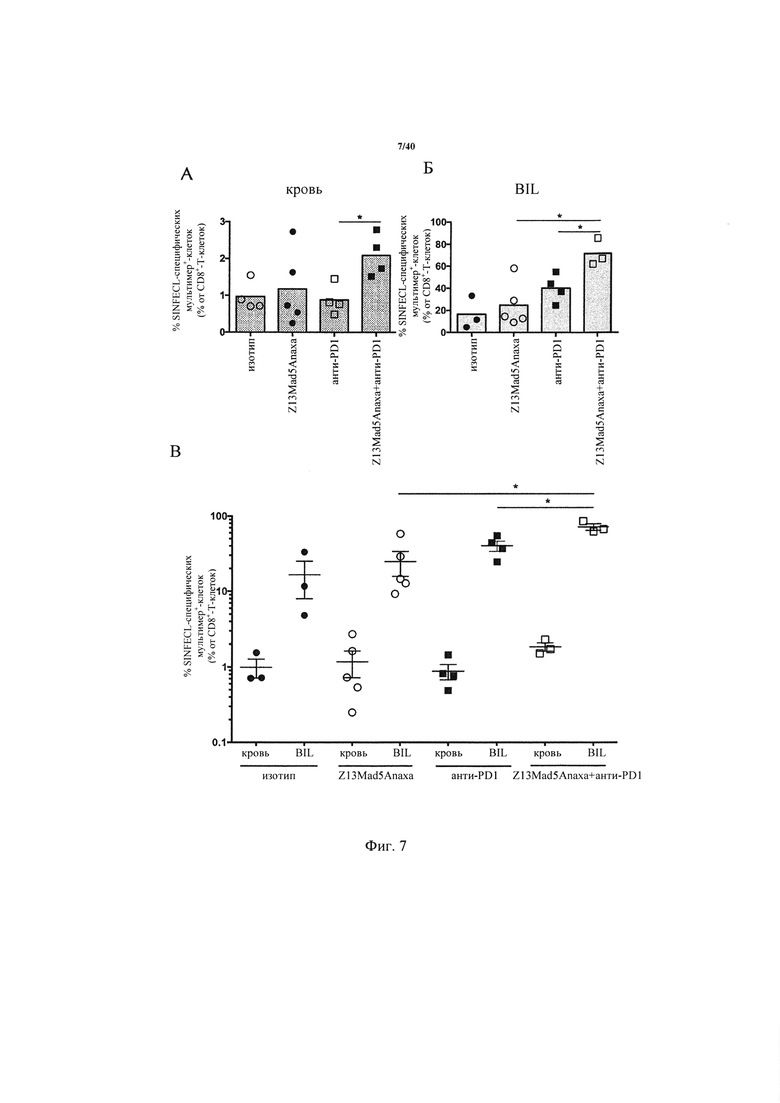
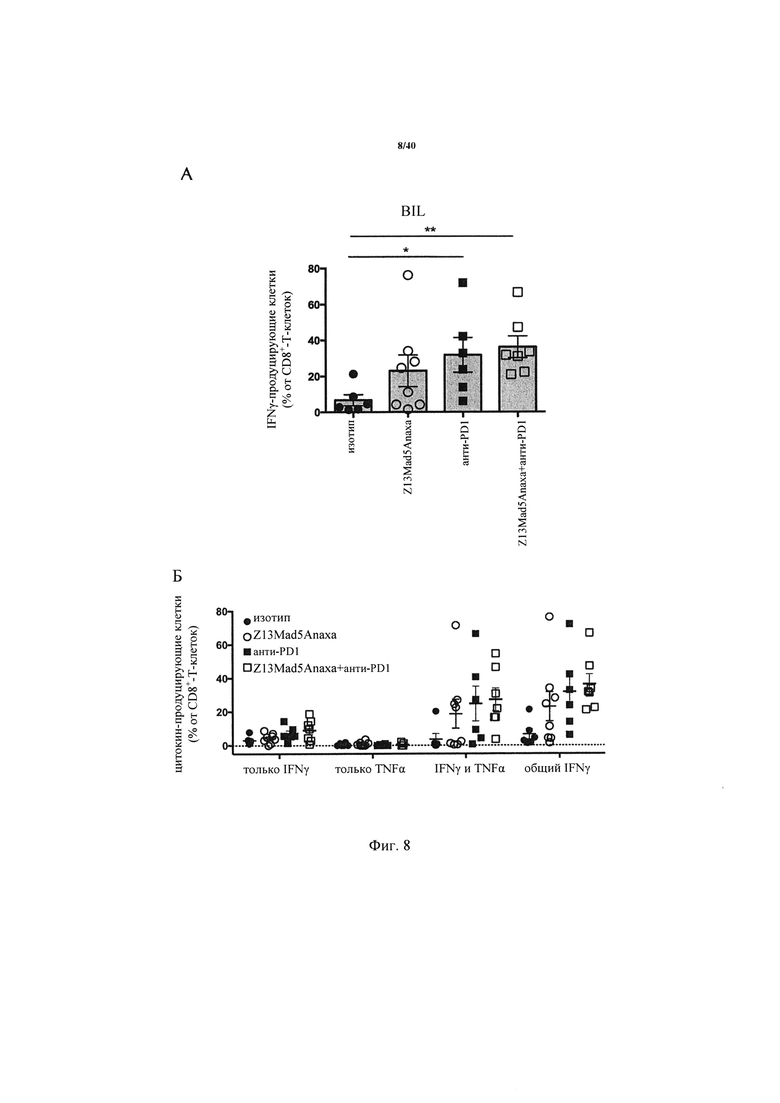

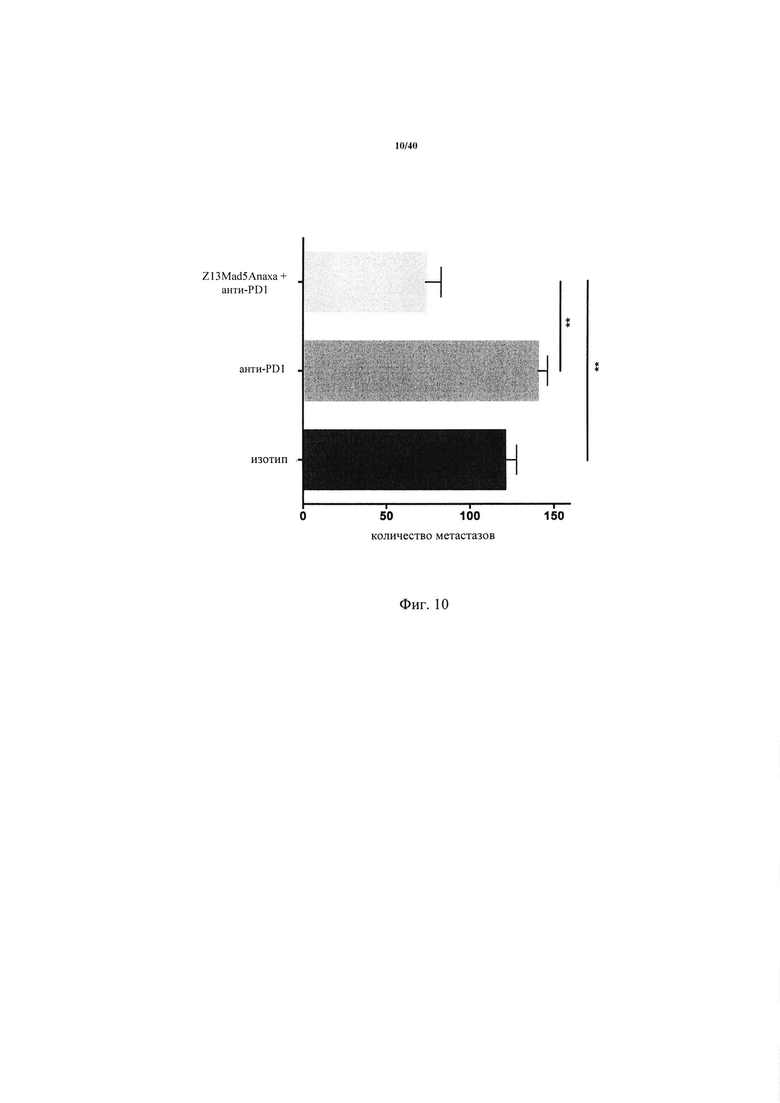
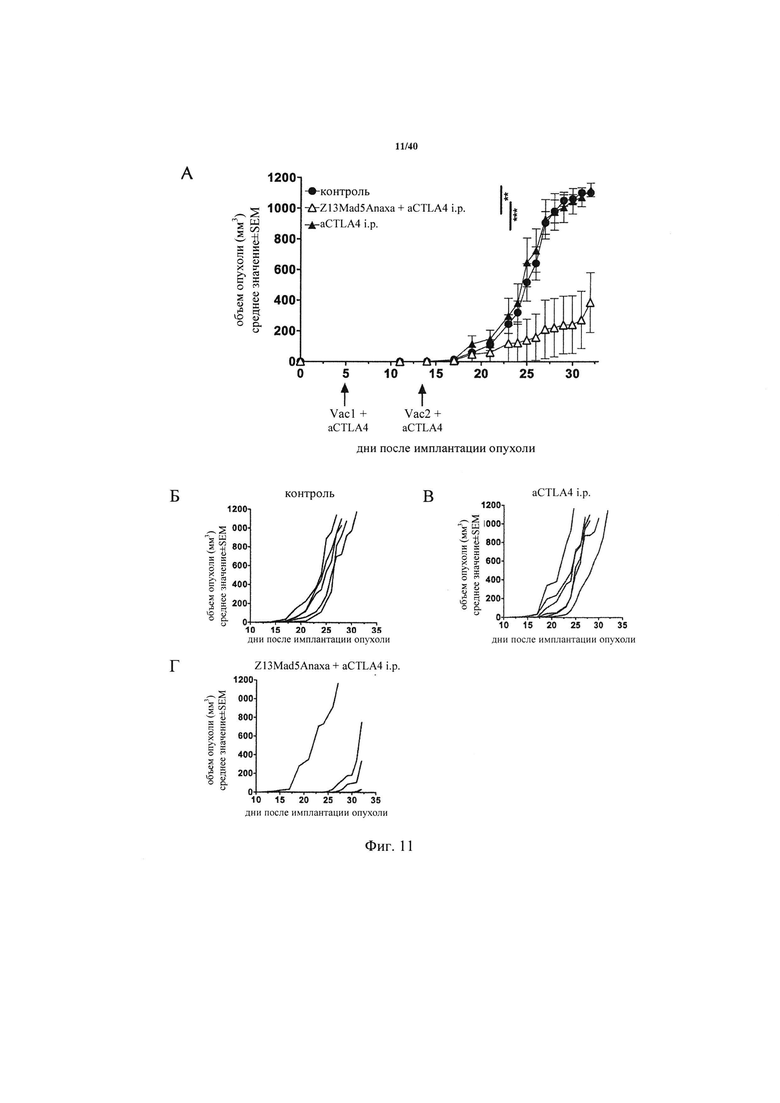
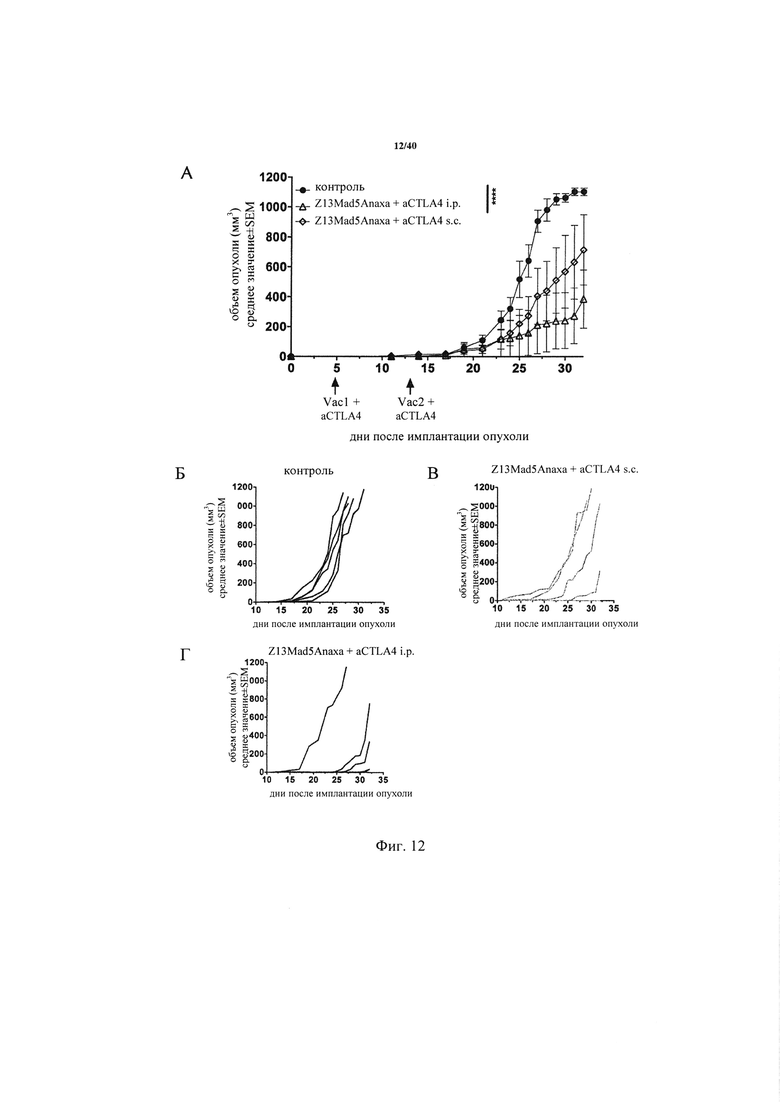
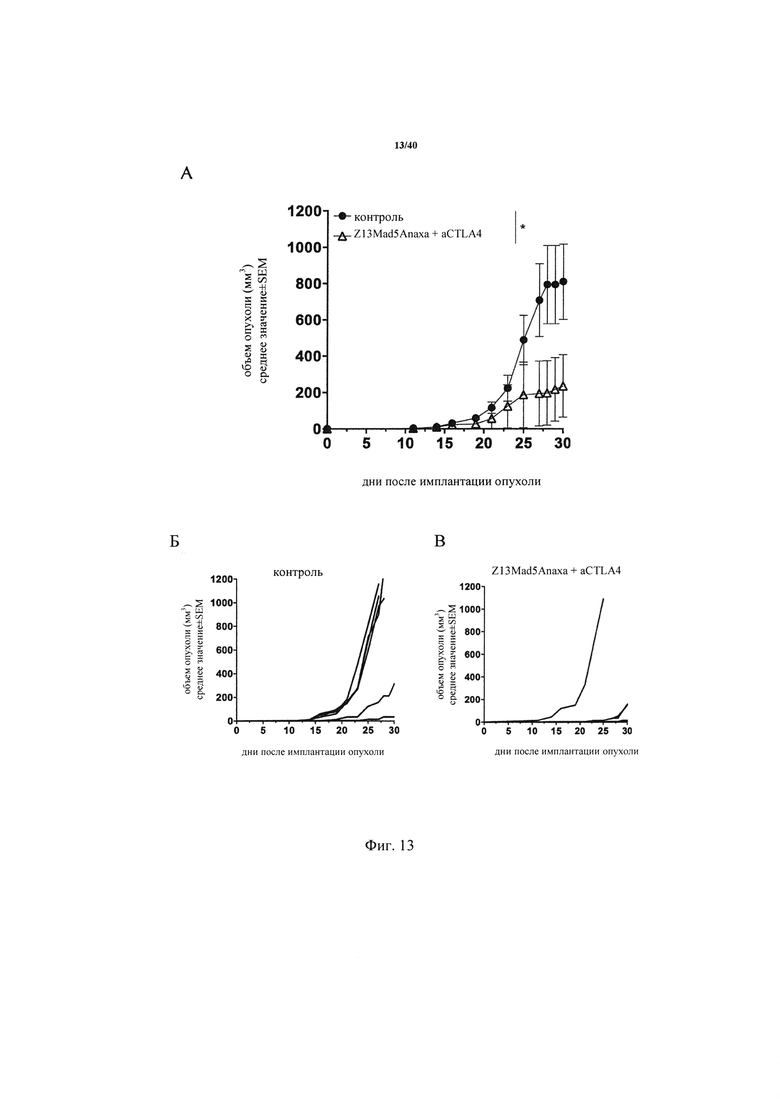
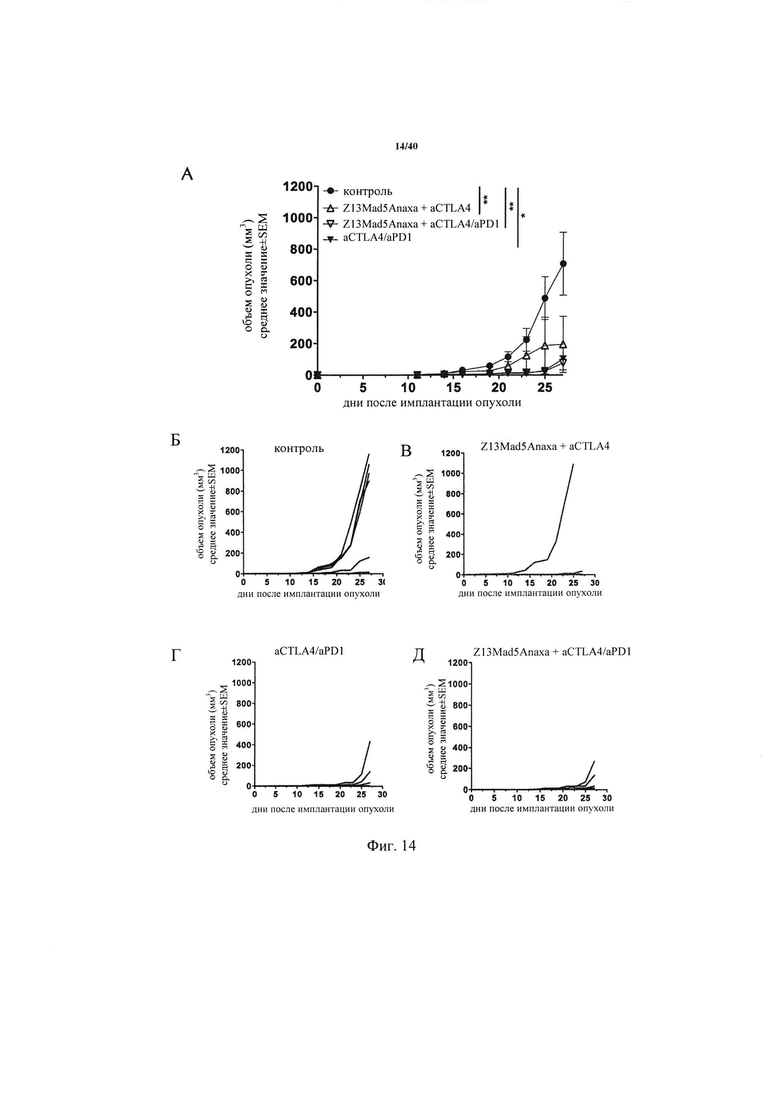
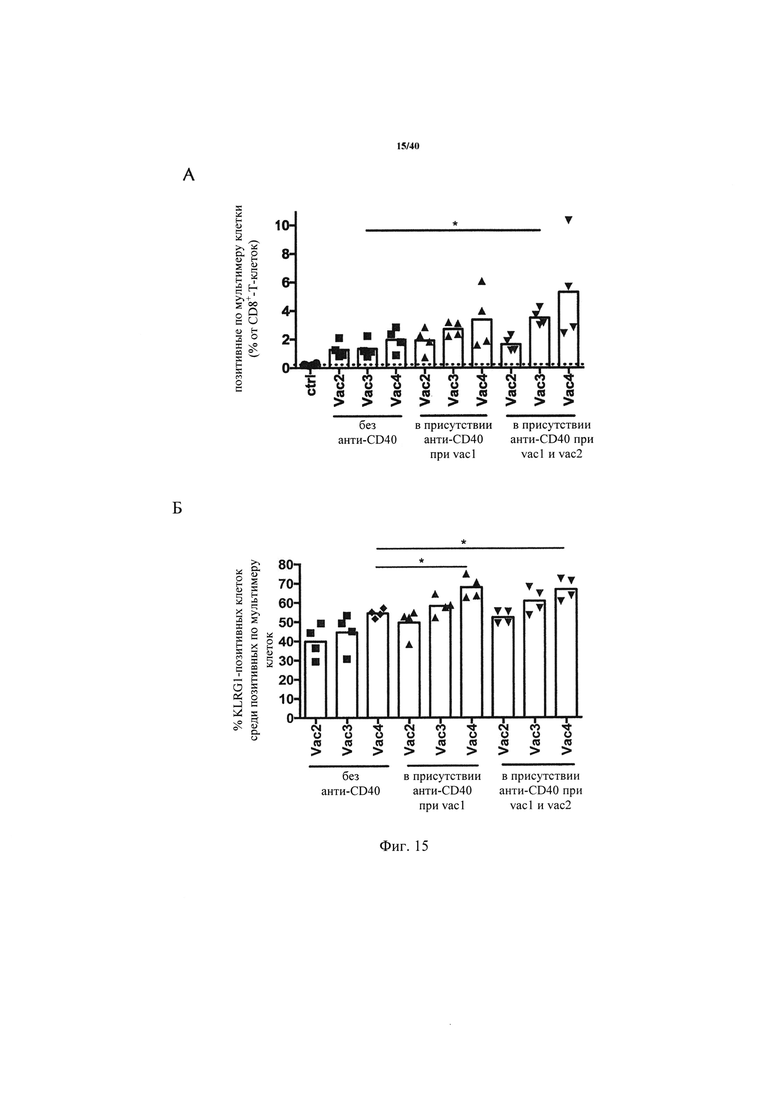
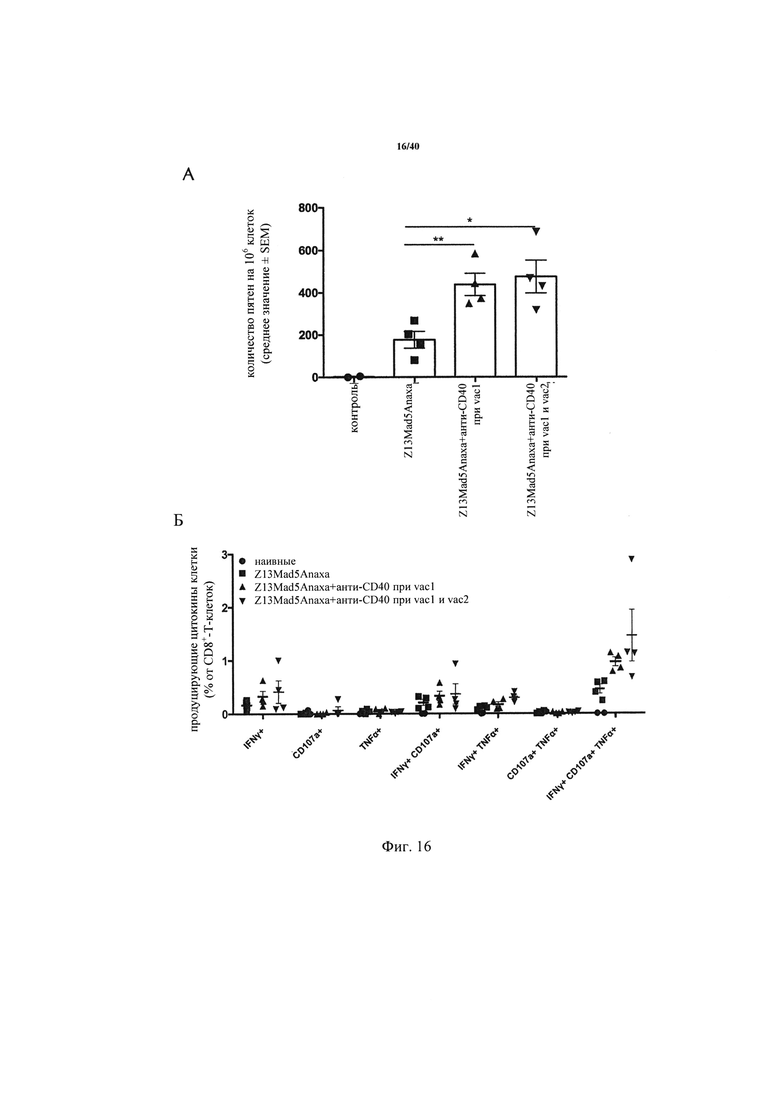
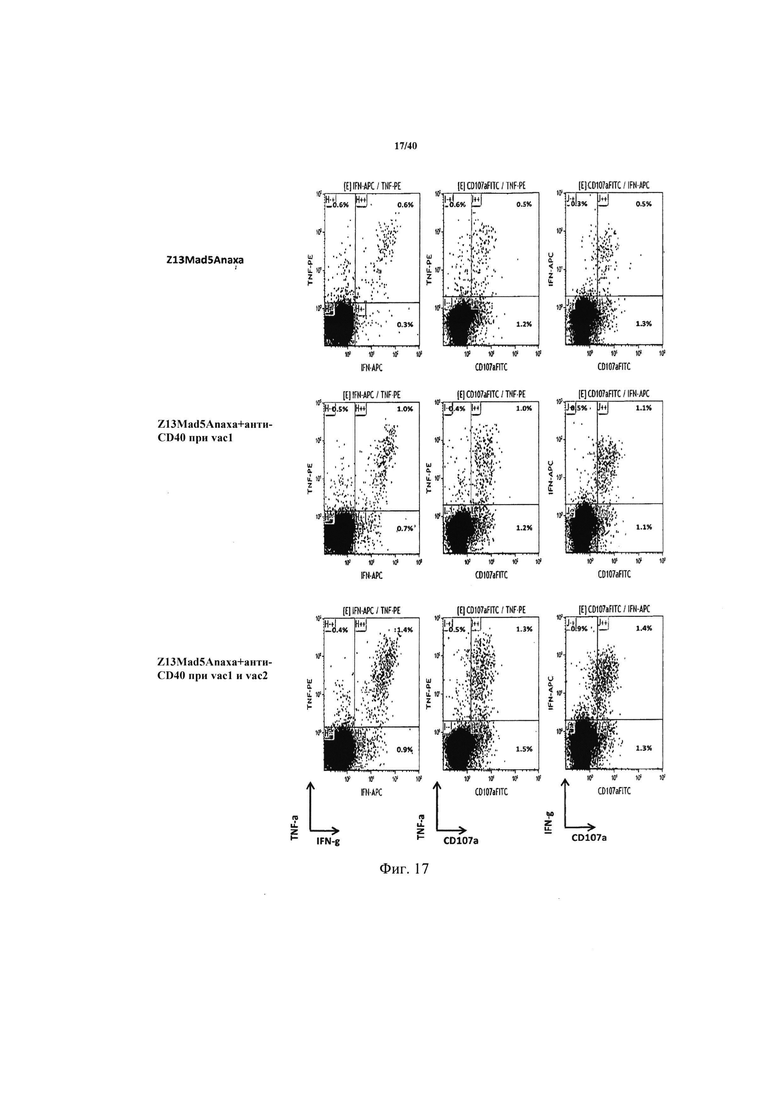
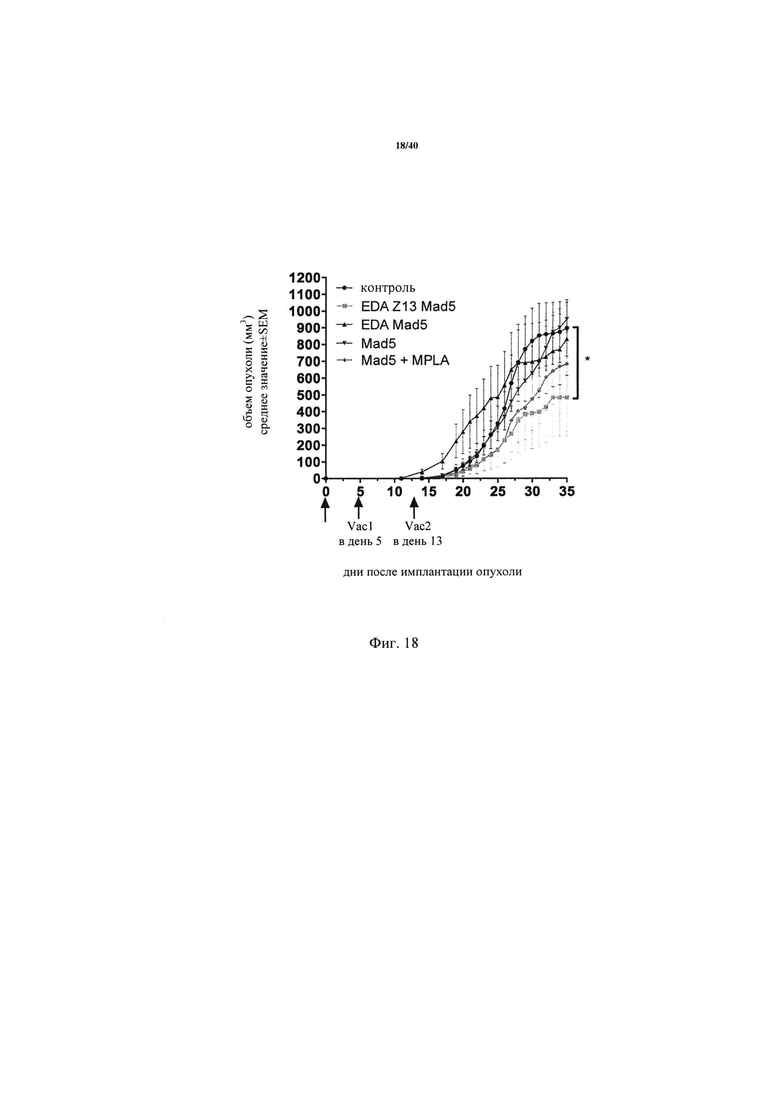
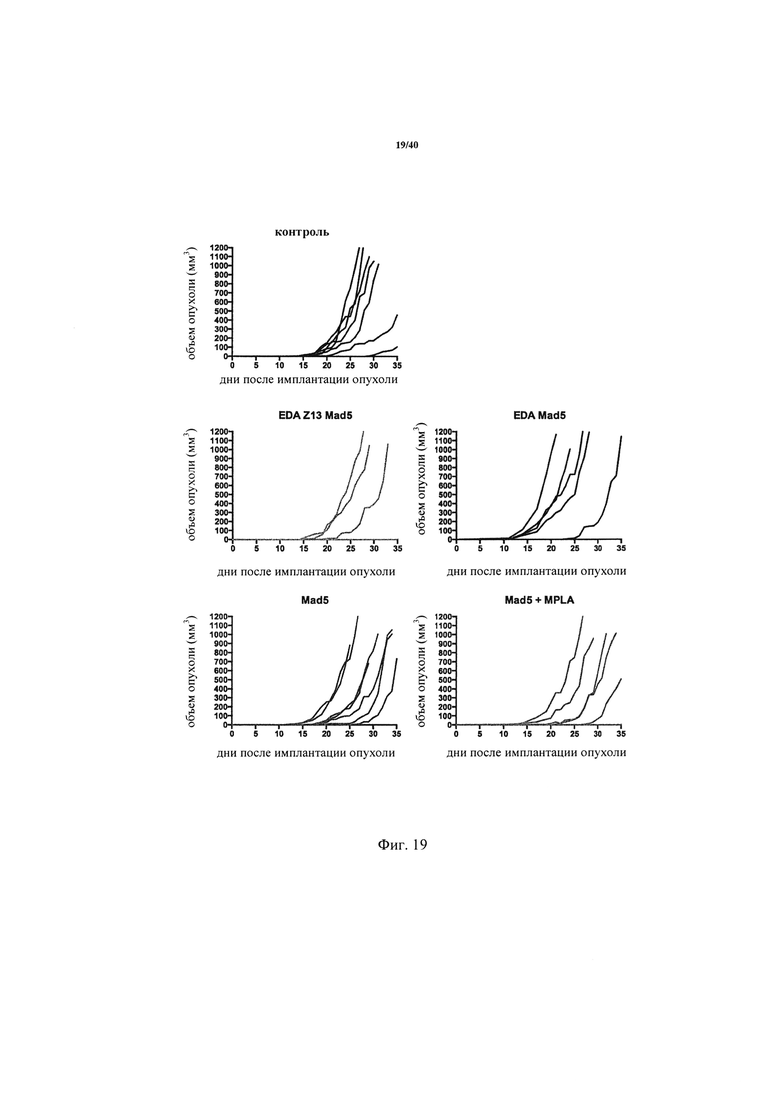
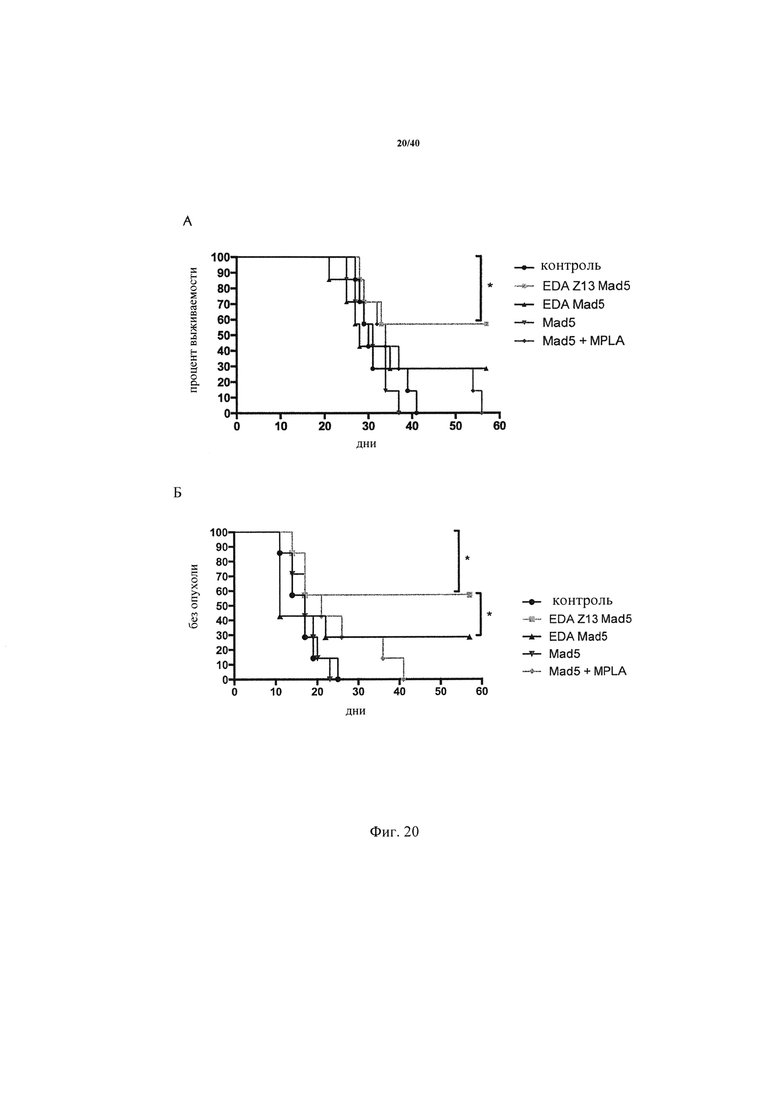
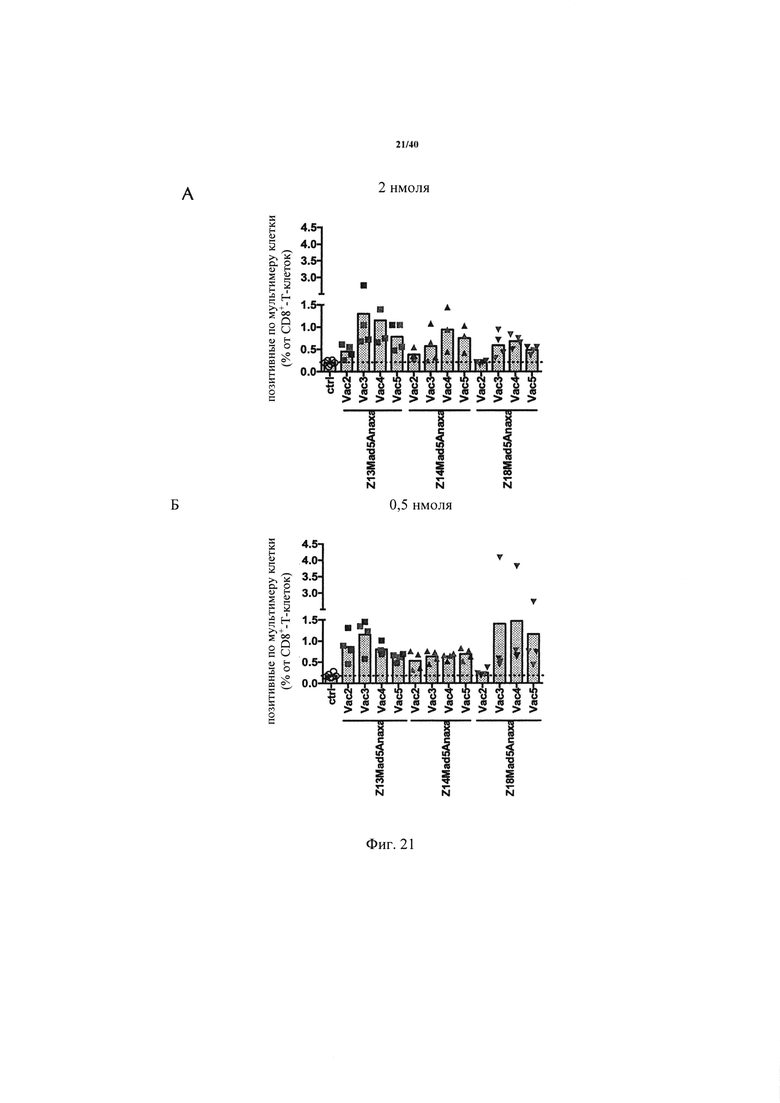
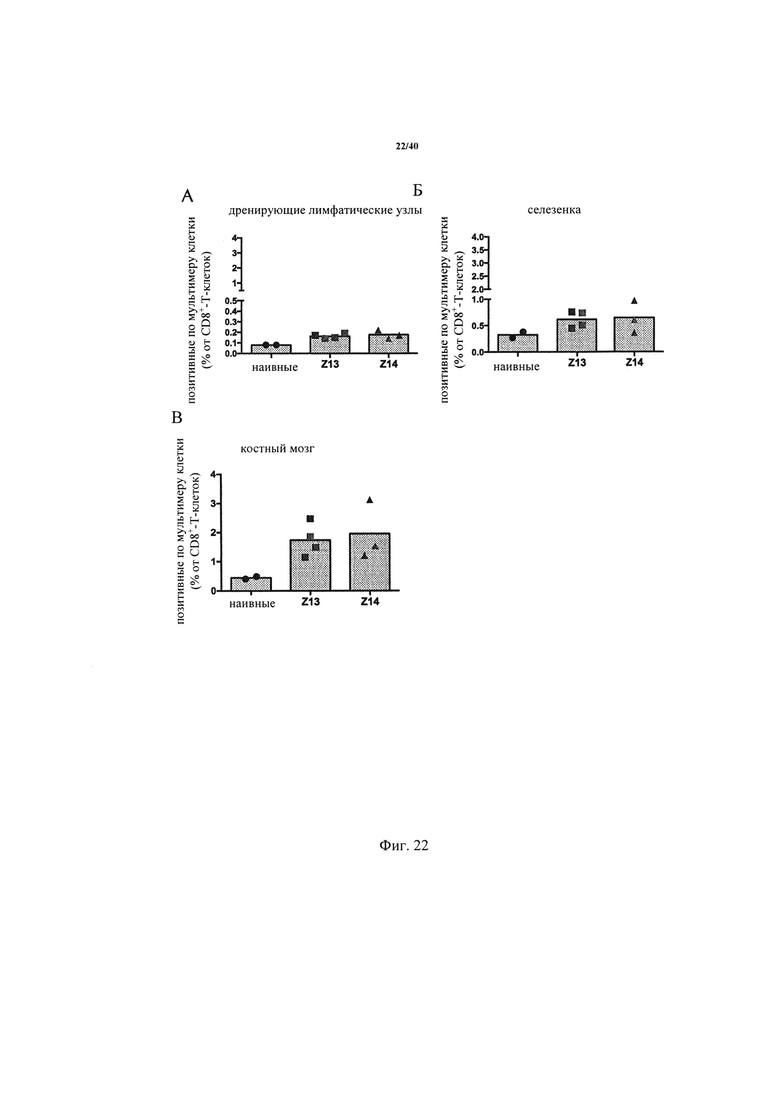
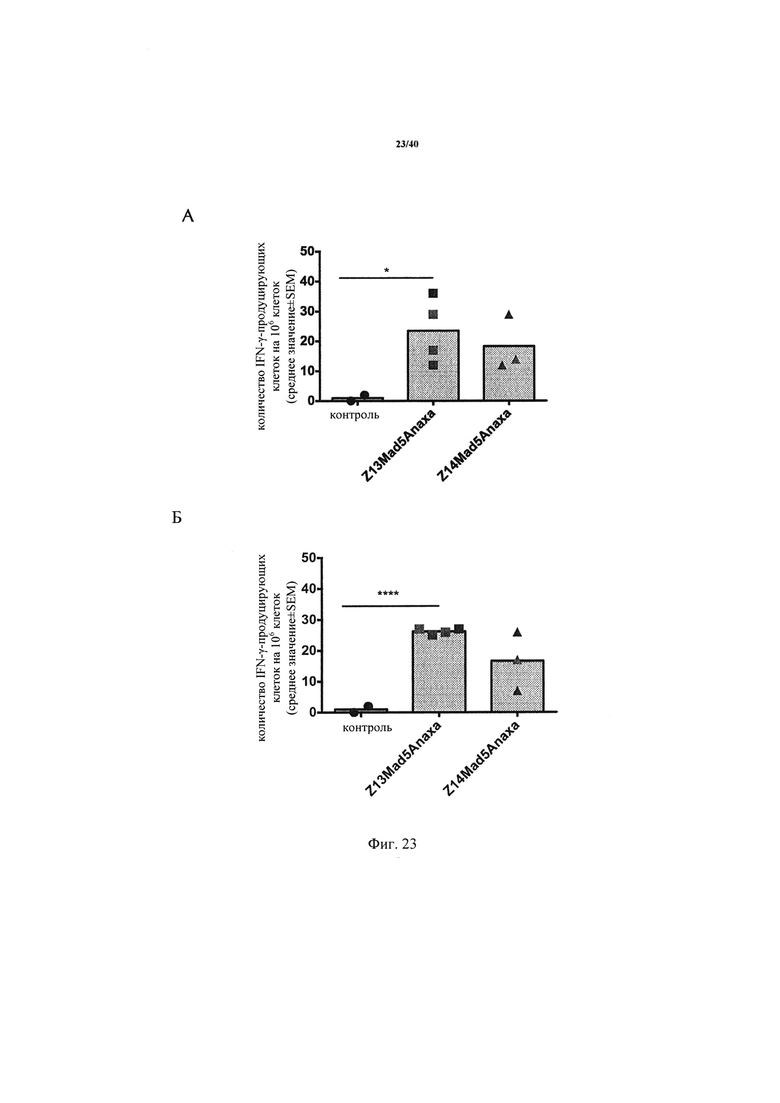
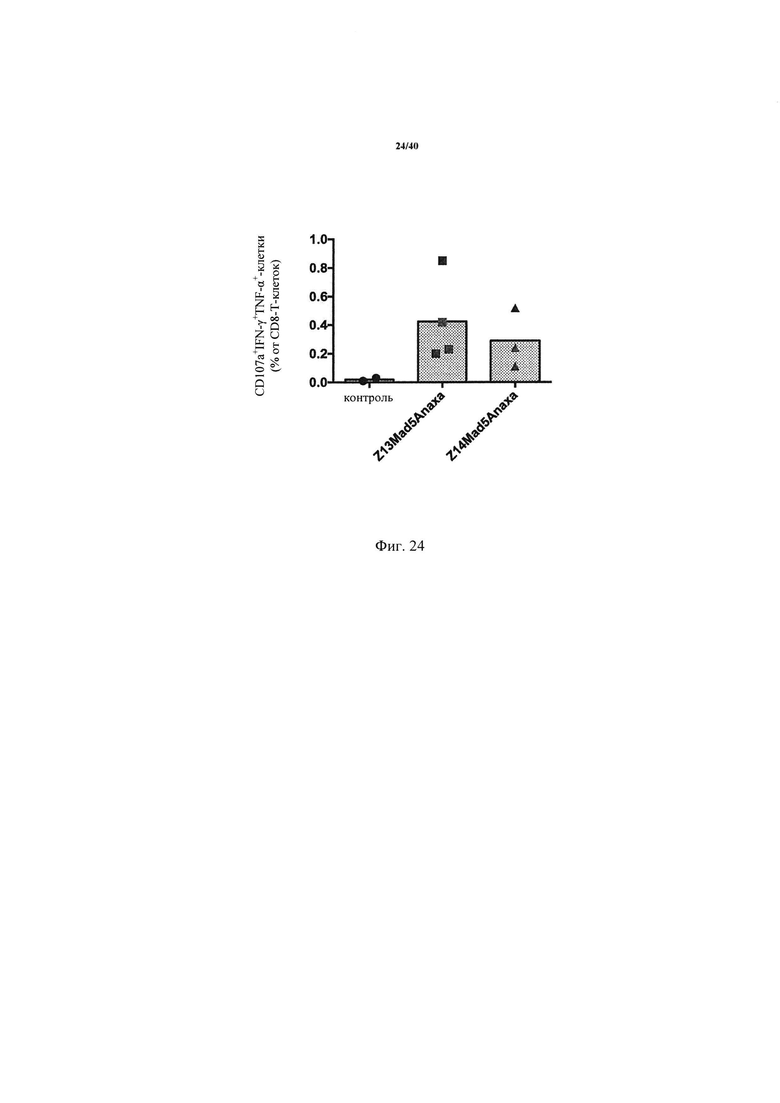
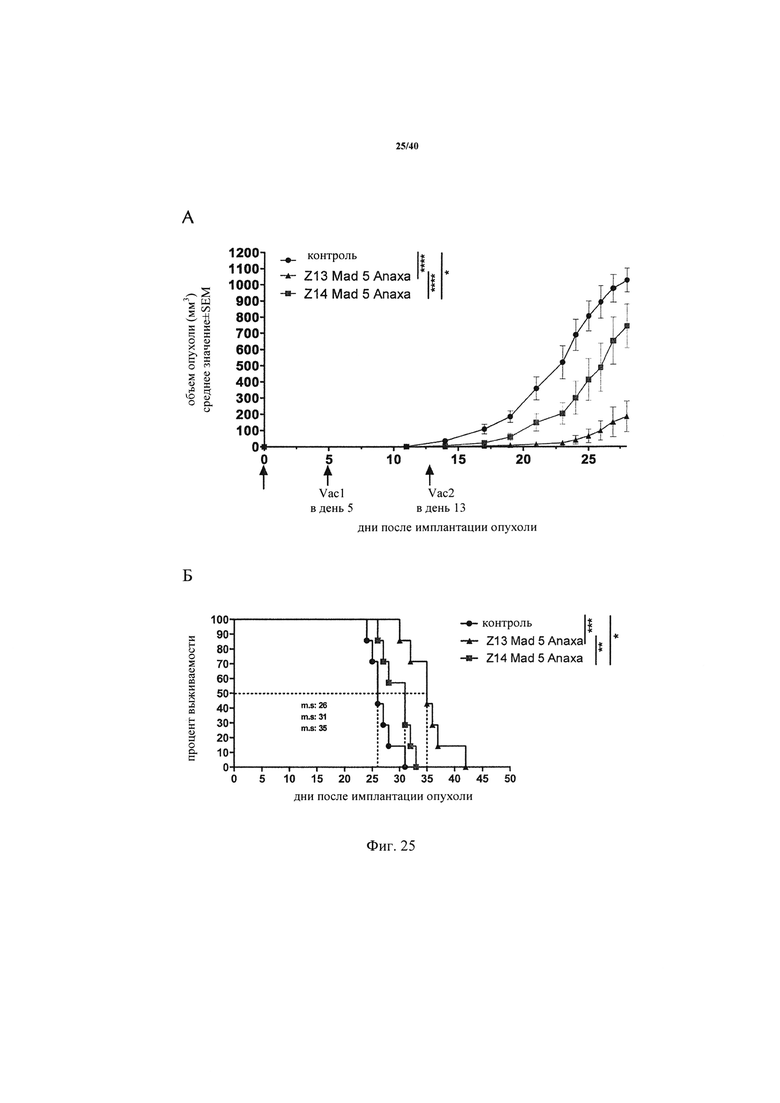
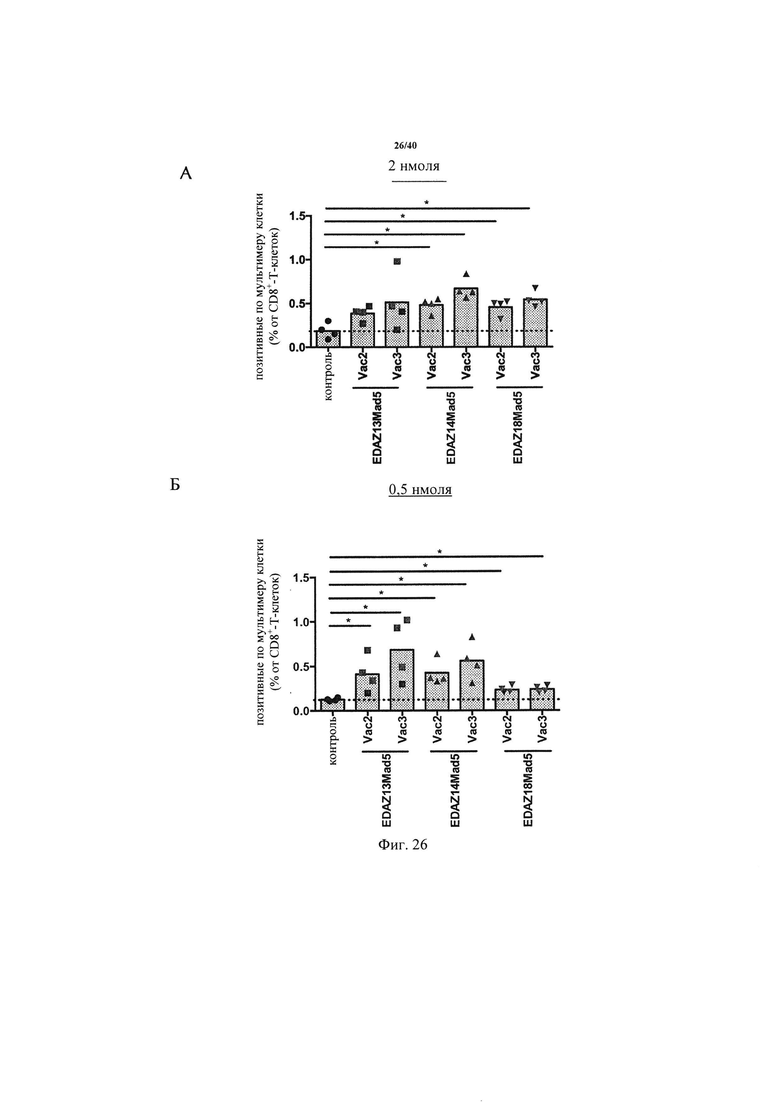
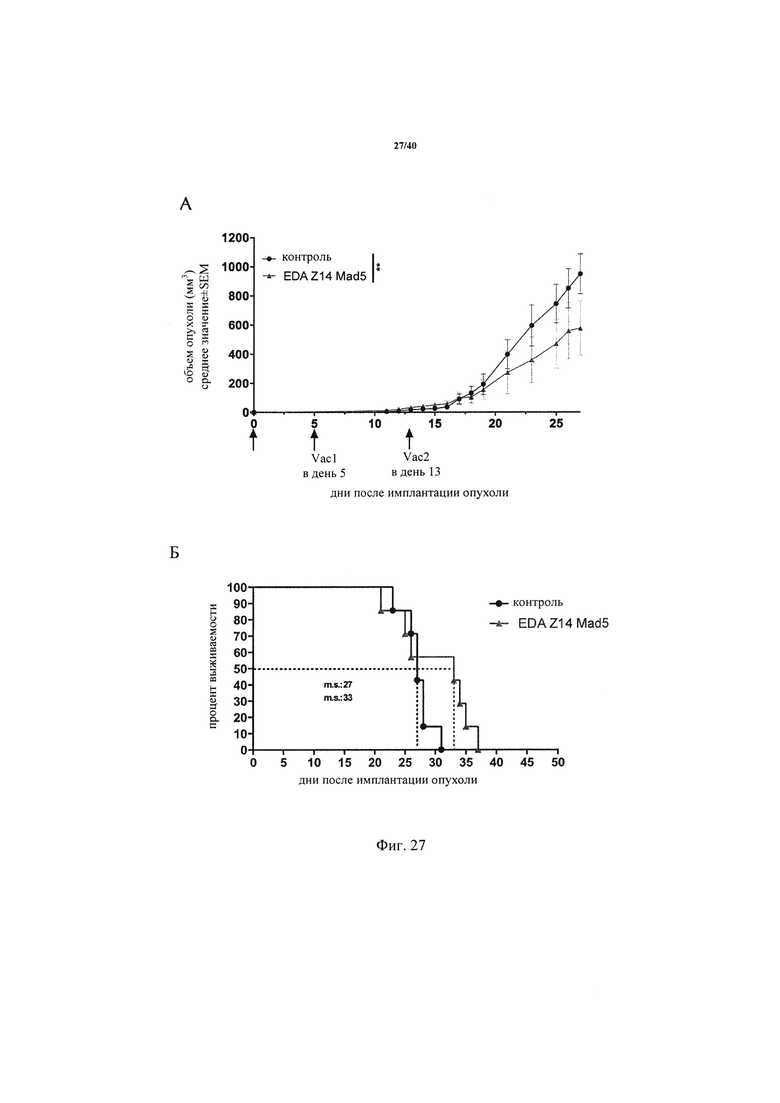
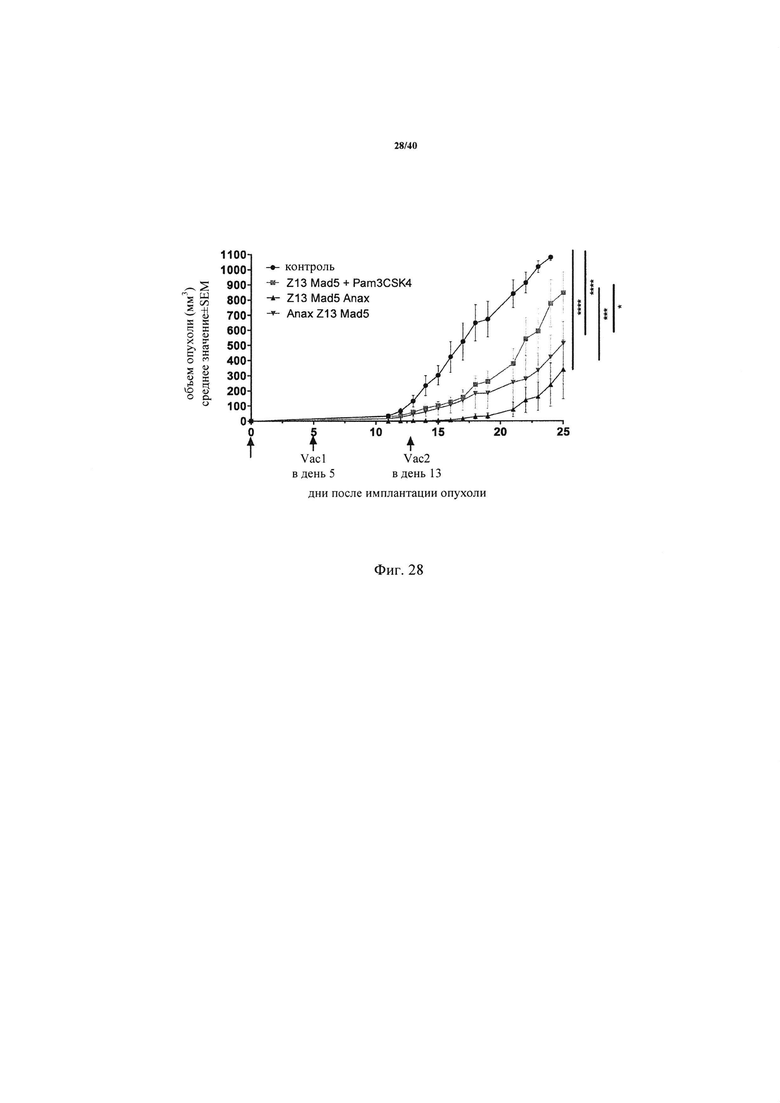
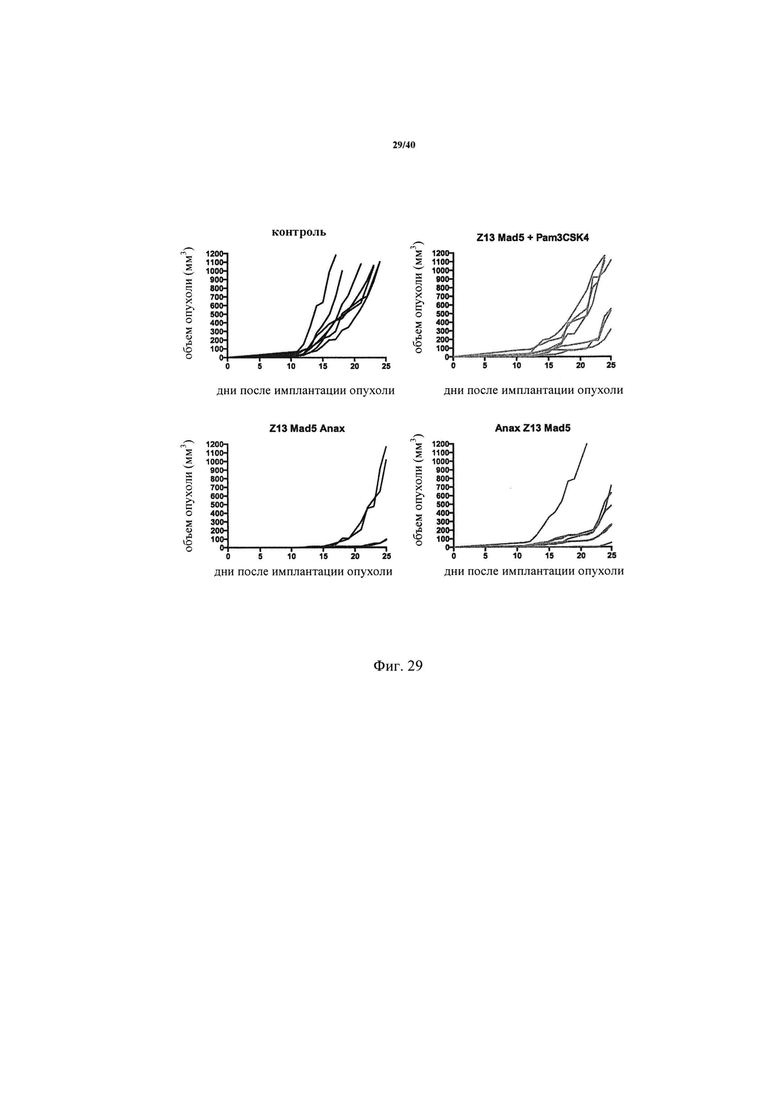
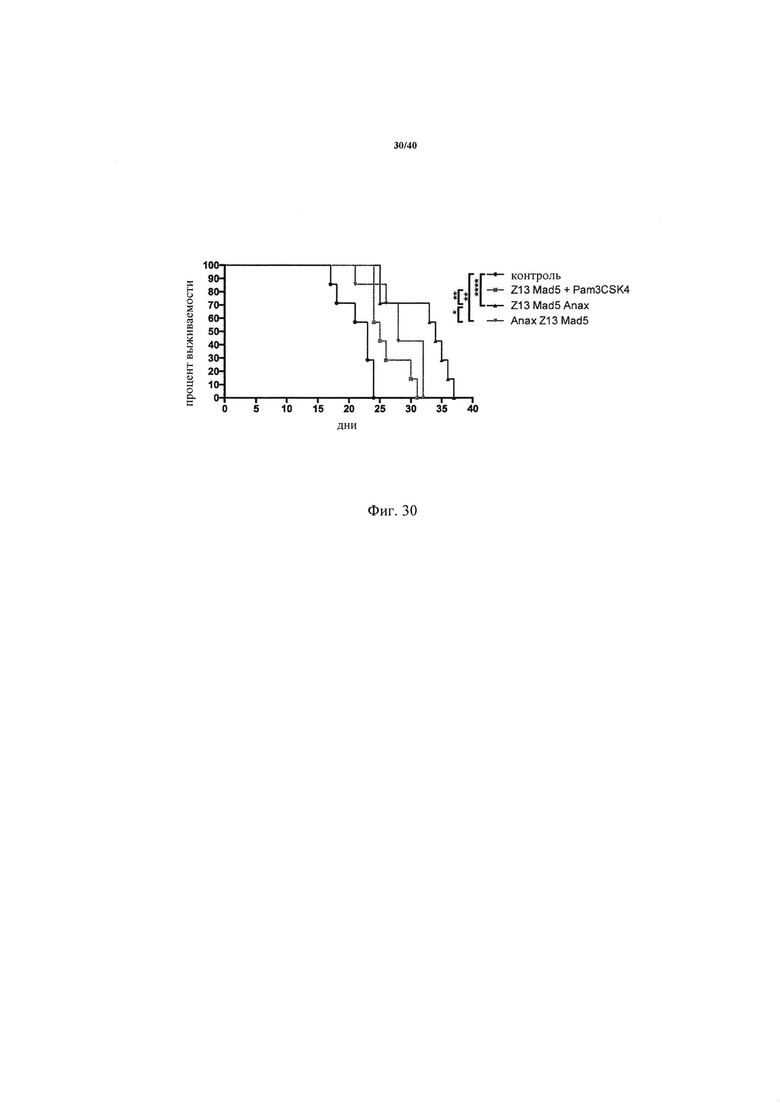
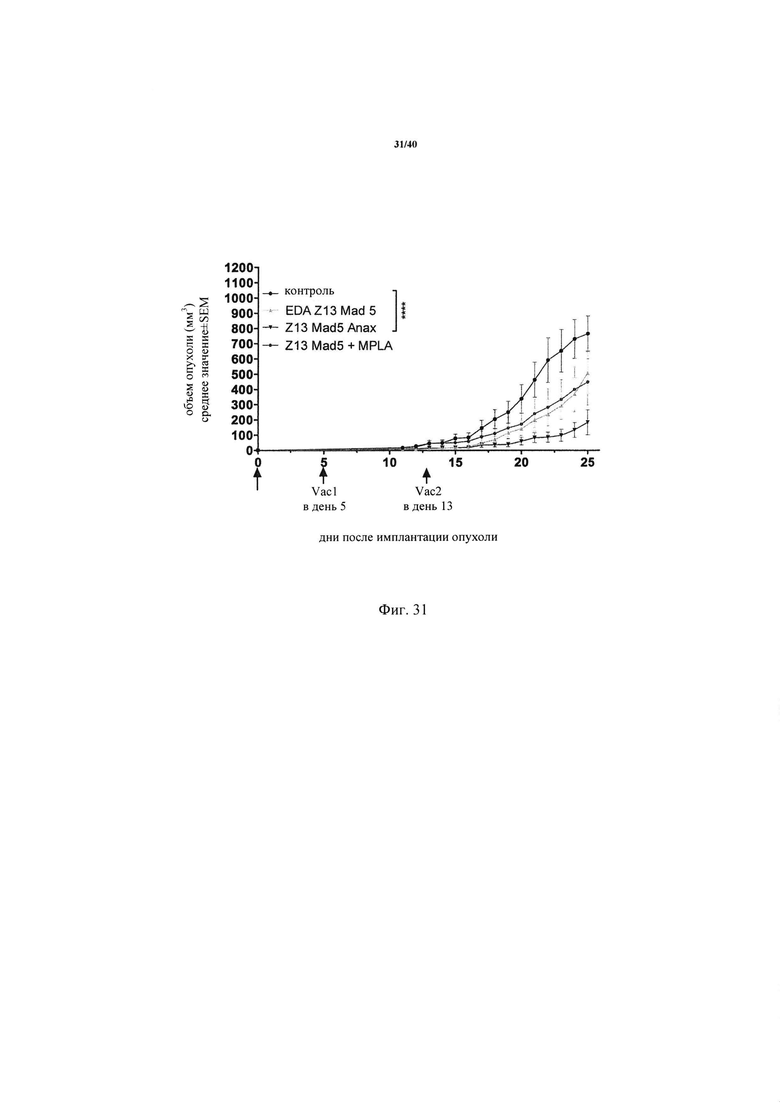
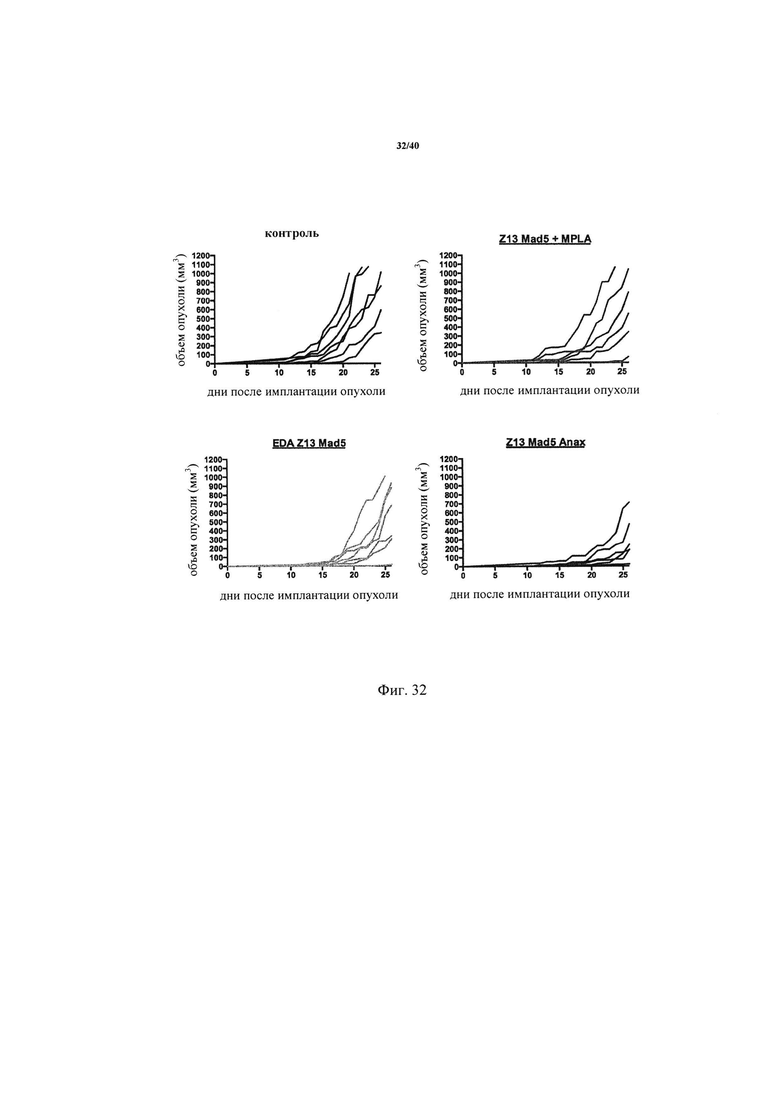
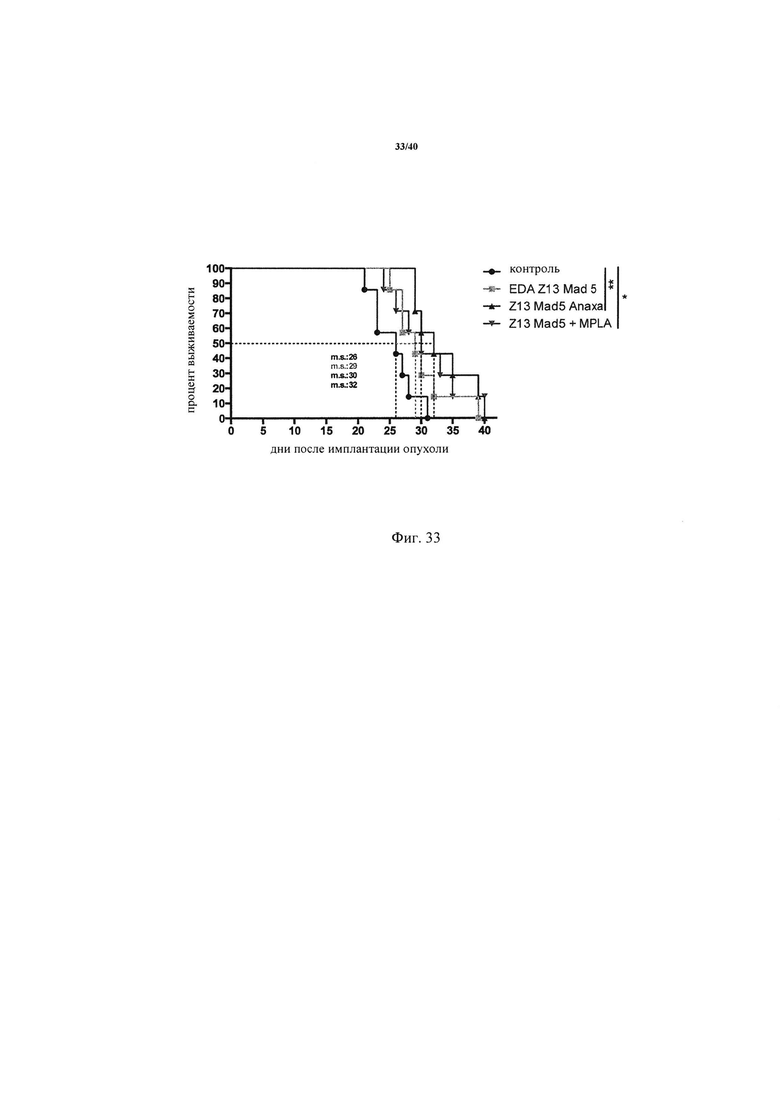



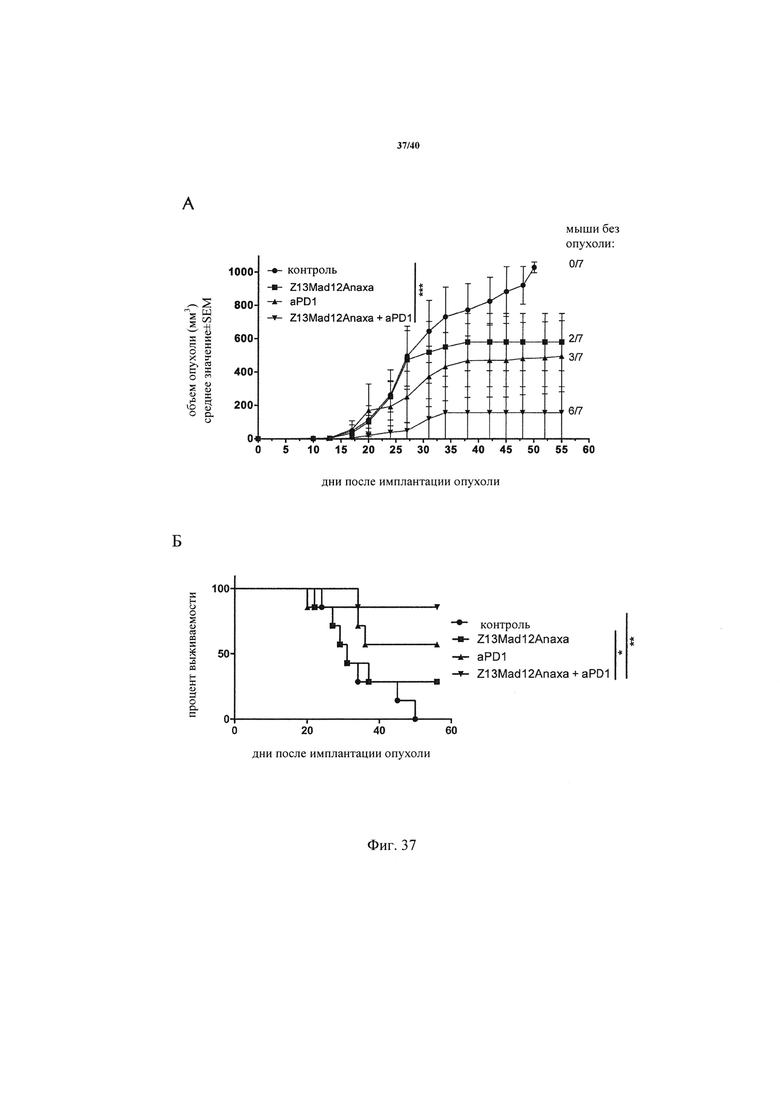
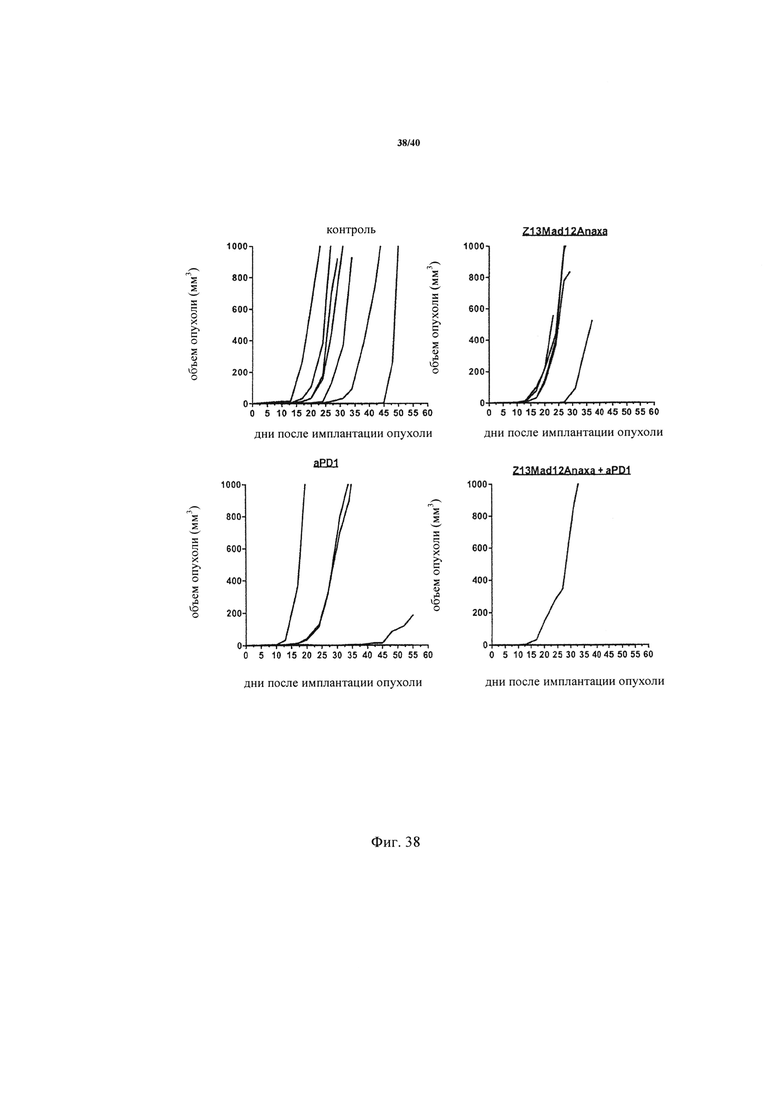
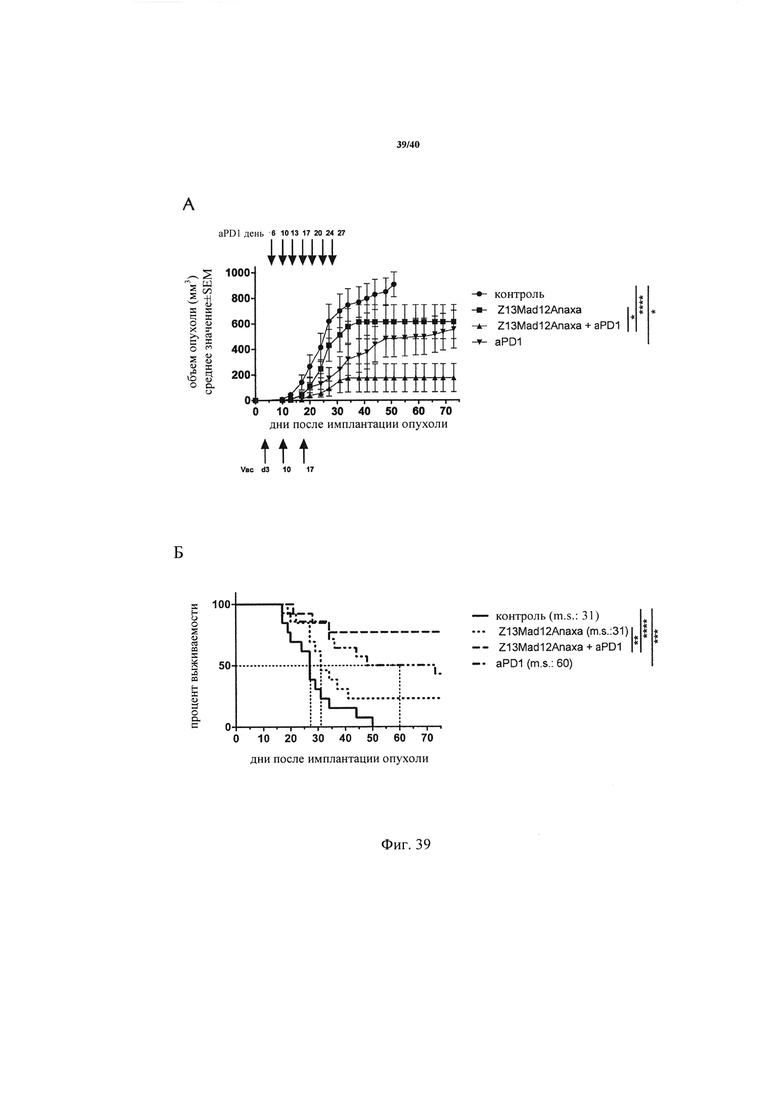
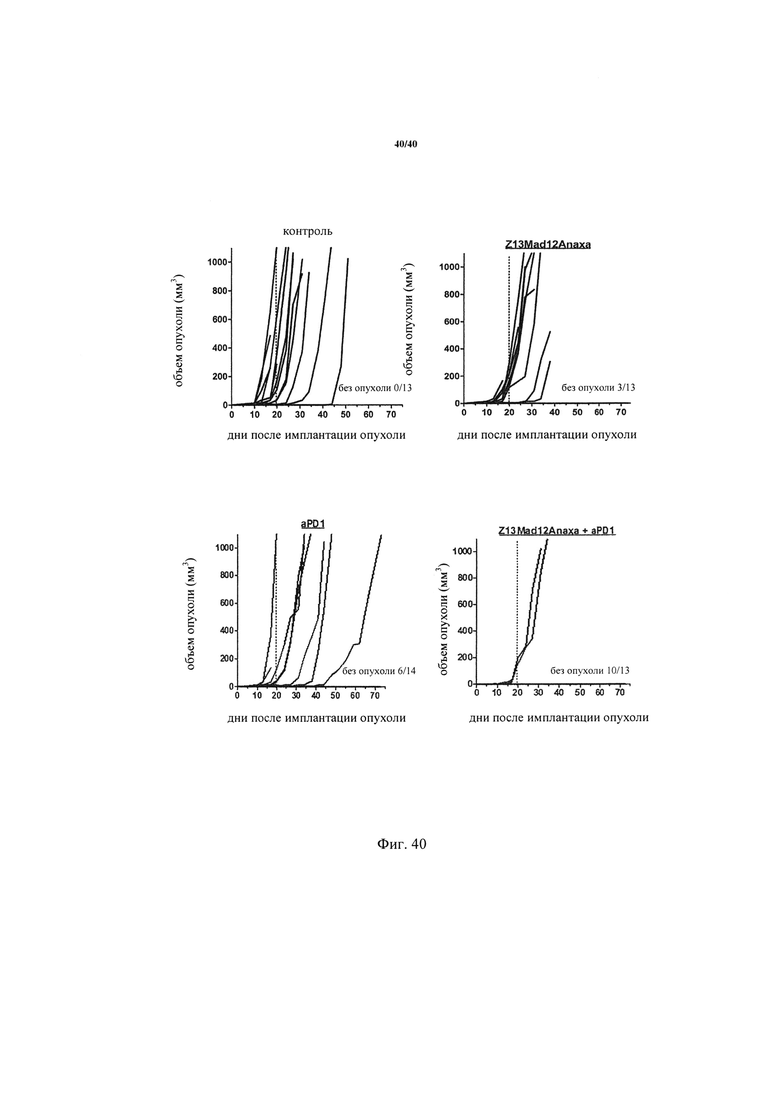
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая комбинацию, предназначенную для предупреждения или лечения рака, набор для предупреждения или лечения рака, композицию, способ лечения рака или инициации, повышения или удлинения противоопухолевого ответа у индивидуума и способ предупреждения или лечения рака, предусматривающий комбинированную терапию. В одном их вариантов реализации изобретения комбинация включает в себя модулятор иммунных контрольных точек и комплекс, содержащий проникающий в клетку пептид, по меньшей мере один антиген или антигенный эпитоп и по меньшей мере один пептидный агонист TLR, где компоненты, входящие в комплекс, ковалентно связаны и где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4. Изобретение расширяет арсенал средств для предупреждения или лечения рака. 5 н. и 112 з.п. ф-лы, 40 ил., 2 табл., 23 пр.
1. Комбинация, предназначенная для предупреждения или лечения рака, включающая
(I) модулятор иммунных контрольных точек и
(II) комплекс, содержащий:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс, ковалентно связаны и где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4.
2. Комбинация по п. 1, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок.
3. Комбинация по п. 1 или 2, в которой проникающий в клетку пептид, входящий в комплекс,
(I) имеет аминокислотную последовательность указанного пептида, состоящую в целом из 5-50 аминокислот, предпочтительно в целом из 10-45 аминокислот, более предпочтительно в целом из 15-45 аминокислот; и/или
(II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или ее вариант.
4. Комбинация по п. 3, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит Ser (S) в положении, эквивалентном положению 189 аминокислотной последовательности ZEBRA, указанной в SEQ ID NO: 3.
5. Комбинация по п. 3 или 4, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую:
(I) последовательность общей формулы (I):
X1X2X3X4X5X6X7X8X9X10X11SX13X14X15X16X17,
в которой 0, 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены без аннулирования указанной способности пептида проникать в клетку, где
X1 обозначает K, R или Н, предпочтительно X1 обозначает K или R;
Х2 обозначает R, K или Н, предпочтительно Х2 обозначает R или K;
Х3 обозначает Y, W или F, предпочтительно Х3 обозначает Y, W или F;
Х4 обозначает K, R или Н, предпочтительно Х4 обозначает K или R;
Х5 обозначает N или Q;
Х6 обозначает R, K или Н, предпочтительно Х6 обозначает R или K;
Х7 обозначает V, I, М, L, F или А, предпочтительно Х7 обозначает V, I, М или L;
X8 обозначает А, V, L, I или G, предпочтительно X8 обозначает А или G;
Х9 обозначает S или Т;
X10 обозначает R, K или Н, предпочтительно Х10 обозначает R или K;
Х11 обозначает K, R или Н, предпочтительно X11 обозначает K или R;
Х13 обозначает R, К или Н, предпочтительно Х13 обозначает R или K;
X14 обозначает А, V, L, I или G, предпочтительно Х14 обозначает А или G;
Х15 обозначает K, R или Н, предпочтительно Х15 обозначает K или R;
X16 обозначает F, L, V, I, Y, W или М, предпочтительно X16 обозначает F, Y или W; и
Х17 обозначает K, R или Н, предпочтительно Х17 обозначает K или R.
6. Комбинация по п. 3 или 4, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 4-13 или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку.
7. Комбинация по п. 6, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку, предпочтительно проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13) или вариантов этой последовательности, у которых не аннулирована способность указанного пептида проникать в клетку.
8. Комбинация по любому из пп. 1-7, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, выбран из группы, состоящей из: (I) пептида, полипептида или белка, (II) полисахарида, (III) липида, (IV) липопротеина, (V) гликолипида, (VI) нуклеиновой кислоты и (VII) низкомолекулярного лекарственного средства или токсина.
9. Комбинация по любому из пп. 1-8, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, содержит или состоит по меньшей мере из одного эпитопа патогена и/или по меньшей мере одного опухолевого эпитопа, предпочтительно по меньшей мере один антиген или антигенный эпитоп содержит или состоит по меньшей мере из одного ракового эпитопа.
10. Комбинация по любому из пп. 1-9, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой по меньшей мере один CD4+-эпитоп и/или по меньшей мере один CD8+-эпитоп.
11. Комбинация по любому из пп. 1-10, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой пептид, полипептид или белок.
12. Комбинация по любому из пп. 1-11, в которой комплекс содержит более одного антигена или антигенного эпитопа, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 или более антигенов или антигенных эпитопов.
13. Комбинация по п. 12, в которой несколько антигенов или антигенных эпитопов, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 или более антигенов или антигенных эпитопов, располагаются последовательно в комплексе.
14. Комбинация по п. 13, в которой по меньшей мере один пептидный агонист TLR, входящий в комплекс, содержит или состоит из аминокислотной последовательности SEQ ID NO: 15 или 47 или варианта указанной последовательности.
15. Комбинация по любому из пп. 1-14, в которой комплекс содержит более одного пептидного агониста TLR, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 пептидных агонистов TLR.
16. Комбинация по любому из пп. 1-15, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на С-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, или с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
17. Комбинация по п. 16, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на С-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, но не с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
18. Комбинация по любому из пп. 2-17, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок и компоненты а)-в), входящие в комплекс, располагаются в направлении N-конец → С-конец главной цепи указанного комплекса в следующем порядке:
(α) компонент а) - компонент б) - компонент в); или
(β) компонент в) - компонент а) - компонент б),
где компоненты могут быть связаны с помощью дополнительного компонента, в частности линкера или спейсера.
19. Комбинация по любому из пп. 1-18, в которой комплекс содержит или состоит из любой из аминокислотных последовательностей SEQ ID NO: 26-32 или 41-45 или комплекс содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из SEQ ID NO: 26-32 или 41-45.
20. Комбинация по любому из пп. 1-19, в которой модулятор иммунных контрольных точек представляет собой активатор или ингибитор одной или нескольких молекулы(л) иммунной(ых) контрольной(ых) точки(ек), выбранной(ых) из CD40, CTLA-4 и/или PD-1; или активатор или ингибитор одного или нескольких их лигандов.
21. Комбинация по любому из пп. 1-20, в которой модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки, или ингибитор ингибирующей молекулы контрольной точки, или их комбинацию.
22. Комбинация по п. 20 или 21, в которой модулятор иммунных контрольных точек представляет собой ингибитор ингибирующей молекулы контрольной точки.
23. Комбинация по п. 20 или 21, в которой модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки.
24. Комбинация по любому из пп. 20-23, в которой модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD-1 или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
25. Комбинация по любому из пп. 20-24, в которой применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
26. Комбинация по п. 25, в которой применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
27. Комбинация по любому из пп. 20-26, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
а) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид, полипептид или белок и предпочтительно содержит или состоит по меньшей мере из одного ракового эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4.
28. Комбинация по п. 27, в которой модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD-1 или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
29. Комбинация по п. 27 или 28, в которой применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
30. Комбинация по п. 29, в которой применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
31. Комбинация по п. 30, где ингибитор CTLA-4 представляет собой ипилимумаб или тремелимумаб.
32. Комбинация по п. 30 или 31, где ингибитор PD-1 или PD-L1 выбирают из ниволумаба, пембролизумаба, пидилизумаба, атезолизумаба.
33. Комбинация по любому из пп. 1-32, в которой модулятор иммунных контрольных точек и комплекс вводят примерно в одно и то же время.
34. Комбинация по любому из пп. 1-32, в которой модулятор иммунных контрольных точек и комплекс вводят последовательно.
35. Комбинация по п. 34, в которой модулятор иммунных контрольных точек вводят до введения комплекса.
36. Комбинация по п. 34, в которой модулятор иммунных контрольных точек вводят после введения комплекса.
37. Комбинация по любому из пп. 1-36, в которой модулятор иммунных контрольных точек и комплекс вводят посредством одного и того же пути введения.
38. Комбинация по любому из пп. 1-36, в которой модулятор иммунных контрольных точек и комплекс вводят посредством различных путей введения.
39. Комбинация по любому из пп. 1-38, в которой модулятор иммунных контрольных точек и комплекс находятся в различных композициях.
40. Комбинация по любому из пп. 1-38, в которой модулятор иммунных контрольных точек и комплекс находятся в одной композиции.
41. Набор для предупреждения или лечения рака, содержащий
(I) модулятор иммунных контрольных точек и
(II) комплекс, содержащий:
а) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты а)-в), входящие в комплекс, ковалентно связаны и где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4, где набор содержит дополнительно листовку-вкладыш в упаковку или этикетку с руководством по лечению рака с помощью комбинации модулятора иммунных контрольных точек и комплекса.
42. Набор по п. 41, в котором комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок.
43. Набор по п. 41 или 42, в котором проникающий в клетку пептид, входящий в комплекс,
(I) имеет аминокислотную последовательность указанного пептида, состоящую в целом из 5-50 аминокислот, предпочтительно в целом из 10-45 аминокислот, более предпочтительно в целом из 15-45 аминокислот; и/или
(II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или ее вариант.
44. Набор по п. 43, в котором проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит Ser (S) в положении, эквивалентном положению 189 аминокислотной последовательности ZEBRA, указанной в SEQ ID NO: 3.
45. Набор по п. 43 или 44, в котором проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую:
(I) последовательность общей формулы (I):
X1X2X3X4X5X6X7X8X9X10X11SX13X14X15X16X17,
в которой 0, 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены
без аннулирования указанной способности пептида проникать в клетку, где
X1 обозначает K, R или H, предпочтительно X1 обозначает K или R;
X2 обозначает R, K или H, предпочтительно X2 обозначает R или K;
X3 обозначает Y, W или F, предпочтительно X3 обозначает Y, W или F;
X4 обозначает K, R или H, предпочтительно X4 обозначает K или R;
X5 обозначает N или Q;
X6 обозначает R, K или H, предпочтительно X6 обозначает R или K;
X7 обозначает V, I, M, L, F или A, предпочтительно X7 обозначает V, I, M или
L;
X8 обозначает A, V, L, I или G, предпочтительно X8 обозначает A или G;
X9 обозначает S или T;
X10 обозначает R, K или H, предпочтительно X10 обозначает R или K;
X11 обозначает K, R или H, предпочтительно X11 обозначает K или R;
X13 обозначает R, K или H, предпочтительно X13 обозначает R или K;
X14 обозначает A, V, L, I или G, предпочтительно X14 обозначает A или G;
X15 обозначает K, R или H, предпочтительно X15 обозначает K или R;
X16 обозначает F, L, V, I, Y, W или M, предпочтительно X16 обозначает F, Y или W; и
X17 обозначает K, R или H, предпочтительно X17 обозначает K или R.
46. Набор по п. 43 или 44, в котором проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 4–13 или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку.
47. Набор по п. 46, в котором проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку, предпочтительно проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13) или вариантов этой последовательности, у которых не аннулирована способность указанного пептида проникать в клетку.
48. Набор по любому из пп. 41-47, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, выбран из группы, состоящей из: (I) пептида, полипептида или белка, (II) полисахарида, (III) липида, (IV) липопротеина, (V) гликолипида, (VI) нуклеиновой кислоты и (VII) низкомолекулярного лекарственного средства или токсина.
49. Набор по любому из пп. 41-48, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, содержит или состоит по меньшей мере из одного эпитопа патогена и/или по меньшей мере одного опухолевого эпитопа, предпочтительно по меньшей мере один антиген или антигенный эпитоп содержит или состоит по меньшей мере из одного ракового эпитопа.
50. Набор по любому из пп. 41-49, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой по меньшей мере один CD4+-эпитоп и/или по меньшей мере один CD8+-эпитоп.
51. Набор по любому из пп. 41-50, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой пептид, полипептид или белок.
52. Набор по любому из пп. 41-51, в котором комплекс содержит более одного антигена или антигенного эпитопа, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 антигенов или антигенных эпитопов.
53. Набор по п. 52, в котором несколько антигенов или антигенных эпитопов, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 антигенов или антигенных эпитопов, располагаются последовательно в комплексе.
54. Набор по п. 53, в котором по меньшей мере один пептидный агонист TLR, входящий в комплекс, содержит или состоит из аминокислотной последовательности SEQ ID NO: 15 или 47 или варианта указанной последовательности.
55. Набор по любому из пп. 41-54, в котором комплекс содержит более одного пептидного агониста TLR, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 пептидных агонистов TLR.
56. Набор по любому из пп. 41-55, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на C-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, или с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
57. Набор по п. 56, в котором по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на C-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, но не с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
58. Набор по одному из пп. 42-57, в котором комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок и компоненты a)-в), входящие в комплекс, располагаются в направлении N-конец → C-конец главной цепи указанного комплекса в следующем порядке:
(α) компонент a) – компонент б) – компонент в); или
(β) компонент в) – компонент a) – компонент б),
где компоненты могут быть связаны с помощью дополнительного компонента, в частности линкера или спейсера.
59. Набор по любому из пп. 41-58, в котором комплекс содержит или состоит из любой из аминокислотных последовательностей SEQ ID NO: 26-32 или 41-45 или комплекс содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из SEQ ID NO: 26–32 или 41-45.
60. Набор по любому из пп. 41-59, в котором модулятор иммунных контрольных точек представляет собой активатор или ингибитор одной или нескольких молекулы(л) иммунной(ых) контрольной(ых) точки(ек), выбранной(ых) CD40, CTLA-4 и/или PD-1; или активатор или ингибитор одного или нескольких их лигандов.
61. Набор по любому из пп. 41-60, в котором модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки, или ингибитор ингибирующей молекулы контрольной точки, или их комбинацию.
62. Набор по п. 60 или 61, в котором модулятор иммунных контрольных точек представляет собой ингибитор ингибирующей молекулы контрольной точки.
63. Набор по п. 60 или 61, в котором модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки.
64. Набор по любому из пп. 60-63, в котором модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD- или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
65. Набор по любому из пп. 60-64, в котором применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
66. Набор по п. 65, в котором применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
67. Набор по любому из пп. 60-66, в котором комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
a) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид, полипептид или белок и предпочтительно содержит или состоит по меньшей мере из одного ракового эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4.
68. Набор по п. 67, в котором модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD-1 или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
69. Набор по п. 67 или 68, в котором применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
70. Набор по п. 69, в котором применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
71. Набор по п. 70, где ингибитор CTLA-4 представляет собой ипилимумаб или тремелимумаб.
72. Набор по п. 70 или 71, где ингибитор PD-1 или PD-L1 выбираются из ниволумаба, пембролизумаба, пидилизумаба, атезолизумаба.
73. Набор по любому из пп. 41-72, в котором модулятор иммунных контрольных точек и комплекс вводят примерно в одно и то же время.
74. Набор по любому из пп. 41-72, в котором модулятор иммунных контрольных точек и комплекс вводят последовательно.
75. Набор по п. 74, в котором модулятор иммунных контрольных точек вводят до введения комплекса.
76. Набор по п. 74, в котором модулятор иммунных контрольных точек вводят после введения комплекса.
77. Набор по любому из пп. 41-76, в котором модулятор иммунных контрольных точек и комплекс вводят посредством одного и того же пути введения.
78. Набор по любому из пп. 41-76, в котором модулятор иммунных контрольных точек и комплекс вводят посредством различных путей введения.
79. Набор по любому из пп. 1-78, в котором модулятор иммунных контрольных точек и комплекс находятся в различных композициях.
80. Набор по любому из пп. 1-78, в которой модулятор иммунных контрольных точек и комплекс находятся в одной композиции.
81. Композиция, предназначенная для предупреждения или лечения рака, где композиция содержит комбинацию
(I) эффективного количества модулятора иммунных контрольных точек и
(II) эффективного количества комплекса, содержащего:
a) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты a)-в), входящие в комплекс, ковалентно связаны, где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4,
а также фармацевтически приемлемый носитель.
82. Композиция по п. 81, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок.
83. Композиция по п. 81 или 82, в которой проникающий в клетку пептид, входящий в комплекс,
(I) имеет аминокислотную последовательность указанного пептида, состоящую в целом из 5-50 аминокислот, предпочтительно в целом из 10-45 аминокислот, более предпочтительно в целом из 15-45 аминокислот; и/или
(II) имеет аминокислотную последовательность, содержащую фрагмент минимального домена ZEBRA, где указанный минимальный домен простирается от остатка 170 до остатка 220 аминокислотной последовательности ZEBRA, представленной в SEQ ID NO: 3, в которой необязательно 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены без аннулирования способности указанного пептида проникать в клетку, или ее вариант.
84. Композиция по п. 83, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит Ser (S) в положении, эквивалентном положению 189 аминокислотной последовательности ZEBRA, указанной в SEQ ID NO: 3.
85. Композиция по п. 83 или 84, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую:
(I) последовательность общей формулы (I):
X1X2X3X4X5X6X7X8X9X10X11SX13X14X15X16X17,
в которой 0, 1, 2, 3, 4 или 5 аминокислот заменены, удалены и/или добавлены без аннулирования указанной способности пептида проникать в клетку, где
X1 обозначает K, R или H, предпочтительно X1 обозначает K или R;
X2 обозначает R, K или H, предпочтительно X2 обозначает R или K;
X3 обозначает Y, W или F, предпочтительно X3 обозначает Y, W или F;
X4 обозначает K, R или H, предпочтительно X4 обозначает K или R;
X5 обозначает N или Q;
X6 обозначает R, K или H, предпочтительно X6 обозначает R или K;
X7 обозначает V, I, M, L, F или A, предпочтительно X7 обозначает V, I, M или
L;
X8 обозначает A, V, L, I или G, предпочтительно X8 обозначает A или G;
X9 обозначает S или T;
X10 обозначает R, K или H, предпочтительно X10 обозначает R или K;
X11 обозначает K, R или H, предпочтительно X11 обозначает K или R;
X13 обозначает R, K или H, предпочтительно X13 обозначает R или K;
X14 обозначает A, V, L, I или G, предпочтительно X14 обозначает A или G;
X15 обозначает K, R или H, предпочтительно X15 обозначает K или R;
X16 обозначает F, L, V, I, Y, W или M, предпочтительно X16 обозначает F, Y или W; и
X17 обозначает K, R или H, предпочтительно X17 обозначает K или R.
86. Композиция по п. 83 или 84, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 4-13 или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку.
87. Композиция по п. 86, в которой проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку, предпочтительно проникающий в клетку пептид, входящий в комплекс, имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13) или вариантов этой последовательности, у которых не аннулирована способность указанного пептида проникать в клетку.
88. Композиция по любому из пп. 81-87, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, выбран из группы, состоящей из: (I) пептида, полипептида или белка, (II) полисахарида, (III) липида, (IV) липопротеина, (V) гликолипида, (VI) нуклеиновой кислоты и (VII) низкомолекулярного лекарственного средства или токсина.
89. Композиция по любому из пп. 81-88, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, содержит или состоит по меньшей мере из одного эпитопа патогена и/или по меньшей мере одного опухолевого эпитопа, предпочтительно по меньшей мере один антиген или антигенный эпитоп содержит или состоит по меньшей мере из одного ракового эпитопа.
90. Композиция по любому из пп. 81-89, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой по меньшей мере один CD4+-эпитоп и/или по меньшей мере один CD8+-эпитоп.
91. Композиция по любому из пп. 81-90, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, представляет собой пептид, полипептид или белок.
92. Композиция по любому из пп. 81-91, в которой комплекс содержит более одного антигена или антигенного эпитопа, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 антигенов или антигенных эпитопов.
93. Композиция по п. 92, в которой несколько антигенов или антигенных эпитопов, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 антигенов или антигенных эпитопов, располагаются последовательно в комплексе.
94. Композиция по п. 93, в которой по меньшей мере один пептидный агонист TLR, входящий в комплекс, содержит или состоит из аминокислотной последовательности SEQ ID NO: 15 или 47 или варианта указанной последовательности.
95. Композиция по любому из пп. 81-94, в которой комплекс содержит более одного пептидного агониста TLR, в частности 2, 3, 4, 5, 6, 7, 8, 9, 10 пептидных агонистов TLR.
96. Композиция по любому из пп. 81-95, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на C-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, или с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
97. Композиция по п. 96, в которой по меньшей мере один антиген или антигенный эпитоп, входящий в комплекс, расположен на C-конце проникающего в клетку пептида, входящего в комплекс, при этом проникающий в клетку пептид и по меньшей мере один антиген или антигенный эпитоп необязательно связаны с помощью дополнительного компонента, например линкера, спейсера, но не с помощью по меньшей мере одного пептидного агониста TLR, входящего в комплекс.
98. Композиция по одному из пп. 82-97, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок и компоненты a)-в), входящие в комплекс, располагаются в направлении N-конец → C-конец главной цепи указанного комплекса в следующем порядке:
(α) компонент a) – компонент б) – компонент в); или
(β) компонент в) – компонент a) – компонент б),
где компоненты могут быть связаны с помощью дополнительного компонента, в частности линкера или спейсера.
99. Композиция по любому из пп. 81-98, в которой комплекс содержит или состоит из любой из аминокислотных последовательностей SEQ ID NO: 26-32 или 41-45 или комплекс содержит или состоит из аминокислотной последовательности, идентичной по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% любой из SEQ ID NO: 26-32 или 41-45.
100. Композиция по любому из пп. 81-99, в которой модулятор иммунных контрольных точек представляет собой активатор или ингибитор одной или нескольких молекулы(л) иммунной(ых) контрольной(ых) точки(ек), выбранной(ых) CD40, CTLA-4 и/или PD-1; или активатор или ингибитор одного или нескольких их лигандов.
101. Композиция по любому из пп. 81-100, в которой модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки, или ингибитор ингибирующей молекулы контрольной точки, или их комбинацию.
102. Композиция по п. 100 или 101, в которой модулятор иммунных контрольных точек представляет собой ингибитор ингибирующей молекулы контрольной точки.
103. Композиция по п. 100 или 101, в которой модулятор иммунных контрольных точек представляет собой активатор стимулирующей или костимулирующей молекулы контрольной точки.
104. Композиция по любому из пп. 100-103, в которой модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD- или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
105. Композиция по любому из пп. 100-104, в которой применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
106. Композиция по п. 105, в которой применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
107. Композиция по любому из пп. 100-106, в которой комплекс представляет собой рекомбинантный полипептид или рекомбинантный белок, в котором
a) проникающий в клетку пептид имеет аминокислотную последовательность, которая содержит или состоит из аминокислотной последовательности SEQ ID NO: 6 (CPP3/Z13), SEQ ID NO: 7 (CPP4/Z14), SEQ ID NO: 8 (CPP5/Z15) или SEQ ID NO: 11 (CPP8/Z18) или вариантов последовательностей, у которых не аннулирована способность указанного пептида проникать в клетку;
б) по меньшей мере один антиген или антигенный эпитоп представляет собой пептид, полипептид или белок и предпочтительно содержит или состоит по меньшей мере из одного ракового эпитопа; и
в) пептидный агонист TLR представляет собой пептидный агонист TLR2 и/или пептидный агонист TLR4.
108. Композиция по п. 107, в которой модулятор иммунных контрольных точек представляет собой модулятор CD40, CTLA-4, PD-L1, PD-L2 и/или PD-1, предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1, PD-L2 и/или PD-1 или активатор CD40, более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4, PD-L1 и/или PD-1 и еще более предпочтительно модулятор иммунных контрольных точек представляет собой ингибитор CTLA-4 и/или PD-1.
109. Композиция по п. 107 или 108, в которой применяют более одного модулятора иммунных контрольных точек, в частности применяют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных модуляторов иммунных контрольных точек, предпочтительно применяют 2, 3, 4 или 5 различных модуляторов иммунных контрольных точек, более предпочтительно применяют 2, 3 или 4 различных модулятора иммунных контрольных точек, еще более предпочтительно применяют 2 или 3 различных модулятора иммунных контрольных точек и наиболее предпочтительно применяют 2 различных модулятора иммунных контрольных точек.
110. Композиция по п. 109, в которой применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1, PD-L1 или PD-L2, предпочтительно применяют по меньшей мере (I) ингибитор CTLA-4 и (II) ингибитор PD-1.
111. Композиция по п. 110, где ингибитор CTLA-4 представляет собой ипилимумаб или тремелимумаб.
112. Композицию по п. 110 или 111, где ингибитор PD-1 или PD-L1 выбираются из ниволумаба, пембролизумаба, пидилизумаба, атезолизумаба.
113. Композиция по любому из пп. 81-112, где композиция содержит по меньшей мере два различных комплекса.
114. Композиция по любому из пп. 81-113, где композиция содержит по меньшей мере два различных модулятора иммунных контрольных точек.
115. Композиция по любому из пп. 81-114, где композиция представляет собой вакцину.
116. Способ лечения рака или инициации, повышения или удлинения противоопухолевого ответа у индивидуума, который нуждается в этом, включающий введение индивидууму
(I) модулятора иммунных контрольных точек и
(II) комплекса, содержащего:
a) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты a)-в), входящие в комплекс, ковалентно связаны и где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4.
117. Способ предупреждения или лечения рака, предусматривающий комбинированную терапию, где комбинированная терапия включает введение
(I) модулятора иммунных контрольных точек и
(II) комплекса, содержащего:
a) проникающий в клетку пептид;
б) по меньшей мере один антиген или антигенный эпитоп; и
в) по меньшей мере один пептидный агонист TLR,
где компоненты a)-в), входящие в комплекс, ковалентно связаны и где по меньшей мере один пептидный агонист TLR является пептидным агонистом TLR2 или пептидным агонистом TLR4.
| WO 2014041505 A1, 20.03.2014 | |||
| WO 2015103037 A2, 09.07.2015 | |||
| WO 2013120073 A1, 15.08.2013 | |||
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ МОНОНАТРИЕВОЙ СОЛИ D-ИЗОГЛУТАМИЛ-D-ТРИПТОФАНА | 2008 |
|
RU2476440C2 |
| US 6093794 A1, 25.07.2000 | |||
| "Нуклеиновые кислоты: от А до Я" Б | |||
| Аппель и др | |||
| под ред | |||
| С | |||
| Мюллер, пер | |||
| с анг.- БИНОМ | |||
| Лаборатория знаний, 2013 - 413 с., см | |||
| стр | |||
| Приспособление для подвешивания тележки при подъемках сошедших с рельс вагонов | 1920 |
|
SU216A1 |
| DREW M | |||
| PARDOLL, "The blockade of immune checkpoints in cancer | |||
Авторы
Даты
2021-05-25—Публикация
2017-03-14—Подача