Изобретение относится к области биотехнологии, в частности к гибридомной технологии, и касается получения штамма гибридных клеток, продуцирующих моноклональные антитела к раково-тестикулярному антигену человека GAGE.
Моноклональные антитела (МКА) являются высокоспецифичными антителами, образованными одной гибридной антителообразующей клеткой, иммортализованной путем слияния с миеломной линией, к определенному антигену, которые синтезируются специально создаваемыми линиями клеток-продуцентов [Кеннет Р.Г., Мак-Керн Т. Дж., Бехтол К.Б. Моноклональные антитела: Гибридомы: новый уровень биологического анализа. М., Медицина, 1983; Ройт А., Бростофф Дж., Мейл Д. Иммунология. М.: Мир, 2000;  Milstein С. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 256, 495-497, 1975].
Milstein С. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 256, 495-497, 1975].
Применение МКА широко распространено в онкологии для изучения опухолевых антигенов, иммунодиагностики и иммунотерапии опухолей [Барышников А.Ю., Тоневицкий А.Г. Моноклональные антитела в лаборатории и клинике. М.: Медицина, 1997]. Следовательно, получение новых гибридом всегда актуально.
Моноклональные антитела, продуцируемые гибридомами, используются для выявления основных структурно-функциональных свойств белков, в том числе и GAGE. Белки семейства GAGE относятся к группе раково-тестикулярных антигенов человека и насчитывают около 16 членов на данный момент. Белки семейства GAGE могут быть потенциальными антигенами для иммунотерапии широкого спектра онкологических заболеваний, так как экспрессируются в различных типах опухолей, но не в нормальных тканях, а также вызывают иммунный ответ [Van den Eynde В, Peeters О, De Backer О, Gaugler В, Lucas S, Boon T. A new family of genes coding for an antigen recognized by autologous cytolytic T -lymphocytes on a human melanoma. J Exp Med, 1995; 182; c. 689-698]. Для оценки прогностических и терапевтических свойств антигенов семейства GAGE необходима проверка их экспрессии в опухолевых клетках на уровне белка, что может быть реализовано с помощью высокоспецифичных антител.
Задачей изобретения является получение штамма гибридных клеток, продуцирующего МКА к раково-тестикулярному антигену человека GAGE.
Поставленная задача решается тем, что предложен новый штамм гибридных культивируемых клеток животных mus musculus α - продуцент моноклональных антител к раково-тестикулярному антигену человека GAGE.
Технический результат заявляемого изобретения состоит в расширении арсенала штаммов гибридом, продуцирующих МКА к раково-тестикулярному антигену человека GAGE, используемых для научно-исследовательских и медицинских целей, для иммуноферментной диагностики и контроля течения заболеваний.
Аналогов заявляемого штамма гибридомы - продуцента моноклональных антител к раково-тестикулярному антигену человека GAGE - не обнаружено.
Заявляемому штамму гибридомных культивируемых клеток животных mus musculus присвоено название 4G1-D2. Полученная новая гибридома 4G1-D2 - продуцент МКА к раково-тестикулярному антигену человека GAGE - обладает стабильными культуральными и морфологическими характеристиками, хранится во Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИгенетика Минобрнауки России (БРЦ ВКПМ) под номером Н-174, дата депонирования 02 мая 2017 г. Полученная гибридома 4G1-D2 может использоваться при создании диагностических тест-систем с целью мониторинга при проводимой терапии и характеризуется следующими свойствами.
Штамм 4G1-D2 получали путем слияния клеток мышиной миеломы NS-1 с клетками селезенки мышей линии Balb/C, иммунизированных внутрибрюшинно рекомбинантным белком человека GAGE. Слияние проведено с помощью полиэтиленгликоля ПЭГ-1500. Селекция гибридных клеток проведена с помощью селективной среды ГАТ (гипоксантин - аминоптерин - тимидин). Штамм прошел 3 клонирования, позитивных клонов не менее 80%. Штамм синтезирует МКА, специфически взаимодействующие в твердофазном иммуноферментном анализе с рекомбинантным белком человека GAGE.
Гибридные клетки штамма 4G1-D2 растут в виде суспензии in vitro или в виде асцитной опухоли в перитонеальной полости после внутрибрюшинного введения гибридных клеток штамма 4G1-D2 сингенным мышам Balb/C.
Для культивирования штамма 4G1-D2 использовали культуральные флаконы. Во флаконы площадью 25 и 75 см2 вносили гибридные клетки штамма 4G1-D2 в количестве 1×106. В качестве культуральной среды использовали среду RPMI-1640, содержащую 20% телячьей эмбриональной сыворотки (ЭТС). Гибридные клетки штамма 4G1-D2 культивировали при t 37°C в атмосфере, содержащей 5% СО2. Частота пассирования - 2-3 суток. Кратность пересева - 1:2-1:4.
За 14 дней до введения гибридных клеток штамма 4G1-D2 мышам линии BALB/C предварительно вводили внутрибрюшинно пристан - 2,6,10,14-тетраметилпентадекан в дозе 0,3-0,5 мл на одну мышь. Далее мышам вводили внутрибрюшинно гибридные клетки штамма 4G1-D2 в дозе (5-10)×106 клеток на одну мышь. Асцитную жидкость, содержащую МКА-продуценты GAGE, забирали через 9-12 дней после введения.
Секрецию МКА-продуцентов GAGE штамма 4G1-D2 определяли методом иммуноферментного анализа (ИФА). Секреция МКА-продуцентов GAGE на 7 день культивирования in vitro составляла 10-15 мкг/мл, титр МКА при культивировании in vitro в соотношении 1:1000-1:2000 (ИФА). Секреция МКА в асцитной жидкости при выращивании in vivo составила 6-10 мг/мл, титр МКА в асцитной жидкости при выращивании in vivo - в соотношении 1:106-1:107 (ИФА).
Получено МКА класса IgG1, легкая цепь - каппа, специфичность - GAGE.
Штамм 4G1-D2 сохраняли посредством криоконсервации в жидком азоте. За 24 часа до замораживания гибридные клетки штамма 4G1-D2 пассировали с кратностью рассева 1:2. Осажденные центрифугированием при 1000 об/мин в течение 5-7 мин гибридные клетки штамма 4G1-D2 ресуспендировали в криозащитной среде, содержащей 90% телячьей эмбриональной сыворотки (ЭТС) и 10% диметилсульфоксида (DMSO), и разливали в пластиковые ампулы по 1 мл в концентрации (5-10)×106 клеток/мл, помещали в теплоизолирующий материал (пенополиуретан) и переносили в низкотемпературный холодильник при температуре -70°С на 24 часа. Для длительного хранения гибридные клетки штамма 4G1-D2 переносили в жидкий азот при температуре -196°С.
Для восстановления штамма 4G1-D2 проводили его быстрое размораживание при температуре 37°С. Гибридные клетки штамма 4G1-D2 разводили в 10 мл бессывороточной среды, осаждали центрифугированием при 1000 об/мин в течение 5-7 мин и ресуспендировали в 5 мл культуральной среды, содержащей 20% ЭТС, в концентрации (3-4)×105 клеток/см2 и переносили в культуральный флакон. Жизнеспособность восстановленных гибридных клеток штамма 4G1-D2 составляла 70-80%, определяли по дифференциальной окраске гибридных клеток штамма 4G1-D2 с использованием 0,4% раствора трипанового синего, рН=7,2-7,3.
Стабильность продуцирования антител гибридными клетками штамма 4G1-D2 сохранялась на протяжении 25 пассажей в культуре клеток и 5 пассажей на мышах линии BALB/C.
При исследовании на контаминацию штамма 4G1-D2 в культуре штамма бактерий и грибов, а также заражения микоплазмой не обнаружено.
При кариологическом исследовании штамма 4G1-D2 модальное число хромосом составило 76. Маркерных хромосом не выявлено.
Для оценки сохранения реактивности МКА штамма 4G1-D2 с GAGE проводили иммуноферментный тест на связывание полученных МКА с GAGE: стенки лунок полистиролового планшета покрывали рекомбинантным белком GAGE1, вносили моноклональное антитело, затем конъюгат антимышиного иммуноглобулина с пероксидазой хрена и субстрат перекиси водорода с тимедин-3,3,5,5-тетраметилбензидином (ТМБ). При положительной реакции появлялось голубое окрашивание.
Рекомбинантный белок GAGE1 получали путем его экспрессии в составе в штамме-продуценте Е. coli, культивируя штамм BL21(DE3)pLysS, трансформированный плазмидой pGAGE1. Рекомбинантный белок GAGE1 был очищен хроматографически на колонке с Ni-агарозой после разрушения клеток продуцента ультразвуком и удаления клеточного дебриса.
Изобретение иллюстрируется фиг. 1-3 и табл. 1, 2.
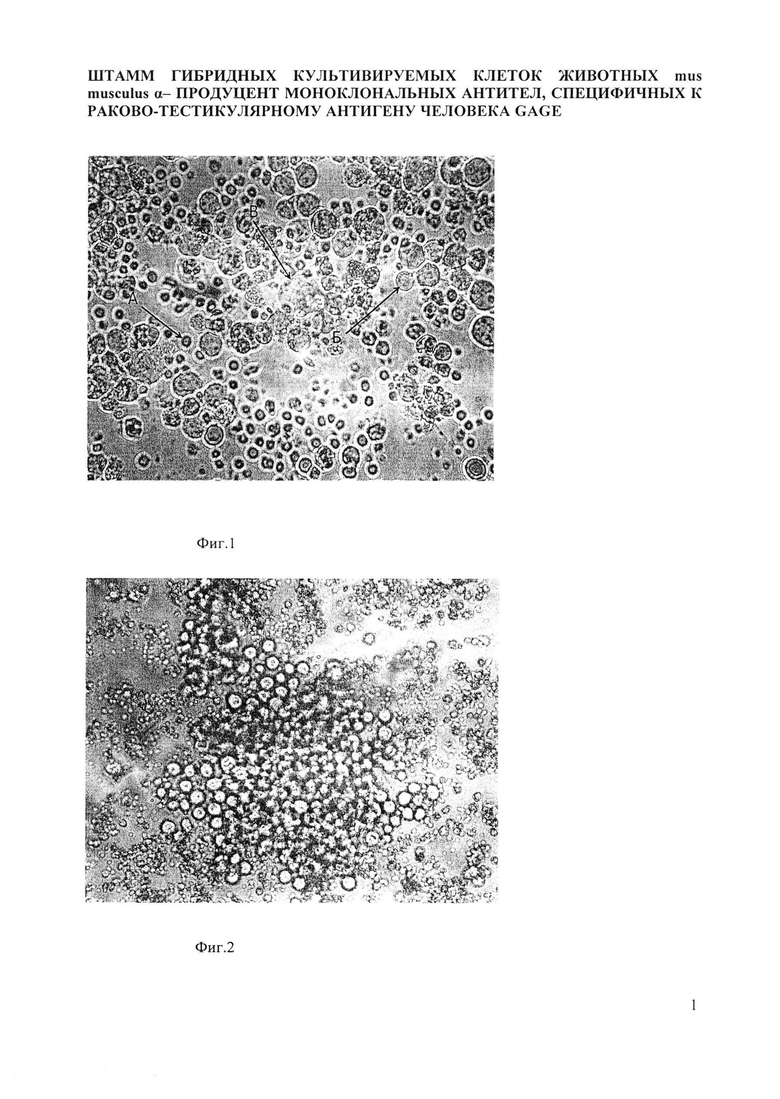
На фиг. 1 представлена обзорная микроскопия гибридизации клеток мышиной миеломы NS-1 с клетками селезенки мышей линии Balb/C, иммунизированных внутрибрюшинно рекомбинантным белком GAGE1: А - клетки селезенки (спленоциты), Б - клетки миеломы, В - гибридизация спленоцитов с клетками миеломы.
На фиг. 2 показана полученная гибридома 4G1-D2. Гибридные клетки представляют собой крупные округлые клетки с узким ободком базофильной цитоплазмы, растут в виде конгломератов клеток по типу «гроздьев винограда». Ядра гиперхромные, неправильно-овальной формы, крупные, с грубой структурой ядерного хроматина.
На фиг. 3 представлен иммуноблот с МКА 4G1-D2. Дорожка А - рекомбинантный тиоредоксин человека, дорожка Б - рекомбинантный белок человека GAGE1, дорожка В - рекомбинантный белок человека GAGE2D.
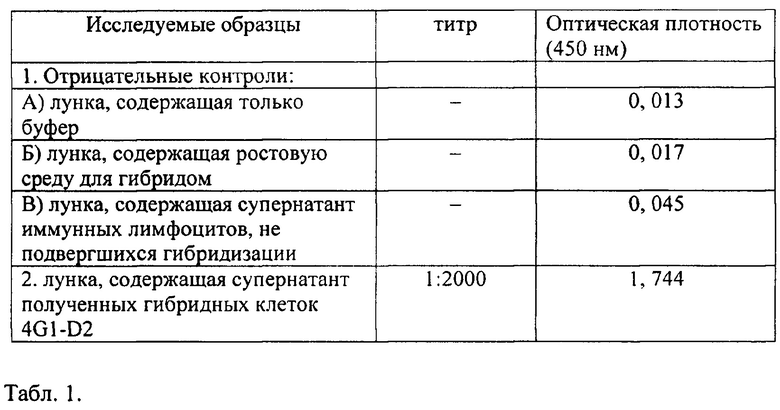
В табл. 1 представлены результаты оценки связывания антител гибридомы 4G1-D2 с антигеном GAGE1 в культуральной жидкости (супернатанты) методом твердофазного ИФА.
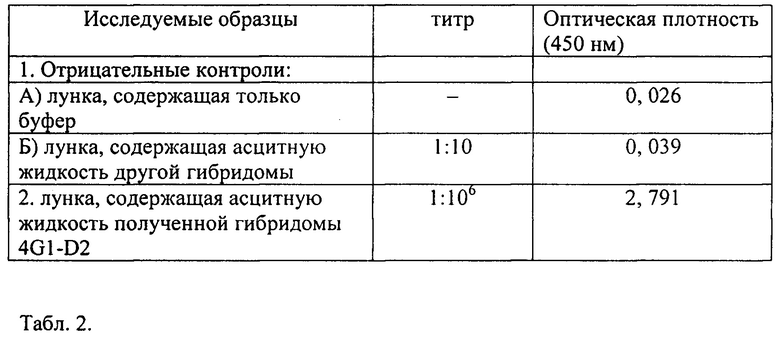
В табл. 2 представлены результаты оценки связывания антител гибридомы 4G1-D2 с антигеном GAGE в асцитной жидкости методом твердофазного ИФА.
Пример 1. Получение штамма гибридомы 4G1-D2
Иммунизация
Мышей линии BALB/C в возрасте 3-4 месяцев трехкратно иммунизировали рекомбинантным белком GAGE1 по схеме: внутрибрюшинно вводили мышам 50 мкг рекомбинантного белка GAGE1 в полном адъюванте Фрейнда; через 21 сутки повторно внутрибрюшинно вводили 20 мкг рекомбинантного белка GAGE1 в неполном адъюванте Фрейнда; через 21 сутки внутривенно вводили мышам 20 мкг рекомбинантного белка GAGE в физиологическом растворе. На третий день после последней инъекции забирали для проверки на специфическую активность кровь у иммунизированных мышей. Титры специфических антител в сыворотках мышей определяли с помощью непрямого твердофазного ИФА, используя в качестве отрицательного контроля сыворотку крови неиммунизированной мыши в титре 1:100.
Гибридизацию проводили в стерильном боксе. На 4-й день после последней внутривенной инъекции извлекали селезенку мыши и проводили гибридизацию спленоцитов мыши в количестве 107 с клетками миеломной линии в количестве 106 в присутствии 1 мл раствора полиэтиленгликоля (ПЭГ/ДМСО, Sigma) в течение 1 минуты. Для слияния использовали перевиваемую клеточную линию мышиной миеломы NS-1, дефектную по гену ГГФРТ (гипоксантин-гунинфосфорибозилтрансфераза), т.е. не способную к синтезу ДНК. Миелома NS-1 синтезирует, но не секретирует легких цепей иммуноглобулинов. В результате слияния с родительскими лимфоцитами этот дефект устраняется. Таким образом, только гибридные клетки способны расти в селективной среде ГАТ. Гибридизацию проводят по методу Kohler G., Milstain С. [Kohler G., Milstain С., 1975]. Миеломные клетки дважды отмывали средой RPMI 1640 и смешивали с клетками селезенки в соотношении 1:10. Полученную смесь клеток отмывали средой RPMI 1640 и помещали в среду RPMI 1640 в объеме 20 мл в пробирку объемом 50 мл, центрифугировали при 800 об/мин в течение 3 минут и после инкубировали в течение 20 мин при температуре 37°С. Затем среду RPMI 1640 удаляли и к осажденным клеткам добавляли медленно, по каплям, в течение 1 минуты 1 мл 50% полиэтиленгликоля, предварительно прогретого при температуре 37°С. Затем в пробирку с клетками, обработанными полиэтиленгликолем, медленно добавляли 20 мл среды RPMI 1640. Далее клетки 2 раза отмывали, не встряхивая, при 800 об/мин в течение 3 мин, добавляли среду ГАТ с 20% культуральной среды и оставляли на 2 часа при температуре 37°С. После этого клетки ресуспендировали и разливали по 0,2 мл в концентрации (1-1,5)×105 клеток в лунки 96-луночного планшета. На 8-й день из среды удаляли ГАТ и далее культивирование проводили на среде RPMI-1640 с 20% ЭТС, 2 мМ/L-глутамина, 50 мкг/мл гентамицина. Полученные гибридные клетки инкубировали при температуре 37°C в атмосфере 5% СО2. Замену среды в лунках с гибридомными клонами проводили каждые 2-3 дня. Видимые колонии появлялись через 10-14 дней.
Для отбора положительных гибридных клонов, продуцирующих МКА, использовали непрямой твердофазный ИФА. В лунки 96-луночного полистиролового планшета вносили по 100 нг рекомбинантного белка GAGE, приготовленного на 0,01 М карбонатном буфере, рН 9,6, в объеме 100 мкл, и затем выдерживали при температуре 4°С в темноте в течение 16-18 ч. Лунки планшета отмывали фосфатно-солевым буферным раствором, содержащим 0,1% Твина-20 (ФСБ-Т) и 3% бычьего сывороточного альбумина (БСА). В лунки планшета вносили по 100 мкл культуральной жидкости МКА и инкубировали при температуре 37°C в течение 2 часов, отмывали ФСБ-Т и добавляли пероксидазный конъюгат антител к IgG мыши в разведении 1:1500. Инкубировали при температуре 37°C 1 час. После каждого этапа несвязавшиеся реагенты отмывали ФСБ-Т. В качестве хромогена использовали тетраметилбензидин (ТМБ). Интенсивность окраски в лунках определяли после остановки реакции 1М H2SO4 на спектрофотометре Multiscan МСС при длине волны 450 нм (табл. 1).
Клонирование гибридом состояло из 2-х этапов: приготовление питательного слоя (фидер) с использованием тимоцитов; клонирование гибридом методом лимитирующих разведений.
Из одной вилочковой железы мыши выделяли около 106 клеток. Вносили по 100 мкл суспензии клеток тимуса в лунки 96-луночного планшета, кроме краевых лунок. В краевые лунки вносят по 200 мкл среды RPMI 1640, содержащей антибиотики (для предотвращения испарения влаги и концентрирования рабочей среды в лунках, содержащих клетки). Инкубируют планшет с фидерным слоем в CO2-инкубаторе 24 часа. На следующий день, проверив тимоциты под микроскопом и убедившись, что они не загрязнены, приступили к клонированию гибридомных клеток. Готовили суспензии гибридомных клеток, ресуспендируя клеточный осадок в полной рабочей среде: 1 мл суспензии с концентрацией 103 клеток в 1 мл, 1 мл суспензии с концентрацией 102 клеток в 1 мл, 1 мл суспензии с концентрацией 500 клеток в 1 мл, 1 мл суспензии с концентрацией 50 клеток, 1 мл суспензии с концентрацией 10 клеток в 1 мл и 1 мл суспензии с концентрацией 5 клеток в 1 мл. Меняли в лунках среду через день, осторожно, избегая перекрестной контаминации лунок, чтобы не нарушить клеточный слой, поскольку гибридные клетки растут на фидерном слое в виде отдельных колоний. На 10-й, 14-й день проверяли супернатанты полученных гибридных клонов на антителообразующую активность (ИФА). Клонирование считается удачным, если рост гибридных клонов отмечен в 30% лунок. Отбирали колонии, выросшие в лунках, которые засевали с наименьшим количеством клеток на лунку. Если гибридных клонов выявлено больше, чем в 30% лунок, клонирование повторяли. Для наращивания гибридомные клоны переносили в стерильные культуральные флаконы площадью 75 см2 уже в неполной рабочей среде (с содержанием сыворотки 10%). Наращивание гибридных клеток необходимо для замораживания полученных стабильных клонов и для введения мышам линии BALB/C для получения асцитной жидкости, содержащей антитела. Флаконы с гибридомными клетками помещают в СО2-инкубатор. При последующем культивировании клеток среду меняли 2-3 раза в неделю.
Пример 2. Получение МКА 4G1-D2
За 1-2 нед. до введения гибридомных клеток, выращенных в культуре, мышам линии BALB/C в возрасте 3-4 мес. проводили интраперитонеальную инъекцию 0,3-0,5 мл минерального масла (пристана) либо за 3 дня до введения - вазелиновое масло по 0,2 мл на каждую мышь для лучшей приживаемости гибридомных клеток и во избежание развития солидных (твердых) опухолей. В процессе развития асцитной опухоли клетки гибридомы оздоравливаются и избавляются от бактериальной и вирусной инфекций. Скорость роста клеток, извлеченных из асцита, обычно значительно выше, чем до введения их в перитонеальную полость. Если вместо асцитной жидкости образовалась солидная опухоль, ее извлекали, гомогенизировали и вводили другим мышам. Каждой мыши вводили 106-107 гибридомных клеток в среде RPMI1640. Гибридома растет в виде асцитной опухоли, и асцитная жидкость содержит антитела в концентрации, приблизительно в 10-500 раз превышающей таковую в культуральной жидкости. Через 7-10 дней после введения гибридомных клеток у мышей собирали асцит, проверяли на антителопродуцирующую активность методом твердофазного ИФА (табл. 2). Часть полученной асцитной жидкости замораживали и хранили при температуре -30°С, а осадок клеток замораживали либо снова вводили мышам для дальнейшей наработки антител.
Пример 3. Иммуноблот с МКА 4G1-D2. Определение специфической активности в отношении рекомбинантных белков человека GAGE1 и GAGE2D
Рекомбинантные белки человека GAGE1, GAGE2D и тиоредоксин, полученные из одного источника, разгоняли в 12% полиакриламидном геле по методу Лэммли [Laemmli, U.К. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227(5259):680-685], после чего переносили на нитроцеллюлозную мембрану (GE Healthcare Life Sciences, Amersham, Germany) на аппарате Mini Trans-Blot (BIO RAD, США). Далее мембрану блокировали раствором 5% бычьего сывороточного альбумина (БСА) в 0,01 М фосфатно-солевом буфере (рН-7,4) и последовательно инкубировали с МКА 4G1-D2 при комнатной температуре 2 часа, затем с пероксидазным конъюгатом к целой молекуле IgG мыши (Sigma, США) при комнатной температуре 1 час с промежуточными трехкратными промываниями в 0,01 М фосфатно-солевом буфере, содержащем 0,1% Твина-20, после каждой инкубации. Визуализацию реакции проводили раствором субстратной смеси на основе диаминобензидина (0,05% диаминобензидина (Sigma, США), 0,015% Н2О2, 0,01 М фосфатно-солевой буфер, рН-7,4). Реакцию останавливали промывкой дистиллированной водой.
Как показал проведенный анализ, МКА 4G1-D2 специфически взаимодействовали с рекомбинантными белками человека GAGE1 и GAGE2D и не давали перекрестную реакцию с рекомбинантным тиоредоксином человека, имеющим сходный молекулярный вес (фиг. 3).
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ mus musculus α-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ГРАНУЛОЦИТАРНОМУ КОЛОНИЕСТИМУЛИРУЮЩЕМУ ФАКТОРУ (GCSF) ЧЕЛОВЕКА | 2013 |
|
RU2542381C2 |
| Способ получения рекомбинантного белка GAGE1 человека | 2016 |
|
RU2652890C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ПЕПТИДУ, ОБЛАДАЮЩЕМУ АПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2009 |
|
RU2402605C1 |
| Штамм гибридных клеток животных Mus musculus 1F1 - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2 | 2021 |
|
RU2769817C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПРЕДОТВРАЩЕНИЯ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К CD3-АНТИГЕНУ Т-ЛИМФОЦИТОВ ЧЕЛОВЕКА, ГИБРИДОМА И СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ, ИМЕЮЩИХ РЕАКЦИЮ ОСТРОГО ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА ПОСЛЕ ПЕРЕСАДКИ ПОЧКИ | 2000 |
|
RU2179862C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. musculus - 4F11, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ВЫСОКОПАТОГЕННОГО ШТАММА virus A/duck/Novosibirsk/56/05 Н5N1 | 2008 |
|
RU2384617C1 |
| Штамм гибридных клеток животных Mus musculus 2E1B5 - продуцент моноклонального антитела к рецептор-связывающему домену белка S вируса SARS-CoV-2 | 2021 |
|
RU2771288C1 |
| Штаммы гибридных клеток животных Mus. Musculus - продуценты моноклональных антител к белку GP вируса Эбола (subtype Zaire) и моноклональные антитела к белку GP вируса Эбола (subtype Zaire) | 2017 |
|
RU2686630C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. Musculus - 1E7, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ПАНДЕМИЧЕСКОГО ВИРУСА ГРИППА А/IIV-Moscow/01/09(H1N1)sw1 | 2011 |
|
RU2457243C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. Musculus - 6F3, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ВЫСОКОПАТОГЕННОГО ШТАММА virus A/duck/Novosibirsk/56/05 H5N1 | 2008 |
|
RU2385929C1 |

Изобретение относится к области биотехнологии, в частности к гибридомной технологии, и представляет собой штамм гибридных клеток mus musculus α - продуцент моноклональных антител к раково-тестикулярному антигену человека GAGE. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИгенетика Минобрнауки России (БРЦ ВКПМ) под номером Н-174. Изобретение позволяет получить высокоспецифичные моноклональные антитела, которые могут использоваться в экспериментальной онкологии для изучения структурно-функциональных свойств белков семейства GAGE в культурах клеток и клинических образцах. 3 ил., 2 табл., 3 пр.
Штамм гибридных культивируемых клеток животных mus musculus α - продуцент моноклональных антител, специфичных к раково-тестикулярному антигену человека GAGE, депонированный во Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИгенетика Минобрнауки России (БРЦ ВКПМ) под номером Н-174.
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 5G6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К V АНТИГЕНУ Yersinia pestis | 2011 |
|
RU2478703C1 |
| US 8969531 B2, 03.03.2015 | |||
| GJERSTORFF M., et al., The role of GAGE cancer/testis antigen in metastasis: the jury is still out, BMC Cancer, 2016, 16, 7, pp.1-4, DOI 10.1186/s12885-015-1998-y. | |||
Авторы
Даты
2018-05-03—Публикация
2017-07-20—Подача