Группа изобретений относится к области молекулярной иммунологии, биотехнологии и медицины, в частности к получению антител, специфически блокирующих опухолеассоциированный MUC1, и может быть использовано в качестве мишени для разработки мониторинговых и терапевтических подходов в лечении больных злокачественными новообразованиями.
Муцин 1 (MUC1) представляет собой гликопротеин, экспрессируется на высоком уровне в ряде эпителиальных злокачественных опухолей человека, в том числе при раке молочной железы, предстательной железы, толстой кишки, яичников и панкреатических карцином, а также на злокачественных клетках множественной миеломы. В раковых клетках регистрируется изменение экспрессии гена MUC1, отклонения от нормального гликозилирования белка и изменения внутриклеточной локализации (Joshi S., Kumar S., Choudhury A., et al. Altered Mucins (MUC) trafficking in benign and malignant conditions. Oncotarget. 2014; 5(17): 7272-84. - Измененное распределение муцинов (MUC) при доброкачественных и злокачественных состояниях). Изменение свойств MUC1 приводит к метаболическому перепрограммированию клетки, приобретению новых функций и играет важное значение в развитии опухоли (Nath S, Mukherjee P. MUC1: a multifaceted oncoprotein with a key role in cancer progression. Trends Mol Med. 2014; 20(6): 332-342. - MUC1: многогранный онкобелок с ключевой ролью в прогрессии рака). Такие изменения в экспрессии MUC1 и его роль в жизнедеятельности опухолевых клеток позволяют использовать опухолеассоциированный MUC1 в качестве мишени для разработки новых мониторинговых и терапевтических подходов в лечении больных со злокачественными новообразованиями. Разработки направлены на получение молекул, специфически блокирующих опухолеассоциированный MUC1.
Известны способы индукции у больного иммунного ответа против MUC1 с использованием иммуногенного гликопептида в качестве вакцины против рака, а также использование экзогенных антител в терапии и диагностике рака (Clausen, et al. US 20140005366 А1). Также известны способы лечения больных немелкоклеточным раком легкого или раком простаты путем введения синтетических пептидов на основе MUC1 в составе липосомальный вакцины (Longenecker, US 20080131495 А1). Известно использование пептидов, соответствующих цитоплазматическому домену для терапии MUC1 позитивных опухолей. Эти пептиды способны ингибировать олигомеризацию белка MUC1, ингибировать взаимодействие MUC1 с NF-kappaB или STAT, тем самым блокировать воспалительную реакцию (Kufe, et al. US 20110015138 А1).
Известно антитело и его антиген-связывающий фрагмент, специфичность которых в отношении опухолеассоциированного MUC 1 выше в 100 раз или более по сравнению с MUC1, экспрессирующимся на поверхности нормальных эпителиальных клеток (Nishimura, et al. US 20120040375 A1). Моноклональные антитела, направленные против эпитопов, расположенных в регионе тандемных повторов MUC1, используемые в качестве иммунотерапевтических средств для лечения и профилактики рака (Nishimura, et al. US 20130034557 A1). Известно использование антител, которые одновременно связывают место объединения альфа- и бета-субъединиц белка MUC1, в диагностике и иммунотерапии онкозаболеваний (Rubinstein, et al. US 20120207772 А1).
За прототип настоящего изобретения выбрано известное моноклональное антитело ИКО25, специфичное к MUC1 и характеризующееся высокой константой ассоциации и высоким числом сайтов связывания на клетку, а также высокой избирательностью воздействия на опухолевые клетки, а также отсутствием тяжелых токсических и побочных эффектов и возможностью системного воздействия на организм путем внутривенного введения препарата (патент RU 2198681 С2, заявка 2000132677/13 «Моноклональное антитело ИКО25, специфичное к антигену MUC1, противоопухолевое средство»).
Недостатком известного изобретения является:
- использование моноклонального антитела мыши, обладающего иммуногенностью у человека, что ограничивает его использование в иммунотерапии онкологических заболеваний;
- известное антитело не обладает непосредственным цитотоксическим действием;
- большой размер молекулы известного антитела препятствует распознаванию некоторых скрытых эпитопов антигена MUC1 за счет структурных особенностей белка;
- производство известного антитела является дорогостоящим.
Таким образом, в уровне техники существует потребность в разработке новых антител (антиген-узнающих молекул), лишенных указанных выше недостатков и специфически узнающих белок MUC 1.
Техническим результатом предлагаемой группы изобретений является
- получение рекомбинантных одноцепочных антител, связывающих опухолеассоциированный белок MUC1, обладающих сниженной иммуногенностью и цитотоксичностью в отношении линий раковых клеток Colo205 (рак толстой кишки) и MCF7 (рак молочной железы).
Группа изобретений направлена на решение двух задач:
- Разработка структуры рекомбинантных одноцепочных антител, обладающих специфичностью к опухолеассоциированному белку MUC1, обладающих сниженной иммуногенностью и обладающих цитотоксичностью в отношении раковых клеток.
- Создание способов получения рекомбинантных одноцепочных антител, связывающих опухолеассоциированный MUC1 и обладающих цитотоксичностью в отношении линий раковых клеток, для иммунотерапии злокачественных новообразований.
Краткое описание
Первая задача решается тем, что в соответствии с изобретением определяют первичную структуру мРНК, кодирующих вариабельные участки легкой и тяжелой цепей моноклонального антитела ИКО25 против MUC1. Полученную нуклеотидную последовательность используют для предсказания аминокислотной. С использованием возможностей базы данных NCBI методами биоинформатики в структуре легкой и тяжелой цепей определяют антигенсвязывающие участки. На основе полученных технических результатов конструируют рекомбинантные одноцепочные антитела связывающие опухолеассоциированный MUC1, обладающие сниженной иммуногенностью. Отличительными признаками структурных вариантов рекомбинантных одноцепочных антител связывающих опухолеассоциированный MUC1 являются комбинации связывающих участков легкой и тяжелой цепей (первый: HL тяжелая - легкая (SEQ ID NO: 1); второй: LH легкая - тяжелая (SEQ ID NO: 2)). Для сохранения функциональной активности связывающих участков при объединении в одну белковую молекулу между ними располагают линкер, состоящий из нуклеотидной последовательности, кодирующей повтор из двенадцати аминокислот (SGGGG)x3.
Технический результат изобретения заключается в создании рекомбинантных одноцепочечных антител, которые сохраняют свойство специфично связывать опухолеассоциированный антиген MUC1 и отличаются от классического бивалентного моноклонального антитела ИКО25 (прототип) тем, что представляют собой одноцепочечное антитело, не содержащее константных регионов, присутствующих в прототипе, что значительно снижает их иммуногенность. Рекомбинантные одноцепочные антитела (молекулярная масса около 27,1 кДа) меньше по размеру, что позволяет узнавать «скрытые» для обычных антител эпитопы. Отличительной функциональной особенностью заявляемых рекомбинантных одноцепочных антител от моноклонального антитела ИКО25 является их цитотоксическое действие на экспрессирующие MUC1 линии клеток рака молочной железы (MCF7) и клеток рака толстой кишки (Colo205), выраженное в снижении жизнеспособности данных клеток, поэтому могут быть использованы для лечения рака толстой кишки, молочной железы и других локализаций злокачественных опухолей эпителиального происхождения.
Вторая задача в соответствии с изобретением достигается изготовлением генетических конструкций, которые в составе плазмидных ДНК содержат последовательности, кодирующие варианты рекомбинантных одноцепочных антител, и получением штаммов бактерий Escherichia coli Rosetta2 (DE3) или дрожжей Pichia pastoris - продуцентов вариантов рекомбинантных одноцепочных антител, связывающих опухолеассоциированный MUC1.
Для штаммов бактерий Escherichia coli Rosetta2 (DE3) используют плазмидную ДНК, в структуру которой с использованием методов молекулярного клонирования встраивают нуклеотидную последовательность, кодирующую SEQ ID NO: 1 варианты рекомбинантных одноцепочечных антител, находящуюся под контролем промотора и терминатора бактериофага Т7.
Для дрожжей Pichia pastoris используют плазмидную ДНК, содержащую последовательность, кодирующую SEQ ID NO: 2 вариант рекомбинантных одноцепочечных MUC1-связывающих антител, находящуюся под контролем АОХ1 промотора и терминатора.
Штамм бактерий Escherichia coli Rosetta2 (DE3) или дрожжей Pichia pastoris (Х33 и GS115) получают методом электропорации плазмидных ДНК, содержащих варианты рекомбинантных одноцепочечных антител, связывающих MUC1, под контролем видоспецифичных промоторов.
Проводят культивирование микроорганизмов и индукцируют экспрессию рекомбинантных одноцепочных антител. Клетки лизируют, проводят очистку и солюбилизацию рекомбинантных одноцепочных антител, связывающих опухолеассоциированный MUC1. Специфичность взаимодействия рекомбинантных одноцепочных антител с опухолеассоциированным MUC1 определяют методами иммуноферментного анализа и иммунофлуоресценции с использованием проточной цитофлуореметрии. Цитотоксичность определяют с использованием МТТ теста.
Разработка структуры рекомбинантных одноцепочных антител, обладающих специфичностью к опухолеассоциированному белку MUC1 и сниженной иммуногенностью, представлена в примере 1. Способ получения рекомбинантных одноцепочных антител, связывающих опухолеассоциированный MUC1, описан в примерах 2 и 3. Возможность использования полученных рекомбинантных одноцепочных антител для детекции белка MUC1 и их функциональные характеристики показаны в примерах 4 и 5.
На фиг. 1 представлены результаты электрофореза образцов нерастворимой фракции белков Е. coli при определении уровня экспрессии рекомбинантного одноцепочечного антитела. Слева расположен маркер молекулярных весов (10; 18,4; 25; 35; 62; 90 КДа), далее нерастворимые фракции белков до и после индукции экспрессии;
На фиг. 2 представлена электрофореграмма амплификации кДНК, кодирующих легкие (VL) и тяжелые (VH) цепи антитела ИКО25, и объединения их в одну молекулу (LH) в сравнении с маркерами равномерности (М) ДНК 100 bp + 1.5 Kb (НПО «СибЭнзим»).
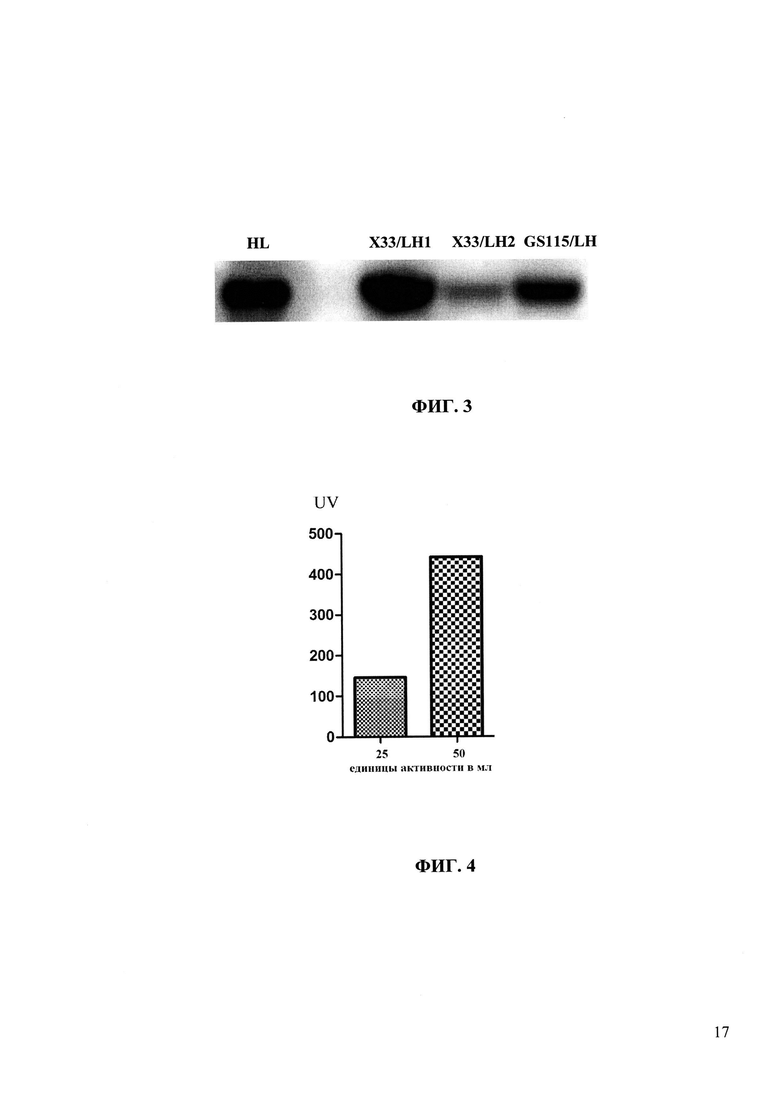
На фиг. 3 представлены результаты детекции рекомбинантного одноцепочного антитела методом Вестерн блотинга в лизатах клеток Е. coli (HL) и Pichia pastoris штаммов X-33/LH1, X-33/LH2 и GS115/LH.
На фиг. 4 представлены результаты иммуноферментного анализа узнавания природного очищенного антигена MUC1 (М20), выделенного из опухоли молочной железы рекомбинантным одноцепочным антителом. Ось ординат отражает данные поглощения при длине волны 405 нм. Представлены усредненные результаты экспериментов для 25 и 50 единиц активности природного очищенного антигена MUC1.
На фиг. 5 показаны результаты проточной цитофлуореметрии клеток Colo205 после взаимодействия с антителами ИКО25 и рекомбинантным одноцепочечным антителом. Ось ординат соответствует количеству клеток. Ось абсцисс отражает уровень флуоресценции при длине волны 650 нм.
Осуществление настоящего изобретения
Пример 1. Конструирование одноцепочечных антител, связывающих опухолеассоциированный MUC1.
С использованием компьютерных программ MEGA 6.0 и Megalign (Lasergen Inc, USA) проводят сравнение нуклеотидных последовательностей мРНК IgG антител мышей линии BALB, доступных в базе данных NCBI (https://www.ncbi.nlm.nih.gov/ доступно на 27.11.2016). В нуклеотидных последовательностях определяют консервативные участки, на основе которых при помощи программ «PrimerSelect» и «EditSEQ» выбирают олигонуклеотидные праймеры.
Синтез комплементарной ДНК вариабельных участков легкой цепи (VL) и тяжелой цепи (VH) мышиного моноклонального антитела проводят на матрице мРНК, выделенной из клеток гибридомы ICO-25, продуцирующих моноклональное антитело против опухолеассоциированного MUC1, методом обратной транскрипции полимеразной цепной реакции (ПЦР) при следующих температурных условиях: 94°C - 5', 45 циклов 94°C - 30'', 50°C - 30'', 72°C - 1' и 72°C - 5') с использованием олигонуклеотидов 5'-GATATACATATGGAAATTGTGCTGACCCA-3' и 5'-TGCAGCCACAGTTCGTTTGATTTCCAGCTT-3' для фрагмента VL и 5'-GATATACATATGGAAGTGCAGCTGGTGGAGTC-3' и 5'-GCCCTTGGTGGAGGCTGAGGAGACTGTGA-3' для фрагмента VH (фиг. 1). Полученные фрагменты кДНК очищают от агарозного геля с использованием набора GeneJET Gel Extraction Kit (Fermentas, Латвия) и используют для определения их первичной структуры. Проводят реакцию терминирования с использованием набора BigDye Terminator v 3.1 cycle SEQuencing kit (ABI Prizm, США). Реакционную смесь осаждают изопропанолом и разводят в 20 мкл деионизованного формамида и прогревают в кипящей водяной бане. Проводят электрофорез одноцепочечной ДНК в приборе ABI Prizm 3130 Genetic Analyzer (США) и регистрируют нуклеотидную последовательность. Аминокислотную последовательность региона, кодирующего вариабельные части легкой и тяжелой цепей моноклонального антитела, продуцируемого клетками гибридомы ICO-25, предсказывают с использованием компьютерной программы, например «EditSEQ» производства Lasergen, США.
С использованием возможностей базы данных NCBI методами биоинформатики в структуре легкой и тяжелой цепей определяют антигенсвязывающие участки. На основе полученных технических результатов конструируют одноцепочечные антитела (scFv), связывающие опухолеассоциированный MUC1, обладающие сниженной иммуногенностью. Отличительными признаками структурных вариантов одноцепочечных MUC1-связывающих антител являются комбинации связывающих участков легкой и тяжелой цепей (первый: LH легкая - тяжелая (SEQ ID NO: 1); второй: HL тяжелая - легкая (SEQ ID NO: 2). Для сохранения функциональной активности связывающих участков при объединении в одну белковую молекулу между ними располагают линкер, состоящий из нуклеотидной последовательности, кодирующей повтор из семнадцати аминокислот SGGGGSGGGGSGGGGS. Структурно молекула scFv может быть представлена в виде нескольких вариантов: VH - линкер - VL или VL - линкер - VH, где VH и VL являются вариабельными частями тяжелой и легкой цепей моноклонального антитела ИКО25 соответственно, соединяемые линкером - участком, необходимым для приобретения правильной конформации. К C-концевой части одноцепочных антител добавляют последовательность, состоящую из шести гистидинов для проведения последующей очистки.
Пример 2. Получение штаммов Escherichia coli - продуцентов рекомбинантного одноцепочечного антитела HL (SEQ ID NO: 1).
Для получения рекомбинантных одноцепочных антител, связывающих опухолеассоциированный MUC1, методами биоинформатики (например, используя компьютерную программу JCat, доступную в сети Интернет (Grote A., Hiller K., Scheer М., Munch R., Nortemann В. et al. JCat: a novel tool to adapt codon usage of a target gene to its potential expression host. Nucleic Acids Res. 2005; 33 (Web Server issue): W526-31 - JCat: новый инструмент адаптации использования кодонов целевого гена для его экспрессии в потенциальном хозяине) в нуклеотидной последовательности, кодирующей одноцепочные антитела, связывающие опухолеассоциированный MUC1, проводят оптимизацию кодонов для их экспрессии в клетках Е. coli. Оптимизированная нуклеотидная последовательность HL, кодирующая пептид (SEQ ID NO: 1), была химически синтезирована фирмой «Евроген», Москва. Полученную нуклеотидную последовательность клонируют по сайтам NdeI и NotI с использованием плазмидного вектора pET22b (Novagen, США) как описано ранее (Sambrook et al., 1989). Проводят отбор клонов, несущих оптимизированную нуклеотидную последовательность, кодирующую антитело связывающий MUC1 в составе плазмиды, методом определения нуклеотидной последовательности. Для этого проводят реакцию терминирования с использованием набора BigDye Terminator v 3.1 cycle SEQuencing kit (ABI Prizm, США). Реакционную смесь осаждают изопропанолом и разводят в 20 мкл деионизованного формамида и прогревают в кипящей водяной бане. Проводят электрофорез одноцепочечной ДНК в приборе ABI Prizm 3130 Genetic Analyzer (США) и регистрируют нуклеотидную последовательность. В результате получают плазмиду pET22-HL, несущую ген рекомбинантного одноцепочечного антитела, расположенный под контролем промотора и терминатора бактериофага Т7.
В качестве клеток продуцентов используют штамм Е. coli Rosetta2 (DE3) производства Novagen, США. Клетки выращивают на селективной среде LB (1% триптон, 1% NaCl, 0,5% дрожжевой экстракт) при 25-37°C до оптической плотности 0,5-0,8 О.Е. в течение 10-14 часов при интенсивном перемешивании. Клетки собирают центрифугированием (7000 об/мин в течение 20 минут при 4°C) и трансформируют плазмидой pET22-HL методом электропорации, как описано ранее (Woodall С.A. Electroporation of Е. coli. Methods Mol. Biol. 2003; 235: 55-69 - Электропорация E. coli). Таким образом получают штамм Е. coli Rosetta2 (DE3), содержащий плазмидную ДНК, кодирующую рекомбинантное одноцепочечное антитело HL (SEQ ID NO: 1). С использованием одной колонии выращивают биомассу клеток на селективной среде LB (1% триптон, 1% NaCl, 0,5% дрожжевой экстракт и 50 мкг/мл ампициллина) и индуцируют экспрессию добавлением 1 мМ индолил-бета-D-галактопиранозида. Клетки инкубируют при интенсивном перемешивании в течение 3 часов при 30°C, собирают центрифугированием, лизируют ультразвуком и разделяют центрифугированием на растворимые и нерастворимые фракции. Полученные фракции анализируют методом электрофореза в полиакриламидном геле (Sambrook et al., 1989). На фиг. 1 представлены результаты электрофореза нерастворимой фракций лизата Е. coli. в которой нарабатывалось рекомбинантное одноцепочечное антитело. Рекомбинантный полипептид выделяют методом аффинной хроматографии с использованием набора Bio-Scale Mini Profinity IMAC cartridges (BioRad, США) в присутствии 6M гуанидин-гидрохлорида. Проводят диализ против буфера содержащего 100 мМ натрий карбоната pH 8.5, 10% глюкозы, 10 мМ β-меркаптоэтанола, 400 мМ аргинина, 150 мМ NaCl, 40 мМ Na2SO4, 40 мкМ CuSO4, 0,02% Tween 20 и используют для исследования биологических свойств.
Пример 3. Получение штаммов дрожжей Pichia pastoris - продуцентов рекомбинантных одноцепочечных антител LH (SEQ ID NO: 2).
Для приготовления генетических конструкций в составе плазмидных ДНК, предназначенных для получения штаммов дрожжей Pichia pastoris - продуцентов рекомбинантных одноцепочных антител связывающих MUC1, методом ПЦР проводят синтез фрагментов ДНК, кодирующих легкие (VL) и тяжелые (VH) цепи антитела ИКО25, с использованием следующих пар праймеров 5'-GGTGGTGGTACCATGGAAATTGTGCTGACCCAG-3', 5'-GCCGCCGCCGCCGCTACCACCACCACCTTTGATTTCCAGCTTTGT-3' и 5'-TGGTTCTGGCGGGCGGCGGCTCCGGTGGTGGTGGTTCTGAAGTGCAGCTGGTGGAG-3', 5'-ATGGCTGCGGCCGCTCAATGATGATGGTGATGATGTGAGGAGACTGTG ACTGA-3' соответственно. Полученные фрагменты ДНК очищают через агарозный гель с использованием набора GeneJET Gel Extraction Kit (Fermentas, Латвия) и используют для рекомбинации методом ПЦР. На Фиг.2 показана электрофореграмма результатов амплификации кДНК, кодирующих легкие (VL) и тяжелые (VH) цепи антитела ИКО25, и объединения их в одну молекулу (LH) в сравнении с маркером размерности (М) ДНК 100 bp + 1.5 Kb (НПО «СибЭнзим»). Таким образом получают последовательности ДНК, кодирующие рекомбинантное одноцепочное антитело, состоящее из легкой (VL) и тяжелой (VH) цепей, соединенных спейсером.
Полученный фрагмент кДНК очищают от агарозного геля, обрабатывают эндонуклеазами рестрикции KpnI и NotI и лигируют с плазмидным вектором pPICZA (Invitrogen, США). Лигазную смесь используют для трансформации клеток Е. coli штамм Тор 10 и высевают на селективную среду LB (1% триптон, 0,5% NaCl, 0,5% дрожжевой экстракт и 50 мкг/мл зеоцина). Селекцию плазмид, не содержащих ошибок, проводят методом определения нуклеотидной последовательности. Для интеграции вектора в геномом Pichia pastoris выделяют плазмиду pPICZA/LH из бактериальной культуры, переводят в линейную форму эндонуклеазой рестрикции Sad и используют для трасформации дрожжей Pichia pastoris штаммов Х-33 и GS115 методом электропорации. Для этого с помощью стерильной петли отбирают отдельную колонию дрожжей и засевают в 10 мл среды YPD (1% дрожжевой экстракт, 2% пептон, 2% D-глюкоза). Оставляют на ночь на качалке (~200 об/мин) при температуре 28-30°С. Далее суспензию клеток разбавляют средой YPD до оптической плотности 0,1-0,2 при длине волны 600 нм. Затем вновь растят клетки на качалке в течение 4-6 часов, пока оптическая плотность культуры не достигает 0,6-1,0. Клетки осаждают центрифугированием при скорости 500×g в течение 5 мин, супернатант удаляют. Клетки ресуспендируют в 10 мл 10% раствора глицерина, смешивают с плазмидой pPICZA/LH и проводят электропорацию в приборе Gene Pulser Xcell (BioRad, США) согласно рекомендациям производителя. Клетки высевают на твердую среду YPD (1% дрожжевой экстракт, 2% пептон, 2% D-глюкоза, 2% агар, 100 мкг/мл зеоцина). Отбор колоний, содержащих нуклеотидную последовательность пептида LH (SEQ ID2), проводят методом ПЦР.
Для наработки рекомбинантного одноцепочного антитела LH отдельной колонией штамма дрожжей засевают 100 мл буферной среды YPD. Инкубируют 24 часа на качалке (250-300 об/мин) при 30°C. Клеточную массу осаживают центрифугированием (500×g, 5 мин) и переносят в буферную среду для индукции (1% дрожжевой экстракт, 2% пептон, 1% метанол, 100 мM KH2PO4 (pH 7,5), 0,000001% биотин). Инкубируют 72 часа при 15°C. Клеточную массу осаждают центрифугированием и исследуют на присутствие рекомбинантного одноцепочечного антитела методом Вестерн-блот с использованием антител против последовательности, состоящей из шести остатков гистидина (Sambrook et al., 1989). На фиг. 3 представлены результаты Вестерн блотинга, из которых следует, что штаммы дрожжей Pichia pastoris X-33/LH1 и GS115/LH обладают наибольшей продуктивностью. Рекомбинантные одноцепочечные антитела выделяют методом аффинной хроматографии с использованием набора Bio-Scale Mini Profinity IMAC cartridges (BioRad, США) согласно рекомендациям производителя.
Пример 4. Детекция опухолевого MUC1 с использованием рекомбинантных одноцепочных антител
Первичную оценку антиген-связывающей активности рекомбинантных одноцепочных антител проводили с применением антигена MUC1 (М20) (ООО Хема, Россия), выделенного из опухоли молочной железы. Для этого в лунки 96-луночного иммунологического планшета сорбируют образцы рекомбинантных одноцепочных антител в концентрации 1-0,10 мкг в мл и инкубируют в течение ночи при +4°C. Затем лунки отмывают фосфатным буфером (PBS) от несвязавшегося рекомбинантного одноцепочечного антитела, добавляют 1% раствор бычьего сывороточного альбумина в PBS и инкубируют в течение 2 часов при комнатной температуре. Лунки отмывают с использованием PBS, добавляют антиген MUC1 (М20) в концентрации 25 и 50 единиц активности в мл инкубируют 1 час при +37°С. Лунки отмывают с использованием PBS, добавляют антитело Х-16 (ООО Хема, Россия), меченное пероксидазой хрена, и инкубируют 1 час при +37°С. Лунки отмывают и проводят детекцию активности пероксидазы хрена с использованием хромогенного субстрата путем измерения оптической плотности при длине волны 405 нм.
Результаты, представленные на фиг. 4, свидетельствуют, что рекомбинантное одноцепочное антитело специфически связывает природный очищенный антиген MUC1 (М20), выделенный из опухоли молочной железы.
Полученные результаты подтверждают в реакции иммунофлуоресценции при исследовании экспрессии MUC1 методом проточной цитометрии. Рекомбинантные одноцепочные антитела метят активированным эфиром флуоресцентного красителя Су5 (Lumiprobe, США) согласно рекомендациям производителя, и используют для детекции белка MUC1 на поверхности линий раковых клеток Colo205, MCF7 и Сасо2. В результате проведенных исследований установлено, что рекомбинантные одноцепочные антитела окрашивают клетки линий Colo205 и MCF7, для которых известна экспрессия белка MUC1 на поверхности, и не окрашивают клетки линии Caco2, в которых экспрессия гена MUC1 не регистрируется.
На фиг. 5 показаны уровни флуоресценции клеток Colo205 после взаимодействия с антителами ИКО25 в сравнении с рекомбинантным одноцепочечным антителом. Установлено, что уровень флуоресценции клеток при окрашивании рекомбинантным одноцепочечным антителом в среднем в 5,5 раз превышал уровень флуоресценции клеток, окрашенных ИКО25. Представленные данные свидетельствуют о способности рекомбинантных одноцепочечным антител узнавать недоступные для классических антител эпитопы белка MUC1.
Пример 5. Оценка цитотоксического действия рекомбинантных одноцепочных антител на линии раковых клеток.
Возможность цитотоксического действия полученных одноцепочных антител определяют по метаболической активности MUC1 позитивных линиях раковых клеток (Colo205 и MCF7) с использованием теста на восстановление 3-[4,5-диметилтиазолил-2-ел]-2,5-дифенилтетразолиум бромида (МТТ). Для этого клетки инкубируют в присутствии различных концентраций рекомбинантных одноцепочных антител в течение 48 часов в питательной среде при 37°C во влажной атмосфере, содержащей 5% СО. Добавляют МТТ и инкубируют 4 часа при 37°C. Образовавшиеся гранулы растворяют в диметилсульфоксиде и измеряют количество восстановленного продукта фотометрически при длине волны 540 нм. В результате установлено, что при концентрации рекомбинантных одноцепочных антител 0,1-10 и 5-50 мкг в мл наблюдается 50%-ная гибель клеток Colo 205 и MCF7 соответственно. В то же время в данном диапазоне концентраций моноклональное антитело ИКО25 не влияло на метаболическую активность клеток линий Colo 205 и MCF7.
Таким образом, приведенные примеры демонстрируют достижение поставленных задач. В соответствии с изобретением разработаны одноцепочечные антитела в соответствии с последовательностью SEQ ID NO: 1 и SEQ ID NO: 2 первичной структурой, которая менее иммуногенна и сохраняет специфичность связывания с опухолеассоциированным антигеном MUC1. На основе клеток Е. coli и P. Pastoris получены штаммы-продуценты рекомбинантных одноцепочечных антител и способы их получения в очищенном виде. Показано, что разработанные рекомбинантные одноцепочечные антитела приобретают цитотоксические свойства в отношении линий раковых клеток, что позволяет использовать их для иммунотерапии злокачественных новообразований.
Перечень последовательностей
Аминокислотные последовательности двух сконструированных одноцепочечных антител, способных специфически связывать опухолеассоциированный белок MUC1 человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЙ ИММУНОТОКСИН НА ОСНОВЕ НЕСТРУКТУРНОГО ГЛИКОПРОТЕИНА NSP4 РОТАВИРУСА ЧЕЛОВЕКА, ПРОЯВЛЯЮЩИЙ ПОВЫШЕННОЕ ЦИТОТОКСИЧЕСКОЕ ВОЗДЕЙСТВИЕ НА ОПУХОЛЕАССОЦИИРОВАННЫЙ MUC1 РАКОВЫХ КЛЕТОК | 2024 |
|
RU2837117C1 |
| Рекомбинантный RBD S-белок коронавируса SARS-CoV-2 и способ его получения | 2023 |
|
RU2833839C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И Fab, СВЯЗЫВАЮЩИЕСЯ С АНТИГЕНОМ F1 ИЗ Yersinia pestis, И СПОСОБ ИХ ПОЛУЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ | 2009 |
|
RU2420587C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ (Fab) ПРОТИВ ВИРУСА БЕШЕНСТВА, ИЗОЛИРОВАННЫЙ ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ Fab ПРОТИВ ВИРУСА БЕШЕНСТВА, КЛЕТКА ДРОЖЖЕЙ, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ Fab ПРОТИВ ВИРУСА БЕШЕНСТВА С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ | 2010 |
|
RU2440412C2 |
| Плазмидная генетическая конструкция pVEAL2-9E2ch-scFv, штамм рекомбинантной клеточной линии CHO-K1-9E2ch и химерное одноцепочечное антитело 9E2ch против вируса Западного Нила, продуцируемое указанным штаммом клеточной линии CHO-K1-9E2ch, обладающее высоким сродством к неонатальному рецептору FcRn | 2022 |
|
RU2801532C1 |
| Рекомбинантный дрожжевой трансформант и способ получения с его использованием Fc-фрагмента иммуноглобулина | 2014 |
|
RU2664862C2 |
| ПРОДУКЦИЯ ГЛИКОПРОТЕИНОВ С МОДИФИЦИРОВАННЫМ ФУКОЗИЛИРОВАНИЕМ | 2008 |
|
RU2479629C2 |
| АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С MUC1, И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2746413C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab), СВЯЗЫВАЮЩИЕСЯ С ИНТЕРФЕРОНОМ- γ ЧЕЛОВЕКА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КЛЕТКА, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА | 2013 |
|
RU2539752C2 |
| Рекомбинантный Fab-scFv на основе нейтрализующего антитела против интерферона бета-1а человека и антитела против рецептора ErbB2 человека | 2019 |
|
RU2748953C1 |


Изобретение относится к области молекулярной иммунологии, биотехнологии и медицины, конкретно к получению антител, специфически блокирующих опухолеассоциированный MUC1, и может быть использовано в медицине. Предложено рекомбинантное одноцепочное антитело, связывающие опухолеассоциированный MUC1, обладающее цитотоксическим действием на линии раковых клеток, и способы его получения с использованием штаммов бактерий Escherichia coli Rosetta2 (DE3) и дрожжей Pichia pastoris X33 и GS115. Техническим результатом предлагаемого изобретения является сниженная иммуногенность получаемого антитела. 3 н.п. ф-лы, 5 ил., 1 табл., 5 пр.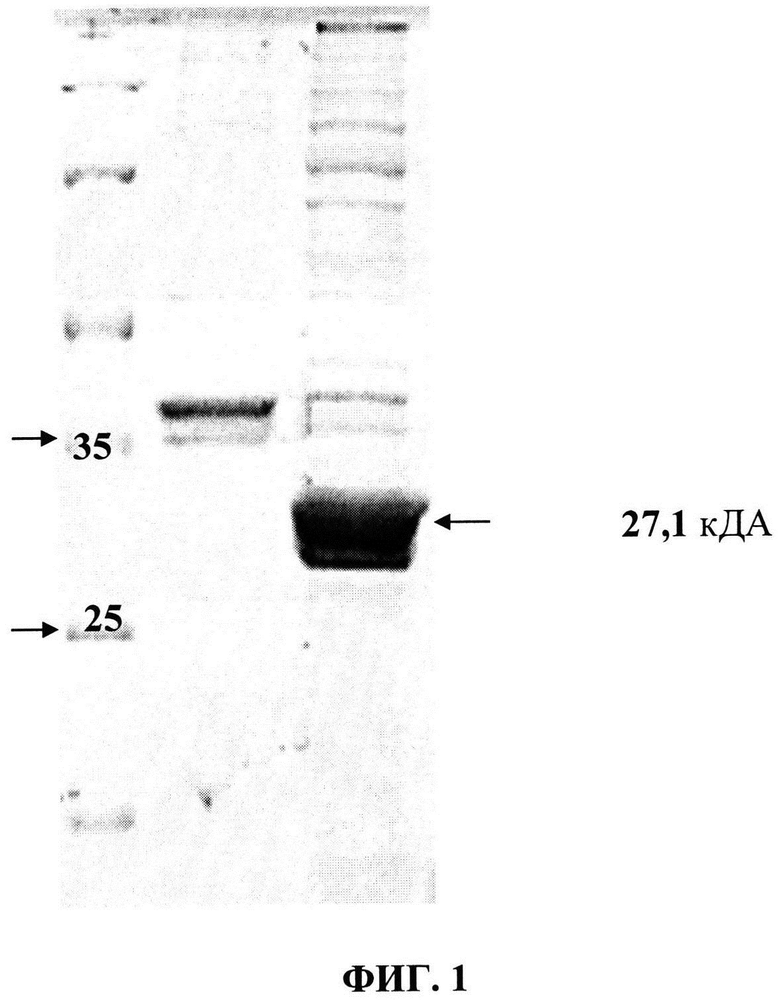
1. Антитело, способное специфически связывать опухолеассоциированный белок MUC1 человека, отличающееся тем, что имеет структуру в соответствии с последовательностью SEQ ID NO: 1 или SEQ ID NO: 2 и обладает сниженной иммуногенностью и прямым цитотоксическим действием на линии раковых клеток.
2. Штамм Rosetta2 (DE3) Escherichia coli - продуцент рекомбинантного одноцепочечного антитела, трансформированный плазмидой, которая содержит последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 1.
3. Штамм Х33 и GS115 Pichia pastoris - продуцент рекомбинантного одноцепочечного антитела, трансформированный плазмидой, которая содержит последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 2.
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИКО25, СПЕЦИФИЧНОЕ К АНТИГЕНУ МИС1, ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2000 |
|
RU2198681C2 |
| US 20120207772 A1, 16.08.2012 | |||
| BERTIL MACAO et | |||
| al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Насос | 1917 |
|
SU13A1 |
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| RAHBARIZADEH F et | |||
| al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2018-05-03—Публикация
2016-12-23—Подача