Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает преимущества предварительной патентной заявки США с серийным номером 61/736835, зарегистрированной 13 декабря 2012 г, раскрытие которой специально включено в настоящую заявку посредством ссылки.
Область техники, к которой относится изобретение
В данной работе предложены способы получения 4-амино-5-фтор-3-галоген-6-(замещенных)пиколинатов. В частности, в данной работе предложены способы получения 4-амино-5-фтор-3-хлор-6-(замещенных)пиколинатов из непиридинового источника.
Уровень техники
Патенты США 6784137 В2 и 7314849 В2 описывают, между прочим, некоторые соединения типа 4-амино-3-хлор-5-фтор-6-(арил)пиколинатов и их применение в качестве гербицидов. Патент США 7432227 В2 описывает, между прочим, некоторые соединения типа 4-амино-3-хлор-5-фтор-6-(алкил)пиколинатов и их применение в качестве гербицидов. Каждый из данных патентов описывает изготовление 4-амино-3-хлор-5-фторпиколинатов в качестве исходных веществ путем фторирования соответствующих 5-незамещенных пиридинов 1-(хлорметил)-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборатом). Каждый из данных патентов также описывает изготовление 6-(арил)-4-аминопиколинатов с помощью реакций сочетания, вовлекающих пиколины, имеющие легко удаляемую группу или металлическое производное в 6-положении пиколинового кольца. Благоприятно было бы получать 4-амино-5-фтор-3-хлор-6-(замещенные)пиколинаты без того, чтобы обращаться к реакциям сочетания в присутствии металла. Было бы полезно получать 4-амино-5-фтор-3-хлор-6-(замещенные)пиколинаты эффективным образом и с высоким выходом из непиридинового источника. Было бы полезно получать 4-амино-5-фтор-3-хлор-6-(замещенные)пиколинаты без того, чтобы обращаться к прямому фторированию 5-положения пиридинового кольца с помощью дорогого фторирующего агента, подобного 1-(хлорметил)-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборату).
Сущность изобретения
В данной работе предложены способы получения 4-амино-5-фтор-3-хлор-6-(замещенных)пиколинатов из непиридинового источника без использования реакций сочетания в присутствии металла и без фторирования с помощью дорогого фторирующего агента, подобного 1-(хлорметил)-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборату). В частности, в данной работе предложен способ получения 4-амино-5-фтор-3-хлор-6-(замещенных)пиколинатов формулы I
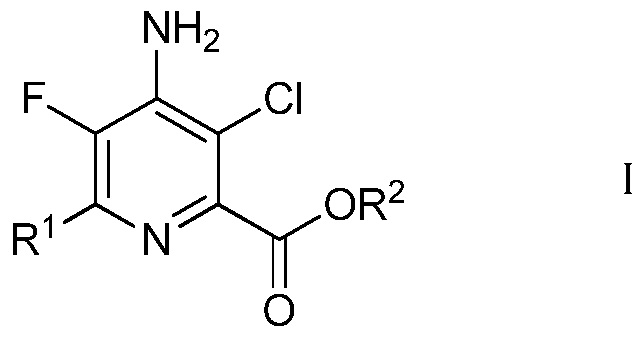
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R2 представляет собой С1-С12алкил или незамещенный или замещенный С7-С11арилалкил,
который включает следующие стадии:
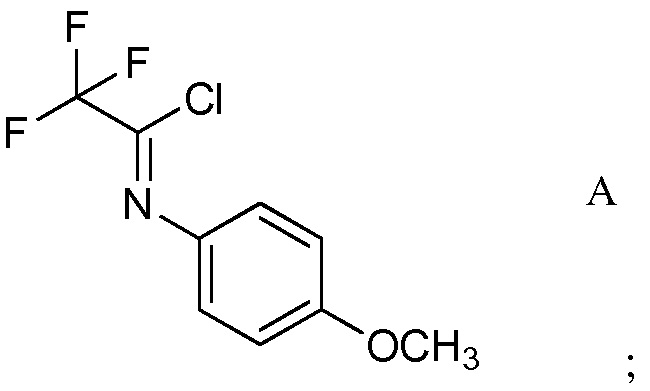
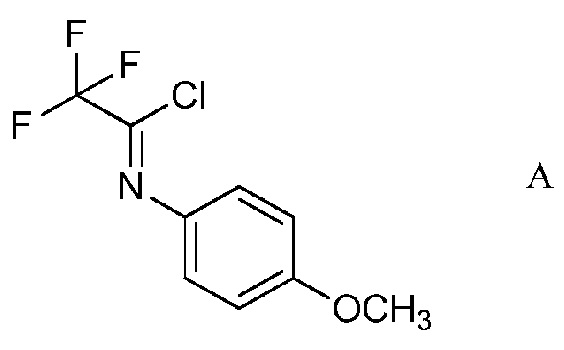
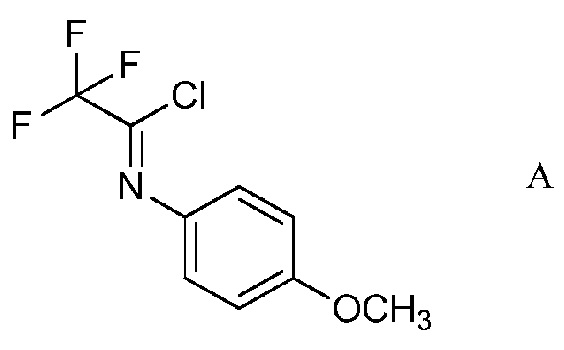
а) контактирование трифторуксусной кислоты с п-метоксианилином в присутствии триарилфосфина и триалкиламинового основания в растворителе четыреххлористый углерод для образования ацетимидоилхлорида формулы А
b) контактирование ацетимидоилхлорида формулы А с 3,3-диалкоксипроп-1-ином (формула В)
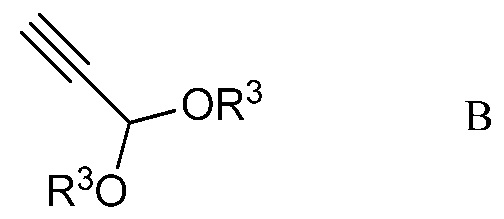
в которой R3 представляет собой С1-С4алкил,
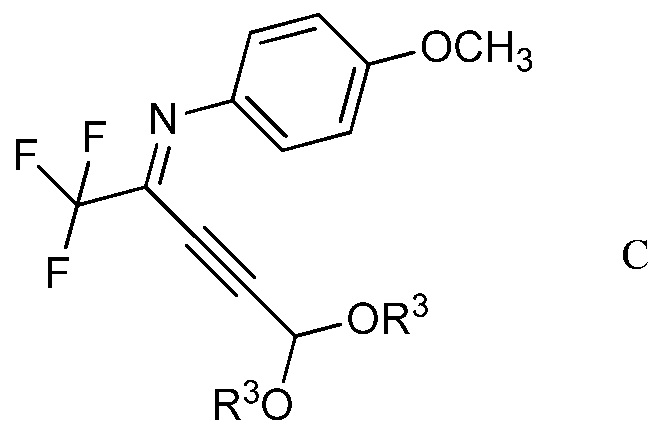
в присутствии иодида меди(I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе для получения (имино)пент-2-индиалкилацеталя формулы С
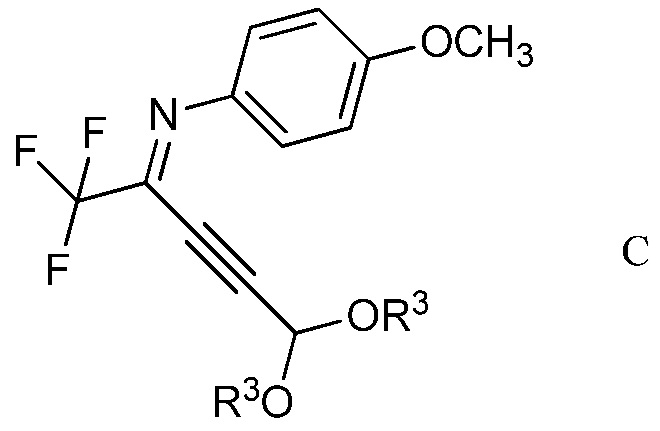
в которой R3 является таким, как определено ранее;
с) циклизация (имино)пент-2-индиалкилацеталя формулы С с амином формулы D

в которой R1 является таким, как определено ранее,
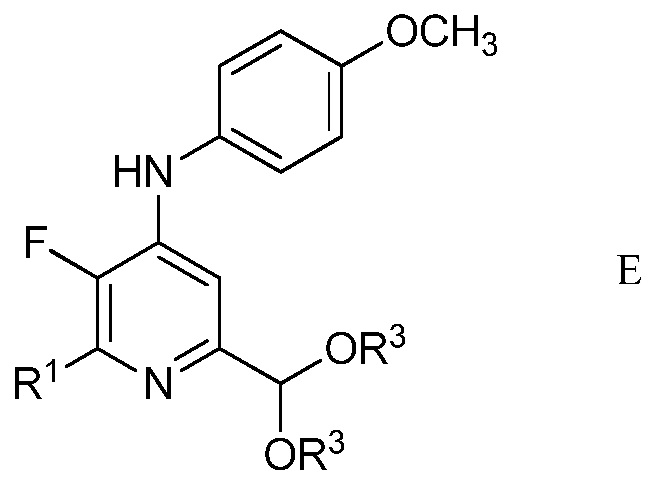
в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре приблизительно от комнатной до приблизительно 100°С для образования 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е
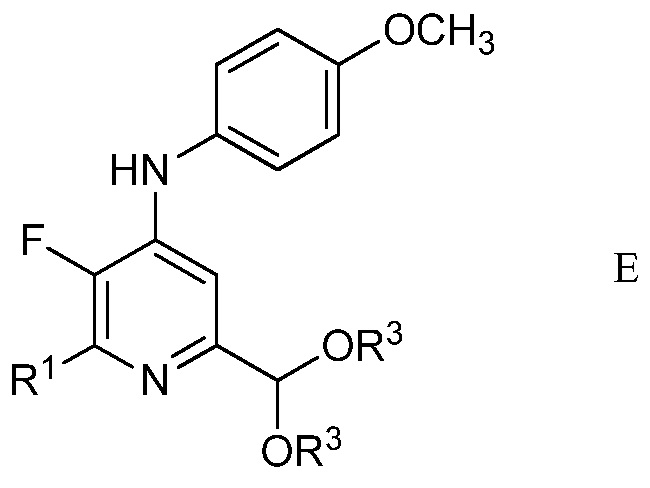
в которой R1 и R3 являются такими, как определено ранее;
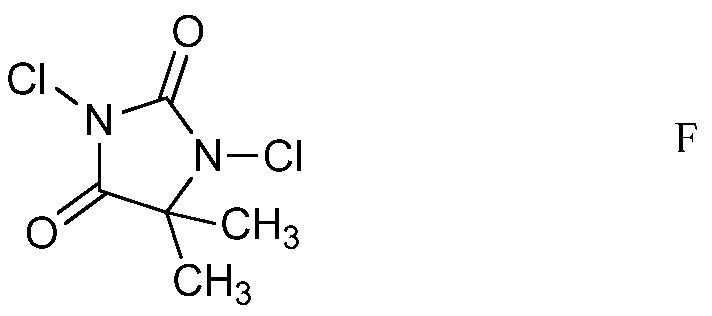
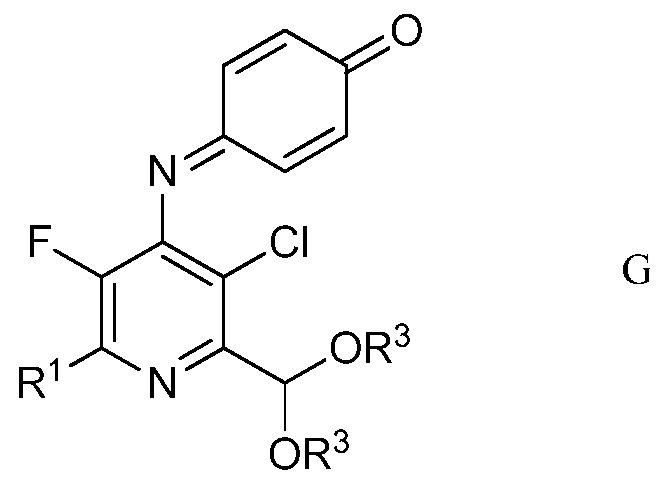
d) хлорирование 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е посредством 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона (формулы F)
в полярном растворителе для получения защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G
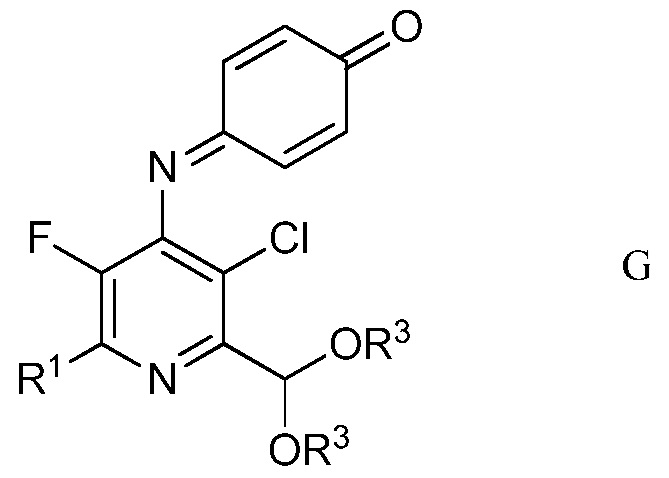
в которой R1 и R3 являются такими, как определено ранее;
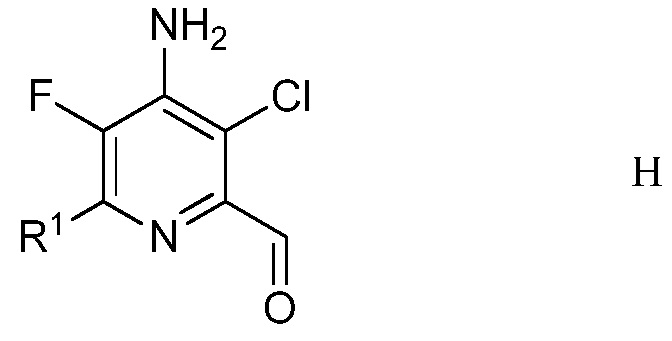
е) удаление защиты и гидролиз защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G с помощью минеральной кислоты в полярном растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н
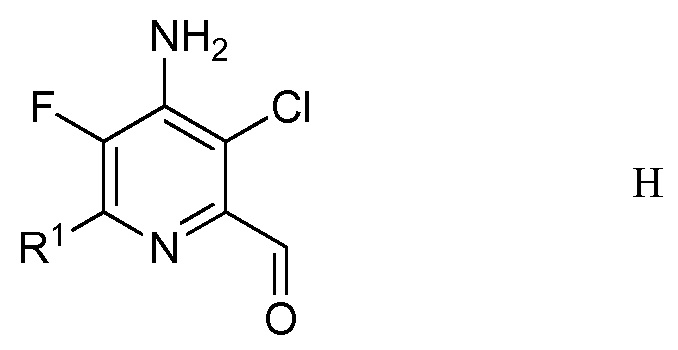
в которой R1 является таким, как определено ранее;
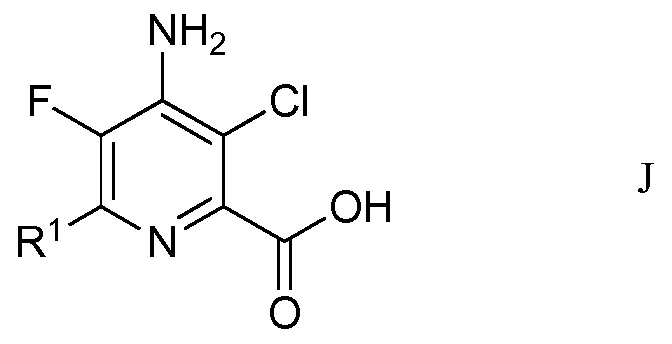
f) окисление 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н хлоритом щелочного металла в присутствии неорганической кислоты и акцептора гипохлористой кислоты в водном спиртовом растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J
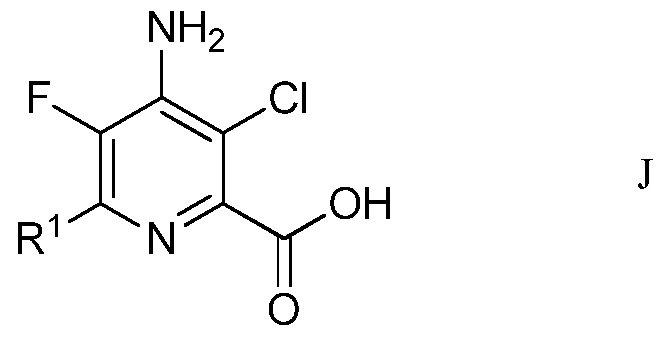
в которой R1 является таким, как определено ранее; и
g) этерификация 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J с соединением формулы
R2X
в которой
Х представляет собой ОН, Cl, Br или I, и
R2 является таким, как определено ранее
для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколината формулы I.
Другим вариантом осуществления является соединение формулы С
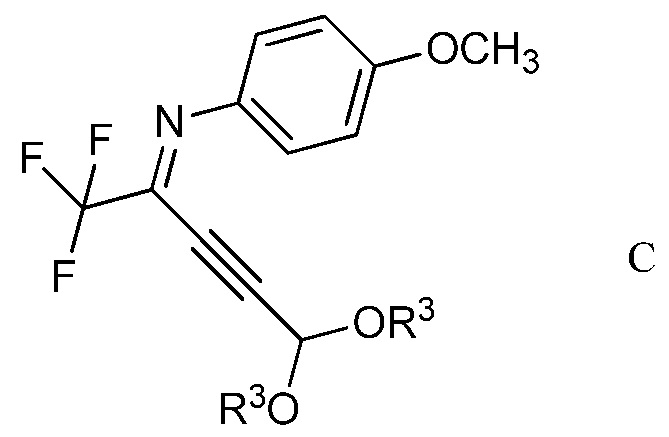
в которой R3 представляет собой С1-С4алкил.
Другим вариантом осуществления является соединение формулы Е
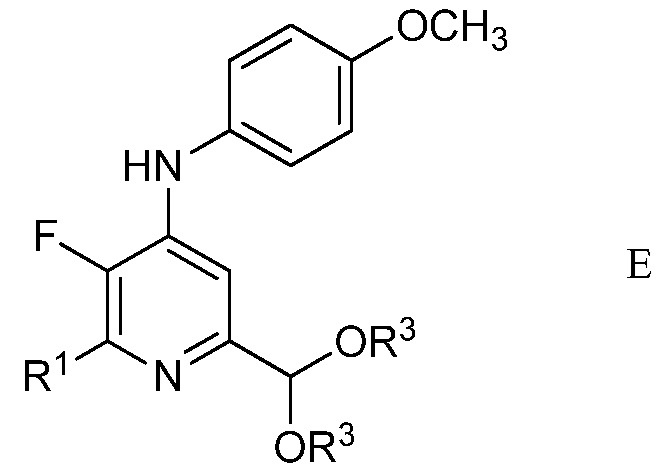
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R3 представляет собой С1-С4алкил.
Другим вариантом осуществления является соединение формулы G
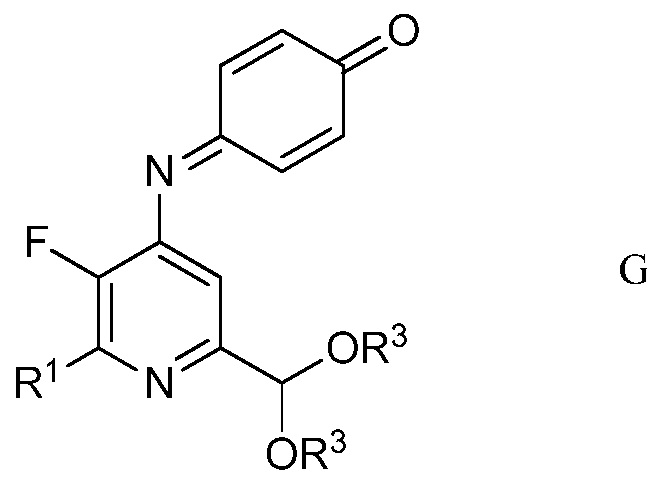
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R3 представляет собой С1-С4алкил.
Другим вариантом осуществления является соединение формулы H
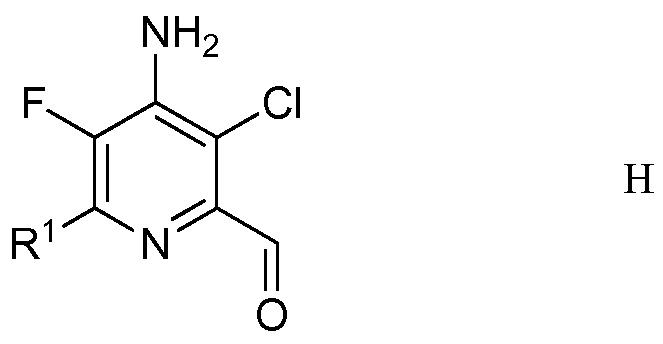
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси.
Подробное описание
Термины “алкил” и “алкенил”, также как и термины для производных, такие как “алкокси”, как они используются в данной работе, включают в пределах их охвата группировки прямых цепей и разветвленных цепей.
Термин “арилалкил”, как он используется в данной работе, относится к алкильной группе, замещенной фенилом, имеющей в целом от 7 до 11 атомов углерода, а именно к бензилу (-СН2С6Н5), 2-метилнафтилу (-СН2С10Н7) и 1- или 2-фенэтилу (-СН2СН2С6Н5 или -СН(СН3)С6Н5). Сама фенильная группа может быть незамещенной или замещенной одним или несколькими заместителями, независимо выбранными из галогена, нитро, циано, С1-С6алкила, С1-С6алкокси, галогенированного С1-С6алкила, галогенированного С1-С6алкокси, С1-С6алкилтио, С(О)ОС1-С6алкила, или где два соседних заместителя вместе образуют группу -О(СН2)nO-, в которой n=1 или 2, при условии, что заместители стерически совместимы и правила химического связывания и энергия деформации являются удовлетворительными.
Если специально не ограничено, термин “галоген”, а также термины производных, такие как “гало” относится к фтору, хлору, брому и иоду.
Фенильная группа, замещенная от 1 до 4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси, С1-С4галогеналкокси может быть любой ориентации, но 4-замещенный фенил, 2,4-дизамещенный фенил, 2,3,4-тризамещенный фенил, 2,4,5-тризамещенный фенил и 2,3,4,6-тетразамещенный фенилизомеры являются предпочтительными.
4-Амино-5-фтор-3-хлор-6-(замещенные)пиколинаты получены из трифторуксусной кислоты, п-метоксианилина, 3,3-диалкоксипроп-1-ина и замещенного метиленамина с помощью ряда стадий.
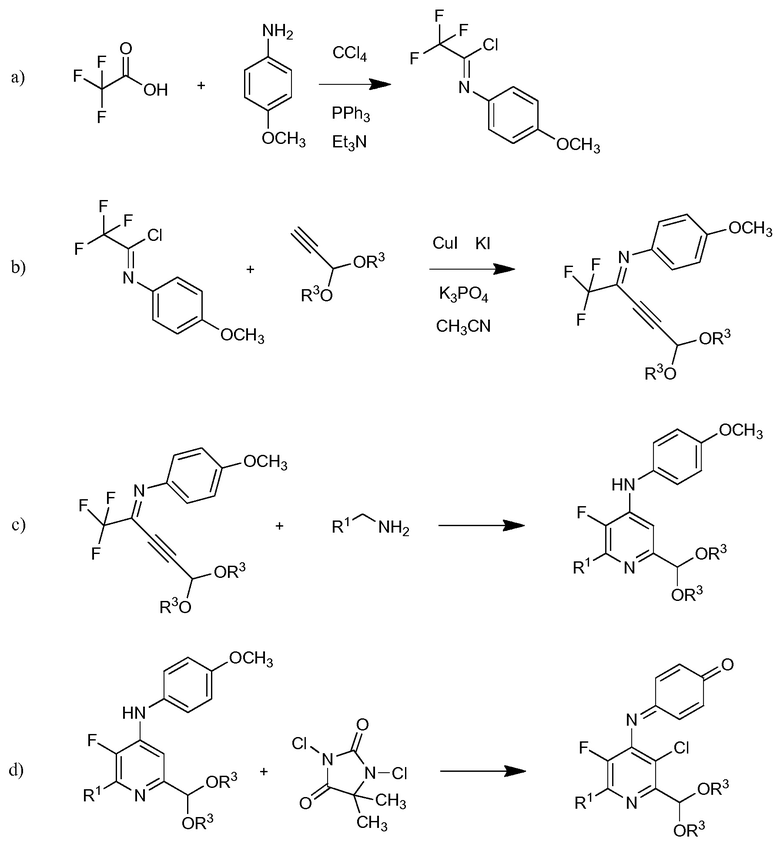

На стадии а), трифторуксусную кислоту подвергали взаимодействию с п-метоксианилином и четыреххлористым углеродом в присутствии триарилфосфина и триалкиламинового основания для получения 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорида. Несмотря на то, что требовался один эквивалент п-метоксианилина на каждый эквивалент трифторуксусной кислоты, часто удобно использовать избыток анилина, обычно избыток от 10 до 20%. Подобный избыток триалкиламинового основания также является предпочтительным. Часто удобно применять намного больший избыток триарилфосфина, обычно в интервале 2-4-кратного избытка. Четыреххлористый углерод, хотя и служащий в качестве реагента, также удобно использован как растворитель для начальной реакции. Реакция является экзотермической и удобно контролировать экзотерму внешним охлаждением и контролированным добавлением раствора п-метоксианилина в четыреххлористом углероде к смеси трифторуксусной кислоты, триалкиламина и триарилфосфина в четыреххлористом углероде. После того, как начальная экзотерма убывает, реакционную смесь обычно нагревали при кипячении с обратным холодильником до завершения превращения.
В типичной реакции, смесь приблизительно 3 эквивалентов трифенилфосфина и трифторуксусной кислоты в четыреххлористом углероде охлаждали до приблизительно 0°С на ледяной бане и добавляли 20% избыток триэтиламина. При непрерывном охлаждении медленно добавляли приблизительно 20% избыток п-метоксианилина в четыреххлористом углероде. После окончания добавления, смесь нагревали приблизительно до 70°С в течение нескольких часов. После охлаждения, реакционную смесь экстрагировали гексаном и растворитель выпаривали с получением неочищенного 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорида.
На стадии b), 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорид сочетали с 3,3-диалкоксипроп-1-ином в присутствии иодида меди(I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе с получением N-(5,5-диалкокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилина. Несмотря на то, что требовался один эквивалент 3,3-диалкоксипроп-1-ина на каждый эквивалент ацетимидоилхлорида, часто удобно использовать избыток 3,3-диалкоксипроп-1-ина, обычно избыток от 10 до 20%. Аналогично, 10-20% молярный избыток иодида щелочного металла и фосфата щелочного металла большей частью является предпочтительным. Хотя реакция является каталитической в иодиде меди(I), обычно использовали от приблизительно 0,1 до приблизительно 0,3 эквивалентов. Реакцию сочетания проводили в полярном апротонном растворителе при температуре от приблизительно 40°С до приблизительно 100°С. Предпочтительные полярные апротонные растворители включают простые эфиры, подобные тетрагидрофурану, сложные эфиры, подобные этилацетату, нитрилы, подобные ацетонитрилу, амиды, подобные N,N-диметилформамиду и N-метилпирролидинону и сульфоксиды, подобные диметилсульфоксиду. Предпочтительными являются безводные растворители, причем безводный ацетонитрил особенно предпочтителен.
В типичной реакции, 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорид и небольшой избыток 3,3-диэтоксипроп-1-ина смешивали приблизительно с 0,3 эквивалентами иодида меди(I) и небольшими избытками фосфата калия и иодида калия в безводном ацетонитриле. Смесь нагревали при приблизительно 60°С в атмосфере азота до завершения реакции. После охлаждения, в смесь наряду с водой добавляли растворитель для экстракции, такой как галогенированный углеводород. Органический слой отделяли, промывали насыщенным раствором соли и сушили. Растворитель выпаривали с получением неочищенного N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилина.
На стадии с), N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилин подвергали взаимодействию с метиленамином, замещенным на алкил, циклопропил, алкенил или (замещенную)фенильную группу в присутствии неорганического основания щелочного металла в полярном апротонном растворителе с получением 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя. Хотя требовался один эквивалент замещенного метиленамина на каждый эквивалент N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилина, часто удобно использовать избыток замещенного метиленамина, обычно 2-4-кратный избыток. Подходящие неорганические основания щелочного металла включают литиевые, натриевые, калиевые и цезиевые соли гидроксидов, карбонатов и фосфатов. Особенно предпочтителен карбонат цезия. В целом, удобно использовать 2-4-кратный избыток неорганического основания щелочного металла. Предпочтительные полярные апротонные растворители включают простые эфиры, подобные тетрагидрофурану, сложные эфиры, подобные этилацетату, нитрилы, подобные ацетонитрилу, амиды, подобные N,N-диметилформамиду и N-метилпирролидинону и сульфоксиды, подобные диметилсульфоксиду. Предпочтительными являются безводные растворители, причем безводный тетрагидрофуран и диметилсульфоксид особенно предпочтительны. Реакцию обычно проводили при температуре от приблизительно комнатной до приблизительно 100°С.
В типичной реакции, N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилин смешивали приблизительно с 2,5-3-кратным избытком п-хлорбензиламина и приблизительно с 2,5-3-кратным избытком карбоната цезия в безводном тетрагидрофуране. Данную смесь нагревали приблизительно при 80°С до завершения реакции. После охлаждения, в смесь наряду с водой добавляли растворитель для экстракции, такой как галогенированный углеводород. Органический слой отделяли, промывали насыщенным раствором соли и сушили. Растворитель выпаривали с получением неочищенного 2-(4-хлорфенил)-6-(диэтоксиметил)-3-фтор-N-(4-метоксифенил)пиридин-4-амина.
На стадии d), 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталь хлорировали с помощью 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона в полярном растворителе при температуре от приблизительно комнатной до приблизительно 100°С с получением 4-((3-хлор-6-(замещенный)-2-(диалкоксиметил)-5-трифторпиридин-4-ил)имино)циклогекса-2,5-диенона. Хотя требовался один эквивалент 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона на каждый эквивалент 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя, часто удобно использовать избыток 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона, обычно 2-4-кратный избыток. Хлорирование удобно выполнять в смеси полярного растворителя, такого как ацетонитрил, с водой.
В типичной реакции, неочищенный 2-(4-хлорфенил)-6-(диэтоксиметил)-3-фтор-N-(4-метоксифенил)пиридин-4-амин обрабатывали двумя эквивалентами 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона в смеси ацетонитрил/вода. Смесь перемешивали при комнатной температуре до завершения реакции. Твердый продукт собирали фильтрованием, промывали дополнительной смесью ацетонитрил/вода и сушили, получая неочищенный 4-((3-хлор-6-(4-хлорфенил)-2-(диэтоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенон.
На стадии е), 4-((3-хлор-6-(замещенный)-2-(диалкоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенон обрабатывали минеральной кислотой в полярном растворителе при температуре приблизительно от комнатной до приблизительно 100°С с получением 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида. Подходящие минеральные кислоты включают серную и фосфорную кислоты с предпочтением для серной кислоты. Минеральные кислоты обычно применяли в виде водных растворов. Требовался приблизительно один эквивалент минеральной кислоты, но предпочитали 10-30% избыток. Удаление защиты/гидролиз обычно проводили в смеси полярного растворителя, такого как ацетонитрил, с водой.
В типичной реакции, 4-((3-хлор-6-(4-хлорфенил)-2-(диэтоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенон обрабатывали 1 М (молярным) раствором серной кислоты в смеси ацетонитрил/вода. Смесь нагревали при кипячении с обратным холодильником до завершения реакции. Смесь добавляли к метиленхлориду, и органический слой отделяли, промывали насыщенным раствором соли и сушили. Растворитель выпаривали, получая неочищенный 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинальдегид.
На стадии f), 4-амино-5-фтор-3-хлор-6-(замещенный)пиколинальдегид подвергали окислению хлоритом щелочного металла в присутствии неорганической кислоты и акцептора хлорноватистой кислоты в водном спиртовом растворе для образования 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты. Хотя требовался один эквивалент хлорита натрия для окисления альдегида в карбоновую кислоту, часто удобно использовать 2-8 эквивалентов. Окисление происходит в смеси воды с органическими растворителями, такими как ацетонитрил или трет-бутиловый спирт в слабо кислых условиях (рН 3-5), достигаемых при добавлении 2-10 эквивалентов солей неорганической кислоты, а именно, динатрийгидрофосфата. Чтобы избежать нежелательных взаимодействий от образованной во время окисления хлорноватистой кислоты, добавляли 2-30 эквивалентов акцептора, такого как 2-метил-2-бутен, резорцин или сульфаминовая кислота.
В типичной реакции, 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинальдегид подвергали окислению с избытком хлорита натрия, с 20-30 эквивалентами 2-метил-2-бутена и приблизительно 5 эквивалентами динатрийгидрофосфата в смеси трет-бутиловый спирт/вода. Смесь нагревали при приблизительно 80°С до завершения реакции. После охлаждения смесь обрабатывали разбавленной хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой отделяли и сушили. Растворитель выпаривали, получая неочищенный 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколиновую кислоту.
На стадии g), 4-амино-5-фтор-3-хлор-6-(замещенную)пиколиновую кислоту подвергали этерификации. Сложные эфиры пиколиновых кислот получали сочетанием пиколиновой кислоты со спиртом с использованием любого числа подходящих активирующих агентов, таких как агенты, применяемые для связывания пептидов, а именно, дициклогексилкарбодиимид (DCC) или карбонилдиимидазол (CDI), или взаимодействием соответствующей кислоты с соответствующим арилалкиловым спиртом в присутствии кислотного катализатора. В альтернативном случае, сложные эфиры могут быть получены взаимодействием пиколиновой кислоты с алкил или арилалкилгалогенидом в присутствии основания. Данные процедуры хорошо известны химикам-органикам и описаны, например, в патентной заявке США 2012/0190551 А1.
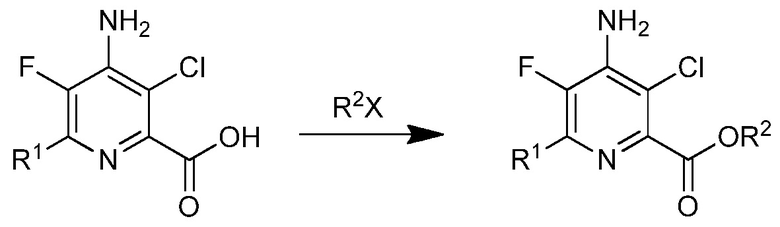
В типичной реакции, 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколиновую кислоту подвергали взаимодействию с небольшим избытком бензилбромида и приблизительно с 2 эквивалентами карбоната калия в полярном апротонном растворителе, таком как диметилсульфоксид или N,N-диметилформамид. Бензил-4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинат выделяли распределением реакционной смеси между этилацетатом и водой, отделением и высушиванием органической фазы и выпариванием растворителя.
Продукты, полученные любым из данных способов, могут быть выделены обычными методами, такими как выпаривание или экстракция, и могут быть очищены стандартными процедурами, такими как перекристаллизация или хроматография.
Описанные варианты осуществления и последующие примеры даются для иллюстративных целей и не предназначены для ограничения объема пунктов формулы изобретения. Другие модификации, применения или комбинации по отношению к композициям, описанным в данной работе, будут очевидными для лица из специалистов в данной области без отступления от сущности и объема заявленного предмета изобретения.
Примеры
Пример 1. 2,2,2-Трифтор-N-(4-метоксифенеил)ацетимидоилхлорид
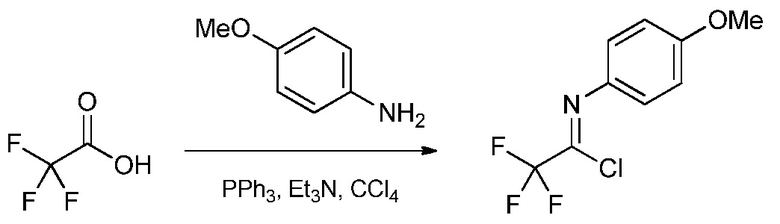
Смесь трифенилфосфина (34,6 грамм (г), 132,0 миллимоль (ммоль)), 2,2,2-трифторуксусной кислоты (3,37 миллилитр (мл), 44 ммоль), триэтиламина (7,38 мл, 53,0 ммоль) и четыреххлористого углерода (21,33 мл, 220,0 ммоль) перемешивали магнитной мешалкой с одновременным охлаждением на ледяной бане. Через 10 минут (мин) медленно добавляли п-метоксианилин (6,53 г, 53,0 ммоль), растворенный в четыреххлористом углероде (21,33 мл, 220,0 ммоль) (реакция экзотермическая). Ледяную баню удаляли и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 4 часов (ч). После охлаждения до комнатной температуры, реакционную смесь промывали гексаном (3×100 мл). Растворитель удаляли с использованием роторного испарителя, получая 9,8 г оранжевого масла. Дистилляция давала 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорид (9,31 г, 39,2 ммоль, выход 89%) в виде светло-желтой жидкости: т.кип. 75-77°С/0,3 мм Hg; 1H ЯМР (400 МГц, CDCl3) δ 7,31 (м, 2Н), 6,96 (м, 2Н), 3,84 (с, 3Н); 13C ЯМР (101 МГц, CDCl3) δ 159,56 (с), 135,45 (с), 127,98 (кв), 124,35 (с), 117,05 (кв), 114,25 (с), 55,50 (с).
Пример 2. N-(5,5-Диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилин
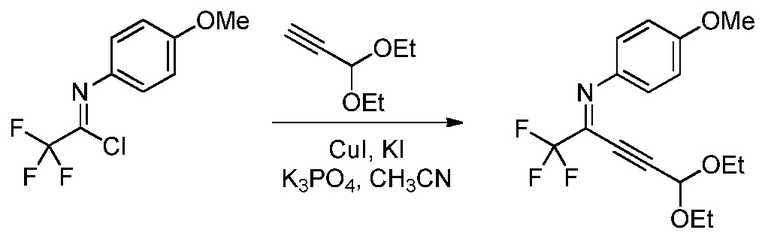
В перемешиваемый магнитной мешалкой раствор 2,2,2-трифтор-N-(4-метоксифенил)ацетимидоилхлорида (2,376 г, 10,00 ммоль) и 3,3-диэтоксипроп-1-ина (1,538 г, 12 ммоль) в ацетонитриле (20 мл) добавляли измельченную смесь иодида меди(I) (0,571 г, 3,00 ммоль), фосфата калия (2,55 г, 12,0 ммоль) и иодида калия (1,660 г, 10,00 ммоль). После нагревания в атмосфере азота при 60°C в течение 16 ч, реакционную смесь добавляли в метиленхлорид (СН2Сl2; 100 мл) и в воду (50 мл). Органический слой промывали насыщенным раствором хлорида натрия (NaCl) и сушили (сульфат магния; MgSO4), и растворитель удаляли, при этом остается 3,35 г желтой жидкости. Флэш-хроматография на силикагеле с элюированием 5% этилацетат (EtOAc)/гексан давала N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилин (2,75 г, 8,18 ммоль, выход 82%) в виде желтой жидкости; 1H ЯМР (400 МГц, CDCl3) δ 7,46 (м, 2Н), 6,93 (м, 2Н), 5,41 (с, 1Н), 3,84 (с, 3Н), 3,63 (м, 4Н), 1,22 (м, 6Н), 13C ЯМР (101 МГц, CDCl3) δ 160,00 (с), 139,55 (с), 134,98 (с), 134,59 (с), 124,65 (с), 113,98 (с), 94,64 (с), 91,21 (с), 74,83 (с), 61,55 (с), 55,50 (с), 15,00 (с), 19F ЯМР (376 МГц, CDCl3) δ - 70,91 (с); HRMS-ESI (m/z) [M+H]+ вычислено для С16Н18F3NO3, 329,1239; найдено, 329,1225.
Пример 3. 2-(4-Хлорфенил)-6-(диэтоксиметил)-3-фтор-N-(4-метоксифенил)пиридин-4-амин
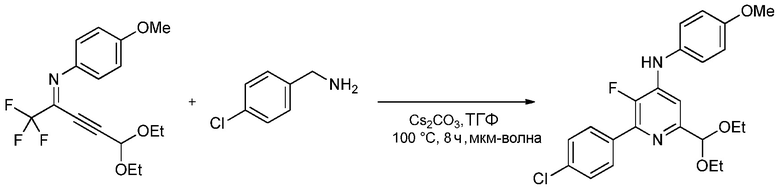
Перемешиваемый магнитной мешалкой раствор N-(5,5-диэтокси-1,1,1-трифторпент-3-ин-2-илиден)-4-метоксианилина (0,659 г, 2 ммоль), п-хлорбензиламина (0,850 г, 6,00 ммоль) и карбоната цезия (1,629 г, 5,00 ммоль) в безводном тетрагидрофуране (ТГФ; 10 мл) нагревали при 100°С в микроволновой печи в течение 8 ч. Реакционную смесь добавляли в простой эфир (100 мл) и воду (50 мл). Органический слой промывали насыщенным раствором NaCl и сушили (MgSO4), и растворитель удаляли, при этом остается 1,42 г желтого твердого вещества. Флэш-хроматография на силикагеле с элюированием 10% EtOAc/гексан давала 2-(4-хлорфенил)-6-диэтоксиметил)-3-фтор-N-4-метоксифенил)пиридин-4-амин (0,689 г, 1,600 ммоль, выход 80%) в виде не совсем белого твердого вещества: т.пл. 110-111°С; 1H ЯМР (400 МГц, CDCl3) δ 7,90 (дд, J=8,5, 1,4 Гц, 2Н), 7,43 (м, 2Н), 7,18 (м, 2Н), 7,13 (д, J=6,2 Гц, 1Н), 6,94 (м, 2Н), 6,19 (д, J=3,7 Гц, 1Н), 5,31 (уш.с, 1Н), 3,84 (с, 3Н), 3,73 (м, 2Н), 3,57 (м, 2Н), 1,22 (т, J=7,1 Гц, 6Н), 19F ЯМР (376 МГц, CDCl3) δ - 150,95; HRMS-ESI (m/z) [M+H]+ вычислено для С23Н24СlFN2O3, 430,1459; найдено, 430,1457.
Пример 4. 4-((3-Хлор-6-(4-хлорфенил)-2-(диэтоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенон
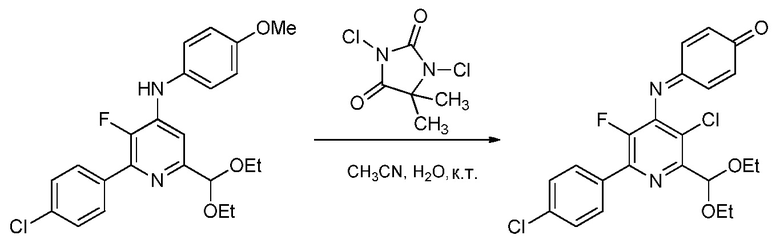
Смесь 2-(4-хлорфенил)-6-диэтоксиметил)-3-фтор-N-4-метоксифенил)пиридин-4-амина (0,862 г, 2 ммоль) и 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона (0,788 г, 4,00 ммоль) в смеси 1:1 ацетонитрил/вода (20 мл) перемешивали при комнатной температуре. Спустя 2 часа, оранжевое твердое вещество собирали фильтрованием, промывали смесью 1:1 ацетонитрил/вода (5 мл), сушили при комнатной температуре и кристаллизовали из простого эфира/гексана. 4-((3-Хлор-6-(4-хлорфенил)-2-(диэтоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенон (0,272 г, выход 30%) выделяли в виде оранжевых кристаллов: т.пл. 134-136°С; 1H ЯМР (400 МГц, CDCl3) δ 7,96 (м, 2Н), 7,44 (м, 3Н), 6,76 (м, 2Н), 6,58 (дд, J=10,2, 2,1 Гц, 1Н), 5,79 (с, 1Н), 3,90 (м, 2Н), 3,72 (м, 2Н), 1,31 (т, J=7,1 Гц, 6Н); 19F ЯМР (376 МГц, CDCl3) δ -134,18; HRMS-ESI (m/z) [M+H]+ вычислено для С22Н19Сl2FN2O3, 448,0757; найдено, 448,0761.
Пример 5. 4-Амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинальдегид
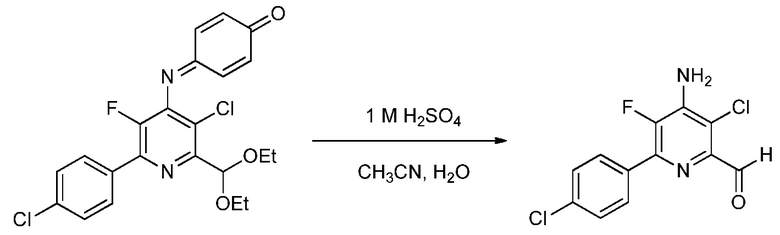
Смесь 4-((3-хлор-6-(4-хлорфенил)-2-(диэтоксиметил)-5-фторпиридин-4-ил)имино)циклогекса-2,5-диенона (180 миллиграмм (мг), 0,401 ммоль) и 0,1 молярной (М) серной кислоты (Н2SO4; 0,5 мл) в 1:1 смеси ацетонитрил/вода (4 мл) нагревали при 80°С в течение 1 ч. После перемешивания при комнатной температуре в течение 2 ч, реакционную смесь добавляли в СН2Сl2 (20 мл). Органический слой промывали насыщенным раствором NaCl и сушили (MgSO4), и растворитель удаляли, при этом остается 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинальдегид (82 мг, 0,273 ммоль, выход 68%) в виде не совсем белого твердого вещества: т.пл. 166-169°С; 1H ЯМР (400 МГц, CDCl3) δ 10,12 (с, 1Н), 7,96 (м, 2Н), 7,48 (м, 2Н), 4,99 (с, 2Н); 19F ЯМР (376 МГц, CDCl3) δ - 137,68; ESIMS (m/z) 285,64 ([M+H]+).
Пример 6. 4-Амино-3-хлор-6-(4-хлорфенил)-5-фторпиколиновая кислота
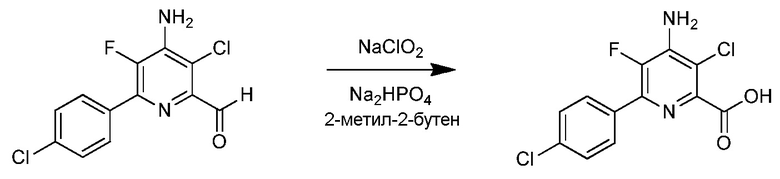
4-Амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинальдегид (105 мг, 0,37 ммоль) растворяли в трет-бутиловом спирте (2,2 мл). Воду (800 мкл), 2-метил-2-бутен (1,0 мл, 700 мг, 10 ммоль), динатрийгидрофосфат (Na2HPO4; 276 мг, 2 ммоль) и хлорит натрия (106 мг, 1,2 ммоль) добавляли в незакупоренный микроволновый сосуд. Реагенты смешивали, и реакционный сосуд запаивали и нагревали при 80°С в течение 16 ч. Реакционную смесь затем охлаждали до комнатной температуры, и смесь разбавляли 1 нормальной (Н) хлористоводородной кислотой (HCl; 5 мл) и EtOAc (10 мл). После перемешивания в течение 5 мин, слои разделяли, и водный слой экстрагировали с помощью EtOAc (4×5 мл). Объединенные органические слои сушили (сульфат натрия; Na2SO4) сушили и выпаривали досуха, получая 95 мг маслянистого коричневого твердого вещества. Твердое вещество растворяли в минимальном количестве водного 1 Н гидроксида натрия (NaOH) и медленно нейтрализовали водной 4 Н HCl до появления белого/коричневого осадка. Осадок собирали и сушили, получая 4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколиновую кислоту (78 мг, выход 72%): 1H ЯМР (400 МГц, CDCl3) δ 8,5 (уш.с, 1Н), 7,96-7,86 (м, 2Н), 7,59-7,75 (м, 2Н), 6,1 (уш.с, 2Н), 19F ЯМР (376 МГц, ДМСО-d6) δ - 141,07; ESIMS (m/z) 299,4 ([M+H]-).
Пример 8. Бензил-4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинат
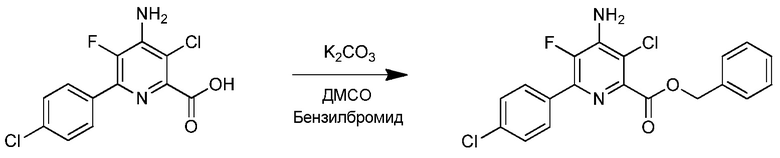
4-Амино-3-хлор-6-(4-хлорфенил)-5-фторпиколиновую кислоту (23,1 мг, 0,080 ммоль) растворяли в диметилсульфоксиде (800 мкл) в незакупоренном микроволновом сосуде. Карбонат калия (23,4 мг, 0,166 ммоль) добавляли вместе с бензилбромидом (10 мкл, 14,4 мг, 0,084 ммоль). Реакционный сосуд запаивали и реакционную смесь энергично перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь затем распределяли между водой (10 мл) и EtOAc (10 мл). Слои разделяли, и водный слой экстрагировали дополнительным количеством EtOAc (3 мл). Объединенные органические слои промывали водой (3×4 мл), промывали насыщенным раствором соли (2 мл), сушили (Na2SO4) и выпаривали досуха, получая 26,1 мг белого твердого вещества. Сырой продукт очищали, используя флэш-колоночную хроматографию с применением 4 г ISCO колонки с диоксидом кремния при элюировании с градиентом 0-100% EtOAc/гексаны в пределах 16 мин. Неочищенный продукт загружали на колонку с минимальным количеством метиленхлорида. Бензил-4-амино-3-хлор-6-(4-хлорфенил)-5-фторпиколинат (8,3 мг, выход 25%) получали в виде светлого восковидного масла: 1H ЯМР (400 МГц, CDCl3) δ 7,93-7,91 (с, J=7,3 Гц, 2Н), 7,53-7,35 (м, 7Н), 5,46 (с, 2Н), 4,94-4,87 (уш.м, 2Н), 19F ЯМР (376 МГц, ДМСО) δ - 144,88; ESIMS (m/z) 391,4 ([M+H]+).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ 4-АМИНО-3-ГАЛОГЕН-6(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ И 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2658825C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2542985C1 |
| 6-АМИНО-2-ЗАМЕЩЕННЫЕ-5- ВИНИЛСИЛИЛПИРИМИДИН-4-КАРБОНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ И 4-АМИНО-6-ЗАМЕЩЕННЫЕ-3-ВИНИЛСИЛИЛПИРИДИН-ПИКОЛИНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ КАК ГЕРБИЦИДЫ | 2012 |
|
RU2556000C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ МОДУЛЯТОРОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 2 (РЕЦЕПТОРА MGLU2) | 2008 |
|
RU2479577C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2632203C2 |
| ФТОРПИКОЛИНОИЛФТОРИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2627659C2 |
| СОЕДИНЕНИЕ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ, СПОСОБЫ БОРЬБЫ С НАСЕКОМЫМИ | 2002 |
|
RU2298007C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА И ИНГИБИТОР БЕЛКА СЛИЯНИЯ RSV | 2005 |
|
RU2388476C2 |
| ФУНГИЦИДНЫЕ ПРОИЗВОДНЫЕ N'-[2-МЕТИЛ-6[2-АЛКОКСИЭТОКСИ]-3-ПИРИДИЛ]-N-АЛКИЛФОРМАМИДИНА ДЛЯ ПРИМЕНЕНИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ | 2015 |
|
RU2701370C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
Изобретение относится к способу получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколината формулы I, включающему стадии а) контактирования трифторуксусной кислоты с п-метоксианилином в присутствии триарилфосфина и триалкиламинового основания в растворителе четыреххлористый углерод для образования ацетимидоилхлорида формулы А; b) контактирования ацетимидоилхлорида формулы А с 3,3-диалкоксипроп-1-ином формулы В в присутствии иодида меди(I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе для получения (имино)пент-2-индиалкилацеталя формулы С; с) циклизации (имино)пент-2-индиалкилацеталя формулы С с амином R1-CH2-NH2 в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре приблизительно от комнатной до приблизительно 100°С для образования 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е; d) хлорирования 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е посредством 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона формулы F в полярном растворителе для получения защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G; е) удаления защиты и гидролиза защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G с помощью минеральной кислоты в полярном растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н; f) окисления 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н хлоритом щелочного металла в присутствии неорганической кислоты и акцептора гипохлористой кислоты в водном спиртовом растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J и g) этерификации 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J соединением формулы R2X, в которой Х представляет собой ОН, Cl, Br или I, для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколината формулы I. Также изобретение относится к соединениям, представленным формулами С, Е, G и H. Значения радикалов R1, R2 и R3 приведены в формуле изобретения. Способ позволяет получить 4-амино-5-фтор-3-хлор-6-(замещенный)пиколинат из непиридинового источника. 5 н.п. ф-лы, 7 пр.
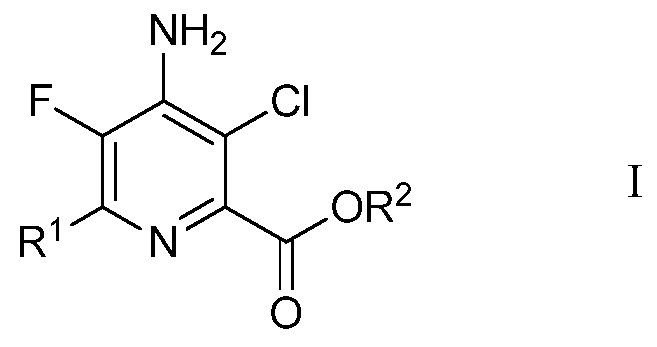
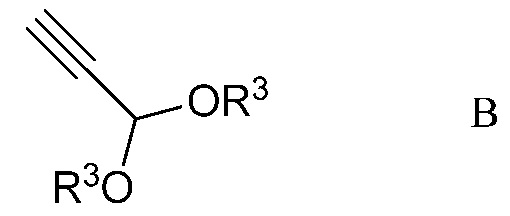

1. Способ получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколината формулы I

в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R2 представляет собой С1-С12алкил или С7-С11арилалкил, незамещенный или замещенный одним или несколькими заместителями, независимо выбранными из галогена, нитро, циано, С1-С6алкила, С1-С6алкокси, галогенированного С1-С6алкила, галогенированного С1-С6алкокси, С1-С6алкилтио, С(О)ОС1-С6алкила, или где два соседних заместителя вместе образуют группу -О(СН2)nO-, в которой n=1 или 2, при условии, что заместители стерически совместимы и правила химического связывания и энергия деформации являются удовлетворительными,
включающий следующие стадии:
а) контактирование трифторуксусной кислоты с п-метоксианилином в присутствии триарилфосфина и триалкиламинового основания в растворителе четыреххлористый углерод для образования ацетимидоилхлорида формулы А
b) контактирование ацетимидоилхлорида формулы А с 3,3-диалкоксипроп-1-ином формулы В
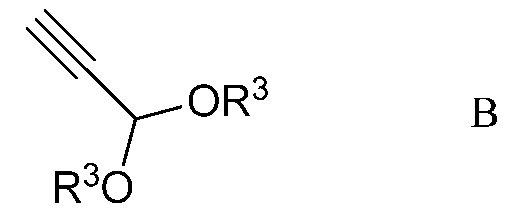
в которой R3 представляет собой С1-С4алкил,
в присутствии иодида меди(I), иодида щелочного металла и фосфата щелочного металла в полярном апротонном растворителе для получения (имино)пент-2-индиалкилацеталя формулы С
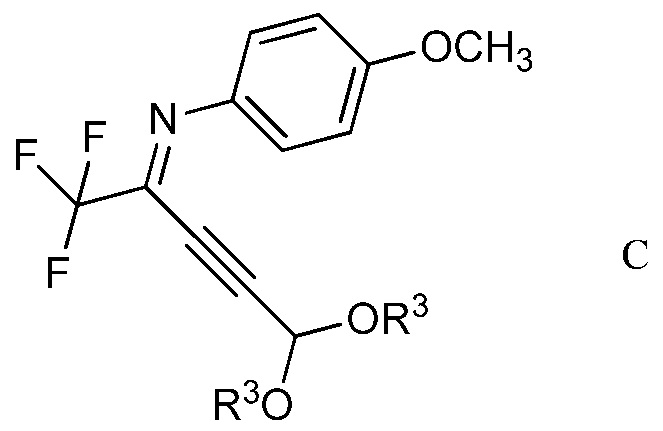
в которой R3 является таким, как определено ранее;
с) циклизация (имино)пент-2-индиалкилацеталя формулы С с амином формулы D

в которой R1 является таким, как определено ранее,
в присутствии неорганического основания щелочного металла в полярном апротонном растворителе при температуре приблизительно от комнатной до приблизительно 100°С для образования 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е
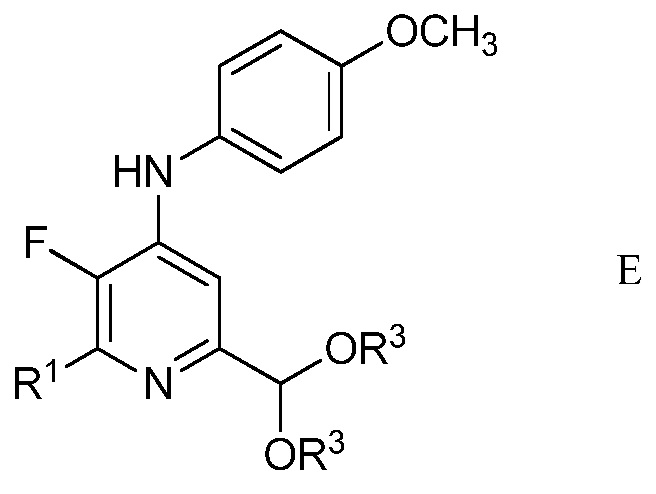
в которой R1 и R3 являются такими, как определено ранее;
d) хлорирование 4-(4-метоксифенил)амино-5-фтор-6-(замещенный)пиридин-2-диалкилацеталя формулы Е посредством 1,3-дихлор-5,5-диметилимидазолидин-2,4-диона формулы F
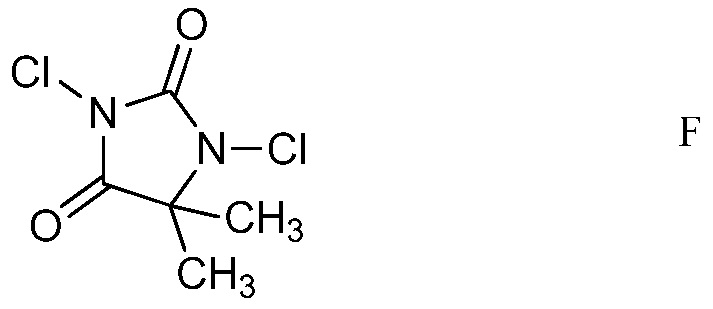
в полярном растворителе для получения защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G
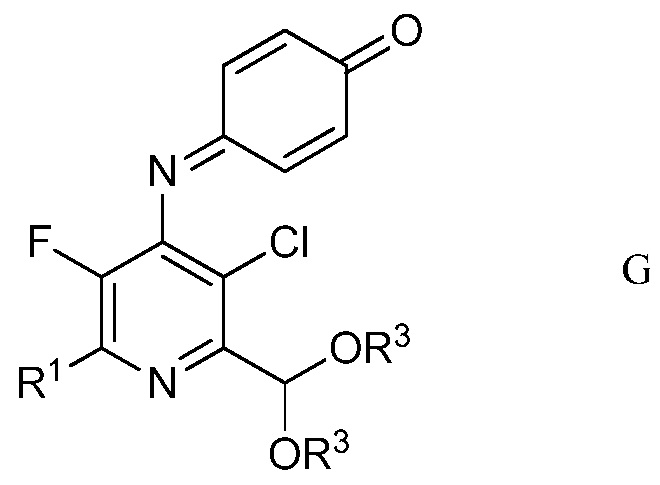
в которой R1 и R3 являются такими, как определено ранее;
е) удаление защиты и гидролиз защищенного 4-амино-5-фтор-3-хлор-6-(замещенный)пиридин-2-диалкилацеталя формулы G с помощью минеральной кислоты в полярном растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н
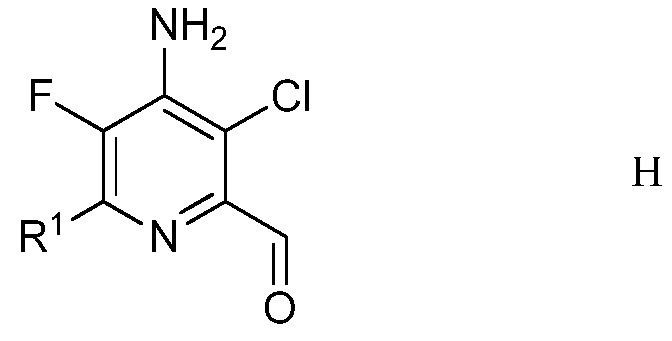
в которой R1 является таким, как определено ранее;
f) окисление 4-амино-5-фтор-3-хлор-6-(замещенного)пиколинальдегида формулы Н хлоритом щелочного металла в присутствии неорганической кислоты и акцептора гипохлористой кислоты в водном спиртовом растворителе для получения 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J
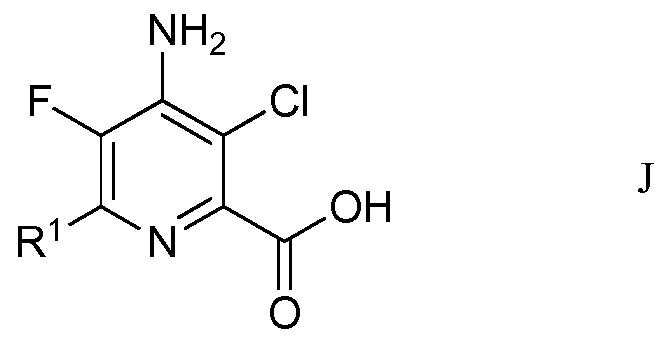
в которой R1 является таким, как определено ранее; и
g) этерификация 4-амино-5-фтор-3-хлор-6-(замещенной)пиколиновой кислоты формулы J соединением формулы
R2X
в которой
Х представляет собой ОН, Cl, Br или I, и
R2 является таким, как определено ранее,
для получения 4-амино-5-фтор-3-хлор-6-(замещенного)пиколината формулы I.
2. Соединение формулы С
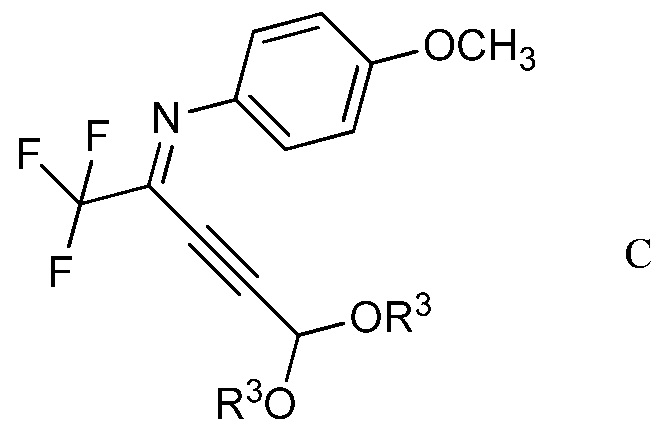
в которой
R3 представляет собой С1-С4алкил.
3. Соединение формулы Е
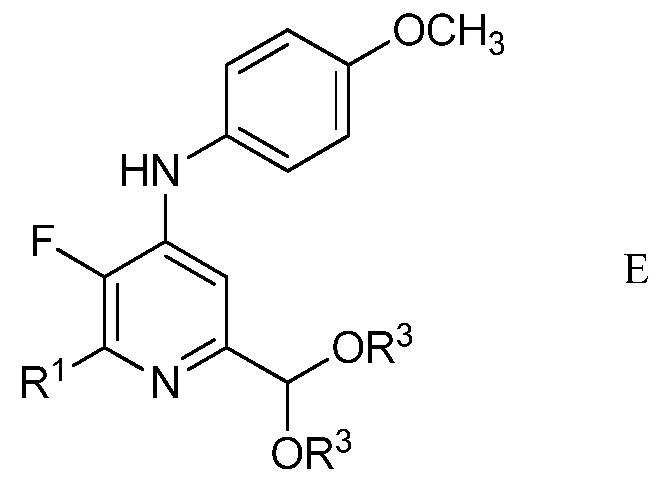
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R3 представляет собой С1-С4алкил.
4. Соединение формулы G
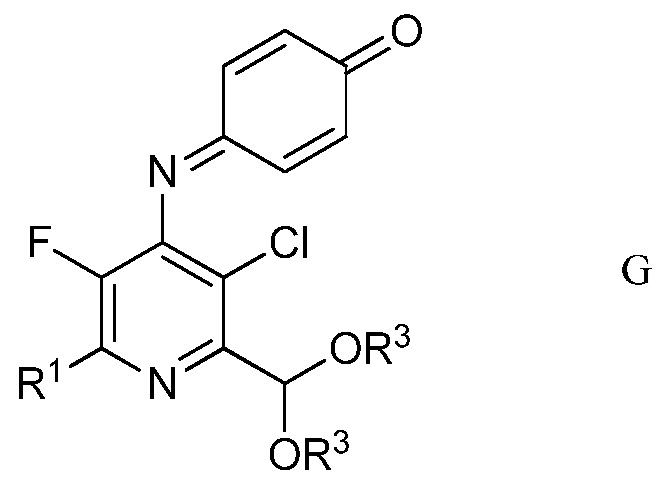
в которой
R1 представляет собой С1-С4алкил, циклопропил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси, и
R3 представляет собой С1-С4алкил.
5. Соединение формулы H
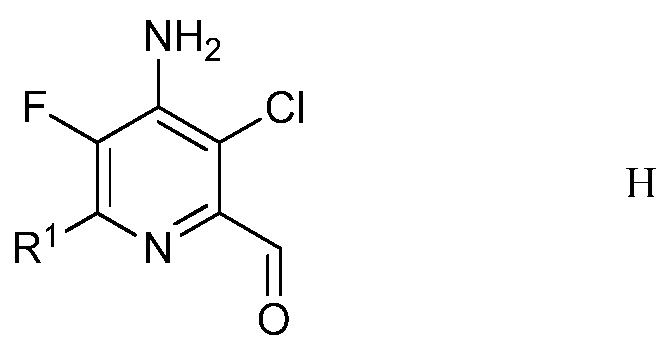
в которой
R1 представляет собой С1-С4алкил, С2-С4алкенил или фенил, замещенный 1-4 заместителями, независимо выбранными из галогена, С1-С4алкила, С1-С4галогеналкила, С1-С4алкокси или С1-С4галогеналкокси.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 7432227 B2, 07.10.2008 | |||
| ZIXIAN CHEN et al: "Selective synthesis of poly-substituted fluorine-containing pyridines and dihydropyrimidines via cascade C-F bond cleavage protocol", ORG.BIOMOL.CHEM, 2011, vol.9(16), p.5682-5691 | |||
| YONG-MING WU et al.: "Facile synthesis of fluorinated alpha-imino alkynes by the coupling reaction of imidoyl iodides with terminal alkynes", JOURNAL OF FLUORINE CHEMISTRY, 2006, vol.127(2), p.218-222 | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Средство борьбы с насекомыми и клещами | 1972 |
|
SU680613A3 |
| 4-АМИНОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2001 |
|
RU2220959C1 |
Авторы
Даты
2018-05-15—Публикация
2013-12-12—Подача