Родственные заявки
Предварительная заявка на выдачу патента США №61/578917, поданная 22 декабря 2011 г., которая включена в настоящий документ посредством ссылки, как если бы она была полностью изложена в настоящем документе.
Область техники
Настоящее изобретение согласно его некоторым вариантам осуществления относится к комбинированной терапии для достижения стабильной и долговременной клеточной или тканевой трансплантации.
Уровень техники
Применение не полностью совместимых по гаплотипу гаплоидентичных доноров в качестве альтернативного источника для трансплантации гемопоэтических стволовых клеток (HSCT) является весьма привлекательным, поскольку фактически у всех пациентов есть доступный гаплоидентичный член семьи, который может служить в качестве донора HSCT. Предыдущие попытки избежать риска развития летальной реакции "трансплантат против хозяина" (GVHD) и применить гаплоидентичную строго без-Т-клеточную трансплантацию костного мозга (TDBMT) у пациентов с лейкозом выявили тот факт, что отсутствие Т-клеток донора в трансплантате приводит к высокому показателю отторжения трансплантата, опосредованного остаточными устойчивыми к лучевой терапии и химиотерапии Т-клетками хозяина (НТС). Для преодоления этого препятствия внимательно исследовали "мегадозу" TDBM-клеток, которые могут преодолеть этот опосредованный НТС иммунный барьер и могут успешно приживиться даже при использовании комбинаций полностью несовместимых линий мышей [Bachar-Lustig Ε. et al., Nat Med. (1995) 1:1268-1273]. В дальнейшем было показано, что у людей, как и у грызунов, повышение дозы CD34+ гемопоэтических стволовых клеток может использоваться для преодоления генетических барьеров, обеспечивая удовлетворительные коэффициенты выживаемости после очищенного гаплоидентичного HSCT [Reisner Y. and Martelli M.F. Immunol Today. (1995) 16:437-440 и патент США №5806529].
Наряду с тем, что использование очищенной "мегадозы" CD34+ HSCT предоставило возможность для гаплоидентичной трансплантации у пациентов с лейкозом, одним главным недостатком, общим для всех без-Т-клеточных трансплантатов, является медленная скорость восстановления иммунной системы реципиента. Это объясняется использованием протоколов обширного иммунного аблационного кондиционирования перед трансплантацией, низкими количествами инфузированных в трансплантате Т-клеток донора и сниженной функцией тимуса взрослых реципиентов. Таким образом, у взрослых реципиентов гаплоидентичного трансплантата CD34+ стволовых клеток значительный показатель связанной с трансплантацией смертности (TRM) обусловлен оппортунистическими инфекциями.
Для решения этой задачи разрабатываются некоторые подходы. Они включают в себя новые способы воздействия для улучшения функции тимуса, постгрансплатационного адоптивного переноса противовирусных специфических Т-клеток, переноса частично поликлональных нереактивных в отношении хозяина подвергнутых аллогенной деплеции Т-клеток или переноса полностью поликлональных Т-клеток, трансфектированных с индуцируемыми "суицидальными" генами. Альтернативным и дополнительным подходом для сохранения иммунитета хозяина является применение кондиционирования сниженной интенсивности (RIC). Этот немиелоаблативный подход сохраняет значительное количество иммунных клеток хозяина и, таким образом, может снижать TRM как путем улучшения постгрансплатационного восстановления иммунной системы, так и снижения токсичности, связанной со средствами для кондиционирования. Гаплоидентичная трансплантация в режиме RIC является даже более сложной, вследствие значительного иммунологического барьера, представленного выжившими Т-клетками хозяина. В недавних попытках преодолеть этот барьер, в большинстве случаев, использовали не подвергнутые деплеции Т-клеток трансплантаты, которые обеспечивали высокий показатель приживления трансплантата, но ценой повышенных показателей GVHD. Другой подход в применении гаплоидентичной трансплантации в режиме RIC использует подвергнутые деплеции CD3/CD19 трансплантаты, которые не только содержат CD34+ стволовые клетки, но также CD34 - отрицательные предшественники, NK, облегчающие приживление клетки и дендритные клетки, тем не менее, он также достигается ценой повышенных показателей GVHD и TRM.
В 1970-е гг. George Santos показал на грызунах, что короткий курс высоких доз циклофосфамида (CY) вскоре после трансплантации костного мозга (ВМТ) направленно активировал аллореактивные Т-клетки донора или хозяина [Owens АН Jr and GW. S. Transplantation. (1971) 11:378-382]. Показали, что циклофосфамид является нетоксичным в отношении гемопоэтических стволовых клеток вследствие высокой экспрессии в них детоксифицирующего фермента альдегиддегидрогеназы, и Slavin с соавт. дополнительно показали, что введение циклофосфамида в высокой дозе может снижать GVHD и отторжение трансплантата у мышей без неблагоприятных эффектов на приживление трансплантата стволовых клеток [Brodsky RA and RJ. J. Lancet. (2005) 365:1647-1656]. Клинические испытания, проведенные John Hopkins и группами из Fred Hutchinson Cancer Research Center, исследовали немиелоаблативный протокол циклофосфамида, флударабина и TBI в дозе 2 Гр, а также профилактику посттрансплатационной GVHD с помощью циклофосфамида (50 мг/кг в дни +3 и +4), MMF (дни +5 - +35) и такролимуса (дни +5 - +180) [Luznik L. et al., Biology of blood and marrow transplantation: journal of the American Society for Blood and Marrow Transplantation. (2008) 14:641]. Согласно данным их исследований этот протокол приводит к высокой частоте рецидивов, что, возможно, обусловлено низкой циторедукцией заболевания с помощью миелоаблативного кондиционирования и отсутствия связанного с GVHD эффекта "трансплантат против лейкоза" (GVL) [Munchel A. et al., Pediatric Reports (2011) 3:43-47].
Были предприняты дополнительные подходы для достижения стабильного приживления трансплантата аллогенных гемопоэтических стволовых клеток, некоторые из них описаны в заявке на выдачу патента США №20110110909, заявке на выдачу патента США №20050118142, заявке на выдачу патента США №20070098693, патент США №5876692, патент США №5514364, патент США №6217867, патент США №5635156, заявке на выдачу патента США №20060140912, заявке на выдачу патента США №20040005300, заявке на выдачу патента США №20070141027, заявке на выдачу патента США №20030017152, заявке на выдачу патента США №20030165475 и заявке на выдачу патента США №20010009663.
Сущность изобретения
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ лечения субъект нуждающийся в несингенном клеточном или тканевом трансплантате, включающий: (а) трансплантацию субъекту дозы без-Т-клеточных (обедненных Т-клетками) незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, включающий: (а) трансплантацию в подвергнутый кондиционированию субъект дозы без-Т-клеточных незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, включающий: (а) кондиционирование субъекта согласно протоколу кондиционирования сниженной интенсивности, причем кондиционирование сниженной интенсивности включает тотальное облучение тела (TBI) и химиотерапевтическое средство; (b) трансплантацию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (с) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ индукции донор-специфической толерантности у субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате, включающий: (а) трансплантацию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, полученных от несингенного донора, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым индуцируя донор-специфическую толерантность у субъекта.
Согласно некоторым вариантам осуществления настоящего изобретения способ дополнительно включает кондиционирование субъекта в режиме кондиционирования сниженной интенсивности перед стадией (а).
Согласно некоторым вариантам осуществления настоящего изобретения способ дополнительно включает кондиционирование субъекта с помощью in vivo Т-клеточной циторедукции перед стадией (а).
Согласно некоторым вариантам осуществления настоящего изобретения доза без-Т-клеточных незрелых гемопоэтических клеток содержит 5-40×106 CD34+ клеток на кг массы тела субъекта.
Согласно некоторым вариантам осуществления настоящего изобретения доза без-Т-клеточных незрелых гемопоэтических клеток содержит по меньшей мере приблизительно 10×106 CD34+ клеток на кг массы тела субъекта.
Согласно некоторым вариантам осуществления настоящего изобретения без-Т-клеточные незрелые гемопоэтические клетки выбраны из группы, состоящей из без-Т-клеточных клеток костного мозга, без-Т-клеточных мобилизированных G-CSF клеток -предшественников гемопоэза из периферической крови, без-Т-клеточной пуповинной крови, очищенных CD34+ клеток, полученных путем положительной селекции из костного мозга и/или из мобилизированных G-CSF клеток - предшественников гемопоэза из периферической крови, и ex vivo размноженных CD34+ клеток.
Согласно некоторым вариантам осуществления настоящего изобретения без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×106 CD8+ TCRα/β- клеток на кг массы тела субъекта.
Согласно некоторым вариантам осуществления настоящего изобретения без-Т-клеточные незрелые гемопоэтические клетки получают путем Т-клеточной циторедукции.
Согласно некоторым вариантам осуществления настоящего изобретения Т-клеточную циторедукцию осуществляют с помощью антител.
Согласно некоторым вариантам осуществления настоящего изобретения антитела выбраны из группы, состоящей из антитела к CD8, антитела к CD4, антитела к CD3, антитела к CD2 и антитела к TCRα/β.
Согласно некоторым вариантам осуществления настоящего изобретения антитела включают в себя антитело к CD3.
Согласно некоторым вариантам осуществления настоящего изобретения незрелые гемопоэтические клетки обрабатывают путем В-клеточной циторедукции.
Согласно некоторым вариантам осуществления настоящего изобретения В-клеточную циторедукцию осуществляют с помощью антитела к CD19 или антитела к CD20.
Согласно некоторым вариантам осуществления настоящего изобретения без-Т-клеточные незрелые гемопоэтические клетки получают от несингенного донора.
Согласно некоторым вариантам осуществления настоящего изобретения несингенный донор является аллогенным или ксеногенным по отношению к субъекту.
Согласно некоторым вариантам осуществления настоящего изобретения аллогенный донор выбран из группы, состоящей из совместимого по HLA сибса, совместимого по HLA неродственного донора, гаплоидентичного по HLA родственного донора и донора, проявляющего одну или несколько различных HLA-детерминант.
Согласно некоторым вариантам осуществления настоящего изобретения субъект представляет собой субъекта - человека.
Согласно некоторым вариантам осуществления настоящего изобретения in vivo Т-клеточную циторедукцию осуществляют с помощью антител.
Согласно некоторым вариантам осуществления настоящего изобретения антитела включают в себя антитело к CD8, антитело к CD4 или оба антитела.
Согласно некоторым вариантам осуществления настоящего изобретения антитела включают в себя антитела - антитимоцитарные глобулины (ATG), антитела к CD52 или антитела к CD3 (ОКТ3).
Согласно некоторым вариантам осуществления настоящего изобретения кондиционирование сниженной интенсивности включает немиелоаблативное кондиционирование.
Согласно некоторым вариантам осуществления настоящего изобретения немиелоаблативное кондиционирование включает в себя по меньшей мере одно из тотального облучения тела (TBI), тотального облучения лимфоидной ткани (TLI), химиотерапевтического средства и/или иммунотерапии антителами.
Согласно некоторым вариантам осуществления настоящего изобретения TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 1-7,5 Гр.
Согласно некоторым вариантам осуществления настоящего изобретения TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 1-3,5 Гр.
Согласно некоторым вариантам осуществления настоящего изобретения TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 2 Гр.
Согласно некоторым вариантам осуществления настоящего изобретения TBI осуществляют в однократной дозе за 2 дня перед стадией (b).
Согласно некоторым вариантам осуществления настоящего изобретения химиотерапевтическое средство содержит по меньшей мере одно из бусульфана, флударабина, мелфалана и тиотепы.
Согласно некоторым вариантам осуществления настоящего изобретения антитело содержит по меньшей мере одно из антитела к CD52, антитела - антитимоцитарного глобулина (ATG) или антитела к CD3 (ОКТ3).
Согласно некоторым вариантам осуществления настоящего изобретения концентрация циклофосфамида составляет приблизительно 100-200 мг на кг массы тела.
Согласно некоторым вариантам осуществления настоящего изобретения концентрация циклофосфамида составляет приблизительно 100 мг на кг массы тела.
Согласно некоторым вариантам осуществления настоящего изобретения циклофосфамид вводят в однократной дозе.
Согласно некоторым вариантам осуществления настоящего изобретения циклофосфамид вводят в двух дозах.
Согласно некоторым вариантам осуществления настоящего изобретения каждая из двух доз содержит концентрацию, составляющую приблизительно 50 мг на кг массы тела.
Согласно некоторым вариантам осуществления настоящего изобретения каждую из двух доз вводят в дни 3 и 4 после стадии (а).
Согласно некоторым вариантам осуществления настоящего изобретения субъект характеризуется наличием злокачественного заболевания.
Согласно некоторым вариантам осуществления настоящего изобретения злокачественное заболевание представляет собой гемопоэтическую злокачественную опухоль.
Согласно некоторым вариантам осуществления настоящего изобретения гемопоэтическая злокачественная опухоль включает в себя лейкоз или лимфому.
Согласно некоторым вариантам осуществления настоящего изобретения гемопоэтическая злокачественная опухоль выбрана из группы, состоящей из следующего: острый лимфобластный лейкоз (ALL), острый миелоцитарный лейкоз (AML), острый нелимфобластный лейкоз (ANLL), хронический лимфоцитарный лейкоз (CLL), хронический миелоцитарный лейкоз (CML), лимфома Ходжкина, неходжкинская лимфома, экстранодальная ΝΚ/Τ-клеточная лимфома, Т-клеточная лимфома кожи, энтеропатическая Т-клеточная лимфома, ангиоиммунобластная Т-клеточная лимфома, анапластическая крупноклеточная Т/0-клеточная лимфома, подкожная панникулитоподобная Т-клеточная лимфома, неспецифическая Т-клеточная лимфома, диффузная крупноклеточная В-клеточная лимфома, В-клеточный хронический лимфоцитарный лейкоз (B-CLL)/хронический лимфоидный лейкоз (CLL), хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома, экстранодальные В-клеточные лимфомы маргинальной зоны - лимфомы лимфоидной ткани слизистых оболочек, фолликулярная лимфома, лимфома из клеток мантийной зоны, нодальная В-клеточная лимфома маргинальной зоны, лимфома Беркитта, волосатоклеточный лейкоз, первичная лимфома центральной нервной системы, В-клеточная лимфома маргинальной зоны селезенки, лимфоплазмоцитарная лимфома, первичная медиастинальная В-клеточная лимфома и множественная миелома.
Согласно некоторым вариантам осуществления настоящего изобретения субъект характеризуется наличием незлокачественного заболевания.
Согласно некоторым вариантам осуществления настоящего изобретения незлокачественное заболевание представляет собой генетическое заболевание или нарушение, аутоиммунное заболевание или метаболическое нарушение.
Согласно некоторым вариантам осуществления настоящего изобретения незлокачественное заболевание выбрано из группы, состоящей из следующего: серповидноклеточная болезнь, наследственный агранулоцитоз, тромбоцитопения, апластическая анемия, миелодиспластический синдром, моносомия 7, врожденный остеосклероз, болезнь Гоше, болезнь Гурлера, метахроматическая лейкодистрофия, адренальная лейкодистрофия, талассемия, врожденная или наследственная гемопоэтическая аномалия, волчанка, аутоиммунный гепатит, глютеновая энтеропатия, сахарный диабет I типа, диффузный токсический зоб, синдром Гийена-Барре, тяжелая миастения, ревматоидный артрит, склеродермия и псориаз.
Согласно некоторым вариантам осуществления настоящего изобретения клеточный или тканевой трансплантат содержит незрелые гемопоэтические клетки.
Согласно некоторым вариантам осуществления настоящего изобретения клеточный или тканевой трансплантат выбран из группы, состоящей из печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишечника и лимфоидной/гемопоэтической ткани или органа.
Согласно некоторым вариантам осуществления настоящего изобретения клеточный или тканевой трансплантат трансплантируют субъекту до, одновременно или после трансплантации дозы без-Т-клеточных незрелых гемопоэтических клеток субъекту.
Согласно некоторым вариантам осуществления настоящего изобретения клеточный или тканевой трансплантат включает котрансплантацию нескольких органов.
Согласно некоторым вариантам осуществления настоящего изобретения клеточный или тканевой трансплантат и без-Т-клеточные незрелые гемопоэтические клетки получают от одного донора.
Согласно некоторым вариантам осуществления настоящего изобретения подвергнутый кондиционированию субъект был подвергнут кондиционированию в режиме кондиционирования сниженной интенсивности.
Согласно некоторым вариантам осуществления настоящего изобретения кондиционирование сниженной интенсивности осуществляют за 1-10 дней перед трансплантацией.
Согласно некоторым вариантам осуществления настоящего изобретения подвергнутый кондиционированию субъект был подвергнут кондиционированию путем in vivo Т-клеточной циторедукции.
Согласно некоторым вариантам осуществления настоящего изобретения in vivo Т-клеточную циторедукцию осуществляют за 4-7 дней перед трансплантацией.
Согласно некоторым вариантам осуществления настоящего изобретения химиотерапевтическое средство включает в себя флударабин.
Согласно некоторым вариантам осуществления настоящего изобретения флударабин вводят в дозе 30 мг/м2/день.
Согласно некоторым вариантам осуществления настоящего изобретения флударабин вводят ежедневно в дни 3-7 перед стадией (b).
Согласно некоторым вариантам осуществления настоящего изобретения без-Т-клеточные незрелые гемопоэтические клетки включают в себя без-Т-клеточные мобилизированные G-CSF клетки - предшественники гемопоэза из периферической крови.
Будет понятно, что настоящее раскрытие может использоваться с такими другими допустимыми протоколами, как протоколы, описанные в РСТ публикациях №№ WO 2001/49243, WO 2007/023491 и WO 2010/049935, которые полностью включены в настоящий документ посредством ссылки.
Если иное не указано, все используемые в настоящем документе технические и/или научные термины имеют такие же значения, которые обычно подразумеваются под ними в настоящей области техники, к которой принадлежит настоящее изобретение. Несмотря на то, что способы и материалы, аналогичные или эквивалентные описанным в настоящей области техники, могут использоваться на практике или при испытании вариантов осуществления настоящего изобретения, ниже описаны иллюстративные способы и материалы. В случае конфликта настоящее описание изобретения, включая в себя определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются исключительно иллюстративными, и не подразумевается, что они являются в обязательном порядке ограничивающими.
Краткое описание чертежей
В настоящем документе описаны некоторые варианты осуществления настоящего изобретения, исключительно в качестве примера, со ссылкой на прилагаемые графические материалы. Делая конкретную ссылку на подробные графические материалы, подчеркивают, что показанные детали представлены исключительно для примера и с целью иллюстративного обсуждения вариантов осуществления настоящего изобретения. В связи с этим, настоящее описание, рассматриваемое совместно с графическими материалами, показывает специалистам в настоящей области техники, как можно осуществить на практике варианты осуществления настоящего изобретения.
На фиг. 1А-В представлены графики, иллюстрирующие долгосрочное приживление трансплантата костного мозга (ВМ) несовместимого донора после трансплантации "мегадозы" строго без-Т-клеточного ВМ и введения циклофосфамида после трансплантации. Мышей подвергали кондиционированию с помощью Т-клеточной циторедукции (TCD) с использованием антител к CD4 и CD8, в день -6, и подвергая воздействию 2,0 Гр тотального облучения тела (TBI) в день -1. Циклофосфамид в высокой дозе (CY, 100 мг/кг) вводили в дни +3 и +4 после трансплантации. Донорский химеризм оценивали через 35 дней (фиг. 1А) и 95 дней (фиг. 1В) после трансплантации.
На фиг. 2А-С представлены точечные диаграммы, иллюстрирующие типичный анализ химеризма с помощью FACS. На фиг. 2С показано, что смешанный химеризм достигался у реципиентов, которым трансплантировали "мегадозу" (25×106) строго без-Т-клеточного ВМ и которым вводили высокую дозу CY. Напротив, мыши - реципиенты, которые получали только протокол кондиционирования (фиг. 2А) или которым инокулировали только 5×106 клеток ВМ и CY, не проявляли донорский химеризм (фиг. 2В).
На фиг. 3 представлен график, иллюстрирующий долгосрочный смешанный химеризм через 180 и 225 дней после трансплантации у мышей - реципиентов, которым трансплантировали "мегадозу" (25×106) без-Т-клеточного ВМ и вводили высокую дозу CY. Следует отметить, что мыши которым инокулировали 5×106 без-Т-клеточный ВМ и CY, не проявляли смешанный химеризм.
На фиг. 4А-В проиллюстрирована трансплантация кожных трансплантатов от линии донорского типа или независимой линии химерным мышам. На фиг. 4А представлен трансплантат, иллюстрирующий приживление (обозначенный "+") или отторжение (обозначенный "-") кожных трансплантатов от линии донорского типа (Balb/c) или независимой линии (C57BL/6) у реципиентов регулярной дозы (5×106) или "мегадозы" (25×106) без-Т-клеточного ВМ, которым вводили высокую дозу СΥ в дни +3 и +4 после трансплантации. На фиг. 4В представлена фотография кожного трансплантата от линии донорского типа (Balb/c) (белая шерсть) или независимой линии (C57BL/6) (черная шерсть) у реципиентов "мегадозы" (25×106) без-Т-клеточного ВМ, которым вводили высокую дозу CY в дни +3 и +4 после трансплантации.
На фиг. 5 представлен график, иллюстрирующий эффект различных доз облучения на донорский химеризм у мышей - реципиентов "мегадозы" (25×106) без-Т-клеточного ВМ и получивших высокую дозу CY после трансплантации.
На фиг. 6 представлен график, иллюстрирующий эффект повышенных доз циклофосфамида (CY) на донорский химеризм у реципиентов "мегадозы" (25×106) без-Т-клеточного ВМ и 2 Гр TBI.
На фиг. 7 представлен график, иллюстрирующий приживление трансплантата ВМ несовместимого донора, достигнутое путем комбинации "мегадозы" CD8+ без-Т-клеточного ВМ и посттрансплантационного введения CY. Следует отметить, что удаление отсаточных CD8+ Т-клеток из препарата ВМ не оказывало никакого неблагоприятного воздействия на уровень химеризма, достигнутый при комбинации "мегадозы" клеток без-Т-клеточного ВМ с посттрансплантационным введением CY.
Подробное описание изобретения
Настоящее изобретение согласно его некоторым вариантам осуществления относится к комбинированной терапии для достижения стабильной и долговременной клеточной или тканевой трансплантации.
Принципы и действие настоящего изобретения могут стать более понятными со ссылкой на графические материалы и сопутствующие описания.
Перед подробным объяснением по меньшей мере одного варианта осуществления настоящего изобретения следует понять, что настоящее изобретение не обязательно ограничено в указанном применении деталями, изложенными в последующем описании или проиллюстрированными с помощью примеров. Настоящее изобретение включает другие варианты осуществления, или оно может осуществляться на практике или может быть выполнено различными путями. Кроме того, следует понимать, что фразеология и терминология в настоящем документе представлена с целью описания и не должна рассматриваться как ограничивающая.
Применение аллогенной трансплантации гемопоэтических стволовых клеток (HSCT) было ограничено отсутствием доступных HLA-совместимых доноров в семье или в международных регистрах неродственных доноров - добровольцев. Напротив, фактически все пациенты, нуждающиеся в трансплантации, имеют несовместимого в отношении полного гаплотипа родственного донора.
Основные препятствия при трансплантации костного мозга от не полностью совместимых по гаплотипу родственных доноров представляли собой реакцию "трансплантат против хозяина" (GVHD) и отторжение трансплантата. Применение очень больших количеств гемопоэтических стволовых клеток с минимальной примесью остаточных Т-клеток и агрессивным иммуносупрессорным и миелоаблативным режимом привело в высоким показателям приживления трансплантата с незначительной GVHD тяжелой степени. Тем не менее, восстановление иммунной системы было замедленным и не полным после применения указанного подхода, и значительный показатель связанной с трансплантацией смертности (TRM) обусловлен оппортунистическими инфекциями.
При применении настоящего изобретения на практике авторы настоящего изобретения обнаружили, что успешное приживление трансплантата несовместимого костного мозга может быть достигнуто путем трансплантации строго без-Т-клеточной "мегадозы" костного мозга и последующего введения субъекту высокой дозы циклофосфамида вскоре после трансплантации. Авторы настоящего изобретения показали, что при таком режиме требуется лишь кратковременный режим иммуномиелоаблативного кондиционирования. Авторы настоящего изобретения также показали, что такая процедура трансплантации приводит к долговременному и стабильному химеризму, и что достигалась иммунологическая толерантность.
Как показано ниже в настоящем документе и в разделе "Примеры", который приведен ниже, посредством трудоемких экспериментов авторы настоящего изобретения обнаружили, что комбинация трансплантации "мегадозы" без-Т-клеточного костного мозга (TDBMT) и посттрансплантационного введения высокой дозы циклофосфамида (CY) обеспечивает долгосрочное приживление трансплантата костного мозга несовместимого донора (фиг. 1А-В и 2А-С). Долгосрочный смешанный химеризм наблюдался в течение пролонгированных периодов времени после трансплантации (через 180 и 225 дней после трансплантации у мышей, фиг. 3). Важно, что комбинация "мегадозы" TDBMT и высокой дозы CY после трансплантации обеспечивала приживление трансплантата гемопоэтических стволовых клеток в режиме кондиционирования сниженной интенсивности (фиг. 5) и приводила к индукции толерантности, на что указывает приживление кожных трансплантатов донора (фиг. 4В).
Таким образом, согласно одному аспекту настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате, включающий: (а) трансплантацию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Используемый в настоящем документе термин "лечение" включает в себя устранение, существенное ингибирование, замедление или обратное прогрессирование состояния, существенное улучшение клинических или эстетических симптомов состояния или существенное предотвращение появления клинических или эстетических симптомов состояния.
Используемый в настоящем документе термин "субъект" или "субъект, нуждающийся в этом" относится к млекопитающему, предпочтительно человеку, мужской или женской особи любого возраста, которая нуждается в клеточной или тканевой трансплантации. Как правило, субъект нуждается в клеточной или тканевой трансплантации (также в настоящем документе называемый реципиент) вследствие нарушения или патологического или нежелательного заболевания, состояния или синдрома или физической, морфологической или физиологической аномалии, которая подвергается лечению посредством клеточной или тканевой трансплантации.
Согласно одному варианту осуществления субъект нуждается в регенерации ткани (твердой или мягкой ткани), например, вследствие старения, травмы, раны или любого патологического состояния, которое приводит к потере функциональности органа.
Согласно одному варианту осуществления субъект характеризуется наличием злокачественного заболевания.
Согласно одному варианту осуществления злокачественное заболевание представляет собой гемопоэтическую злокачественную опухоль.
Иллюстративные гемопоэтические злокачественные опухоли включают в себя без ограничения следующее: острый лимфобластный лейкоз (ALL), Т-клеточный острый лимфоцитарный лейкоз (T-ALL), острый миелоцитарный лейкоз (AML), острый нелимфобластный лейкоз (ANLL), хронический лимфоцитарный лейкоз (CLL), хронический миелоцитарный лейкоз (CML), Т-клеточный пролимфоцитарный лейкоз, В-клеточный пролимфоцитарный лейкоз, ювенильный миеломоноцитарный лейкоз, лимфома Ходжкина, неходжкинская лимфома, экстранодальная ΝΚ/Τ-клеточная лимфома, Т-клеточная лимфома кожи, энтеропатическая Т-клеточная лимфома, ангиоиммунобластная Т-клеточная лимфома, анапластическая крупноклеточная Т/0-клеточная лимфома, подкожная панникулитоподобная Т-клеточная лимфома, неспецифическая Т-клеточная лимфома, диффузная крупноклеточная В-клеточная лимфома (DLBCL), В-клеточный хронический лимфоцитарный лейкоз (В-CLL)/хронический лимфоидный лейкоз (CLL), хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома, экстранодальные В-клеточные лимфомы маргинальной зоны - лимфомы лимфоидной ткани слизистых оболочек, фолликулярная лимфома, лимфома из клеток мантийной зоны, нодальная В-клеточная лимфома маргинальной зоны, лимфома Беркитта, волосатоклеточный лейкоз, первичная лимфома центральной нервной системы, В-клеточная лимфома маргинальной зоны селезенки, лимфоплазмоцитарная лимфома, первичная медиастинальная В-клеточная лимфома, лейкоз/лимфома из предшественников Т-клеток, MALT-лимфома, грибовидный микоз и множественная миелома.
Согласно одному варианту осуществления гемопоэтическая злокачественная опухоль включает в себя лейкоз или лимфому.
Согласно одному варианту осуществления субъект характеризуется наличием незлокачественного заболевания.
Согласно одному варианту осуществления незлокачественное заболевание представляет собой генетическое заболевание или нарушение, аутоиммунное заболевание или метаболическое нарушение.
Иллюстративные незлокачественные заболевания включают в себя без ограничения следующее: синдромы тяжелого комбинированного иммунодефицита (SCID), серповидноклеточная болезнь (серповидноклеточная анемия), наследственный агранулоцитоз, тромбоцитопения, апластическая анемия (например, тяжелая апластическая анемия), миелодиспластический синдром, моносомия 7, врожденный остеосклероз, болезнь Гоше, болезнь Гурлера, метахроматическая лейкодистрофия, адренальная лейкодистрофия, талассемия, врожденная или наследственная гемопоэтическая аномалия, недостаточность аденозиндезаминазы (ADA), волчанка, аутоиммунный гепатит, глютеновая энтеропатия, сахарный диабет I типа, диффузный токсический зоб, синдром Гийена-Барре, тяжелая миастения, ревматоидный артрит, склеродермия и псориаз.
Согласно одному варианту осуществления субъект настоящего изобретения может страдать от любого из следующего: сердечно-сосудистое заболевание, ревматоидное заболевание, заболевание железы секреции, заболевание желудочно-кишечного тракта, кожное заболевание, заболевание печени, нейрологическое заболевание, заболевание мышц, заболевание почек, заболевание соединительной ткани, системное заболевание и/или связанное с репродукцией заболевание, подлежащее лечению путем клеточной или тканевой трансплантации.
Используемая в настоящем документе фраза "клеточный или тканевой трансплантат" относится к клетке (например, отдельной клетке или группе клеток) или ткани организма (например, твердым тканям или мягким тканям, которые можно трансплантировать полностью или частично). Иллюстративные ткани, которые можно трансплантировать согласно настоящему раскрытию, включают в себя без ограничения ткани печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишечника и лимфоидные/гемопоэтические ткани (например, лимфатический узел, пейеровы бляшки, тимус или костный мозг). Иллюстративные клетки, которые можно трансплантировать согласно настоящему раскрытию, включают в себя без ограничения незрелые гемопоэтические клетки, включая в себя стволовые клетки. Настоящее изобретение также включает трансплантацию целых органов, таких как, например, почка, сердце, легкое, печень, поджелудочная железа или селезенка.
Согласно одному варианту осуществления клеточный или тканевой трансплантат содержит незрелые гемопоэтические клетки.
Согласно одному варианту осуществления способ осуществляют с использованием клетки или ткани, которая является несингенной по отношению к субъекту.
В зависимости от применения способ можно осуществить с использованием клеточного или тканевого трансплантата, который является аллогенным или ксеногенным по отношению к субъекту.
Используемый в настоящем документе термин "аллогенный" относится к клетке или ткани, которая получена от донора, относящегося к тому же виду, что и субъект, но которая является по существу неклональной по отношению к субъекту. Как правило, аутбредные млекопитающие - незиготные близнецы одного вида являются аллогенными друг другу. Следует понимать, что аллогенный донор может являться HLA-идентичным или HLA-неидентичным (т.е. проявляющим одну или несколько различных HLA-детерминант) по отношению к субъекту.
Согласно одному варианту осуществления аллогенный донор представляет собой совместимого в отношении HLA сибса, совместимого в отношении HLA неродственного донора, гаплоидентичного по HLA родственного донора или донора, проявляющего одну или несколько различных HLA-детерминант.
Используемый в настоящем документе термин "ксеногенный" относится к клетке или ткани, которая по существу экспрессирует антигены другого вида относительно вида значительной части лимфоцитов субъекта. Как правило, аутбредные млекопитающие различных видов являются ксеногенными относительно друг друга.
Настоящее изобретение включает, что ксеногенные клетки или ткани происходят из разнообразных видов, таких как без ограничения крупный рогатый скот (например, корова), непарнокопытные (например, лошадь), свиньи (например, поросенок), козьи (например, коза, овца), кошачьи (например, Felis domestica), псовые (например, Canis domestica), грызуны (например, мышь, крыса, кролик, морская свинка, песчанка, хомяк) или приматы (например, шимпанзе, макак-резус, макак, мартышка).
Клетки или ткани ксеногенного происхождения (например, свиного происхождения) предпочтительно получают из источника, который, как известно, не содержит такие зоонозы, как свиные эндогенные ретровирусы. Аналогично, происходящие от человека клетки или ткани предпочтительно получают из по существу непатогенных источников.
Согласно одному варианту осуществления настоящего изобретения как субъект, так и донор являются людьми.
В зависимости от применения и доступных источников клеточный или тканевой трансплантат согласно настоящему изобретению можно получить от пренатального организма, постнатального организма, взрослого или трупного донора. Более того, в зависимости от требуемого применения клеточный или тканевой трансплантат может быть нативным или генетически модифицированным. Определение типа клеточного или тканевого трансплантата, подлежащего использованию, будет находится в компетенции специалиста в настоящей области техники. Кроме того, любой известный в настоящей области техники способ может использоваться для получения клеточного или тканевого трансплантата (например, для трансплантации).
Как указано, дозу без-Т-клеточных гемопоэтических клеток или ткани, содержащей незрелые гемопоэтические клетки (включая в себя, например, CD34+), трансплантируют субъекту.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки являются несингенными (например, аллогенными или ксеногенными) по отношению к субъекту.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки и клеточный или тканевой трансплантат являются сингенными (например, получены от одного донора).
Используемая в настоящем документе фраза "незрелые гемопоэтические клетки" относится к препарату гемопоэтической ткани или клеток, содержащему гемопоэтические клетки - предшественники. Такой тканевой/клеточный препарат включает в себя или получен из биологического образца, например, костного мозга, мобилизированной периферической крови (например, мобилизация CD34-клеток для увеличения их концентрации), пуповинной крови (например, пупочного канатика), фетальной печени, желточного мешка и/или плаценты. Кроме того, очищенные CD34+ клетки или другие гемопоэтические стволовые клетки, такие как CD131+ клетки, могут использоваться в соответствии с настоящим раскрытием, либо с ex vivo размножением, либо без него.
Согласно одному варианту осуществления незрелые гемопоэтические клетки содержат без-Т-клеточные незрелые гемопоэтические клетки.
Используемая в настоящем документе фраза "без-Т-клеточные незрелые гемопоэтические клетки" относится к популяции гемопоэтических клеток, которые подвергли деплеции по Т-лимфоцитам. Без-Т-клеточные незрелые гемопоэтические клетки могут включать в себя, например, CD34+, CD33+ и/или CD56+ клетки. Без-Т-клеточные незрелые гемопоэтические клетки можно подвергать деплеции по CD3+ клеткам, CD2+ клеткам, CD8+ клеткам, CD4+ клеткам, α/β Т-клеткам и/или γ/δ Т-клеткам.
Согласно одному варианту осуществления незрелые гемопоэтические клетки содержат без-Т-клеточные мобилизированные G-CSF клетки крови, обогащенные CD34+ незрелыми гемопоэтическими клетками.
Согласно одному варианту осуществления незрелые гемопоэтические клетки подвергают деплеции по CD3+ Т-клеткам.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 50×105 CD3+ Т-клеток, 40×105 CD3+ T-клеток, 30×105 CD3+ Т-клеток, 20×105 CD3+ Т-клеток, 15×105 CD3+ Т-клеток, 10×105 CD3+ Т-клеток, 9×105 CD3+ Т-клеток, 8×105 CD3+ Т-клеток, 7×105 CD3+ Τ-клеток, 6×105 CD3+ Т-клеток, 5×105 CD3+ Т-клеток, 4×105 CD3+ Т-клеток, 3×105 CD3+ Т-клеток, 2×105 CD3+ Т-клеток или 1×105 CD3+ Т-клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ Т-клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 20×105 CD3+ Т-клетки, но больше чем 10 CD3+ Т-клеток.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат по меньшей мере 1×103-1×105 CD3+ Т-клеток.
Согласно одному варианту осуществления незрелые гемопоэтические клетки подвергают деплеции по CD8+ клеткам.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×104-4×105 CD8+ клеток на кг массы тела субъекта.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 50×105 CD8+ клеток, 25×105 CD8+ клеток, 15×105 CD8+ клеток, 10×105 CD8+ клеток, 9×105 CD8+ клеток, 8×105 CD8+ клеток, 7×105 CD8+ клеток, 6×105 CD8+ клеток, 5×105 CD8+ клеток, 4×105 CD8+ клеток, 3×105 CD8+ клеток, 2×105 CD8+ клеток, 1×105 CD8+ клеток, 9×104 CD8+ клеток, 8×104 CD8+ клеток, 7×104 CD8+ клеток, 6×104 CD8+ клеток, 5×104 CD8+ клеток, 4×104 CD8+ клеток, 3×104 CD8+ клеток, 2×104 CD8+ клеток или 1×104 CD8+ клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 4×105 CD8+ клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 4×105 CD8+ клетки, но больше чем 10 CD8+ клеток.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×106 CD8+ TCRα/β- клеток на кг массы тела субъекта.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×106 CD8+ TCRα/β- клеток, 0,5×106 CD8+ TCRα/β- клеток, 1×105 CD8+ TCRα/β- клеток, 0,5×105 CD8+ TCRα/β- клеток, 1×104 CD8+ TCRα/β- клеток, 0,5×104 CD8+ TCRα/β- клеток, 1×103 CD8+ TCRα/β- клеток или 0,5×103 CD8+ TCRα/β- клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×106 CD8+ TCRα/β- клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 1×106 CD8+ TCRα/β- клеток, но больше чем 10 CD8+ TCRα/β- клеток.
Согласно одному варианту осуществления незрелые гемопоэтические клетки подвергают деплеции по В-клеткам.
Согласно одному варианту осуществления незрелые гемопоэтические клетки подвергают деплеции по В-клеткам (CD 19+ и/или CD20+ В-клеткам).
Согласно одному варианту осуществления незрелые гемопоэтические клетки содержат меньше чем 5×105 В-клеток, 40×105 В-клеток, 30×105 В-клеток, 20×105 В-клеток, 10×105 В-клеток, 9×105 В-клеток, 8×105 В-клеток, 7×105 В-клеток, 6×105 В-клеток, 5×105 В-клеток, 4×105 В-клеток, 3×105 В-клеток, 2×105 В-клеток или 1×105 В-клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления незрелые гемопоэтические клетки содержат меньше чем 4×105 В-клеток на кг массы тела субъекта. Согласно конкретному варианту осуществления незрелые гемопоэтические клетки содержат меньше чем 50×105 В-клеток, но больше чем 10В-клеток.
Деплецию Т-клеток, например, CD3+, CD2+, TCRα/β+, CD4+ и/или CD8+ клеток, или В-клеток, например, CD 19+ и/или CD20+ клеток, можно провести с использованием любого известного в настоящей области техники способа, например, путем эрадикации (например, цитолиза) с помощью специфических антител или путем основанного на аффинности очищения, например, путем применения техник магнитного разделения клеток, сортера FACS и/или мечения на основе ELISA с захватом.
Такие способы описаны в настоящем документе и в THE HANDBOOK OF EXPERIMENTAL IMMUNOLOGY, Volumes 1-4, (D.N. Weir, editor) и FLOW CYTOMETRY AND CELL SORTING (A. Radbruch, editor, Springer Verlag, 1992). Например, клетки можно отсортировать, например, путем проточной цитометрии или FACS. Таким образом, может использоваться сортировка клеток с активацией флуоресценции (FACS) и она может характеризоваться варьирующими углами каналов цветового сигнала, каналами обнаружения светорассеяния под малыми и тупыми углами и каналами сопротивления. Любые известные в настоящей области техники лиганд-зависимые техники разделения могут использоваться совместно с техниками как положительного, так и отрицательного разделения, которые основаны на физических свойствах клеток, а не на аффинности антител, включая в себя без ограничения элютриацию и центрифугирование в градиенте плотности.
Другие способы сортировки клеток включают в себя, например, пэннинг и разделение с использованием техник на основе аффинности, включая в себя те техники, в которых используются такие твердые подложки, как планшеты, гранулы и колонки. Таким образом, биологические образцы можно разделить путем "пэннинга" с антителом, прикрепленным к твердой матрице, например, к планшету.
Альтернативно, клетки можно отсортировать/разделить с помощью техник магнитного разделения, и некоторые из этих способов используют магнитные гранулы. Различные магнитные гранулы доступны из ряда источников, включая в себя, например, Dynal (Норвегия), Advanced Magnetics (Кэмбридж, Массачусетс, США), Immuncon (Филадельфия, США), Immunotec (Марсель, Франция), Invitrogen, Stem cell Technologies (США) и Cellpro (США). Альтернативно, антитела могут быть биотинилированы или конъюгированы с дигоксигенином и использованы в сочетании с авидином или покрытыми антителами к дигоксигенину аффинными колонками.
Согласно одному варианту осуществления различные способы деплеции/разделения могут комбинировать, например, магнитную сортировку клеток могут комбинировать с FACS для увеличения качества разделения или для обеспечения сортировки по множественным параметрам.
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки получают путем Т-клеточной циторедукции (TCD).
Т-клеточную циторедукцию можно осуществить с использованием антител, включающих в себя, например, антитела к CD8, антитела к CD4, антитела к CD3 антитела к CD2, антитела к TCRα/β и/или антитела к TCRγ/δ.
Согласно одному варианту осуществления деплецию В-клеток осуществляют путем В-клеточной циторедукции.
В-клеточную циторедукцию можно осуществить с использованием антител, включающих в себя например, антитела к CD19 или к CD20. Альтернативно, циторедукцию in vivo В-клеток можно осуществить путем инфузии антител к CD20.
Альтернативно, положительную селекцию CD34+ или CD 131+ стволовых клеток можно провести с использованием, например, техник магнитного разделения клеток, сортера FACS и/или мечение на основе ELISA с захватом, как описано подробнее выше.
Как указано, Т-клеточную или В-клеточную циторедукцию можно осуществить in vitro или in vivo (например, у донора перед получением от него незрелых гемопоэтических клеток).
Согласно одному варианту осуществления без-Т-клеточные незрелые гемопоэтические клетки (например, содержащие CD34+ клетки) содержат без-Т-клеточные клетки костного мозга, без-Т-клеточные мобилизированные клетки - предшественники гемопоэза из периферической крови (например, мобилизированные с помощью G-CSF), без-Т-клеточную пуповинную кровь/фетальную печень/желточный мешок и/или очищенные CD34+ клетки (полученные из всех упомянутых выше источников, например, из костного мозга и/или из мобилизированных G-CSF клеток - предшественников гемопоэза из периферической крови), и их подвергают положительной селекции (например, с помощью магнитных гранул с использованием антитела к CD34). Кроме того, очищенные CD34+ клетки, размноженные ex vivo для увеличения количества клеток, также предусмотрены согласно настоящим способам.
Согласно одному варианту осуществления настоящего изобретения субъекту вводят дозу без-Т-клеточных незрелых гемопоэтических клеток, содержащую по меньшей мере приблизительно 4×106, 4,5×106, 5×106, 5,5×106, 6×106, 6,5×106, 7×106, 7,5×106, 8×106, 8,5×106, 9×106, 9,5×106, 10×106, 12,5×106, 15×106, 20×106, 25×106, 30×106, 35×106, 40×106, 45×106, 50×106, 60×106, 70×106, 80×106, 90×106 CD34+ клеток на кг массы тела.
Согласно конкретному варианту осуществления субъекту вводят дозу без-Т-клеточных незрелых гемопоэтических клеток, содержащую по меньшей мере приблизительно 10×106 CD34+ клеток на кг массы тела.
Согласно конкретному варианту осуществления субъекту вводят дозу без-Т-клеточных незрелых гемопоэтических клеток, содержащую по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела.
Согласно одному варианту осуществления субъекту вводят дозу без-Т-клеточных незрелых гемопоэтических клеток, содержащую диапазон, составляющий приблизительно 4-30×106, 4-40×106, 4-50×106, 4-60×106, 4-70×106, 4-80×106, 4-90×106, 4-100×106, 5-10×106, 5-20×106, 5-30×106, 5-40×106, 5-50×106, 5-60×106, 5-70×106, 5-80×106, 5-90×106, 5-100×106, 10-20×106, 10-30×106, 10-40×106, 10-50×106, 10-60×106, 10-70×106, 10-80×106, 10-90×106,10-100×106, 20-30×106, 20-40×106, 20-50×106, 20-60×106, 20-70×106, 20-80×106, 20-90×106, 20-100×106, 30-40×106, 30-50×106, 30-60×106, 30-70×106, 30-80×106, 30-90×106, 30-100×106, 40-50×106, 40-60×106, 40-70×106, 40-80×106, 40-90×106, 40-100×106, 50-60×106, 50-70×106, 50-80×106, 50-90×106, 50-100×106, 60-70×106, 60-80×106, 60-90×106, 60-100×106, 70-80×106, 70-90×106, 70-100×106, 80-90×106, 80-100×106 CD34+ клеток на кг массы тела субъекта.
Согласно конкретному варианту осуществления субъекту вводят дозу без-Т-клеточных незрелых гемопоэтических клеток, содержащую диапазон, составляющий приблизительно 5-40×106 CD34+ клеток на кг массы тела.
Без-Т-клеточные незрелые гемопоэтические клетки согласно настоящему изобретению могут трансплантировать реципиенту с использованием любого способа, известного в настоящей области техники для клеточной трансплантации, такого как без ограничения клеточная инфузия (например, внутривенная), интраперитонеальным путем или внутрикостным путем.
Как указано, субъекту согласно настоящему изобретению могут дополнительно трансплантировать клеточный или тканевой трансплантат (например, печень, поджелудочную железу, селезенку, почку, сердце, легкое, кожу, кишечник и/или лимфоидные/гемопоэтические ткани).
Трансплантацию клетки или ткани субъекту можно осуществить различными путями, в зависимости от различных параметров, таких как, например, тип клетки или ткани; тип, стадия или тяжесть заболевания реципиента (например, функциональная недостаточность органа); физические или физиологические параметры, специфические для субъекта; и/или требуемый терапевтический результат.
Трансплантацию клеточного или тканевого трансплантата согласно настоящему изобретению можно осуществить путем трансплантации клеточного или тканевого трансплантата в любое одно из различных анатомических положений в зависимости от применения. Клеточный или тканевой трансплантат можно трансплантировать в гомотопическое анатомические положение (нормальное анатомические положение для трансплантата), или в эктопическое анатомические положение (аномальное анатомические положение для трансплантата). В зависимости от применения клеточный или тканевой трансплантат можно преимущественно имплантировать под почечную капсулу или в почку, тестикулярную жировую клетчатку, подкожный жировой слой, сальник, портальную вену, печень, селезенку, полость сердца, сердце, грудную полость, легкое, кожу, поджелудочную железу и/или внутрибрюшинное пространство.
Например, ткань печени согласно настоящему раскрытию можно трансплантировать в печень, портальную вену, почечную капсулу, подкожный жировой слой, сальник, селезенку и внутрибрюшинное пространство. Трансплантацию печени в различные анатомические положения, такие как перечисленные выше, как правило, проводят в настоящей области техники для лечения заболеваний, подлежащих лечению посредством трансплантации печени (например, печеночной недостаточности). Аналогично, трансплантацию ткани поджелудочной железы согласно настоящему изобретению можно преимущественно осуществить путем трансплантации ткани в портальную вену, печень, поджелудочную железу, тестикулярную жировую клетчатку, подкожный жировой слой, сальник, петлю кишечника (субсерозную оболочку U-образной петли тонкого кишечника) и/или внутрибрюшинное пространство. Трансплантация ткани пожделудочной железы может использоваться для лечения заболеваний, подлежащих лечению посредством трансплантации поджелудочной железы (например, диабета). Аналогично, трансплантацию таких тканей, как ткань почки, сердца, легкого или кожи можно провести в любое описанное выше анатомическое положение с целью лечения реципиентов, страдающих, например, от почечной недостаточности, сердечной недостаточности, легочной недостаточности или кожного повреждения (например, ожогов).
Необязательно при трансплантации клеточного или тканевого трансплантата по настоящему изобретению субъекту с поврежденным органом, может быть предпочтительным вначале по меньшей мере частично удалить поврежденный орган у субъекта для того, чтобы обеспечить оптимальное развитие трансплантата и его структурную/функциональную интеграцию с анатомией/физиологией субъекта.
Способ по настоящему изобретению также включает котрансплантацию нескольких органов (например, сердца и легкого, печени и селезенки, поджелудочной железы и костного мозга, например, гемопоэтических стволовых клеток, почки и костного мозга, например, гемопоэтических стволовых клеток и т.д.) в случае, если такая процедура может оказать благоприятное воздействие на субъекта.
Согласно одному варианту осуществления котрансплантация включает трансплантацию незрелых гемопоэтических клеток и твердой ткани/цельного органа или нескольких цельных органов/твердых тканей.
Согласно одному варианту осуществления незрелые гемопоэтические клетки и цельный орган получают от одного донора.
Согласно одному варианту осуществления клеточный или тканевой трансплантат (например, цельный орган) трансплантируют субъекту до, одновременно или после трансплантации без-Т-клеточных незрелых гемопоэтических клеток (например, содержащих CD34+ клетки) субъекту.
После трансплантации клеточного или тканевого трансплантата субъекту целесообразно согласно стандартной медицинской практике проводить мониторинг функциональности в отношении роста и иммуносовместимости органа согласно любой одной из различных стандартных техник, известных в настоящей области техники. Например, функциональность трансплантата ткани пожделудочной железы можно подвергнуть мониторингу после трансплантации с помощью стандартных исследований функций поджелудочной железы (например, анализ содержания инсулина в сыворотке). Аналогично, трансплантат ткани печень можно подвергнуть мониторингу после трансплантации с помощью стандартных исследований функций печени (например, анализ содержания альбумина, общего белка, АЛТ, ACT и билирубина в сыворотке и анализ времени коагуляции крови). Структурное развитие клеточного или тканевого трансплантата можно подвергнуть мониторингу посредством компьютерной томографии или ультразвукового исследования.
Независимо от типа трансплантата для снижения по меньшей мере приблизительно на 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% или предпочтительно во избежание отторжения трансплантата и/или реакции "трансплантат против хозяина" (GVHD), настоящее изобретение после трансплантации включает введение циклофосфамида.
Согласно одному варианту осуществления настоящее изобретение дополнительно включает введение циклофосфамида перед трансплантацией (например, в дни 4, 3 или 2 перед трансплантацией, т.е. Т-4, -3 или -2) в дополнение к введению после трансплантации, как описано в настоящем документе.
Следует отметить, что дату трансплантации (клеточного или тканевого трансплантата) принимают за Т=0.
Используемый в настоящем документе термин "циклофосфамид" относится к алкилирующему средству хлорметину, которое специфически присоединяет алкильную группу (CnH2n+1) к ДНК (также известному как цитофосфан). Согласно конкретному варианту осуществления циклофосфамид относится к молекулярной формуле C7H15C12N2O2P⋅Н2О и химическому названию 2-[бис(2-хлорэтил)амино]тетрагидро-2Н-1,3,2-оксазафосфорин-2-оксидмоногидрат. Циклофосфамид коммерчески доступен, например, от Zydus (German Remedies), Roxane Laboratories Inc-Boehringer Ingelheim, Bristol-Myers Squibb Co - Mead Johnson and Co, и Pfizer - Pharmacia & Upjohn, под торговыми названиями Endoxan, Cytoxan, Neosar, Procytox и Revimmune.
Терапевтически эффективное количество циклофосфамида, как правило, вводят субъекту после трансплантации клеточного или тканевого трансплантата.
Не ограничиваясь теорией, терапевтически эффективное количество представляет собой количество циклофосфамида, эффективное для цитолиза активированных аллореактивных Т-клеток донора или хозяина, не являясь токсическим для субъекта.
Например, в случае клеточного или тканевого трансплантата терапевтическое эффективное количество циклофосфамида составляет приблизительно 1-25 мг, 1-50 мг, 1-75 мг, 1-100 мг, 1-250 мг, 1-500 мг, 1-750 мг, 1-1000 мг, 5-50 мг, 5-75 мг, 5-100 мг, 5-250 мг, 5-500 мг, 5-750 мг, 5-1000 мг, 10-50 мг, 10-75 мг, 10-100 мг, 10-250 мг, 10-500 мг, 10-750 мг, 10-1000 мг, 25-50 мг, 25-75 мг, 25-100 мг, 25-125 мг, 25-200 мг, 25-300 мг, 25-400 мг, 25-500 мг, 25-750 мг, 25-1000 мг, 50-75 мг, 50-100 мг, 50-125 мг, 50-150 мг, 50-175 мг, 50-200 мг, 50-250 мг, 50-500 мг, 50-1000 мг, 75-100 мг, 75-125 мг, 75-150 мг, 75-250 мг, 75-500 мг, 75-1000 мг, 100-125 мг, 100-150 мг, 100-200 мг, 100-300 мг, 100-400 мг, 100-500 мг, 100-1000 мг, 125-150 мг, 125-250 мг, 125-500 мг, 125-1000 мг, 150-200 мг, 150-300 мг, 150-500 мг, 150-1000 мг, 200-300 мг, 200-400 мг, 200-500 мг, 200-750 мг, 200-1000 мг, 250-500 мг, 250-750 мг, 250-1000 мг на кг массы тела субъекта.
Согласно конкретному варианту осуществления терапевтическое эффективное количество циклофосфамида составляет приблизительно 25-200 мг на кг массы тела субъекта.
Как показано в представленном ниже разделе "Примеры", авторы настоящего изобретения показали, что введение двух доз циклофосфамида после трансплантации (в дни 3 и 4 после трансплантации) обеспечивает долгосрочное приживление трансплантата и толерантность "мегадозы" без-Т-клеточного костного мозга от несовместимого донора.
Согласно одному варианту осуществления циклофосфамид вводят в однократной дозе.
Согласно одному варианту осуществления циклофосфамид вводят в множественных дозах, например, в 2, 3, 4, 5 дозах или больше.
Согласно конкретному варианту осуществления циклофосфамид вводят в двух дозах.
Согласно одному варианту осуществления циклофосфамид вводят ежедневно, например один раз в день или два раза в день.
Доза каждого введения циклофосфамида может содержать приблизительно 5 мг, 7,5 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг, 210 мг, 220 мг, 230 мг, 240 мг, 250 мг, 260 мг, 270 мг, 280 мг, 290 мг, 300 мг, 350 мг, 400 мг, 450 мг или 500 мг на кг массы тела субъекта.
Согласно конкретному варианту осуществления доза циклофосфамида составляет 50 мг на кг массы тела субъекта.
Как указано, циклофосфамид вводят после трансплантации. Таким образом, например, циклофосфамид могут вводить субъекту через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 дней или больше после трансплантации (т.е. Т+1, +2, +3, +4, +5, +6, +7, +8, +9, +10). Согласно конкретному варианту осуществления циклофосфамид вводят субъекту в двух дозах через 3 и 4 дня после трансплантации.
Согласно одному варианту осуществления циклофосфамид вводят перед трансплантация и после трансплантации. Таким образом, например, циклофосфамид могут вводить субъекту за 3 дня перед трансплантацией (Т-3) и затем после трансплантации (например, в дни Т+3, +4 и т.д.).
Количество введений и терапевтически эффективное количество циклофосфамида можно отрегулировать в соответствии с потребностью, принимая во внимание тип трансплантации и ответ субъекта на режим. Определение количества ведений и терапевтически эффективного количества будет находиться в пределах компетенции специалистов в настоящей области техники, особенно в свете представленного в настоящем документе подробного раскрытия.
Для облегчения приживления трансплантата клеточного или тканевого трансплантата способ может дополнительно преимущественно включать кондиционирование субъекта с помощью дополнительного иммуносупрессивного лекарственного средства и/или иммуносупрессивного облучения до, одновременно или после трансплантации клеточного или тканевого трансплантата.
Следует понимать, что в ситуации, в которой клеточный или тканевой трансплантат (например, цельный орган) трансплантируют перед без-Т-клеточными незрелыми гемопоэтическими клетками, рекомендуется использовать иммунносупрессивные средства общего действия (например, описанный более подробно ниже циклоспорин А), чтобы избежать отторжения органа. Как только без-Т-клеточные незрелые гемопоэтические клетки трансплантируют, и достигается химеризм, введение иммунносупрессивных средств общего действия могут снижать и впоследствии прекращать. Напротив, в ситуациях, в которых клеточный или тканевой трансплантат (например, цельный орган) трансплантируют после без-Т-клеточных незрелых гемопоэтических клеток, после индукции химеризма, применение иммунносупрессивных средств общего действия может не понадобиться.
Подробное руководство относительно выбора и введения подходящих иммуносупрессивных режимов для трансплантации представлено в литературе в настоящей области техники (например, ссылаются на: Kirkpatrick СН. and Rowlands DT Jr., 1992. JAMA. 268, 2952; Higgins RM. et al., 1996. Lancet 348, 1208; Suthanthiran M. and Strom ТВ., 1996. New Engl. J. Med. 331, 365; Midthun DE. et al., 1997. Mayo Clin Proc. 72, 175; Morrison VA. et al., 1994. Am J Med. 97, 14; Hanto DW., 1995. Annu Rev Med. 46, 381; Senderowicz AM. et al., 1997. Ann Intern Med. 126, 882; Vincenti F. et al., 1998. New Engl. J. Med. 338, 161; Dantal J. et al. 1998. Lancet 351, 623).
Таким образом, согласно одному варианту осуществления настоящего изобретения субъект подвергают кондиционированию в режиме кондиционирования сниженной интенсивности перед трансплантацией клеточного или тканевого трансплантата.
Согласно одному варианту осуществления кондиционирование сниженной интенсивности осуществляют в течение до 2 недель (например, 1-10 или 1-7 дней) перед трансплантацией клеточного или тканевого трансплантата.
Таким образом, например, на субъекта могут воздействовать с помощью миелоаблативного или немиелоаблативного кондиционирования. Такое кондиционирование может включать, например, и как описано подробно в приведенном ниже разделе "Примеры", in vivo Т-клеточную циторедукцию, например, с помощью антитела к CD4, антитела к CD8, антител к CD3 (ОКТ3), антител к CD52 (например, CAMP ΑΤΗ) и/или антитела - антитимоцитарного глобулина (ATG) (например, за 6 дней перед трансплантацией в терапевтической эффективной дозе, составляющей приблизительно 300 мкг для каждого антитела).
Кондиционирование может дополнительно или альтернативно включать тотальное облучение тела (TBI), тотальное облучение лимфоидной ткани (TLI, т.е. воздействие на все лимфатические узлы, тимус и селезенку), химиотерапевтическое средство и/или иммунотерапию антителами.
Таким образом, согласно одному варианту осуществления TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 0,5-1 Гр, 0,5-1,5 Гр, 0,5-2,5 Гр, 0,5-5 Гр, 0,5-7,5 Гр, 0,5-10 Гр, 0,5-15 Гр, 1-1,5 Гр, 1-2 Гр, 1-2,5 Гр, 1-3 Гр, 1-3,5 Гр, 1-4 Гр, 1-4,5 Гр, 1-1,5 Гр, 1-7,5 Гр, 1-10 Гр, 2-3 Гр, 2-4 Гр, 2-5 Гр, 2-6 Гр, 2-7 Гр, 2-8 Гр, 2-9 Гр, 2-10 Гр, 3-4 Гр, 3-5 Гр, 3-6 Гр, 3-7 Гр, 3-8 Гр, 3-9 Гр, 3-10 Гр, 4-5 Гр, 4-6 Гр, 4-7 Гр, 4-8 Гр, 4-9 Гр, 4-10 Гр, 5-6 Гр, 5-7 Гр, 5-8 Гр, 5-9 Гр, 5-10 Гр, 6-7 Гр, 6-8 Гр, 6-9 Гр, 6-10 Гр, 7-8 Гр, 7-9 Гр, 7-10 Гр, 8-9 Гр, 8-10 Гр, 10-12 Гр или 10-15 Гр.
Согласно конкретному варианту осуществления TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 1-3,5 Гр.
Согласно одному варианту осуществления лечение TBI вводят субъекту за 1-10 дней (например, за 1-3 дня) перед трансплантацией. Согласно одному варианту осуществления субъект подвергают кондиционированию один раз с помощью TBI за 1 или 2 дня перед трансплантацией.
Согласно конкретному варианту осуществления TLI включает в себя облучение доза в пределах диапазона, составляющего 0,5-1 Гр, 0,5-1,5 Гр, 0,5-2,5 Гр, 0,5-5 Гр, 0,5-7,5 Гр, 0,5-10 Гр, 0,5-15 Гр, 1-1,5 Гр, 1-2 Гр, 1-2,5 Гр, 1-3 Гр, 1-3,5 Гр, 1-4 Гр, 1-4,5 Гр, 1-1,5 Гр, 1-7,5 Гр, 1-10 Гр, 2-3 Гр, 2-4 Гр, 2-5 Гр, 2-6 Гр, 2-7 Гр, 2-8 Гр, 2-9 Гр, 2-10 Гр, 3-4 Гр, 3-5 Гр, 3-6 Гр, 3-7 Гр, 3-8 Гр, 3-9 Гр, 3-10 Гр, 4-5 Гр, 4-6 Гр, 4-7 Гр, 4-8 Гр, 4-9 Гр, 4-10 Гр, 5-6 Гр, 5-7 Гр, 5-8 Гр, 5-9 Гр, 5-10 Гр, 6-7 Гр, 6-8 Гр, 6-9 Гр, 6-10 Гр, 7-8 Гр, 7-9 Гр, 7-10 Гр, 8-9 Гр, 8-10 Гр, 10-12 Гр, 10-15 Гр, 10-20 Гр, 10-30 Гр, 10-40 Гр, 10-50 Гр, 0,5-20 Гр, 0,5-30 Гр, 0,5-40 Гр или 0,5-50 Гр.
Согласно конкретному варианту осуществления TLI включает в себя дозу однократного или фракционированного облучения в пределах диапазона, составляющего 1-3,5 Гр.
Согласно одному варианту осуществления лечение TLI вводят субъекту за 1-10 дней (например, за 1-3 дня) перед трансплантацией. Согласно одному варианту осуществления субъект подвергают кондиционированию один раз с помощью TLI за 2-7 дней перед трансплантацией.
Согласно одному варианту осуществления кондиционирование включает в себя химиотерапевтическое средство. Иллюстративные химиотерапевтические средства включают в себя без ограничения бусульфан, милеран, бусульфекс, флударабин, мелфалан и тиотепа и циклофосфамид. Химиотерапевтическое(ие) средство(а) могут вводить субъекту в однократной дозе или в нескольких дозах, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше дозах (например, ежедневных дозах) перед трансплантацией. Согласно одному варианту осуществления субъекту вводят химиотерапевтическое средство (например, флударабин, например, в дозе, составляющей приблизительно 30 мг/м2/день) в течение 5 последовательных дней перед трансплантацией (например, в дни с -7 по -3).
Согласно одному варианту осуществления кондиционирование включает в себя иммунотерапию антителами. Иллюстративные антитела включают в себя без ограничения антитело к CD52 (например, алтемтузумаб, продаваемый под торговыми названиями, например, Campath, MabCampath, Campath-1H и Lemtrada) и средство -антитимоцитарный глобулин (ATG) [например, Thymoglobulin (ATG кролика, rATG, доступный от Genzyme) и Atgam (ATG лошади, eATG, доступный от Pfizer)]. Дополнительная иммунотерапия антителами может включать в себя средства к CD3 (ОКТ3), к CD4 или к CD8. Согласно одному варианту осуществления антитело вводят субъекту в однократной дозе или в нескольких дозах, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше дозах (например, ежедневных дозах) перед трансплантацией (например, за 6 дней перед трансплантацией).
Согласно одному варианту осуществления субъект не получает длительное лечение (например, в течение пролонгированного периода времени, например, в течение больше чем 10 дней) путем профилактики GVHD после трансплантации.
Согласно одному варианту осуществления в случае рецидива после трансплантации гемопоэтических стволовых клеток субъект может дополнительно получить лечение с помощью инфузий донорских лимфоцитов (DLI). Например, субъекту могут вводить ступенчатые дозы Т-клеток, как описано ранее Dazzi с соавт. [Dazzi, Szydlo et al., Blood, (2000) 96: 2712-6], полностью включенной в настоящий документ посредством ссылки.
Согласно одному варианту осуществления субъект может получать лечение путем инфузий приблизительно 0,5-5×104 CD3+ лимфоцитов на кг массы тела реципиента (например, 1×104 CD3+ лимфоцитов, например, не подвергшихся манипуляции CD3+ лимфоцитов на кг массы тела пациента) для лечения рецидива после без-Т-клеточной гаплоидентичной трансплантации.
Согласно одному варианту осуществления пациент с ранним молекулярным и/или гематологическим рецидивом будет дополнительно получать лечение с помощью первой дозы, составляющей приблизительно 1×104 CD3+ клеток на кг массы тела пациента. При отсутствии GVHD вторую инфузию, составляющую приблизительно 1×105 CD3+ клеток на кг массы тела пациента, будут, как правило, вводить приблизительно через 45 дней, после чего через 2 месяца будут вводить третью дозу, составляющую приблизительно 1×106 CD3+ клеток на кг массы тела пациента. Следует понимать, что доноры, как правило, подвергаются лейкаферезу для сбора лимфоцитов перед мобилизацией гемопоэтических клеток (например, для трансплантации). Замороженные препараты при необходимости оттаивают и проводят быструю инфузию в течение периода, составляющего 5-10 минут. Пациенты, проявляющие острую GVHD или которые не могут продемонстрировать приживление гематологического трансплантата, как правило, не будут получать DLL
Согласно одному варианту осуществления пациент с рецидивирующей В-клеточной неходжкинской лимфомой будет, как правило, получать лечение с помощью ритуксимаба (например, 375 мг/м каждую неделю в течение приблизительно 4 недель) с DLI, проводимой одновременно со второй дозой ритуксимаба.
Согласно одному варианту осуществления пациент с рецидивирующей множественной миеломой будет дополнительно получать лечение с помощью бортезомиба (например, 1,3 мг/м в дни 1,4, 8 и 11) перед началом DLL
Согласно одному варианту осуществления совместно с настоящими способами не будут применяться никакие иммуносупрессивные средства после DLL
Согласно аспекту настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в трансплантации без-Т-клеточных незрелых гемопоэтических клеток, включающий: (а) трансплантацию подвергнутому кондиционированию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Согласно аспекту настоящего изобретения предусмотрен способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, включающий: (а) кондиционирование субъекта согласно протоколу кондиционирования сниженной интенсивности, причем кондиционирование сниженной интенсивности включает в себя тотальное облучение тела (TBI) и химиотерапевтическое средство; (b) трансплантацию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (с) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Согласно аспекту настоящего изобретения предусмотрен способ индукции донор-специфической толерантности у субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате, включающий: (а) трансплантацию субъекту дозы без-Т-клеточных незрелых гемопоэтических клеток, полученных от несингенного донора, причем без-Т-клеточные незрелые гемопоэтические клетки содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем терапевтически эффективное количество составляет 25-200 мг на кг массы тела, тем самым обеспечивая лечение субъекта.
Используемый в настоящем документе термин "донор-специфическая толерантность" относится к состоянию, при котором существует сниженная реактивность клеток реципиента (например, Т-клеток реципиента), когда они приходят в контакт с клетками донора (например, гемопоэтическими клетками донора) по сравнению с реактивностью клеток реципиента при отсутствии такого способа лечения.
Индукция толерантности обеспечивает возможность трансплантации клеточного или тканевого трансплантата (описанной подробнее выше в настоящем документе) со сниженным риском отторжения трансплантата или GVHD.
Согласно одному варианту осуществления настоящего изобретения пациенты с ранним молекулярным и/или гематологическим рецидивом могут получать инфузии донорских лимфоцитов (DLI).
Согласно одному варианту осуществления настоящего изобретения DLI может содержать 1×103-1×106 CD3+ Т-клеток/кг массы тела реципиента.
Согласно одному варианту осуществления пациенты с ранним молекулярным и/или гематологическим рецидивом могут получать однократную дозу или несколько доз (две, три, четыре, пять или больше доз) DLL Таким образом, например, пациенты с ранним молекулярным и/или гематологическим рецидивом могут получать первую дозу, составляющую 1×104 CD3+ Т-клеток/кг массы тела реципиента. При отсутствии реакции "трансплантат против хозяина" (GVHD) вторую инфузию 1×105 CD3+ Т-клеток/кг массы тела реципиента могут вводить, например, через 45 дней с последующей, например, через 2 месяца, третьей дозой, составляющей 1×106 CD3+ Т-клеток/кг массы тела реципиента.
Согласно одному варианту осуществления пациенты с ранним молекулярным и/или гематологическим рецидивом могут получать тотальное облучение тела (TBI), тотальное облучение лимфоидной ткани (TLI), химиотерапевтическое средство и/или иммунотерапию антителами.
Таким образом, например, пациенты с рецидивирующей В-клеточной неходжкинской лимфомой могут получать ритуксимаб (например, в дозе 375 мг/м2 каждую неделю) в течение приблизительно 4 недель с DLI, проводимой одновременно со второй дозой ритуксимаба.
Таким образом, например, пациенты с рецидивирующей множественной миеломой могут получать лечение с помощью бортезомиба (например, в дозе, составляющей 1,3 мг/м в дни 1,4, 8 и 11) перед началом DLI.
Используемый в настоящем документе термин "приблизительно" относится к ±10%.
Термины "содержит", "содержащий", "включает в себя", "включающий", "характеризующийся" и их родственные слова означают "включающий без ограничения".
Термин "состоящий из" означает "включая в себя и ограничиваясь этим".
Термин "состоящий по существу из" означает, что композиция, способ или структура может включать в себя дополнительные ингредиенты, стадии и/или части, но только если дополнительные ингредиенты, стадии и/или части не изменяют существенно основные и новые характеристики заявленной композиции, способа или структуры.
Используемые в настоящем документе формы единственного числа включают в себя ссылки на формы множественного числа, если в контексте ясно не указано иное. Например, термин "соединение" или "по меньшей мере одно соединение" может включать в себя множество соединений, включая в себя их смеси.
В настоящей заявке различные варианты осуществления настоящего изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона представлено для удобства и краткости и не должно рассматриваться как жесткое ограничение объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретное раскрытие всех возможных поддиапазонов, а также отдельных численных значений в пределах этого диапазона. Например, описание такого диапазона, как от 1 до 6 должно рассматриваться как конкретное раскрытие таких поддиапазонов, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельных численных значение в пределах этого диапазона, например, 1, 2, 3, 4, 5 и 6. Это применяется независимо от ширины диапазона.
Во всех случаях в настоящем документе, когда указан численных диапазон, это означает, что он включают в себя любое указанное число (дробное или целое) в пределах указанного диапазона. Фразы "в диапазоне/диапазоны между" первым указанным числом и вторым указанным числом и "в диапазон/диапазоны от" первого указанного числа "до" второго указанного числа используются в настоящем документе взаимозаменяемо и означают включение первого и второго указанных чисел и всех дробных и целых чисел между ними.
Используемый в настоящем документе термин "способ" относится к способам, средствам, техникам и процедурам для осуществления поставленной задачи, включая в себя без ограничения те способы, средства, техники и процедуры, которые либо являются известными, либо легко разрабатываются на основе известных способов, средств, техник и процедур специалистами в химической, фармакологической, биологической, биохимической и медицинских областях.
Следует понимать, что определенные признаки настоящего изобретения, который для ясности описаны в контексте отдельных вариантов осуществления, также могут быть предусмотрены в комбинации в одном варианте осуществления. Напротив, различные признаки настоящего изобретения, которые для краткости описаны в контексте одного варианта осуществления, также могут быть предусмотрены отдельно или в любой подходящей подкомбинации или подходящим образом в любом другом описанном варианте осуществления настоящего изобретения. Определенные признаки, описанные в контексте различных вариантов осуществления, не должны рассматриваться в качестве основных признаков этих вариантов осуществления, за исключением случаев, когда вариант осуществления является нефункциональным без указанных элементов.
Различные варианты осуществления и аспекты настоящего изобретения, представленные в настоящем документе выше и заявленные в формуле изобретения ниже, находят экспериментальное подтверждение в последующих примерах.
ПРИМЕРЫ
Последующие примеры вместе с представленными выше описаниями иллюстрируют настоящее изобретение неограничивающим образом.
Как правило, используемая в настоящем документе номенклатура и используемые в настоящем изобретении лабораторные процедуры включают в себя молекулярные, биохимические, микробиологические техники и техники рекомбинантной ДНК. Такие техники всесторонне описаны в литературе. Смотрите, например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R.M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методики, представленные в патентах США №№4666828; 4683202; 4801531; 5192659 и 5272057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J.E., ed. (1994); "Current Protocols in Immunology" Volumes I-III Coligan J.E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W.H. Freeman and Co., New York (1980); доступные иммуноанализы всесторонне описаны в патентной и научной литературе, смотрите, например, патенты США №№3791932; 3839153; 3850752; 3850578; 3853987; 3867517; 3879262; 3901654; 3935074; 3984533; 3996345; 4034074; 4098876; 4879219; 5011771 и 5281521; "Oligonucleotide Synthesis" Gait, Μ.J., ed. (1984); "Nucleic Acid Hybridization" Hames, B.D., and Higgins S.J., eds. (1985); "Transcription and Translation" Hames, B.D., and Higgins S.J., Eds. (1984); "Animal Cell Culture" Freshney, R.I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, В., (1984) и "Methods in Enzymology" Vol.1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все из которых включены в настоящий документ посредством ссылки, как если бы они были полностью изложены в настоящем документе. Другие общие ссылки представлены по ходу настоящего документа. Считается, что описанные в них процедуры хорошо известны в настоящей области техники и представлены для удобства читателя. Вся содержащаяся в них информация включена в настоящий документ посредством ссылки.
ПРИМЕР 1
Стабильное приживление трансплантата HLA-несовместимого костного мозга после трансплантации "мегадозы" костного мозга и посттрансплантационного введения циклофосфамида
Материалы и экспериментальные процедуры
Животные
Используемые в настоящих исследованиях мыши представляли собой самок мышей возрастом 6-12 недель. Линии Balb/c-Nude (H-2d) и С3Н/Hen (Н-2k) покупали в Harlan Israel (Rehovot, Израиль). Всех мышей содержали в небольших клетках (по 5 животных в каждой клетке) и кормили стерильной пищей и подкисленной водой. Эти исследования были одобрены Комитетом по содержанию и использованию лабораторных животных Института имени Вейцмана.
Протокол трансплантации
Клетки ВМ в низкой (5×106) и высокой дозе (25×106) от мышей Balb/c-Nude (которые представляют собой источник ВМ, подвергнутого деплеции Т-клеток) трансплантировали аллогенным реципиентам (С3Н/Hen) в день 0 после in vivo Т-клеточной циторедукции (TCD) с помощью антител к CD4 (клон GK1.5) и к CD8 (клон 53.6.72) (по 300 мкг каждое; Bio X Cell, NH, США), вводимых в день -6, и воздействия 2,0 Гр тотального облучения тела (TBI) в день -1. Высокую дозу циклофосфамида (CY, 100 мг/кг, Baxter Oncology, Германия) вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 35 и 95 дней после трансплантации с использованием конъюгированных с флуоресцеином антител к Н-2 хозяина и донора (например, меченное FlTC антитело к H-2Dd, специфическое к клеткам донорского типа, и меченное РЕ антитело к Н-2Kk, специфическое к клеткам характерного для хозяина типа).
Протокол трансплантации кожи
Кожные трансплантаты линии донорского типа (Balb/c) и независимой линии (C57BL/6) трансплантировали смешанным химерным реципиентам, как описано выше [т.е. тем мышам, которым предварительно трансплантировали мегадозу (25×106) без-Т-клеточного ВМ и ввели высокую дозу CY] и мышам - реципиентам, которым инокулировали регулярную дозу (5×106) клеток без-Т-клеточного ВМ и вводили высокую дозу CY.
Результаты
Для исследования потенциального синергизма между "мегадозой" без-Т-клеточного трансплантата костного мозга (ВМТ) и высокой дозы циклофосфамида (CY) после трансплантации, после кондиционирования сниженной интенсивности (RIC) мышей - реципиентом, проводили следующие эксперименты.
Мыши - реципиенты (С3Н/Hen) получали лечение с помощью протокола кондиционирования перед трансплантацией без-Т-клеточного трансплантата костного мозга. В частности, на мышей воздействовали in vivo путем Т-клеточной циторедукции (TCD) с использованием антител к CD4 и CD8, вводимых в день -6, и путем воздействия с помощью 2,0 Гр тотального облучения тела (TBI) в день -1. Далее низкую (5×106) или высокую дозу (25×106) клеток ВМ Balb/c-Nude (обеспечивающих источник ВМ, подвергнутого деплеции Т-клеток, поскольку мыши Nude характеризуются минимальным содержанием зрелых Т-клеток) трансплантировали аллогенным реципиентам (С3Н/Hen) в день 0. Высокую дозу циклофосфамида (CY, 100 мг/кг) вводили в дни +3 и +4 после трансплантации. Оценку приживление трансплантата клеток костного мозга проводили с помощью оценки донорского химеризма в 35 и 95 дни после трансплантации.
Как показано на фиг. 1А-В и 2А-В, анализ химеризма в день 35 и день 95 выявил, что ни одна из контрольных мышей (подвергнутых кондиционированию с помощью TCD, 2 Гр TBI и необязательно CY, но которая не получила ВМ) не проявляла донорский химеризм. Аналогично, ни одна из мышей - реципиентов ВМ, которым трансплантировали регулярную дозу, составляющую 5×106 без-Т-клеточного ВМ, в присутствии или при отсутствии лечения циклофосфамидом, не проявляла донорский химеризм. Тем не менее, когда дозу без-Т-клеточного ВМ увеличивали до 25×106 клеток, долгосрочный смешанный химеризм достигался у 4 из 7 мышей, которые также получали лечение циклофосфамидом в дни +3 и +4 после трансплантации (фиг.1А-В и 2С).
Последующее наблюдение за этими мышами - реципиентами в дни 180 и 225 после трансплантации выявило, что индуцированный химеризм был стабильным и долгосрочным (фиг. 3). Как показано на фиг. 3, количество химерных реципиентов с клетками донорского типа и уровень донорского химеризма оставались неизменными через 225 дней после трансплантации, указывая на то, что была достигнута толерантность.
Индукцию толерантности измеряли путем трансплантации кожных трансплантатов от линии донорского типа (Balb/c) и независимой линии (C57BL/6) смешанным химерным реципиентам, которым трансплантировали мегадозу (25×106) без-Т-клеточного ВМ и которым вводили высокую дозу CY (как описано выше), по сравнению с реципиентами, которым инокулировали регулярную дозу (5×106) клеток без-Т-клеточного ВМ (как описано выше).
Как показано на фиг. 4А-В, три из 4 химерных мышей, которым трансплантировали 25×106 без-Т-клеточного ВМ, приживляли трансплантат от линии донорского типа и отторгали кожные трансплантаты от независимой линии. Напротив, мыши - реципиенты, которым инокулировали 5×106 клеток без-Т-клеточного ВМ и CY, отторгали кожные трансплантаты как от линии донорского типа, так и от независимой линии (фиг. 4А).
Эти результаты показывают, что комбинация мегадозы без-Т-клеточного ВМ и лечения циклофосфамидом в высокой дозе обеспечивает успешное приживление трансплантата гемопоэтических стволовых клеток, в режиме кондиционирования сниженной интенсивности наряду с индукцией толерантности.
Опираясь на эти результаты, инициировали ряд калибровочных экспериментов для определения оптимального облучения и дозы циклофосфамида для улучшения индукции химеризма с помощью указанного подхода.
ПРИМЕР 2
Эффект различных доз тотального облучения тела (TBI) на химеризм
Материалы и экспериментальные процедуры
Животные
Как описаны в примере 1, в настоящем документе выше.
Протокол трансплантации
Высокую дозу (25×106) клеток ВМ Balb/c-Nude (обеспечивающих источник ВМ, подвергнутого деплеции Т-клеток) трансплантировали аллогенным реципиентам (С3Н/Hen) в день 0 после in vivo Т-клеточной циторедукции (TCD) с помощью антител к CD4 (клон GK1.5) и к CD8 (клон 53.6.72) (по 300 мкг каждое; Βiο X Cell, NH, США), вводимых в день -6, и воздействия различных доз облучения в диапазоне от 1 до 3,5 Гр TBI в день -1. Высокую дозу циклофосфамида (CY, 100 мг/кг, Baxter Oncology, Германия) вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 30 дней после трансплантации с использованием конъюгированных с флуоресцеином антител к Н-2 хозяина и донора (например, меченное FlTC антитело к H-2Dd, специфической к клеткам донорского типа, и меченное РЕ антитело к Н-2Kk, специфическое к клеткам характерного для хозяина типа).
Результаты
В указанном эксперименте определили минимальную дозу облучения. "Мегадозу" (25×106) без-Т-клеточного ВМ Balb/c-Nude трансплантировали 5 группам аллогенных реципиентов (С3Н/Hen) в день 0 после Т-клеточной циторедукции (с антителами к CD4 и CD8) в день -6, и различными дозами облучения (в диапазоне от 1 до 3,5 Гр TBI) в день -1. Высокую дозу циклофосфамида (CY) вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 30 дней после трансплантации.
Как видно на фиг. 5, все мыши - реципиенты, которых облучали с помощью 2, 5, 3 или 3,5 Гр TBI (6/6), были химерными, проявляющими донорский химеризм в диапазоне 58-83%. Аналогично, 87% (13/15) мышей, на которых воздействовали с помощью 2 Гр TBI, проявляли донорский химеризм в диапазоне 56-85%.
Дальнейшее снижение дозы облучения до 1,0 Гр вызывало небольшое снижение процентного отношения химерных мышей, которое составляло 83% (5/6), тем не менее диапазон донорского химеризма был существенно снижен до 14,5-58%.
ПРИМЕР 3
Эффект различных доз циклофосфамида (CY) на химеризм
Материалы и экспериментальные процедуры
Животные
Как описаны в примере 1, в настоящем документе выше.
Протокол трансплантации
Высокую дозу (25×106) клеток ВМ Balb/c-Nude (обеспечивающих источник ВМ, подвергнутого деплеции Т-клеток) трансплантировали аллогенным реципиентам (С3Н/Hen) в день 0 после in vivo Т-клеточной циторедукции (TCD) с помощью антител к CD4 (клон GK1.5) и к CD8 (клон 53.6.72) (каждое по 300 мкг; Bio X Cell, NH, США), вводимых в день -6, и воздействия 2,0 Гр тотального облучения тела (TBI) в день -1. Различные дозы циклофосфамида (CY, 100 мг/кг, 125 мг/кг или 150 мг/кг, Baxter Oncology, Германия) вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 30 дней после трансплантации с использованием конъюгированных с флуоресцеином антител к Н-2 хозяина и донора (например, меченное F1TC антитело к H-2Dd, специфической к клеткам донорского типа, и меченное РЕ антитело к Н-2Kk, специфическое к клеткам характерного для хозяина типа).
Результаты
В настоящем эксперименте определили оптимальную дозу CY после трансплантации. "Мегадозу" (25×106) клеток ВМ Balb/c-Nude трансплантировали 3 группам аллогенных реципиентов (С3Н/Hen) в день 0 после Т-клеточной циторедукции (TCD) с помощью антител к CD4 и CD8 в день -6, и 2 Гр TBI в день -1. Различные дозы циклофосфамида (CY), 100 мг/кг, 125 мг/кг или 150 мг/кг, вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 30 дней после трансплантации.
Как показано на фиг. 6, увеличение дозы С Υ до 125 мг/кг или 150 мг/кг не обеспечивало существенного усиления химеризма. Таким образом, мыши - реципиенты, которым вводили 100 мг/кг, 125 мг/кг или 150 мг/кг CY, проявляли средние значения донорского химеризма, составляющие 57,5±25,8, 66,5±20,6 или 67,4±27,4, соответственно. Не обнаружена статистическая значимость при сравнении реципиентов, получивших лечение с помощью 100 мг/кг, с реципиентами, получившими лечение с помощью 125 мг/кг или 150 мг/кг (Р=0,5 и р=0,469 соответственно).
ПРИМЕР 4
Не относящиеся к CD8+ Т-клетки не являются важными для достижения химеризма путем комбинации "мегадозы" без-Т-клеточного ВМ с введением CY после трансплантации
Материалы и экспериментальные процедуры
Животные
Как описаны в примере 1, в настоящем документе выше.
Протокол трансплантации
Высокую дозу (25×106) подвергнутых деплеции CD8 и не подвергнутых деплеции клеток ВМ Balb/c-Nude трансплантировали 2 когортам аллогенных реципиентов (С3Н/Hen) в день 0 после in vivo Т-клеточной циторедукции (TCD) с помощью антител к CD4 (клон GK1.5) и к CD8 (клон 53.6.72) (каждое по 300 мкг; Bio X Cell, NH, США), вводимых в день -6, и воздействия 2,0 Гр тотального облучения тела (TBI) в день -1. Высокую дозу циклофосфамида (CY, 100 мг/кг, Baxter Oncology, Германия) вводили в дни +3 и +4 после трансплантации и донорский химеризм оценивали через 30 дней после трансплантации с использованием конъюгированных с флуоресцеином антител к Н-2 хозяина и донора (например, меченное FlTC антитело к H-2Dd, специфической к клеткам донорского типа, и меченное РЕ антитело к Н-2Kk, специфическое к клеткам характерного для хозяина типа).
Источником ВМ в настоящих экспериментах являлись мыши Balb/c-Nude. Более того, мыши, которым проводили трансплантацию в указанных экспериментах, были бестимусными, и по существу они не содержали Т-клетки. Тем не менее, для опровержения возможности того, что эффект был обусловлен остаточными не относящимися к CD8 Т-клетками, препарат ВМ от мышей Balb/c-Nude подвергали отрицательной сортировке в отношении С08-клеток с использованием системы сортировки клеток (например, магнитных гранул к CD8 или сортера FACS).
Результаты
Поскольку ранее Ildstad с соавт. предполагали, что клетки ВМ подкласса CD8+ TCR- являются критически важными для достижения донорского химеризма [Fugier-Vivier IJ et al., J Exp Med (2005) 201:373-383; Grimes HL et al., Exp Hematol. (2004) 32:946-954; Huang Y et al., Blood (2011) 117:2494-2505; Kaufman CL et al., Blood (1994) 84:2436-2446; Leventhal J et al., BMC Med (2012) 10:48; Leventhal J et al., Sci Transl Med. (2012) 4:124ral28], авторы настоящего изобретения подвергли деплеции остаточные CD8+ клетки из препарата "мегадозы" ВМ Balb/c-Nude и измерили индукцию химеризма по сравнению с контрольными не подвергнутыми деплеции CD8+ клеток ВМ Nude.
Как показано на фиг. 7, деплеция CD8+ Т-клеток из препарата ВМ не оказывала какого-либо неблагоприятного воздействия на уровень достигнутого химеризма при комбинации "мегадозы" клеток без-Т-клеточного ВМ с посттрансплантационным введением CY.
ПРИМЕР 5
Клинический протокол
Схема исследования
Исследование представляет собой проспективное, наблюдательное многоцентровое исследование Ι/ΙΙ фазы. Десять пациентов с гематологическими нарушениями будут вовлечены в настоящее исследование в течение периода, составляющего один год.
Первичным конечным показателем исследования является приживление трансплантата, и 10 подлежащих оцениванию пациентов (т.е. пациентов, выживших в период после 28 дня) будут включены в исследование. Приемлемый показатель первичной недостаточности трансплантата или отторжения составляет приблизительно 10%.
Длительность исследования
Первичный анализ будут проводить с использованием данных последующего наблюдения в течение 6 и 12 месяцев. Пациентов будут подвергать последующему наблюдению до достижения 48 месяцев после трансплантации.
Определения
Стабильное длительное приживление трансплантата определяют по показателям содержания нейтрофилов, составляющего больше чем 1000/мкл в течение трех последовательных дней, и содержания тромбоцитов, составляющего больше чем 20000/мкл в течение трех последовательных дней без трансфузии.
Отторжение трансплантата определяют как быстрое падение содержания нейтрофилов, составляющее меньше чем 100/мкл после документально зарегистрированного приживления нейтрофилов, с увеличением лимфоцитов или без него.
Недостаточность трансплантата определяют как невозможность достижения содержания больше чем 1000/мкл нейтрофилов в течение трех последовательных дней и больше чем 20000/мкл тромбоцитов в течение трех последовательных дней без трансфузии в день +28.
Вторичный конечный показатель исследования представляет собой частоту возникновения острой GVHD II-IV степени. Приемлемая частота возникновения острой GVHD II-IV степени составляет приблизительно 10%.
Для острой GVHD критерии определения степени представлены в таблицах 1А-В ниже.
Статистические аспекты
Временные интервалы для определения показателей приживления трансплантата, выживаемости, выживаемости без заболевания, частоты рецидива и риска связанной с трансплантацией смертности будут рассчитывать, начиная с даты трансплантации стволовых клеток. Вероятностные кривые будут рассчитывать согласно методу Каплана-Майера.
Критерии отбора
Критерии включения - Пациент
- Возраст - больше или равен 18 и меньше или равен 70 годам
- Пациенты с CLL с рефрактерностью к флударабину или другой химиотерапии вследствие потери р53 путем делеции 17р и/или мутации ТР53
- Фолликулярная лимфома с любой неблагоприятной цитогенетикой, такой как комплексный кариотип, делеция 17р, делеция 6q23-26, мутации в ТР53, минус 1р
- Лимфома Ходжкина, рецидивирующая после аутологичной трансплантации, не поддающаяся иммунотерапии с помощью антитела к CD30
- Множественная миелома, рецидивирующая после аутологичной трансплантации, с неблагоприятной цитогенетикой либо в частичной, либо в полной ремиссии
- Тяжелая апластическая анемия, рецидивирующая после иммунотерапии
- Отсутствие полностью HLA-совместимого или HLA-несовместимого по одному локусу родственного донора
- Отсутствие совместимого неродственного донора или отсутствие права на поиск донора в регистре доноров (IBMDR)
- Присутствие гаплоидентичного родственного донора и резерв аутологичных стволовых клеток пациента
- Стабильные клинические состояния и ожидаемая продолжительность жизни, составляющая больше 12 недель
- Индекс Карнофски - больше 70%
- Письменное информированное согласие
Оценка предыдущего лечения
- полная клиническая история и исследование и определение индекса общего состояния и площади поверхности тела
- клинический анализ крови
- группа крови, подгруппы эритроцитов, типа анти-А и/или анти-В агглютининов
- клиренс креатинина, содержание мочевой кислоты, ферритина, лактатдегидрогеназы, бета-2-микроглобулина, протеинограмма, ACT, АЛТ, анализ мочи, содержание глюкозы в крови, содержание азота в крови, содержание иммуноглобулинов, реакции Кумбса
- проба на наличие беременности
- определение антител к ВИЧ, поверхностного антигена вируса гепатита В, ДНК вируса гепатита В, антител в вирусу гепатита С, РНК вируса гепатита С, антител к цитомегаловирусу, антител к токсоплазме, антител к вирусу простого герпеса
- ЭКГ и измерение фракции выброса с помощью ультразвукового или сцинтиграфического исследования
- рентгенография органов грудной клетки
- компьютерная томография легких, мозга, гайморовой полости
- рентгенограмма зубов и ее изучение
- биопсия и аспират костного мозга для морфологического и цитогенетического анализа, поиска молекулярного маркера (если таковой известен) и анализа FACS (в соответствии с основным заболеванием)
- нейрологическое обследование и спинномозговая пункция у находящегося в группе риска пациента
- радиологическое сканирование (КТ, ЯМР) локализации известного заболевания
- полное серологическое и молекулярное HLA-типирование, исследование культур ML и цитотоксичности с выбранными донорами
- цитотоксические антитела к HLA
- абдоминальная эхография
Критерии исключения - Пациент
- заболевание с локализацией в центральной нервной системе в анамнезе
- положительный статус в отношении ВИЧ, вируса гепатита С, РНК вируса гепатита С, поверхностного антигена вируса гепатита В, ДНК вируса гепатита В
- активная и документально зафиксированная пневмония любого вида, грибковая инфекция тканей, вирусные положительные культуры в секреции из органов дыхания или крови
- билирубин больше чем в 2 раза превышает норму
- клиренс креатинина в крови меньше чем 50 мл/мин
- DLCO меньше чем 50% от прогнозируемого значения
- фракция выброса меньше 45% (или миокардиальный инсульт за последний год)
- беременность или лактация
- психиатрические нарушения
Критерии отбора - Донор
- Отсутствие гемопоэтического или связанного с функцией костного мозга заболевания, которое препятствует забору достаточных количеств нормальных клеток - предшественников
- Отсутствие любого медицинского состояния, которое будет представлять существенный риск здоровью при осуществлении забора стволовых клеток периферической крови
- Отрицательные анализы на ВИЧ, HTLV-1
- Любой здоровый член семьи будет рассматриваться в качестве донора гемопоэтических стволовых клеток. Выбор донора будет основан на типировании HLA-A, В, С, DR-локусов, которое необходимо провести на реципиенте, родных братьях и сестрах, родителях и возможно других членах семьи, таких как тети, дяди и двоюродные братья и сестры. Перспективный родственный донор должен быть по меньшей мере генотипически HLA-A, В, С, DR-гаплоидентичным пациенту, но может отличаться по 2-3 HLA-аллелям на не являющимся общим гаплотипе.
- Донора будут выбирать предпочтительно на основании аллореактивности NK донора-против-реципиента.
Оценка донора
- Полная история болезни, физический осмотр и физическое обследование вен сотрудниками осуществляющей аферез службы для определения пригодности для афереза через периферические вены
- Анализы крови: абсолютное содержание лейкоцитов, содержание тромбоцитов, гемоглобин, протромбиновое время, частичное тромбоплатиновое время, общий белок, альбумин, электролиты, глюкоза, АСТ/АЛТ, щелочная фосфатаза, билирубин, лактатдегидрогеназа, мочевая кислота, креатинин
- Серологический анализ на цитомегаловирус, вирус Эпштейна-Барра, вирус простого герпеса, вирус Варицелла-Зостер, гепатит В+С, ВИЧ, токсоплазму
- Полное типирование эритроцитов
- Серологический анализ на сифилис, вирус Эпштейна-Барра, вирус простого герпеса, вирус Варицелла-Зостер, гепатит В+С, HTLV-1, ВИЧ, токсоплазмоз
- Исследование в отношении передаваемых с трансфузией заболеваний должно проводиться за 30 - 7 дней перед забором стволовых клеток
- Рентгенография органов грудной клетки
- ЭКГ
- Анализ локусов с варьирующим числом тандемных повторов (VNTR) с помощью ПЦР
- Донорам будут отдавать предпочтение на основании более молодого возраста, лучшего состояния здоровья и если они являются ЦМВ-отрицательными для ЦМВ-отрицательных реципиентов.
Критерии исключения - Донор
- Положительный анализ на ВИЧ или HTLV-1 или доказательства активной/персистирующей инфекции вирусного гепатита будут исключать донора из участия в настоящем исследовании.
- Присутствие любого медицинского состояния которое будет представлять существенный риск здоровью при осуществлении забора стволовых клеток периферической крови (т.е. инсулинзависимый диабет, сердечно-сосудистые нарушения, хронические воспалительные заболевания).
Процедуры лечения
Мобилизация HSC донора и обработка трансплантата.
Необходимо, чтобы пациенты имели родственного донора (в возрасте от 18 до 60 лет), готового и способного стать донором стимулированных филграстимом/ленограстимом гемопоэтических клеток периферической крови. Доноров будут подвергать отбору согласно общим правилам станции переливания крови. Рекомендуется проводить исследование ЭКГ с нагрузкой у доноров возрастом старше 50 лет. Нормальные доноры будут получать филграстим или ленограстим 5 мкг/кг подкожно каждые 12 часов; на 5 день будут начинать лейкаферез. Дозировку филграстима/ленограстима будут регулировать для поддержания содержания лейкоцитов ниже 60×109/л. На 4-й день лечения филграстимом/ленограстимом, если количество циркулирующих CD34+ клеток составляет больше чем 40/мкл, донор будет начинать лейкаферез. Ежедневный лейкаферез будет продолжаться в течение запланированных 3 дней, максимум 4 дней, для забора необходимой дозы клеток, составляющей больше чем 10×106 CD34+ клеток/кг. Если цель достигнута раньше, забор могут продолжать в течение в целом 3 дней для получения наибольшей возможной дозы. Если донор не переносит процедуру в любой из составляющих ее частей, могут использовать альтернативного донора, если таковой доступен. Если из одного места невозможно собрать больше чем 10×106 CD34+ клеток/кг от соответствующего донора, пациенты не имеют права продолжать участие в исследовании. РВРС будут подвергать деплеции донорских Т- и В-клеток путем селекции CD3+ и/или CD 19+ клеток с использованием системы сортировки клеток (например, анти-CD3/19 магнитных гранул или сортера FACS). Необходимый объем CD34-положительных клеток будет составлять по меньшей мере 10×106/кг массы тела реципиента.
Аферез будут проводить через латеральные подкожные вены руки.
Как описано в таблице 2 выше, флударабин будут вводить внутривенно ежедневно в течение 5 последовательных дней, -7, -6, -5, -4 и -3, в дозе, составляющей 30 мг/м2. Каждую дозу будут инфузировать в течение 30 минут. TBI 200 сГр будут осуществлять в день -1 в однократной фракции.
В день 0, CD3-/CD19- подвергнутые иммуноселекции HSC будут оттаивать, отмывать и инфузировать через центральный доступ.
CY будут вводить внутривенно в течение одного часа в дни +3 и +4 после трансплантации в дозе 50 мг/кг/день.
Специальные предписания ведения пациентов
a. двупросветный центральный венозный катетер будут помещать до осуществления режима кондиционирования;
b. для профилактики образования уратов будут перорально вводить аллопуринол в дозе 300 мг;
c. противорвотную терапию будут проводить согласно указаниям из единого исследовательского центра;
d. при трансфузии фильтрованных и облученных препаратов крови поддерживать содержание гемоглобина больше чем 8 г/л и содержание тромбоцитов больше чем 15000/мкл при отсутствии лихорадки или признаков кровотечения;
Мониторинг пациентов в течение лечения
a. ежедневный общий анализ крови и лейкоцитарная формула;
b. креатинин в сыворотке, Na+, К+, Са++, билирубин ежедневно в ходе химиотерапии и гипергидратации;
c. анализы функции печени, альбумин, анализы коагуляции с определением антитромбина III, цитомегаловирусной антигенемии и ПЦР дважды в неделю;
d. надзор за культурами согласно центральным указаниям.
Оценка токсичности
Токсичность будут оценивать согласно критериям ВОЗ, как показано в таблице 3 ниже.
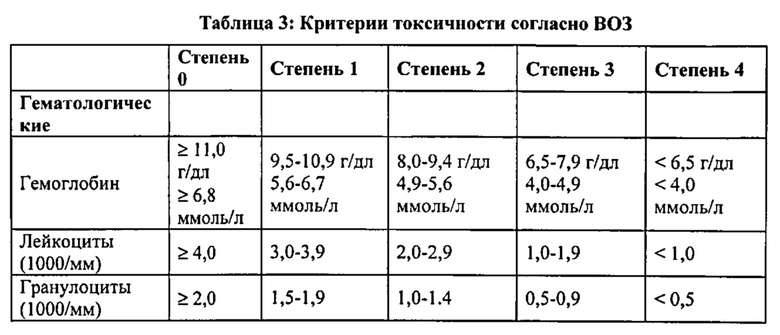
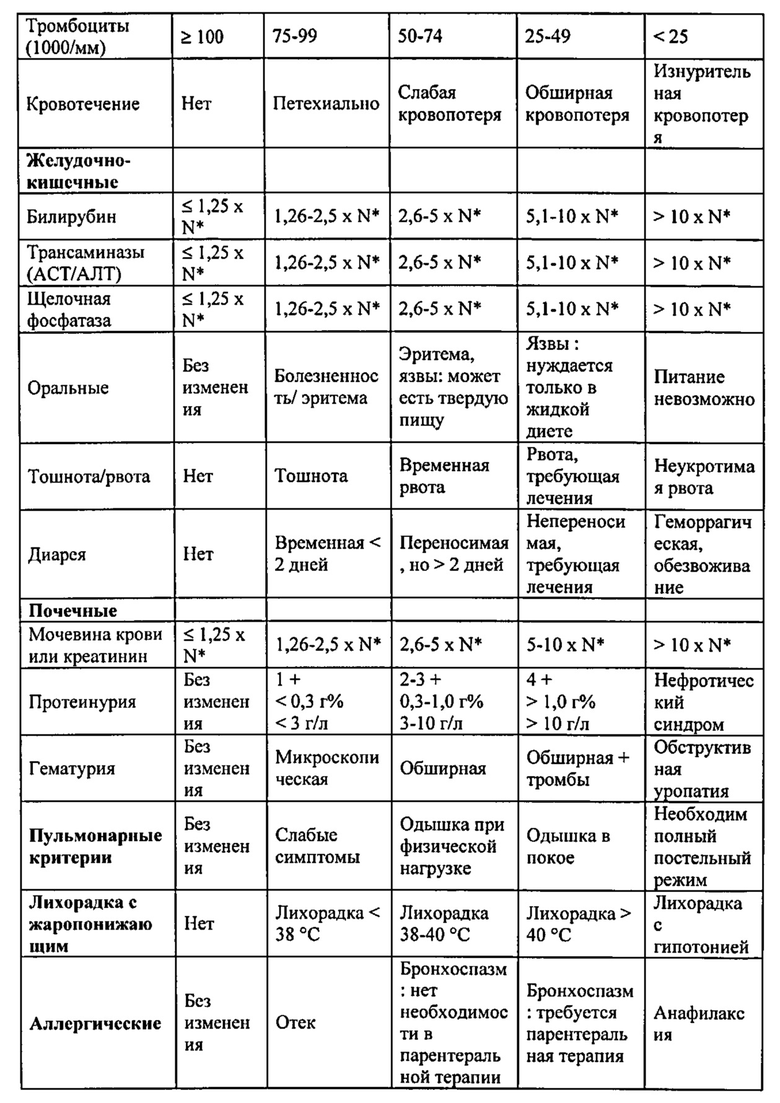
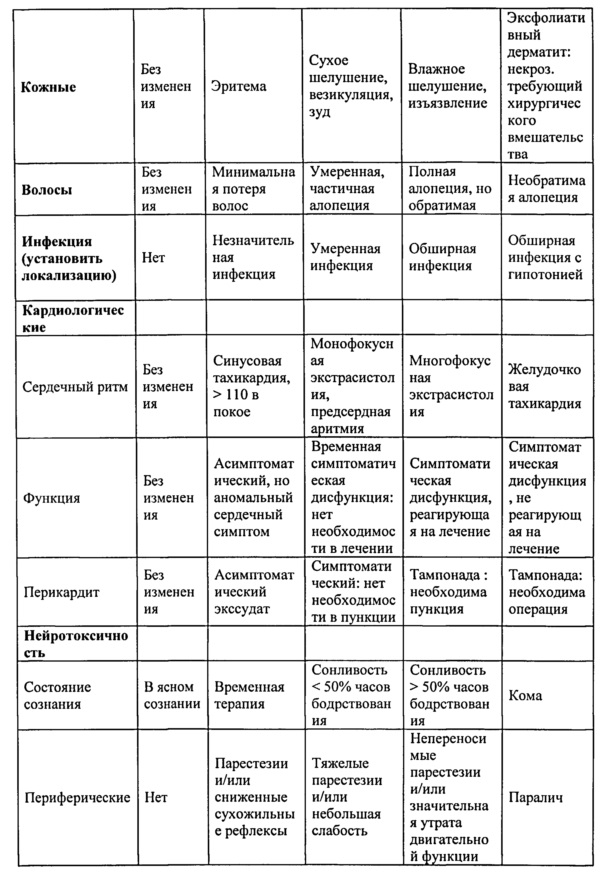

Применение наркотических средств может быть эффективно в ослаблении боли в зависимости от переносимости пациента.
Поддерживающая терапия
Мониторинг и лечение бактериальных и грибковых инфекций
За пациентами ухаживают в изолированных палатах с ламинарным потоком воздуха или высокоэффективной фильтрацией микрочастиц в воздухе. Липосомальный амфотерицин вводят в дозе 1 мг/кг/день, начиная с дня -5 до приживления трансплантата в качестве противогрибковой профилактики. Бактериальные инфекции подвергают мониторингу с помощью взятия мазков и гемокультур каждую неделю. Внутривенную антибактериальную терапию начинают на основании клинических признаков инфекции (лихорадка неизвестного генеза) или положительных гемокультур. Если у пациента все еще наблюдается жар через 72 часов, эмпирическую противогрибковую терапию начинают с использованием или L-AMB в дозе 3 мг/кг/день, или вариконазола в дозе 8 мг/кг/день внутривенно. Ванкомицин добавляют через следующие 72 часа лихорадки, или в присутствии грам+ сепсиса, или положительной гемикультуры.
Профилактика, мониторинг и лечение цитомегаловирусных инфекций
У реципиентов, которые являются сероположительными в отношении антитела к ЦМВ, профилактика ЦМВ состоит из введения ганцикловира (10 мг/кг/день) между десятым и вторым днем перед инфузией стволовых клеток. Ганцикловир повторно вводят в качестве упреждающей терапии с дня +21 до дня +360. ЦМВ-антигенемию/ПЦР определяют каждую неделю в образцах крови. Если развивается ЦМВ-антигенемия/ПЦР, то пациенты будут получать лечение с помощью ганцикловира (10 мг/кг/день) или фоскарнета (180 мг/кг/день).
Перед трансфузией препараты крови облучают (30 Гр).
Посттрансплатационная лабораторная оценка:
1. Ежедневно полные гемограммы, до самоподдержания содержания гранулоцитов и тромбоцитов, затем три раза в неделю до выписки; по меньшей мере каждую неделю после выписки до 100 дня и затем каждые 2 недели до 12 месяцев.
2. Скрининг профиля с анализами функций печени и почек дважды каждую неделю в течение первых 30 дней, затем каждую неделю до выписки; чаще, если есть клинические показания.
3. Аспираты костного мозга для морфологического анализа химеризма с помощью FISH (несовместимые по полу трансплантаты) или цитогенетического исследования будут проводить приблизительно через 1, 3, 6, 12 месяцев, и каждые 4 месяца после этого в течение приблизительно 3 лет. Дополнительный анализ будут проводить в случае клинических показаний. Пациенты с CML также будут подвергаться мониторингу показателя рецидива bcr/abl.
4. Иммунологическое восстановление будут подвергать мониторингу с помощью анализов in vitro, включающих в себя фенотипический анализ циркулирующих лимфоцитов, оценку функции натуральных киллеров и активированных лимфокинами клеток-киллеров, реакции трансформации лимфоцитов на Т-клеточные и В-клеточные митогены и содержание иммуноглобулинов.
Последующее наблюдение
До дня +90 клинические анализы крови, анализ антигенемии и ПЦР на ЦМВ, С-реактивный белок, полный анализ функций печени и почек будут проводить дважды в неделю.
Каждые две недели до +90 анализ фенотипа периферической крови (CD3, CD4, CD8, CD 19, CD56, CD57, HLADR), рентгенография органов грудной клетки. Каждые две недели от +90 до +180:
клинические анализы крови, антигенемия и ПЦР на ЦМВ, С - реактивный белок, полный анализ функций печени и почек.
Каждый месяц:
Содержание иммуноглобулинов, протеинограмма,
после +90 анализ фенотипа периферической крови (CD3, CD4, CD8, CD19, CD56, CD57, HLADR), рентгенография органов грудной клетки.
после +180 клинические анализы крови, антигенемия и ПЦР на ЦМВ, С-реактивный белок, полный анализ функций печени и почек.
Полное рестадирование заболевания будут проводить через 2, 4, 6, 8, 12, 18 и 24 месяцев после трансплантации, затем ежегодно, оно включает в себя оценку донорского химеризма с помощью анализа ПЦР HLA на клетках периферической крови и костного мозга.
Критерии определения степени общего состояния показаны в таблице 4 ниже.

Запрограммированные инфузии донорских лимфоцитов
Инфузии донорских лимфоцитов (DLI) эффективны в лечении рецидивов после аллогенной HSCT. Тем не менее, успех DLI был в определенной степени ограничен ассоциированной GVHD заболеваемостью и смертностью. Дробные дозы Т-клеток менее вероятно вызовут GVHD, чем одна большая инфузия и, вероятно, являются эффективными в индукции ремиссии [Dazzi, Szydlo et al., Blood, (2000) 96: 2712-6]. Недавнее исследовании подбора дозы показало, что 1×104 не подвергшихся манипуляции CD3+ лимфоцитов/кг массы тела реципиента можно безопасно инфузировать пациентам, которые провели без-Т-клеточную гаплоидентичную трансплантацию [Lewalle P. et al. Bone Marrow Transplant (2002) 29 (suppl 2): S26, 0164a].
Пациенты с ранним молекулярным и/или гематологическим рецидивом будут получать первую дозу, составляющую 1×104 CD3+ клеток/кг массы тела реципиента; при отсутствии GVHD вторую инфузию 1×105 CD3+ клеток/кг будут вводить через 45 дней с последующим введением через 2 месяца третьей дозы, составляющей 1×106 CD3+ клеток/кг. Доноры будут подвергаться лейкаферезу для забора лимфоцитов перед мобилизацией гемопоэтических клеток, поскольку было показано, что G-CSF оказывает иммунномодулирующий эффект на некоторые субпопуляции Т-лимфоцитов, снижая их реактивность на аллогенные стимулы. Замороженные препараты будут оттаивать и быстро инфузировать в течение периода, составляющего 5-10 минут. Пациенты с острой GVHD или которые не демонстрируют приживления гематологического трансплантата не будут получать DLI.
Пациенты с рецидивирующей В-клеточной неходжкинской лимфомой будут получать ритуксимаб в дозе 375 мг/м2 каждую неделю в течение 4 недель с DLI, проводимой одновременно со второй дозой ритуксимаба. Пациенты с рецидивирующей множественной миеломой будут получать лечение бортезомибом (1,3 мг/м2 в дни 1, 4, 8 и 11) перед началом DLI.
После DLI не будут применять никаких иммуносупрессивных средств.
Хотя настоящее изобретение было описано вместе с его конкретными вариантами осуществления, очевидно, что многие альтернативы, модификации и варианты станут очевидными специалистам в настоящей области техники. Соответственно, предусмотрено включение всех таких альтернатив, модификаций и вариантов, которые находятся в пределах сущности и широкого объема прилагаемой формулы изобретения.
Все упомянутые в настоящем описании изобретения публикации, патенты и патентные публикации полностью включены в настоящее описание в той же степени, как если бы было указано, что каждая отдельная публикация, патент или патентная публикация была специально и отдельно включена в настоящий документ посредством ссылки. Кроме того, цитирование или определение любой ссылки в настоящей заявке не должно быть истолковано как допущение того, что такая ссылка доступна в качестве предшествующего уровня техники настоящего изобретения. В тех случаях, когда используются названия разделов, они не должны рассматриваться в качестве обязательным образом ограничивающих.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ СТАБИЛЬНОГО И ДОЛГОВРЕМЕННОГО ПРИЖИВЛЕНИЯ ТРАНСПЛАНТАТА С ИСПОЛЬЗОВАНИЕМ КОНКРЕТНЫХ ПРОТОКОЛОВ ДЛЯ Т/В-КЛЕТОЧНОЙ ДЕПЛЕЦИИ | 2012 |
|
RU2648354C2 |
| ПРОТИВОВИРУСНЫЕ КЛЕТКИ ВЕТО ЦЕНТРАЛЬНОЙ ПАМЯТИ CD8+ ПРИ ГАПЛОИДЕНТИЧНОЙ ТРАНСПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК | 2020 |
|
RU2834894C2 |
| Т-КЛЕТКИ ЦЕНТРАЛЬНОЙ ПАМЯТИ ПРОТИВ ТРЕТЬЕЙ СТОРОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТРАНСПЛАНТАЦИИ И ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2636503C2 |
| ВЕТО-КЛЕТКИ, ПОЛУЧЕННЫЕ ИЗ Т-КЛЕТОК ПАМЯТИ | 2017 |
|
RU2779844C2 |
| Т-КЛЕТКИ ЦЕНТРАЛЬНОЙ ПАМЯТИ ПРОТИВ ТРЕТЬЕЙ СТОРОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТРАНСПЛАНТАЦИИ И ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2506311C2 |
| УСТРОЙСТВА И СПОСОБЫ ДЛЯ ОТБОРА КЛЕТОК, УСТОЙЧИВЫХ К АПОПТОТИЧЕСКИМ СИГНАЛАМ, И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630301C2 |
| Способ совместного кондиционирования и хемоселекции за один цикл | 2012 |
|
RU2728867C2 |
| Способ совместного кондиционирования и хемоселекции за один цикл | 2012 |
|
RU2611396C2 |
| СПОСОБ ЛЕЧЕНИЯ РЕЦИДИВА ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА ПОСЛЕ ТРАНСПЛАНТАЦИИ АЛЛОГЕННЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК | 2013 |
|
RU2538799C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ T-КЛЕТОК ДЛЯ T-КЛЕТОЧНОЙ ТЕРАПИИ | 2020 |
|
RU2834232C1 |
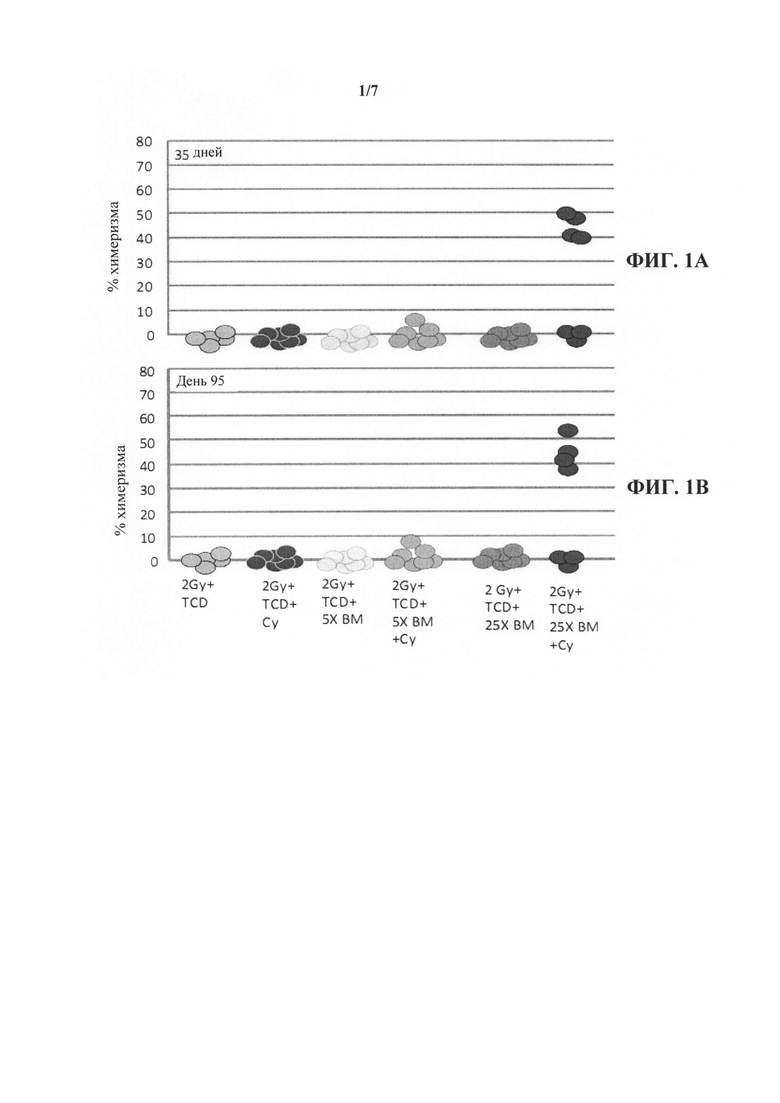
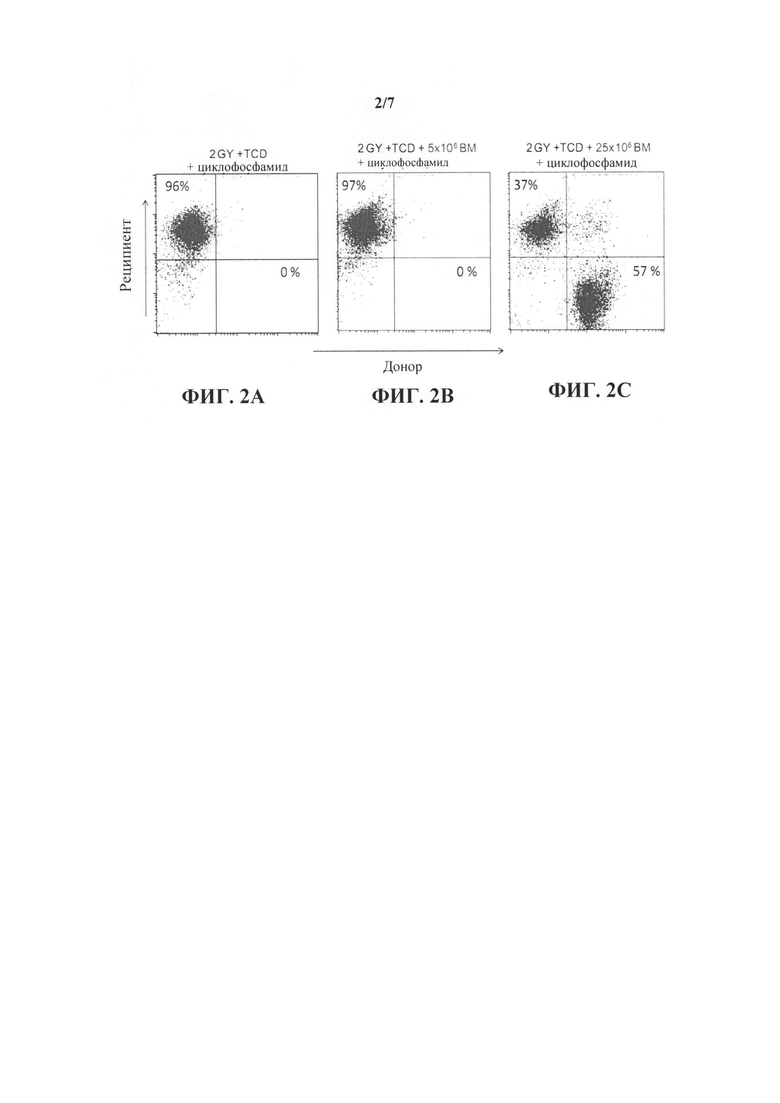
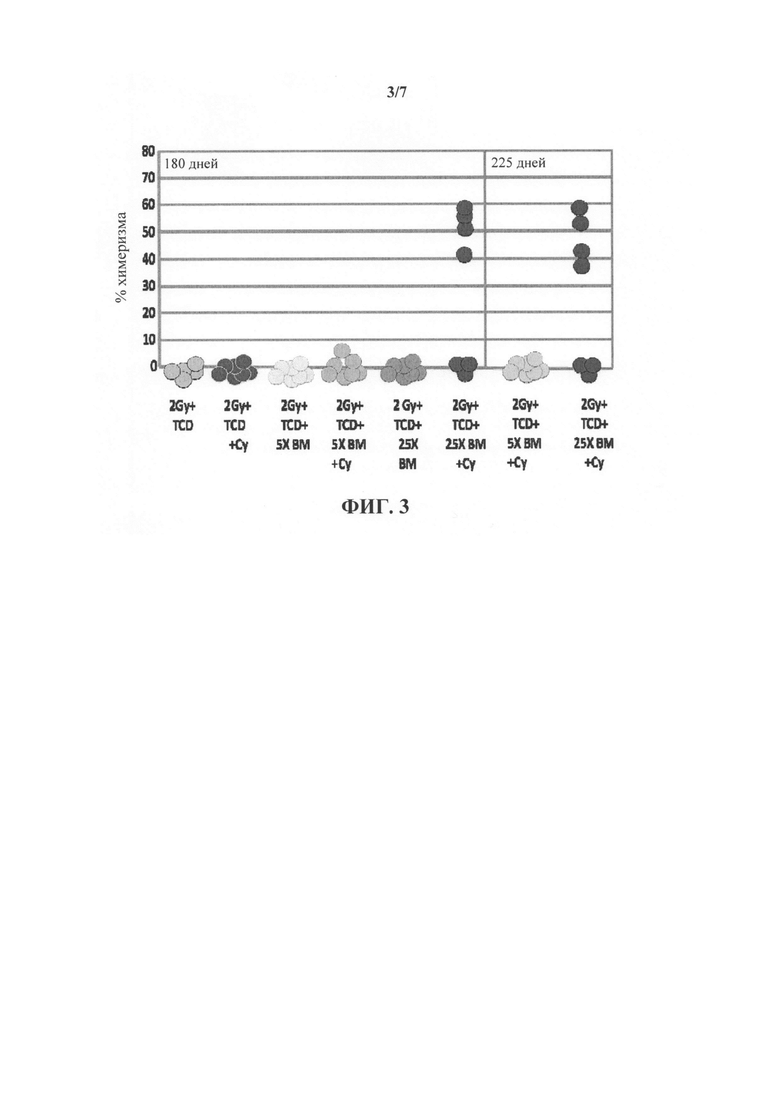


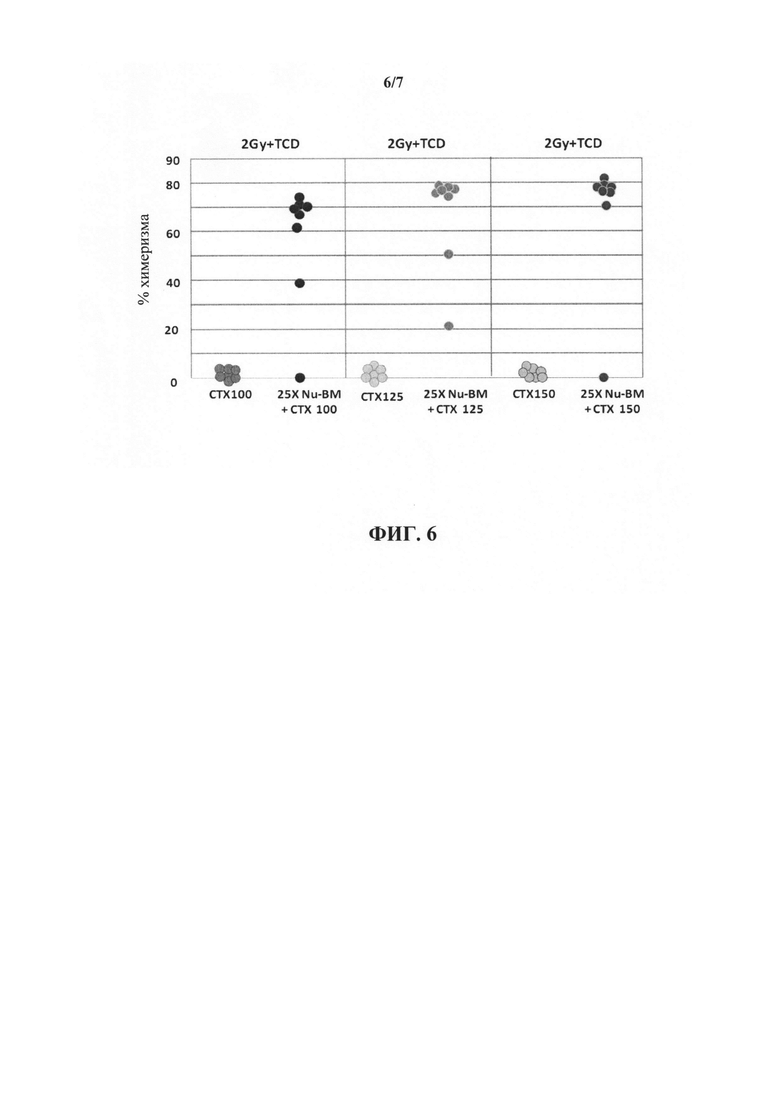
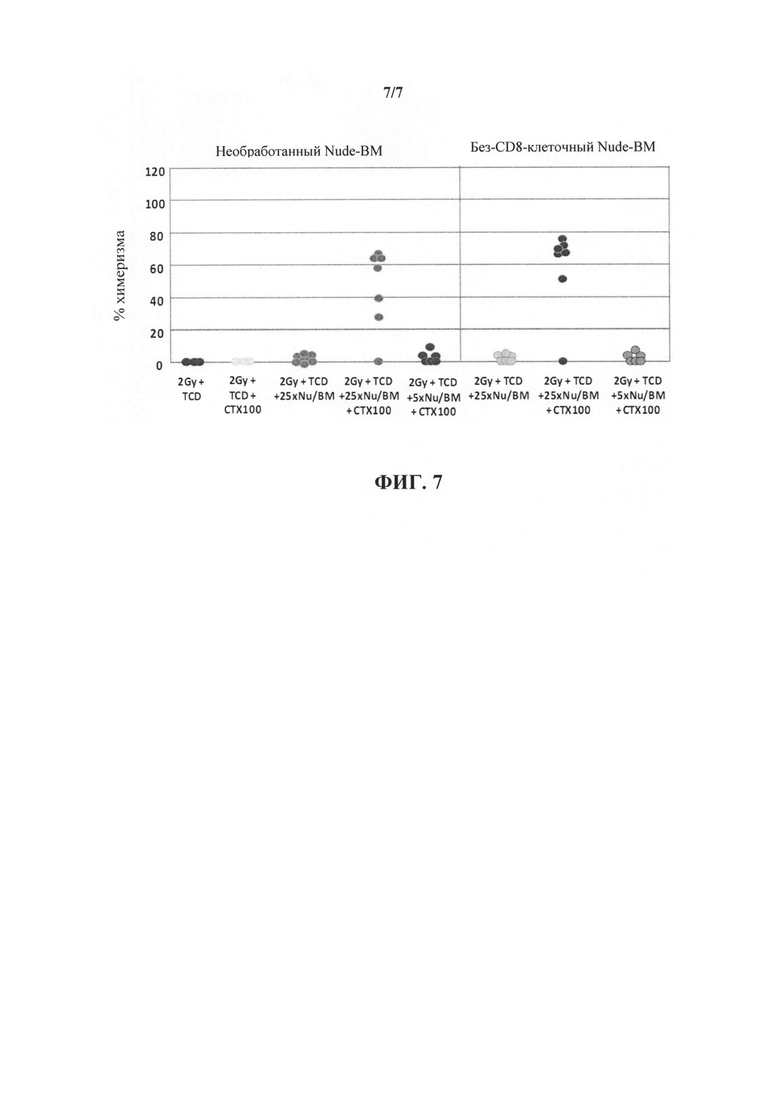
Группа изобретений относится к медицине, а именно к трансплантологии, и может быть использована для лечения субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате. Способ лечения включает: (a) трансплантацию субъекту дозы незрелых гемопоэтических клеток, обедненных Т-клетками, причем указанные незрелые гемопоэтические клетки, обедненные Т-клетками, содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем указанная доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии; (b) введение субъекту терапевтически эффективного количества циклофосфамида, причем указанное терапевтически эффективное количество составляет 25-200 мг на кг массы тела субъекта, и где указанный циклофосфамид вводится субъекту после трансплантации, тем самым обеспечивая лечение субъекта. Группа изобретений относится также к способу лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток и к способу индукции донор-специфической толерантности у субъекта. Использование данной группы изобретений обеспечивает приживление гематопоэтических стволовых клеток при протоколе минимального кондиционирования и приводит к индукции толерантности, о чем свидетельствует принятие донорных кожных трансплантатов. 4 н. и 22 з.п. ф-лы, 7 ил., 5 табл., 5 пр.
1. Способ лечения субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате, включающий:
(a) трансплантацию субъекту дозы незрелых гемопоэтических клеток, обедненных Т-клетками, причем указанные незрелые гемопоэтические клетки, обедненные Т-клетками, содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем указанная доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии
(b) введение субъекту терапевтически эффективного количества циклофосфамида, причем указанное терапевтически эффективное количество составляет 25-200 мг на кг массы тела субъекта, и где указанный циклофосфамид вводится субъекту после трансплантации, тем самым обеспечивая лечение субъекта.
2. Способ по п. 1, дополнительно включающий:
(i) кондиционирование субъекта в режиме кондиционирования сниженной интенсивности перед стадией (а); или
(ii) кондиционирование субъекта с помощью in vivo Т-клеточной циторедукции перед стадией (а), и необязательно при котором указанную in vivo Т-клеточную циторедукцию осуществляют с помощью антител.
3. Способ по п. 1, при котором доза указанных незрелых гемопоэтических клеток, обедненных Т-клетками, содержит 5-40×106 CD34+ клеток на кг массы тела субъекта.
4. Способ по п. 1, при котором указанные незрелые гемопоэтические клетки, обедненные Т-клетками:
(i) содержат меньше чем 1×106 CD8+ TCRα/β- клеток на кг массы тела субъекта; или
(ii) получают путем Т-клеточной циторедукции; или
(iii) получают от несингенного донора.
5. Способ по п. 1, при котором указанные незрелые гемопоэтические клетки обрабатывают путем В-клеточной циторедукции.
6. Способ по п. 2, при котором указанное кондиционирование сниженной интенсивности включает немиелоаблативное кондиционирование и необязательно при котором указанное немиелоаблативное кондиционирование включает в себя по меньшей мере одно из тотального облучения тела (TBI), тотального облучения лимфоидной ткани (TLI), химиотерапевтического средства и иммунотерапии антителами.
7. Способ по п. 6, при котором:
(i) указанное TBI включает дозу однократного или фракционированного облучения в пределах диапазона, составляющего 1-7,5 Гр; или
(ii) указанное химиотерапевтическое средство включает в себя по меньшей мере одно из бусульфана, флударабина, мелфалана и тиотепы; или
(iii) указанное антитело содержит по меньшей мере одно из антитела к CD52, антитела - антитимоцитарного глобулина (ATG) и антитела к CD3 (OKT3).
8. Способ по п. 1, при котором указанная концентрация указанного циклофосфамида составляет приблизительно 100-200 мг на кг массы тела субъекта.
9. Способ по п. 1, при котором указанный циклофосфамид вводят в однократной дозе или в двух дозах и необязательно при котором каждая из указанных двух доз:
(i) содержит концентрацию, составляющую приблизительно 50 мг на кг массы тела субъекта; или
(ii) каждую из указанных двух доз вводят в дни 3 и 4 после стадии (а).
10. Способ по п. 1, при котором субъект:
(i) представляет собой субъекта - человека; или
(ii) характеризуется наличием злокачественного заболевания и необязательно при котором указанное злокачественное заболевание представляет собой гемопоэтическую злокачественную опухоль; или
(iii) характеризуется наличием незлокачественного заболевания и необязательно при котором указанное незлокачественное заболевание представляет собой генетическое заболевание или нарушение, гемопоэтическую аномалию, аутоиммунное заболевание или метаболическое нарушение.
11. Способ по п. 1, при котором указанный клеточный или тканевой трансплантат:
(i) выбирают из группы, состоящей из незрелых гемопоэтических клеток, печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишечника и лимфоидной/гемопоэтической ткани или органа; или
(ii) трансплантируют субъекту перед, одновременно или после указанной трансплантации указанной дозы незрелых гемопоэтических клеток, обедненных Т-клетками, указанному субъекту; или
(iii) включает котрансплантацию нескольких органов.
12. Способ по п. 11, при котором указанный клеточный или тканевой трансплантат и указанные незрелые гемопоэтические клетки, обедненные Т-клетками, получают от одного донора.
13. Способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, включающий:
(a) трансплантацию подвергнутому кондиционированию субъекту дозы незрелых гемопоэтических клеток, обедненных Т-клетками, причем указанные незрелые гемопоэтические клетки, обедненные Т-клетками, содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем указанная доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии
(b) введение субъекту терапевтически эффективного количества циклофосфамида, причем указанное терапевтически эффективное количество составляет 25-200 мг на кг массы тела субъекта, и где указанный циклофосфамид вводится субъекту после трансплантации, тем самым обеспечивая лечение субъекта.
14. Способ по п. 13, при котором указанного подвергнутого кондиционированию субъекта подвергли кондиционированию в режиме кондиционирования сниженной интенсивности и необязательно при котором указанное кондиционирование сниженной интенсивности:
(i) осуществляют за 1-10 дней перед указанной трансплантацией; или
(ii) включает протокол немиелоаблативного кондиционирования, включающий в себя по меньшей мере одно из тотального облучения тела (TBI), тотального облучения лимфоидной ткани (TLI), химиотерапевтического средства и иммунотерапии антителами.
15. Способ по п. 13, при котором указанного подвергнутого кондиционированию субъекта подвергли кондиционированию с помощью in vivo Т-клеточной циторедукции и необязательно:
(i) при котором указанную in vivo Т-клеточную циторедукцию осуществляют за 4-7 дней перед указанной трансплантацией; или
(ii) при котором указанную in vivo Т-клеточную циторедукцию осуществляют с помощью антител.
16. Способ лечения субъекта, нуждающегося в трансплантации незрелых гемопоэтических клеток, включающий:
(a) кондиционирование субъекта согласно протоколу кондиционирования сниженной интенсивности, при котором указанное кондиционирование сниженной интенсивности включает в себя тотальное облучение тела (TBI) и химиотерапевтическое средство;
(b) трансплантацию субъекту дозы незрелых гемопоэтических клеток, обедненных Т-клетками, причем указанные незрелые гемопоэтические клетки, обедненные Т-клетками, содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем указанная доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии
(c) введение субъекту терапевтически эффективного количества циклофосфамида, причем указанное терапевтически эффективное количество составляет 25-200 мг на кг массы тела субъекта, и где указанный циклофосфамид вводится субъекту после трансплантации, тем самым обеспечивая лечение субъекта.
17. Способ по п. 16, при котором указанное TBI:
(i) содержит дозу однократного или фракционированного облучения в пределах диапазона, составляющего 2 Гр; или
(ii) осуществляют в однократной дозе за 2 дня перед стадией (b).
18. Способ по п. 16, при котором указанное химиотерапевтическое средство включает в себя флударабин и необязательно при котором указанный флударабин:
(i) вводят в дозе, составляющей 30 мг/м2/день; или
(ii) вводят ежедневно в дни 3-7 перед стадией (b).
19. Способ по п. 16, при котором доза указанных незрелых гемопоэтических клеток, обедненных Т-клетками, содержит по меньшей мере приблизительно 10×106 CD34+ клеток на кг массы тела субъекта.
20. Способ по п. 16, при котором указанные незрелые гемопоэтические клетки, обедненные Т-клетками:
(i) содержат мобилизированные G-CSF клетки - предшественники гемопоэза из периферической крови, обедненные Т-клетками; или
(ii) получают путем Т-клеточной циторедукции; или
(iii) получают от несингенного донора.
21. Способ по п. 16, при котором указанный циклофосфамид вводят в двух дозах и необязательно при котором каждая из указанных двух доз:
(i) содержит концентрацию, составляющую приблизительно 50 мг на кг массы тела субъекта; или
(ii) каждую из указанных двух доз вводят в дни 3 и 4 после стадии (b).
22. Способ индукции донор-специфической толерантности у субъекта, нуждающегося в несингенном клеточном или тканевом трансплантате, включающий:
(a) трансплантацию субъекту дозы незрелых гемопоэтических клеток, обедненных Т-клетками, полученных от несингенного донора, причем указанные незрелые гемопоэтические клетки, обедненные Т-клетками, содержат меньше чем 5×105 CD3+ клеток на кг массы тела субъекта, и причем указанная доза содержит по меньшей мере приблизительно 5×106 CD34+ клеток на кг массы тела субъекта; и впоследствии
(b) введение субъекту терапевтически эффективного количества циклофосфамида, причем указанное терапевтически эффективное количество составляет 25-200 мг на кг массы тела субъекта, и где указанный циклофосфамид вводится субъекту после трансплантации, тем самым индуцируя донор-специфическую толерантность у субъекта.
23. Способ по п. 22, дополнительно включающий:
(i) кондиционирование субъекта в режиме кондиционирования сниженной интенсивности перед стадией (а); или
(ii) кондиционирование субъекта с помощью in vivo Т-клеточной циторедукции перед стадией (а).
24. Способ по п. 22, при котором указанный клеточный или тканевой трансплантат:
(i) выбирают из группы, состоящей из незрелых гемопоэтических клеток, печени, поджелудочной железы, селезенки, почки, сердца, легкого, кожи, кишечника и лимфоидной/гемопоэтической ткани или органа; или
(ii) трансплантируют субъекту перед, одновременно или после указанной трансплантации указанной дозы незрелых гемопоэтических клеток, обедненных Т-клетками, указанному субъекту; или
(iii) включает котрансплантацию нескольких органов.
25. Способ по п. 22, при котором указанный клеточный или тканевой трансплантат и указанные незрелые гемопоэтические клетки, обедненные Т-клетками, получают от одного донора.
26. Способ по пп. 1, 13, 16 или 22, где указанный субъект не подвергается лечению иммуносупрессивными средствами в течение более 10 дней после трансплантации.
| US 5806529 A, 15.09.1998 | |||
| WO 9925367 A2, 27.05.1999 | |||
| BOMBERGER C | |||
| et al | |||
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
Авторы
Даты
2018-06-15—Публикация
2012-12-20—Подача