Изобретение относится к медицинской и ветеринарной микробиологии, в частности, к проблеме получения эритроцитарных диагностикумов на основе моноклональных антител (МКА), которые могут быть использованы для выявления антигенов возбудителя сапа в реакции непрямой гемагглютинации (РНГА).
Сап - особо опасная инфекция, возбудителя которой Burkholderia mallei относят ко II группе патогенности. Возбудитель сапа общепризнан как потенциальное биологическое оружие [Мелиоидоз и сап /Топорков А.В., Викторов Д.В., Липницкий А.В., Меринова Л.К. и др. - Волгоград, изд-во «Волга-Пресс», 2016. - С. 31].
В естественных условиях сап поражает, прежде всего, непарнокопытных животных (лошадей, мулов, верблюдов, ослов, лошаков), а также медведей и представителей семейства кошачьих. Возможны заболевания у овец, коз, молодых собак, волков, а также - при заражении большими дозами возбудителя - крупного рогатого скота [там же, с. 35]. Животные с острыми формами болезни, проявляющимися в виде открытых с обильным гноетечением язв, являются основным резервуаром и источником высококонтагиозной для человека инфекции. Существует профессиональный риск для специалистов, имеющих контакт с однокопытными животными (ветеринаров, работников цирков, зоопарков, конных заводов, мясокомбинатов и т.д.). Не исключены случаи внутрилабораторного заражения сотрудников при нарушении ими требований биологической безопасности [там же, с. 30]. Восприимчивость человека к сапу считается очень высокой, особенно при аэрогенном заражении.
Заболевание является эндемичным, прежде всего, для некоторых районов Африки, Центральной и Южной Америки, а также на близлежащих к РФ территориях Турции, Ирана, Объединенных Арабских Эмиратов, Афганистана, Китая, Монголии, Туркменистана и др. Развитие транспортных и туристических связей, а также расширение потоков трудовых мигрантов потенцируют опасность завоза сапа в Россию.
Для повышения качества лабораторного анализа в Российской Федерации на базе Волгоградского научно-исследовательского противочумного института создан Референс-Центр по мониторингу за возбудителями мелиоидоза и сапа, и обеспечение Центра диагностическими препаратами с видоспецифическим действием для экспресс-анализа является актуальной задачей практического здравоохранения.
В схеме лабораторной диагностики сапа реакция непрямой гемагглютинации может быть использована как на этапах первичного исследования проб, так и при идентификации выделенной культуры возбудителя [Лабораторная диагностика опасных инфекционных заболеваний. Практ. рук-во. /Под рек. акад РАМН Г.Г. Онищенко и акад. РАМН В.В. Кутырева. - М., «Шико, 2013. - с. 219]. При этом проведение анализа осуществляют с помощью разработанного в ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора и зарегистрированного в РФ «Набора реагентов. Диагностикум эритроцитарный сапной и мелиоидозный иммуноглобулиновый сухой» (№ ФСР 2011/11613). Согласно нормативной документации, препарат предназначен для индикации и идентификации в биологическом материале, объектах внешней среды и чистых культурах как возбудителей сапа, так и возбудителей мелиоидоза. Близкое генетическое родство Burkholderia mallei и Burkholderia pseudomallei, обуславливающее наличие большого количества перекрестнореагирующих антигенных структур, существенно затрудняет проведение их видовой дифференциации. Сконструированный в ВолгоградНИПЧИ на основе сапных моноклональных антител Диагностикум эритроцитарный сапной и мелиоидозный моноклональный [Саяпина Л.В., Касина И.В., Малахаева и др. Оценка эффективности нового эритроцитарного сапного моноклонального диагностикума //Сб. научных трудов, посв. 75-летию НИИ микробиологии МО РФ. - Киров, 2003. - с. 53-54], обладая такими же аналитическими характеристиками, однако существенно отличаясь по трудоемкости и экономической целесообразности, не демонстрировал преимуществ перед препаратом на основе поликлональных антител козьих сывороток, в связи с чем не нашел практического применения.
Таким образом, прототипом изобретения является препарат, описанный в "Диагностикум эритроцитарный сапной и мелиоидозный иммуноглобулиновый" (Производственный Регламент №01898084 - 03-11), выпускаемый ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора [Куделина A.M. с соавт.], где в качестве сенситина эритроцитов использованы иммуноглобулины поликлонального происхождения. Этот препарат имеет высокую чувствительность (3,12⋅106 м.к./мл, в макроварианте - 1,56⋅106 м.к./мл), но не обладает видоспецифичными характеристиками.
Создание видоспецифичного препарата определяет задачу изобретения, заключающуюся в получении моноклональных антител, направленных к специфичной антигенной детерминанте возбудителя сапа, и производстве на их основе эритроцитарного диагностикума для РИГА.
Цель изобретения - конструирование диагностикума эритроцитарного сапного иммуноглобулинового моноклонального, обладающего видоспецифичностью и предназначенного для выявления антигенов возбудителя сапа в РНГА.
Поставленная цель достигается благодаря тому, что для нагрузки эритроцитов барана используют сапные моноклональные антитела, полученные в результате слияния клеток мышиной миеломы P3X63Ag8.653 и спленоцитов мыши BALB/c, иммунизированной подкожно инактивированными клетками В. mallei в суммарной дозе 3⋅106 м.к./мышь (микробных клеток на мышь) и получившую бустерную внутриселезеночную инъекцию водорастворимого антигенного комплекса, выделенного из клеток В. mallei методом формамидной экстракции (по D. Fuller в модификации Н.Н. Пивня), после чего полученный диагностикум в целях длительного (срок наблюдения - 2 года) сохранения его характеристик подвергается лиофилизации.
Для обеспечения максимального выхода высокоспецифических сапных моноклональных антител проводят иммунизацию мышей BALB/c инактивированной клеточной взвесью В. mallei 10230 трижды в дозе по 1⋅106 м.к./мышь с интервалами между инъекциями 21 день - двукратно подкожно в смеси (1:1) с полным адьювантом Фрейнда (CFA, Sigma) и однократно внутрибрюшинно без адъюванта. Бустерную инъекцию осуществляют внутриселезеночно путем введения формамидного антигенного комплекса в дозе 50 мкг/мышь за 3 дня до опыта по гибридизации. Слияние клеток осуществляют с помощью высокоочищенного полиэтиленгликоля (ПЭГ). Селекцию гибридных клеток миелома/спленоцит проводят в НАТ-среде, после чего гибридомы клонируют методом лимитирующих разведений. Антителопродуцирующую активность в супернатантах лунок определяют в иммуноферментном анализе (ИФА) по мере роста клонов, накопление сапных иммуноглобулинов проводят в культуре и асцитической жидкости сингенных мышей. Сапные моноклональные антитела выделяют методом двукратного переосаждения сульфатом аммония, затем на их основе получают диагностикум эритроцитарный сапной иммуноглобулиновый моноклональный.
Для получения эритроцитарного диагностикума берут навески мышиных моноклональных сапных иммуноглобулинов в концентрациях 10, 20, 40 и 80 мкг/мл, определяют оптимальную сенсибилизирующую дозу (ОСД), проводят сенсибилизацию формалинизированных танизированных эритроцитов барана в двойной ОСД и последующую лиофилизацию полученного диагностикума при постепенном снижении вакуума, обеспечивающем плавный подъем температуры, после чего осуществляют постановку РНГА с полученным диагностикумом с бактериями сапа, мелиоидоза и гетерологичных микроорганизмов и в титрах (2,5-5,0)⋅106 м.к./мл подтверждают аналитические характеристики препарата, который выявляет только возбудитель сапа и не взаимодействуют с близкородственными и гетерологичными микроорганизмами.
Таким образом, технологию получения диагностикума осуществляют в соответствии со следующими этапами:
1. Получение клеточной взвеси и формамидного экстракта инактивированных клеток возбудителя сапа;
2. Проведение иммунизации мышей линии BALB/c; проверка иммунного ответа экспериментальных животных;
3. Осуществление слияния клеток;
4. Культивирование гибридом в селективных средах;
5. Клонирование гибридом методом лимитирующих разведений;
6. Накопление гибридом in vitro и in vivo;
7. Выделение иммуноглобулинов из асцитической жидкости мышей BALB/c;
8. Приготовление формалинизированных танизированных эритроцитов барана;
9. Осуществление сенсибилизации обработанных формалином и танином эритроцитов сапными моноклональными иммуноглобулинами;
10. Лиофилизация диагностикума;
11. Проверка активности (чувствительности и специфичности) полученного препарата в РНГА.
Примеры конкретного выполнения Пример №1. Получение гибридомы, продуцирующей сапные моноклональные антитела.
Штамм клеток возбудителя сапа В. mallei 10230 получали из Коллекции живых культур ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора и высевали на гидролизат-казеиновый агар (АГК), содержащий 5% глицерина. Через 48 час культуру смывали стерильным 0,15 М раствором NaCl. С целью инактивации возбудителя к взвеси добавляли трехкратный объем ацетона, после чего спустя 2-3 сут осуществляли контроль стерильности в соответствии с СП 1.3.1285-03 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)» и использовали в работе.
Для получения формамидного экстракта 4,0 г ацетонвысушенных клеток В. mallei 10230 суспендировали в 15-кратном по объему количестве формамида (Serva, Германия), встряхивали на шейкере в течение 48 час при комнатной температуре, после чего к смеси добавляли 2,5 объема ацетона, содержащего 5% 2N HCl. Образующийся осадок отделяли центрифугированием (10000 g - 15 мин при 10°С), растворяли в 10 мл дистиллированной воды и повторно центрифугировали при тех же условиях. К супернатанту добавляли 50 мл подкисленного ацетона и вновь осаждали (10000 g - 15 мин при 10°С). Осадок растворяли в дистиллированной воде и подвергали диализу (24 час при +4°С).
Концентрация белка в полученном растворе при спектрофотометрическом измерении по 1% раствору бычьего сывороточного альбумина (БСА) при длине волны 280 нм составляла 8,4 мг/мл.
Мышей линии BALB/c 6-8 недельного возраста иммунизировали инактивированной клеточной взвесью В. mallei 10230 в дозе 3⋅106 м.к./мл с интервалами между инъекциями 21 день двукратно подкожно в смеси (1:1) с полным адьювантом Фрейнда (CFA, Sigma) и однократно внутрибрюшинно без адъюванта. Спустя 7 дней путем прижизненного взятия крови из ретроорбитального пространства и проведения ее исследования в ИФА была отобрана мышь с наиболее выраженным иммунным ответом (титр реакции по отношению к возбудителю сапа составлял 1:1280, к возбудителю мелиоидоза - 1:20). Бустерную инъекцию осуществляли внутриселезеночно с помощью формамидного антигенного комплекса в дозе 50 мкг/мышь за 3 дня до опыта по гибридизации.
Клетки мышиной миеломы P3X63Ag8.653, находящиеся в хранилище с жидким азотом, размораживали по стандартной методике и путем культивирования при 37°С и ежедневных пересевов в среде RPMI-1640, содержащей 10% фетальной сыворотки теленка (FCS, Sigma), а также антибиотики-антимикотики, HEPES-буфер, раствор витаминов, пируват натрия, глутамин, выводили в логарифмическую фазу роста.
Для слияния ядерного материала клеток применяли химический метод гибридизации с помощью ПЭГ с М.м. 4000. Для этого клетки миеломы и селезенки отмывали путем их центрифугирования в бессывороточной среде RPMI-1640 (800 g - 10 мин), после чего к осадку в центрифужной пробирке по каплям в течение 1 мин добавляли 1 мл 50% ПЭГ 4000 (Merck, Германия), который затем ежеминутно постепенно разводили двукратными объемами бессывороточной среды, добавляя ее последовательно в объеме 1, 2, 4, 8 и 16 мл. Смесь клеток центрифугировали (800 g - 10 мин), супернатант декантировали, а осадок осторожно суспендировали в 20 мл НАТ-среды, после чего раскапывали в лунки 96 - луночного планшета (Tissue Culture, Costar) на предварительно подготовленный слой интактных «подкормочных» перитонеальных макрофагов (так называемый Feeder).
В среде HAT (Гипоксантин-Аминоптерин-Тимидин) блокируется основной путь синтеза ДНК, за счет чего выживание возможно только гибридом, получивших от миеломного партнера способность к неограниченному росту, а от селезеночных соматических клеток, деление которых лимитировано барьером Хейфлика, фермент гуанидингипоксантинфосфорибозилтрансферазу (HHPRT), обеспечивающую клеткам возможность метаболизировать гипоксантин и осуществлять репликацию ДНК за счет обходного пути метаболизма. В целом, гибридные клетки приобретают способность выживать в НАТ-среде и неограниченно долго размножаться в культуре.
Лунки с ростом гибридом тестировали в ИФА и по показателям наиболее выраженной антителопродуцирующей активности отбирали для клонирования с целью гарантированного получения клеток одного клона. Для этого на предварительно (за 1-2 сут) подготовленный слой фидерных клеток вносили клетки из отобранной лунки 96 луночной планшеты из расчета: 3 ряда - 10 кл/лунку, 3 ряда - 5 кл/лунку, 2 ряда - 1 кл/лунку. В дальнейшем отбирали лунку с ростом единственного клона, активного в качестве антителопродуцента. Таким образом этап клонирования повторяли дважды. В целом был отобран стабильный клон G6/C3/F4, синтезирующий сапные иммуноглобулины, специфическая активность и специфичность которого были подтверждены результатами ИФА. На рис. 1 представлены результаты ИФА с супернатантами лунок растущих клонов гибридомы G6/C3/F4 в 96-луночной (1-6 ряды) и 24-луночной планшетах (ряды 7-8). За положительный результат реакции принимали показатели оптической плотности (ОП) раствора в лунках с пробами, не менее чем двукратно превышающие ОП контролей. На верхней планшете, сенсибилизированной антигенным комплексом В. mallei 10230, ОП контролей составляет (0,04-0,08), ОП лунок с супернатантами - (0,177-0,432). Нижняя пластина сенсибилизирована антигенами В. pseudomallei 56830, в ней ОП контролей и ОП лунок с супернатантами находятся на одном уровне - (0,048-0,075) и (0,038-0,08) соответственно. Таким образом, полученные результаты подтверждают специфичность антителопродукции полученного клона в отношении возбудителя сапа.
Для сохранения клон был тиражирован и заморожен в жидком азоте при температуре - 196°С. По мере производственной необходимости культуру гибридных клеток извлекают извлекали из сосуда Дьюара с жидким азотом, размораживали при температуре +37°С и использовали для накопления в культуре и асцитической жидкости сингенных мышей.
Клон гибридом, продуцирующий сапные моноклональные антитела, накапливали путем рассева в культуральных матрацах объемом 25 см3 и 100 см3 (Tissue Culture, Costar). По мере роста клетки отбирали, осаждали центрифугированием, отмывали в бессывороточной среде и вводили внутрибрюшинно (105-106 кл/мышь - 0,5 мл) предварительно праймированным пристаном (Prystane, synthetic, Sigma) мышам BALB/c с целью получения у них асцитической жидкости. В среднем на 7-10 сут у мышей, уснувших под парами хлороформа, осуществляли отбор асцитической жидкости, которую центрифугировали (1000 g - 10 мин), после чего тестировали в иммуноферментном анализе (ИФА) и непрямом методе флуоресцирующих антител (НМФА) и хранили в условиях низкотемпературного холодильника при - 40°С.
На рис. 2 представлены результаты НМФА, при выполнении которого на стекла с мазками из клеток В. mallei 10230 и В. pseudomallei 56830 в концентрациях по 1⋅109 м.к./мл наслаивали пробу асцитической жидкости в разведениях от 1:8 до 1:4096. Положительный результат реакции (флуоресценция на 3+) был отмечен у клеток В. mallei 10230 титрах до 1:1024.
Асцитические жидкости подвергали для получения фракции сапных моноклональных иммуноглобулинов двукратному осаждению насыщенным раствором сульфата аммония при его 50%-ном насыщении. Для этого к смеси асцитов при постоянном перемешивании в течение 15-20 мин дробно добавляли равный объем насыщенного раствора сульфата аммония и оставляли на сутки при температуре от +2 до +4°С. Через 24 часа пробы центрифугировали (6000 g - 15 мин), супернатант декантировали, осадок иммуноглобулинов ресуспендировали до первоначального объема в 0,15 М растворе NaCl (pH 7,2), затем процедуру высаливания повторяли. После второго переосаждения осадок иммуноглобулинов ресуспендировали в половинном от исходного объема 0,15 М растворе NaCl (рН 7,2) и диализировали против дистиллированной воды. Диализ проводили при температуре от +2 до +4°С в течение 24-48 часов с интервалами замены дистиллированной воды от 4 до 8 часов. После проведения контроля специфической активности выделенной фракции сапных моноклональных иммуноглобулинов проводили определение концентрации белка в растворе (спектрофотометр Nanophotometer Р-300, длина волны 280 нм) при использовании в качестве стандарта 1% раствора БСА.
Пример №2. Получение эритроцитарного диагностикума на основе сапных моноклональных антител.
Для приготовления формалинизированных танизированных эритроцитов кровь барана, взятую из яремной вены, отбирали в стеклянные колбы с 5%-ным раствором цитрата натрия (из расчета 250 мл цитрата натрия на 1000 мл крови) и тщательно перемешивали. Дефибринированную кровь фильтровали через 4 слоя марлевой ткани и трижды отмывали 0,15 М раствором NaCl (рН 7,2) центрифугированием (1100 g - 20 мин) с целью освобождения эритроцитарной массы от лейкоцитов. Осадок отмытых эритроцитов разводили в 0,15 М раствором NaCl (рН 7,2) до конечной концентрации 8%. После определения процентного содержания формальдегида в исходном растворе формалина по МУК 4.1/4/2.588-96 последний с помощью 0,15 М раствора NaCl (рН 7,2) доводили до концентрации 3% по формальдегиду.
Формалинизацию эритроцитов проводили путем капельного добавления полученного 3% раствора формалина (по формальдегиду) к эритроцитарной массе в соотношении по объему 1:1 при непрерывном перемешивании на водяной бане (Wasserbad Water Bath, GFL, Germany) при температуре 37°C в течение 24 часов. Обработанные формалином эритроциты трижды отмывали 0,15 М раствором NaCl (pH 7,2) и суспендировали (1:1) в 0,15 М растворе NaCl (рН 7,2), содержащим 1% формалина.
К отмытым эритроцитам ex tempore добавляли равный объем раствора танина в концентрации последнего 1:40 000. Танизацию осуществляли на водяной бане при 37°С в течение 15 мин, после чего танизированные формалинизированные эритроциты трижды отмывали 0,15 М раствором NaCl (рН 7,2) путем центрифугирования при 2500 g - 20 мин. Конечную концентрацию формалинизированных танизированных эритроцитов доводили до 10%.
Для контроля спонтанной агглютинации формалинизированные танизированные эритроциты разводили до концентрации 2,5% и по капле вносили в лунки заранее подготовленного макропланшета для РНГА, содержащего 0,5 мл 0,15 М раствора NaCl (рН 7,2). Наличие осадка в виде «пуговки» эритроцитов свидетельствовало об отсутствии у биологического носителя склонности к спонтанной агглютинации и его пригодности для сенсибилизации.
Непосредственно перед нагрузкой эритроцитов моноклональными иммуноглобулинами определяли их ОСД. Для этого в 4 центрифужные пробирки вносили по 0,5 мл 10%-ных формалинизированных танизированных эритроцитов барана, к которым после осаждения центрифугированием (3000 g - 5 мин) добавляли по 2,5 мл разведенных на 0,01 М ФБР (рН 5,9) сапных моноклональных иммуноглобулинов в концентрациях по белку 10, 20, 40 и 80 мкг/мл. Взвесь тщательно перемешивали и инкубировали, периодически встряхивая, на водяной бане при 45°С 90 мин. Затем с целью фиксации иммуноглобулинов на эритроцитах в каждую пробирку добавляли раствор формалина до конечной концентрации 1%, после чего сенсибилизированные эритроциты отмывали трехкратно центрифугированием (3000 g - 5 мин) с помощью 0,15 М раствора NaCl (рН 7,2), содержащим 1% формалина, и в этом же растворе суспендировали до концентрации 1% (для микрометода) и 2,5% (для макрометода), после чего проверяли в РНГА с взвесью инактивированной культуры В. mallei 10230.
За ОСД принимали такое разведение сенситина, при котором диагностикум демонстрировал наиболее высокую чувствительность при четких отрицательных контролях (оседание эритроцитов в разводящей жидкости - 1% нормальной кроличьей сыворотке (НКС).
Для приготовления основной серии диагностикума эритроцитарного сапного иммуноглобулинового моноклонального использовали 2 мл 10%-ной взвеси формалинизированных танизированных эритроцитов, которые осаждали центрифугированием (3000 g - 5 мин). К осадку при постоянном перемешивании добавляли 10 мл сапных МКА в двукратной ОСД, после чего инкубировали на водяной бане при постоянном встряхивании при 45°С в течение 2 час. Сенситин на эритроцитах фиксировали добавлением формалина до конечной концентрации 1% и инкубированием смеси в течение 30 мин.
Полученный диагностикум осаждали (3000 g - 5 мин), после чего отмывали 0,15 М раствором NaCl (рН 7,2), содержащим 1% формалина, путем трехкратного центрифугирования при тех же условиях, и затем суспендировали до 5%-ой концентрации.
Для лиофилизации, существенно расширяющей возможности сохранения нативных свойств диагностикума в течение 2 и более лет (срок наблюдения), готовили среду высушивания: реополиглюкин 15%, сахароза 7,5%, азид натрия 0,001%, твин-80 0,001% в дистиллированной воде. Диагностикум суспендировали в протективной среде до концентрации 5% и разливали в ампулы по 1 мл.
Диагностикум, разлитый в ампулы, замораживали в низкотемпературном холодильнике (SANYO Electric Co., Ltd.) при -70°C и закаливали в течение 18-24 час.
Лиофилизацию диагностикума проводили на установке «COOLSAFE-100-9» (изготовитель «SCANLAF», Дания), в комплектацию которого входил вакуумный насос RZ-1 фирмы «VACUUBRAND», блок автоматического регулирования вакуума («SCANLAF», Дания), а также компьютер для программирования и контроля параметров высушивания.
Режим лиофилизации, представленный в графике на рис. 3, был основан на плавном снижении вакуума 0,3 hPa до 0,1 hPa и постепенном без скачков подъеме температуры от -35°С до +22°С (Пушкарь В.Г., Новицкая И.В., Кулаков М.Я., Павлова К.А., Степурина A.M. Способ лиофильной сушки эритроцитарного диагностикума: пат. RU 2476791. 2013 г.).
По окончании процесса ампулы запаивали в устройстве полуавтоматного типа АП-6М (Россия). Качество сухого диагностикума оценивали по следующим параметрам:
1.1 Растворимость - при добавлении 5 мл 0,15 М раствора NaCl (рН 7,2) диагностикум должен растворяться в течение 1 мин;
1.2 рН - должен находится в пределах 7,0±0,2;
1.3 Потеря в массе при высушивании - не более 5%;
1.4 Гомогенность ресуспендированного диагностикума - при микроскопии должно быть не более 3-х скоплений эритроцитов в 10 полях зрения;
1.5 Отсутствие спонтанной агглютинации - при добавлении к 0,5 мл 0,15 М раствору NaCl (рН 7,2) 2,5%-ой взвеси диагностикума через 4 часа должен формироваться осадок в виде "пуговки";
1.6 Количество эритроцитов - при подсчете в камере Горяева в 1 мм3 2,5%-ного диагностикума должно содержаться (5,5±0,5)⋅105 эритроцитов;
1.7 Чувствительность - должен выявлять В. mallei в концентрации 5⋅106 м.к./мл в микроварианте РНГА и 2,5⋅106 м.к./мл в макроварианте РНГА;
1.8 Специфичность - не должен выявлять в РНГА инактивированные культуры гетерологичных микроорганизмов в концентрации 2⋅107 м.к./мл;
1.9 Для проверки качества герметизации ампул их на кассетах помещают капиллярами вниз в камеру, в которой при откачивании воздуха создают разрежение. Из плохо запаянных ампул раствор выливается полностью или частично.
Пример №3. Проверка аналитических характеристик (чувствительности и специфичности) диагностикума эритроцитарного сапного иммуноглобулинового моноклонального в РНГА.
Аналитические характеристики диагностикума эритроцитарного сапного иммуноглобулинового моноклонального изучали в РНГА на наборе штаммов возбудителей сапа, мелиоидоза, а также ряда гетерологичных микроорганизмов, представленных в Музее Коллекционных штаммов ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора.
Для постановки микроварианта реакции во все лунки 96-луночной пластины вносили по 50 мкл 1% раствора НКС и 50 мкл клеточной взвеси в концентрации 8⋅107 м.к./мл в первую лунку длинного ряда (при этом концентрация исследуемых микроорганизмов в первой лунке составляла 4⋅107 м.к/мл) и титровали двукратным шагом до 11 лунки пластины (до концентрации 3,9⋅104 м.к./мл), из которой 50 мкл взвеси удаляли (12 лунка - отрицательный контроль). Затем во все лунки, включая контрольные, добавляли по 25 мкл полученного 1%-ного эритроцитарного диагностикума, аккуратно встряхивали пластину и оставляли при температуре 22±4°С. Учет результатов проводили предварительно через 2-4 часа, окончательно на следующие сутки.
Для макроварианта РНГА во все лунки планшета вносили по 0,5 мл 1% раствора НКС. Затем в первую лунку добавляли 0,5 мл клеточной взвеси в концентрации 8⋅107 м.к./мл и проводили последовательные двукратные разведения до 11 лунки. 12 лунка - отрицательный контроль диагностикума. Из 11-ой лунки лишние 0,5 мл удаляли. Затем вносили по 0,05 мл 2,5% диагностикума, пластины аккуратно встряхивали и оставляли при температуре 22±4°С. Через 2-4 часа проводили предварительный учет результатов, окончательно - на следующие сутки.
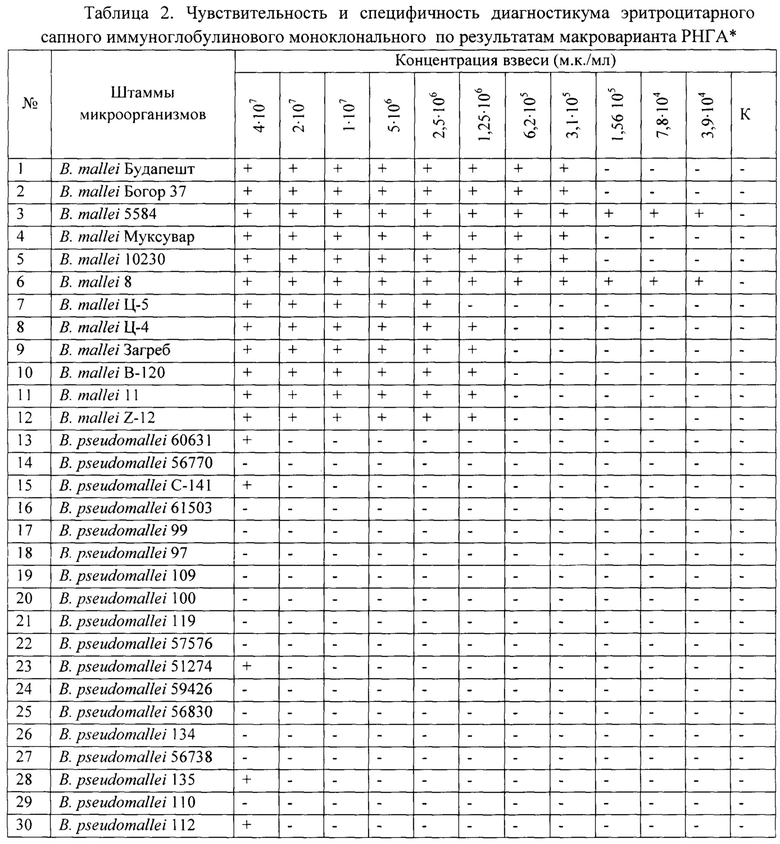
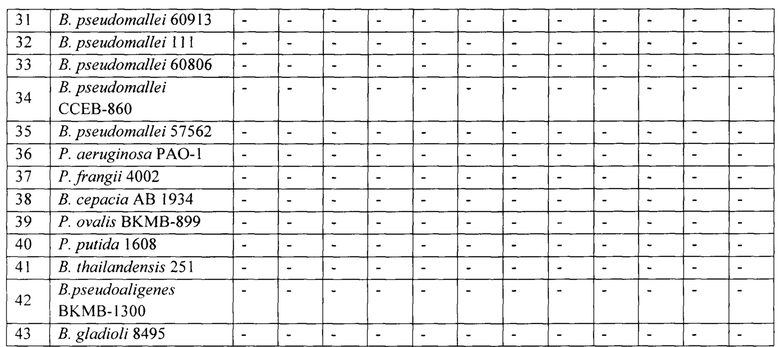
Чувствительность по отношению к возбудителю сапа в микроварианте РНГА составила 5⋅106 м.к./мл (табл. 1, рис. 4), в макроварианте РНГА - 2,5⋅106 м.к./мл (табл. 2), при этом как с близкородственным возбудителем мелиоидоза, так и гетерологичными микроорганизмами, включая условно-патогенные виды В. cepacia и В. thailandensis, в дозах до 2⋅107 м.к./мл гемагглютинации отмечено не было (рис. 4).
Диагностикум эритроцитарный сапной иммуноглобулиновый моноклональный успешно прошел контрольные межлабораторные испытания на базе ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора (протокол №1 от 15.02.2017 г., утвержденный директором института д.м.н. А.В. Топорковым) и рекомендован к внедрению в производство.
Следует отметить, что по сравнению с используемым в настоящее время в лабораторной практике прототипом (Набор реагентов. Диагностикум эритроцитарный сапной и мелиоидозный иммуноглобулиновый сухой) в технологическом процессе наиболее дорогостоящим является процесс получения клона-продуцента, однако при наличии такого клона воспроизводство иммуноглобулинов значительно упрощается: не требуется накопление ПБА, что связано с особыми режимными условиями работы, не используются крупные животные, при этом все полученные иммуноглобулины стандартны, воспроизводимы в неограниченном количестве и видоспецифичны.
Полученные впервые в РФ видоспецифичные сапные антитела позволяют с высокой точностью проводить дифференциацию особо опасных буркхольдерий, что в диагностическом отношении является их несомненным преимуществом. Используемый режим лиофилизации позволяет сохранять аналитические характеристики препарата в течение не менее 2 лет (срок наблюдения), что делает его для медицинской практики более доступным.
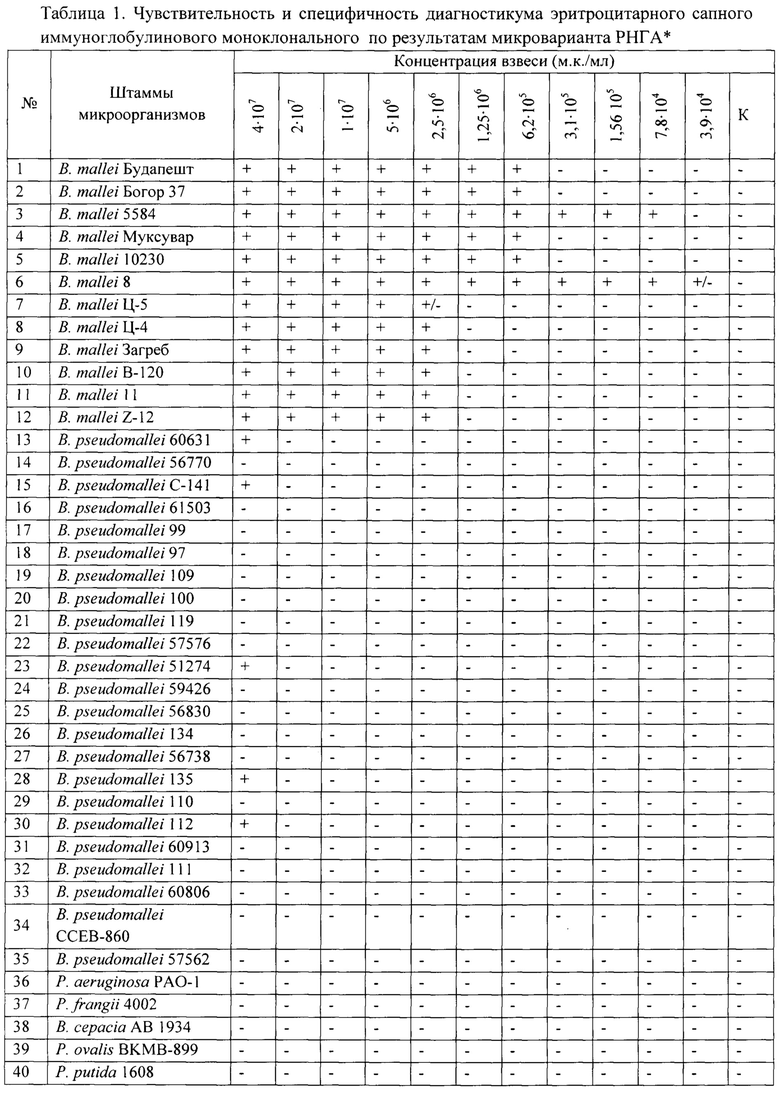
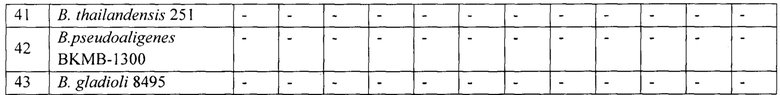
Примечание: *За титр реакции принимали концентрацию м.к./мл, которая была выявлена в РНГА с Диагностикумом эритроцитарным сапным иммуноглобулиновый моноклональным в лунках на 3+ и 4+ по общепринятым принципам учета реакции:
«+» - положительный результат реакции (формирование «зонтика» агглютината);
«-» - отрицательный результат реакции (нагруженные эритроциты на дне лунки в виде «пуговки»)
Примечание: *За титр реакции принимали концентрацию м.к/мл, которая была выявлена в РНГА с Диагностикумом эритроцитарным сапных иммуноглобулиновым моноклональным в лунках на 3+ и 4+ по общепринятым принципам учета реакции:
«+» - положительный результат реакции (формирование «зонтика» агглютината);
«-» - отрицательный результат реакции (нагруженные эритроциты на дне лунки в виде «пуговки»)
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К ТЕРМОСТАБИЛЬНОМУ АНТИГЕНУ, ОБЩЕМУ ДЛЯ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 1997 |
|
RU2117043C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 2013 |
|
RU2540902C1 |
| ДИАГНОСТИКУМ ПСЕВДОТУБЕРКУЛЕЗНЫЙ ЭРИТРОЦИТАРНЫЙ МОНОКЛОНАЛЬНЫЙ | 2008 |
|
RU2377308C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ИММУНОГЛОБУЛИНОВОГО ТУЛЯРЕМИЙНОГО | 2020 |
|
RU2747420C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО АНТИГЕННОГО САПНОГО | 2001 |
|
RU2188036C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОТУЛЯРЕМИЙНОЙ ГИПЕРИММУННОЙ СЫВОРОТКИ И СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО ТУЛЯРЕМИЙНОГО ИММУНОГЛОБУЛИНОВОГО СУХОГО | 2002 |
|
RU2240822C2 |
| Способ иммуноферментного выявления возбудителя псевдотуберкулеза 1 серотипа на основе моноклональных антител к о-боковым цепям липополисахарида | 2018 |
|
RU2695525C1 |
| СПОСОБ ВИДОВОЙ ДИФФЕРЕНЦИАЦИИ ПАТОГЕННЫХ БУРКХОЛЬДЕРИЙ С ИСПОЛЬЗОВАНИЕМ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2018 |
|
RU2702723C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS. MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К ТЕРМОСТАБИЛЬНОМУ ПОВЕРХНОСТНОМУ АНТИГЕНУ ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 1997 |
|
RU2116344C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. BPM VD-11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 6A/G К АНТИГЕНУ 200 kDA ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 2014 |
|
RU2570634C1 |


Изобретение относится к области медицинской и ветеринарной микробиологии, в частности к проблеме получения эритроцитарных диагностикумов на основе сапных моноклональных антител, которые могут быть использованы для выявления антигенов возбудителя сапа в реакции непрямой гемагглютинации (РНГА). Изобретение позволяет эффективно выявлять в РНГА антигены возбудителя сапа, при этом как с близкородственным возбудителем мелиоидоза, так и с гетерологичными микроорганизмами гемагглютинации не возникает. 1 з.п. ф-лы, 4 ил., 2 табл., 3 пр.
1. Способ получения диагностикума эритроцитарного сапного иммуноглобулинового моноклонального, включающий получение иммуноглобулинов и создание на их основе эритроцитарного диагностикума, отличающийся тем, что для обеспечения максимального выхода моноклональных антител, специфически выявляющих антигены возбудителя сапа, проводят иммунизацию мышей BALB / c трехкратно инактивированной клеточной взвесью Burkholderia mallei 10230 в дозе по 1⋅106 м.к./мл с интервалами между инъекциями 21 день двукратно подкожно в смеси с полным адьювантом Фрейнда и однократно внутрибрюшинно без адъюванта, бустерную инъекцию осуществляют внутриселезеночно с помощью формамидного антигенного комплекса в дозе 50 мкг/мышь, через 3 дня осуществляют гибридизацию миеломных клеток и спленоцитов с помощью ПЭГ, после чего образующиеся гибридомы культивируют в НАТ-среде и по мере роста клонов определяют их антителопродуцирующую активность с помощью ИФА, затем проводят клонирование методом лимитирующих разведений, накопление иммуноглобулинов в асцитической жидкости сингенных мышей, выделение сапных моноклональных антител методом двукратного переосаждения сульфатом аммония и в последующем на основе полученных сапных мышиных моноклональных антител с учетом оптимальной сенсибилизирующей дозы иммуноглобулинов формалинизированных танизированных эритроцитов барана получают эритроцитарный сапной иммуноглобулиновый моноклональный диагностикум.
2. Способ по п. 1, отличающийся тем, что для получения эритроцитарного диагностикума полученные путем пункции яремной вены эритроциты барана отмывают и обрабатывают их поверхность 3% раствором формалина и танином 1:40000, доводят взвесь формалинизированных танизированных эритроцитов барана до конечной концентрации 10%, мышиные моноклональные сапные иммуноглобулины в концентрациях 10, 20, 40 и 80 мкг/мл используют для определения в РНГА с инактивированными 1% формалином клетками возбудителя сапа оптимальной сенсибилизирующей дозы - ОСД - путем инкубации при периодическом встряхивании на водяной бане при 45°C в течение 90 мин, затем осуществляют сенсибилизацию формалинизированных танизированных эритроцитов барана сапными моноклональными иммуноглобулинами в двойной ОСД на водяной бане при 45°C и постоянном встряхивании в течение 2 часов, после чего сенситин на эритроцитах фиксируют добавлением формалина до конечной концентрации 1% и инкубированием смеси в течение 30 мин, в последующем лиофилизируют полученный диагностикум, осуществляют постановку РИГА с лиофилизированным диагностикумом с инактивированными бактериями сапа, мелиоидоза, а также гетерологичными культурами и подтверждают аналитические характеристики диагностикума, который в титрах 2,5·106-5,0·106м.к./мл выявляет возбудитель сапа и не взаимодействует с близкородственными и гетерологичными микроорганизмами.
| САВИНА Е | |||
| В | |||
| и др | |||
| Разработка эритроцитарного иммуноглобулинового моноклонального диагностикума для лабораторной диагностики мелиоидоза | |||
| Материалы научно-практической конференции "Диагностика и профилактика инфекционных болезней на современном этапе", 2016 | |||
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 2013 |
|
RU2540902C1 |
| ТАТАРЕНКО Ю | |||
| С | |||
| и др | |||
| Иммуноферментный анализ с использованием конъюгатов на основе поли-и моноклональных мелиоидозных антител в серологическом мониторинге мелиоидоза как особо опасной инфекции, Материалы научно-практической конференции "Диагностика и профилактика инфекционных болезней на современном этапе", 2016 | |||
| ЗАМАРИНА Т | |||
| В | |||
| Мяльно-трепальный станок для обработки тресты лубовых растений | 1922 |
|
SU200A1 |
| на соискание ученой степени канд | |||
| мед | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ХРАПОВА Н | |||
| П | |||
| и др | |||
| Современное состояние серодиагностики мелиоидоза | |||
| Проблемы особо опасных инфекций, 2011. | |||
Авторы
Даты
2018-06-21—Публикация
2017-03-28—Подача