Изобретение относится к гибридомной технологии и касается получения моноклональных антител. Штамм назван MVd - 2(1F4). Штамм депонирован в специализированной коллекции перевиваемых соматических клеток позвоночных Всероссийской коллекции клеточных культур под номером ВСКК(П) 648Д.
Иммунодиагностические препараты для обнаружения и идентификации возбудителей сапа и мелиоидоза с помощью метода флуоресцирующих антител до недавнего времени изготавливали на основе иммунных специфических сывороток различных видов животных. Технологические особенности производства таких препаратов осложняют получение стандартных по свойствам диагностических средств. В то же время создание видоспецифических препаратов на основе поликлональных иммуноглобулинов представляет определенные трудности ввиду близкого родства возбудителей сапа и мелиоидоза [1].
Однако процесс получения гипериммунных специфических сывороток от животных-продуцентов продолжительный и сложный. При изготовлении препарата предусмотрен этап дополнительной адсорбции гетерологичных антител клетками возбудителя сапа, что, как правило, снижает активность иммуноглобулинового сырья и не обеспечивает абсолютной специфичности флуоресцирующих препаратов. Эти трудности являются серьезным препятствием к полному воспроизведению всех этапов технологии производства, влияют на качество отдельных серий и затрудняют стандартизацию препаратов.
Целью изобретения является получение штамма гибридомы-продуцента специфических гомогенных по составу и свойствам моноклональных антител МКА, взаимодействующих с антигеном, локализованным на поверхности клеточной стенки мелиоидозной бактерии - сырья для производства иммуноглобулинов диагностических флуоресцирующих мелиоидозных видоспецифических моноклональных.
Получение гибридомы достигается иммунизацией мышей BALB/c целыми клетками Pseudomonas pseudomallei с последующей гибридизацией лимфоцитов селезенки иммунизированных мышей с миеломными клетками мыши. Концентрация иммуноглобулинов (IgG2b) в среде составляет в среднем 0,6-1,2 мг/мл, активность иммуноглобулинов в культуральной среде в ТИФА 1:640, в асцитической жидкости 1:1•107. Стабильность продуцирования сохраняется на протяжении 20 пассажей в культуре. Антитела взаимодействуют с поверхностным антигеном возбудителя мелиоидоза, не взаимодействуют с близкородственным возбудителем сапа, вследствие чего данный тип моноклональных иммуноглобулинов отобран для использования в качестве сырья для производства видоспецифического препарата флуоресцирующих мелиоидозных иммуноглобулинов.
Гибридома получена слиянием миеломы мышей РЗ-Х63-Ag 8.653 и спленоцитов мыши линии BALB/c. Слияние проведено с помощью полиэтиленкликоля с последующим клонированием штамма-продуцента методом лимитирующих разведений. Полученный штамм назван MVd-2(1F4) и характеризуется следующими признаками.
Культуральные признаки.
Культивирование in vitro. Среда для культивирования - среда RPM1-1640 с добавлением 15%-ной эмбриональной телячьей сыворотки, 2 мМ L - глютамина, 10 мМ ГЭПЭС, 4 мМ пирувата натрия.
Клетки культивируют при 37oC в атмосфере 5% CO2 и 70-80% влажности. Клетки пассируют один раз в 3-4 дня, контролируя микроскопически интенсивность роста. Кратность рассева 1:4-1:10. Культура суспензионная.
Культивирование в организме животного. Для накопления асцита клетки гибридомы вводят праймированным мышам линии BALB/c в дозе 1•105-1•106 клеток на мышь. Асцит образуется через 2-4 недели.
Продуктивность штамма. Продукция МКА в среде культивирования составляет 0,6-1,2 мг/мл, в асцитической жидкости - 25-30 мг/мл. Продукция МКА в культуральной жидкости сохраняется на протяжении 20 пассажей.
Характеристика получаемого продукта. Антитела относятся к классу IgG2b. Они специфически взаимодействуют с определенным эпитопом термостабильного поверхностного антигена возбудителя мелиоидоза. Специфичность взаимодействия определяют с помощью ТИФА и НМФА.
Криоконсервирование. 2-4•106 клеток штамма консервируют в 1 мл среды RPM1-1640 с 20% эмбриональной телячьей сыворотки и 7% диметилсульфоксида в пластиковых ампулах. Замораживание производят при 4oC (30 мин), а затем помещают в комплекс криоконсервирования биоматериалов, предназначенный для контролируемого замораживания клеточных культур тканей в заданном режиме: до температуры - 20oC со скоростью 1oC/мин, до - 40oC со скоростью 1,5oC/мин, до -70oC со скоростью 5oC/мин. Затем ампулы погружают в жидкий азот и хранят в нем до момента использования. Размораживание производят быстро при -37oC на водяной бане. Жизнеспособность после размораживания составляет 65-75%.
Пример 1. Штамм получают следующим образом.
Мышей линии BALB/c иммунизируют ультразвуковыми дезинтегратами клеток, P. pseudomallei C-141. Первые две инъекции с интервалом в одну неделю производят подкожно в дозе 5•108 м.к. с неполным адъювантом Фрейнда (1:1) в объеме 0,3 мл и внутрибрюшинно в дозе 1•109 м.к. в объеме 0,5 мл физиологического раствора. Бустирующее введение антигена производят на 21-22 в день после начала иммунизации внутриселезеночно в дозе клеток 5•108 м.к. в 0,1 мл физиологического раствора. Через 3 дня после этого 1•108 спленоцитов иммунных мышей гибридизируют с 1•107 клеток мышиной миеломы P3-X63-Ag8.653 в присутствии 1 мл 50% полиэтиленгликоля с мол.м. 4000 в течение 2 мин. Затем к этой смеси при постоянном перемешивании последовательно вносят 1, 2, 4 и 8 мл бессывороточной среды, каждую порцию в течение 2 мин. После этого клетки центрифугируют при 1000 об/мин в течение 10 мин. Осадок ресуспендируют в селективной среде ГАТ-среде с 15% эмбриональной телячьей сыворотки, 2 мм L - глютамина, 4 мМ пирувата натрия. Клетки высевают в 96-луночную пластину с фидером по 2,5-5•105 клеток в лунку. Смену среды производят через 3-4 дня. Отбор гибридом-продуцентов в лунках опытной пластины определяют по наличию специфических иммуноглобулинов в культуральной среде с помощью ТИФА. Выявленные гибридомы-продуценты клонируют не менее двух раз методом предельных разведений на среде RPMI-1640 с 15% эмбриональной телячьей сыворотки с добавками в 96-луночных плато с фидером - мышиными перитонеальными макрофагами (4•104 клеток в лунке). После второго клонирования практически все 100% субклонов продуцируют МКА.
Среди продуктивных клонов, секретирующих МКА против антигенных детерминант возбудителей сапа и мелиоидоза, селекционирован клон-продуцент MVd-2(1F4).
Пример 2. Накопление МКА.
Ампулы с клетками гибридомы вынимают из сосуда с жидким азотом и быстро оттаивают на водяной бане при 37oC. Размороженные клетки переносят в центрифужную пробирку с 20 мл бессывороточной среды RPMI-1640, осторожно наслаивают взвесь клеток на среду. Клетки осаждают центрифугированием и после удаления отмывающей среды высевают на матрас 25 см2 на среду RPMI-1640 с 15% эмбриональной телячьей сыворотки. Матрас инкубируют во влажной атмосфере с 5% CO2 при 37oC. Когда колония клеток покрывает более трети дна матраса, осуществляют отбор проб культуральной среды с целью определения титра МКА с помощью ТИФА. При полном покрытии дна матраса гибридными клетками производят их рассев на несколько матрасов. Таким способом тиражируют клетки гибридомы in vitro.
Для получения более концентрированного препарата антител гибридомы-продуценты накапливают в асцитической жидкости мышей BALB/c. Животных предварительно сенсибилизируют внутрибрюшинным введением пристана - 2,6,10,14-тетраметилпентадекана (0,3 мл на мышь) или неполного адъюванта Фрейнда (0,5 мл на мышь). Через неделю мышам внутрибрюшинно вводят по 1•105-1•106 клеток гибридомы. После появления у мышей асцитической жидкости и солидных опухолей собирают содержимое брюшной полости. Клетки осаждают центрифугированием, к надосадочной жидкости добавляют сульфат аммония до 50%-ного его насыщения. Рыхлый осадок центрифугируют при 10000 об/мин в течение 20 мин, надосадочную жидкость удаляют. Плотный осадок растворяют в физиологическом растворе до исходного объема, диализуют против этого же раствора в течение суток при 4oC до полного удаления сульфата аммония. Осаждение МКА сульфатом аммония до 50%-ного его насыщения повторяют трижды, как описано выше. В полученном растворе очищенных МКА определяют концентрацию белка спектрофотометрически. В качестве стандартного используют 1%-ный раствор бычьего сывороточного альбумина.
Специфическую активность МКА определяют с помощью ТИФА и НМФА. При постановке ТИФА полистироловые пластины обрабатывают в течение ночи при 4oC водно-солевым экстрактом P. pseudomallei 56830 или P.mallei 10230, разведенным на 0,05 М карбонатно-бикарбонатном буфере, pH 9,5, до концентрации 1-10 мкг/мл по белку. Затем пластины трижды отмывают забуференным физраствором с 0,05% твина-20. На этом же растворе производят титрование образцов МКА в объеме 100 мкл, которые выдерживают в пластинах в течение 1 ч при 37oC. После очередного трехкратного отмывания пластин вносят антивидовой конъюгат в рабочем разведении, приготовленный на ЭФР с твином-20. Конъюгат представляет собой кроличьи антимышиные IgG, меченные пероксидазой хрена. Время инкубации 1 ч при 37oC, объем 100 мкл на лунку. Вновь повторяют отмывание. В заключении вносят смесь - перекись водорода с 5-аминосалициловой кислотой. После инкубации при комнатной температуре в течение 40 мин - 1 ч измеряют оптическую плотность жидкости в каждой лунке при длине волны 405 нм. МКА, выделенные из асцитической жидкости в ТИФА, активны в разведении 1: 5•105-1•107.
Специфическую активность МКА оценивают в непрямом методе флуоресцирующих антител с коммерческим антивидовым конъюгатом люминесцирующих иммуноглобулинов против глобулинов мыши. МКА, выделенные из асцитической жидкости мышей, в НМФА активны в разведении 1:1•103-1:104.
Средний объем асцитической жидкости, получаемый при культивировании гибридомы MVd-2(1F4) в организме животных, составляет 5,6+0,14 мл, продуцирующая активность in vivo - 25-30 мг моноклональных иммуноглобулинов на 1 мл асцитической жидкости.
Пример 3. Использование МКА MVd-2(1F4) для изготовления иммуноглобулинов диагностических флуоресцирующих мелиоидозных видоспецифических моноклональных.
Для получения иммунодиагностических препаратов используют образцы МКА MVd-2(1F4) с титром не менее 1:5•103-1•104 в НМФА. Конъюгирование иммуноглобулинов с флуорохромом осуществляют при постоянном перемешивании, температуре +4oC и контроле pH раствора. При этом в раствор белка в течение 30-40 мин дробно вносят флуоресцеинизотиоцианат (ФИТЦ), растворенный в 1 мл 0,1 М NaHCO3, pH 9,5 из расчета 25 мг на 1 г белка. В течение этого времени поддерживают pH раствора на уровне 8,5-9 с помощью 0,1 М NaHCO3. После стабилизации pH раствора конъюгирование продолжают в течение 2 ч. Очистку конъюгата от несвязавшегося флуорохрома проводят на колонках сефадексом Г-25 элюирующим 0,1 М фосфатным буфером, pH 7,2 со скоростью 40-50 мл/ч. Качество приготовленных конъюгатов оценивают по показателю концентрации белка и молярного соотношения ФИТЦ/белок. Расчеты вели по формулам: Мфитц/Мбелок= 2,87 ОП495/ОП280-(0,35 ОП495); Сб = ОП280 - (0,35 ОП495)/1,4. Спектрофотометрически определяют показатели оптической плотности цельного конъюгата и его разведений при длине волны 280 и 495 нм.
Концентрация белка в готовом препарате должна быть равна 5+1, молярное соотношение - 7,0+3,0. Лиофилизированные препараты МКА-ФИТЦ хранят в ампулах при +4oC в течение 2 лет.
Пример 4. Оценка активности, специфической активности и специфичности иммуноглобулинов диагностических флуоресцирующих мелиоидозных видоспецифических моноклональных.
Рабочее разведение препаратов определяли на фиксированных мазках, приготовленных из бактериальных взвесей 5 типичных штаммов P.pseudomallei с концентрацией 5•108 м.к./мл.
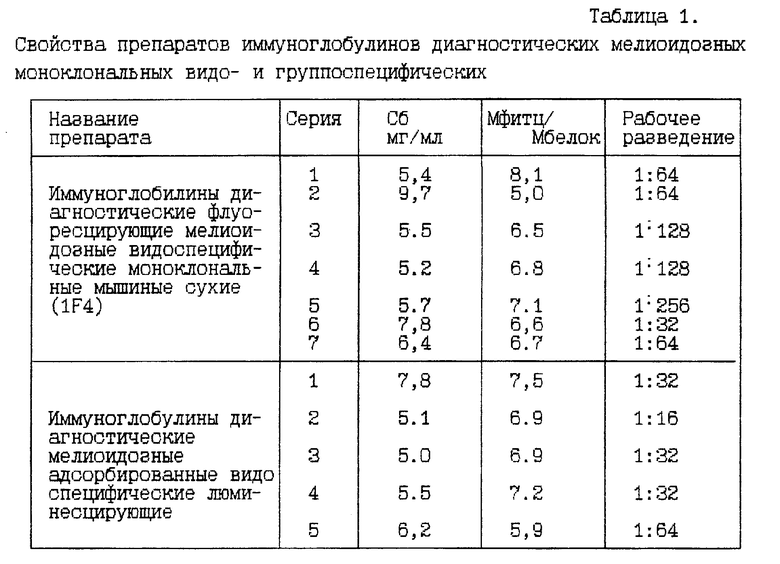
Результаты определения красящего титра и рабочего разведения конъюгатов представлены в табл. 1.
Данные, представленные в табл.1, свидетельствуют о том, что флуоресцирующие препараты на основе МКА MVd-2(1F4) по параметрам активности превышают возможности коммерческих поликлональных аналогов. Рабочее разведение МКА MVd-2(1F4), конъюгированных с ФИТЦ, 1:64-1:128 и выше. Минимальные концентрации МКА-ФИТЦ, обеспечивающие окрашивание бактерий на 3-4+ для различных серий препаратов, колебались в пределах для конъгатов: МКА 1F4-ФИТЦ 0,08-0.4 мг/мл, для коммерческих препаратов 0,16-0,8 мг/мл.
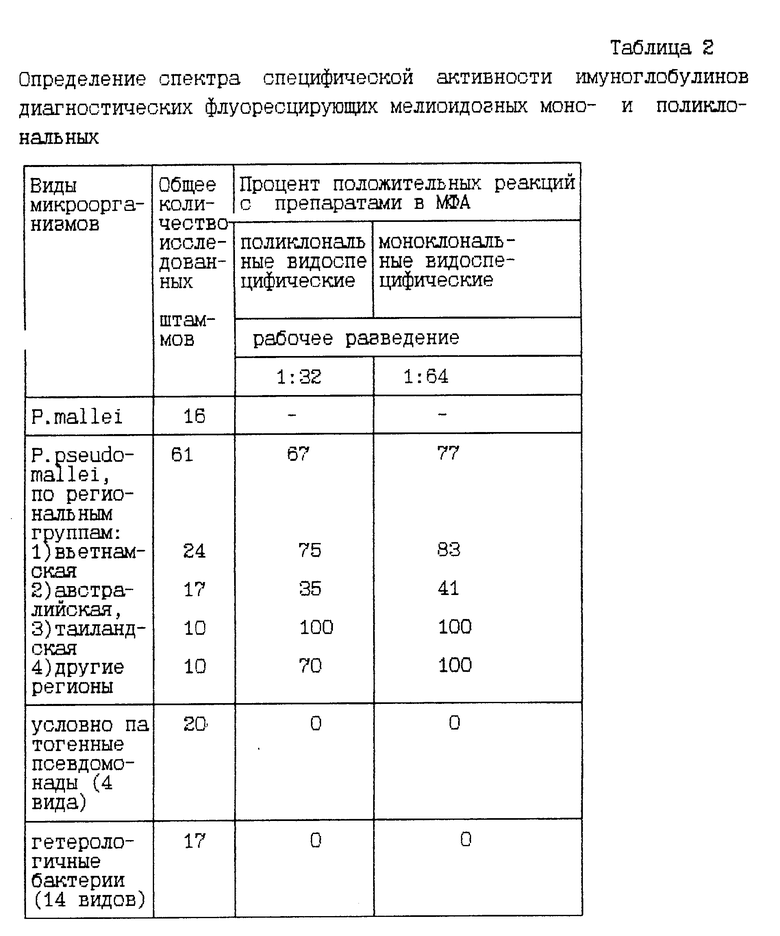
Специфическую активность и специфичность МКА 1F4, конъюгированных с ФИТЦ, оценивают в МФА на фиксированных мазках из живых культур Pseudomonas mallei, близкородственных (Pseudomonas cepacia, P.putida, P.aeruginosa, P. fluorescens) и гетерологичных видов микроорганизмов, приготовленных из взвесей с концентрацией 1•107 м.к./мл (табл. 2).
В качестве препарата сравнения (прототип) используют коммерческий препарат, выпускаемый ВолгНИПЧИ: иммуноглоулины диагностические мелиоидозные адсорбированные видоспецифические люминесцирующие.
Таким образом, данные, приведенные в табл. 1, 2, свидетельствуют о том, что разработанные диагностические моноклональные ЛИГ для МФА высокоактивны и специфичны.
Необходимо отметить, что чувствительность МФА при окрашивании мазков-препаратов моноклональными препаратами сохранялась на уровне 1•104 - 5•104 м. к. /мл. При проведении данного этапа исследования мазки-препараты использовали взвеси 5 штаммов P.mallei и 5 штаммов P.pseudomallei, приготовленных в концентрациях 5•105, 1•105, 5•104, 1•104, 5•103 м.к./мл. Результаты опытов представлены в табл. 3.
Таким образом, в результате проведенных исследований были разработаны способы получения стандартных флуоресцирующих мелиоидозных моноклональных видоспецифических препаратов, установлена их высокая чувствительность и специфичность в МФА при обнаруржении и идентификации P.pseudomallei. По параметрам активности полученный на основе МКА MVd-2(1F4) диагностический препарат для МФА превосходит коммерческий поликлональный аналог.
Преимуществами использования моноклональных антител в качестве основы для конструирования диагностических флуоресцирующих мелиоидозных препаратов являются стабильность, гомогенность иммуноглобулинового сырья, более высокая удельная активность на 1 мг белка, при котором возможна достоверная индикация возбудителя мелиоидоза, практически 100%-ная воспроизводимость результатов опытов. Использование стабильных гибридных клеточных линий, депонированных во Всероссийской специализированной коллекции клеточных культур РАН (г. Санкт-Петербург), обеспечивает получение специфических иммуноглобулинов в необходимых количествах для производства стандартных иммунодиагностических препаратов для МФА.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К ТЕРМОСТАБИЛЬНОМУ КОМПОНЕНТУ КАПСУЛОПОДОБНОЙ СУБСТАНЦИИ ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 1997 |
|
RU2117042C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. BPM VD-10 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 5H/E К АНТИГЕНУ 200 KDA ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 2014 |
|
RU2570638C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. BPM VD-11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 6A/G К АНТИГЕНУ 200 kDA ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 2014 |
|
RU2570634C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К ТЕРМОСТАБИЛЬНОМУ АНТИГЕНУ, ОБЩЕМУ ДЛЯ ВОЗБУДИТЕЛЕЙ САПА И МЕЛИОИДОЗА | 1997 |
|
RU2117043C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО САПНОГО ИММУНОГЛОБУЛИНОВОГО МОНОКЛОНАЛЬНОГО | 2017 |
|
RU2658434C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV VD-1-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 4G/B К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2535982C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L. - продуцент моноклональных антител к антигену РSеUDомоNаS рSеUDомаLLеI, не реагирующих с близкородственным возбудителем сапа | 1990 |
|
SU1740415A1 |
| Штамм гибридных культивируемых клеток MUS мUSсULUS L - продуцент моноклональных антител к поверхностному антигену типичных штаммов возбудителя сапа РSеUDомоNаS маLLеI | 1991 |
|
SU1791451A1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ЛПС ХОЛЕРНЫХ ВИБРИОНОВ О139 СЕРОГРУППЫ | 2010 |
|
RU2425875C1 |
| Штамм гибридных культивируемых клеток MUS мUSсULUS L - продуцент моноклональных антител к антигену 8 возбудителя мелиоидоза РSеUDомоNаS рSеUDомаLLеI | 1990 |
|
SU1791450A1 |

Штамм предназначен для получения моноклональных антител к термостабильному поверхностному антигену возбудителя мелиоидоза. Антитела относятся к изотипу IgG2b. Концентрация иммуноглобулинов в культуральной среде составляет 0,35-0,52 мг/мл. Антитела взаимодействуют с поверхностным антигеном возбудителя мелиоидоза, не взаимодействуют с клетками близкородственного возбудителя сапа, вследствие чего данный тип моноклональных иммуноглобулинов отобран для использования в качестве сырья для производства видоспецифического препарата флуоресцирующих мелиоидозных иммуноглобулинов. 3 табл.
Штамм культивируемых гибридных клеток животного Mus. musculus ВСКК(П)648 Д - продуцент моноклонального антитела к термостабильному поверхностному антигену возбудителя мелиоидоза.
| Рыбкин В.С., Яковлев А.Т., Волков Е.А | |||
| К вопросу о совершенствовании техн ологии производства мелиоидозных видоспецифических люминесцирующих иммуног лобулинов | |||
| Особо опасные инфекционные заболевания: иммунология, генетика и биология | |||
| Сборник научный работ | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Ударно-долбежная врубовая машина | 1921 |
|
SU115A1 |
Авторы
Даты
1998-07-27—Публикация
1997-07-02—Подача