ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в целом, относится к идентификации биомаркера, уровень экспрессии которого является пригодным для прогнозирования ответа пациента на лечение антипролиферативным средством, в частности, ингибитором WEE1. Уровень экспрессии биомаркера можно использовать для прогнозирования у пациента наличия злокачественного заболевания, которое опосредуется ингибированием апоптоза, и у которого вероятен ответ на лечение ингибитором WEE1.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Многие общепринятые лекарственные средства против злокачественной опухоли неспецифично нацелены на ДНК в делящихся клетках и, в конечном счете, вызывают повреждение ДНК. Это, в свою очередь, запускает активацию точек контроля клеточного цикла, которая останавливает прогрессирование клеточного цикла (в фазы G1, S или G2/M) с целью обеспечения времени для репарации ДНК перед тем, как клетка подвергнется репликации или делению ДНК. С терапевтической точки зрения, ингибирование киназ точки контроля, которые опосредуют остановку клеточного цикла, может вынудить опухолевые клетки продолжить клеточное деление перед репарацией химически вызванного повреждения ДНК, в конечном счете, вызывая апоптоз или нарушение митоза (Medema, R.H. and Macurek, L., Oncogene, 2012, 31(21):2601-2613). Исследования на линиях клеток подтверждают эту гипотезу и демонстрируют хемосенсибилизацию и радиосенсибилизацию при фармакологическом или генетическом прерывании активности киназ точки контроля, включая CHK1, WEE1, ATR и ATM. Ингибиторы этих киназ находятся на различных стадиях доклинической и клинической разработки ввиду их способности сенсибилизировать опухолевые клетки к терапевтическому повреждению ДНК.
Киназа WEE1 точки контроля катализирует ингибиторное фосфорилирование как CDK1 (CDC2), так и CDK2 на тирозине 15 (Parker, L. L. and Piwnica-Worms, H., Science, 1992, 257(5078):1955-1957; Watanabe, N., et al., Embo J., 1995, 14(9):1878-1891). WEE1-зависимое ингибирование CDK1 и CDK2 останавливает клеточный цикл в ответ на вызванное извне повреждение ДНК (Hamer, P.C.D., et al., Clin. Cancer Res., 2011, 17(13):4200-4207). Активность WEE1 также существенна для ненарушенного клеточного цикла (Mcgowan, C.H. and Russell, P., Embo J., 1993, 12(1):75-85; Tominaga, Y., et al., Intl. J. Biol. Sci., 2006, 2(4):161-170). Исследование синхронизации клеток в нормальных фибробластах человека выявило, что сходные количества белка WEE1 выявляются как в S-фазе, и в фазах G2/M, однако наибольшей его активность является в фазе S клеточного цикла (Watanabe, N., 1995). Кроме того, после кондиционального нокаута WEE1 в эмбриональных фибробластах мыши (MEF) клетки демонстрируют признаки геномной нестабильности, нарушения функций точек контроля и преждевременного митоза (Tominaga, et al., 2006). Этот фенотип был частично объяснен последними данными, которые демонстрируют ключевую роль WEE1 в синтезе ДНК. Нокдаун WEE1 в отсутствие агентов, повреждающих ДНК, приводил к быстрому и стабильному обнаружению двунитевых разрывов ДНК, в частности, в клетках в S-фазе, подвергающихся репликации ДНК (Beck, H., et al., J. Cell Biol., 2010, 188(5):629-638; Dominguez-Kelly, R., et al., J. Cell Biol., 2011, 194(4):567-579). Данные свидетельствуют в пользу модели WEE1-зависимой геномной устойчивости, при которой нокдаун или ингибирование WEE1 ведет к аберрантно высокой активности CDK1 и 2, что приводит к несвоевременному запуску избыточных ориджинов репликации ДНК, который быстро истощает количества нуклеотидов и приводит к застреванию репликационных вилок, которые, в отсутствие активности WEE1, являются субстратами для ДНК-эндонуклеаз и вызывают двунитевые разрывы ДНК (Beck, H., et al., 2012).
Полагают, что нарушение регуляции экспрессии или активности WEE1 является отличительным признаком патологии при нескольких типах злокачественной опухоли. WEE1 часто сверхэкспрессируется в глиобластомах, и его активность защищает этот тип опухолей от нарушения митоза, так что высокие уровни WEE1 ассоциируют с неблагоприятным прогнозом (Mir, S.E., et al., Cancer Cell, 2010, 18(3):244-257). Высокая экспрессия WEE1 была обнаружена при злокачественной меланоме, и она коррелировала с низкой выживаемостью без признаков заболевания в этой популяции (Magnussen, G.I., et al., Plos One, 2012, 7(6)). Аберрантная экспрессия WEE1 вовлечена в другие типы опухолей, такие как печеночно-клеточная карционома (Masaki, T., et al., Hepatology, 2003, 37(3):534-543), рак молочной железы (Iorns, E., et al., Plos One, 2009, 4(4)), карцинома ободочной кишки (Backert, S., et al., Intl., J. Cancer, 1999, 82(6):868-874)), карцинома легкого (Yoshida, T., et al., Annals of Oncology, 2004, 15(2):252-256) и плоскоклеточная карцинома головы и шеи (Wu, Z.X., et al., Mol. & Cell. Proteomics, 2011, 10(12)). Для развернутых опухолей с повышенным уровнем геномной нестабильности могут требоваться функциональные точки контроля, чтобы обеспечить возможность репарации такого летального повреждения ДНК. В сущности, WEE1 представляет собой привлекательную мишень при развернутых опухолях, при которых, как полагают, его ингибирование будет приводить к нерепарируемому повреждению ДНК (Sorensen, C.S. and Syljuasen, R.G., Nuc. Acids Res., 2012, 40(2):477-486).
Существует потребность в биомаркерах, которые можно использовать для прогнозирования того, какие пациенты будут поддаваться лечению специфическими способами лечения, в частности, для пациентов, которые не отвечают на лечение или у которых имеется вероятность развития устойчивости к способам терапии первой линии. Поэтому, целью настоящего изобретения является предоставление прогностического биомаркера для отбора пациентов, которые, вероятно, будут отвечать на лечение ингибитором WEE1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к идентификации прогностического биомаркера, уровень экспрессии которого является пригодным для оценки и классификации пациентов в отношении лечения ингибитором WEE1. В одном варианте осуществления изобретения прогностический биомаркер, PKMYT1, используют для идентификации пациентов с вероятностью ответа на лечение ингибитором WEE1, причем ингибитор WEE1 представляет собой WEE1-1. В другом варианте осуществления изобретение относится к способу лечения пациента, у которого диагностирована злокачественная опухоль, ассоциированная с WEE1, ингибитором WEE1, где злокачественные клетки указанного пациента характеризуются низкой экспрессией PKMYT1. В еще одном варианте осуществления изобретение относится к способу лечения пациента со злокачественной опухолью, который является чувствительным к лечению ингибитором WEE1, где злокачественные клетки указанного пациента характеризуются уровнем экспрессии PKMYT1, который является меньшим, чем эталонная величина. В другом варианте осуществления изобретение относится к способу идентификации ингибиторов WEE1 для применения при лечении злокачественной опухоли, ассоциированной с киназой WEE1. В еще одном варианте осуществления изобретение относится к набору для идентификации пациентов с вероятностью ответа на лечение ингибитором WEE1, содержащему реагенты, взаимодействующие с PKMYT1.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано графическое представление прерывания пролиферации клеток в различных опухолевых клеточных линиях ингибитором WEE1. Пролиферацию в течение 96-часового интервала анализировали в трех повторениях для 522 линий злокачественных клеток с обработкой посредством титрования WEE1-1 из 9 точек. Данные ответа клеточных линий разделены с учетом ткани, из которой они происходят, и представлены в виде фракционной жизнеспособности (относительно обработанных DMSO контрольных клеток)) в зависимости от концентрации WEE1-1.
На фиг.2A и 2B представлены иллюстрации повреждения ДНК в S-фазе в результате обработки ингибитором WEE1, где клетки ES-2, A2058, A431, A427, KNS62 и NCI-H460 обрабатывали или DMSO (-), или возрастающими концентрациями WEE1-1 в течение 2 часов. Белковые лизаты анализировали вестерн-блоттингом с антителами против фосфорилированной CHK1S345, фосфорилированной CDK1Y15, фосфорилированной CDK1T14 или актина в качестве нагрузочного контроля (фиг.2A). Клетки TOV-21G обрабатывали DMSO или 150 нМ WEE1-1 в течение периода до 2 или 6 часов (фиг.2B). Клетки импульсно метили за один час до сбора посредством BrdU для мечения клеток в S-фазе, активно подвергающихся репликации ДНК. Клетки анализировали проточной цитометрией для выявления двунитевых разрывов ДНК (γH2AX) относительно общего содержания ДНК (фиг.2B, левые панели) или γH2AX относительно захвата BrdU (фиг.2B, правые панели). Процентная доля клеток с окрашиванием γH2AX отображает клеточную популяцию, содержащую двунитевые разрывы ДНК, и она указана для каждого условия обработки и разделена по статусу BrdU на правых панелях.
На фиг.3A-3C представлены иллюстрации замедления прогрессирования S-фазы в результате обработки ингибитором WEE1. Клетки ES-2 синхронизировали через 36 часов после взятия сыворотки. На фиг.3A и 3B, клетки стимулировали для возобновления цикла посредством 20% FBS в присутствии добавленного либо носителя (DMSO) на дорожках 1-6, либо 500 нМ WEE1-1 на дорожках 7-11. Указано время сбора после стимуляции FBS. За один час до сбора клетки импульсно метили посредством BrdU, и процент клеток с окрашиванием BrdU представлен на верхней панели. Белковые лизаты из параллельно обработанных клеток ES-2 собирали, а затем проводили вестерн-блоттинг с указанными антителами. По сравнению с обработанным носителем контролем, обработка WEE1-1 задерживает прохождение через S-фазу (фиг.3A, верхняя панель, и фиг.3B) и захват BrdU в S-фазе (фиг.3A, верхняя панель), указывая на замедление репликации ДНК. Обработка WEE1-1 задерживает экспрессию циклина A и индуцирует передачу сигналов о повреждении ДНК, о чем свидетельствует pChk1S345 (фиг.3A, нижняя левая панель). На фиг.3B представлены результаты проточно-цитометрического анализа в выбранных образцах (обработки через 4, 12 и 24 часа) из части A, сравнивающий окрашивание BrdU и содержание ДНК. Данные на фиг.3C иллюстрируют лишенные сыворотки клетки ES-2, к которым были добавлены 500 нМ WEE1-1 либо в присутствии, либо в отсутствие 20% FBS. Через двадцать четыре часа содержание ДНК и γH2AX (двунитевые разрывы ДНК) анализировали проточной цитометрией. Процентные доли общей популяции клеток представлены на диаграмме (фиг. 3C), демонстрируя, что WEE1-1 индуцирует двунитевые разрывы ДНК в большем количестве клеток, когда популяцию стимулируют 20% FBS.
Фиг.4A и 4B иллюстрируют, что преждевременный митоз не обязательно индуцирует цитотоксичность при ингибировании WEE1. Клетки A2058, HT-29 и LoVo обрабатывали в течение 24 часов или DMSO (-WE1-1), или WEE1-1 при концентрациях лекарственного средства, представляющих собой EC90. Проточную цитометрию использовали для идентификации популяции клеток, положительных по маркеру митоза - фосфорилированному гистону H3 (pHH3S10, фиг.4A) или маркеру двунитевых разрывов ДНК - γH2AX (фиг.4B). На верхней панели рамка справа указывает ожидаемую митотическую популяцию (содержание ДНК 4N), и окно слева указывает на клетки, положительные в отношении pHH3 с содержанием ДНК менее чем 4N.
Фиг.5A-5D представляют собой иллюстрации эффективности in vivo лечения одним средством WEE1-1, при котором мышам, имеющим ксенотрансплантат A427, вводили либо носитель (0,5% метилцеллюлоза), либо 60 мг/кг WEE1-1. Введение как носителя, так и соединения проводили по схеме BID в течение 28 последовательных суток. Объемы ксенотрансплантатов опухолей определяли дважды в неделю и наносили на график (средний объем -/+ SEM) против количества суток лечения для мышей, которым вводили носитель (n=10) и WEE1-1 (n=10) (фиг.5A). На фиг.5B представлен нанесенный на график конечный объем опухолей индивидуальных ксенотрансплантатов A427 после введения в течение 28 суток либо носителя, либо MK-1775. Средний объем опухоли в начале исследования составлял 164 мм3, и он указан пунктирной линией. На фиг.5C и 5D проиллюстрированы дополнительные исследования эффективности in vivo, проведенные на моделях с ксенотрансплантатами SK-MES-1 (C) и LoVo (D), как описано для фиг. 5A, за исключением того, что введение WEE1-1 прекращали на 13-ые сутки в исследовании ксенотрансплантата LoVo (указано звездочкой), и объемы опухолей измеряли в течение дополнительных 2 недель.
На фиг.6A и 6B проиллюстрировано, что нокдаун PKMYT1 селективно повышал чувствительность к WEE1-1 и снижал ингибиторное фосфорилирование CDK1. На фиг.6A проиллюстрировано, что нокдаун PKMYT1 происходил в двух линиях клеток, которые проявляют относительную устойчивость к WEE1-1: H460 и KNS62. Клетки трансфицировали совокупностями миРНК (siRNA), содержавшими ненацеленные контрольные (CT) последовательности или последовательности PKMYT1. Клетки обрабатывали WEE1-1, карбоплатином, ингибитором MEK (PD0325901) или доксорубицином в течение 72 часов перед анализом для выявления пролиферации с помощью анализа ATP ViaLight. Нокдаун PKMYT1 снижал EC50 пролиферации в случае WEE1-1 отдельно, но не в случае других исследованных соединений. На фиг.6B клетки KNS62 трансфицировали совокупностью ненацеленных контрольных (CT) миРНК или миРНК PKMYT1, и обрабатывали 400 нМ WEE1-1 в течение указанных периодов времени.
На фиг.7A и 7B проиллюстрировано, что низкая экспрессия PKMYT1 повышала чувствительность к WEE1-1. На фиг.7A, относительную экспрессию PKMYT1 (база данных CCLE, Broad-Novartis) наносили на график против ответа на обработку 400 нМ WEE1-1 305 линий клеток, каждая из которых представлена единичной точкой. Ответ на WEE1-1 (ось x) представляет собой величину с внесенной поправкой на основании анализа пролиферации в течение 96 часов, где величина 1 указывает на отсутствие изменений в скорости роста относительно клеток, обработанных DMSO, а величина 0,25 (вертикальная пунктирная линия) или менее указывает на отрицательную скорость роста или гибель клетки. Средняя относительная экспрессия PKMYT1 среди 305 линий клеток составляет 413. На фиг.7B проиллюстрирован пролиферативный ответ на WEE1-1, измеренный в величинах EC50 (мкМ), нанесенных на график против относительной экспрессии мРНК PKMYT1 (левая панель) или белка PKMYT1 (правая панель) для тринадцати линий клеток, не включенных в анализ на фиг.7A, выше.
На фиг.8A и 8B проиллюстрировано, что ингибирование WEE1 посредством WEE1-1 приводит к увеличенной активности CDK1 и 2. Клетки ES-2 обрабатывали в течение 24 часов либо DMSO, или 250 нМ WEE1-1, собирали и лизировали для анализа с использованием вестерн-блоттинга. На фиг.8A лизаты исследовали с помощью индивидуальных антител против субстрата WEE1 (pCDK1Y15), маркера DDR (pCHK1S345) или субстратов CDK1 и 2 (pStathminS38 и pLaminA/CS22, соответственно). На фиг.8B лизаты исследовали с помощью антитела к мотиву общего субстрата CDK.
На фиг.9A и 9B проиллюстрировано, что повреждение ДНК, индуцированное обработкой WEE1-1, требует митогенной стимуляции. Клетки ES-2 лишали сыворотки в течение 36 часов, и в это время их либо оставляли не стимулированными, либо обрабатывали 20% FBS. Клетки, культивированные в обоих условиях, обрабатывали либо DMSO, либо 500 нМ WEE1-1 в течение 24 часов перед сбором для проточно-цитометрического анализа содержания ДНК (7-AAD) и двунитевых разрывов ДНК (γH2AX). На фиг.9A проиллюстрирована гистограмма для распределения клеточного цикла. На фиг.9B проиллюстрирован график разброса данных для окна, которое указывает на популяцию γH2AX. Процентная доля всех клеток указана либо в фазе клеточного цикла, либо в качестве γH2AX-положительных клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Многие способы лечения злокачественной опухоли действуют посредством повреждения ДНК, которое впоследствии инициирует ответ на повреждение ДНК (DDR) и активирует киназы точки контроля для остановки деления, в то время как происходит репарация ДНК. Тирозинкиназа WEE1 активируется посредством DDR, фосфорилируя и ингибируя циклинзависимые киназы (CDK) 1 и 2, и, в сущности, останавливает деление клеток. Ингибирование WEE1 усиливает повреждающие ДНК способы лечения путем предотвращения остановки клеточного цикла и должной репарации ДНК.
WEE1-1, также известный как 2-аллил-1-[6-(1-гидрокси-1-метилэтил)пиридин-2-ил]-6-{[4-(4-метилпиперазин-1-ил)фенил]амино}-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-он, представляет собой сильнодействующий (IC50=5,2 нМ) и селективный конкурирующий с ATP низкомолекулярный ингибитор WEE1 (Hirai, H., et al., Mol. Cancer Ther., 2009, 8(11):2992-3000), который в настоящее время находится на стадии клинической разработки в качестве противоопухолевого средства в комбинации с химиотерапевтическими средствами, применяемыми в стандарте лечения (SOC) (Stathis, A. and Oza A., Drug News & Perspectives, 2010, 23(7):425-429; Schellens, J.H.M., et al., J. Clin.Oncol., 2011, 29:2011 (suppl; abstr 3068); Mizuarai, S., et al., Mol. Cancer, 2009, 8:34). Предшествующие исследования WEE1-1 продемонстрировали его потенциал в качестве вспомогательного средства или сенсибилизатора для химиотерапевтических средств, применяемых в стандарте лечения (SOC), ввиду его способности принудительно вызывать незапланированный митоз, который, в конечном счете, приводит к апоптозу или нарушению митоза (Hirai, H., et al., Cancer Biol. & Ther., 2010, 9(7):514-522; Aarts, M., et al., Cancer Discovery, 2012, 2(6):524-539; Indovina, P. and Giordano A., Cancer Biol. & Ther., 2010, 9(7);523-525; Wang, Y.L., et al., Cancer Biol. & Ther., 2004, 3(3):305-313). Однако потенциальный терапевтический эффект ингибирования WEE1 в отсутствие химиотерапии SOC является в меньшей степени определенным. Нокдаун WEE1 с помощью РНК-i ингибировал пролиферацию линий клеток злокачественной опухоли (Iorns, E., et al., Cancer Targets, 2009, Plos One, 4(4); Murrow, L.M., et al., Breast Cancer Research and Treatment, 2010, 122(2):347-357), и недавно было продемонстрировано, что WEE1-1 отдельно может индуцировать апоптоз в линиях клеток саркомы, обработанных in vitro (Kreahling, J.M., et al., Mol. Cancer Ther., 2012, 11(1):174-182).
Заявители демонстрируют в настоящем описании, что фармакологическое ингибирование только WEE1 посредством применения WEE1-1 в качестве единственного средства является цитотоксичным для широкого диапазона линий опухолевых клеток и активно индуцирует двунитевые разрывы ДНК. Примечательно, что WEE1-1 индуцировал повреждение ДНК, происходящее в S-фазе, которое было независимым от химиотерапии SOC или лучевой терапии, и в основе которого лежала активная репликация ДНК. При переносимых дозах, монотерапия WEE1-1 приводила к ингибированию или регрессии роста ксенотрансплантата опухоли. Нокдаун PKMYT1 - киназы, функционально связанной с WEE1, селективно сенсибилизровал раковые клетки к WEE1-1, но не сенсибилизровал их к другим цитотоксическим средствам. Как описано в настоящем описании, экспрессия PKMYT1 была ниже средней приблизительно в трех четвертях линий раковых клеток, в наибольшей степени отвечающих на WEE1-1. Выбор линий клеток, которые имели низкую экспрессию PKMYT1, являлся прогностическим для чувствительности этих линий клеток к WEE1-1 in vitro. Взятые вместе, эти данные обеспечивают основание для применения ингибирования WEE1 в качестве сильнодействующего средства терапии против злокачественной опухоли, и использования низкой экспрессии PKMYT1 для идентификации и отбора пациентов, которые с наибольшей вероятностью будут отвечать на монотерапию WEE1-1.
Соответственно, настоящее изобретение относится к способам лечения злокачественной опухоли ингибитором WEE1, где ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль. В другом варианте осуществления изобретение относится к прогностическому биомаркеру PKMYT1, экспрессия которого чувствительна к ингибированию WEE1 ингибитором WEE1. В еще одном варианте осуществления изобретение относится к способу лечения пациента, у которого диагностирована злокачественная опухоль, ассоциированная с киназой WEE1, нуждающемуся в его лечении, ингибитором WEE1, где злокачественные клетки указанного пациента характеризуются низкой экспрессией PKMYT1, и где указанный ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль. В еще одном варианте осуществления изобретение относится к способу лечения пациента со злокачественной опухолью, который является чувствительным к лечению ингибитором WEE1, где злокачественные клетки указанного пациента характеризуются уровнем экспрессии PKMYT1, который ниже эталонной величины, и где указанный ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль. В другом варианте осуществления изобретение относится к способу идентификации ингибиторов PKMYT1 для применения при лечении злокачественной опухоли, ассоциированной с киназой WEE1. В еще одном варианте осуществления изобретение относится к набору для идентификации пациентов, которые, вероятно, будут отвечать на лечение ингибитором WEE1, содержащему реагенты, взаимодействующие с PKMYT1.
В одном варианте осуществления изобретения ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль.
В другом варианте осуществления изобретения ингибитор WEE1 вводят в дозе от 100 мг в сутки до 200 мг в сутки. В одном варианте осуществления изобретения ингибитор WEE1 можно вводить два раза в сутки (BID) в течение курса из двух с половиной суток (всего 5 доз) или один раз в сутки (QD) в течение курса из двух суток (всего 2 дозы).
Термин «злокачественная опухоль», как используют в настоящем описании, включает различные виды саркомы и карциномы и включает солидную опухоль и гемопоэтическую опухоль. Солидная злокачественная опухоль, как используют в настоящем описании, включают, например, злокачественную опухоль головного мозга, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легких, немелкоклеточный рак легких, рак молочной железы, рак эндометрия, рак легких, рак желудка, рак желчного пузыря/желчных протоков, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориокарциному, рак тела матки, рак шейки матки, рак почечной лоханки/уретры, рак мочевого пузыря, рак предстательной железы, рак полового члена, рак яичек, фетальную злокачественную опухоль, опухоль Вильмса, рак кожи, злокачественную меланому, нейробластому, остеосаркому, опухоль Юинга, саркому мягкой части. С другой стороны, гематопоэтический рак включает, например, острый лейкоз, хронический лимфолейкоз, хронический миелоцитарный лейкоз, истинную полицитемию, злокачественную лимфому, множественную миелому, лимфому Ходжкина, неходжкинскую лимфому.
Термин «злокачественная опухоль, ассоциированная с киназой WEE1», как используют в настоящем описании, обозначает злокачественную опухоль, ассоциированную с активностью или ингибированием киназы WEE1, включая, но не ограничиваясь ими, злокачественную опухоль головного мозга, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легких, немелкоклеточный рак легких, рак молочной железы, рак легких, рак желудка, рак желчного пузыря/желчных протоков, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориокарциному, рак тела матки, рак шейки матки, рак почечной лоханки/уретры, рак мочевого пузыря, рак предстательной железы, рак полового члена, рак яичек, фетальную злокачественную опухоль, опухоль Вильмса, рак кожи, злокачественную меланому, нейробластому, остеосаркому, опухоль Юинга, саркому мягкой части, острый лейкоз, хронический лимфолейкоз, хронический миелоцитарный лейкоз, лимфому Ходжкина, или в качестве сенсибилизаторов для химиотерапии или лучевой терапии этих злокачественных опухолей. В частности, ингибитор WEE1 по настоящему изобретению пригоден в качестве лекарственного средства, например, от рака молочной железы, рака легких, рака поджелудочной железы, рака толстого кишечника, рака яичника, острой лейкемии, хронической лимфатической лейкемии, хронической миелоцитарной лейкемии, лимфомы Ходжкина, или в качестве сенсибилизаторов для химиотерапии или лучевой терапии этих злокачественных опухолей.
Термин «лечение злокачественной опухоли», как используют в настоящем описании, обозначает, что средство против злокачественной опухоли вводят пациенту со злокачественной опухолью, чтобы ингибировать рост злокачественных клеток у пациента. Предпочтительно, лечение приводит к некоторой форме регрессии роста злокачественной опухоли, или лечение задерживает или предотвращает рецидив злокачественной опухоли. Более предпочтительно, лечение приводит к полному исчезновению злокачественной опухоли.
Термин «пациент» или «индивидуум», как используют в настоящем описании, обозначает реципиента, нуждающегося в медицинском вмешательстве или лечении. В него входят пациенты или индивидуумы, являющиеся и не являющиеся млекопитающими.
Термин «прогностический биомаркер», как используют в настоящем описании, обозначает генный маркер, экспрессия которого коррелирует с ответом на данное терапевтическое средство или класс терапевтических средств. Как используют в настоящем описании, этот термин относится к PKMYT1, экспрессия которого коррелирует с терапевтическим эффектом ингибитора WEE1. В одном варианте осуществления настоящего изобретения ингибитор WEE1 представляет собой WEE1-1.
Термин «происходящие из маркера полинуклеотиды» означает РНК, транскрибированную с маркерного гена, любую кДНК или кРНК, продуцированную с него, и любую нуклеиновую кислоту, происходящую из нее, такую как синтетическая нуклеиновая кислота, имеющая последовательность, происходящую из гена, соответствующего маркерному гену.
Термины «контроль», «контрольный уровень», «эталонный уровень» или «заданный эталонный уровень» означает отдельный исходный уровень, измеренный в сравнимой контрольной клетке, которая может иметь или не иметь патологических изменений. Она может представлять собой клетку того же индивидуума или другого индивидуума, который здоров или не имеет того же заболевания, что и у индивидуума, от которого получен патологический или исследуемый образец. Таким образом, «эталонный уровень» может представлять собой абсолютную величину, диапазон величин, усредненную величину, срединную величину, среднюю величину или величину, сравниваемую с конкретной контрольной или исходной величиной. Эталонная величина может быть основана на величине отдельного образца, такой как величина, полученная для образца от индивидуума, страдающего злокачественно опухолью, ассоциированной с киназой WEE1, но в более ранний момент времени или перед лечением, или величина, полученная для образца от пациента, у которого диагностирована злокачественная опухоль, ассоциированная с киназой WEE1, отличного от пациента, подвергаемого исследованию, или «нормального» индивидуума, который является индивидуумом, у которого не диагностирована злокачественная опухоль, ассоциированная с киназой WEE1. Эталонная величина может быть основана на ряде образцов, например, от множества пациентов, у которых диагностирована злокачественная опухоль, опосредуемая киназой WEE1, или здоровых индивидуумов, или она может быть основана на совокупности образцов, включающих или исключающих исследуемый образец.
Термин «PKMYT1», как используют в настоящем описании, обозначает ген, который кодирует ассоциированную с мембраной тирозин- и треонин-специфическую ингибиторную киназу CDK1 - белок, который является членом семейства сериновых/треониновых протеинкиназ (Liu, F., et al., Mol. Cell. Biol., 1997, 17(2):571-583), последовательность которой представлена под номерами эталонных последовательностей NCBI NM_004203 (SEQ ID NO: 1) и NP_004194 (SEQ ID NO: 2).
Термин «низкая экспрессия PKMYT1» или «низкая PKMYT1 экспрессия», как используют в настоящем описании, обозначает клетку, полученную из линии клеток, охарактеризованной как линия злокачественных клеток, или полученную от пациента, у которого диагностирована злокачественная опухоль, имеющая сниженную экспрессию ДНК, мРНК или белка PKMYT1, или уменьшение числа копий гена PKMYT1, по сравнению с клеткой, полученной из линии клеток, охарактеризованной как линия клеток, не являющихся злокачественными, или полученной от пациента, у которого не диагностирована злокачественная опухоль, или с контрольной клеткой.
Как используют в настоящем описании, термины «измерение уровня экспрессии», «измерение уровня экспрессии гена» или «получение уровня экспрессии» и т.п. включают способы, которые количественно определяют уровень экспрессии гена-мишени, например, транскрипта гена, включая микроРНК (miRNA), или белка, кодируемого геном, а также способы, которые определяют, экспрессируется ли вообще представляющий интерес ген. Таким образом, анализ, который обеспечивает результат «да» или «нет» без обязательного обеспечения количественного определения величины экспрессии, представляет собой анализ, который «измеряет экспрессию», как этот термин используют в настоящем описании. Альтернативно, термин может включать количественное определение уровня экспрессии гена-мишени, выражаемого в количественной величине, например, в величине кратного изменения экспрессии, вверх или вниз, относительно контрольного гена или относительно того же гена в другом образце, или логарифмической величине соотношения экспрессии, или в любом его визуальном представлении, например, таком как «тепловая карта», где интенсивность цвета отображает величину выявленной экспрессии гена. Иллюстративные способы выявления уровня экспрессии гена включают, но не ограничиваются ими, норзерн-блоттинг, иммуноанализ с использованием дот-блоттинга или слот-блоттинга, матрицу репортерного гена (см., например, патент США № 5569588), защиту от нуклеаз, ОТ-ПЦР, профилирование на микрочипах, дифференциальный дисплей, SAGE (Velculescu et al., (1995), Science 270:484-87), Digital Gene Expression System (см. WO2007076128; WO2007076129), мультиплексный анализ мРНК (Tian et al., (2004), Nucleic Acids Res. 32:e126), PMAGE (Kim et al., (2007), Science 316:1481-84), анализ с кДНК-опосредуемым отжигом, отбором, удлинением и лигированием (DASL, Bibikova, et al., (2004), AJP 165:1799-807), мультиплексный анализ разветвленной ДНК (Flagella et al., (2006), Anal. Biochem. 352:50-60), 2D гель-электрофорез, SELDI-TOF, ICAT, ферментный анализ, анализ с антителами и т.п.
Ингибиторы WEE1
В одном варианте осуществления изобретения представляющий интерес ингибитор WEE1 по настоящему изобретению представляет собой WEE1-1, структура которого показана ниже.
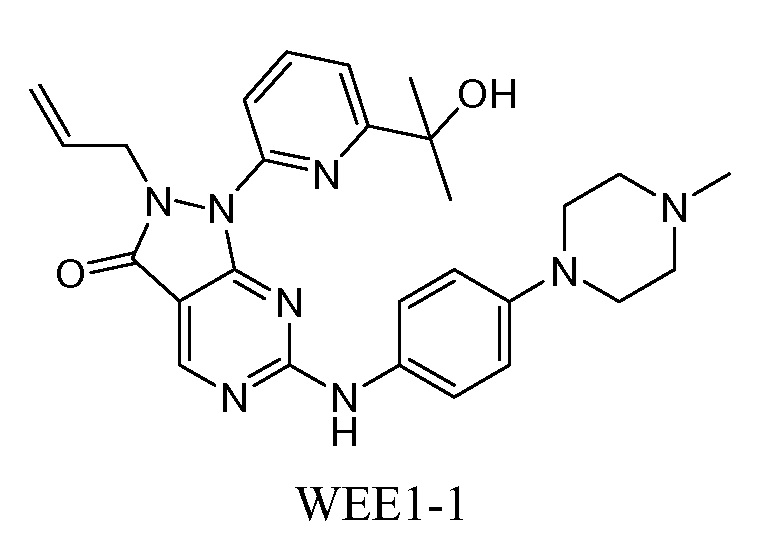
WEE1-1 представляет собой ингибитор WEE1, который является пригодным для лечения злокачественной опухоли. WEE1-1 также известен как 2-аллил-1-[6-(1-гидрокси-1-метилэтил)пиридин-2-ил]-6-{[4-(4-метилпиперазин-1-ил)фенил]амино}-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-он. WEE1-1 описан в патенте США № 7834019 и в международных публикациях PCT WO2007/126122, WO 2007/126128 и WO2008/153207, которые включены в настоящее описание в качестве ссылок в полном объеме. Кристаллические WEE1-1 описаны в публикации США № US2010-0124544 и в международной публикации PCT WO2011/034743, которые включены в настоящее описание в качестве ссылок в полном объеме.
В одном варианте осуществления изобретения ингибитор WEE1 по настоящему изобретению представляет собой WEE1-2, структура которого показана ниже.

WEE1-2 представляет собой ингибитор WEE1, который является пригодным для лечения злокачественной опухоли. WEE1-2 также известен как 3-(2,6-дихлорфенил)-4-имино-7-[(2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-ил)амино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он. WEE1-2 был описан в международной публикации PCT № WO2008/153207 и в публикации США US2011-0135601, которые полностью включены в настоящее описание в качестве ссылок в полном объеме. Кристаллические формы WEE1-2 описаны в международной публикации № WO2009/151997 и в публикации США US2011-0092520.
Соединения по настоящему изобретению могут иметь асимметричные центры, хиральные оси и хиральные плоскости (как описано в: E.L. Eliel and S.H. Wilen, Stereochemistry of Carbon Compounds, John Wiley & Sons, New York, 1994, страницы 1119-1190), и встречаются в виде рацематов, рацемических смесей и в виде отдельных диастереомеров, со всеми их возможными изомерами и смесями, включая оптические изомеры, причем все такие стереоизомеры включены в настоящее изобретение. Кроме того, соединения, описанные в настоящем описании, могут существовать в качестве таутомеров, и предполагается, что обе таутомерные формы входят в объем изобретения, даже если изображена только одна таутомерная структура.
В соединениях, описанных в рамках настоящего изобретения, атомы могут проявлять их естественную распространенность, или один или несколько атомов могут быть искусственно обогащены конкретным изотопом, имеющим такое же атомное число, но атомную массу или массовое число, отличающееся от атомной массы или массового числа, преимущественно встречающихся в природе. Предполагается, что настоящее изобретение включает все подходящие изотопные варианты соединений, описанных в настоящем описании. Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий представляет собой преобладающий изотоп водорода, встречающийся в природе. Обогащение дейтерием может обеспечить определенные терапевтические преимущества, такие как увеличение времени полужизни in vivo или снижение требуемой дозировки, или может обеспечить соединение, пригодное в качестве стандарта для охарактеризации биологических образцов. Изотопно обогащенные соединения, описанные в настоящем описании, можно получать без излишнего экспериментирования обычными способами, хорошо известными специалистам в данной области, или способами, аналогичными тем, которые описаны в настоящем описании в разделе «Схемы и примеры», с использованием соответствующих изотопно обогащенных реагентов и/или промежуточных соединений.
Ингибиторы WEE1 по настоящему изобретению также могут существовать в виде различных кристаллов, аморфных веществ, фармацевтически приемлемых солей, гидратов и сольватов. Кроме того, ингибиторы WEE1 по настоящему изобретению могут быть предоставлены в форме пролекарств. В целом, такие пролекарства представляют собой функциональные производные ингибиторов WEE1 по настоящему изобретению, которые могут без труда преобразовываться в соединения, которые требуются живым организмам. Соответственно, в способе лечения различных злокачественных опухолей по изобретению термин «введение» включает не только введение определенного соединения, но также введение соединения, которое после введения пациенту может преобразовываться в конкретное соединение в живых организмах. Общепринятые способы выбора и получения подходящих пролекарственных производных описаны, например, в «Design of Prodrugs», ed. H. Bundgaard, Elsevier, 1985, которая включена в настоящее описание, как его часть, в качестве ссылки в полном объеме. Метаболиты соединения могут включать активные соединения, которые продуцируются при помещении соединения в биологическую среду, и они входят в объем соединения по изобретению.
Определение уровней экспрессии биомаркера
A. Способ количественного определения биомаркера
В одном варианте осуществления изобретение относится к прогностическому биомаркеру PKMYT1, экспрессия которого чувствительна к ингибированию WEE1 ингибитором WEE1. Уровни экспрессии прогностического биомаркера в образце можно определить с помощью средств, известных в данной области. Уровень экспрессии можно определить путем выделения и определения уровня (т.е. количества) нуклеиновой кислоты, транскрибированной с биомаркера. Альтернативно или дополнительно, можно определять уровень определенных белков, кодируемых биомаркером.
Уровень экспрессии биомаркера можно определить путем определения количества мРНК или полинуклеотидов, происходящих из нее, присутствующих в образце. Можно использовать любой способ определения уровней РНК. Например, РНК выделяют из образца и отделяют на агарозном геле. Затем отделенную РНК переносят на твердую подложку, такую как фильтр. Затем нуклеиновокислотные зонды, соответствующие одному или нескольким маркерам, гибридизируют на фильтре норзерн-гибридизацией, и определяют количество происходящей из маркера РНК. Такое определение может быть визуальным или автоматизированнным, например, с использованием денситометра. Другим способом определения уровней РНК является использование дот-блота или слот-блота. В этом способе осуществляют мечение РНК или происходящей из нее нуклеиновой кислоты из образца. Затем РНК или происходящую из нее нуклеиновую кислоту гибридизуют на фильтре, содержащем олигонуклеотиды, происходящие из одного или нескольких маркерных генов, причем олигонуклеотиды помещают на фильтре в дискретных легко идентифицируемых областях. Гибридизацию, или ее отсутствие, меченой РНК со связанными с фильтром олигонуклеотидами определяют визуально или деситометром. Полинуклеотиды можно метить с использованием радиоактивной метки или флуоресцентной (т.е. видимой) метки.
Экспрессию биомаркерного гена в ряде образцов ткани можно охарактеризовывать с использованием «тканевой матрицы» (Kononen et al., Nat. Med, 1998, 4(7):844-847). В тканевой матрице множество образцов ткани можно оценивать на одном и том же микрочипе. Тканевая матрица обеспечивает возможность выявления in situ уровней РНК и белка; последовательные срезы обеспечивают возможность одновременного анализа множества образцов.
Эти примеры не предназначены для ограничения, поскольку в данной области известны другие способы определения количества РНК.
B. Микрочипы
В некоторых вариантах осуществления для измерения экспрессии можно использовать полинуклеотидные микрочипы с тем, чтобы одновременно оценивать статус экспрессии каждого биомаркера. Когда используется этот способ измерения, то микрочип предпочтительно содержит по меньшей мере 2, 3, 4, 5 или более биомаркеров, или все биомаркеры, или любую комбинацию биомаркеров, идентифицированных как классификационно-информативные в пределах подгруппы индивидуумов. Действительное число информативных биомаркеров, которое содержит микрочип, варьирует в зависимости от конкретного представляющего интерес состояния, числа идентифицированных биомаркеров и, необязательно, числа информативных биомаркеров, для которых обнаружено, что они приводят к наименьшей ошибке I типа, ошибке II типа, или ошибке I типа и II типа при определении конечного фенотипа. Как используют в настоящем описании, термин «ошибка I типа» означает ложноположительный результат и «ошибка II типа» означает ложноотрицательный результат; в примере прогнозирования ответа пациента на лечение при воздействии ингибитора CDK, ошибка I типа представляет собой ошибочную охарактеризацию индивидуума с терапевтическим с ответом на ингибитор CDK как не отвечающего на лечение ингибитором CDK, и ошибка II типа представляет собой ошибочную охарактеризацию индивидуума с отсутствием ответа на ингибитор CDK как имеющего ответ на лечение.
Как используют в конкретном варианте осуществления, изобретение относится к полинуклеотидным микрочипам, в которых биомаркеры, идентифицированные для конкретной рассматриваемой подгруппы, составляют по меньшей мере 50%, 60%, 70%, 80%, 85%, 90%, 95% или 98% зондов на указанном чипе. В другом конкретном варианте осуществления микрочип содержит множество зондов, причем указанное множество зондов включает зонды, комплементарные и гибридизующиеся по меньшей мере с 75% биомаркеров, информативных в отношении воздействия/прогноза для ингибитора WEE1, идентифицированных для конкретной подгруппы пациентов. Безусловно, микрочипы по изобретению могут содержать зонды, комплементарные и способные к гибридизации с биомаркерами, информативными в отношении прогнозирования/оценки, для множества подгрупп индивидуумов или для каждой подгруппы индивидуумов, идентифицированных для конкретного состояния. Далее, микрочип по изобретению содержит множество зондов, комплементарных и гибридизующихся по меньшей мере с 75% биомаркеров, информативных в отношении прогноза/оценки для ингибитора WEE1, идентифицированных для каждой подгруппы индивидуумов, идентифицированных для представляющего интерес состояния, и где указанные зонды, в целом, составляют по меньшей мере 50% зондов на указанном микрочипе.
В еще одном конкретном варианте осуществления микрочип представляет собой коммерчески доступный кДНК-микрочип, который содержит по меньшей мере два биомаркера, идентифицированных способами, описанными в настоящем описании. Предпочтительно, коммерчески доступный кДНК-микрочип содержит все биомаркеры, идентифицированных способами, описанными в настоящем описании, как являющиеся информативными для подгруппы пациентов с конкретным состоянием. Однако такой микрочип может содержать по меньшей мере 1, 2, 3, 4 или 5 таких маркеров, вплоть до максимального числа идентифицированных маркеров.
Любые из микрочипов, описанных в настоящем описании, могут быть предоставлены в герметичном контейнере в наборе.
C. Полинуклеотиды, используемые для количественного определения продуктов прогностического биомаркера
Также предусматриваются полинуклеотиды, способные специфически или селективно связываться с мРНК-транскриптами, кодирующими полипептидный прогностический биомаркер PKMYT1 по изобретению. Например, в соответствии с изобретением являются пригодными олигонуклеотиды, кДНК, ДНК, РНК, продукты ПЦР, синтетическая ДНК, синтетическая РНК или другие комбинации встречающихся в природе или модифицированных нуклеотидов, которые специфически и/или селективно гибридизируются с одним или несколькими РНК-продуктами прогностического биомаркера по изобретению.
В предпочтительном варианте осуществления используют олигонуклеотиды, кДНК, ДНК, РНК, продукты ПЦР, синтетическую ДНК, синтетическую РНК или другие комбинации встречающихся в природе или модифицированных нуклеотидов, которые как специфически, так и селективно гибридизируются с одним или несколькими РНК-продуктами прогностического биомаркера по изобретению.
Для определения (высокого или низкого) уровня экспрессии PKMYT1 при применении настоящего изобретения на практике можно использовать любой способ, известный в данной области. В одном варианте осуществления изобретения используют экспрессию, основанную на выявлении РНК, которая гибридизируется с геном, идентифицированным и описанным в настоящем описании. Это легко осуществить любыми способами выявления или амплификации РНК, известными или признанными в качестве эквивалентных в данной области, такими как, но не ограничиваясь ими, ПЦР с обратной транскрипцией и способы выявления присутствия или отсутствия стабилизирующих или дестабилизирующих РНК последовательностей.
Альтернативно, можно использовать экспрессию, основанную на определении статуса ДНК. Выявление ДНК идентифицированного гена можно использовать для генов, увеличенная экспрессия которых коррелирует с конкретным исходом. Это может быть без труда осуществлено способами на основе ПЦР, известными в данной области, включая, но не ограничиваясь этим, Q-ПЦР. Напротив, выявление ДНК амплифицированного идентифицируемого гена можно использовать для генов, увеличенная экспрессия которых коррелирует с конкретным исходом лечения. Это можно без труда осуществить с помощью основанных на ПЦР способов флуоресцентной гибридизации in situ (FISH) и гибридизации хромосом in situ (CISH), известными в данной области.
D. Способы измерения продуктов РНК биомаркера
1. ПЦР в реальном времени
На практике, анализ экспрессии, основанный на генной экспрессии, в основе которого лежит небольшое число генов, т.е. примерно от 1 до 3000 генов, можно осуществлять с относительно небольшим усилием с использованием существующей технологии количественной ПЦР в реальном времени, известной в клинических лабораториях. Количественная ПЦР в реальном времени измеряет накопление продукта ПЦР посредством флуорогенного зонда с двойным мечением. Можно использовать разнообразные способы нормализации, такие как внутренний конкурент для каждой последовательности-мишени, ген нормализации, содержащийся внутри образца, или ген домашнего хозяйства. Достаточное количество РНК для ПЦР в реальном времени можно выделить из низкомиллиграммовых количеств, взятых у индивидуума. В настоящее время можно использовать количественные термоциклеры с микрожидкостными картами, предварительно загруженными реагентами, что делает повседневное клиническое применение анализов на основе мультигенной экспрессии реалистичной целью.
Генные маркеры для прогностического биомаркера по изобретению или их подгруппа, которые анализируют в соответствии с настоящим изобретением, обычно представлены в форме общей РНК или мРНК или обратно транскрибированной тотальной РНК или мРНК. Основные способы экстракции тотальной РНК и мРНК хорошо известны в данной области и описаны в стандартных монографиях по молекулярной биологии, включая Ausubel et al., Current Protocols of Molecular Biology, John Wiley and Sons (1997). Выделение РНК можно также проводить с использованием набора для очистки, комплекта буферов и протеазы от коммерческих производителей, таких как компании Qiagen (Valencia, CA) и Ambion (Austin, TX), в соответствии с инструкциями изготовителя.
Количественную ПЦР в реальном времени TAQman можно проводить с использованием коммерчески доступных реагентов для ПЦР (Applied Biosystems, Foster City, CA) и оборудования, такого как система для выявления последовательностей ABI Prism 7900HT Sequence Detection System (Applied Biosystems), в соответствии с инструкциями изготовителя. Система состоит из термоциклера, лазера, прибора с зарядовой связью (CCD), камеры и компьютера. Система амплифицирует образцы в 96-луночном или 384-луночном формате на термоциклере. Во время амплификации индуцируемый лазером сигнал собирается в реальном масштабе времени через оптоволоконные кабели для всех 96 лунок и осуществляется их детекции на CCD. Система включает программное обеспечение для эксплуатации прибора и для анализа данных.
На основании прогностического биомаркера, идентифицированного в рамках настоящего изобретения, можно использовать анализ ПЦР TAQman в реальном времени для проведения измерений экспрессии генов и выполнения способов классификации, описанных в настоящем описании. Как очевидно для специалиста в данной области, широкое разнообразие олигонуклеотидных праймеров и зондов, которые являются комлпементарными или гибридизируются с прогностическим биомаркером по изобретению, можно выбирать на основании последовательности транскрипта прогностического биомаркера.
2. Гибридизация на матрицах
Полинуклеотид, используемый для измерения продуктов РНК по изобретению, можно использовать в качестве нуклеиновокислотных элементов, стабильно связанных с подложкой, составляющих матрицу, в соответствии с одним аспектом изобретения. Длина нуклеиновокислотного элемента может находиться в диапазоне от 8 до 1000 нуклеотидов, и ее выбирают так, чтобы элемент был специфичным к РНК-продуктам прогностического биомаркера по изобретению. В одном варианте осуществления эти элементы являются селективными в отношении РНК-продуктов по изобретению. Нуклеиновокислотные элементы могут быть одно- или двунитевыми, и/или они могут представлять собой олигонуклеотиды или фрагменты ПЦР, амплифицированные с кДНК. Предпочтительно, олигонуклеотиды имеют длину приблизительно 20-30 нуклеотидов. EST предпочтительно имеют длину от 100 до 600 нуклеотидов. Специалисту в данной области понятно, что в качестве зонда на чипе можно использовать части экспрессируемых областей прогностического биомаркера по изобретению. Более конкретно, являются пригодными олигонуклеотиды, комплементарные генам по изобретению, и кДНК или EST, происходящие из генов по изобретению. Для чипов на основе олигонуклеотидов выбор олигонуклеотидов, соответствующих представляющему интерес гену, которые можно использовать в качестве зондов, хорошо понятен в данной области. Более конкретно, важно выбрать области, которые обеспечат возможность гибридизации с нуклеиновыми кислотами-мишенями. Важными факторами являются такие факторы как Tm олигонуклеотида, процентное содержание GC, доля вторичной структуры и длина нуклеиновой кислоты. См., например, патент США № 6551784.
3. Конструирование нуклеиновокислотной матрицы
В предлагаемых способах матрицу из нуклеиновокислотных элементов, стабильно связанных с поверхностью подложки, контактируют с образцом, содержащим нуклеиновые кислоты-мишени, в условиях гибридизации, достаточных для формирования профиля гибридизации комплементарных нуклеиновокислотных элементов/комплексов-мишеней, в которых один или несколько комплементарных нуклеиновокислотных элементов в уникальных положениях на матрице специфически гибридизуются с нуклеиновыми кислотами-мишенями. Идентичность нуклеиновых кислот-мишеней, которые гибридизуются, можно определять по положению нукелиновокислотных элементов на чипе.
Нуклеиновокислотные элементы можно получать с использованием общепринятых технологий, таких как полимеразная цепная реакция (ПЦР) и обратная транскрипция (RT). Эти способы сходны со способами, которые известны в настоящее время в данной области (см., например, PCR Strategies, Michael A. Innis (Editor), et al., 1995 и PCR: Introduction to Biotechniques Series, C. R. Newton, A. Graham, 1997). Амплифицированные нуклеиновые кислоты очищают способами, хорошо известными в данной области (например, колоночной очисткой или спиртовым осаждением). Нуклеиновую кислоту считают чистой, когда она была выделена так, чтобы быть по существу свободной от праймеров и неполных продуктов, продуцированных во время синтеза желаемой нуклеиновой кислоты. Предпочтительно, очищенная нуклеиновая кислота также по существу не содержит примесей, которые могут препятствовать или иным образом маскировать активность специфического связывания молекулы.
Матрица в соответствии с одним аспектом изобретения содержит множество нуклеиновых кислот, прикрепленных к одной поверхности подложки с плотностью, превышающей 20 различных нуклеиновых кислот/см2, причем каждая из нуклеиновых кислот прикреплена к поверхности подложки в неидентичной предварительно выбранной области (например, микрочип). Каждый связанный образец на матрице содержит композицию нуклеиновой кислоты известной идентичности, обычно с известной последовательностью, как более подробно описано ниже. В рамках изобретения можно использовать любой постижимый субстрат.
В одном варианте осуществления нуклеиновая кислота, прикрепленная к поверхности подложки, представляет собой ДНК. В одном варианте осуществления нуклеиновая кислота, прикрепленная к поверхности подложки, представляет собой кДНК или РНК. В другом варианте осуществления нуклеиновая кислота, прикрепленная к поверхности подложки, представляет собой кДНК, синтезированную полимеразной цепной реакцией (ПЦР). Обычно, нуклеиновокислотный элемент на чипе в соответствии с изобретением имеет длину по меньшей мере 10, 25, 50, 60 нуклеотидов. В одном варианте осуществления нуклеиновокислотный элемент имеет длину по меньшей мере 150 нуклеотидов. Предпочтительно, нуклеиновокислотный элемент имеет длину менее 1000 нуклеотидов. Предпочтительнее, нуклеиновокислотный элемент имеет длину менее 500 нуклеотидов.
В матрицах по изобретению композиции нуклеиновых кислот стабильно связаны с поверхностью подложки, причем подложка может представлять собой гибкую или жесткую подложку. Под «стабильно связанными» подразумевается, что каждый нуклеиновокислотный элемент сохраняет уникальное положение относительно подложки в условиях гибридизации и промывания. В сущности, образцы не ковалентно или ковалентно стабильно связаны с поверхностью подложки. Примеры нековалентной ассоциации включают неспецифическую адсорбцию, связывание на основе электростатических взаимодействий (например, взаимодействия ионных пар), гидрофобные взаимодействия, взаимодействия на основе водородных связей, специфическое связывание через специфически связывающий член пары, ковалентно связанный с поверхностью подложки, и т.п. Примеры ковалентного связывания включают ковалентные связи, образованные между нуклеиновыми кислотами и функциональной группой, присутствующей на поверхности жесткой подложки (например, -OH), где функциональная группа может быть встречающейся в природе или присутствующей в качестве члена внесенной линкерной группы, как более подробно описано ниже.
Количество нуклеиновой кислоты, присутствующее в каждой композиции, должно быть достаточным для обеспечения надлежащей гибридизации и выявления последовательностей нуклеиновой кислоты-мишени во время анализа, в котором используется матрица. В целом, количество каждого нуклеиновокислотного элемента, стабильно связанного с подложкой матрицы, составляет по меньшей мере приблизительно 0,001 нг, предпочтительно по меньшей мере приблизительно 0,2 нг и более предпочтительно по меньшей мере, примерно 0,05 нг, причем количество может достигать 1000 нг или выше, но обычно не превышает приблизительно 20 нг. Когда нуклеиновокислотный элемент наносят «пятнами» на подложку в пятне, имеющем в целом форму круга, диаметр «пятна» в основном находится в диапазоне примерно от 10 до 5000 мкм, обычно приблизительно от 20 до 2000 мкм и чаще приблизительно от 100 до 200 мкм.
На матрице могут присутствовать контрольные нуклеиновокислотные элементы, включая нуклеиновокислотные элементы, содержащие олигонуклеотиды или нуклеиновые кислоты, соответствующие геномной ДНК, генам домашнего хозяйства, векторным последовательностям, последовательности нуклеиновых кислот растений, генам отрицательного и положительного контроля и т.п. Контрольные нуклеиновокислотные элементы представляют собой калибровочные или контрольные гены, чья функция состоит не в указании на то, экспрессируется ли конкретный представляющий интерес «ключевой» ген, но скорее в предоставлении другой полезной информации, такой как фоновый или базовый уровень экспрессии.
На матрицу наносят пятнами другие контрольные нуклеиновые кислоты и их используют в качестве нуклеиновых кислот контроля экспрессии мишени и нуклеотидов контроля несоответствия оснований для мониторинга неспецифического связывания или перекрестной гибридизации с нуклеиновой кислотой в образец, отличной от мишени, на которую направлен зонд. Таким образом, зонды несоответствия оснований указывают на то, является ли гибридизация специфической или нет. Например, если присутствует мишень, абсолютно совпадающие зонды всегда должны быть более яркими, чем зонды несоответствия оснований. Кроме того, если присутствуют все контрольные несоответствия оснований, то зонды несоответствия оснований используют для обнаружения мутации.
Многочисленные способы можно использовать для прикрепления нуклеиновокислотных элементов по изобретению к субстрату (процесс, именуемый «нанесением пятнами»). Например, нуклеиновые кислоты прикрепляют с использованием технологии, например, описанной в патенте США № 5807522, который включен в настоящее описание в качестве ссылки для описания способов прикрепления полимеров. Альтернативно, нанесение пятнами можно проводить с использованием технологии контактного отпечатка, как известно в данной области.
Измерение экспрессии РНК-продукта по изобретению можно проводить с использованием тех полинуклеотидов, которые специфичны и/или селекивны в отношении РНК-продуктов по изобретению, для количественного определения экспрессии РНК-продукта. В конкретном варианте осуществления изобретения полинуклеотиды, которые специфичны и/или селективны в отношении РНК-продуктов, представляют собой зонды или праймеры. В одном варианте осуществления эти полинуклеотиды имеют форму нуклеиновокислотных зондов, которые могут быть нанесены пятнами на чип для измерения РНК из подлежащего измерению образца индивидуума. В другом варианте осуществления для измерения экспрессии РНК-продукта можно использовать коммерческие матрицы. В еще одном варианте осуществления полинуклеотиды, которые специфичны и/или селективны в отношении РНК-продуктов по изобретению, используют в форме зондов и праймеров в таких технологиях, как количественная ПЦР в реальном времени, с использованием, например, технологии SYBR®Green, или с использованием технологий TaqMan® или молекулярных маяков, где используемые полинуклеотиды применяют в форме прямого праймера, обратного праймера, меченого зонда TaqMan или меченого зонда молекулярного маяка.
В вариантах осуществления, где предстоит анализ только одного или двух генов, нуклеиновая кислота, происходящая из клетки (клеток), предпочтительно может быть амплифицирована с использованием соответствующих праймеров с тем, чтобы амплифицировались только подлежащие анализу гены, для уменьшения фоновых сигналов от других генов, экспрессируемых в клетках молочной железы. Альтернативно, когда анализу подлежит множество генов или когда используется очень мало клеток (или одна клетка), то нуклеиновую кислоту из образца можно подвергать глобальной амплификации перед гибридизацией с иммобилизованными полинуклеотидами. Безусловно, РНК или ее кДНК-аналог можно непосредственно метить и использовать без амплификации способами, известными в данной области.
4. Использование микрочипа
«Микрочип» представляет собой линейную или двухмерную матрицу из предпочтительно дискретных областей, причем каждая имеет определенную площадь на поверхности твердой подложки, такой как, но не ограничиваясь ими, стекло, пластмасса или синтетическая мембрана. Плотность дискретных областей на микрочипе определяется общими количествами подлежащих выявлению иммобилизованных полинуклеотидов на поверхности одной твердофазной подложки, предпочтительно по меньшей мере приблизительно 50/см2, более предпочтительно по меньшей мере примерно 100/см2, еще более предпочтительно по меньшей мере приблизительно 500/см2, но предпочтительно менее чем приблизительно 1000/см2. Предпочтительно, чипы содержат всего менее чем приблизительно 500, приблизительно 1000, приблизительно 1500, приблизительно 2000, приблизительно 2500 или приблизительно 3000 иммобилизованных полинуклеотидов. Как используют в настоящем описании, ДНК-микрочип представляет собой матрицу из олигонуклеотидов или полинуклеотидов, помещенных на чип или другие поверхности, используемую для гибридизации с амплифицированными или клонированными полинуклеотидами из образца. Поскольку положение каждой конкретной группы праймеров в матрице известно, то идентичность полинуклеотидов образца можно определить на основании их связывания с конкретным положением на микрочипе.
Определение уровней экспрессии генов можно осуществлять с использованием микрочипов. Как правило, могут быть включены следующие стадии: (a) получение образца мРНК от индивидуума и получение из него меченых нуклеиновых кислот («нуклеиновых кислот-мишеней» или «мишеней»); (b) контактирование нуклеиновых кислот-мишеней с матрицей в условиях, достаточных для связывания нуклеиновых кислот-мишеней с соответствующими зондами на матрице, например, путем гибридизации или специфического связывания; (c) необязательное удаление с матрицы не связавшихся мишеней; (d) выявление связавшихся мишеней и (e) анализ результатов, например, с использованием компьютерных способов анализа. Как используют в настоящем описании, термины «нуклеиновокислотные зонды» или «зонды» представляют собой нуклеиновые кислоты, прикрепленные к матрице, тогда как «нуклеиновые кислоты-мишени» представляют собой нуклеиновые кислоты, которые гибридизируются с матрицей.
Образец нуклеиновой кислоты может быть получен от подлежащего исследованию индивидуума с использованием либо «инвазивных», либо «неинвазивных» способов взятия образцов. Способ взятия образцов считают «инвазивным», если он вовлекает сбор нуклеиновых кислот из кожи или органов животного (включая мышь, человека, овцу, лошадь, корову, свинью, собаку или кошку). Примеры инвазивного способа взятия образцов включают взятие крови, взятие семенной жидкости, игольную биопсию, аспирацию плевральной полости, биопсию пупочного канатика. Примеры таких способов обсуждаются в Kim, et al., J. Virol., 1992, 66:3879-3882, Biswas, et al., Ann. NY Acad. Sci., 1990, 590:582-583, и Biswas, et al., J. Clin. Microbiol., 1991, 29:2228-2233.
Напротив, «неинвазивный» способ взятия образцов представляет собой способ, в котором молекулы нуклеиновой кислоты извлекаются из внутренней или наружной поверхности тела животного. Примеры «неинвазивного» способа взятия образцов включают «взятие мазка», забор слезной жидкости, слюны, мочи, калового материала и т.п.
В одном варианте осуществления настоящего изобретения у подлежащего исследованию индивидуума получают одну или несколько клеток, т.е. образец, и из клеток выделяют РНК. Также возможно получение образца клеток от индивидуума, а затем увеличение содержания в образце желаемого типа клеток. Например, клетки можно отделить от других клеток с использованием различных технологий, таких как выделение с помощью антитела, связывающегося с эпитопом на клеточной поверхности желаемого типа клеток. Когда желаемые клетки находятся в солидной ткани, то конкретные клетки можно рассекать, например, микрорассечением или микрорассечением лазерным захватом (LCM) (см., например, Bonner, et al., Science, 1997, 278:1481, Emmert-Buck, et al., Science, 1996, 274:998, Fend, et al., Am. J. Path., 1999, 154:61, и Murakami, et al., Kidney Hit., 2000, 58:1346.
РНК можно экстрагировать из образцов ткани или клеток разнообразными способами, например, лизисом тиоцианатом гуанидия с последующим центрифугированием в CsCl (Chirgwin, et al., Biochemistry, 1979, 18:5294-5299). РНК из одиночных клеток можно получить, как описано в способах получения библиотек кДНК из одиночных клеток (см., например, Dulac, Curr. Top. Dev. Biol., 1998, 36:245, и Jena, et al., J. Immunol. Methods, 1996, 190:199).
В образце РНК можно дополнительно увеличить содержание конкретного типа. В одном варианте осуществления, например, из образца РНК можно выделять поли(A)+РНК. В другом варианте осуществления в популяции РНК можно увеличить содержание представляющих интерес последовательностей праймер-специфическим синтезом кДНК или множественными циклами линейной амплификации на основе синтеза кДНК и направляемой матрицей транскрипцией in vitro (см., например, Wang, et al., Proc. Natl. Acad. Sci. USA, 1989, 86:9717; Dulac, et al., выше; Jena, et al., выше). Кроме того, популяцию РНК, обогащенную или не обогащенную конкретными типами или последовательностями, можно далее амплифицировать разнообразными способами амплификации, включая ПЦР, лигазную цепную реакцию (LCR) (см., например, Wu and Wallace, Genomics, 1989, 4:560; Landegren, et al., Science, 1988, 241:1077), самоподдерживающуюся репликацию последовательностей (SSR) (см., например, Guatelli, et al., Proc. Natl. Acad. Sci. USA, 1990, 87:1874), амплификацию последовательностей на основе нуклеиновых кислот (NASBA) и транскрипционную амплификацию (см., например, Kwoh, et al., Proc. Natl. Acad. Sci. USA, 1989, 86:1173). Способы ПЦР хорошо известны в данной области (см., например, PCR Technology: Principles and Applications for ДНК Amplification, ed. H. A. Erlich, Freeman Press, N.Y., N.Y., 1992; PCR Protocols: A Guide to Methods and Applications, eds. Innis, et al., Academic Press, San Diego, Calif., 1990; Mattila, et al., Nucleic Acids Res., 1991, 19:4967; Eckert, et al., PCR Methods and Applications, 1991, 1:17; PCR, eds. McPherson et al., IRL Press, Oxford; и патент США № 4683202). Способы амплификации описаны, например, в Ohyama, et al., BioTechniques, 2000, 29:530; Luo, et al., Nat. Med., 1999, 5:117; Hegde, et al., BioTechniques, 2000, 29:548; Kacharmina, et al., Meth. Enzymol., 1999, 303:3; Livesey, et al., Curr. Biol., 2000, 10:301; Spirin, et al., Invest. Ophtalmol. Vis. Sci., 1999, 40:3108; и Sakai, et al., Anal. Biochem., 2000, 287:32. Амплификацию РНК и синтез кДНК можно также проводить в клетках in situ (см., например, Eberwine, et al., Proc. Natl. Acad. Sci. USA, 1992, 89:3010).
В еще одном варианте осуществления изобретения всю или часть выявленной маркерной последовательности можно амплифицировать и выявлять такими способами, как полимерназная цепная реакция (ПЦР) и ее варианты, такие как, но не ограничиваясь ими ПЦР (Q-ПЦР), ПЦР с обратной транскрипцией (ОТ-ПЦР), и ПЦР в реальном времени, необязательно, ОТ-ПЦР в реальном времени. В таких способах используют один или два праймера, которые являются комплементарными частям описанной последовательности, где праймеры используют в качестве затравки для синтеза нуклеиновых кислот.
Вновь синтезированные нуклеиновые кислоты необязательно метят, и их можно выявлять прямо или путем гибридизации с полинуклеотидом по изобретению.
Молекулы нуклеиновых кислот можно метить для обеспечения возможности выявления гибридизации молекул нуклеиновых кислот с микрочипом. Иными словами, зонд может содержать элемент генерирующей сигнал системы и, таким образом, он поддается выявлению, либо прямо, либо через комбинированное действие с одним или несколькими дополнительными элементами продуцирующей сигнал системы. Например, нуклеиновые кислоты можно метить флуоресцентно меченым dNTP (деоксирибонуклеотидом трифосфатом) (см., например, Kricka, Nonisotopic DNA Probe Techniques, Academic Press San Diego, Calif., 1992), биотинилированными dNTP или rNTP с последующим добавлением меченого стрептавидина, хемилюминесцентными метками или изотопами. Другой пример меток включает «молекулярные маяки», как описано в публикации Tyagi and Kramer, Nature Biotech., 1996, 14:303. Вновь синтезированные нуклеиновые кислоты можно контактировать с полинуклеотидами (содержащими последовательности) по изобретению в условиях, которые обеспечивают возможность их гибридизации. Гибридизацию также можно определять, например, с помощью плазмонного резонанса (см., например, Thiel, et al., Anal. Chem., 1997, 69:4948).
В одном варианте осуществления множество, например, два набора нуклеиновых кислот-мишеней метят и используют в одной реакции гибридизации («мультиплексный» анализ). Один набор нуклеиновых кислот может соответствовать РНК из одной клетки, а другой набор нуклеиновых кислот может соответствовать РНК из другой клетки. Множество наборов нуклеиновых кислот можно метить различными метками, такими как различные флуоресцентные метки (например, флуоресцеин и родамин), которые имеют различные спектры эмиссии, чтобы их можно было различить. Затем наборы можно смешивать и одновременно гибридизировать на одном микрочипе (см., например, публикацию Shena, et al., Science, 1995, 270:467-470).
Ряд различных конфигураций микрочипов и способов их получения известен специалистам в данной области и описан в патентах США № 5242974; 5384261; 5405783; 5412087; 5424186; 5429807; 5436327; 5445934; 5556752; 5405783; 5412087; 5424186; 5429807; 5436327; 5472672; 5527681; 5529756; 5545531; 5554501; 5561071; 5571639; 5593839; 5624711; 5700637; 5744305; 5770456; 5770722; 5837832; 5856101; 5874219; 5885837; 5919523; 6022963; 6077674 и 6156501; Shena, et al., Tibtech 16:301, 1998; Duggan, et al., Nat. Genet. 21:10, 1999; Bowtell, et al., Nat. Genet. 21:25, 1999; Lipshutz, et al., 21 Nature Genet. 20-24, 1999; Blanchard, et al., 11 Biosensors and Bioelectronics, 687-90, 1996; Maskos, et al., 21 Nucleic Acids Res. 4663-69, 1993; Hughes, et al., Nat. Biotechol. (2001) 19:342, содержание которых включено в настоящую заявку в качестве ссылки. Патенты, в которых описаны способы использования матриц в различных способах применения, включают: патенты США № 5143854; 5288644; 5324633; 5432049; 5470710; 5492806; 5503980; 5510270; 5525464; 5547839; 5580732; 5661028; 5848659 и 5874219, содержание которых включено в настоящую заявку в качестве ссылки.
В одном варианте осуществления олигонуклеотидную матрицу можно синтезировать на твердой подложке. Иллюстративные твердые подложки включают стекло, пластмассу, полимеры, металлы, метоллоиды, керамику, органические соединения и т.д. Используя технологии маскировки чипов и фотопротективной химии, можно создавать упорядоченные матрицы нуклеиновокислотных зондов. Эти матрицы, которые известны, например, как «чипы ДНК» или полимерные матрицы с высококрупномасштабной иммобилизацией (матрицы «VLSIPS®»), могут включать миллионы определенных областей зондов на субстрате, имеющих площадь приблизительно от 1 см2 до нескольких см2, тем самым, включающих от малого количества до миллионов зондов (см., например, патент США № 5631734).
Для сравнения уровней экспрессии меченые нуклеиновые кислоты могут контактировать с матрицей в условиях, достаточных для связывания между нуклеиновой кислотой-мишенью и зондом на чипе. В одном варианте осуществления условия гибридизации могут быть выбраны для обеспечения желаемого уровня специфичности гибридизации; иными словами, условия, достаточные для осуществления гибридизации между мечеными нуклеиновыми кислотами и зондами на микрочипе.
Гибридизацию можно проводить в условиях, обеспечивающих возможность по существу специфической гибридизации. Длина и содержание GC в нуклеиновой кислоте определяют термическую точку плавления и, таким образом, условия гибридизации, необходимые для достижения специфической гибридизации зонда с нуклеиновой кислотой-мишенью. Эти факторы хорошо известны специалисту в данной области и могут быть также исследованы в анализах. Обширное руководство по гибридизации нуклеиновых кислот можно найти в монографии Tijssen, et al., Laboratory Techniques in Biochemistry and Molecular Biology, Vol. 24: Hybridization with Nucleic Acid Probes, P. Tijssen, ed. Elsevier, N.Y., 1993.
Описанные выше способы приводят к получению профилей гибридизации меченых нуклеиновых кислот-мишеней на поверхности матрицы. Итоговые профили гибридизации меченых нуклеиновых кислот можно визуализировать или выявлять различными путями, причем конкретный способ выявления выбирают, исходя из конкретной метки нуклеиновой кислоты-мишени. Репрезентативные способы выявления включают подсчет сцинтилляции, авторадиографию, измерение флуоресценции, калориметрическое измерение, измерение световой эмиссии, рассеяние света и т.п.
В одном таком способе выявления используется сканнер матриц, который является коммерчески доступным (Affymetrix, Santa Clara, Calif.), например, 417® Arrayer, 418® Array Scanner, или Agilent GeneArray® Scanner. Этот сканнер контролируется системным компьютером и простыми в использовании программными инструментами. Выходной сигнал может прямо импортироваться или непосредственно считываться разнообразными программными приложениями. Иллюстративные сканирующие устройства описаны, например, в патентах США № 5143854 и 5424186.
Дозировка и пути введения
В отношении ингибиторов WEE1 по изобретению, можно выбирать различные формы получения, и их примеры включают пероральные препараты, такие как таблетки, капсулы, порошки, гранулы или жидкости, или стерилизованные жидкие парентеральные препараты, такие как растворы или суспензии, суппозитории, мази и т.п. Ингибиторы WEE1 доступны в виде фармацевтически приемлемых солей. Ингибиторы WEE1 по изобретению получают с фармацевтически приемлемыми носителями или разбавителями.
Термин «фармацевтически приемлемая соль», как используют в настоящем описании, означает обычную фармацевтически приемлемую соль. Например, когда соединение имеет гидроксильную группу или кислотную группу, такую как карбоксильная группа и тетразолильная группа, то оно может образовывать основно-аддитивную соль по гидроксильной группе или кислотной группе; или когда соединение имеет аминогруппу или основную гетероциклильную группу, то оно может образовывать кислотно-аддитивную соль по аминогруппе или основной гетероциклильной группе.
Основно-аддитивные соли включают, например, соли щелочных металлов, такие как соли натрия, соли калия; соли щелочноземельных металлов, такие как соли кальция, соли магния; соли аммония и соли органических аминов, такие как соли триметиламина, соли триэтиламина, соли дициклогексиламина, соли этаноламина, соли диэтаноламина, соли триэтаноламина, соли прокаина, соли N,N'-дибензилэтилендиамина.
Кислотно-аддитивные соли включают, например, соли неорганических кислот, такие как гидрохлориды, сульфаты, нитраты, фосфаты, перхлораты; соли органических кислот, такие как малеаты, фумараты, тартраты, цитраты, аскорбаты, трифторацетаты и сульфонаты, такие как метансульфонаты, изетионаты, бензолсульфонаты, п-толуолсульфонаты.
Термин «фармацевтически приемлемый носитель или разбавитель» относится к эксципиентам (например, жиры, пчелиный воск, полутвердые и жидкие полиолы, натуральные или гидрогенизированные масла и т.д.), воде (например, дистиллированная вода, в частности, дистиллированная вода для инъекций и т.д.), физиологическому солевому раствору, спирту (например, этанол), глицерину, полиолам, водному раствору глюкозы, манниту, растительным маслам и т.д. и добавкам (например, разрыхлитель, дезинтегрирующее вещество, связующее вещество, смазывающее вещество, смачивающее вещество, стабилизатор, эмульгатор, диспергирующее вещество, консервант, подсластитель, краситель, вкусовая добавка или ароматизатор, концентрирующее вещество, разбавитель, буферное вещество, растворитель или солюбилизирующее вещество, химическое соединение для достижения эффекта хранения, соль для модификации осмотического давления, вещество покрытия или антиоксидант и т.п.).
Твердые препараты можно получать в формах таблетки, капсулы, гранулы и порошка без каких-либо добавок или получать, используя соответствующие носители (добавки). Примеры таких носителей (добавок) могут включать сахариды, такие как лактоза или глюкоза; кукурузный, пшеничный или рисовый крахмал; жирные кислоты, такие как стеариновая кислота; неорганические соли, такие как метасиликат алюминат магния или безводный фосфат кальция; синтетические полимеры, такие как поливинилпирролидон или полиалкиленгликоль; спирты, такие как стеариловый спирт или бензиловый спирт; синтетические производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, этилцеллюлоза или гидроксипропилметилцеллюлоза, и другие обычно используемые добавки, такие как желатин, тальк, растительное масло и аравийская камедь.
Эти твердые препараты, такие как таблетки, капсулы, ранулы и порошки, как правило, могут содержать, например, от 0,1 до 100% по массе, и предпочтительно, от 5 до 98% по массе ингибитора WEE1, в расчете на общую массу каждого препарата.
Жидкие препараты получают в формах суспензии, сиропа, препарата для инъекций и капельной инфузии (жидкость для внутривенного введения) с использованием соответствующих добавок, которые обычно используются в жидких препаратах, таких как вода, спирт или растительное масло, такое как соевое масло, арахисовое масло и кунжутное масло.
В частности, когда препарат вводят парентерально в форме внутримышечной инъекции, внутривенной инъекции или подкожной инъекции, соответствующий растворитель или разбавитель может быть проиллюстрирован дистиллированной водой для инъекций, водным раствором лидокаина гидрохлорида (для внутримышечной инъекции), физиологическим солевым раствором, водным раствором глюкозы, этанолом, полиэтиленгликолем, пропиленгликолем, жидкостью для внутривенной инъекции (например, водный раствор лимонной кислоты, цитрат натрия и т.п.) или электролитным раствором (для внутривенной капельной инфузии и внутривенной инъекции), или их смешанным раствором.
Такой инъекционный препарат может быть представлен в форме заранее приготовленного раствора или в форме порошка как такового или порошка в смеси с подходящим носителем (добавкой), который растворяют во время применения. Инъекционная жидкость может содержать, например, от 0,1 до 10% по массе активного ингредиента в расчете на общую массу каждого препарата.
Жидкие препараты, такие как суспензия или сироп для перорального введения, могут содержать, например, от 0,1 до 10% по массе активного ингредиента в расчете на общую массу каждого препарата.
Каждый препарат по изобретению может быть изготовлен специалистом в данной области в соответствии с общепринятыми способами или обычными технологиями. Например, если препарат представляет собой пероральный препарат, то его можно получать, например, путем смешения соответствующего количества соединения по изобретению с соответствующим количеством лактозы и заполнением этой смеси твердых желатиновых капсул, которые пригодны для перорального введения. С другой стороны, если препарат, содержащий соединение по изобретению, представляет собой препарат для инъекций, его можно получать, например, путем смешения соответствующего количества соединения по изобретению с соответствующим количеством 0,9% физиологического солевого раствора и заполнения этой смесью флаконов для инъекций.
Компоненты по настоящему изобретению можно вводить млекопитающим, включая людей, либо отдельно, либо в комбинации с фармацевтически приемлемыми носителями, эксципиентами или разбавителями, в фармацевтической композиции, в соответствии со стандартной фармацевтической практикой. Компоненты можно вводить перорально или парентерально, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, ректальный и местный пути введения.
Подходящие дозировки известны практикующим медицинским работникам и, безусловно, зависят от конкретного болезненного состояния, конкретной активности вводимой композиции и конкретного пациента, подвергаемого лечению. В некоторых случаях для достижения желаемого терапевтического количества может быть необходимо проведение повторного введения, т.е. повторных индивидуальных введений конкретной контролируемой или отмеренной дозы, причем индивидуальные введения повторяют до достижения желаемой суточной дозы или эффекта. Дополнительная информация о подходящих дозировках представлена ниже.
Термин «введение» и его варианты (например, «проведение введения» соединения) при указании на компонент по изобретению означает внедрение компонента или пролекарства компонента в систему нуждающегося в лечении животного. Когда компонент по изобретению или его пролекарство предоставлены в комбинации с одним или несколькими другими активными веществами (например, ингибитор WEE1), подразумевается, что «введение» и каждый из его вариантов включают одновременное и последовательное внедрение компонента или его пролекарства и других средств.
Как используют в настоящем описании, термин «композиция» охватывает продукт, содержащий указанные ингредиенты в указанных количествах, а также любой продукт, который, прямо или косвенно, получен в результате комбинирования указанных ингредиентов в указанных количествах.
Как используют в настоящем описании, термин «терапевтически эффективное количество» означает количество активного соединения или фармацевтического средства, которое вызывает биологический или терапевтический ответ в ткани, системе, организме животного или человека, искомое исследователем, ветеринаром, врачом или другим клиницистом. Это включает комбинированную терапию, включающую применение множества терапевтических средств, таких как комбинированное количество средств терапии первой и второй линии, где комбинированное количество достигает желаемого биологического ответа. Желаемый биологический ответ представляет собой частичное или полное ингибирование, задержку или предотвращение прогрессирования злокачественной опухоли, включая метастазирование злокачественной опухоли; ингибирование, задержку или предотвращение рецидива злокачественной опухоли, включая метастазирование злокачественной опухоли; или предотвращение возникновения или развития рака (химиопрофилактика) у млекопитающего, например человека.
Подходящее количество ингибитора WEE1 вводят пациенту, подвергаемому лечению злокачественной опухоли. В одном варианте осуществления ингибитор WEE1 вводят в дозах в диапазоне приблизительно от 100 мг в сутки до 250 мг в сутки. В одном варианте осуществления изобретения ингибитор WEE1 вводят два раза в сутки (BID), в течение курса из двух с половиной суток с введением всего 5 доз. В другом варианте осуществления изобретения ингибитор WEE1 вводят один раз в сутки (QD) в течение курса из двух суток с введением всего 2 доз.
В одном варианте осуществления изобретения ингибитор WEE1 можно вводить 5 раз в неделю. В другом варианте осуществления изобретения ингибитор WEE1 можно вводить 2 раза в неделю.
Показания
В одном варианте осуществления настоящее изобретение представляет собой способ лечения ингибитором WEE1 пациента, у которого диагностирована злокачественная опухоль, ассоциированная с WEE1, где указанный пациент характеризуется как имеющий низкую экспрессию PKMYT1. Ингибитор WEE1 по изобретению оказывает эффект ингибирования киназы, в частности, эффект ингибирования киназы WEE1, и поэтому по существу пригоден в качестве лекарственного средства против различных форм злокачественной опухоли, ассоциированной с киназой WEE1. Примеры злокачественной опухоли, ассоциированной с киназой WEE1, включают, но не ограничиваются ими, злокачественную опухоль головного мозга, рак головы и шеи, рак пищевода, рак щитовидной железы, мелкоклеточный рак легких, немелкоклеточный рак легких, рак молочной железы, рак легких, рак желудка, рак желчного пузыря/желчных протоков, рак печени, рак поджелудочной железы, рак толстой кишки, рак прямой кишки, рак яичников, хориокарциному, рак тела матки, рак шейки матки, рак почечной лоханки/уретры, рак мочевого пузыря, рак предстательной железы, рак полового члена, рак яичек, фетальную злокачественную опухоль, опухоль Вильмса, рак кожи, злокачественную меланому, нейробластому, остеосаркому, опухоль Юинга, саркому мягкой части, острый лейкоз, хронический лимфолейкоз, хронический миелоцитарный лейкоз, лимфому Ходжкина, или ингибиторы WEE1 полезны в качестве сенсибилизаторов для химиотерапии или лучевой терапии указанных форм рака.
В частности, ингибиторы WEE1 по изобретению полезны в качестве лекарственных средств, например, против рака молочной железы, рака легких, рака поджелудочной железы, рака толстой кишки, рака яичников, острого лейкоза, хронического лимфолейкоза, хронического миелоцитарного лейкоза, лимфомы Ходжкина, или в качестве сенсибилизаторов для химиотерапии или лучевой терапии указанных форм рака.
В дополнение к лечению указанных выше форм злокачественной опухоли, ассоциированных с киназой WEE1, ингибитор WEE1 также можно применять для лечения следующих форм злокачественной опухоли: сердца: саркома (ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома), миксома, рабдомиома, фиброма, липома и тератома; легких: бронхогенная карцинома (послоскоклеточная, недифференцированная мелкоклеточная, недифференцированная крупноклеточная, аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, саркома, лимфома, хондроматозная гамартома, мезотелиома; желудочно-кишечного тракта: пищевода (плоскоклеточный рак, аденокарцинома, лейомиосаркома, лимфома), желудка (карцинома, лимфома, лейомиосаркома), поджелудочной железы (аденокарцинома протоков, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), тонкой кишки (аденокарцинома, лимфома, карциноидные опухоли, саркома Капоши, лейомиома, гемангиома, липома, нейрофиброма, фиброма), толстой кишки (аденокарцинома, трубчатая аденома, ворсинчатая аденома, гамартома, лейомиома), ободочной кишки, ободочной и прямой кишки, прямой кишки; мочеполового тракта: почек (аденокарцинома, опухоль Вильмса [нефробластома], лимфома, лейкоз), мочевого пузыря и уретры (плоскоклеточная карцинома, переходноклеточная карцинома, аденокарцинома), предстательной железы (аденокарцинома, саркома), яичек (семинома, тератома, эмбриональная карцинома, тератокарцинома, хориокарцинома, саркома, карцинома интерстициальных клеток, фиброма, фиброаденома, аденоматоидные опухоли, липома); печени: гепатома (гепатоцеллюлярная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома, гемангиома; костей: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулярно-клеточная саркома), множественная миелома, злокачественная гигантоклеточная хордома, остеохондрома (костнохрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма, остеоидная остеома и гигантоклеточные опухоли; нервной системы: черепа (остеома, гемангиома, гранулома, ксантома, деформирующий остеит), мозговых оболочек (менингиома, менингиосаркома, глиоматоз), мозга (астроцитома, медуллобластома, глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома, олигодендроглиома, шваннома, ретинобластома, врожденные опухоли), нейрофиброма спинного мозга, менингиома, глиома, саркома); половой системы: матки (эндометриальная карцинома), шейки (карцинома шейки матки, предопухолевая дисплазия шейки матки), яичников (карцинома яичников [серозная цистаденокарцинома, слизистая цистаденокарцинома, неклассифицированная карцинома], гранулезно-текальноклеточная опухоль, опухоли из клеток Сертоли-Лейдига, дисгерминома, злокачественная тератома), вульвы (плоскоклеточная карцинома, внутриэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (светлоклеточная карцинома, плоскоклеточная карцинома, ботриоидной саркомы (эмбриональная рабдомиосаркома), фалоппиевых труб (карцинома); кроветворной системы: крови (миелоидный лейкоз [острый и хронический], острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, миелопролиферативные заболевания, множественная миелома, миелодиспластический синдром), болезнь Ходжкина, неходжкинская лимфома [злокачественная лимфома]; и кожи: злокачественная меланома, базальноклеточная карцинома, плоскоклеточная карцинома, саркома Капоши, диспластические невусы, липома, ангиома, дерматофиброма. Таким образом, термин «злокачественная клетка», как описано в настоящем описании, включает клетку, пораженную любым из указанных выше состояний.
Кроме того, в объем изобретения входит способ лечения или профилактики заболевания, в которое вовлечен ангиогенез, который состоит в введении млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества комбинации по настоящему изобретению. Глазные неоваскулярные заболевания являются примером состояний, при которых большую часть результирующего повреждения ткани можно связать с аберрантной инфильтрацией кровеносных сосудов в глазу (WO 2000/30651). Нежелательная инфильтрация может запускаться ишемической ретинопатией, такой как ретинопатия, которая развивается в результате диабетической ретинопатии, ретинопатии недоношенности, окклюзий вен сетчатки и т.д., или дегенеративными заболеваниями, такими как хороидальная неоваскуляризация, наблюдаемая при возрастной дегенерации желтого пятна. Таким образом, ингибирование роста кровеносных сосудов путем введения соединений по настоящему изобретению может предотвратить инфильтрацию кровеносных сосудов и предотвратить или излечить заболевания, в которые вовлечен ангиогенез, такие как глазные заболевания, такие как васкуляризация сетчатки, диабетическая ретинопатия, возрастная дегенерация желтого пятна и т.п.
Кроме того, в объем изобретения входит способ лечения или профилактики незлокачественного заболевания, в которое вовлечен ангиогенез, включая, но не ограничиваясь ими: глазные заболевания (такие как васкуляризация сетчатки, диабетическая ретинопатия и возрастная дегенерация желтого пятна), атеросклероз, артрит, псориаз, ожирение и болезнь Альцгеймера (Dredge, et al., Expert Opin. Biol. Ther., 2002, 2(8):953-966). В другом варианте осуществления способ лечения или профилактики заболевания, в которое вовлечен ангиогенез, включает: глазные заболевания (такие как васкуляризация сетчатки, диабетическая ретинопатия и возрастная дегенерация желтого пятна), атеросклероз, артрит и псориаз.
Кроме того, в объем изобретения входит способ лечения гиперпролиферативных расстройств, таких как рестеноз, воспаление, аутоиммунные заболевания и аллергия/астма.
Кроме того, в объем изобретения входит применение комбинации по настоящему изобретению для покрытия стентов и, поэтому, применение соединений по настоящему изобретению на покрытых стентах для лечения и/или профилактики рестеноза (WO 2003/032809).
Кроме того, в объем изобретения включено применение комбинации по настоящему изобретению для лечения и/или профилактики остеоартрита (WO 2003/035048).
Кроме того, в объем изобретения входит способ лечения гипоинсулинизма.
Изобретение иллюстрируется применением описанного выше ингибитора WEE1 для получения лекарственного препарата для лечения злокачественной опухоли, ассоциированной с WEE1.
Дополнительные средства против злокачественной опухоли
Ингибитор WEE1, вводимый в способах по настоящему изобретению, также можно применять в комбинации с дополнительными терапевтическими, химиотерапевтическими средствами и средствами против злокачественной опухоли. Дополнительная комбинация ингибитора WEE1 по настоящему изобретению с терапевтическими, химиотерапевтическими средствами и средствами против злокачественной опухоли входит в объем изобретения. Примеры таких средств могут быть найдены в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Специалист в данной области способен установить, какие комбинации средств могли бы быть полезны, исходя из конкретных характеристик лекарственных средств и имеющейся формы злокачественной опухоли. Такие дополнительные средства включают следующие средства: модуляторы рецепторов эстрогена, модуляторы рецепторов андрогена, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические средства, антипролиферативные средства, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA(3-гидрокси-3-метилглутарил-CoA)-редуктазы и другие ингибиторы ангиогенеза, ингибиторы протеазы ВИЧ, ингибиторы обратной транскриптазы, ингибиторы клеточной пролиферации и передачи сигналов выживания, бисфосфонаты, ингибиторы ароматазы, терапевтические средства на основе миРНК, ингибиторы γ-секретазы, средства, которые влияют на рецепторные тирозинкиназы (RTK), и средства, которые влияют на точки контроля клеточного цикла. Комбинация ингибитора mTOR и антагониста интегрина αvβ3 по настоящему изобретению может быть особенно полезна при совместном введении с лучевой терапией.
Термин «модуляторы эстрогеновых рецепторов» относится к соединениям, которые препятствуют или ингибируют связывание экстрогена с рецептором, независимо от механизма. Примеры модуляторов эстрогеновых рецепторов включают, но не ограничиваются ими, тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фулвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4-метил-2-[4-[2-(1-пиперидинил)этокси]фенил]-2H-1-бензопиран-3-ил]-фенил-2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646.
Термин «модуляторы андрогеновых рецепторов» относится к соединениям, которые препятствуют или ингибируют связывание андрогенов с рецептором, независимо от механизма. Примеры модуляторов андрогеновых рецепторов включают финастерид и другие ингибиторы 5α-редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абиратерон ацетат.
Термин «модуляторы ретиноидных рецепторов» относится к соединениям, которые препятствуют или ингибируют связывание ретиноидов с рецептором, независимо от механизма. Примеры таких модуляторов рецепторов ретиноидов включают бексаротен, третиноин, 13-цис-ретиноевую кислоту, 9-цис-ретиноевую кислоту, α-дифторметилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил) ретинамид и N-4-карбоксифенилретинамид.
«Цитотоксические/цитостатические средства» относятся к соединениям, которые вызывают гибель клеток или ингибируют клеточную пролиферацию, прежде всего, непосредственно препятствуя функционированию клетки, или препятствуя митозу клетки, включая алкилирующие средства, факторы некроза опухолей, интеркаляторы, соединения, активируемые гипоксией, ингибиторы микротрубочек/средства, стабилизирующие микротрубочки, ингибиторы митотических кинезинов, ингибиторы гистондеацетилазы, ингибиторы киназ, вовлеченных в митотическое прогрессирование, ингибиторы киназ, вовлеченных в пути передачи сигналов факторов роста и цитокинов, антиметаболиты, модификаторы биологической реакции, гормональные/антигормональные терапевтические средства, гематопоэтические факторы роста, направленные терапевтические средства на основе моноклональных антител, ингибиторы топоизомеразы, ингибиторы протеосомы, ингибиторы убикситинлигазы и ингибиторы киназы aurora.
Примеры цитотоксических/цитостатических средств включают, но не ограничиваются ими, сертенеф, кахектин, ифосфамид, тасонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдульцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, импросульфан тозилат, трофосфамид, нимустин, диброспидий хлорид, пумитепа, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофульвен, дексифосфамид, цис-аминдихлор(2-метил-пиридин)платину, бензилгуанин, глуфосфамид, GPX100, (транс,транс,транс)-бис-мю-(гексан-1,6-диамин)-мю-[диамин-платина(II)]бис[диамин(хлор)платины(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-деамино-3'-морфолино-13-деоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755, 4-демэтокси-3-деамино-3-азиридинил-4-метилсульфонилдаунорубицин (см. WO 00/50032), ингибиторы Raf-киназы (такие как Bay43-9006) и ингибиторы mTOR, такие как ридафоролимус, эверолимус, темсиролимус, сиролимус или аналог рапамицина.
Примером активируемого гипоксией соединения является тирапазамин.
Примеры ингибиторов протеосом включают, но не ограничиваются ими, лактацистин и MLN-341 (Velcade).
Примеры ингибиторов микротрубочек/средств, стабилизирующих микротрубочки, включают паклитаксел, виндезин сульфат, 3',4'-дидегидро-4'-деокси-8'-норвинкалейкобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4-метоксифенил)бензолсульфонамид, ангидровинбластин, N,N-диметил-L-валил-L-валил-N-метил-L-валил-L-пропил-L-пролин-т-бутиламид, TDX258, эпотилоны (см., например, патенты США № 6284781 и 6288237) и BMS188797. В одном варианте осуществления эпотилоны не включены в ингибиторы микротрубочек/средства, стабилизирующие микротрубочки.
Некоторыми примерами ингибиторов топоизомеразы являются топотекан, гикаптамин, иринотекан, рубитекан, 6-этоксипропионил-3',4'-O-эксо-бензилиденкартеузин, 9-метокси-N,N-диметил-5-нитропиразоло[3,4,5-kl]акридин-2-(6H)пропанамин, 1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':b,7]-индолизино[1,2b]хинолин-10,13(9H,15H)дион, луртотекан, 7-[2-(N-изопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозид фосфат, тенипозид, собузоксан, 2'-диметиламино-2'-деоксиэтопозид, GL331, N-[2-(диметиламино)этил]-9-гидрокси-5,6-диметил-6H-пиридо[4,3-b]карбазол-1-карбоксамид, асулакрин, (5a, 5aB, 8aa,9b)-9-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5-диметоксифенил]-5,5a,6,8,8a,9-гексогидрофуро(3',4':6,7)нафто(2,3-d)-1,3-диоксол-6-он, 2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[c]-фенантридиний, 6,9-бис[(2-аминоэтил)амино]бензо[g]изогуинолин-5,10-дион, 5-(3-аминопропиламино)-7,10-дигидрокси-2-(2-гидроксиэтиламинометил)-6H-пиразоло[4,5,1-de]акридин-6-он, N-[1-[2(диэтиламино)этиламино]-7-метокси-9-оксо-9H-тиоксантен-4-илметил]формамид, N-(2-(диметиламино)этил)акридин-4-карбоксамид, 6-[[2-(диметиламино)этил]амино]-3-гидрокси-7H-индено[2,1-c]хинолин-7-он и димесна.
Примеры ингибиторов митотических кинезинов и, в частности, человеческого митотического кинезина KSP, описаны в публикациях WO 2003/039460, WO 2003/050064, WO 2003/050122, WO 2003/049527, WO 2003/049679, WO 2003/049678, WO 2004/039774, WO 2003/079973, WO 2003/099211, WO 2003/105855, WO 2003/106417, WO 2004/037171, WO 2004/058148, WO 2004/058700, WO 2004/126699, WO 2005/018638, WO 2005/019206, WO 2005/019205, WO 2005/018547, WO 2005/017190, US 2005/0176776. В одном варианте осуществления ингибиторы митотических кинезинов включают, но не ограничиваются ими, ингибиторы KSP, ингибиторы MKLP1, ингибиторы CENP-E, ингибиторы MCAK и ингибиторы Rab6-KIFL.
Примеры «ингибиторов гистондеацетилазы» включают, но не ограничиваются ими, SAHA, TSA, оксамфлатин, PXD101, MG98 и скриптаид. Дополнительную ссылку на другие ингибиторы гистондеацетилазы можно найти в следующей публикации: Miller, T.A., et al., J. Med. Chem., 2003, 46(24):5097-5116.
«Ингибиторы киназ, вовлеченных в митотическое прогрессирование», включают, но не ограничиваются ими, ингибиторы киназы aurora, ингибиторы Polo-подобных киназ (PLK; в частности ингибиторы PLK-1), ингибиторы bub-1 и ингибиторы bub-R1. Примером «ингибитора киназы aurora» является VX-680.
«Антипролиферативные средства» включают антисмысловые РНК- и ДНК-олигонуклеотиды, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001, и антиметаболиты, такие как эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, фостеабин натрия гидрат, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-деокси-2'-метилиденцитидин, 2'-фторметилeн-2'-деоксицитиден, N-[5-(2,3-дигидро-бензофурил)сульфонил]-N'-(3,4-дихлорфенил)мочевина, N6-[4-деокси-4-[N2-[2(E),4(E)-тетрадекадиеноил]глициламино]-L-глицеро-B-L-манно-гептопиранозил]аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3H-пиримидинo[5,4-b][1,4]тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фторурацил, аланозин, сложный эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,11-диазатетрацикло(7.4.1.0.0)-тетрадека-2,4,6-триен-9-илуксусной кислоты, сваинсонин, лометрексол, декстразоксан, метиониназа, 2'-циано-2'-деокси-N4-пальмитоил-1-B-D-арабинофуранозилцитозин, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон и трастузумаб.
Примеры направленных терапевтических средств на основе моноклональных антител, включают терапевтические средства, которые имеют цитотоксические средства или радиоизотопы, прикрепленные к специфичному к злокачественной клетке или специфичному к клетке-мишени моноклональному антителу. Примеры включают Бекксар.
Термин «ингибиторы HMG-CoA-редуктазы» относится к ингибиторам 3-гидрокси-3-метилглутарил-CoA-редуктазы. Примеры ингибиторов HMG-CoA-редуктазы, которые можно применять, включают, но не ограничиваются ими, ловастатин (MEVACOR®; см. патенты США № 4231938, 4294926 и 4319039), симвастатин (ZOCOR®; см. патенты США № 4444784, 4820850 и 4916239), правастатин (PRAVACHOL®; см. патенты США № 4346227, 4537859, 4410629, 5030447 и 5180589), флувастатин (LESCOL®; см. патенты США № 5354772, 4911165, 4929437, 5189164, 5118853, 5290946 и 5356896), аторвастатин (LIPITOR®; см. патенты США № 5273995, 4681893, 5489691 и 5342952) и церивастатин (также известный как ривастатин и BAYCHOL®; см. патент США № 5177080). Структурные формулы этих и дополнительных ингибиторов HMG-CoA, которые можно применять в способах по настоящему изобретению, описаны на стр. 87 документа M. Yalpani, Cholesterol Lowering Drugs, Chemistry & Industry, 1996, pp. 85-89, и в патентах США № 4782084 и 4885314. Как используют в настоящем описании, термин ингибитор HMG-CoA-редуктазы включает все фармацевтически приемлемые лактоновые и открытые кислые формы (т.е., где лактоновое кольцо открыто с образованием свободной кислоты), а также солевые и сложноэфирные формы соединений, которые имеют активность ингибирования HMG-CoA-редуктазы, и поэтому, применение таких солей, сложных эфиров, открытых кислых и лактоновых форм включено в объем настоящего изобретения.
«Ингибитор пренил-протеинтрансферазы» относится к соединению, которое ингибирует любой или любую комбинацию ферментов пренил-протеинтрансфераз, включая фарнезил-протеинтрансферазу (FPT-аза), геранилгеранил-протеинтрансферазу типа I (GGPT-аза-I) и геранилгеранил-протеинтрансферазу типа-II (GGPT-аза-II, также называемая Rab GGPT-азой).
Примеры ингибиторов пренил-протеинтрансферазы можно найти в следующих публикациях и патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665, WO 98/28980, WO 98/29119, WO 95/32987, патент США № 5420245, патент США № 5523430, патент США № 5532359, патент США № 5510510, патент США № 5589485, патент США № 5602098, публикация патента Европы 0 618 221, публикация патента Европы 0 675 112, публикация патента Европы 0 604 181, публикация патента Европы 0 696 593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, WO 95/10514, патент США № 5661152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, патент США № 5571792, WO 96/17861, WO 96/33159, WO 96/34850, WO 96/34851, WO 96/30017, WO 96/30018, WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252, WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920, WO 97/17070, WO 97/23478, WO 97/26246, WO 97/30053, WO 97/44350, WO 98/02436 и патент США № 5532359. В качестве примера роли ингибитора пренил-протеинтрансферазы в ангиогенезе, см. публикацию European J. of Cancer, 1999, 35(9):1394-1401.
Термин «ингибиторы ангиогенеза» относится к соединениям, которые ингибируют образование новых кровеносных сосудов, независимо от механизма. Примеры ингибиторов ангиогенеза включают, но не ограничиваются ими, ингибиторы тирозинкиназы, такие как ингибиторы рецепторов тирозинкиназы Flt-1 (VEGFR1) и Flk-1/KDR (VEGFR2), ингибиторы эпидермальных, фибробластных или тромбоцитарных факторов роста, ингибиторы MMP (матричной металлопротеазы), блокаторы интегрина, интерферон-α, интерлейкин-12, пентозан полисульфат, ингибиторы циклооксигеназы, включая нестероидные противовоспалительные средства (NSAIDs), подобные аспирину и ибупрофену, а также селективные ингибиторы циклооксигеназы-2, подобные целекоксибу и рофекоксибу (PNAS, 1992, 89:7384; JNCI, 1982, 69:475; Arch. Opthalmol., 1990, 108:573; Anat. Rec., 1994, 238:68; FEBS Letters, 1995, 372:83; Clin, Orthop., 1995, 313:76; J. Mol. Endocrinol., 1996, 16:07; Jpn. J. Pharmacol., 1997, 75:105; Cancer Res., 1997, 57:1625; Cell, 1998, 93:705; Intl. J. Mol. Med., 1998, 2:715; J. Biol. Chem., 1999. 274:9116), стероидные противовоспалительные средства (такие как кортикостероиды, минералокортикоиды, дексаметазон, преднизон, преднизолон, метилпред, бетаметазон), карбоксиамидотриазол, комбретастатин A-4, скваламин, 6-O-хлорацетилкарбонил)фумагиллол, талидомид, ангиостатин, тропонин-1, антагонисты ангиотензина II (см. публикацию Fernandez, et al., J. Lab. Clin. Med., 1985, 105:141-145), и антитела к VEGF (см. публикации Nature Biotechnology, 1999, 17:963-968); Kim, et al., Nature, 1993, 362:841-844; WO 2000/44777 и WO 2000/61186).
Другие терапевтические средства, которые модулируют или ингибируют ангиогенез, и которые также можно использовать в комбинации с настоящим изобретением, включают средства, которые модулируют или ингибируют системы свертывания и фибринолиза (см., обзор в публикации Clin. Chem. La. Med., 2000, 38:679-692). Примеры таких средств, которые модулируют или ингибируют пути свертывания и фибринолиза, включают, но не ограничиваются ими, гепарин (см. публикацию Thromb. Haemost., 1998, 80:10-23), низкомолекулярные гепарины и ингибиторы карбоксипептидазы U (также известные как ингибиторы активируемого тромбином ингибитора фибринолиза [TAFIa]) (см. публикацию Thrombosis Res., 2001, 101:329-354). Ингибиторы TAFIa были описаны в международной публикации PCT WO 2003/013526. «Средства, которые препятствуют точкам контроля клеточного цикла», относятся к соединениям, которые ингибируют протеинкиназы, передающие сигналы точек контроля клеточного цикла, тем самым, сенсибилизируя злокачественную клетку к средствам, повреждающим ДНК. Такие средства включают ингибиторы киназ ATR, ATM, CHK1 и ингибиторы киназ cdk и cdc, и, в частности, иллюстрируются 7-гидроксистауроспорином, флавопиридолом, CYC202 (циклацел) и BMS-387032.
«Средства, которые препятствуют рецепторным тирозинкиназам (RTK)», относятся к соединениям, которые ингибирируют RTK, и поэтому участвуют в механизмах, вовлеченных в онкогенез и прогрессирование опухолей. Такие средства включают ингибиторы c-Kit, Eph, PDGF, Flt3 и c-Met. Дополнительные средства включают ингибиторы RTK, как описано Bume-Jensen and Hunter, Nature, 2001, 411:355-365.
«Ингибиторы клеточной пролиферации и пути передачи сигналов выживания» относятся к соединениям, которые ингибируют каскады передачи сигналов ниже рецепторов клеточной поверхности. Такие средства включают ингибиторы сериновых/треониновых киназ (включая, но не ограничиваясь ими, ингибиторы Akt, как описано в WO 02/083064, WO 02/083139, WO 02/083140, US 2004-0116432, WO 02/083138, US 2004-0102360, WO 03/086404, WO 03/086279, WO 03/086394, WO 03/084473, WO 03/086403, WO 2004/041162, WO 2004/096131, WO 2004/096129, WO 2004/096135, WO 2004/096130, WO 2005/100356, WO 2005/100344, US 2005/029941, US 2005/44294, US 2005/43361, WO 2006/135627, WO 2006/091395, WO 2006/110638), ингибиторы Raf киназы (например, BAY-43-9006), ингибиторы MEK (например, CI-1040 и PD-098059), ингибиторы mTOR (например, Wyeth CCI-779) и ингибиторы PI3K (например, LY294002).
Специфические антитела против IGF-1R включают, но не ограничиваются ими, далотузумаб, фигитумумаб, циксутумумаб, SHC 717454, Roche R1507, EM164 или Amgen AMG479.
Как описано выше, комбинации с NSAID относятся к применению NSAID, которые представляют собой сильнодействующие средства, ингибирующие COX-2. Для целей настоящего описания, NSAID является сильнодействующим, если он обладает IC50 в отношении ингибирования COX-2, составляющей 1 мкМ или менее при измерении с помощью клеточных или микросомальных анализов.
Изобретение также охватывает комбинации с NSAID, которые представляют собой селективные ингибиторы COX-2. Для целей настоящего описания NSAID, которые представляют собой селективные ингибиторы COX-2, определяют как NSAID, которые обладают специфичностью в отношении ингибирования COX-2, по меньшей мере в 100 раз превосходящей специфичность в отношении ингибирования COX-1, при измерении по соотношению IC50 для COX-2 и IC50 для COX-1 при оценке с помощью клеточных или микросомальных анализов. Такие соединения включают, но не ограничиваются ими, соединения, которые описаны в патенте США № 5474995, патенте США № 5861419, патенте США № 6001843, патенте США № 6020343, патенте США № 5409944, патенте США № 5436265, патенте США № 5536752, патенте США № 5550142, патенте США № 5604260, патенте США № 5698584, патенте США № 5710140, WO 94/15932, патенте США № 5344991, патенте США № 5134142, патенте США № 5380738, патенте США № 5393790, патенте США № 5466823, патенте США № 5633272 и патенте США № 5932598, все из которых включены в настоящее описание в качестве ссылок.
Ингибиторами COX-2, которые особенно полезны в данном способе лечения, являются: 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5H)-фуранон и 5-хлор-3-(4-метилсульфонил)фенил-2-(2-метил-5-пиридинил)пиридин или их фармацевтически приемлемая соль.
Соединения, которые были описаны как специфические ингибиторы COX-2 и поэтому полезны в рамках настоящего изобретения, включают, но не ограничиваясь ими, следующие соединения: парекоксиб, BEXTRA® и CELEBREX® или их фармацевтически приемлемая соль.
Другие примеры ингибиторов ангиогенеза включают, но не ограничиваются ими, эндостатин, украин, ранпирназу, IM862, 5-метокси-4-[2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат, ацетилдинаналин, 5-амино-1-[[3,5-дихлор-4-(4-хлорбензоил)фенил]метил]-1H-1,2,3-триазол-4-карбоксамид, CM101, скваламин, комбретастатин, RPI4610, NX31838, сульфатированный фосфат маннопентоазы, 7,7-(карбонил-бис[имино-N-метил-4,2-пирролокарбонилимино[N-метил-4,2-пиррол]капбонилимино]-бис-(1,3-нафталин дисульфонат) и 3-[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416).
Используемый выше термин «блокаторы интегрина» относится к соединениям, которые осуществляют селективный антагонизм, ингибируют или противодействуют связыванию физиологического лиганда с интегрином αvβ3, к соединениям, которые осуществляют селективный антагонизм, ингибируют или противодействуют связыванию физиологического лиганда с интегрином αvβ5, к соединениям, которые осуществляют селективный антагонизм, ингибируют или противодействуют связыванию физиологического лиганда как с интегрином αvβ3, так и с интегрином αvβ5, и к соединениям, которые осуществляют селективный антагонизм, ингибируют или противодействуют активности конкретного интегрина(ов), экспрессируемого на капиллярных эндотелиальных клетках. Термин также относится к антагонистам интегринов αvβ6, αvβ8, α1β1, α2β1, α5β1, α6β1 и α6β4. Термин также относится к антагонистам любой комбинации интегринов αvβ3, αvβ5, αvβ6, αvβ8, α1β1, α2β1, α5β1, α6β1 и α6β4.
Некоторые конкретные примеры ингибиторов тирозинкиназы включают N-(трифторметилфенил)-5-метилизоксазол-4-карбоксамид, 3-[(2,4-диметилпиррол-5-ил)метилиденил)индолин-2-он, 17-(аллиламино)-17-деметоксигелданамицин, 4-(3-хлор-4-фторфениламино)-7-метокси-6-[3-(4-морфолинил)пропоксил]хиназолин, N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, BIBX1382, 2,3,9,10,11,12-гексагидро-10-(гидроксиметил)-10-гидрокси-9-метил-9,12-эпокси-1H-дииндоло[1,2,3-fg:3',2',1'-kl]пирроло[3,4-i][1,6]бензодиазоцин-1-он, SH268, генистеин, STI571, CEP2563, 4-(3-хлорфениламино)-5,6-диметил-7H-пирроло[2,3-d]пиримидинметансульфонат, 4-(3-бром-4-гидроксифенил)амино-6,7-диметоксихиназолин, 4-(4'-гидроксифенил)амино-6,7-диметоксихиназолин, SU6668, STI571A, N-4-хлорфенил-4-(4-пиридилметил)-1-фталазинамин и EMD121974.
Комбинации с соединениями, отличными от соединений против злокачественной опухоли, также охватываются способами по настоящему изобретению. Например, при лечении определенных злокачественных заболеваний можно применять комбинацию ингибитора mTOR и антагониста интегрина αvβ3 по настоящему изобретению в комбинации с агонистами PPAR-γ (т.е. PPAR-гамма) и агонистами PPAR-δ (т.е. PPAR-дельта). PPAR-γ и PPAR-δ представляют собой активируемые пролифератором пероксисомы рецепторы γ и δ. Экспрессия PPAR-γ на эндотелиальных клетках и его вовлечение в ангиогенез описаны в литературе (см., J. Cardiovasc. Pharmacol., 1998, 31:909-913; J. Biol. Chem., 1999, 274:9116-9121; Invest. Ophthalmol Vis. Sci., 2000, 41:2309-2317). Позднее было показано, что агонисты PPAR-γ ингибируют ангиогеннный ответ на VEGF in vitro; как троглитазон, так и росиглитазон малеат ингибируют развитие неоваскуляризации сетчатки у мышей (Arch. Ophthamol., 2001; 119:709-717). Примеры агонистов PPAR-γ и агонистов PPAR-γ/α включают, но не ограничиваются ими, тиазолидинедионы (такие как DRF2725, CS-011, троглитазон, росиглитазон и пиоглитазон), фенофибрат, гемфиброзил, клофибрат, GW2570, SB219994, AR-H039242, JTT-501, MCC-555, GW2331, GW409544, NN2344, KRP297, NP0110, DRF4158, NN622, GI262570, PNU182716, DRF552926, 2-[(5,7-дипропил-3-трифторметил-1,2-бензисоксазол-6-ил)окси]-2-метилпропионовую кислоту (описанную в USSN 09/782856), и 2(R)-7-(3-(2-хлор-4-(4-фторфенокси)фенокси)пропокси)-2-этилхроман-2-карбоновую кислоту (описанную в USSN 60/235708 и 60/244697).
Другой вариант осуществления настоящего изобретения относится к применению соединений, описанных в настоящем описании, в комбинации с генной терапией для лечения злокачественной опухоли. Для обзора генетических стратегий лечения злокачественной опухоли см. Hall, et al., Am. J. Hum. Genet., 1997, 61:785-789 и Kufe, et al., Рак Medicine, 5th Ed, B.C. Decker, Hamilton, 2000, pp 876-889. Генную терапию можно применять для доставки любого подавляющего опухоль гена. Примеры таких генов включают, но не ограничиваются ими, p53, который можно доставить путем опосредованного рекомбинантным вирусом переноса гена (см. патент США № 6069134), антагонист uPA/uPAR (Gene Therapy, 1998, 5(8):1105-13) и интерферон гамма (J. Immunol., 2000, 164:217-222).
Соединения по настоящему изобретению также можно вводить в комбинации с ингибитором присущей множественной устойчивости к лекарственным средствам (MDR), в частности, MDR, ассоциированной с высокими уровнями экспрессии белков-переносчиков. Такие ингибиторы MDR включают ингибиторы п-гликопротеина (P-gp), такие как LY335979, XR9576, OC144-093, R101922, VX853 и PSC833 (валсподар).
Соединение по настоящему изобретению можно использовать в сочетании с противорвотными средствами для лечения тошноты или рвоты, включая острую, отсроченную, позднефазовую и предвидимую рвоту, которая может возникнуть в результате применения соединения по настоящему изобретению, отдельно или с лучевой терапией. Для профилактики или лечения рвоты соединение по настоящему изобретению можно применять в сочетании с другими противорвотными средствами, в частности, антагонистами рецепторов нейрокинина-1, антагонистами рецепторов 5HT3, такими как ондастерон, гранисетрон, трописетрон и затисетрон, агонистами рецепторов GABAB, такими как баклофен, кортикостероид, такой как Декадрон (дексаметазон), Кеналог, Аристокорт, Насалид, Преферид, Бенекортен или другие, такие как описаны в патентах США №№ 2789118, 2990401, 3048581, 3126375, 3929768, 3996359, 3928326 и 3749712, антидофаминергическое средство, такое как фенотиазины (например, прохлорперазин, флуфеназин, тиоридазин и мезоридазин), метоклопрамид или дронабинол. В другом варианте осуществления совместная терапия с противорвотным средством, выбранным из антагониста рецепторов нейрокинина-1, антагониста рецепторов 5HT3 кортикостероида, предусматривается для лечения или профилактики рвоты, которая может возникнуть в результате введения соединений по настоящему изобретению.
Антагонисты рецепторов нейрокинина-1 для применения в сочетании с соединениями по настоящему изобретению полностью описаны, например, в патентах США № 5162339, 5232929, 5242930, 5373003, 5387595, 5459270, 5494926, 5496833, 5637699, 5719147; в публикациях патентов Европы № EP 0 360 390, 0 394 989, 0 428 434, 0 429 366, 0 430 771, 0 436 334, 0 443 132, 0 482 539, 0 498 069, 0 499 313, 0 512 901, 0 512 902, 0 514 273, 0 514 274, 0 514 275, 0 514 276, 0 515 681, 0 517 589, 0 520 555, 0 522 808, 0 528 495, 0 532 456, 0 533 280, 0 536 817, 0 545 478, 0 558 156, 0 577 394, 0 585 913, 0 590 152, 0 599 538, 0 610 793, 0 634 402, 0 686 629, 0 693 489, 0 694 535, 0 699 655, 0 699 674, 0 707 006, 0 708 101, 0 709 375, 0 709 376, 0 714 891, 0 723 959, 0 733 632 и 0 776 893; в международных публикациях патентов PCT № WO 90/05525, 90/05729, 91/09844, 91/18899, 92/01688, 92/06079, 92/12151, 92/15585, 92/17449, 92/20661, 92/20676, 92/21677, 92/22569, 93/00330, 93/00331, 93/01159, 93/01165, 93/01169, 93/01170, 93/06099, 93/09116, 93/10073, 93/14084, 93/14113, 93/18023, 93/19064, 93/21155, 93/21181, 93/23380, 93/24465, 94/00440, 94/01402, 94/02461, 94/02595, 94/03429, 94/03445, 94/04494, 94/04496, 94/05625, 94/07843, 94/08997, 94/10165, 94/10167, 94/10168, 94/10170, 94/11368, 94/13639, 94/13663, 94/14767, 94/15903, 94/19320, 94/19323, 94/20500, 94/26735, 94/26740, 94/29309, 95/02595, 95/04040, 95/04042, 95/06645, 95/07886, 95/07908, 95/08549, 95/11880, 95/14017, 95/15311, 95/16679, 95/17382, 95/18124, 95/18129, 95/19344, 95/20575, 95/21819, 95/22525, 95/23798, 95/26338, 95/28418, 95/30674, 95/30687, 95/33744, 96/05181, 96/05193, 96/05203, 96/06094, 96/07649, 96/10562, 96/16939, 96/18643, 96/20197, 96/21661, 96/29304, 96/29317, 96/29326, 96/29328, 96/31214, 96/32385, 96/37489, 97/01553, 97/01554, 97/03066, 97/08144, 97/14671, 97/17362, 97/18206, 97/19084, 97/19942 и 97/21702; и в публикациях патентов Великобритании № 2 266 529, 2 268 931, 2 269 170, 2 269 590, 2 271 774, 2 292 144, 2 293 168, 2 293 169 и 2 302 689. Получение таких соединений полностью описано в упомянутых выше патентах и публикациях, которые включены в настоящее описание в качестве ссылки.
В одном варианте осуществления антагонист рецепторов нейрокинина-1 для применения в сочетании с соединениями по настоящему изобретению выбран из: 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина или его фармацевтически приемлемой соли, которые описаны в патенте США № 5719147.
Ингибитор WEE1 по настоящему изобретению можно также вводить со средством, полезным при лечении анемии. Такое средство для лечения анемии представляет собой, например, активатор рецепторов непрерывного эритропоэза (такой как эпоэтин-альфа).
Ингибитор WEE1 по настоящему изобретению также можно вводить со средством, полезным при лечении нейтропении. Такое средство для лечения нейтропении представляет собой, например, гематопоэтический фактор роста, который регулирует продукцию и функцию нейтрофилов, такой как гранулоцитарный колониестимулирующий фактор (G-CSF) человека. Примеры G-CSF включают филгастрим.
Ингибитор WEE1 по настоящему изобретению можно также вводить с препаратом, усиливающим иммунитет, таким как левамизол, изоприназин и задаксин.
Ингибитор WEE1 по настоящему изобретению также можно применять для лечения или профилактики рака, включая рак костей, в комбинации с бисфосфонатами (понятно, что включаются бисфосфонаты, дифосфонаты, бисфосфоновые кислоты и дифосфоновые кислоты). Примеры бисфосфонатов включают, но не ограничиваются ими: этидронат (Дидронел), памидронат (Аредиа), алендронат (Фосамакс), риседронат (Актонел), золедронат (Зомета), ибандронат (Бонива), инкадронат или цимадронат, клодронат, EB-1053, минодронат, неридронат, пиридронат и тилудронат, включая любые и все фармацевтически приемлемые соли, производные, гидраты и их смеси.
Ингибитор WEE1 по настоящему изобретению также можно применять для лечения или профилактики злокачественной опухоли в комбинации с ингибиторами ароматазы. Примеры ингибиторов ароматазы включают, но не ограничиваются ими: анастрозол, летрозол и экземестан.
Ингибитор WEE1 по настоящему изобретению также можно применять для лечения или профилактики злокачественной опухоли в комбинации с терапевтическими средствами на основе миРНК.
Ингибитор WEE1 по настоящему изобретению также можно вводить в комбинации с ингибиторами γ-секретазы и/или ингибиторами передачи сигналов NOTCH. Такие ингибиторы включают соединения, описанные в документах WO 01/90084, WO 02/30912, WO 01/70677, WO 03/013506, WO 02/36555, WO 03/093252, WO 03/093264, WO 03/093251, WO 03/093253, WO 2004/039800, WO 2004/039370, WO 2005/030731, WO 2005/014553, USSN 10/957251, WO 2004/089911, WO 02/081435, WO 02/081433, WO 03/018543, WO 2004/031137, WO 2004/031139, WO 2004/031138, WO 2004/101538, WO 2004/101539 и WO 02/47671 (включая LY-450139).
Ингибитор WEE1 по настоящему изобретению можно также применять для лечения и профилактики злокачественной опухоли в комбинации с ингибиторами Akt. Такие ингибиторы включают соединения, описанные, но без ограничения в следующих публикациях: WO 02/083064, WO 02/083139, WO 02/083140, US 2004-0116432, WO 02/083138, US 2004-0102360, WO 03/086404, WO 03/086279, WO 03/086394, WO 03/084473, WO 03/086403, WO 2004/041162, WO 2004/096131, WO 2004/096129, WO 2004/096135, WO 2004/096130, WO 2005/100356, WO 2005/100344, US 2005/029941, US 2005/44294, US 2005/43361, WO 2006/135627, WO 2006091395, WO 2006/110638).
Ингибитор WEE1 по настоящему изобретению также можно применять для лечения и профилактики злокачественной опухоли в комбинации с ингибиторами PARP.
Сама лучевая терапия является обычным способом в области лечения злокачественной опухоли. Для лучевой терапии используются различные излучения, такие как рентгеновское излучение, γ-излучение, нейтронное излучение, электронный пучок, протонный пучок и источники излучения. В наиболее распространенной лучевой терапии используют линейный ускоритель для облучения внешними видами излучения, γ-излучением.
Ингибитор WEE1 по настоящему изобретению также можно применять для лечения злокачественной опухоли в дополнительной комбинации со следующими терапевтическими средствами: абареликс (Plenaxis depot®); абиратерон ацетат (Zytiga®); (Actiq®); альдеслейкин (Prokine®); Альдеслейкин (Proleukin®); Алемтузумаб (Campath®); алфузосин HCl (UroXatral®); алитретионин (Panretin®); аллопуринол (Zyloprim®); алтретамин (Hexalen®); амифостин (Ethyol®); анастрозол (Arimidex®); (Anzemet®); (Anexsia®); апрепитант (Emend®); триоксид мышьяка (Trisenox®); аспарагиназа (Elspar®); азацитидин (Vidaza®); Бендамустин гидрохлорид (Treanda®); бевакузимаб (Avastin®); капсулы бексаротена (Targretin®); бексаротен гель (Targretin®); блеомицин (Blenoxane®); бортезомиб (Velcade®); (Brofenac®); бусульфан внутривенный (Busulflex®); бусульфан пероральный (Myleran®); кабазитаксел (Jevtana®); калустерон (Methosarb®); капецитабин (Xeloda®); карбоплатин (Paraplatin®); кармустин (BCNU®, BiCNU®); кармустин (Gliadel®); кармустин с импалантатом Полифепросана 20 (Gliadel Wafer®); целекоксиб (Celebrex®); цетуксимаб (Erbitux®); хлорамбуцил (Leukeran®); цинакалцет (Sensipar®); цисплатин (Platinol®); кладрибин (Leustatin®, 2-CdA®); клофарабин (Clolar®); циклофосфамид (Cytoxan®, Neosar®); циклофосфамид (Cytoxan Injection®); циклофосфамид (Cytoxan Tablet®); цитарабин (Cytosar-U®); цитарабин липосомальный (DepoCyt®); дакарбазин (DTIC-Dome®); дактиномицин, актиномицин D (Cosmegen®); Дарбепоэтин альфа (Aranesp®); дасатиниб (Sprycel®); даунорубицин липосомальный (DanuoXome®); даунорубицин, дауномицин (Daunorubicin®); даунорубицин, дауномицин (Cerubidine®); децитабин (Dacogen®); дегареликс (Degarelix®); Денилейкин дифтитокс (Ontak®); деносумаб (Xgeva®); декстразоксан (Zinecard®); доцетаксел (Taxotere®); доксорубицин (Adriamycin PFS®); доксорубицин (Adriamycin®, Rubex®); доксорубицин (Adriamycin PFS Injection®); доксорубицин липосомальный (Doxil®); дромостанолон пропионат (dromostanolone®); дромостанолон пропионат (masterone injection®); раствор Эллиота B (Elliott's B Solution®); эпирубицин (Ellence®); Эпоэтин альфа (epogen®); эрибулин мезилат (Halaven®); эрлотиниб (Tarceva®); эстрамустин (Emcyt®); этопозид фосфат (Etopophos®); этопозид, VP-16 (Vepesid®); эверолимус (Afinitor®); экземестан (Aromasin®); фентанил буккальный (Onsolis®); фентанил цитрат (Fentora®); фентанил сублингвальные таблетки (Abstral®); Филгастрим (Neupogen®); флоксуридин (внутриартериальный) (FUDR®); флударабин (Fludara®); фторурацил, 5-FU (Adrucil®); флутамид (Eulexin®); фулвестрант (Faslodex®); гефитиниб (Iressa®); гемцитабин (Gemzar®); гемтузумаб озогамицин (Mylotarg®); госерелин ацетат (Zoladex Implant®); госерелин ацетат (Zoladex®); гранисетрон (Kytril Solution®) (Sancuso®); гистерлин ацетат (Histrelin implant®); бивалентная вакцина к вурусу папилломы человека (Cervarix®); гидроксимочевина (Hydrea®); Ибритумомаб Тиуксетан (Zevalin®); идарубицин (Idamycin®); ифосфамид (IFEX®); иматиниб мезилат (Gleevec®); интерферон альфа 2a (Roferon A®); Интерферон альфа-2b (Intron A®); ипилимумаб (Yervoy®); иринотекан (Camptosar®); (Kadian®); иксабепилон (Ixempra®); лапатиниб (Tykerb®); леналидомид (Revlimid®); летрозол (Femara®); лейковорин (Wellcovorin®, Leucovorin®); Лейпролид Ацетат (Eligard®); (Lupron Depot®); (Viadur®); левамизол (Ergamisol®); леволейковорин (Fusilev®); ломустин, CCNU (CeeBU®); меклоретамин, азотистый иприт (Mustargen®); мегестрол ацетат (Megace®); мелфалан, L-PAM (Alkeran®); меркаптопурин, 6-MP (Purinethol®); месна (Mesnex®); месна (Mesnex tabs®); метотрексат (Methotrexate®); метоксален (Uvadex®); митомицин C (Mutamycin®); митомицин C (Mitozytrex®); митотан (Lysodren®); митоксантрон (Novantrone®); нандролон фенпропионат (Durabolin-50®); неларабин (Arranon®); нитолиниб гидрохлорид моногидрат (Tasigna®); Нофетумомаб (Verluma®); офатумумаб (Arzerra®); ондансетрон (Zuplenz®); Опрелвекин (Neumega®); (Neupogen®); оксалиплатин (Eloxatin®); паклитаксел (Paxene®); паклитаксел (Taxol®); связанные с белком частицы паклитаксел (Abraxane®); палифермин (Kepivance®); палоносетрон (Aloxi®); памидронат (Aredia®); панитумумаб (Vectibix®); пазопаниб (Votrient®); пегамаза (Adagen (Pegademase Bovine)®); пегаспаргаза (Oncaspar®); Пэгфилграстим (Neulasta®); пегинтерферон альфа-2B (Sylatron®); пеметрексед динатрий (Alimta®); пентостатин (Nipent®); пипоброман (Vercyte®); плериксафор в инъекциях (Mozobil®); пликамицин, митрамицин (Mithracin®); порфимер натрий (Photofrin®); пралатрексат инъекции (Folotyn®); прокарбазин (Matulane®); (Quadramet®); четырехвалентная рекомбинантная вакцина вирус папилломы человека (типов 6, 11, 16, 18) (Gardasil®); квинакрин (Atabrine®); ралоксифен гидрохлорид (Evista®); Расбуриказа (Elitek®); Ритуксимаб (Rituxan®); ромидепсин (Istodax®); сарграмостим (Leukine®); Сарграмостим (Prokine®); секретин (SecreFlo®); сипулейцел-T (Provenge®); сорафениб (Nexavar®); стрептозоцин (Zanosar®); сунитиниб малеат (Sutent®); тальк (Sclerosol®); тамоксифен (Nolvadex®); темозоломид (Temodar®); темсиролимус (Torisel®); тенипозид, VM-26 (Vumon®); (Temodar®); тестолактон (Teslac®); талидомид (Thalomid®); тиогуанин, 6-TG (Thioguanine®); тиотепа (Thioplex®); топотекан (Hycamtin®); торемифен (Fareston®); Тоситумомаб (Bexxar®); Тоситумомаб/I-131 тоситумомаб (Bexxar®); Трастузумаб (Herceptin®); (Trelstar LA®); третиноин, ATRA (Vesanoid®); трипторелин памоат (Trelstar Depot®); (UltraJect®); Урацил Иприт (Uracil Mustard Capsules®); валрубицин (Valstar®); вандетаниб (Vandetanib®); винбластин (Velban®); винкристин (Oncovin®); винорелбин (Navelbine®); вориностат (Zolinza®); (Zofran ODT®) и золедронат (Zometa®).
Все указанные патенты, публикации и находящиеся на рассмотрении патентные заявки включены в настоящее описание путем ссылки.
ПРИМЕРЫ
Пример 1
Получение WEE1-1
Получение 2-аллил-1-[6-(1-гидрокси-1-метилэтил)пиридин-2-ил]-6-{[4-(4-метилпиперазин-1-ил)фенил]амино}-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-она
Стадия 1) Получение 2-(6-бром-2-пиридинил)-2-пропанола:
В атмосфере азота 30 мл 3 M метилмагниййодида/простого диэтилового эфира добавляли к 300 мл раствора 8,72 г метил 6-бромпиридин-2-карбоксилата в диэтиловом эфире. К реакционной жидкости добавляли воду и 2 н хлористоводородную кислоту, и экстрагировали этилацетатом. Реакционный раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором и сушили безводным сульфатом магния. Растворитель выпаривали при пониженном давлении с получением неочищенного 2-(6-бром-2-пиридинил)-2-пропанола в виде желтого маслянистого вещества. 1H-ЯМР (400 МГц, CDCl3) δ: 7,56 (1H, т, J=7,8 Гц), 7,38 (1H, дд, J=7,8, 1,0 Гц), 7,36 (1H, дд, J=7,8, 1,0 Гц), 1,55(6H, с). ESI-MS: найдено: m/z[M+H]+ 216, 218.
Стадия 2) Получение 2-аллил-1-[6-(1-гидрокси-1-метилэтил)-2-пиридинил]-6-(метилтио)-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-она:
Указанное в заголовке соединение получали таким же образом, как и в примере получения 1-1, для чего, однако, соединение, полученное в указанной выше реакции, использовали вместо 2-йодпиридина, использованного в примере получения 1-1. 1H-ЯМР (400 МГц, CDCl3) δ: 8,95 (1H, с), 7,91 (1H, т, J=8,0 Гц), 7,76 (1H, д, J=7,3 Гц), 7,40 (1H, дд, J=7,8, 1,0 Гц), 5,70 (1H, ддт, J=17,1, 10,2, 6,3 Гц), 5,06 (1H, дд, J=10,2, 1,0 Гц), 4,93 (1H, дд, J=17,1, 1,2 Гц), 4,81 (2H, д, J=6,3 Гц), 2,59 (4H, с), 1,59 (6H, с). ESI-MS: найдено: m/z[M+H]+ :358.
Стадия 3) Получение 2-аллил-1-[6-(1-гидрокси-1-метилэтил)пиридин-2-ил]-6-{[4-(4-метилпиперазин-1-ил)фенил]амино}-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-она:
817 мг м-хлорпербензойной кислоты (>65%) добавляли к раствору в толуоле (20 мл) 1,10 г указанного выше продукта и перемешивали в течение 20 минут. К реакционной жидкости добавляли 1,61 мл N,N-диизопропилэтиламина и 706 мг 4-(4-метилпиперазин-1-ил)анилина и перемешивали в течение ночи. К реакционной жидкости добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом, промывали насыщенным водным солевым раствором и сушили безводным сульфатом магния. Растворитель выпаривали и остаток очищали основной колоночной хроматографией на силикагеле (гексан/этилацетат = от 1/1 до 0/1, этилацетат/этанол = 98/2). После концентрирования раствор перекристаллизовывали из этилацетата с получением указанного в заголовке соединения в виде желтого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ: 8,83 (1H, с), 7,86 (1H, дд, J=8,0, 7,8 Гц), 7,75 (1H, д, J=7,3 Гц), 7,49 (1H, уш.с), 7,48 (2H, д, J=9,0 Гц), 7,34 (1H, д, J=7,4 Гц), 6,93 (2H, д, J=9,0 Гц), 5,70 (1H, ддт, J=17,2, 10,0, 6,5 Гц), 5,04 (1H, д, J=10,0 Гц), 4,94 (1H, д, J=17,2 Гц), 4,74 (2H, д, J=6,5 Гц), 3,26 (4H, т, J=4,8 Гц), 2,73 (4H, уш.с), 2,44 (3H, с), 1,59 (6H, с). ESI-MS: найдено: m/z[M+H]+ 501
Пример получения 1-1
Получение 2-аллил-6-(метилтио)-1-пиридин-2-ил-3H-пиразоло[3,4-d]пиримидин-3-она:
К раствору 4,44 г 2-аллил-6-(метилтио)-1,2-дигидро-3H-пиразоло[3,4-d]пиримидин-3-она в 1,4-диоксане (50 мл) добавляли 2,4 мл N,N'-диметилэтилендиамина, 3,80 г йодида меди(I), 5,33 г 2-йодпиридина и 3,80 г карбоната калия и перемешивали в течение ночи при 95°C. Реакционную жидкость охлаждали, к ней добавляли водный раствор аммиака и экстрагировали этилацетатом, промывали насыщенным водным солевым раствором и сушили безводным сульфатом магния. Растворитель выпаривали при пониженным давлении и кристаллизовали этилацетатом с получением указанного в заголовке соединения в виде белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ: 8,94 (1H, с), 8,52 (1H, д, J=5,1 Гц), 7,90 (2H, д, J=3,5 Гц), 7,29-7,25 (1H, m), 5,68 (1H, ддт, J=17,0, 10,2, 6,3 Гц), 5,05 (1H, д, J=10,2 Гц), 4,91 (1H, д, J=17,0 Гц), 4,85 (1H, д, J=6,3 Гц), 2,58 (3H, с).
Пример 2
Получение WEE1-2
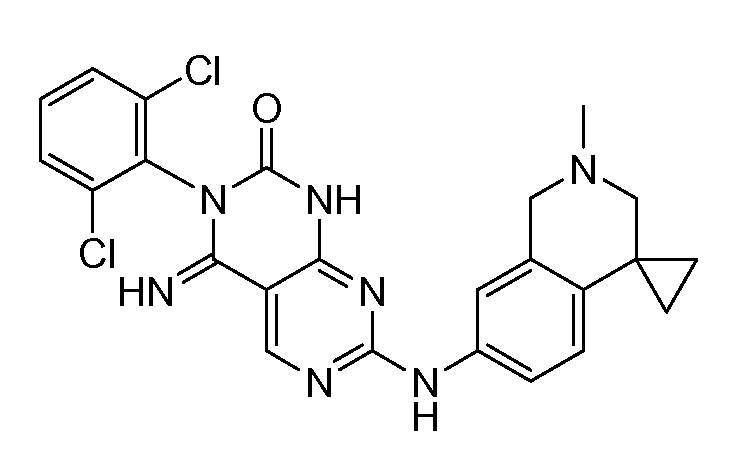
Получение 3-(2,6-дихлорфенил)-4-имино-7-[(2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-ил)амино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-она
Раствор 1,5 г 7-хлор-3-(2,6-дихлорфенил)-4-имино-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-она, полученного в примере получения 2-1, 1 г 2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-амина, полученного в примере получения 2-2, и 0,83 г моногидрата п-толуолсульфоновой кислоты перемешивали при 90°C в течение 15 минут. Реакционную жидкость охлаждали, разбавляли хлороформом и органический слой промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным водным солевым раствором и сушили безводным сульфатом магния, фильтровали и растворитель выпаривали. Полученный таким образом неочищенный продукт очищали основной колоночной хроматографией на силикагеле с получением 3-(2,6-дихлорфенил)-4-имино-7-[(2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-ил)амино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-она. Его растворяли в смешанном растворителе хлороформа/метанола и к нему добавляли 1,5 эквивалента водного раствора хлористоводородной кислоты и перемешивали при комнатной температуре в течение 5 минут. Затем растворитель выпаривали, остаток промывали этилацетатом с получением 3-(2,6-дихлорфенил)-4-имино-7-[(2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-ил)амино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-она дигидрохлорида в виде желтого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ: 11,83 (1H, уш.с), 10,05 (1H, уш.с), 9,10 (1H, с), 8,88 (1H, с), 7,79-7,68 (1H, м), 7,63-7,59 (2H, м), 7,47 (1H, т, J=8,2 Гц), 7,38 (1H, д, J=8,3 Гц), 6,63 (1H, д, J=8,5 Гц), 3,59 (2H, с), 2,44 (2H, с), 2,32 (3H, с), 0,90-0,81 (4H, м) ESI-MS: Найдено: m/z [M+H]+ 494
Пример получения 2-1
Получение 7-хлор-3-(2,6-дихлорфенил)-4-имино-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-она
1,12 г гидрида натрия добавляли к раствору 3,0 г 4-амино-2-хлорпиримидин-5-карбонитрила в N,N-диметилформамиде (35 мл) и перемешивали при комнатной температуре в течение 5 минут. К реакционной жидкости добавляли 4,38 г 2,6-дихлорфенилизоцианата и перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли этилацетат и 1 н водный раствор хлористоводородной кислоты, и органические слои отделяли. Их промывали насыщенным водным солевым раствором, сушили безводным сульфатом магния и растворитель выпаривали. Осажденное твердое вещество отверждали смешанным раствором метанола/этилацетата и собирали фильтрацией с получением указанного в заголовке соединения в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ: 9,33 (1H, с), 7,66 (2H, д, J=8,2 Гц), 7,53 (1H, т, J=8,2 Гц) ESI-MS: найдено: m/z [M+H] 342
Пример получения 2-2
Получение 2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-амина
Стадия 1) Получение метил 1-(2-цианофенил)циклопропанкарбоксилата:
1,5 г тетра-н-бутиламмония бромида, 6,5 г 1,2-дибромэтана и 20 мл 50% водного раствора гидроксида натрия добавляли к раствору 4,0 г метил 2-цианофенилацетата в толуоле (40 мл) и перемешивали при комнатной температуре в течение 1 часа. К реакционной жидкости добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным водным солевым раствором, сушили безводным сульфатом магния и растворитель выпаривали под пониженным давлением. Неочищенный продукт очищали хроматографией на колонке силикагеля (гексан/этилацетат) с получением указанного в заголовке соединения в виде бесцветного соединения. 1H-ЯМР (400 МГц, CDCl3) δ: 7,66 (1H, дд, J=7,6, 1,2 Гц), 7,55 (1H, тд, J=7,6, 1,2 Гц), 7,43-7,36 (2H, м), 3,66 (3H, с), 1,82 (2H, кв., J=3,7 Гц), 1,30 (2H, кв., J=3,7 Гц); ESI-MS: найдено: m/z [M+H] 202
Стадия 2) Получение метил 1-[2-(аминометил)фенил]циклопропанкарбоксилата моногидрохлорида:
1,6 г 10% палладия на угле добавляли к раствору 2,95 г соединения, описанного в указанной выше реакции (стадия 1), в этаноле (50 мл), и перемешивали в атмосфере водорода под давлением 2 атмосферы при комнатной температуре в течение 3 часов. Палладий на угле удаляли посредством фильтрации, фильтрат концентрировали при пониженном давлении и неочищенный продукт промывали простым диэтиловым эфиром с получением указанного в заголовке соединения в виде бесцветного твердого вещества. 1H-ЯМР (DMSO-d6) δ: 8,47 (2H, с), 7,55 (1H, д, J=6,8 Гц), 7.38 (3H, тд, J=7,2, 2,1 Гц), 7,36-7,29 (2H, м), 4,04 (2H, д, J=4,9 Гц), 3,54 (3H, с), 1,61-1,56 (2H, м), 1,33-1,29 (2H, м). ESI-MS Найдено: m/z [M+H] 206
Стадия 3) Получение 1',2'-дигидро-3'H-спиро[циклопропан-1,4'-изохинолин]-3'-она:
4 мл 5 н. водного раствора гидроксида натрия добавляли к раствору 3,2 г соединения, описанного в указанной выше реакции (стадия 2), в метаноле (50 мл) и перемешивали при комнатной температуре в течение 30 минут. Его нейтрализовали 1 н водным раствором хлористоводородной кислоты, добавленным к нему, и метанол выпаривали при пониженном давлении. Остаток разбавляли водой и экстрагировали три раза этилацетатом. Органический слой промывали насыщенным водным солевым раствором, сушили безводным сульфатом магния, и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного твердого вещества. 1H-ЯМР (CDCl3) δ: 7,23 (1H, тд, J=7,8, 1,1 Гц), 7,18 (1H, тд, J=7,3, 1,1 Гц), 7,10 (1H, дд, J=7,3, 1,0 Гц), 6,73 (1H, дд, J=7,8, 1,0 Гц), 4.69 (2H, д, J=1,5 Гц), 1,85 (2H, кв., J=3,7 Гц), 1,24 (2H, кв., J=3,7 Гц). ESI-MS, найдено: m/z [M+H] 174
Стадия 4) Получение 7'-нитро-1',2'-дигидро-3'H-спиро[циклопропан-1,4'-изохинолин]-3'-она:
1,3 г нитрата калия постепенно добавляли к раствору 2,1 г соединения, описанного в указанной выше реакции (стадия 3) в серной кислоте (60 мл) в течение 5 минут, и дополнительно перемешивали при комнатной температуре в течение 10 минут. Реакционную жидкость выливали в ледяную воду, осажденный кристалл извлекали посредством фильтрации и промывали водой с получением указанного в заголовке соединения в виде желтого твердого вещества. 1H-ЯМР (CDCl3) δ: 8,09 (1H, дд, J=8,8, 2,4 Гц), 8,01 (1H, т, J=2,4 Гц), 6,86 (1H, д, J=8,8 Гц), 6,30 (1H, с), 4,78 (2H, д, J=1,5 Гц), 2,01 (2H, кв., J=4,1 Гц), 1.35 (2H, кв., J=4,1 Гц) ESI-MS, найдено: m/z [M+H] 219
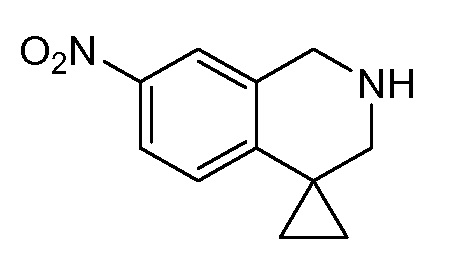
Стадия 5) Получение 7'-нитро-1',2'-дигидро-3'H-спиро[циклопропан-1,4'-изохинолина]:
При охлаждении льдом, 6,3 г комплекса трифторид бора-диэтилового эфира добавляли к суспензии 1,3 г боргидрида натрия в тетрагидрофуране и перемешивали в течение 1 часа. К реакционной жидкости добавляли раствор 2,4 г соединения, описанного в указанной выше реакции (стадия 4), в тетра-гидрофуране (100 мл), и нагревали при температуры кипения с обратным холодильником в течение 2 часов. Реакционную жидкость охлаждали и затем нейтрализовали насыщенным водным раствором бикарбоната натрия. Растворитель выпаривали под пониженным давлением, остаток растворяли в этаноле, к нему добавляли 5 н хлористоводородную кислоту и нагревали при температуре кипения с обратным холодильником в течение 1 часа. Реакционную жидкость охлаждали, затем растворитель выпаривали при пониженным давлении, и остаток нейтрализовали водным раствором карбоната калия. Водный слой экстрагировали хлороформом, органический слой сушили безводным сульфатом магния и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения. ESI-MS Найдено: m/z [M+H] 205

Стадия 6) Получение 2'-метил-7'-нитро-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолина]:
1,5 г цианоборгидрида натрия добавляли к раствору соединения (2,3 г), полученного в указанной выше реакции на стадии 5), в метаноле (50 мл), 2,7 мл водного 37% раствора формальдегида и 0,7 мл уксусной кислоты и перемешивали при комнатной температуре в течение 15 часов. Реакционную жидкость нейтрализовали насыщенным водным раствором бикарбоната натрия, и метанол выпаривали под пониженным давлением. Остаток разбавляли водой и экстрагировали три раза хлороформом. Органический слой сушили безводным сульфатом магния, растворитель выпаривали под пониженным давлением, и неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. 1H-ЯМР (CDCl3) δ: 7,97 (1H, дд, J=8,8, 2,4 Гц), 7,91 (1H, д, J=2,4 Гц), 6,78 (1H, д, J=8,8 Гц), 3,77 (2H, с), 2,57 (2H, с), 2,48 (3H, с), 1,16-1,12 (2H, м), 1,10-1,06 (2H, м). ESI-MS: Найдено: m/z [M+H] 219
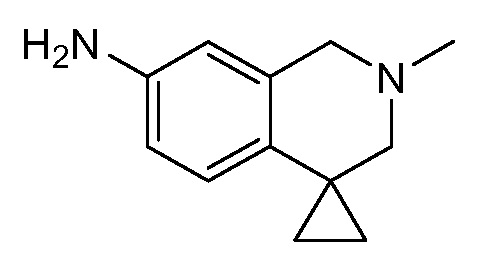
Стадия 7) Получение 2'-метил-2',3'-дигидро-1'H-спиро[циклопропан-1,4'-изохинолин]-7'-амина:
800 мг 10% палладия на угле добавляли к раствору 1,7 г соединения, описанного в указанной выше реакции (стадия 6), в этаноле (20 мл) и перемешивали в атмосфере водорода под давлением 1 атмосфера при комнатной температуре в течение 15 часов. Палладий на угле удаляли фильтрацией, фильтрат концентрировали при пониженном давлении, и неочищенный продукт очищали основной колоночной хроматографией на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения в виде бесцветного твердого вещества. 1H-ЯМР (CDCl3) δ: 6,50-6,48 (2H, м), 6,38-6,36 (1H, м), 3,61 (2H, с), 3,50 (2H, с), 2,49 (2H, с), 2,42 (3H, с), 0,91 (2H, дд, J=6,3, 4,6 Гц), 0,81 (2H, дд, J=6,3, 4,6 Гц). ESI-MS: Найдено: m/z [M+H] 189
Пример 3
Основные материалы и методы
A. Клеточная культура, анализы пролиферации и нокдаун с помощью миРНК MYT1
Все линии злокачественных клеток выращивали в среде, рекомендованной поставщиком клеточных линий (ATCC). Среду для культивирования тканей, сыворотку и добавки приобретали у компании Sigma-Aldrich® (St. Louis, MO). Для скрининга в анализе пролиферации (фиг.1), клетки высевали в 384-луночные планшеты для культуры тканей и выращивали с обработкой соединением или носителем. Через 96 часов CellTiter-Glo (Promega, Madison, WI) использовали в соответствии с протоколом изготовителя для аппроксимации содержания клеток. Образцы исследовали в трех повторениях, и рост рассчитывали в виде неисправленной величины CellTiter-Glo для обработанных образцов относительно контрольных лунок, обработанных носителем.
Для исследований нокдауна, NCI-H460 и KNS62 - две линии клеток немелкоклеточного рака легких, American Type Culture Collection, Manassas, VA, трансфицировали совокупностями миРНК (SMARTpool, Dharmacon, Thermo Fisher Scientific, Waltham, MA) либо с ненацеленными контрольными последовательностями, либо с последовательностями PKMYT1. Клетки высевали через 48 часов после трансфекции в 96-луночные планшеты для культивирования тканей, и на следующие сутки их обрабатывали соединением или носителем в течение 72 часов. Для аппроксимации содержания клеток использовали ViaLight (Lonza, Basel, Switzerland) в соответствии с протоколом изготовителя. Образцы исследовали в трех повторениях, и рост рассчитывали путем определения процента от контрольной неисправленной величины для каждой обработки.
B. Вестерн-блоттинг
Клетки лизировали в реагенте для экстракции белка млекопитающих (MPER, Thermo Fisher 78505, Waltham, MA), а затем подвергали SDS-PAGE и переносили на нитроцеллюлозную мембрану или мембрану из PVDF. Антитела, использованные для вестерн блоттинга, были из следующих источников: тотальный CDK1, pCDK1Y15, pCDK1T14, pCHK1S345, pStathminS38, pLaminA/CS22, мотив субстрата pCDK, γH2AX, Cyclin A и тотальный PKMYT1 от компании Cell Signaling Technologies (Beverly, MA); актин-HRP от компании Santa Cruz Biotechnology (Santa Cruz, CA); вторичные конъюгированные с HRP антитела против антител мыши и антитела кролика от компании GE Healthcare (Waukesha, WI). На блоты воздействовали хемилюминисцентным субстратом SuperSignal West Femto (Thermo Fisher Pierce, Waltham, MA).
C. Проточная цитометрия
Для выявления двунитевых разрывов ДНК, клетки окрашивали конъюгированным с FITC антителом против γH2AX (S139) (набор 17-344, Millipore, Billerica, MA) после фиксации в течение ночи в ледяном 70% растворе в этаноле пропидия йодида (PI)/РНКзы (BD Biosciences, Franklin Lakes, NJ) для выявления общего содержания ДНК. Для исследований, детально изучающих преждевременный митоз, добавляли антитело против pHH3-Alexa 647 (BD Biosciences 558217).
Для исследований синхронизации клетки инкубировали в бессывороточной среде в течение 36 часов, с последующим восполнением 20% FBS. За один час до каждого сбора клетки подвергали пульсирующей обработке 10 мкМ бромдеоксиуридина (BrdU). Клетки фиксировали и окрашивали для выявления содержания BrdU и ДНК посредством конъюгированного с FITC антитела против BrdU и красителя 7-аминоактиномицина-D (7-AAD), соответственно, в соответствии с инструкциями в наборе для проточной цитометрии BD Pharmingen™ FITC BrdU Flow Kit (BD Biosciences, Franklin Lakes, NJ). Все данные цитометриии получали на проточном цитометре BD LSR II, используя программное обеспечение BD FACS Diva™ (BD Biosciences, Franklin Lakes, NJ), и результаты анализировали в версии 7.5 FlowJo.
D. Исследования эффективности In Vivo
Самок мышей CD-1 Nu/Nu в возрасте 5-6 недель получали из Charles River Laboratories (Wilmington, DE) в виварии заявителя в стандартных лабораторных условиях и кормили саморасщепляющимся рационом 2018S (Harlan Laboratories, Indianapolis, IN) и водой без ограничений. Протокол был утвержден внутриучрежденческим комитетом заявителя по уходу за животными и их использованию. Мышам вводили клетки (1:1 Matrigel:PBS) подкожно (SC) в правый бок. Когда объем опухоли достигал 200 мм3 (+/-50) мышей подбирали по парам так, чтобы каждая группа имела сходную среднюю величину и среднее отклонение. Объем опухоли и массу тела регистрировали каждые 2 недели. Мышам проводили введение в течение четырех курсов два раза в сутки (BID) в течение двух суток, вводя либо носитель, либо WEE1-1 (60 мг/кг).
Пример 4
Ингибирование WEE1 прерывает клеточную пролиферацию в разнообразных линиях опухолевых клеток
Утрата экспрессии WEE1 у мышей посредством нацеливания на ген является летальной, прерывающей развитие, даже до того, как эмбрионы достигают стадии бластоцистов (сутки 3,5 преэмбрионального периода). Этот фенотип вызван апоптозом и преждевременными митозами в эмбрионах, а также повреждением ДНК в эмбриональных фибробластах мыши, не содержащих ген WEE1 (Tominaga, Y., et al., J. Biol. Sciences, 2006, 2(4):161-170). Кроме того, опосредуемый РНК-I сайленсинг WEE1 ведет к нарушению жизнеспособности в многочисленных трансформированных линиях клеток человека. WEE1-1 представляет собой сильнодействующий конкурирующий с АТФ ингибитор WEE1 и он сенсибилизирует злокачественные клетки к экзогенному повреждению ДНК (Hirai, H., et al., Mol. Рак Ther., 2009, 8(11):2992-3000). Заявители использовали этот низкомолекулярный ингибитор для исследования эффектов фармакологического ингибирования WEE1 в панели разнообразных линий опухолевых клеток человека (фиг.1).
Когда проводили скрининг 522 линии раковых клеток, соответствующих 16 различным типам опухолей WEE1-1, наблюдали широкий спектр ответов в клеточном пролиферативной анализе (фиг.1). Величины EC50 находились в диапазоне от ≤0,1 мкМ в 2% (9/522) до ≥1 мкМ в 19% (98/522) для исследованных линий клеток. Сравнение средних величин EC50 различных типов опухолей выявило, что, как группа, линии клеток рака ободочной и прямой кишки была менее чувствительной (средняя EC50=1,16 мкМ, n=66, диапазон от 0,17 до >10 мкМ) и линии клеток нейробластомы были в среднем более чувствительными к обработке WEE1-1 (средняя EC50=0,28 мкМ, n=7, диапазон от 0,12 до 0,45 мкМ). Размер выборки последней группы был ограничен, но данные о том, что клетки нейробластомы имеют тенденцию быть более отвечающими на ингибирование WEE1, согласуются с последними данными (Russell et al., submitted manuscript). Было заметно, что многие линии клеток продолжают расти и делиться даже в присутствии более высоких концентраций WEE1-1. Эти данные демонстрируют антипролиферативный потенциал фармакологического ингибирования WEE1 и разнообразие среди линий опухолевых клеток человека.
Пример 5
Ингибирование WEE1 активирует ответ на повреждение ДНК
Функциональный генный скрининг и подтверждающие исследования продемонстрировали, что нокдаун WEE1 приводит к двухцепочечным разрывам ДНК и активации ответа на повреждение ДНК (DDR). Заявители использовали pCHK1S345 в качестве маркера активированного DDR для исследования эффекта фармакологического ингибирования WEE1 в шести клеточных линиях с различной чувствительностью к WEE1-1: ES-2 (EC50=256 нМ), A2058 (EC50=225 нМ), A431 (EC50=170 нМ), A427 (EC50=116 нМ), KNS62 (EC50=487 нМ) и NCI-H460 (EC50=535 нМ). Вестерн-блоты для pCHK1S345 продемонстрировали дозозависимую активацию DDR во всех шести клеточных линиях и признаки увеличенного уровня pCHK1S345 уже при 50 нМ WEE1-1 в более чувствительных клеточных линиях, т.е. ES-2, A2058, A431 и A427 (фиг.2A). Увеличенная активность CDK в результате обработки WEE1-1 была подтверждена в клетках ES-2 (фиг.8A). Как и ожидалось, также наблюдали сопутствующее дозозависимое снижение pCDK1Y15 во всех шести клеточных линиях, указывающее на связь между индукцией DDR и увеличенной активностью CDK в результате ингибирования WEE1. Также известно, что фосфорилирование CDK1 и CDK2 в T14 посредством PKMYT1 снижает активность киназ CDK1/2 и WEE1-1 ингибирует PKMYT1 in vitro при приблизительно в 100 раз более высоких концентрациях, чем концентрации, требуемые для ингибирования WEE1 (Hirai, H., et al., 2009). Заявители задались вопросом, влияют ли на уровни pCDK1T14 концентрации WEE1-1, которые индуцируют повреждение ДНК. За исключением, возможно, клеточной линии A427, заявители не наблюдали зависимого от WEE1-1 эффекта на pCDK1T14 (фиг.2A).
Пример 6
Ингибирование WEE1 нарушает динамику S-фазы и целостность репликации ДНК
Для понимания того, где происходит зависимое от WEE1-1 повреждение ДНК, заявители проанализировали клетки рака яичника TOV21G проточной цитометрией. В клетках TOV21G на стадии экспоненциального роста от 1% до 2% популяции окрашивались положительно по маркеру двунитевого разрыва ДНК γH2AX. Однако обработка в течение только двух часов посредством WEE1-1 приводила к 23% клеток, окрашивающихся положительно по γH2AX (фиг.2B, левая панель). Содержание хромосом в положительных по γH2AX клетках составило >2N, что указывает на то, что во время или после инициации репликации ДНК в S-фазе происходит повреждение ДНК вследствие ингибирования WEE1. Когда клетки TOV21G обрабатывали WEE1-1 и импульсно метили BrdU, повреждение ДНК обнаруживалось практически исключительно в положительных по BrdU клетках (95% через 2 часа, 92% через 6 часов), что подтверждает наблюдение заявителя, что двунитевые разрывы ДНК являются следствием ингибирования WEE1 в процессе репликации ДНК (фиг.2B, правая панель).
Ожидалось, что хромосомные разрывы в S-фазе активируют точку контроля репликации ДНК и задерживают прогрессирование в S-фазе. Для подтверждения этого предположения проводили исследования с синхронизацией клеток. Для этих исследований были выбраны клеточные линии ES-2, поскольку они в большей степени подтверждены синхронизации G1, индуцируемой устранением митогена при истощении сыворотки, чем другие клетки (данные не представлены). Другие подходы для синхронизации в S-фазе (например, двойной тимидиновый блок, афидиколин, гидроксимочевина, актиномицин D, и т.д.) не использовали, поскольку эти способы могут независимо индуцировать повреждение ДНК и могут нарушать динамику репликации ДНК. Как показано на фиг.3A, устранение сыворотки на 36 часов не вызывало полную остановку клеток ES-2 в G1. Однако добавление 20% FBS приводило к тому, что популяция обработанных носителем клеток ES-2 в S-фазе удваивалась до примерно 40% через 8 часов и достигала пика, составляющего 50%, через 12-14 часов. Напротив, когда с добавлением 20% FBS была включена обработка WEE1-1, отсутствовало поддающееся обнаружению изменение популяции в S-фазе через 8 часов и пики уровней (примерно 50%) задерживались до 24 часов после обработки FBS (фиг.3A). Даже на пике, средняя интенсивность флуоресценции включенного BrdU была значительно более низкой в клетках, обработанных WEE1-1, по сравнению с клетками, обработанных носителем, что указывает на замедленную репликацию ДНК в положительной по BrdU популяции. Анализ с использованием вестерн-блоттинга, представленный на фиг.3A подтвердил замедленное прогрессирование S-фазы (циклин A), более быструю и более стойкую активацию DDR (pCHK1S345), и ингибирование активности киназы WEE1 (pCDK1Y15) в обработанных WEE1-1 клетках относительно обработанных носителем клеток. Интересно, что фосфорилирование pCDK1Y15 в клетках ES-2 возрастало в течение 24-часов. Степень двунитевых разрывов ДНК (γH2AX), индуцированных обработкой WEE1-1 в течение 24 часов, была заметно большей в условиях стимуляции митогеном, где наблюдали резкое увеличение репликации ДНК по сравнению с клетками, которые не стимулировали повторно (фиг.3B и фиг.9).
Пример 7
Повреждение ДНК в качестве основного цитотоксического следствия ингибирования WEE1
WEE1 требуется для временной активации как киназы CDK2, так и киназы CDK1, в S-фазе и G2-фазе клеточного цикла, соответственно. Таким образом, ожидалось, что ингибирование WEE1 приведет к дефектам S-фазы (разрывы двунитевой ДНК в процессе репликации ДНК) и G2-M (преждевременный митоз). Для оценки того, является ли необходимым или достаточным любой или оба из этих эффектов для чувствительности к WEE1-1, γH2AX и фосфорилированный гистон H3 (pHH3), являющийся маркером митоза, при цитотоксических концентрациях (EC90) WEE1-1 исследовали в трех чувствительных клеточных линиях: A2058, HT-29 и LoVo. После обработки WEE1-1 в течение 24 часов, процент положительных по pHH3 клеток возрастал во всех трех клеточных линиях (фиг.4). Из этих трех линий только клетки HT-29 содержали значительную митотическую популяцию, 43% с 4N ДНК и 23% с <4N ДНК, что указывает на преждевременный митоз из клеток в S-фазе, не завершивших репликацию ДНК. Однако во всех трех линиях после обработки WEE1-1 наблюдали существенную положительную по H2AX популяцию клеток (8% в A2058, 59% в HT-29, 27% в LoVo). Без связи с какой-либо теорией, эти данные указывают на то, что индукция двунитевых разрывов ДНК (γH2AX), а не преждевременный митоз (pHH3), была основным цитотоксическим следствием ингибирования WEE1 посредством WEE1-1 в чувствительных клеточных линиях.
Пример 8
Противоопухолевая активность in vivo вследствие ингибирования WEE1
Для определения эффекта монотерапии с введением WEE1-1 на рост опухоли in vivo в переносимах дозах, максимальная переносимая доза (MTD) была определена как 60 мг на кг для введения два раза в сутки (BID). Среднее снижение массы тела в ходе исследования в течение 28 суток в этой дозе и по этой схеме не превышало 5% в группе введения (данные не представлены). WEE1-1 ингибировал пролиферацию линии клеток немелкоклеточного рака легкого A427 в низких концентрациях (EC50=116 нМ) и сразу индуцировал ответ в виде повреждения ДНК (фиг.2A). В модели с ксенотрансплантатом A427, введение WEE1-1 вызывало регрессию до приблизительно 50% от первоначального среднего объема опухоли (фиг.5A). Индивидуальный анализ опухоли показал, что 9 из 10 опухолей A427, в случае введения носителя, вырастали в 2-6 раз относительно их исходного объема (фиг.5B). Напротив, конечные объемы для всех 10 опухолей после введения WEE1-1 были меньшими, чем их исходные объемы (фиг.5B). Эффекты против роста опухоли обработки единственным средством WEE1-1 наблюдали в дополнительных моделях с ксенотрансплантатами (фиг.5C): ингибирование роста опухоли (TGI) составило 92% в модели NSCLC SK-MES-1, 13% регрессию опухоли наблюдали в модели опухоли ободочной и прямой кишки LoVo, 88% TGI в модели эпидермоидной опухоли A431 и 64% TGI в модели NSCLC NCI-H2122. Процентный TGI вычисляли как 100-(100*ΔT/ΔC), если ΔT>0, где ΔT = конечный средний объем – исходный средний объем в группе введения и ΔC = конечный средний объем – исходный средний объем в контрольной группе носителя. В совокупности, эти данные продемонстрировали противоопухолевый терапевтический потенциал ингибирования WEE1 при хорошо переносимых дозах WEE1-1.
Пример 9
Экспрессия PKMYT1 влияла на чувствительность к ингибитору WEE1
Экспрессия WEE1 необходима для жизнеспособности эмбриона (Tominaga, Y., et al., 2006) и большинство подвергаемых скринингу злокачественных клеточных линий демонстрирует по меньшей мере некоторую степень чувствительности к обработке WEE1-1 (фиг.1). Однако не все клеточные линии были в равной степени чувствительными к ингибированию WEE1 и антипролиферативные EC50 варьировали по меньшей мере в 10 раз (фиг.1). Заявители обнаружили в рамках настоящего изобретения, что потенциальным решающим фактором в чувствительности к ингибированию WEE1 является активность функционально родственной CDK-ингибиторной киназы PKMYT1. Фосфорилирование CDK1 или CDK2 по любому из двух N-концевых участков, T14 или Y15, вызывало инактивацию этой киназы, несмотря на присутствие активирующего в ином случае циклинсвязывающего партнера (циклин B или циклин A, соответственно). Известно, что WEE1 фосфорилирует Y15 в CDK1 и CDK2, и было показано, что PKMYT1 аналогично ингибирует CDK1 и CDK2 путем фосфорилирования T14 и/или Y15 (Mueller, P.R., et al., Science, 1995, 270(5233):86-90).
В рамках настоящего изобретения заявители использовали нокдаун посредством миРНК для оценки того, может ли экспрессия PKMYT1 специфично изменять ответ на ингибирование WEE1 в двух клеточных линиях: NCI-H460 и KNS62. Эти линии были выбраны, поскольку они демонстрируют относительную нечувствительность к обработке WEE1-1 и обладают относительно высокой экспрессией PKMYT1 (данные не представлены). Клетки трансфицировали совокупностью различных миРНК, все из которых нацелены на PKMYT1, и анализировали в анализах пролиферации на чувствительность к различным цитотоксическим средствам (фиг.6A). Как проиллюстрировано на фиг.6A, антипролиферативные EC50 WEE1-1 в отношении NCI-H460 (n=3) и KNS62 (n=2) сдвигались с 677 нМ до 104 нМ и с 487 нМ до 93 нМ, соответственно, когда осуществлялся нокдаун PKMYT1. Примечательно, что истощение PKMYT1 не влияло на максимальный эффект обработки WEE1-1. С использованием кратности изменения EC50 в качестве показателя усиления, PKMYT1 усиливало WEE1-1 в среднем в 4,7 раза в клетках NCI-H460 (n=3) и в 4,9 раза в клетках KNS62 (n=2). Специфичность зависимой от PKMYT1 сенсибилизации к WEE1-1 подтверждалась идентичными кривыми доза-эффект как в контрольных клетках (CT), так и в клетках обработанных миРНК PKMYT1, обработанных карбоплатином, ингибитором MEK (PD-0325901) или доксорубицином (фиг.6A). Анализ клеток KNS62 с использованием вестерн-блоттинга (фиг.6B) показал, что нокдаун PKMYT1 приводил к немного более низкому базовому фосфорилированию CDK1 и 2 на Y15 и значительно снижал базовое фосфорилирование на T14 (дорожка 9 против дорожек 1 и 5). Нокдаун PKMYT1 также приводил к общему увеличению как pCHK1S345, так и γH2AX. Это согласовывалось с данными наблюдений, что опосредуемая WEE1-1 цитотоксичность была результатом повреждения ДНК (фиг.4A и 4B) и что нокдаун PKMYT1 увеличивал чувствительность к WEE1-1 и его антипролиферативный эффект (фиг.6B).
Поскольку нокдаун PKMYT1 приводил к увеличенной чувствительности к WEE1-1, заявители предположили, что низкая экспрессия PKMYT1 также может прогнозировать наиболее отвечающие на WEE1-1 клеточные линии. Для подтверждения этой гипотезы панель из 522 клеточных линий для уровней мРНК PKMYT1 оценивали с использованием Broad-Novartis Cancer Cell Line Encyclopedia (CCLE), общедоступной базы данных клеточных линий совместного проекта между Broad Institute (Cambridge, MA) и Novartis Institute for Biomedical Research (Cambridge, MA) и его Genomics Institute of the Novartis Research Foundation (San Diego, CA) (Stransky, B. C., et al., Nature, 2012, 483:603-807). Из 522 клеточных линий злокачественной опухоли, проанализированных в отношении чувствительности к WEE1-1, данные об экспрессии PKMYT1 были доступны для 305 линий. График относительной экспрессии PKMYT1 из базы данных CCLE относительно наблюдаемых данных об ответе клеточных линий при 450 нМ WEE1-1 не продемонстрировал корреляции между мРНК PKMYT1 и чувствительностью к WEE1-1 (фиг.7A). Однако 24 из 33 клеточных линий (73%), которые погибали при обработке WEE1-1 в концентрации 450 нМ (ответ <0,25 по скорректированной шкале, указанный пунктирной линией на фиг.7A) имели уровень экспрессии мРНК PKMYT1, меньший среднего, т.е. 413±154.
Для дальнейшего исследования гипотезы, что экспрессия PKMYT1 была прогнозирующей для чувствительности к WEE1-1, было выбрано 13 дополнительных клеточных линий из базы данных CCLE, которые ранее не обрабатывали WEE1-1. Антипролиферативные величины EC50 для WEE1-1 в этих клеточных линиях 13 коррелировали как с экспрессией мРНК (фиг.7B, левая панель), так и с уровнями белков (фиг.7B, правая панель) PKMYT1. Взятые вместе, эти данные подтверждают гипотезу, что низкая экспрессия PKMYT1 прогнозирует отвечающие на WEE1-1 клеточные линии, т.е. чувствительность к обработке WEE1-1.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ, ДИАГНОСТИЧЕСКИЕ И ПРОГНОСТИЧЕСКИЕ СПОСОБЫ ДЛЯ РАКА МОЧЕВОГО ПУЗЫРЯ | 2015 |
|
RU2739942C2 |
| БИОМАРКЕРЫ, ПРОГНОЗИРУЮЩИЕ СПОСОБНОСТЬ К ТЕРАПЕВТИЧЕСКОМУ ОТВЕТУ НА ТЕРАПИЮ ХИМЕРНЫМ РЕЦЕПТОРОМ АНТИГЕНА, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2743657C2 |
| ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ | 2012 |
|
RU2614254C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРА ATR | 2018 |
|
RU2813966C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2718542C2 |
| МАРКЕРЫ, АССОЦИИРОВАННЫЕ С ИНГИБИТОРАМИ WNT | 2014 |
|
RU2663701C2 |
| БИОМАРКЕРЫ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С PD-1 И PD-L1 СОСТОЯНИЙ | 2014 |
|
RU2820869C1 |
| БИОМАРКЕРЫ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С PD-1 И PD-L1 СОСТОЯНИЙ | 2014 |
|
RU2701378C2 |
| КОМБИНАЦИЯ ИНГИБИТОРОВ ЧЕКПОЙНТ-КИНАЗЫ 1 И ИНГИБИТОРОВ КИНАЗЫ WEE 1 | 2011 |
|
RU2627841C2 |
| СПОСОБ ПРИМЕНЕНИЯ AXL В КАЧЕСТВЕ МАРКЕРА ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОГО ПЕРЕХОДА | 2010 |
|
RU2586493C2 |
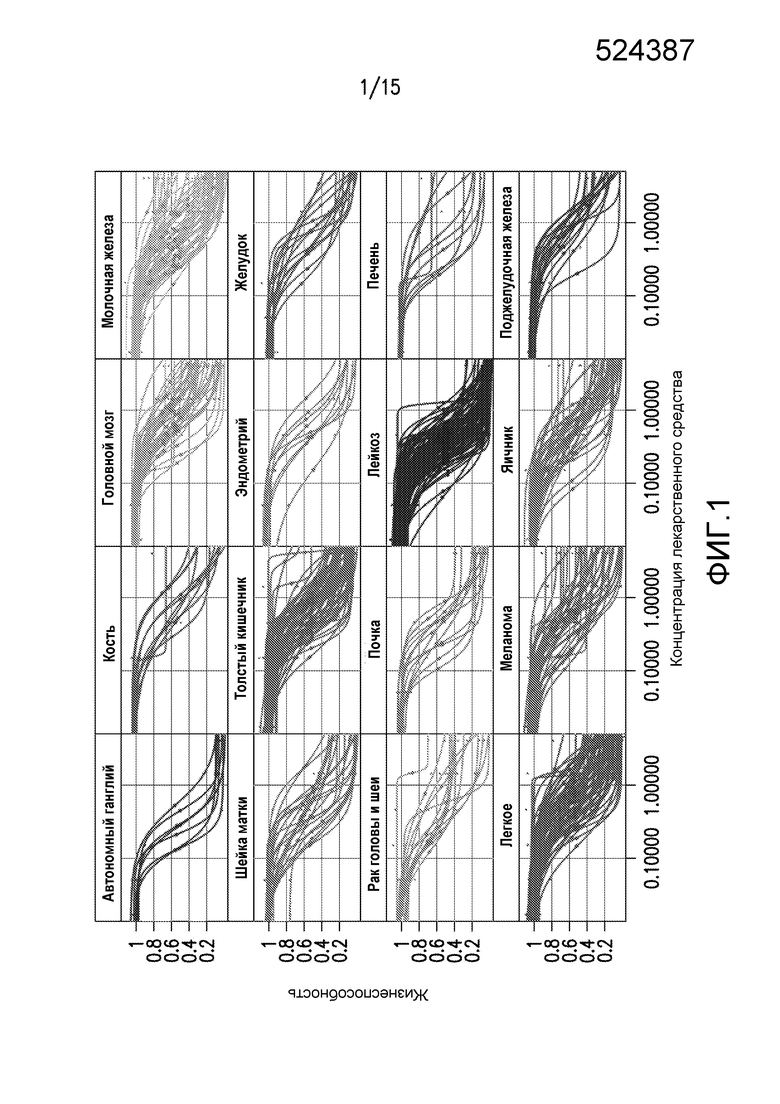

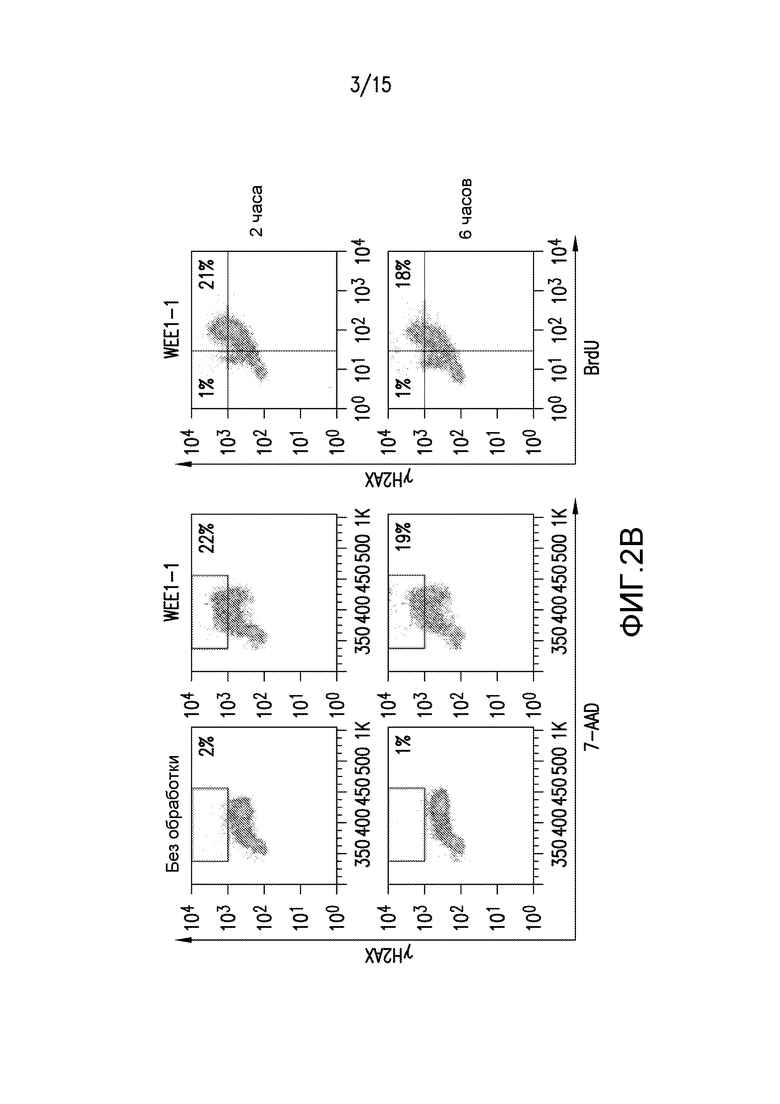
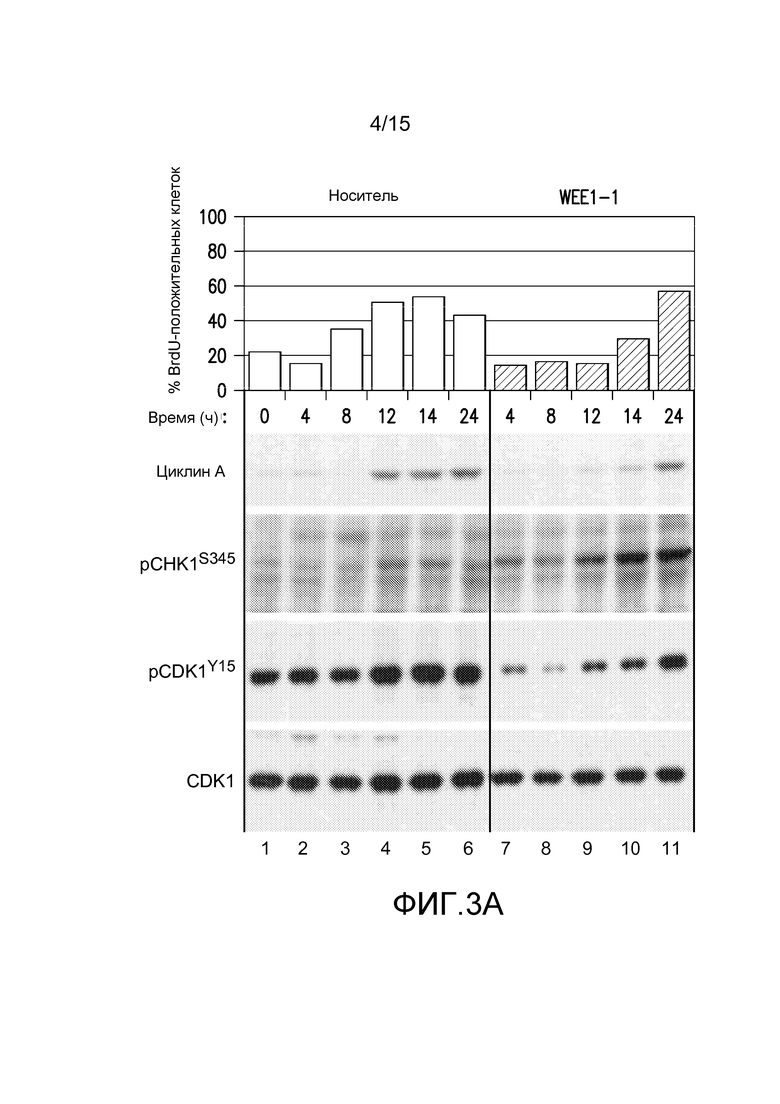
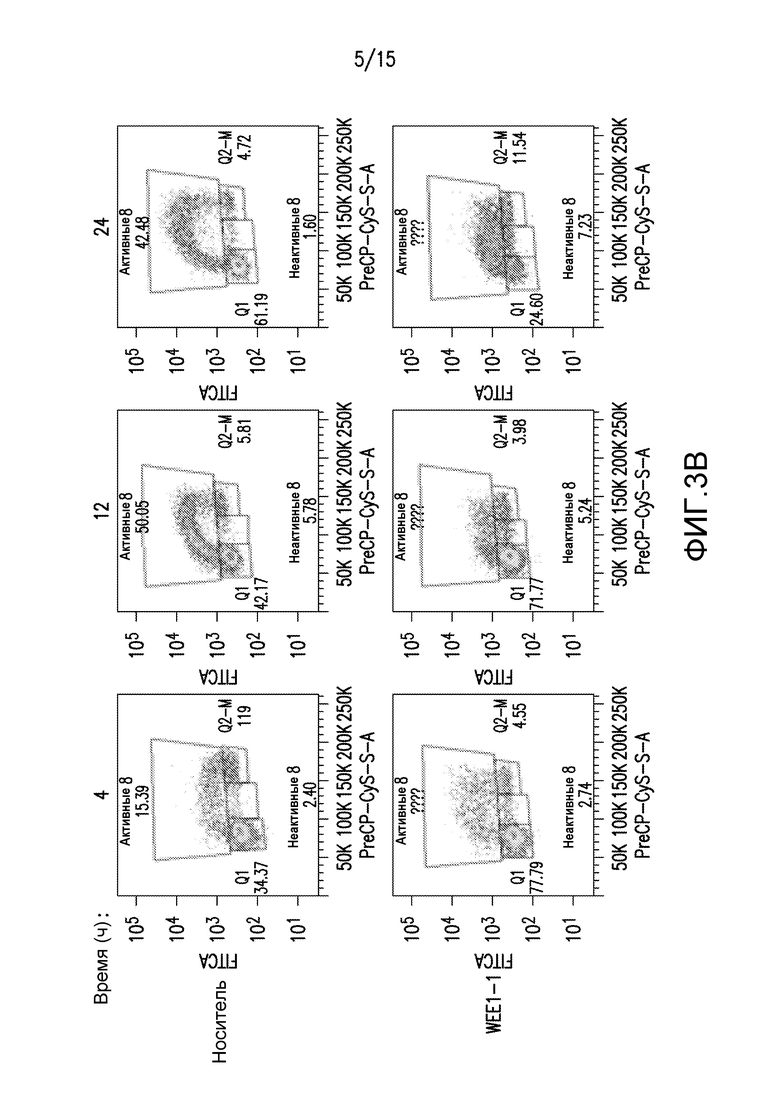
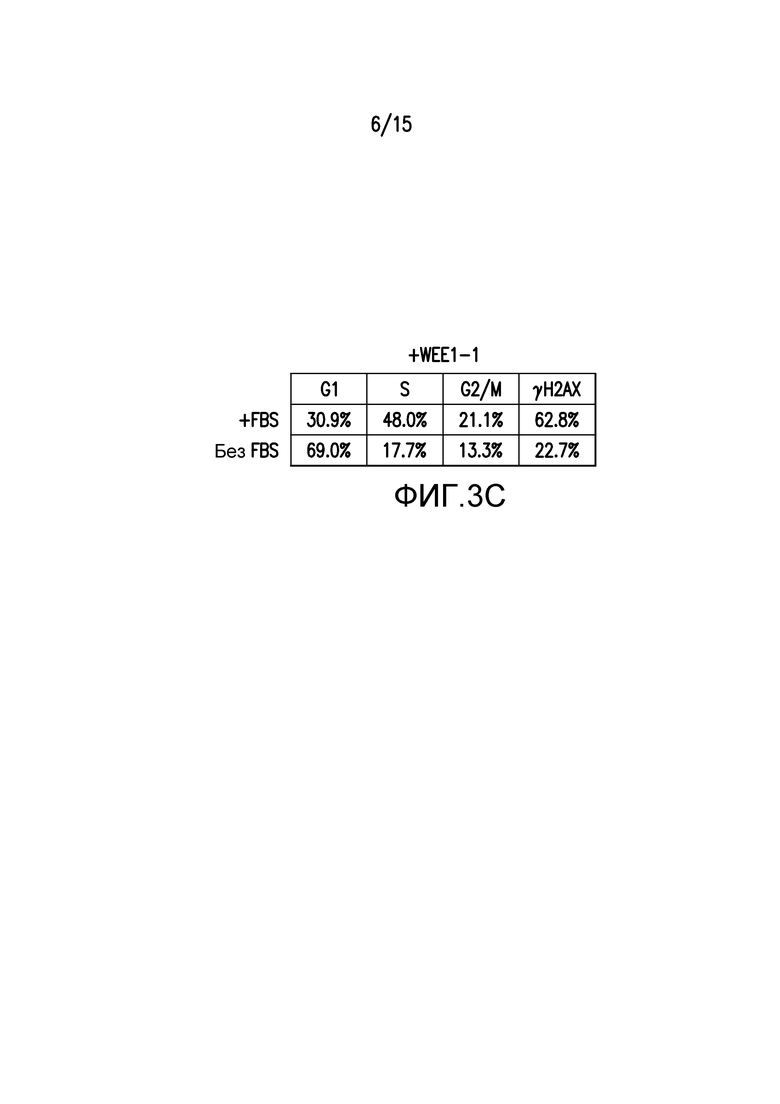
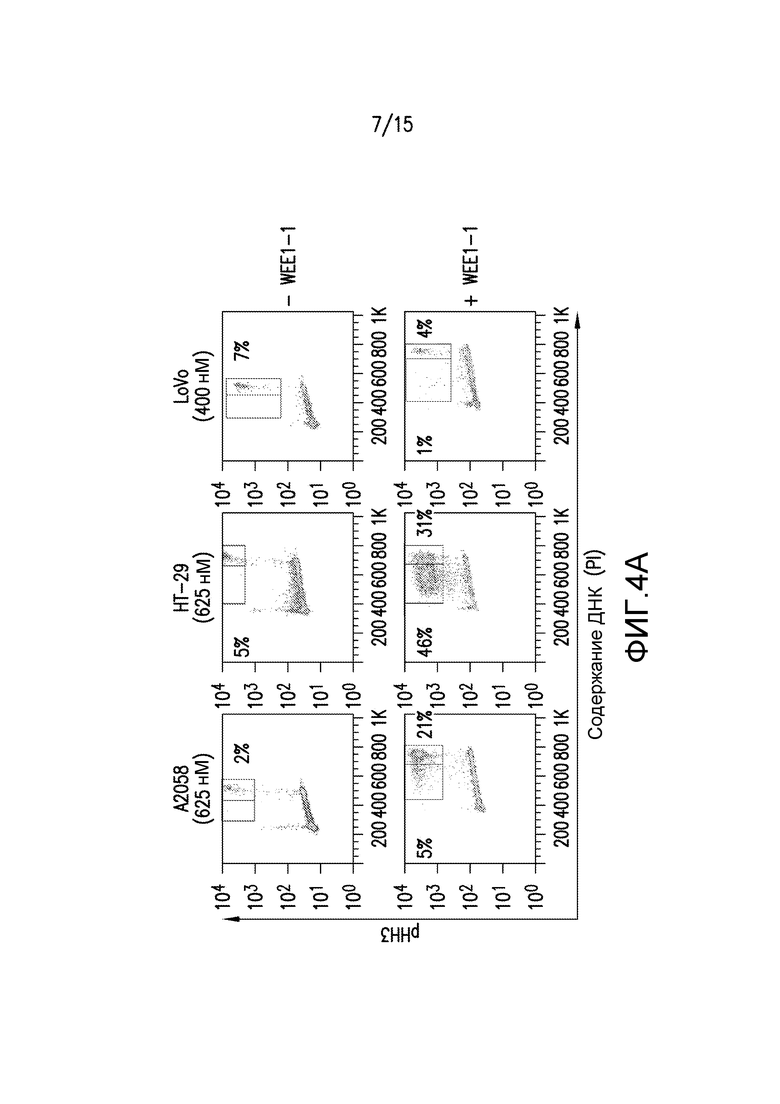
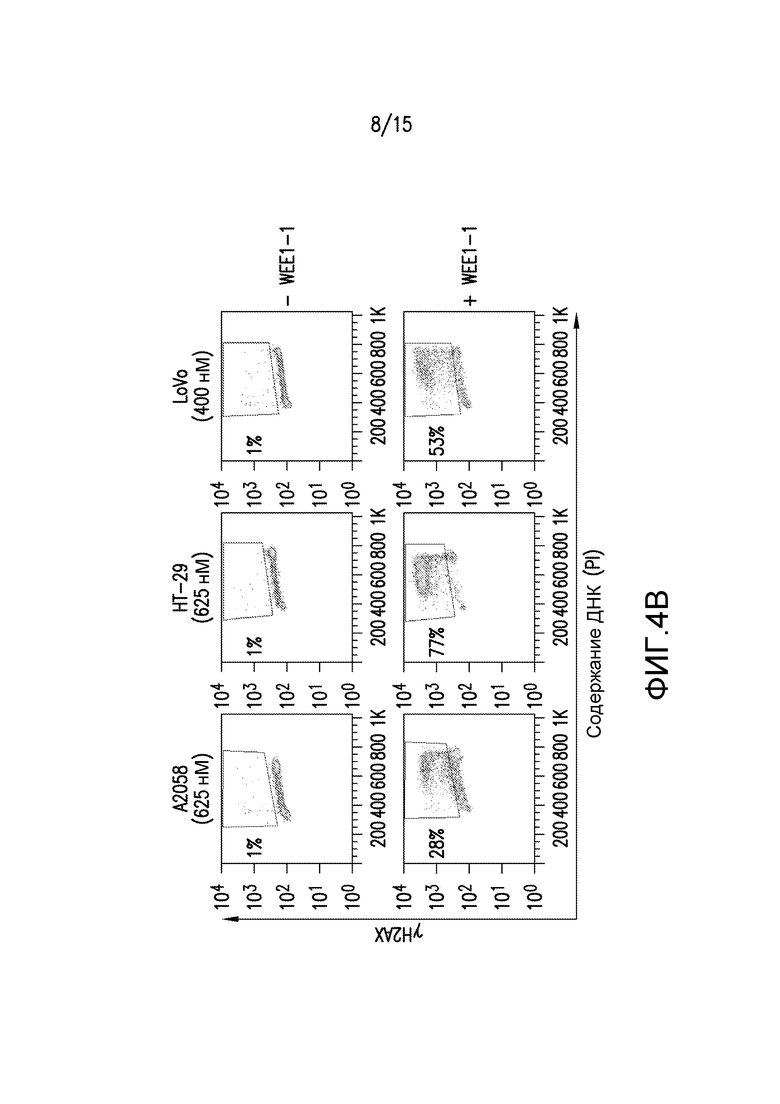
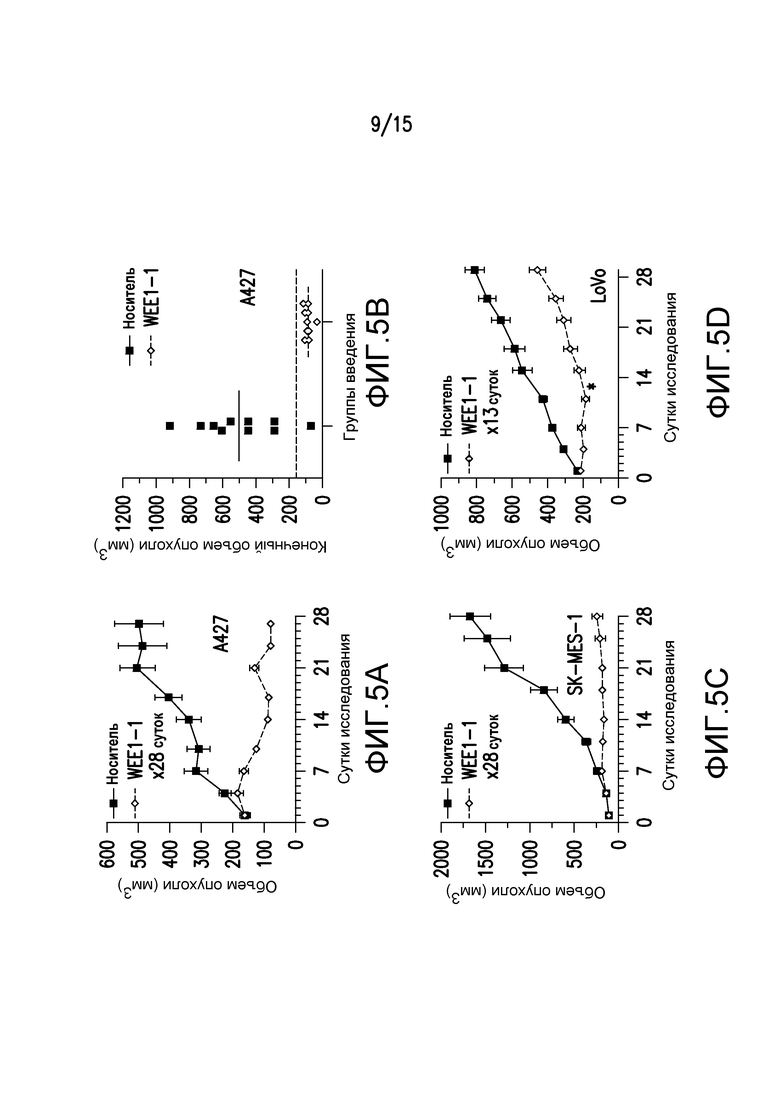
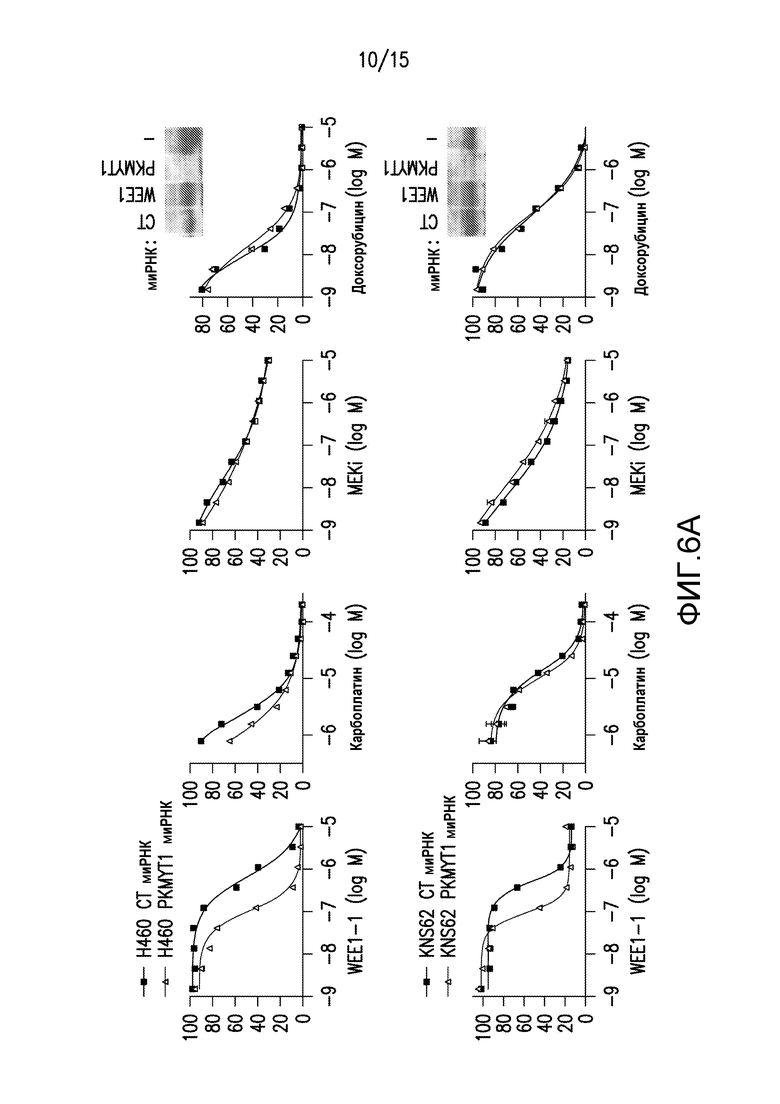

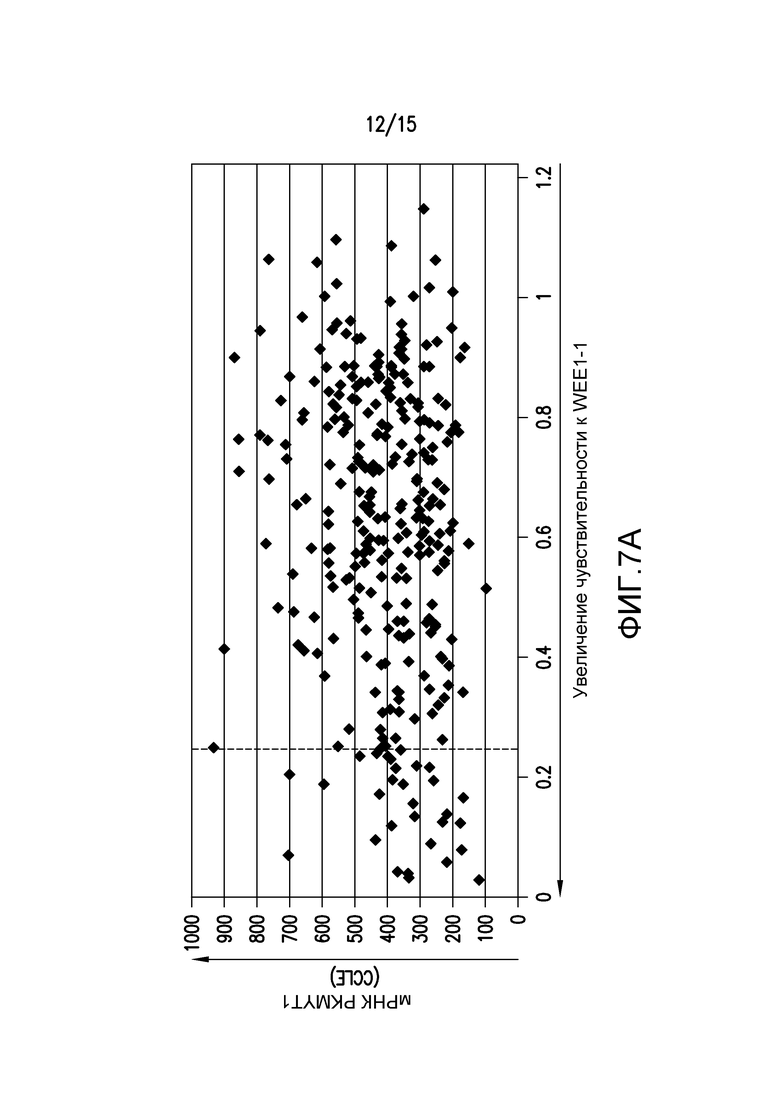
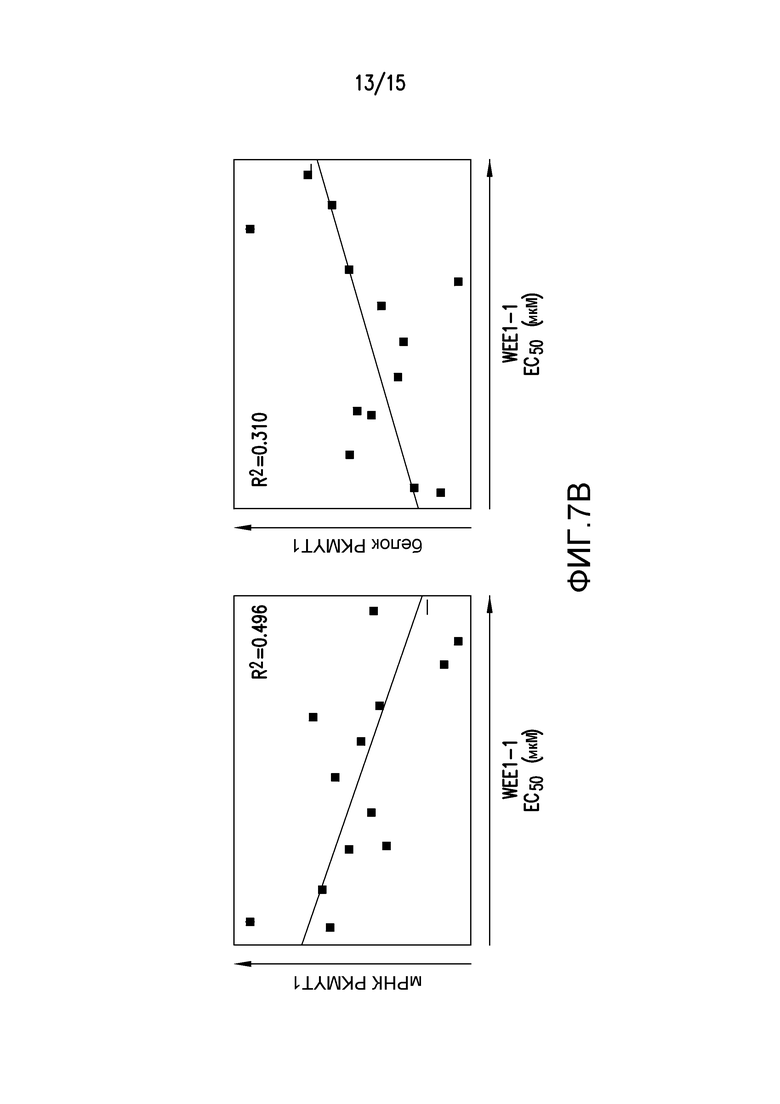
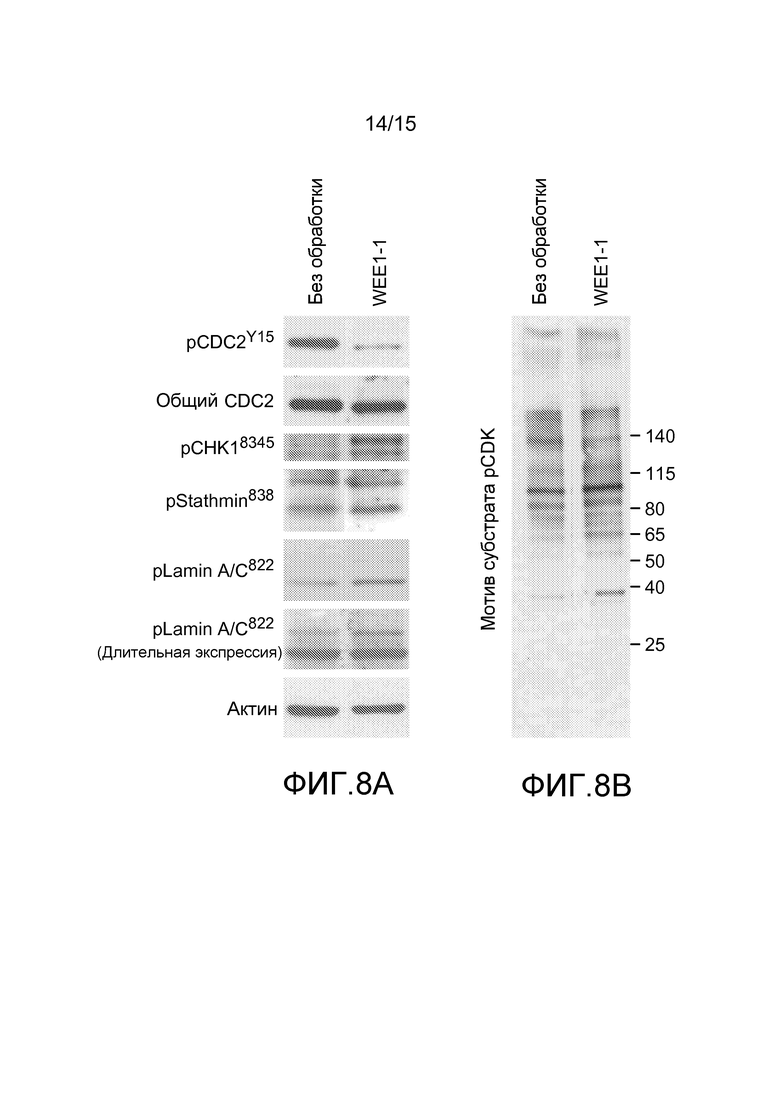
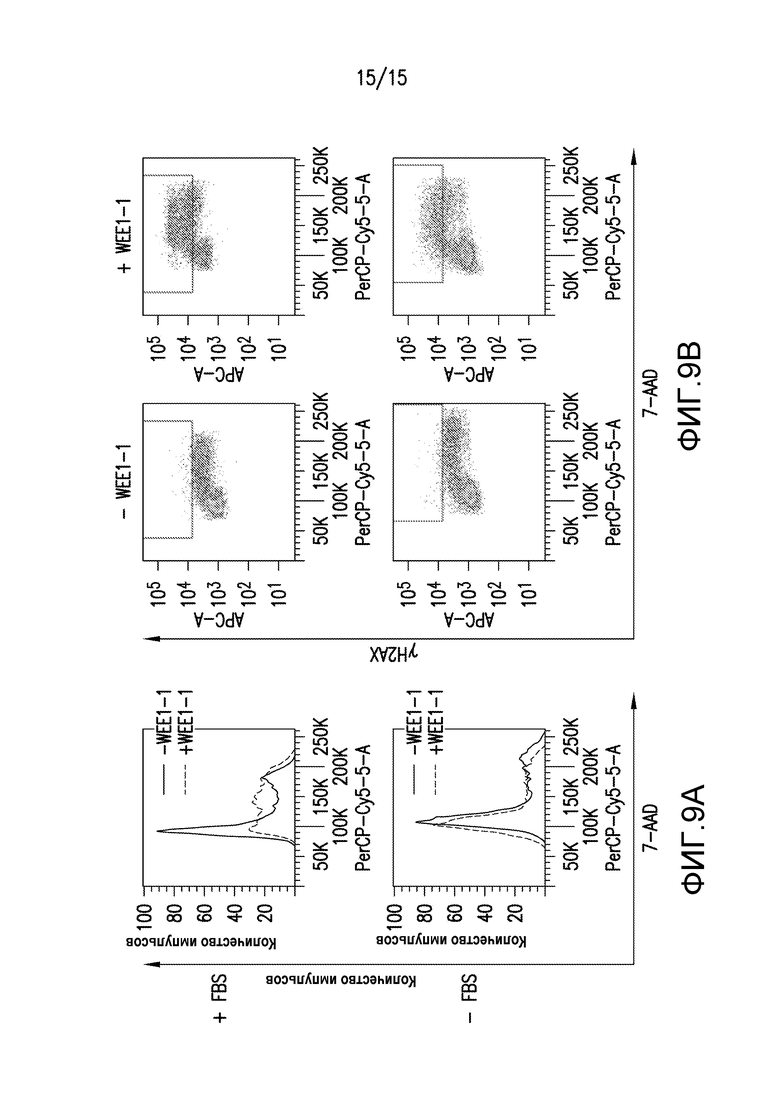
Группа изобретений относится к медицине и может быть использована для лечения пациента, у которого диагностирована злокачественная опухоль, ассоциированная с киназой WEE1. Для этого пациенту проводят измерение уровня экспрессии гена PKMYT1 в биологическом образце, содержащем злокачественные клетки, полученном от указанного пациента, и в контрольном образце. После чего определяют, является ли уровень экспрессии гена PKMYT1 в указанном образце от пациента более высоким или более низким, чем уровень экспрессии в указанном контрольном образце. Затем проводят отбор указанного пациента для лечения ингибитором WEE1, если уровень PKMYT1 из образца пациента является более низким, чем в контрольном образце. И выбранному пациенту для лечения злокачественной опухоли вводят ингибитор WEE1. Также предложен способ лечения пациента со злокачественной опухолью, ассоциированной с киназой WEE1, где пациенты характеризуются низкими уровнями экспрессии PKMYT1. Группа изобретений обеспечивает лечение злокачественной опухоли у пациентов с низкими уровнями экспрессии PKMYT1. 3 н. и 10 з.п. ф-лы, 20 ил., 9 пр.
1. Способ лечения пациента, у которого диагностирована злокачественная опухоль, ассоциированная с киназой WEE1, ингибитором WEE1, включающий:
(a) измерение уровня экспрессии гена PKMYT1 в биологическом образце, содержащем злокачественные клетки, полученном от указанного пациента, и в контрольном образце;
(b) определение того, является ли уровень экспрессии гена в указанном образце от пациента более высоким или более низким, чем уровень экспрессии в указанном контрольном образце;
(c) отбор указанного пациента для лечения ингибитором WEE1, где уровень PKMYT1 из указанного образца пациента является более низким, чем в контрольном образце; и
(d) введение ингибитора WEE1 выбранному пациенту.
2. Способ по п.1, где указанный контрольный образец получают от одного или нескольких индивидуумов, которые не имеют заболевания или у которых не была диагностирована злокачественная опухоль, ассоциированная с киназой WEE1.
3. Способ по п.1, где указанный ингибитор WEE1 представляет собой WEE1-1, или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль.
4. Способ по п.3, где указанный ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль.
5. Способ по п.3, где указанный ингибитор WEE1 представляет собой WEE1-2 или его фармацевтически приемлемую соль.
6. Способ лечения пациента со злокачественной опухолью, чувствительного к лечению ингибитором WEE1, включающий:
(a) измерение уровня экспрессии гена PKMYT1 в биологическом образце, содержащем злокачественные клетки, полученном от указанного пациента, и в контрольном образце;
(b) определение того, является ли уровень экспрессии гена в указанном образце от пациента более высоким или более низким, чем уровень экспрессии в указанном контрольном образце;
(c) идентификацию указанного чувствительного пациента для лечения ингибитором WEE1, где уровень PKMYT1 в указанном образце пациента является более низким, чем в контрольном образце; и
(d) введение ингибитора WEE1 чувствительному пациенту.
7. Способ по п.6, где указанный контрольный образец получен от одного или двух индивидуумов, которые не имеют заболевания или у которых не диагностирована злокачественная опухоль, ассоциированная с киназой WEE1.
8. Способ по п.6, где указанный ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль.
9. Способ по п.8, где указанный ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль.
10. Способ по п.8, где указанный ингибитор WEE1 представляет собой WEE1-2 или его фармацевтически приемлемую соль.
11. Способ по п.6, где указанная злокачественная опухоль представляет собой злокачественную опухоль, ассоциированную с киназой WEE1, выбранную из группы, состоящей из рака молочной железы, рака легкого, рака поджелудочной железы, рака толстого кишечника, рака яичника, острого лейкоза, хронического лимфоцитарного лейкоза, хронического миелоцитарного лейкоза и лимфомы Ходжкина.
12. Способ лечения пациента со злокачественной опухолью, ассоциированной с киназой WEE1, нуждающегося в лечении, включающий введение терапевтически эффективного количества ингибитора WEE1, где ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль, или WEE1-2 или его фармацевтически приемлемую соль, и где злокачественные клетки указанного пациента, подлежащего лечению, характеризуются низкой экспрессией PKMYT1.
13. Способ по п.12, где ингибитор WEE1 представляет собой WEE1-1 или его фармацевтически приемлемую соль.
| WO 2012074754 А1, 07.06.2012 | |||
| US 2012172370 A1, 05.07.2012 | |||
| US 2011092520 А1, 21.04.2011 | |||
| TIBES R et al., RNAi screening of the kinome with cytarabine in leukemias, Blood 2012, 119:2863-2872 - реферат, C | |||
| СОРТИРОВКА-ГОРКА | 1925 |
|
SU2863A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
Авторы
Даты
2018-07-05—Публикация
2013-11-22—Подача