ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение предлагает новое антитело против белка запрограммированной смерти клетки 1 (англ. PD-1, programmed cell death protein 1 - белок запрограммированной смерти клетки 1) (анти-PD-1 антитело) или его функциональный фрагмент. В частности, настоящее изобретение также относится к применению антитела при приготовлении лекарственного средства для лечения опухолей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Передача сигнала от Т-клеточного корецептора является важным механизмом четкого регулирования иммунных ответов. Молекулы клеточной поверхности для передачи косигналов (включая костимуляцию и косупрессию) можно подразделить на два основных семейства: суперсемейство иммуноглобулинов (lg) и суперсемейство фактора некроза опухоли (TNF)-рецептор фактора некроза опухоли (TNFR). Как правило, активация Т-клеток зависит от антигенных пептидов, представленных молекулами HLA (англ. human leukocyte antigens - антигены лейкоцитов человека) класса I или II. Корецепторные сигналы будут усиливать либо предотвращать такую активацию. Например, инициацию и зрелость лимфоцитов в периферических лимфоидных органах можно стимулировать или их реакцию в организме можно усиливать за счет активации CD28 или 4-1ВВ агонистами с помощью уникальных путей костимуляции. Иммунная активация также может быть обеспечена путем блокирования косупрессии сигнальных путей с помощью антагонистов, как, например, пути белка запрограммированной смерти клетки 1 (PD-1), В7 гомолога 1 (В7-Н1, также называемого PDL1), пути антигена 4 цитотоксических Т-лимфоцитов (CTLA4), В/Т лимфоцитарного аттенюатора (англ. BTLA) и других путей. Такие косупрессии сигнальных путей играют важную роль в регуляции иммунной толерантности, обеспечивающей отрицательные сигналы, которые ограничивают, обрывают и/или ослабляют иммунные реакции. Иммунная активация, опосредованная костимуляцией рецепторов, активируется путем стимулирования мембранной проксимальной киназы и продуцирует каскадное усиление фосфорилирования, тогда как косупрессия рецепторов, таких как CTLA4, PD1 и В/Т лимфоцитарного аттенюатора (BTLA), вовлекает фосфатазу в обратное фосфорилирование, индуцированное иммунной активацией. Иммуномодулирующие биологические композиции могут широко применяться при лечении иммунопатологических заболеваний, для ингибирования гиперфункции иммунной системы, вызванной отторжением трансплантата, аутоиммунным заболеванием или воспалительным заболеванием, или для стимулирования иммунного ответа в случае гипофункции иммунной системы, как, например, при онкологическом заболевании, хронической бактериальной инфекции и вирусной инфекции и тому подобном. В отличие от распространенных методов лечения, в основе которых лежат моноклональные антитела и рекомбинантные слитые белки, то есть действующих за счет нейтрализации или потребления антигенов-мишеней или положительных клеток-мишеней, иммуномодулирующие биологические композиции регулируют сигналы в отношении антиген-специфических Т-клеточных (TCR) и В-клеточных (BCR) рецепторов преимущественно путем связывания и регуляции сигнальных молекул на поверхности иммуноцитов хозяина, что позволяет управлять направлением и интенсивностью реакции лимфоцитов.
Ген PD-1 активируется при апоптозе Т-клеточной гибридомы и называется белком запрограммированной смерти клетки 1. PD-1 (CD279) экспрессируется в активированных Т-клетках, В-клетках и активированных миелоидных клетках (Ishida Y, Agata Y, Shibahara K, Honjo Т. EMBO J. 1992, 1: 3887-3895), а также экспрессируется в активированных макрофагах, DC (англ. dendritic cell - дендритная клетка) и моноцитах, но отсутствует в их незрелых клетках (Agata Y, et al. Int. Immunol. 1996, 8: 765-772; Said E A, et al. Nature Med. 2010, 16: 452-459). Такие повышенные уровни экспрессии PD-1 на клеточной поверхности могут ингибировать приобретенные иммунные ответы и врожденные иммунные ответы организма. Внутриклеточный домен PD-1 содержит два тирозиновых сайта, один из которых представляет собой иммунорецепторный тирозиновый ингибирующий мотив (англ. ITIM, immunoreceptor tyrosine-based inhibitory motif), а другой - иммунорецепторный тирозиновый переключающий мотив (англ. ITSM, immunoreceptor tyrosine-based switch motif). Фосфорилирование тирозина на ITSM задействует тирозинфосфатазу SHP2 и/или SHP1. Эти фосфатазы будут дефосфорилировать ZAP70, CD3 и PKC, ослабляя тем самым сигналы Т-клеток. PD-1 в основном ингибирует пролиферацию Т-клеток и В-клеток, блокируя клетки в G0/G1 фазе, и ингибирует образование цитокина в Т-клетках. Животные с делецией экспрессии PD-1 развивают различные аутоиммунные фенотипы, включая аутоиммунную кардиомиопатию и волчаночноподобный синдром с артритом и нефритом (Nishimura et al. Immunity. 1999, H: 141-51; Nishimura et al. Science. 2001, 291: 319-22). Кроме того, PD-1 также играет важную роль в аутоиммунном энцефаломиелите, системной красной волчанке (SLE), болезни "трансплантат против хозяина" (GVHD), диабете I типа и ревматоидном артрите и т.д. (Salama et al. J Exp Med. 2003, 198: 71-78; Prokunina and Alarcon-Riquelme, Hum Mol Genet. 1992, 13: R143; Nielsen et al. Lupus. 2004, 11: 510).
В настоящее время в литературе описаны два лиганда для PD-1, PD-L1/B7H1/CD274 и PD-L2/B7-DC/CD273 (Freeman G J, et al. J. Exp. Med. 2000, 192: 1027-1034; Latchman Y, et al. Nature Immunol. 2001, 2: 261-268). PD-L1 экспрессируется на низком уровне в иммуноцитах, таких как В-клетки, дендритные клетки, макрофаги и Т-клетки, имеет повышенный уровень экспрессии при активации клетки. PD-L1 также экспрессируется в нелимфоидных органах, таких как клетки эндотелия сосудов, сердце, легкие, поджелудочная железа, мышца, кератиноциты и плацента и т.д. Экспрессия PD-L1 в нелимфоидной ткани показывает, что PD-L1 может регулировать функцию аутореактивных Т-клеток, В-клеток и миелоидных клеток в периферических тканях, и может также участвовать в воспалительных реакциях органа-мишени. Экспрессия PD-L1 регулируется главным образом интерфероном 1 или 2, которые также являются основными регуляторами уровня PD-L1 в клетках эндотелия сосудов и клетках эпителия. PD-L1 также экспрессируется в опухолевых клетках и тесно связан с неблагоприятным прогнозом. Различные вирусные инфекции могут индуцировать экспрессию PD-L1 в тканях хозяина на высоком уровне. Хотя PD-L2-транскрипт обнаружен в негемопоэтических тканях, таких как сердце, печень и поджелудочная железа, экспрессия PD-L2/B7-DC на клеточной поверхности ограничена только макрофагами и дендритными клетками и зависит от продуцирования цитокинов IFNγ и Th2. Экспрессии PD-L1 и PD-L2 также подвержены воздействию различных стимуляций. PD-L1 на макрофагах индуцируется INFγ, тогда как PD-L2 регулируется IL-4. Аналогичное явление наблюдается также и на дендритных клетках. Исследования показывают, что PD-L1, вероятно, предпочтительно регулирует реакцию Тh1, тогда как PD-L2 будет регулировать реакцию Th2 клеток. И PD-L1, и PD-L2 могут ингибировать пролиферацию Т-клеток, продуцирование цитокинов и адгезию, опосредованную β1/β2 интегрином. PD-L2 может также запускать обратную сигнализацию дендритных клеток, посредством этого приводя к продуцированию IL-12 и активации Т-клетки.
Ось регуляции PD-L1-PD-1 играет ключевую роль в контроле над активацией Т-клетки человека и сохранении иммунной толерантности организма, а также используется опухолевой клеткой и вирусом при хронической вирусной инфекции (Yao S, Chen L. Trends Mol. Med. 2006, 12: 244-246; Zou W, Chen L. Nature Rev. Immunol. 2008, 8: 467-477). PD-L1 экспрессируется на высоком уровне в различных раковых тканях человека (Dong et al, Nat. Med. 2002, 8: 787-9). Экспрессия PD-L1 тесно связана с развитием и неблагоприятными прогнозами некоторых типов злокачественных опухолей (Thompson R Н, et al. Cancer Res. 2006, 66: 3381-3385). Также подтверждено, что путь PD-L1-PD1 способствует истощению популяции Т-клеток (Zajac A J, et al. J. Exp. Med. 1998, 188: 2205-2213). Путь PD-L1-PD1, обусловленный опухолями или вирусами, может привести к ускользанию раковых клеток от механизмов иммунологического надзора хозяина посредством различных механизмов, включая стимулирование инактивации Т-клеток, усталость, неотвечаемость и апоптоз, индуцирование амплификации регуляторной Т-клетки и усиление внутренней способности опухоли противостоять киллингу и апоптозу. Взаимодействие между PD-1 и PD-L1, опосредованное раковыми клетками, приводит к уменьшению инфильтрующих опухоль лимфоцитов, ингибированию опосредованной рецепторами Т-клеток пролиферации и усиленному ускользанию раковых клеток от иммунологического надзора (Dong et al. J. Mol. Med. 2003, 81: 281-7; Blank et al. Cancer Immunol. Immunother. 2005, 54: 307-314; Konishi et al. Clin. Cancer Res. 2004, 10: 5094-100).
На сегодняшний день все еще отсутствует удовлетворительный способ, позволяющий индуцировать эффективный иммунный ответ у больных раком, чтобы специфически блокировать ось регуляции PD-L1-PD-1 и обеспечить активацию противоопухолевого и противовирусного иммунного ответа. Таким образом, ощущается острая необходимость в разработке и развитии терапевтического способа, позволяющего специфически блокировать ось регуляции PD-L1-PD-1, преодолеть супрессию иммунного ответа пациентов, страдающих раковым заболеванием или хронической инфекцией.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В общем смысле, настоящее изобретение предлагает новое антитело против белка запрограммированной смерти клетки 1 или его функциональный фрагмент. В частности, антитело по настоящему изобретению представляет собой гуманизированное антитело.
Согласно одному из аспектов, настоящее изобретение предлагает антитело или его функциональный фрагмент, которые могут специфически связываться с PD-1, где антитело содержит тяжелую цепь и легкую цепь, где (i) тяжелая цепь включает в себя участки H-CDR1, H-CDR2 и H-CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO 7, 8 и 11, или 9, 10 и 11, соответственно; a (ii) легкая цепь включает в себя участки L-CDR1, L-CDR2 и L-CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO 12, 13 и 14, соответственно.
Согласно одному из аспектов, настоящее изобретение предлагает антитело или его функциональный фрагмент, которые могут специфически связываться с PD-1, где (i) тяжелая цепь включает в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 1, 2, 4 или 5; a (ii) легкая цепь включает в себя вариабельный участок легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 3 или 6.
Согласно другому аспекту, настоящее изобретение предлагает антитело или его функциональный фрагмент, которые могут специфически связываться с PD-1, где (i) тяжелая цепь включает в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 4 или 5; a (ii) легкая цепь включает в себя вариабельный участок легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 6.
Предпочтительно, антитело к PD-1 по настоящему изобретению выбирают из 10F8, 15Н6, ВА08-1 и ВА08-2.
Согласно еще одному аспекту, настоящее изобретение предлагает изолированный полинуклеотид, кодирующий антитело к PD-1 или его функциональный фрагмент по настоящему изобретению.
Согласно еще одному аспекту, настоящее изобретение предлагает комбинацию изолированных полинуклеотидов, включающую в себя полинуклеотид, кодирующий легкую цепь антитела к PD-1 или его функционального фрагмента по настоящему изобретению, и полинуклеотид, кодирующий тяжелую цепь антитела к PD-1 или его функционального фрагмента по настоящему изобретению.
Согласно еще одному аспекту, настоящее изобретение предлагает экспрессионный вектор, включающий в себя полинуклеотид по настоящему изобретению или комбинацию полинуклеотидов по настоящему изобретению, полинуклеотид эффективно связывается с регуляторной последовательностью, что позволяет осуществлять экспрессию полипептида, кодированного полинуклеотидом, в клетке-хозяине или бесклеточной экспрессирующей системе. Предпочтительно, экспрессионный вектор является вирусным вектором или невирусным вектором.
Согласно еще одному аспекту, настоящее изобретение предлагает фармацевтическую композицию, включающую в себя антитело к PD-1 или его функциональный фрагмент по настоящему изобретению и фармацевтически приемлемый носитель.
Согласно еще одному аспекту, настоящее изобретение предлагает способ лечения или предупреждения ракового или инфекционного заболевания у субъекта, нуждающегося в этом, включающий в себя введение субъекту антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению. Согласно некоторым определенным вариантам осуществления, субъект получает или предполагает получать терапию антителом к CD3 (анти-CD3 антитело).
Согласно еще одному аспекту, настоящее изобретение предлагает способ усиления Т-клеточного иммунного ответа у субъекта, нуждающегося в этом, включающий в себя введение субъекту антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению. Согласно некоторым вариантам осуществления, усиление Т-клеточного иммунного ответа включает в себя усиление продуцирования цитокинов Т-клетками, предпочтительно, цитокин включает в себя IL-2 и/или IFN-γ. Согласно некоторым предпочтительным вариантам осуществления, усиление продуцирования цитокинов Т-клетками включает в себя продуцирование цитокинов Т-клетками, стимулированными антителом к CD3. Согласно некоторым другим предпочтительным вариантам осуществления, субъектом является пациент, страдающий раком, например, пациент, страдающий PD-L1-положительным раком, предпочтительно, пациент, страдающий раком легких или меланомой.
Согласно еще одному аспекту, настоящее изобретение предлагает способ стимулирования активации Т-клетки у субъекта, нуждающегося в этом, включающий в себя введение субъекту антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению. Предпочтительно, способ также включает в себя введение субъекту антитела к CD3.
Согласно еще одному аспекту, настоящее изобретение предлагает способ устранения ингибирования PD-L1 при активации Т-клетки у субъекта, нуждающегося в этом, включающий в себя введение субъекту антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению. Предпочтительно, способ также включает в себя введение субъекту антитела к CD3.
Согласно еще одному аспекту, настоящее изобретение предлагает способ (предпочтительно, in vitro (лат. in vitro - вне организма)) стимулирования активации Т-клетки, включающий в себя контактирование антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению с Т-клетками. Предпочтительно, способ также включает в себя контактирование антитела к CD3 с Т-клетками.
Согласно еще одному аспекту, настоящее изобретение предлагает способ (предпочтительно, in vitro) устранения ингибирования PD-L1 при активации Т-клетки, включающий в себя контактирование антитела к PD-1 или его функционального фрагмента, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора и/или фармацевтической композиции по настоящему изобретению с Т-клетками. Предпочтительно, способ также включает в себя контактирование антитела к CD3 с Т-клетками.
Согласно еще одному аспекту, способ по изобретению также представляет комбинированную терапию, включающую в себя введение антитела к PD-1 по настоящему изобретению и антитела к CD3 субъекту, нуждающемуся в этом.
Согласно еще одному аспекту, настоящее изобретение предлагает применение антитела к PD-1 или его функционального фрагмента по настоящему изобретению при приготовлении лекарственного средства для лечения или предупреждения ракового или инфекционного заболевания.
Согласно еще одному аспекту, настоящее изобретение предлагает применение антитела к PD-1 или его функционального фрагмента по настоящему изобретению при приготовлении лекарственного средства для усиления Т-клеточного иммунного ответа. Согласно некоторым вариантам осуществления, усиление Т-клеточного иммунного ответа включает в себя усиление продуцирования цитокинов Т-клетками, предпочтительно, цитокин включает в себя IL-2 и/или IFN-γ. Согласно некоторым предпочтительным вариантам осуществления, усиление продуцирования цитокинов Т-клетками включает в себя продуцирование цитокинов Т-клетками, стимулированными антителом к CD3.
Согласно некоторым вариантам осуществления, антитело к PD-1 или его функциональный фрагмент по настоящему изобретению могут применяться для лечения PD-L1 положительного рака и PD-1 отрицательного рака. Согласно некоторым определенным вариантам осуществления, раковое заболевание является раком легких или меланомой (например, PD-L1 положительным раком легких или меланомой и/или PD-L1 отрицательным раком легких или меланомой), а инфекционное заболевание является ВИЧ-инфекцией или вирусом гепатита В.
Согласно некоторым определенным вариантам осуществления, антитело к PD-1 или его функциональный фрагмент согласно настоящему изобретению блокирует взаимодействие между PD-1 и PD-L1 и/или взаимодействие между PD-1 и PD-L2.
Согласно некоторым предпочтительным вариантам осуществления, антитело к PD-1 или его функциональный фрагмент по настоящему изобретению также включает в себя константный участок тяжелой цепи человеческого IgG4 или IgG1 и константный участок легкой цепи к-типа человека.
Настоящее изобретение также относится к способу скрининга и приготовления гуманизированного антитела, описанного выше: иммунизации мышей BLAC/C человеческим белком PD-1, скринингу мышиных антиген-специфических В-клеток с высоким титром посредствам проточного цитометра, клонированию генов тяжелой цепи антитела и вариабельного участка легкой цепи методом ОТ-ПЦР (англ. RT-PCR, reverse transcription polymerase chain reaction - полимеразная цепная реакция с обратной транскриптазой), затем экспрессии рекомбинантного антитела, используя 293 клетки. После очистки с помощью белка А и в результате скрининга на предмет сродства и блокирования активности связывания с PD-L1 в конечном итоге выбирали антитела 10F8 и 15Н6 с неожиданно высоким сродством к PD-1 и способностью к активации Т-клетки. Аминокислотные последовательности вариабельного участка тяжелой цепи антител 10F8 и 15Н6 представлены в SEQ ID NO 1 и 2, соответственно; два антитела содержат вариабельный участок легкой цепи с такой же аминокислотной последовательностью, как представлено в SEQ ID NO 3. Аминокислотные последовательности участков, определяющих комплементарность (CDRs, от англ. complementary-determining regions), тяжелой цепи (H-CDR1, H-CDR2 и H-CDR3) антитела 10F8 представлены в SEQ ID NO 7, 8 и 11, соответственно; аминокислотные последовательности CDRs участков тяжелой цепи (H-CDR1, H-CDR2 и H-CDR3) антитела 15Н6 представлены в SEQ ID NO 9, 10 и 11, соответственно; аминокислотные последовательности CDRs участков легкой цепи (L-CDR1, L-CDR2 и L-CDR3) антител 10F8 и 15Н6 представлены в SEQ ID NO 12, 13 и 14, соответственно. На основании последовательностей каркасных областей FR1, FR2, FR3 и FR4 (FR, от англ. - framework region) вариабельного участка тяжелой цепи было сделано сравнение с библиотекой последовательностей генов антитела человека и были обнаружены серии соответствующих кандидатных последовательностей вариабельных участков человеческого антитела эмбрионального типа, аналогичных последовательностям каркасных областей FR1, FR2, FR3 и FR4 вариабельного участка тяжелой цепи. Сродство к связыванию серии кандидатных последовательностей с молекулами HLA-DR анализировали методом компьютерного моделирования (в кремнии) для определения последовательностей рамок считывания с самым низким сродством, чтобы посредством этого в конечном итоге установить гуманизированные последовательности каркасных областей FR1, FR2, FR3 и FR4 вариабельного участка тяжелой цепи. На основе этих последовательностей каркасных областей, применяли анализ компьютерной модели молекулы для определения соответствующих аминокислотных остатков каркасных областей, зарезервированных в мышином антителе, необходимых для поддержания конфигурации CDR. Аминокислотные последовательности вариабельного участка тяжелой цепи гуманизированного антитела ВА08-1, соответствующие 10F8, и гуманизированного антитела ВА08-2, соответствующие 15Н6, представлены в SEQ ID NO 4 и 5, соответственно. Такой же анализ проводили для последовательности вариабельного участка легкой цепи мышиного антитела. На основании последовательностей каркасных областей FR1, FR2, FR3 и FR4 вариабельного участка легкой цепи было сделано сравнение с библиотекой последовательностей генов антитела человека (NCBI Ig BLAST) и были обнаружены соответствующие кандидатные последовательности вариабельных участков человеческого антитела эмбрионального типа, аналогичные последовательностям каркасных областей FR1, FR2, FR3 и FR4 вариабельного участка легкой цепи. Сродство к связыванию последовательностей с молекулами HLA-DR определяли с помощью компьютерного анализа (в кремнии), и выбирали последовательности каркасных областей с самым низким сродством, чтобы посредством этого в конечном итоге установить гуманизированные последовательности каркасных областей FR1, FR2, FR3 и FR4 вариабельных участков легкой цепи. Учитывая эти последовательности каркасных областей, применяли анализ компьютерной модели молекулы для определения пространственной стереоструктуры мышиного антитела и для анализа соответствующих аминокислотных остатков каркасных областей, зарезервированных в легкой цепи мышиного антитела, необходимых для поддержания конфигурации CDR. Вариабельные участки легкой цепи гуманизированного антитела ВА08-1 и гуманизированного антитела ВА08-2, соответствующие 10F8 и 15Н6, представлены в SEQ ID NO 6.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
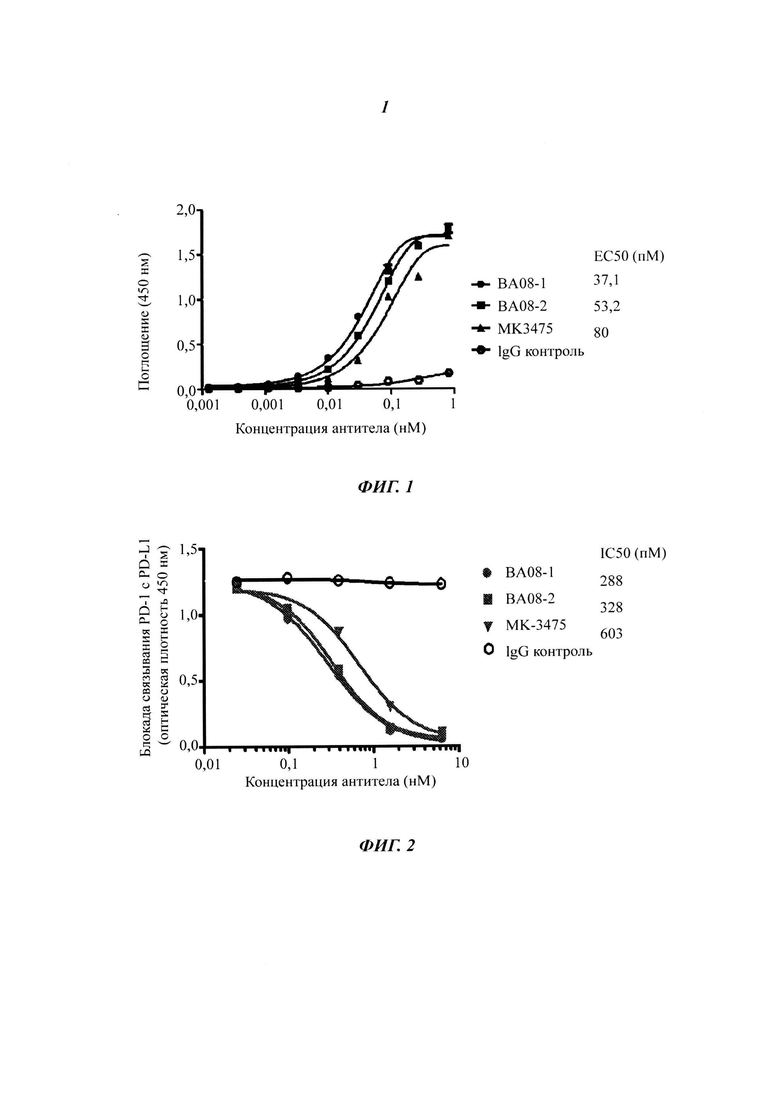
На Фиг. 1 показано, что антитела ВА08-1 и ВА-08-2 связываются с белком PD-1 с высоким сродством.
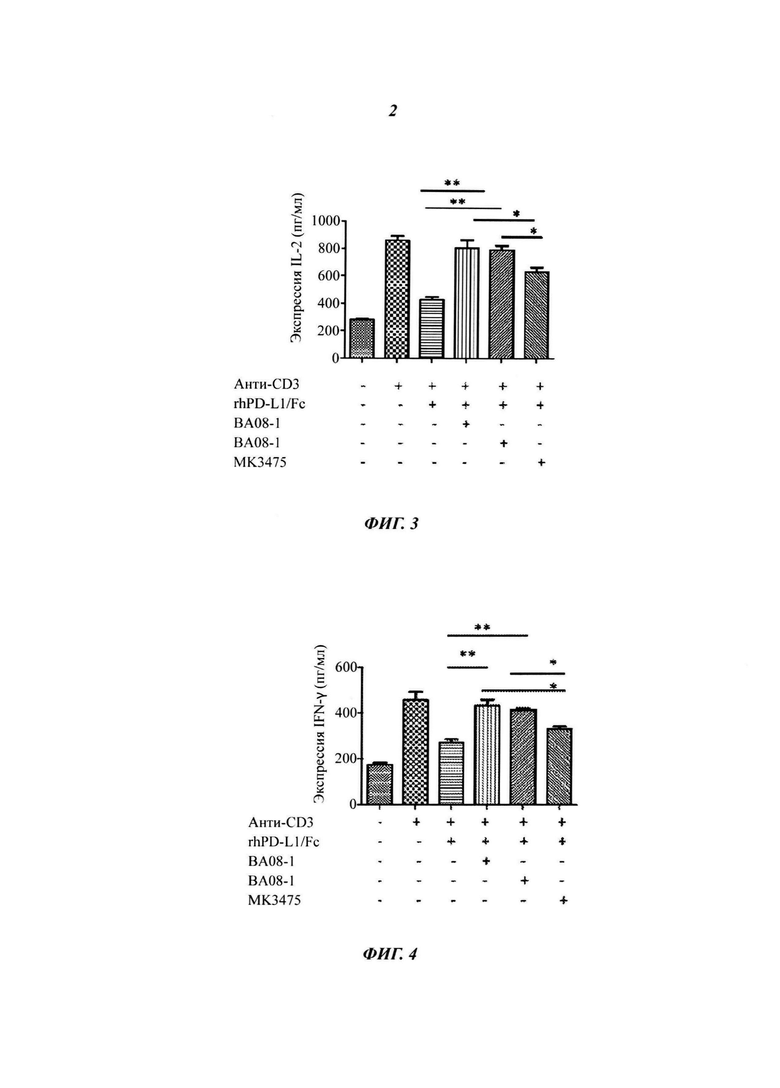
На Фиг. 2 показано, что антитела ВА08-1 и ВА-08-2 блокируют связывание PD-L1 cPD-1.
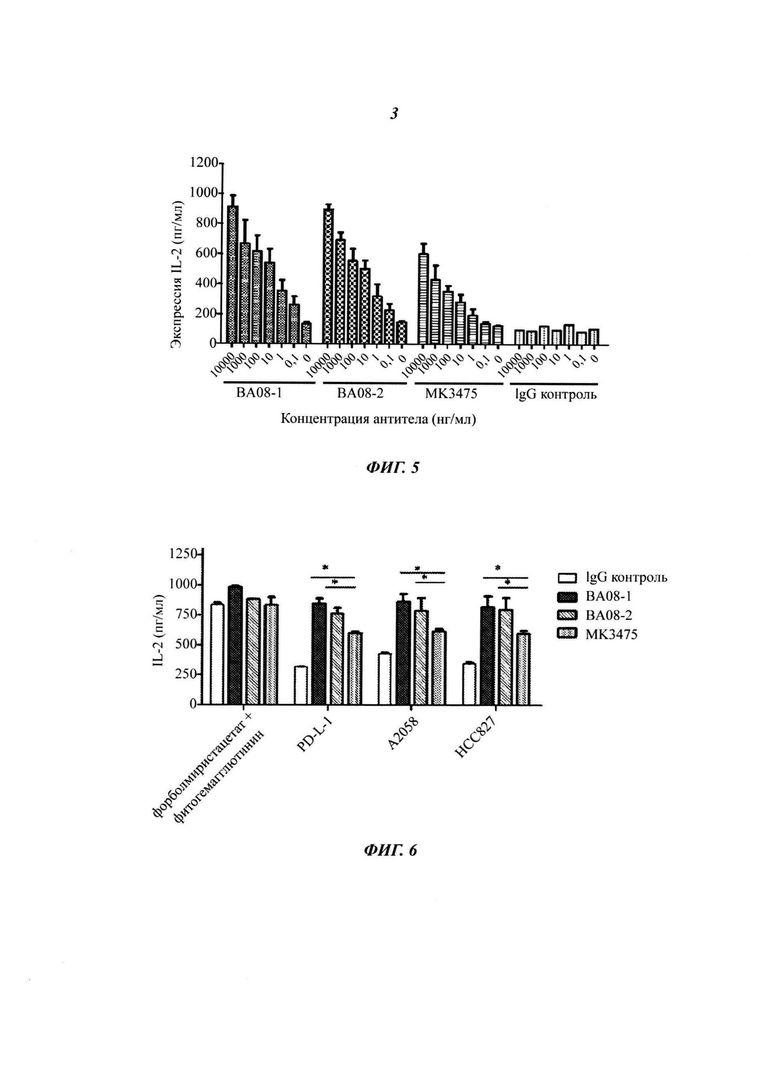
На Фиг. 3 показано, что антитела ВА08-1 и ВА-08-2 значительно усиливают продуцирование IL-2 Т-клеток. Столбики означают слева направо: отрицательный контроль без антитела, положительный контроль (только антитело к CD3), ингибирование PD-L1 при экспрессии IL-2, стимулированной антителом к CD3 (при добавлении PD-L1 и антитела к CD3), антагонизм ингибирующего эффекта PD-L1 с помощью антитела ВА08-1 по настоящему изобретению (при добавлении ВА08-1, PD-L1 и антитела к CD3), антагонизм ингибирующего эффекта PD-L1 с помощью антитела ВА08-2 по настоящему изобретению (при добавлении ВА08-2, PD-L1 и антитела к CD3) и антагонизм ингибирующего эффекта PD-L1 с помощью MK3475 (при добавлении MK3475, PD-L1 и антитела к CD3), в соответствии с условными обозначениями в нижней части рисунка.
На Фиг. 4 показано, что антитела ВА08-1 и ВА-08-2 значительно усиливают продуцирование IFN-γ Т-клеток. Столбики означают слева направо: контроль в отсутствии антитела CD3, положительный контроль (только антитело к CD3), ингибирование PD-L1 при экспрессии IFN-γ, стимулированной антителом к CD3 (при добавлении PD-L1 и антитела к CD3), антагонизм ингибирующего эффекта PD-L1 с помощью антитела ВА08-1 по настоящему изобретению (при добавлении ВА08-1, PD-L1 и антитела к CD3), антагонизм ингибирующего эффекта PD-L1 с помощью антитела ВА08-2 по настоящему изобретению (при добавлении ВА08-2, PD-L1 и антитела к CD3) и антагонизм ингибирующего эффекта PD-L1 с помощью MK3475 (при добавлении MK3475, PD-L1 и антитела к CD3), в соответствии с условными обозначениями в нижней части рисунка.
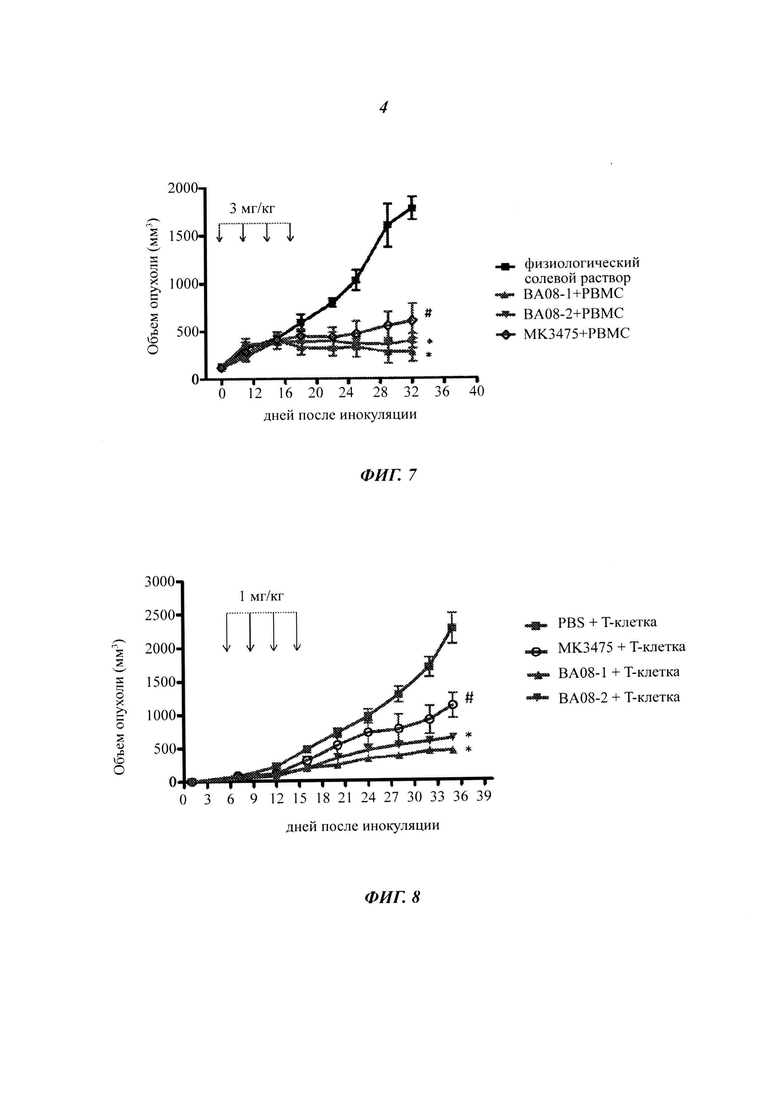
На Фиг. 5 показаны влияния антител ВА08-1 и ВА-08-2 на продуцирование цитокинов лимфоцитов.
Фиг. 6 показаны влияния антител ВА08-1 и ВА-08-2 на опухолевые клетки (включая клетку меланомы и клетку рака легких) для ингибирования продуцирования IL-2 активированными Т-клетками, где PD-L1 представляет собой иммобилизованный PD-L1.
На Фиг. 7 показана оценка противоопухолевого эффекта in vivo гуманизированного антитела к PD-1 при использовании мышей модели Hu-PBL SCID с человеческим раком легких.
На Фиг. 8 показана оценка противоопухолевого эффекта in vivo гуманизированного антитела к PD-1 против меланомы.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Если не указано иное, все технические и научные термины, использованные в данной работе, имеют значения, понятные специалистам в данной области техники. Что касается определений и терминологии, принятых в данной области, можно сослаться на работу Current Protocols in Molecular Biology (Ausubel). Сокращенные названия аминокислотных остатков являются стандартными 3-буквенными и/или 1-буквенными кодами для любой из 20 L-аминокислот, широко используемых в данной области техники.
Настоящее изобретение предлагает антитело к PD-1 и его функциональный фрагмент, которые могут связываться с фактором запрограммированной смерти 1 (PD-1). Антитело или его функциональный фрагмент по настоящему изобретению обладают по меньшей мере одной из следующих характеристик: способны блокировать взаимодействие PD-1 и PD-L1 с высоким сродством; способны связываться с PD-1 с высокой специфичностью; активируют опухолеспецифические Т-клетки, тем самым убивая опухолевые клетки; значительно улучшают Т-клеточный иммунный ответ, например, улучшают продуцирование цитокинов (включая IFNγ и IL-2) Т-клетками; и в значительной степени повышают уровни иммунных эффекторов.
Настоящее изобретение также предлагает гуманизированное антитело к PD-1 и его функциональный фрагмент. Например, гуманизированное антитело получают с помощью проектирования методом компьютерного моделирования из мышиного антитела, полученного от иммунизированной мыши, в сочетании с технологией дрожжевого дисплея.
При условии несущественного влияния на активность антитела, специалистами в данной области техники могут быть сделаны замена, добавление и/или делеция одной или более (как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более) аминокислот в последовательностях по настоящему изобретению с получением вариантов последовательности антитела или его функционального фрагмента. Такие варианты считаются включенными в объем охраны по настоящему изобретению. Например, аминокислота в вариабельных участках может быть заменена кислотой с аналогичными свойствами. Последовательность варианта по изобретению может быть по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичной начальной последовательности. Идентичность последовательностей по настоящему изобретению может быть измерена с помощью программного обеспечения для анализа последовательностей. Например, может быть использована компьютерная программа BLAST с параметрами по умолчанию, в особенности, BLASTP или TBLASTN.
При использовании в данном контексте, термин "антитело" охватывает полноразмерные антитела (например, антитело IgGI или IgG4), различные их функциональные фрагменты (например, те из них, которые могут включать лишь антигенсвязывающую часть, такие как фрагмент Fab, F(ab')2 или scFv) и модифицированные антитела (например, гуманизированные, гликозилированные и т.д.). Настоящее изобретение включает в себя антитело к PD-1 с модифицированным профилем гликозилирования. В некоторых применениях может быть применима модификация для удаления нежелательных сайтов гликозилирования, или отсутствие фукозного фрагмента на олигосахаридной цепи антитела, например, увеличивает антителозависимую клеточную цитотоксичность (англ. ADCC). В других применениях может быть произведена модификация галактозилирования для изменения комплементзависимой цитотоксичности (англ. CDC).
При использовании в данном контексте, термин "его функциональный фрагмент" предназначен для обозначения фрагмента, сохраняющего функцию полноразмерного антитела; это, например, антигенсвязывающий фрагмент, в частности, следующие фрагменты антитела: например, Fv, scFv (sc означает одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc фрагмент или диатело, или любые фрагменты, которые являются химически модифицированными либо встроенными в липосому для удлинения времени полужизни, при этом химическая модификация представляет собой, например, добавление полиалкиленгликоля, такого как полиэтиленгликоль ("пегилирование, на основе PEG") (пегилированные фрагменты обозначают как Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или Fab'-PEG) (англ. PEG, polyethylene glycol - полиэтиленгликоль).
Молекула ДНК (англ. DNA, deoxyribonucleic acid - дезоксирибонуклеиновая кислота), кодирующей антитело к PD-1 по настоящему изобретению, может быть клонирована в векторе специалистами в данной области техники и затем трансформирована в клетку-хозяина. Соответственно, настоящее изобретение также предлагает вектор рекомбинантной ДНК, включающий в себя молекулу ДНК, кодирующую антитело к PD-1 по настоящему изобретению.
Предпочтительно, вектор рекомбинантной ДНК является экспрессионным вектором, и специалисты в данной области техники могут клонировать молекулу ДНК антитела в экспрессионном векторе и трансформировать ее в клетки-хозяева с получением антитела с помощью индуцирования экспрессии. Экспрессионный вектор по настоящему изобретению содержит последовательности ДНК, кодирующие вариабельный участок тяжелой цепи, вариабельный участок легкой цепи и/или константный участок антитела к PD-1. Однако два экспрессионных вектора могут быть сконструированы по отдельности, при этом один будет содержать вариабельный участок тяжелой цепи и константный участок, а другой - вариабельный участок легкой цепи и константный участок, и трансфицированы млекопитающему вместе. Согласно одному из предпочтительных вариантов осуществления, экспрессионный вектор также включает в себя промотор и последовательность ДНК, кодирующую сигнальный пептид секреции, и по меньшей мере один ген лекарственной резистентности для скрининга.
Клетка-хозяин по настоящему изобретению может быть прокариотической клеткой-хозяином, эукариотической клеткой-хозяином или бактериофагом. Прокариотическая клетка-хозяин может быть Escherichia coli, Bacillus subtilis, streptomyces или Proteus mirabilis и т.д. Эукариотическая клетка-хозяин может представлять собой грибы, такие как Pichia pastoris, Saccharomyces cerevisiae, Schizosaccharomyces pombe, trichoderma и т.д.; клетку насекомого, такую как Mythimna separate; клетку растения, такого как табак, и клетку млекопитающего, такую как клетка ВНК (англ. Baby Hamster Kidney - почка новорожденного хомяка), клетка СНО (англ. Chinese Hamster Ovary - яичник китайского хомячка), клетка COS, миеломная клетка и т.д. Согласно некоторым вариантам осуществления, клетка-хозяин по настоящему изобретению предпочтительно является клеткой млекопитающего, более предпочтительно, клеткой ВНК, клеткой СНО, клеткой COS, клеткой NSO или клеткой COS.
При использовании в данном контексте, термин "фармацевтическая композиция" относится к комбинации по меньшей мере одного лекарственного средства и необязательно фармацевтически приемлемого носителя или вспомогательного вещества, которые объединяют вместе для достижения определенной цели. Согласно некоторым вариантам осуществления, фармацевтическая композиция включает в себя комбинацию компонентов, разделенных во времени и/или пространстве, при условии что они могут функционировать вместе для осуществления цели по настоящему изобретению. Например, ингредиенты, содержащиеся в фармацевтической композиции (например, антитело, молекула нуклеиновой кислоты, комбинация молекул нуклеиновой кислоты и/или конъюгата согласно настоящему изобретению), могут быть введены субъекту как единое целое или вводиться субъекту по отдельности. В случае, когда ингредиенты, содержащиеся в фармацевтической композиции, вводят субъекту по отдельности, указанные ингредиенты могут вводиться субъекту одновременно или последовательно. Предпочтительно, фармацевтически приемлемый носитель является водой, буферным раствором, изотоническим солевым раствором, таким как PBS (англ. phosphate buffered saline - фосфатно-солевой буферный раствор), глюкозой, маннитом, декстрозой, лактозой, крахмалом, стеаратом магния, целлюлозой, карбонатом магния, 0,3% глицерином, гиалуроновой кислотой, этанолом или полиалкиленгликолями, такими как полипропиленгликоль, триглицерид и тому подобное. Тип фармацевтически приемлемого носителя зависит от конкретного способа введения, для которого приготовлена композиция по изобретению, такого как пероральное, назальное, внутрикожное, подкожное, внутримышечное или внутривенное введение. Композиция по изобретению может содержать в виде добавок увлажняющие агенты, эмульгаторы или буферные вещества.
Фармацевтические композиции согласно настоящему изобретению могут вводиться любым подходящим способом, например, с помощью перорального, назального, внутрикожного, подкожного, внутримышечного или внутривенного способов введения.
В соответствующем аспекте настоящее изобретение предлагает фармацевтическую композицию, являющуюся комбинацией антитела к PD-1 со вторым терапевтическим агентом. Согласно одному из вариантов осуществления, второй терапевтический агент является любым агентом, успешно объединенным с антителом к PD-1. Примеры агентов, которые могут быть успешно объединены с антителом к PD-1, включают, не ограничиваясь перечнем, другие агенты, ингибирующие PD-1 активность (включая другие антитела или их антигенсвязывающие фрагменты, пептидные ингибиторы, низкомолекулярные антагонисты и т.д.), и/или агенты, интерферирующие до или после сигнальной трансдукции PD-1. Предпочтительно, второй терапевтический агент является антителом к CD3.
При использовании в данном контексте, термин "PD-L1 положительный рак или инфекционное заболевание" означают раковое или инфекционное заболевание, проистекающее из экспрессии PD-1 или имеющее признак/особенность экспрессии PD-1. Раковое заболевание включает, не ограничиваясь перечнем, рак легких, рак печени, рак яичников, рак шейки матки, рак кожи, рак мочевого пузыря, рак толстой кишки, рак молочной железы, глиому, рак почки, рак желудка, рак пищевода, плоскоклеточная карцинома полости рта, рак головы и шеи. Инфекционное заболевание включает, не ограничиваясь перечнем, ВИЧ-инфекцию и вирус гепатита В.
"Терапевтически эффективное количество" при использовании в данном контексте относится к дозе, достаточной для обеспечения положительного воздействия на субъекта, которому она введена. Фактическое введенное количество, а также скорость и период действия введения будут зависеть от состояния и серьезности заболевания субъекта, подлежащего лечению. Рекомендации по лечению (например, определение дозы) относятся в конечном итоге к зоне ответственности врача общей практики и других врачей и будут зависеть от их решений, принимаемых, главным образом, с учетом заболевания, подлежащего лечению, состояния конкретного пациента, места доставки, способа введения и других факторов, известных врачам.
Термин "субъект" при использовании в данном контексте относится к млекопитающему, такому как человек, но может также относиться к другим животным, таким как дикие животные (такие как цапля, аист, журавль и т.д.), домашние животные (такие как утка, гусь и т.д.) или лабораторные животные (такие как орангутан, обезьяна, крыса, мышь, кролик, морская свинка и т.д.).
Следующие примеры представлены для иллюстрации и дополнительного пояснения некоторых предпочтительных вариантов осуществления и аспектов настоящего изобретения, однако их не следует рассматривать, как ограничивающие объем изобретения.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Получение мышиного моноклонального антитела к PD-1
6-10 недельные мыши линии BALB/C были подкожно (англ. SC) иммунизированы антигеном PD-1-mFc рекомбинантного слитого белка, включающим внеклеточную часть PD-1 (25 мкг) (Sino Biological Inc, Cat lot: 10377-H08H). Мышей сначала иммунизировали путем инокуляции антигеном, смешанным с полным адъювантом Фрейнда (F5881, Sigma), с последующей инокуляцией с помощью подкожной иммунизации антигеном, смешанным с неполным адъювантом Фрейнда (F5506, Sigma) (всего 6 иммунизаций, на 1, 7, 14, 28, 60 и 64 день, соответственно). Иммунный ответ контролировали путем взятия проб крови из орбитального венозного сплетения. Иммунную сыворотку проверяли с помощью ELISA (англ. enzyme-linked immunosorbent assay - твердофазный иммуноферментный анализ), и очищенный рекомбинантный слитый белок PD-1 (Sino Biological Inc, Cat lot: 10377-H08H) разбавляли до 1 мкг/мл PBS, наносили слоем в микролуночный планшет по 100 мкл/лунку и инкубировали при температуре 4°C в течение ночи. Затем лунки блокировали раствором PBS, содержащим 5% фетальную бычью сыворотку и 0,05% Tween 20, по 200 мкл/лунку. После градиентного разбавления в каждую лунку добавляли сыворотку мышей, иммунизированных PD-1, и инкубировали при комнатной температуре в течение 1 часа. После промывки планшета раствором PBS/Tween-20 в него добавляли поликлональное антитело козы к иммуноглобулину G мыши, конъюгированное с пероксидазой хрена (Jackson Immunoresearch Labs, Cat#: 115-035-044), и инкубировали в течение 1 часа при комнатной температуре. После промывки планшет проявляли с помощью ТМБ субстрата (англ. ТМВ, (tetramethylbenzidine) substrate - тетраметилбензидиновый субстрат) (Pierce, Cat# 34021) и регистрировали оптическую плотность на уровне OD 450 (англ. optical density). На основании сравнения титров мышей с высоким титром иммуноглобулина против PD-1 использовали для выделения PD-1-специфических В-клеток. Клетки линии B каждой мыши отделяли с помощью сортировки флуоресцентно-активированных клеток (англ. FACS) в соответствии со связыванием с меченным биотином PD-1, и транскрипты генов соответствующей вариабельной области тяжелой цепи (Н) полноразмерного Ig и вариабельной области легкой цепи (L) Ig амплифицировали с помощью ОТ-ПЦР (англ. RT-PCR, reverse transcription polymerase chain reaction - полимеразная цепная реакция с обратной транскрипцией). Руководствуясь протоколом производителя, продукты амплификации клонировали в экспрессирующую систему 293 Expression System (Life Technology). Для очистки получаемого в результате моноклонального антитела использовали колонку с белком A, очищенное антитело далее анализировали на способность связываться с PD-1 и блокировать взаимодействие между PD-1 и PD-L1. На основании способности антитела блокировать связывание PD-1 и PD-L1 в качестве кандидатных клонов для дальнейшего исследования и разработки гуманизированных антител были выбраны 10F8 и 15Н6.
Пример 2
Создание последовательности вариабельного участка тяжелой цепи гуманизированного моноклонального антитела против PD-1 рецептора
Аминокислотные последовательности, кодирующие вариабельный участок тяжелой цепи моноклональных антител 10F8 и 15Н6, представлены в SEQ ID NO 1 и SEQ ID NO 2, соответственно. Последовательности каркасных областей зародышевой линии человека с низкой иммуногенностью выбирали путем сравнения с известной последовательностью тяжелой цепи иммуноглобулина зародышевой линии человека, и в конечном итоге было определено, что сегмент VH 3-66 зародышевой линии человека, неопределяемый сегмент D и сегмент JH4 зародышевой линии человека могут быть использованы в качестве тяжелых цепей гуманизированных антител 10F8 и 15Н6. Аминокислотные последовательности вариабельных участков тяжелой цепи гуманизированного 10F8 (то есть ВА08-1) и гуманизированного 15Н6 (то есть ВА08-2) антител представляли собой SEQ ID NO 4 и SEQ ID NO 5, соответственно.

Пример 3
Создание последовательности вариабельного участка легкой цепи гуманизированного моноклонального антитела против PD-1 рецептора
Аминокислотные последовательности вариабельных участков легкой цепи 10F8 и 15Н6 являются идентичными (SEQ ID NO 3). Последовательность каркасных областей зародышевой линии человека с низкой иммуногенностью выбирали путем сравнения с известной последовательностью тяжелой цепи иммуноглобулина зародышевой линии человека, и в конечном итоге было определено, что сегменты VH 3-11 и JK4 зародышевой линии человека могут быть использованы в качестве легких цепей гуманизированных антител 10F8 и 15Н6. Аминокислотная последовательность вариабельного участка легкой цепи, общая для гуманизированного 10F8 (ВА08-1) и гуманизированного 15Н6 (ВА08-2), представляет собой SEQ ID NO 6.

Пример 4
Экспрессия и получение гуманизированного моноклонального антитела против PD-1 рецептора
Последовательность Fc-фрагмента иммуноглобулина IgG4 константного участка тяжелой цепи IgG4 человека (J Ellison, J Buxbaum, L Hood-ДНК, 1981) и последовательность k-фрагмента константного участка легкой цепи (Hieter, Р.А., Max, E.E., Seidman, J.G., Maizel, J.V. Jr., and Leder, P. Cell. 1980; 22: 197-207) были синтезированы компанией IDT Inc. (Integrated DNA Technologies, Coralville, Iowa). Векторы pBA-H4 и pBA-Ck настоящего изобретения конструировали с пкДНКЗ в качестве остова, где рВА-Н4 (содержащий константный участок IgG4Fc тяжелой цепи человеческого IgG4) и pBA-Ck (содержащий k-фрагмент константного участка легкой цепи человека) векторы были сконструированы компанией Bioabs Inc. В векторе рВА-Н4 используются промотор CMV для VH и СН и промотор PGK - для пуромицин-резистентного гена, тогда как в векторе pBA-Ck используются промотор CMV для VL и промотор SV40 для неомицин-резистентного гена. На основании белковых последовательностей последовательности вариабельного участка тяжелой цепи и вариабельного участка легкой цепи антитела были созданы последовательности ДНК, кодирующие вариабельные участки тяжелой цепи и вариабельные участки легкой цепи, которые впоследствии оптимизировали для оптимальной экспрессии в клетках СНО, где последовательности ДНК, кодирующие вариабельный участок тяжелой цепи гуманизированного антитела к PD-1 по настоящему изобретению, представлены в SEQ ID NO 15 (ВА08-1) и 16 (ВА08-2), соответственно, а последовательность ДНК, кодирующая вариабельный участок легкой цепи гуманизированного антитела к PD-1 по настоящему изобретению, представлена в SEQ ID NO 17. ДНК, кодирующие оптимизированные вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, были синтезированы компанией IDT Inc. (Integrated DNA Technologies, Coralville, Iowa). С помощью набора для клонирования In-Fusion®HD (Clontech Cat#: 638910) синтезированный фрагмент ДНК, содержащий тяжелые цепи ВА08-1 и ВА08-2, напрямую клонировали в рВА-Н4 вектор, линеаризованный с Nhel ферментом, а синтезированный фрагмент ДНК, содержащий легкие цепи ВА08-1 и ВА08-2, напрямую клонировали в pBA-Ck вектор, линеаризованный с BsiWI ферментом, с последующей трансформацией в DH5α бактерию, экстракцией плазмид и секвенированием, при этом результат секвенирования согласуется с кодирующими последовательностями ДНК созданного гуманизированного антитела. CHO-S клетки (имеющиеся в Invitrogen) культивировали с 1×CD-CHO (имеющимися в GIBCO), 1×НТ (имеющимися в GIBCO), 8 мМ глутамина (имеющегося в GIBCO) в инкубаторе при температуре 37°C, 8% СO2. CHO-S клетки котрансфецировали плазмидами, содержащими тяжелую цепь и легкую цепь антител ВА08-1 и ВА08-2, при этом метод трансфекции соответствует инструкциям к набору для трансфекции DMRIE-C (приобретенному в Invitrogen). Через 3 дня после трансфекции клетки культивировали в описанной выше культурной среде и добавляли 500 мкг/мл G418 (имеющегося в GIBCO) и 12,5 мкг/мл пуромицина (имеющегося в Sigma) для скрининга под давлением (?pressurized screening?). Через 14 дней после создания избыточного давления (pressurizing?) отбирали положительные клоны, культивировали в 6-луночном планшете и определяли с помощью прямого ELISA количество экспрессии антитела. Выбирали клон с самой высокой скоростью экспрессии, культивировали в крупном масштабе в течение 10 дней, после чего центрифугировали и собирали культуральный супернатант, который очищали с помощью колонки для аффинной хроматографии с белком А (имеющейся в GE), диализовали в PBS и фильтровали через мембрану 0,22 мкм для различных исследований.
Пример 5
Специфичность связывания и относительное сродство к связыванию между антителом и PD-1
Относительное связывание антитела по настоящему изобретению с человеческим PD-1 определяли с помощью ELISA на основе белка. Вкратце, очищенный рекомбинантный слитый белок PD-1 (Sino Biological Inc, Cat#: 10377-H08H) разбавляли до 1 мкг/мл с помощью BPS, наносили слоем в микролуночный планшет по 100 мкл/лунку и инкубировали при температуре 4°C в течение ночи. Затем лунки блокировали раствором PBS, содержащим 5% фетальную бычью сыворотку и 0,05% Tween 20, по 200 мкл/лунку. После градиентного разбавления антитело к PD-1 по настоящему изобретению, MK3475 (контрольный аналог MK-3475, сконструированный авторами настоящего изобретения с помощью экспрессионного вектора по настоящему изобретению в соответствии с раскрытой последовательностью MK3475, далее для краткости именуемый MK3475, специфический протокол конструирования аналогичен настоящему изобретению) и контроль IgG добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. После промывки планшета раствором PBS/Tween-20 добавляли поликлональное антитело козы к иммуноглобулину IgG человека, конъюгированное с пероксидазой хрена (Jackson Immunoresearch Labs, Cat#: 109-035-088), и инкубировали в течение 1 часа при комнатной температуре. После промывки планшет проявляли с помощью ТМБ субстрата (Cat# 34021, Pierce) и регистрировали оптическую плотность на уровне OD 450. Результат анализа методом ELISA показан на Фиг. 1. Сродство, измеренное с помощью прибора Blitz (Pall life Science), представлено в Таблице 3.
Антитело по настоящему изобретению проявляет неожиданно высокие сродство к связыванию и специфичность связывания с PD-1.
Таблица 3

Пример 6
Антитело к PD-1 блокирует связывание лиганда PD-L1 с рецептором PD-1 Гуманизированное антитело к PD-1 настоящего изобретения испытывали на блокирование связывания PD-1 с его лигандом. В частности, 96-луночный планшет был покрыт 1 мкг/мл немеченным hPD-L1/Fc (R&D Systems, Cat# 156-В7-100) в течение 16 часов. 0,5 мкг/мл белка PD-1 предварительно инкубировали с рекомбинантными антителами к PD-1 при разных концентрациях при температуре 37°C в течение 30 минут, затем добавляли в микролуночный планшет для реакции. Связывание белка PD-1 с покрытым PD-L1 гибридизировали мышиным антителом против человеческого PD-1 (eBioscience, Cat# 14-9989-8214) и далее детектировали с помощью способа на основе козьего антимышиного антитела, конъюгированного с пероксидазой хрена. После промывки планшет проявляли с помощью ТМБ субстрата (Pierce, Cat# 34021) и регистрировали оптическую плотность на уровне OD 450. Как показано на Фиг. 2, ВА08-1 и ВА08-2 антитела против PD-1 специфически блокировали связывание PD-1 с его лигандом PD-L1 (Фиг. 2), с блокирующим действием, значительно лучшим, чем в случае MK-3475. Таким образом, антитело по настоящему изобретению позволяет достичь неожиданно более высокого блокирования связывания PD-L1 и PD-1.
Пример 7
Влияние антитела к PD-1 на ингибирование активности человеческой Т-клетки, опосредованное PD-L1
Мононуклеарные клетки периферической крови человека (англ. РВМС, Human peripheral blood mononuclear cells) изолировали от здоровых доноров методом фиколла. Т-клетки периферической крови человека в состоянии покоя получали с помощью негативного отбора на колонке для обогащения CD3+ Т-клеток (R&D Systems). 96-луночный планшет покрывали 500 нг/мл антитела к CD3 и 1 мкг/мл рекомбинантного человеческого PD-L1/Fc в течение ночи при температуре 4°C. По 1 мкг антитела к PD-1 по настоящему изобретению или MK3475 добавляли в каждую лунку и инкубировали при температуре 37°C в течение 4 часов. Добавляли RMPI суспензию изолированных Т-клеток (2×104) и собирали супернатант после культивирования в течение 2 дней. Экспрессии IL-2 и IFN-γ детектировали с помощью набора IL-2 ELISA kit (eBioscience Cat# 88-7025-88) и набора IFN-γ ELISA kit (R&D Systems), соответственно, согласно инструкциям по применению. Как изображено на Фиг. 3 и Фиг. 4, столбики означают слева направо: контроль в отсутствии антитела CD3, положительный контроль (использовали только антитело к CD3), ингибирование PD-L1 при экспрессии IL-2 или IFN-γ, стимулированной антителом к CD3 (при добавлении PD-L1 и антитела к CD3), антагонизм антитела ВА08-1 по настоящему изобретению и ингибирующего действия PD-L1 (при добавлении ВА08-1, PD-L1 и антитела к CD3), антагонизм антитела ВА08-2 по настоящему изобретению и ингибирующего действия PD-L1 (при добавлении ВА08-2, PD-L1 и антитела к CD3) и антагонизм МК3475 и ингибирующего действия PD-L1 (при добавлении MK3475, PD-L1 и антитела к CD3). Оба антитела к PD-1, ВА08-1 и ВА08-2, в значительной степени устраняют ингибирующее действие PD-L1 на продуцирование IL-2 и IFN-γ CD3-стимулированными Т-клетками (** p<0,01), с иммуноусиливающим действием, которое значительно превышает таковое в случае MK-3475 аналога (* p<0,05).
Пример 8
Влияние антитела к PD-1 на экспрессию цитокинов в реакции смешанных лимфоцитов
Влияние блокирования PD-L1/PD-1 пути на эффекторные лимфоциты определяли с помощью гетерологичной смешанной лимфоцитной реакции (англ. MLR, mixed lymphocyte reaction). Определяли влияние присутствия или отсутствия моноклонального антитела к PD-1 человека на секрецию IFN-γ Т-клетками. Человеческие CD4+ Т-клетки получали очисткой из РВМС (англ. peripheral blood mononuclear cells - мононуклеарные клетки периферической крови) с помощью набора для негативной селекции CD4+ клеток (Miltenyi Biotech). Дендритные клетки извлекали из очищенных моноцитов, которые культивировали с 1000 ед./мл IL-4 и 500 ед./мл GM-CSF (R&D Biosystems) в течение семи дней. В каждой MLR реакции участвуют 105 очищенных Т-клеток и 104 аллогенных дендритных клеток в общем объеме 200 мкл. Гуманизированное моноклональное антитело к PD-1 добавляли в культуральный планшет при разных концентрациях, после культивирования клеток при температуре 37°C в течение 5 дней отбирали 100 мкл культурального супернатанта для измерения содержания цитокинов. Измерение IL-2 выполняли с помощью такого же метода, как описан в Примере 7, результаты представлены на Фиг. 5. ВА08-1 и ВА08-2 антитела к PD-1 в значительной степени стимулировали активацию Т-клеток и повышали экспрессию IL-2 в зависимости от дозы, оказывая воздействие, которое значительно превосходило таковое для MK-3475.
Пример 9
Влияние антитела к PD-1 на ингибирование опухолевой клеткой продуцирования IL-2 активированной Т-клеткой
Клетки из клеточной линии А2058 меланомы человека и клеточной линии НСС827 рака легких человека приобретали в АТСС (Manassas, VA). Рекомбинантный интерферон человека (англ. IFN) -γ, форбол-12-миристат-13-ацетат (англ. РМА) и фитогемагглютинин (англ. РНА) приобретали в Sigma-Aldrich (St. Louis, МО). Клетки меланомы и рака легких выращивали в полной среде RPMI-1640 (англ. Roswell Park Memorial Institute) до 80% конфлюентности, затем добавляли 500 ед./мл рекомбинантного человеческого IFN-γ для обработки в течение более 48 часов для повышающей регуляции экспрессии PD-L1, которую подтверждали с помощью проточного цитометра с мышиным антителом против PD-L1 человека (BD Pharmingen, Cat# 557924). Т-клетки периферической крови человека в состоянии покоя получали с помощью негативного отбора на колонке для обогащения CD3+ Т-клеток (R&D Systems). Полученные в результате Т-клетки обрабатывали 1 мкг/мл РНА и 50 нг/мл РМА в течение ночи, затем добавляли в 96-луночный планшет, предварительно покрытый 1 мкг/мл рекомбинантным белком PD-L1-Fc (Corning, NY) (обозначенным как PD-L1 на Фиг. 6); или в присутствии 3 мкг/мл антитела (контроль IgG, ВА08-2 или ВА08-1 антитело к PD-1 по настоящему изобретению, или МК3475) добавляли в обработанные IFN-γ опухолевые клетки в соотношении 6:1 (опухолевые клетки:Т-клетки) и инкубировали в течение 48 часов (обозначены как А2058 и НСС827 на Фиг. 6); или же без какой-либо дополнительной обработки (контроль, обозначен как РМА+РНА на Фиг. 6). Собирали супернатант и анализировали на предмет экспрессии IL-2 с помощью ELISA. Как показано на Фиг. 6, иммобилизованный PD-L1 может ингибировать способность активированных Т-клеток продуцировать IL-2, и ВА08-1 и ВА08-2 антитела к PD-1 в значительной степени подавляют ингибирующее действие PD-L1. Аналогичным образом, предварительно обработанные IFN-γ опухолевые клетки также ингибируют экспрессию IL-2, опосредованную активированными Т-клетками, при этом ингибирующее действие также может быть блокировано ВА08-1 и ВА08-2 антителами к PD-1 (*p<0,05), и воздействие антитела по настоящему изобретению значительно превышает таковое в случае MK-3475.
Пример 10
Эксперимент in vivo (на живых организмах) с использованием антитела к PD-1 по настоящему изобретению для лечения рака легких
Для оценки эффекта in vivo гуманизированного антитела к PD-1 в 1 день эксперимента 6-недельные мыши линии NOD-SCID были подкожно инокулированы 1×107 клетками клеточной линии НСС827 человеческого рака легких, полученными из тканевой культуры. Обработку начали на 8 день, когда средний объем опухоли достигает 100 мм3 (55-150 мм3), в каждой группе было по 6 животных, и всем животным в указанной партии внутрибрюшинно вводили человеческие РВМС. Способ приготовления человеческих РВМС такой, как описан выше. РВМС получают с помощью очистки с использованием фиколла в течение 3 часов. Каждую мышь инокулировали с помощью внутрибрюшинной инъекции суспензией RPMI, содержащей 1×107 человеческих РВМС, и в тот же день внутрибрюшинно вводили антитело, два раза в неделю в дозе 5 мг/кг, в общей сложности четыре дозы. Объем опухоли мыши измеряли два раза в неделю с помощью кронциркуля и вычисляли по следующей формуле: Объем = (длина × ширина2)/2. Как показано на Фиг. 7, гуманизированное антитело к PD-1 показало эффективную и продолжительную противоопухолевую активность, при этом воздействие антитела по настоящему изобретению значительно превосходило таковое для MK-3475. По сравнению с контрольной группой скорости ингибирования опухолей ВА08-1 и ВА08-2 антителами к PD-1 на 32 день составляли 84,5% и 77,8% (р<0,01), соответственно, что было значительно больше, чем для образца MK3475, скорость ингибирования опухоли которого составляла 66% (p<0,05).
Пример 11
Эксперимент In vivo с использованием антитела к PD-1 по настоящему изобретению для лечения меланомы
6-недельные мыши линии NOD-SCID были подкожно инокулированы 2×106 клетками меланомы А375 человека и 1×106 человеческими Т-клетками, стимулированными такими же опухолевыми клетками, которые были получены из тканевой культуры. Человеческие Т-клетки, стимулированные опухолевыми клетками, получали следующим образом: негативно селектируемые Т-клетки из мононуклеарных клеток периферической крови здорового человека с помощью набора RosetteSep (Stemcell technologies) сокультивировали с клетками меланомы А375 человека, обработанными 2 мкг митомицина С в течение 16 часов в культуральной среде 10% FBS-RPMI, содержащей 50 ед./мл рекомбинантного IL-2, в течение семи дней и собирали для использования. Обработку начинали в один и тот же день для 6 животных, включенных в каждую группу, животным внутрибрюшинно вводили антитело к PD-1 два раза в неделю в дозе 3 мг/кг, в сумме четыре дозы. Объем опухоли мыши измеряли два раза в неделю с помощью кронциркуля и вычисляли по следующей формуле: Объем = (длина × ширина2)/2. Как показано на Фиг. 8, по сравнению с контрольной группой скорости ингибирования опухолей ВА08-1 и ВА08-2 антителами к PD-1 на 35 день составляли 82% и 72% (p<0,01), соответственно, что было значительно больше, чем для образца МК3475, скорость ингибирования опухоли которого составляла 58% (p<0,05).
Рассмотренные выше предпочтительные варианты осуществления описаны исключительно в качестве примеров, а не в качестве ограничений, с целью объединения основных признаков для осуществления настоящего изобретения. Представленные названия не предназначены для ограничения различных вариантов осуществления настоящего изобретения. Термины, такие как "включает в себя", "содержит" и "включает" не предназначены для того, чтобы быть ограничениями. Кроме того, если не указано иное, если имя существительное не изменено во множественное число, оно включает в себя его форму множественного числа, а "или" означает "и/или". Если не указано иное, все технические и научные термины, использованные в данной работе, имеют значения, обычно понимаемые специалистами в данной области техники.
Все публикации и патенты, упомянутые в данной заявке, включены в нее посредством ссылки. Без отступления от объема и сущности настоящего изобретения различные модификации и изменения способов и композиций, описанных в настоящем изобретении, являются очевидными для специалистов в данной области техники. Хотя настоящее изобретение описано посредством конкретных и предпочтительных вариантов осуществления, подразумевается, что заявляемое изобретение не должно быть безосновательно ограничено такими частными вариантами осуществления. Фактически, множество вариантов, очевидных для специалистов в данной области техники, для осуществления описанных способов настоящего изобретения включены в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ PD-1 | 2015 |
|
RU2711141C2 |
| АНТИТЕЛО ПРОТИВ ЛИГАНДА 1 ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК (PD-L1), ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2727914C2 |
| Антитела к PD-1 и способы их применения | 2015 |
|
RU2701797C2 |
| ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ АНТИТЕЛ, СВЯЗЫВАЮЩИХ БЕЛОК 1 ПРОГРАММИРУЕМОЙ СМЕРТИ КЛЕТОК (PD-1) | 2017 |
|
RU2768404C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2788616C2 |
| Иммунотерапия с применением антител, связывающих лиганд 1 белка программируемой смерти клеток (PD-L1) | 2017 |
|
RU2766582C2 |
| PD-1 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ. | 2016 |
|
RU2722451C1 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2013 |
|
RU2599417C2 |








Изобретение относится к биохимии и представляет собой антитело, включающее тяжелую цепь и легкую цепь, способное специфически связываться с белком запрограммированной смерти клетки 1 (PD-1). Изобретение касается также фармацевтической композиции для лечения или профилактики PD-L1-положительного рака или PD-L1-положительного инфекционного заболевания, включающей заявленное антитело и фармацевтически приемлемый носитель. Изобретение позволяет эффективно лечить или предупреждать PD-L1-положительный рак или PD-L1-положительное инфекционное заболевание у субъекта, нуждающегося в этом. 7 н. и 5 з.п. ф-лы, 8 ил., 3 табл., 11 пр.
1. Антитело, включающее тяжелую цепь и легкую цепь, способное специфически связываться с белком запрограммированной смерти клетки 1 (PD-1), отличающееся тем, что
(i) тяжелая цепь включает участки H-CDR1, H-CDR2 и H-CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO 7, 8 и 11 или 9, 10 и 11 соответственно; и
(ii) легкая цепь включает участки L-CDR1, L-CDR2 и L-CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO 12, 13 и 14 соответственно.
2. Антитело по п. 1, где
(i) тяжелая цепь включает вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 1, 2, 4 или 5; и
(ii) легкая цепь включает вариабельный участок легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 3 или 6.
3. Антитело по п. 1, где
(i) тяжелая цепь включает вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 4 или 5; и
(ii) легкая цепь включает вариабельный участок легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO 6.
4. Изолированный полинуклеотид, кодирующий антитело по любому из пп. 1-3.
5. Комбинация изолированных полинуклеотидов, которая кодирует антитело по любому из пп. 1-3, включающая полинуклеотид, кодирующий легкую цепь антитела по любому из пп. 1-3, и полинуклеотид, кодирующий тяжелую цепь антитела по любому из пп. 1-3.
6. Экспрессионный вектор, включающий полинуклеотид по п. 4 или комбинацию полинуклеотидов по п. 5, где полинуклеотид эффективно связывается с регуляторной последовательностью, что позволяет осуществлять экспрессию полипептида, кодированного полинуклеотидом, в клетке-хозяине или в бесклеточной экспрессирующей системе.
7. Фармацевтическая композиция для лечения или профилактики PD-L1-положительного рака или PD-L1-положительного инфекционного заболевания, включающая антитело по любому из пп. 1-3 и фармацевтически приемлемый носитель.
8. Способ лечения или предупреждения PD-L1-положительного рака или PD-L1-положительного инфекционного заболевания у субъекта, нуждающегося в этом, включающий введение субъекту антитела по любому из пп. 1-3, полинуклеотида по п. 4, комбинации полинуклеотидов по п. 5, экспрессионного вектора по п. 6 и/или фармацевтической композиции по п. 7.
9. Способ по п. 8, где раковое заболевание является раком легких или меланомой, а инфекционное заболевание представляет собой ВИЧ-инфекцию или вирус гепатита В.
10. Способ усиления Т-клеточного иммунного ответа у субъекта, нуждающегося в этом, включающий введение субъекту антитела по любому из пп. 1-3, полинуклеотида по п. 4, комбинации полинуклеотидов по п. 5, экспрессионного вектора по п. 6 и/или фармацевтической композиции по п. 7.
11. Способ по п. 10, где усиление Т-клеточного иммунного ответа включает усиление продуцирования цитокинов Т-клетками, предпочтительно, цитокин включает IL-2 и/или IFN-γ.
12. Способ по п. 10, где способ также включает введение субъекту антитела к CD3.
| WO 2011110604 A1, 15.09.2011 | |||
| WO 2010089411 A2, 12.08.2010 | |||
| FULLER MJ et.al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2494107C2 |
Авторы
Даты
2018-07-18—Публикация
2015-08-28—Подача