ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области терапевтических моноклональных антител и, более конкретно, к антителам, нацеленным на белок программированной гибели - 1 (PD-1). Изобретение также относится к применению этого антитела в лечении различных заболеваний, включая рак, инфекционные и воспалительные заболевания.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ЕХНИКИ
Белок программируемой клеточной гибели-1 (PD-1) является членом семейства CD28 и иммуносупрессорным рецептором, экспрессируемым на поверхности активированных Т-клеток и В-клеток (Yao Z et al., 2013, Nat Rev Drug Discov, 12(2):130-146), который был первоначально получен из апоптотических Т-клеточных гибридом методом субтрактивной гибридизации. PD-1 в основном экспрессируется на поверхности CD4+ T-клеток, CD8+ T-клеток, NKT-клеток, B-клеток и активированных моноцитов. Его экспрессия на поверхности этих клеток индуцируется передачей сигналов рецепторами T-клеток (TCR) или B-клеток (BCR) и усиливается TNF-α (фактор некроза опухоли альфа) (Francisco LM et al., 2010, Immunol Rev, 236: 219-242). Молекула PD-1 состоит из внеклеточного домена, трансмембранного участка и внутриклеточного хвоста. Внеклеточный домен имеет домен IgV вариабельной области иммуноглобулина, а внутриклеточный хвост содержит два мотива передачи сигнала на основе тирозина: ITIM (Иммунорецепторный ингибиторный мотив на основе тирозина) и ITSM (Иммунорецепторный мотив переключения на основе тирозина). После активации Т-клеток PD-1 рекрутирует тирозин-фосфолипазу SHP2, главным образом через мотив ITSM, приводя к дефосфорилированию эффекторных молекул, включающих CD3ζ, PKCθ и ZAP70. PD-1 имеет два лиганда, PD-L1 и PD-L2. PD-L1 также известен как B7H1 или CD274, а PD-L2 также называют B7DC или CD273. PD-L1 и PD-L2 экспрессируются в разных типах клеток (Shimauchi, Kabashima et al., 2007, Int J Cancer, 121 (12):2585-2590). С точки зрения картины экспрессии, экспрессия PD-L2 сильно ограничена, главным образом, в активированных макрофагах, дендритных клетках и небольшой части опухолевых клеток. Напротив, PD-L1 широко экспрессируется на активированных Т-клетках, В-клетках, макрофагах, дендритных клетках и опухолевых клетках, и в местах иммунных привилегий, включая плаценту и глаза, а также сосудистых эндотелиальных клетках, эпителиальных клетках, мышечных клетках и гепатоцитах.
PD-1 взаимодействует со своими лигандами PD-L1 и PD-L2 (лиганды белка программируемой гибели-1, PD-L), чтобы значительно ингибировать CD3/CD28- опосредованную активацию Т-клеток и продуцирование цитокинов посредством путей внутриклеточной передачи сигнала, и, следовательно, PD-1 и PD-L являются важными белками иммунных контрольных точек, которые регулируют Т-клеточные ответы. В обычных условиях сигнальный путь PD-1/PD-L может индуцировать и поддерживать иммунную толерантность периферических тканей, что положительно влияет на предотвращение чрезмерного воспаления тканей и возникновение аутоиммунных заболеваний (Latchman Y et al., 2001, Nat Immunol, 2:261-268). В патологическом состоянии взаимодействие PD-1 с PD-L1/PD-L2 подавляет секрецию Т-клеточных иммуностимулирующих цитокинов, таких как IFN-γ, IL-2 и TNF-α, и экспрессию белков выживаемости, и способствует секреции иммуносупрессорного цитокина IL-10, тем самым ингибируя Т-клеточные иммунные ответы (Hamid O et al., 2013, Expert Opin Biol Ther, 13(6):847-861). Исследования показали, что ко-ингибирующая передача сигналов PD-1 тесно связана с возникновением различных заболеваний человека, и на ко-ингибирующие сигнальные молекулы PD-1 можно нацеливаться при лечении заболеваний. (Okazaki T et al., 2007, J Immunol; 19:813-824).
Сигнальный путь PD-1/PD-L1 тесно связан с развитием опухоли. У пациентов с опухолями повышенная экспрессия PD-L1 может усиливать способность метастазирования опухоли, что приводит к увеличению смертности и плохому прогнозу. Исследования показали, что высокая экспрессия PD-L1 была обнаружена в опухолевых тканях человека при раке легких, раке печени, раке яичника, раке шейки матки, раке кожи, раке мочевого пузыря, раке толстой кишки, раке молочной железы, глиоме, раке почки, раке желудка, раке пищевода, плоскоклеточном раке полости рта и раке головы и шеи. Кроме того, PD-L1 экспрессируется на высоком уровне в опухолевых клетках в присутствии различных цитокинов и связан с иммунным ускользанием опухолевых клеток. При этом опухоль-инфильтрирующие CD8 + T-клетки в местах опухоли также подвержены влиянию микроокружения опухоли и имеют более высокую экспрессию PD-1, чем T-клетки в периферической крови. PD-1 взаимодействует с PD-L1 на поверхности опухолевых клеток, ингибируя активацию и пролиферацию Т-клеток. Опухолевые клетки могут избежать гибели, вызванной цитотоксическими лимфоцитами (CTL), и ослабить противоопухолевый иммунный ответ организма. Блокирование передачи сигналов PD-1/PD-L1 моноклональными анти- PD1 антителами может активировать секрецию IFN-γ, IL-2 и IL-10, эффективно удалить ингибирование пролиферации CD4+ и CD8+ Т-клеток и значительно усилить активацию и поражающую способность Т-клеток (Dong HD et al., 2002, Nat Med, 8:793-800).
Множественные хронические и острые вирусные инфекции также ускользают от иммунного надзора у человека через взаимодействие PD-1/PD-L. Периферические вирус-специфические CD4+, CD8+ T-клетки сверхэкспрессируют PD-1, что приводит к дисфункции или неспособности к быстрому и эффективному удалению инфекционного вируса (Venkatachari NJ et al., 2008, Virology, 376:140-153). В последнее время большое количество исследований показали, что блокирование пути ингибирования PD-1/PD-L специфическими моноклональными антителами может эффективно активировать и вызывать пролиферацию CD4 +, CD8 + Т-клеток, специфичных к вирусам HIV, HBV и HCV, продуцировать такие факторы уничтожения, как IFN-γ, TNF-α и гранзим B, и восстанавливать иммунные клеточно-специфические противовирусные свойства (Barber DL et al., 2006, Nature, 439:682-687).
Таким образом, могут быть получены специфические моноклональные анти-PD-1 антитела для блокирования передачи сигналов PD-1/PD-L1 и отключения ингибирующего пути, что будет усиливать функцию CTL для уничтожения опухолевых клеток и эффективно ингибировать образование и рост опухоли. В настоящее время на рынке имеется два препарата противоопухолевых анти-PD1 антител, а именно пембролизумаб (товарный знак Keytruda, Merck Sharp & Dohme) и ниволумаб (товарный знак Opdivo, Ono Pharmaceutical/Bristol-Myers Squibb). Пидилизумаб, разработанный Cure Tech, проходит II фазу клинических испытаний. AMP-224 и AMP-514, разработанные MedImmune, находятся на I фазе клинических испытаний. Хотя существует множество моноклональных антител иммунных контрольных точек против PD-1, PD-L1 и CTLA4, используемых в клиническом лечении, показатели ответно реакции на эти антитела, при использовании в качестве единственного лекарственного средства, все еще являются низкими, в среднем только 15-20%. Следовательно, необходимо разработать новые моноклональные анти-PD-1 антитела с более высокой специфичностью, более низкими токсическими побочными эффектами и лучшей клинической эффективностью, которые предоставят больше возможностей для лечения раковых пациентов и пациентов с инфекционными заболеваниями.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предложение моноклонального анти-PD-1 антитела с высокой аффинностью к молекуле PD-1.
В одном аспекте настоящего изобретения предложено выделенное моноклональное антитело, которое связывается с PD-1 и которое содержит:
вариабельную область тяжелой цепи, содержащую аминокислотные последовательности CDR-H1, CDR-H2 и CDR-H3, и
вариабельную область легкой цепи, содержащую аминокислотные последовательности CDR-L1, CDR-L2 и CDR-L3,
где:
(1) вариабельная область тяжелой цепи содержит последовательность CDR-H1, выбранную из SEQ ID NO: 1 или 2, последовательность CDR-H2, выбранную из SEQ ID NO: 3 или 4, и последовательность CDR-H3, выбранную из SEQ ID NO: 5 или 6; и
(2) вариабельная область легкой цепи содержит последовательность CDR-L1, выбранную из SEQ ID NO: 7 или 8, последовательность CDR-L2, выбранную из SEQ ID NO: 9 или 10, и последовательность CDR-L3, выбранную из SEQ ID NO: 11 или 12.
В предпочтительном воплощении изобретения вариабельная область тяжелой цепи антитела содержит последовательность CDR-H1, показанную в SEQ ID NO: 1, последовательность CDR-H2, показанную в SEQ ID NO: 3, и последовательность CDR-H3, показанную в SEQ ID NO: 5; и вариабельная область легкой цепи антитела содержит последовательность CDR-L1, показанную в SEQ ID NO: 7, последовательность CDR-L2, показанную в SEQ ID NO: 9, и последовательность CDR- L3, показанную в SEQ ID NO: 11.
В другом предпочтительном воплощении изобретения, вариабельная область тяжелой цепи антитела содержит последовательность CDR-H1, показанную в SEQ ID NO: 2, последовательность CDR-H2, показанную в SEQ ID NO: 4, и последовательность CDR-H3, показанную в SEQ ID NO: 6; и вариабельная область легкой цепи антитела содержит последовательность CDR-L1, показанную в SEQ ID NO: 8, последовательность CDR-L2, показанную в SEQ ID NO: 10, и последовательность CDR-L3, показанную в SEQ ID NO: 12.
Кроме того, антитела, содержащие последовательности CDR, описанные выше, являются мышиными, химерными или гуманизированными.
Например, антитело является мышиным или химерным. Его вариабельная область тяжелой цепи дополнительно содержит FR-область тяжелой цепи мышиного IgG1, IgG2, IgG3, IgG4 или ее вариант; вариабельная область его легкой цепи содержит FR-область легкой κ, λ-цепи мыши или ее вариант.
Более предпочтительно, мышиное или химерное антитело содержит:
(а) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, показанную в SEQ ID NO: 15,
(б) вариабельную область легкой цепи, содержащую аминокислотную последовательность, показанную в SEQ ID NO: 16.
Например, в предпочтительных воплощениях изобретения мышиного антитела AB12N1 и химерного антитела AB12N2, их вариабельные области тяжелой цепи содержат аминокислотную последовательность, показанную в SEQ ID NO: 15, и их вариабельные области легкой цепи содержат аминокислотную последовательность, показанную в SEQ ID NO: 16.
Более предпочтительно, мышиное или химерное антитело содержит:
(а) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13;
(б) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 14.
Например, в предпочтительных воплощениях настоящего изобретения, мышиное антитело AB12M1 и химерное антитело AB12M2, их вариабельные области тяжелой цепи содержат аминокислотную последовательность, показанную в SEQ ID NO: 13, и их вариабельные области легкой цепи содержат аминокислотную последовательность, показанную в SEQ ID NO: 14.
Например, антитела являются гуманизированными. Способы получения гуманизированных антител хорошо известны специалистам в данной области. Например, гуманизированные анти-PD-1 антитела по настоящему изобретению можно получить путем переноса последовательностей CDR по изобретению в вариабельные области антител человека. Гуманизированные антитела не продуцируют ответ против антител (AAR) или ответ антител человека против антител мышей (HAMA) и не удаляются быстро из-за нейтрализации антителами.
В предпочтительном воплощении настоящего изобретения мышиное антитело AB12M1 гуманизируют с помощью CDR-прививки. В полученном гуманизированном антителе предпочтительно его вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17, 19, 21, 23, 25, 27 и 29, и его вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 20, 22, 24, 26, 28 и 30. Более предпочтительно, в полученных гуманизированных антителах AB12M3, AB12M4, AB12M5, AB12M6, AB12M7, AB12M8 и AB12M9 их вариабельные области тяжелой цепи содержат аминокислотные последовательности SEQ ID NO: 17, 19, 21, 23, 25, 27 и 29 соответственно, и соответствующие вариабельные области легкой цепи содержат аминокислотные последовательности SEQ ID NO: 18, 20, 22, 24, 26, 28 и 30 соответственно.
В другом предпочтительном воплощении настоящего изобретения мышиное антитело AB12N1 гуманизируют с помощью CDR-прививки. В полученном гуманизированном антителе, предпочтительно, вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, 33 и 35, и вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 32, 34 и 36. Более предпочтительно, в полученных гуманизированных антителах AB12N3, AB12N4 и AB12N5 вариабельные области тяжелой цепи содержат аминокислотные последовательности SEQ ID NO: 31, 33 и 35, соответственно, а соответствующие вариабельные области легкой цепи содержат аминокислотные последовательности SEQ ID NO: 32, 34 и 36, соответственно.
Без существенного влияния на активность антитела, специалист в данной области способен заменить, добавить и/или удалить одну или более (например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более) аминокислот в последовательности антитела по изобретению с получением варианта антитела, который следует рассматривать как входящий в объем настоящего изобретения. Например, замены предполагаются для аминокислот с аналогичными свойствами в вариабельных областях. Аминокислотные последовательности вариантов по изобретению могут иметь по меньшей мере 80%-ную идентичность последовательности с их исходными аминокислотными последовательностями до модификации; более предпочтительно, аминокислотные последовательности вариантов по изобретению могут иметь по меньшей мере 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичность последовательности с их исходными аминокислотными последовательностями до модификации.
Антитела по изобретению могут быть полноразмерными антителами. Например, в некоторых предпочтительных воплощениях, анти-PD1 антитело человека по изобретению дополнительно содержит константную область тяжелой цепи человеческого IgG4 или IgG1 и константную область легкой κ-цепи человека. Альтернативно, антитело может содержать только антигенсвязывающие фрагменты, такие как фрагмент Fab или F(ab')2, или одноцепочечное антитело scFv.
В любом из вышеописанных воплощений, антитела по изобретению способны связываться с PD-1 с KD примерно 1 нМ или менее; в предпочтительных воплощениях антитела способны связываться с PD-1 с KD примерно 100 пM или менее; в более предпочтительных воплощениях антитела способны связываться с PD-1 с KD примерно 10 пM или менее; в наиболее предпочтительных воплощениях антитела способны связываться с PD-1 с KD примерно 1 пM или менее.
В другом аспекте настоящего изобретения предлагается молекула ДНК, кодирующая любое из вышеописанных антител.
Например, молекула ДНК, кодирующая вариабельную область тяжелой цепи предпочтительного химерного антитела AB12M2 по настоящему изобретению, показана в SEQ ID NO: 37 и молекула ДНК, кодирующая его вариабельную область легкой цепи, показана в SEQ ID NO: 38.
В качестве другого примера, молекула ДНК, кодирующая вариабельную область тяжелой цепи предпочтительного гуманизированного антитела AB12M3 по изобретению, показана в SEQ ID NO: 39 и молекула ДНК, кодирующая его вариабельную область легкой цепи, показана в SEQ ID NO: 40.
В качестве другого примера, молекула ДНК, кодирующая вариабельную область тяжелой цепи другого предпочтительного гуманизированного антитела AB12M4 по изобретению, показана в SEQ ID NO: 41, и молекула ДНК, кодирующая его вариабельную область легкой цепи, показана в SEQ ID NO: 42.
В другом аспекте изобретения предложен экспрессионный вектор, содержащий любую из молекул ДНК по изобретению, как описано выше.
В другом аспекте изобретения предлагается клетка-хозяин, трансфицированная любым экспрессионным вектором, описанным выше. Предпочтительно, клетка-хозяин представляет собой клетку СНО (клетка яичника китайского хомяка).
В другом аспекте изобретения предложен иммуноконъюгат, содержащий антитело по изобретению, конъюгированное с терапевтическим агентом. Терапевтическим агентом предпочтительно является токсин, радиоизотоп, лекарственное средство или цитотоксический агент.
В другом аспекте изобретения предлагается биспецифическая молекула, содержащая любое антитело по изобретению. Например, описанное выше антитело к PD-1 может быть функционально связано с антителом или фрагментом антитела с другой антигенсвязывающей специфичностью с образованием биспецифического антитела. Например, биспецифическое антитело дополнительно включает, без ограничения ими, антитело против таких молекул, как VEGF, EGFR, HER2/neu, рецепторов VEGF или других рецепторов фактора роста, CD20, CD40, CTLA-4, OX-40, 4-1BB и ICOS.
В другом аспекте изобретения предлагается фармацевтическая композиция, содержащая антитело по изобретению и фармацевтически приемлемые эксципиенты, носители или разбавители.
В другом аспекте изобретения предложен способ получения антител по изобретению, включающий: (а) культивирование описанной выше клетки-хозяина по изобретению в условиях, позволяющих продуцировать антитело, (б) извлечение и выделение полученного антитела.
В другом аспекте изобретения предлагается применение анти-PD-1 антител, фармацевтических композиций, иммуноконъюгатов и биспецифических молекул по изобретению в изготовлении лекарственного средства для лечения заболевания или состояния, опосредованного PD-1.
Предпочтительно заболевание или состояние представляет собой рак, более предпочтительно рак с высоким уровнем экспрессией PD-L1, и рак включает, без ограничения им, рак легких, рак печени, рак яичника, рак шейки матки, рак кожи, рак мочевого пузыря, рак толстой кишки, рак молочной железы, глиому, рак почки, рак желудка, рак пищевода, плоскоклеточный рак полости рта, и рак головы и шеи; более предпочтительно рак представляет собой рак молочной железы, рак легкого, рак желудка, рак толстой кишки, рак почки или меланому; наиболее предпочтительно рак представляет собой немелкоклеточный рак легкого, меланому или рак почки.
Предпочтительно заболевание представляет собой инфекционное заболевание, например хроническую вирусную инфекцию, бактериальную инфекцию или паразитарную инфекцию, и более предпочтительно инфекционное заболевание представляет собой HIV (вирус иммунодефицита человека), HBV (вирус гепатита В) или HCV (вирус гепатита C).
При изготовлении лекарственного средства для лечения рака или инфекционных заболеваний предпочтительно можно использовать химерные или гуманизированные анти-PD-1 антитела; более предпочтительно используют гуманизированные анти-PD-1 антитела.
Антитела, предлагаемые в настоящем изобретении, можно использовать отдельно или в комбинации с другими терапевтическими агентами или терапевтическими методами: например противоопухолевыми агентами или иммуногенными агентами (например опухолевыми антигенами), антигенпрезентирующими клетками (например дендритными клетками, стимулированными антигенами или нуклеиновыми кислотами, полученными из опухолей), иммуностимулирующими цитокинами (например IL-2, IFNA2, GM-CSF) и клетками, трансфицированными генами, кодирующими иммуностимулирующие цитокины (например теми, которые включают, без ограничения им, GM-CSF); стандартным лечением рака (например химиотерапией, лучевой терапией или хирургией); или другими антителами (которые включают, без ограничения ими, антитела против VEGF, EGFR, HER2/neu, рецепторов VEGF или других рецепторов фактора роста, CD20, CD40, CTLA-4, OX-40, 4-IBB и ICOS).
По сравнению с Keytruda и Opdivo, используемыми в клиническом лечении, гуманизированные анти-PD-1 антитела, предлагаемые в настоящем изобретении, имеют не только более высокую аффинность связывания с PD-1, с константой связывания KD менее 1 пМ, но также и высокую специфичность. Противоопухолевые данные in vivo показали, что гуманизированные антитела, предложенные в настоящем изобретении, значительно ингибируют рост имплантированной опухоли у трансгенных мышей, а у некоторых мышей даже полностью устраняют опухоль. Кроме того, антитела по настоящему изобретению экспрессируются в клетках СНО и обладают преимуществами высокого выхода, высокой активности, простого процесса очистки и низкой себестоимости получения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Сокращения и определения
hPD-1, человеческий белок PD-1;
CDR, область, определяющая комплементарность вариабельной области иммуноглобулина, определенной по схеме нумерации Кабата;
EC50, концентрация антитела, обеспечивающая полумаксимальное связывание;
ELISA, твердофазный иммуноферментный анализ;
FR, каркасная область антитела, вариабельная область иммуноглобулина за исключением областей CDR;
HRP, пероксидаза хрена;
IL-2, интерлейкин 2;
IFN, интерферон;
IC50, концентрация ингибитора, которая обеспечивает 50%-ное ингибирование;
IgG, иммуноглобулин G;
Kabat, схема нумерации и выравнивания иммуноглобулинов, предложенная Элвином А. Кабатом;
mAb, моноклональное антитело;
PCR, полимеразная цепная реакция;
V-область, сегмент вариабельной последовательности IgG разных антител, который включает от 1 до 109 остатков по Kabat в легкой цепи и от 1 до 113 остатков по Kabat в тяжелой цепи;
VH, вариабельная область тяжелой цепи иммуноглобулина;
Vκ, вариабельная область легкой κ-цепи иммуноглобулина;
KD, равновесная константа диссоциации;
ka, константа скорости ассоциации;
kd, константа скорости диссоциации.
При использовании здесь термин “антитело” включает полноразмерные антитела (например антитела IgG1 или IgG4), их различные функциональные фрагменты (например только антигенсвязывающие фрагменты, такие как фрагменты Fab, F(ab')2 или scFv), и модифицированные антитела (например гуманизированные, гликозилированные и т.д.). Настоящее изобретение также включает анти-PD-1 антитела с модификациями посредством гликозилирования и дегликозилирования. В некоторых применениях модификации выполняют путем удаления нежелательных сайтов гликозилирования, таких как модификации удаления фукозы из олигосахаридных цепей для усиления функции антителозависимой клеточно-опосредованной цитотоксичности (ADCC); в других применениях модификацию галактозилирования выполняют для изменения активности антитело-опосредованной комплемент-зависимой цитотоксичности (CDC).
Термин "моноклональное антитело или mAb" относится к антителу, полученному из одного клонального штамма, который не ограничен эукариотическими клетками, прокариотическими клетками или фагами. Моноклональные антитела или антигенсвязывающие фрагменты могут быть получены с использованием, например, гибридомных методик, рекомбинантных методик, методик фагового дисплея, композиционных методов (например прививки CDR) или нескольких современных комбинированных методик и т.д.
"Фрагмент антитела" и "антигенсвязывающий фрагмент" относятся к антигенсвязывающему фрагменту антитела или аналога антитела, который обычно содержит по меньшей мере часть антигенсвязывающей области или вариабельной области (например одну или более CDR) родительского антитела. Фрагмент антитела сохраняет по меньшей мере некоторую специфичность связывания родительского антитела. Как правило, фрагмент антитела сохраняет по меньшей мере 10% родительской связывающей активности, где активность выражена в молях. Предпочтительно фрагмент антитела сохраняет по меньшей мере 20%, 50%, 70%, 80%, 85%, 90%, 95% или более аффинности связывания родительского антитела с мишенью. Примеры фрагментов антител включают, без ограничения им, фрагменты Fab, Fab', F(ab')2 и Fv; двойные антитела; линейные антитела; молекулы одноцепочечных антител, например scFv и UniBody (Genmab); нанотела (Ablynx); доменные антитела (Domantis); и мультиспецифические антитела, образованные фрагментами антител. Обзор сконструированных вариантов антител см. в Holliger B et al., 2005, Nat Biotechnol, 23:1126-1136.
"Фрагмент Fab" состоит из легкой цепи, области CH1 и вариабельной области тяжелой цепи. Тяжелая цепь молекулы Fab не может образовывать дисульфидную связь с тяжелой цепью другой молекулы Fab.
Область "Fc" содержит два фрагмента тяжелой цепи, каждый из которых содержит домены антитела СН2 и СН3. Два фрагмента тяжелой цепи удерживаются вместе двумя или более межцепочечными дисульфидными связями и гидрофобными взаимодействиями между доменами СН3.
"Фрагмент Fab'" содержит легкую цепь и домен VH тяжелой цепи, домен CH1 и константную область между доменами CH1 и CH2, и, таким образом, две тяжелые цепи двух фрагментов Fab' могут образовывать дисульфидную связь между цепями с образованием молекулы F(ab')2.
"Фрагмент F(ab')2" содержит две легких цепи и два VH-домена тяжелых цепей, домены CH1 и константные области между доменами CH1 и CH2, образуя тем самым межцепочечную дисульфидную связь между двумя тяжелыми цепями. Таким образом, фрагмент F(ab')2 состоит из двух фрагментов Fab', которые удерживаются вместе дисульфидной связью между двумя тяжелыми цепями.
Область "Fv" содержит вариабельные области как тяжелой, так и легкой цепи, но не содержит константных областей.
"Одноцепочечное Fv антитело" (или "scFv антитело") относится к фрагменту антитела, содержащему домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Обзора scFv см. в  1994, The pharmacology of monoclonal antibodies, Rosenberg M and Moore GP, eds, Vol. 113, pp 269-315, Springer Verlag, New York. См. также публикацию международной заявки на патент WO 88/01649 и патенты США 4946778 и 5260203.
1994, The pharmacology of monoclonal antibodies, Rosenberg M and Moore GP, eds, Vol. 113, pp 269-315, Springer Verlag, New York. См. также публикацию международной заявки на патент WO 88/01649 и патенты США 4946778 и 5260203.
"Антигенсвязывающий фрагмент" представляет собой фрагмент иммуноглобулина, имеющий иммунологическую функцию, который содержит только вариабельную область тяжелой цепи или вариабельную область легкой цепи.
При использовании здесь термин "гипервариабельная область" относится к аминокислотным остаткам антитела, ответственным за связывание антигена. Гипервариабельная область содержит следующие аминокислотные остатки: остатки из "областей, определяющих комплементарность" или "CDR", как определено путем выравнивания последовательностей, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельных доменов легкой цепи, и остатки 31-35 (H1), 50-65 (H2) и 95-102 (H3) вариабельных доменов тяжелой цепи, см. Kabat EA et al., 1991, Sequences of Proteins of Immunological Interest, 5th edition, Public Health Service, National Institutes of Health, Bethesda, Md.; и/или аминокислотные остатки "гипервариабельных петель" (HVL), как определено структурами, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) вариабельных доменов легкой цепи, и остатки 26-32 (H1), 53-55 (H2) и 96-101 (H3) вариабельных доменов тяжелой цепи, см. Chothia C and Leskl, 1987, J MoI Biol, 196:901-917. Остатки "каркасной области" (FR) относятся к остаткам в вариабельной области, за исключением остатков в гипервариабельной области, определенной в настоящем документе.
Термин "химерное антитело" представляет собой антитело, у которого слиты вариабельные области мышиного антитела с константными областями человеческого антитела для уменьшения иммунного ответа, индуцированного мышиным антителом. Для получения химерного антитела необходимо разработать клетки гибридомы, которые секретируют специфические мышиные моноклональные антитела. Затем гены вариабельной области клонируют из клеток гибридомы мыши и, при необходимости, клонируют гены константной области человеческого антитела. Гены вариабельной области мыши и гены константной области человека лигируют в химерные гены. Химерные гены вводят в векторы и, наконец, экспрессируют в эукариотической или прокариотической экспрессионной системе для получения химерного антитела. В предпочтительном воплощении изобретения вариабельная область легкой цепи химерного анти-PD-1 антитела также содержит FR-области легкой κ-цепи мыши, λ-цепи или их варианта. Вариабельная область тяжелой цепи химерного анти-PD-1 антитела также содержит FR-области тяжелой цепи мышиного IgG1, IgG2, IgG3, IgG4 или их варианта. Константные области химерного анти-PD-1 антитела могут быть выбраны из константных областей человеческого IgG1, IgG2, IgG3, IgG4 или их варианта, предпочтительно константных областей человеческого IgG2 или IgG4 или константных областей человеческого IgG1, которые не имеют ADCC (антитело-зависимой клеточно- опосредованной цитотоксичности) токсичности после аминокислотных мутаций.
Термин "биспецифическая молекула" означает, что анти-PD-1 антитело или его антигенсвязывающий фрагмент по настоящему изобретению можно дериватизировать или присоединить к другой функциональной молекуле, такой как другой пептид или белок (например к опухоль-ассоциированным антигенам, цитокинам и рецепторам клеточной поверхности), для получения биспецифической молекулы, которая связывается по меньшей мере с двумя разными сайтами связывания или целевыми молекулами. Для получения биспецифической молекулы по изобретению антитело по изобретению может быть функционально связано (например посредством химического связывания, слияния генов, нековалентных взаимодействий или иным образом) с одной или более другими связывающими молекулами, такими как другое антитело, фрагмент антитела, пептид или миметик связывания, тем самым образуя биспецифическую молекулу. Например, "биспецифическое антитело" означает, что два разных вариабельных домена или две единицы scFv связаны друг с другом так, что полученное антитело распознает два разных антигена.
При использовании здесь термин "иммунное связывание" или "свойство иммунного связывания" относится к нековалентным взаимодействиям, которые происходят между молекулой иммуноглобулина и антигеном, специфичным для молекулы иммуноглобулина. Сила связывания или аффинность иммуносвязывающих взаимодействий может быть выражена через равновесную константу диссоциации (KD) взаимодействий, при этом, чем меньше значение KD, тем выше аффинность. Свойство иммунного связывания полипептидов может быть количественно определено с использованием методов, хорошо известных в данной области. Один из методов включает измерение скоростей образования и диссоциации комплексов антиген- связывающий партнер/антиген. И "константа скорости ассоциации" (Ka или Kon), и "константа скорости диссоциации" (Kd или Koff) могут быть рассчитаны с концентрациями и фактическими скоростями ассоциации и диссоциации (см. Malmqvist M, 1993, Nature, 361:186-187). Соотношение Kd/Ka равно константе диссоциации KD (см. Davies et al., 1990, Annual Rev Biochem, 59:439-473). Значения KD, ka и kd могут быть измерены любым эффективным методом. В предпочтительном воплощении равновесную константу диссоциации определяют с использованием принципов оптической интерферометрии (например, с помощью прибора Pall ForteBio Octet, описанного в примере 3.4). В других предпочтительных воплощениях равновесная константа диссоциации может быть определена с использованием метода поверхностного плазмонного резонанса (например Biacore) или анализа на основе KinExA. Антитело по настоящему изобретению считается способным специфически связываться с эпитопом PD-1, когда равновесная константа диссоциации KD составляет от ≤10 мкМ, предпочтительно ≤100 нМ, более предпочтительно ≤10 нМ и наиболее предпочтительно ≤100 пМ до примерно 1 пМ.
Гомологичные антитела
В еще одном аспекте вариабельные области тяжелой и легкой цепи антитела по изобретению содержат аминокислотные последовательности, которые гомологичны последовательностям предпочтительного антитела, описанного здесь, в то время как антитело сохраняет необходимые функциональные свойства анти-PD-1 антитела по изобретению.
Например, настоящее изобретение предлагает гуманизированные PD-1-связывающие антитела или их антигенсвязывающие фрагменты, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где: (а) вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая имеет по меньшей мере 80% идентичность аминокислотной последовательности с последовательностью, выбранной из SEQ ID NO: 17, 19, 21, 23, 25, 27 и 29; более предпочтительно вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая имеет по меньшей мере 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичность аминокислотной последовательности с последовательностью, выбранной из SEQ ID NO: 17, 19, 21, 23, 25, 27 и 29; (б) вариабельная область легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 18, 20, 22, 24, 26, 28 и 30; более предпочтительно вариабельная область легкой цепи содержит аминокислотную последовательность, которая имеет по меньшей мере 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичность аминокислотной последовательности с последовательностью, выбранной из SEQ ID NO: 18, 20, 22, 24, 26, 28 и 30.
Консервативно модифицированные антитела
Термин "консервативная модификация" означает, что аминокислотная модификация не оказывает существенного влияния или не изменяет существенно связывающие свойства антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации могут быть введены в антитела по изобретению стандартными методами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативные аминокислотные замены относятся к заменам, которые меняют аминокислоты на другие аминокислоты с подобными боковыми цепями. Семейства, которые содержат аминокислоты с подобными боковыми цепями, подробно описаны в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например с лизином, аргинином, гистидином), с кислотными боковыми цепями (например с аспарагиновой кислотой, глутаминовой кислотой), с незаряженными полярными боковыми цепями (например с глицином, аспарагином, глутамином, серином, треонином, тирозином, цистеином, триптофаном), с неполярными боковыми цепями (например с аланином, валином, лейцином, изолейцином, пролином, фенилаланином, метионином), с бета-разветвленными боковыми цепями (например с треонином, валином, изолейцином) и с ароматическими боковыми цепями (например с тирозином, фенилаланином, триптофаном, гистидином). Таким образом, один или более аминокислотных остатков в областях CDR антитела по изобретению могут быть замещены другими аминокислотными остатками из тех же семейств боковых цепей.
В некоторых воплощениях, антитело по изобретению содержит вариабельную область тяжелой цепи, содержащую последовательности CDR-H1, CDR-H2 и CDR-H3, и вариабельную область легкой цепи, содержащую последовательности CDR-L1, CDR-L2 и CDR-L3, где одна или более из этих последовательностей CDR содержат специфические аминокислотные последовательности на основе предпочтительного антитела (например AB12M1 или AB12N1), как описано здесь, или их консервативные модификации, и антитело сохраняет нужные функциональные свойства анти-PD-1 антитела по изобретению. Следовательно, настоящее изобретение относится к выделенному PD-1-связывающему антителу или его антигенсвязывающему фрагменту, который содержит вариабельную область тяжелой цепи, содержащую последовательности CDR-H1, CDR-H2 и CDR-H3, и вариабельную область легкой цепи, содержащую последовательности CDR-L1, CDR-L2 и CDR-L3, где: (а) последовательность CDR-H1 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 1 или 2, или их консервативных модификаций; и/или последовательность CDR-H2 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 3 или 4, или их консервативных модификаций; и/или последовательность CDR-H3 вариабельной области тяжелой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 5 или 6 или их консервативных модификаций; и/или (б) последовательность CDR-L1 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 7 или 8, или их консервативных модификаций; и/или последовательность CDR-L2 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 9 или 10, или их консервативных модификаций; и/или последовательность CDR-L3 вариабельной области легкой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 11 или 12, или их консервативных модификаций.
Терапевтические применения анти-PD-1 антитела
Антитела по изобретению включают биспецифические, поликлональные, моноклональные и гуманизированные антитела и можно использовать в качестве терапевтических агентов. Эти агенты обычно могут использоваться для лечения или профилактики рака у субъекта, повышения эффективности вакцины или усиления врожденных иммунных реакций.
Антитело или его фрагмент по изобретению, которые специфично связываются с белком PD-1, можно вводить в форме фармацевтической композиции для лечения рака или хронических инфекций.
Терапевтически эффективное количество антитела по изобретению обычно включает количество, необходимое для достижения терапевтического эффекта. Как отмечено выше, оно имеет отношение к связывающему взаимодействию между антителом и его целевым антигеном. Количество для введения зависит не только от аффинности связывания антитела с его специфическим антигеном, но также от фармакокинетических свойств антитела в субъекте. В неограничивающем примере обычный диапазон эффективной терапевтической дозы антитела или фрагмента антитела по изобретению может составлять от примерно 0,1 мг/кг массы тела до примерно 50 мг/кг массы тела. Обычная частота приема может составлять, например, от двух раз в сутки до одного раза в неделю.
В случае применения фрагментов антител предпочтительным является минимальный ингибирующий фрагмент, который специфически связывается с доменом связывания белка-мишени, например фрагмент, который основан на последовательности вариабельной области антитела и сохраняет способность связываться с целевым белком. Такие пептиды могут быть синтезированы химически и/или получены методами рекомбинантной ДНК (см., например, Marasco et al., 1993, Proc Natl Acad Sci USA, 90:7889-7893). В зависимости от конкретных показаний к лечению, препараты могут также содержать более одного активного соединения, предпочтительно не оказывающего негативного влияния друг на друга, но обладающего комплементарной активностью. Альтернативно или дополнительно, композиция может содержать агенты, которые усиливают ее функцию, например цитотоксические агенты, цитокины, химиотерапевтические агенты или ингибиторы роста.
Рак
Антитело или антигенсвязывающий фрагмент по изобретению можно использовать для лечения рака, то есть для ингибирования роста или выживания опухолевых клеток. Предпочтительные раковые заболевания, рост которых можно ингибировать с помощью антител по изобретению, включают те, которые обычно чувствительны к иммунотерапии. Неограничивающие примеры предпочтительных раковых заболеваний включают меланому (например злокачественную метастатическую меланому), рак почки (например светлоклеточную карциному), рак предстательной железы (например гормонорезистентную аденокарциному простаты), аденокарциному поджелудочной железы, рак молочной железы, рак толстой кишки, рак легкого (например немелкоклеточный рак легкого), рак пищевода, плоскоклеточный рак головы и шеи, рак печени, рак яичника, рак шейки матки, рак щитовидной железы, глиобластому, глиому, лейкоз, лимфому и другие злокачественные заболевания.
Инфекционные заболевания
Антитела или фрагменты антител по изобретению также можно использовать для профилактики или лечения инфекций и инфекционных заболеваний. Антитела или фрагменты антител можно использовать отдельно или в комбинации с вакцинами для стимуляции иммунных реакций против патогенов, токсинов и аутоантигенов. Антитела или их антигенсвязывающие фрагменты можно использовать для стимуляции иммунных ответов на патогенные вирусы, инфицирующие человека, и примеры этих патогенных вирусов включают, без ограничения ими, HIV, вирус гепатита (A, B или C), вирус герпеса (например, VZV, HSV-1, HAV-6, HSV-II, CMV и вирус Эпштейна-Барр), аденовирус, вирус гриппа, флавивирус, эховирус, риновирус, вирус Коксаки, корновирус, респираторно-синцитиальный вирус, вирус свинки, ротавирус, вирус кори, вирус краснухи, парвовирус, вирус коровьей оспы, вирус HTLV, вирус денге, вирус папилломы, вирус моллюска, полиовирус, вирус бешенства, вирус JC (вирус Джона Каннингема) и вирус арбовирусного энцефалита. Антитела или их антигенсвязывающие фрагменты также можно использовать для стимуляции иммунного ответа на инфекции, вызванные бактериями, грибами, паразитами или другими патогенами.
Иммунные адъюванты
Антитела или фрагменты антител по изобретению можно использовать в комбинации с другими рекомбинантными белками и/или пептидами (например опухолевыми антигенами или раковыми клетками) для усиления иммунного ответа на эти белки, то есть использовать в схемах вакцинации.
Например, анти-PD-1 антитела и фрагменты этих антител можно использовать для стимуляции антигенспецифических иммунных ответов путем совместного введения анти-PD-1 антител и целевых антигенов (например вакцин). Таким образом, в другом аспекте настоящего изобретения предложен способ усиления иммунного ответа субъекта на антиген, который включает введение субъекту (1) антигена и (2) анти-PD-1 антитела или его антигенсвязывающего фрагмента по изобретению для усиления иммунного ответа субъекта на антиген. Например, антиген может представлять собой опухолевый антиген, вирусный антиген, бактериальный антиген или антиген из патогена. Неограничивающие примеры таких антигенов включают, без ограничения ими, опухолевые антигены или антигены из вирусов, бактерий или других патогенов.
Нетерапевтическое применение антител и фрагментов антител по изобретению
Нетерапевтические продукты на основе анти-PD1 антител уже существуют, например, анти-hPD-1 моноклональные антитела J116 и J105, продаваемые eBioscience из Сан-Диего, Калифорния, США, для проточной цитометрии, иммуногистохимии и функционального анализа in vitro, а также анти-hPD-1 моноклональное антитело MAB1086, продаваемое R & D Systems из Миннеаполиса, Миннесота, США, для проточной цитометрии, вестерн-блоттинга и ELISA. Антитела по изобретению можно использовать для любых нетерапевтических целей, предусмотренных в настоящее время для J116, J105 и / или MAB1086.
Антитела по настоящему изобретению можно использовать в качестве реагента для аффинной очистки.
Антитела также можно использовать в диагностических анализах, например для обнаружения экспрессии PD-1 в конкретных клетках, тканях или сыворотках. Для диагностических применений антитела могут быть помечены прямо или косвенно детектируемыми группировками. Можно использовать многочисленные маркеры, которые обычно делят на следующие категории: биотин, флуоресцентные красители, радиоактивные нуклеотиды, ферменты, йод и биосинтетические маркеры.
Антитела по изобретению можно использовать в любых известных анализах, таких как анализы конкурентного связывания, прямой и непрямой сэндвич-анализы и анализы иммунопреципитации (Zola H, 1987, Monoclonal antibodies: a manual of techniques, pp 147-158, CRC Press, Inc.).
Антитела также можно использовать в диагностических тестах in vivo. Антитела обычно метят радионуклидами (например, 111In, 99Tc, 4C, 131I, 125I, 3H, 32P, 35S или 18F), так что антигены или антиген-экспрессирующие клетки могут быть локализованы с помощью иммуносцинтиграфии или позитронной визуализации.
Получение моноклональных антител
Моноклональные антитела (mAb) по настоящему изобретению могут быть получены различными способами, включающими обычные методики для моноклональных антител, такие как стандартные методы соматической гибридизации, описанные в Kohler G and Milstein C, 1975, Nature, 256:495. Хотя методы гибридизации соматических клеток являются предпочтительными, также можно использовать другие способы получения моноклональных антител, такие как вирус-опосредованная иммортализация В-клеток человека,.
Предпочтительными животными системами для получения гибридом являются мышиные животные системы. Получение гибридом с использованием мышей является хорошо отработанной процедурой. Протоколы иммунизации и способы выделения иммунизированных клеток селезенки для слияния известны в данной области. Также известны партнеры по слиянию, такие как клетки миеломы мыши, и протоколы слияния.
Для экспрессии антитела или его фрагмента, последовательности ДНК, кодирующие часть или полноразмерные легкие или тяжелые цепи, могут быть получены стандартными методами молекулярной биологии, например ПЦР-амплификацией или клонированием кДНК с использованием клеток гибридомы, экспрессирующих целевое антитело, и встраивание кДНК в экспрессионные векторы, так чтобы целевые гены были функционально связаны с транскрипционными и трансляционными регуляторными последовательностями. Сконструированные векторы трансфицируют в клетку-хозяина для экспрессии белка, и предпочтительно клетка- хозяин является эукариотической, более предпочтительно клеткой млекопитающего, такой как клетка СНО и производная клеточная линия.
Антитело может быть очищено с помощью хорошо известных методов, таких как аффинная хроматография с использованием белка A или белка G. Затем, или альтернативно, конкретный антиген или его эпитоп могут быть иммобилизованы на колонке для очистки иммуноспецифического антитела посредством иммуноаффинной хроматографии. Очистка иммуноглобулинов описана в Wilkinson D (The Scientist, 2000, Vol 14, No. 8, pp 25-28, опубликовано The Scientist, Inc., Philadelphia PA).
Химерное или гуманизированное антитело по настоящему изобретению можно получить на основе последовательности мышиного моноклонального антитела, полученного, как описано выше. Последовательности ДНК, кодирующие тяжелые и легкие цепи иммуноглобулина, могут быть получены из целевых мышиных гибридом и сконструированы таким образом, чтобы включать последовательности немышиных (например человеческих) иммуноглобулинов, используя стандартные методы молекулярной биологии. Например, для получения химерного антитела мышиные вариабельные области могут быть соединены с человеческими константными областями с использованием способов, известных в данной области (см., например, патент США 4816567, Cabilly et al.). Выделенная последовательность ДНК, кодирующая область VH, может быть превращена в полноразмерный ген тяжелой цепи путем функционального связывания последовательности VH ДНК с другой последовательностью ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константной области тяжелой цепи человека известны в данной области (см., например, Kabat EA et al., 1991, Sequences of Proteins of Immunological Interest, 5th edition, US Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК этих константных областей могут быть получены при помощи стандартной ПЦР-амплификации. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно, константную область IgG1 или IgG4.
Для получения гуманизированного антитела, последовательности мышиной области CDR могут быть введены в последовательности человеческой каркасной области с использованием способов, известных в данной области (см. патент США 5225539, Winter, и патенты США 5530011; 5585989; 5693772 и 6180370, Queen et al.) Кроме того, также можно использовать трансгенных животных для гуманизации антител, например мышей HuMAb (Medarex Inc.), которые содержат минилокусы генов человеческого иммуноглобулина, кодирующие неупорядоченные последовательности тяжелой μ- и γ-цепи и легкой κ-цепи иммуноглобулина, вместе с целевыми мутациями, которые инактивируют эндогенные локусы μ- и κ-цепи (см., например, Lonberg et al., 1994, Nature, 368:856-859); или мышей KM, которые несут трансген тяжелой цепи человека и трансхромосому легкой цепи человека (см. патент WO 02/43478). Другие способы гуманизации антител включают технологию фагового дисплея.
Данное изобретение будет дополнительно проиллюстрировано следующими ниже примерами, которые не следует истолковывать как дополнительные ограничения объема изобретения. Все цитируемые графические материалы, ссылки, патенты и опубликованные патентные заявки в тексте этой заявке включены в настоящий документ посредством ссылки.
Краткое описание графических материалов
Фиг. 1: Определение связывания AB12N1 и AB12M1 с человеческим PD-1 с помощью ELISA.
Фиг. 2-1: Определение перекрестной реактивности AB12N1 и AB12M1 с PD-1 яванского макака и человеческим ICOS с помощью ELISA.
Фиг. 2-2: Определение перекрестной реактивности AB12N1 и AB12M1 с человеческим CTLA4 с помощью ELISA.
Фиг. 2-3: Определение перекрестной реактивности AB12N1 и AB12M1 с человеческим CD28 с помощью ELISA.
Фиг. 3: Определение способности AB12N1 и AB12M1 блокировать связывание человеческого PD-1/PD-L1 с помощью конкурентного ELISA.
Фиг. 4: Качественный анализ AB12N1 и AB12M1 с помощью SDS-PAGE (полиакриламидный гель-электрофорез с додецилсульфатом натрия) в восстанавливающих условиях.
Фиг. 5: Определение значений EC50 и специфичности AB12M2, AB12M3 и AB12M4 с помощью ELISA.
Фиг. 6: Определение перекрестной реактивности AB12M2, AB12M3 и AB12M4 с мышиным PD-1 с помощью ELISA.
Фиг. 7: Определение аффинности AB12M2, AB12M3, AB12M4 относительно Keytruda с помощью конкурентного ELISA.
Фиг. 8: Определение аффинности AB12M2, AB12M3, AB12M4 относительно Opdivo с помощью конкурентного ELISA.
Фиг. 9: AB12M3 и AB12M4 связываются с клетками CHO, сверхэкспрессирующими PD-1.
Фиг. 10: AB12M3 и AB12M4 связываются с активированными человеческими T-клетками.
Фиг. 11: AB12M3 и AB12M4 способствуют пролиферации Т-клеток зависимым от концентрации образом.
Фиг. 12: AB12M3 и AB12M4 способствуют секреции IFN-γ зависимым от концентрации образом.
Фиг. 13: AB12M3 и AB12M4 способствуют секреции IL-2 T-клетками.
Фиг.14: AB12M4 ингибирует рост опухоли у мышей.
Примеры
Пример 1. Получение мышиных моноклональных антител против человеческого PD-1.
Самцов мышей BALB/c иммунизировали в нескольких местах 50 мкг очищенного фрагмента внеклеточного домена PD-1 человека (Sino Biological Inc., Beijing, China), эмульгированного в полном адъюванте Фрейнда. Иммунный цикл составлял один раз каждые три недели. На 10-й день после третьей иммунизации кровь собирали через глазницу для оценки титров анти-PD-1-антител в плазме с помощью ELISA для наблюдения за уровнем иммунного ответа у мышей. Мышь с самым высоким титром антител против человеческого PD-1 бустировали один раз за трое суток до слияния. Затем мышь умерщвляли для выделения клеток селезенки, которые затем сливали с клетками миеломы мыши Sp2/0. Для слияния 2×108 клеток Sp2/0 смешивали с 2×108 клеток селезенки в растворе, содержащем 50% полиэтиленгликоля (молекулярная масса 1450) и 5% диметилсульфоксида (DMSO). Количество клеток селезенки доводили до 5×105/мл с помощью среды Искова (содержащей 10% фетальной бычьей сыворотки, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина, 0,1 мМ гипоксантина, 0,4 мкМ аминоптерина и 16 мкМ тимидина). 96-луночный культуральный планшет с 0,3 мл клеточной суспензии помещали в инкубатор с 5% CO2 при 37°C. После 10 суток инкубации супернатант культуры гибридомных клеток использовали для конкуренции с меченым биотином человеческим PD-L1-Fc за связывание с PD-1 посредством ELISA, как в примере 3.2. Было идентифицировано восемь высококонкурентных положительных клонов гибридомы. Клоны клеток субклонировали и мышиные антитела, очищенные от супернатанта, подвергали скринингу и снова идентифицировали. Были получены два положительных клона моноклональных клеток #22 и #32.
Пример 2. Определение значений EC50 мышиных анти-PD1 антител с помощью ELISA
Значения EC50 мышиных моноклональных антител, очищенных от культурального супернатанта штаммов #22 и #32 клеток гибридомы определяли с помощью ELISA. Моноклональные антитела, секретируемые штаммами #22 и #32 клеток гибридомы, были названы AB12N1 и AB12M1 соответственно. Человеческий PD-1 (Sino Biological Inc., Beijing, China) разбавляли до 0,1 мкг/мл буфером PBS и добавляли в 96-луночный планшет в объеме 100 мкл/лунку и помещали при 4°С на 16-20 часов. Буфер PBS аспирировали из 96-луночного планшета, и планшет один раз промывали PBST (PBS, содержащий 0,05% Твина 20, рН 7,4). 200 мкл PBST/1% обезжиренного молока добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа для блокирования. Блокирующий раствор удаляли и планшет промывали 3 раза PBST. Тестируемое мышиное анти-PD1 антитело разбавляли смесью PBST/1% обезжиренное молоко до подходящей концентрации. 100 мкл анти-PD-1 антитела добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1,5 часов. Реакционный раствор удаляли и планшет промывали 3 раза PBST. 50 мкл HRP-меченого козьего вторичного антитела против мышиного IgG (The Jackson Laboratory), разбавленного смесью PBST/1% обезжиренное молоко (коэффициент разбавления 1:4000), добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. Планшет промывали 3 раза PBST. 100 мкл 3,3',5,5'- тетраметилбензидина (TMB) добавляли в каждую лунку и инкубировали при комнатной температуре в течение 10-30 минут для развития окраски. 50 мкл 0,2 М серной кислоты добавляли в каждую лунку для прекращения реакции. Значения поглощения (O.D.) измеряли при двух длинах волн 450/620 нм в считывающем устройстве для микропланшетов, и рассчитывали значение EC50.
Как показано на Фиг. 1, оба мышиных моноклональных антитела, AB12N1 и AB12M1, экспрессируемых клонами #22 и #32 гибридомы соответственно, были способны связываться с PD-1. Значение ЕС50 или антигенсвязывающая активность AB12M1 составляла примерно 0,002 мкг/мл, а это значение для AB12N1 составляло примерно 0,1 мкг/мл.
Пример 3. Скрининг и идентификация мышиных моноклональных анти-PD1 антител
3.1. Определение специфичности связывания мышиных анти-PD-1 антител
Для определения специфических активностей связывания анти-PD-1 антител с другими белками семейства PD-1, человеческий CTLA4, человеческий CD28 и человеческий ICOS использовали для тестирования. При этом для определения разницы связывания мышиных анти-PD-1-антител с другими видами PD-1, отличными от PD-1 человека, для тестирования использовали PD-1 мышей и яванского макака.
Человеческий PD-1/His, человеческий ICOS/Fc, человеческий CTLA4/His, человеческий CD28/Fc, PD-1/Fc яванского макака и мышиный PD-1/His (все от Sino Biological Inc., Beijing, China) разбавляли буфером PBS до 0,1 мкг/мл, и добавляли в 96-луночный планшет в объеме 100 мкл/лунку, и помещали при 16°C на 16-20 часов. Буфер PBS аспирировали из 96-луночного планшета и планшет один раз промывали PBST (PBS, содержащий 0,05% Tween 20, pH 7,4). 200 мкл PBST/1% обезжиренного молока добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа для блокирования. Блокирующий раствор удаляли и планшет 3 раза промывали PBST. 100 мкл тестируемого анти-PD-1 антитела добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1,5 часов. Реакционный раствор удаляли и планшет промывали 3 раза PBST. 50 мкл разбавленного (коэффициент разбавления 1:4000) HRP-меченого козьего вторичного антитела против мышиного IgG (The Jackson Laboratory) добавляли в каждую лунку. Инкубировали при комнатной температуре в течение 1 часа. Планшет промывали PBST 3 раза. 100 мкл TMB добавляли в каждую лунку и инкубировали при комнатной температуре в течение 5-10 минут. 50 мкл 0,2 М серной кислоты добавляли в каждую лунку для прекращения реакции. Значения поглощения считывали при двух длинах волн 450/620 нм в считывающем устройстве для микропланшетов.
Как показано на Фиг. 2-1-Фиг. 2-3, AB12N1 и AB12M1 не обладали специфическим связыванием с тремя другими белками семейства PD-1. При этом AB12N1 и AB12M1 не вступают в перекрестную реакцию с мышиным PD-1, но AB12M1 специфично связывается с PD-1 яванского макака, с которым AB12N1 не связывается.
3.2. Мышиные анти-PD-1 антитела блокируют связывание PD-1 с PD-L1
Биотин-меченый человеческий PD-L1 использовали в качестве реагента. Человеческий PD-1 (Sino Biological Inc., Beijing, China) разбавляли до 2,0 мкг/мл буфером PBS, добавляли в 96-луночный планшет в объеме 100 мкл/лунку и оставляли на ночь при комнатной температуре. Раствор для покрытия удаляли, 200 мкл PBST/1% обезжиренного молока добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. Блокирующий раствор удаляли и планшет промывали 3 раза PBST. Затем смесь 50 мкл разбавленного мышиного моноклонального антитела AB12N1 или AB12M1 и 50 мкл меченого биотином человеческого PD-L1 добавляли в каждую лунку и инкубировали. Несвязанное антитело и меченый биотином PD-L1 вымывали с помощью PBST. Затем в каждую лунку добавляли 100 мкл авидина, меченого HRP. После тщательной инкубации несвязанный HRP-меченый авидин вымывали PBST. 100 мкл раствора TMB-субстрата добавляли в каждую лунку и в течение 30 мин развивалась окраска. Реакцию гасили 0,2 М серной кислотой и значения оптической плотности считывали при двух длинах волн 450/620 нм, используя считывающее устройство для микропланшетов. Как показано на Фиг. 3, мышиные антитела AB12N1 и AB12M1 специфически блокировали связывание PD-1 с PD-L1, и AB12M1 был значительно лучше, чем AB12N1, в блокировании связывания PD-1 с PD-L1.
3.3. SDS-PAGE анализ и идентификация посредством вестерн-блоттинга очищенных мышиных анти-PD1 антител
Очищенные мышиные моноклональные антитела AB12N1 и AB12M1 были качественно и полуколичественно проанализированы с помощью электрофореза SDS- PAGE и иммуноблоттинга (вестерн-блоттинга). 12% SDS-PAGE-гель готовили в соответствии с протоколом и 4 мкг антител AB12N1, AB12M1, Keytruda и Opdivo загружали на каждую дорожку соответственно. Электрофорез проводили вплоть до достижения красителем нижней части разрешающего геля. Затем отключали питание. Результаты электрофореза наблюдали с использованием системы визуализации геля. Как показано на Фиг. 4, в восстанавливающих условиях, SDS-PAGE-гель демонстрировал две четких и гомогенных полосы для обоих мышиных антител AB12N1 и AB12M1, где одна представляла собой тяжелую цепь примерно 50 кДа, а другая - легкую цепь примерно 25 кДа соответственно. Дорожки были загружены следующим образом: дорожка 1 - маркеры; дорожка 2 - AB12N1; дорожка 3 - AB12N1; дорожка 4 - АВ12М1; дорожка 5 - АВ12М1; дорожка 6 - Keytruda; и дорожка - Opdivo.
В соответствии с протоколом изготовления SDS-PAGE-геля, был приготовлен 15% невосстанавливающий SDS-PAGE гель. На этот гель наносили 5 г образца человеческого PD-1. Электрофорез проводили вплоть до достижения красителем нижней части разрешающего геля. Отключали питание. Гель извлекали и помещали на нитроцеллюлозную мембрану такого же размера. В соответствии с площадью геля подавали ток силой 1 мА/см2 и осуществляли электроперенос в течение 2-4 часов. Мембрану погружали в блокирующий раствор и инкубировали при 4°С в течение ночи. Мембрану промывали 3 раза PBST, каждый раз 10 минут. Затем добавляли избыток антитела AB12N1 или AB12M1 и инкубировали в течение 1 часа. Мембрану промывали 3 раза PBST, каждый раз 10 мин, а затем инкубировали в течение 1 ч с HRP-козьими вторичными антителами к мышиному IgG Fc, разбавленными 1:5000. Мембрану промывали 3 раза буфером PBST. Развитие окраски происходило без света в растворе субстрата DAB в течение 15 мин. Затем выполняли промывание водой для прекращения реакции сразу после появления полос. Делали снимки для качественного и количественного анализа.
Результаты вестерн-блоттинга показали PD-1 целевую полосу примерно 34 кДа, что указывает на то, что и AB12N1, и AB12M1 специфически связывались с человеческим PD-1.
3.4. Кинетический анализ и определение аффинности мышиных анти-PD-1 антител
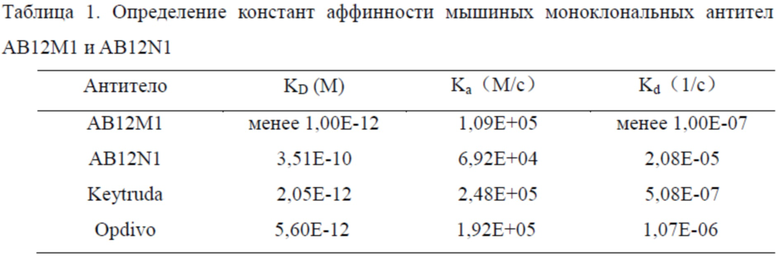
Авторы изобретения использовали метод биослойной интерферометрии (BLI) для характеристики кинетики связывания и аффинности очищенных мышиных моноклональных антител. В соответствии со стандартной процедурой использовали прибор для определения молекулярного взаимодействия Octet (ForteBio Octet RED & QK system, PALL corp.). Антитела Keytruda и Opdivo использовали в качестве контролей. Для многоканального параллельного количественного анализа были установлены градиенты концентрации антител 3,125; 6,25; 12,5; 25; 50 и 100 нМ и человеческий PD-1/His (Sino Biological Inc., Beijing, China) был соединен с датчиком Ni-NTA. Затем определяли кинетику ассоциации и диссоциации антиген-антитело. Данные были проанализированы с получением значений ka (kon), kd (koff) и KD, которые показаны в таблице 1. Равновесная константа диссоциации KD для мышиного моноклонального антитела AB12M1 и человеческого PD-1 была менее 1,00×10-12 М, что сравнимо со значениями контрольных антител Keytruda и Opdivo. Между тем, значение KD для AB12N1 составляло 3,51×10-10 М, указывая на то, что его аффинность связывания была ниже, чем у контрольных антител Keytruda и Opdivo.
Пример 4. Идентификация подкласса и амплификация вариабельной области мышиных моноклональных анти-PD-1антител
Определение подкласса антитела: Используя набор для изотипирования мышиных моноклональных антител IsoStripTM (Santa Cruz Biotechnology, каталожный номер sc-24958), для идентификации подкласса антитела брали супернатант гибридомной клеточной культуры. Подкласс моноклонального антитела AB12N1 был идентифицирован как IgG1 (Kappa), а подкласс моноклонального антитела AB12M1, как IgG2b (Kappa).
Амплификация вариабельной области антитела: представляющие интерес клетки гибридомы #22 или #32 культивировали до в общей сложности 107 клеток, и клетки собирали центрифугированием при 1000 об/мин в течение 10 минут. Тотальную РНК экстрагировали с использованием набора TRIzol (Invitrogen). кДНК первой цепи получали с использованием набора для обратной транскрипции SMARTer RACE. (Clontech). При использовании кДНК первой цепи в качестве матрицы, последовательность ДНК вариабельной области моноклонального антитела, секретируемого клетками гибридомы, должна была быть амплифицирована после конструирования праймеров. На основании результатов идентификации подкласса были известны последовательности константной области тяжелой и легкой цепи подкласса антитела, и специфичные вложенные праймеры для ПЦР были сконструированы в соответствии с последовательностями. Последовательности праймеров, использованные в реакции амплификации, были комплементарны нуклеотидной последовательности 1-й каркасной области вариабельной области и последовательности константной области антитела. Целевые гены амплифицировали общепринятым методом ПЦР и амплифицированные продукты секвенировали. Для антитела AB12N1, секретируемого гибридомным клоном #22, последовательность вариабельной области тяжелой цепи была SEQ ID NO: 15, а последовательность вариабельной области легкой цепи была SEQ ID NO: 16. Аминокислотные последовательности CDR тяжелой цепи (CDR-H1, CDR-H2 и CDR-H3) антитела показаны в SEQ ID NO: 2, 4 и 6 соответственно, а последовательности CDR легкой цепи (CDR- L1, CDR-L2 и CDR-L3) показаны в SEQ ID NO: 8, 10 и 12 соответственно. Для антитела АВ12М1, секретируемого клоном #32 гибридомы, последовательность вариабельной области тяжелой цепи была SEQ ID NO: 13, а последовательность вариабельной области легкой цепи была SEQ ID NO: 14. Аминокислотные последовательности CDR тяжелой цепи (CDR-H1, CDR-H2 и CDR-H3) антитела показаны в SEQ ID NO: 1, 3 и 5 соответственно, а последовательности CDR легкой цепи (CDR- L1, CDR-L2 и CDR-L3) показаны в SEQ ID NO: 7, 9 и 11 соответственно.
Пример 5. Гуманизация мышиных анти-PD-1 антител
На основании последовательностей вариабельных областей антител AB12N1 и AB12M1, полученных выше, осуществляли гуманизацию антител с использованием компьютерного трехмерного моделирования и структурного анализа антител. CDR-прививка является обычным методом гуманизации антител, который сохраняет активность при снижении иммуногенности мышиного антитела путем замены остатков FR человеческого антитела мышиными остатками FR. Метод гуманизации антител, в котором использовали инструмент для анализа Discovery Studio для CDR-прививки, в основном включал следующие стадии: (1) моделирование трехмерной структуры антитела, (2) анализ ключевых остатков. Аминокислотные последовательности вариабельных областей и окружающих их каркасных остатков анализировали посредством молекулярного докинга, и пути пространственного стерического связывания исследовали для идентификации ключевых остатков, критически важных для поддержания конформаций областей CDR. Присутствовали, в основном, три вида ключевых остатков: первые, расположенные на границе связывания между областями VL и VH, которые играли ключевую роль в фолдинге этих двух доменов; вторые, расположенные вблизи областей CDR и заглубленные в белок; третьи, которые непосредственно взаимодействовали с областями CDR через гидрофобные взаимодействия, водородные связи и солевые мостики. (3) Выбор матрицы человеческого антитела. Процесс выбора включал следующие две стадии. Во-первых, аминокислотную последовательность антитела, секретируемого каждым штаммом гибридомных клеток, выравнивали с аминокислотными последовательностями антител зародышевой линии человека, чтобы найти высокогомологичные последовательности человека. Во-вторых, для снижения иммуногенности, были выбраны последовательности каркасных областей человеческих зародышевых антител, имеющие низкую аффинность связывания с HLA-DR MHC II. И (4) на основе анализа ключевых остатков выполняли пересадку из мышиного антитела в зародышевое антитело человека для получения гуманизированной последовательности антитела.
Используя последовательность вариабельной области тяжелой цепи человека VH3-23 и последовательность вариабельной области легкой цепи человека VK3D-11 в качестве матриц, из мышиного антитела AB12M1 были получены 7 гуманизированных антител, которые представляли собой AB12M3, AB12M4, AB12M5, AB12M6, AB12M7, AB12M8 и AB12M9. При этом было сконструировано химерное мышиное-человеческое антитело AB12M2. Вариабельная область тяжелой цепи мышиного антитела была привита на константную область тяжелой цепи человеческого IgG1, а вариабельная область легкой цепи мышиного антитела была привита на константную область легкой каппа-цепи человека. Вышеописанные аминокислотные последовательности вариабельной области гуманизированных антител показаны в таблице 2 ниже.
Используя последовательность вариабельной области тяжелой цепи человека VH3-33 и последовательность вариабельной области легкой цепи человека VK3-11 в качестве матриц, из мышиного антитела AB12N1 были получены 3 гуманизированных антитела, которые представляли собой AB12N3, AB12N4 и AB12N5. При этом было сконструировано химерное мышиное-человеческое антитело AB12N2. Вариабельная область тяжелой цепи мышиного антитела была привита на константную область тяжелой цепи человеческого IgG1, и вариабельная область легкой цепи мышиного антитела была привита на константную область легкой каппа-цепи человека. Вышеописанные аминокислотные последовательности вариабельной области гуманизированных антител показаны в таблице 2 ниже.
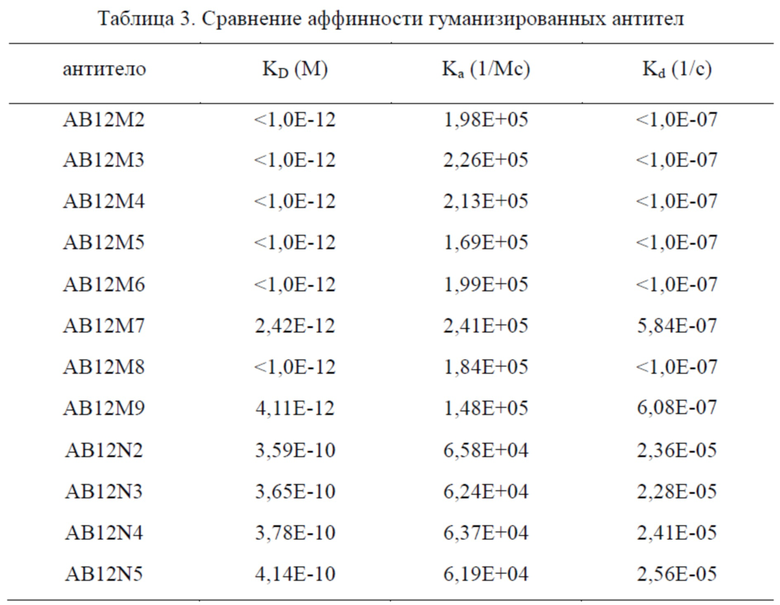
Гуманизированные антитела AB12M3, AB12M4, AB12M5, AB12M6, AB12M7, AB12M8 и AB12M9 содержат более 95% человеческих последовательностей. Их константы аффинности и кинетические константы представлены в таблице 3. Согласно таблице 3, почти все гуманизированные антитела имеют значение KD ниже 1×10-12 М и не имеют значительной потери аффинности связывания по сравнению с мышиным антителом АВ12М1 и химерным антителом АВ12М2. Следовательно, гуманизированные антитела сохраняли аффинность и специфичность исходного моноклонального мышиного антитела и в значительной степени уменьшенную иммуногенность.
Другая группа гуманизированных антител AB12N3, AB12N4 и AB12N5 также содержала более 95% человеческих последовательностей, и значения KD были порядка 10-10 М, указывая на то, что эти гуманизированные антитела не демонстрируют значительной потери аффинности связывания по сравнению с мышиным антителом AB12N1 и химерным антителом AB12N2.

Пример 6. Функциональная характеристика гуманизированных анти-PD1 антител
6.1. Определение значений ЕС50 и специфичности связывания гуманизированных антител с помощью непрямого ELISA
Значения ЕС50 гуманизированных антител АВ12М3 и АВ12М4 и химерного антитела АВ12М2 к антигену PD-1 определяли посредством непрямого ELISA. Keytruda и Opdivo использовали в качестве контрольных антител, а среду - в качестве отрицательного контроля. HRP-меченное козье антитело против человеческого IgG (The Jackson Laboratory) использовали в качестве вторичного антитела, и подробный протокол анализа был таким же, как описано в Примере 2. Тот же самый анализ использовали для обнаружения наличия или отсутствия перекрестных реакций гуманизированных антител AB12M3 и AB12M4 и химерного антитела AB12M2 с мышиным PD-1 (Sino Biological Inc., Beijing, China), также используя антитела Keytruda и Opdivo в качестве контрольных антител и среду в качестве отрицательного контроля.
Как показано на Фиг. 5, гуманизированные антитела AB12M3 и AB12M4 и химерное антитело AB12M2 были способны специфично связываться с человеческим PD-1, и их антигенсвязывающие активности, значения EC50, находились в пределах примерно 0,001-0,01 мкг/мл, то есть ниже значений контрольных антител Keytruda и Opdivo. Это указывает на то, что гуманизированные анти-PD-1 антитела AB12M3 и AB12M4 и химерное антитело AB12M2, сконструированное согласно настоящему изобретению, не демонстрируют снижения PD-1-связывающей способности в результате гуманизации, и высокая аффинность родительского мышиного антитела сохранялась. Кроме того, они не связывались с мышиным PD-1, что указывает на сильную видовую специфичность связывания (Фиг. 6).
6.2. Определение относительной аффинности гуманизированных анти-PD1 антител
Антитела Keytruda и Opdivo, меченные пероксидазой хрена (HRP), использовали в качестве реагентов. Человеческий PD-1 (Sino Biological Inc., Beijing, China) разбавляли до 0,1 мкг/мл буфером PBS и добавляли в 96-луночный планшет в объеме 100 мкл/лунку и оставляли на ночь при комнатной температуре. Удаляли раствор для покрытия, 200 мкл PBST/1% обезжиренного молока добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа для блокировки. Удаляли блокирующий раствор и планшет промывали 3 раза PBST. Затем добавляли смесь 50 мкл ростовой среды (DMEM + 5% FBS) и 50 мкл HRP-меченого Keytruda или Opdivo. Вымывали несвязанные HRP-меченые антитела Keytruda или Opdivo. Затем добавляли антитело AB12M2, AB12M3 или AB12M4, и в качестве положительного контроля использовали немеченые антитела Keytruda или Opdivo. После инкубации несвязанные HRP-меченые антитела Keytruda или Opdivo вымывали с помощью PBS, и значения поглощения считывали при двух длинах волн 450/620 нм, используя считывающее устройство для микропланшетов.
Результаты показаны на Фиг. 7 и 8. Антитела AB12M2, AB12M3 и AB12M4 в значительной степени конкурентно блокировали связывание Keytruda или Opdivo с PD-1, и значения EC50 для AB12M2, AB12M3 и AB12M4, которые конкурировали с Keytruda-HRP или Opdivo-HRP за связывание с PD-1, были ниже, чем у Keytruda или Opdivo, составляя от 0,1 до 1 мкг/мл. Следовательно, можно сделать вывод, что аффинности антител AB12M2, AB12M3 и AB12M4 были сравнимы с аффинностями Keytruda и Opdivo.
6.3. In vitro блокирование связывания PD-1/PD-L1 гуманизированными анти-PD1 антителами
Фрагмент внеклеточного домена белка PD-1, содержащий His-метку, наносили на 96-луночный планшет для ELISA. После блокирования и промывки добавляли тестируемое анти-PD1 антитело, и в то же время добавляли меченный биотином PD-L1-Fc и инкубировали. После промывки планшета измеряли количество связанного биотин-меченого PD-L1-Fc и рассчитывали значение IC50 анти-PD-1 антитела, которое блокировало связывание PD-1 с его лигандом PD-L1.
PD-1/His разбавляли до 2 мкг/мл буфером PBS, pH 7,2, и добавляли в 96- луночный планшет для ELISA в количестве 100 мкл на лунку и инкубировали при встряхивании при комнатной температуре в течение 1 часа. Буфер PBS аспирировали из 96-луночного планшета для ELISA. 200 мл PBST (PBS, содержащий 0,05% Tween 20, pH 7,4)/1% обезжиренного молока добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 ч для блокирования. Планшет промывали 3 раза PBST. 50 мкл тестируемого анти-PD-1 антитела добавляли в каждую лунку и разбавляли блокирующим раствором до соответствующей концентрации. В то же время в каждую лунку добавляли 50 мкл меченого биотином PD-L1/Fc, разбавленного до 200 нг/мл блокирующим раствором. Инкубацию проводили при комнатной температуре в течение 1 часа. Планшет промывали 3 раза PBST. 100 мкл SA-Avidin-HRP (HRP-меченого стрептавидина) разбавляли в соотношении 1:250 блокирующим раствором, добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 ч. Три раза промывали планшет раствором PBST. 100 мкл раствора субстрата TMB добавляли в каждую лунку и инкубировали при комнатной температуре в течение 5-10 минут. Добавляли 50 мкл 0,2 М серной кислоты в каждую лунку для прекращения реакции. Значения поглощения определяли при 450 нм в считывающем устройстве для микропланшетов. Рассчитывали значение IC50 анти-PD-1 антитела, которое блокировало связывание PD-1 с его лигандом PD-L1.
Как показали экспериментальные результаты в Таблице 4, оба антитела AB12M3 и AB12M4 эффективно блокировали связывание PD-1 с PD-L1, превосходили Keytruda и были аналогичны Opdivo.

6.4. Активность клеточного связывания гуманизированных анти-PD1 антител in vitro
FACS (сортировка флуоресцентно-активированных клеток) является тестом, используемым для обнаружения связывания между белками и клетками. Этот тест использовали для определения активности связывания гуманизированных анти-PD1 антител по настоящему изобретению с нативным PD-1, экспрессируемым на поверхности клетки. Используемые для тестирования клетками представляли собой клетки CHO, сверхэкспрессирующие PD-1. 3×105 клеток CHO инкубировали с тестируемым антителом AB12M3 или AB12M4 (первичное антитело) в ряде градиентных концентраций в течение 30 мин. После промывки добавляли вторичные FITC-меченое козье антитело против человеческого IgG (BD Biosciences) и инкубировали в течение 30 минут. Сигналы FITC обнаруживали с помощью проточной цитометрии. Результаты на Фиг. 9 показали, что AB12M3 и AB12M4 могут специфично связываться с PD-1, сверхэкспрессируемым на поверхности клеток CHO.
6.5. Тест на специфичное связывание гуманизированных анти-PD1 антителам и активированных Т-клеток человека.
Свежие мононуклеарные клетки получали из периферической крови человека центрифугированием в градиенте плотности (Lymphoprep™, раствор для разделения лимфоцитов человека, STEMCELL) и Т-лимфоциты высокой чистоты были получены с использованием реагентов для выделения Т-клеток (STEMCELL). Т-лимфоциты стимулировали 5 мкг/мл анти-CD3 антитела в течение 48 часов и культивировали в течение 7 суток после добавления 250 МЕ/мл человеческого IL-2. Затем было получено большое количество активированных Т-лимфоцитов. 3×105 активированных T-лимфоцитов инкубировали с тестируемым антителом AB12M3 или AB12M4 (первичное антитело) в ряде градиентов концентрации в течение 30 минут. После промывки добавляли FITC-меченое козье вторичное антитело против человеческого IgG (BD Biosciences) и инкубировали в течение 30 минут. Сигналы FITC обнаруживали с помощью проточной цитометрии. Результаты на Фиг. 10 показали, что AB12M3 и AB12M4 могут специфично связываться с PD-1, экспрессируемым на поверхности активированных T-клеток.
Пример 7. Определение биологических активностей гуманизированных антител к человеческому PD-1.
7.1. Влияние гуманизированных анти-PD1 антител на пролиферацию клеток и секрецию цитокинов в реакции смешанной культуры лимфоцитов
Реакцию смешанной культуры лимфоцитов использовали для демонстрации эффектов блокирования пути PD-1/PD-L1 на лимфоидных эффекторных клетках. Определяли влияние анти-PD1 антител и контрольного антитела изотипа IgG на пролиферацию Т-клеток и секрецию IFN-γ в реакции смешанной культуры лимфоцитов.
Свежевыделенные мононуклеарные клетки периферической крови человека (PBMC) доводили до плотности клеток 2,0×106 клеток/мл и моноциты получали методом адгезии. Добавляли 100 нг/мл GM-CSF и 100 нг/мл IL-4 и культивировали в течение 5 суток. Затем добавляли 100 нг/мл TNF-α для индукции созревания DC клеток (дендритных клеток). CD4+ Т-клетки выделяли из свежих PBMC человека с использованием набора для позитивной селекции CD4 человека (STEMCELL). В 96-луночном планшете каждая лунка содержала 250 мкл культуральной среды, содержащей 105 изолированных Т-клеток, 104 зрелых DC-клеток и ряд градиентов концентрации AB12M3 или AB12M4. Контрольное антитело изотипа IgG использовали в качестве отрицательного контроля. Смешанные T- и DC-клетки культивировали в инкубаторе с 5% CO2 при 37°C в течение 6 суток, и затем из каждой лунки 96-луночного планшета для определения концентрации IFN-γ удаляли 100 мкл культурального супернатанта. Концентрацию IFN-γ определяли с использованием набора OptEIA ELISA (BD Biosciences). Количество жизнеспособных клеток в 96- луночном планшете определяли с использованием набора CellTiter-Glo (Promega) для измерения пролиферации клеток. Результаты показали, что AB12M3 и AB12M4 стимулируют пролиферацию Т-клеток (Фиг. 11) и секрецию IFN-γ (Фиг. 12) зависимым от концентрации образом.
7.2. Влияние гуманизированных анти-PD1 антител на секрецию цитокинов клетками РВМС человека, индуцированную стимуляцией суперантигеном.
Свежевыделенные человеческие клетки РВМС ресуспендировали в количестве 106 клеток/мл в среде RPMI 1640, содержащей 10% инактивированной FBS (фетальная бычья сыворотка) и 20 мкг/мл AB12M3, или AB12M4, или контрольного антитела изотипа IgG, и вносили в 96-луночный планшет, 100 мкл/лунку. Самую высокую концентрацию суперантигена SEB, которая составляла 2500 нг/мл, разбавляли в 4 серийных 10-кратных разведениях и добавляли в 96-луночный планшет в трех повторах. Клетки культивировали в течение 72 ч. Супернатант отбирали для определения концентрации IL-2 с использованием набора OptEIA ELISA (BD Biosciences). Результаты на Фиг. 13 показали, что AB12M3 и AB12M4 могут стимулировать секрецию IL-2 Т-клетками.
7.3. Влияние стимуляции T-клеток гуманизированными анти-PD1 антителами на гибель опухолевых клеток in vitro.
Клетки линии HCC827 немелкоклеточного рака легкого человека, которые сверхэкспрессировали PD-L1 (Банк клеток Китайской академии наук (Шанхай)), инокулировали в 96-луночный планшет для культивирования. Добавляли ряд концентраций AB12M1, AB12M3, AB12M4 или huIgG. Затем добавляли Т-клетки, которые были активированы как анти-CD3 антителом, так и IL-2, в соотношении эффектор/мишень 10:1 и культивировали в течение 48 часов. Планшет промывали средой для удаления большей части Т-клеток. Жизнеспособность клеток HCC827 анализировали с использованием набора для пролиферации клеток CCK-8 (Dojindo) и рассчитывали скорость уничтожения. Результаты в таблице 5 показывают, что AB12M3 и AB12M4 обладали способностью усиливать T-клеточную гибель опухолевых клеток.
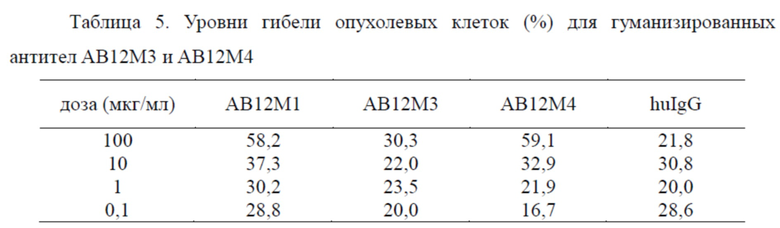
7.4. Эффективность гуманизированных анти-PD1 антител in vivo в PD-1 гуманизированной мышиной модели с подкожно имплантированными клетками рака толстой кишки MC38.
B-hPD-1 гуманизированных мышей использовали для оценки in vivo эффективности анти-PD1 антител человека. Мыши B-hPD-1 были получены от мышей с генетическим фоном C57BL/6 компанией Beijing Biocytogen Co., Ltd. Используя способ направленного воздействия на гены, часть второго экзона гена PD-1 мышей C57BL/6, включая часть домена IgV, заменяли фрагментом человеческого PD-1. Успешно созданные мыши могут экспрессировать химерный человеческий-мышиный PD-1, который содержит внеклеточную часть hPD-1 и внутриклеточную часть mPD-1. Этот тип химерного PD-1 имеет нормальную сигнальную способность PD-1, так как мышиный или человеческий лиганд PD-L1 может связываться с этим рецептором PD-1 для ингибирования активности Т-клеток.
Мышиные клетки рака толстой кишки MC38 (Shunran Shanghai Biotechnology Co., Ltd.) в количестве 5×105 клеток/0,1 мл подкожно инокулировали в правую переднюю часть самок гуманизированных мышей B-hPD-1. Когда размер опухоли достигал примерно 150 мм3, мышей случайным образом разделяли на 3 группы, по 8 мышей в каждой, которые представляли собой (1) контрольную группу с растворителем (группа PBS), (2) группу с обработкой AB12M4 и (3) контрольную группу с обработкой Keytruda (Merck, сер. номер 5SNL80505). Доза лекарственного средства и объем введения для обеих групп (2) и (3) составляли 20 мг/кг и 10 мл/кг соответственно. Для всех групп путь введения представлял внутрибрюшинную инъекцию. лекарственные средства давали один раз каждые 3 суток и в общей сложности 6 раз непрерывно. Эксперимент был прекращен через 28 суток после инокуляции.
Максимальный диаметр (L) и минимальный диаметр (W) опухоли измеряли с помощью штангенциркуля, и объем опухоли (V) рассчитывали по формуле V = 1/2 (L×W2). Объем опухоли измеряли три раза в неделю, и одновременно измеряли массу тела мыши.
Как показано на Фиг. 14, в конце эксперимента средний объем опухоли в контрольной группе с растворителем составлял 3405,2 мм3. Средние объемы опухоли в группе обработки АВ12М4 и в контрольной группе обработки Keytruda составляли 277,4 мм3 и 249 мм3 соответственно, указывая на то, что антитела АВ12М4 оказывали значительный противоопухолевый эффект, и их противоопухолевый эффект был сравним с эффектом Keytruda. Кроме того, в течение всего эксперимента животные были здоровы и ни одно животное не погибло. В конце эксперимента масса тела в каждой группе увеличилась, и не было значительного различия в массе тела между группой обработки AB12M4 и контрольной группой с растворителем (p>0,05), что указывало на хорошую переносимость животными AB12M4, и на то, что AB12M4 не оказывал очевидного токсического действия на экспериментальных животных.
Все публикации, упомянутые в настоящем изобретении, включены посредством ссылки в той же степени, как если бы каждый из документов был отдельно приведен для ссылки. Кроме того, следует понимать, что различные изменения и модификации, которые также входят в объем прилагаемой формулы изобретения, могут быть сделаны специалистами в данной области техники после прочтения вышеизложенных принципов настоящего изобретения.
--->
Перечень последовательностей
<110> AMPSOURCE BIOPHARMA SHANGHAI INC.
<120> Anti-PD-1 Antibody and Use Thereof
<130> 201612
<160> 42
<170> PatentIn version 3.3
<210> 1
<211> 8
<212> PRT
<213> CDR-H1
<400> 1
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 2
<211> 8
<212> PRT
<213> CDR-H1
<400> 2
Gly Ile Thr Phe Ser Asn Ser Gly
1 5
<210> 3
<211> 8
<212> PRT
<213> CDR-H2
<400> 3
Ile Ser Gly Gly Gly Arg Asp Thr
1 5
<210> 4
<211> 7
<212> PRT
<213> CDR-H2
<400> 4
Trp Tyr Asp Gly Ser Lys Arg
1 5
<210> 5
<211> 11
<212> PRT
<213> CDR-H3
<400> 5
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His
1 5 10
<210> 6
<211> 6
<212> PRT
<213> CDR-H3
<400> 6
Ala Thr Asn Asp Asp Tyr
1 5
<210> 7
<211> 10
<212> PRT
<213> CDR-L1
<400> 7
Glu Ser Val Asp Asp Tyr Gly Ile Ser Phe
1 5 10
<210> 8
<211> 6
<212> PRT
<213> CDR-L1
<400> 8
Gln Ser Val Ser Ser Tyr
1 5
<210> 9
<211> 3
<212> PRT
<213> mAb1 CDR-L2
<400> 9
Val Ala Ser
1
<210> 10
<211> 3
<212> PRT
<213> CDR-L2
<400> 10
Asp Ala Ser
1
<210> 11
<211> 9
<212> PRT
<213> CDR-L3
<400> 11
Gln Gln Ser Lys Glu Val Pro Trp Thr
1 5
<210> 12
<211> 9
<212> PRT
<213> CDR-L3
<400> 12
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1 5
<210> 13
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of the murine
antibody AB12M1 or the chimeric antibody AB12M2
<400> 13
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 14
<211> 111
<212> PRT
<213> Amino acid sequence of the light chain variable region of the murine
antibody AB12M1 or the chimeric antibody AB12M2
<400> 14
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Val Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 15
<211> 111
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of the murine
antibody AB12N1 or the chimeric antibody AB12N2
<400> 15
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
<210> 16
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of the murine
antibody AB12N1 or the chimeric antibody AB12N2
<400> 16
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M3
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 18
<211> 111
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M3
<400> 18
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Val Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 19
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M4
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 20
<211> 111
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M4
<400> 20
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Val Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 21
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M5
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 22
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M5
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Val Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Pro Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M6
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 24
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M6
<400> 24
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Leu Ala Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Val Ala Ser Asn Arg Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Pro Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M7
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 26
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M7
<400> 26
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Leu Ala Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Val Ala Ser Asn Arg Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Pro Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Asp Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M8
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 28
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M8
<400> 28
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Val Ala Ser Asn Arg Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Asp Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 118
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12M9
<400> 29
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Lys Asp Thr Ser Trp Phe Val His Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 30
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12M9
<400> 30
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asp Tyr
20 25 30
Gly Ile Ser Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Val Ala Ser Asn Arg Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Asp Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 31
<211> 110
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12N3
<400> 31
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
<210> 32
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12N3
<400> 32
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 33
<211> 111
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12N4
<400> 33
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
<210> 34
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12N4
<400> 34
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 110
<212> PRT
<213> Amino acid sequence of the heavy chain variable region of humanized
antibody AB12N5
<400> 35
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
<210> 36
<211> 107
<212> PRT
<213> Amino acid sequence of the light chain variable region of humanized
antibody AB12N5
<400> 36
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 354
<212> DNA
<213> Nucleotide sequence of the heavy chain variable region of the chimeric
antibody AB12M2
<400> 37
gaggtgaagc tggtggagag cggaggagga ctggtgaagc caggaggatc tctgaagctg 60
agctgtgctg cctctggctt caccttttcc tcttacggca tgagctgggt gagacagaca 120
cccgagaagc gcctggaatg ggtcgctacc atctctggcg gcggcagaga cacatactat 180
cctgattccg tgaagggcag attcaccatc agccgcgata acgccaaaaa taatctgtat 240
ctgcaaatgt cttccctgag gtctgaggac accgctctgt actattgcgc ccggcagaag 300
gatacatctt ggttcgtgca ctggggacag ggcaccctgg tgaccgtgtc cgcc 354
<210> 38
<211> 333
<212> DNA
<213> Nucleotide sequence of the light chain variable region of the chimeric
antibody AB12M2
<400> 38
gacatcgtgc tgacccagtc tccagctagc ctggccgtgt ccctgggaca gagggctacc 60
atcagctgtc gggcctctga gtctgtcgac gattacggca tctctttcat gaattggttc 120
cagcagaaac ctggccagcc ccctaaactg ctgatctatg tcgcttccaa tcagggaagc 180
ggagtgcctg ctagattcag cggatctgga tctggaaccg acttcagcct gaacatccat 240
ccaatggagg aggacgatac cgccatgtac ttctgtcagc agtctaaaga agtcccttgg 300
acctttggcg gcggcacaaa gctggagatc aag 333
<210> 39
<211> 354
<212> DNA
<213> Nucleotide sequence of the heavy chain variable region of humanized
antibody AB12M3
<400> 39
gaggtgcagc tggtggagtc cggaggagga ctggtgcagc ctggaggcag cctgagactg 60
tcttgcgccg cttccggctt caccttttcc agctacggca tgtcttgggt gagacaggct 120
cctggcaagg gactggagtg ggtggctacc atctccggag gaggaaggga cacatactat 180
ccagatagcg tgaagggcag gttcacaatc tctcgggaca acgctaagaa caatctgtat 240
ctgcagatga actccctgag agctgaggac accgccctgt actattgcgc ccgccagaag 300
gatacaagct ggtttgtgca ctggggccag ggcaccctgg tgacagtgtc ttcc 354
<210> 40
<211> 333
<212> DNA
<213> Nucleotide sequence of the light chain variable region of humanized
antibody AB12M3
<400> 40
gagatcgtgc tgacccagag ccctgccaca ctgagcctgt ctccaggcga gagggctacc 60
ctgtcttgtc gggcctccga gagcgtggac gattacggca tctccttcat gaactggttt 120
cagcagaagc caggccaggc tcccaagctg ctgatctatg tggccagcaa tcagggctct 180
ggagtgccag ctcgcttctc tggctccgga agcggaaccg acttttctct gacaatcagc 240
tctctggagc cagacgatac agccatgtac ttctgccagc agtccaagga ggtgccatgg 300
acctttggcg gaggaacaaa ggtggagatc aag 333
<210> 41
<211> 354
<212> DNA
<213> Nucleotide sequence of the heavy chain variable region of humanized
antibody AB12M4
<400> 41
gaggtgcagc tggtggagag cggaggagga ctggtgaagc caggaggatc tctgaggctg 60
agctgtgctg cctctggctt caccttttcc tcttacggca tgagctgggt gagacagaca 120
cccgagaagc gcctggaatg ggtcgctacc atctctggcg gcggcagaga cacatactat 180
cctgattccg tgaagggcag attcaccatc agccgcgata acgccaaaaa taatctgtat 240
ctgcaaatgt cttccctgag gtctgaggac accgctctgt actattgcgc ccggcagaag 300
gatacatctt ggttcgtgca ctggggacag ggcaccctgg tgaccgtgtc ctcc 354
<210> 42
<211> 333
<212> DNA
<213> Nucleotide sequence of the light chain variable region of humanized
antibody AB12M4
<400> 42
gaaatcgtgc tgacccagtc tccagctaca ctggccgtgt cccctggaga gagggctacc 60
atcagctgtc gggcctctga gtctgtcgac gattacggca tctctttcat gaattggttc 120
cagcagaaac ctggccagcc ccctaaactg ctgatctatg tcgcttccaa tcagggaagc 180
ggagtgcctg ctagattcag cggatctgga tctggaaccg acttcaccct gaacatccat 240
ccaatggagg aggacgatac cgccatgtac ttctgtcagc agtctaaaga agtcccttgg 300
acctttggcg gcggcacaaa gctggagatc aag 333
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
| Способы лечения рака с помощью анти-PD-1-антител и анти-CTLA4-антител | 2019 |
|
RU2825835C2 |
| АНТИ-PD-L1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783685C2 |
| НОВЫЕ КОМПОЗИЦИИ АНТИТЕЛ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2019 |
|
RU2804490C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СЛИТОГО БЕЛКА РЕЦЕПТОРА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА БЕТА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2791683C2 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| РЕЖИМ ВВЕДЕНИЯ АНТИТЕЛА К TIGIT ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2833669C2 |
| АНТИТЕЛА ПРОТИВ PD-L1 И ИХ ВАРИАНТЫ | 2017 |
|
RU2770590C2 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
| АНТИТЕЛА ПРОТИВ БЕЛКА-1 ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ (PD-1) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725950C1 |
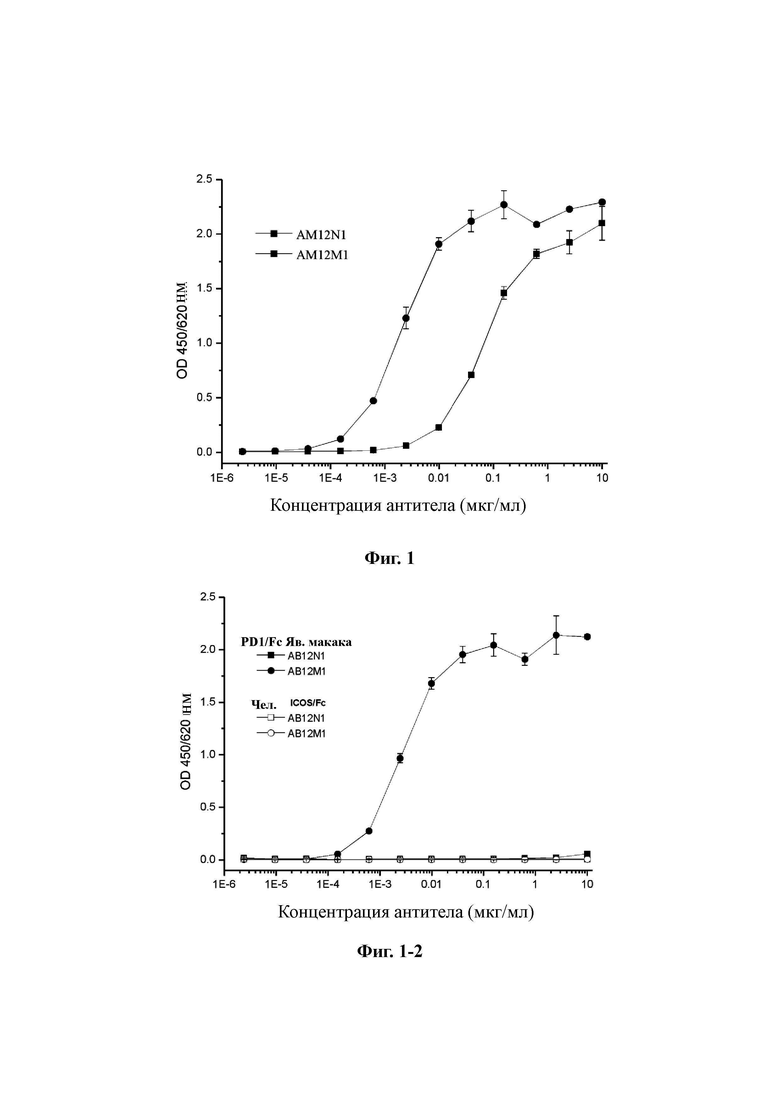
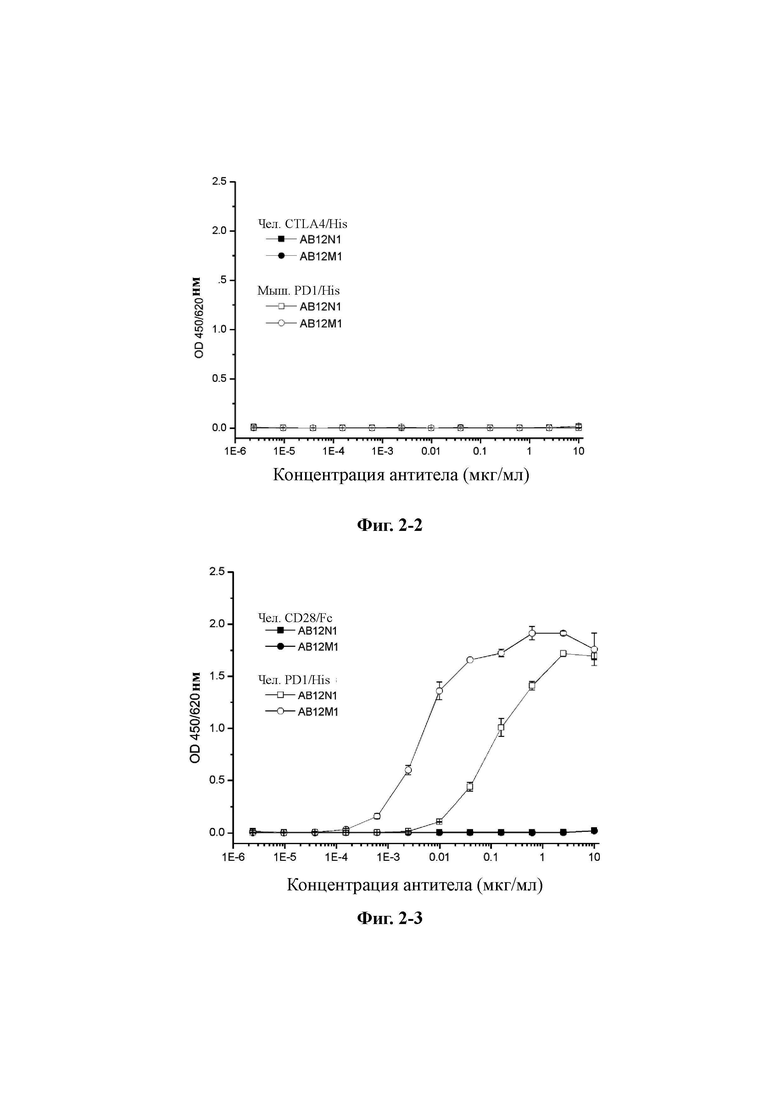
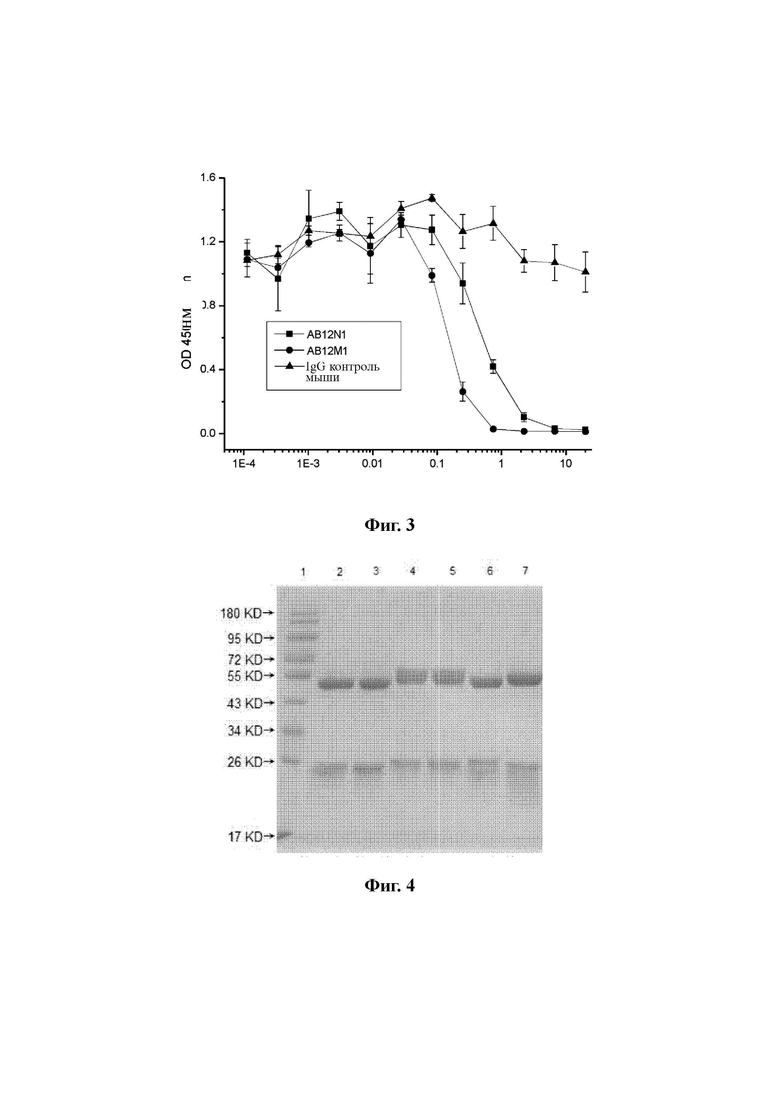
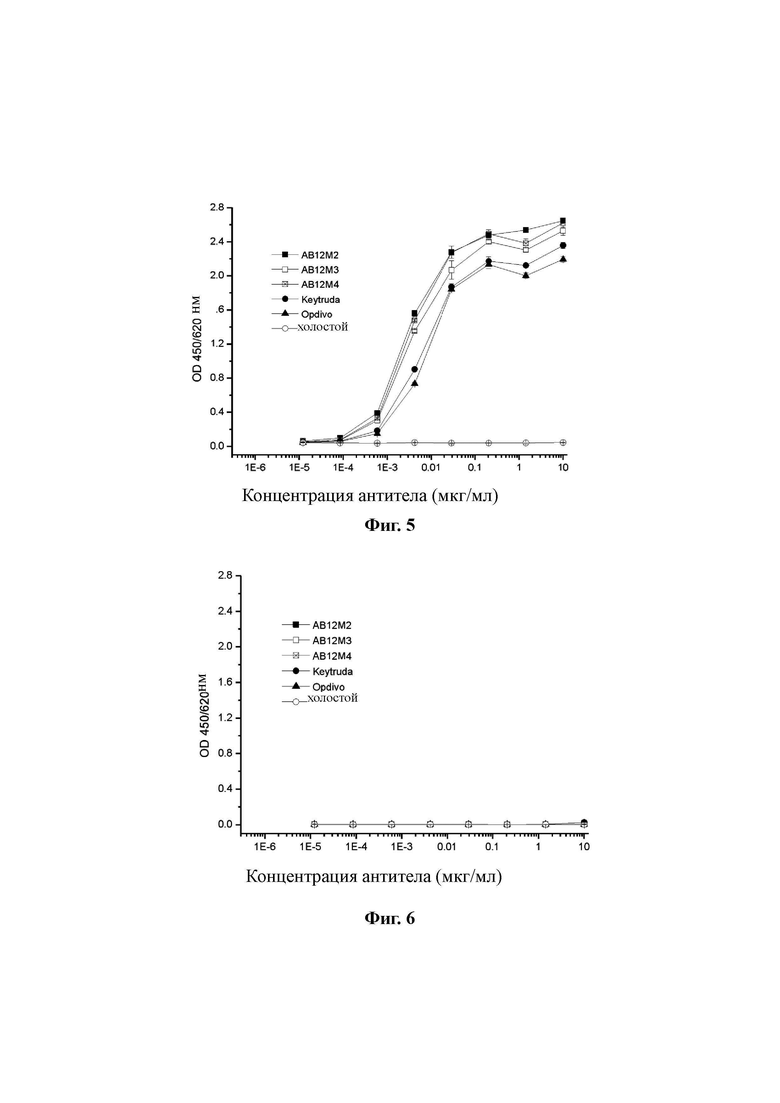
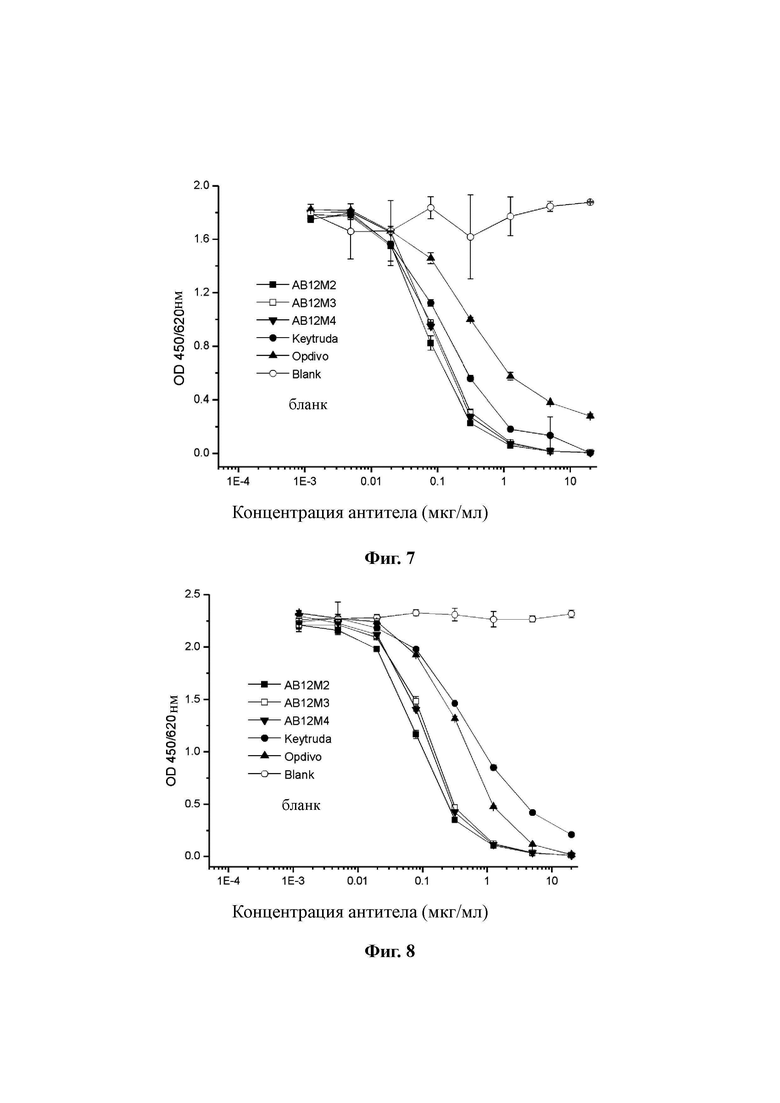
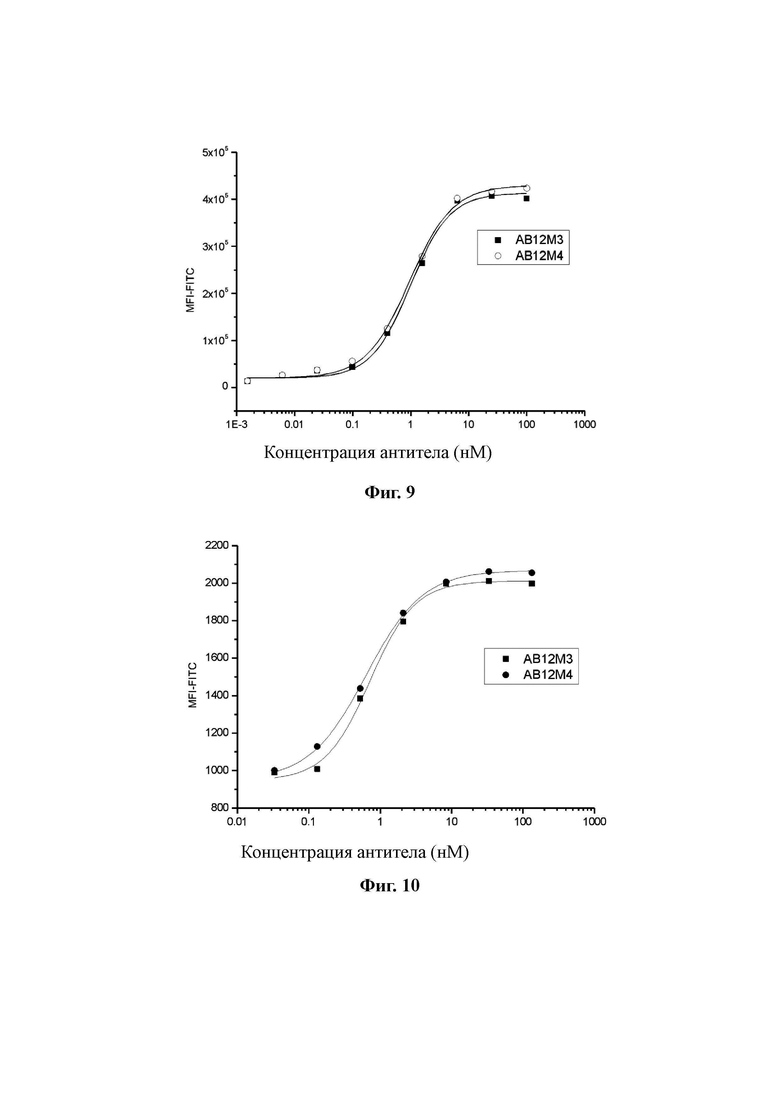
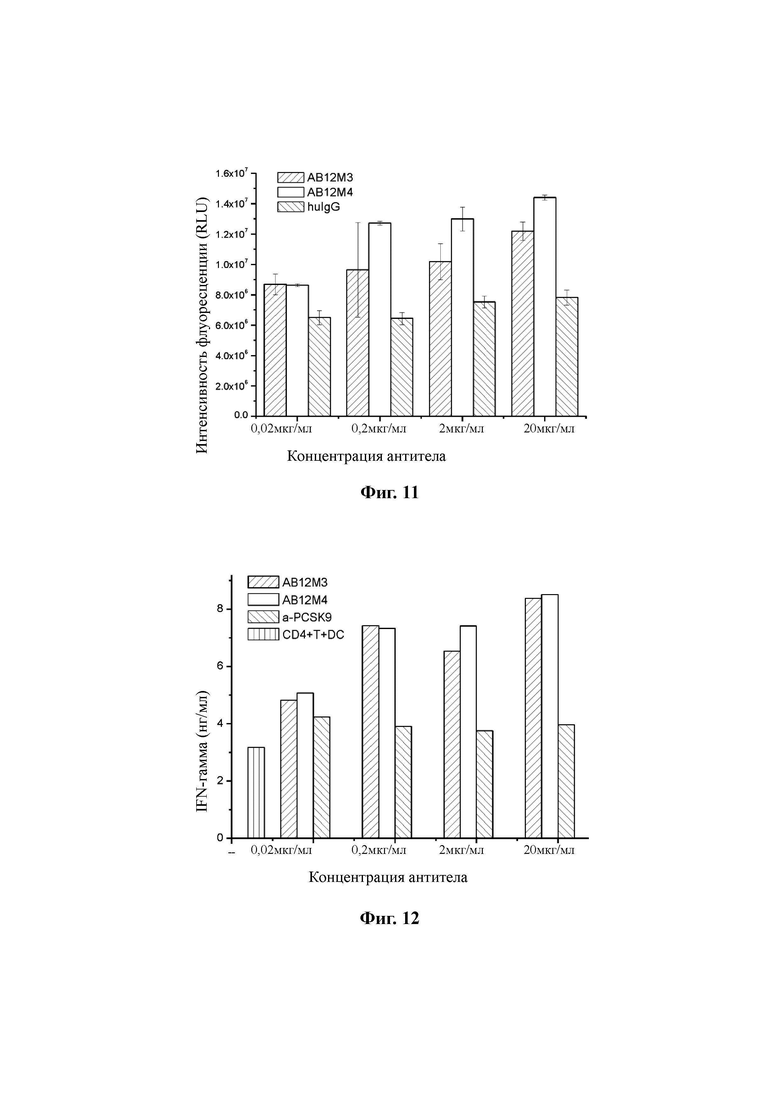
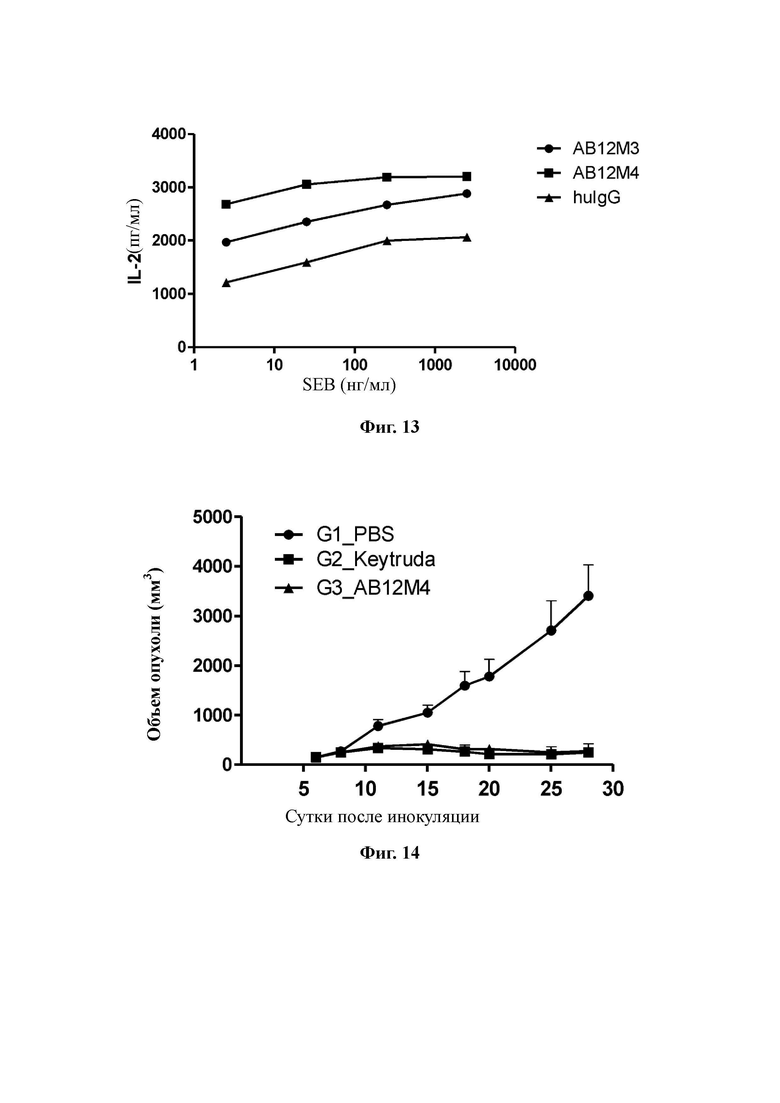
Данная группа изобретений относится к иммунологии. Предложено антитело, специфично связывающееся с PD-1 и охарактеризованное аминокислотными последовательностями CDR. Также предложены: молекула ДНК, биспецифическая молекула, фармацевтическая композиция и применение препарата, содержащего антитело, биспецифической молекулы и фармацевтической композиции в качестве лекарственного средства для лечения PD-1-опосредованного заболевания или состояния. Настоящая группа изобретений может найти дальнейшее применение в терапии различных заболеваний, в том числе рака и инфекционных заболеваний. 5 н. и 11 з.п. ф-лы, 14 ил., 5 табл., 7 пр.
1. Выделенное моноклональное антитело, связывающееся с PD-1, которое содержит
вариабельную область тяжелой цепи, содержащую аминокислотные последовательности CDR-H1, CDR-H2 и CDR-H3, и
вариабельную область легкой цепи, содержащую аминокислотные последовательности CDR-L1, CDR-L2 и CDR-L3,
где:
(1) вариабельная область тяжелой цепи содержит последовательность CDR-H1, показанную в SEQ ID NO: 1, последовательность CDR-H2, показанную в SEQ ID NO: 3, и последовательность CDR-H3, показанную в SEQ ID NO: 5; и
(2) вариабельная область легкой цепи содержит последовательность CDR-L1, показанную в SEQ ID NO: 7, последовательность CDR-L2, показанную в SEQ ID NO: 9, и последовательность CDR-L3, показанную в SEQ ID NO: 11.
2. Антитело по п.1, которое является мышиным или химерным, и где вариабельная область тяжелой цепи содержит FR-область тяжелой цепи мышиного IgG1, IgG2, IgG3 или ее вариант, и вариабельная область легкой цепи содержит FR-область легкой цепи мышиной каппа-, лямбда-цепи или ее вариант.
3. Антитело по п.2, где вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 13, а вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 14.
4. Антитело по п.1, которое является гуманизированным.
5. Антитело по п.4, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17, 19, 21, 23, 25, 27 и 29; и вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 20, 22, 24, 26, 28 и 30.
6. Антитело по п.5, где:
(a) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 17, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 18;
(б) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 19, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 20;
(в) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 21, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 22;
(г) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 23, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 24;
(д) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 25, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 26;
(е) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 27, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 28; или
(ж) вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 29, и вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 30.
7. Антитело по п.6, которое имеет замену, добавление и/или делецию одной или более аминокислот FR-области антитела по п.6 и имеет по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%-ную идентичность аминокислотной последовательности с исходной последовательностью до модификации.
8. Антитело по любому из пп.1-7, которое представляет собой полноразмерное антитело, содержащее константную область тяжелой цепи человеческого IgG4 или IgG1 и константную область легкой каппа-цепи человека или содержащее антигенсвязывающий фрагмент, выбранный из Fab, F(ab')2 или scFv.
9. Антитело по любому из пп.1-7, которое является гликозилированным.
10. Антитело по любому из пп.1-7, которое связывается с PD-1 с KD 1 нМ или менее, предпочтительно с KD 100 пМ или менее, более предпочтительно с KD 10 пМ или менее и наиболее предпочтительно с KD 1 пМ или менее.
11. Молекула ДНК, кодирующая антитело по любому из пп.1-7, где молекула ДНК содержит последовательность первой нуклеиновой кислоты, кодирующей тяжелую цепь вариабельной области антитела, и второй нуклеиновой кислоты, кодирующей легкую цепь вариабельной области антитела, где молекула ДНК выбрана из любой из группы, состоящей из (a), (b) и (c):
(a) последовательности первой нуклеиновой кислоты, как показано в SEQ ID NO: 37, и последовательности второй нуклеиновой кислоты, как показано в SEQ ID NO: 38;
(b) последовательности первой нуклеиновой, кислоты как показано в SEQ ID NO: 39, и последовательности второй нуклеиновой кислоты, как показано в SEQ ID NO: 40; или
(c) последовательности первой нуклеиновой кислоты, как показано в SEQ ID NO: 41, и последовательности второй нуклеиновой кислоты, как показано в SEQ ID NO: 42.
12. Биспецифическая молекула, содержащая антитело по любому из пп.1-7, где предпочтительно биспецифическая молекула дополнительно содержит антитело против молекулы, выбранной из группы, состоящей из VEGF (фактор роста эндотелия сосудов), EGFR (эпидермальный фактор роста), HER2/neu, рецептора VEGF или других рецепторов факторов роста, CD20, CD40, CTLA-4 (антиген цитотоксических Т-лимфоцитов 4 типа), OX-40, 4-1-BB и ICOS (индуцируемый T-клеточный костимулятор).
13. Фармацевтическая композиция для лечения PD-1-опосредованного заболевания или состояния, содержащая антитело по любому из пп.1-7 в эффективной дозе примерно от 0,1 мг/кг массы тела до 50 мг/кг массы тела и фармацевтически приемлемый эксципиент, носитель или разбавитель.
14. Применение препарата, содержащего антитело по любому из пп.1-7, биспецифической молекулы по п.12 и фармацевтической композиции по п.13 в качестве лекарственного средства для лечения PD-1-опосредованного заболевания или состояния.
15. Применение по п.14, где заболевание или состояние предпочтительно представляет собой рак, более предпочтительно рак с высокой экспрессией PD-L1; и рак включает, без ограничения ими, рак легких, рак печени, рак яичников, рак шейки матки, рак кожи, рак мочевого пузыря, рак толстой кишки, рак молочной железы, глиому, рак почки, рак желудка, рак пищевода, плоскоклеточный рак полости рта, или рак головы и шеи; предпочтительно рак представляет собой рак молочной железы, рак легких, рак желудка, рак толстой кишки, рак почки или меланому; и более предпочтительно рак представляет собой немелкоклеточный рак легкого, меланому или рак почки.
16. Применение по п.14, где заболевание предпочтительно является инфекционным заболеванием; инфекционное заболевание включает, без ограничения ими, хронические вирусные инфекции, бактериальные инфекции или паразитарные инфекции; и наиболее предпочтительно инфекционное заболевание представляет собой HIV (вирус иммунодефицита человека), HBV (вирус гепатита B) или HCV (вирус гепатита С).
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| HIRANO, FUMIYA, et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| САХНО Л.В | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-12-28—Публикация
2017-07-06—Подача