РОДСТВЕННЫЕ ЗАЯВКИ НА ПАТЕНТЫ
Данная заявка испрашивает приоритет предварительной заявки на патент США №62/438949, поданной 23 декабря 2016 г., полностью включенной в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Иммунотерапия для лечения раковых заболеваний быстро развивается от видов терапии, глобально и неспецифично стимулирующих иммунную систему, в направлении более нацеленной активации отдельных компонентов иммунной системы, приводящей в результате к повышенной эффективности и сниженной токсичности. В центре внимания находятся виды терапии, ингибирующие взаимодействие между лигандом 1 белка программируемой смерти клеток (PD-L1), присутствующим на поверхности опухоли или антигенпрезентирующих клеток, и белком 1 программируемой смерти клеток (PD-1), присутствующим на поверхности активированных лимфоцитов.
Белок 1 программируемой смерти клеток (PD-1) является представителем семейства рецепторов CD28, которое также включает CD28, антиген 4 цитотоксических Т лимфоцитов (CTLA-4), индуцируемый Т-клеточный костимулятор (ICOS) и В- и Т-лимфоцитарный аттенюатор (BTLA). Белок PD-1 посредством связывания с его двумя основными лигандами PD-L1 (В7-Н1) или PD-L2 (B7-DC) подавляет активацию Т-клеток, что, как правило, должно происходить при распознавании Т-регуляторными клетками опухолевых антигенов, экспрессируемых на опухолевых клетках в контексте главного комплекса гистосовместимости (ГКГ). При раковых заболеваниях пути PD-L1 и PD-1/PD-L1 могут защищать опухоли от цитотоксических Т-клеток, поскольку за счет инактивации цитотоксических Т-клеток в микроокружении опухоли и предотвращения примирования и активации новых Т-клеток в лимфатических узлах и последующего их рекрутирования в опухоль, в конечном счете, происходит ингибирование противоопухолевого иммунного ответа (Chen and Irving, Clin Cancer Res., 18:6580-6587, 2012).
В доклинических моделях ингибирование взаимодействия PD-1/PD-L1 опосредует сильную противоопухолевую активность (патенты США №№8008449 и 7943743), и начаты клинические исследования применения антительных (Ат) ингибиторов взаимодействия PD-1/PD-L1 для лечения ракового заболевания (см., например, Topalian et al., Curr Opin Immunol., 24:207-212, 2012; Brahmer et al., N Engl J Med., 366(26):2455-65, 2012; Garon et al., N Engl J Med, 372:2018-2028, 2015; Philips et al., Int. Immunol., 27(1): 39-46, 2015). Экспрессия PD-1 обнаружена в нескольких раковых заболеваниях человека и мыши, включая карциному легкого, яичника и ободочной кишки и различных миеломах человека, и в настоящее время проведена или проводится клиническая оценка антител к PD-1, разработанных, например, компаниями Bristol-Myers Squibb (ниволумаб), Merck (пембролизумаб) и Medivation (пидилизумаб).
Благодаря переносимости и уникальному механизму действия блокаторы пути PD-1 стали идеальной основой для разработки схем комбинированной терапии. По недавним клиническим данным о комбинировании блокирования CTLA-4 и PD-L1 у пациентов с меланомой показана повышенная частота объективных ответов опухоли по сравнению с блокированием любой из этих контрольных точек по отдельности; таким образом, подтверждена повышенная клиническая польза, наблюдаемая в результате комбинированного блокирования контрольных точек иммунитета (Wolchok et al, N Engl J Med, 366:2443-54, 2012).
Настоящее изобретение основано на идентификации новых антител к PD-1 и их антигенсвязывающих фрагментов. Соответственно, изобретение относится к композициям и способам диагностики, прогнозирования и лечения состояний, при которых принесло бы пользу модулирование PD-L1 и/или PD-1 (например, ракового заболевания, хронических инфекционных заболеваний, аутоиммунных заболеваний, бронхиальной астмы, отторжения трансплантата и воспалительных расстройств) с применением новых человеческих антител к PD-1 и их антигенсвязывающих фрагментов, описанных в настоящем документе.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предложены выделенные антитела и их антигенсвязывающие фрагменты, специфично связывающие белок 1 программируемой смерти клеток (PD-1). Эти антитела к PD-1 или их антигенсвязывающие фрагменты обладают высокой аффинностью к PD-1, выполняют функцию ингибирования PD-1, обладают меньшей иммуногенностью по сравнению с их немодифицированными родительскими антителами у данного биологического вида (например, у человека), способны повышать пролиферацию Т-клеток и секрецию интерлейкина 2 (IL-2) в смешанной лимфоцитарной реакции и могут применяться для лечения заболеваний человека (например, ракового заболевания, инфекционных заболеваний, аутоиммунных заболеваний, бронхиальной астмы, отторжения трансплантата и воспалительных расстройств).
В различных воплощениях изобретения антитело или антигенсвязывающий фрагмент выбраны из человеческого антитела, гуманизированного антитела, химерного антитела, моноклонального антитела, поликлонального антитела, рекомбинантного антитела, одноцепочечного антитела, диатела, триатела, тетратела, Fab фрагмента, Fab' фрагмента, Fab2 фрагмента, F(ab)'2 фрагмента, доменного антитела, IgD антитела, IgE антитела, IgM антитела, IgG1 антитела, IgG2 антитела, IgG3 антитела, IgG4 антитела или IgG4 антитела, имеющего по меньшей мере одну мутацию в шарнирной области, которая ослабляет тенденцию к образованию дисульфидных связей в Н-цепях. В различных воплощениях изобретения антитело представляет собой химерное антитело. В различных воплощениях изобретения антитело представляет собой гуманизированное антитело. В различных воплощениях изобретения антитело представляет собой полностью человеческое антитело. В различных воплощениях изобретения предложены выделенные антитела и их антигенсвязывающие фрагменты, которые обладают высокой аффинностью к белку PD-1 человека SEQ ID NO: 1.
В различных воплощениях изобретения антитело или антигенсвязывающий фрагмент связывается с белком PD-1 с константой диссоциации (KD) по меньшей мере примерно 1×10-6 М, по меньшей мере примерно 1×10-7 М, по меньшей мере примерно 1×10-8 М, по меньшей мере примерно 1×10-9 М, по меньшей мере примерно 1×10-10 М, по меньшей мере примерно 1×10-11 М или по меньшей мере примерно 1×10-12 М.
В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит либо (а) последовательность CDR3 легкой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR3, выбранной из SEQ ID NO: 17-19; либо (b) последовательность CDR3 тяжелой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR3, выбранной из SEQ ID NO: 8-10; либо (с) последовательность CDR3 легкой цепи (а) и последовательность CDR3 тяжелой цепи (b).
В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент дополнительно содержит аминокислотную последовательность, выбранную из: (d) последовательности CDR1 легкой цепи, идентичной, по существу идентичной или по существу подобной последовательности CDR1, выбранной из SEQ ID NO: 11-13; (е) последовательности CDR2 легкой цепи, идентичной, по существу идентичной или по существу подобной последовательности CDR2, выбранной из SEQ ID NO: 14-16; (f) последовательности CDR1 тяжелой цепи, идентичной, по существу идентичной или по существу подобной последовательности CDR1, выбранной из SEQ ID NO: 2-4; (g) последовательности CDR2 тяжелой цепи, идентичной, по существу идентичной или по существу подобной последовательности CDR2, выбранной из SEQ ID NO: 5-7; (h) последовательности CDR1 легкой цепи (d) и последовательности CDR1 тяжелой цепи (f); или (i) последовательности CDR2 легкой цепи (е) и последовательности CDR2 тяжелой цепи (g).
В различных воплощениях изобретения выделенное человеческое моноклональное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит: (а) последовательность CDR1 легкой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR1, выбранной из SEQ ID NO: 11-13; (b) последовательность CDR2 легкой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR2, выбранной из SEQ ID NO: 14-16; (с) последовательность CDR3 легкой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR3, выбранной из SEQ ID NO: 17-19; (d) последовательность CDR1 тяжелой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR1, выбранной из SEQ ID NO: 2-4; (е) последовательность CDR2 тяжелой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR2, выбранной из SEQ ID NO: 5-7; и (f) последовательность CDR3 тяжелой цепи, идентичную, по существу идентичную или по существу подобную последовательности CDR3, выбранной из SEQ ID NO: 8-10.
В различных воплощениях изобретения выделенное человеческое моноклональное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит: (а) последовательность CDR1 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 11; (b) последовательность CDR2 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 14; (с) последовательность CDR3 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 17; (d) последовательность CDR1 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 2; (е) последовательность CDR2 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 5; и (f) последовательность CDR3 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 8.
В различных воплощениях изобретения выделенное человеческое моноклональное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит: (а) последовательность CDR1 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 12; (b) последовательность CDR2 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 15; (с) последовательность CDR3 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 18; (d) последовательность CDR1 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 3; (е) последовательность CDR2 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 6; и (f) последовательность CDR3 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 9.
В различных воплощениях изобретения выделенное человеческое моноклональное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит: (а) последовательность CDR1 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 13; (b) последовательность CDR2 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 16; (с) последовательность CDR3 легкой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 19; (d) последовательность CDR1 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 4; (е) последовательность CDR2 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 7; и (f) последовательность CDR3 тяжелой цепи, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 10.
В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит либо (а) вариабельный(ые) домен(ы) тяжелой и/или легкой цепи, где вариабельный(ые) домен(ы) имеет(ют) набор из трех CDR1, CDR2 и CDR3 легкой цепи, идентичных, по существу идентичных или по существу подобных SEQ ID NO: 11-13, 14-16 и 17-19, и/или набор из трех CDR1, CDR2 и CDR3 тяжелой цепи, идентичных, по существу идентичных или по существу подобных SEQ ID NO: 2-4, 5-7 и 8-10; и (b) набор из четырех каркасных областей вариабельной области иммуноглобулина человека (IgG). В различных воплощениях изобретения антитело может возможно включать в себя шарнирную область. В различных воплощениях изобретения каркасные области выбраны из последовательностей экзонов XH, JH, Vκ и Jκ зародышевой линии человека. В различных воплощениях изобретения антитело представляет собой полностью гуманизированное антитело. В различных воплощениях изобретения антитело представляет собой полностью человеческое антитело.
В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 20, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 26. В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 22, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 28. В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 24, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 30.
В различных воплощениях изобретения выделенное антитело или его антигенсвязывающий фрагмент при связывании с PD-1 человека: (а) связывается с PD-1 человека по существу с такой же Kd, что и эталонное антитело, или большей; (b) конкурирует за связывание с PD-1 человека с указанным эталонным антителом; или (с) обладает меньшей иммуногенностью для субъекта-человека, чем указанное эталонное антитело, где указанное эталонное антитело содержит комбинацию последовательностей вариабельных доменов тяжелой цепи и вариабельных доменов легкой цепи, выбранных из SEQ ID NO: 20/26, 22/28 и 24/30.
В различных воплощениях изобретения выделенное химерное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит тяжелую цепь, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 32, и легкую цепь, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 34.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит вариабельную область тяжелой цепи, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 36, 38, 40-42 и 53, и вариабельную область легкой цепи, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 37, 39, 43-52 и 54-57. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 36, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 37. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 38, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 39. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 40, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 37. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 54. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 55. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 56. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 57.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 58, и последовательность легкой цепи, представленную в SEQ ID NO: 60.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 62, и последовательность легкой цепи, представленную в SEQ ID NO: 64.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 66, и последовательность легкой цепи, представленную в SEQ ID NO: 68.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей выделенное антитело или его антигенсвязывающий фрагмент по настоящему изобретению в смеси с фармацевтически приемлемым носителем. В различных воплощениях изобретения фармацевтическая композиция содержит выделенное человеческое антитело в смеси с фармацевтически приемлемым носителем. В различных воплощениях изобретения фармацевтическую композицию готовят в лекарственной форме для введения путем, выбранным из группы, состоящей из подкожной инъекции, интраперитонеальной инъекции, внутримышечной инъекции, интрастернальной инъекции, внутривенной инъекции, внутриартериальной инъекции, подоболочечной инъекции, внутрижелудочковой инъекции, интрауретральной инъекции, интракраниальной инъекции, интрасиновиальной инъекции, или путем инфузий.
В другом аспекте настоящее изобретение относится к способам лечения субъекта, страдающего заболеванием, связанным с Т-клетками, или заболеванием, которое можно ослаблять или предотвращать посредством усиления, либо подавления, либо продления иммунного ответа, включающим введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) антитела или его антигенсвязывающего фрагмента по настоящему изобретению. В различных воплощениях изобретения субъект представляет собой человека.
В другом аспекте настоящее изобретение относится к способам лечения ракового заболевания у субъекта, включающим введение субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) выделенного антитела или антигенсвязывающего фрагмента по настоящему изобретению. В различных воплощениях изобретения раковое заболевание представляет собой раковое заболевание, связанное с повышенной экспрессией PD-1. В различных воплощениях изобретения раковое заболевание выбрано из группы, состоящей из меланомы (например, метастатической злокачественной меланомы), колоректального рака (CRC), рака почки, немелкоклеточного рака легкого (NSCLC), рака мочевого пузыря, рака предстательной железы, рака молочной железы, рака ободочной кишки, рака яичника и рака легкого. В различных воплощениях изобретения субъект ранее отвечал на лечение противоопухолевой терапией, но после прекращения терапии страдал рецидивом (далее в настоящем документе «рецидивирующее раковое заболевание»). В различных воплощениях изобретения у субъекта присутствует резистентное или рефрактерное раковое заболевание.
В другом аспекте настоящее изобретение относится к способам лечения инфекционного заболевания у субъекта, включающим введение субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) выделенного антитела или антигенсвязывающего фрагмента по настоящему изобретению. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, резистентное к лечению, или эффективность лечения с применением традиционных вакцин отсутствует.
В другом аспекте настоящее изобретение относится к различным видам комбинированной терапии, предназначенным для лечения ракового заболевания или инфекционного заболевания у субъекта, включающим введение субъекту терапевтически эффективного количества выделенного антитела или антигенсвязывающего фрагмента по настоящему изобретению, и Ь) проведение одного или более дополнительных видов терапии, выбранных из группы, состоящей из иммунотерапии, химиотерапии, таргетной терапии низкомолекулярными ингибиторами киназ, хирургического вмешательства, лучевой терапии, протоколов вакцинации и трансплантации стволовых клеток, где комбинированная терапия обеспечивает усиленное уничтожение опухолевых клеток, т.е. при совместном применении выделенного антитела или антигенсвязывающего фрагмента и дополнительных видов терапии они обладают синергетическим действием.
В другом аспекте предложен выделенный иммуноконъюгат или слитый белок, содержащий антитело или антигенсвязывающий фрагмент, конъюгированные, связанные (или иначе стабильно ассоциированные) с эффекторной молекулой. В различных воплощениях изобретения эффекторная молекула представляет собой иммунотоксин, цитокин, хемокин, терапевтический агент или химиотерапевтический агент.
В другом аспекте антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть ковалентно связаны (или иначе стабильно ассоциированы) с дополнительной функциональной группировкой, такой как метка или группировка, придающая желаемые фармакокинетические свойства. В различных воплощениях изобретения метка выбрана из группы, состоящей из флуоресцентной метки, радиоактивной метки и метки, имеющей определенную сигнатуру ядерного магнитного резонанса.
В другом аспекте в настоящем изобретении предложен способ обнаружения in vitro или in vivo наличия антигена PD-1 человека в образце, например, для диагностики заболевания человека, связанного c PD-1.
В другом аспекте предложены выделенные нуклеиновые кислоты, содержащие полинуклеотидную последовательность, кодирующую описанные в настоящем документе антитела или антигенсвязывающие фрагменты. Также предложены экспрессионные векторы, содержащие нуклеиновую кислоту по настоящему изобретению. Также предложены выделенные клетки, содержащие экспрессионные векторы по изобретению. В различных воплощениях изобретения клетка представляет собой клетку-хозяина, содержащую экспрессионный вектор по настоящему изобретению. В различных воплощениях изобретения клетка представляет собой гибридому, в которой хромосома клетки содержит нуклеиновую кислоту по настоящему изобретению. Дополнительно предложен способ получения антитела или антигенсвязывающего фрагмента по настоящему изобретению, включающий культивирование или инкубацию клетки в условиях, позволяющих клетке экспрессировать антитело или антигенсвязывающий фрагмент по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 представлено выравнивание аминокислотной последовательности привитого PD1 (SEQ ID NO: 37/36), Ат PD1-BM (SEQ ID NO: 39/38), PD1-BM-min (SEQ ID NO: 37/40) и четырех полученных из библиотеки клонов AS05614 (SEQ ID NO: 54/53), AS05616 (SEQ ID NO: 55/53), AS05618 (SEQ ID NO: 57/53) и AS05617 (SEQ ID NO: 56/53). Подчеркнутыми буквами обозначены сайты обратной мутации, * = идентичные остатки; : = подобные остатки.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антигенсвязывающим белкам, таким как антитела или их антигенсвязывающие фрагменты, специфично связывающие PD-1 человека. В одном аспекте предложены выделенные антитела и их антигенсвязывающие фрагменты, которые специфично связывают PD-1, обладают аффинностью к PD-1, обладают функцией ингибирования PD-1, обладают меньшей иммуногенностью по сравнению с их немодифицированными родительскими антителами у данного биологического вида (например, человека) и могут применяться для лечения заболеваний (например, ракового заболевания), инфекций и других расстройств, опосредованных PD-1, у человека. Также предложены молекулы нуклеиновых кислот и их производные и фрагменты, содержащие последовательность полинуклеотидов, которая полностью кодирует полипептид или его участок, связывающийся с PD-1, например, нуклеиновая кислота, полностью кодирующая антитело к PD-1 или его часть, фрагмент антитела или производное антитела. Также предложены векторы и плазмиды, содержащие такие нуклеиновые кислоты, и клетки или линии клеток, содержащие такие нуклеиновые кислоты и/или векторы и плазмиды. Также предложены способы получения, идентификации или выделения антигенсвязывающих белков, которые связываются с PD-1 человека, таких как антитела к PD-1, способы определения, связывается ли антигенсвязывающий белок с PD-1, способы получения композиций, таких как фармацевтические композиции, содержащие антигенсвязывающий белок, который связывается с PD-1 человека, и способы введения антитела или его антигенсвязывающего фрагмента, который связывает PD-1, субъекту, например, способы лечения состояния, опосредованного PD-1.
Определения
Если в настоящем документе не определено иное, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, в целом понятные обычным специалистам в данной области техники. Кроме того, если контекст не требует иного, термины в единственном числе будут включать в себя множественное число, а термины во множественном числе будут включать в себя единственное число. Описанные в настоящем документе номенклатуры и методы, используемые в связи с культурой клеток и тканей, молекулярной биологией, иммунологией, микробиологией, генетикой и химией и гибридизацией белков и нуклеиновых кислот, в целом общеприняты и хорошо известны в данной области техники. Если не указано иное, способы и методы по настоящему изобретению, как правило, выполняют в соответствии с общепринятыми способами, хорошо известными в данной области техники и описанными в различных общих и более конкретных ссылках, цитируемых и обсуждаемых во всем тексте настоящего описания. См., например, Green and Sambrook, Molecular Cloning: A Laboratory Manual, 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2012), включенную в настоящий документ посредством ссылки. Ферментативные реакции и методы очистки выполняют в соответствии со спецификациями производителей, как обычно выполняют в данной области техники или как описано в настоящем документе. Описанные в настоящем документе номенклатура, лабораторные методики и методы, используемые в связи с аналитической химией, химией органического синтеза и медицинской и фармацевтической химией, общеприняты и хорошо известны в данной области техники. Для химических синтезов, химических анализов, приготовления фармацевтических препаратов, приготовления лекарственных форм, их доставки и введения субъектам используют стандартные методы.
Полинуклеотидные и полипептидные последовательности указаны с использованием стандартных одно- и трехбуквенных сокращений. Если не указано иное, амино-концы полипептидных последовательностей находятся слева, а их карбокси-концы- справа, и 5'-концы последовательностей однонитевых нуклеиновых кислот и верхней нити последовательностей двунитевых нуклеиновых кислот находятся слева, а их 3'-концы- справа. Конкретный отрезок полипептида может быть обозначен номером аминокислотного остатка, например, аминокислоты 80-119, или фактическим остатком в данном сайте, например, Ser80-Ser119. Конкретная полипептидная или полинуклеотидная последовательность может быть также описана на основании того, как она отличается от эталонной последовательности. Полинуклеотидные и полипептидные последовательности конкретных вариабельных доменов легкой и тяжелой цепи обозначены L1 (вариабельный домен 1 легкой цепи) и H1 (вариабельный домен 1 тяжелой цепи). Антитела, содержащие легкую цепь и тяжелую цепь, указаны путем объединения названия легкой цепи и названия тяжелой цепи вариабельных доменов. Например, «L4H7» указывает, что антитело содержит вариабельный домен легкой цепи L4 и вариабельный домен тяжелой цепи Н7.
Используемый в настоящем документе термин «антитело» относится к белку, содержащему один или более полипептидов, по существу или частично кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов, и обладающему специфичностью к опухолевому антигену или специфичностью к молекуле, гиперэкспрессируемой в патологическом состоянии. Известные гены иммуноглобулинов включают гены константной области каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также подтипы этих генов, и множество генов вариабельных областей иммуноглобулинов. Легкие цепи (LC) классифицируют как каппа или лямбда. Тяжелые цепи (НС) классифицируют как гамма, мю, альфа, дельта или эпсилон, которые, в свою очередь, определяют классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE соответственно. Структурная единица типичного иммуноглобулина (например, антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, где каждая пара имеет одну «легкую» (примерно 25 кД) и одну «тяжелую» (примерно 50-70 кД) цепь. N-конец каждой цепи определяет вариабельную область от примерно 100 до 110 или более аминокислот, прежде всего ответственную за распознавание антигена.
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в настоящем документе как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов CH1, СН2 и СН3 (и в некоторых случаях СН4). Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в настоящем документе как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL можно дополнительно подразделить на области гипервариабельности, называемые областями, определяющими комплементарность (CDR; complementarity determining regions), разделенные более консервативными областями, называемыми каркасными областями (FR; framework regions). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных в следующем порядке от амино-конца к карбокси-концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Каркасные области и CDR имеют определенную протяженность. Последовательности каркасных областей различных легких или тяжелых цепей относительно консервативны в пределах биологического вида, например человека. Каркасная область антитела, то есть объединенные каркасные области составляющих его легких и тяжелых цепей, служит для расположения и выравнивания CDR в трехмерном пространстве. Молекулы иммуноглобулина могут относиться к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
CDR прежде всего ответственны за связывание эпитопа антигена. CDR каждой цепи обычно обозначают как последовательно пронумерованные CDR1, CDR2, CDR3, начиная с N-конца, а также обычно идентифицируют цепью, в которой локализована соответствующая CDR. Так, VH CDR3 локализована в вариабельном домене тяжелой цепи антитела, в котором она находится, a VL CDR1 представляет собой CDR1 из вариабельного домена легкой цепи антитела, в котором она находится. Антитела с различной специфичностью (т.е. различными комбинированными сайтами для различных антигенов) имеют различные CDR. Хотя именно CDR варьируют от одного антитела к другому, непосредственно в связывание антигена вовлечено лишь ограниченное число положений аминокислот внутри CDR. Эти положения внутри CDR называют остатками, определяющими специфичность (SDR; specificity determining residues).
Стандартом для нумерации остатков в антителе является система нумерации по Кабату, которую обычно используют для идентификации областей CDR. База данных Кабата теперь поддерживается онлайн, и последовательности CDR, например, можно определить с помощью доступной в Интернете программы IMGT/V-QUEST, версия 3.2.18, 29 марта 2011 г., и в работе Brochet, X. et al., Nucl. Acids Res. 36, W503-508, 2008. Определение Чотиа подобно определению Кабата, но в определении Чотиа учитывают положения некоторых областей структурных петель. См., например, Chothia et al., J. Mol. Biol., 196: 901-17, 1986; Chothia et al., Nature, 342: 877-83, 1989. В определении AbM используют разработанный Оксфордской группой молекулярных исследований (Oxford Molecular Group) встроенный пакет программ, который моделирует структуру антитела. См., например, Martin et al., Proc. Natl. Acad. Sci. USA, 86:9268-9272, 1989; AbM™, A Computer Program for Modeling Variable Regions of Antibodies, Oxford, UK; Oxford Molecular, Ltd. Определение AbM моделирует третичную структуру антитела на основании первичной последовательности с использованием известных баз данных и методов моделирования с самого начала, как описано, например, в работе Samudrala et al., Ab Initio Protein Structure Prediction Using a Combined Hierarchical Approach, в кн. PROTEINS, Structure, Function and Genetics Suppl., 3:194-198, 1999. Определение контактов основано на анализе доступных комплексных кристаллических структур. См., например, MacCallum et al., J. Mol.Biol., 5:732-45, 1996.
Термин «область Fc» используют для определения С-концевой области тяжелой цепи иммуноглобулина, которая может быть получена путем расщепления интактного антитела папаином. Область Fc может представлять собой нативную последовательность области Fc или вариант области Fc. Область Fc иммуноглобулина обычно содержит два константных домена, домен СН2 и домен СН3, и возможно содержит домен СН4. Участок Fc антитела опосредует несколько важных эффекторных функций, например индукцию цитокинов, антителозависимую клеточно-опосредованную цитотоксичность (ADCC; antibody-dependent cell-mediated cytotoxicity), фагоцитоз, комплементзависимую цитотоксичность (CDC; complement dependent cytotoxicity) и период полувыведения/клиренс антитела, и образование комплексов антиген-антитело (например, неонатальный FcR (FcRn) связывается с областью Fc IgG при кислом рН в эндосоме и защищает IgG от распада, что, таким образом, вносит вклад в длительный период полувыведения IgG из сыворотки крови). В данной области техники известны замены аминокислотных остатков в участке Fc для изменения эффекторной функции антитела (см., например, Winter et al., патент U.S. №5648260 и 5624821).
Антитела существуют в виде интактных иммуноглобулинов или в виде ряда хорошо охарактеризованных фрагментов. Такие фрагменты включают Fab фрагменты, Fab' фрагменты, Fab2, F(ab)'2 фрагменты, одноцепочечные Fv белки (scFv) и Fv белки, стабилизированные дисульфидными связями (dsFv), которые связываются с антигеном-мишенью. Белок scFv представляет собой гибридный белок, в котором вариабельная область легкой цепи иммуноглобулина и вариабельная область тяжелой цепи иммуноглобулина связаны линкером, тогда как в dsFv цепи мутированы со встраиванием дисульфидной связи для стабилизации ассоциации цепей. Хотя различные фрагменты антитела определяют как результат расщепления интактного антитела, специалисту в данной области техники понятно, что такие фрагменты можно синтезировать de novo либо химическим путем, либо с использованием методологии рекомбинантных ДНК. Таким образом, используемый в настоящем документе термин «антитело» включает в себя, например, моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), образованные по меньшей мере из двух интактных антител, человеческие антитела, гуманизированные антитела, верблюжьи антитела, химерные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, однодоменные антитела, доменные антитела, Fab фрагменты, F(ab')2 фрагменты, фрагменты антитела, проявляющие желаемую биологическую активность, связанные дисульфидными связями Fv (sdFv), интратела и эпитоп-связывающие фрагменты или антигенсвязывающие фрагменты любого из указанного выше.
В результате расщепления антител папаином образуется два идентичных антигенсвязывающих фрагмента, называемых «Fab» фрагментами, каждый из которых содержит один антигенсвязывающий сайт.«Fab фрагмент» содержит одну легкую цепь и СН1 и вариабельные области одной тяжелой цепи. Тяжелая цепь молекулы Fab не может образовать дисульфидную связь с другой молекулой тяжелой цепи. «Fab' фрагмент» содержит одну легкую цепь и участок тяжелой цепи, содержащий домен VH и домен СН1, а также область между доменами СН1 и СН2, так что между двумя тяжелыми цепями двух фрагментов Fab' может образоваться дисульфидная связь с образованием молекулы F(ab')2.
В результате обработки антитела пепсином образуется F(ab')2 фрагмент, в котором объединены два антигенсвязывающих сайта, и который сохраняет способность к сшиванию антигена. «F(ab')2 фрагмент» содержит две легких цепи и две тяжелых цепи, содержащих участок константной области между доменами СН1 и СН2, так что между двумя тяжелыми цепями образуется межцепочечная дисульфидная связь. F(ab')2 фрагмент, таким образом, состоит из двух Fab' фрагментов, которые удерживаются вместе дисульфидной связью между двумя тяжелыми цепями.
«Область Fv» содержит вариабельные области из обеих тяжелых и легких цепей, но не содержит константные области.
«Одноцепочечные антитела» представляют собой молекулы Fv, в которых вариабельные области тяжелой и легкой цепи соединены гибким линкером с образованием единой полипептидной цепи, образующей антигенсвязывающую область. Подробное обсуждение одноцепочечных антител представлено в публикации международной заявки на патент WO 88/01649, в патенте U.S. №4946778 и 5260203, описания которых включены посредством ссылки.
Используемые в настоящем документе термины «антигенсвязывающий фрагмент» и «антигенсвязывающий белок» означают любой белок, который связывает указанный антиген-мишень. «Антигенсвязывающий фрагмент» включает без ограничений антитела и их связывающие участки, такие как иммунологически функциональные фрагменты. Примером антигенсвязывающего фрагмента антитела является(ются) CDR тяжелой цепи и/или легкой цепи или вариабельная область тяжелой цепи и/или легкой цепи.
Используемый в настоящем документе термин «иммунологически функциональный фрагмент» (или просто «фрагмент») антитела или цепи иммуноглобулина (тяжелой или легкой цепи) антигенсвязывающего белка представляет собой вид антигенсвязывающего белка, содержащий участок (независимо от того, как получен или синтезирован этот участок) антитела, в котором отсутствуют некоторые из аминокислот, присутствующих в полноразмерной цепи, но при этом сохранивший способность к связыванию с антигеном. Биологическая активность таких фрагментов состоит в том, что они связываются с антигеном-мишенью и могут конкурировать за связывание с определенным эпитопом с другими антигенсвязывающими белками, включая интактные антитела. В некоторых воплощениях изобретения эти фрагменты являются нейтрализующими фрагментами. В одном аспекте в таком фрагменте сохранится по меньшей мере один CDR, присутствующий в полноразмерной легкой или тяжелой цепи, и в некоторых воплощениях он будет содержать одну тяжелую цепь и/или легкую цепь или их участок. Биологически активные фрагменты могут быть получены методами рекомбинантных ДНК или получены путем ферментативного или химического расщепления антигенсвязывающих белков, включая интактные антитела. Иммунологически функциональные фрагменты иммуноглобулина включают без ограничений Fab, диатело, Fab', F(ab')2, Fv, доменные антитела и одноцепочечные антитела и могут быть получены из любого источника млекопитающих, включая без ограничений человека, мышь, крысу, верблюда или кролика. Далее рассматривают, что функциональный участок описанных в настоящем документе антигенсвязывающих белков, например один или более CDR, может быть ковалентно связан со вторым белком или с молекулой небольшого размера для создания терапевтического агента, направленного на конкретную мишень в организме, обладающего бифункциональными терапевтическими свойствами или имеющего продленный период полувыведения из сыворотки крови.
Диатела представляют собой бивалентные антитела, содержащие две полипептидные цепи, где каждая полипептидная цепь содержит области VH и VL, соединенные линкером, который является слишком коротким для спаривания между двумя областями на одной и той же цепи, что, таким образом, допускает спаривание каждой области с комплементарной областью на другой полипептидной цепи (см., например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90:6444-48, 1993; и Poljak et al., Structure, 2:1121-23, 1994). Если две полипептидные цепи диатела идентичны, диатело, образованное в результате их спаривания, будет иметь два идентичных антигенсвязывающих сайта. Полипептидные цепи, имеющие различные последовательности, можно использовать для получения диатела с двумя различными антигенсвязывающими сайтами. Аналогичным образом тритела и тетратела представляют собой антитела, содержащие три и четыре полипептидных цепи соответственно и образующие три и четыре антигенсвязывающих сайта соответственно, которые могут быть одинаковыми или разными.
Биспецифичные антитела или фрагменты могут находиться в нескольких конфигурациях. Например, биспецифичные антитела могут напоминать одно антитело (или фрагменты антитела), но иметь два разных антигенсвязывающих сайта (вариабельные области). В различных воплощениях изобретения биспецифичные антитела могут быть получены химическими методами (Kranz et al., Proc. Natl. Acad. Sci. USA, 78:5807, 1981; «полигибридомными» методами (см., например, патент U.S. №4474893); или методами рекомбинантных ДНК. В различных воплощениях изобретения биспецифичные антитела по настоящему описанию могут обладать связывающими специфичностями по меньшей мере к двум различным эпитопам, по меньшей мере один из которых представляет собой опухолеспецифичный антиген. В различных воплощениях изобретения антитела и фрагменты могут также представлять собой гетероантитела. Гетероантитела представляют собой два или более слитых вместе антител или связывающих фрагментов антител (например, Fab), где каждое антитело или фрагмент обладает отличающейся специфичностью.
Используемый в настоящем документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу однородных антител, т.е. составляющие популяцию отдельные антитела идентичны за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минимальных количествах. Моноклональные антитела высокоспецифичны, поскольку направлены на один антиген. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают в себя различные антитела, направленные на различные детерминанты (эпитопы), каждое моноклональное антитело направлено на единственную детерминанту на антигене. Определение «моноклональное» не следует истолковывать как требующее получение антитела каким-либо конкретным способом.
Используемый в настоящем документе термин «химерное антитело» относится к антителу, имеющему каркасные остатки от одного биологического вида, например человека, a CDR (которые, как правило, обеспечивают связывание антигена) - от другого биологического вида, например, к мышиному антителу, специфично связывающему антиген-мишень.
Используемый в настоящем документе термин «человеческое антитело» подразумевает включение антител, имеющих вариабельные и константные области, полученные из последовательностей иммуноглобулинов человека зародышевого типа. Человеческие антитела по описанию могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов человека зародышевого типа (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или в результате соматической мутации in vivo), например, в CDR и, в частности, в CDR3. Однако используемый в настоящем документе термин «человеческое антитело» не подразумевает включение в него антител, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающих, например мыши, привиты на каркасные последовательности человека.
Используемый в настоящем документе термин «гуманизированное антитело» относится к антителу, содержащему иммуноглобулин с гуманизированной легкой цепью и гуманизированной тяжелой цепью. Гуманизированное антитело связывается с тем же антигеном, что и антитело-донор, обеспечивающее CDR. Акцепторный каркас гуманизированного иммуноглобулина или антитела может иметь ограниченное количество замен аминокислотами, взятыми из каркасной области антитела-донора. Гуманизированные или другие моноклональные антитела могут иметь дополнительные консервативные замены аминокислот, по существу не оказывающие влияния на антигенсвязывающие или другие функции иммуноглобулина. В различных воплощениях изобретения каркасные области выбраны из последовательностей экзонов XH, JH, Vκ и Jκ зародышевой линии человека. Например, акцепторные последовательности для гуманизации FR домена VH могут быть выбраны из экзонов VH 1-18 (Matsuda et al., Nature Genetics 3:88-94, 1993) или VH 1-2 (Shin et al., EMBO J. 10:3641-3645, 1991) природной VH, а для шарнирной области (JH) - экзона JH-6 (Mattila et al., Eur. J. Immunol. 25:2578-2582, 1995). В других примерах в качестве акцепторных последовательностей для гуманизации домена VL могут быть выбраны экзон В3 Vκ зародышевого типа (Сох et al., Eur. J. Immunol. 24:827-836, 1994) и Jκ экзон Jκ-1 (Hieter et al, J. Biol. Chem. 257:1516-1522, 1982).
Используемый в настоящем документе термин «рекомбинантное человеческое антитело» подразумевает включение всех человеческих антител, полученных, экспрессированных, созданных или выделенных рекомбинантными методами, например антител, экспрессированных с использованием рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина; антител, выделенных из рекомбинантной комбинаторной библиотеки человеческих антител; антител, выделенных у животного (например, мыши), трансгенного по генам иммуноглобулинов человека; либо антител, полученных, экспрессированных, созданных или выделенных любыми другими способами, в которые вовлечен сплайсинг последовательностей генов иммуноглобулинов человека с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области, полученные из последовательностей иммуноглобулинов человека зародышевого типа. Тем не менее, в различных воплощениях изобретения такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или соматическому мутагенезу in vivo в случае использования трансгенных животных по последовательностям Ig человека), и поэтому аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и получены из последовательностей VH и VL человека зародышевого типа и родственны им, могут отсутствовать в природном репертуаре антител человека зародышевого типа in vivo. Все такие рекомбинантные методы хорошо известны обычным специалистам в данной области техники.
Используемый в настоящем документе термин «эпитоп» включает любую белковую детерминанту, способную к специфичному связыванию с иммуноглобулином или Т-клеточным рецептором, либо взаимодействовать с этой молекулой иным путем. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок из таких молекул, как боковые цепи аминокислот, либо углеводов, либо Сахаров, и, как правило, обладают особыми характеристиками трехмерной структуры, а также особыми характеристиками заряда. Эпитоп может быть «линейным» или «конформационным». В линейном эпитопе все точки взаимодействия между белком и молекулой, с которой он взаимодействует (такой как антитело), расположены линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе точки взаимодействия встречаются на отделенных друг от друга аминокислотных остатках белка. Как только определен желаемый эпитоп на антигене, к этому эпитому можно создать антитела, например, используя описанные в настоящем документе методы. Альтернативно создание и определение характеристик антител в процессе разработки может прояснить информацию о желаемых эпитопах. Затем на основании этой информации можно проводить конкурентный скрининг антител на связывание с одним и тем же эпитопом. Подход к достижению этой цели состоит в проведении перекрестных конкурентных исследований по поиску антител, которые конкурентно связываются друг с другом, например, антител, конкурирующих за связывание с антигеном.
Антигенсвязывающий белок, включая антитело, «специфично связывается» с антигеном, если он связывается с этим антигеном с высокой аффинностью связывания, которую определяют на основании значения константы диссоциации (KD или соответствующей константы связывания (Kb), как определено ниже) по меньшей мере 1×10-6 М, либо по меньшей мере 1×10-7 М, либо по меньшей мере 1×10-8 М, либо по меньшей мере 1×10-9 М, либо по меньшей мере 1×10-10 М, либо по меньшей мере 1×10-11 М. Антигенсвязывающий белок, который специфично связывается с представляющим интерес антигеном человека, может также обладать способностью к связыванию того же представляющего интерес антигена другого биологического вида с одинаковой или разной аффинностью. Используемый в настоящем документе термин «LD» относится к равновесной константе диссоциации конкретного взаимодействия антиген-антитело.
Используемый в настоящем документе термин «поверхностный плазмонный резонанс» относится к оптическому явлению, позволяющему проводить анализ биоспецифичных взаимодействий в режиме реального времени путем определения изменений концентрации белка в биосенсорной матрице, например, используя систему BIACORE™ (Pharmacia Biosensor АВ, Uppsala, Sweden и Piscataway, N.J.). Дополнительные описания см. в работах Jonsson U. et al., Ann. Biol. Clin., 51:19-26, 1993; Jonsson U. et al., Biotechniques, 11:620-627, 1991; Jonsson B. et al., J. Mol. Recognit, 8:125-131, 1995; и Johnsson B. et al., Anal. Biochem, 198:268-277, 1991.
Используемый в настоящем документе термин «иммуногенность» относится к способности антитела или антигенсвязывающего фрагмента вызывать иммунный ответ (гуморальный или клеточный) при введении реципиенту и включает, например, ответ человеческого антимышиного антитела (НАМА; human anti-mouse antibody). Инициация ответа НАМА происходит при иммунном ответе Т-клеток субъекта на введенное антитело. Затем Т-клетки рекрутируют В-клетки, которые вырабатывают специфичные антитела к антителу.
Используемый в настоящем документе термин «иммунная клетка» означает любую клетку гемопоэтической линии, вовлеченную в регуляцию иммунного ответа на антиген (например, на аутоантиген). В различных воплощениях изобретения иммунная клетка представляет собой, например, Т-клетку, В-клетку, дендритную клетку, моноцит, естественный киллер, макрофаг, клетки Лангерганса или клетки Купфера.
Термины «полипептид», «пептид» и «белок» в настоящем документе используют взаимозаменяемо и относят к полимеру из аминокислотных остатков. В различных воплощениях изобретения «пептиды», «полипептиды» и «белки» представляют собой цепи аминокислот, в которых альфа-атомы углерода связаны посредством пептидных связей. Таким образом, концевая аминокислота на одном конце цепи (амино-конце) имеет свободную аминогруппу, а концевая аминокислота на другом конце цепи (карбокси-конце) имеет свободную карбоксильную группу. Используемый в настоящем документе термин «амино-конец» (сокращенно N-конец) относится к свободной α-аминогруппе на аминокислоте на амино-конце пептида или к а-аминогруппе (иминогруппе при участии в пептидной связи) аминокислоты в любом другом положении внутри пептида. Аналогичным образом термин «карбокси-конец» относится к свободной карбоксильной группе на карбокси-конце пептида или к карбоксильной группе аминокислоты в любом другом положении внутри пептида. Пептиды также включают по существу любую полиаминокислоту, включая без ограничений миметики пептидов, например аминокислоты, соединенные эфирной, а не амидной связью.
Используемый в настоящем документе термин «рекомбинантный полипептид» подразумевает включение всех полипептидов, включая гибридные молекулы, которые получают, экспрессируют, создают, образуют или выделяют рекомбинантными методами, например, полипептидов, экспрессируемых с рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина.
Полипептиды по описанию включают полипептиды, которые были модифицированы любым путем и по любой причине, например, для: (1) снижения чувствительности к протеолизу, (2) снижения чувствительности к окислению, (3) изменения аффинности связывания для образования белковых комплексов, (4) изменения значений аффинности связывания, и (5) придания или модификации других физико-химических или функциональных свойств. Например, в природной последовательности (например, в участке полипептида снаружи от домена(ов), образующего(их) межмолекулярные контакты) можно выполнить единственную или множественные замены аминокислот (например, консервативные замены аминокислот). «Консервативная замена аминокислоты» относится к замене аминокислоты в полипептиде функционально подобной аминокислотой. Каждая из следующих шести групп содержит аминокислоты, являющиеся консервативными заменами друг для друга:
аланин (А), серии (S) и треонин (Т)
аспарагиновая кислота (D) и глутаминовая кислота (Е)
аспарагин (N) и глутамин (Q)
аргинин (R) и лизин (K)
изолейцин (I), лейцин (L), метионин (М)и валин (V)
фенилаланин (F), тирозин (Y) и триптофан (W)
«Неконсервативная замена аминокислоты» относится к замене представителя одного из этих классов представителем другого класса. При выполнении таких замен в соответствии с различными воплощениями изобретения можно учитывать гидропатический индекс аминокислот. Каждой аминокислоте на основании ее характеристик гидрофобности и заряда присвоен гидропатический индекс. Они составляют: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серии (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9); и аргинин (-4,5).
В данной области техники понятна важность гидропатического индекса аминокислоты при придании интерактивной биологической функции белку (см., например, Kyte et al., 1982, J. Mol. Biol. 157:105-131). Известно, что некоторые аминокислоты могут быть замещены другими аминокислотами, имеющими подобный гидропатический индекс или балл и сохраняющими подобную биологическую активность. При выполнении замен на основании гидропатического индекса в различных воплощениях изобретения включают замену аминокислот, гидропатические индексы которых находятся в пределах плюс/минус 2. В различных воплощениях изобретения включены индексы в пределах плюс/минус 1, ив различных воплощениях изобретения - в пределах плюс/минус 0,5.
В данной области техники также понятно, что замена подобных аминокислот может быть эффективно выполнена на основании гидрофильности, в частности, если биологически функциональный белок или пептид, созданный таким путем, предназначен для применения в иммунологических воплощениях изобретения, как описано в настоящем документе. В различных воплощениях изобретения наибольшая локальная средняя гидрофильность белка, которая определяется гидрофильностью его смежных аминокислот, коррелирует с его иммуногенностью и антигенностью, т.е. с биологическим свойством белка.
Этим аминокислотным остаткам присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0+-0,1); глутамат (+3,0+-0,1); серии (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5+-0,1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5) и триптофан (-3,4). При выполнении замен на основании подобных значений гидрофильности в различных воплощениях изобретения включают замену аминокислот, значения гидрофильности которых находятся в пределах плюс/минус 2, в различных воплощениях значения в пределах плюс/минус 1 и в различных воплощениях значения плюс/минус 0,5. Примеры аминокислотных замен приведены в таблице 1.

Используемый в настоящем документе термин «полипептидный фрагмент» и «укороченный полипептид» относится к полипептиду, имеющему амино-концевую и/или карбокси-концевую делецию по сравнению с соответствующим полноразмерным белком. В различных воплощениях изобретения фрагменты могут составлять, например, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 100, по меньшей мере 150, по меньшей мере 200, по меньшей мере 250, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 500, по меньшей мере 600, по меньшей мере 700, по меньшей мере 800, по меньшей мере 900 или по меньшей мере 1000 аминокислот в длину. В различных воплощениях изобретения фрагменты могут также составлять, например, максимум 1000, максимум 900, максимум 800, максимум 700, максимум 600, максимум 500, максимум 450, максимум 400, максимум 350, максимум 300, максимум 250, максимум 200, максимум 150, максимум 100, максимум 50, максимум 25, максимум 10 или максимум 5 аминокислот в длину. Фрагмент может дополнительно содержать на любом или на обоих концах одну или более дополнительных аминокислот, например последовательность аминокислот из другого встречающегося в природе белка (например, Fc или домен лейциновой «застежки-молнии») или искусственную аминокислотную последовательность (например, искусственную линкерную последовательность).
Используемые в настоящем документе термины «вариант полипептида» или «мутант полипептида» относятся к полипептиду, содержащему аминокислотную последовательность, в которую встроены, из которой делетированы и/или в которой заменены один или более аминокислотных остатков относительно другой полипептидной последовательности. В различных воплощениях изобретения количество встроенных, делетированных или замещенных аминокислотных остатков может составлять, например, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450 или по меньшей мере 500 аминокислот в длину. Варианты по настоящему описанию включают гибридные белки.
«Производное» полипептида представляет собой полипептид, который был модифицирован химическим путем, например, путем конъюгации с другой химической группировкой, такой как, например, полиэтиленгликоль, альбумин (например, человеческий сывороточный альбумин), фосфорилирования и гликозилирования.
Термин «% идентичности последовательности» в настоящем документе используют взаимозаменяемо с термином «% идентичности» и относят к уровню идентичности аминокислотной последовательности между двумя или более пептидными последовательностями или к уровню идентичности нуклеотидной последовательности между двумя или более нуклеотидными последовательностями при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80%-ная идентичность означает то же, что и 80%-ная идентичность последовательности, определенная с помощью конкретного алгоритма, и означает, что данная последовательность по меньшей мере на 80% идентична другой длине другой последовательности. В различных воплощениях изобретения % идентичности выбран из, например, по меньшей мере 60%-ной, по меньшей мере 65%-ной, по меньшей мере 70%-ной, по меньшей мере 75%-ной, по меньшей мере 80%-ной, по меньшей мере 85%-ной, по меньшей мере 90%-ной, по меньшей мере 95%-ной или по меньшей мере 99%о-ной или более идентичности последовательности с данной последовательностью. В различных воплощениях изобретения % идентичности находится в диапазоне, например, от примерно 60% до примерно 70%, от примерно 70% до примерно 80%о, от примерно 80%>до примерно 85%, от примерно 85% до примерно 90%, от примерно 90%) до примерно 95% или от примерно 95%) до примерно 99%.
Термин «% гомологии последовательности» в настоящем документе используют взаимозаменяемо с термином «% гомологии» и относят к уровню гомологии аминокислотной последовательности между двумя или более пептидными последовательностями или к уровню гомологии нуклеотидной последовательности между двумя или более нуклеотидными последовательностями при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80%-ная гомология означает то же, что и 80%-ная гомология последовательности, определенная с помощью конкретного алгоритма, и соответственно гомолог данной последовательности обладает по меньшей мере 80%о-ной гомологией последовательности по всей длине данной последовательности. В различных воплощениях изобретения % гомологии выбран из, например, по меньшей мере 60%-ной, по меньшей мере 65%-ной, по меньшей мере 70%-ной, по меньшей мере 75%-ной, по меньшей мере 80%-ной, по меньшей мере 85%-ной, по меньшей мере 90%-ной, по меньшей мере 95%-ной или по меньшей мере 99%-ной или более гомологии последовательности с данной последовательностью. В различных воплощениях изобретения % гомологии находится в диапазоне, например, от примерно 60% до примерно 70%, от примерно 70% до примерно 80%, от примерно 80% до примерно 85%, от примерно 85%о до примерно 90%, от примерно 90% до примерно 95% или от примерно 95% до примерно 99%.
Примеры компьютерных программ, которые можно использовать для определения идентичности между двумя последовательностями, включают без ограничений пакет программ BLAST, например BLASTN, BLASTX и TBLASTX, BLASTP и TBLASTN, общедоступные в Интернете на вебсайте NCBI. См. также Altschul et al., J. Mol. Biol. 215:403-10, 1990 (со специальной ссылкой на опубликованные настройки по умолчанию, т.е. параметры w=4, t=17) и Altschul et al., Nucleic Acids Res., 25:3389-3402, 1997. При оценке данной аминокислотной последовательности относительно аминокислотных последовательностей в банке белковых последовательностей GenBank и других общедоступных базах данных поиск последовательностей обычно проводят с помощью программы BLASTP. Программа BLASTX предпочтительна для поиска последовательностей нуклеиновых кислот, транслированных во всех рамках считывания, по сравнению с аминокислотными последовательностями в банке белковых последовательностей GenBank и других общедоступных базах данных. Прогон как BLASTP, так и BLASTX выполняют, используя параметры по умолчанию: штраф на открытие гэпа 11,0 и штраф на продление гэпа 1,0, и используют матрицу BLOSUM-62. См. Id.
В дополнение к вычислению процента идентичности последовательности алгоритм BLAST также выполняет статистический анализ подобия между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA, 90:5873-5787, 1993). Одной из мер подобия, предоставляемых алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), обеспечивающая показатель вероятности того, что совпадение между двумя нуклеотидными или аминокислотными последовательностями является случайным событием. Например, нуклеиновую кислоту считают подобной эталонной последовательности, если наименьшая суммарная вероятность в сравнении исследуемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет, например, менее чем примерно 0,1, менее чем примерно 0,01 или менее чем примерно 0,001.
Термины «существенное подобие» или «по существу подобный» в контексте полипептидных последовательностей указывают на то, что область полипептида имеет последовательность с по меньшей мере 70%, в характерном случае по меньшей мере 80%, в более характерном случае по меньшей мере 85%), или по меньшей мере 90%, или по меньшей мере 95% подобием последовательности с эталонной последовательностью. Например, полипептид по существу подобен второму полипептиду, например, если два пептида различаются одной или более чем одной консервативной заменой.
«Полинуклеотид» относится к полимеру, состоящему из нуклеотидных звеньев. Полинуклеотиды включают как встречающиеся в природе нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота («ДНК») и рибонуклеиновая кислота («РНК»), так и аналоги нуклеиновых кислот. Аналоги нуклеиновых кислот включают аналоги, включающие в себя неприродные основания; нуклеотиды, участвующие в связях с другими нуклеотидами, отличающихся от природной фосфодиэфирной связи; или включающие в себя основания, присоединенные посредством связей, отличающихся от фосфодиэфирных связей. Таким образом, аналоги нуклеотидов включают в качестве неограничивающих примеров фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-О-метилрибонуклеотиды, пептидные нуклеиновые кислоты (ПНК) и т.п. Такие полинуклеотиды можно синтезировать, например, с помощью автоматического синтезатора ДНК. Термин «нуклеиновая кислота» в характерном случае относится к полинуклеотидам большого размера. Термин «олигонуклеотид» в характерном случае относится к коротким полинуклеотидам, как правило, не более 50 нуклеотидов. Должно быть понятно, что, если нуклеотидная последовательность представлена последовательностью ДНК (т.е. А, Т, G, С), она также включает в себя последовательность РНК (т.е. A, U, G, С), в которой урацил (U) заменяет тимин (Т).
В настоящем документе для описания полинуклеотидных последовательностей используют общепринятое обозначение: левый конец однонитевой полинуклеотидной последовательности представляет собой 5'-конец; направление двунитевой полинуклеотидной последовательности влево называют 5'-направлением. Направление присоединения нуклеотидов от 5' к 3'-конца образующихся транскриптов РНК называют направлением транскрипции. Нить ДНК, имеющая ту же последовательность, что и мРНК, называют «кодирующей нитью»; последовательности на нити ДНК, имеющие ту же последовательность, что и мРНК, транскрибируемая с этой ДНК, и имеющие 5'-локализацию по отношению к 5'-концу транскрипта РНК, называют «апстрим последовательностями»; последовательности на нити ДНК, имеющие ту же последовательность, что и РНК, и имеющие 3'-локализацию по отношению к 3'-концу кодирующего транскрипта РНК, называют «даунстрим последовательностями».
«Комплементарный» относится к топологической совместимости или совпадению при совмещении взаимодействующих поверхностей двух полинуклеотидов. Таким образом, эти две молекулы могут быть описаны как комплементарные, и кроме того, охарактеризовать контактирующие поверхности как комплементарные друг другу. Первый полинуклеотид комплементарен второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида по существу идентична нуклеотидной последовательности полинуклеотида, являющегося партнером связывания второго полинуклеотида, или если первый полинуклеотид может гибридизоваться со вторым полинуклеотидом в жестких условиях гибридизации.
«Специфично гибридизующийся с», либо «специфичная гибридизация», либо «селективно гибридизуется с» относятся к связыванию, образованию дуплекса или гибридизации молекулы нуклеиновой кислоты преимущественно с конкретной нуклеотидной последовательностью в жестких условиях гибридизации при наличии этой последовательности в сложной смеси, например, суммарной клеточной ДНК или РНК. Термин «жесткие условия» относится к условиям, в которых зонд будет преимущественно гибридизоваться с его последовательностью-мишенью и в меньшей степени или совсем не гибридизоваться с другими последовательностями. «Жесткие условия гибридизации» или «жесткие условия отмывки после гибридизации» в контексте экспериментов по гибридизации нуклеиновых кислот, таких как Саузерн- и Нозерн-гибридизация, зависят от последовательности и различаются для различных параметров окружающей среды. Обширное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen, 1993, Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, part I, chapter 2, Overview of principles of hybridization and the strategy of nucleic acid probe assays, Elsevier, N.Y.; Sambrook et al., 2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 3.sup.rd ed., NY; и Ausubel et al., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY.
В целом условия гибридизации и отмывки высокой жесткости выбраны так, чтобы температура была приблизительно на 5°С ниже температурной точки плавления (Tm) для конкретной последовательности в определенных условиях ионной силы и рН. Tm представляет собой температуру (при определенной ионной силе и рН), при которой 50% последовательности-мишени гибридизуется с точно совпадающим зондом. Условия очень высокой жесткости выбраны так, чтобы температура была равна Tm для конкретного зонда. Например, жесткие условия гибридизации для гибридизации комплементарных нуклеиновых кислот, имеющих более чем примерно 100 комплементарных остатков, на фильтре в методе Саузерн- или Нозерн-гибридизации представляют собой 50% формалина с 1 мг гепарина при 42°С, при этом гибридизацию проводят в течение ночи. Примером условий отмывки высокой жесткости является отмывка раствором 0,15 моль/л NaCl при 72°С в течение примерно 15 минут. Примером условий жесткой отмывки является отмывка 0,2-кратным буфером SSC при 65°С в течение 15 минут. Описание буфера SSC см. в Sambrook et al. Чтобы удалить фоновый сигнал от зонда, отмывке высокой жесткости может предшествовать отмывка низкой жесткости. Примером отмывки средней жесткости для дуплекса длиной, например, более чем примерно 100 нуклеотидов, является отмывка 1-кратным буфером SSC при 45°С в течение 15 минут. Примером отмывки низкой жесткости для дуплекса длиной, например, более чем примерно 100 нуклеотидов, является отмывка 4-6-кратным буфером SSC при 40°С в течение 15 минут. Как правило, отношение сигнала к шуму, равное 2 или выше, наблюдаемое для неродственного зонда в конкретном анализе гибридизации, указывает на обнаружение специфичной гибридизации.
«Праймер» относится к полинуклеотиду, способному к специфичной гибридизации с предназначенной для нее полинуклеотидной матрицей и обеспечивающему точку инициации синтеза комплементарного полинуклеотида. Такой синтез осуществляется при помещении полинуклеотидного праймера в условия, при которых происходит индукция синтеза, т.е. в присутствии нуклеотидов, комплементарной полинуклеотидной матрицы и агента для полимеризации, такого как ДНК-полимераза. Праймер в характерном случае является однонитевым, но может быть и двунитевым. В характерном случае праймеры представляют собой дезоксирибонуклеиновые кислоты, но для многих областей применения используют широкий ряд синтетических и природных праймеров. Праймер комплементарен матрице, для гибридизации с которой он предназначен, и служит в качестве сайта инициации синтеза, но необязательно отражает точную последовательность матрицы. В таком случае специфичная гибридизация праймера с матрицей зависит от жесткости условий гибридизации. Праймеры могут быть меченными, например, хромогенными, радиоактивными или флуоресцентными группировками и использоваться в качестве обнаружимых группировок.
«Зонд» при использовании по отношению к полинуклеотиду относится к полинуклеотиду, способному к специфичной гибридизации с предназначенной для нее последовательностью другого полинуклеотида. Зонд специфично гибридизуется с комплементарным полинуклеотидом-мишенью, но необязательно отражает точную комплементарную последовательность матрицы. В таком случае специфичная гибридизация зонда с мишенью зависит от жесткости условий гибридизации. Зонды могут быть меченными, например, хромогенными, радиоактивными или флуоресцентными группировками и использоваться в качестве обнаружимых группировок. В тех случаях, когда зонд обеспечивает точку инициации синтеза комплементарного полинуклеотида, этот зонд также может быть праймером.
«Вектор» представляет собой полинуклеотид, который используют для введения в клетку другой, связанной с ним нуклеиновой кислоты. Одним из типов вектора является «плазмида», которая относится к линейной или кольцевой двунитевой молекуле ДНК, в которой можно лигировать дополнительные нуклеиново-кислотные сегменты. Другим типом вектора является вирусный вектор (например, ретровирусы, аденовирусы и аденоассоциированные вирусы с нарушенной репликацией), в вирусный геном которых могут быть введены дополнительные сегменты ДНК. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, содержащие точку начала репликации в бактериях, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) после их введения в клетку-хозяина интегрируют в геном клетки-хозяина и, следовательно, реплицируются вместе с геномом клетки-хозяина. «Экспрессионный вектор» представляет собой тип вектора, который может направлять экспрессию выбранного полинуклеотида.
«Регуляторная последовательность» представляет собой нуклеиновую кислоту, которая влияет на экспрессию (например, уровень, временные рамки или локализацию экспрессии) нуклеиновой кислоты, с которой она функционально связана. Регуляторная последовательность может осуществлять свои действия, например, непосредственно на регулируемую нуклеиновую кислоту, или посредством действия одной или более других молекул (например, полипептидов, связывающихся с регуляторной последовательностью и/или с нуклеиновой кислотой). Примеры регуляторных последовательностей включают промоторы, энхансеры и другие контрольные элементы экспрессии (например, сигналы полиаденилирования). Дополнительные примеры регуляторных последовательностей описаны, например, в Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif, и Baron et al., 1995, Nucleic Acids Res. 23:3605-06. Нуклеотидная последовательность «функционально связана» с регуляторной последовательностью, если регуляторная последовательность влияет на экспрессию (например, на уровень, временные рамки или локализацию экспрессии) нуклеотидной последовательности.
«Клетка-хозяин» представляет собой клетку, которую можно использовать для экспрессии полинуклеотида по описанию. Клетка-хозяин может представлять собой прокариотическую клетку, например Е. coli, или эукариотическую клетку, например одноклеточный эукариот (например, дрожжи или другой гриб), клетку растения (например, клетку растения табака или томата), клетку животного (например, клетку человека, клетку обезьяны, клетку хомяка, клетку крысы, клетку мыши или клетку насекомого) или гибридому. В характерном случае клетка-хозяин представляет собой культивируемую клетку, которую можно трансформировать или трансфицировать кодирующей полипептид нуклеиновой кислотой, которая может впоследствии экспрессироваться в клетке-хозяине. Выражение «рекомбинантная клетка-хозяин» может быть использовано для обозначения клетки-хозяина, трансформированной или трансфицированной экспрессируемой нуклеиновой кислотой. Клетка-хозяин может также представлять собой клетку, которая содержит нуклеиновую кислоту, но не экспрессирует ее на желаемом уровне, если в эту клетку-хозяина не введена регуляторная последовательность таким образом, чтобы она стала функционально связанной с нуклеиновой кислотой. Понятно, что термин «клетка-хозяин» относится не только к конкретной клетке, являющейся предметом изобретения, но и к потомству или потенциальному потомству такой клетки. В связи с тем, что в последующих поколениях могут происходить некоторые модификации вследствие, например, мутации или влияния окружающей среды, такое потомство фактически может быть неидентичным родительской клетке, но тем не менее включено в объем используемого в настоящем документе термина.
Термин «выделенная молекула» (где молекула представляет собой, например, полипептид или полинуклеотид) представляет собой молекулу, которая в силу своего происхождения или источника получения (1) не связана с сопутствующими ей в природе компонентами, которые сопровождают ее в естественном состоянии, (2) по существу не содержит других молекул того же биологического вида, (3) экспрессируется клеткой от другого биологического вида или (4) не встречается в природе. Таким образом, молекула, синтезированная химическим путем или экспрессированная в клеточной системе, отличающейся от клетки, от которой она имеет естественное происхождение, будет «выделена» от природ но связанных с ней компонентов. Молекула также может быть по существу освобождена от природно связанных с ней компонентов путем ее выделения с помощью хорошо известных в данной области техники методов очистки. Чистоту или однородность молекулы можно определить количественно с помощью многочисленных известных в данной области техники способов. Например, чистоту образца полипептида можно определить количественно с помощью электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида известными в данной области техники способами. Для некоторых целей высокое разрешение можно обеспечить, используя высокоэффективную жидкостную хроматографию (ВЭЖХ) или другие известные в данной области техники способы очистки.
Белок или полипептид является «по существу чистым», «по существу однородным» или «по существу очищенным», если по меньшей мере в примерно 60%-75% образца выявлен один вид полипептида. Полипептид или белок может быть мономерным или мультимерным. По существу чистый полипептид или белок в характерном случае будет составлять примерно 50%, 60%, 70%, 80% или 90% масс/масс, образца белка, чаще всего примерно 95%, и предпочтительно будет иметь чистоту более 99%. Чистота или однородность белка может быть показана несколькими способами, хорошо известными в данной области техники, такими как электрофорез образца белка в полиакриламидном геле с последующей визуализацией единственной полосы полипептида после окрашивания геля красителем, хорошо известным в данной области техники. Для некоторых целей высокое разрешение можно обеспечить, используя высокоэффективную жидкостную хроматографию (ВЭЖХ) или другие известные в данной области техники способы очистки.
«Линкер» относится к молекуле, соединяющей две другие молекулы либо ковалентными, либо ионными, ван-дер-Ваальсовыми или водородными связями, например к молекуле нуклеиновой кислоты, которая гибридизуется с одной комплементарной последовательностью на 5' конце и с другой комплементарной последовательностью на 3' конце, соединяя таким образом две комплементарные последовательности. «Расщепляемый линкер» относится к линкеру, который может распадаться или претерпевать разрыв иным путем с разделением двух компонентов, соединенных этим расщепляемым линкером. Расщепляемые линкеры, как правило, расщепляются ферментами, в характерном случае пептидазами, протеазами, нуклеазами, липазами и т.п.Расщепляемые линкеры могут также расщепляться под действием ключевых факторов окружающей среды, таких как, например, изменения температуры, рН, концентрация солей и т.д.
Используемые в настоящем документе термины «метка» или «меченый» относятся к включению в антитело другой молекулы. В одном воплощении изобретения метка представляет собой обнаружимый маркер, например включение радиоактивно меченой аминокислоты или присоединение к полипептиду биотинилированных группировок, которые могут быть обнаружены меченым авидином (например, стрептавидином, содержащим флуоресцентный маркер или ферментативную активность, которые можно обнаружить оптическими или калориметрическими методами). В другом воплощении изобретения метка или маркер могут быть терапевтическими, например, представлять собой конъюгат с лекарственным средством или токсином. В данной области техники известны и могут быть использованы различные методы мечения полипептидов и гликопротеинов. Примеры меток для полипептидов включают без ограничений следующие: радиоизотопы или радионуклиды (например, 3Н, 14С, 15N, 35S, 90Y, 99Тс, 111In, 125I, 131I), флуоресцентные метки (например, флуоресцеинизотиоцианат (ФИТЦ), родамин, лантанидфосфаты), ферментативные метки (например, пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные маркеры, биотинильные группы, предопределенные пептидные эпитопы, распознаваемые вторичным репортером (например, спаренные последовательности посредством «лейциновой застежки-молнии», сайты связывания вторичных антител, металл связывающие домены, эпитопные метки), магнитные агенты, такие как гадолиниевые хелаты, токсины, такие как коклюшный токсин, таксол, цитохалазин В, грамицидин D, этидиумбромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацина дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги и гомологи. В некоторых воплощениях изобретения метки присоединяют с помощью спейсерных групп различной длины, чтобы уменьшить стерическое препятствие.
Используемый в настоящем документе термин «иммунотерапия» относится к видам противоопухолевого лечения, включающим без ограничений лечение с применением истощающих антител к специфичным опухолевым антигенам; лечение с применением конъюгатов антитела с лекарственным средством; лечение с применением агонистических, антагонистических или блокирующих антител к костимуляторным или коингибиторным молекулам (контрольным точкам иммунитета), таким как PD-1, PD-L1, ОХ-40, CD137, GITR, LAG3, ТГМ-3 и VISTA; лечение с применением биспецифичных привлекающих Т-клетки антител (BiTE®), таких как блинатумомаб: этот вид лечения включает введение модификаторов биологического ответа, таких как IL-2, IL-12, IL-15, IL-21, GM-CSF, IFN-α, IFN-β и IFN-γ; лечение с применением терапевтических вакцин, таких как сипулейцел-Т; лечение с применением дендритно-клеточных вакцин или пептидных вакцин к опухолевому антигену; лечение с применением Т-клеток с химерными антигенными рецепторами (CAR; chimeric antigen receptor); лечение с применением естественных киллеров с химерными антигенными рецепторами (CAR-NK); лечение с применением инфильтрирующих опухоль лимфоцитов (TIL); лечение с применением адоптивного переноса противоопухолевых Т-клеток (размноженных ex vivo и/или трансгенных по Т-клеточному рецептору (TCR)); лечение с применением клеток TALL-104; и лечение с применением иммуностимулирующих агентов, таких как агонисты toll-подобного рецептора (TLR) CpG и имиквимод.
Используемый в настоящем документе термин «иммуноконъюгат» или «слитый белок» относится к молекуле, содержащей антитело или его антигенсвязывающий фрагмент, непосредственно или опосредованно конъюгированные (или слитые) с эффекторной молекулой. Эффекторная молекула может представлять собой обнаружимую метку, иммунотоксин, цитокин, хемокин, терапевтический агент или химиотерапевтический агент. Антитело или его антигенсвязывающий фрагмент могут быть конъюгированы с эффекторной молекулой посредством пептидного линкера. Иммуноконъюгат и/или слитый белок сохраняет иммунореактивность антитела или антигенсвязывающего фрагмента, например, антитело или антигенсвязывающий фрагмент обладают приблизительно такой же или незначительно сниженной способностью к связыванию антигена после конъюгации, как и до конъюгации. При использовании в настоящем документе иммуноконъюгат может также называться конъюгатом антитело -лекарственное средство (АЛС). Поскольку иммуноконъюгаты и/или слитые белки исходно получают из двух молекул с различными функциональными группами, таких как антитело и эффекторная молекула, их иногда также называют «химерными молекулами».
«Фармацевтическая композиция» относится к композиции, пригодной для фармацевтического применения у животного. Фармацевтическая композиция содержит фармацевтически эффективное количество активного агента и фармацевтически приемлемый носитель. «Фармаццевтически эффективное количество» относится к такому количеству агента, которое эффективно для получения предусмотренного фармакологического результата. «Фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, сред растворения, буферов и эксципиентов, таких как фосфатно-солевой буферный раствор, 5%-ый водный раствор декстрозы и эмульсии, такие как эмульсия масло/вода или вода/масло, и различных типов увлажняющих агентов и/или адъювантов. Подходящие фармацевтические носители и лекарственные формы описаны в Remington's Pharmaceutical Sciences, 21st Ed. 2005, Mack Publishing Co, Easton. «Фармацевтически приемлемая соль» представляет собой соль, которую можно включать в соединение для фармацевтического применения, включающая, например, соли металлов (натрия, калия, магния, кальция и т.д.) и соли аммония или органических аминов.
Термины «лечить», «осуществление лечения» и «лечение» относятся к способу облегчения или устранения биологического расстройства и/или по меньшей мере одного из сопровождающих его симптомов. При использовании в настоящем документе «облегчение» заболевания, расстройства или состояния означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. При использовании в настоящем документе «лечение» представляет собой подход к получению благоприятных или желательных клинических результатов. Для целей настоящего изобретения полезные или желаемые клинические результаты включают без ограничений любое одно или более из: облегчения одного или более симптомов, уменьшения степени заболевания, предотвращения или отсрочки распространения (например, метастазов, например метастазов в легкое или лимфатический узел) заболевания, предотвращения или задержки рецидива заболевания, задержки или замедления прогрессирования заболевания, ослабления болезненного состояния и ремиссии (частичной или полной). Термин «лечение» также охватывает уменьшение патологических последствий пролиферативного заболевания. В способах по изобретению рассмотрен один или более из этих аспектов лечения.
Используемый в настоящем документе термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству соединения или композиции, достаточному для лечения указанного расстройства, состояния или заболевания, например его улучшения, облегчения, уменьшения и/или отсрочки появления одного или более симптомов. В отношении неходжкинской лимфомы (NHL; non-Hodgkin's lymphoma) и других видов злокачественных опухолей или иной нежелательной пролиферации клеток термин «эффективное количество» включает в себя количество, достаточное для: (1) уменьшения количества злокачественных клеток; (2) уменьшения размера опухоли; (3) ингибирования, задержки, замедления до некоторой степени и предпочтительно прекращения инфильтрации злокачественных клеток в периферические органы; (4) ингибирования (т.е. замедления до некоторой степени и предпочтительно прекращения) метастазов опухоли; (5) ингибирования роста опухоли; (6) предотвращения или задержки возникновения или рецидива опухоли; и/или (7) облегчения до некоторой степени одного или более симптомов, обусловленных злокачественной опухолью. Эффективное количество можно вводить за одно или более введений.
«Резистентное или рефрактерное раковое заболевание» относится к опухолевым клеткам или раковому заболеванию, не отвечающему на проведенную ранее противораковую терапию, включающую, например, химиотерапию, хирургическое вмешательство, лучевую терапию, трансплантацию стволовых клеток и иммунотерапию. Опухолевые клетки могут быть резистентными или рефрактерными в начале лечения или стать резистентными или рефрактерными в процессе лечения. Рефрактерные опухолевые клетки включают опухоли, первоначально не отвечающие на лечение или отвечающие в течение короткого периода времени, а впоследствии неспособные к ответу на лечение. Рефрактерные опухолевые клетки также включают опухоли, отвечающие на проведение противораковой терапии, но неспособные отвечать на последующие раунды терапии. Для целей данного изобретения рефрактерные опухолевые клетки также включают опухоли, для которых наблюдается ингибирование в результате проведения противораковой терапии, но рецидивирующие в течение вплоть до пяти лет, иногда вплоть до десяти лет или более длительного периода после прекращения терапии. В противораковой терапии можно применять монотерапию химиотерапевтическими агентами, монотерапию облучением, монотерапию методами таргетной терапии, только хирургическое вмешательство или их комбинации. Для простоты описания, но не для ограничения, следует понимать, что термин «рефрактерные опухолевые клетки» взаимозаменяем с термином «резистентная опухоль».
Понятно, что описанные в настоящем документе аспекты и воплощения изобретения включают в себя «состоящие из» и/или «состоящие по существу из» аспектов и воплощений.
В настоящем документе ссылка на «примерно» в отношении величины или параметра включает в себя (и описывает) варианты, относящиеся к самой этой величине или параметру. Например, описание, относящееся к «примерно X» включает в себя описание «X».
Используемые в настоящем документе и в прилагаемой формуле изобретения формы единственного числа включают в себя соответствующее множественное число, если контекст явным образом не требует иного. Понятно, что описанные в настоящем документе аспекты и варианты изобретения включают в себя «состоящие из» и/или «состоящие по существу из» аспектов и вариантов.
Антиген PD-1
Используемый в настоящем документе термин «PD-1» включает в себя PD-1 человека (hPD-1), его варианты, изоформы и молекулы, гомологичные hPD-1, и его аналоги, имеющие по меньшей мере один общий эпитоп с hPD-1. В различных воплощениях изобретения используемый в настоящем документе полипептид hPD-1 может включать в себя аминокислотную последовательность, представленную в виде эталонной последовательности в базе данных Национального центра биотехнологической информации (NCBI; National Center for Biotechnology Information): NP_005009.2 (SEQ ID NO: 1):

В различных воплощениях изобретения полипептид PD-1 включает в себя аминокислотную последовательность, имеющую экспериментально определенную гомологию, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%), по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% с последовательностью PD-1 человека SEQ ID NO: 1. В некоторых воплощениях изобретения вариант GDF-15 обладает по меньшей мере 70%-ной, по меньшей мере 75%-ной, по меньшей мере 80%-ной, по меньшей мере 85%-ной, по меньшей мере 90%-ной, по меньшей мере 95%-ной, по меньшей мере 96%-ной, по меньшей мере 97%-ной, по меньшей мере 98%-ной, по меньшей мере 99%-ной, по меньшей мере 1-кратной, по меньшей мере 1,5-кратной, по меньшей мере 2-кратной, по меньшей мере 2,5-кратной или по меньшей мере 3-кратной активностью PD-1 человека SEQ ID NO: 1. Полипептидные варианты PD-1 могут быть описаны в отношении добавления, делеции или замены аминокислотного остатка, находящегося в определенном положении 223-аминокислотной последовательности SEQ ID NO: 1. Так, например, термином «P21W» указано, что остаток «Р» (пролин в стандартном однобуквенном коде) в положении 21 в SEQ ID NO: 1 заменен «W» (триптофан в стандартном однобуквенном коде). Антитела
Способы получения новых антител, которые связываются с полипептидом PD-1 человека, известны специалистам в данной области техники. Например, способ получения моноклонального антитела, специфично связывающегося с полипептидом PD-1, может включать введение мыши количества содержащей полипептид PD-1 иммуногенной композиции, эффективного для стимуляции определяемого иммунного ответа, получение продуцирующих антитело клеток (например, клеток селезенки) мыши и слияние продуцирующих антитело клеток с клетками миеломы с получением продуцирующих антитело гибридом и тестирование продуцирующих антитело гибридом для идентификации гибридомы, продуцирующей моноклональное антитело, которое специфично связывается с полипептидом PD-1. После получения гибридомы ее можно размножать в культуре клеток, возможно в условиях культивирования, где клетки, имеющие происхождение от гибридомы, продуцируют моноклональное антитело, которое специфично связывается с полипептидом PD-1. Моноклональное антитело может быть очищено из культуры клеток. Таким образом, для тестирования взаимодействия антитела с антигеном для идентификации конкретных желаемых антител доступен ряд различных методов.
Можно использовать другие подходящие способы получения или выделения антител требуемой специфичности, включающие, например, способы с отбором рекомбинантного антитела из библиотеки или способы, основанные на иммунизации трансгенных животных (например, мышей), способных к продуцированию полного репертуара человеческих антител. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551-2555, 1993; Jakobovits et al., Nature, 362:255-258, 1993; Lonberg et al., патент U.S. №5545806; Surani et al., патент U.S. №5545807.
Антитела можно конструировать разнообразными методами генной инженерии. Они могут быть получены в виде одноцепочечных антител (включая иммунофармацевтические средства на основе модульного белка малого размера, или SMIP™ (small modular immunopharmaceuticals)), фрагменты Fab и F(ab')2 и т.д. Антитела могут быть гуманизированными, химерными, деиммунизированными или полностью человеческими. Множество типов антител и способы генно-инженерного конструирования таких антител представлены в многочисленных публикациях. См., например, патенты U.S. №№6355245; 6180370; 5693762; 6407213; 6548640; 5565332; 5225539; 6103889 и 5260203.
Химерные антитела могут быть получены методами рекомбинантных ДНК, известными в данной области техники. Например, ген, кодирующий молекулу моноклонального антитела с константной областью Fc мыши (или другого биологического вида), расщепляют ферментами рестрикции, чтобы удалить область, кодирующую Fc мыши, и заменяют эту область эквивалентным участком гена, кодирующим константную область Fc человека (см. Robinson et al., публикация международной заявки на патент PCT/US86/02269; Akira, et al., заявка на европейский патент 184187; Taniguchi, М., заявка на европейский патент 171496; Morrison et al., заявка на европейский патент 173,494; Neuberger et al., международная заявка на патент WO 86/01533; Cabilly et al. патент U.S. №4816567; Cabilly et al., заявка на европейский патент 125023; Better et al., Science, 240:1041-1043, 1988; Liu et al., PNAS USA, 84:3439-3443, 1987; Liu et al., J. Immunol. 139:3521-3526, 1987; Sun et al., PNAS USA, 84:214-218, 1987; Nishimura et al., Cane. Res. 47:999-1005, 1987; Wood et al., Nature 314:446-449, 1985; и Shaw et al., J. Natl Cancer Inst., 80:1553-1559, 1988).
Способы гуманизации антител описаны в данной области техники. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки каркасной области заменены остатками из аналогичных участков антител грызунов. Соответственно, такие «гуманизированные» антитела представляют собой химерные антитела, в которых область, существенно меньшая, чем интактная вариабельная область, заменена соответствующей последовательностью биологического вида, отличающегося от человека. В определенной степени это может быть выполнено в сочетании с методами гуманизации и методов дисплея с использованием соответствующих библиотек. Должно быть понятно, что мышиные антитела или антитела других биологических видов могут быть гуманизированы или приматизированы с использованием методов, хорошо известных в данной области техники (см., например, Winter et al., Immunol Today, 14:43-46, 1993; и Wright et al., Crit. Reviews in Immunol., 12125-168, 1992). Представляющее интерес антитело может быть сконструировано методами рекомбинантных ДНК для замены СН1, СН2, СН3, шарнирных доменов и/или каркасного домена соответствующей последовательностью человека (см. WO 92/02190 и патент U.S. №№5530101, 5585089, 5693761, 5693792, 5714350 и 5777085). В данной области техники также известно использование кДНК Ig для конструирования химерных генов иммуноглобулинов (Liu et al., P.N.A.S. 84:3439, 1987; J. Immunol. 139:3521, 1987). мРНК выделяют из гибридомы или другой клетки, продуцирующей антитело, и используют для получения кДНК. Представляющую интерес кДНК можно амплифицировать методом полимеразной цепной реакции (ПЦР) с использованием специфичных праймеров (патенты U.S. №№4683195 и 4683202). Альтернативно для выделения интересующей последовательности получают библиотеку и проводят ее скрининг. Затем последовательность ДНК, кодирующую вариабельную область антитела, гибридизуют с последовательностями константных областей человека. Последовательности генов константных областей человека можно найти в работе Kabat et al. (1991) Sequences of Proteins of Immunological Interest, номер публикации N.I.H. 91-3242. Последовательности генов С области человека могут быть легко получены из известных клонов. При выборе изотипа будут руководствоваться желаемыми эффекторными функциями, такими как фиксация комплемента или активность в антителозависимой клеточной цитотоксичности. В различных воплощениях изобретения изотип выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. Можно использовать любую из константных областей легкой цепи человека, каппа или лямбда. Затем химерное гуманизированное антитело экспрессируют общепринятыми способами.
В патенте U.S. №5693761, выданном Queen et al, описано усовершенствование гуманизации антител Winter et al., основанное на допущении, что утрата авидности связана с проблемами в структурных мотивах гуманизированной каркасной области, которые в связи со стерической или иной химической несовместимостью препятствуют укладке CDR в способной к связыванию конформации, обнаруживаемой в мышином антителе. Чтобы разрешить эту проблему, в работе Queen рекомендовано использование каркасных последовательностей человека, близко гомологичных линейной пептидной последовательности каркасных последовательностей мышиного антитела, предназначенного для гуманизации. Соответственно, предложенные в работе Queen способы сосредоточены на межвидовом сравнении каркасных последовательностей. Как правило, все доступные последовательности вариабельной области человека сравнивают с конкретной последовательностью мыши и рассчитывают процент идентичности между соответствующими каркасными остатками. Для получения каркасных последовательностей для проекта гуманизации отбирают вариабельную область человека с самым высоким процентом идентичности. В работе Queen также указано, что важно сохранить в гуманизированной каркасной области определенные аминокислотные остатки каркасной области мыши, критичные для поддержания CDR в способной к связыванию конформации. Потенциальную критичность оценивают на молекулярных моделях. Остатки-кандидаты для сохранения, как правило, представляют собой остатки, примыкающие в линейной последовательности к CDR или физически расположенные в пределах 6Å любого остатка CDR.
При других подходах значимость конкретных аминокислотных остатков каркасной области определяют экспериментально, как только получена гуманизированная конструкция с низкой авидностью, путем реверсии отдельных остатков в последовательности мыши и количественного определения связывания антигена, как описано в работе Riechmann et al, 1988. Другой пример подхода к идентификации значимых аминокислот в каркасных последовательностей описан в патенте U.S. №5821337, выданном Carter et al, и в патенте U.S. №5859205, выданном Adair et al. В этих источниках описаны конкретные положения остатков в каркасной области по системе Кабата, замена которых соответствующими аминокислотными остатками мыши может потребоваться в гуманизированном антителе для сохранения авидности.
Другой способ гуманизации антител, называемый «перетасовкой каркасной области», относится к созданию комбинаторной библиотеки, в которой вариабельные области CDR вида, отличающегося от человека, соединены в одной рамке считывания с пулом индивидуальных каркасных областей зародышевой линии человека (Dall'Acqua et al., Methods, 36:43, 2005). Затем проводят скрининг этих областей для идентификации клонов, кодирующих гуманизированные антитела, которые сохраняют хорошее связывание.
Для снижения антигенности очень важен выбор вариабельных областей как легкой, так и тяжелой цепи человека для использования при получении желаемых гуманизированных антител. В соответствии с так называемым способом «наилучшего приближения» проводят скрининг последовательности вариабельной области антитела грызуна по сравнению со всей библиотекой известных последовательностей вариабельного домена человека. Затем последовательность человека, наиболее приближенная к последовательности грызунов, принимают в качестве каркасной области человека (каркасной области) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296, 1993; Chothia et al., J Mol. Biol., 196:901, 1987). В другом способе используют конкретную каркасную область, полученную из консенсус-последовательности всех человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепи. Для нескольких различных гуманизированных антител можно использовать одну и ту же каркасную область (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285, 1992; Presta et al., J. Immunol., 151:2623, 1993).
На выбор остатков отличающегося от человека вида для замены остатков в вариабельной области человека может влиять ряд факторов. Эти факторы включают, например, редкость аминокислоты в конкретном положении, вероятность взаимодействия либо с CDR, либо с антигеном и вероятность задействования в границе раздела между вариабельными доменами легкой и тяжелой цепи. (См., например, патенты U.S. №№5693761, 6632927 и 6639055). Один из способов анализа этих факторов осуществляют путем использования трехмерных моделей гуманизированных последовательностей и последовательностей вида, отличающегося от человека. Трехмерные модели иммуноглобулинов общедоступны и знакомы специалистам в данной области техники. Доступны компьютерные программы, которые позволяют иллюстрировать и выводить на экран изображения вероятных трехмерных конформационных структур выбранных последовательностей-кандидатов иммуноглобулинов. Просмотр этих изображений позволяет проводить анализ вероятной роли остатков в функционировании последовательности-кандидата иммуноглобулина, например, анализ остатков, которые влияют на способность иммуноглобулина-кандидата к связыванию с его антигеном. Таким путем можно выбирать остатки вида, отличающегося от человека, и заменять остатками вариабельной области человека для достижения желаемых характеристик антитела, таких как повышенная аффинность к целевому(ым) антигену(ам).
Способы получения полностью человеческих антител описаны в данной области техники. В качестве примера способ получения антитела к PD-1 или его антигенсвязывающего фрагмента включает стадии синтеза библиотеки человеческих антител на фаге, скрининга этой библиотеки PD-1 или его антитело-связывающим участком, выделение фага, связывающего PD-1, и получение антитела из этого фага. В качестве другого примера один из способов получения библиотеки антител для использования в методах фагового дисплея включает стадии иммунизации PD-1 или его антигенным участком животного, отличающегося от человека, содержащего локусы иммуноглобулина человека, для получения иммунного ответа, выделения продуцирующих антитело клеток у иммунизированного животного; выделения РНК, кодирующей тяжелую и легкую цепи антител по изобретению из выделенных клеток, обратной транскрипции этой РНК с получением кДНК, амплификации кДНК с использованием праймеров и вставки кДНК в вектор фагового дисплея таким образом, чтобы антитела экспрессировались на фаге. Таким путем могут быть получены рекомбинантные антитела к PD-1 по изобретению.
Рекомбинантные человеческие антитела к PD-1 по изобретению могут быть также выделены путем скрининга рекомбинантной комбинаторной библиотеки антител. Предпочтительно библиотека представляет собой библиотеку фагового дисплея scFv, созданную с использованием кДНК VL и VH, полученной из мРНК, выделенной из В-клеток. Способы получения и скрининга таких библиотек известны в данной области техники. Наборы реактивов для получения библиотек фагового дисплея имеются в продаже (например, Pharmacia Recombinant Phage Antibody System, №по каталогу 27-9400-01; и набор реактивов для получения библиотеки фагового дисплея Stratagene SurfZAP™, №по каталогу 240612). Также существуют другие способы и реактивы, которые можно использовать для получения и скрининга библиотек дисплея антител (см., например, патент U.S. №5223409; публикации РСТ №№ WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; Fuchs et al., Bio/Technology 9:1370-1372 (1991); Hay et al., Hum. Antibod. Hybridomas 3:81-85, 1992; Huse et al., Science 246:1275-1281, 1989; McCafferty et al., Nature 348:552-554, 1990; Griffiths et al., EMBO J. 12:725-734, 1993; Hawkins et al., J. Mol. Biol. 226:889-896, 1992; Clackson et al., Nature 352:624-628, 1991; Gram et al., Proc. Natl. Acad. Sci. USA 89:3576-3580, 1992; Garrad et al., Bio/Technology 9:1373-1377, 1991; Hoogenboom et al., Nuc. Acid Res. 19:4133-4137, 1991; и Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982, 1991, где каждая из публикаций включена в настоящий документ посредством ссылки для целей обучения приготовлению и скринингу библиотек фагового дисплея.
Человеческие антитела также получают путем иммунизации отличающегося от человека трансгенного животного, в геном которого включены некоторые или все локусы тяжелой цепи и легкой цепи иммуноглобулина человека, антигеном IgE человека, например животного XenoMouse™ (Abgenix, Inc./Amgen, Inc. Fremont, Calif). Мыши XenoMouse™ представляют собой линии мышей, полученные методами генной инженерии, которые содержат большие фрагменты локусов тяжелой цепи и легкой цепи иммуноглобулина человека и характеризуются дефицитом выработки мышиных антител. См., например, Green et al., Nature Genetics 7:13-21, 1994; и патенты U.S. №№5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598, 6130364, 6162963 и 6150584. См. также WO 91/10741, WO 94/02602, WO 96/34096, WO 96/33735, WO 98/16654, WO 98/24893, WO 98/50433, WO 99/45031, WO 99/53049, WO 00/09560 и WO 00/037504. У мышей XenoMouse™ вырабатываются антитела, подобные репертуару полностью человеческих антител взрослого человека, и образуются антиген-специфичные человеческие антитела. В некоторых воплощениях изобретения мыши линии XenoMouse™ содержат приблизительно 80% гена V репертуара человеческих антител в результате введения фрагментов локусов тяжелой цепи и локусов легкой цепи каппа человека, имеющих конфигурацию зародышевой линии размером порядка нескольких мегабаз в дрожжевой искусственной хромосоме (YAC). В других воплощениях изобретения мыши линии XenoMouse™ дополнительно содержат приблизительно весь локус легкой цепи лямбда человека. См. Mendez et al., Nature Genetics 15:146-156, 1997, Green and Jakobovits, J. Exp.Med. 188:483-495 (1998) и WO 98/24893 (каждая из которых полностью включена в настоящий документ посредством ссылки в целях обучения приготовлению полностью человеческих антител). В другом аспекте в настоящем изобретении предложен способ получения антител к PD-1 у животных, отличающихся от человека и от мыши, путем иммунизации антигеном PD-1 трансгенных животных, отличающихся от человека, которые содержат локусы иммуноглобулина человека. Такие животные могут быть получены с использованием способов, описанных в цитируемых выше документах.
Определение характеристик связывания антитела с антигеном
Связывание антител по настоящему изобретению с PD-1 можно исследовать, например, стандартным методом твердофазного иммуноферментного анализа (тИФА). В качестве примера в лунки микропланшета вносят в виде покрытия очищенный PD-1 в ФСБ, а затем блокируют 5%-ным раствором бычьего сывороточного альбумина в ФСБ. Разведения антитела (например, разведения плазмы крови от мышей, иммунизированных PD-1) добавляют в каждую лунку и инкубируют в течение 1-2 часов при 37°С. Планшеты промывают ФСБ/Твин, а затем инкубируют со вторым реактивом (например, для человеческих антител это козий античеловеческий IgG Fc-специфичный поликлональный реактив), конъюгированным со щелочной фосфатазой в течение 1 часа при 37°С. После промывки планшеты проявляют субстратом pNPP (1 мг/мл) и анализируют при OD 405-650. Предпочтительно для получения гибридных конструкций используют мышей с самыми высокими титрами. Анализ тИФА можно также использовать для скрининга на гибридомы, проявляющие положительную реактивность с иммуногеном PD-1. Гибридомы, которые с высокой авидностью связываются с PD-1, субклонируют и проводят их дальнейшую характеристику. Один клон от каждой гибридомы, который сохраняет реактивность родительских клеток на основании тИФА, может быть выбран для создания банка клеток из 5-10 флаконов, который хранят при -140°С, и для очистки антитела.
Чтобы определить, связываются ли отобранные моноклональные антитела к PD-1 с уникальными эпитопами, каждое антитело может быть биотинилировано с использованием имеющихся в продаже реактивов (Pierce, Rockford, Ill.). Можно провести исследования конкурентного связывания с использованием немеченых моноклональных антител и биотинилированных моноклональных антител с использованием покрытых PD-1 планшетов для тИФА, как описано выше. Связывание биотинилированного моноклонального антитела (мАт) можно обнаружить с помощью зонда, представляющего собой стрептавидин, меченый щелочной фосфатазой. Для определения изотипа очищенных антител можно провести тИФА с изотипированием, используя специфичные реактивы для антител конкретного изотипа. Например, для определения изотипа человеческого моноклонального антитела, в лунки микротитрационных планшетов можно вносить в качестве покрытия 1 ME.г/мл античеловеческого иммуноглобулина в течение ночи при 4 градусах С. После блокирования 1% бычьим сывороточным альбумином (БСА) образцы в лунках планшетов подвергают взаимодействию с 1 мкг/мл или менее тестируемых моноклональных антител или очищенных антител контроля изотипа при температуре окружающей среды в течение от одного до двух часов. Затем образцы в лунках планшета можно подвергать взаимодействию с зондами, специфичными к человеческому IgG1 или к человеческому IgM, конъюгированными со щелочной фосфатазой. Планшеты проявляют и анализируют, как описано выше.
Человеческие IgG к PD-1 можно подвергать дополнительному тестированию на реактивность с антигеном PD-1 методом Вестерн-блоттинга. Кратко, подготовленный PD-1 можно подвергать электрофорезу в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ). После электрофореза разделенные антигены переносят на нитроцеллюлозные мембраны, блокируют 10%-ной фетальной телячьей сывороткой и гибридизуют с подлежащими тестированию моноклональными антителами. Связывание с человеческим IgG можно обнаружить, используя античеловеческий IgG, меченый щелочной фосфатазой, и проявлять таблетками субстрата, представляющего собой 5-бромо-4-хлоро-3-индолфосфатазу/нитросиний тетразолий (BCIP/NBT) (Sigma Chem. Co., St. Louis, Mo.).
Идентификация антител к PD-1
В настоящем изобретении предложены моноклональные антитела и их антигенсвязывающие фрагменты, которые специфично связываются с антигеном PD-1.
В настоящее изобретение дополнительно включены антитела, которые связываются с тем же эпитопом, что и антитела к PD-1 по настоящему изобретению. Чтобы определить, может ли антитело конкурировать за связывание с тем же эпитопом, который связывает антитела к PD-1 по настоящему изобретению, можно проводить анализ перекрестного блокирования, например, конкурентный анализ тИФА. В примере конкурентного анализа тИФА PD-1, нанесенный в лунки микропланшета в виде покрытия, предварительно инкубируют с конкурирующим антителом-кандидатом или в его отсутствие, а затем добавляют меченое биотином антитело к PD-1 по изобретению. Количество меченого антитела к PD-1, связанного с антигеном PD-1 в лунках планшета, определяют, используя конъюгат авидина с пероксидазой и соответствующий субстрат. Антитело может быть меченным радиоактивной или флуоресцентной меткой или какой-либо другой обнаружимой и определяемой количественно меткой. Количество меченого антитела к PD-1, которое связывается с антигеном, характеризуется непрямой корреляцией со способностью конкурирующего антитела-кандидата (тестируемого антитела) к конкуренции за связывание с одним и тем же эпитопом, т.е., чем больше аффинность тестируемого антитела к тому же эпитопу, тем меньшее количество антитела будет связываться с лунками, покрытыми антигеном. Конкурентным антителом-кандидатом считают антитело, которое связывается по существу с тем же эпитопом и конкурирует за связывание с тем же эпитопом, что и антитело к PD-1 по изобретению, если это антитело-кандидат может блокировать связывание антитела к PD-1 по меньшей мере на 20%, предпочтительно по меньшей мере на 20-50%, даже более предпочтительно по меньшей мере на 50% по сравнению с контролем, который проводят параллельно в отсутствие конкурентного антитела-кандидата. Понятно, что для получения аналогичного количественного значения могут быть проведены варианты этого анализа. В различных воплощениях изобретения антитела по настоящему изобретению включают антитела, которые связываются с тем же эпитопом, что и моноклональное антитело, обозначенное PD1#1. В различных воплощениях изобретения антитела по настоящему изобретению включают антитела, которые связываются с тем же эпитопом, что и моноклональное антитело, обозначенное PD1#3. B различных воплощениях изобретения антитела по настоящему изобретению включают антитела, которые связываются с тем же эпитопом, что и моноклональное антитело, обозначенное PD1#4.
Аминокислотные последовательности CDR тяжелой цепи и CDR легкой цепи трех мышиных антител PD1#1, PDL#3 и PD1#4, полученных, как описано в настоящем документе, показаны в таблице 2 ниже.


CDR легкой цепи

В различных воплощениях настоящего изобретения антитело или антигенсвязывающий фрагмент представляет собой мышиное антитело PD1#1, содержащее последовательность вариабельной области тяжелой цепи SEQ ID NO: 20)

и последовательность вариабельной области легкой цепи SEQ ID NO: 26:
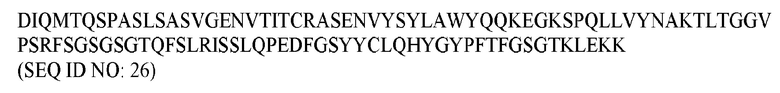
В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи, и где вариабельная область тяжелой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%о или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 20, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 21:

и где легкая цепь содержит вариабельную область легкой цепи, и где вариабельная область легкой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%о, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 26, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 27:

В различных воплощениях настоящего изобретения антитело или антигенсвязывающий фрагмент представляет собой мышиное антитело PD1#3, содержащее последовательность вариабельной области тяжелой цепи SEQ ID NO: 22:
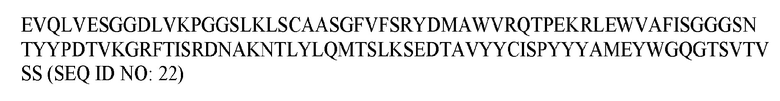
и последовательность вариабельной области легкой цепи SEQ ID NO: 28:
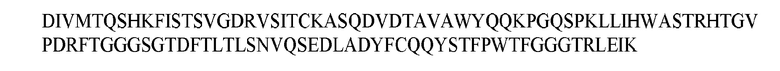
(SEQ ID NO: 28)
В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи, и где вариабельная область тяжелой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%о, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 22, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 23:
и где легкая цепь содержит вариабельную область легкой цепи, и где вариабельная область легкой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 28, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 29:
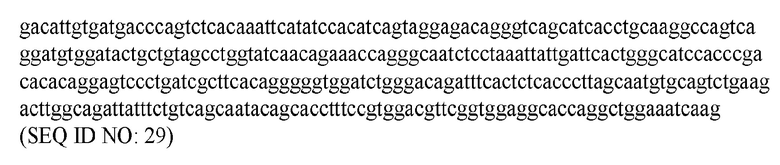
В различных воплощениях настоящего изобретения антитело или антигенсвязывающий фрагмент представляет собой мышиное антитело PD1#4, содержащее последовательность вариабельной области тяжелой цепи SEQ ID NO: 24:
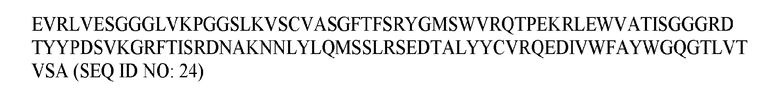
и последовательность вариабельной области легкой цепи SEQ ID NO: 30:

В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи, и где вариабельная область тяжелой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%о или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 24, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 25:
и где легкая цепь содержит вариабельную область легкой цепи, и где вариабельная область легкой цепи содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 30, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 31:

В различных воплощениях изобретения вариабельный домен тяжелой цепи содержит последовательность аминокислот, кодируемую полинуклеотидом, который гибридизуется в условиях средней жесткости с комплементом полинуклеотида, кодирующего вариабельный домен тяжелой цепи, имеющий последовательность SEQ ID NO: 21, 23 или 25. В различных воплощениях изобретения вариабельный домен тяжелой цепи содержит последовательность аминокислот, кодируемую полинуклеотидом, который гибридизуется в жестких условиях с комплементом полинуклеотида, кодирующего вариабельный домен тяжелой цепи, имеющий последовательность SEQ ID NO: 21, 23 или 25. В различных воплощениях изобретения вариабельный домен легкой цепи содержит последовательность аминокислот, кодируемую полинуклеотидом, который гибридизуется в условиях средней жесткости с комплементом полинуклеотида, кодирующего вариабельный домен легкой цепи, имеющий последовательность SEQ ID NO: 27, 29 или 31. В различных воплощениях изобретения вариабельный домен легкой цепи содержит последовательность аминокислот, кодируемую полинуклеотидом, который гибридизуется в жестких условиях с комплементом полинуклеотида, кодирующего вариабельный домен легкой цепи, имеющий последовательность SEQ ID NO: 27, 29 или 31.
В различных воплощениях настоящего изобретения антитело или антигенсвязывающий фрагмент представляет собой химерное антитело мыши и человека, полученное из мышиного антитела PD1#3, содержащего последовательность тяжелой цепи SEQ ID NO: 32, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

и последовательность легкой цепи SEQ ID NO: 34, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

В некоторых альтернативных воплощениях изобретения антитело представляет собой химерное антитело мыши и человека, содержащее тяжелую цепь и легкую цепь, где тяжелая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 32, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 33:

и где легкая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 34, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 35:

В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит вариабельную область тяжелой цепи, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 36, 38, 40-42 и 53, и вариабельную область легкой цепи, имеющую последовательность, идентичную, по существу идентичную или по существу подобную SEQ ID NO: 37, 39, 43-52 и 54-57. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 36, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 37. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 38, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 39. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 40, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 37. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 54. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 55. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 56. В различных воплощениях антитело представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент, которые содержат вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 53, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 57.
В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты содержат вариабельный домен тяжелой цепи, содержащий последовательность аминокислот, которая отличается от последовательности вариабельного домена тяжелой цепи, имеющим аминокислотную последовательность, представленную в SEQ ID NO: 36, 38, 40-42 и 53, только на 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0 остатков, где каждое такое различие последовательностей независимо представляет собой делецию, вставку или замену одного аминокислотного остатка. В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты содержат вариабельный домен тяжелой цепи, содержащий последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99%о с аминокислотной последовательностью, представленной в SEQ ID NO: 36, 38, 40-42 и 53.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержат последовательность аминокислот, которая отличается от последовательности вариабельного домена легкой цепи, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 37, 39, 43-52 и 54-57, только на 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0 остатков, где каждое такое различие последовательностей независимо представляет собой делецию, вставку или замену одного аминокислотного остатка. В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты содержат вариабельный домен легкой цепи, содержащий последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%о, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 37, 39, 43-52 и 54-57.
В различных воплощениях настоящего изобретения антитело представляет собой гуманизированное антитело IgG, содержащее последовательность тяжелой цепи SEQ ID NO: 58, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

и последовательность легкой цепи SEQ ID NO: 60, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую цепь и легкую цепь, где тяжелая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%) или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 58, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 59:

и где легкая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 60, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 61:

В различных воплощениях настоящего изобретения антитело представляет собой гуманизированное антитело IgG, содержащее последовательность тяжелой цепи SEQ ID NO: 62, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

и последовательность легкой цепи SEQ ID NO: 64, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую цепь и легкую цепь, где тяжелая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 62, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 63:

и где легкая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 64, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 65:

В различных воплощениях настоящего изобретения антитело представляет собой гуманизированное антитело IgG, содержащее последовательность тяжелой цепи SEQ ID NO: 66, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

и последовательность легкой цепи SEQ ID NO: 68, и в котором аминокислоты 1-19 представляют собой лидерную последовательность:

В некоторых альтернативных воплощениях изобретения антитело представляет собой антитело, содержащее тяжелую цепь и легкую цепь, где тяжелая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 66, или с ее соответствующей нуклеотидной последовательностью SEQ ID NO: 67:


и где легкая цепь содержит последовательность, обладающую идентичностью по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% с аминокислотной последовательностью, представленной в SEQ ID NO: 68, или с ее соответствующей полинуклеотидной последовательностью SEQ ID NO: 69:

В различных воплощениях настоящего описания антитело может представлять собой антитело к PD-1, обладающее аналогичной или более высокой антигенсвязывающей аффинностью по сравнению с антителом, содержащим последовательность тяжелой цепи, представленную в любой из SEQ ID NO: 58, 62 и 66. В различных воплощениях антитело может представлять собой антитело к PD-1, обладающее аналогичной или более высокой антигенсвязывающей аффинностью по сравнению с антителом, содержащим последовательность тяжелой цепи, представленную в любой из SEQ ID NO: 58, 62 и 66. В различных воплощениях антитело представляет собой антитело к PD-1, конкурирующее с антителом, содержащим последовательность тяжелой цепи, представленную в любой из SEQ ID NO: 58, 62 и 66. В различных воплощениях антитело может представлять собой антитело к PD-1, которое содержит по меньшей мере одну (например, две или три) CDR последовательности тяжелой цепи, представленную в SEQ ID NO: 58, 62 и 66.
В различных воплощениях изобретения антитело содержит аминокислотную последовательность тяжелой цепи, имеющую экспериментально определенную гомологию, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% с любой из SEQ ID NO: 58, 62 и 66. В различных воплощениях изобретения антитело содержит нуклеиново-кислотную последовательность тяжелой цепи, имеющую экспериментально определенную гомологию, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% с любой из SEQ ID NO: 59, 63 и 67.
В различных воплощениях настоящего описания антитело может представлять собой антитело к PD-1, обладающее аналогичной или более высокой антигенсвязывающей аффинностью по сравнению с антителом, содержащим последовательность легкой цепи, представленную в любой из SEQ ID NO: 60, 64 и 68. В различных воплощениях антитело может представлять собой антитело к PD-1, обладающее аналогичной или более высокой антигенсвязывающей аффинностью по сравнению с антителом, содержащим последовательность легкой цепи, представленную в любой из SEQ ID NO: 60, 64 и 68. В различных воплощениях антитело представляет собой антитело к PD-1, конкурирующее с антителом, содержащим последовательность легкой цепи, представленную в любой из SEQ ID NO: 60, 64 и 68. В различных воплощениях антитело может представлять собой антитело к PD-1, которое содержит по меньшей мере одну (например, две или три) CDR последовательности легкой цепи, представленную в SEQ ID NO: 60, 64 и 68.
В различных воплощениях изобретения антитело содержит аминокислотную последовательность легкой цепи, имеющую экспериментально определенную гомологию, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% с любой из SEQ ID NO: 60, 64 и 68. В различных воплощениях изобретения антитело содержит нуклеиново-кислотную последовательность тяжелой цепи, имеющую экспериментально определенную гомологию, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% с любой из SEQ ID NO: 61, 65 и 69.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 58, и последовательность легкой цепи, представленную в SEQ ID NO: 60.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 62, и последовательность легкой цепи, представленную в SEQ ID NO: 64.
В различных воплощениях изобретения выделенное гуманизированное антитело или его антигенсвязывающий фрагмент по настоящему изобретению связывается с PD-1 человека и содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 66, и последовательность легкой цепи, представленную в SEQ ID NO: 68.
Антитела или их антигенсвязывающие фрагменты по изобретению могут содержать любую константную область, известную в данной области техники. Константная область легкой цепи может представлять собой, например, константную область легкой цепи каппа- или лямбда-типа, например, константную область легкой цепи человека каппа- или лямбда-типа. Константная область тяжелой цепи может представлять собой, например, константные области тяжелой цепи альфа-, дельта-, эпсилон-, гамма- или мю-типа, например, константную область тяжелой цепи IgA-, IgD-, IgE-, IgG- и IgM-типа. В различных воплощениях изобретения константная область легкой или тяжелой цепи представляет собой фрагмент, производное, вариант или мутеин встречающейся в природе константной области.
Известны методы получения производных антитела подкласса или изотипа, отличающегося от представляющего интерес антитела, т.е. переключения подкласса. Так, например, антитела IgG могут быть получены из антитела IgM, и наоборот. Такие методы позволяют получить новые антитела, которые обладают антигенсвязывающими свойствами данного антитела (родительского антитела), но также проявляют биологические свойства, обусловленные изотипом или подклассом антитела, отличающимся от такового родительского антитела. Можно использовать методы рекомбинантных ДНК. В таких методиках можно использовать клонированную ДНК, кодирующую конкретные антительные полипептиды, например, ДНК, кодирующую константный домен антитела желаемого изотипа. См. также Lanitto et al., Methods Mol. Biol. 178:303-16, 2002.
В различных воплощениях изобретения антитело по изобретению дополнительно содержит константный домен легкой цепи каппа или лямбда или его фрагмент и дополнительно содержит константный домен тяжелой цепи или его фрагмент. Последовательности константной области легкой цепи и константной области тяжелой цепи, используемые в примерах антител, и кодирующие их полинуклеотиды приведены ниже.
Константная область легкой цепи (каппа)
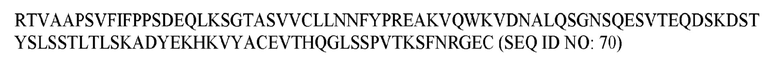
Константная область легкой цепи (лямбда)
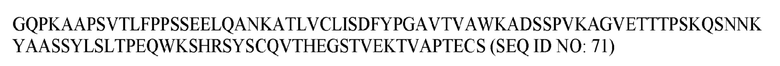
Константная область тяжелой цепи

Антитела по настоящему изобретению могут быть также описаны или определены в отношении их перекрестной реактивности. В настоящее изобретение также включены антитела, которые связывают полипептиды PD-1, обладающие по меньшей мере 95%-ной, по меньшей мере 90%-ной, по меньшей мере 85%-ной, по меньшей мере 80%-ной, по меньшей мере 75%-ной, по меньшей мере 70%-ной, по меньшей мере 65%-ной, по меньшей мере 60%-ной, по меньшей мере 55%-ной и по меньшей мере 50%-ной идентичностью (рассчитанной способами, известными в данной области техники и описанными в настоящем документе) PD-1 человека.
В настоящее изобретение дополнительно включены антитела, которые связываются с тем же эпитопом, что и антитела к PD-1 по настоящему изобретению. Чтобы определить, может ли антитело конкурировать за связывание с тем же эпитопом, который связывает антитела к PD-1 по настоящему изобретению, можно проводить анализ перекрестного блокирования, например, конкурентный анализ тИФА. В примере конкурентного анализа тИФА PD-1, нанесенный в лунки микропланшета в виде покрытия, предварительно инкубируют с конкурирующим антителом-кандидатом или в его отсутствие, а затем добавляют меченое биотином антитело к PD-1 по изобретению. Количество меченого антитела к PD-1, связанного с антигеном PD-1 в лунках планшета, определяют, используя конъюгат авидина с пероксидазой и соответствующий субстрат. Антитело может быть меченным радиоактивной или флуоресцентной меткой или какой-либо другой обнаружимой и определяемой количественно меткой. Количество меченого антитела к PD-1, которое связывается с антигеном, характеризуется непрямой корреляцией со способностью конкурирующего антитела-кандидата (тестируемого антитела) к конкуренции за связывание с одним и тем же эпитопом, т.е., чем больше аффинность тестируемого антитела к тому же эпитопу, тем меньшее количество антитела будет связываться с лунками, покрытыми антигеном. Конкурирующее антитело-кандидат считают антителом, которое связывается по существу с тем же эпитопом и конкурирует за связывание с тем же эпитопом, что и антитело к PD-1 по изобретению, если это антитело-кандидат может блокировать связывание антитела к PD-1 по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% по сравнению с контролем, который проводят параллельно в отсутствие конкурирующего антитела-кандидата. Понятно, что для получения аналогичного количественного значения могут быть проведены варианты этого анализа.
В некоторых альтернативных воплощениях изобретения антитела по настоящему изобретению могут быть сконструированы путем модификации одного или более остатков в одной или в обеих вариабельных областях (т.е. VH и/или VL) или путем модификации остатков в константной(ых) области(областях), например, для изменения эффекторной(ых) функции (функций) антитела. В различных воплощениях изобретения вариабельная область антитела будет модифицирована путем проведения прививания CDR, используя каркасных областей, которые могут быть получены из общедоступных баз данных ДНК или опубликованных литературных источников, которые включают последовательности генов антител зародышевой линии (например, Tomlinson, I. М., et al., J. Mol. Biol. 227:776-798, 1992; и Cox, J. P. L. et al., Eur. J. Immunol. 24:827-836, 1994; содержание каждой из них явным образом включено в настоящий документ посредством ссылки). В различных воплощениях изобретения антитела могут быть модифицированы с помощью сайт-направленного мутагенеза или ПЦР-опосредованного мутагенеза с введением мутации (мутаций) в VH и/или VL, которая(ые) улучшает(ют) связывающую аффинность и/или уменьшает(ют) иммуногенность. В различных воплощениях изобретения антитела могут быть модифицированы в области Fc в целях изменения периода полувыведения из сыворотки крови, фиксации комплемента, связывания с рецептором Fc и/или антигензависимой клеточной цитотоксичности антитела. В различных воплощениях изобретения антитела могут быть модифицированы в целях модификации гликозилирования антитела. Способы проведения каждой из модификаций, описанные в настоящем документе и в других документах, хорошо известны специалистам в данной области техники.
Фармацевтические композиции
В другом аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент, как описано выше. Фармацевтические композиции, способы и применения по изобретению, таким образом, также включают в себя воплощения комбинаций (совместного введения) с другими активными агентами, как подробно описано ниже.
Как правило, антитела или антигенсвязывающие фрагменты антител по настоящему изобретению пригодны для введения в виде лекарственной формы в сочетании с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин «эксципиент» используют в настоящем документе для описания любого ингредиента, отличающегося от соединения(ий) по изобретению. Выбор эксципиента(ов) будет в значительной степени зависеть от таких факторов, как конкретный способ введения, действие эксципиента на растворимость и стабильность и характер дозированной формы. При использовании в настоящем документе «фармацевтически приемлемый эксципиент» включает любое и все из растворителей, дисперсионных сред, покрытий, антибактериальных и противогрибковых агентов, изотонических и замедляющих абсорбцию агентов и т.п., которые являются физиологически совместимыми. Некоторыми примерами фармацевтически приемлемых эксципиентов являются вода, физиологический раствор, фосфатно-солевой буферный раствор, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях предпочтительным будет включение в композицию изотонических агентов, например Сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия. Дополнительными примерами фармацевтически приемлемых веществ являются смачивающие агенты или минимальные количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок годности или эффективность антитела. Фармацевтические композиции по настоящему изобретению и способы их получения будут легко очевидны специалистам в данной области техники. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). Фармацевтические композиции предпочтительно производят в условиях надлежащей производственной практики (GMP; good manufacturing practice).
Фармацевтическую композицию по изобретению можно готовить, упаковывать или продавать в нерасфасованном в виде, в виде отдельной единичной дозы или в виде множества отдельных единичных доз. При использовании в настоящем документе «единичная доза» представляет собой дискретное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозировке активного ингредиента, которую надлежит вводить субъекту, или удобная доля такой дозировки, такая как, например, половина или одна треть такой дозировки.
Для антител и их участков по изобретению можно подходящим образом использовать любой способ введения пептидов, белков или антител, приемлемый в данной области техники.
Фармацевтические композиции по изобретению, как правило, пригодны для парентерального введения. При использовании в настоящем документе «парентеральное введение» фармацевтической композиции включает любой путь введения, характеризующийся созданием физической бреши в ткани субъекта и введением фармацевтической композиции через брешь в ткани, что, как правило, приводит к непосредственному введению в кровоток, мышцу или внутренний орган. Парентеральное введение, таким образом, включает без ограничений введение фармацевтической композиции путем инъекции композиции, путем нанесения композиции через хирургический надрез, путем нанесения композиции через проникающую в ткань неоперационную рану и т.п. В частности, парентеральное введение подразумевает включение без ограничений подкожную, интраперитонеальную, внутримышечную, интрастернальную, внутривенную, внутриартериальную, подоболочечную, внутрижелудочковую, интрауретральную, интракраниальную, интрасиновиальную инъекцию или инфузию; и инфузионные методы почечного диализа. Различные воплощения изобретения включают внутривенный и подкожный пути.
Лекарственные формы фармацевтической композиции, пригодной для парентерального введения, как правило, в целом содержат активный ингредиент в комбинации с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический физиологический раствор. Такие лекарственные формы можно готовить, упаковывать или продавать в форме, пригодной для болюсного введения или непрерывного введения. Инъекционные лекарственные формы можно готовить, упаковывать или продавать в единичной дозированной форме, например в ампулах, или в многодозовых контейнерах, содержащих консервант. Лекарственные формы для парентерального введения включают без ограничений суспензии, растворы, эмульсии в масляных или водных носителях, пасты и т.п. Такие лекарственные формы могут дополнительно содержать один или более дополнительных ингредиентов, включая без ограничений суспендирующие, стабилизирующие или диспергирующие агенты. В одном воплощении лекарственной формы для парентерального введения активный ингредиент представлен в сухой (т.е. в порошковой или гранулярной) форме для восстановления подходящей несущей средой (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции. Парентеральные лекарственные формы также включают водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до рН от 3 до 9), но для некоторых применений их можно более приемлемо готовить в виде стерильного неводного раствора или в сухой форме для применения в сочетании с подходящей несущей средой, такой как стерильная апирогенная вода. Примеры форм для парентерального введения включают растворы или суспензии в стерильных водных растворах, например, в водных растворах пропиленгликоля или декстрозы. Такие дозированные формы могут быть при необходимости подходящим образом забуферены. Другие полезные лекарственные формы для парентерального введения включают формы, содержащие активный ингредиент в микрокристаллической форме или в липосомном препарате. Лекарственные формы для парентерального введения можно готовить для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают формы отсроченного, пролонгированного, импульсного, контролируемого, нацеленного и программируемого высвобождения.
Например, в одном аспекте стерильные инъекционные растворы можно готовить путем включения антитела к PD-1 в необходимое количество соответствующего растворителя с комбинацией перечисленных выше ингредиентов по мере необходимости с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят путем включения активного соединения в стерильную несущую среду, которая содержит базовую дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами их приготовления являются вакуумная сушка и лиофилизация с получением порошка активного ингредиента с добавлением любого желаемого дополнительного ингредиента из их раствора, предварительно простерилизованного фильтрованием. Надлежащую текучесть раствора можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ (ПАВ). Пролонгированной абсорбции инъекционных композиций можно добиться путем включения в композицию агента, который замедляет абсорбцию, например, солей моностеарата и желатина.
Антитела по изобретению можно также вводить интраназально или путем ингаляции, обычно в форме сухого порошка (либо отдельно, либо в виде смеси, либо в виде частицы из смешанных компонентов, например, в смеси с подходящим фармацевтически приемлемым эксципиентом) из ингалятора сухого порошка, в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, распылителя (предпочтительно распылителя, в котором используется электрогидродинамика для получения мелкой пыли) или небулайзера с использованием или без использования подходящего пропеллента, или в виде назальных капель.
Контейнер под давлением, насос, спрей, распылитель или небулайзер, как правило, содержат раствор или суспензию антитела по изобретению, содержащие, например, подходящий агент для диспергирования, солюбилизации или пролонгированного высвобождения активного ингредиента и пропеллент(ы) в качестве растворителя.
Перед применением лекарственной формы в виде сухого порошка или суспензии лекарственный препарат обычно микронизируют до размера, подходящего для доставки путем ингаляции (как правило, менее 5 мкм). Этого можно достичь любым подходящим способом измельчения, например с помощью спиральной струйной мельницы, струйной мельницы с псевдоожиженным слоем, сверхкритической жидкостной обработки с образованием наночастиц, гомогенизации высокого давления или распылительной сушки.
Для использования в ингаляторе или инсуффляторе можно готовить капсулы, контурные ячейковые упаковки и картриджи, которые содержат порошкообразную смесь соединения по изобретению, подходящую порошковую основу и модификатор характеристик.
В эти лекарственные формы по изобретению, предназначенные для ингаляционного/интраназального препарата можно добавлять подходящие ароматизаторы, такие как ментол или левоментол, или подсластители, такие как сахарин или сахарин натрий.
Лекарственные формы для ингаляционного/интраназального введения можно готовить для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают формы отсроченного, пролонгированного, импульсного, контролируемого, нацеленного и программируемого высвобождения.
В случае ингаляторов сухого порошка и аэрозолей единица дозировки определяется с помощью клапана, который доставляет отмеренное количество. Устройства в соответствии с изобретением, как правило, устроены так, чтобы вводить отмеренную дозу или «вдувание» антитела по изобретению. Общую суточную дозу, как правило, будут вводить в виде однократной дозы или чаще всего в виде разделенных доз в течение суток.
Антитела и участки антитела по изобретению можно также готовить для перорального пути введения. Пероральное введение может включать прием внутрь таким образом, чтобы соединение попадало в желудочно-кишечный тракт, и/или трансбуккальное, язычное или подъязычное введение, в результате которого соединение попадает в кровоток непосредственно из полости рта.
Лекарственные формы, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие вещества в форме мульти- или наночастиц, жидкости или порошки; лепешки (включая наполненные жидкостью); жевательные таблетки; гели; быстро диспергируемые дозированные формы; пленки; суппозитории; спреи; и трансбуккальные/мукоадгезивные пластыри.
Фармацевтические композиции, предназначенные для перорального применения, можно готовить в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, в целях получения фармацевтически приемлемого на вид и вкус препарата. Например, чтобы получить таблетки для пероральной доставки, антитело или его антигенсвязывающий фрагмент, смешивают по меньшей мере с одним фармацевтическим эксципиентом, и твердую лекарственную форму прессуют для формирования таблетки в соответствии с известными способами для доставки в желудочно-кишечный тракт. Композицию в форме таблетки, как правило, включают в препараты с добавками, например с носителем, представляющим собой сахарид или целлюлозу, связующим веществом, таким как крахмальная паста или метилцеллюлоза, наполнителем, разрыхлителем или другими добавками, как правило, обычно используемыми в производстве лекарственных препаратов для медицинского применения. Для получения капсул для пероральной доставки DHEA (дегидроэпиандростерон) смешивают по меньшей мере с одним фармацевтическим эксципиентом, и твердый препарат помещают в капсульный контейнер, подходящий для доставки в желудочно-кишечный тракт. Композиции, содержащие антитела или их антигенсвязывающие фрагменты, можно готовить, как в целом описано в Remington's Pharmaceutical Sciences, 18th Ed. 1990 (Mack Publishing Co. Easton Pa. 18042) в главе 89, которая включена в настоящий документ посредством ссылки.
В различных воплощениях изобретения композиции включают в препараты в виде таблеток для пероральной доставки, содержащие антитела или их антигенсвязывающие фрагменты в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые подходят для производства таблеток. Эти эксципиенты могут представлять собой инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и разрыхлители, например кукурузный крахмал, желатин или аравийскую камедь, и смазывающие агенты, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут не содержать или содержать покрытие, которое наносят известными методами для замедления разрыхления и абсорбции в желудочно-кишечном тракте, обеспечивая таким образом пролонгированное действие в течение длительного периода времени. Например, можно использовать материал, замедляющий действие, такой как моностеарат глицерина или дистеарат глицерина отдельно или с воском.
В различных воплощениях изобретения фармацевтические композиции включают в препараты в виде твердых желатиновых капсул, где антитело или его антигенсвязывающий фрагмент смешивают с инертным твердым носителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где антитело или его антигенсвязывающий фрагмент смешивают с водной или масляной средой, например арахисовым маслом, растительным арахисовым маслом, жидким парафином или оливковым маслом.
Жидкие лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие лекарственные формы можно использовать в качестве наполнителей в мягких или твердых желатиновых капсулах (выполненных, например, из желатина или гидроксипропилметилцеллюлозы) и, как правило, содержит носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты можно также готовить путем восстановления твердого вещества, например из пакетика-саше.
Терапевтические применения
В другом аспекте настоящее изобретение относится к способам лечения субъекта, страдающего заболеванием, связанным с Т-клетками, или заболеванием, которое можно ослаблять или предотвращать посредством усиления, либо подавления, либо продления иммунного ответа, включающим введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) антитела или его антигенсвязывающего фрагмента по настоящему изобретению. В различных воплощениях изобретения субъект представляет собой человека.
В другом аспекте в настоящем изобретении предложены способы лечения равкового заболевания у субъекта, включающие введение указанному субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) антитела или его антигенсвязывающего фрагмента по настоящему изобретению. Такие расстройства включают без ограничений солидные опухоли, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожную или глазную злокачественную меланому, рак тела матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак яичка, рак тела матки, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, неходжкинскую лимфому, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягкой ткани, рак уретры, рак пениса, хронические или острые лейкозы, включая острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, солидные опухоли детского возраста, лимфоцитарную лимфому, рак мочевого пузыря, рак почки или мочеточника, карциному почечной лоханки, новообразование центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухолевый ангиогенез, опухоль оси позвоночника, глиому ствола головного мозга, аденому гипофиза, саркому Капоши, эпидермоидный рак, плоскоклеточный рак, Т-клеточную лимфому и комбинации указанных раковых заболеваний. В различных воплощениях изобретения субъект ранее отвечал на лечение противоопухолевой терапией, но после прекращения терапии страдал рецидивом (далее в настоящем документе «рецидивирующее раковое заболевание»). В различных воплощениях изобретения у субъекта присутствует резистентное или рефрактерное раковое заболевание. В различных воплощениях изобретения раковые клетки представляют собой иммуногенные опухоли (например, те опухоли, при которых вакцинация с использованием самой опухоли может приводить к иммунитету к провоцирующей стимуляции опухолевыми клетками). В различных воплощениях изобретения раковое заболевание выбрано из группы, состоящей из меланомы (например, метастатической злокачественной меланомы), колоректального рака (CRC), рака почки, рака мочевого пузыря, немелкоклеточного рака легкого (NSCLC), рака предстательной железы, рака молочной железы, рака ободочной кишки, рака яичника и рака легкого.
В различных воплощениях изобретения настоящие антитела и их антигенсвязывающие фрагменты можно использовать для прямого уничтожения или абляции раковых клеток in vivo. В прямое уничтожение вовлечено введение антител (которые возможно конъюгированы с цитотоксическим лекарственным средством) субъекту, требующему такого лечения. В различных воплощениях изобретения раковое заболевание содержит раковые клетки, в которых уровень экспрессии PD-1 превышает уровень экспрессии в нераковых клетках ткани, подлежащей сравнительной оценке. Поскольку антитела, распознающие PD-1 на раковых клетках, любые такие клетки, с которыми связываются антитела, разрушаются. Если антитела используют отдельно для уничтожения или абляции раковых клеток, такой киллинг или абляцию можно осуществить посредством инициации эндогенных иммунных функций, таких как CDC и/или ADCC. Количественные анализы по определению, уничтожает ли антитело раковые клетки таким путем, находятся в пределах компетенции специалистов в данной области техники.
В различных воплощениях изобретения настоящие антитела и их антигенсвязывающие фрагменты можно использовать для стимуляции ингибирования роста и/или пролиферации раковой опухолевой клетки. Этими способами можно ингибировать или предотвращать рост раковых клеток у указанного субъекта в такой степени, как, например, на по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%о, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%о. В результате, если раковое заболевание представляет собой солидную опухоль, модулирование может привести к уменьшению размера солидной опухоли на по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%.
Ингибирование пролиферации раковой клетки можно измерить с помощью клеточных анализов, таких как включение бромдезоксиуридина (БДУ) (Hoshino et al, Int. J. Cancer 38, 369, 1986; Campana et al., J. Immunol. Meth. 107:79, 1988; включение [3H]-тимидина (Chen, J., Oncogene 13:1395-403, 1996; Jeoung, J., J. Biol. Chem. 270:18367-73, 1995; краситель аламаровый синий (имеющийся в продаже у компании Biosource International) (Voytik-Harbin et al., In Vitro Cell Dev Biol Anim 34:239-46, 1998). «Безъякорный» рост раковых клеток оценивают путем анализа образования колоний в мягком агар-агаре, например путем подсчета колоний раковых клеток, образующийся на поверхности мягкого агара (см. Примеры и Sambrook et al., Molecular Cloning, Cold Spring Harbor, 1989).
Ингибирование роста раковых клеток у субъекта можно оценивать путем мониторинга роста ракового заболевания у субъекта, например в биологической модели или у человека. Одним из примеров способов мониторинга является анализ туморогенности. В одном из примеров ксенотрансплантат содержит клетки человека из уже существующей опухоли или из опухолевой линии клеток. Анализы ксенотрансплантатов опухоли известны в данной области техники и описаны в настоящем документе (см., например, Ogawa et al., Oncogene 19:6043-6052, 2000). В другом примере мониторинг туморогенности проводят с использованием анализа полых волокон, который описан в патенте U.S. №5698413, который полностью включен в настоящий документ посредством ссылки.
Процент ингибирования рассчитывают путем сравнения пролиферации раковой клетки, «безъякорного» роста или роста раковой клетки на фоне модулирующей терапии и в условиях отрицательного контроля (как правило, в отсутствие модулирующей терапии). Например, если количество раковых клеток или колоний раковых клеток (анализ образования колоний) или включения БДУ или [3Н]-тимидина равно А (на фоне терапии модуляторами) и С (в условиях отрицательного контроля) процент ингибирования будет составлять (С-А)/Сх100%.
Примеры линий опухолевых клеток, полученных из опухолей человека и доступных для применения в исследованиях in vitro и in vivo включают без ограничений линии клеток лейкоза (например, CCRF-CEM, HL-60(ТВ), K-562, MOLT-4, RPM1-8226, SR, Р388 and P388/ADR); линии клеток немелкоклеточного рака легкого (например, А549/АТСС, EKVX, НОР-62, НОР-92, NCI-H226, NCI-H23, NCI-H322M, NCI-H460, NCI-Н522 и LXFL 529); линии клеток мелкоклеточного рака легкого (например, DMS 114 и SHP-77); линии клеток рака ободочной кишки (например, COLO 205, НСС-2998, НСТ-116, НСТ-15, НТ29, КМ12, SW-620, DLD-1 и KM20L2); линии клеток рака центральной нервной системы (ЦНС) (например, SF-268, SF-295, SF-539, SNB-19, SNB-75, U251, SNB-78 и XF 498); линии клеток меланомы (например, LOX I MVI, MALME-3M, М14, SK-MEL-2, SK-MEL-28, SK-MEL-5, UACC-257, UACC-62, RPMI-7951 и M19-MEL); линии клеток рака яичника (например, IGROV1, OVCAR-3, OVCAR-4, OVCAR-5, OVCAR-8 и SK-OV-3); линии клеток рака почки (например, 786-0, А498, ACHN, CAKI-1, RXF 393, SN12C, ТК-10, UO-31, RXF-631 и SN12K1); линии клеток рака предстательной железы (например, РС-3 и DU-145); линии клеток рака молочной железы (например, MCF7, NCI7ADR-RES, MDA-MB-231/АТСС, HS 578Т, MDA-MB-435, ВТ-549, T-47D и MDA-MB-468); и линии клеток рака щитовидной железы (например, SK-N-SH).
В другом аспекте в настоящем изобретении предложены способы лечения инфекционного заболевания у субъекта, включающие введение субъекту терапевтически эффективного количества (либо в виде монотерапии, либо в режиме комбинированной терапии) антитела или его антигенсвязывающего фрагмента по настоящему изобретению. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, вызванное патогенным вирусом. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, вызванное патогенными бактериями. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, вызванное патогенными грибами. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, вызванное патогенным паразитом. В различных воплощениях изобретения у субъекта присутствует инфекционное заболевание, резистентное к лечению, или эффективность лечения с применением традиционных вакцин отсутствует.
«Терапевтически эффективное количество» или «терапевтически эффективная доза» относится к такому количеству вводимого терапевтического агента, которое приведет к облегчению до некоторой степени одного или более симптомов расстройства, подлежащего лечению.
Терапевтически эффективную дозу можно первоначально установить на основании количественных анализов на культурах клеток с определением концентрации, приводящей к ингибированию половины клеток в культуре (IC50). Затем в биологических моделях можно рассчитать дозу, которая позволяет достичь диапазона концентрации в плазме циркулирующей крови, который включает в себя IC50, определенную в культуре клеток. Такую информацию можно использовать для более точного определения полезных доз у человека. Концентрации в плазме крови можно измерить, например, методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Точную композицию, путь введения и дозировку может выбрать индивидуальный врач с учетом состояния субъекта.
Режимы дозирования можно регулировать для обеспечения оптимума желаемого ответа (например, терапевтический или профилактический ответ). Например, можно проводить однократную болюсную инъекцию, можно вводить несколько разделенных доз (либо многократных, либо повторных, либо поддерживающих) за некоторый период времени и пропорционально уменьшать или увеличивать дозу в зависимости от потребностей терапевтической ситуации. Особыми преимуществами обладает приготовление препаратов композиций для парентерального введения в единичной дозированной форме для простоты введения и единообразия дозировки. Единичная дозированная форма при использовании в настоящем документе относится к физически дискретным единицам, соответствующие стандартным дозировкам для лечения субъектов млекопитающих; при этом каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с необходимым фармацевтическим носителем. Спецификация для единичных дозированных форм по настоящему описанию будет определяться, прежде всего, уникальными характеристиками антитела и конкретным терапевтическим или профилактическим эффектом, который должен быть достигнут.
Таким образом, специалисту в данной области техники на основании приведенного в настоящем документе описания должно быть понятно, что дозу и режим дозирования регулируют в соответствии со способами, хорошо известными в области терапии. Таким образом, может быть легко установлена максимальная переносимая доза, а также определено эффективное количество, обеспечивающее определяемую терапевтическую пользу для субъекта, а также временные требования к введению каждого агента для получения определяемой терапевтической пользы для субъекта. Соответственно, хотя в настоящем документе приведены примеры конкретных доз и режимов введения, эти примеры никоим образом не ограничивают дозу и режим введения, которые могут быть предложены субъекту при применении на практике настоящего описания.
Следует отметить, что величины дозировки могут изменяться в зависимости от типа и тяжести состояния, которое нужно облегчить, и могут включать в себя однократные или многократные дозы. Следует дополнительно понимать, что для любого конкретного субъекта конкретные режимы дозирования следует регулировать по времени в соответствии с индивидуальной потребностью и профессиональным мнением специалиста, вводящего или осуществляющего руководство введением композиций, и что приведенные в настоящем документе диапазоны дозировки являются лишь примерами и не предназначены для ограничения объема или применения заявленной композиции на практике. Дополнительно режим дозирования композиций по данному описанию может быть основан на ряде факторов, включающих тип заболевания, возраст, массу тела, пол, медицинское состояние субъекта, тяжесть состояния, путь введения и конкретное используемое антитело. Таким образом, режим дозирования может широко изменяться, но может быть рутинно определено стандартными способами. Например, дозы можно регулировать на основании фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты и/или лабораторные показатели. Таким образом, настоящее описание охватывает наращивание дозы для одного субъекта, как определено специалистом в данной области техники. Определение надлежащих дозировок и режимов хорошо известно в соответствующей области техники, и должно быть понятно, что оно входит в пределы компетенции специалиста в данной области техники на основании предложенных идей настоящего документа.
Для введения субъекту-человеку диапазон общей месячной дозы антител или их антигенсвязывающих фрагментов по описанию может составлять 0,5-1200 мг на субъекта, 0,5-1100 мг на субъекта, 0,5-1000 мг на субъекта, 0,5-900 мг на субъекта, 0,5-800 мг на субъекта, 0,5-700 мг на субъекта, 0,5-600 мг на субъекта, 0,5-500 мг на субъекта, 0,5-400 мг на субъекта, 0,5-300 мг на субъекта, 0,5-200 мг на субъекта, 0,5-100 мг на субъекта, 0,5-50 мг на субъекта, 1-1200 мг на субъекта, 1-1100 мг на субъекта, 1-1000 мг на субъекта, 1-900 мг на субъекта, 1-800 мг на субъекта, 1-700 мг на субъекта, 1-600 мг на субъекта, 1-500 мг на субъекта, 1-400 мг на субъекта, 1-300 мг на субъекта, 1-200 мг на субъекта, 1-100 мг на субъекта или 1-50 мг на субъекта в зависимости от курса лечения и способа введения. Например, для внутривенной месячной дозы может потребоваться примерно 1-1000 мг на субъекта. В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты по описанию можно вводить в количестве примерно 1-200 мг на субъекта, 1-150 мг на субъекта или 1-100 мг на субъекта. Общую месячную дозу можно вводить в однократной или в разделенных дозах, и по решению врача она может выходить за рамки типичных приведенных в настоящем документе диапазонов.
Не имеющий ограничительного характера диапазон суточной дозировки, представляющий собой терапевтически или профилактически эффективное количество антитела или его антигенсвязывающего фрагмента по описанию, может составлять от 0,001 до 100 мг/кг, от 0,001 до 90 мг/кг, от 0,001 до 80 мг/кг, от 0,001 до 70 мг/кг, от 0,001 до 60 мг/кг, от 0,001 до 50 мг/кг, от 0,001 до 40 мг/кг, от 0,001 до 30 мг/кг, от 0,001 до 20 мг/кг, от 0,001 до 10 мг/кг, от 0,001 до 5 мг/кг, от 0,001 до 4 мг/кг, от 0,001 до 3 мг/кг, от 0,001 до 2 мг/кг, от 0,001 до 1 мг/кг, от 0,010 до 50 мг/кг, от 0,010 до 40 мг/кг, от 0,010 до 30 мг/кг, от 0,010 до 20 мг/кг, от 0,010 до 10 мг/кг, от 0,010 до 5 мг/кг, от 0,010 до 4 мг/кг, от 0,010 до 3 мг/кг, от 0,010 до 2 мг/кг, от 0,010 до 1 мг/кг, от 0,1 до 50 мг/кг, от 0,1 до 40 мг/кг, от 0,1 до 30 мг/кг, от 0,1 до 20 мг/кг, от 0,1 до 10 мг/кг, от 0,1 до 5 мг/кг, от 0,1 до 4 мг/кг, от 0,1 до 3 мг/кг, от 0,1 до 2 мг/кг, от 0,1 до 1 мг/кг, от 1 до 50 мг/кг, от 1 до 40 мг/кг, от 1 до 30 мг/кг, от 1 до 20 мг/кг, от 1 до 10 мг/кг, от 1 до 5 мг/кг, от 1 до 4 мг/кг, от 1 до 3 мг/кг, от 1 до 2 мг/кг или от 1 до 1 мг/кг массы тела. Следует отметить, что величины дозировки могут изменяться в зависимости от типа и тяжести состояния, которое нужно облегчить. Следует дополнительно понимать, что для любого конкретного субъекта конкретные режимы дозирования следует регулировать по времени в соответствии с индивидуальной потребностью и профессиональным мнением специалиста, вводящего или осуществляющего руководство введением композиций, и что приведенные в настоящем документе диапазоны дозировки являются лишь примерами и не предназначены для ограничения объема или применения заявленной композиции на практике.
В различных воплощениях изобретения при общей введенной дозе будет достигнута концентрация антитела в плазме крови в диапазоне, наконец, от примерно 1 до 1000 мкг/мл, от примерно 1 до 750 мкг/мл, от примерно 1 до 500 мкг/мл, от примерно 1 до 250 мкг/мл, от примерно 10 до 1000 мкг/мл, от примерно 10 до 750 мкг/мл, от примерно 10 до 500 мкг/мл, от примерно 10 до 250 мкг/мл, от примерно 20 до 1000 мкг/мл, от примерно 20 до 750 мкг/мл, от примерно 20 до 500 мкг/мл, от примерно 20 до 250 мкг/мл, от примерно 30 до 1000 мкг/мл, от примерно 30 до 750 мкг/мл, от примерно 30 до 500 мкг/мл, от примерно 30 до 250 мкг/мл.
Токсичность и терапевтический индекс фармацевтических композиций по изобретению можно определить с помощью стандартных фармацевтических процедур на культурах клеток или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% популяции). Отношение дозы между токсичной и терапевтически эффективной дозой представляет собой терапевтический индекс и может быть выражено в виде отношения LD50/ED50. В целом предпочтительны композиции, которые характеризуются большими терапевтическими индексами.
В различных воплощениях изобретения проводят однократное или многократные введения фармацевтических композиций в зависимости от дозировки и периодичности, требующихся субъекту и переносимых им. В любом случае композиция должна обеспечивать достаточное количество по меньшей мере одного из антител или их антигенсвязывающих фрагментов, описанных в настоящем документе, для эффективного лечения субъекта. Дозировку можно вводить один раз, но применять периодически либо до достижения терапевтического результата, либо до возникновения необходимости в прекращении терапии из-за побочных эффектов.
Периодичность дозирования при введении фармацевтической композиции антитела или его антигенсвязывающего фрагмента зависит от характера терапии и конкретного подлежащего лечению заболевания. Субъекта можно лечить через регулярные интервалы, например, раз в неделю или раз в месяц до достижения желаемого терапевтического результата. Примеры периодичности дозирования включают без ограничений: раз в неделю без перерыва; раз в неделю, каждую следующую неделю; один раз в 2 недели, один раз в 3 недели; раз в неделю без перерыва в течение 2 недель, затем раз в месяц; раз в неделю без перерыва в течение 3 недель, затем раз в месяц; раз в месяц; раз в два месяца; раз в три месяца; раз в четыре месяца; раз в пять месяцев или раз в шесть месяцев или раз в год.
Комбинированная терапия
Используемые в настоящем документе термины «совместное введение», «вводить совместно» и «в комбинации с» по отношению к антителам или их антигенсвязывающим фрагментам по описанию и одному или более других терапевтических агентов предназначены для обозначения, отнесения и включения следующего: одновременное введение субъекту, нуждающемуся в лечении, такой комбинации антител или их антигенсвязывающих фрагментов по описанию и терапевтического(их) агента(ов), когда такие компоненты включены в препарат в одной дозированной форме, из которой указанные компоненты высвобождаются у субъекта по существу одновременно; по существу одновременное введение субъекту, нуждающемуся в лечении, такой комбинации антител или их антигенсвязывающих фрагментов по описанию и терапевтического(их) агента(ов) при включении таких компонентов в препарат отдельно друг от друга в отдельных дозированных формах, которые указанный субъект принимает по существу одновременно, при этом указанные компоненты высвобождаются у субъекта по существу одновременно; последовательное введение субъекту, нуждающемуся в лечении, такой комбинации антител или их антигенсвязывающих фрагментов по описанию и терапевтического(их) агента(ов), когда такие компоненты включены в препарат отдельно друг от друга в отдельных дозированных формах, которые указанный субъект принимает в последовательные моменты времени со значительным интервалом между введениями, при этом указанные компоненты высвобождаются у субъекта по существу в различные моменты времени; и последовательное введение субъекту, нуждающемуся в лечении, такой комбинации антител или их антигенсвязывающих фрагментов по описанию и терапевтического(их) агента(ов) при совместном включении этих компонентов в препарат в одной дозированной форме, из которой указанные компоненты высвобождаются контролируемым образом, при этом они высвобождаются у указанного субъекта одновременно, последовательно и/или в перекрывающиеся периоды времени в одно и то же и/или в различное время, при этом каждую часть можно вводить одним и тем же или различными путями.
В другом аспекте настоящее изобретение относится к различным видам комбинированной терапии, предназначенным для лечения ракового заболевания или инфекционного заболевания у субъекта, включающим введение субъекту терапевтически эффективного количества выделенного антитела или антигенсвязывающего фрагмента по настоящему изобретению, и b) проведение одного или более дополнительных видов терапии, выбранных из группы, состоящей из иммунотерапии, химиотерапии, таргетной терапии низкомолекулярными ингибиторами киназ, хирургического вмешательства, лучевой терапии, протоколов вакцинации и трансплантации стволовых клеток, где комбинированная терапия обеспечивает усиленное уничтожение опухолевых клеток, т.е. при совместном применении выделенного антитела или антигенсвязывающего фрагмента и дополнительных видов терапии они обладают синергетическим действием.
В различных воплощениях изобретения иммунотерапия выбрана из группы, состоящей из: лечения с применением агонистических, антагонистических или блокирующих антител к костимуляторным или коингибиторным молекулам (контрольным точкам иммунитета), таким как PD-1, PD-L1, ОХ-40, CD137, GITR, LAG3, ТГМ-3 и VISTA; лечения с применением биспецифичных привлекающих Т-клетки антител (BiTE®), таких как блинатумомаб: это лечение включает введение модификаторов биологического ответа, таких как IL-2, IL-12, IL-15, IL-21, GM-CSF, IFN-α, IFN-β и IFN-γ; лечения с применением терапевтических вакцин, таких как сипулейцел-Т; лечения с применением дендритно-клеточных вакцин или пептидных вакцин к опухолевому антигену; лечения с применением Т-клеток с химерными антигенными рецепторами (CAR; chimeric antigen receptor); лечения с применением естественных киллеров с химерными антигенными рецепторами (CAR-NK); лечения с применением инфильтрирующих опухоль лимфоцитов (TIL); лечения с применением адоптивного переноса противоопухолевых Т-клеток (размноженных ex vivo и/или трансгенных по Т-клеточному рецептору (TCR)); лечения с применением клеток TALL-104; и лечения с применением иммуностимулирующих агентов, таких как агонисты toll-подобного рецептора (TLR) CpG и имиквимод.
Показано, что противоопухолевой активностью обладает широкий ряд соединений. Эти соединения применяют в качестве фармацевтических агентов в химиотерапии для сокращения солидных опухолей, предотвращения метастазов и дальнейшего роста или уменьшения количества злокачественных Т-клеток при лейкозе или злокачественных опухолях костного мозга. Хотя химиотерапия эффективна при лечении различных типов злокачественных опухолей, многие противоопухолевые соединения вызывают нежелательные побочные эффекты. Показано, что при комбинировании двух и более различных видов лечения эти виды лечения могут обладать синергетическим действием и позволяют уменьшить дозировку в каждом из видов лечения, в результате чего вредные побочные эффекты, оказываемые каждым соединением при более высоких дозировках, уменьшаются. В других случаях рефрактерные к лечению злокачественные опухоли могут отвечать на комбинированную терапию двух или более различных видов лечения.
При одновременном или последовательном введении описанного в настоящем документе антитела или его антигенсвязывающего фрагмента в комбинации с другим традиционным противоопухолевым агентом такое антитело или его антигенсвязывающий фрагмент может усиливать терапевтический эффект противоопухолевого агента или позволяет преодолеть клеточную резистентность к такому противоопухолевому агенту. Это позволяет уменьшить дозировку противоопухолевого агента и, таким образом, уменьшить нежелательные побочные эффекты или восстановить эффективность противоопухолевого агента в резистентных Т-клетках.
Фармацевтические композиции, которые можно применять для комбинированной противоопухолевой терапии, включают только для иллюстрации: аминоглутетимид, амсакрин, анастрозол, аспарагиназу, вакцину БЦЖ, бикалутамид, блеомицин, бусерелин, бусульфан, камптотецин, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, клодронат, колхицин, циклофосфамид, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диенэстрол, диэтилстильбэстрол, доцетаксел, доксорубицин, эпирубицин, эстрадиол, эстрамустин, этопозид, экземестан, филграстим, флударабин, флудрокортизон, фторурацил, флуоксиместерон, флутамид, гемцитабин, генистеин, гозерелин, гидроксимочевина, идарубицин, ифосфамид, иматиниб, интерферон, иринотекан, иронотекан, летрозол, лейковорин, леупролид, левамизол, ломустин, меклоретамин, медроксипрогестерон, мегестрол, мелфалан, меркаптопурин, месна, метотрексат, митомицин, митотан, митоксантрон, нилутамид, нокодазол, остреотид, оксалиплатин, паклитаксел, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралтитрексед, ритуксимаб, стрептозоцин, сурамин, тамоксифен, темозоломид, тенипозид, тестостерон, тиогуанин, тиотепа, титаноцена дихлорид, топотекан, трастузумаб, третиноин, винбластин, винкристин, виндезин и винорельбин.
Эти химиотерапевтические противоопухолевые соединения можно разделить на категории по их механизму действия, например на следующие группы: антиметаболиты/противоопухолевые агенты, такие как аналоги пиримидинов (5-фторурацил, флоксуридин, капецитабин, гемцитабин и цитарабин) и аналоги пуринов, антагонисты фолатов и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин (кладрибин)); антипролиферативные/антимитотические агенты, включая натуральные препараты, такие как винка-алкалоиды (винбластин, винкристин и винорельбин), агенты, разрушающие микротрубочки, такие как таксан (паклитаксел, доцетаксел), винкристин, винбластин, нокодазол, эпотилоны и навельбин, эпидиподофиллотоксины (этопозид, тенипозид), агенты, повреждающие ДНК (актиномицин, амсакрин, антрациклины, блеомицин, бусульфан, камптотецин, карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, цитоксан, дактиномицин, даунорубицин, доксорубицин, эпирубицин, гексаметилмеламиноксалиплатин, ифосфамид, мелфалан, мехлоретамин, митомицин, митоксантрон, нитрозомочевина, пликамицин, прокарбазин, таксол, таксотер, тенипозид, триэтилентиофосфорамид и этопозид (VP16)); антибиотики, такие как дактиномицин (актиномицин D), даунорубицин, доксорубицин (адриамицин), идарубицин, антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин) и митомицин; ферменты (L-аспарагиназа, которая системно метаболизирует L-аспарагин и истощает клетки, не обладающие способностью синтезировать собственный аспарагин); антитромбоцитарные агенты; антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (меклоретамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты - бусульфан, нитрозомочевины (кармустин, BCNU) и аналоги, стрептозоцин), тразены - дакарбазин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевина, митотан, аминоглютетимид; гормоны, аналоги гормонов (эстроген, тамоксифен, гозерелин, бикалутамид, нилутамид) и ингибиторы ароматазы (летрозол, анастрозол); антикоагулянты (гепарин, синтетические соли гепарина и другие ингибиторы тромбина); фибринолитические агенты (такие как активатор тканевого плазминогена, стрептокиназа и урокиназа), аспирин, дипиридамол, тиклопидин, клопидогрель, абциксимаб; агенты, препятствующие миграции; антисекреторные агенты (брефельдин); иммуносупрессивные средства (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, микофенолят мофетил); антиангиогенные соединения (TNP-470, генистеин) и ингибиторы факторов роста (ингибиторы фактора роста эндотелия сосудов (VEGF), ингибиторы фактора роста фибробластов (FGF)); блокатор рецептора ангиотензина; доноры оксида азота; антисенс-олигонуклеотиды; антитела (трастузумаб); ингибиторы клеточного цикла и индукторы дифференцировки (третиноин); ингибиторы mTOR, ингибиторы топоизомеразы (доксорубицин (адриамицин), амсакрин, камптотецин, даунорубицин, дактиномицин, энипозид, эпирубицин, этопозид, идарубицин и митоксантрон, топотекан, иринотекан), кортикостероиды (кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизон и преднизолон); ингибиторы киназ передачи сигналов факторов роста; индукторы митохондриальной дисфункции и активаторы каспаз; и агенты, разрушающие хроматин.
В различных воплощениях изобретения химиотерапия включает химиотерапевтический агент, выбранный из группы, состоящей из: даунорубицина, дактиномицина, доксорубицина, блеомицина, митомицина, азотистого иприта, хлорамбуцила, мелфалана, циклофосфамида, 6-меркаптопурина, 6-тиогуанина, бендамустина, цитарабина (СА), 5-фторурацила (5-FU), флоксуридина (5-FUdR), метотрексата (МТХ), колхицина, винкристина, винбластина, этопозида, тенипозида, цисплатина, карбоплатина, оксалиплатина, пентостатина, кладрибина, цитарабина, гемцитабина, пралатрексата, митоксантрона, диэтилстильбэстрола (DES), флударабина, ифосфамида, гидроксимочевины, таксанов (таких как паклитаксел и доцетаксел) и/или антрациклиновых антибиотиков, а также комбинаций агентов, таких как, но не ограниченных ими, DA-EPOCH, CHOP, CVP или FOLFOX.
В различных воплощениях изобретения таргетная терапия низкомолекулярными ингибиторами киназ включает низкомолекулярный ингибитор киназы, выбранный из группы, состоящей из: ингибитора тирозинкиназы Брутона (ВТК), ингибитора фосфатидилинозитол-3-киназы (PI3K), ингибитора SYK (например, энтосплетиниба), ингибитора AKT, ингибитора mTOR, ингибитора Src, ингибитора JAK/STAT, ингибитора Ras/Raf/MEK/ERK и ингибитора киназы Аврора (см. D'Cruz et al, Expert Opin Pharmacother, 14(6): 707-21, 2013).
В различных воплощениях изобретения комбинированная терапия включает в себя введение антитела или его антигенсвязывающего фрагмента и проведение одного или более дополнительных видов терапии одновременно. В различных воплощениях изобретения введение композиции антитела или его антигенсвязывающего фрагмента и проведение одного или более дополнительных видов терапии осуществляют последовательно, т.е. композицию антитела или его антигенсвязывающего фрагмента вводят либо до, либо после проведения одного или более дополнительных видов терапии.
В различных воплощениях изобретения введение композиции антитела или его антигенсвязывающего фрагмента и проведение одного или более дополнительных видов терапии осуществляют одновременно, т.е. период введения композиции антитела или его антигенсвязывающего фрагмента и проведения одного или более дополнительных видов терапии перекрываются друг с другом.
В различных воплощениях изобретения введение композиции антитела или его антигенсвязывающего фрагмента и проведение одного или более дополнительных видов терапии осуществляют неодновременно. Например, в различных воплощениях изобретения введение композиции антитела или его антигенсвязывающего фрагмента прекращают до проведения одного или более дополнительных видов терапии. В различных воплощениях изобретения проведение одного или более дополнительных видов терапии прекращают до введения композиции антитела или его антигенсвязывающего фрагмента.
При одновременном или последовательном введении описанного в настоящем документе антитела или его антигенсвязывающего фрагмента в комбинации с проведением одного или более дополнительных видов терапии такое антитело или его антигенсвязывающий фрагмент может усиливать терапевтический эффект одного или более дополнительных видов терапии или позволяет преодолеть клеточную резистентность к такому одному или более дополнительных видов терапии. Это позволяет уменьшить дозировку или продолжительность одного или более дополнительных видов терапии, что позволяет за счет этого снизить риск нежелательных побочных эффектов или восстановить действенность одного или более дополнительных видов терапии.
Диагностические применения
В другом аспекте в настоящем изобретении предложен способ обнаружения in vitro или in vivo наличия антигена PD-1 человека в образце, например, для диагностики заболевания человека, связанного с PD-1. В некоторых способах этого достигают путем приведения подлежащего исследованию образца параллельно с контрольным образцом в контакт с последовательностью антитела человека или моноклонального антитела человека по изобретению или с его антигенсвязывающим участком (или с биспецифичной или мультиспецифичной молекулой) в условиях, позволяющих образовать комплекс между антителом и PD-1 человека. Впоследствии в обоих образцах определяют образование комплекса (например, используя метод тИФА), и любое статистически значимое различие между образцами в образовании комплексов указывает на наличие антигена PD-1 человека в исследуемом образце.
В различных воплощениях изобретения предложены способы обнаружения ракового заболевания или подтверждения диагноза ракового заболевания у субъекта. Этот способ включает приведение биологического образца от субъекта в контакт с выделенным антителом или его антигенсвязывающим фрагментом по изобретению и определение связывания выделенного человеческого моноклонального антитела или его антигенсвязывающего фрагмента с образцом. На основании усиления связывания выделенного человеческого моноклонального антитела или его антигенсвязывающего фрагмента с образцом по сравнению со связыванием выделенного человеческого моноклонального антитела или его антигенсвязывающего фрагмента с контрольным образцом определяют раковое заболевание у субъекта или подтверждают диагноз ракового заболевания у субъекта. Контрольный образец может представлять собой образец от субъекта с известным отсутствием ракового заболевания или стандартное значение. Образец может представлять собой любой образец, включая без ограничений ткань биопсии, аутопсии и образцов патологического исследования. Биологические образцы также включают срезы тканей, например замороженные срезы, полученные в целях гистологического исследования. Биологические образцы дополнительно включают жидкости организма, такие как кровь, сыворотка крови, плазма крови, мокрота и спинномозговая жидкость.
В одном воплощении изобретения предложен набор реактивов для определения PD-1 в биологическом образце, таком как образец крови. Наборы реактивов для определения полипептида, как правило, будет содержать человеческое антитело, специфично связывающее PD-1, такое как любое из описанных в настоящем документе антител. В некоторых воплощениях изобретения в набор реактивов включают фрагмент антитела, такой как Fv. Для применений in vivo антитело может представлять собой фрагмент scFv. В дополнительном воплощении изобретения антитело является меченым (например, флуоресцентной, радиоактивной или ферментной меткой).
В одном воплощении изобретения набор реактивов включает в себя материалы инструкций, в которых описаны способы применения антитела, специфично связывающего PD-1. Материалы инструкций могут быть представлены в письменном виде, в электронном виде (таком как компьютерная дискета или компакт-диск) или могут быть визуальными (такими как видеофайлы). Наборы реактивов также могут включать в себя дополнительные компоненты, способствующими конкретному применению, для которого предназначен этот набор реактивов. Так, например, набор реактивов может дополнительно содержать средства обнаружения метки (такие как субстраты ферментов для ферментных меток, комплекты фильтров для обнаружения флуоресцентных меток, соответствующие вторичные метки, такие как вторичное антитело, и т.п.). Наборы реактивов могут дополнительно включать в себя буферы и другие реактивы, рутинно используемые для осуществления конкретного способа на практике. Такие наборы и их соответствующее содержимое хорошо известны специалистам в данной области техники.
В одном воплощении изобретения диагностический набор реактивов включает в себя иммунологический анализ. Хотя подробное содержание иммунологических анализов может различаться в зависимости от конкретного используемого формата, способ определения PD-1 в биологическом образце в целом включает стадии приведения биологического образца в контакт с антителом, которое специфично взаимодействует с PD-1 в условиях иммунологической реактивности. Антителу позволяют специфично связаться в условиях иммунологической реактивности для образования иммунного комплекса, и присутствие иммунного комплекса (связанного антитела) определяют прямо или косвенно.
В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты для диагностических целей могут быть мечеными или немечеными. Как правило, диагностические анализы приводят к обнаружению образования комплекса в результате связывания антитела с PD-1. Антитела могут быть непосредственно меченными. Можно использовать различные метки, включающие без ограничений радионуклиды, флуоресцентные метки, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов и лиганды (например, биотин, гаптены). Многочисленные подходящие иммунологические анализы известны специалисту в данной области техники (см., например, патенты U.S. №№3817827; 3850752; 3901654; и 4098876). В случае немеченых антител их можно использовать в таких анализах, как анализы агглютинации. Немеченые антитела можно также использовать в комбинации с другим (одним или более) подходящим реактивом, который можно использовать для определения антитела, такого как меченое антитело (например, второе антитело), способное реагировать с первым антителом (например, антиидиотипические антитела или другие антитела, специфичные к немеченому иммуноглобулину), или другой подходящий реактив (например, меченый белок А).
Предложенные в настоящем документе антитело или его антигенсвязывающий фрагмент можно также использовать в способе определения подверженности млекопитающего определенному заболеванию. В качестве иллюстрации этот способ можно использовать для определения подверженности млекопитающего заболеваниям, прогрессирование которых зависит от количества присутствующего в клетках PD-1 и/или от количества PD-1-положительных клеток у млекопитающего. В одном воплощении изобретения предложено применение способа определения подверженности млекопитающего опухоли. В этом воплощении изобретения подлежащий исследованию образец приводят в контакт с антителом, которое связывается с PD-1 или его участком в условиях, подходящих для связывания с ним указанного антитела, где образец содержит клетки, экспрессирующие PD-1 у нормальных индивидов. Определяемое связывание антитела и/или количество связывания указывает на подверженность индивида опухоли, где высокие уровни рецептора коррелируют с повышенной подверженностью индивида опухоли.
В различных воплощениях изобретения антитела или их антигенсвязывающие фрагменты присоединены к метке, которую можно обнаружить (например, метка может представлять собой радиоактивный изотоп, флуоресцентное соединение, фермент или кофактор фермента). Активная группировка может представлять собой радиоактивный агент, такой как: радиоактивные тяжелые металлы, такие как хелаты железа, радиоактивные хелаты гадолиния или марганца, испускающие позитроны изотопы кислорода, азота, железа, углерода или галлия, 43K, 52Fe, 57Со, 67Cu, 67Ga, 68Ga, 123I, 125I, 131I, 132I или 99Тс. Связывающий агент, прикрепленный к такой группировке, можно использовать в качестве агента визуализации и вводить в количестве, эффективном для диагностического применения у млекопитающего, такого как человек, а затем определять локализацию и накопление агента визуализации. Локализацию и накопление агента визуализации можно определить методами радиосцинтиграфии, ядерно-магнитно-резонансной визуализации, компьютерной томографии или позитронно-эмиссионной томографии.
Для определения и/или диагностики раковых заболеваний и сосудистой системы можно использовать иммуносцинтиграфию с использованием антител или антигенсвязывающих фрагментов, направленных на PD-1. Например, для такой визуализации можно эффективно использовать моноклональные антитела к маркеру PD-1, меченные технецием-99, индием-111 или йодом-125. Как будет очевидно специалистам в данной области техники, количество радиоизотопа, которое следует вводить, зависит от радиоактивного изотопа. Обычный специалист в данной области техники может легко установить количество агента визуализации, которое следует вводить, на основании его удельной активности и энергии данного радионуклида в качестве активной группировки. Как правило, вводят 0,1-100 милликюри, или 1-10 милликюри, или 2-5 милликюри агента визуализации на дозу. Таким образом, описанные композиции полезны в качестве агентов визуализации, содержащих нацеливающую группировку, конъюгированную с радиоактивной группировкой, содержащей 0,1-100 милликюри, в некоторых воплощениях 1-10 милликюри, в некоторых воплощениях 2-5 милликюри, в некоторых воплощениях 1-5 милликюри.
Иммуноконъюгаты
В заявке дополнительно предложены иммуноконъюгаты, содержащие антитело или его антигенсвязывающий фрагмент по настоящему изобретению, конъюгированные (или связанные) с эффекторной молекулой непосредственно или опосредованно. В этом отношении «конъюгированный» или «связанный» относится к получению из двух полипептидов одной непрерывной молекулы полипептида. Эта связь может быть создана либо химическими, либо рекомбинантными методами. В одном воплощении изобретения эта связь является химической, где в результате взаимодействия между группировкой антитела и эффекторной молекулой образуется ковалентная связь между этими двумя молекулами с образованием одной молекулы. Между антителом и эффекторной молекулой может быть возможно включен пептидный линкер (короткая пептидная последовательность). В различных воплощениях изобретения антитело или его антигенсвязывающий фрагмент присоединены к эффекторной молекуле. В других воплощениях изобретения к антителу или антигенсвязывающему фрагменту, присоединенным к эффекторной молекуле, дополнительно присоединен липид, белок или пептид, чтобы увеличить его период полувыведения в организме. В соответствии с различными воплощениями изобретения антитела по настоящему описанию можно использовать для доставки различных эффекторных молекул.
Эффекторная молекула может представлять собой обнаружимую метку, иммунотоксин, цитокин, хемокин, терапевтический агент или химиотерапевтический агент.
Конкретные, не имеющие ограничительного характера примеры иммунотоксинов включают без ограничений абрин, рицин, экзотоксин псевдомонад (РЕ, такой как РЕ35, РЕ37, РЕ38 и РЕ40), дифтерийный токсин (DT), ботулотоксин, холерный токсин или их модифицированные токсины, либо другие токсические агенты, прямо или косвенно ингибирующие рост или уничтожающие клетки.
«Цитокин» представляет собой класс белков или пептидов, высвобождаемых одной популяцией клеток, действующие на другие клетки как межклеточные медиаторы. Цитокины могут действовать как иммуномодулирующий агент. Примеры цитокинов включают лимфокины, монокины, факторы роста и традиционные полипептидные гормоны. Таким образом, в воплощениях изобретения можно использовать интерферон (например, IFN-α, IFN-β и IFN-γ); представитель суперсемейства факторов некроза опухоли (TNFSF); гормон роста человека; тироксин; инсулин; проинсулин; релаксин; прорелаксин; фолликулостимулирующий гормон (ФСГ); тиреотропный гормон (ТТГ); лютеинизирующий гормон (ЛГ); печеночный фактор роста; простагландин, фактор роста фибробластов; пролактин; плацентарный лактоген, белок OB; TNF-α; TNF-β; интегрин; тромбопоэтин (ТПО); фактор роста нервов, такой как NGF-β; фактор роста фибробластов; TGF-α; TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (ЭПО); колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF); интерлейкин (IL-1 - IL-21), набор комплексов белок-лиганд или FLT-3, ангиостатин, тромбоспондин или эндостатин. Эти цитокины включают белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативной последовательностью.
Хемокины можно также конъюгировать с антителами, описанными в настоящем документе. Хемокины представляют собой суперсемейство низкомолекулярных (приблизительно от примерно 4 до примерно 14 кДа), индуцибельных и секретируемых провоспалительных цитокинов, которые действуют в основном как хемоаттрактанты и активаторы специфичных подтипов лимфоцитов. Продуцирование хемокинов индуцируют воспалительные цитокины, факторы роста и патогенные стимулы. Хемокиновые белки разделяют на подсемейства (альфа, бета и дельта) на основании консервативных мотивов аминокислотной последовательности и классифицируют на четыре высоко консервативных группы - СХС, СС, С и СХ3С - на основании положения первых двух цистеинов, примыкающих к амино-концу. К настоящему времени открыто более 50 хемокинов, и у человека существует по меньшей мере 18 рецепторов хемокинов с семью трансмембранными доменами (7ТМ). Используемые хемокины включают без ограничений RANTES, MCAF, МСР-1 и фракталкин.
Терапевтический агент может представлять собой химиотерапевтический агент. Специалист в данной области техники может легко идентифицировать химиотерапевтический агент для использования (см., например, Slapak and Kufe, Principles of Cancer Therapy, Chapter 86 in Harrison's Principles of Internal Medicine, 14th edition; Perry et al., Chemotherapy, Ch. 17 in Abeloff, Clinical Oncology 2.sup.nd ed., COPYRIGHT. 2000 Churchill Livingstone, Inc; Baltzer L., Berkery R. (eds): Oncology Pocket Guide to Chemotherapy, 2nd ed. St. Louis, Mosby-Year Book, 1995; Fischer D S, Knobf M F, Durivage H J (eds): The Cancer Chemotherapy Handbook, 4th ed. St. Louis, Mosby-Year Book, 1993). Полезные химиотерапевтические агенты для получения иммуноконъюгатов включают ауристатин, доластатин, ММАЕ, MMAF, AFP, DM1, АЕВ, доксорубицин, даунорубицин, метотрексат, мелфалан, хлорамбуцил, винка-алкалоиды, 5-фторуридин, митомицин-С, таксол, L-аспарагиназу, меркаптопурин, тиогуанин, гидроксимочевину, цитарабин, циклофосфамид, ифосфамид, нитрозомочевины, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбазин, топотекан, азотистые иприты, цитоксан, этопозид, BCNU, иринотекан, камптотецины, блеомицин, идарубицин, дактиномицин, пликамицин, митоксантрон, аспарагиназу, винбластин, винкристин, винорельбин, паклитаксел и доцетаксел и их соли, сольваты и производные. В различных воплощениях изобретения химиотерапевтический агент представляет собой ауристатин Е (также известный в данной области техники как доластатин-10) или его производное, а также их фармацевтически приемлемые соли или сольваты. Типичные производные ауристатина включают DM1, АЕВ, AEVB, AFP, MMAF и ММАЕ. Синтез и структура ауристатина Е и его производных, а также линкеров описаны, например, в публикации заявки на патент U.S. №20030083263; публикации заявки на патент U.S. №20050238629; и в патенте U.S. №6884869 (каждое из которых полностью включено в настоящий документ посредством ссылки). В различных воплощениях изобретения терапевтический агент представляет собой ауристатин или производное ауристатина. В различных воплощениях изобретения производное ауристатина представляет собой довалин-валин-долаизолейцин-долапролин-фенилаланин (MMAF) или монометилауристатин Е (ММАЕ). В различных воплощениях изобретения терапевтический агент представляет собой майтанзиноид или аналог майтанзинола. В различных воплощениях изобретения майтанзиноид представляет собой DM1.
Эффекторные молекулы могут быть связаны с антителом или антигенсвязывающим фрагментом по настоящему изобретению с использованием любого количества способов, известных специалистам в данной области техники. Можно использовать способы как ковалентного, так и нековалентного присоединения. Методика присоединения эффекторной молекулы к антителу изменяется в соответствии с химической структурой эффекторной молекулы. Полипептиды, как правило, содержат ряд функциональных групп; таких как карбоксильная (СООН), свободная аминная (-NH2) или сульфгидрильная (--SH) группы, доступных для взаимодействия с подходящей функциональной группы на антителе, приводящего в результате к связыванию эффекторной молекулы. Альтернативно получают производное антитела, чтобы открыть или присоединить дополнительные реакционноспособные функциональные группы. В получение производного может быть вовлечено присоединение любого количества линкерных молекул, таких как имеющиеся в продаже от Pierce Chemical Company, Rockford, Ill. Линкер может представлять собой любую молекулу, используемую для присоединения антитела к эффекторной молекуле. Линкер способен к образованию ковалентных связей, как с антителом, так и с эффекторной молекулой. Подходящие линкеры хорошо известны специалистам в данной области техники и включают без ограничений прямоцепочечные или разветвленные углеродные линкеры, гетероциклические углеродные линкеры или пептидные линкеры. Если антитело и эффекторная молекула представляют собой полипептиды, линкеры могут быть присоединены к соответствующим аминокислотам посредством их боковых групп (например посредством дисульфидной связи с цистеином) или к альфа-атому углерода амино- и карбоксильных групп концевых аминокислот.
В некоторых обстоятельствах желательно освободить эффекторную молекулу от антитела после того, как иммуноконъюгат прореагировал со своим сайтом-мишенью. Таким образом, в этих обстоятельствах иммуноконъюгаты будут содержать связи, расщепляемые вблизи сайта-мишени. Расщепление линкера для высвобождения эффекторной молекулы из антитела можно стимулировать посредством ферментативной активности или условий, воздействующих на иммуноконъюгат либо внутри клетки-мишени, либо вблизи сайта-мишени.
Методики конъюгации антител с эффекторными молекулами описаны ранее и находятся в пределах компетенции специалиста в данной области техники. Например, методики получения ферментативно активных полипептидов иммунотоксинов описаны в WO 84/03508 и WO 85/03508, которые включены в настоящий документ посредством ссылки в целях использования их определенных идей. Другие методы описаны в Shih et al., Int. J. Cancer 41:832-839 (1988); Shih et al., Int. J. Cancer 46:1101-1106 (1990); Shih et al., патент U.S. №5057313; Shih Cancer Res. 51:4192, международная публикация WO 02/088172; патент U.S. №6884869; международная публикация патента WO 2005/081711; публикация заявки на патент U.S. 2003-0130189 А; и заявка на патент US №20080305044, каждое из которых включено в настоящий документ посредством ссылки для цели обучения таким методам.
Иммуноконъюгат по настоящему изобретению сохраняет иммунореактивность антитела или его антигенсвязывающего фрагмента, например, антитело или его антигенсвязывающий фрагмент обладают приблизительно такой же или незначительно сниженной способностью к связыванию антигена после конъюгации, как и до конъюгации. При использовании в настоящем документе иммуноконъюгат также называют конъюгатом антитело-лекарственное средство (ADC).
Биспецифичные молекулы
В другом аспекте признаком настоящего изобретения являются биспецифичные молекулы, содержащие антитело к PD-1 или его антигенсвязывающий фрагмент по изобретению. Антитело по изобретению или его антигенсвязывающий фрагмент могут быть преобразованы в их производные или связаны с другой функциональной молекулой, например с другим пептидом или белком (например, с другим антителом или лигандом к рецептору) с образованием биспецифичной молекулы, которая связывается с по меньшей мере двумя различными сайтами связывания или молекулами-мишенями. Фактически антитело по изобретению может быть преобразовано в его производное или связано с более чем одной другой функциональной молекулой с образованием мультиспецифичных молекул, которые связываются с более чем двумя различными сайтами связывания и/или молекулами-мишенями; для таких мультиспецифичных молекул также предусмотрено включение в объем термина «биспецифичная молекула», используемого в настоящем документе. Чтобы создать биспецифичную молекулу по изобретению, антитело по изобретению может быть функционально связано (например, путем химического сочетания, генетической конъюгации, нековалентного связывания или другого) с одной или более других связывающих молекул, таких как другое антитело, фрагмент антитела, пептид или связывающий миметик, так чтобы получить в результате биспецифичную молекулу. В различных воплощениях изобретение включает биспецифичные молекулы, способные к связыванию как с эффекторными клетками, экспрессирующими FcγR или FcαR (например, моноцитами, макрофагами или полиморфноядерными клетками (PMN)), так и с клетками-мишенями, экспрессирующими PD. В таких воплощениях изобретения биспецифичные молекулы нацеливают PD-1-экспрессирующие клетки на эффекторную клетку и запускают опосредованные рецептором Fc активности эффекторных клеток, например фагоцитоз PD-1-экспрессирующих клеток, антителозависимую клеточно-опосредованную цитотоксичность (ADCC), высвобождение цитокинов или образование супероксидного аниона. Способы получения биспецифичных молекул по настоящему изобретению хорошо известны в данной области техники.
Полинуклеотиды и экспрессия антитела
В заявке дополнительно предложены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело к PD-1 или его антигенсвязывающий фрагмент. В связи с вырожденностью генетического кода аминокислотную последовательность каждого антитела кодируют различные нуклеиново-кислотные последовательности. В заявке дополнительно предложены полинуклеотиды, которые гибридизуются с полинуклеотидами, кодирующими антитело, связывающееся с PD-1, в жестких условиях или в условиях низкой жесткости гибридизации, например, как определено в настоящем документе.
Жесткие условия гибридизации включают без ограничений гибридизацию связанной на фильтре ДНК в 6-кратном буфере SSC при температуре примерно 45°С, за которой следует одна или более отмывок в 0,2-кратном SSC с 0,1% додецилсульфатом натрия (SDS) при температуре примерно 50-65°С, условия высокой жесткости, такие как гибридизация связанной на фильтре ДНК в 6-кратном буфере SSC при температуре примерно 45°С, за которой следует одна или более отмывок в 0,1-кратном SSC с 0,2% SDS при температуре примерно 60°С или другие жесткие условия гибридизации, известные специалистам в данной области техники (см., например, Ausubel, F. М. et al., eds. 1989 Current Protocols in Molecular Biology, vol. 1, Green Publishing Associates, Inc. and John Wiley and Sons, Inc., NY на страницах 6.3.1 - 6.3.6 и 2.10.3).
Полинуклеотиды могут быть получены и определены их нуклеотидные последовательности любым способом, известным в данной области техники. Например, если известна нуклеотидная последовательность антитела, полинуклеотид, кодирующий это антитело, может быть собран из олигонуклеотидов, синтезированных химическим путем (например, как описано в Kutmeier et al., BioTechniques 17:242 (1994)), который в кратком описании включает синтез перекрывающихся олигонуклеотидов, содержащих участки кодирующей антитело последовательности, отжиг и лигирование этих олигонуклеотидов с последующей амплификацией лигированных олигонуклеотидов методом ПЦР. В одном воплощении изобретения используемые кодоны включают в себя кодоны, типичные для человека и мыши (см., например, Nakamura, Y., Nucleic Acids Res. 28: 292 (2000)).
Полинуклеотид, кодирующий антитело, может быть также получен из нуклеиновой кислоты из подходящего источника. В случае недоступности клона, содержащего кодирующую конкретное антитело нуклеиновую кислоту, при наличии известной последовательности молекулы антитела кодирующую иммуноглобулин нуклеиновую кислоту можно синтезировать химическим путем или получить из подходящего источника (например, библиотеки кДНК антител или библиотеки кДНК, полученной из любых экспрессирующих антитело ткани или клеток, таких как клетки гибридомы, отобранные для экспрессии антитела, либо полученной из них нуклеиновой кислоты, предпочтительно выделенной из них поли-А+ РНК) путем амплификации методом ПЦР с использованием синтетических праймеров к 3' и 5' концам последовательности или путем клонирования с использованием олигонуклеотидного зонда, специфичного к последовательности конкретного гена для идентификации, например, клона кДНК из кодирующей антитело библиотеки кДНК. Впоследствии амплифицированные нуклеиновые кислоты, полученные методом ПЦР, можно клонировать в реплицирующихся клонирующих векторах, используя любой известный в данной области техники способ.
Настоящее изобретение также относится к клеткам-хозяевам, экспрессирующим полипептид PD-1 и/или антитела к PD-1 по изобретению. Для экспрессии антитела по настоящему изобретению можно использовать широкий ряд экспрессионных систем в клетках-хозяевах, известных в данной области техники, включая прокариотические (бактериальные) и эукариотические экспрессионные системы (такие как дрожжи, бакуловирус, клетки растений, млекопитающих и других животных, трансгенные животные и клетки гибридомы), а также экспрессионные системы фагового дисплея.
Антитело по изобретению может быть получено путем рекомбинантной экспрессии генов легкой и тяжелой цепей иммуноглобулина в клетке-хозяине. Для экспрессии антитела рекомбинантным способом клетку-хозяина трансформируют, трансдуцируют, инфицируют и т.п. одним или более рекомбинантных экспрессионных векторов, несущих фрагменты ДНК, кодирующие легкие и/или тяжелые цепи иммуноглобулина антитела, таким образом, что легкая и/или тяжелая цепь экспрессируется в клетке-хозяине. Тяжелая цепь и легкая цепь могут быть экспрессированы независимо с разных промоторов, с которыми они функционально связаны, в одном векторе, либо альтернативно тяжелая цепь и легкая цепь могут быть экспрессированы независимо с разных промоторов, с которыми они функционально связаны, в двух векторах, где в одном экспрессируется тяжелая цепь, и в одном экспрессируется легкая цепь. Возможно тяжелая цепь и легкая цепь могут быть экспрессированы в разных клетках-хозяевах.
Дополнительно рекомбинантный экспрессионный вектор может кодировать сигнальный пептид, способствующий секреции легкой и/или тяжелой цепи антитела из клетки-хозяина. Ген легкой и/или тяжелой цепи антитела можно клонировать в векторе так, что ген сигнального пептида функционально связан с геном цепи антитела в одной рамке считывания, соответствующей его амино-концу. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид. Предпочтительно рекомбинантные антитела секретируются в питательную среду, в которой культивируют клетки-хозяева и из которой можно выделить или очистить антитела.
Выделенную ДНК, кодирующую HCVR, можно преобразовать в полноразмерный ген тяжелой цепи путем функционального связывания кодирующей ДНК HCVR с другой молекулой ДНК, кодирующей константные области тяжелой цепи. Последовательности генов константной области тяжелой цепи человека, а также других млекопитающих известны в данной области техники. Фрагменты ДНК, включающие в себя эти области, могут быть получены, например, путем амплификации стандартным методом ПНР. Константная область тяжелой цепи может представлять собой константную область любого типа (например, IgG, IgA, IgE, IgM или IgD), класса (например, IgG1, IgG2, IgG3 and IgG4) или подкласса или любой ее аллотипический вариант, как описано в работе Кабата (Kabat) (см. выше).
Выделенную ДНК, кодирующую LCVR, можно преобразовать в полноразмерный ген легкой цепи (а также в ген Fab-фрагмента легкой цепи) путем функционального связывания кодирующей ДНК LCVR с другой молекулой ДНК, кодирующей константную область легкой цепи. Последовательности генов константной области легкой цепи человека, а также других млекопитающих известны в данной области техники. Фрагменты ДНК, включающие в себя эти области, могут быть получены путем амплификации стандартным методом ПНР. Константная область легкой цепи может представлять собой константную область каппа или лямбда.
В дополнение к гену (генам) тяжелой и/или легкой цепи антитела рекомбинантный экспрессионный вектор по изобретению несет регуляторные последовательности, контролирующие экспрессию гена (генов) цепи антитела в клетке-хозяине. Термин «регуляторная последовательность» подразумевают как включающий в себя промоторы, энхансеры и по мере необходимости другие контрольные элементы экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию гена (генов) цепи антитела. Конструирование экспрессионного вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, уровень экспрессии желаемого белка. Предпочтительные регуляторные последовательности для экспрессии клеток-хозяев млекопитающих, включают вирусные элементы, обеспечивающие высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, происходящие от цитомегаловируса (CMV), обезьяньего вируса 40 (SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и/или полиомавируса.
Кроме того, рекомбинантные экспрессионные векторы по изобретению могут нести дополнительные последовательности, такие как последовательности, регулирующие репликацию вектора в клетках-хозяевах (например, точки начала репликации) и один или более селективных генов-маркеров. Селективный ген-маркер способствует отбору клеток-хозяев, в которые введен вектор. Например, как правило, селективный ген-маркер придает клеткам-хозяевам, в которые введен вектор, устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные селективные гены-маркеры включают ген дигидрофолатредуктазы (dhfr) (для использования в отрицательных по dhfr клетка-хозяевах для отбора/амплификации с метотрексатом), ген пео (для отбора с G418) и глутаминсинтетазы (GS) в GS-отрицательной линии клеток (такой как NSO) для отбора/амплификации.
Для экспрессии легких и/или тяжелых цепей экспрессионный(ые) вектор(ы), кодирующий(ие) тяжелые и/или легкие цепи, вводят в клетку-хозяина стандартными методами, например электропорации, кальцийфосфатной преципитации, трансфекции с ДЭАЭ-декстраном, трансдукции, инфекции и т.п. Хотя экспрессия антител по изобретению теоретически возможна либо в прокариотических, либо в эукариотических клетках-хозяевах, предпочтительны эукариотические клетки-хозяева, и наиболее предпочтительны клетки-хозяева млекопитающих, поскольку в таких клетках наиболее вероятна сборка и секреция правильно свернутого и иммунологически активного антитела. Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичника китайского хомячка (СНО), включая dhfr-отрицательные клетки СНО, как описано в работе Urlaub and Chasin, Proc. Natl. Acad. Sci. USA 77:4216-20, 1980, используемые с селективным маркером DHFR, например, как описано в работе Kaufman and Sharp, J. Mol. Biol. 159:601-21, 1982, клетки миеломы NSO, клетки COS и клетки SP2/0. При введении рекомбинантных экспрессионных векторов в клетки-хозяева млекопитающих антитела получают путем культивирования клеток-хозяев в течение достаточного периода времени, позволяющего экспрессировать антитело в клетках-хозяевах или более предпочтительно секретировать антитело в культуральной среде, в которой клетки-хозяева выращивают в надлежащих условиях, известных в данной области техники. Антитела могут быть выделены из клетки-хозяина и/или культуральной среды с использованием стандартных способов очистки.
В изобретении предложена клетка-хозяин, содержащая молекулу нуклеиновой кислоты по настоящему изобретению. Предпочтительно клетка-хозяин по изобретению содержит один или более векторов или конструкций, содержащих молекулу нуклеиновой кислоты по настоящему изобретению. Например, клетка-хозяин по изобретению представляет собой клетку, в которую введен вектор по изобретению, где указанный вектор содержит полинуклеотид, кодирующий LCVR антитела по изобретению и/или полинуклеотид, кодирующий HCVR антитела по изобретению. В изобретении также предложена клетка-хозяин, в которую введены два вектора по изобретению, один из которых содержит полинуклеотид, кодирующий LCVR антитела по изобретению, а один содержит полинуклеотид, кодирующий HCVR, присутствующую в антителе по изобретению, и каждый функционально связан с энхансерным/промоторным регуляторными элементами (например, полученными из SV40, CMV, аденовируса и т.п., такими как регуляторный элемент, представляющий собой энхансер CMV/промотор AdMLP или энхансер SV40/промотор AdMLP) для обеспечения высоких уровней транскрипции этих генов.
После экспрессии интактные антитела, отдельные легкие и тяжелые цепи или другие формы иммуноглобулина по настоящему изобретению могут быть очищены в соответствии со стандартными методиками данной области техники, включая осаждение сульфатом аммония, ионный обмен, аффинность (например, белок А), гидрофобную колоночную хроматографию с обращенной фазой, хроматографию на гидроксиапатите, гель-электрофорез и т.п. Стандартные методы очистки терапевтических антител описаны авторами Feng L1, Joe X. Zhou, Xiaoming Yang, Tim Tressel и Brian Lee в статье, озаглавленной «Current Therapeutic Antibody Production and Process Optimization)) (BioProcessing Journal, сентябрь/октябрь 2005 г. ), полностью включенной посредством ссылки в целях обучения очистки терапевтических антител. Кроме того, в данной области техники также известны стандартные методы удаления вирусов из препаратов рекомбинантно экспрессированных антител (см., например, работу Gerd Kern и Mani Krishnan «Viral Removal by Filtration: Points to Consider)) (Biopharm International, октябрь 2006 г. )). Известно, что эффективность фильтрования вирусов из препаратов терапевтических антител по меньшей мере частично зависит от концентрации белка и/или антитела в фильтруемом растворе. Способ очистки антител по настоящему изобретению может включать стадию фильтрования для удаления вирусов из основного потока одной или более операций хроматографии. Предпочтительно перед фильтрованием через нанофильтр фармацевтической степени чистоты для удаления вирусов основной поток после хроматографии, содержащий антитело по настоящему изобретению, разводят или концентрируют с получением общей концентрации белка и/или общей концентрации антитела от примерно 1 г/л до примерно 3 г/л. Даже более предпочтительно нанофильтр представляет собой нанофильтр DV20 (например, Pall Corporation; East Hills, N.Y.). Для фармацевтических применений предпочтительны по существу чистые иммуноглобулины с гомогенностью по меньшей мере примерно 90%, примерно 92%, примерно 94%) или примерно 96%, и наиболее предпочтительно от примерно 98 до примерно 99% или более. После очистки антител до желаемой частичной или полной гомогенности стерильные антитела можно применять терапевтически, как указано в настоящем документе.
В свете приведенного выше обсуждения настоящее изобретение дополнительно относится к антителу, которое может быть получено способом, включающим стадии культивирования клетки-хозяина, включающей без ограничений клетку млекопитающего, растения, бактерии, трансгенного животного или трансгенного растения, трансформированную полинуклеотидом или вектором, содержащим молекулы нуклеиновой кислоты, кодирующие антитела по изобретению, таким образом, чтобы нуклеиновая кислота экспрессировалась, и возможно выделения антитела из культуральной среды клетки-хозяина.
В некоторых аспектах в настоящей заявке предложены линии клеток гибридомы, а также моноклональные антитела, продуцируемые этими клетками гибридомы. Описанные линии клеток имеют другие применения, кроме продукции моноклональных антител. Например, линии клеток могут быть конъюгированы с другими клетками, такими как содержащие маркеры лекарственных средств клетки миеломы человека, миеломы мыши, гетеромиеломы человека и мыши или лимфобластоидные клетки человека, с получением дополнительных гибридом и, таким образом, обеспечением переноса генов, кодирующих моноклональные антитела. Кроме того, линии клеток можно использовать в качестве источников нуклеиновых кислот, кодирующих цепи иммуноглобулина к PD-1, которые могут быть выделены и экспрессированы (например, в условиях переноса в другие клетки с использованием любого подходящего метода (см., например, Cabilly et al., патент U.S. №4816567; Winter, патент U.S. №5225539)). Например, можно выделить клоны, содержащие перегруппированную легкую или тяжелую цепь антитела к PD-1 (например, методом ПНР), или получить библиотеки кДНК из мРНК, выделенной из этих линий клеток, и можно выделить клоны кДНК, кодирующие цепь иммуноглобулина антитела к PD-1. Таким образом, можно получить нуклеиновые кислоты, кодирующие тяжелые и/или легкие цепи антител или их участков, и использовать их в соответствии с методами рекомбинантных ДНК для получения конкретного иммуноглобулина, цепи иммуноглобулина или их вариантов (например, гуманизированных иммуноглобулинов) в различных Т-клетках-хозяевах или в системе трансляции in vitro. Например, нуклеиновые кислоты, включая кДНК, или их производные, кодирующие варианты, такие как гуманизированный иммуноглобулин или цепь иммуноглобулина, можно помещать в подходящие прокариотические или эукариотические векторы (например, экспрессионные векторы) и вводить в подходящие Т-клетки-хозяева надлежащим способом (например, трансформации, трансфекции, электропорации, инфекции) таким образом, чтобы нуклеиновая кислота была функционально связана с одним или более контрольных элементов экспресии (например, в векторе или интегрированные в геном Т-клетки-хозяина). Для продуцирования Т-клетки-хозяева можно поддерживать в условиях, подходящих для экспрессии (например, в присутствии индуктора, в подходящей среде с добавлением соответствующих солей, факторов роста, антибиотиков, питательных добавок и т.Д.), в результате чего получают кодируемый полипептид. При желании кодируемый белок может быть выделен и/или изолирован, например, из Т-клеток-хозяев или из питательной среды. Должно быть понятно, что способ получения включает в себя экспрессию в Т-клетке-хозяине трансгенного животного (см., например, публикацию WO 92/03918, GenPharm International от 19 марта 1992 г.) (полностью включена посредством ссылки).
Клетки-хозяева можно также использовать для получения участков или фрагментов интактных антител, например Fab-фрагментов или молекул scFv, методами, которые являются традиционными. Например, может быть желательна трансфекция клетки-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь антитела по изобретению. Технологию рекомбинантных ДНК можно также использовать для удаления некоторой или всей ДНК, кодирующей любую из тяжелой и легкой цепи или обе цепи, которая не является необходимой для связывания с PD-1 человека. Антитела по изобретению также включают в себя молекулы, экспрессируемые с таких укороченных молекул ДНК.
Способы экспрессии одноцепочечных антител и/или повторного свертывания в соответствующую активную форму, включая одноцепочечные антитела из бактерий, таких как Е. coli, описаны и хорошо известны и применимы к описанным в настоящем документе антителам (см., например, Buchner et al., Anal. Biochem. 205:263-270, 1992; Pluckthun, Biotechnology 9:545, 1991; Huse et al., Science 246:1275, 1989 и Ward et al., Nature 341:544, 1989, все публикации включены в настоящий документ посредством ссылки).
Функциональные гетерологичные белки из Е. coli или других бактерий чаще всего выделяют из телец включения, и требуется их солюбилизация с использованием сильных детергентов и последующий рефолдинг. В ходе стадии солюбилизации, как хорошо известно в данной области техники, должен присутствовать восстанавливающий агент для разделения дисульфидных связей. Примером буфера для восстанавливающего агента является: 0,1 М Трис рН 8, 6 М гуанидина, 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 0,3 М дитиотрейтола (ДТЭ). Повторное окисление дисульфидных связей может осуществляться в присутствии низкомолекулярных тиольных реактивов в восстановленной и окисленной форме, как описано в работе Saxena et al., Biochemistry 9: 5015-5021, 1970, включенной в настоящий документ посредством ссылки, и, в частности, как описано в работе Buchner et al., см. выше.
Ренатурацию, как правило, осуществляют путем разведения (например, 100-кратного) денатурированного и восстановленного белка в буфере для рефолдинга. Примером буфера является 0,1 М Трис, рН 8,0, 0,5 М L-аргинина, 8 мМ окисленного глутатиона (GSSG) и 2 мМ ЭДТА.
В качестве модификации протокола очистки двухцепочечного антитела области тяжелой и легкой цепи солюбилизируют и восстанавливают по отдельности, а затем объединяют в растворе для рефолдинга. Примерный выход получают при смешивании этих двух белков в таком молярном соотношении, чтобы молярный избыток одного белка по сравнению с другим не превышал 5-кратный. После завершения окисления - восстановления - шиффлинга к раствору для рефолдинга можно добавлять избыток окисленного глутатиона или других окисляющих низкомолекулярных соединений.
В дополнение к рекомбинантным методам описанные в настоящем документе антитела, меченые антитела и их антигенсвязывающие фрагменты можно также полностью и частично конструировать, используя стандартный пептидный синтез. Твердофазный синтез полипептидов длиной менее чем примерно 50 аминокислот можно осуществить путем присоединения С-концевой аминокислоты последовательности к нерастворимому носителю, после чего последовательно добавляют остальные аминокислоты в последовательности. Методы твердофазного синтеза описаны в Barany & Merrifield, The Peptides: Analysis, Synthesis, Biology. Vol. 2: Special Methods in Peptide Synthesis, Part A. pp. 3-284; Merrifield et al., J. Am. Chem. Soc. 85:2149-2156, 1963, и Stewart et al., Solid Phase Peptide Synthesis, 2nd ed., Pierce Chem. Co., Rockford, Ill, США, 1984. Белки большей длины можно синтезировать путем конденсации амино- и карбокси-концов более коротких фрагментов. Способы образования пептидных связей путем активации карбокси-конца (например, путем использования реагента сочетания N,N'-дициклогексилкарбодиимида) хорошо известны в данной области техники.
Следующие примеры предложены для более полной иллюстрации изобретения, но не предназначены для ограничения его объема.
Пример 1
Получение моноклональных антител, специфично нацеленных HaPD-1 человека
Конструировали PD-1 человека (NP_005009.2, Leu25-Gln167) с меткой IgG1 (Pro100-Lys330) человека на С-конце (обозначенный как слитый белок PD1/Fc), экспрессировали в линии клеток миеломы мыши (NSO), очищали на колонке с белком А и использовали в качестве иммуногена. Чистота PD1/Fc, количественно оцениваемая на основании электрофореза в ДСН-ПААГ в восстанавливающих условиях и визуализации окрашиванием серебром, составляла выше 95%.
Самок мышей BaIb/c и C57BI/6 иммунизировали три раза (раз в две недели) интраперитонеально (и/п) 50 мкг PD1/Fc на одну мышь. При первой иммунизации антиген вводили путем инъекции в виде смеси 1:1 с полным адъювантом Фрейнда (Sigma, St. Louis, МО), а вторую и третью дозы вводили с неполным адъювантом Фрейнда (Sigma, St. Louis, МО). Окончательную бустер-иммунизацию мышей проводили 25 мкг PD1/Fc путем инъекции в хвостовую вену, и спустя 4 дня собирали спленоциты для конъюгации с клетками линии миеломы NS0 из Американской коллекции типовых культур (АТСС; Allendale, NJ). Для получения клеток гибридомы использовали способы электрослияния, а затем супернатанты гибридомы подвергали скринингу на связывание антигена, блокирование лиганда, сортировку IgG, связывание эталонного антитела и связывание, определяемое методом сортировки флуоресцентно-активированных клеток (FACS). На основании первоначальных скринингов связывающей способности в конечном счете было отобрано 12 мАт для субклонирования (метод ограниченных разведений) и дальнейшей оценки. Для выращивания гибридом в роллерных флаконах для сбора супернатантов для получения антител использовали питательную среду BD Cell MAb. мАт очищали аффинной хроматографией с белком А. Чистота мАт, количественно оцениваемая на основании электрофореза в ДСН-ПААГ с окрашиванием Кумасси, составляла 90%. Вторичный скрининг 12-ти очищенных мАт включал в себя: анализы связывания PD-1 человека (тИФА), анализы связывания PD-1 мыши (тИФА), анализы блокирования лиганда PD1/PD-1 методом тИФА и с помощью системы ForteBio и скрининг методом эпитоп-специфической сортировки. Ни одно из очищенных мАт не проявляло перекрестной реактивности на мышь, в 5 мАт не показана активность блокирования лиганда, а при эпитоп-специфической сортировке было идентифицировано 3 эпитопа.
Сводные данные анализа связывания и анализа блокирования для 3 наилучших мАт представлены в таблице 3.
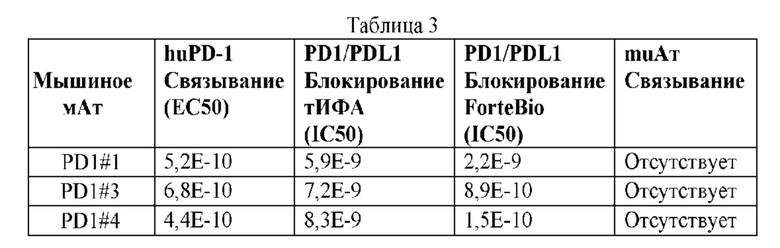
На основании совокупности результатов вторичных анализов были отобраны очищенные мАт PD1#1, PD1#3 и PD1#4 для секвенирования и дальнейшего анализа. Суммарную РНК из замороженных клеток гибридомы экстрагировали, следуя техническому руководству к реактиву TRIzol®. Суммарную РНК анализировали методом электрофореза в агарозном геле. Для обратной транскрипции суммарной РНК в кДНК использовали специфичные к изотипу антисенс-праймеры или универсальные праймеры, следуя техническому руководству к набору реактивов для синтеза 1-й нити кДНК PrimeScript™. Затем проводили ПНР для амплификации вариабельных областей тяжелых и легких цепей антител, которые впоследствии по отдельности клонировали в стандартном клонирующем векторе и секвенировали. мАт PD1#1, PD1#3 и PD1#4 содержат последовательности вариабельных областей тяжелой цепи, представленные в SEQ ID NO: 20, 22 и 24 соответственно, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NO: 26, 28 и 30. Вариабельные области тяжелой цепи мАт PD1#1, PD1#3 и PD1#4 закодированы последовательностями нуклеиновой кислоты, представленными в SEQ ID NO: 21, 23 и 25 соответственно, и вариабельные области легкой цепи мАт PD1#1, PD1#3 и PD1#4 закодированы последовательностями нуклеиновой кислоты, представленными в SEQ ID NO: 27, 29 и 31 соответственно.
Чтобы провести оценку эффективности PD1#3 при активации Т-клеток, проводили анализ PD1#3 методом смешанной лимфоцитарной реакции (MLR; mixed lymphocyte reaction). Активацию Т-клеток измеряли на основании концентрации интерлейкина-2 (TL-2), секретируемого Т-клетками. Из человеческих мононуклеарных клеток периферической крови (МКПК) от здоровых доноров выделяли дендритные клетки (DC) и CD 4+ Т-клетки. CD4+ Т-клетки очищали с помощью набора для выделения CD4+ Т-клеток. Дендритные клетки очищали с помощью набора реактивов для выделения пан-моноцитов и анализировали экспрессию в них костимуляторных молекул и молекул главного комплекса гистосовместимости (ГКГ) II в анализе методом FACS. Была определена стимуляция DC, и на их поверхности наблюдали экспрессию маркеров CD1a, CD83, CD86 и Н LA-DR. В качестве внутреннего контроля для мониторинга производительности анализа использовали активность препарата Кейтруда (Keytruda®) (Merck & Со.) при активации Т-клеток в MLR. Значения полумаксимальной эффективной концентрации (ЕС50) анализировали путем подбора сигмоидальной кривой нелинейной регрессии «доза-ответ» с помощью программного обеспечения GraphPad Prism. Значение IC50 для PD1#3 при активации Т-клеток составляло 0,8 нМ по сравнению с 1,1 нМ для внутреннего контроля пембролизумаба (Keytruda®). Таким образом, продемонстрировано, что PD1#3 способно усиливать пролиферацию Т-клеток и секрецию IL-2 в смешанной лимфоцитарной реакции.
Пример 2
Получение химерных IgG, специфично нацеленных на PD-1 человека
С использованием последовательности HCVR и последовательности LCVR мАт PD1#3 был получен химерный Fab-фрагмент мыши и человека (далее в настоящем документе «химерный IgG»), содержащий последовательность тяжелой цепи, представленную в SEQ ID NO: 32, и последовательность легкой цепи, представленную в SEQ ID NO: 34. Тяжелая цепь и легкая цепь химерного IgG кодируются последовательностями нуклеиновой кислоты, представленными в SEQ ID NO: 33 и 35 соответственно. Нуклеиновые кислоты, кодируемые SEQ ID NO: 33 и SEQ ID NO: 35, которые включают лидерную последовательность, амплифицировали и встраивали в вектор рТТ5 с получением экспрессионной плазмиды полноразмерного IgG. Экспрессионные плазмиды с тяжелой цепью и легкой цепью использовали для котрансфекции клеток эмбриональных почек человека (HEK293-6Е) в объеме 100 мл. Рекомбинантные IgG, секретируемые в питательную среду, очищали, используя аффинность к белку А. Очищенные IgG мигрировали в электрофорезе в ДСН-ПААГ в виде полосы ~ 170 кДа в невосстанавливающих условиях и полос ~ 55 кДа и ~ 30 кДа в восстанавливающих условиях. Чистота химерного IgG составляет более 90%, и выход из 100 мл культуры составлял 0,46 мг. Аффинность связывания между химерным IgG и слитым белком PD1/Fc определяли с помощью биосенсора поверхностного плазмонного резонанса (SPR) Biacore Т200 (GE Healthcare). PD1#3 иммобилизовали на сенсорном чипе, предварительно покрытом античеловеческим фрагментом Fc гамма. В качестве анализируемого вещества использовали His-меченный белок PD-1 человека. Данные констант скорости диссоциации (kd) и ассоциации (ka) были получены с помощью программного обеспечения для оценки данных Biacore Т200. Равновесные константы диссоциации (KD) рассчитывали на основании отношения kd ka. Продемонстрирована высокая аффинность химерного IgG, KD (моль) = 4,8Е-10.
Пример 3
Получение гуманизированных Fab-фрагментов, специфично нацеленных на PD-1 человека Для получения гуманизированных мАт к PD1, имеющих происхождение от мАт PD1#3, использовали способ прививания CDR и обратных мутаций. Кратко, последовательность HCVR и последовательность LCVR мышиных мАт выравнивали с помощью программы Blast в сравнении с базой данных последовательностей зародышевой линии человека. Человеческим акцепторами, выбранными для VH и VL, были AAA17961 и AIT38817 GenBank соответственно. CDR и петли HV человеческих акцепторов замещали соответствующими последовательностями мыши (прививание CDR), в результате чего получили последовательность привитого антитела, далее в настоящем документе идентифицированного как PD1-привитое Ат, которое содержало последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 36, и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 37.
Была построена модель гомологии мышиного фрагмента Fv к PD1, в которой были идентифицированы предполагаемые сайты обратных мутаций (т.е. углубленные остатки каркасных областей, различающиеся в мышиной и человеческой акцепторной последовательностях). Общее количество предполагаемых сайтов обратных мутаций составляло 14. Синтезировали вариант гуманизированного Fab, содержащий все 14 предполагаемых сайтов обратных мутаций PD1-привитого Ат, подвергнутого обратному мутированию с образованием соответствующих последовательностей мыши (далее в настоящем документе идентифицированный как Ат PD1-BM), содержащий последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 38, и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 39. В дополнение к этому синтезировали 14 вариантов Ат PD1-ВМ (далее в настоящем документе идентифицированных как Fab 1-14), каждый из которых включал по меньшей мере один из 14 предполагаемых сайтов обратных мутаций в Ат PD1-BM, подвергнутого обратной мутации с получением соответствующей последовательности человека. Эти конструкции использовали для трансформации штамма TG1 Е. coli. Для каждой отдельной конструкции собирали отдельные колонии и выращивали в питательной среде для Е. coli. Неочищенные химерные и гуманизированные Fab собирали и подвергали количественной оценке аффинности во множестве циклов методом поверхностного плазмонного резонанса (SPR). Результаты представлены в таблице 4.
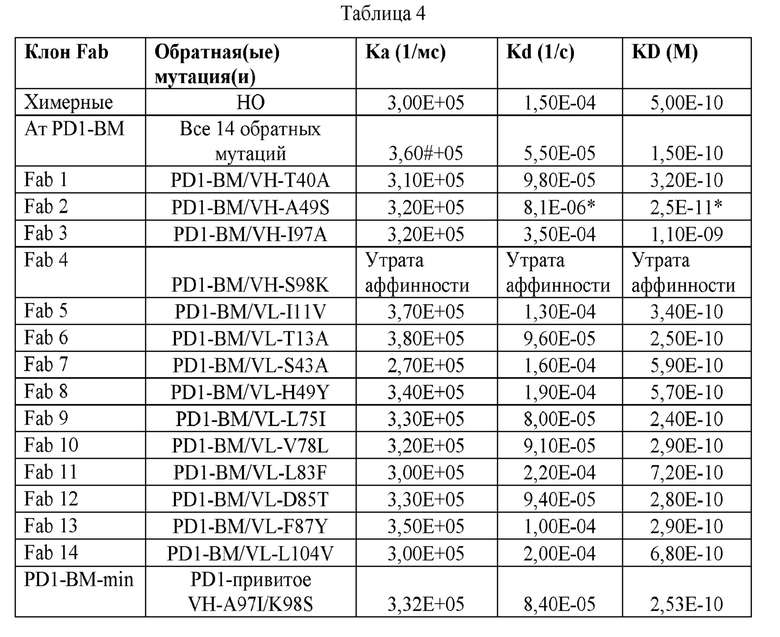
* ниже предела обнаружения
Связывающая аффинность PD1-привитого Ат была низкой по сравнению с химерным Fab, что позволяет предположить необходимость проведения обратных мутаций для сохранения связывающей аффинности. Все варианты PD1-BM характеризовались сходными или более высокими значениями связывающей аффинности по сравнению с химерными Fab за исключением Fab 3 и Fab 4, что позволяет предположить, что предполагаемые сайты обратных мутаций VH-A97 и VH-K98 могут быть критическими для сохранения связывающей аффинности антитела. В свете этого наблюдаемого результата был синтезирован гуманизированный вариант PD1-BM, имеющий обе обратные мутации VH-A97I/K98S (далее в настоящем документе идентифицированный как Ат PD1-BM-min), и проведено его тестирование методом SPR. PD1-BM-min содержит последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 40, и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 37. Связывающая аффинность PD1-BM-min была сопоставимой с другими вариантами PD1-BM, что подтверждает, что обратные мутации в данных положениях соответствующей последовательности мыши являются существенными (см. таблицу 4 выше).
Сводные данные о последовательностях HCVR и LCVR для Fab 1, Fab 2 и Fab 5-14 представлены в таблице 5.
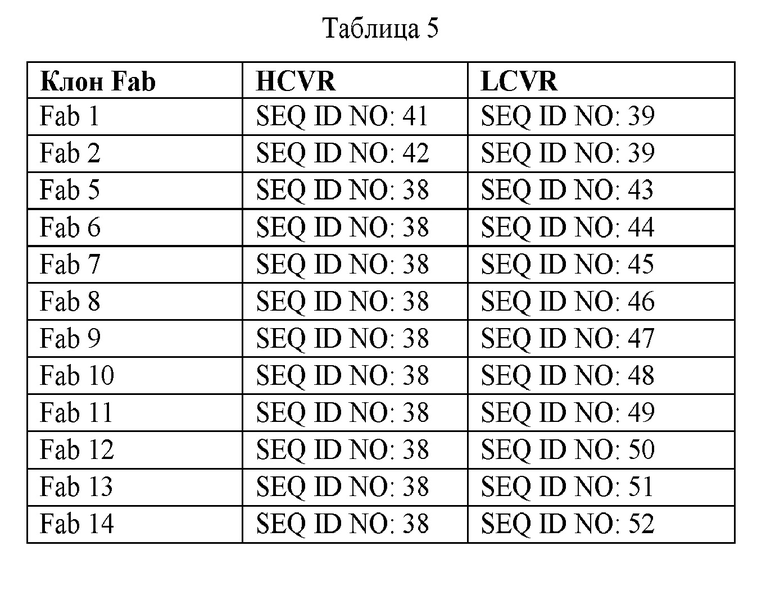
Пример 4
Выделение гуманизированных Fab к PD-1 из библиотеки фагового дисплея
Была сконструирована библиотека фагового дисплея гуманизированных Fab с обратными мутациями, которые включали все 14 предполагаемых сайтов обратных мутаций. Каждому положению была присвоена 50%-ная вероятность приобретения обратной мутации. Для конструирования библиотеки были разработаны и использованы вырожденные праймеры. ПЦР с перекрывающимися праймерами использовали для сборки гуманизированного Fab фрагмента, который расщепляли и встраивали в фагмидный вектор. Продукт лигирования использовали для трансформации штамма TG1 Е. coli. Фаговые частицы, полученные из трансформированных клеток, подвергали пэннингу против слитого белка PD-1/Fc. Для получения разнообразных и высоко аффинных связывающих агентов связанный фаг подвергали конкурентной элюции химерным IgG с последующей элюцией триэтаноламином (ТЭА). Фаг, полученный в результате элюции ТЭА, использовали для трансфекции штамма TG1 Е. coli. Полученные в результате отдельные фаговые клоны амплифицировали в 96-луночных планшетах с глубокими лунками и проводили анализ амплифицированного фага методом тИФА против белка PD-1. Связанный фаг обнаруживали с помощью меченного пероксидазой хрена (HRP) моноклонального антитела к М13. Отобранный в результате фаг использовали для инфекции экспоненциально растущих клеток TG1. Трансфицированные клетки выращивали и выделяли из них двунитевую ДНК (днДНК). Гуманизированные Fab-фрагменты вырезали из двунитевой фагмиды и встраивали в вектор pFASEBA (Genscript) для скрининга наилучших клонов гуманизированного антитела. Полученные в результате отдельные фаговые клоны амплифицировали в 96-луночных планшетах с глубокими лунками и проводили анализ амплифицированного фага методом тИФА против бычьего сывороточного альбумина (БСА) и белка PD-1 для оценки экспрессии и связывающей активности соответственно.
Для ранжирования аффинности БСА иммобилизовали на сенсорном чипе, используя метод аминного сочетания. Отобранный Fab -S AS А, секретируемый в культуральную среду, после введения на колонку захватывался БСА посредством прочного связывания между БСА и SASA (фаза захвата). После уравновешивания вводили His-меченный антиген PD-1 в течение 300 секунд (фаза ассоциации) с последующим вводом подвижного буфера в течение 900 секунд (фаза диссоциации). Перед вводом трех других клонов Fab-SASA поверхность регенерировали. Этот процесс повторяли до завершения анализа всех отобранных белков Fab-SASA. В каждом цикле отклики эталонной проточной кюветы вычитали из откликов проточных кювет Fab-SASA. Ранжирование антител проводили на основании их констант диссоциации (скорости диссоциации, KD). Проводили количественную оценку связывающей аффинности 13-ти клонов библиотеки методом SPR. Результаты представлены в таблице 6.
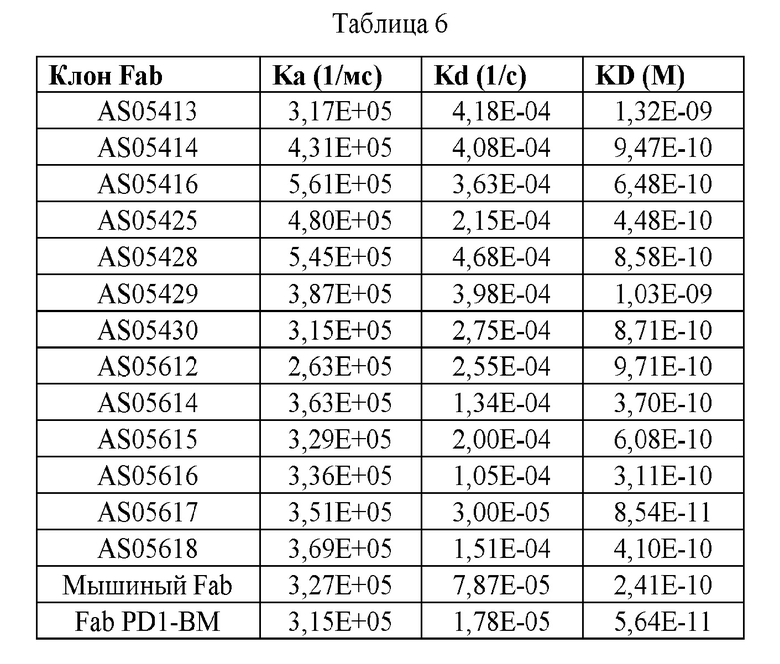
Для анализа последовательности было отобрано 4 клона, сводные данные о последовательностях которых представлены в таблице 7.

Выравнивание аминокислотных последовательностей PD1-привитого Ат, Ат PD1-ВМ, PD1-BM-min, AS05614, AS05616, AS05618 и AS05617 представлено на Фиг. 1. Буквами красного цвета обозначены сайты обратной мутации, (*) = идентичные остатки; и (:) = подобные остатки.
Пример 4
Получение и определение характеристик IgG к PD1
Для экспрессии, очистки и измерения аффинности полноразмерного IgG было отобрано 3 гуманизированных связывающих агентов PD1 (Ат PD1-BM, PD1-BM-min и AS05617).
Последовательности ДНК, кодирующие Ат PD1-BM, PD1-BM-min и AS05617, включая лидерную последовательность, амплифицировали и встраивали в вектор рТТ5 для получения экспрессионных плазмид с полноразмерными IgG. Экспрессионные плазмиды с тяжелой цепью и легкой цепью использовали для котрансфекции клеток HEK293 в объеме 100 мл культуры клеток. Рекомбинантные IgG, секретируемые в питательную среду, очищали, используя аффинную хроматографию с белком А. Очищенные IgG мигрировали в электрофорезе в ДСН-ПААГ в виде полосы ~170 кДа в невосстанавливающих условиях и полос ~55 кДа и ~ 30 кДа в восстанавливающих условиях.
Аффинность связывания очищенных IgG с белком PD-1 человека определяли с помощью биосенсора поверхностного плазмонного резонанса (SPR) Biacore Т200 (GE Healthcare). Антитела иммобилизовали на сенсорном чипе, предварительно покрытом античеловеческим фрагментом Fc гамма. В качестве анализируемого вещества использовали His-меченный белок PD-1 человека. Данные констант скорости диссоциации (kd) и ассоциации (ka) были получены с помощью программного обеспечения для оценки данных Biacore Т200. Равновесные константы диссоциации (KD) рассчитывали на основании отношения kd к ka. Данные связывания для каждого антитела обрабатывали и приводили в соответствие с моделью взаимодействия 1:1 с помощью программного обеспечения для оценки данных Biacore Т200. Все экспериментальные данные хорошо укладывались в эту модель. Сводные данные представлены в таблице 8.
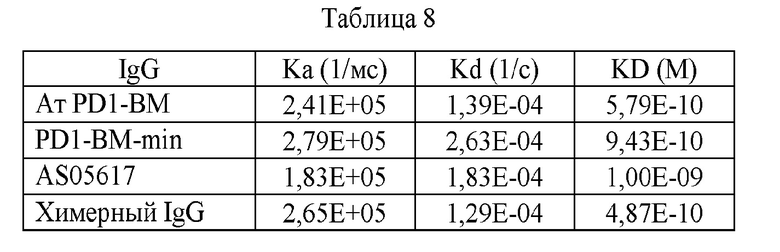
Сводные данные о последовательностях НС и LC для PD1-BM, PD1-BM-min и AS05617 представлены в таблице 9.

Пример 5
Оценка активности мАт к PD-1 методом смешанной лимфоцитарной реакции Для оценки активности химерного IgG, Ат PD1-BM, PD1-BM-min и AS05617 при активации Т-клеток использовали анализ смешанной лимфоцитарной реакции (MLR). Активацию Т-клеток измеряли на основании концентрации интерлейкина-2 (TL-2), секретируемого Т-клетками. Из человеческих мононуклеарных клеток периферической крови (МКПК) выделяли дендритные клетки (DC) и CD 4+ Т-клетки. В качестве внутреннего контроля для мониторинга производительности анализа использовали активность препарата Кейтруда® при активации Т-клеток в MLR. Значения полумаксимальной эффективной концентрации (ЕС50) анализировали путем подбора кривой «доза агониста-ответ» с изменяемым наклоном (четыре параметра) с помощью программного обеспечения GraphPad Prism. Значения ЕС50 для химерного Fab, Ат PD1-ВМ, PD1-BM-min и AS05617 при активации Т-клеток составляли 0,135 мкг/мл, 0,185 мкг/мл, 0,065 мкг/мл и 0,579 мкг/мл соответственно. Отрицательный контроль, представляющий собой IgG4 человека, не оказывал воздействия на активацию Т-клеток. Таким образом, продемонстрировано, что гуманизированные антитела к PD-1 способны усиливать пролиферацию Т-клеток и секрецию IL-2 в смешанной лимфоцитарной реакции.
В свете настоящего описания все описанные и заявленные изделия и способы могут быть получены и выполнены без ненужного экспериментирования. При описании изделий и способов по данному изобретению в отношении предпочтительных воплощений специалисту в данной области техники будет очевидно, что можно применять варианты этих изделий и способов, не отклоняясь от сущности и объема изобретения. Все такие варианты и эквиваленты, очевидные специалистам в данной области техники, уже существующие или разработанные впоследствии, считают включенными в сущность и объем изобретения, определенные в прилагаемой формуле изобретения. Все патенты, заявки на патенты и публикации, упоминаемые в описании, являются показателями уровня знаний обычного специалиста в области техники, к которой относится изобретение. Все патенты, заявки на патенты и публикации полностью включены в настоящий документ посредством ссылки для всех целей и в такой же степени, как если бы каждая отдельная публикация была конкретно и индивидуально указана как полностью включенная посредством ссылки для любых и всех целей. Изобретение, описанное в настоящем документе в иллюстративном виде, можно успешно применять на практике в отсутствие какого-либо(каких-либо) элемента(ов), конкретно не описанных в настоящем документе. Таким образом, должно быть понятно, что хотя настоящее изобретение конкретно описано посредством предпочтительных воплощений и необязательных признаков, специалисты в данной области техники могут прибегать к модификациям и вариантам описанных в настоящем документе концепций, и такие модификации и варианты считают входящими в объем данного изобретения, определенный прилагаемой формулой изобретения.
Перечни последовательностей
Нуклеиново- и аминокислотные последовательности, приведенные в сопроводительном перечне последовательностей, показаны с использованием стандартных буквенных обозначений оснований нуклеотидов и трехбуквенного кода для аминокислот, как определено в статье 37, п. 1.822 Свода федеральных нормативных актов США.
SEQ ID NO: 1 представляет собой аминокислотную последовательность, содержащую полипептид PD-1 человека.
SEQ ID NO: 2-4 представляют собой аминокислотные последовательности CDR1 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 5-7 представляют собой аминокислотные последовательности CDR2 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 8-10 представляют собой аминокислотные последовательности CDR3 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 11-13 представляют собой аминокислотные последовательности CDR1 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 14-16 представляют собой аминокислотные последовательности CDR2 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 17-19 представляют собой аминокислотные последовательности CDR3 тяжелой цепи в моноклональном антителе, специфично связывающем PD-1.
SEQ ID NO: 20, 22 и 24 представляют собой аминокислотные последовательности вариабельной области тяжелой цепи мышиных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 21, 23 и 25 представляют собой последовательности нуклеиновых кислот вариабельной области тяжелой цепи мышиных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 26, 28 и 30 представляют собой последовательности нуклеиновых кислот вариабельной области легкой цепи мышиных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 27, 29 и 31 представляют собой последовательности нуклеиновых кислот вариабельной области легкой цепи мышиных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 32 представляет собой аминокислотную последовательность тяжелой цепи химерного антитела мыши и человека, специфично связывающего PD-1.
SEQ ID NO: 33 представляет собой последовательность нуклеиновых кислот тяжелой цепи химерного антитела мыши и человека, специфично связывающего PD-1.
SEQ ID NO: 34 представляет собой аминокислотную последовательность легкой цепи химерного антитела мыши и человека, специфично связывающего PD-1.
SEQ ID NO: 35 представляет собой последовательность нуклеиновых кислот легкой цепи химерного антитела мыши и человека, специфично связывающего PD-1.
SEQ ID NO: 36, 38, 40-42 и 53 представляют собой аминокислотные последовательности тяжелой цепи гуманизированных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 37, 39, 43-52 и 54-57 представляют собой аминокислотные последовательности легкой цепи гуманизированных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 59, 63 и 67 представляют собой последовательности нуклеиновых кислот тяжелой цепи гуманизированных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 60, 64 и 68 представляют собой аминокислотные последовательности легкой цепи гуманизированных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 61, 65 и 69 представляют собой последовательности нуклеиновых кислот легкой цепи гуманизированных моноклональных антител, специфично связывающих PD-1.
SEQ ID NO: 70 и 71 представляют собой аминокислотные последовательности константной области легкой цепи моноклонального антитела, специфично связывающего PD-1.
SEQ ID NO: 72 представляет собой аминокислотную последовательность константной области тяжелой цепи моноклонального антитела, специфично связывающего PD-1.
ПЕРЕЧНИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 - аминокислотная последовательность антигена PD-1

SEQ ID NO: 2 - аминокислотная последовательность CDR1 тяжелой цепи мышиного моноклонального антитела DCWMH
SEQ ID NO: 3 - аминокислотная последовательность CDR1 тяжелой цепи мышиного моноклонального антитела RYDMA
SEQ ID NO: 4 - аминокислотная последовательность CDR1 тяжелой цепи мышиного моноклонального антитела RYGMS
SEQ ID NO: 5 - аминокислотная последовательность CDR2 тяжелой цепи мышиного моноклонального антитела AIDTSNSYTTYNQKFKG
SEQ ID NO: 6 - аминокислотная последовательность CDR2 тяжелой цепи мышиного моноклонального антитела FISGGGSNTYYPDTVKG
SEQ ID NO: 7 - аминокислотная последовательность CDR2 тяжелой цепи мышиного моноклонального антитела TISGGGRDTYYPDSVKG
SEQ ID NO: 8 - аминокислотная последовательность CDR3 тяжелой цепи мышиного моноклонального антитела SLQRPFDY
SEQ ID NO: 9 - аминокислотная последовательность CDR3 тяжелой цепи мышиного моноклонального антитела PYYYAMEY
SEQ ID NO: 10 - аминокислотная последовательность CDR3 тяжелой цепи мышиного моноклонального антитела QEDIVWFAY
SEQ ID NO: 11 - аминокислотная последовательность CDR1 легкой цепи мышиного моноклонального антитела RASENVYSYLA
SEQ ID NO: 12 - аминокислотная последовательность CDR2 тяжелой цепи мышиного моноклонального антитела KASQDVDTAVA
SEQ ID NO: 13 - аминокислотная последовательность CDR1 легкой цепи мышиного моноклонального антитела RASESVDNSGLSFMN
SEQ ID NO: 14 - аминокислотная последовательность CDR2 легкой цепи мышиного моноклонального антитела NAKTLTG
SEQ ID NO: 15 - аминокислотная последовательность CDR2 легкой цепи мышиного моноклонального антитела WASTRHT
SEQ ID NO: 16 - аминокислотная последовательность CDR2 легкой цепи мышиного моноклонального антитела AASNQGS
SEQ ID NO: 17 - аминокислотная последовательность CDR3 легкой цепи мышиного моноклонального антитела LQHYGYPFT
SEQ ID NO: 18 - аминокислотная последовательность CDR3 легкой цепи мышиного моноклонального антитела QQYSTFPWT
SEQ ID NO: 19 - аминокислотная последовательность CDR3 легкой цепи мышиного моноклонального антитела QQSKEVPWT
SEQ ID NO: 20 - аминокислотная последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела

SEQ ID NO: 21 - последовательность нуклеиновых кислот вариабельной области тяжелой цепи мышиного моноклонального антитела
SEQ ID NO: 22 - аминокислотная последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела
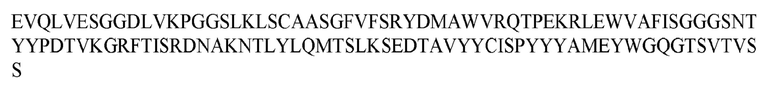
SEQ ID NO: 23 -последовательность нуклеиновых кислот вариабельной области тяжелой цепи мышиного моноклонального антитела
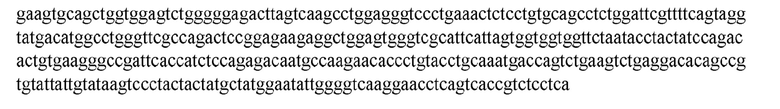
SEQ ID NO: 24 - аминокислотная последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела

SEQ ID NO: 25 - последовательность нуклеиновых кислот вариабельной области тяжелой цепи мышиного моноклонального антитела
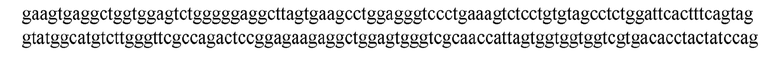
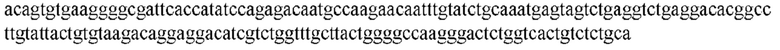
SEQ ID NO: 26 - аминокислотная последовательность вариабельной области легкой цепи мышиного моноклонального антитела
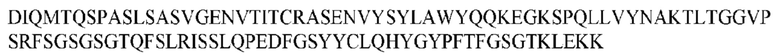
SEQ ID NO: 27 - последовательность нуклеиновых кислот вариабельной области легкой цепи мышиного моноклонального антитела
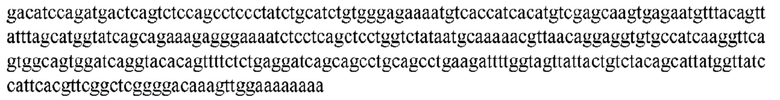
SEQ ID NO: 28 - аминокислотная последовательность вариабельной области легкой цепи мышиного моноклонального антитела
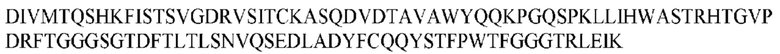
SEQ ID NO: 29 - последовательность нуклеиновых кислот вариабельной области легкой цепи мышиного моноклонального антитела
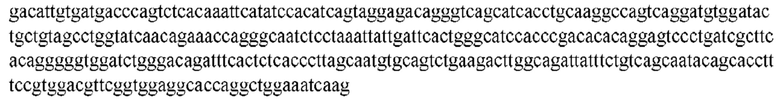
SEQ ID NO: 30 - аминокислотная последовательность вариабельной области легкой цепи мышиного моноклонального антитела
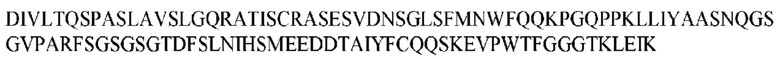
SEQ ID NO: 31 - последовательность нуклеиновых кислот вариабельной области легкой цепи мышиного моноклонального антитела

SEQ ID NO: 32 - аминокислотная последовательность тяжелой цепи химерного антитела мыши и человека

SEQ ID NO: 33 - последовательность нуклеиновых кислот тяжелой цепи химерного антитела мыши и человека

SEQ ID NO: 34 - аминокислотная последовательность легкой цепи химерного антитела мыши и человека

SEQ ID NO: 35 - последовательность нуклеиновых кислот легкой цепи химерного антитела мыши и человека
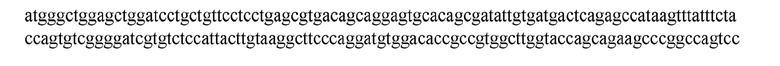

SEQ ID NO: 36 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
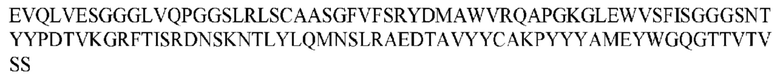
SEQ ID NO: 37 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
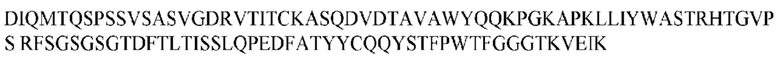
SEQ ID NO: 38 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
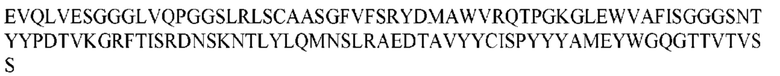
SEQ ID NO: 39 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
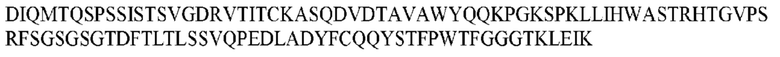
SEQ ID NO: 40 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
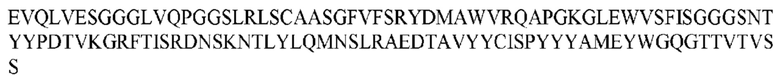
SEQ ID NO: 41 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
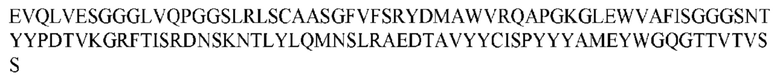
SEQ ID NO: 42 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
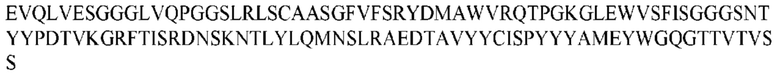
SEQ ID NO: 43 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
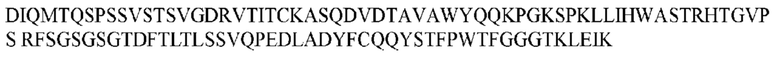
SEQ ID NO: 44 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
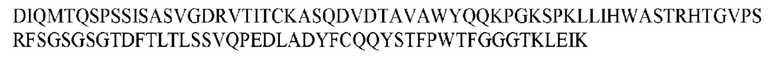
SEQ ID NO: 45 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
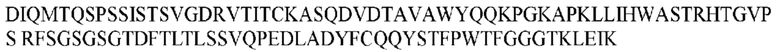
SEQ ID NO: 46 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
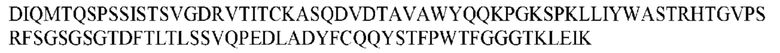
SEQ ID NO: 47 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
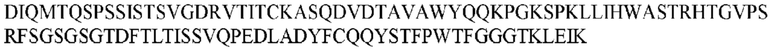
SEQ ID NO: 48 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
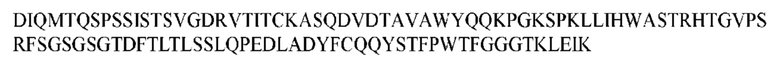
SEQ ID NO: 49 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
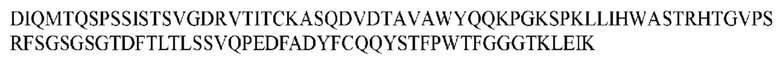
SEQ ID NO: 50 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
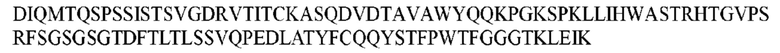
SEQ ID NO: 51 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
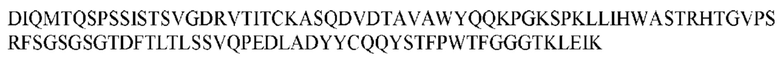
SEQ ID NO: 52 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
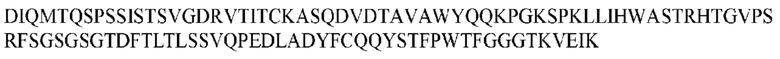
SEQ ID NO: 53 - аминокислотная последовательность гуманизированной вариабельной области тяжелой цепи
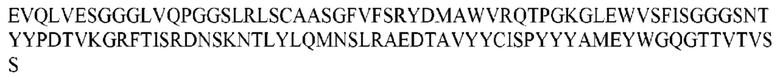
SEQ ID NO: 54 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
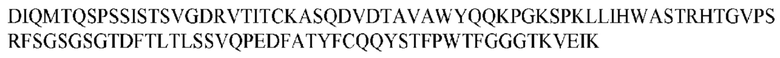
SEQ ID NO: 55 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
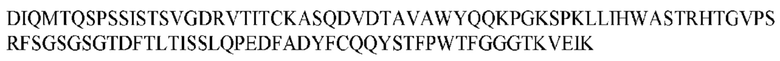
SEQ ID NO: 56 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
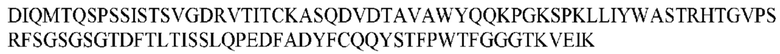
SEQ ID NO: 57 - аминокислотная последовательность гуманизированной вариабельной области легкой цепи
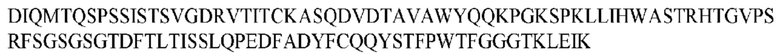
SEQ ID NO: 58 - аминокислотная последовательность гуманизированной тяжелой цепи 
SEQ ID NO: 59 -последовательность нуклеиновых кислот гуманизированной тяжелой цепи

SEQ ID NO: 60 - аминокислотная последовательность гуманизированной легкой цепи

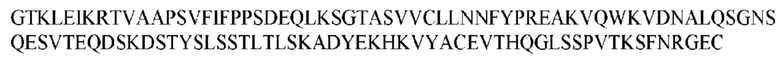
SEQ ID NO: 131 - последовательность нуклеиновых кислот гуманизированной легкой цепи

SEQ ID NO: 62 - аминокислотная последовательность гуманизированной тяжелой цепи

SEQ ID NO: 63 - последовательность нуклеиновых кислот гуманизированной тяжелой цепи

SEQ ID NO: 64 - аминокислотная последовательность гуманизированной легкой цепи

SEQ ID NO: 132 - последовательность нуклеиновых кислот гуманизированной легкой цепи

SEQ ID NO: 66 - аминокислотная последовательность гуманизированной тяжелой цепи 
SEQ ID NO: 67 - последовательность нуклеиновых кислот гуманизированной тяжелой цепи

SEQ ID NO: 68 - аминокислотная последовательность гуманизированной легкой цепи

SEQ ID NO: 133 - последовательность нуклеиновых кислот гуманизированной легкой цепи

SEQ ID NO: 70 - аминокислотная последовательность константной области легкой цепи 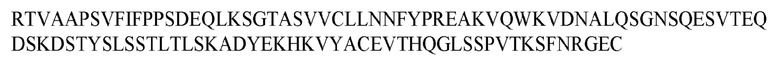
SEQ ID NO: 71 - аминокислотная последовательность константной области легкой цепи
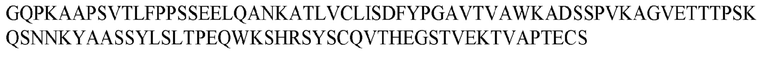
SEQ ID NO: 72 - аминокислотная последовательность константной области тяжелой цепи

--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> REMD Biotherapeutics, Inc.
<120> ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ АНТИТЕЛ, СВЯЗЫВАЮЩИХ БЕЛОК 1
ПРОГРАММИРУЕМОЙ СМЕРТИ КЛЕТОК(PD-1)
<130> CACRE1.0013WO
<160> 72
<170> PatentIn version 3.5
<210> 1
<211> 288
<212> PRT
<213> Homo sapiens
<400> 1
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 2
<211> 5
<212> PRT
<213> Mus musculus
<400> 2
Asp Cys Trp Met His
1 5
<210> 3
<211> 5
<212> PRT
<213> Mus musculus
<400> 3
Arg Tyr Asp Met Ala
1 5
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Arg Tyr Gly Met Ser
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Ala Ile Asp Thr Ser Asn Ser Tyr Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 6
<211> 17
<212> PRT
<213> Mus musculus
<400> 6
Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val Lys
1 5 10 15
Gly
<210> 7
<211> 17
<212> PRT
<213> Mus musculus
<400> 7
Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 8
<211> 8
<212> PRT
<213> Mus musculus
<400> 8
Ser Leu Gln Arg Pro Phe Asp Tyr
1 5
<210> 9
<211> 8
<212> PRT
<213> Mus musculus
<400> 9
Pro Tyr Tyr Tyr Ala Met Glu Tyr
1 5
<210> 10
<211> 9
<212> PRT
<213> Mus musculus
<400> 10
Gln Glu Asp Ile Val Trp Phe Ala Tyr
1 5
<210> 11
<211> 11
<212> PRT
<213> Mus musculus
<400> 11
Arg Ala Ser Glu Asn Val Tyr Ser Tyr Leu Ala
1 5 10
<210> 12
<211> 11
<212> PRT
<213> Mus musculus
<400> 12
Lys Ala Ser Gln Asp Val Asp Thr Ala Val Ala
1 5 10
<210> 13
<211> 15
<212> PRT
<213> Mus musculus
<400> 13
Arg Ala Ser Glu Ser Val Asp Asn Ser Gly Leu Ser Phe Met Asn
1 5 10 15
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Asn Ala Lys Thr Leu Thr Gly
1 5
<210> 15
<211> 7
<212> PRT
<213> Mus musculus
<400> 15
Trp Ala Ser Thr Arg His Thr
1 5
<210> 16
<211> 7
<212> PRT
<213> Mus musculus
<400> 16
Ala Ala Ser Asn Gln Gly Ser
1 5
<210> 17
<211> 9
<212> PRT
<213> Mus musculus
<400> 17
Leu Gln His Tyr Gly Tyr Pro Phe Thr
1 5
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Gln Gln Tyr Ser Thr Phe Pro Trp Thr
1 5
<210> 19
<211> 9
<212> PRT
<213> Mus musculus
<400> 19
Gln Gln Ser Lys Glu Val Pro Trp Thr
1 5
<210> 20
<211> 117
<212> PRT
<213> Mus musculus
<400> 20
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Met Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Ile Thr Asp Cys
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Thr Ser Asn Ser Tyr Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Glu Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Phe Asn Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ile Ser Leu Gln Arg Pro Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 21
<211> 351
<212> ДНК
<213> Mus musculus
<400> 21
caggtccaac tgcagcagcc tggggctgag cttgtgatgc ctggggcttc agtgaagatg 60
tcctgtaagg cttcgggcta cacaatcact gactgctgga tgcactgggt gaagcagagg 120
cctggacaag gccttgagtg gatcggagcg attgatactt ctaatagtta tactacttac 180
aatcaaaagt tcaagggcaa ggccacattg actgtagacg aatcctccag cacagcctac 240
atgcagttca acagcctgac atctgacgac tctgcggtct atttctgtgc aatttcctta 300
caacggccgt ttgactactg gggccaaggc accactctca cagtctcctc a 351
<210> 22
<211> 117
<212> PRT
<213> Mus musculus
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Ser Leu Lys Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 351
<212> ДНК
<213> Mus musculus
<400> 23
gaagtgcagc tggtggagtc tgggggagac ttagtcaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cgttttcagt aggtatgaca tggcctgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcattc attagtggtg gtggttctaa tacctactat 180
ccagacactg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga ccagtctgaa gtctgaggac acagccgtgt attattgtat aagtccctac 300
tactatgcta tggaatattg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 24
<211> 118
<212> PRT
<213> Mus musculus
<400> 24
Glu Val Arg Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Val Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Arg Gln Glu Asp Ile Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 25
<211> 354
<212> ДНК
<213> Mus musculus
<400> 25
gaagtgaggc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaagtc 60
tcctgtgtag cctctggatt cactttcagt aggtatggca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcaacc attagtggtg gtggtcgtga cacctactat 180
ccagacagtg tgaaggggcg attcaccata tccagagaca atgccaagaa caatttgtat 240
ctgcaaatga gtagtctgag gtctgaggac acggccttgt attactgtgt aagacaggag 300
gacatcgtct ggtttgctta ctggggccaa gggactctgg tcactgtctc tgca 354
<210> 26
<211> 107
<212> PRT
<213> Mus musculus
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Asn Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Val Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Glu Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Thr Gly Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Arg Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Leu Gln His Tyr Gly Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Lys Lys
100 105
<210> 27
<211> 321
<212> ДНК
<213> Mus musculus
<400> 27
gacatccaga tgactcagtc tccagcctcc ctatctgcat ctgtgggaga aaatgtcacc 60
atcacatgtc gagcaagtga gaatgtttac agttatttag catggtatca gcagaaagag 120
ggaaaatctc ctcagctcct ggtctataat gcaaaaacgt taacaggagg tgtgccatca 180
aggttcagtg gcagtggatc aggtacacag ttttctctga ggatcagcag cctgcagcct 240
gaagattttg gtagttatta ctgtctacag cattatggtt atccattcac gttcggctcg 300
gggacaaagt tggaaaaaaa a 321
<210> 28
<211> 107
<212> PRT
<213> Mus musculus
<400> 28
Asp Ile Val Met Thr Gln Ser His Lys Phe Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 29
<211> 321
<212> ДНК
<213> Mus musculus
<400> 29
gacattgtga tgacccagtc tcacaaattc atatccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtggat actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaattatt gattcactgg gcatccaccc gacacacagg agtccctgat 180
cgcttcacag ggggtggatc tgggacagat ttcactctca cccttagcaa tgtgcagtct 240
gaagacttgg cagattattt ctgtcagcaa tacagcacct ttccgtggac gttcggtgga 300
ggcaccaggc tggaaatcaa g 321
<210> 30
<211> 111
<212> PRT
<213> Mus musculus
<400> 30
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Ser Met Glu Glu Asp Asp Thr Ala Ile Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 31
<211> 333
<212> ДНК
<213> Mus musculus
<400> 31
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atctcctgca gagccagcga aagtgttgat aattctggcc ttagttttat gaactggttc 120
caacagaaac caggacagcc acccaaactc ctcatctatg ctgcttccaa ccaaggatcc 180
ggggtccctg ccaggtttag tggcagtggg tctgggacag acttcagcct caacatccat 240
tctatggagg aggatgatac tgcaatatat ttctgtcagc aaagtaagga ggttccgtgg 300
acgttcggtg gaggcaccaa gttggaaatc aaa 333
<210> 32
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь химерного антитела, связывающего PD-1 - 19 aa лидерная
последовательность
<400> 32
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys
20 25 30
Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe
35 40 45
Ser Arg Tyr Asp Met Ala Trp Val Arg Gln Thr Pro Glu Lys Arg Leu
50 55 60
Glu Trp Val Ala Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro
65 70 75 80
Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Thr Ser Leu Lys Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln
115 120 125
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
225 230 235 240
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
275 280 285
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 33
<211> 1389
<212> ДНК
<213> Искусственная
<220>
<223> Тяжелая цепь химерного антитела, связывающего PD-1 - 19 aa лидерная
последовательность
<400> 33
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgaa 60
gtgcagctgg tggagtccgg gggcgatctg gtcaaacctg gagggagcct gaaactgtct 120
tgtgccgcat ctggattcgt cttttccaga tatgacatgg cctgggtgag gcagacccca 180
gagaagcgcc tggagtgggt ggccttcatc tctggcggcg gcagcaacac atactatccc 240
gacaccgtga agggccggtt tacaatcagc agagataacg ccaagaatac actgtatctg 300
cagatgacct ctctgaagag cgaggatacc gccgtgtact attgcatctc tccttactat 360
tacgccatgg agtactgggg ccagggcaca agcgtgaccg tgagctccgc ctccacaaag 420
ggaccaagcg tgttcccact ggcaccatgc tctcgcagca catccgagtc taccgccgcc 480
ctgggatgtc tggtgaagga ctacttccct gagccagtga ccgtgtcctg gaacagcggc 540
gccctgacat ccggagtgca cacctttcca gccgtgctgc agtctagcgg cctgtatagc 600
ctgtcctctg tggtgacagt gcccagctcc tctctgggca ccaagacata cacctgcaac 660
gtggaccaca agcctagcaa taccaaggtg gataagcggg tggagtccaa gtatggacca 720
ccttgcccac catgtccagc acctgagttt ctgggaggac catccgtgtt cctgtttcct 780
ccaaagccta aggacacact gatgatctcc agaacacctg aggtgacctg cgtggtggtg 840
gacgtgtctc aggaggatcc agaggtgcag ttcaactggt acgtggatgg cgtggaggtg 900
cacaatgcca agaccaagcc cagggaggag cagtttaaca gcacatatcg cgtggtgtcc 960
gtgctgaccg tgctgcacca ggattggctg aacggcaagg agtacaagtg caaggtgagc 1020
aataagggcc tgcctagctc catcgagaag acaatctcca aggcaaaggg acagcctagg 1080
gagccacagg tgtataccct gcccccttct caggaggaga tgacaaagaa ccaggtgagc 1140
ctgacctgtc tggtgaaggg cttctaccca tccgacatcg ccgtggagtg ggagtctaat 1200
ggccagcccg agaacaatta taagaccaca ccacccgtgc tggacagcga tggctccttc 1260
tttctgtact ctcggctgac cgtggataag agcagatggc aggagggcaa cgtgttcagc 1320
tgttccgtga tgcacgaagc actgcacaat cattacactc agaaaagcct gtcactgtcc 1380
ctgggcaaa 1389
<210> 34
<211> 233
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь химерного антитела, связывающего PD-1 - 19 aa лидерная
последовательность
<400> 34
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Ile Ser Thr
20 25 30
Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val
35 40 45
Asp Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
50 55 60
Leu Leu Ile His Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg
65 70 75 80
Phe Thr Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Asn
85 90 95
Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr
100 105 110
Phe Pro Trp Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 35
<211> 699
<212> ДНК
<213> Искусственная
<220>
<223> Легкая цепь химерного антитела, связывающего PD-1 - 19 aa лидерная
последовательность
<400> 35
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgat 60
attgtgatga ctcagagcca taagtttatt tctaccagtg tcggggatcg tgtctccatt 120
acttgtaagg cttcccagga tgtggacacc gccgtggctt ggtaccagca gaagcccggc 180
cagtccccta aactgctgat ccactgggca tctactaggc acaccggagt gccagaccgg 240
ttcacaggcg gaggaagcgg gactgacttc accctgacac tgtctaacgt ccagagtgag 300
gacctggccg attacttctg tcagcagtat tcaaccttcc cttggacctt cggggggggt 360
acacggctgg aaatcaaacg tactgtggct gcaccatctg tcttcatctt cccgccatct 420
gatgagcagt tgaaatctgg aactgcctct gtggtgtgcc tgctgaataa cttctatccc 480
agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa ctcccaggag 540
agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac cctgacgctg 600
agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 660
agctcgcccg tcacaaagag cttcaacagg ggagagtgt 699
<210> 36
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 36
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 37
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 38
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 38
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 39
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 39
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 40
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 40
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 41
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 41
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 42
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 43
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 44
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 45
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 46
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 47
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 48
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 49
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 50
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 51
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Tyr Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 52
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 52
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 53
<211> 117
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела,
связывающего PD-1
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Arg Tyr
20 25 30
Asp Met Ala Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 54
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 54
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 55
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 55
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 56
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 56
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 57
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела,
связывающего PD-1
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asp Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 58
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 58
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe
35 40 45
Ser Arg Tyr Asp Met Ala Trp Val Arg Gln Thr Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro
65 70 75 80
Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
225 230 235 240
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
275 280 285
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 59
<211> 1389
<212> ДНК
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 59
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgag 60
gtgcagctgg tggaatctgg ggggggactg gtgcagcctg gaggaagcct gagactgtct 120
tgtgccgcat ctgggtttgt gttctccaga tacgacatgg catgggtgcg ccagacccca 180
ggcaagggcc tggagtgggt ggccttcatc agcggaggag gatccaacac ctactatcct 240
gacacagtga agggccggtt taccatctct agagataaca gcaagaatac actgtatctg 300
cagatgaaca gcctgcgggc cgaggataca gccgtgtact attgcatctc accttactac 360
tacgcaatgg aatactgggg acaggggact accgtcaccg tctcctcagc ctctacaaag 420
ggcccctccg tgtttccact ggctccctgc agcaggtcta catccgagag caccgctgct 480
ctgggatgtc tggtgaagga ttacttccct gagccagtga ccgtgagctg gaactccgga 540
gctctgacat ccggagtgca cacctttcct gctgtgctgc agagctctgg cctgtacagc 600
ctgtccagcg tggtgacagt gccatcttcc agcctgggca ccaagacata tacctgcaac 660
gtggaccata agcccagcaa taccaaggtg gataagagag tggagtctaa gtacggacca 720
ccttgcccac catgtccagc tcctgagttt ctgggaggac catccgtgtt cctgtttcct 780
ccaaagccta aggacaccct gatgatctct cgcacacccg aggtgacctg tgtggtggtg 840
gacgtgtccc aggaggatcc tgaggtgcag ttcaactggt acgtggatgg cgtggaggtg 900
cacaatgcta agaccaagcc tagggaggag cagtttaaca gcacataccg ggtggtgtct 960
gtgctgaccg tgctgcatca ggactggctg aacggcaagg agtataagtg caaggtgagc 1020
aataagggcc tgccatcttc catcgagaag acaatctcta aggctaaggg acagcctagg 1080
gagccacagg tgtacaccct gcccccttcc caggaggaga tgacaaagaa ccaggtgagc 1140
ctgacctgtc tggtgaaggg cttctatcct tctgacatcg ctgtggagtg ggagtccaat 1200
ggccagccag agaacaatta caagaccaca ccacccgtgc tggactccga tggcagcttc 1260
tttctgtatt ccaggctgac cgtggataag agccggtggc aggagggcaa tgtgttttct 1320
tgttccgtga tgcacgaagc actgcacaac cactacactc agaagtccct gtcactgtcc 1380
ctgggcaag 1389
<210> 60
<211> 233
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 60
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val
35 40 45
Asp Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys
50 55 60
Leu Leu Ile His Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Ser Ser
85 90 95
Val Gln Pro Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr
100 105 110
Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 61
<211> 699
<212> ДНК
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 61
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgac 60
attcagatga cccagagccc ttcaagtatt agcacctcag tcggggatag agtcacaatc 120
acctgtaaag ccagccagga cgtggacacc gcagtggcat ggtaccagca gaagcctggc 180
aagtccccta agctgctgat ccactgggca tctaccaggc acacaggagt gccaagcaga 240
ttctctggca gcggctccgg cacagatttt accctgacac tgagctccgt gcagccagag 300
gacctggcag attatttctg tcagcagtat tcaaccttcc cttggacctt cggcggaggc 360
actaaactgg agatcaaacg aacggtggct gcaccatctg tcttcatctt cccgccatct 420
gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa cttctatccc 480
agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa ctcccaggag 540
agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac cctgacgctg 600
agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 660
agctcgcccg tcacaaagag cttcaacagg ggagagtgt 699
<210> 62
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 62
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe
35 40 45
Ser Arg Tyr Asp Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro
65 70 75 80
Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
225 230 235 240
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
275 280 285
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 63
<211> 1389
<212> ДНК
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 63
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgag 60
gtgcagctgg tggaatctgg ggggggactg gtgcagcctg gaggaagcct gagactgtct 120
tgtgccgcat ctgggtttgt gttctccaga tacgacatgg catgggtgcg ccaggcacca 180
ggcaagggcc tggagtgggt gagcttcatc agcggaggag gatccaacac ctactatcct 240
gacacagtga agggccggtt taccatctct agagataaca gcaagaatac actgtatctg 300
cagatgaaca gcctgcgggc cgaggataca gccgtgtact attgcatctc accttactac 360
tacgcaatgg aatactgggg acaggggact accgtcaccg tctcctcagc ctctacaaag 420
ggcccctccg tgtttccact ggctccctgc agcaggtcta catccgagag caccgctgct 480
ctgggatgtc tggtgaagga ttacttccct gagccagtga ccgtgagctg gaactccgga 540
gctctgacat ccggagtgca cacctttcct gctgtgctgc agagctctgg cctgtacagc 600
ctgtccagcg tggtgacagt gccatcttcc agcctgggca ccaagacata tacctgcaac 660
gtggaccata agcccagcaa taccaaggtg gataagagag tggagtctaa gtacggacca 720
ccttgcccac catgtccagc tcctgagttt ctgggaggac catccgtgtt cctgtttcct 780
ccaaagccta aggacaccct gatgatctct cgcacacccg aggtgacctg tgtggtggtg 840
gacgtgtccc aggaggatcc tgaggtgcag ttcaactggt acgtggatgg cgtggaggtg 900
cacaatgcta agaccaagcc tagggaggag cagtttaaca gcacataccg ggtggtgtct 960
gtgctgaccg tgctgcatca ggactggctg aacggcaagg agtataagtg caaggtgagc 1020
aataagggcc tgccatcttc catcgagaag acaatctcta aggctaaggg acagcctagg 1080
gagccacagg tgtacaccct gcccccttcc caggaggaga tgacaaagaa ccaggtgagc 1140
ctgacctgtc tggtgaaggg cttctatcct tctgacatcg ctgtggagtg ggagtccaat 1200
ggccagccag agaacaatta caagaccaca ccacccgtgc tggactccga tggcagcttc 1260
tttctgtatt ccaggctgac cgtggataag agccggtggc aggagggcaa tgtgttttct 1320
tgttccgtga tgcacgaagc actgcacaac cactacactc agaagtccct gtcactgtcc 1380
ctgggcaag 1389
<210> 64
<211> 233
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 64
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val
35 40 45
Asp Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr
100 105 110
Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 65
<211> 699
<212> ДНК
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 65
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgac 60
attcagatga ctcagagccc ttcaagcgtg tcagcaagcg tgggcgacag ggtcaccatc 120
acatgcaaag cctctcagga tgtggacacc gcagtcgcct ggtatcagca gaagcctggg 180
aaagctccaa agctgctgat ctactgggca agtacacggc acactggagt gccttccaga 240
ttctccggct ctgggagtgg aacagacttt actctgacca tcagcagcct ccagcccgag 300
gacttcgcta cctactattg tcagcagtac agcacatttc cttggacttt tggcggggga 360
accaaagtgg aaatcaagcg aacggtggct gcaccatctg tcttcatctt cccgccatct 420
gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa cttctatccc 480
agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa ctcccaggag 540
agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac cctgacgctg 600
agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 660
agctcgcccg tcacaaagag cttcaacagg ggagagtgt 699
<210> 66
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 66
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe
35 40 45
Ser Arg Tyr Asp Met Ala Trp Val Arg Gln Thr Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Phe Ile Ser Gly Gly Gly Ser Asn Thr Tyr Tyr Pro
65 70 75 80
Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ile Ser Pro Tyr Tyr Tyr Ala Met Glu Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
225 230 235 240
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
275 280 285
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 67
<211> 1389
<212> ДНК
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 67
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgag 60
gtgcagctgg tggaaagtgg agggggactg gtgcagcccg gagggagcct gagactgagt 120
tgtgccgcaa gtggattcgt gttctcaaga tacgacatgg catgggtgcg ccagacacca 180
ggcaagggac tggagtgggt cagcttcatc tccggcgggg gaagcaacac ctactatcct 240
gacacagtga agggccggtt tactatctct agagataaca gtaagaacac cctgtatctg 300
cagatgaatt ctctgcgagc cgaagatacc gctgtctact attgcatctc accttattat 360
tacgctatgg agtattgggg acagggaaca acagtcaccg tcagcagcgc ctctacaaag 420
ggcccctccg tgtttccact ggctccctgc agcaggtcta catccgagag caccgctgct 480
ctgggatgtc tggtgaagga ttacttccct gagccagtga ccgtgagctg gaactccgga 540
gctctgacat ccggagtgca cacctttcct gctgtgctgc agagctctgg cctgtacagc 600
ctgtccagcg tggtgacagt gccatcttcc agcctgggca ccaagacata tacctgcaac 660
gtggaccata agcccagcaa taccaaggtg gataagagag tggagtctaa gtacggacca 720
ccttgcccac catgtccagc tcctgagttt ctgggaggac catccgtgtt cctgtttcct 780
ccaaagccta aggacaccct gatgatctct cgcacacccg aggtgacctg tgtggtggtg 840
gacgtgtccc aggaggatcc tgaggtgcag ttcaactggt acgtggatgg cgtggaggtg 900
cacaatgcta agaccaagcc tagggaggag cagtttaaca gcacataccg ggtggtgtct 960
gtgctgaccg tgctgcatca ggactggctg aacggcaagg agtataagtg caaggtgagc 1020
aataagggcc tgccatcttc catcgagaag acaatctcta aggctaaggg acagcctagg 1080
gagccacagg tgtacaccct gcccccttcc caggaggaga tgacaaagaa ccaggtgagc 1140
ctgacctgtc tggtgaaggg cttctatcct tctgacatcg ctgtggagtg ggagtccaat 1200
ggccagccag agaacaatta caagaccaca ccacccgtgc tggactccga tggcagcttc 1260
tttctgtatt ccaggctgac cgtggataag agccggtggc aggagggcaa tgtgttttct 1320
tgttccgtga tgcacgaagc actgcacaac cactacactc agaagtccct gtcactgtcc 1380
ctgggcaag 1389
<210> 68
<211> 233
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 68
Met Gly Trp Ser Trp Ile Leu Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Ile Ser Thr
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val
35 40 45
Asp Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys
50 55 60
Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
85 90 95
Leu Gln Pro Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Thr
100 105 110
Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 69
<211> 699
<212> ДНК
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела, связывающего PD-1 - 19 aa
лидерная последовательность
<400> 69
atgggctgga gctggatcct gctgttcctc ctgagcgtga cagcaggagt gcacagcgac 60
atccagatga cccagtctcc ctcaagcatt tcaacctcag tcggcgatag agtgaccatt 120
acctgcaagg caagccagga cgtggacaca gccgtggctt ggtaccagca gaagcccggc 180
aaaagtccta agctgctgat ctattgggca agcactcggc acaccggggt cccatccaga 240
ttctctggca gtgggtcagg aaccgatttt accctgacaa ttagctccct gcagcccgag 300
gacttcgccg attacttttg tcagcagtat tcaacatttc cctggacttt cggcgggggc 360
accaaggtcg agattaagcg aacggtggct gcaccatctg tcttcatctt cccgccatct 420
gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa cttctatccc 480
agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa ctcccaggag 540
agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac cctgacgctg 600
agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 660
agctcgcccg tcacaaagag cttcaacagg ggagagtgt 699
<210> 70
<211> 107
<212> PRT
<213> Homo sapiens
<400> 70
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 71
<211> 106
<212> PRT
<213> Homo sapiens
<400> 71
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 72
<211> 327
<212> PRT
<213> Homo sapiens
<400> 72
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2732604C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| АНТИТЕЛА ПРОТИВ БЕЛКА-1 ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ (PD-1) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725950C1 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ TIGIT, ОТДЕЛЬНО И В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ РЕЦЕПТОРА 1 ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-1), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820576C2 |
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АКТИВИРУЮЩИХ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ ПРОТИВ CD3 И ФОЛАТНОГО РЕЦЕПТОРА 1 (FOLR1) И АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С ОСЬЮ PD-1 | 2015 |
|
RU2753902C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| АНТИТЕЛА К PD-1 | 2015 |
|
RU2715628C2 |
| Иммунотерапия с применением антител, связывающих лиганд 1 белка программируемой смерти клеток (PD-L1) | 2017 |
|
RU2766582C2 |

Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, специфично связывающим белок 1 программируемой смерти клеток (PD-1) человека. Также раскрыты фармацевтическая композиция, содержащая указанное антитело, иммуноконъюгат и слитый белок, содержащие указанное антитело, молекула выделенной нуклеиновой кислоты, кодирующая указанное антитело, рекомбинантный экспрессионный вектор, содержащий указанную нуклеиновую кислоту, клетка-хозяин, содержащая указанный вектор. Раскрыты способ лечения субъекта с применением заявленного антитела. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с экспрессией белка PD-1. 16 н. и 2 з.п. ф-лы, 1 ил., 9 табл., 5 пр.
1. Выделенное антитело или его антигенсвязывающий фрагмент, специфично связывающие белок 1 программируемой смерти клеток (PD-1) человека, где антитело или его антигенсвязывающий фрагмент содержит:
(a) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 11, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 14, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 17, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 2, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 5, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 8; или
(b) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 12, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 15, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 18, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 3, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 6, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 9; или
(c) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 13, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 16, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 19, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 4, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 7, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 10.
2. Выделенное антитело или его антигенсвязывающий фрагмент, специфично связывающие PD-1 человека, где антитело или его антигенсвязывающий фрагмент содержит:
(a) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 11, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 14, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 17, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 2, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 5, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 8; или
(b) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 12, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 15, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 18, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 3, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 6, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 9; или
(c) последовательность CDR1 легкой цепи, представленную в SEQ ID NO: 13, последовательность CDR2 легкой цепи, представленную в SEQ ID NO: 16, последовательность CDR3 легкой цепи, представленную в SEQ ID NO: 19, последовательность CDR1 тяжелой цепи, представленную в SEQ ID NO: 4, последовательность CDR2 тяжелой цепи, представленную в SEQ ID NO: 7, последовательность CDR3 тяжелой цепи, представленную в SEQ ID NO: 10;
и где антитело или его антигенсвязывающий фрагмент дополнительно содержит набор из четырех каркасных областей вариабельной области иммуноглобулина человека (IgG).
3. Выделенное антитело или его антигенсвязывающий фрагмент по п. 1 или 2, связывающиеся с белком PD-1 с константой диссоциации (KD) по меньшей мере примерно 1x10-6 М, по меньшей мере примерно 1x10-7 М, по меньшей мере примерно 1x10-8 М, по меньшей мере примерно 1x10-9 М, по меньшей мере примерно 1x10-10 М, по меньшей мере примерно 1x10-11 М или по меньшей мере примерно 1x10-12 М.
4. Выделенное антитело или его антигенсвязывающий фрагмент по любому из пп. 1-3, выбранные из человеческого антитела, гуманизированного антитела, химерного антитела, моноклонального антитела, поликлонального антитела, рекомбинантного антитела, антигенсвязывающего фрагмента антитела, одноцепочечного антитела, диатела, триатела, тетратела, Fab фрагмента, Fab' фрагмента, Fab2 фрагмента, F(ab)'2 фрагмента, доменного антитела, IgD антитела, IgE антитела, IgM антитела, IgG1 антитела, IgG2 антитела, IgG3 антитела, IgG4 антитела или IgG4 антитела, имеющего по меньшей мере одну мутацию в шарнирной области, которая ослабляет тенденцию к образованию дисульфидных связей в H-цепях.
5. Выделенное гуманизированное антитело или его антигенсвязывающий фрагмент, специфично связывающие PD-1 человека и содержащие последовательность вариабельной области тяжелой цепи, идентичную SEQ ID NO: 36, 38, 40–42 и 53, и последовательность вариабельной области легкой цепи, идентичную SEQ ID NO: 37, 39, 43–52 и 54–57.
6. Выделенное гуманизированное антитело или его антигенсвязывающий фрагмент, специфично связывающиеся с PD-1 человека и содержащие последовательность тяжелой цепи, представленную в SEQ ID NO: 58, и последовательность легкой цепи, представленную в SEQ ID NO: 60.
7. Выделенное гуманизированное антитело или его антигенсвязывающий фрагмент, специфично связывающиеся с PD-1 человека и содержащие последовательность тяжелой цепи, представленную в SEQ ID NO: 62, и последовательность легкой цепи, представленную в SEQ ID NO: 64.
8. Выделенное гуманизированное антитело или его антигенсвязывающий фрагмент, специфично связывающиеся с PD-1 человека и содержащие последовательность тяжелой цепи, представленную в SEQ ID NO: 66, и последовательность легкой цепи, представленную в SEQ ID NO: 68.
9. Фармацевтическая композиция для лечения расстройств, опосредованных PD-1, содержащая эффективное количество выделенного антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8 в смеси с фармацевтически приемлемым носителем.
10. Способ лечения субъекта, страдающего связанным с T-клетками заболеванием, где указанное связанное с T-клетками заболевание опосредовано PD-1, включающий введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8.
11. Способ лечения субъекта, страдающего раковым заболеванием, где указанное раковое заболевание опосредовано PD-1, включающий введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8.
12. Способ лечения субъекта, страдающего инфекционным заболеванием, где указанное инфекционное заболевание опосредовано PD-1, включающий введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8.
13. Способ лечения субъекта, страдающего инфекционным заболеванием или раковым заболеванием, где указанное инфекционное заболевание или раковое заболевание опосредовано PD-1, включающий: a) введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8 и b) проведение одного или более дополнительных видов терапии, выбранных из группы, состоящей из иммунотерапии, химиотерапии, таргетной терапии низкомолекулярными ингибиторами киназ, хирургического вмешательства, лучевой терапии, протоколов вакцинации и трансплантации стволовых клеток, где комбинированная терапия обеспечивает усиленное уничтожение опухолевых клеток, т.е. при совместном применении выделенного антитела или его антигенсвязывающего фрагмента и дополнительных видов терапии они обладают синергетическим действием.
14. Выделенный иммуноконъюгат для лечения расстройств, опосредованных PD-1, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, соединенный с эффекторной молекулой.
15. Слитый белок для лечения расстройств, опосредованных PD-1, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, соединенный с эффекторной молекулой.
16. Молекула выделенной нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8.
17. Рекомбинантный экспрессионный вектор, содержащий выделенную нуклеиновую кислоту по п. 16.
18. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8, содержащая вектор по п. 17.
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ И ОПУХОЛЕЙ | 2007 |
|
RU2540490C2 |
| WO 2016092419 A1, 16.06.2016 | |||
| WO 2016077397 A2, 19.05.2016. | |||
Авторы
Даты
2022-03-24—Публикация
2017-12-23—Подача