Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии.
Большая подкожная вена (БПВ) в настоящее время является самым используемым конудитом при коронарном шунтировании в силу доступности и простоты выделения. Несмотря на это, окклюзия и стенозирование аутовенозных шунтов в краткосрочном и долгосрочном периоде после операции представляет собой важную и неразрешенную проблему в кардиохирургической практике. В краткосрочном периоде (в течение 1 месяца) причиной непроходимости является тромботическая окклюзия шунтов, в то время как в долгосрочном периоде доминирующей причиной непроходимости шунтов является атеросклеротический процесс с последующей окклюзией, протекающий на фоне гиперплазии неоинтимы [1]. Ключевую роль в ранней дисфункции аутовенозных шунтов играют структурные и функциональные изменения компонентов стенки венозного конудита. Это происходит вследствие воздействия множества факторов, таких как среда и температура хранения, воздействие гидростатического давления при гидравлической дилятации вены. Хранение венозных аутортрансплантантов в теплом солевом растворе приводит к гибели эндотелиоцитов, тогда как хранение в теплой крови сопровождается умеренными изменениями эндотелия. Ситуация складывается иначе при хранении кондуитов в холодных средах: сохраняется целостность эндотелия в обеих случаях, хотя при хранении в холодном солевом растворе отмечался отек стенки кондуита [2].
Немаловажное значение имеет давление, нагнетаемое при гидравлической дилятации кондуита. Последняя применяется для проверки герметичности, выявления повреждений и предотвращения спазма, вызванного травмой и гипоксией во время операции и послеоперационном периоде. [3] При ручной гидравлической дилятации, которая применяется в рутинной практике, гидростатическое давление неконтролируемо и обычно превышает значение 300 мм рт. ст.
Высокое давление приводит к глубоким структурным и функциональным изменениям. Расширение вены под давлением свыше 300 мм рт. ст. вызывает серьезные повреждения эндотелия и отек стенки. Сосудистый эндотелий уплощается и разрушается, отмечаются глубокие повреждения интимы и медии [2]. Гибель эндотелиоцитов приводит к накоплению фибрина на поверхности стенки, адгезии тромбоцитов и нейтрофилов.
Повреждение эндотелия активизирует внешний каскад коагуляции с помощью тканевого фактора, который экспрессируется субэндотелием [4].
Воздействие высокого давления также приводит к снижению активности NO-синтазы с увеличением склонности к агрегации тромбоцитов, усиливается экспрессия генов, контролирующих пролиферацию и миграцию гладкомышечных клеток [3, 5]. Активность NO-синтазы коррелирует с проходимостью шунтов в раннем и отдаленном послеоперационном периоде.
Гидравлическая дилятация под давлением, пропорциональным артериальному давлению крови, способствует сохранению целостности всех слоев сосудистой стенки, биохимических характеристик и функции эндотелия и медии, не приводит к снижению синтеза NO [3].
Высокое гидродинамическое давление также приводит к функциональным изменениям стенки будущего шунта. Нагнетание давления до 300 мм рт. ст. и выше приводит к снижению сократительного ответа на действие фенилэфрина и деполяризующего раствора хлорида, а также снижению ответа на эндотелий-зависимые вазодилятаторы (ацетилхолин и брадикинин), изменения отсутствовали при нагнетании давления 100 мм рт. ст. [6]. Таким образом существует настоятельная необходимость разработки способа контролируемой гидравлической дилятации вены.
В проанализированной патентной и научно-медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является создание легко воспроизводимого, стандартизированного способа гидравлической дилятации кондуита, сохраняющего морфофункциональные характеристики будущего венозного шунта.
Поставленная задача решается тем, что интактный венозный кондуит после выделения канюлируют и помещают в холодный раствор гепаринизированной крови. К аортальной канюле через порт Люера предварительно присоединяют переходник в форме тройника, к которому фиксируют дополнительный переходник по типу «папа-папа» для соединения с венозным кондуитом. После канюляции аорты венозный кондуит через переходники соединяют с аортальной магистралью. Запускают искусственное кровообращение с перфузионным давлением 50-70 мм рт. ст. (в среднем 65 мм рт. ст.), тщательно проверяют герметичность кондуита, накладывают дополнительные сосудистые клипы.
Новым в предлагаемом в качестве изобретения способе является присоединение венозного кондуита к аортальной магистрали через систему переходников с перфузионной гидравлической дилятацией перфузионным давлением аорты.
Предлагаемый способ исключает необходимость использования трудоемких технологий по физиологическому расправлению венозного кондуита.
Существенные признаки, характеризующие изобретение, проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не являющиеся очевидными для специалиста.
Идентичной совокупности признаков не обнаружено при изучении патентной и научно-медицинской литературы.
Данное изобретение может быть использовано в практическом здравоохранении для повышения качества и эффективности лечения.
Предлагаемое изобретение соответствует условиям патентоспособности «Новизна», «Изобретательский уровень», «Промышленная применимость».
Предлагаемое изобретение будет понятно из следующего описания и приложенных к нему чертежей, где:
На Фиг. 1 приведен способ оптимальной гидравлической дилятации в процессе подготовки аутовенозных кондуитов при операциях коронарного шунтирования. Крупный план:
1 - Аорта;
2 - Артериальная магистраль ИК;
3 - Система переходников;
4 - Канюлированный венозный кондуит;
На Фиг. 2 - Способ оптимальной гидравлической дилятации в процессе подготовки аутовенозных кондуитов при операциях коронарного шунтирования. Обзорный снимок:
1 - Аорта;
2 - Артериальная магистраль ИК;
3 - Система переходников;
4 - Канюлированный венозный кондуит;
На фиг. 3 - морфологическая картина изменений стенки сосуда, подвергнутого ручной гидравлической дилятации. Выраженное истончение стенки сосуда
На фиг. 4 - морфологическая картина изменений стенки сосуда, подвергнутого ручной гидравлической дилятации. Множественные микроразрывы во всех оболочках.
На фиг. 5 - морфологическая картина изменений стенки сосуда при перфузионной гидравлической дилятации. Слои стенки сосуда сохранены.
На фиг. 6 - Результаты биофизического исследования. Ответ гладкомышечного аппарата стенки вены на деполяризующий раствор хлорида калия и фенилэфрина:
МН - механическое напряжение;
ФЭ - фенилэфрин;
мМ - милиммоль;
мкМ - микроммоль;
KCl - хлорид калия;
NaCl - хлорид натрия;
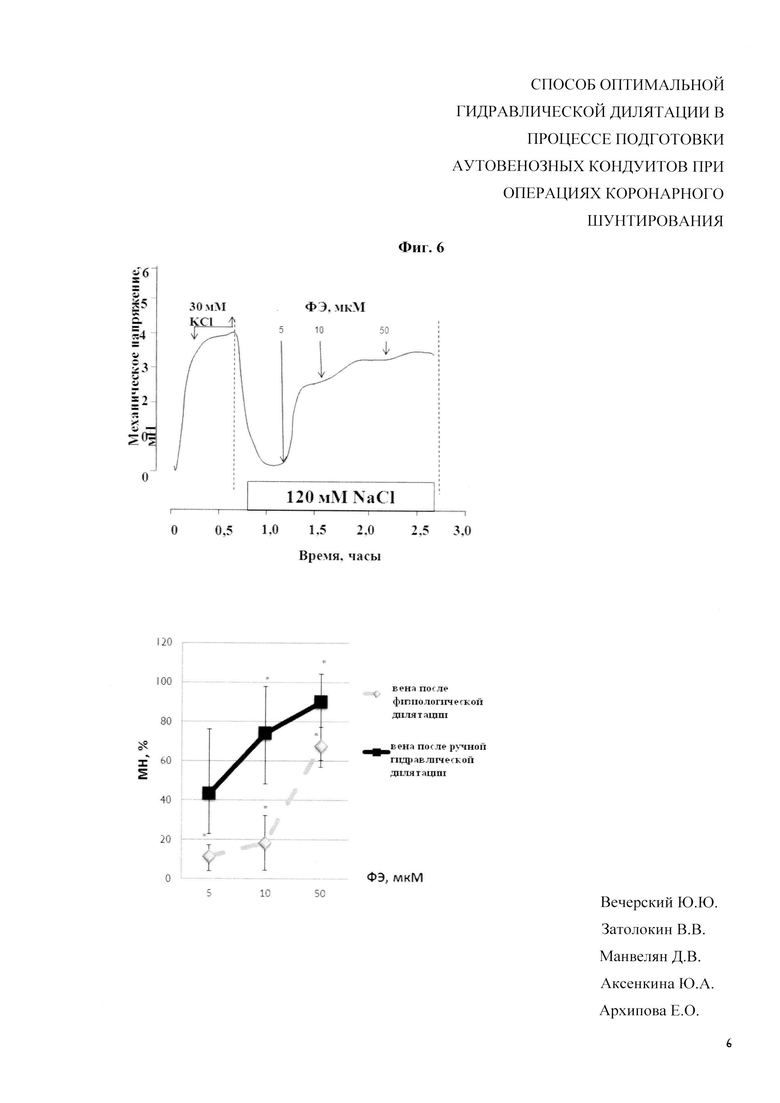
На фиг. 7 - Результаты биофизического исследования. Ответ гладкомышечного аппарата стенки вены на нитропруссид натрия:
МН - механическое напряжение;
РЕ - фенилэфрин;
мМ - милиммоль;
мкМ - микроммоль;
KCl - хлорид калия;
NaCl - хлорид натрия;
НП - нитропруссид натрия:
Способ осуществляют следующим образом.
Доставляют пациента в операционную. Проводят индукцию вводный наркоз, интубацию, катетеризацию центральной вены и лучевой артерии слева. В условиях нейролептаналгезии проводится обработка раствором антисептика и ограничение операционного поля. Разрезают кожу, подкожную клетчатку, выполняют срединную стернотомию. Проводят широкую Т-образную перикардиотомию. После вскрытия перикарда вводят раствор гепарина (из расчета 300 ЕД на 1 кг массы тела больного).
Одновременно с разрезом на груди начинается выделение большой подкожной вены с разрезом кожи, подкожной клетчатки на протяжении всей длины забираемого кондуита. Производится выделение вены из окружающих тканей с максимальным сохранением паравазальной клетчатки.
После вскрытия перикарда накладываются кисетные швы и подключается аппарат искусственного кровообращения, вариант подключения выбирают в соответствии с планируемым объемом операции, при этом к аортальной канюле предварительно подсоединяют конструкцию переходников по вышеуказанной схеме. Инициируется начало искусственного кровообращения. После этого к порту переходника присоединяется канюлированная аутовена, порт открывается (фиг. 1 и 2). Кровью вымываются остаточные тромботические массы. Далее на дистальный от аортальной магистрали конец вены накладывается сосудистый зажим типа «Бульдог». Начинается перфузионная гидравлическая дилятация вены под влиянием перфузионного давления.
Вена тщательно осматривается, необходимые участки клипируются. После этого порт закрывается, венозный кондуит отсоединяется.
Выполняют поперечное пережатие аорты, после чего начинают антеградную кардиоплегию раствором «Кустодиол» в корень аорты. Начинается основной этап. Накладываются дистальные анастомозы к пораженным коронарным артериям. Снимается поперечный зажим с аорты. После восстановления сердечной деятельности выполняется боковое пережатие аорты с последующим формированием проксимальных анастомозов к аорте. Останавливается искусственное кровообращение, после этого выполняется флоуметрическая оценка кровотока по шунтам. Деканюляция, гемостаз. Дренирование полости перикарда и переднего средостения, при необходимости плевральных полостей. Далее проводится металлоостеосинтез грудины проволочными лигатурами, после чего послойно ушиваются мягкие ткани. Завершается операция наложением асептической повязки.
Клинический пример
Пациент С., 59 года. Диагноз: ИБС. Стенокардия напряжения, ФК III. Атеросклероз коронарных артерий (передняя нисходящая артерия субтотальный стеноз в пр/3, I диагональная артерия в устье стеноз 75%, огибающая артерия в ср/3 75%, правая коронарная артерия 75%). НК I, ФК II по NYHA.
Эхокардиография до операции: нарушения глобальной и локальной сократимости, патологии клапанов не выявлено.
Ультразвуковое сканирование вен нижних конечности: вены проходимы, не расширены, компрессивность сохранена.
06.04.17 - выполнена операция аортокоронарного и маммарокоронарного шунтирования коронарных артерий. Интраоперационной использовалась гидравлическая дилятация кондуита предложенным способом. Выполнялась флоуметрическая оценка кровотока по шунтам: объемная скорость соответствует диаметру коронарной артерии, пульсативный индекс менее 5, диастолическое наполнение более 65%. Операция закончена в обычном порядке.
Фрагменты вены, оставшиеся после операции, подвергаются ручной гидравлической дилятации шприцом с гепаринизированной кровью. К канюле аутовены присоединяется переходник по типу тройника, соединенный посредством магистрали с монометрическим датчиком (величина давления составила 320 мм рт. ст.).
Образцы вен перфузионной и ручной неуправляемой гидравлической дилятации были исследованы. Проведена морфологическая и биофизическая оценка обоих методов расширения.
Послеоперационный период протекал гладко, возврата стенокардии, периоперационного инфаркта не отмечено. Осложнений со стороны нижних конечностей не отмечено, заживление ран первичным натяжением. На 18-й день после операции пациент был выписан из стационара с улучшением течения текущего заболевания.
Морфологические изменения в стенках вен. Ручная гидравлическая дилятация характеризуется истончением стенки сосуда (фиг. 3), множественными микроразрывами во всех оболочках (фиг. 4). Для перфузионной дилатации характерна сохранность слоев стенки сосуда, повреждения, обусловленные методом расширения, не выявлены (фиг. 5).
Функциональное состояние вен. Исследование сократительной активности гладких мышц проводили методом механографии. Амплитуду сократительных ответов рассчитывали в процентах от амплитуды гиперкалиевого сокращения (эквимолярное замещение 30 мМ NaCl на KCl) и/или фенилэфрин-индуцированного сокращения, которые принимали за 100%. Способность гладких миоцитов к релаксации оценивалась с помощью добавления к предсокращенным сегментам вен нитропруссида натрия.
Механографическим методом установлено, что гиперкалиевый раствор вызывает увеличение сокращения гладкомышечного препарата при обоих методах дилятации. Амплитуда сокращения выше во фрагментах вен, подвергнутых перфузионно гидравлической дилятации. Фрагменты вен, подвергнутые ручной гидравлической дилятации, менее чувствительны к α-адреномиметику фенилэфрину, амплитуда сокращения значительно ниже (фиг. 6). Нитропруссид натрия вызывает полное снижение напряжения гладкомышечного препарата, предсокращенного как фенилэфрином, так и гиперкалиевым раствором как при перфузионной дилятации, так и при ручной дилятации (фиг. 7).
Предлагаемый в качестве изобретения способ апробирован на 30 пациентах со стенокардией напряжения и позволяет исключить травмирующее влияние неконтролируемого гидродинамического давления на стенку будущего венозного шунта в виде грубых морфофункциональных изменений. Это дает возможность исключить негативное влияние высокого гидростатического давления на дальнейшее функционирование аутовенозного кондуита. Предлагаемый способ легко воспроизводим.
Список используемой литературы
1. Motwani JG, Topol EJ. Aortocoronary saphenous vein graft disease: pathogenesis, predisposition, and prevention. Circulation. 1998 Mar 10;97(9):916-31. Review.
2. Gundry SR, Jones M, Ishihara T, Ferrans VJ. Optimal preparation techniques for human saphenous vein grafts. Surgery. 1980 Dec; 88(6):785-94.
3. Okon EB, Millar MJ, Crowley CM, Bashir JG, Cook RC, Hsiang YN, McManus B, van Breemen C. Effect of moderate pressure distention on the human saphenous vein vasomotor function. Ann Thorac Surg. 2004 Jan; 77(l):108-14.
4. Verrier ED, Boyle EM Jr. Endothelial cell injury in cardiovascular surgery. Ann Thorac Surg. 1996 Sep; 62(3):915-22. Review.
5. Dashwood MR, Savage K, Tsui JC, Dooley A, Shaw SG, 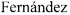 Alfonso MS, Bodin L, Souza DS. Retaining perivascular tissue of human saphenous vein grafts protects against surgical and distension-induced damage and preserves endothelial nitric oxide synthase and nitric oxide synthase activity. J Thorac Cardiovasc Surg. 2009 Aug; 138(2):334-40. doi: 10.1016/j.jtcvs. 2008.11.060. Epub 2009 Mar 10.
Alfonso MS, Bodin L, Souza DS. Retaining perivascular tissue of human saphenous vein grafts protects against surgical and distension-induced damage and preserves endothelial nitric oxide synthase and nitric oxide synthase activity. J Thorac Cardiovasc Surg. 2009 Aug; 138(2):334-40. doi: 10.1016/j.jtcvs. 2008.11.060. Epub 2009 Mar 10.
6. Chester AH. Buttery LD, Borland JA, Springall DR. Rothery S, Severs NJ, Polak JM, Yacoub MH. Structural, biochemical and functional effects of distendingpressure in the human saphenous vein: implications for bypass grafting. Coron. Artery Dis. 1998; 9(2-3):143-51.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ физиологической дилатации венозного кондуита для подготовки к аорто-коронарному шунтированию без искусственного кровообращения | 2024 |
|
RU2836288C1 |
| Способ забора аутовенозного кондуита для шунтирования коронарных артерий | 2024 |
|
RU2840604C1 |
| СПОСОБ ЭНДОСКОПИЧЕСКОГО ЗАБОРА ВЕНОЗНОГО КОНДУИТА ДЛЯ ОПЕРАЦИИ КОРОНАРНОГО ШУНТИРОВАНИЯ | 2014 |
|
RU2561001C1 |
| СПОСОБ ПРЯМОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА ПРИ ИЗОЛИРОВАННОМ УСТЬЕВОМ ПОРАЖЕНИИ СТВОЛА ЛЕВОЙ КОРОНАРНОЙ АРТЕРИИ | 2014 |
|
RU2551187C1 |
| СПОСОБ ФОРМИРОВАНИЯ БИФУРКАЦИОННОГО АУТОВЕНОЗНОГО КОНДУИТА | 2020 |
|
RU2745727C1 |
| Способ замещения корня аорты композитным биологическим кондуитом, состоящим из бесшовного клапанного протеза и линейного сосудистого протеза | 2022 |
|
RU2802744C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ОЦЕНКИ НЕСОСТОЯТЕЛЬНОСТИ КОРОНАРНЫХ ШУНТОВ | 2014 |
|
RU2556785C1 |
| СПОСОБ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ ДЛЯ ИНТРАОПЕРАЦИОННОЙ ГИСТОМОРФОЛОГИЧЕСКОЙ ОЦЕНКИ ЦЕЛОСТНОСТИ КОРОНАРНЫХ КОНДУИТОВ ПРИ АОРТОКОРОНАРНОМ ШУНТИРОВАНИИ | 2018 |
|
RU2677785C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ПУТИ ОТТОКА ЛЕВОГО ЖЕЛУДОЧКА ПРИ ЭКСТРАВАЛЬВУЛЯРНОМ РАЗРУШЕНИИ УСТЬЯ АОРТЫ | 2004 |
|
RU2300320C2 |
| СПОСОБ ФОРМИРОВАНИЯ ДИСТАЛЬНОГО АНАСТОМОЗА ПРИ РЕКОНСТРУКЦИИ ВЫВОДНОГО ОТДЕЛА ПРАВОГО ЖЕЛУДОЧКА ЭКСТРАКАРДИАЛЬНЫМ КОНДУИТОМ У ДЕТЕЙ С ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА | 2017 |
|
RU2644921C1 |





Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии. Интактный венозный кондуит после выделения канюлируется и помещается в холодный раствор гепаринизированной крови. К аортальной канюле через порт Люера предварительно присоединяется переходник в форме тройника, к которому фиксирован дополнительный переходник по типу «папа-папа» для соединения с венозным кондуитом. После канюляции аорты венозный кондуит через переходники соединяется с аортальной магистралью. Запускается искусственное кровообращение с перфузионным давлением 50-70 мм рт. ст. На фоне искусственного кровообращения тщательно проверяется герметичность кондуита, при необходимости накладываются дополнительные сосудистые клипы. Присоединяют венозный кондуит к аортальной магистрали через систему переходников с перфузионной гидравлической дилятацией перфузионным давлением аорты. Способ позволяет исключить травмирующее влияние неконтролируемого гидродинамического давления на стенку будущего венозного шунта в виде грубых морфофункциональных изменений и тем самым способствующего хорошей проходимости шунтов в ранние сроки после операции. 7 ил., 1 пр.
Способ гидравлической дилатации в процессе подготовки аутовенозных кондуитов при операциях коронарного шунтирования, характеризующийся тем, что интактный венозный кондуит после выделения канюлируют и помещают в холодный раствор гепаринизированной крови, затем соединяют кондуит с аортальной магистралью, для соединения кондуита с аортальной магистралью к аортальной канюле предварительно через порт Люера присоединяют переходник в форме тройника, к которому фиксируют дополнительный переходник по типу «папа-папа», после канюляции аорты венозный кондуит через данные переходники соединяют с аортальной магистралью, затем запускают искусственное кровообращение с перфузионным давлением 50-70 мм рт. ст., а на дистальный от аортальной магистрали конец аутовенозного кондуита накладывают сосудистый зажим и проверяют герметичность кондуита.
| Лызиков А | |||
| А., Аутологичная вена как протез сосуда, Проблемы здоровья и экологии, 2010, 2, С.132-139 | |||
| СПОСОБ ПОДГОТОВКИ АУТОВЕНЫ МАЛОГО ДИАМЕТРА ДЛЯ ВАЛЬВУЛОТОМИИ ПРИ БЕДРЕННО-ПОДКОЛЕННОМ ШУНТИРОВАНИИ | 2015 |
|
RU2585747C2 |
| Под ред | |||
| Покровского А | |||
| В., Клиническая ангиология, М., 2004 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Питательный кран для вагонных резервуаров воздушных тормозов | 1921 |
|
SU189A1 |
| Gundry SR, Jones M, Ishihara T, Ferrans VJ | |||
| Optimal preparation techniques for human saphenous vein grafts | |||
| Surgery | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
Авторы
Даты
2018-07-19—Публикация
2017-07-17—Подача