ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В целом изобретение относится к области диагностических или прогностических анализов, в частности к оптимизации анализов для выявления антител в образце, содержащем жидкость организма пациента, где такие антитела используют в качестве биологических маркеров болезненного состояния или предрасположенности к заболеванию.
УРОВЕНЬ ТЕХНИКИ
Многие диагностические, прогностические анализы и/или анализы для наблюдения основаны на выявлении биологического маркера конкретного болезненного состояния или предрасположенности к заболеванию. Такие биологические маркеры представляют собой обычные белки или полипептиды, характерные для конкретного заболевания или связанные с предрасположенностью к заболеванию.
В последние годы стало очевидно, что антитела, а особенно аутоантитела, также могут служить в качестве биологических маркеров заболевания или предрасположенности к заболеванию. Аутоантитела представляют собой природные антитела, направленные против антигена, который иммунная система индивида распознает как чужеродный, даже если этот антиген на самом деле образовался у индивида. Они могут находиться в кровотоке в виде циркулирующих свободных аутоантител или в виде циркулирующих иммунных комплексов, состоящих из аутоантител, которые связаны с их маркерным белком-мишенью. Различия между белком дикого типа, экспрессируемым "нормальными" клетками, и измененной формой белка, продуцируемой пораженной заболеванием клеткой или в процессе заболевания, могут в некоторых случаях приводить к тому, что измененный белок распознается иммунной системой индивида как "чужеродный", и, таким образом, у этого индивида развивается иммунная реакция. Это может быть гуморальная (т.е. опосредуемая B-клетками) иммунная реакция, приводящая к продукции аутоантител, которые иммунологически специфичны в отношении измененного белка.
В WO 99/58978 описаны способы выявления/диагностики рака на основе оценки иммунной реакции индивида на два или более различных маркеров опухоли. Как правило, эти способы включают в себя контактирование полученного у индивида образца жидкости организма с набором из двух или более различных антигенов, являющихся маркерами опухоли, где каждый получен из отдельного белка-маркера опухоли, и регистрацию образования комплексов антигенов-маркеров опухоли, связанных с циркулирующими аутоантителами, которые иммунологически специфичны в отношении белков-маркеров опухоли. Присутствие таких циркулирующих аутоантител рассматривают как указание на наличие рака.
Анализы, посредством которых у индивида измеряют иммунную реакцию на наличие белка-маркера опухоли на уровне продукции аутоантител, представляют собой альтернативу непосредственному измерению или выявлению белка-маркера опухоли в жидкостях организма. В основном такие анализы связаны с косвенной регистрацией присутствия белка-маркера опухоли. По-видимому, вследствие природы иммунной реакции образование аутоантител может быть вызвано очень небольшим количеством циркулирующего белка-маркера опухоли, и, соответственно, косвенные способы на основе регистрации иммунной реакции на маркеры опухоли, являются более чувствительными, чем способы прямого измерения количества маркеров опухоли в жидкостях организма. Поэтому способы анализа на основе регистрации аутоантител могут представлять особую ценность в начале процесса заболевания, а также, возможно, и в отношении отбора пациентов с отсутствием симптомов, например, в отборе для выявления в популяции индивидов с отсутствием симптомов, обнаруживаемых у тех индивидов, которые "имеют риск" развития заболевания, для выявления в популяции индивидов с отсутствием симптомов тех индивидов, у которых развилось заболевание. Кроме того, способ на основе регистрации аутоантител может представлять особую ценность в начале процесса заболевания, а также, возможно, его можно использовать для выявления в популяции индивидов с симптомами тех индивидов, у которых развилось заболевание. Кроме того, способы могут быть эффективны для более раннего выявления повторного заболевания. Также способы анализа могут представлять ценность для выбора или наблюдения за вариантами лечения заболевания.
Также антитела и аутоантитела могут служить в качестве биологических маркеров других состояний заболевания или предрасположенности к заболеваниям, только лишь примерами которых являются ревматоидный артрит, системная красная волчанка (SLE), первичный билиарный цирроз (PBC), аутоиммунный тиреоидит (например, тиреоидит Хашимото), аутоиммунный гастрит (например, злокачественная анемия), аутоиммунное воспаление надпочечников (например, болезнь Аддисона), аутоиммунный гипопаратиреоз, аутоиммунный диабет (например, диабет типа 1), тяжелая миастения.
Авторы настоящего изобретения выявили, что когда анализы на основе регистрации антител используют в диагностических или прогностических целях для оценки болезненного состояния, развития заболевания или предрасположенности к заболеванию у индивида в популяции, то могут возникать сложности в разработке стандартизированного способа анализа, приемлемого в целом для популяции индивидов, подлежащих скринингу, поскольку абсолютные количества присутствующего антитела значительно отличаются от индивида к индивиду. Это может приводить к высокой частоте ложноотрицательных результатов, например, среди индивидов с низким количеством антитела. Сходным образом, существует проблема количественной оценки истинных положительных результатов, поскольку различия в абсолютных количествах антитела от индивида к индивиду обуславливают сложность установления порогового значения для положительного результата анализа, которое было бы приемлемым для всех индивидов в популяции, подлежащей скринингу.
К настоящему времени авторы настоящего изобретения определили, что проведение, а более конкретно, клиническое использование и достоверность, анализов на основе выявления антител, особенно аутоантител как биологических маркеров заболевания, можно значительно улучшить посредством включения стадии титрования антигена. Тестирование образца, в котором предполагается наличие антител против серий различных количеств антигена, и построение кривой титрования дает возможность достоверно выявить истинные положительные результаты скрининга, независимо от абсолютного количества антитела, присутствующего в образце. Такой способ отличается от способов предшествующего уровня, в которых антиген титровали только для построения калибровочной кривой, позволяющей установить наиболее подходящие концентрации антигена, которые следует использовать для выявления антител в настоящих образцах от пациентов. В этих способах для фактической диагностики предложено измерение только одной точки. Таким образом, эти способы не позволяют определить различие в количествах антитела от индивида к индивиду, что, как было сказано, приводит к возникновению ложноположительных и ложноотрицательных результатов. Авторы настоящего изобретения обнаружили, что описанный в настоящей заявке способ титрования антигена согласно изобретению имеет более высокую специфичность и чувствительность, чем измерение реактивности аутоантител при одной концентрации антигена, или чем способы, в которых титруют образец сыворотки, а не антиген.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к способу выявления болезненного состояния или предрасположенности к заболеванию у млекопитающего, где способ включает в себя выявление антитела в тестируемом образце, содержащем жидкость из организма указанного млекопитающего, где указанное антитело является биологическим маркером болезненного состояния или предрасположенности к заболеванию, где способ включает в себя
(a) контактирование указанного тестируемого образца со множеством различных количеств антигена, специфичного в отношении указанного антитела,
(b) выявление величины специфического связывания указанного антитела и указанного антигена,
(c) построение графика или вычисление кривой зависимости величины указанного специфического связывания от количества антигена для каждого количества антигена, используемого на стадии (a), и
(d) определение наличия или отсутствия указанного болезненного состояния или предрасположенности к заболеванию на основе величины специфического связывания указанного антитела и указанного антигена для каждой отдельной используемой концентрации антигена.
Во втором аспекте изобретение относится к способу выявления антитела в тестируемом образце, содержащем жидкость из организма млекопитающего, где указанное антитело направлено против чужеродного вещества, введенного в организм указанного млекопитающего, где способ включает в себя
(a) контактирование тестируемого образца со множеством различных количеств антигена, специфичного в отношении указанного антитела,
(b) выявление величины специфического связывания указанного антитела и указанного антигена, и
(c) построение графика или вычисление кривой зависимости величины указанного специфического связывания от количества антигена для каждого количества антигена, используемого на стадии (a).
В третьем аспекте изобретение относится к способу выявления антитела в тестируемом образце, содержащем жидкость из организма млекопитающего, где указанное антитело представляет собой биологический маркер болезненного состояния или предрасположенности к заболеванию, где способ включает в себя
(a) контактирование тестируемого образца со множеством различных количеств антигена, специфичного в отношении указанного антитела,
(b) выявление величины специфического связывания указанного антитела и указанного антигена, и
(c) построение графика или вычисление кривой зависимости величины указанного специфического связывания от количества антигена для каждого количества антигена, используемого на стадии (a).
Предпочтительно во всех аспектах изобретения, чтобы млекопитающим являлся человек.
Предпочтительно во всех аспектах изобретения, чтобы способ осуществлялся in vitro для тестируемого образца, содержащего жидкость организма, извлекаемую или получаемую у млекопитающего.
Особым свойством изобретения во всех его аспектах является то, что решение относительно наличия или отсутствия соответствующего антитела в тестируемом образце основано на величине специфического связывания, наблюдаемой для каждой отдельной тестируемой концентрации антигена, иначе говоря, на совокупных величинах, а не только на считывании при одной концентрации. Таким образом, определение наличия или отсутствия болезненного состояния или предрасположенности к заболеванию или антител против чужеродного вещества в образце от пациента можно осуществлять на основе непосредственно этих совокупных величин. Предпочтительно, чтобы оценка осуществлялась на основе обычно S-образной или сигмовидной кривой, когда строят график зависимости величины специфического связывания от количества антигена. Как очевидно из представленных в настоящей заявке примеров, авторами изобретения было выявлено, что способы титрования антигена согласно изобретению имеют более высокую специфичность и чувствительность, чем способы диагностики или регистрации, основанные на единичном считывании, а также снижают частоту ложноположительных и ложноотрицательных определений.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1: измерение количества аутоантител в сыворотке с использованием кривой титрования антигена. Сыворотка 17766(C) от пациента с раком в значительной степени связывает тестируемый антиген с характерной сигмовидной кривой  , но не связывается с отрицательным контролем, VOL
, но не связывается с отрицательным контролем, VOL  . В сравнении с этим, сыворотка от здорового индивида, 18052(N), не связывается с тестируемым антигеном
. В сравнении с этим, сыворотка от здорового индивида, 18052(N), не связывается с тестируемым антигеном 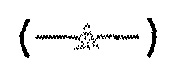 или с отрицательным контролем
или с отрицательным контролем 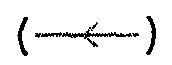 .
.
Фиг.2: сравнение уровней аутоантитела против p53 у здоровых индивидов и пациентов с первичным раком молочной железы (PBC), как измерено с использованием анализа титрования антигена. Уровни аутоантитела выражены в виде разности величины OD650, обусловленной связыванием с тестируемым антигеном (p53), и величины OD650, обусловленной связыванием с отрицательным контролем. Нормальный уровень (-----) рассчитывали как среднее значение плюс 2 стандартных отклонения для обычной популяции.
На фиг.3 представлено сравнение уровней аутоантител против p53 и NY-ESO у здоровых индивидов и пациентов с раком легких, как измерено с использованием анализа титрования антигена. Уровни аутоантител выражены в виде разности величины OD650, обусловленной связыванием с тестируемым антигеном (p53 или NY-ESO), и величины OD650, обусловленной связыванием с отрицательным контролем. Нормальные отсекаемые уровни (-----) рассчитывали как среднее значение плюс 2 стандартных отклонения для обычной популяции.
На фиг.4 представлена кривая титрования для выявления аутоантител против p53 и NY-ESO в образце асцитной жидкости, полученной у пациента с раком молочной железы. Для этого пациента проводили тест, но не обнаружили продукции аутоантител против c-myc.
На фиг.5 представлена кривая титрования для выявления аутоантител против BRCA1, BRCA2 и HER2 в образце сыворотки от пациента с раком молочной железы (карцинома протоков in situ).
На фиг.6 представлена кривая титрования для выявления аутоантител против NY-ESO в образце сыворотки от пациента с раком легких. Для этого пациента проводили тест, но не обнаружили продукции аутоантител против p53 или c-myc.
На фиг.7 представлена кривая титрования для выявления аутоантител против NY-ESO и p53 в образце сыворотки от пациента с раком легких. Для этого пациента проводили тест, но не обнаружили продукции аутоантител против c-myc.
На фиг.8(a) и 8(b) представлены результаты двух независимых анализов титрования для аутоантител против p53, c-myc и NY-ESO-1 в образцах сыворотки от "здорового" индивида (т.е. индивида без признаков рака).
На фиг.9(a) и 9(b) представлены результаты двух независимых анализов титрования, выполненных для образцов сыворотки от одного пациента с инвазивным раком молочной железы с использованием диапазона различных антигенов.
На фиг.10(a) и 10(b) представлены результаты анализов титрования, в которых образцы сыворотки от клинически нормального человека тестировали на наличие аутоантител с использованием биотинилированных антигенов BRCA2, HER2, c-myc и NY-ESO-1, небиотинилированного BRCA1 и контрольных продуктов экспрессии "пустого" вектора VOL, кодирующего биотиновую метку, но без дополнительного антигена.
На фиг.11 представлены результаты анализа аутоантител у пациента с первичным раком молочной железы с использованием анализа титрования антигена согласно изобретению в отношении антигенов p53, c-myc и NY-ESO-1 и контрольных продуктов экспрессии "пустого" вектора VOL.
На фиг.12 представлены результаты повторного анализа, представленного на фиг.11, но с использованием сыворотки от здорового индивида.
На фиг.13 представлены дополнительные результаты, полученные с использованием анализа титрования антигена в соответствии с данным изобретением для пациента с первичным раком молочной железы, у которого, однако, также наблюдают реакцию антител на биотин.
На фиг.14 на нормальных образцах представлены результаты экспериментального сравнения, полученных при анализе регистрации аутоантител, когда антиген титруют в соответствии с изобретением, и при анализе регистрации аутоантител, когда количество антигена остается постоянным, а титруют сыворотку.
На фиг.15 представлены результаты экспериментального сравнения для образца от пациента с первичным раком молочной железы, полученные при анализе регистрации аутоантител, когда антиген титруют в соответствии с изобретением, и при анализе регистрации аутоантител, когда количество антигена остается постоянным, а титруют сыворотку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В целом изобретение относится к способу иммуноанализа для выявления антитела, служащего биологическим маркером болезненного состояния или предрасположенности к заболеванию, где способ характеризуется тем, что образец, подлежащий тестированию на наличие антитела, тестируют на предмет специфического связывания с различными количествами специфичного в отношении антитела антигена, и получают кривую титрования по связыванию антиген-антитело в зависимости от количества тестируемого антигена.
Общие характеристики иммуноанализов, например, ELISA, радиоиммунных анализов и т.п., хорошо известны специалистам в данной области (см. Immunoassay, E. Diamandis and T. Christopoulus, Academic Press, Inc., San Diego, CA, 1996). Как правило, иммуноанализы для выявления антител с конкретной иммунологической специфичностью требуют использования реагента (антигена), обладающего специфической иммунологической реактивностью в отношении тестируемого антитела. В зависимости от схемы анализа, этот антиген может быть иммобилизован на твердом носителе. Образец, подлежащий тестированию на наличие антитела, приводят в контакт с антигеном, и если антитела требуемой иммунологической специфичности присутствуют в образце, то они иммунологически взаимодействуют с антигеном, образуя комплексы антиген-антитело, которые затем можно выявлять или измерять количественно.
Способ согласно изобретению характеризуется тем, что стандартизированный образец, подлежащий тестированию на наличие антитела, тестируют против множества различных количеств антигена (также называемых в настоящей заявке сериями титрования). Образец тестируют против по меньшей мере двух, а предпочтительно, трех, четырех, пяти, шести или семи различных количеств антигена. Также обычные анализы могут включать отрицательный контроль, не содержащий какого-либо антигена.
В этом контексте термин "антиген" относится к веществу, содержащему по меньшей мере одну антигенную детерминанту или эпитоп, способный специфически взаимодействовать с антителом-мишенью, которое требуется выявить, или к любому веществу для захвата, специфически взаимодействующему с вариабельной областью или гипервариабельными участками указанного антитела. Как правило, антиген представляет собой природную или синтетическую биологическую макромолекулу, такую, например, как белок или пептид, полисахарид или нуклеиновая кислота, и может содержать антитела или их фрагменты, например, антиидиотипические антитела.
Специалисты в данной области понимают, что в способе согласно изобретению количество антигенных детерминант или эпитопов, доступных для связывания с антителом-мишенью, является важным для получения серий титрования. Во многих схемах анализа количество доступных для связывания антигенных детерминант или эпитопов прямо связано с количеством присутствующих молекул антигена. Однако в других вариантах осуществления, например, в определенных системах твердофазного анализа, количество подвергающихся воздействию антигенных детерминант или эпитопов может не быть прямо связано с количеством антигена, а может зависеть от других факторов, таких как прикрепление к твердому носителю. В этих вариантах осуществления ссылки в настоящей заявке на "различные количества антигена" в сериях титрования могут относиться к различным количествам антигенной детерминанты или эпитопа.
Относительную или абсолютную величину специфического связывания антитела и антигена определяют для каждого отдельного используемого количества антигена (антигенной детерминанты или эпитопа) и применяют для построения или расчета кривой (относительной или абсолютной) величины специфического связывания в зависимости от количества антигена для каждого тестируемого количества антигена. Характерные результаты проиллюстрированы на прилагающихся чертежах, только с целью примера, в отношении выявления множества различных антител. Наличие в тестируемом образце антитела, которое реакционноспособно в отношении используемого в анализе антигена, определяют на основе величины специфического связывания, наблюдаемого для каждого количества антигена, и обычно указывают посредством, в основном, S-образной или сигмовидной кривой. Как правило, абсолютные величины специфического связывания антитела и антигена не являются вещественными, за исключением случая, когда требуется осуществить количественное измерение. Для простого определения да/нет в отношении наличия или отсутствия антител достаточно только получить кривую надлежащей формы. Если различие в выявляемых величинах связывания для различных тестируемых количеств антигена отсутствует, то это можно оценивать как отсутствие поддающегося выявлению количества антитела. В предпочтительных вариантах осуществления изобретения способ не является количественным. Таким образом, он способен обеспечить определение да/нет в отношении наличия или отсутствия антитела при использовании безразмерного пропорционального соотношения, которое не зависит от интенсивности сигнала.
Оценку количества антитела, присутствующего в конкретном образце, можно, при необходимости, получать из результатов анализов титрования антигена.
Способ согласно изобретению предпочтителен для использования в клинических, диагностических, прогностических, предсказательных и/или контролирующих анализах, где абсолютные количества присутствующего антитела-мишени могут значительно отличаться от пациента к пациенту. Авторами настоящего изобретения было выявлено, что если такие анализы основаны на регистрации связывания антитела с использованием единственной величины количества/концентрации тестируемого антигена, то образцы от пациентов, содержащие антитело в количестве, которое находится у самой нижней или самой верхней границы нормального физиологического диапазона для количества антитела среди популяции, могут быть пропущены вследствие ограничений способа анализа; образцы с низким количеством антитела могут быть оценены как ложноотрицательные результаты, тогда как образцы с очень высокими уровнями антитела могут выходить за пределы шкалы точной регистрации для выбранного способа анализа.
Также способ анализа титрования согласно изобретению особенно эффективен для регистрации антител/аутоантител как биологических маркеров болезненного состояния или предрасположенности, где от пациента к пациенту существуют значительные различия в специфичности и аффинности антител/аутоантител в отношении антигена-мишени. По самой своей природе реакции аутоантител могут значительно различаться от пациента к пациенту, где различия возникают как в абсолютных количествах присутствующих аутоантител, так и в специфичности/аффинности аутоантител. В способе согласно изобретению может учитываться такое различие от пациента к пациенту, что, таким образом, обеспечивает возможность разработки стандартной схемы анализа для любого рассматриваемого антитела/аутоантитела.
Как правило, взаимодействия между аутоантителами и их антигенами-мишенями обладают низкой аффинностью, однако прочность связывания может различаться от пациента к пациенту, как указано выше. Способ согласно изобретению особенно эффективен для регистрации связывания с низкой аффинностью, поскольку положительный результат можно выводить из формы кривой титрования.
Также способ согласно изобретению обеспечивает защиту от различий от суток к суткам в проведении иммуноанализов, используемых для выявления аутоантител/антител в целях диагностики, прогнозирования и/или наблюдения (за состоянием заболевания или лечением). Часто наблюдают, что при проведении иммуноанализов для выявления антител в образцах, содержащих жидкости организма пациента, могут быть значительные различия величины сигнала от суток к суткам. Такое отличие может возникать, например, вследствие различий в способе получения и хранения образцов до тестирования. Такие факторы затрудняют достоверную количественную оценку результатов клинических анализов, например, на основе простой пороговой величины для связывания антитело/антиген. Настоящее изобретение минимизирует эффекты такого различия от суток к суткам, поскольку положительный результат в отношении наличия антитела четко виден из формы кривой титрования вне зависимости от величины сигнала.
Дополнительные преимущества способа согласно изобретению состоят в том, что он предоставляет возможность разведения образца от пациента, обеспечивая при этом достоверные результаты, а также в том, что, как правило, способ приводит к получению одинакового по качеству результата скрининга (положительного/отрицательного) при использовании жидкостей организма из различных источников из одного индивида (например, кровь или сыворотка в сравнении с асцитной жидкостью или плевральным выпотом), даже если абсолютная концентрация антител в различных жидкостях может отличаться.
Способ согласно изобретению можно осуществлять по любой приемлемой схеме, позволяющей контактирование образца, в котором предполагают наличие антитела, и антигена во множестве различных количествах. Удобно, что контактирование образца и различных количеств антигена можно осуществлять в отдельных, но параллельных реакционных камерах, таких как лунки планшета для микротитрования. Различные количества антигена можно наносить в лунки планшета для микротитрования посредством получения серийных разведений из исходного источника антигена на протяжении лунок планшета для микротитрования. Исходный источник антигена может иметь известную или неизвестную концентрацию. Затем в лунки планшета можно добавлять аликвоты тестируемого образца при сохранении в каждой лунке постоянного объема и разведения тестируемого образца. Абсолютные количества антигена, добавляемого в лунки планшета для микротитрования, могут различаться в зависимости от таких факторов, как природа антитела-мишени, природа тестируемого образца, разведение тестируемого образца и т.д., как понимают специалисты в данной области. Как правило, количества антигена и разведение тестируемого образца выбирают таким образом, чтобы получить диапазон интенсивности сигнала, входящий в приемлемый регистрируемый диапазон для считывания данных, выбранного в способе для выявления связывания антитело/антиген. Общепринятые количества и разведения для тестирования образцов сыворотки человека, в которых предполагают наличие аутоантител против маркеров опухоли, приведены в прилагаемых примерах. Удобно, что тестируемые количества антигена могут различаться в диапазоне от 0,01 мкг/мл до 10 мкг/мл.
Как указано выше, также существует возможность строить кривую титрования, начиная с единственного исходного источника антигена, даже если абсолютная концентрация антигена в исходном источнике неизвестна. При условии, что используют один и тот же единственный исходный раствор и осуществляют серийные разведения одним и тем же способом, существует возможность сравнивать результаты отдельных анализов титрования этого антигена, осуществляемых с различными исходными тестируемыми образцами.
В другом варианте осуществления различные количества антигена (антигенных детерминант или эпитопов) могут быть зафиксированы в отдельных положениях или реакционных участках на твердом носителе. После этого весь носитель можно приводить в контакт с тестируемым образцом и регистрировать или измерять связывание антитела с антигеном в каждом из отдельных положений или реакционных участков. Приемлемые твердые носители также включают в себя микрочипы, например, чипы, где отдельные участки или точки на чипе содержат различные количества антигена. Микрочипы можно получать фиксированием различных количеств конкретного антигена в отдельных, поддающихся разрешению реакционных участках на чипе. В других вариантах осуществления фактическое количество фиксированных молекул антигена можно поддерживать практически постоянным, однако размер участков или точек на чипе меняют для изменения количества доступного связывающего эпитопа, обеспечивая серии титрований участков или точек с различными количествами доступного связывающего эпитопа. В таких вариантах осуществления для получения серий титрования важна концентрация двумерной поверхности связывающего эпитопа(ов) на антигене, а не абсолютное количество антигена. Способы получения и считывания данных для белковых/пептидных микрочипов общеизвестны в данной области.
Из приведенного выше описания понятно, что во всех вариантах осуществления изобретения различие в количестве антигена можно получать изменением плотности антигена или эпитопа, против которого тестируют образец, или посредством поддержания плотности антигена или эпитопа, но при увеличении площади поверхности, на которой закреплен антиген, или посредством обоих способов.
Микрочипы можно использовать для проведения параллельно множества анализов для антител различной специфичности для одного образца. Это можно осуществлять с использованием чипов, содержащих множество наборов различных антигенов, где каждый набор содержит конкретный антиген во множестве различных количеств или концентраций. Термин "различные антигены" включает антигены, получаемые из различных белков или полипептидов (например, антигены, получаемые из неродственных белков, которые кодируются различными генами), а также антигены, получаемые из различных пептидных эпитопов одного белка или полипептида. Рассматриваемый микрочип может содержать только наборы различных антигенов, полученных из различных белков или полипептидов, или только наборы различных антигенов, полученных из различных пептидных эпитопов одного белка или полипептида, или смесь двух наборов в любом соотношении. Следует отметить, что каждый отдельный набор антигена в различных количествах или концентрациях в любом из вариантов осуществления изобретения, как правило, содержит только один антиген, а не его смеси.
В рамках настоящей заявки термин "жидкость организма" в отношении вещества, подлежащего тестированию на наличие антител с использованием способа согласно изобретению, включает, наряду с прочим, плазму, сыворотку, цельную кровь, мочу, пот, лимфу, фекалии, спинномозговую жидкость, асцитную жидкость, плевральный выпот, сперму, мокроту, аспират из сосков, послеоперационное опухолевидное скопление сыворотки или жидкость в результате дренирования раны. Как указано выше, способы согласно изобретению предпочтительно осуществляют in vitro для тестируемого образца, содержащего жидкость организма, которую получают у тестируемого индивида. Тип используемой жидкости организма может различаться в зависимости от природы антитела, подлежащего тестированию, и клинического состояния, при котором используют анализ. Как правило, предпочтительно проводить анализы для образцов сыворотки или плазмы. В дополнение к жидкости организма тестируемый образец может содержать добавочные компоненты, такие как, например, разбавители, консерванты, стабилизаторы, буферные вещества и т.д.
В рамках настоящей заявки термин "антиген" используют в широком смысле для обозначения любого вещества, проявляющего специфическую иммунологическую реактивность в отношении подлежащего выявлению антитела-мишени. Приемлемые антигены могут включать в себя, но ими не ограничиваются, природные белки, рекомбинантные или синтетические белки или полипептиды, синтетические пептиды, пептидомиметики и т.д., а также полисахариды и нуклеиновые кислоты. Конкретно, при использовании в настоящей заявке термина "антиген" подразумевают, что он включает в себя любое вещество для захвата, имеет ли оно человеческое происхождение, происхождение от млекопитающего или иное, где вещество способно к специфическому иммунологическому взаимодействию со множеством гипервариабельных участков антитела, подлежащего выявлению. Например, с этой целью в качестве антигена можно также рассматривать антиидиотипические антитела, как можно рассматривать антигены, получаемые посредством фагового дисплея.
Определенные антигены могут содержать или быть получены из белков или полипептидов, которые выделяют из природных источников, включая в себя, но ими не ограничиваясь, белки или полипептиды, выделяемые из ткани или жидкостей из организма пациента. В таких вариантах осуществления антиген может содержать практически весь природный белок, т.е. белок практически в том виде, в котором его выделяют из природного источника, или он может содержать фрагмент природного белка. Для того, чтобы быть эффективным в качестве антигена в способе согласно изобретению, любой такой "фрагмент" должен сохранять иммунологическую реактивность в отношении антител, для которых его используют в тестировании. Например, приемлемые фрагменты можно получать химическим или ферментативным расщеплением выделенного белка.
В зависимости от точного характера анализа, в котором его используют, антиген может содержать природный белок или его фрагмент, связанный с одной или несколькими дополнительными молекулами, которые придают некоторые желаемые характеристики, отсутствующие у белка в природе. Например, белок или фрагмент можно конъюгировать с регистрируемой меткой, такой как, например, флуоресцентная метка, цветная метка, люминесцентная метка, радиоактивная метка или тяжелый металл, такой как коллоидное золото. В других вариантах осуществления белок или фрагмент можно экспрессировать в виде слитого белка. В качестве примера, слитые белки могут содержать пептид-метку на N- или C-конце для способствования очистке рекомбинантно экспрессируемого антигена.
В зависимости от схемы анализа, в котором его подлежит использовать, антиген может быть зафиксирован на твердом носителе, таком как, например, лунки планшета для микротитрования, гранулы микрочипов или чипы или магнитные гранулы. Фиксацию можно осуществлять нековалентной адсорбцией или ковалентным присоединением.
Можно использовать любые приемлемые способы присоединения при условии, что это в значительной степени не оказывает неблагоприятного эффекта на способность антигена иммунологически реагировать с антителом-мишенью.
Изобретение не ограничено твердофазными анализами, но также включает анализы, которые полностью или частично проводят в жидкой фазе, например, анализы с гранулами в жидкой фазе.
В одном из вариантов осуществления антигены могут быть мечены лигандом, способствующим фиксации, например, биотином. Затем антиген можно разводить до приемлемого диапазона титрования и после этого позволять реагировать в растворе с аутоантителами в образцах от пациентов. После этого получаемые иммунные комплексы можно фиксировать на твердом носителе посредством взаимодействия лиганд-рецептор (например, биотин-стрептавидин) и проводить остальную часть анализа, как описано ниже.
Для способствования получению биотинилированных антигенов для использования в способах анализа согласно изобретению кДНК, кодирующие полноразмерный антиген, его усеченный вариант или его антигенный участок, можно экспрессировать в виде слитого белка, меченного белковой или полипептидной меткой, к которой можно посредством ферментативной реакции присоединять вспомогательный биотиновый фактор. Векторы для получения рекомбинантных биотинилированных антигенов коммерчески доступны во множестве источников.
Как проиллюстрировано в прилагаемых примерах, дополнительное преимущество использования способа кривой титрования вместе с биотинилированными антигенами состоит в том, что анализ позволяет различить связывание биотинового компонента с антителами против биотина и истинное связывание антигена с родственным ему антителом. Авторами изобретения было выявлено, что у значительного количества популяции людей в природе продуцируются антитела против биотина, что может приводить к ложноположительным результатам в анализах, основанных на использовании биотинилированного антигена.
Как указано выше, "иммуноанализ", используемый для выявления антител согласно изобретению, может быть основан на известных в данной области общепринятых способах, за исключением использования множества количеств антигена для построения кривой титрования. В наиболее предпочтительном варианте осуществления иммуноанализ может представлять собой ELISA. Как правило, ELISA хорошо известна в данной области. В обычном "непрямом" ELISA антиген, обладающий специфичностью к тестируемым антителам, фиксируют на твердом носителе (например, лунки обычного аналитического планшета для микротитрования или поверхность микрогранулы или микрочипа), и образец, содержащий жидкость организма, которую подлежит тестировать на наличие антител, приводят в контакт с зафиксированным антигеном. Любые антитела с желаемой специфичностью, присутствующие в образце, связываются с зафиксированным антигеном. Затем связавшиеся комплексы антитело/антиген можно выявлять любым приемлемым способом. В одном из предпочтительных вариантов осуществления для выявления комплексов антитело/антиген используют меченое вторичное антитело против иммуноглобулина человека, специфически распознающее эпитоп, общий для одного или нескольких классов иммуноглобулинов человека. Как правило, вторичное антитело представляет собой антитело против IgG или IgM. Обычно вторичное антитело метят поддающимся выявлению маркером, как правило, таким ферментом-маркером, как, например, пероксидаза или щелочная фосфатаза, делая возможным количественную регистрацию посредством добавления субстрата для фермента, образующего поддающийся регистрации продукт, например, окрашенный, хемилюминесцентный или флуоресцентный продукт. С равным эффектом можно использовать другие известные в данной области выявляемые метки.
Изобретение относится к способу выявления антител, являющихся биологическими маркерами болезненного состояния или предрасположенности к заболеванию. Предпочтительно, этот конкретный аспект изобретения исключает анализы, сконструированные для тестирования на предмет антител, продуцируемых в результате введения вакцины или схемы иммунизации, отличной от вакцинации маркерами рака. Поэтому анализы по этому аспекту изобретения, предпочтительно, не включают анализы, сконструированные для тестирования на наличие антител против вирусов или против бактерий после вакцинации/иммунизации.
В определенных вариантах осуществления изобретения антитело может представлять собой аутоантитело. Как указано выше, термин "аутоантитело" относится к природному антителу, направленному против антигена, который иммунная система индивида распознает как чужеродный, даже если этот антиген на самом деле образуется у индивида. Аутоантитела включают антитела, направленные против измененных форм природных белков, продуцируемых пораженной заболеванием клеткой или в течение процесса заболевания. Измененная форма белка образуется у индивида, но может рассматриваться иммунной системой индивида как "чужеродная" и, таким образом, вызывать у индивида иммунную реакцию в виде аутоантител, иммунологически специфичных к измененному белку. Например, такие измененные формы белка могут включать мутантные формы с измененной аминокислотной последовательностью, необязательно, сопровождающиеся изменениями во вторичной, третичной или четвертичной структурах, усеченные формы, варианты сплайсинга, измененные гликоформы и т.д. В других вариантах осуществления аутоантитело может быть направлено против белка, который при состоянии заболевания сверхэкспрессируется вследствие амплификации гена или патологической регуляции транскрипции. Сверхэкспрессия белка, обычно не встречающегося в значительных количествах клеткам иммунной системы, может вызывать иммунную реакцию, приводящую к продукции аутоантител. В еще одном варианте осуществления аутоантитело может быть направлено против зародышевой формы белка, который начинает экспрессироваться при состоянии заболевания. Если зародышевый белок, который обычно экспрессируется только на ранних стадиях развития до становления иммунной системы функциональной, начинает экспрессироваться при состоянии заболевания, то зародышевая форма может распознаваться иммунной системой как "чужеродная", вызывая иммунную реакцию, которая приводит к продукции аутоантител.
В одном из вариантов осуществления антитело может представлять собой аутоантитело, специфичное к белку-маркеру опухоли, а более конкретно, "связанное с раком" аутоантитело против опухоли.
Термин "связанное с раком" аутоантитело против опухоли относится к аутоантителу, направленному против эпитопа, присутствующего на вариантах белков-маркеров опухоли, предпочтительно экспрессирующихся при состоянии заболевания раком. Наличие таких аутоантител характерно для состояния заболевания раком или предрасположенности к раку у пациентов с отсутствием симптомов.
В предпочтительных вариантах применения способ согласно изобретению используют для выявления наличия связанных с раком аутоантител против опухоли у относящихся к человеку индивидов или пациентов, и, наиболее предпочтительно, способ имеет форму иммуноанализа in vitro, выполняемого для тестируемого образца, который содержит образец жидкости организма, полученный у индивида/пациента. Перед тестированием образец жидкости организма можно разводить в приемлемом буфере или можно обрабатывать для длительного хранения или иным образом.
Иммуноанализы in vitro являются неинвазивными и их можно повторять так часто, сколько предполагается необходимым для получения профиля продукции аутоантител у пациента или до возникновения заболевания, например, при скрининге индивидов "с риском развития заболевания", или на протяжении хода заболевания (дополнительно описано ниже в отношении предпочтительных вариантов использования способа).
В частности, но без ограничения, варианты осуществления способов согласно изобретению могут включать иммуноанализы для (одновременного) выявления двух или более видов аутоантител, где каждое обладает специфичностью к различным эпитопам на одинаковых или родственных белках-маркерах опухоли (например, различных изоформах или вариантах, кодируемых одним геном) или к эпитопам на различных белках-маркерах опухоли (подразумевая белки, кодируемые различными генами). Как правило, эти способы включают использование панели из двух или более наборов антигенов, где каждый набор антигенов обычно получают из отличного белка-маркера опухоли ("отличный" в этом контексте обозначает белки, являющиеся продуктами различных генов), хотя, как указано выше, набор антигенов также может содержать различные эпитопы на одном и том же белке-маркере опухоли. Набор антигенов относится к одному подлежащему тестированию антигену в различных количествах/концентрациях в способе согласно изобретению. В этих способах, которые ниже могут быть названы "анализы панелей", используют панель из двух или более наборов антигенов для наблюдения общей иммунной реакции индивида на опухоль или другое канцерогенное/неопластическое изменение. Таким образом, этими способами регистрируют "профиль" иммунной реакции у рассматриваемого индивида, выявляя, какие маркеры опухоли вызывают иммунную реакцию, приводящую к продукции аутоантител. Как правило, использование панели из двух или более антигенов для наблюдения продукции аутоантител против двух или более различных маркеров опухоли является более чувствительным, чем выявление аутоантител против отдельных маркеров, и приводит к значительно более низкой частоте ложноотрицательных результатов (см. WO 99/58978 и WO 2004/044590, содержания которых приведены здесь полностью в качестве ссылки).
Таким образом, в неограничивающем варианте осуществления изобретение относится к способу выявления двух или более антител в тестируемом образце, содержащем жидкость организма млекопитающего, где по меньшей мере одно из указанных антител является биологическим маркером болезненного состояния или предрасположенности к заболеванию, где способ включает в себя
(a) контактирование тестируемого образца с двумя или более наборами антигенов, где каждый из указанных наборов антигенов специфичен к одному из указанных антител, подлежащих выявлению в тестируемом образце, и где каждый набор антигенов содержит множество различных количеств указанного антигена,
(b) выявление величины специфического связывания указанных антител и указанных антигенов, и
(c) построение графика или расчет кривой для величины указанного специфического связывания в зависимости от количества антигена для каждого набора антигенов, используемого на стадии (a).
В одном из вариантов осуществления каждое из указанных двух или более антител является биологическим маркером болезненного состояния или предрасположенности к заболеванию, при этом в объем изобретения входит сочетание анализа титрования для антигена-маркера заболевания и анализа титрования для любого другого вида антитела, которое может являться или может не являться маркером заболевания, в том же самом тестируемом образце.
Так или иначе, оценка того, присутствуют или нет соответствующие антитела в тестируемом образце, основана на величине специфического связывания, наблюдаемой для каждой из различных концентраций антигена в отношении каждого различного антигена в тесте, иначе говоря, на суммарных величинах для каждого антигена, а не на считывании данных для единственной концентрации для каждого антигена. Таким образом, определение наличия или отсутствия болезненного состояния или предрасположенности к заболеванию, или антител против чужеродного вещества в образце от пациента, исходя из присутствия двух или более видов антитела, может быть основано на таких суммарных величинах для каждого антигена. Предпочтительно, оценку осуществляют на основе изображения, в основном, S-образной или сигмовидной кривой в отношении какого-либо или всех антигенов, присутствующих в тесте.
Во избежание недоразумений анализы, основанные на использовании одного вида антигена для выявления антител, могут быть названы в настоящей заявке "анализами одного маркера", тогда как анализы, основанные на использовании панели из двух или более антигенов, названы "анализами панелей".
Способ согласно изобретению можно приспосабливать к использованию в выявлении аутоантител практически для любого белка-маркера опухоли, для которого может быть получен приемлемый антиген, или в виде анализа одного маркера, или в виде компонента в анализе панелей. В частности, способ можно приспосабливать к выявлению/измерению аутоантител против белка рецептора эпидермального фактора роста EGFR (Downward et al. (1984) Nature 307:521-527; Robertson et al. (2001) Archives of Pathology and Laboratory Medicine 126:177-81), гликопротеина MUC1 (Batra, S.K. et al. (1992) Int. J. Pancreatology, 12:271-283) и регуляторных белков передачи сигналов/клеточного цикла Myc (Blackwood, E.M. et al. (1994) Molecular Biology of the Cell 5:597-609), p53 (Matlashewski, G. et al. (1984) EMBO J. 3:3257-3262; Wolf, D. et al. (1985) Mol. Cell. Biol. 5:1887-1893) и ras (или Ras) (Capella, G. et al. (1991) Environ Health Perspectives. 93:125-131), а также BRCA1 (Scully, R. et al. (1997) PNAS 94:5605-10), BRCA2 (Sharan, S.K. et al. (1997) Nature 386:804-810), APC (Su, L.K. et al. (1993) Cancer Res. 53:2728-2731; Munemitsu, S. et al. (1995) PNAS 92:3046-50), CA125 (Nouwen, E.J. et al. (1990) Differentiation. 45:192-8), PSA (Rosenberg, R.S. et al. (1998) Biochem Biophys Res Commun. 248:935-939), карциноэмбрионального антигена CEA (Duffy, M.J. (2001) Clin Chem, Apr 47(4):624-30), CA19.9 (Haga, Y. et al (1989) Clin Biochem (1989) Oct 22(5):363-8), NY-ESO-1 (антигена рака/семенников; Chen, Y.T. et al., Proc. Nat. Acad. Sci. 94:1914-1918, 1997), PSMA (специфического мембранного антигена простаты; Israeli, R.S. et al., Cancer Res. 53:227-230, 1993), PSCA (антигена стволовых клеток простаты; Reiter, R.E. et al., Proc. Nat. Acad. Sci. 95:1735-1740, 1998) и EpCam (молекулы адгезии клеток эпителия; Szala, S. et al., Proc. Nat. Acad. Sci. 87:3542-3546, 1990), HER2 (также называемого c-erbB2 Coussens, L. et al., Science 230:1132-1139, 1985), CAGE (Jager D, et al., Cancer Res. 1999 Dec 15;59(24):6197-204; Mashino K, et al., Br J Cancer. 2001 Sep 1;85(5):713-20), цитокератинов (Moll R, et al., Cell. 1982 Nov;31(1):11-24; Braun S, et al., N Engl J Med. 2000;342:525-533), рековерина (Maeda A, et al., Cancer Res. 2000 Apr 1;60(7):1914-20), калликреинов (Kim H, et al., Br J Cancer 2001;84:643-650; Yousef GM, et al., Tumor Biol 2002;23:185-192); аннексинов (Hudelist G, et al., Breast Cancer Res Treat. 2004 Aug;86(3):281-91), α-фетопротеина (Stiller D, et al., Acta Histochem Suppl. 1986;33:225-31), GRP78 (Block TM, et al., Proc Natl Acad Sci USA. 2005 Jan 18;102(3):779-84; Hsu WM, et al., Int J Cancer. 2005 Mar 1;113(6):920-7), CA125 (Norum LF, et al., Tumour Biol. 2001 Jul-Aug;22(4):223-8; Perey L, et al., Br J Cancer. 1990 Oct;62(4):668-70; Devine PL, et al., Anticancer Res. 1992 May-Jun;12(3):709-17); маммоглобина (Zehentner BK, et al., Clin Chem. 2004 Nov;50(11):2069-76; Zehentner BK, Carter D. Clin Biochem. 2004 Apr;37(4):249-57), raf (Callans LS. et al., Ann Surg Oncol. 1995 Jan;2(1):38-42; Pratt MA, et al., Mol Cell Biochem. 1998 Dec;189(1-2):119-25), бета-хорионического гонадотропина человека b-HCG (Ayala AR, et al., Am J Reprod Immunol. 1983 Apr-May;3(3):149-51; Gregory JJ Jr, et al., Drugs. 1999 Apr;57(4):463-7) или антигена 4-5 (Krause P, et al., J Immunol Methods. 2003 Dec;283(1-2):261-7). Однако подразумевают, что изобретение не ограничивается выявлением аутоантител против этих конкретных маркеров опухоли.
Способы анализа согласно изобретению, основанные на выявлении аутоантител против маркеров опухоли (в виде одного маркера или в виде анализа панелей), можно использовать во множестве различных клинических случаях. В частности, способ можно использовать для выявления или диагностики рака, в оценке прогноза для пациента с диагностированным раком, в прогнозе реакции на лечение, в наблюдении за развитием у пациента рака или другого неопластического заболевания, для выявления раннего неопластического или раннего канцерогенного изменения у человека с отсутствием симптомов, в скрининге популяции людей с отсутствием симптомов для выявления тех индивидов, кто обладает повышенным риском развития рака, или для диагностирования наличия рака, в прогнозе реакции пациента с раком на противораковое лечение (например, вакцинацию, варианты лечения, направленные против фактора роста или передачи сигналов, лучевую терапию, эндокринную терапию, лечение антителами человека, химиотерапию), в наблюдении реакции пациента с раком на противораковое лечение (например, вакцинацию, варианты лечения, направленные против фактора роста или передачи сигналов, лучевую терапию, эндокринную терапию, лечение антителами человека, химиотерапию), для выявления повторного заболевания у пациента, у которого ранее диагностировали рак и который подвергался противораковому лечению для уменьшения степени присутствующего рака, или в выборе противоракового лечения (например, вакцина, варианты лечения, направленные против фактора роста или передачи сигналов, лучевая терапия, эндокринная терапия, лечение антителами человека, химиотерапия) для использования для конкретного пациента.
В целом, авторами настоящего изобретения было выявлено, что уровни связанных с раком аутоантител проявляют положительную взаимосвязь с состоянием заболевания (см. также WO 99/58979, содержания которого приведены здесь полностью в качестве ссылки). Таким образом, при использовании способа согласно изобретению в клинических вариантах применения повышенные уровни аутоантител против маркеров опухоли в сравнении с соответствующими контролями, как правило, рассматривают как признак состояния заболевания раком.
Например, при использовании иммуноанализов в диагностике рака наличие повышенного уровня аутоантител в сравнении с "нормальными" контрольными индивидами рассматривается как показатель наличия у индивида рака. Предпочтительно, "нормальные" контрольные индивиды представляют собой соответствующих по возрасту контрольных индивидов, у которых отсутствует какой-либо диагноз рака на основе клинических, полученных посредством визуализации и/или биохимических показателей.
При использовании иммуноанализов в прогнозировании реакции пациента с раком на противораковое лечение (например, вакцинацию, варианты лечения, направленные против фактора роста или передачи сигналов, лучевую терапию, эндокринную терапию, лечение антителами человека, химиотерапию) наличие повышенного уровня аутоантител в сравнении с "нормальными" контрольными индивидами может рассматриваться как показатель вероятности того, ответит ли индивид на противораковое лечение или нет. Предпочтительно, "нормальные" контрольные индивиды представляют собой соответствующих по возрасту контрольных индивидов, у которых отсутствует какой-либо диагноз рака на основе клинических, полученных посредством визуализации и/или биохимических показателей.
Для каждого из указанных выше вариантов лечения взаимосвязь уровня аутоантител, сравниваемого с контролями, и вероятной эффективности лечения можно выявлять посредством наблюдения за результатом такого лечения у пациентов, у которых на протяжении лечения наблюдают состояние аутоантител. Затем ранее выявленную взаимосвязь можно использовать для прогнозирования вероятности эффективности каждого варианта лечения для рассматриваемого пациента на основе оценки состояния аутоантител.
При использовании иммуноанализов в наблюдении развития у пациента рака или другого неопластического заболевания наличие повышенного уровня аутоантител в сравнении с "нормальным контролем" рассматривается как показатель наличия у пациента рака. "Нормальный контроль" может представлять собой уровни аутоантител, присутствующие у контрольных индивидов, предпочтительно, соответствующих по возрасту, у которых отсутствует какой-либо диагноз рака на основе клинических, полученных посредством визуализации и/или биохимических показателей. Альтернативно, "нормальный контроль" может представлять собой "исходный" уровень, устанавливаемый для конкретного тестируемого пациента. Например, "исходный" уровень может представлять собой уровень аутоантител, присутствующих при первом диагностировании рака или диагностировании повторного рака. Любое превышение исходного уровня рассматривается как показатель повышения степени присутствующего у пациента рака, тогда как любое уменьшение ниже исходного уровня рассматривается как показатель уменьшения степени присутствующего у пациента рака. Также "исходная" величина, например, может представлять собой уровень до начала нового лечения. Изменение уровня аутоантител рассматривается как показатель эффективности лечения. Направление "изменения" (т.е. повышение или снижение), указывающее на положительную реакцию на лечение, зависит от точного характера лечения. Для любого заданного варианта лечения направление "изменения" уровней аутоантител, указывающее на положительный результат, можно легко определить, например, наблюдением уровней аутоантител в сравнении с другими клиническими или биохимическими показателями реакции на лечение.
При использовании иммуноанализов в скрининге популяции людей с отсутствием симптомов, что можно проводить для выявления тех индивидов, которые обладают повышенным риском развития рака, индивидов с увеличенным уровнем аутоантител в сравнении с "нормальными" контрольными индивидами определяют как "обладающих риском" развития рака. Предпочтительно, "нормальные" контрольные индивиды представляют собой соответствующих по возрасту контрольных индивидов, у которых не выявлено какой-либо предрасположенности к развитию рака или какого-либо значительно повышенного риска развития рака. Исключением из этого может являться случай, когда возраст сам по себе представляет основной фактор риска.
При использовании иммуноанализов в скрининге популяции людей с отсутствием симптомов, что можно проводить для выявления тех индивидов, у которых уже развился рак, индивидов с повышенным уровнем аутоантител в сравнении с "нормальными" контрольными индивидами оценивают как пораженных раком или другим видом неопластических изменений. Предпочтительно, "нормальные" контрольные индивиды представляют собой соответствующих по возрасту контрольных индивидов, у которых не выявлено какой-либо предрасположенности к развитию рака или какого-либо значительно повышенного риска развития рака. Исключением из этого может являться случай, когда возраст сам по себе представляет основной фактор риска. Альтернативно, "нормальный контроль" может представлять собой "исходный" уровень, устанавливаемый для конкретного тестируемого пациента. Например, "исходный" уровень может представлять собой уровень аутоантител, присутствующий, когда пациента тестировали в первый раз и не обнаружили у него повышенных уровней в сравнении с "нормальной контрольной" популяцией. Любое превышение исходного уровня после этого рассматривается как показатель наличия рака у этого индивида. Таким образом, посредством такого исходного теста индивид может стать своим собственным контролем для будущего измерения аутоантител.
При использовании иммуноанализов в наблюдении за реакцией пациента с раком на противораковое лечение (например, вакцинацию, варианты лечения, направленные против фактора роста или передачи сигналов, лучевую терапию, эндокринную терапию, лечение антителами человека, химиотерапию) наличие измененного уровня аутоантител после лечения рассматривается как показатель того, что пациент положительно отреагировал на лечение. Исходный уровень аутоантител, рассматриваемый до начала лечения, можно использовать в целях сравнения для определения того, приводит ли лечение к "повышению или понижению" уровней аутоантител. Изменение уровня аутоантител рассматривается как показатель эффективности лечения. Направление "изменения" (т.е. повышение или снижение), указывающее на положительную реакцию на лечение, зависит от точного характера лечения. Для любого заданного варианта лечения направление "изменения" уровней аутоантител, указывающее на положительный результат, можно легко определить, например, наблюдением уровней аутоантител в сравнении с другими клиническими или биохимическими показателями реакции на лечение.
Способ согласно изобретению можно использовать в прогнозировании и/или наблюдении реакции индивида на практически любой известный вариант противоракового лечения. Например, такие варианты включают в себя лечение антителами человека, где пациенту вводят инфузией моноклональные или поликлональные антитела, неограничивающим специфическим примером чего является лечение антителом против фактора роста HerceptinTM (Baselga, J., D. Tripathy et al., J Clin Oncol., 14(3), 737-744, 1995). Наличие естественной реакции аутоантитела может усиливать или ингибировать эффективность лечения искусственно вводимыми инфузией терапевтическими антителами. С использованием способа согласно изобретению можно соотносить реакцию на какой-либо вариант противоракового лечения, включая лечение антителами, с природными уровнями аутоантител у какого-либо пациента или группы пациентов до и в течение курса лечения. Затем эти данные можно в свою очередь использовать для прогнозирования того, как другие пациенты (или тот же самый пациент в случае повторного лечения) отреагируют на такое же лечение.
При использовании иммуноанализов для выявления повторного заболевания наличие у пациента повышенного уровня аутоантител в сравнении с "нормальным контролем" рассматривается как показатель повторного развития заболевания. "Нормальный контроль" может представлять собой уровни аутоантител, присутствующие у контрольных индивидов, предпочтительно, соответствующих по возрасту, у которых отсутствует какой-либо диагноз рака на основе клинических, полученных посредством визуализации и/или биохимических показателей. Альтернативно, "нормальный контроль" может представлять собой "исходный" уровень, устанавливаемый для конкретного тестируемого пациента. Например, "исходный" уровень может представлять собой уровень аутоантител, присутствующий в период ремиссии заболевания, что основано на клинических, полученных посредством визуализации и/или биохимических показателях.
Способ анализа согласно изобретению можно использовать для выявления множества различных видов рака, примерами которых являются рак молочной железы, мочевого пузыря, прямой и ободочной кишки, предстательной железы, легких, поджелудочной железы и яичников. Анализы могут дополнять существующие способы скрининга и наблюдения. Например, в случае первичного рака молочной железы иммуноанализы для аутоантител можно использовать для указания клиницистам получить биопсию незначительных участков повреждения на маммограммах, которые радиографически не вызывают подозрений, или провести визуализацию молочной железы, или повторить визуализацию молочной железы в более ранний период времени, чем планировалось. Предполагают, что в клинике способы анализа согласно изобретению будут более объективными и воспроизводимыми, чем существующие в настоящее время способы визуализации (т.е. маммография и ультразвуковое исследование), эффективность которых может зависеть от управляющего процессом индивида.
"Анализы панелей" могут быть приспособлены в отношении конкретного клинического варианта использования. Панель антигенов для выявления аутоантител, по меньшей мере, против p53 и c-erbB2 является особенно эффективной для многих видов рака и может быть, необязательно, дополнена другими маркерами, для которых известна связь с конкретным вариантом рака или стадией конкретного варианта рака, подлежащим выявлению. Например, в случае рака молочной железы панель может содержать MUC 1 и/или c-myc, и/или BRCA1, и/или BRCA2, и/или PSA, тогда как в случае рака мочевого пузыря панель, необязательно, может содержать MUC 1 и/или c-myc, в случае рака прямой и ободочной кишки ras и/или APC, в случае рака предстательной железы PSA и/или BRCA1, и/или BRCA2 или в случае рака яичника BRCA1 и/или BRCA2, и/или CA125. Существуют другие предпочтительные варианты осуществления, в которых p53 или c-erbB2 не являются существенно необходимыми.
В случае рака молочной железы приемлемые панели можно выбирать из следующего:
p53 и MUC 1, необязательно, вместе с c-erbB2 и/или c-myc, и/или BRCA1, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
p53 и c-myc, необязательно, вместе с c-erbB2 и/или MUC 1, и/или BRCA1, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
p53 и BRCA1, необязательно, вместе с c-erB2 и/или MUC 1, и/или c-myc, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
p53 и BRCA2, необязательно, вместе с c-erbB2 и/или MUC 1, и/или c-myc, и/или BRCA1, и/или PSA, и/или NY-ESO-1, и/или BRC1;
c-erbB2 и MUC 1, необязательно, вместе с p53 и/или c-myc, и/или BRCA1, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
c-erbB2 и c-myc, необязательно, вместе с p53 и/или MUC1, и/или BRCA1, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
c-erbB2 и BRCA1, необязательно, вместе с p53 и/или MUC 1, и/или c-myc, и/или BRCA2, и/или PSA, и/или NY-ESO-1, и/или BRC1;
c-erbB2 и BRCA2, необязательно, вместе с p53 и/или MUC 1, и/или c-myc, и/или BRCA1, и/или PSA;
p53, c-myc, NY-ESO-1 и BRCA2.
В случае рака прямой и ободочной кишки приемлемые панели можно выбирать, например, из следующего:
p53 и ras, необязательно, вместе с c-erbB2 и/или APC;
p53 и APC, необязательно, вместе с c-erbB2 и/или Ras;
Ras и APC, необязательно, вместе с p53 и/или c-erbB2.
Также такие панели могут содержать CEA или CA19-9.
В случае рака предстательной железы приемлемые панели можно выбирать, например, из следующего:
p53 и PSA, необязательно, вместе с BRCA1 и/или BRCA2, и/или c-erbB2;
c-erbB2 и PSA, необязательно, вместе с p53 и/или BRCA1, и/или BRCA2;
PSMA, PSCA и калликреины.
В случае рака яичников приемлемые панели можно выбирать, например, из следующего:
p53 и CA125, необязательно, вместе с c-erbB2 и/или BRCA1, и/или BRCA2;
c-erbB2 и CA125, необязательно, вместе с p53 и/или BRCA1, и/или BRCA2;
HER2, аннексины, CAGE и 4-5.
В случае рака легких приемлемые панели можно выбирать из:
p53 и NY-ESO-1, необязательно, вместе с дополнительными маркерами;
HER2, аннексины, CAGE и 4-5.
Если способ согласно изобретению используют для проведения "анализа панели", основанного на двух или более антигенах-маркерах опухоли, полученных из различных белков, то по меньшей мере один из антигенов в панели необходимо протестировать в анализе согласно изобретению, основанному на тестировании множества различных количеств антигена для формирования кривой титрования. Предпочтительно, каждый из формирующих панель антигенов тестируют в соответствии с анализом согласно изобретению и строят график/вычисляют кривую титрования для каждого отдельного антигена в панели.
Также согласно изобретению подразумевают, что анализ титрования для выявления по меньшей мере одного антитела против маркера опухоли можно использовать в сочетании с анализом, сконструированным для выявления в образце от того же самого пациента по меньшей мере одного белка-маркера опухоли (который может быть родственным или неродственным антигену, используемому в анализе титрования). Таким образом, анализы для аутоантител против маркеров опухоли и анализы для белков-маркеров опухоли можно выполнять параллельно для одного образца от пациента.
В другом варианте осуществления способ иммуноанализа согласно изобретению можно использовать в выборе противораковой вакцины для использования для конкретного пациента. В этом варианте осуществления получаемый от пациента образец жидкости организма тестируют с использованием панели из двух или более антигенов, где каждый соответствует отдельному белку-маркеру опухоли, для определения относительной величины иммунной реакции пациента на каждый из отдельных белков-маркеров опухоли. На "величину иммунной реакции" для заданного белка- или белков-маркеров опухоли указывает наличие и/или количество связанных с раком аутоантител, специфичных к тому белку-маркеру опухоли, который выявлен с использованием иммуноанализа; в случае количественного подсчета аутоантител чем выше уровень связанных с раком аутоантител, тем сильнее иммунная реакция. Затем белок- или белки-маркеры опухоли, которые выявляют как вызывающие наиболее сильную иммунную реакцию или сильные реакции у пациента (т.е. наивысший уровень аутоантител), отбирают для формирования основы противораковой вакцины для использования для пациента.
Использование способа согласно изобретению не ограничено выявлением аутоантител против опухоли, хотя для этой цели анализ является особенно эффективным. Рак представляет собой только один из примеров заболевания, где выявление аутоантител можно использовать в качестве биологического маркера для болезненного состояния/предрасположенности к заболеванию. Авторами изобретения было показано, что посредством использования способа титрования для выявления аутоантител в образцах от пациентов достигаются значительные преимущества. Поэтому допустимо заключить, что сходные преимущества достигаются при использовании способа титрования для выявления аутоантител, являющихся биологическими маркерами для отличных от рака заболеваний. Таким образом, способ применим для выявления любого аутоантитела, служащего биологическим маркером болезненного состояния или предрасположенности к заболеванию для любого заболевания, для которого была показана (или может быть показана) связь с продукцией аутоантител.
Другие варианты использования способа согласно изобретению включают в себя, но ими не ограничиваются, выявление аутоантител, являющихся биологическими маркерами аутоиммунного заболевания, такого как, например, ревматоидный артрит, системная красная волчанка (SLE), первичный билиарный цирроз (PBC), аутоиммунный тиреоидит (например, тиреоидит Хашимото), аутоиммунный гастрит (например, злокачественная анемия), аутоиммунное воспаление надпочечников (например, болезнь Аддисона), аутоиммунный гипопаратиреоз, аутоиммунный диабет (например, диабет типа 1) или тяжелая миастения, а также скрининг образцов от пациентов на предмет заболевания почек или печени, приводящего к недостаточности или отказу обоих органов, и скрининг образцов от пациентов после трансплантации для выявления наличия антител, направленных против пораженной заболеванием ткани (которая осталась в участке после трансплантации) или против трансплантированной ткани.
В другом аспекте изобретение относится к способу выявления антитела в тестируемом образце, содержащем жидкость из организма млекопитающего, где указанное антитело направлено против чужеродного вещества, введенного в указанного млекопитающего, где способ включает:
(a) контактирование тестируемого образца со множеством различных количеств антигена, специфичного к указанному антителу,
(b) выявление величины специфического связывания указанного антитела и указанного антигена, и
(c) построение графика или расчет кривой для величины указанного специфического связывания в зависимости от количества антигена при каждом количестве антигена, используемом на стадии (a).
Предпочтительно, в этом варианте осуществления изобретения способ включает в качестве стадии (d) определение наличия указанного антитела на основе величины специфического связывания указанного антитела и указанного антигена при каждой отдельной используемой концентрации антигена, иначе говоря, на суммарных величинах, наблюдаемых для конкретного антигена. Предпочтительно, на наличие в тестируемом образце антитела, реактивного по отношению к используемому в анализе антигену, указывает, в целом, S-образная или сигмовидная кривая.
В этом аспекте изобретения способ титрования можно использовать для оценки иммунной реакции у млекопитающего, а предпочтительно человека, на любое чужеродное вещество, введенное указанному индивиду.
В одном из вариантов осуществления чужеродное вещество может представлять собой терапевтическое средство, такое как, например, лекарственное средство или пролекарство, антитела человека для лечения или вакцина. Способ согласно изобретению можно использовать для оценки того, вызывает ли введение пациенту терапевтического средства иммунную реакцию, приводящую к продукции антител, специфичных к эпитопу на терапевтическом средстве или к компоненту инертного вещества для доставки, эксципиента, носителя и т.д., которые вводят вместе с терапевтическим средством.
Точный характер терапевтического средства изобретением не ограничен. В неограничивающих вариантах осуществления способ согласно изобретению можно использовать для оценки иммунной реакции на синтетические небольшие молекулы, природные вещества, природные или полученные синтетически биологические средства или на любое сочетание двух или более из указанного выше, необязательно, в сочетании с эксципиентами, носителями или инертными веществами для доставки.
В одном из эффективных вариантов осуществления способ согласно изобретению можно использовать для оценки иммунной реакции на не являющийся мишенью участок терапевтического средства или вакцины. Под "не являющимся мишенью" участком подразумевают составную часть вводимого терапевтического средства или вакцины, который, в случае терапевтического средства, не вносит непосредственный вклад в терапевтическую активность или, в случае вакцины, не предназначен для вызова продукции антител в организме-хозяине. Например, не являющийся мишенью участок может присутствовать для способствования очистке терапевтического средства или вакцины или может быть сконструирован для способствования доставке, поглощению или нацеливанию терапевтического средства/вакцины. Примеры таких "не являющихся мишенью" участков включают в себя, но ими не ограничиваются, линкеры или особые участки, обычно присоединяемые к рекомбинантно экспрессируемым полипептидам, такие как биотиновые метки, гистидиновые метки и т.д.
В другом варианте осуществления этого аспекта изобретения чужеродное вещество может представлять собой инфицирующее вещество, такое как грибок, бактерии, вирус или паразит.
Дополнительно изобретение понимают на основе следующих неограничивающих экспериментальных примеров:
Пример 1
Общая схема титрования антигена в анализе аутоантител
Образцы (биотинилированных) антигенов-маркеров опухоли можно получать рекомбинантной экспрессией в соответствии со способами, аналогичными способам, которые описаны в WO 99/58978.
Вкратце, кДНК, кодирующие интересующие антигены-маркеры, клонировали в вектор pET21 (Invitrogen), который был модифицирован для кодирования биотиновой метки и 6×-гистидиновой метки для способствования очистке экспрессируемого белка. Получаемые клоны выращивают в приемлемой бактериальной клетке-хозяине (в тельцах-включениях), бактерии лизируют и денатурируют, а экспрессируемые антигены выделяют посредством колонок для аффинной хроматографии с хелатообразующим никелем (Hi-trap, коммерчески доступно в Amersham, в соответствии с протоколом производителя). Экспрессируемые антигены восстанавливали диализом в соответствующем буфере, а выход экспрессируемого белка оценивали посредством SDS-PAGE, Вестерн-блоттинга и ELISA и определяли количественно перед хранением.
Отрицательный контроль VOL представляет собой пустой вектор (т.е. без клонированной кДНК), который однако содержит последовательности гистидиновой и биотиновой меток.
Уникальные идентификаторы банка генов для множества кДНК маркеров являются следующими:
P53: B003596
с-myc: V00568
внеклеточный домен ECD6 (HER2): M11730
NY-ESO: NM_001327
BRCA2: U43746
BRCA1 дельта 9-10: NM_007302
1. Антигены и VOL (отрицательный контроль) разводили до соответствующих концентраций в 0,1 М карбонатном буфере, а затем проводили серию разведений для получения полулогарифмического диапазона титрования (см. таблицу 1). Разведения антигенов распределяли по 50 мкл/лунка по рядам планшета для микротитрования Falcon в соответствии со схемой планшета, используя электронную многоканальную пипетку. Планшеты закрывали и хранили в течение 48 часов при 4°C.
2. Планшеты один раз промывали посредством PBS + 0,1% Tween 20 с использованием автоматического устройства для промывки планшетов, а затем сушили постукиванием о папиросную бумагу.
3. Планшеты блокировали в буфере для инкубации с высоким содержанием соли (HSB, PBS + 0,5 М NaCl + 0,1% казеин) при 200 мкл/лунка в течение одного часа или до тех пор, пока не потребуется для использования (хранили в закрытом состоянии при 4°C).
4. Образцы сыворотки размораживали, встряхивали и разводили 1/100 в HSB при комнатной температуре.
5. Планшеты очищали и сушили постукиванием о папиросную бумагу. Каждый разведенный образец сыворотки распределяли по 50 мкл/лунка по всем лункам планшета для микротитрования, используя электронную многоканальную пипетку. Контрольные антитела разводили 1/1000 в HSB и распределяли в соответствующие лунки конечного планшета. Планшеты закрывали и инкубировали при встряхивании в течение 1,5 часа при комнатной температуре
6. Стадия промывки: планшеты трижды промывали в PBS + 0,1% Tween 20 с использованием автоматического устройства для промывки планшетов, а затем сушили постукиванием о папиросную бумагу.
7. Во все лунки планшета для микротитрования помещали по 50 мкл/лунка конъюгированных с пероксидазой хрена антител кролика против Ig человека (Jackson, 1/10000 в HSB). В контрольные лунки, содержащие антитело против антигена, помещали HRP-конъюгированные антитела кролика против Ig мыши (1/1000 в HSB). Затем планшеты инкубировали при встряхивании в течение 1 часа при комнатной температуре.
8. Планшеты промывали, как на стадии 6.
9. Добавляли предварительно полученный субстрат TMB по 50 мкл/лунка, и инкубировали планшет в течение 10 минут на лабораторном столе. Для перемешивания по планшетам осторожно постукивали.
10. Оптическую плотность в лунках определяли при 650 нм с использованием общепринятого протокола для планшет-ридера.
Пример 2
Выявление аутоантител при первичном раке молочной железы
Следующие данные были получены из предварительного исследования для оценки чувствительности и воспроизводимости набора анализов титрования с использованием аутоантител при первичном раке молочной железы (PBC). Исследование включало сыворотку от 17 женщин с отсутствием признаков рака и образцы сыворотки от 20 женщин с первичным раком молочной железы до операции. Нормальные образцы и образцы с раком соответствовали по возрасту. Один нормальный образец и три образца с раком необходимо было удалить из исследования, поскольку для них наблюдали признаки реакций антитела против биотина, и поэтому они не могли быть оценены с использованием анализа при его настоящей схеме. Предполагают, что приблизительно у 10% популяции развивается иммунная реакция против биотина.
Анализ проводили в соответствии с указанной в примере 1 схемой, используя антигены p53, c-myc, NY-ESO-1 и BRCA2.
На фиг.1 представлены примеры кривых, полученных при использовании анализа титрования антигена для измерения количества аутоантител против p53 в сыворотке. Можно видеть, что сыворотка от пациента с раком 17766(C) проявляет значительное связывание с тестируемым антигеном (p53) при характерной сигмовидной кривой, но не связывается с отрицательным контролем, VOL. В сравнении с этим сыворотка от обычного индивида 18052(N) не приводит к получению кривой титрования для связывания с тестируемым антигеном или отрицательным контролем.
Уровни аутоантител выражали в виде разницы величины оптической плотности (650 нм), обусловленной связыванием с тестируемым антигеном, и величины, обусловленной связыванием с отрицательным контролем (VOL). Нормальный отсекаемый уровень рассчитывали как 95 процентиль (среднее значение + 2 значения стандартного отклонения) для нормальной группы. Он показан пунктирной линией на фиг.2, где сравниваются уровни аутоантител против p53 у обычных индивидов и пациентов с раком. Можно видеть, что у группы с раком, в целом, наблюдают более высокие уровни аутоантител, а также более высокую долю индивидов с уровнями, превышающими отсекаемый уровень.
Панель состоит из четырех антигенов: p53, c-myc, NY-ESO-1 и BRCA2. Чувствительность отдельных анализов указана в таблице 2 вместе с общей чувствительностью панели из четырех антигенов при выявлении первичного рака молочной железы (63%).
Измеряли количество аутоантител против четырех различных антигенов и вычисляли общую чувствительность панели. Отсекаемые уровни рассчитывали как среднее значение + 2 значения стандартного отклонения для набора нормальных образцов. Индивиды с реакциями антител против биотина были исключены, как не допускающие оценку.
Для оценки того, были ли воспроизводимыми или нет измерения, полученные с использованием анализа титрования с применением аутоантител, анализы проводили в трое отдельных суток, а результаты представлены в таблице 3. Анализ считали воспроизводимым, если все три результата совпадали. Воспроизводимость измерений, проведенных для нормальной сыворотки, составляла 94% (15/16), а для образцов с раком молочной железы 88% (14/16).
Таблица 3
Воспроизводимость анализа титрования антигена для аутоантител против p53
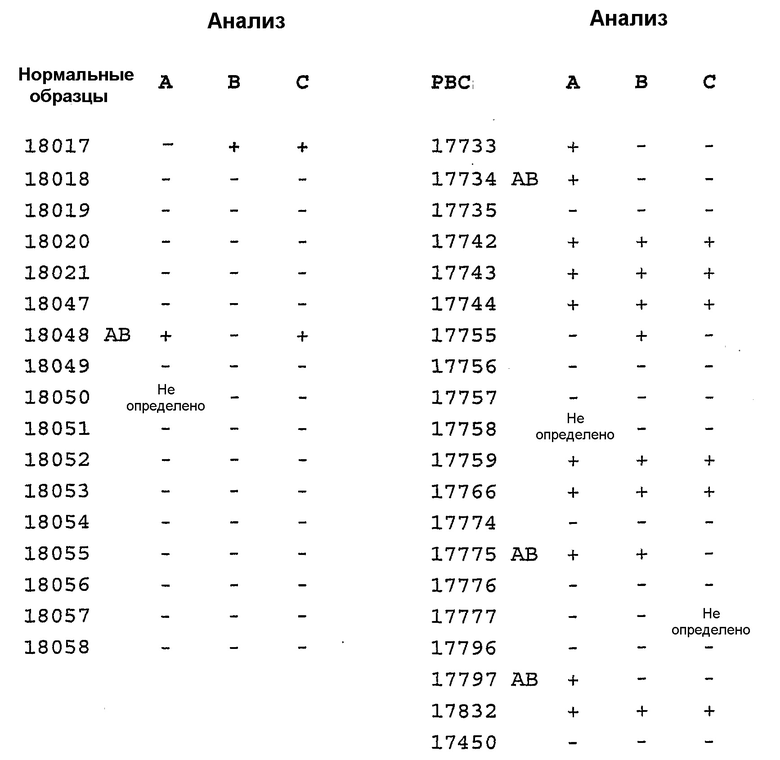
Анализы проводили в трое отдельных суток (анализы A, B и C) для образцов сыворотки от пациентов с первичным раком молочной железы (PBC) или нормальных контролей. Отсекаемые уровни рассчитывали на суточной основе как среднее значение + 2 значения стандартного отклонения для набора нормальных образцов. AB обозначает индивидов, у которых наблюдали признаки реакции антитела против биотина и для которых была невозможна оценка при настоящей схеме анализа. Анализ считали воспроизводимым, если все три результата совпадали. Воспроизводимость для обычных индивидов составляла 94% (15/16), а для пациентов PBC составляла 88% (14/16).
Пример 3
Выявление аутоантител при раке легких
В анализе реакций аутоантител против 2 антигенов (p53 и NY-ESO) в предварительном исследовании для рака легких (10 нормальных образцов плазмы и 9 с раком легких) была выявлена вероятность регистрации, составляющая 78% (фиг.3).
Анализ проводили в соответствии с общей схемой из примера 1, за исключением использования образцов плазмы вместо сыворотки.
Для положительных образцов от пациентов наблюдали сигмовидные кривые титрования, сходные с кривыми, которые представлены на фиг.1. На фиг.3 представлено сравнение уровней аутоантител против p53 и NY-ESO у обычных индивидов и пациентов с раком легких, как измерено с использованием анализа титрования антигенов. Нормальные отсекаемые уровни рассчитывали как среднее значение + 2 значения стандартного отклонения для нормальной популяции.
Пример 4
Дополнительные кривые титрования
Все следующие дополнительные кривые титрования были получены в анализах, основанных на общем способе, который описан в примере 1. Результаты указывают на то, что способ кривой титрования можно использовать для выявления множества различных антигенов в различных типах жидкостей организма и при различных заболеваниях (например, при различных видах рака), а также иллюстрируют преимущество способа согласно изобретению в различении "истинных" и "ложных" положительных результатов.
На фиг.4 представлена кривая титрования для выявления аутоантител против p53 и NY-ESO в образце асцитной жидкости, полученной у пациента с раком молочной железы. Этого пациента тестировали, но не выявили продукции аутоантител против c-myc.
На фиг.5 представлена кривая титрования для выявления аутоантител против BRCA1, BRCA2 и HER2 в образце сыворотки от пациента с раком молочной железы (карцинома протоков in situ).
На фиг.6 представлена кривая титрования для выявления аутоантител против NY-ESO в образце сыворотки от пациента с раком легких. Этого пациента тестировали, но не обнаружили продукции аутоантител против p53 или c-myc.
На фиг.7 представлена кривая титрования для выявления аутоантител против NY-ESO и p53 в образце сыворотки от пациента с раком легких. Этого пациента тестировали, но не обнаружили продукции аутоантител против c-myc.
На фиг.8(a) и 8(b) представлены результаты двух независимых анализов титрования для аутоантител против p53, c-myc и NY-ESO-1 в образцах сыворотки от "обычного" индивида (т.е. индивида без признаков рака). В анализе, представленном на фиг.8(a), для возрастающих количеств антигена наблюдают пологую кривую, что указывает на то, что образцы сыворотки не содержат аутоантител против какого-либо из тестируемых антигенов. Когда вторую порцию образца сыворотки от того же пациента снова тестировали с использованием того же способа анализа, то анализ оказался неудачным, приведя к аномальным результатам, которые представлены на фиг.8(b). Отсутствие характерной кривой титрования при возрастающих количествах антигена указывает на то, что это аномальный результат, а не истинно положительный. Если бы этот образец был протестирован в одноточечном анализе с использованием одного фиксированного количества антигена, то для него могли бы наблюдать "ложноположительный" результат. Таким образом, эти результаты иллюстрируют преимущество способа кривой титрования в различении истинных и ложных положительных результатов.
На фиг.9(a) и 9(b) представлены результаты двух независимых анализов титрования, выполненных для образцов сыворотки от одного пациента с инвазивным раком молочной железы с использованием диапазона различных антигенов. У этого конкретного пациента наблюдают аутоантитела против NY-ESO-1, HER2 и BRCA2. В случае каждого положительного антигена на положительный результат анализа указывает возрастание интенсивности сигнала по мере увеличения концентрации антигена, т.е. сигнала титрования.
На фиг.10(a) и 10(b) представлена иллюстрация использования изобретения в различении реакций антител против биотина и "истинных" аутоантител против специфического антигена (т.е. маркера опухоли). В этих анализах образцы сыворотки от клинически нормального человека тестировали на наличие аутоантител с использованием биотинилированных антигенов BRCA2, HER2, c-myc и NY-ESO-1, небиотинилированного BRCA1 и контрольных продуктов экспрессии "пустого" вектора VOL, кодирующего биотиновую метку, но без дополнительного антигена. У тестируемого индивида наблюдают реакцию титрования как на биотинилированные антигены, так и на пустой вектор VOL, который фактически представляет собой только биотин, и отсутствие реакции на небиотинилированный антиген BRCA1, что указывает на то, что "положительные" результаты для биотинилированных маркеров действительно обусловлены наличием у этого индивида антител против биотина.
Пример 5
Анализ чувствительности и специфичности анализов титрования антигена в сравнении с одноточечным измерением
Измерения для аутоантитела (AAb) проводили для 100 женщин с первичным раком молочной железы (PBC) и 80 женщин без признаков злокачественного заболевания, используя способ титрования и измерение при единственной концентрации антигена (10 мкг/мл). Ниже приведены таблицы, в которых представлено непосредственное сравнение двух способов:
Можно видеть, что в сравнении с одноточечным измерением при использовании нескольких точек на кривой титрования антигена достигали как более высокую чувствительность, так и специфичность.
Пример 6
Возможные причины более высокой чувствительности и специфичности при анализе титрования антигена
Не ограничиваясь теорией, автор заявки полагает, что существует множество причин для наблюдаемой более высокой специфичности и чувствительности в анализе, где титруют антиген.
(i) На фиг.11 представлены результаты анализа AAb сыворотки пациента с первичным раком молочной железы (PCB) при использовании антигенов p53, c-myc и NY-ESO-1 при различной концентрации. Эти результаты показывают, что в некоторых случаях кривая образует провал при высоких уровнях антигена (кривая NY-ESO-1). Это часто наблюдаемое явление в иммунохимии. Если бы использовали одноточечное измерение при 10 мкг/мл, то такого пациента определили бы как отрицательного в отношении аутоантител против NY-ESO-1, хотя на самом деле наблюдается четкая положительная реакция.
(ii) На фиг.12 представлен анализ сыворотки от обычного индивида, где также использовали титруемый антиген p53, c-myc и NY-ESO-1. На этой фигуре показано действие, которое авторы заявки наблюдали в приблизительно 10% анализов, в которых исходный уровень для измерения антигена (в этом случае p53) сдвинут на уровень, превышающий таковой для отрицательного контроля (VOL). Это приводит к ложным высоким показаниям. Этот тип результата легко выявляем с использованием анализа титрования, однако неразличим в наборе одноточечных анализов. Это приводит к сниженной специфичности, обусловленной такими ложноположительными результатами (см. таблицу 5).
(iii) Как описано в примере 4, антигены, используемые в анализе титрования с использованием AAb, содержат биотиновую метку, которую можно применять в очистке белка. Однако известно, что приблизительно у 10% популяции развивается реакция антитела на биотин, являющийся витамином. На фиг.13 показана реакция антител против биотина у пациента с PBC. Такая реакция может быть четко выявлена с использованием кривой титрования как значительная реакция антитела против отрицательного контроля VOL (который также является биотинилированным). Этих индивидов следует рассматривать как не поддающихся оценке посредством анализа при такой схеме. Однако если бы использовали одноточечный анализ, то индивидов с реакций антител на биотин нельзя было бы отличить от истинных реакций.
Пример 7
Проявление повышенной чувствительности титрования антигена в сравнении с титрованием сыворотки
Измерения для AAb проводили двумя способами в двух полностью отдельных экспериментах. В первом использовали обычную схему, в которой на планшет наносили антиген при полулогарифмическом титровании от 10 мкг/мл до 0,01 мкг/мл. После блокирования добавляли сыворотку при разведении 1 в 100. Во втором на планшеты наносили антиген в концентрации 3 мкг/мл, а после блокирования добавляли сыворотку в полулогарифмическом диапазоне титрования от разведения 1 в 10 до 1 в 10000. В отношении остальной части анализов способы были одинаковыми. Анализировали две совокупности сывороток, для которых известно, что они положительны в отношении p53 и c-myc, и 8 образцов сыворотки от женщин с PBC, а также 10 образцов сыворотки от обычных индивидов. Результаты представлены в приведенной ниже таблице 6.
Таблица 6
Чувствительность анализов для AAb, включающих титрование антигена, в сравнении с анализами, включающими титрование сыворотки

Можно видеть, что схема анализа, включающая титрование антигена, является более чувствительной, чем схема, которая включает титрование сыворотки. Образцы, являвшиеся в значительной степени положительными, были выявлены с использованием обеих схем, тогда как слабоположительные в анализе титрования антигена, как правило, не выявлялись в анализе титрования сыворотки.
Более низкая чувствительность, наблюдаемая для схемы титрования сыворотки, обусловлена внутренне присущим неспецифическим связыванием сыворотки при высокой концентрации. Это обуславливает определенную величину связывания с белками даже в обычных образцах (см. фиг.14), что увеличивает нормальную отсекаемую величину вместе с последующим снижением чувствительности. Также специфичность была снижена в схеме титрования сыворотки (BRCA2=90%) при сравнении со схемой титрования антигена (BRCA2=100%).
На фиг.15 представлены эксперименты, приведенные на фиг.4, но вместе с сывороткой от пациента с первичным раком молочной железы. При использовании способа титрования антигена согласно изобретению пациента выявили как положительного в отношении аутоантител против p53 и c-myc, но отрицательного в отношении аутоантител против BRCA2. Однако при измерении аутоантител в пределах диапазона титрования сыворотки аутоантитела выявлены не были (см. таблицу 6). Это обусловлено неспецифическим связыванием, проявляемым сывороткой при высоких концентрациях (представленным высокой величиной связывания с белком, являющимся отрицательным контролем (VOL)), что скрывает сигналы, обусловленные специфическим связыванием аутоантител. Заключение, что при использовании разведения сыворотки в анализе можно выявить пациента с первичным раком молочной железы, является отрицательным. Поскольку величина чувствительности = истинные положительные значения/истинные положительные значения + ложноотрицательные значения, то это приводит к эффекту увеличения знаменателя и, соответственно, уменьшению величины чувствительности.
Таким образом, авторами заявки было показано, что анализы аутоантител с использованием титрования антигена являются более чувствительными и специфичными, чем измерение реактивности аутоантител при одной концентрации антигена. Это обусловлено тем, что титрование антигена обеспечивает возможность выявлять низкоаффинные антитела с низким содержанием при высоких концентрациях антигена, а также антитела с высоким содержанием, которые в ином случае захватываются при высокой концентрации антигена, но максимальное связывание проявляют при дальнейшем спуске кривой титрования. Это позволяет также отличать не поддающиеся оценке анализы от истинных результатов, что невозможно осуществлять с использованием одноточечного измерения. Предполагают, что анализы для AAb с использованием титрования антигена являются более чувствительными, чем простое титрование сыворотки, поскольку высокая величина неспецифического связывания, наблюдаемая при высокой концентрации сыворотки, повышает обычные отсекаемые уровни, снижая тем самым чувствительность.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЕ СПОСОБЫ ИММУНОАНАЛИЗА | 2006 |
|
RU2416095C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ ИММУНОАНАЛИЗА | 2006 |
|
RU2636532C2 |
| АНАЛИЗ АНТИТЕЛ | 2017 |
|
RU2769987C2 |
| ЧЕЛОВЕЧЕСКОЕ ОПУХОЛЕСПЕЦИФИЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО | 2008 |
|
RU2488593C2 |
| НОВЫЙ РАКОВЫЙ АНТИГЕН ДЛЯ РАННЕГО ВЫЯВЛЕНИЯ РАКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ДЕТЕКЦИИ | 2020 |
|
RU2818471C2 |
| ПЕРОРАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБЫ ИММУНОТЕРАПИИ | 2015 |
|
RU2719586C2 |
| СПОСОБЫ ДИАГНОСТИКИ ГЛАУКОМЫ | 2011 |
|
RU2657515C2 |
| СПОСОБЫ НА ОСНОВЕ ДЕТЕКТИРОВАНИЯ ОЧАГОВ RAD51 В ОПУХОЛЕВЫХ КЛЕТКАХ | 2018 |
|
RU2825699C2 |
| СПОСОБ ИЗМЕРЕНИЯ АНТИТЕЛА ПРОТИВ WT1 | 2012 |
|
RU2633068C2 |
| ИММУНОЛОГИЧЕСКИЙ ТЕСТ ДЛЯ ОПРЕДЕЛЕНИЯ АУТОАНТИТЕЛ ПРОТИВ АНТИГЕНОВ СЕМЕННИКОВ | 2009 |
|
RU2528060C2 |
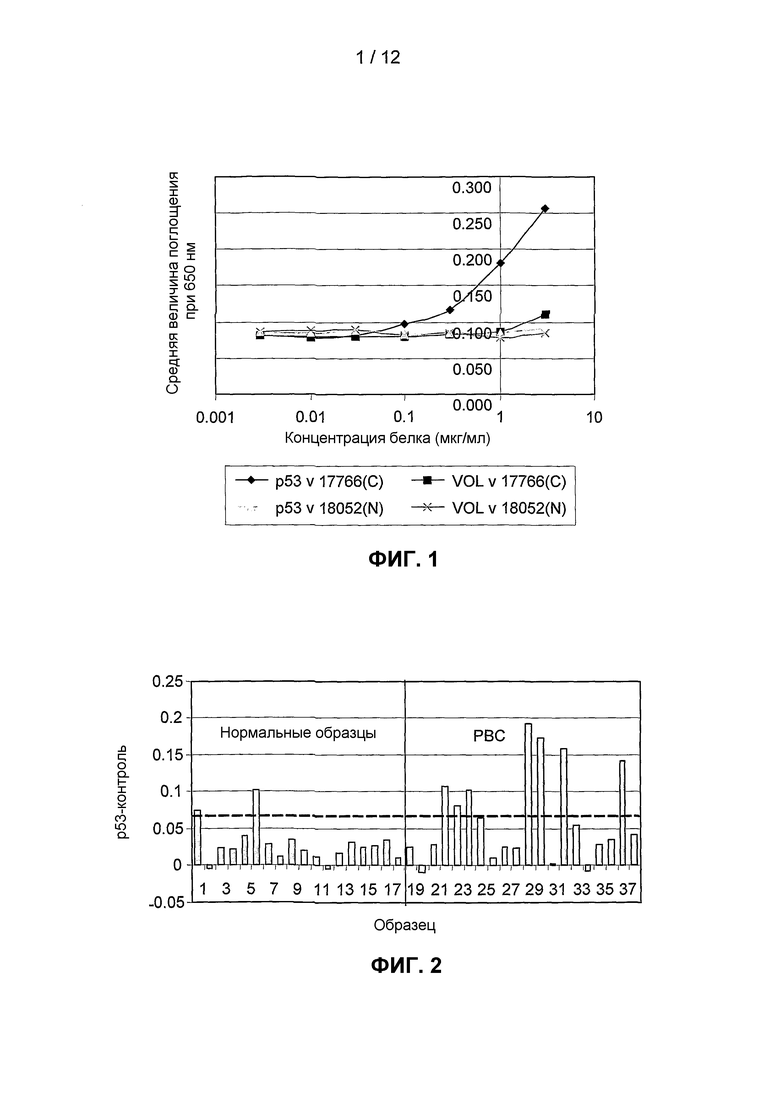
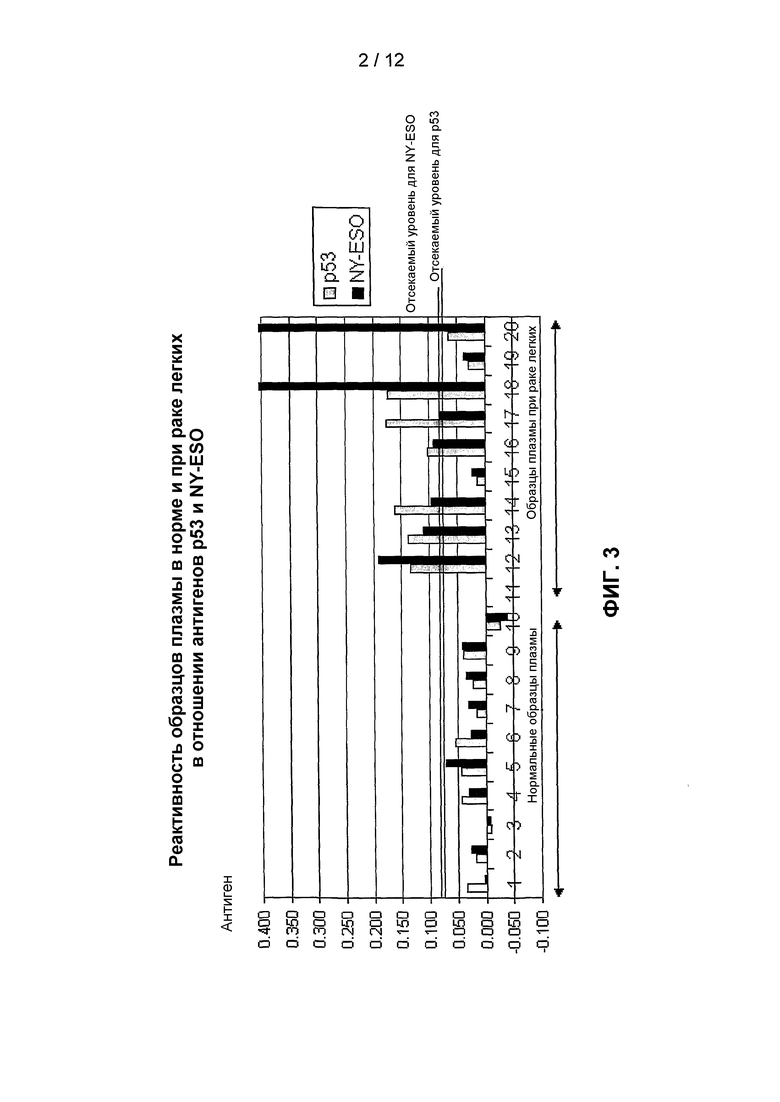
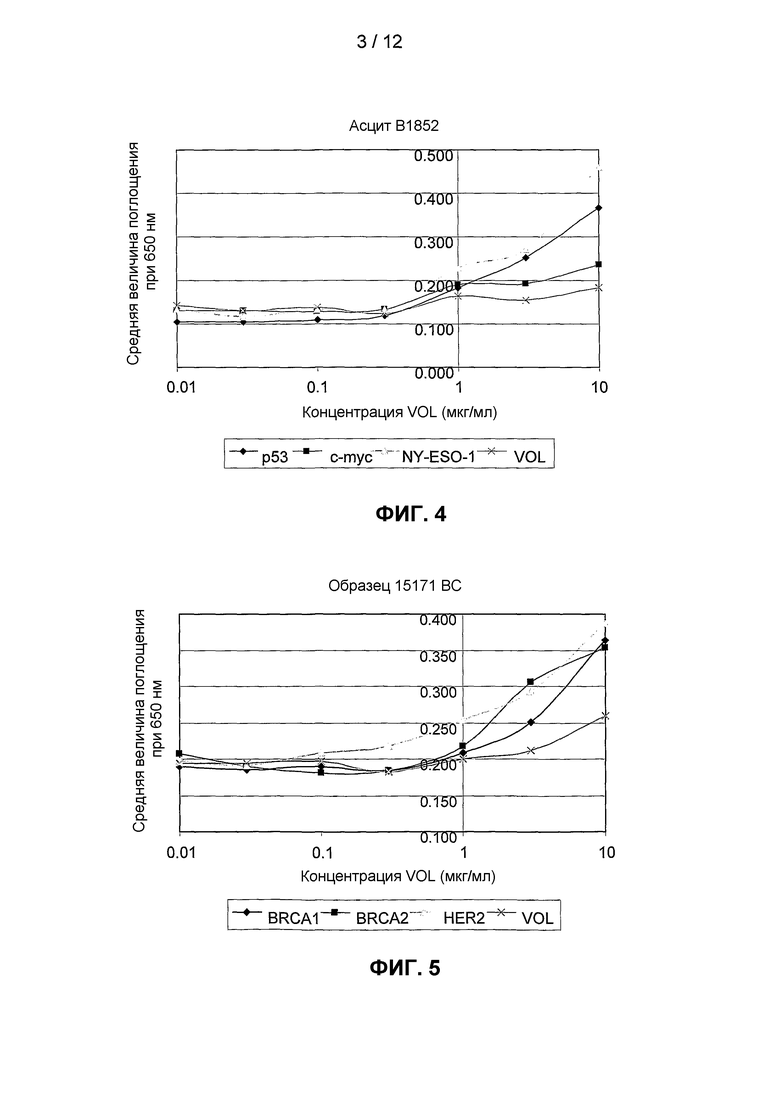
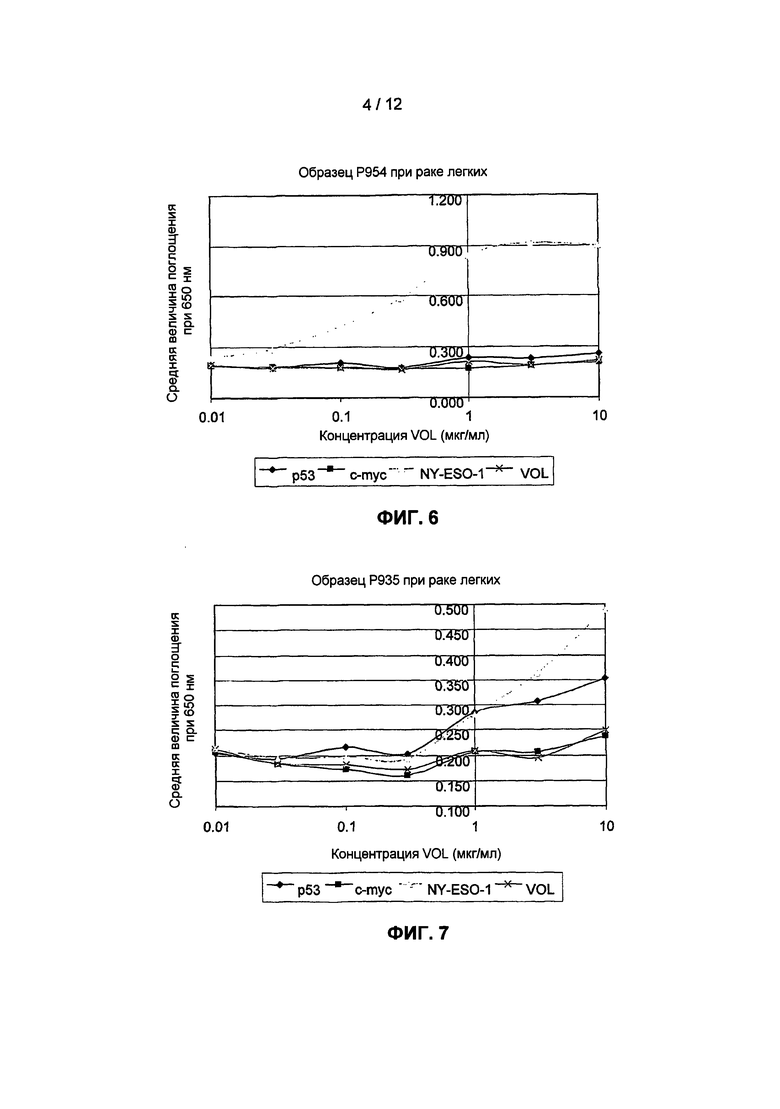
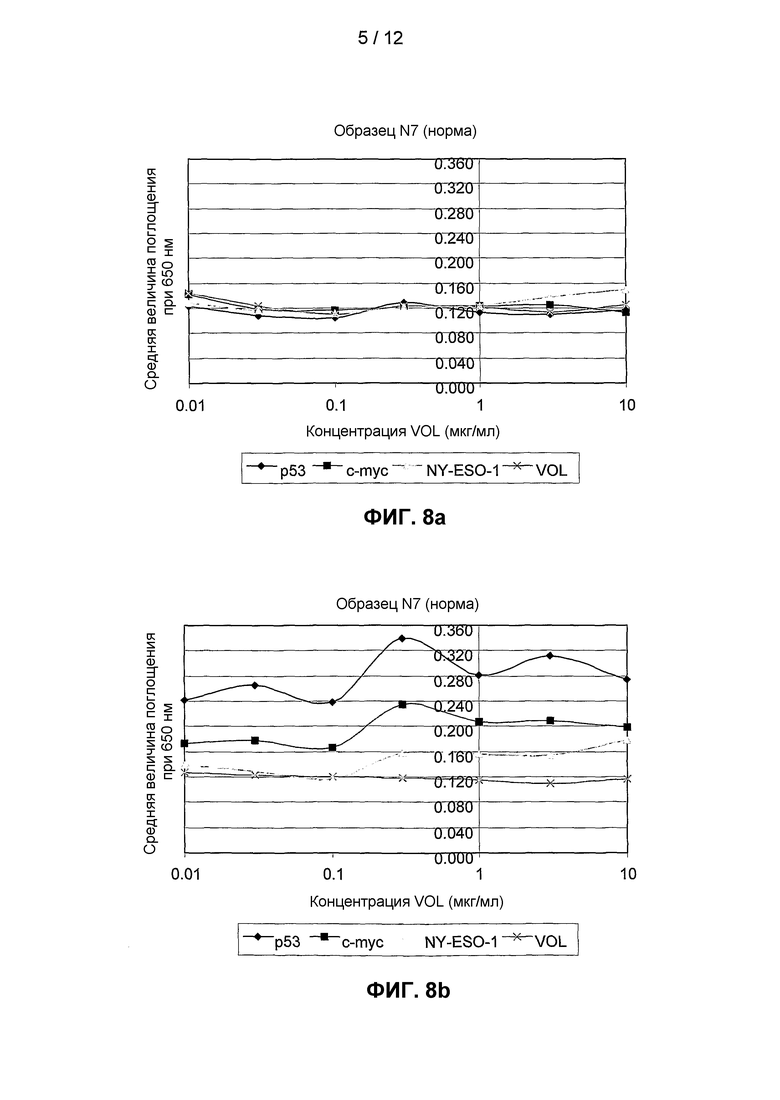
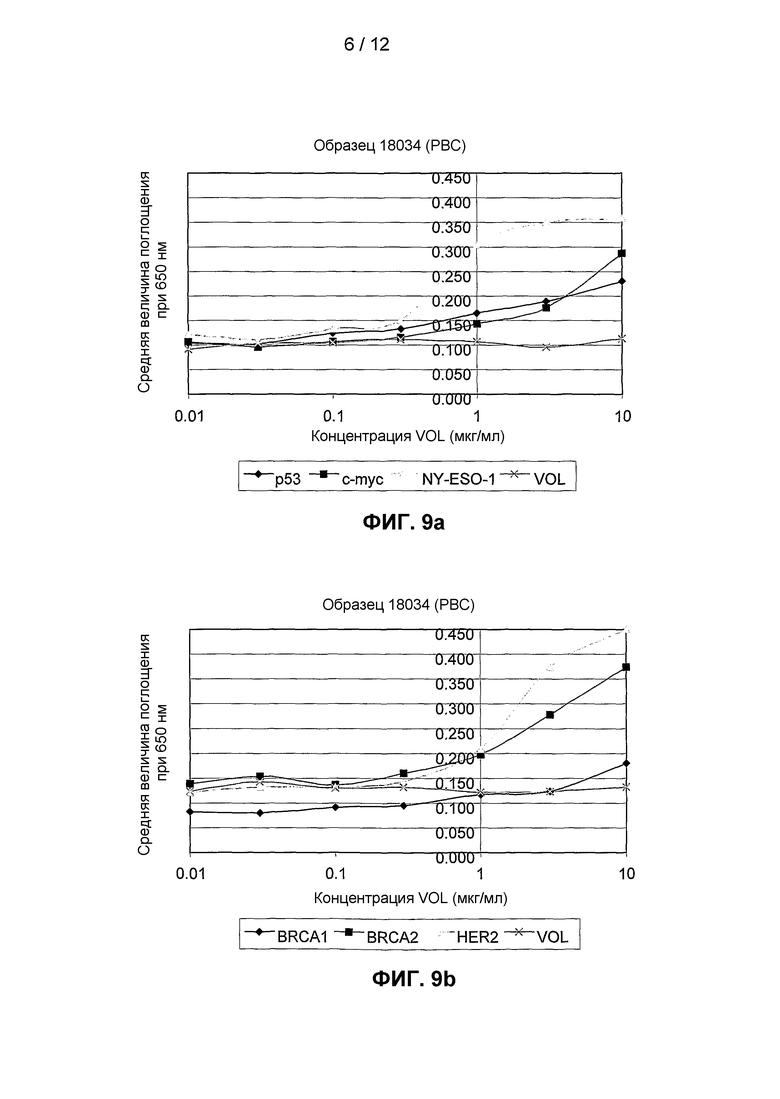
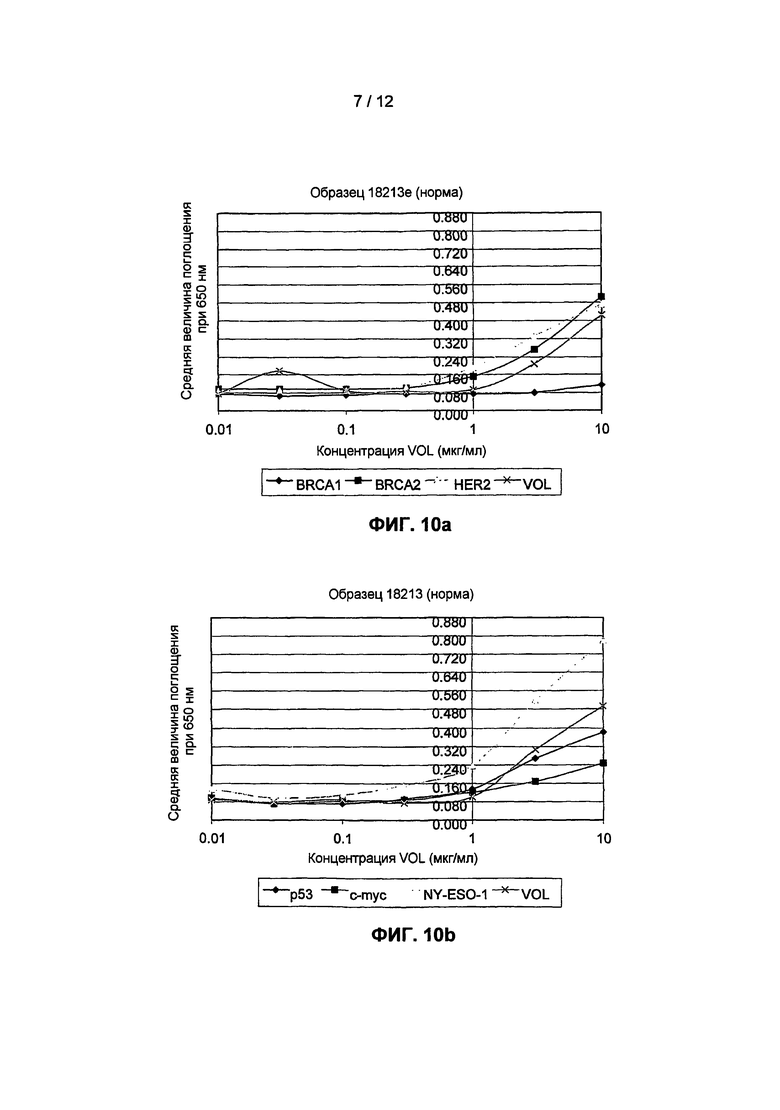
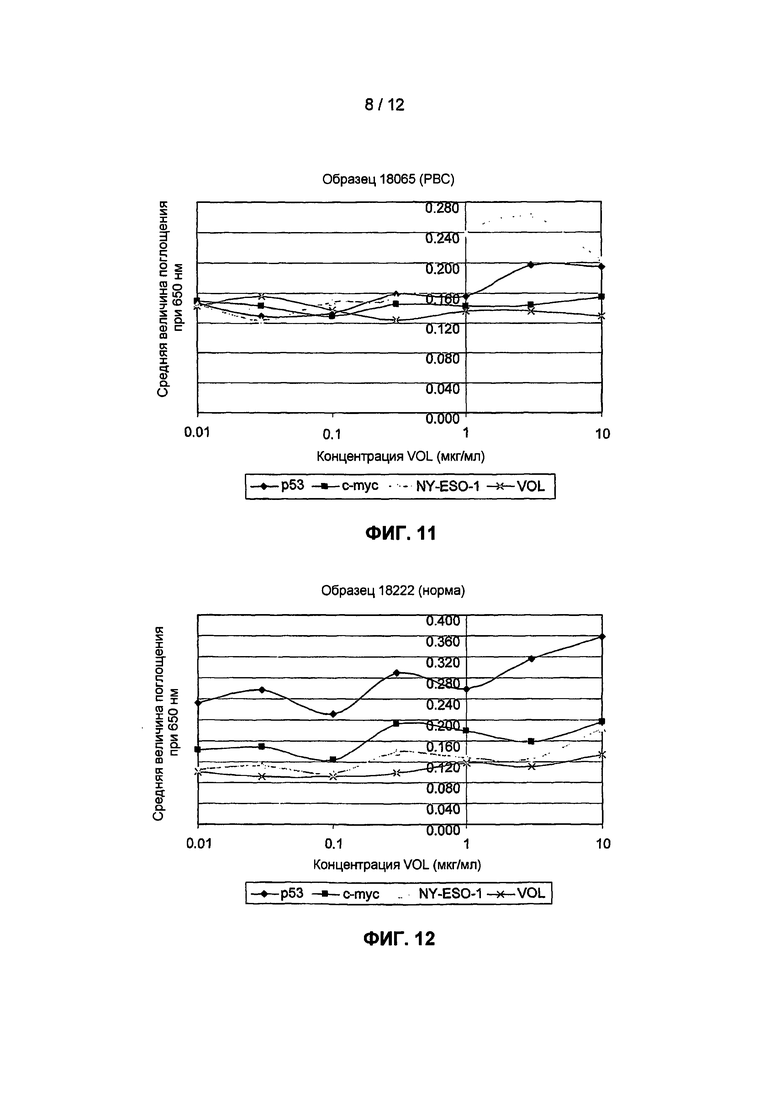
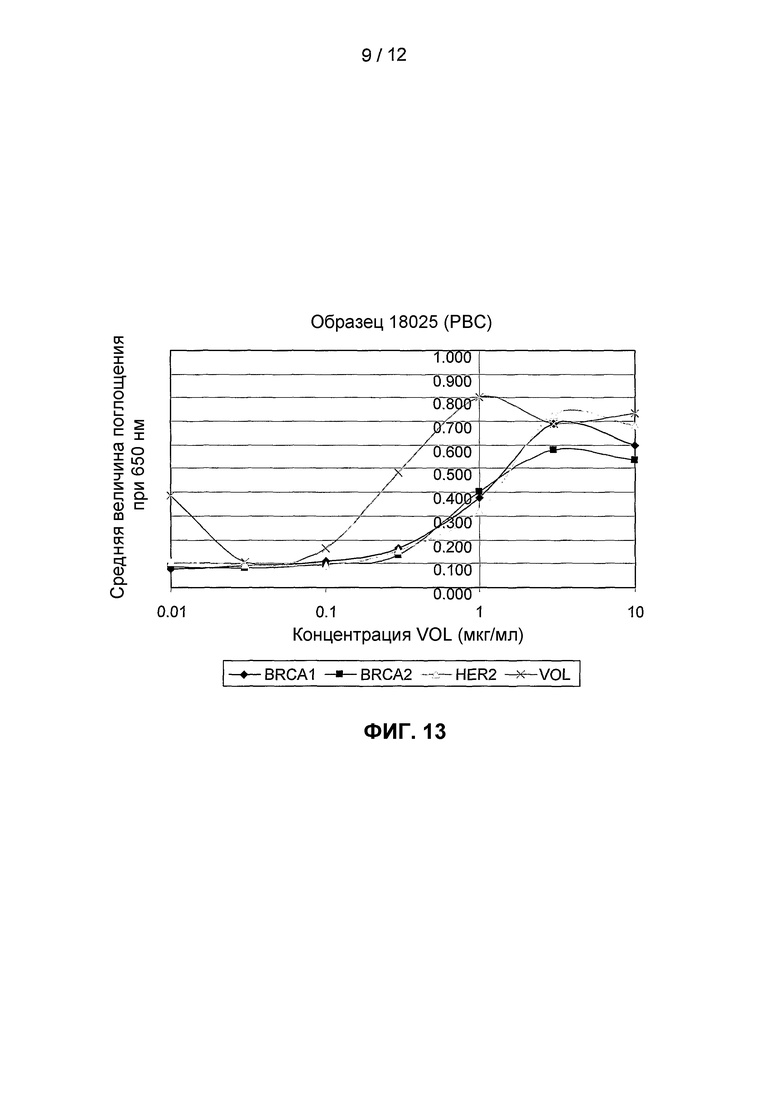
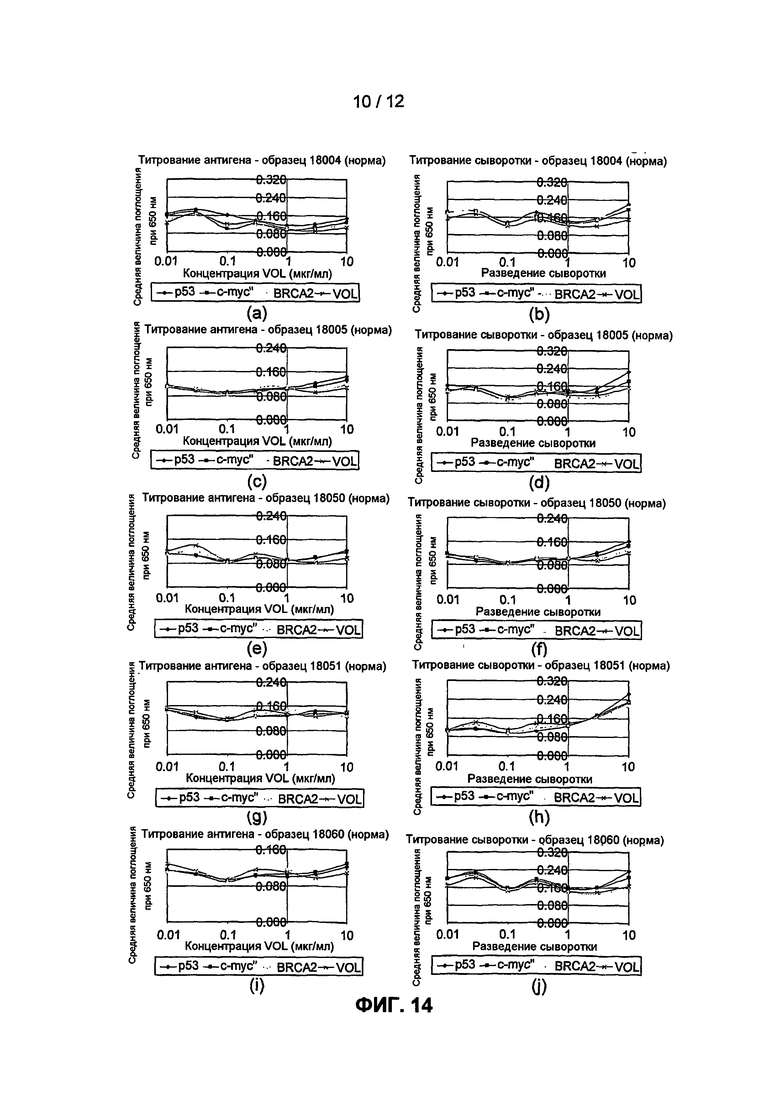

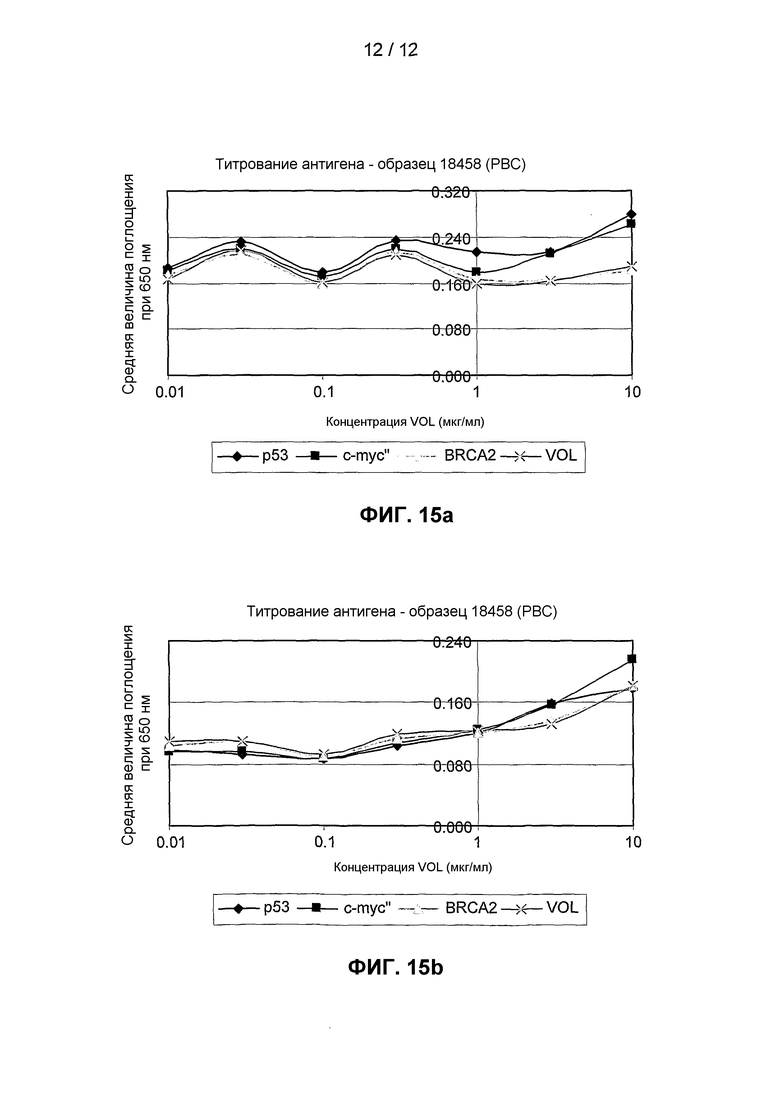
Группа изобретений относится к медицине и может быть использована для диагностики рака путем определения профиля продукции антитела в тестируемом образце, содержащем жидкость организма субъекта-млекопитающего. Для этого осуществляют приведение тестируемого образца в контакт с множеством различных количеств антигена, специфичного в отношении указанного антитела. Затем выявляют величину специфического связывания антитела и антигена. Строят график или вычисляют кривую зависимости величины специфического связывания от количества антигена для построения профиля продукции антитела у указанного субъекта до возникновения заболевания или на протяжении хода заболевания. При этом антитело - это биологический маркер болезненного состояния или предрасположенности к заболеванию, где антиген представляет собой MUC1, c-myc, EGFR, p53, ras, BRCA1, BRCA2, APC, HER2, PSA, CEA, CA19.9, NY-ESO-1, антиген 4-5, CAGE, PSMA, PSCA, EpCam, цитокератин, рековерин, калликреин, аннексин, AFP, GRP78, CA125, маммоглобин или raf. Также предложено применение для диагностики рака у пациента. Группа изобретений позволяет диагностировать рак у пациента путем определения профиля продукции антитела в тестируемом образце. 2 н. и 4 з.п. ф-лы, 6 табл., 15 ил., 7 пр.
1. Способ определения профиля продукции антитела в тестируемом образце, содержащем жидкость организма субъекта-млекопитающего, где указанное антитело представляет собой биологический маркер болезненного состояния или предрасположенности к заболеванию, где способ включает:
(a) приведение указанного тестируемого образца в контакт со множеством различных количеств антигена, специфичного в отношении указанного антитела,
(b) выявление величины специфического связывания указанного антитела и указанного антигена и
(c) построение графика или вычисление кривой зависимости величины указанного специфического связывания от количества антигена для каждого количества антигена, используемого на стадии (a), для построения профиля продукции антитела у указанного субъекта или до возникновения заболевания, или на протяжении хода заболевания,
где антиген представляет собой MUC1, c-myc, EGFR, p53, ras, BRCA1, BRCA2, APC, HER2, PSA, CEA, CA19.9, NY-ESO-1, антиген 4-5, CAGE, PSMA, PSCA, EpCam, цитокератин, рековерин, калликреин, аннексин, AFP, GRP78, CA125, маммоглобин или raf.
2. Способ по п.1, где способ повторяют для построения профиля продукции антитела.
3. Способ по п.1 или 2, где антиген представляет собой природный белок или полипептид, рекомбинантный белок или полинуклеотид, синтетический белок или полипептид, синтетический пептид, пептидомиметик, полисахарид или нуклеиновую кислоту.
4. Применение способа по п.1 или 2 в диагностике рака.
5. Применение по п.4 для:
(a) скрининга популяции людей с отсутствием симптомов для выявления тех субъектов, которые имеют повышенный риск развития рака, где образцы, подлежащие тестированию с использованием указанного способа, представляют собой образцы жидкости организма, полученные у субъектов, и где субъектов, имеющих повышенный уровень аутоантител в сравнении с нормальным контролем, который представляет или уровень аутоантител, имеющий место у контрольных субъектов, или исходный уровень для того субъекта, определяют как имеющих риск развития рака; или
(b) выявления раннего неопластического или раннего канцерогенного изменения у человека с отсутствием симптомов, где образец, подлежащий тестированию с использованием указанного способа, представляет собой образец жидкости организма, полученный у субъекта, и где наличие повышенного уровня аутоантител в сравнении с нормальным контролем, который представляет или уровень аутоантител, имеющий место у контрольных субъектов, или исходный уровень для того субъекта, рассматривают как указание на раннее неопластическое или раннее канцерогенное изменение у субъекта; или
(с) скрининга популяции людей с отсутствием симптомов для выявления тех субъектов, у которых развился рак, где образцы, подлежащие тестированию с использованием указанного способа, представляют собой образцы жидкости организма, полученные у субъектов, и где субъектов, имеющих повышенный уровень аутоантител в сравнении с нормальным контролем, который представляет или уровень аутоантител, имеющий место у контрольных субъектов, или исходный уровень для того субъекта, диагностируют как имеющих рак; или
(d) тестирования популяции людей с симптомами для выявления тех субъектов, у которых развился рак, где образцы, подлежащие тестированию с использованием указанного способа, представляют собой образцы жидкости организма, полученные у субъектов, и где субъектов, имеющих повышенный уровень аутоантител в сравнении с нормальным контролем, который представляет или уровень аутоантител, имеющий место у контрольных субъектов, или исходный уровень для того субъекта, диагностируют как имеющих рак; или
(е) мониторинга развития рака или другого неопластического заболевания у пациента, где образец, подлежащий тестированию с использованием указанного способа, представляет собой образец жидкости организма, полученный у пациента-человека, и где уровень аутоантител, имеющий место у указанного пациента, сравнивают с нормальным контролем, который представляет или уровень антител, имеющий место у контрольных субъектов, или исходный уровень, установленный для того пациента;
(f) оценки прогноза для пациента, у которого диагностировали рак;
(g) предсказания реакции ракового пациента на противораковое лечение, такое как лечение, направленное против фактора роста или передачи сигналов, лучевая терапия, эндокринная терапия, лечение человеческими антителами, химиотерапия или вакцинация; или
(h) мониторинга реакции ракового пациента на противораковое лечение, такое как лечение, направленное против фактора роста или передачи сигналов, лучевая терапия, эндокринная терапия, лечение человеческими антителами, химиотерапия или вакцинация; или
(i) выбора противораковой вакцины для применения в отношении ракового пациента.
6. Применение по п.4 или 5, где антиген представляет собой природный белок или полипептид, рекомбинантный белок или полинуклеотид, синтетический белок или полипептид, синтетический пептид, пептидомиметик, полисахарид или нуклеиновую кислоту.
| WO 9958978 A2, 18.11.1999 | |||
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ВАКЦИН ПРОТИВ ГЕПАТИТА В | 1999 |
|
RU2181893C2 |
| CARLSSON H | |||
| et al., Titration of Antibodies to Salmonella 0 Antigens by Enzyme-Linked Immunosorbent Assay, Infect | |||
| Immun., 1972, November, V | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ОСТАНОВКИ ПОЕЗДОВ | 1915 |
|
SU703A1 |
| ZIELEN S et al., Simple determination of polysaccharide specific antibodies by means of chemically modified ELISA plates | |||
| J Immunol Methods | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
Авторы
Даты
2018-07-26—Публикация
2010-12-01—Подача