Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям, которые обеспечивают модуляцию иммунных ответов, связанных с введением биофармацевтического лекарственного средства.
Предшествующий уровень техники
Вследствие многочисленных причин, таких как размер молекулы, многие современные лекарственные средства, такие как биофармацевтические препараты, являются непригодными для перорального введения. Вместо этого, они должны вводиться инвазивно либо во внесосудистое пространство, например, подкожно (п.к.), внутримышечно (в.м.), либо непосредственно в сосудистую систему, например, внутривенно (в.в.). Из данных вариантов, подкожный путь введения обычно является наиболее предпочтительным. Одна из главных причин этого заключается в том, что это дает возможность самостоятельного введения лекарственного средства пациентами, что особенно актуально в случае хронической терапии. Кроме того, данный путь является менее инвазивным по сравнению с внутривенным введением и, соответственно, связанные с ним риски, как правило, ниже, как например, в случае непреднамеренного введения в недостаточных санитарно-гигиенических условиях. Подкожное введение является удобным несмотря на то, что частичная резорбция из подкожного пространства и низкая биодоступность, как правило, требуют увеличения дозы, которое приводит к увеличению затрат на лечение.
В дополнение к функциям регуляции и чувствительности, главной функцией кожи является защита. Она действует как барьер против механических нагрузок, но также и как первая линия защиты индивидуума от микроорганизмов, что доказано увеличением риска инфекции/воспаления в случае поврежденной кожи. Поскольку исключительно механической функции может быть недостаточно, дополнительными механизмами химической защиты против патогенных микроорганизмов служат рН и, на некоторых участках, протеазы. Одним из важных, высокоэффективных механизмов защиты является усиленный контроль за тканью со стороны иммунной системы. В то время как физиологически является желательным обнаружение патогенов, распознавание биофармацевтических препаратов иммунной системой аналогично патогенным микроорганизмам в большинстве случаев является нежелательной. Таким образом, усиление иммунного контроля обосновывает второй ключевой недостаток подкожного введения биофармацевтических препаратов, а именно - нежелательную иммуногенность, в дополнение к увеличению затрат, являющихся не только результатом применения большего количества препарата, но и затраты больших усилий для производства и разработки продукции данного класса. Такая нежелательная иммуногенность может привести к многочисленным последствиям. Это может привести к снижению эффективности, повышенному клиренсу из кровотока или служить спусковым механизмом для потенциально угрожающих жизни анафилактических реакций. Поскольку снижение эффективности может быть замечено после длительного периода, это может также означать лишние затраты для системы здравоохранения в связи с высокой ценой продукции данного класса. С точки зрения пациента, как стороны, заинтересованной в получении медицинской помощи, ограниченная биодоступность в сочетании с рисками, такими как иммуногенность, представляют серьезную проблему.
Поскольку факторы риска возникновения иммуногенности, связанные с пациентом, такие как генетическая предрасположенность, являются недостаточно понятными и, соответственно, трудно контролируемыми, контроль и оптимизация факторов риска, связанных с продуктом, являются единственной возможностью для пациентов в полной мере воспользоваться всеми преимуществами современных методов лечения, таких как биологические препараты, в особенности потому, что они назначаются только в случае, когда всех другие способы терапии были неудачны, также и вследствие их высокой стоимости.
Желательная модуляция в данном контексте в большинстве случаев может означать нацеленность на снижение иммуногенности, поскольку в большинстве случаев лекарственные средства, потенциально распознаваемые иммунной системой, включая последующее образование против них антител, являются полностью эффективными и безопасными только тогда, когда такой иммунный ответ отсутствует. С другой стороны, существуют методы лечения, которые специально направлены на вызов соответствующего иммунного ответа для устранения или инактивации намеченной мишени. Соответствующей мишенью может быть чужеродный белок, который должен быть распознан/нейтрализован.
Во всех этих случаях может быть желательным дальнейшее увеличение намеченного иммунного ответа на препарат, и в таких случаях может оказаться полезным наличие лимонной кислоты в растворе для введения или на предшествующих стадиях производства.
Композиции существующего уровня техники, например, Humira®, используемая как композиция против ФНО-альфа (против-ФНОα) антител адалимубаб, включающие в себя кроме того фосфат, а также лимонную кислоту в качестве буферного вещества, отвечают требованиям по переносимости введения, стабильности биофармацевтического лекарственного препарата и сроку годности.
Однако указанные лекарственные формы имеют ряд существенных недостатков. Один из недостатков состоит в том, что многие биофармацевтические препараты при подкожном введении вызывают нежелательную иммуногенность, как описано выше. Иные белковые примеси, вследствие их антигенных свойств, которые трудно обнаружить аналитически, также могут вызвать иммунологические ответы в организме человека. Более того, белки животного происхождения могут вызвать иммунологические ответы в организме человека из-за своих видоспецифических свойств в целом. Даже если риск таких ответов при современном уровне техники методов производства достаточно низок, он может накапливаться с течением времени, в частности, при хроническом повторном применении таких лекарственных средств.
Этого, в частности, следует опасаться в случае подкожного применения, поскольку выведение и распространение посредством кровотока намного медленнее в сравнении с внутривенным применением. Подходящая композиция, следовательно, будет способствовать снижению иммуногенности, вызванной лекарственным средством, обеспечивая экономически более эффективное лекарственное средство, или увеличению иммуногенности, вызванной лекарственным средством в случае, если данная реакция предполагается в качестве профилактического или терапевтического вмешательства.
Проблемой, лежащей в основе настоящего изобретения, является предоставление композиции для биофармацевтических лекарственных средств, которая не обнаруживает вышеописанных недостатков до сих пор известных композиций, нацеленной на низкую иммуногенность или приводящей к повышенной иммунной реакции, если это желательно. Она, в частности, должна быть пригодна для самостоятельного применения пациентами или обученным медицинским персоналом и должна характеризоваться возможностью уменьшать или увеличивать иммуногенность в зависимости от медицинской ситуации и/или в то же время избегать нежелательного раздражения кожи и/или боли в месте инъекции, часто встречающихся при самостоятельном или ином применении препарата путем инъекции.
Таким образом, необходимо предоставить подходящие фармацевтические композиции для парентерального, в частности, подкожного введения/инъекции.
Эта проблема решается посредством вариантов осуществления, описанных в формуле настоящего изобретения. Способ настоящего изобретения дает преимущества в подготовке композиций для уменьшения или увеличения иммуногенности биофармацевтических лекарственных средств, описанных в настоящем описании. Изобретение основано на неожиданном наблюдении, что иммунный ответ может модулироваться посредством выбора походящей композиции, содержащей гександиовую кислоту и/или подходящий уровень лимонной кислоты. Это может быть особенно желательно для лекарственных средств, потенциально распознаваемых иммунной системой. Это делает композиции настоящего изобретения подходящими и преимущественными для применения в готовых к использованию шприцах и комплектах, предоставляемых, например, для домашнего использования.
Краткое содержание сущности изобретения
Прежде подробного описания изобретения, следует понимать, что настоящее изобретение не ограничивается конкретными составными частями описанных устройств или стадий производства описанного способа, поскольку такие устройства и способы могут различаться. Следует также понимать, что терминология используется в настоящем документе с целью описания только конкретных вариантов осуществления и не ограничивается этим. Следует отметить, что, как используется в описании и прилагаемой формуле изобретения, формы единственного числа включают ссылки в единственном и/или множественном числе, если контекст явно не предписывает иное. Более того, следует понимать, что в случае, если даны диапазоны параметров, которые разделены числовыми значениями, диапазоны подразумевают включение данных граничных значений.
В первом аспекте, изобретение предоставляет способ получения фармацевтической композиции, содержащей биофармацевтическое лекарственное средство, причем способ обеспечивает модуляцию иммунных ответов, связанных с ее введением. Указанный способ включает в себя стадии:
(i) предоставление буфера, содержащего
гександиовую кислоту или, по меньшей мере, одну ее соль и/или
лимонную кислоту или, по меньшей мере, одну ее соль
(ii) контактирование данного буфера с биофармацевтическим лекарственным средством
(iii) необязательно лиофилизацию композиции и
(iv) получение композиции или суспензии (ii) и/или лиофилизированной композиции (iii).
Гександиовая кислота представляет собой соединение карбоновой кислоты, которое также называют адипиновой кислотой, 1,4-бутандикарбоновой кислотой, 1,6-гександиовой кислотой, ацифлоктином, ацинеттеном, адипиновой кислотой, октафторгександиовой кислотой или расплавленной адипиновой кислотой. Адипиновая кислота имеет молекулярную формулу C6H10O4 и молекулярную массу 146,1 г/моль. Термины "адипиновая кислота" и "гександиовая кислота" используются взаимозаменяемо в данном документе.
В соответствии с еще одним аспектом изобретения, предоставлен способ применения гександиовой кислоты или, по меньшей мере, одной ее соли, и/или лимонной кислоты или, по меньшей мере, одной ее соли, причем способ позволяет модулировать иммуногенность фармацевтической композиции, содержащейбиофармацевтическое лекарственное средство.
В соответствии с еще одним аспектом изобретения, предоставлена фармацевтическая композиция, которая обеспечивает модуляцию иммунных ответов, относящихся к ее введению. Указанная лекарственная форма содержит биофармацевтическое лекарственное средство и
гександиовую кислоту или, по меньшей мере, одну ее соль, и/или
лимонную кислоту или, по меньшей мере, одну ее соль,
или композиция является получаемой посредством обсужденного выше способа.
В соответствии с настоящим изобретением, термин "фармацевтическая композиция" относится к любой композиции, которая является подходящей для введения пациенту и включает в себя лекарственное средство, которое проявляет терапевтический и/или диагностический эффект. Такая "фармацевтическая композиция" предпочтительно является композицией для доставки лекарственного средства.
В соответствии с еще одним аспектом изобретения, предоставлен способ модулирования иммунных ответов, относящихся к введению фармацевтической композиции. Указанный способ включает в себя стадии адаптации в буфере, содержащемся в указанной лекарственной форме, концентрирования
гександиовой кислоты или, по меньшей мере, одной ее соли, и/или
лимонной кислоты или, по меньшей мере, одной ее соли.
Как использовано в настоящем документе, термин "иммуногенность" и/или "иммуногенный" и/или "степень иммуногенности" должен быть понят в показателях потенциала молекулы, введенной субъекту посредством инъекции, быть распознанной иммунной системой, включая последующие реакции, ожидаемые или неожидаемые, такие как образование антител против молекулы, т.е. быть причиной/вызывать ответ, влияющий на иммунную систему субъекта.
Как использовано в настоящем документе, термин "модуляция иммунных реакций" следует понимать как увеличение или уменьшение иммуногенности, связанной с введением данной композиции. Хотя во многих случаях, снижение иммуногенности может быть желательным для того, чтобы повысить уступчивость пациентов и снизить вредные побочные эффекты, увеличение иммуногенности может быть желательным в других случаях.
Термин "пониженная иммуногенность", используемый в настоящем документе, относится к композиции, выполненной с включением в себя, по меньшей мере, одной биофармацевтической молекулы, которая при введении пациенту, например, подкожно, будет причиной/вызовет иммунный ответ, который не является существенно сильнее иммунного ответа, индуцированного посредством исходной молекулы, обозначенной, как по существу, не являющейся иммуногенной.
Как использовано в настоящем документе, термин "биофармацевтическое лекарственное средство" будет включать любую терапевтическую или диагностическую молекулу, полученную из биологического или биотехнологического источника или химически синтезированную как эквивалент продукции указанного источника, например, белок, пептид, нуклеиновую кислоту, иммуноглобулин, полисахарид, клеточный продукт, растительный экстракт, экстракт животного происхождения, рекомбинантный белок или их комбинации. Обычно биофармацевтическое лекарственное средство представляет собой активный ингредиент биофармацевтического препарата. Термины "лекарственное средство" и "соединение" используются взаимозаменяемо в данном документе и предназначены для обозначения агента(агентов) и/или медикамента(медикаментов), применяемых для диагностики, профилактики или лечения симптомов заболевания, физического или психического состояния, травмы или инфекции.
Термин "биодоступность" относится к степени или величине, в которых лекарственное средство или другое вещество поглощается или становится доступным на участке физиологической активности после введения. Биодоступность макромолекулы может быть проанализирована in vivo посредством фармакокинетических способов, известных в данной области техники.
Подходящие анализы для оценки иммуногенности хорошо известны в технике и включают качественные и полуколичественные реакции связывания, нейтрализации, и подтверждающие анализы (иммуно-, а также иммунохроматографические тесты) для измерения антител к лекарственному средству (ADA). Дальнейшие анализы включают в себя качественные анализы на определение общего количества антител (скрининг и титр), подтверждающего анализа (специфического) посредством применения ИФА, ЭХЛ, РИА и разновидности проточной цитометрии (в том числе кислотной диссоциации "AD" и твердофазной экстракции "SPEAD" и "BEAD" анализы повышенной толерантности к лекарственному средству). Аналитические тесты на клеточной основе для обнаружения нейтрализующих антител и анализа токсикокинетики для анализа крупных молекул также хорошо известны в технике.
Термины "субъект" или "человек", или "животное", или "пациент", или "млекопитающее" означают любой субъект, в частности, млекопитающее, для которого желательны диагноз, прогноз, профилактика или терапия. К "млекопитающим", для назначения лечения, относится к любое животное, классифицируемое как млекопитающее, включая, но не ограничиваясь этим, человека, домашних и сельскохозяйственных животных, а также содержащихся в зоопарке, спортивных или домашних животных, таких как собаки, лошади, кошки, коровы и тому подобное. Предпочтительно млекопитающее представляет собой человека.
В процессе экспериментов, проводимых в пределах объема настоящего изобретения, были обнаружены благоприятные свойства композиции, забуференной гександиовой кислотой, включающие в себя неожиданно хорошую переносимость/совместимость у кроликов после подкожной инъекции и пониженный клиренс в сравнении с доступными для приобретения препаратами и эталонными композициями после одной недели дозирования. Таким образом, как показано в примерах 1 и 2, возможно оказывать воздействие на иммуногенность путем выбора соответствующей концентрации гександиовой кислоты в композиции или применяемом растворе. Это может быть особенно желательно для лекарственных средств, потенциально распознаваемых иммунной системой.
На иммуногенность фармацевтических композиций, содержащих биофармацевтические лекарственные средства, влияют многие факторы, включая структурные особенности (изменение последовательности и гликозилирование), условия хранения (денатурация или агрегация, вызванные окислением), загрязняющие вещества или примеси в препарате, доза и длительность лечения, а также путь введения, подходящая композиция и генетические особенности пациентов. Клинические проявления были изложены в предыдущем разделе.
Как описано детально в экспериментальной части, изобретатели неожиданно обнаружили, что композиция, включающая в себя гександиовую кислоту, характеризуется сниженным иммунным ответом при подкожной инъекции у кроликов, сравнимым с инъекцией композиции, содержащей лимонную кислоту. В то же время, изобретатели неожиданно обнаружили, что композиция, которая имеет пониженное содержание или по существу не содержит лимонной кислоты или ее соли, характеризуется сниженным иммунным ответом при подкожной инъекции у кроликов. Последнее особенно поразительно, потому что, как правило, малые молекулы, подобные органическим кислотам, не вызывают иммунного ответа. Вне связи с теорией, авторы изобретения утверждают, что лимонная кислота или ее соли могут быть иммуногенными как таковые, или играют роль в развитии иммунного ответа.
Таким образом, разумно ожидать, что составление фармацевтического лекарственного средства в буфере гександиовой кислоты будет вызывать меньшее раздражение или иммунный ответ по сравнению, например, с буферами лимонной кислоты. В то же время разумно ожидать, что составление фармацевтического лекарственного средства в буфере, который имеет пониженное содержание или по существу не содержит лимонной кислоты или ее солей, будет вызывать меньшее раздражение или иммунный ответ по сравнению с, например, буферами лимонной кислоты. Настоящее изобретение впервые раскрывает данные удивительные наблюдения, которые, примененные соответственным образом, позволяют оказать воздействие, уменьшить, минимизировать и/или модулировать иммуногенность лекарственных средств, распознаваемых иммунной системой в композиции, не влияя на биодоступность.
Далее, является разумным ожидать, что при составлении биофармацевтического лекарственного средства в буфере, включающем в себя достаточно высокую концентрацию лимонной кислоты, желаемый иммунный ответ может быть значительно увеличен.
Способы и композиции настоящего изобретения могут изменяться, как известно специалистам в данной области, но, как правило, будут следовать методике, описанной далее. Во-первых, очищенное биофармацевтическое лекарственное средство, такое как антитело или белок, получают в желательной концентрации в растворителе, таком как вода, предпочтительно дополняют подходящим буфером, таким как NaCl, Твин-80 или другие буферные средства, хорошо известные в данной области техники, при значениях pH от 5 до 8, при которых биофармацевтическое лекарственное средство является стабильным. Фармацевтическая композиция в соответствии с настоящим изобретением содержит биофармацевтическое лекарственное средство в количестве, которое является эффективным для достижения терапевтического эффекта.
На второй стадии указанное биофармацевтическое лекарственное средство растворяют в буфере, содержащем, по меньшей мере, гександиовую кислоту или, по меньшей мере, одну ее соль в подходящей концентрации, как описано в деталях ниже, чтобы обеспечить создание композиции или суспензии биофармацевтического лекарственного средства. При получении жидкой композиции в соответствии с настоящим изобретением, буферное вещество предпочтительно предоставляется в форме его свободной кислоты. Желательный pH раствора корректировали добавлением оснований, как, например, гидроксидов щелочных металлов, гидроксидов редкоземельных металлов или гидроксида аммония. С этой целью является предпочтительным использовать гидроксид натрия.
Обычно композиция для биофармацевтического лекарственного средства включает один или более буфер(ов), изотонизирующее вещество(вещества) и воду для инъекций в качестве растворителя. Дополнительно, к нему часто добавляются стабилизаторы, как например криопротекторы. Кроме того, могут быть добавлены одно или более веществ, образующих хелатные соединения с металлами и тенсид(тенсиды). Некоторые вещества могут иметь двойную роль, например, некоторые сахара или сахарные спирты могут служить в качестве криопротектора и изотонизирующего вещества.
Как будет понятно специалисту в данной области, чтобы получить композицию в подходящих количествах, могут быть добавлены одна или более других подходящих кислот. Особенно предпочтительными являются моно- или дикарбоновые кислоты, или их соли, где, по меньшей мере, одна выбрана из группы, состоящей из:
уксусной кислоты или ацетата
глутаминовой кислоты или глутамата
яблочной кислоты или малата
лимонной кислоты и/или цитрата
фосфорной кислоты и/или фосфата
винной кислоты или гидротартрата, и/или
янтарной кислоты или сукцината.
В соответствии с настоящим изобретением, специалисты в данной области техники поймут, что термин "подходящая кислота(ы)" относится к кислоте(ам), которые не являются иммуногенными в "подходящем количестве", т.е. при конечной концентрации полученной композиции. Таким образом, определенные кислота(кислоты), известные как распознаваемые иммунной системой, т.е. являющиеся иммуногенными и/или индуцирующими иммунный ответ субъекта/пациента, не рассматриваются как пригодные для получения композиция для снижения иммуногенности в соответствии с настоящим изобретением.
Дополнительные добавки, такие как стабилизаторы, поверхностно-активные вещества, изотонизирующие вещества, металло-ионные хелаторы и др. могут быть добавлены в композицию и/или суспензию, причем данные добавки являются подходящими для требуемого применения, хорошо известно специалисту в данной области техники. Как используется в настоящем документе, термин "стабилизатор" относится к веществу, которое помогает поддерживать структурную целостность биофармацевтического лекарственного средства, особенно во время замораживания и/или лиофилизации, и/или хранения. Такие вещества в контексте настоящего изобретения также называют "криопротектор" или "лиопротектор".
В качестве необязательной стадии в способе настоящего изобретения, полученная композиция и/или суспензия может быть лиофилизирована с помощью стандартных методик, которые хорошо известны квалифицированным специалистам. В предпочтительном варианте изобретения, указанная композиция находится в форме, выбранной из группы, состоящей из
а) водной формы
b) лиофилизированной формы и/или
с) суспензии.
В водной форме указанная композиция может быть готова к введению, а в лиофилизированной форме указанная композиция может быть переведена в жидкую форму перед введением, например, посредством добавления воды для инъекций, которая может содержать или не содержать консерванты, такие как бензиловый спирт, антиоксиданты, такие как витамин А, витамин Е, витамин C, ретинилпальмитат и селен, аминокислоты цистеин и метионин, лимонная кислота и цитрат натрия, синтетические консерванты, такие как парабены, метилпарабен и пропилпарабен.
Наконец, полученная композиция, суспензия и/или лиофилизированная композиция может быть обработана, например, посредством добавления консервантов для длительного хранения или залита в подходящую емкость для желательного введения. Следовательно, композиция, полученная посредством способа настоящего изобретения, является пригодной для парентерального введения терапевтического и/или диагностического лекарственного средства. Парентеральное введение может быть внутримышечным или подкожным, где подкожное применение является особенно предпочтительным.
В частности, композиция настоящего изобретения является желательной для пероральной доставки, за исключением пероральной доставки ротавирусов, а также непероральных путей доставки, таких как, но не ограничиваясь ими, парентеральное введение, местное введение, ингаляционное введение.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции и/или способу, как отмечалось выше, и подробно описано ниже, где композиция находится в непероральной дозированной форме, т.е. не предназначена для перорального введения.
Предпочтительно, гександиовая кислота применяется только в качестве карбоновой кислоты или соли, или даже в качестве только основного буфера в композиции в соответствии с настоящим изобретением.
Особенно предпочтительно, композиция может по существу не содержать, по меньшей мере, одного дополнительного буферного соединения выбранного из группы, состоящей из:
уксусной кислоты или ацетата
глутаминовой кислоты или глутамата
яблочной кислоты или малата
фосфорной кислоты и/или фосфата
винной кислоты или гидротартрата и/или
янтарной кислоты или сукцината
или любого другого подходящего соединения, для которого известно индуцирование или увеличение иммуногенности после введения субъекту.
Соответственно предпочтительному варианту осуществления предоставлено, что способ или композиция настоящего изобретения приводят к снижению иммунных ответов, относящихся к ее введению. В предпочтительном варианте осуществления это может быть достигнуто, в частности, таким образом, что композиция имеет пониженное содержание или по существу не содержит лимонной кислоты или ее соли. Предпочтительно, вместо нее композиция содержит гександиовую кислоту.
Термин "пониженное содержание лимонной кислоты", используемый здесь, означает, что композиция предпочтительно не содержит более чем 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2 или 1,3 мМ лимонной кислоты или ее соли.
Данный диапазон концентраций может также охватывать совокупные концентрации лимонной кислоты и ее соли, например, цитрата натрия. В случае, когда лимонная кислота предоставлена в качестве гидрата (например, моногидрата), соответствующие концентрации должны быть соответственно изменены.
Термин "по существу не содержит лимонной кислоты", используемый здесь, означает, что лимонная кислота или ее соли не добавляются в состав намеренно. Общее количество лимонной кислоты или ее соли как продукта непреднамеренного загрязнения поэтому ниже 0,05%, предпочтительно ниже 0,01%. Наиболее предпочтительной является композиция, в которой отсутствуют лимонная кислота или ее соли в количествах, которые могут быть обнаружены с помощью стандартных аналитических методов, используемых в фармацевтической технологии.
Является особенно предпочтительным, что гександиовая кислота присутствует в композиции в соответствии с настоящим изобретением в концентрации между ≥1 и ≤100 мМ, предпочтительно между ≥2 и ≤50 мМ, и даже более предпочтительно между ≥5 и ≤25 мМ, наиболее предпочтительно 23 мМ. Следует понимать, что каждое числовое значение в диапазоне от 1 мМ до 100 мМ может быть использовано в соответствии с настоящим изобретением и зависит от предполагаемого применения композиции и пациента, получающего лечение.
Кроме того, предпочтительно, чтобы в дополнение к гександиовой кислоте, фармацевтическая композиция могла также содержать фосфаты, предпочтительно фосфат натрия (в настоящем документе также называемый "NaP"). Термин "фосфат натрия" следует понимать как охватывающий дигидрофосфат натрия и гидрофосфат динатрия, и все вероятные их соли и/или гидраты.
Соответственно другому предпочтительному варианту осуществления предоставлено, что способ или композиция в соответствии с настоящим изобретением приводят к увеличению иммунных ответов, относящихся к ее введению. В предпочтительном варианте осуществления это может быть достигнуто, в частности, таким образом, что композиция содержит лимонную кислоту или ее соли.
Предпочтительно, это означает, что лимонная кислота или ее соли были намеренно добавлены в состав, хотя этот вариант также охватывает те композиции, где лимонная кислота присутствует без преднамеренного добавления.
Предпочтительно, чтобы композиция содержала бы больше, чем 1,30, 1,40, 1,50, 1,60, 1,70, 1,80, 1,90, 2,00, 2,10, 2,20, 2,30, 2,40, 2,50, 2,60, 2,70, 2,80, 2,90, 3,00, 3,10, 3,20, 3,30, 3,40, 3,50, 3,60, 3,70, 3,80, 3,90, 4,00, 4,10, 4,20, 4,30, 4,40, 4,50, 4,60, 4,70, 4,80, 4,90, 5,00, 5,10, 5,20, 5,30, 5,40, 5,50, 5,60, 5,70, 5,80, 5,90, 6,00, 6,10, 6,20, 6,30, 6,40, 6,50, 6,60, 6,70, 6,80, 6,90, 7,00, 7,10, 7,20, 7,30, 7,40, 7,50, 7,60, 7,70, 7,80, 7,90, 8,00, 8,10, 8,20, 8,30, 8,40, 8,50, 8,60, 8,70, 8,80, 8,90, 9,00, 9,10, 9,20, 9,30, 9,40, 9,50, 9,60, 9,70, 9,80, 9,90 или 10,00 мМ лимонной кислоты или ее соли.
Данный диапазон концентраций может также охватывать совокупные концентрации лимонной кислоты и ее соли, например, цитрата натрия. В случае, когда лимонная кислота предоставлена в качестве гидрата (например, моногидрата), соответствующие концентрации должны быть изменены соответственно.
Указанная водная форма фармацевтической композиции имеет рН, предпочтительно, между ≥3 и ≤9, предпочтительно между ≥4 и ≤8, более предпочтительно между ≥5 и ≤7.
В еще одном предпочтительном варианте осуществления настоящего изобретения композиция дополнительно включает в себя, по меньшей мере, один стабилизатор, выбранный из группы, состоящей из аминокислоты, сахарного полиола, дисахарида и/или полисахарида.
Предпочтительно, указанный дисахарид представляет собой, по меньшей мере, одно вещество, выбранное из группы, состоящей из сахарозы, трегалозы, мальтозы и/или лактозы.
Также предпочтительно, указанный сахарный полиол представляет собой, по меньшей мере, одно вещество, выбранное из группы, включающей маннит и/или сорбит. Маннит является особенно предпочтительным среди этих сахарных полиолов. Предпочтительно, он используется в качестве единственного сахарного полиола или даже единственного стабилизатора в фармацевтической композиции в соответствии с настоящим изобретением.
Является особенно предпочтительным, что указанный стабилизатор присутствует в водной форме фармацевтической композиции в концентрации между ≥1 мМ и ≤300 мМ, предпочтительно между ≥2 мМ и ≤200 мМ, и более предпочтительно между ≥5 мМ и ≤150 мМ.
В еще одном предпочтительном варианте осуществления настоящего изобретения, указанная композиция дополнительно включает в себя, по меньшей мере, одно вещество, выбранное из группы, состоящей из:
поверхностно-активного вещества
изотонизирующего вещества и/или
металло-ионного хелатора.
Указанное поверхностно-активное веществ изменяет смачиваемость компонентов и поддерживает их растворимость. Это особенно важно, поскольку биофармацевтические лекарственные средства часто составляются при высоких концентрациях (например, > 100 мг в 1-10 мл).
Подходящими поверхностно-активными веществами, являются, например, лецитин и другие неионные тенсиды, как полисорбаты (“Tween”) или полоксамеры. Особенно предпочтительными являются вещества полисорбат 80 (“Tween-80”) или полоксамер 188.
Указанное изотонизирующее вещество служит для удержания осмотического давления композиции в соответствии с настоящим изобретением при физиологически допустимом значении, например, осмолярности крови.
Изотонизирующее вещество представляет собой физиологически приемлемое соединение и конкретно не ограничивается. Типичные примеры изотонизирующего вещества представляют собой, например, неорганические соли, такие как хлорид натрия, хлорид калия или хлорид кальция и тому подобное. Они могут использоваться отдельно или в смеси друг с другом.
Указанный металло-ионный хелатор служит для образования комплекса тяжелых металлов, которые в противном случае могут инактивировать биофармацевтическое лекарственное средство, включенное в композицию в соответствии с настоящим изобретением. Предпочтительно указанный металло-ионный хелатор представляет собой ЭДТА и/или ЭГTA.
Хотя появляется все больше доказательств того, что высокие количества лимонной кислоты могут оказать влияние на иммуногенность при подкожном введении, причем иммуногенность, вероятно, индуцирует и/или увеличивает клиренс фармацевтического лекарственного средства, содержащегося в композиции, забуференной лимонной кислотой, является желательным избегать нежелательного клиренса фармацевтических лекарственных средств, которые должны присутствовать в активной форме в организме.
Как описано в Примере 2, а также на Фиг. 3 и в Таблице 4, применение композиции, забуференной адипиновой кислотой, содержащей адалимумаб без лимонной кислоты, проявляет на удивление низкий иммунный ответ при подкожном введении. В результате композиция, забуференная адипиновой кислотой, приводит к очень низкому уровню иммунного ответа и, таким образом, делает данную композицию превосходной для подкожных инъекций.
Таким образом, в еще одном предпочтительном варианте осуществления указанная композиция представляет собой композицию, подходящую для парентерального введения, предпочтительно для внутримышечного и/или подкожного введения. Является особенно предпочтительным, что композиция разработана для подкожного введения.
В предпочтительном варианте осуществления настоящего изобретения, указанная композиция является подходящей для поддержания структурной целостности биофармацевтического лекарственного средства, заключенного в ней, с точки зрения агрегации, защитного потенциала и стабильности (например, термодинамической устойчивости).
В следующей таблице показаны композиции, содержащие химерные, гуманизированные или человеческие антитела (формата IgG), которые показывают превосходное агрегационное поведение под контролем буферов, содержащим фосфатную/цитратную систему, как, например, раскрытые в WO2012/089778, представленной правопреемником, содержание которой включено в настоящий документ посредством ссылки.
(для регуляции pH)
Аналитические методы для измерения стабильности белка доступны в данной области техники и рассматриваются, например, в Peptide and Protein Drug Delivery, 247-301 (Vincent Lee ed., New York, N.Y., 1991) и Jones, 1993 Adv. Drug Delivery Rev. 10: 29-90. Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени, как приведено посредством предоставленных примеров. Хранение стабильной композиции (т.е. срок годности) составляет предпочтительно, по меньшей мере, 6 месяцев, более предпочтительно 12 месяцев, более предпочтительно 12-18 месяцев, и более предпочтительно в течение 2 или более лет.
В другом предпочтительном варианте осуществления настоящего изобретения указанное биофармацевтическое лекарственное средство представляет собой белок. Указанный белок может быть природным белком, модифицированным белком (т.е. белком, который был модифицирован по отношению к его природному аналогу, называемому также каркасом или матрицей) или полностью синтетическим белком (т.е. белком который не имеет природных аналогов).
Указанный белок может быть извлечен из природного организма или он может быть получен путем ферментации культивируемого организма. Кроме того, указанный белок может быть гомологичным или гетерологичным белку, который был получен из организма. Кроме того, указанный белок может быть рекомбинантным белком.
В особенно предпочтительном варианте осуществления биофармацевтическое лекарственное средство представляет собой иммуноглобулин. Предпочтительно, он представляет собой IgG.
Предпочтительно, чтобы белок и/или иммуноглобулин предоставлялся в водной форме фармацевтической композиции в концентрации между ≥0,1 и ≤500 мг/мл-1, предпочтительно между ≥20 и ≤200 мг мл-1.
Термин "иммуноглобулин" означает, включая, но не ограничиваясь этим, антитело и фрагмент антитела (такие как scFv, Fab, Fc, F(ab')2), и другие генно-инженерные части антител. В зависимости от аминокислотной последовательности константных доменов их тяжелых цепей, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM. Некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3 и IgG4; IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа (α) дельта (δ), эпсилон (ε), гамма (γ) и мю (μ) соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Особенно предпочтительным в соответствии с настоящим изобретением является иммуноглобулин, представляющий собой, по меньшей мере, одно антитело или его фрагмент, или производное, выбранное из группы, состоящей из:
(i) моноклональное антитело
(ii) химерное антитело
(iii) гуманизированное антитело и/или
(iv) человеческое антитело.
Является особенно предпочтительным, что указанный иммуноглобулин представляет собой моноклональное антитело или его фрагмент, или производное.
Как используется в настоящем документе, термин "моноклональное антитело (mAb)", относится к композиции антитела, обладающей однородной популяцией антител, т.е. однородной популяцией, состоящей из целого иммуноглобулина или его фрагмента или производного. Особенно предпочтительно, например, антитело, выбранное из группы, состоящей из IgG, IgD, IgE, IgA и/или IgM, или их фрагмента или производного.
Как используется в настоящем документе, термин "фрагмент" относится к фрагментам таких антител, сохраняющим, в некоторых случаях, целевую связывающую способность, например
CDR (область, определяющая комплементарность)
гипервариабельная область
вариабельный домен (Fv)
тяжелая цепь IgG (содержащая VH, CH1, шарнирную область, CH2 и CH3 области)
легкая цепь IgG (содержащая VL и CL области) и/или
Fab и/или F(ab)2.
Как используется в настоящем документе, термин “производное” относится к конструкциям белка и/или иммуноглобулина, которые конструктивно отличаются, но все же имеют некоторое конструктивное родство, общую концепцию антитела, например, scFv, fab и/или F(аb)2, а также би-, три - или более конструкции специфического антитела. Все данные элементы описаны ниже.
Другие производные антител, известные специалистам, представляют собой диатела, антитела верблюжьих, доменные антитела, бивалентные гомодимеры с двумя цепями, состоящие из scFvs, IgAs (две структуры IgG соединены посредством J цепи и секреторного компонента), антитела акулы, антитела, состоящие из каркаса антител приматов Нового Света и приматов не-Нового Света CDR, димеризованные конструкции, включающие СН3+VL+VH, и конъюгаты антител (например, антитела или фрагменты, или производные, связывающие токсин, цитокин, радиоизотоп или метку).
Способы получения и/или выбора химерных, гуманизированных и/или человеческих моноклональных антител известны в данной области техники. Например, US6331415 от Genentech описывает получение химерных антител, в то время как US6548640 от Medical Research Council описывает методы трансплантации CDR, и US5859205 от Celltech описывает получение гуманизированных антител. Библиотеки антител in vitro, в числе других раскрыты в US6300064 от MorphoSys и US6248516 от MRC/Scripps/Stratagene. Методы фагового отображения, например, раскрыты в US5223409 от Dyax. Трансгенные платформы млекопитающих описаны в примерах в US200302048621 от TaconicArtemis.
IgG, scFv, fab и/или F(аb)2 представляют собой форматы антител, хорошо известных специалистам. Соответствующие методы обеспечения доступны в соответствующих руководствах.
Как используется в настоящем документе, термин “Fab” относится к фрагменту IgG, включающему в себя антигенсвязывающую область, указанный фрагмент состоит из одного константного и одного вариабельного доменов из каждой тяжелой и легкой цепи антитела.
Как используется в настоящем документе, термин “F(ab)2” относится к фрагменту IgG, состоящему из двух Fab-фрагментов, соединенных друг с другом дисульфидными связями.
Как используется в настоящем документе, термин “scFv” относится к одноцепочечному вариабельному фрагменту, являющемуся гибридом вариабельных областей тяжелой и легкой цепей иммуноглобулинов, связанных вместе коротким линкером, обычно серином (S) или глицином (G). Эта химерная молекула сохраняет специфичность исходного иммуноглобулина, несмотря на удаление константных областей и введение линкерного пептида.
Модифицированные форматы антител представляют собой, например, конструкции би- или триспецифичных антител, гибридные белки на основе антител, иммуноконъюгаты и тому подобное.
В другом предпочтительном варианте осуществления настоящего изобретения указанное антитело или его фрагмент, или производное представляет собой антитело против ФНО-α.
Один пример антитела против ФНО-α описывается посредством списка последовательностей, раскрытого в международной заявке WO2012089778. В нем, SEQ ID No 1 определяет кодирующую последовательность нуклеиновой кислоты для тяжелой цепи IgG, SEQ ID No 2 определяет кодирующую последовательность нуклеиновой кислоты для легкой цепи IgG, и SEQ ID No 3 и 4 определяет аминокислотные последовательности тяжелой цепи и легкой цепи соответственно.
SEQ ID No 5, 7 и 9 определяют аминокислотные последовательности областей, определяющих комплементарность (CDR) легких цепей, (т.е., LC CDR 3, LC CDR 2 и LC CDR 1). SEQ ID No 6, 8 и 10 определяют аминокислотные последовательности областей, определяющих комплементарность (CDR) тяжелых цепей (т.е. HC CDR 3, HC CDR 2 и HC CDR 1).
Отметим, что SEQ ID N 1 и 2 или их части могут быть эквивалентно заменены
последовательностями нуклеиновых кислот, кодирующими те же белки или белковые цепи, кодируемые посредством SEQ ID No 1 и 2, но имеющими замену нуклеотидов, которые являются допустимыми в соответствии с вырожденностью генетического кода,
последовательностями, кодирующими фракцию, вариант, гомолог или дериват белков или белковых цепей, кодируемых SEQ ID No 1 и 2,
последовательностями нуклеиновых кислот, которые имеют код, оптимизированный для данного хозяина экспрессии, и/или
молекулами нуклеиновой кислоты, имеющими последовательность, идентичную SEQ ID No 1 или 2, по меньшей мере, на 70, предпочтительно на 95%.
В особенно предпочтительном варианте осуществления фармацевтическая композиция или композиция, получаемая посредством способа в соответствии с настоящим изобретением, включает в себя антитело, включающее в себя (i) аминокислотную последовательность, которая, по меньшей мере, на 80% идентична аминокислотной последовательности SEQ ID No 1 и/или SEQ ID No 2; и/или (ii) области CDR, которые имеют аминокислотные последовательности, идентичные аминокислотным последовательностям областей CDR адалимумаб.
В одном варианте осуществления антитело изобретения включает в себя, по меньшей мере, CDR одной тяжелой или легкой цепей молекулы антитела, известного как адалимумаб. В другом варианте осуществления антитело изобретения включает в себя, по меньшей мере, две CDR из одной или более молекулы антитела. В другом варианте осуществления антитело изобретения включает в себя, по меньшей мере, три CDR из одной или более молекул антитела. В другом варианте осуществления, антитело изобретения включает в себя, по меньшей мере, четыре CDR из одной или более молекул антитела. В другом варианте осуществления, антитело включает в себя, по меньшей мере, пять CDR из одной или более молекул антитела. В другом варианте осуществления, антитело включает в себя, по меньшей мере, шесть CDR из одной или более молекул антитела.
В еще одном другом варианте осуществления фармацевтическая композиция или композиция, получаемая посредством способа в соответствии с настоящим изобретением, включает в себя антитело, которое содержит аминокислотную последовательность, которая, по меньшей мере, на 80%, 85%, 90% или 95% идентична аминокислотной последовательности SEQ ID No 1 и/или SEQ ID No 2. В частности, указанное антитело включает в себя, то есть, по существу состоит из вариабельной области тяжелой и/или легкой цепи иммуноглобулина (VL и/или VH), где, по меньшей мере, одна из VL-CDR вариабельных областей легкой цепи или, по меньшей мере, две из VL-CDR вариабельных областей легкой цепи являются, по меньшей мере, на 80%, 85%, 90% или 95% идентичными референтной аминокислотной последовательности VL-CDR1, VL-CDR2, или VL-CDR3, и/или VH-CDR4, VH-CDR5 или VH-CDR6 легкой цепи антитела, как описано в SEQ ID No от 1 до 10.
Отмечают, что SEQ ID No от 3 до 10 или их части, могут быть эквивалентно заменены аминокислотными последовательностями, несущими одну или более консервативную аминокислотную замену(замен), т.е. одну или более замену(замен), которые не затрагивают существенные характеристики белка, такие как целевая связывающая способность, иммуногенность, ADCC ответ, время полувыведения из сыворотки, растворимость и так далее.
Другие предпочтительные антитела представляют собой антитела, которые распознают какие-либо один или сочетание белков, включая, но не ограничиваясь этим, любые из указанных белков и/или следующих антигенов: CD2, CD3, CD4, CD8, CD11a, CD14, CD18, CD20, CD22, CD23, CD25, CD33, CD40, CD44, CD52, CD80 (B7,1), CD86 (B7,2), CD147, IL-la, IL-1, IL-2, IL-3, IL-7, IL-4, IL-5, IL-8, IL-10, IL-2 рецептор, IL-4 рецептор, IL-6 рецептор, IL-13 рецептор, IL-18 рецепторные субъединицы, PDGF-β и его аналоги, PLGF, VEGF, TGF, TGF-β2, TGF-p1, EGF рецептор, PLGF рецептор, VEGF рецептор, фактор роста гепатоцитов, остеопротегерин лиганд, гамма-интерферон, стимулятор В-лимфоцитов, С5 компонент комплемента, IgE, опухолевый антиген СА125, опухолевый антиген MUC1, антиген PEM, ErbB2/HER-2, опухоль-ассоциированные эпитопы, повышенные уровни которых присутствуют в сыворотке крови больных, ассоциированные с злокачественным образованием эпитопы или белки, экспрессированные на раковых клетках молочной железы, толстой кишки, плоского эпителия, простаты, поджелудочной железы, легких и/или почек, и/или на клетках меланомы, глиомы, нейробластомы, некротического ядра опухоли, интегрина альфа 4 бета 7, интегрина VLA-4, В2 интегринов, TRAIL рецепторов 1,2,3, и 4, RANK, RANK лиганд, ФНО-α, молекулы адгезии VAP-1, молекулы адгезии эпителиальных клеток (EpCAM), молекулы-3 межклеточной адгезии (ICAM-3), лейкоинтегринадгезина, гликопротеина тромбоцитов gpIIb/IIIa, тяжелой цепи сердечного миозина, паратиреоидного гормона, MHC I, карциноэмбрионального антигена (СЕА), альфа-фетопротеина (AFP), фактора некроза опухоли (TNF), Fc-y-1 рецептора, HLA-DR 10 бета, HLA-DR антигена, L-селектина и IFN-γ.
Альтернативно, указанное биофармацевтическое лекарственное средство представляет собой миметик антитела, то есть, мишень-связывающую белковую молекулу, не являющуюся иммуноглобулином. Многие из указанных методов применимы также для этих молекул. Такие миметики антител представляют собой, например, производные от белков с анкириновым повтором, лектинов С-типа, А-доменных белков золотистого стафилококка, трансферринов, липокалинов, фибронектинов, домена Куница ингибиторов протеазы, убиквитина, узлы или узелки цистеина, тиоредоксина А и так далее, и известны специалисту в данной области из соответствующей литературы.
В качестве другой альтернативы указанное биофармацевтическое лекарственное средство представляет собой рекомбинантный белок, включающий в себя какой-либо из указанных белков или по существу аналогичных белков. Например, рекомбинантные гибридные белки, включающие в себя один из указанных белков плюс домен мультимеризации, такой как лейциновая застежка, суперспираль и Fc-фрагмент антитела, или по существу аналогичный белок, может быть биофармацевтическим лекарственным средством, включенным в композиции настоящего изобретения. В частности, включенными в число таких рекомбинантных гибридных белков являются белки, в которых, по меньшей мере, часть TNFR или RANK гибридизируется в Fc-фрагмент антитела. Особенно предпочтительными являются указанные рекомбинантные гибридные белки, включающие в себя мишень-связывающий домен и Fc-домен IgG (так называемые -цепт молекулы).
Поскольку, например, определенные антитела должны применяться подкожно на регулярной основе, например, ежедневно, еженедельно, раз в две недели (т.е., каждые 13-15 дней) и/или раз в месяц и определенные буферы, используемые в настоящее время для такой цели, могут вызывать при инъекции в кожу местное раздражение и/или боль, и/или стимулировать клиренс введенного антитела, желательно предоставить способ, который эффективен при модуляции, такой как предотвращение, минимизация и/или понижение иммуногенности.
Как оценит специалист в данной области, некоторые кислоты, применяемые в качестве основных буферных соединений, такие как лимонная кислота, страдают тем недостатком, что при подкожной инъекции вызывают раздражение кожи, а также боль вокруг места инъекции. Настоящее изобретение впервые неожиданно раскрывает, как показано в Примерах, что лимонная кислота в концентрациях от 1,3 мМ до 9,6 мМ сильно влияет на иммуногенность при подкожной инъекции белка, такого как антитело адалимумаб.
В одном варианте осуществления забуференная композиция в соответствии с настоящим изобретением предназначена для получения лекарственного препарата, предпочтительно для подкожного или внутримышечного введения, например, посредством инъекции из предварительно наполненных шприцев или посредством инфузии, в случае, если желательным является долговременное непрерывное введение биофармацевтического лекарственного средства, как определено выше.
Как уже упоминалось выше и показано в примерах из WO2012/089778, композиция адалимумаб с гександиовым буфером остается стабильной в течение длительного периода времени и в принципе может храниться в любой подходящей емкости. Соответственно, настоящее изобретение также относится к емкости, содержащей одну из композиций, описанных выше и/или в примерах.
Обычно емкость-контейнер, предназначенная для хранения и/или введения биофармацевтического лекарственного средства, выглядит как флакон, шприц, инъекционная ручка, ампула, карпула или инфузионный контейнер, где композиция в соответствии с настоящим изобретением является особенно преимущественной для использования в готовых к использованию шприцах, ручках и ампулах. В предпочтительном варианте осуществления жидкая композиция предоставлена в шприце или ручке в эффективной концентрации, в случае антител к ФНО-альфа, таких как адалимумаб, - 40 мг в 0,8 мл.
В одном варианте осуществления, настоящее изобретение относится к предварительно заполненному шприцу или ручке, флакону или инфузионному мешку, указанным шприцу или ручке, флакону или инфузионному мешку, содержащим фармацевтическую композицию или композицию/суспензию и/или лиофилизированные формы, получаемые согласно способу настоящего изобретения.
В еще одном аспекте настоящего изобретения, предоставлена первичная упаковка, такая как предварительно заполненный шприц или ручка, флакон или инфузионный мешок, содержащая композицию, полученную согласно способу первого аспекта изобретения и/или композицию согласно второму аспекту настоящего изобретения.
Предварительно заполненный шприц или ручка могут содержать композицию либо в лиофилизированной форме (которая впоследствии должна быть растворена, например, в воде для инъекций перед введением), либо в водной форме. Указанные шприц или ручка часто являются предметами для одноразового применения и могут иметь объем от 0,1 до 20 мл. Однако шприц или ручка могут также быть многоразовыми или мультидозовыми шприцем или ручкой.
Указанный флакон может также содержать композицию в лиофилизированной форме или в водной форме и может служить в качестве одноразового устройства или устройства для многократного применения. В качестве устройства для многократного применения указанный флакон может иметь больший объем.
Указанный мешок для инфузии обычно содержит композицию в водной форме и может иметь объем от 20 до 5000 мл.
В дополнительном аспекте изобретения фармацевтическая композиция или композиция/суспензия и/или лиофилизированная композиция, доступная посредством способа, и/или указанная первичная упаковка, как уже упоминалось выше, предназначена для применения в лечении, по меньшей мере, одного патологического состояния, выбранного из группы, состоящей из:
аутоиммунных заболеваний
инфекционных заболеваний
неопластических и/или злокачественных заболеваний (рака) и
заболеваний нервной системы.
Подходящие аутоиммунные заболевания представляют собой артрит и ревматические заболевания, такие как псориаз, болезнь Крона или ревматоидный артрит. Подходящие инфекционные заболевания представляют собой вирусные и/или бактериальные инфекции. Подходящие неопластические и/или злокачественные заболевания представляют собой саркомы, карциномы, лимфомы и лейкемии, предпочтительно рак легких, рак молочной железы, рак яичников, рак толстой кишки, рак предстательной железы, рак шейки матки и тому подобное. Подходящие заболевания нервной системы представляют собой, в частности, нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, болезнь Хантингтона, или боковой амиотрофический склероз.
В других случаях и в той же дозировке, композиции, содержащие антитела противФНО-альфа в соответствии с настоящим изобретением могут быть использованы согласно информации о продукте Нumira® (INN: адалимумаб), в частности, той, что касается дозировки, введения и медицинских показаний.
Поскольку смешивание с дополнительными вспомогательными веществами или принятие дополнительных подготовительных мер, таких как фильтрация, смешивание и др., перед введением композиции биофармацевтического лекарственного средства в соответствии с настоящим изобретением преимущественно могут быть пропущены, биофармацевтическое лекарственное средство в соответствии с настоящим изобретением может быть получено для немедленного введения, например, в наборе.
В варианте осуществления, который является особенно преимущественным для врачей, фармацевтов и особенно для пациентов, настоящее изобретение также относится к набору для парентерального введения композиции, получаемой посредством способа настоящего изобретения, или фармацевтической композиции, применяемой в способе снижения иммуногенности, содержащей один или более из вышеописанных сосудов, желательно вместе с инструкциями для хранения и/или введения.
Предпочтительно, в соответствии с настоящим изобретением в наборе предоставлено 1 или 2, или 3, или 4, или 5 шприцев или ручек, необязательно больше, как например, 7 шприцев или ручек в наборе, предназначенном для ежедневного введения в течение одной недели.
Из соображений безопасного обращения, набор в соответствии с настоящим изобретением преимущественно имеет безопасные отсеки для шприцев и для инъекционных и/или инфузионных игл, соответственно. Здесь также должны быть продуманы устройство для извлечения игл и готовые или предварительно установленные герметизирующие колпачки.
Как описано выше, композиции в соответствии с настоящим изобретением являются стабильными в течение длительного периода времени, в частности при примерно 5°С, предпочтительно в течение, по меньшей мере, 4 недель. Поэтому композиции, сосуды и наборы в соответствии с настоящим изобретением могут с успехом храниться в обычном холодильнике.
Данные и дополнительные варианты осуществления, которые вытекают из настоящего изобретения охватываются формулой изобретения.
Раскрытие документов предшествующего уровня техники, приведенное выше и в последующем включены в настоящую заявку путем ссылки, в частности по производству антител против ФНО-альфа и гександиового кислотного буфера. Данные и последующие варианты осуществления раскрыты и очевидны для специалиста в данной области техники и охватываются описанием и примерами настоящего изобретения. Дополнительная литература по указанным наполнителям, а также электронным средствам, которые могут быть использованы в соответствии с настоящим изобретением, могут быть взяты из предшествующего уровня техники, например из публичных библиотек, используя, например, электронные средства. Кроме того, дополнительные публичные базы данных легко доступны через интернет, как например "PubMed".
Методы выполнения настоящего изобретения известны специалисту в данной области техники и могут быть взяты из соответствующей литературы, см., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986).
Краткое описание чертежей
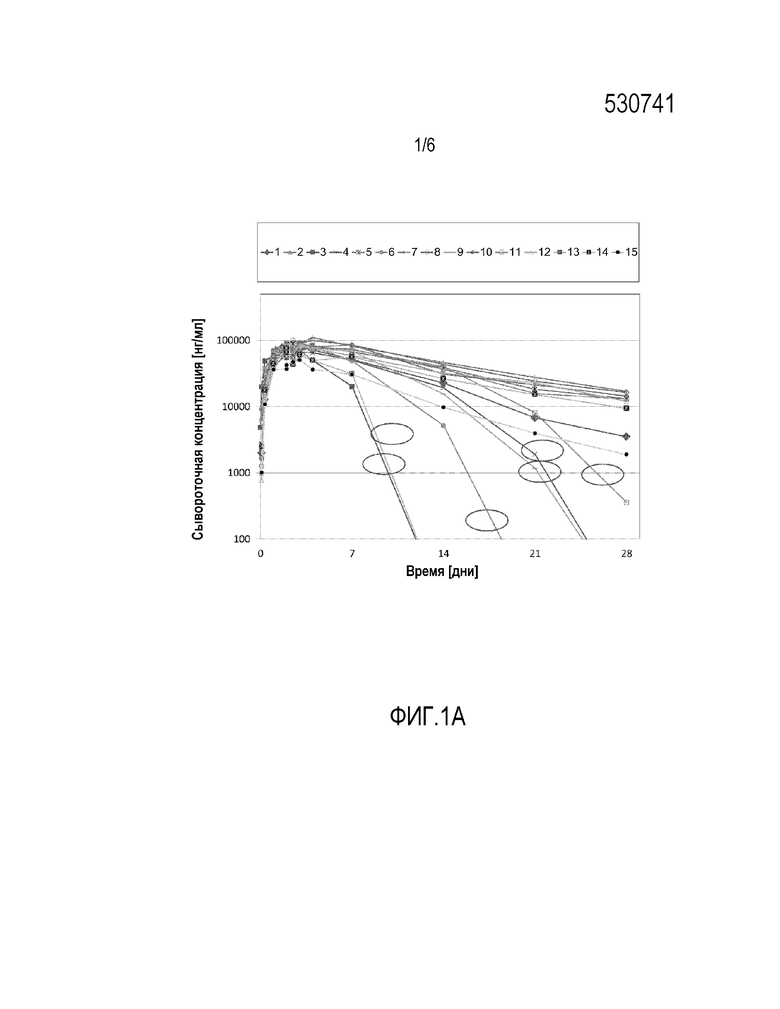
Фиг. 1-a: Полулогарифмическое представление концентраций адалимумаб в сыворотке индивидуума после однократного п.к. введения Humira® (у индивидуумов, характеризующихся циклическим соответствующим ADA ответом)
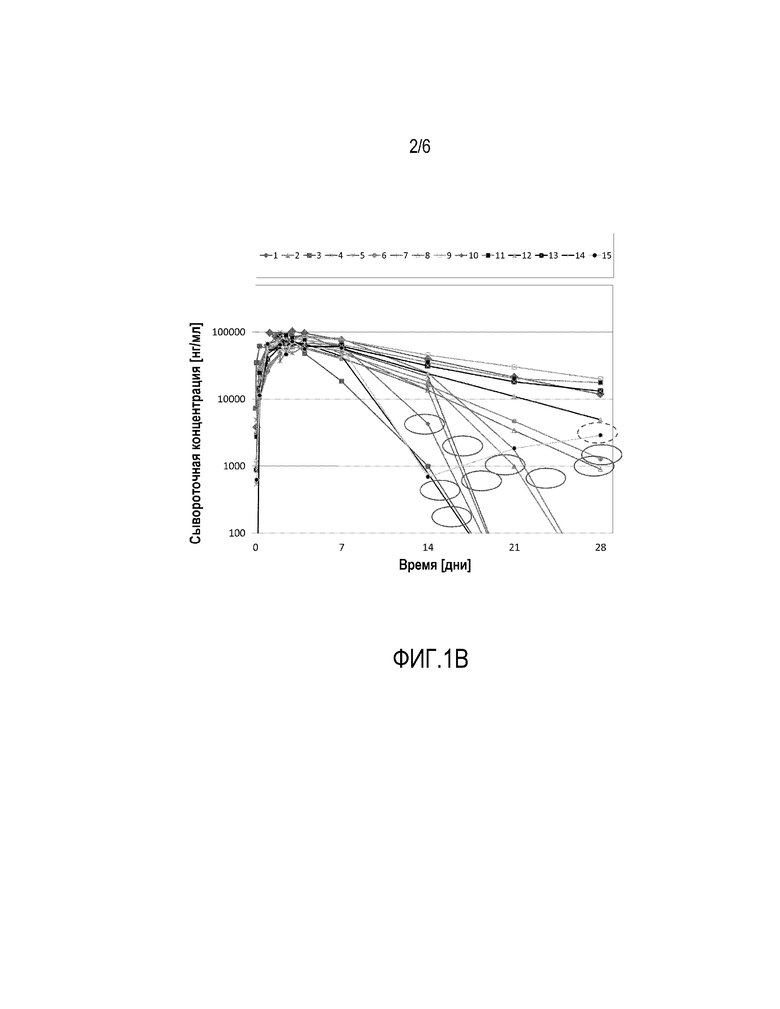
Фиг. 1-b: Полулогарифмическое представление концентраций адалимумаба в сыворотке индивидуума после однократного п.к. введения принадлежащей правопреемнику версии адалимумаб, изготовленной подобно Humira®, однако при повышенной концентрации лимонной кислоты (у индивидуумов, характеризующихся циклическим соответствующим ADA ответом)
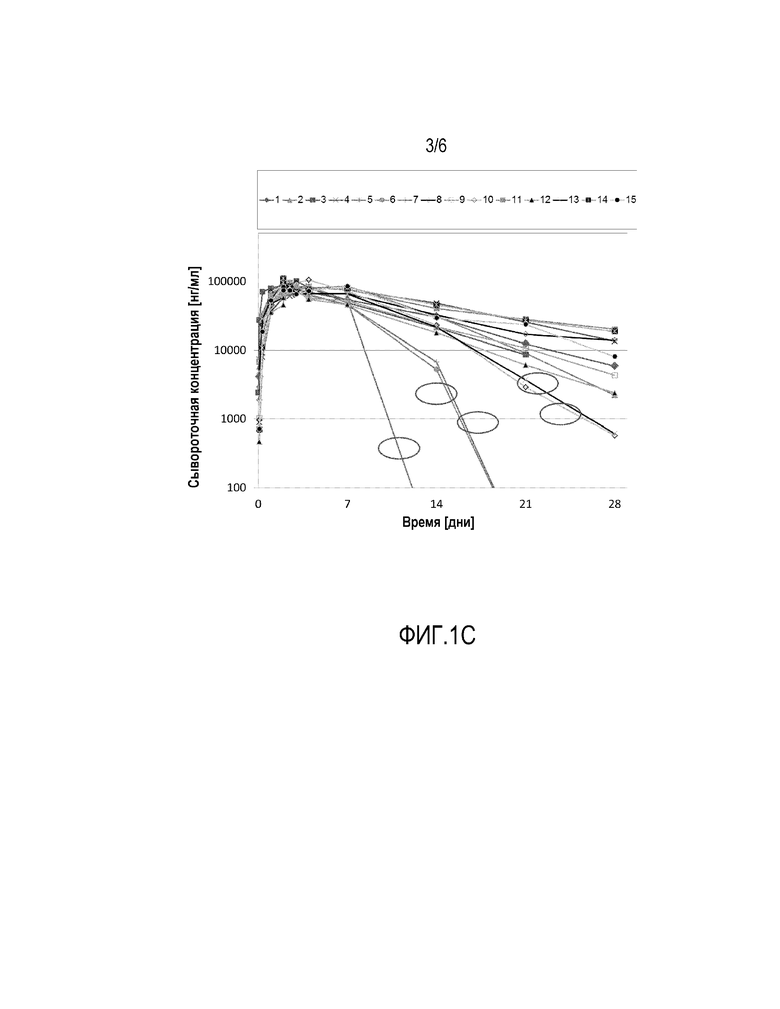
Фиг. 1-c: Полулогарифмическое представление концентраций адалимумаба в сыворотке индивидуума после однократного п.к. введения принадлежащей правопреемнику версии адалимумаб, изготовленной с адипиновой кислотой и имеющей пониженную концентрацию лимонной кислоты по сравнению с Humira® (у индивидуумов, характеризующихся циклическим соответствующим ADA ответом)
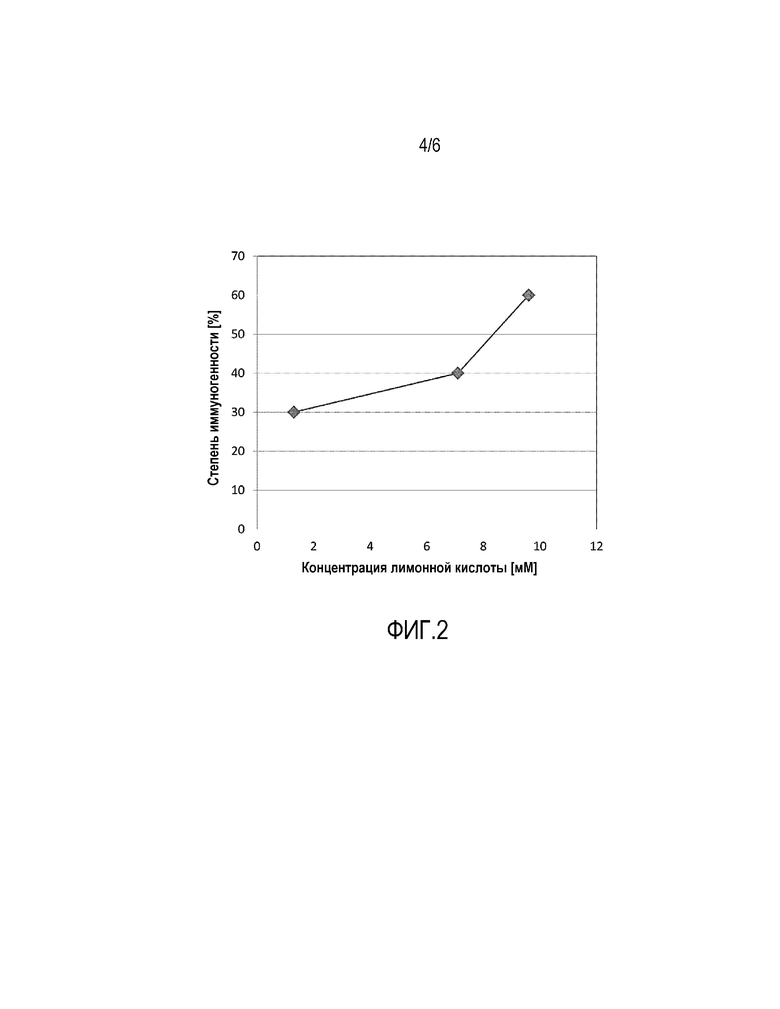
Фиг. 2: Cтепень иммуногенности в исследовании № 1. Корреляция между концентрацией лимонной кислоты и степенью иммуногенности в трех группах исследования
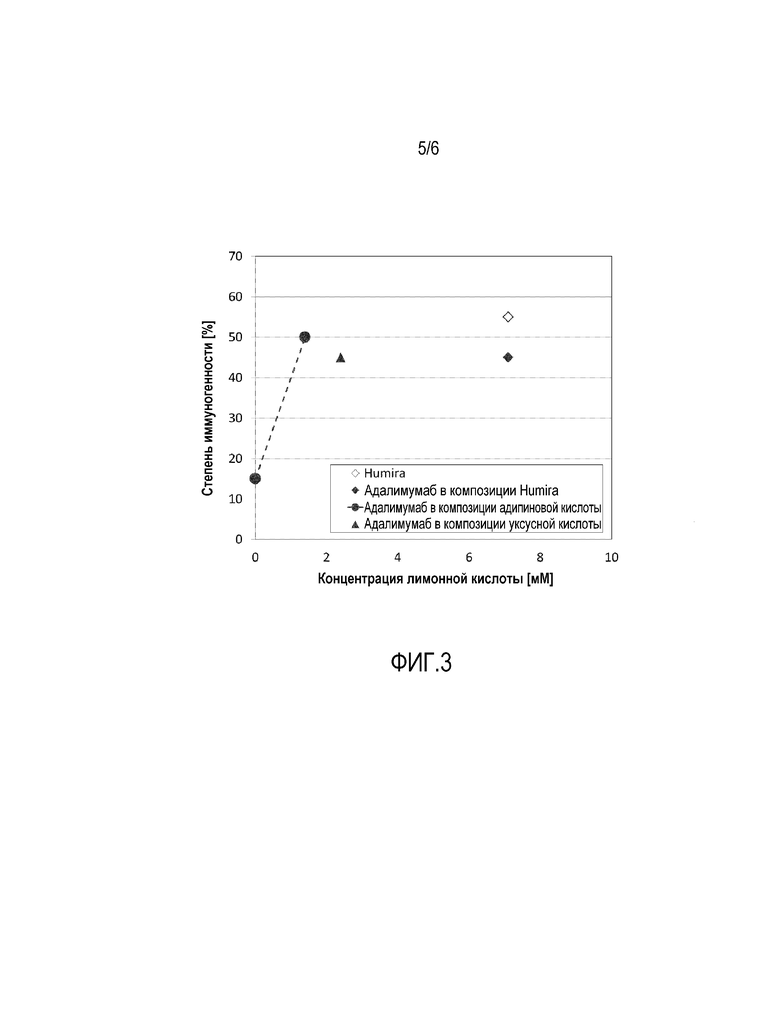
Фиг. 3: Степень высокого титра иммунного ответа в исследовании № 2 принадлежащей правопреемнику версии адалимумаб, изготовленной подобно Humira®. Полученная в результате величина иммуногенности имеет тот же порядок, т.е. в этом отношении принадлежащая правопреемнику версия адалимумаб может распространяться как Нumira®
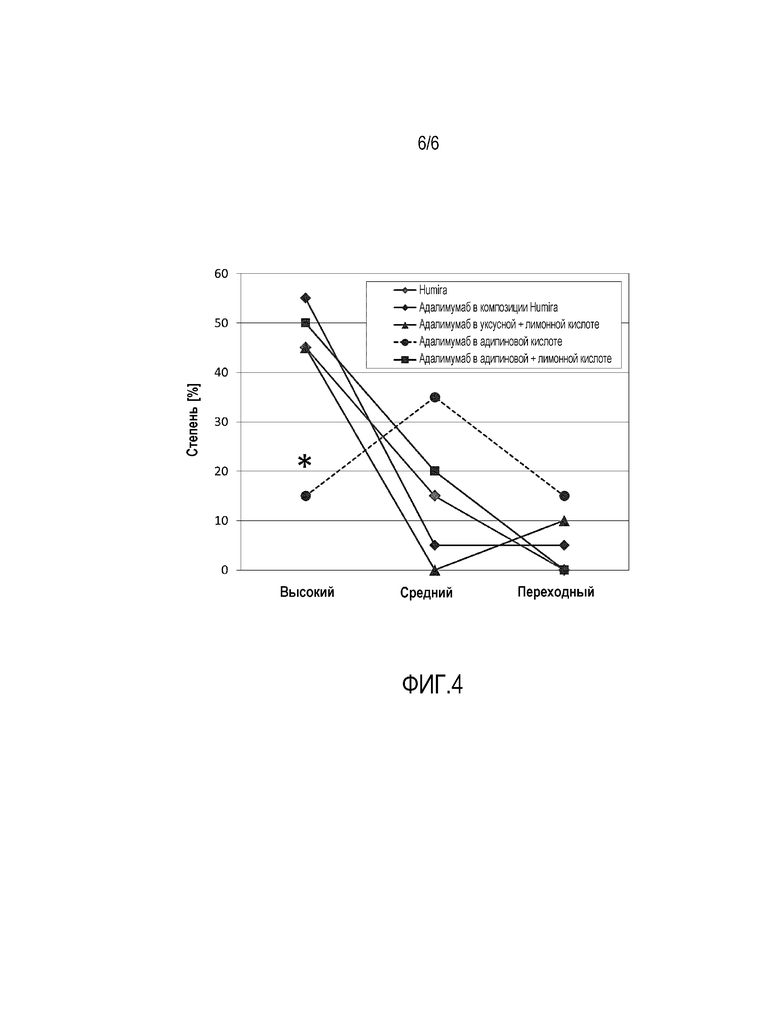
Фиг. 4: Степень иммуногенности в исследовании № 2. Профиль иммунного ответа на композицию с адипиновой кислотой (высокий, средний, переходный, никакого ответа) вел себя статистически значимо по сравнению с Humira® (р<0,05 для t-теста с точным критерием Фишера; Пирсон: 9,167 (р=0,02716) для хи-квадрат, с 3 степенями свободы и за исключением случаев наступления нулевой ячейки)
ПРИМЕРЫ
Материалы и методы
Пример 1: Исследование №1
Животные:
45 чистопородных самок новозеландского белого (NZW) кролика были доставлены промышленным заводчиком. Масса тела животных составляла приблизительно около 3 кг, и все животные обследовали на внешние признаки болезни, чтобы гарантировать включение исключительно здоровых индивидуумов. Индивидуумов пометили вытатуированными номерами.
Применение:
Все животные получили дозу лекарства в день 1 исследования путем подкожной болюсной инъекции в область спины, сделанной одним зоотехником. Скорость введения составила около 15 секунд/доза, объем введения 0,2 мл/кг массы тела.
Группы лечения:
Определили три группы лечения, две из которых (группы 1 и 3) получали композицию, включающую в себя версию адалимумаб, принадлежащую правопреемнику, и одна из которых (группа 2), включающую в себя препарат Нumira ®.
Размер группы, уровень дозирования
[мг/кг м.т.]
Животных распределяли по группам при помощи метода случайного выбора, генерируемого компьютером.
Питание/Условия содержания/Питьевой режим:
Животным предоставили сертифицированные коммерческие корма (ssniff® K-H (ssniffSpezialdiäten GmbH, 59494 Soest, Germany) и питьевую воду из крана ad libitum. Животных разместили в индивидуальных стандартных клетках при комнатной температуре приблизительно 20°C+3°C и относительной влажности 55%+15%. Краткосрочные отклонения температуры произошли во время чистки. Жилые помещения освещали (около 150 люкс при высоте помещения прибл. 1,50 м) циклично: 12 часов света/12 часов темноты.
Забор крови:
Образцы крови собрали в следующие моменты времени: перед получением доз, на 2, 8 (тестовый день 1), 24, 40 (тестовый день 2), 48, 60 ч. р.а. и в тестовые дни 4, 5, 8, 15, 22, 29. Из образца получили сыворотку и хранили в замороженном виде при температуре -20°C или ниже до отправки и анализа концентрации адалимумаб с помощью обычного сэндвич-ИФА, предназначенного для этой цели.
Пример 2: Исследование №2
Животные:
100 породистых самцов новозеландского белого (NZW) кролика были доставлены тем же коммерческим заводчиком, как и в исследовании №1. Незначительное увеличение размера группы, n=20 в группе против n=15 в группе в исследовании №1 выбрали для обеспечения повышенной надежности полученных данных. Самцов отобрали, чтобы оценить, что на выводы исследования №1 не оказывал влияния пол. Характеристики животных были такими же, как и остальные аспекты дизайна исследования, т.е. случайное распределение в группах лечения, дозировка, количество применения, питание, жилищные условия, питьевой режим и условия освещенности, пробы крови переработка и хранение образцов.
Группы лечения:
Определили пять групп лечения, четыре из которых (группы 2-5) обработали композицией, включающей в себя версию адалимумаб, принадлежащую правопреемнику, и одну из которых (группа 1) - включающую в себя препарат Нumira ®.
Размер группы, уровень дозирования
[мг/кг м.т.]
пол
Забор крови:
Моменты времени забора крови для анализа сывороточных концентраций адалимумаб и иммуногенности слегка расширили, чтобы обеспечить максимальный зазор, минимизировать вмешательство лекарственное средство в обнаружение ADA. Образцы собирали в следующие моменты времени: перед получением доз, 2, 8 (тестовый день 1), 24, 40 (тестовый день 2), 56 ч. p.a. и на тестовые дни 4, 5, и с интервалом в неделю после этого, т.е. на тестовые дни 8, 15, 22, 29, 36, 43, 50, 57, 64, 71, 78. Из образца получили сыворотку и хранили в замороженном виде при температуре -20°C или ниже до отправки и анализа концентрации адалимумаб с помощью обычного сэндвич-ИФА, предназначенного для этой цели.
Результаты
Фигура 1-а иллюстрирует период действия адалимумаб в исследовании № 1, после однократной п.к. инъекции. Начиная примерно через одну неделю после приема препарата, приблизительно у 40% особей произошло значительное снижение уровня в сыворотке крови. Поскольку мишень-опосредованное распределение лекарственного средства у данного биологического вида исключено вследствие высокой специфичности адалимумаб к ФНО человека и приматов, весьма вероятной причиной увеличенного клиренса была иммуногенность, т.е. образование антител к лекарственному средству, возможно, с нейтрализующими/ингибирующими характеристиками. Такой повышенный клиренс представляет ключевую характеристику комплексов антитело-лекарственное средство, по сравнению с лекарственным средством, не связанным с антителом. Также момент первого появления, т.е. после одной недели после введения, хорошо совпадает с данной интерпретацией, эффект был ожидаемым для человеческого белка, введенного животному другого биологического вида, конкретно, если введение произведено путем, провоцирующим иммуногенность, таким как подкожное введение.
Фигура 1-b иллюстрирует результаты лечения 2-й группы в данном исследовании, которая получила такое же количество версии адалимумаб, принадлежащей правопреемнику, изготовленной как Humira®, с применением несколько более высокой концентрации лимонной кислоты. В целом это изменение композиции существенно не влияет на кинетику резорбции, т.е. момент времени, когда была достигнута максимальная концентрация в сыворотке крови и/или ее максимальная концентрация остались в тех же пределах. Также в данной второй группе значительная доля животных показала резкий подъем клиренса, указывающий на формирование ADA, через неделю после дозирования. Интересно, что даже при игнорировании одного индивидуума, который показал лишь временное увеличение клиренса, доля животных, вырабатывающих ADA ответ, возросла по сравнению с группой 1. В то время, как известно, что лимонная кислота вызывает кратковременную боль после подкожной инъекции, роль данного часто используемого компонента в иммуногенности биофармацевтических препаратов не описана до сих пор.
Группа 3 набиралась с целью проверить, может ли основной буферный компонент Нumira®, т.е. фосфат, быть заменен адипиновой кислотой, не влияя на ключевые фармакокинетические параметры и переносимость, что и было сделано. Адипиновая кислота была выбрана, так как она успешно стабилизирует адалимумаб против процессов деградации и агрегации. В целях обеспечения объективности сравнения необходимо, чтобы соответствующие индивидуумы были размещены, обслужены и получили дозу так же, как 1 и 2 группа. В дополнение к обмену фосфата на адипиновую кислоту, была введена версия адалимумаб, принадлежащая правопреемнику, с концентрацией лимонной кислоты, сниженной по сравнению с Нumira®, позволяющая потенциально минимизировать болевые ощущения при инъекции. Неожиданно, не только повышенная концентрация лимонной кислоты в группе 2 привело к увеличению заболеваемости иммуногенностью, но кроме того, снижение концентрации лимонной кислоты коррелирует с низким уровнем иммуногенности в данном исследовании (Фигура 1-с).
Корреляция между концентрацией лимонной кислоты и степенью иммуногенности в трех группах этого исследования обобщены на Фигуре 2 и в таблице 3.
Суммарный ADA титр в исследовании №1
**Продаваемая композиция Humira®
Чтобы далее охарактеризовать и подтвердить обнаруженное в исследовании №1, было проведено второе исследование, с дизайном, по существу, воспроизводящим модель исследования №1, но лаборатория, выполнявшая внутреннюю часть исследования, т.е. содержание животных, генерацию введения доз и получения образцов, была другой. Данный шаг был предпринят, чтобы гарантировать, что никакой неконтролируемый фактор не может вызвать наблюдаемый эффект адипиновая кислота/лимонная кислота. Как дополнительный шаг был разработан узкоспециализированный анализ ADA, поскольку это позволяет напрямую продемонстрировать модуляцию иммунной системы, преднамеренную или непреднамеренную. Кроме того, такой анализ позволяет количественно измерять иммунный ответ, т.е. классифицировать высокий титр/нейтрализацию/ингибирование, средний или просто переходный ответ.
Ориентируясь на клинически наиболее важный высокий титр ответа, на фигуре 3 и в таблице 4 суммированы результаты данного исследования. Во-первых, оно в целом подтвердило основные выводы первого исследования, что концентрация лимонной кислоты сильно влияет на иммуногенность лекарственного средства, распознаваемого иммунной системой, такого как адалимумаб.
Во-вторых, данные показывают, что если версия адалимумаб, принадлежащая правопреемнику, составлена так же, как Нumira®, полученная иммуногенность имеет тот же порядок величины, т.е. версия адалимумаб, принадлежащая правопреемнику, может быть в этом отношении объединена с Нumira®. Об этом свидетельствует тот факт, что также Смах, tмах и AUC были эквивалентны по сравнению с Humira®. При повышенной концентрации лимонной кислоты иммуногенность версии адалимумаб, принадлежащей правопреемнику, была ниже по сравнению с несколько меньшей концентрацией лимонной кислоты, но с использованием адипиновой кислоты в качестве основного компонента. С одной стороны, это еще раз показывает, что лимонная кислота с большой вероятностью играет большую роль в иммуногенности, чем разнообразный ассортимент буферных систем. Наконец, фигура 4 иллюстрирует, что профиль иммунного ответа композиции адипиновой кислоты (высокий, средний, переходный, никакого ответа) вел себя статистически значимо по сравнению с Humira® (р<0,05 для t-теста с точным критерием Фишера; Пирсон: 9,167 (р=0,02716) для хи-квадрата, с 3 степенями свободы и за исключением случаев наступления нулевой ячейки. Без лимонной кислоты клинически релевантный высокий титр ответа на композицию адипиновой кислоты была пренебрежимо низким.
Взятые в совокупности, эти данные показывают, что иммунный ответ может модулироваться путем выбора соответствующей концентрации композиции или применяемого раствора, и, кроме того, использование адипиновой кислоты может привести к очень низкому уровню иммунного ответа. Это может быть конкретно желательно для лекарственных средств, потенциально распознаваемых иммунной системой.
Встречаемость высокого титра ответов в исследовании № 2
**Продаваемая композиция Humira®
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БИОФАРМАЦЕВТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2587056C2 |
| Жидкая композиция антитела против TNF альфа | 2018 |
|
RU2756619C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АДАЛИМУМАБ | 2014 |
|
RU2664736C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 2009 |
|
RU2531548C2 |
| АНТИТЕЛА ПРОТИВ TNF-α И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2595379C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ С ВЫСОКИМИ КОНЦЕНТРАЦИЯМИ БЕЛКОВ АНТИТЕЛ ЧЕЛОВЕКА ПРОТИВ TNF-АЛЬФА | 2010 |
|
RU2560701C2 |
| ТРИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IL-17A, IL-17F И ДРУГОЙ ПРОВОСПАЛИТЕЛЬНОЙ МОЛЕКУЛЫ | 2016 |
|
RU2680011C2 |
| АВТОМАТИЧЕСКОЕ ИНЪЕКЦИОННОЕ УСТРОЙСТВО | 2007 |
|
RU2438721C2 |
| Способы идентификации антител с пониженной иммуногенностью | 2013 |
|
RU2648141C2 |
| НАБОР ДЛЯ ДЕТЕКЦИИ СПОР, ПРОИСХОДЯЩИХ ИЗ МИКОБАКТЕРИЙ | 2008 |
|
RU2559782C2 |







Изобретение относится к медицине, в частности к способу получения фармацевтической композиции, содержащей антитело против ФНО-α, способу применения гександиовой кислоты для модулирования иммуногенности фармацевтической композиции, а также фармацевтической композиции и способу модулирования иммунных ответов. Композиция содержит антитело против ФНО-α, буфер, включающий в себя гександиовую кислоту или по меньшей мере одну ее соль, и/или лимонную кислоту или по меньшей мере одну ее соль. 4 н. и 14 з.п. ф-лы, 4 табл., 2 пр., 6 ил.
1. Способ получения фармацевтической композиции, содержащей антитело против ФНО-α, допускающей модуляцию иммунных ответов, связанных с ее введением, который включает стадии:
(i) предоставления буфера, включающего
гександиовую кислоту или по меньшей мере одну ее соль
и/или
лимонную кислоту или по меньшей мере одну ее соль,
(ii) контактирования указанного буфера с биофармацевтическим лекарственным средством,
(iii) получения композиции или суспензии (ii).
2. Способ по п.1, дополнительно включающий лиофилизацию композиции.
3. Способ применения гександиовой кислоты или по меньшей мере одной ее соли и/или лимонной кислоты или по меньшей мере одной ее соли, чтобы модулировать иммуногенность фармацевтической композиции, содержащей антитело против ФНО-α.
4. Способ по п.3, причем способ приводит к снижению иммунных ответов, связанных с введением композиции.
5. Способ по п.3, причем способ приводит к увеличению иммунных ответов, связанных с введением композиции.
6. Фармацевтическая композиция, которая обеспечивает модуляцию иммунных ответов, связанных с ее введением, содержащая антитело против ФНО-α и
гександиовую кислоту или по меньшей мере одну ее соль, и/или
лимонную кислоту или по меньшей мере одну ее соль.
7. Композиция по п.6, причем композиция приводит к снижению иммунных ответов, связанных с ее введением.
8. Композиция по п.6, где композиция имеет пониженное содержание или по существу не содержит лимонную кислоту или ее соль.
9. Композиция по п.6, причем композиция приводит к увеличению иммунных ответов, связанных с ее введением.
10. Композиция по п.6, где композиция содержит лимонную кислоту или ее соль.
11. Композиция по п.6, где композиция дополнительно содержит по меньшей мере один стабилизатор, выбранный из группы, состоящей из аминокислоты, сахарного полиола, дисахарида и/или полисахарида.
12. Композиция по п.11, где указанный дисахарид представляет собой по меньшей мере одно средство, выбранное из группы, состоящей из сахарозы, трегалозы, мальтозы и/или лактозы.
13. Композиция по п.11, где указанный сахарный полиол представляет собой по меньшей мере одно средство, выбранное из группы, состоящей из маннита и/или сорбита.
14. Композиция по любому из пп.1-13, где композиция предназначена для внутримышечного или подкожного введения.
15. Композиция по любому из пп.1-13, где композиция предназначена для неперорального введения.
16. Способ модулирования иммунных ответов, связанных с введением фармацевтической композиции, содержащей антитело против ФНО-α, включающий стадии адаптации в буфере, содержащейся в указанной лекарственной форме, концентрации гександиовой кислоты или по меньшей мере одной ее соли, и/или
лимонной кислоты или по меньшей мере одной ее соли.
17. Способ по п.16, причем способ приводит к снижению иммунных ответов, связанных с введением композиции, где указанная композиция содержит гександиовую кислоту или по меньшей мере одну ее соль, и/или содержит лимонную кислоту в концентрации не более чем 1,2 мМ.
18. Способ по п.16, причем способ приводит к увеличению иммунных ответов, связанных с введением композиции, где указанная композиция свободна от гександиовой кислоты или по меньшей мере одной ее соли, и/или содержит лимонную кислоту в концентрации более чем 1,3 мМ.
| WO 2012089778 A1, 05.07.2012 | |||
| WO 2013011076 A2, 24.04.2013 | |||
| US 2012237547 A1, 20.09.2012 | |||
| RU 2014145275 (A), 10.06.2016. |
Авторы
Даты
2018-07-26—Публикация
2014-07-21—Подача