Область техники изобретения
Данное изобретение относится к жидкому фармацевтическому составу биспецифических антител к ангиопоэтину-2 (ANG-2)-2 и фактору роста эндотелия сосудов человека (VEGF, VEGF-A) (биспецифических антител к VEGF/ANG2) и способу получения и применениям состава.
Уровень техники
Биспецифические антитела к ангиопоэтину-2 (ANG-2)-2 и фактору роста эндотелия сосудов человека (VEGF, VEGF-A) (биспецифические антитела к VEGF/ANG2) представляют терапевтический интерес, в частности, в качестве лекарственных средств для лечения и профилактики лечения сосудистых заболеваний, включая сосудистое заболевание глаз. Биспецифические антитела к VEGF/ANG2 описаны, например, в WO 2010040508, WO 2011/117329 или WO 2014/009465. Эти антитела ингибируют связывание Vegf с рецептором VEGF и в то же время связывание ANG-2 с Tie2.
Молекулы антител, как часть группы белковых фармацевтических препаратов, очень предрасположены к физическому и химическому разложению. Химическое разложение включает любой процесс, который включает модификацию белка посредством образования или разрыва связи, что дает новое химическое вещество. Известно множество химических реакций, которые воздействуют на белки. Эти реакции могут включать гидролиз, включая разрыв пептидных связей, а также дезамидирование, изомеризацию, окисление и разложение. Физическое разложение относится к изменениям в структуре более высокого порядка и включает денатурацию, адсорбцию на поверхностях, агрегацию и осаждение. На стабильность белка влияют характеристики самого белка, например, аминокислотная последовательность, профиль гликозилирования, и внешние факторы, такие как температура, рН растворителя, вспомогательные вещества, поверхности контакта или скорости сдвига. Таким образом, важно определить оптимальные условия состава для защиты белка от реакций разложения при изготовлении, хранении и введении. (Manning, М.С, et al. (1989), "Stability of protein pharmaceuticals", Pharm Res 6(11), 903-918; Zheng, J. Y., Janis, L.J. (2005), "Influence of pH, buffer species, and storage temperature on physicochemical stability of a humanized monoclonal antibody LA298", Int. J. Pharmaceutics 308, 46-51). Стабильные жидкие составы терапевтических антител особенно сложно получать, когда состав должен содержать антитела в высокой концентрации.
Таким образом, целью настоящего изобретения является обеспечение жидкого, в частности, высококонцентрированного, состава биспецифического антитела к VEGF/ANG2 с как можно меньшим количеством необходимых вспомогательных веществ, который облегчает желаемое дозирование и обеспечивает удобное интравитреальное введение биспецифического антитела посредством тонких игл пациенту.
Сущность изобретения
Настоящее изобретение относится к жидкому фармацевтическому составу биспецифического антитела к VEGF/ANG2, способу получения и применениям состава. В частности, фармацевтические составы настоящего изобретения предназначены для применения при интравитреальном введении для лечения офтальмологических заболеваний, таких как ВМД и ДМО.
В одном аспекте настоящее изобретение относится к жидкому фармацевтическому составу, содержащему:
- от 20 до 150 мг/мл биспецифического антитела к VEGF/ANG2, содержащего константную область тяжелой цепи подкласса IgG1 человека,
- от 15 до 35 мМ хлорида натрия,
- от 15 до 25 мМ гистидин-ацетатного буфера, при рН 5,5±0,5; где
биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 1, CDR2H-область с SEQ ID NO: 2 и CDR1H-область с SEQ ID NO: 3, а в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 4, CDR2L-область с SEQ ID NO: 5 и CDR2L-область с SEQ ID NO: 6; и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 9, CDR2H-область с SEQ ID NO: 10 и CDR1H-область с SEQ ID NO: 11, и в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 12, CDR2L-область с SEQ ID NO: 13 и CDR1L-область с SEQ ID NO: 14, и где
iii) биспецифическое антитело содержит константную область тяжелой цепи подкласса IgG1 человека, содержащую мутации 1253А, Н310А и Н435А и мутации L234A, L235A и P329G (нумерация согласно EU-индексу Кабата).
В одном варианте реализации биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
В одном варианте реализации биспецифическое антитело к VEGF/ANG2 представляет собой фарицимаб.
В одном варианте реализации состав дополнительно содержит
- от 1 до 20 мМ по меньшей мере одного стабилизатора.
В одном варианте реализации состав дополнительно содержит
- 7,0 мМ ± 2,0 мМ метионина.
В одном варианте реализации состав дополнительно содержит
- 0,01-0,07% (масс./об.) поверхностно-активного вещества.
В одном варианте реализации состав дополнительно содержит
- 0,04% (масс./об.) ± 0,02% (масс./об.) полисорбата 20.
В одном варианте реализации состав дополнительно содержит
- 50-250 мМ регулятора тоничности.
В одном варианте реализации состав дополнительно содержит
- 160 мМ ± 24 мМ сахарозы.
В одном варианте реализации состав по существу не содержит видимые частицы.
В одном варианте реализации состав представляет собой стабильный состав.
В одном варианте реализации осмоляльность состава составляет 300±100 мОсм/кг.
В одном варианте реализации состав предназначен для интравитреального введения.
В одном аспекте состав предназначен для применения в лечении сосудистого заболевания глаз.
В одном варианте реализации сосудистое заболевание глаз выбрано из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), макулярной дегенерации, влажной формы возрастной макулярной дегенерации (влажной ВМД), ретинопатии недоношенных (РН), неоваскулярной глаукомы, пигментного ретинита (ПР), ретинальной ангиоматозной пролиферации, макулярной телеангиэктазии, ишемической ретинопатии, неоваскуляризации радужной оболочки, внутриглазной неоваскуляризации, неоваскуляризации роговицы, неоваскуляризации сетчатки, хориоидальной неоваскуляризации и дегенерации сетчатки, в частности из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), влажной формы возрастной макулярной дегенерации (влажной ВМД).
Один аспект настоящего изобретения представляет собой способ получения фармацевтического состава согласно настоящему изобретению.
Один аспект настоящего изобретения представляет собой флакон, содержащий фармацевтический состав согласно настоящему изобретению.
Один аспект настоящего изобретения представляет собой предварительно заполненный шприц, содержащий фармацевтический состав согласно настоящему изобретению.
Один аспект настоящего изобретения представляет собой лиофилизированную форму жидкого фармацевтического состава согласно настоящему изобретению.
Настоящее изобретение обеспечивает жидкий фармацевтический состав биспецифического антитела к VEGF/ANG2 (с константной областью IgG1), который имеет полезные свойства, пригодные для офтальмологического применения и интравитреального введения: состав имеет низкую вязкость и низкую мутность (даже при высоких концентрациях, например, приблизительно 120 мг/л), состав стабильный и изотоничный. Это, в частности, достигается комбинацией 20-150 мг/мл (в частности, 100-140 мг/мл) биспецифического антитела к VEGF/ANG2, содержащего константную область тяжелой цепи подкласса IgG1 человека, как описано в настоящем документе, 15-35 мМ хлорида натрия и 15-25 мМ гистидинового буфера при рН 5,5±0,5.
Краткое описание графических материалов
Фигура 1 Результаты по мутности (фиг. 1А) и вязкости (фиг. 1Б) составов из части I отбора рН/буфера. Фиг. 1 сравнивает результаты по мутности и вязкости составов из части I отбора рН/буфера (под столбиками: первая строка: №образца состава; вторая строка: значение рН; третья строка: буферная система; четвертая строка: ионная сила).
Фигура 2 Результаты по мутности (фиг. 2А) и вязкости (фиг. 2Б) составов из части II отбора рН/буфера (под столбиками: первая строка: №образца состава; вторая строка: значение рН; третья строка: понизитель вязкости отсутствует (-), NaCl или CaCl2; четвертая строка: ионная сила).
Фигура 3 Высокомолекулярные соединения (ВМС) составов из части II отбора рН/буфера вначале и через 8 недель хранения при 5°С и 25°С (под столбиками: первая строка: №образца состава; вторая строка: значение рН; третья строка: понизитель вязкости отсутствует (-), NaCl или CaCl2; четвертая строка: ионная сила).
Фигура 4 Уровни высокомолекулярных соединений (ВМС) вначале и после механического стресса (под столбиками: первая строка: тип физического стресса; вторая строка: % поверхностно-активного вещества; третья строка: №образца состава).
Фигура 5 Мутность (фиг. 5А) и вязкость (фиг. 5Б) составов из отбора I вспомогательных веществ (под столбиками: первая строка: значение рН с NaCl в качестве понизителя вязкости, отсутствие (-) или присутствие (+) метионина в качестве стабилизатора; вторая строка: №образца состава).
Фигура 6 Уровни высокомолекулярных соединений (ВМС) вначале и при хранении при 5°С (под столбиками: первая строка: значение рН с NaCl в качестве понизителя вязкости, отсутствие (-) или присутствие (+) метионина в качестве стабилизатора; вторая строка: № образца состава).
Фигура 7 Уровни высокомолекулярных соединений (ВМС) вначале и при хранении при 25°С (под столбиками: первая строка: значение рН с NaCl в качестве понизителя вязкости, отсутствие (-) или присутствие (+) метионина в качестве стабилизатора; вторая строка: №образца состава).
Фигура 8 Уровни заряженных частиц (главный пик (фиг. 8А), кислотный пик (фиг. 8Б) и основной пик (фиг. 8В)) вначале и при хранении при 5°С (под столбиками: первая строка: значение рН с NaCl в качестве понизителя вязкости, отсутствие (-) или присутствие (+) метионина в качестве стабилизатора; вторая строка: №образца состава).
Фигура 9 Уровни заряженных частиц (главный пик (фиг. 9А), кислотный пик (фиг. 9Б) и основной пик (фиг. 9В)) вначале и при хранении при 25°С (под столбиками: первая строка: значение рН с NaCl в качестве понизителя вязкости; отсутствие (-) или присутствие (+) метионина в качестве стабилизатора; вторая строка: №образца состава).
Фигура 10 Мутность (фиг. 10А) и вязкость (фиг. 10Б) оптимизированного и эталонного состава с концентрацией белка 120 мг/мл из отбора II вспомогательных веществ.
Фигура 11 Мутность (фиг. 11А) и вязкость (фиг. 11Б) оптимизированного и эталонного состава с концентрацией белка 30 мг/мл из отбора II вспомогательных веществ.
Фигура 12 Уровни высокомолекулярных соединений (ВМС) вначале (левый столбик) и через 13 недель хранения при 5 (средний столбик) и 25°С (правый столбик) оптимизированного и эталонного состава с концентрацией белка 120 мг/мл.
Фигура 13 Уровни высокомолекулярных соединений (ВМС) вначале (левый столбик) и через 13 недель хранения при 5 (средний столбик) и 25°С (правый столбик) оптимизированного и эталонного состава с концентрацией белка 30 мг/мл.
Фигура 14 Уровни заряженных частиц (главный пик (фиг. 14А), кислотный пик (фиг. 14Б) и основной пик (фиг. 14В)) вначале (левый столбик) и через 13 недель хранения при 5 (средний столбик) и 25°С (правый столбик) оптимизированного и эталонного состава.
Подробное описание сущности изобретения
Настоящее изобретение относится к жидкому фармацевтическому составу, содержащему биспецифическое антитело к VEGF/ANG2, содержащее константную область тяжелой цепи подкласса IgG1 человека.
Термин «фармацевтический состав» относится к препаратам, которые находятся в такой форме, чтобы обеспечивать однозначную эффективность биологической активности активных ингредиентов, и которые не содержат дополнительные компоненты, которые являются токсичными для субъектов, которым вводят состав.
Термин «жидкий» при использовании в настоящем документе применительно к составу согласно настоящему изобретению означает состав, который является жидким по меньшей мере при температуре от приблизительно 2°С до приблизительно 35°С (в одном варианте реализации - от приблизительно 2°С до приблизительно 25°С) при атмосферном давлении. Концентрация биспецифического антитела к VEGF/ANG2, содержащегося в фармацевтическом составе, находится в диапазоне от приблизительно 20 мг/мл до приблизительно 150 мг/мл, в частности, концентрация составляет 120 мг/мл ± 18 мг/мл, более конкретно концентрация составляет 120 мг/мл ± 12 мг/мл. В другом варианте реализации концентрация может составлять 30 мг/мл ± 4,5 мг/мл.
При использовании в настоящем документе «антитело» относится к связывающему белку, который содержит антигенсвязывающие сайты. Термины «связывающий сайт» или «антигенсвязывающий сайт» при использовании в настоящем документе означают область(и) молекулы антитела, с которой фактически связывается лиганд. Термин «антигенсвязывающий сайт» включает вариабельные домены тяжелой цепи (VH) антитела и вариабельные домены легкой цепи (VL) антитела (пара VH/VL).
Специфичность антитела относится к селективному распознаванию антителом конкретного эпитопа антигена. Естественные антитела, например, являются моноспецифическими.
«Биспецифические антитела» согласно настоящему изобретению представляют собой антитела, которые имеют две различные антигенсвязывающие специфичности. Антитела настоящего изобретения являются специфическими к двум различным антигенам, VEGF в качестве первого антигена и ANG-2 в качестве второго антигена.
Термин «моноспецифическое» антитело при использовании в настоящем документе означает антитело, которое имеет один или более связывающих сайтов, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена.
Термин «валентный» при использовании в настоящей заявке означает присутствие определенного числа связывающих сайтов в молекуле антитела. Таким образом, термины «двухвалентный», «четырехвалентный» и «шестивалентный» означают присутствие двух связывающих сайтов, четырех связывающих сайтов и шести связывающих сайтов, соответственно, в молекуле антитела. Биспецифические антитела согласно настоящему изобретению предпочтительно являются «двухвалентными».
Термины «биспецифическое антитело, которое связывается с фактором роста эндотелия сосудов человека (VEGF) и с ангиопоэтином-2 (ANG-2) человека», «биспецифическое антитело к VEGF/ANG2» и «биспецифическое антитело <VEGF/ANG2>» при использовании в настоящем документе являются взаимозаменяемыми и относятся к антителу, которое имеет по меньшей мере два различных антигенсвязывающих сайта, один, который связывается с VEGF, и второй, который связывается с ANG2.
Биспецифические антитела к VEGF/ANG2 описаны, например, в WO 2010/040508, WO 2011/117329, WO 2012/131078, WO 2015/083978, WO 2017/197199 и WO 2014/009465. WO 2014/009465 описывает биспецифические антитела к VEGF/ANG2, специально разработанные для лечения сосудистых заболеваний глаз. Биспецифические антитела к VEGF/ANG2 из WO 2014/009465 (который включен в настоящий документ во всей своей полноте) являются особенно пригодными в лечении и в схемах лечения сосудистых заболеваний глаз, как описано в настоящем документе. В частности, антитело к VEGF/ANG2 CrossMAb VEGFang2-0016, как описано в WO 2014/009465, которое также описано как фарицимаб (в World Health Organization (2017). "International Nonproprietary Names for Pharmaceutical Substances (INN). Proposed INN: List 118" WHO Drug Information. 31 (4)), является предпочтительным биспецифическим антителом к VEGF/ANG2 настоящего изобретения.
В одном варианте реализации биспецифическое антитело, которое связывается с фактором роста эндотелия сосудов человека (VEGF) и с ангиопоэтином-2 (ANG-2) человека, является биспецифическим антителом к VEGF/ANG2, содержащим первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 1, CDR2H-область с SEQ ID NO: 2 и CDR1H-область с SEQ ID NO: 3, а в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 4, CDR2L-область с SEQ ID NO: 5 и CDR1L-область с SEQ ID NO: 6; и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 9, CDR2H-область с SEQ ID NO: 10 и CDR1H-область с SEQ ID NO: 11, и в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 12, CDR2L-область с SEQ ID NO: 13 и CDR1L-область с SEQ ID NO: 14, и где
iii) биспецифическое антитело содержит константную область тяжелой цепи подкласса IgG1 человека, содержащую мутации 1253А, Н310А и Н435А и мутации L234A, L235A и P329G (нумерация согласно EU-индексу Кабата).
В одном варианте реализации такое биспецифическое антитело к VEGF/ANG2 является двухвалентным.
В одном варианте реализации такое биспецифическое двухвалентное антитело к VEGF/ANG2 характеризуется тем, что
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в качестве вариабельного домена тяжелой цепи VH аминокислотную последовательность SEQ ID NO: 7, а в качестве вариабельного домена легкой цепи VL - аминокислотную последовательность SEQ ID NO: 8, и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в качестве вариабельного домена тяжелой цепи VH аминокислотную последовательность SEQ ID NO: 15, а в качестве вариабельного домена легкой цепи VL аминокислотную последовательность SEQ ID NO: 16.
В одном аспекте настоящего изобретения такое биспецифическое двухвалентное антитело согласно настоящему изобретению характеризуется тем, что содержит
а) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфически связывается с VEGF;
б) модифицированную тяжелую цепь и модифицированную легкую цепь второго полноразмерного антитела, которое специфически связывается с ANG-2, где константные домены CL и СН1 заменяются друг другом.
Этот формат биспецифического двухвалентного антитела для биспецифического антитела, специфически связывающегося с фактором роста эндотелия сосудов (VEGF) человека и ангиопоэтином-2 (ANG-2) человека, описан в WO 2009/080253 (включая модифицированные по типу «выступы во впадины» домены СН3). Антитела на основе этого формата биспецифического двухвалентного антитела называются CrossMAb.
В одном варианте реализации такое биспецифическое двухвалентное антитело к VEGF/ANG2 характеризуется тем, что содержит:
а) в качестве тяжелой цепи первого полноразмерного антитела аминокислотную последовательность SEQ ID NO: 17, а в качестве легкой цепи первого полноразмерного антитела аминокислотную последовательность SEQ ID NO: 18, и
б) в качестве модифицированной тяжелой цепи второго полноразмерного антитела аминокислотную последовательность SEQ ID NO: 19, в качестве модифицированной легкой цепи второго полноразмерного антитела аминокислотную последовательность SEQ ID NO: 20.
В одном варианте реализации такое биспецифическое, двухвалентное антитело к VEGF/ANG2 характеризуется тем, что содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
Следовательно, один вариант реализации настоящего изобретения представляет собой биспецифическое двухвалентное антитело, содержащее первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, характеризующееся тем, что содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
В одном варианте реализации домены СН3 биспецифического двухвалентного антитела согласно настоящему изобретению изменены по технологии «выступы во впадины», которая описана подробно с несколькими примерами, например, в WO 96/027011, Ridgway J.В., et al., Protein Eng 9 (1996) 617-621; и Merchant, A.M., et al., Nat Biotechnol 16 (1998) 677-681. В этом способе поверхности контакта двух доменов СН3 изменяют для повышения гетеродимеризации обеих тяжелых цепей, содержащих эти два домена СН3. Каждый из двух доменов СН3 (двух тяжелых цепей) может быть «выступом», тогда как другой является «впадиной». Введение дисульфидного мостика стабилизирует гетеродимеры (Merchant, А.М, et al., Nature Biotech 16 (1998) 677-681; Atwell, S., et al. J. Mol. Biol. 270 (1997) 26-35) и повышает выход.
В предпочтительном аспекте настоящего изобретения биспецифические антитела к VEGF/ANG2 согласно настоящему изобретению характеризуются тем, что
каждый из домена СН3 одной тяжелой цепи и домена СН3 другой тяжелой цепи стыкуются на поверхности контакта, которая содержит исходную поверхность контакта между доменами СН3 антитела;
где указанная поверхность контакта изменена для обеспечения образования биспецифического антитела, причем изменение характеризуется тем, что:
а) домен СН3 одной тяжелой цепи изменен так,
чтобы в пределах исходной поверхности контакта домен СН3 одной тяжелой цепи, которая стыкуется с исходной поверхностью контакта домена СН3 другой тяжелой цепи в пределах биспецифического антитела,
аминокислотный остаток заменялся на аминокислотный остаток, имеющий больший объем боковых цепей, при этом образуя выступ в пределах поверхности контакта домена СН3 одной тяжелой цепи, который может располагаться в полости в пределах поверхности контакта домена СН3 другой тяжелой цепи,
и
б) домен СН3 другой тяжелой цепи измени так,
чтобы в пределах исходной поверхности контакта второго домена СН3, который стыкуется с исходной поверхностью контакта первого домена СН3 в пределах биспецифического антитела,
аминокислотный остаток заменялся на аминокислотный остаток, имеющий меньший объем боковых цепей, при этом образуя полость в пределах поверхности контакта второго домена СН3, в котором может располагаться выступ в пределах поверхности контакта первого домена СН3. Таким образом, биспецифические антитела к VEGF/ANG2 для применения, описанного в настоящем документе, предпочтительно характеризуются тем, что
каждый домен СН3 тяжелой цепи полноразмерного антитела из а) и домен СН3 тяжелой цепи полноразмерного антитела из б) стыкуются на поверхности контакта, которая содержит изменение в исходной поверхности контакта между доменами СН3 антитела;
где i) в домене СН3 одной тяжелой цепи
аминокислотный остаток заменялся на аминокислотный остаток, имеющий больший объем боковых цепей, при этом образуя выступ в пределах поверхности контакта домена СН3 одной тяжелой цепи, который может располагаться в полости в пределах поверхности контакта домена СН3 другой тяжелой цепи,
и где
ii) в домене СН3 другой тяжелой цепи
аминокислотный остаток заменялся на аминокислотный остаток, имеющий меньший объем боковых цепей, при этом образуя полость в пределах поверхности контакта второго домена СН3, в котором может располагаться выступ в пределах поверхности контакта первого домена СН3.
Предпочтительно указанный аминокислотный остаток, имеющий больший объем боковых цепей, выбирают из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
Предпочтительно указанный аминокислотный остаток, имеющий меньший объем боковых цепей, выбирают из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном аспекте настоящего изобретения оба домена СН3 дополнительно изменены путем введения цистеина (С) в качестве аминокислоты в соответствующих положениях каждого домена СН3, так что между обоими доменами СН3 может образовываться дисульфидный мостик.
В одном варианте реализации биспецифическое антитело содержит мутацию T366W в домене СН3 «цепи выступов» и мутации T366S, L368A, Y407V в домене СН3 «цепи впадин». Дополнительный дисульфидный мостик между цепями между доменами СН3 можно также использовать (Merchant, А.М, et al., Nature Biotech 16 (1998) 677-681), например, путем введения мутации S354C в домен СН3 и мутации Y349C в другой домен СН3.
В другом предпочтительном варианте реализации биспецифическое антитело содержит мутации S354C и T366W в одном из двух доменов СН3 и мутации Y349C, T366S, L368A, Y407V в другом из двух доменов СН3. В другом предпочтительном варианте реализации биспецифическое антитело содержит мутации Y349C, T366W в одном из двух доменов СН3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов СН3 (дополнительная мутация Y349C или S354C в одном домене СН3 и дополнительная мутация S354C или Y349C в другом домене СН3, образующие дисульфидный мостик между цепями) (нумерация всегда согласно EU-индексу Кабата (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
Другие техники для модификаций СН3 для усиления гетеродимеризации рассматриваются как альтернативы настоящего изобретения и описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954 и WO 2013/096291.
В одном варианте реализации подход к гетеродимеризации, описанный в ЕР 1870459А1, используется альтернативно. Этот подход основан на введении замещений/мутаций заряженных аминокислот с противоположным зарядом в конкретных положениях аминокислот на поверхности раздела доменов СН3/СН3 между обеими тяжелыми цепями. Один предпочтительный вариант реализации для указанных мультиспецифических антител представляет мутации R409D и K370E аминокислот в домене СН3 одной тяжелой цепи и мутации D399K и E357K аминокислот в домене СН3 другой тяжелой цепи мультиспецифического антитела (нумерация согласно EU-индексу Кабата).
В другом варианте реализации указанное мультиспецифическое антитело содержит мутацию T366W аминокислоты в домене СН3 «цепи выступов» и мутации T366S, L368A и Y407V аминокислот в домене СН3 «цепи впадин»; и дополнительно содержит мутации R409D и K370E аминокислот в домене СН3 «цепи выступов» и мутации D399K и E357K аминокислот в домене СН3 «цепи впадин».
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2013/157953, используется альтернативно. В одном варианте реализации домен СН3 одной тяжелой цепи содержит мутацию Т366К аминокислоты, а домен СН3 другой тяжелой цепи содержит мутацию L351D аминокислоты. В дополнительном варианте реализации домен СН3 одной тяжелой цепи также содержит мутацию L351K аминокислоты. В дополнительном варианте реализации домен СН3 другой тяжелой цепи также содержит мутацию аминокислоты, выбранную из Y349E, Y349D и L368E (в одном варианте реализации L368E).
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2012/058768, используется альтернативно. В одном варианте реализации домен СН3 одной тяжелой цепи содержит мутации L351Y и Y407A аминокислот, а домен СН3 другой тяжелой цепи содержит мутации Т366А и K409F аминокислот.В дополнительном варианте реализации домен СН3 другой тяжелой цепи также содержит мутацию аминокислоты в положении Т411, D399, S400, F405, N390 или К392. В одном варианте реализации указанную мутацию аминокислоты выбирают из группы, состоящей из
а) T411N, T411R, T411Q, Т411К, T411D, Т411Е и T411W,
б) D399R, D399W, D399Y и D399K,
в) S400E, S400D, S400R и S400K,
г) F405I, F405M, F405T, F405S, F405V и F405W,
д) N390R, N390K и N390D,
е) K392V, K392M, K392R, K392L, K392F и K392E.
В дополнительном варианте реализации домен СН3 одной тяжелой цепи содержит мутации L351Y и Y407A аминокислот, а домен СН3 другой тяжелой цепи содержит мутации T366V и K409F аминокислот. В дополнительном варианте реализации домен СН3 одной тяжелой цепи содержит мутацию Y407A аминокислоты, а домен СН3 другой тяжелой цепи содержит мутации Т366А и K409F аминокислот. В дополнительном варианте реализации домен СН3 другой тяжелой цепи также содержит мутации K392E, Т411Е, D399R и S400R аминокислот.
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2011/143545, используется альтернативно. В одном варианте реализации модификацию аминокислот согласно WO 2011/143545 вводят в домен СН3 тяжелой цепи в положении, выбранном из группы, состоящей из 368 и 409.
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2011/090762, который также использует технологию «выступы во впадины», описанную выше, используется альтернативно. В одном варианте реализации домен СН3 одной тяжелой цепи содержит мутацию T366W аминокислоты, а домен СН3 другой тяжелой цепи содержит мутацию Y407A аминокислоты. В одном варианте реализации домен СН3 одной тяжелой цепи содержит мутацию T366Y аминокислоты, а домен СН3 другой тяжелой цепи содержит мутацию Y407T аминокислоты.
В одном варианте реализации полиспецифическое антитело представляет изотип IgG2, и подход к гетеродимеризации, описанный в WO 2010/129304, используется альтернативно.
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2009/089004, используется альтернативно. В одном варианте реализации домен СН3 одной тяжелой цепи содержит аминокислотную замену K392 или N392 на отрицательно заряженную аминокислоту (в одном варианте реализации глутаминовую кислоту (Е) или аспарагиновую кислоту (D); в дополнительном варианте реализации мутацию K392D или N392D), а домен СН3 другой тяжелой цепи содержит аминокислотную замену D399, Е356, D356 или Е357 на положительно заряженную аминокислоту (в одном варианте реализации лизин (К) или аргинин (R), в дополнительном варианте реализации замену D399K, Е356К, D356K или Е357К; а в еще одном дополнительном варианте реализации мутацию D399K или E356K). В дополнительном варианте реализации домен СН3 одной тяжелой цепи также содержит аминокислотную замену К409 или R409 на отрицательно заряженную аминокислоту (в одном варианте реализации глутаминовую кислоту (Е) или аспарагиновую кислоту (D); в дополнительном варианте реализации мутацию K409D или R409D). В дополнительном варианте реализации домен СН3 одной тяжелой цепи дополнительно или альтернативно содержит аминокислотную замену K439 и/или K370 на отрицательно заряженную аминокислоту (в одном варианте реализации глутаминовую кислоту (Е) или аспарагиновую кислоту (D)).
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2007/147901, используется альтернативно. В одном варианте реализации домен СН3 одной тяжелой цепи содержит мутации K253E, D282K и K322D аминокислот, а домен СН3 другой тяжелой цепи содержит мутации D239K, Е240К и K292D аминокислот.
В одном варианте реализации подход к гетеродимеризации, описанный в WO 2007/110205, используется альтернативно.
В одном предпочтительном варианте реализации такое биспецифическое антитело к VEGF/ANG2 является двухвалентным.
В одном варианте реализации биспецифическое двухвалентное антитело,
которое связывается с фактором роста эндотелия сосудов человека (VEGF) и с ангиопоэтином-2 (ANG-2) человека, является биспецифическим антителом к VEGF/ANG2, содержащим первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 1, CDR2H-область с SEQ ID NO: 2 и CDR1H-область с SEQ ID NO: 3, а в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 4, CDR2L-область с SEQ ID NO: 5 и CDR1L-область с SEQ ID NO: 6; и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 9, CDR2H-область с SEQ ID NO: 10 и CDR1H-область с SEQ ID NO: 11, и в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 12, CDR2L-область с SEQ ID NO: 13 и CDR1L-область с SEQ ID NO: 14, и где
iii) биспецифическое антитело содержит константную область тяжелой цепи подкласса IgG1 человека, содержащую мутации 1253А, Н310А и Н435А и мутации L234A, L235A и P329G (нумерация согласно EU-индексу Кабата); и где
iv) в константной области тяжелой цепи мутация T366W содержится в
одном домене СН3, а мутации T366S, L368A, Y407V содержатся в другом домене СН3 (нумерация согласно EU-индексу Кабата). В одном варианте реализации биспецифическое двухвалентное антитело,
которое связывается с фактором роста эндотелия сосудов человека (VEGF) и с ангиопоэтином-2 (ANG-2) человека, является биспецифическим антителом к VEGF/ANG2, содержащим первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в вариабельном домене тяжелой цепи CDRSH-область с SEQ ID NO: 1, CDR2H-область с SEQ ID NO: 2 и CDR1H-область с SEQ ID NO: 3, а в вариабельном домене легкой цепи CDRSL-область с SEQ ID NO: 4, CDR2L-область с SEQ ID NO: 5 и CDR1L-область с SEQ ID NO: 6; и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 9, CDR2H-область с SEQ ID NO: 10 и CDR1H-область с SEQ ID NO: 11, и в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 12, CDR2L-область с SEQ ID NO: 13 и CDR1L-область с SEQ ID NO: 14, и где
iii) биспецифическое антитело содержит константную область тяжелой цепи подкласса IgG1 человека, содержащую мутации 1253А, Н310А и Н435А и мутации L234A, L235A и P329G (нумерация согласно EU-индексу Кабата); и где
iv) в константной области тяжелой цепи мутации S354C и T366W содержатся в одном домене СН3, а мутации Y349C, T366S, L368A и Y407V содержатся в другом домене СН3 (нумерация согласно EU-индексу Кабата).
В одном варианте реализации такое биспецифическое, двухвалентное антитело к VEGF/ANG2 характеризуется тем, что содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
Следовательно, один вариант реализации настоящего изобретения представляет собой биспецифическое двухвалентное антитело, содержащее первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, характеризующееся тем, что содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
В одном предпочтительном варианте реализации такое биспецифическое антитело к VEGF/ANG2 представляет собой фарицимаб.
Термин «VEGF» при использовании в настоящем документе относится к фактору роста эндотелия сосудов человека (VEGF/VEGF-A), фактору роста эндотелиальных клеток сосудов человека из 165 аминокислот (аминокислоты 27-191 последовательности предшественника VEGF165 человека: SEQ ID NO: 25; аминокислоты 1-26 представляют сигнальный белок) и родственным изоформам 121, 189 и 206 фактора роста эндотелиальных клеток сосудов, как описано в Leung, D.W., et al., Science 246 (1989) 1306-9; Houck et al., Mol. Endocrin. 5 (1991) 1806-1814; Keck, P.J., et al., Science 246 (1989) 1309-12, и Connolly, D.T., et al., J. Biol. Chem. 264 (1989) 20017-24; вместе с встречающимися в природе аллельными и процессированными формами этих факторов роста. VEGF вовлечен в регуляцию нормального и атипичного ангиогенеза и неоваскуляризации, связанных с опухолями и внутриглазными заболеваниями (Ferrara, N., et al., Endocr. Rev. 18 (1997) 4-25; Berkman, R.A.,et al., J. Clin. Invest. 91 (1993) 153-159; Brown, L.F., et al., Human Pathol. 26 (1995) 86-91; Brown, L.F., et al., Cancer Res. 53 (1993) 4727-4735; Mattern, J., et al., Brit. J. Cancer. 73 (1996) 931-934; и Dvorak, H.F., et al., Am. J. Pathol. 146 (1995) 1029-1039). VEGF представляет собой гомодимерный гликопротеин, который был выделен из нескольких источников и содержит несколько изоформ. VEGF показывает высокоспецифическую митогенную активность относительно эндотелиальных клеток. Антагонист/ингибитор VEGF ингибирует связывание VEGF с его рецептором VEGFR. Известные антагонисты/ингибиторы VEGF включают биспецифические антитела к VEGF/ANG2, как описано в WO 2014/009465.
Термин «ANG-2» при использовании в настоящем документе относится к ангиопоэтину-2 (ANG-2) человека (альтернативно имеет сокращение ANGPT2 или ANG2) (SEQ ID NO: 24), который описан, например, в Maisonpierre, Р.С, et al, Science 277 (1997) 55-60, и Cheung, А.Н., et al., Genomics 48 (1998) 389-91. Ангиопоэтины 1 и 2 были обнаружены как лиганды к Tie, семейству тирозинкиназ, которые селективно экспрессируются в эндотелии сосудов (Yancopoulos, G.D., et al., Nature 407 (2000) 242-48). Сейчас существует четыре точно определенных члена семейства ангиопоэтинов. Ангиопоэтины 3 и 4 (Ang-3 и Ang-4) могут представлять сильно отличающиеся аналоги одного и того же локуса гена у мышей и человека (Kim, I., et al., FEBS Let, 443 (1999) 353-56; Kim, I., et al., J Biol Chem 274 (1999) 26523-28). ANG-1 и ANG-2 были первоначально идентифицированы при экспериментах на культурах тканей в виде агониста и антагониста, соответственно (см. для ANG-1: Davis, S., et al., Cell 87 (1996) 1161-69; а для ANG-2: Maisonpierre, P.C., et al., Science 277 (1997) 55-60). Все из известных ангиопоэтинов связываются в первую очередь со своим рецептором TIE2, и как Ang-1, так и Ang-2 связываются с TIE2 с аффинностью 3 нМ (Kd) (Maisonpierre, Р.О, et al., Science 277 (1997) 55-60). Антагонист/ингибитор ANG2 ингибирует связывание ANG2 с его рецептором TIE2. Известные антагонисты/ингибиторы ANG2 включают биспецифические антитела к VEGF/ANG2, как описано в WO 2014/009465.
Антигенсвязывающие сайты биспецифического антитела настоящего изобретения содержат шесть определяющих комплементарность областей (CDR), которые вносят в различной степени вклад в аффинность связывающего сайта для антигена. Существуют три вариабельных домена CDR тяжелой цепи (CDRH1, CDRH2 и CDRH3) и три вариабельных домена CDR легкой цепи (CDRL1, CDRL2 и CDRL3). Размер CDR и каркасные области (FR) определяются сравнением с собранной базой данных аминокислотных последовательностей, в которой эти области были определены согласно вариабельности среди последовательностей.
Антитела настоящего изобретения содержат константные области иммуноглобулина, полученные из иммуноглобулина класса IgG1 человека.
Термины «моноклональное антитело» или «состав моноклонального антитела» при использовании в настоящем документе относятся к препарату молекул антител с одним аминокислотным составом.
Термин «химерное антитело» относится к антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида и, по меньшей мере, часть константной области, полученную из другого источника или вида, обычно полученную путем технологий рекомбинантной ДНК. Химерные антитела, содержащие мышиную вариабельную область и человеческую константную область, представляют особый интерес.Другие формы «химерных антител», охватываемые настоящим изобретением, представляют такие, в которых константная область была модифицирована или изменена относительно таковой в исходном антителе для получения желаемых свойств согласно настоящему изобретению, особенно в отношении связывания с C1q и/или связывания с рецептором Fc (FcR). Такие химерные антитела также называются «антителами с переключенным классом». Химерные антитела являются продуктом экспрессированных генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные области иммуноглобулинов, и сегменты ДНК, кодирующие константные области иммуноглобулинов. Способы получения химерных антител включают обычные технологии рекомбинантной ДНК и генной трансфекции и хорошо известны в данной области. См., например, Morrison, S.L., et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855; патенты США №5202238 и №5204244.
Термин «гуманизированное антитело» относится к антителам, в которых каркасные области или «определяющие комплементарность области» (CDR) были модифицированы так, чтобы содержать CDR иммуноглобулина с отличной специфичностью по сравнению с исходным иммуноглобулином. В предпочтительном варианте реализации мышиная CDR прививается в каркасную область антитела человека для получения «гуманизированного антитела». См., например, Riechmann, L., et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют таким, которые представляют последовательности, распознающие антигены, указанные выше для химерных антител. Другие формы «гуманизированных антител», охватываемые настоящим изобретением, представляют такие, в которых константная область была дополнительно модифицирована или изменена относительно таковой в исходном антителе для получения свойств согласно настоящему изобретению, особенно в отношении связывания с C1q и/или связывания с рецептором Fc (FcR).
Термин «антитело человека» при использовании в настоящем документе предназначен включать антитела, имеющие вариабельные и константные области, полученные из последовательностей иммуноглобулинов зародышевых линий человека. Антитела человека хорошо известны в данной области техники (van Dijk, М.А., and van de Winkel, J.G., Curr. Opin. Chem. Biol. 5 (2001) 368-374). Антитела человека можно также получать у трансгенных животных (например, мышей), которые могут при иммунизации продуцировать полный набор или выборку антител человека в отсутствие продуцирования эндогенных иммуноглобулинов. Перенос генной матрицы иммуноглобулинов зародышевых линий человека у таких мышей с мутантной зародышевой линией будет приводить к продуцированию антител человека при антигенной стимуляции (см., например, Jakobovits, A., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 2551-2555; Jakobovits, A., et al., Nature 362 (1993) 255-258; Bruggemann, M., et al., Year Immunol. 7 (1993) 33-40). Антитела человека можно также получать в фаг-дисплейных библиотеках (Hoogenboom, H.R., and Winter, G., J. Mol. Biol. 227 (1992) 381-388; Marks, J.D., et al., J. Mol. Biol. 222 (1991) 581-597). Технологии Cole и соавт.и Boerner и соавт.также доступны для получения моноклональных антител человека (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Как уже упоминалось для химерных и гуманизированных антител согласно настоящему изобретению, термин «антитело человека» при использовании в настоящем документе также включает такие антитела, которые модифицированы в константной области для получения свойств согласно настоящему изобретению, особенно в отношении связывания Clq и/или связывания с FcR, например, путем «переключения класса», т.е. изменения или мутации частей Fc (например, с IgG1 на IgG4 и/или мутация IgG1/IgG4).
Термин «рекомбинантное антитело человека» при использовании в настоящем документе предназначен включать все антитела человека, которые получены, экспрессированы, созданы или выделены рекомбинантными средствами, такие как антитела, выделенные из клетки-хозяина, такой как клетка NS0 или СНО, или из животного (например, мыши), которое является трансгенным в отношении генов иммуноглобулинов человека, или антитела, экспрессированные при помощи рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина. Такие рекомбинантные антитела человека имеют вариабельные и константные области в перегруппированной форме. Рекомбинантные антитела человека согласно настоящему изобретению подвергались in vivo соматической гипермутации. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют последовательности, которые, хотя получены из и являются родственными последовательностям VH и VL зародышевых линий человека, не могут естественным образом существовать в наборе зародышевых линий антитела человека in vivo.
«Вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) или «вариабельный домен» при использовании в настоящем документе означает каждую из пар доменов легких и тяжелых цепей, которые вовлечены непосредственно в связывание антитела с антигеном. Вариабельные домены легких и тяжелых цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области (FR), последовательности которых являются в значительной степени консервативными, соединенные тремя «гипервариабельными областями» (или определяющими комплементарность областями, CDR). Каркасные области принимают β-складчатую конформацию, a CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи удерживаются в своей трехмерной структуре при помощи каркасных областей и образуют вместе с CDR из другой цепи антигенсвязывающий сайт. CDR3-области тяжелых и легких цепей антитела играют особенно важную роль в специфичности/аффинности связывания антител согласно настоящему изобретению. Термин «антигенсвязывающая часть антитела» при использовании в настоящем документе относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Антигенсвязывающая часть антитела содержит аминокислотные остатки из «определяющих комплементарность областей» или «CDR». «Каркасные» области или «FR» являются областями вариабельных доменов, не относящихся к остаткам гипервариабельной области, как определено в данном документе. Таким образом, вариабельные домены тяжелых и легких цепей антитела содержат от N- до С-конца домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В частности, CDR3 тяжелой цепи представляет собой область, которая обеспечивает главным образом связывание антигена и определяет свойства антитела. Области CDR и FR определяются согласно стандартному определению из Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), и/или их остаткам из «гипервариабельной петли».
Термин «эпитоп» включает любую полипептидную детерминанту, способную специфически связываться с антителом. В некоторых вариантах реализации детерминанта-эпитоп включает химически активные поверхностные группировки молекул, такие как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, а в некоторых вариантах реализации может иметь специфические трехмерные структурные характеристики и/или специфические зарядные характеристики. Эпитоп представляет собой область антигена, которая связывается антителом.
Термин «полноразмерное антитело» означает антитело, состоящее из двух «тяжелых цепей полноразмерного антитела» и двух «легких цепей полноразмерного антитела». «Тяжелая цепь полноразмерного антитела» представляет собой полипептид, состоящий в направлении от N-конца до С-конца из вариабельного домена (VH) тяжелой цепи антитела, константного домена 1 (СН1) тяжелой цепи антитела, шарнирной области (HR) антитела, константного домена 2 (СН2) тяжелой цепи антитела и константного домена 3 (СН3) тяжелой цепи антитела, который сокращенно называется VH-CH1-HR-СН2-СН3; и необязательно константного домена 4 (СН4) тяжелой цепи антитела в случае антитела подкласса IgE. Предпочтительно «тяжелая цепь полноразмерного антитела» представляет собой полипептид, состоящий в направлении от N-конца до С-конца из VH, CHI, HR, СН2 и СН3. «Легкая цепь полноразмерного антитела» представляет собой полипептид, состоящий в направлении от N-конца до С-конца из вариабельного домена легкой цепи (VL) антитела и константного домена легкой цепи (CL) антитела, что сокращенно называется VL-CL. Константный домен легкой цепи (CL) антитела может быть каппа или лямбда. Две цепи полноразмерного антитела связаны вместе посредством дисульфидных связей между полипептидами между доменом CL и доменом СН1 и между шарнирными областями тяжелых цепей полноразмерного антитела. Примеры типичных полноразмерных антител представляют естественные антитела, такие как IgG (например, IgG1 и IgG2), IgM, IgA, IgD и IgE. Полноразмерные антитела согласно настоящему изобретению могут быть от одного вида, например, человека, или они могут быть химерными или гуманизированными антителами. Полноразмерные антитела согласно настоящему изобретению содержат два антигенсвязывающих сайта, каждый образован парой VH и VL, оба из которых специфически связываются с одним и тем же антигеном. С-конец тяжелой или легкой цепи указанного полноразмерного антитела означает последнюю аминокислоту на С-конце указанной тяжелой или легкой цепи. N-конец тяжелой или легкой цепи указанного полноразмерного антитела означает последнюю аминокислоту на N-конце указанной тяжелой или легкой цепи.
Термин «константная область» или «константные домены» при использовании в рамках текущих применений означает сумму доменов антитела, отличных от вариабельной области. Константная область не вовлечена непосредственно в связывание антигена, а проявляет различные эффекторные функции. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела разделяются на классы: IgA, IgD, IgE, IgG и IgM, а некоторые из них могут быть дополнительно разделены на подклассы, такие как IgG1, IgG2, IgG3, и IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют разным классам антител, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Константные области легкой цепи, которые можно обнаружить во всех пяти классах антител, называются каппа и лямбда.
Термин «константная область человеческого происхождения» при использовании в настоящей заявке означает константную область тяжелой цепи антитела человека подкласса IgG1, IgG2, IgG3 или IgG4 и/или константную область каппа или лямбда легкой цепи. Такие константные области хорошо известны в данной области техники и, например, описаны у Kabat, Е. А. (см., например, Johnson, G., and Wu, Т.Т., Nucleic Acids Res. 28 (2000) 214-218; Kabat, E. A., et al, Proc. Natl. Acad. Sci. USA 72 (1975) 2785-2788).
Термин константный домен (или область) тяжелой цепи при использовании в настоящем документе определяет С-концевую область тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области тяжелой цепи.
Термин включает нативные последовательности константных доменов тяжелой цепи и вариантные константные домены тяжелой цепи. Вариантные константные домены тяжелой цепи включают, например, мутации в константных доменах, которые используются для содействия гетеродимеризации, как описано выше для технологии выступы во впадины. Также могут быть включены другие мутации, такие как, например, L234A (Leu235Ala), L235A (Leu234Ala) и P329G (Pro329Gly), так как константные домены с такими мутациями имеют сниженное связывание с FcR (в частности, они больше не демонстрируют связывание с FcR-гамма-I, FcR-гамма-II и FcR-гамма-Ш). Это особенно пригодно для снижения потенциальных побочных эффектов, таких как, например, тромбоз (Meyer, Т., et al., J. Thromb. Haemost. 7 (2009) 171-81). Кроме того, например, также мутации 1253А, Н310А и Н435А (нумерация согласно EU-индексу Кабата) могут быть включены в константный домен, поскольку константные домены с такими мутациями имеют сниженное связывание с FcRn (одна или две мутации) или устраненное связывание с FcRn (все 3 мутации).
В одном аспекте константная область тяжелой цепи IgG человека идет от аланина 118 (А118) (нумерация согласно EU-индексу Кабата) до карбоксильного конца тяжелой цепи. Однако антитела, продуцируемые клетками-хозяевами, могут подвергаться посттрансляционному отщеплению одной или более, в частности одной или двух, аминокислот от С-конца тяжелой цепи. Таким образом, антитело, продуцируемое клеткой-хозяином путем экспрессии специфической молекулы нуклеиновой кислоты, кодирующей полноразмерную тяжелую цепь, может содержать полноразмерную тяжелую цепь, или оно может содержать расщепленный вариант полноразмерной тяжелой цепи. Это может быть случай, в котором конечные две аминокислоты С-конца тяжелой цепи представляют собой глицин (G446) и лизин (К447, нумерация согласно EU-индексу). Таким образом, лизин (Lys447) на С-конце или глицин (Gly446) и лизин (Lys447) на С-конце константного домена тяжелой цепи могут присутствовать или могут не присутствовать. Аминокислотные последовательности тяжелых цепей, включающих константный домен тяжелой цепи, обозначаются в настоящем документе как С-концевой дипептид глицин-лизин, если не указано иное.
«Стабильный» состав представляет собой такой, в котором белок, например, антитело, по существу сохраняет свою физическую и химическую стабильность и, таким образом, свою биологическую активность при хранении; например, где содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 10% через 8 недель при 25°С (в одном варианте реализации менее 5%, в одном варианте реализации менее 2,5%). В одном варианте реализации содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 10% через 52 недель при 25°С (в одном варианте реализации менее 5%). В одном варианте реализации «стабильный жидкий фармацевтический состав» представляет собой жидкий состав без значительных изменений, наблюдаемых при температуре охлаждения (2-8°С) в течение по меньшей мере 12 месяцев, в частности, 2 лет и более конкретно 3 лет.Критерии для стабильности являются следующими: не более 10%, в частности 5%, мономера антитела разлагается, что измерено при помощи эксклюзионной хроматографии (ЭХ-ВЭЖХ). Кроме того, раствор является бесцветным или от прозрачного до слегка опалового при визуальном анализе. Концентрация белка в составе изменяется не более чем на +/-10%. Образуется не более чем 10%, в частности 5%, агрегатов. Стабильность измеряется методами, известными в данной области, такими как УФ-спектроскопия, эксклюзионная хроматография (ЭХ-ВЭЖХ), ионообменная хроматография (ИО-ВЭЖХ), турбидиметрия и визуальный осмотр.
Мутность (в ЕМФ (=единица мутности по формазину))
Мутность фармацевтического состава может быть определена на турбидиметре (например, на турбидиметре Hach 2100 AN согласно Европейской фармакопее 2.2.1 (Прозрачность и степень опалесценции жидкостей)). Объем образца приблизительно 2 мл раствора образца переносят в стеклянную кювету с внутренним диаметром 11 мм. Стеклянную кювету помещают в турбидиметр и мутность измеряют относительно калибровочной кривой эталонных суспензий 1 ЕМФ, 3 ЕМФ, 10 ЕМФ, 20 ЕМФ и 100 ЕМФ.
Вязкость (в мПа)
Вязкость образцов фармацевтического состава можно определять на реометре (например, ротационном реометре Anton Рааг Physica MCR 301 с 25 мм - конусом 0,5° при скорости сдвига 1000 с-1 и температуре 20°С).
Видимые частицы
Образцы во флаконах визуально осматривали на соответствующей контрольно-измерительной машине (например, контрольно-измерительной машине Seidenader V90-T) с помощью 2 х увеличительной линзы. Источники освещения LI, L2 и L3 доводили до установки 5. Образцы флаконов изучали при вращательном движении на наличие частиц. Образование видимых частиц неприемлемо для интравитреального введения согласно требованиям USP-NF <790>, которые по существу не содержат видимые частицы. USP-NF <790>обеспечивает, что достигается стандарт «по существу не содержит», когда проверяются парентеральные лекарственные средства, и наблюдается, что не более определенного числа элементов содержат видимые твердые частицы. Более конкретно, для парентеральных лекарственных средств, подвергнутых 100% проверке, стандарт «по существу не содержит» удовлетворяется, когда партия удовлетворяет приемлемому уровню качества (ПУК) 0,65% или менее. И если будет необходимо оценить продукт, который был отгружен заказчикам (например, из-за претензии или нормативного запроса), фирма может отобрать и осмотреть 20 элементов. Если в образце не наблюдаются частицы, партия считается такой, которая «по существу не содержит» видимые твердые частицы.
Концентрация белка (в мг/мл)
Концентрацию белка в образцах состава измеряли путем поглощения ультрафиолетового (УФ) излучения на фотометре для ультрафиолетовой и видимой части спектра Lambda 35 от Perkin Elmer. Образцы состава разбавляли при помощи 20 мМ раствора L-гистидин-ацетатного буфера рН 5,5 до концентрации белка приблизительно 0,5 мг/мл и набирали в кювету для измерения с толщиной 1 см. УФ-поглощение кюветы для измерения измеряли при длине волны 280 и 320 нм.
Концентрацию белка рассчитывали из измеренных поглощений УФ-излучения при 280 (А280) и 320 нм (А320), коэффициенте экстинкции (Е) 1,70 мл/(мг × см), толщине (d) 1 см и коэффициенте разведения (КР), соответствующем фактическому разведению, согласно следующему уравнению:

рН
рН образцов составов определяли потенциометрией со стеклянным электродом.
Ионная сила
Безразмерную ионную силу I составов рассчитывали согласно Уравнение 1:
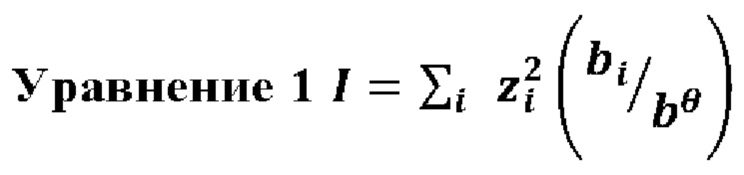
В этом выражении z представляет собой зарядовое число иона I (положительное для катионов и отрицательное для анионов), bi представляет его молярность. bθ соответствует 1 моль/кг и требуется для того, чтобы сделать I безразмерным (Physical Chemistry, P. Atkins, J. de Paula, Oxford Press Nineth edition, p. 194).
Молярность заряженных частиц буфера рассчитывали при помощи уравнения Хендерсона-Хассельбаха (Methods in Enzymology- Guide to Protein Purification, Volume 182, M.P. Deutscher, Academic Press, Inc., 1990, p. 24ff).
Осмоляльность
Осмоляльность образцов состава измеряли на осмометре Osmomat 030 3Р от Gonotec согласно принципу понижения температуры замерзания. Поверхностно-активные вещества
Фармацевтический состав настоящего изобретения содержит поверхностно-активное вещество для снижения агрегации антител и образования частиц. Термин «поверхностно-активное вещество» при использовании в настоящем документе означает фармацевтически приемлемое вспомогательное вещество, которое используется для защиты составов белков от механических нагрузок, таких как перемешивание и усилия сдвига. Примеры фармацевтически приемлемых поверхностно-активных веществ включают сложные эфиры полиоксиэтиленсорбитана и жирных кислот (Tween), алкиловые эфиры полиоксиэтилена (например, продаваемые под торговым названием Brij™) и сополимер полиоксиэтилена-полиоксипропилена (Poloxamer, Pluronic).
Предпочтительно поверхностно-активное вещество представляет собой сложный эфир полиоксиэтиленсорбитана и жирных кислот или полоксамер. Примеры сложных эфиров полиоксиэтиленсорбитана и жирных кислот представляют полисорбат 20 (продаваемый под торговым названием Tween 20™) и полисорбат 80 (продаваемый под торговым названием Tween 80™). Предпочтительным эфиром полиоксиэтиленсорбитана и жирной кислоты является полисорбат 20.
Вышеуказанные поверхностно-активные вещества обычно используют в концентрации 0,01% (масс./об.) или выше, например, от 0,01 до приблизительно 0,09% (масс./об.). Поверхностно-активное вещество в фармацевтической композиции настоящего изобретения, в частности, используется в диапазоне от приблизительно 0,02% до приблизительно 0,06% (масс./об.), более конкретно в диапазоне от приблизительно 0,03% до приблизительно 0,05% (масс./об.), еще более конкретно в концентрации приблизительно 0,04% (масс./об.).
Термин «полоксамер» при использовании в настоящем документе включает триблок-сополимер полиоксиэтилена-полиоксипропилена, состоящий из центральной гидрофобной цепи полиоксипропилена с двумя гидрофильными цепями полиоксиэтилена по бокам, известный как полоксамер 188, продаваемый под торговым названием PLURONIC® F68 от BASF (Парсипини, Нью-Джерси). Другие полоксамеры, которые можно использовать в составах настоящего изобретения, включают полоксамер 403 (продаваемый как PLURONIC® PI23), полоксамер 407 (продаваемый как PLURONIC® PI 27), полоксамер 402 (продаваемый как PLURONIC® PI 22), полоксамер 181 (продаваемый как PLURONIC® L61), полоксамер 401 (продаваемый как PLURONIC® L121), полоксамер 185 (продаваемый как PLURONIC® Р65) и полоксамер 338 (продаваемый как PLURONIC® F108).
Буферы
Термин «буфер» при использовании в настоящем документе обозначает фармацевтически приемлемое вспомогательное вещество, которое стабилизирует рН фармацевтического препарата. Подходящие буферы хорошо известны в данной области и могут быть найдены в литературных источниках. Типичные фармацевтически приемлемые буферы для интравитреального введения включают, помимо прочего, гистидиновые буферы, цитратные буферы, сукцинатные буферы, ацетатные буферы, фосфатные буферы или их смеси. В этом контексте буферы, представляющие особый интерес, включают L-гистидин («гистидиновый буфер») или смеси L-гистидина и гидрохлорида L-гистидина с регулированием рН при помощи кислоты или основания, известного в данной области. Буферы, представляющие особый интерес, включают L-гистидин («гистидиновый буфер»), в частности L-гистидин с регулированием рН при помощи уксусной кислоты (например, 30%) или гидрохлорида. Вышеуказанные буферы обычно используются в концентрации от приблизительно 2 мМ до приблизительно 200 мМ или от приблизительно 5 мМ до приблизительно 100 мМ, в частности, в концентрации от приблизительно 10 мМ до приблизительно 30 мМ или от приблизительно 15 мМ до приблизительно 20 мМ, и более конкретно приблизительно 20 мМ. Независимо от используемого буфера рН можно доводить до значения в диапазоне от 4,5 до 7,0 и, в частности, до значения в диапазоне от 5,0 до 6,0 и наиболее конкретно рН 5,5±0,2 при помощи кислоты или основания, известных в данной области, например, уксусной кислоты, соляной кислоты, фосфорной кислоты, серной кислоты и лимонной кислоты, гидроксида натрия и гидроксида калия, в частности уксусной кислоты. Буфером, представляющим особый интерес, является гистидин (L-гистидин)-ацетатный буфер в концентрации 15-25 мМ (в одном варианте реализации 20 мМ ± 3 мМ, в частности 20 мМ ± 2 мМ) при рН 5,5±0,5 (в одном варианте реализации при рН 5,5±0,3; в частности, при рН 5,5±0,2) Стабилизаторы
Термин «стабилизатор» означает фармацевтически приемлемое вспомогательное вещество, которое защищает активный фармацевтический ингредиент и/или состав от химического и/или физического разложения при производстве, хранении и применении. Пути химического и физического разложения белковых фармацевтических препаратов рассматриваются в Cleland et al. (1993), Crit Rev Ther Drug Carrier Syst 10(4):307-77, Wang (1999) Int J Pharm 185(2): 129-88, Wang (2000) Int J Pharm 203(1-2): 1-60, и Chi et al. (2003) Pharm Res 20(9): 1325-36. Стабилизаторы включают, помимо прочего, сахара, аминокислоты, полиолы, циклодекстрины, например, гидроксипропил-р-циклодекстрин, сульфобутилэтил-р-циклодекстрин, р-циклодекстрин,
полиэтиленгликоли, например, PEG 3000, PEG 3350, PEG 4000, PEG 6000, альбумин, альбумин человеческой сыворотки (АЧС), альбумин бычьей сыворотки (АБС), соли, например, хлорид натрия, хлорид магния, хлорид кальция, хелаторы, например, ЭДТК, как определено далее. Стабилизаторы, которые в том числе используются в настоящем изобретении, выбирают из группы, состоящей из сахаров, полиолов и аминокислот. Более конкретно, стабилизаторы выбирают из группы, состоящей из сахарозы, трегалозы, сорбита и метионина.
Более предпочтительно стабилизатор представляет собой метионин. Метионин использовали в составах, описанных в настоящем документе, впервые для использования в применениях для глаз. Доклинические исследования безопасности показали, что метионин показывает хороший профиль безопасности для использования при заболеваниях глаз при введении, например, интравитреально.
Стабилизаторы могут присутствовать в составе в концентрации от приблизительно 2 мМ до приблизительно 600 мМ, в частности, если стабилизатором является метионин, в концентрации от приблизительно 2 мМ до приблизительно 15 мМ или от 5 до 12 мМ; более конкретно в концентрации от приблизительно 5 до 9 мМ или приблизительно 7 мМ.
В одном предпочтительном варианте реализации стабилизатором является метионин в концентрации 7,0 мМ ± 2,0 мМ метионина (в одном варианте реализации 7,0 мМ ± 1,0 мМ метионина; в одном варианте реализации 7,0 мМ ± 0,7 мМ метионина). Метионин в качестве стабилизатора является особенно полезным, поскольку он может работать, помимо прочего, в качестве поглотителя для пероксида водорода, который используется для стерилизации инъекционных растворов или упакованных предварительно заполненных шприцев.
В некоторых вариантах реализации жидкий фармацевтический состав настоящего изобретения содержит антиоксидант в качестве второго стабилизатора. «Антиоксидант» представляет собой фармацевтически приемлемое вспомогательное вещество, которое предотвращает окисление активного фармацевтического ингредиента. Антиоксиданты включают, помимо прочего, хелатирующие средства, такие как ЭДТК, лимонная кислота, аскорбиновая кислота, бутилированный гидрокситолуол (БГТ), бутилированный гидроксианизол (БГА), сульфит натрия, п-аминобензойная кислота, глутатион, пропилгаллат, цистеин, метионин, этанол, бензиловый спирт и н-ацетилцистеин. Антиоксиданты можно использовать в концентрации от приблизительно 0,01 до приблизительно 100 мМ, в частности, в концентрации от приблизительно 5 до приблизительно 50 мМ и более конкретно в концентрации от приблизительно 5 до приблизительно 25 мМ. В частности, метионин выбирают как второй стабилизатор, в частности, в концентрации от приблизительно 5 до приблизительно 25 мМ, более конкретно в концентрации приблизительно 10 мМ.
Термин «сахар» при использовании в настоящем документе означает моносахарид или олигосахарид. Моносахарид представляет собой мономерный углевод, который не гидролизуется кислотами, включая простые сахара и их производные, например, аминосахара. Примеры моносахаридов включают глюкозу, фруктозу, галактозу, маннозу, сорбозу, рибозу, дезоксирибозу, нейраминовую кислоту. Олигосахарид представляет собой углевод, состоящий из более чем одного мономерного сахаридного звена, соединенного гликозидной(ыми) связью(ями), или разветвленного, или в виде цепи. Мономерные сахаридные звенья в олигосахариде могут быть одинаковыми или разными. В зависимости от числа мономерных сахаридных звеньев олигосахарид является ди-, три-, тетра- пента- и т.д. сахаридом. В отличие от полисахаридов моносахариды и олигосахариды являются растворимыми в воде. Примеры олигосахаридов включают сахарозу, трегалозу, лактозу, мальтозу и рафинозу. В частности, сахара выбирают из сахарозы и трегалозы, в частности сахарозы.
Термин «аминокислота» при использовании в настоящем документе означает в общем фармацевтически приемлемую органическую молекулу, имеющую аминофрагмент, расположенный в а-положении относительно карбоксильной группы. Примеры аминокислот включают аргинин, глицин, орнитин, лизин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, изолейцин, лейцин, аланин, фенилаланин, тирозин, триптофан, метионин, серии, пролин, в частности, метионин.
Термин «полиолы» при использовании в настоящем документе означает фармацевтически приемлемые спирты с более чем одной гидроксигруппой. Подходящие полиолы включают, помимо прочего, маннит, сорбит, глицерин, декстран, глицерин, арабит, пропиленгликоль, полиэтиленгликоль и их комбинации. Полиолы можно использовать в концентрации от приблизительно 10 мМ до приблизительно 500 мМ, в частности, в концентрации от приблизительно 10 до приблизительно 250 мМ и более конкретно в концентрации от приблизительно 200 до приблизительно 250 мМ.
Термин «стабилизаторы» также включает лиопротекторы. Термин «лиопротектор» означает фармацевтическое приемлемое вспомогательное вещество, которое защищает нестабильный активный ингредиент (например, белок) от дестабилизирующих условий в процессе лиофилизации, при последующем хранении и разбавлении. Лиопротекторы включают, помимо прочего, группу, состоящую из сахаров, полиолов (таких как, например, сахарные спирты) и аминокислот. В частности, лиопротекторы можно выбирать из группы, состоящей из сахаров, таких как сахароза, трегалоза, лактоза, глюкоза, манноза, мальтоза, галактоза, фруктоза, сорбоза, рафиноза, нейраминовая кислота, аминосахаров, таких как глюкозамин, галактозамин, N-метилглюкозамин («меглюмин»), полиолов, таких как маннит и сорбит, и аминокислот, таких как метионин или глицин. Лиопротекторы обычно используют в концентрации от приблизительно 10 до приблизительно 600 мМ, в частности, в концентрации от приблизительно 10 до приблизительно 250 мМ и более конкретно в концентрации от приблизительно 100 до приблизительно 250 мМ.
Регуляторы тоничности
Фармацевтический состав может также содержать регуляторы тоничности. Термин «регуляторы тоничности» при использовании в настоящем документе означает фармацевтически приемлемые регуляторы тоничности, которые используют для модулирования тоничности состава. Состав может быть гипотоничным, изотоничным или гипертоничным. Изотоничность, в общем, относится к осмотическому давлению относительно раствора, обычно относительно сыворотки крови человека. Состав согласно настоящему изобретению может быть гипотоничным, изотоничным или гипертоничным, предпочтительно фармацевтический состав является изотоничным. Изотоничный состав представляет собой жидкость или жидкость, разведенную из твердой формы, например, из лиофилизированной формы, и означает раствор, имеющий тоничность, подобную тоничности некоторого другого раствора, с которым его сравнивают, таким как физиологический солевой раствор и сыворотка крови. Подходящие регуляторы тоничности включают, помимо прочего, хлорид натрия, хлорид калия, глицерин и любой компонент из группы аминокислот, сахаров, в частности сахарозу. В одном варианте реализации настоящего изобретения предпочтительным регулятором тоничности является сахароза. Регуляторы тоничности обычно используют в концентрации от приблизительно 5 мМ до приблизительно 1000 мМ, в частности, от приблизительно 30 мМ до приблизительно 500 мМ, более конкретно от приблизительно 120 мМ до приблизительно 200 мМ. Регуляторы тоничности для изотоничных составов настоящего изобретения обычно используют в концентрации от приблизительно 50 мМ до приблизительно 250 мМ, в частности, от приблизительно 120 мМ до приблизительно 200 мМ. Более конкретно, регуляторы тоничности для изотоничных составов используют в концентрации от 130 мМ до 190 мМ и еще более конкретно в концентрации приблизительно 160 мМ ± 24 мМ в случае, когда сахарозу используют в качестве регулятора тоничности. Регулятор тоничности и его концентрацию выбирают для обеспечения изотоничного состава с целевой осмоляльностью 300±100 мОсм/кг (в частности, с целевой осмоляльностью 300±50 мОсм/кг).
В рамках стабилизаторов и регуляторов тоничности есть группа соединений, которая может работать обоими путями, т.е. они могут одновременно быть стабилизатором и регулятором тоничности. Их примеры можно найти в группе сахаров, аминокислот, полиолов, циклодекстринов, полиэтиленгликолей и солей. Примером сахара, который может одновременно быть стабилизатором и регулятором тоничности, является сахароза и трегалоза, в частности, сахароза.
Понизитель вязкости
Фармацевтический состав может также содержать понизители вязкости. Термин «понизители вязкости» при использовании в настоящем документе означает фармацевтически приемлемый модификатор ионной силы, который используют для снижения вязкости состава, что важно для составов с высокими концентрациями и составов, которые предусмотрены для интравитреального введения в глаз посредством тонких иголок (обеспечивая относительно быстрое введение без необходимости в высоком давлении для инъекции) в лечении заболеваний глаз. Примерами типичных понизителей вязкости являются, например, хлорид кальция или хлорид натрия.
Адъюванты
Фармацевтический состав может также содержать адъюванты, такие как консерванты, смачивающие средства, эмульгаторы и диспергирующие средства. Предотвращение присутствия микроорганизмов может обеспечиваться как процедурами стерилизации, так и включением различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и подобного. Консерванты обычно используют в концентрации от приблизительно 0,001 до приблизительно 2% (масс./об.). Консерванты включают, помимо прочего, этанол, бензиловый спирт, фенол, м-крезол, п-хлор-м-крезол, метил- или пропилпарабены, хлорид бензалкония.
Фармацевтический состав может также содержать различные вышеуказанные средства, такие как буферы, поверхностно-активные вещества, стабилизатор, модификатор ионной силы, в меньших количествах, которые по существу не изменяют технические признаки фармацевтического состава настоящего изобретения, например, такие как вязкость 20 мПа⋅с или менее (предпочтительно 15 мПа⋅с или менее), мутность 30 ЕМФ или менее (предпочтительно 25 ЕМФ или менее), осмоляльность 300±50 мОсм/кг, по существу отсутствие видимых частиц.
Применение
Фармацевтический состав биспецифического антитела к VEGF/ANG2 согласно настоящему изобретению можно использовать при профилактике или лечении сосудистых заболеваний глаз. Для этой цели обеспечивается фармацевтический состав биспецифического антитела к VEGF/ANG2 для интравитреального введения в виде жидкого изотоничного состава с вязкостью 20 мПа⋅с или менее (предпочтительно 15 мПа⋅с или менее), мутностью 30 ЕМФ или менее (предпочтительно 25 ЕМФ или менее), осмоляльностью 300±50 мОсм/кг, по существу отсутствием видимых частиц. Жидкий изотоничный фармацевтический состав биспецифического антитела к VEGF/ANG2 для этой цели можно обеспечивать в стеклянных флаконах или в виде предварительно заполненного шприца, в частности, в виде предварительно заполненного стеклянного шприца.
Для таких составов, которые вводят интравитреально в глаз, вспомогательных веществ, таких как например, аргинин, следует избегать, поскольку была описана токсичность аргинина в качестве носителя для тканевого активатора плазминогена (t-PA) для сетчатки и пигментного эпителия сетчатки (см., например, Benner J D, Morse LS, Toth С A et al Arch Ophthalmol 19911091731-1736.1736; Johnson MW, Olsen KR. Hernandez E. et al, Arch Ophthalmool 1990108259-263.263, Irvine W D, Johnson MW, Heinandez E. et al,. Arch Ophthalmol 1991109718-722.722, Johnson MW, Olsen KR. Heinandez E., Retina 199111250-258.258). Таким образом, жидкий фармацевтический состав настоящего изобретения по существу не содержит аргинин (что означает, что состав не содержит аргинин или содержит количества аргинина ниже концентрации/уровня, при которых они могут быть токсичными (за счет их функции носителя для тканевого активатора плазминогена (t-PA)), или не содержит аргинин. Низкая вязкость также важна для обеспечения промышленного способа производства (повышение концентрации ультрафильтрацией) и для обеспечения простого и удобного интравитреального введения (силы впрыска (скольжения) менее 20 Н, в частности менее 15 Н, при скорости впрыска 50 мм/мин). Было показано, что жидкий фармацевтический состав настоящего изобретения с вязкостью менее 15 мПа⋅с можно было вводить при помощи инъекционной иглы 30G с временем впрыска 5 с при силе впрыска менее 5 Н. Для этой цели фармацевтический состав биспецифического антитела к VEGF/ANG2 представляет собой жидкий изотоничный состав с вязкостью 15 мПа⋅с или менее, мутностью 25 ЕМФ или менее, осмоляльностью 300±50 мОсм/кг, по существу не содержащий видимых частиц. Чтобы избежать каких-либо видимых частиц, жидкий фармацевтический состав настоящего изобретения по существу не содержит хлорид кальция (что означает, что состав не содержит хлорид кальция или содержит количества хлорида кальция ниже концентрации/уровня, при которых они могут способствовать образованию видимых частиц, так что состав остается таким, который не содержит видимых частиц/по существу не содержит видимых частиц) или не содержит хлорид кальция.
Термины «глазное сосудистое заболевание» и «сосудистое заболевание глаз» используются взаимозаменяемо в настоящем документе и включают, помимо прочего, внутриглазные неоваскулярные синдромы, такие как диабетическая ретинопатия, диабетический макулярный отек, ретинопатия недоношенных, неоваскулярная глаукома, окклюзии вены сетчатки, окклюзии центральной вены сетчатки, макулярная дегенерация, возрастная макулярная дегенерация, пигментный ретинит, ретинальная ангиоматозная пролиферация, макулярная телеангиэктазия, ишемическая ретинопатия, неоваскуляризация радужной оболочки, внутриглазная неоваскуляризация, неоваскуляризация роговицы, неоваскуляризация сетчатки, хориоидальная неоваскуляризация и дегенерация сетчатки. (Garner, A., Vascular diseases, In: Pathobiology of ocular disease, A dynamic approach, Garner, A., and Klintworth, G.K., (eds.), 2nd edition, Marcel Dekker, New York (1994), pp. 1625-1710). При использовании в настоящем документе глазное сосудистое заболевание относится к любому патологическому состоянию, характеризующемуся измененной или нерегулируемой пролиферацией и инвазией новых кровеносных сосудов в структуры глазных тканей, таких как сетчатка или роговица. В одном варианте реализации глазное сосудистое заболевание выбирают из группы, состоящей из: влажной формы возрастной макулярной дегенерации (влажной ВМД) (также называемой неоваскулярной возрастной макулярной дегенерацией (нВМД)), диабетического макулярного отека (ДМО), диабетической ретинопатии (ДР), непролиферативной диабетической ретинопатии (НПДР), пролиферативной диабетической ретинопатии (ПДР), кистозного макулярного отека (КМО), васкулита (например, окклюзии центральной вены сетчатки), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), отека диска зрительного нерва, ретинита, конъюктивита, увеита, хориоидита, мультифокального хориоидита, окулярного гистоплазмоза, блефарита, синдрома сухого глаза (синдрома Шегрена) и других офтальмологических заболеваний, причем заболевание или расстройство глаз связано с неоваскуляризацией в глазах, транссудацией и/или отеком сетчатки, в частности, влажной формой возрастной макулярной дегенерации (влажной ВМД) (также называемой неоваскулярной возрастной макулярной дегенерацией (нВМД)), диабетическим макулярным отеком (ДМО), диабетической ретинопатией (ДР), непролиферативной диабетической ретинопатией (НПДР), пролиферативной диабетической ретинопатией (ПДР), кистозным макулярным отеком (КМО), васкулитом (например, окклюзией центральной вены сетчатки), окклюзией вены сетчатки (ОВС), окклюзией центральной вены сетчатки (ОЦВС). Таким образом, биспецифические антитела к VEGF/ANG2 для применения и способы, описанные в настоящем документе, пригодны для профилактики и лечения влажной ВМД (также называемой неоваскулярной возрастной макулярной дегенерацией (нВМД)), ДМО, ДР, НПДР, ПДР, также предпочтительно влажной ВМД, ДМО и ОВС, также предпочтительно влажной ВМД. В некоторых вариантах реализации сосудистое заболевание глаз выбирают из группы, содержащей влажную форму возрастной макулярной дегенерации (влажной ВМД)), диабетический макулярный отек (ДМО), окклюзию вены сетчатки (ОВС), диабетическую ретинопатию (ДР) и ретинопатию недоношенных (РН).
Другие заболевания, связанные с неоваскуляризацией роговицы, включают, помимо прочего, эпидемический кератоконъюнктивит, дефицит витамина А, чрезмерное ношение контактных линз, атопический кератит, верхний лимбальный кератит, сухой кератит крыловидной плевы, синдром Шегрена, розацею, фликтенулезный конъюнктивит, сифилис, микобактериальные инфекции, липидную дегенерацию, химические ожоги, бактериальные язвы, грибковые язвы, инфекции простого герпеса, инфекции опоясывающего герпеса, инфекции простейшими, саркому Капоши, язву Мурена, маргинальную дегенерацию Терриена, краевую дистрофию роговицы, ревматоидный артрит, системную волчанку, полиартериит, травму, саркоидоз Вегенера, склерит, синдром Стивенса-Джонсона, перифигоидную радиальную кератотомию и отторжение роговичного трансплантата.
Заболевания, связанные с неоваскуляризацией сетчатки/хориоидальной неоваскуляризацией, включают, помимо прочего, диабетическую ретинопатию, макулярную дегенерацию, серповидноклеточную анемию, саркоид, сифилис, эластическую псевдоксантому, болезнь Педжета, окклюзию вен, окклюзию артерий, обструктивное заболевание сонной артерии, хронический увеит/витрит, микобактериальные инфекции, болезнь Лайма, системную красную волчанку, ретинопатию новорожденных, пигментный ретинит, отек сетчатки (включая макулярный отек), болезнь Илза, болезнь Бехчета, инфекции, вызывающие ретинит или хориоидит, предполагаемый гистоплазмоз глаз, болезнь Беста, миопию, врожденные ямки в диске зрительного нерва, болезнь Штаргардта, парспланит, хроническое отслоение сетчатки, синдром повышенной вязкости крови, токсоплазмоз, травму и осложнения после лазерной операции. Другие заболевания включают, помимо прочего, заболевания, связанные с покраснением радужки (неоваскуляризацией угла передней камеры), и заболевания, вызываемые атипичной пролиферацией сосудисто-волокнистой или волокнистой ткани, включая все формы пролиферативной витреоретинопатии.
Ретинопатия недоношенных (РН) представляет собой заболевание глаза, которое поражает недоношенных младенцев. Считается, что она вызвана нарушенным ростом кровеносных сосудов сетчатки, что может приводить к рубцеванию и отслоению сетчатки. РН может быть умеренной и может самопроизвольно устраняться, но может приводить к слепоте в серьезных случаях. Таким образом, все родившиеся преждевременно младенцы находятся в группе риска РН, и очень малый вес при рождении является дополнительным фактором риска. Как отравление кислородом, так и относительная гипоксия может способствовать развитию РН.
Макулярная дегенерация является медицинским состоянием, главным образом обнаруживаемым у людей старшего возраста, при котором центр внутренней оболочки глаза, известной как желтое пятно сетчатки, подвергается утонению, атрофии и в некоторых случаях кровотечению. Это может приводить к потере центрального зрения, что вызывает неспособность видеть мелкие детали, читать или узнавать лица. Согласно Американской академии офтальмологии сегодня это основная причина потери центрального зрения (слепоты) в Соединенных Штатах для людей возрастом более пятидесяти лет.Хотя некоторые виды макулярной дегенерации, которые поражают более молодых индивидуумов, иногда называют макулярной дистрофией, термин в общем относится к возрастной макулярной дегенерации (ВМД или СВМД).
«Возрастная макулярная дегенерация (ВМД)» при использовании в настоящем документе относится к серьезному патологическому состоянию глаз, когда разрушается небольшая центральная часть сетчатки, известная как макула. Влажная форма ВМД (влажная ВМД (вВМД), также называемая неоваскулярной ВМД (нВМД)), форма развитой ВМД, характеризуется ростом атипичных кровеносных сосудов из хориоида под макулой. Это называется хориоидальной неоваскуляризацией. Эти кровеносные сосуды пропускают кровь и жидкость в сетчатку, вызывая искажение зрения, из-за которого прямые линии кажутся волнистыми, а также приводит к слепым пятнам и потере центрального зрения. Эти атипичные кровеносные сосуды в итоге рубцуются, что приводит к безвозвратной потере центрального зрения. Симптомы ВМД включают темные, смазанные области в центре зрения; и ухудшают или изменяют цветовосприятие. ВМД можно обнаружить при обычной проверке глаз. Одним из наиболее ранних признаков макулярной дегенерации является присутствие мелких желтых отложений в друзах под сетчаткой или агрегация пигмента.
Пигментный ретинит (ПР) представляет группу генетических патологических состояний глаз. При прогрессировании симптомов ПР ночная слепота обычно предшествует туннельному зрению за годы или даже десятилетия. Многие люди с ПР не официально не признаются слепыми до 40 или 50 лет и сохраняют некоторую часть зрения всю свою жизнь. Другие становятся полностью слепыми из-за ПР, в некоторых случаях даже в детстве. Развитие ПР отличается в каждом случае. ПР представляет тип наследственной дистрофии сетчатки, группу наследственных расстройств, при которой отклонения от нормы фоторецепторов (палочек и колбочек) или пигментного эпителия сетчатки (ПЭС) приводят к постепенной потере зрения. Индивидуумы с нарушением сначала испытывают нарушение темновой адаптации или никталопию (ночную слепоту), а затем снижение периферического поля зрения (известное как туннельное зрение) и иногда потерю центрального зрения на поздних стадиях заболевания.
Макулярный отек возникает, когда жидкость и отложения белков собираются на или под макулой глаза, желтой центральной областью сетчатки, вызывая ее утолщение и набухание. Набухание может искажать центральное зрение человека, поскольку макула находится около центра сетчатки сзади глазного яблока. Эта область содержит плотно упакованные колбочки, которые обеспечивают острое, ясное центральное зрение, чтобы обеспечить то, что человек видит форму, цвет и детали, которые находятся непосредственно на линии взгляда. Кистозный макулярный отек представляет тип макулярного отека, который включает образование кист.
«Диабетический макулярный отек» (ДМО) при использовании в настоящем документе относится к серьезному патологическому состоянию глаз, которое поражает людей с диабетом (1 или 2 типа). Макулярный отек возникает, когда кровеносные сосуды в сетчатке протекают в макулу, и жидкость и отложения белков собираются на или под макулой глаза (желтой центральной областью сетчатки) и вызывают ее утолщение и набухание (отек). Набухание может искажать центральное зрение человека, поскольку макула находится около центра сетчатки сзади глазного яблока. Первичные симптомы ДМО включают, помимо прочего, туманный взгляд, плавающие точки, потерю контраста, двоение в глазах и возможную потерю зрения. Патология ДМО характеризуется разрушением гемато-ретинального барьера, обычно мешая движению воды в сетчатке, таким образом обеспечивая накопление жидкости в ткани сетчатки и присутствие утолщения сетчатки. ДМО в настоящее время диагностируется при осмотре глаз, состоящем из проверки остроты зрения, при котором определяют самые мелкие буквы, которые человек может читать на стандартной карте, расширенной проверке зрения для проверки на признаки заболевания, процедуре получения изображений, такой как оптическая когерентная томография (ОКТ) или флуоресцентная ангиография (ФА) и тонометрия, инструмент, который измеряет давление внутри глаза. Следующие исследования также проводили для определения лечения: оптическая когерентная томография (ОКТ), флуоресцентная ангиография и стереофотография глазного дна. ДМО можно в широком смысле разделить на две основные категории - фокальный и диффузный. Фокальный ДМО характеризуется конкретными зонами отдельного и различимого протекания в макулу с достаточным макулярным кровотоком. Диффузный ДМО происходит вследствие протекания из всего капиллярного ложа, окружающего макулу, что происходит из-за разрушения внутреннего гемато-ретинального барьера глаза. Помимо фокального и диффузного, ДМО также подразделяют на основе результатов клинических обследований на клинически значимый макулярный отек (КЗМО), не-КЗМО и КЗМО с центральным поражением (КЗМО-ЦП), которое включает ямку. Настоящее изобретение включает способы для лечения вышеуказанных категорий ДМО. В одном варианте реализации настоящего изобретения сосудистое заболевание глаз выбрано из группы, состоящей из: влажной формы возрастной макулярной дегенерации (влажной ВМД), диабетического макулярного отека (ДМО), диабетической ретинопатии (ДР), непролиферативной диабетической ретинопатии (НПДР), пролиферативной диабетической ретинопатии (ПДР), васкулита (например, окклюзии вены сетчатки (ОВС) и окклюзии центральной вены сетчатки (ОЦВС). В одном варианте реализации сосудистое заболевание глаз выбрано из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), макулярной дегенерации, влажной формы возрастной макулярной дегенерации (влажной ВМД), ретинопатии недоношенных (РН), неоваскулярной глаукомы, пигментного ретинита (ПР), ретинальной ангиоматозной пролиферации, макулярной телеангиэктазии, ишемической ретинопатии, неоваскуляризации радужной оболочки, внутриглазной неоваскуляризации, неоваскуляризации роговицы, неоваскуляризации сетчатки, хориоидальной неоваскуляризации и дегенерации сетчатки, в частности из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), влажной формы возрастной макулярной дегенерации (влажной ВМД).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет диабетическую ретинопатию (ДР).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет диабетический макулярный отек (ДМО).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет окклюзию вены сетчатки (ОВС).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет окклюзию центральной вены сетчатки (ОЦВС).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет ретинопатию недоношенных (РН).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет макулярную дегенерацию.
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет возрастную макулярную дегенерацию (ВМД).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет влажную форму возрастной макулярной дегенерации (вВМД).
В одном варианте реализации настоящего изобретения сосудистое заболевание глаз представляет хориоидальную неоваскуляризацию.
Введение
Жидкий фармацевтический состав согласно настоящему изобретению можно вводить интравитреальными (ИВТ) средствами, например, известными в фармацевтической области (например, соответствующим шприцем). Для интравитреальной инъекции обычно объемы инъекции составляют 50-100 мкл. Интравитреальную инъекцию осуществляют путем использования одноразового шприца и иглы для инъекции 30G (25G-30G) или предварительно заполненного шприца с соответствующей иглой для инъекции. Жидкий состав можно отбирать из флакона, содержащего состав, при помощи иглы с фильтром с размером пор 5 мкм. Техника введения интравитреальных инъекций описана, например, в D.Yorston, Community Eye Health. 2014; 27(87): 47.
Для этой цели фармацевтический состав биспецифического антитела к VEGF/ANG2 находится в виде жидкого изотоничного состава с вязкостью 15 мПа⋅с или менее, мутностью 25 ЕМФ или менее, осмоляльностью 300±50 мОсм/кг, по существу не содержащего видимые частицы.
Составы, предназначенные для введения in vivo, должны быть стерильными. Это легко выполняется путем фильтрации через стерильные фильтрующие мембраны и асептической производственной практики.
Способ получения состава
Фармацевтический состав согласно настоящему изобретению можно получать способами или процессами, известными в данной области, например, ультрафильтрацией-диафильтрацией, диализом, добавлением и перемешиванием, лиофилизацией, разбавлением и их комбинациями. Примеры получения составов согласно настоящему изобретению можно найти далее в настоящем документе.
В одном варианте реализации настоящего изобретения фармацевтический состав может быть получен путем следующего способа или процесса изготовления, включающего шаги:
1. Замена буфера на буфер диафильтрации, содержащий гистидин-ацетатный буфер, или гистидин-ацетатный буфер и хлорид натрия, или гистидин-ацетатный буфер, хлорид натрия и метионин, или гистидин-ацетатный буфер, хлорид натрия, метионин и сахарозу, путем ультрафильтрации и диафильтрации с использованием полупроницаемой мембраны с ОММ (отсечением по молекулярной массе) от 5 до 80 кДа (30-50 кДа) (30 кДа). Обычно отношение между буфером для диафильтрации и основным объемом раствора составляет 5-20 (5-10).
2. Альтернативно 1, замену буфера можно обеспечить при помощи диализа, используя буфер для диализа, содержащий гистидин-ацетатный буфер, или гистидин-ацетатный буфер и хлорид натрия, или гистидин-ацетатный буфер, хлорид натрия и метионин, или гистидин-ацетатный буфер, хлорид натрия, метионин и сахарозу, и диализную мембрану с ОММ от 5 до 80 кДа (30-50 кДа) (30 кДа). Обычно отношение между буфером для диализа и основным объемом раствора составляет 5-20 (5-10).
3. Основной объем раствора с замененным буфером концентрируют ультрафильтрацией, используя мембрану для диафильтрации с ОММ (отсечением по молекулярной массе) от 5 до 80 кДа (30-50 кДа) (30 кДа) с концентрацией белка более 120 мг/мл (120-160 мг/мл) (120-200 мг/мл).
4. Готовую композицию фармацевтического состава регулируют добавлением исходных растворов соответствующих вспомогательных веществ или при помощи соответствующего стабилизирующего буфера. Раствор гомогенизируют перемешиванием.
Кроме того, способ или процесс изготовления может включать следующие шаги:
5. Готовый составленный раствор можно хранить замороженным при температуре ниже -20°С (ниже -40°С).
6. Перед заполнением в окончательный первичный контейнер раствор размораживают.
7. Несколько контейнеров или партий фармацевтического состава смешивают и гомогенизируют перемешиванием.
8. Гомогенизированный фармацевтический состав фильтруют через несколько (по меньшей мере два) стерилизующих фильтра с размером пор по меньшей мере 0,2 или 0,22 мкм.
9. Стерильно отфильтрованным раствором заполняют в асептических условиях в стерильные флаконы или предварительно заполняемые шприцы и закрывают эластомерной пробкой, соответствующими ограничителем хода поршня и колпачками наконечников.
10. Заполненные первичные контейнеры осматривают на дефекты и видимые частицы.
11. Предварительно заполненные шприцы собирают с соответствующими компонентами устройства, упаковывают в стерильную защитную систему и стерилизуют по наружной поверхности.
12. Флаконы и стерилизованные шприцы упаковывают в окончательную вторичную упаковку.
Фармацевтические составы согласно настоящему изобретению также могут быть в лиофилизированной форме или в жидком виде, восстановленном из лиофилизированной формы. «Лиофилизированную форму» изготавливают путем способов лиофильной сушки, известных в данной области. Лиофилизат обычно имеет остаточное содержание влаги приблизительно 0,1-5% (масс./масс.) и находится в виде порошка или физически стабильного осадка. «Восстановленную форму» можно получать из лиофилизата путем быстрого растворения после добавления среды для восстановления. Подходящие среды для восстановления включают, помимо прочего, воду для инъекции (ВДИ), бактериостатическую воду для инъекции (БВДИ), растворы хлорида натрия (например, 0,9% (масс./об.) NaCl) и растворы глюкозы (например, 5% (масс./об.) глюкозы).
Получение антител
Антитела к VEGF/ANG2, которые особенно пригодны для настоящего изобретения, получают рекомбинантными средствами. Способы рекомбинантного получения широко известны в уровне техники и включают экспрессию белков в клетках прокариот и эукариот с последующим выделением антитела и обычно очисткой до фармацевтически приемлемой чистоты. Для экспрессии антител, как указано выше в клетке-хозяине, нуклеиновые кислоты, кодирующие соответствующие модифицированные легкие и тяжелые цепи, вставляют в векторы экспрессии стандартными методами. Экспрессию проводят в соответствующих клетках-хозяевах прокариот или эукариот, таких как клетки СНО, клетки NSO, клетки SP2/0, клетки НЕК293, клетки COS, клетки PER.C6, дрожжи или клетки E.coli, и выделяют антитело из клеток (супернатанта или клеток после лизиса). Общие методы рекомбинантного получения антител хорошо известны в данной области и описаны, например, в обзорных статьях Makrides, S.C., Protein Expr. Purif. 17 (1999) 183-202; Geisse, S., et al, Protein Expr. Purif. 8 (1996) 271-282; Kaufman, R.J., Mol. Biotechnol 16 (2000) 151-160; Werner, R.G., Drug Res. 48 (1998) 870-880. Способ получения антитела, пригодный в настоящем изобретении, включает шаги а) трансформация клетки-хозяина векторами, содержащими молекулы нуклеиновых кислот, кодирующих указанное антитело; б) культивацию клетки-хозяина при условиях, которые обеспечивают синтез указанной молекулы антитела; и в) выделение указанной молекулы антитела из указанной культуры.
Антитела удобно отделять от культуральной среды с помощью традиционных процедур очистки иммуноглобулина, таких как, например, хроматография с протеином А-сефарозой, с гидроксиапатитом, гель-электрофорез, диализ или аффинная хроматография. ДНК и РНК, кодирующие моноклональные антитела, легко выделять и секвенировать при помощи обычных процедур. Клетки гибридомы могут служить в качестве источника такой ДНК и РНК. Как только выделена, ДНК может быть вставлена в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, такие как клетки НЕК 293, клетки СНО или клетки миеломы, которые в ином случае не продуцируют белок-иммуноглобулин, с получением синтеза рекомбинантных моноклональных антител в клетках-хозяевах.
Варианты аминокислотных последовательностей (или мутанты) биспецифического антитела получают путем введения соответствующих изменений нуклеотидов в ДНК антитела или путем нуклеотидного синтеза. Такие модификации можно проводить, однако, только в очень ограниченном диапазоне. Например, модификации не изменяют вышеуказанные характеристики антитела, такие как изотип IgG и связывание антигена, но могут улучшать выход рекомбинантного получения, стабильность белка или облегчать очистку.
Термин «клетка-хозяин» при использовании в настоящей заявке означает любой вид клеточной системы, который можно сконструировать для создания антител, содержащихся в составе настоящего изобретения. В одном варианте реализации клетки НЕК293 и клетки СНО используют в качестве клеток-хозяев.
При использовании в настоящем документе выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первично измененные клетки и культуры, полученные из них, вне зависимости от числа переносов. Также понятно, что все потомство может не быть точно идентичным в отношении содержания ДНК из-за намеренных или случайных мутаций. Включено потомство вариантов, которое имеет такую же функцию или биологическую активность, в отношении которых проводится скрининг изначально трансформированных клеток.
Экспрессия в клетках NS0 описана, например, в Barnes, L.M., et al, Cytotechnology 32 (2000) 109-123; Barnes, L.M., et al, Biotech. Bioeng. 73 (2001) 261-270. Временная экспрессия описана, например, в Durocher, Y., et al, Nucl. Acids. Res. 30 (2002) E9. Клонирование вариабельных доменов описано в Orlandi, R., et al, Proc. Natl. Acad. Sci. USA 86 (1989) 3833-3837; Carter, P., et al, Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Norderhaug, L., et al, J. Immunol. Methods 204 (1997) 77-87. Предпочтительная система временной экспрессии (НЕК 293) описана Schlaeger, E.-J., и Christensen, К., в Cytotechnology 30 (1999) 71-83 и Schlaeger, E.-J., в J. Immunol. Methods 194 (1996) 191-199.
Например, регуляторные последовательности, которые подходят для прокариот, включают промотор, необязательно последовательность оператора и сайт связывания рибосомы. Известно, что эукариотические клетки используют промоторы, энхансеры и сигналы полиаденилирования.
Нуклеиновая кислота является «функционально связанной», когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для предпоследовательности или секреторной лидерной последовательности функционально связана с ДНК для полипептида, если она экспрессируется в виде белка-предшественника, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчить трансляцию. Как правило, «функционально связанный» означает, что последовательности ДНК, являющиеся связанными, являются смежными и, в случае секреторной лидерной последовательности, смежными и находятся в рамке считывания. Однако энхансеры не должны быть смежными. Связывание осуществляется путем лигирования в удобных сайтах рестрикции. Если таких сайтов не существует, синтетические олигонуклеотидные адаптеры или линкеры используются в соответствии с общепринятой практикой.
Очистку антител проводят для исключения компонентов клеток или других загрязняющих веществ, например, других нуклеиновых кислот или белков клеток, стандартными технологиями, включая обработку щелочью/ДСН, CsCl-бэндинг, колоночную хроматографию, электрофорез в агарозном геле и другие, хорошо известные в данной области. См. Ausubel, F., et al, ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, New York (1987). Для очистки белков разработаны и нашли широкое распространение различные методы, такие как аффинная хроматография с использованием белков микроорганизмов (например, аффинная хроматография на белке А или белке G), ионообменная хроматография (например, катионообменная (карбоксиметиловые смолы), анионообменная (аминоэтиловые смолы) хроматография и хроматография со смешанной формой разделения), тиофильная адсорбция (например, с бета-меркаптоэтанолом и другими SH-лигандами), хроматография на основе гидрофобного взаимодействия или адсорбционная хроматография ароматических соединений (например, с фенил-сефарозой, аза-аренофильными смолами или м-аминофенилбороновой кислотой), металлхелатирующая аффинная хроматография (например, с материалом, обладающим аффинностью к Ni(II) и Cu(II)), гель-фильтрация и электрофоретические методы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi, М.А., Appl. Biochem. Biotech. 75 (1998) 93-102).


Далее перечислены варианты реализации настоящего изобретения:
1. Жидкий фармацевтический состав, содержащий:
- от 20 до 150 мг/мл биспецифического антитела к VEGF/ANG2, содержащего константную область тяжелой цепи подкласса IgG1 человека (в одном варианте реализации 30 мг/мл ± 4,5 мг/мл или 120 мг/мл ± 18 мг/мл),
- от 15 до 35 мМ хлорида натрия (в одном варианте реализации 25 мМ ± 5 мМ; в одном варианте реализации 25 мМ ± 3,75 мМ хлорида натрия; в частности, 25 мМ ± 2,5 мМ хлорида натрия),
- от 15 до 25 мМ гистидин-ацетатного буфера (в одном варианте реализации 20 мМ ± 3 мМ гистидин-ацетатного буфера; в одном варианте реализации 20 мМ ± 2 мМ гистидин-ацетатного буфера),
при рН 5,5±0,5 (в одном варианте реализации при рН 5,5±0,3; в частности, при рН 5,5±0,2);
где биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в вариабельном домене тяжелой цепи CDR3H-область с SEQ ID NO: 1, CDR2H-область с SEQ ID NO: 2 и CDR1H-область с SEQ ID NO: 3, а в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 4, CDR2L-область с SEQ ID NO: 5 и CDR1L-область с SEQ ID NO: 6; и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в вариабельном домене тяжелой цепи CDRSH-область с SEQ ID NO: 9, CDR2H-область с SEQ ID NO: 10 и CDR1H-область с SEQ ID NO: 11, и в вариабельном домене легкой цепи CDR3L-область с SEQ ID NO: 12, CDR2L-область с SEQ ID NO: 13 и CDR1L-область с SEQ ID NO: 14, и где
iii) биспецифическое антитело содержит константную область тяжелой цепи подкласса IgG1 человека, содержащую мутации 1253А, Н310А и Н435А и мутации L234A, L235A и P329G (нумерация согласно EU-индексу Кабата).
2. Фармацевтический состав согласно варианту реализации 1, в котором
биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
i) указанный первый антигенсвязывающий сайт, специфически связывающийся с VEGF, содержит в качестве вариабельного домена тяжелой цепи VH аминокислотную последовательность SEQ ID NO: 7, а в качестве вариабельного домена легкой цепи VL - аминокислотную последовательность SEQ ID NO: 8, и
ii) указанный второй антигенсвязывающий сайт, специфически связывающийся с ANG-2, содержит в качестве вариабельного домена тяжелой цепи VH аминокислотную последовательность SEQ ID NO: 15, а в качестве вариабельного домена легкой цепи VL - аминокислотную последовательность SEQ ID NO: 16.
3. Фармацевтический состав согласно варианту реализации 2, в котором биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит первый антигенсвязывающий сайт, который специфически связывается с VEGF человека, и второй антигенсвязывающий сайт, который специфически связывается с ANG-2 человека, где
iv) в константной области тяжелой цепи мутации S354C и T366W содержатся в одном домене СН3, а мутации Y349C, T366S, L368A и Y407V содержатся в другом домене СН3 (нумерация согласно EU-индексу Кабата).
4. Фармацевтический состав согласно любому одному из вариантов реализации 1-3, в котором биспецифическое антитело к VEGF/ANG2 является двухвалентным и содержит аминокислотные последовательности SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20.
5. Фармацевтический состав согласно любому одному из вариантов реализации 1-3, в котором биспецифическое антитело к VEGF/ANG2 представляет собой фарицимаб.
6. Фармацевтический состав согласно варианту реализации 1, причем состав содержит
- 120 мг/мл ± 18 мг/мл биспецифического антитела к VEGF/ANG2 (в частности, 120 мг/мл ± 12 мг/мл биспецифического антитела к VEGF/ANG2).
7. Фармацевтический состав по любому одному из пп. 1-7 для интравитреального введения.
8. Фармацевтический состав согласно любому одному из вариантов реализации 1-6, причем состав по существу не содержит видимые частицы.
9. Фармацевтический состав согласно любому одному из вариантов реализации 1-8, причем состав дополнительно содержит
- от 1 до 20 мМ по меньшей мере одного стабилизатора (в одном варианте реализации выбранного из сахаров, полиолов и аминокислот).
10. Фармацевтический состав согласно любому одному из вариантов реализации 1-8, причем состав дополнительно содержит
- 7,0 мМ ± 2,0 мМ метионина (в одном варианте реализации 7,0 мМ ± 1,0 мМ метионина; в одном варианте реализации 7,0 мМ ± 0,7 мМ метионина).
11. Фармацевтический состав согласно любому одному из вариантов реализации 1-10, причем состав дополнительно содержит
- 0,01-0,07% поверхностно-активного вещества (в одном варианте реализации выбранного из полисорбата 20, полисорбата 80 или полоксамера).
12. Фармацевтический состав согласно любому одному из вариантов реализации 1-10, причем состав дополнительно содержит
- 0,04% (масс./об.) ± 0,02 (масс./об.) полисорбата 20 (в одном варианте реализации от 0,03% (масс./об.) до 0,07% (масс./об.)); в одном варианте реализации 0,04% (масс./об.) ± 0,01 (масс./об.); в одном варианте реализации приблизительно 0,04% (масс./об.)).
13. Фармацевтический состав согласно любому одному из вариантов реализации 1-12, причем состав дополнительно содержит
- 50-250 мМ регулятора тоничности (в одном варианте реализации регулятор тоничности выбирают из сахарозы, трегалозы и сорбита).
14. Фармацевтический состав согласно любому одному из вариантов реализации 1-12, причем состав дополнительно содержит
- 160 мМ ± 24 мМ сахарозы (в одном варианте реализации 160 мМ ± 16 мМ; в одном варианте реализации приблизительно 160 мМ).
15. Фармацевтический состав согласно любому одному из вариантов реализации 1-14, причем состав имеет вязкость 20 мПа⋅с или менее (в одном варианте реализации 17 мПа⋅с или менее; в одном варианте реализации 16 мПа⋅с или менее, в одном варианте реализации приблизительно 15 мПа⋅с или менее; в одном варианте реализации 15 мПа⋅с или менее).
16. Фармацевтический состав согласно любому одному из вариантов реализации 1-15, причем состав имеет мутность 30 ЕМФ или менее (в одном варианте реализации 27 ЕМФ или менее; в одном варианте реализации 26 ЕМФ или менее; в одном варианте реализации приблизительно 25 ЕМФ или менее; в одном варианте реализации 25 ЕМФ или менее).
17. Фармацевтический состав согласно любому одному из вариантов реализации 1-16, причем состав имеет ионную силу от 20 до 50 (в одном варианте реализации ионную силу от 30 до 50 (в одном варианте реализации ионную силу от 30 до 45; в одном варианте реализации ионную силу 30±10).
18. Фармацевтический состав согласно любому одному из вариантов реализации 1-17 для интравитреального введения, причем состав по существу не содержит хлорид кальция (или не содержит хлорид кальция).
19. Фармацевтический состав согласно любому одному из вариантов реализации 1-17 для интравитреального введения, причем состав по существу не содержит аргинин (или не содержит аргинин).
20. Фармацевтический состав согласно любому одному из вариантов реализации 1-17 для интравитреального введения, причем состав по существу не содержит аргинин и хлорид кальция (или не содержит аргинин и хлорид кальция).
21. Фармацевтический состав согласно любому одному из вариантов реализации 1-5 и 7-20, причем состав содержит или состоит (по меньшей мере) из следующих компонентов:
- от 20 до 150 мг/мл биспецифического антитела к VEGF/ANG2 (в одном варианте реализации 30 мг/мл ± 4,5 мг/мл или 120 мг/мл ± 18 мг/мл, в частности, 120 мг/мл ± 12 мг/мл);
- от 15 до 35 мМ хлорида натрия (в одном варианте реализации 25 мМ ± 5 мМ; в одном варианте реализации 25 мМ ± 3,75 мМ хлорида натрия; в частности, 25 мМ ± 2,5 мМ хлорида натрия);
- от 15 до 25 мМ гистидин-ацетатного буфера (в одном варианте реализации 20 мМ ± 3 мМ гистидин-ацетатного буфера; в одном варианте реализации 20 мМ ± 2 мМ гистидин-ацетатного буфера);
- 7,0 мМ ± 2,0 мМ метионина (в одном варианте реализации 7,0 мМ ± 1,0 мМ метионина; в одном варианте реализации 7,0 мМ ± 0,7 мМ метионина);
- от 0,03% (масс./об.) до 0,07% (масс./об.) полисорбата 20 (в одном варианте реализации 0,04% (масс./об.) ± 0,02 (масс./об.); в одном варианте реализации 0,04% (масс./об.) ± 0,01 (масс./об.); в одном варианте реализации приблизительно 0,04% (масс./об.));
- 160 мМ ± 24 мМ сахарозы (в одном варианте реализации 160 мМ ± 16 мМ; в одном варианте реализации приблизительно 160 мМ);
- вода (для (офтальмологических) инъекций);
при рН 5,5±0,5 (в одном варианте реализации при рН 5,5±0,3; в частности, при рН 5,5±0,2);
22. Фармацевтический состав согласно любому одному из вариантов реализации 1-21, причем состав представляет собой стабильный состав.
23. Фармацевтический состав согласно любому одному из вариантов реализации 1-21, в котором содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 10% через 8 недель при 25°С или через 52 недели при 25°С (в одном варианте реализации менее 5%).
24. Фармацевтический состав согласно любому одному из вариантов реализации 1-21, причем главный пик биспецифического антитела в фармацевтическом составе составляет более 50%, и содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 10% через 2 года при 2-8°С (или через 3 года при 2-8°С) (главный пик биспецифического антитела в фармацевтическом составе составляет более 55%, и содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 7% через 2 года при 2-8°С (или через 3 года при 2-8°С)).
25. Фармацевтический состав согласно любому одному из вариантов реализации 1-24, причем осмоляльность состава составляет 300±100 мОсм/кг (в одном варианте реализации 300±50 мОсм/кг).
26. Фармацевтический состав согласно любому одному из вариантов реализации 1-25 для применения в лечении сосудистого заболевания глаз.
27. Фармацевтический состав для применения согласно варианту реализации 26, где сосудистые заболевания глаз выбраны из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), макулярной дегенерации, влажной формы возрастной макулярной дегенерации (влажной ВМД), ретинопатии недоношенных (РН), неоваскулярной глаукомы, пигментного ретинита (ПР), ретинальной ангиоматозной пролиферации, макулярной телеангиэктазии, ишемической ретинопатии, неоваскуляризации радужной оболочки, внутриглазной неоваскуляризации, неоваскуляризации роговицы, неоваскуляризации сетчатки, хориоидальной неоваскуляризации и дегенерации сетчатки, в частности из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), влажной формы возрастной макулярной дегенерации (влажной ВМД).
28. Фармацевтический состав для применения согласно варианту реализации 26, причем сосудистое заболевание глаз представляет диабетическую ретинопатию.
29. Фармацевтический состав для применения согласно варианту реализации 26, причем сосудистое заболевание глаз представляет диабетический макулярный отек (ДМО).
30. Фармацевтический состав для применения согласно варианту реализации 26, причем сосудистое заболевание глаз представляет окклюзию вены сетчатки (ОВС).
31. Фармацевтический состав для применения согласно варианту реализации 26, причем окклюзия вены сетчатки представляет окклюзию центральной вены сетчатки (ОЦВС).
32. Фармацевтический состав для применения согласно варианту реализации 26, причем сосудистое заболевание глаз представляет макулярную дегенерацию.
33. Фармацевтический состав для применения согласно варианту реализации 26, причем макулярная дегенерация представляет возрастную макулярную дегенерацию (ВМД).
34. Фармацевтический состав для применения согласно варианту реализации 26, причем макулярная дегенерация представляет влажную форму возрастной макулярной дегенерации (вВМД) (также называемой неоваскулярной возрастной макулярной дегенерацией (нВМД).
35. Фармацевтический состав для применения согласно варианту реализации 26, причем сосудистое заболевание глаз представляет хориоидальную неоваскуляризацию.
36. Способ получения фармацевтического состава по любому одному из вариантов реализации 1-25, причем
способ включает такие шаги:
- замена буфера основного объема раствора биспецифического антитела а) на буфер для диафильтрации путем ультрафильтрации и диафильтрации или б) путем диализа при помощи буфера для диализа, причем буферы содержат гистидин-ацетатный буфер, или гистидин-ацетатный буфер и хлорид натрия, или гистидин-ацетатный буфер, хлорид натрия и метионин, или гистидин-ацетатный буфер, хлорид натрия, метионин и сахарозу;
- концентрирование основного объема раствора с замененным буфером путем ультрафильтрации;
- регулирование готовой композиции фармацевтического состава путем добавления исходных растворов соответствующих вспомогательных веществ или при помощи соответствующего стабилизирующего буфера и гомогенизация жидкого фармацевтического состава путем перемешивания.
37. Флакон, содержащий фармацевтический состав по любому одному из вариантов реализации 1-25.
38. Предварительно заполненный шприц, содержащий фармацевтический состав по любому одному из вариантов реализации 1-25.
39. Лиофилизированная форма жидкого фармацевтического состава по любому одному из вариантов реализации 1-25.
Примеры
Жидкие фармацевтические составы лекарственных средств для интравитреального (ИВТ) введения согласно настоящему изобретению были разработаны следующим образом.
Пример 1: Материалы и способы
Биспецифическое антитело к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаб), полученное и очищенное, как описано в WO 2014/009465, предоставляли для дальнейших экспериментов исходно в концентрации приблизительно 130-140 мг/мл в 20 мМ гистидин-HCl буфера при рН 5,5.
Краткое описание материалов (включая поставщика), используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
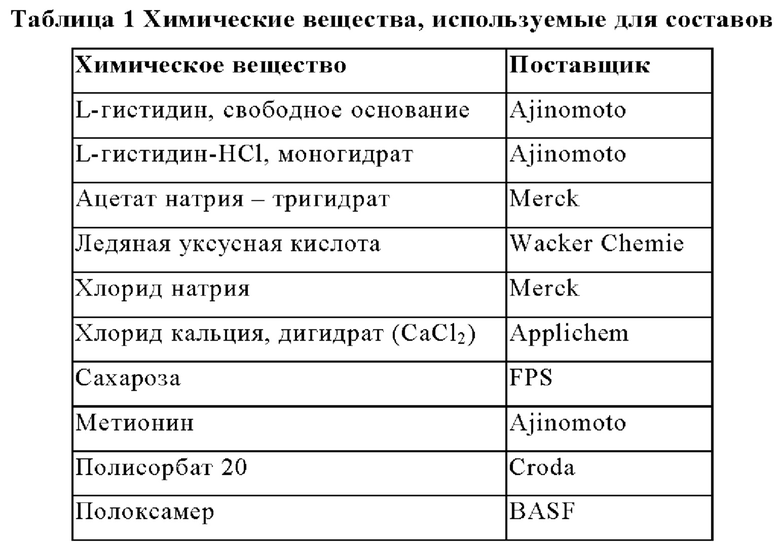
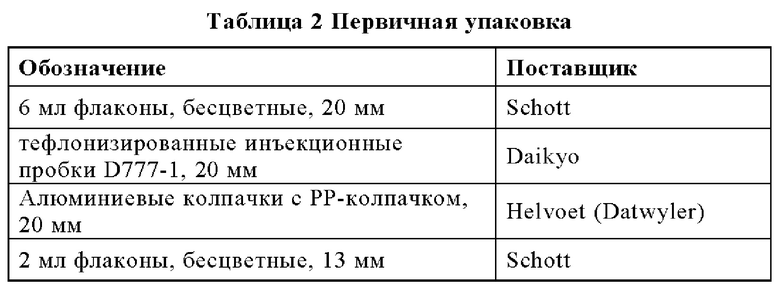
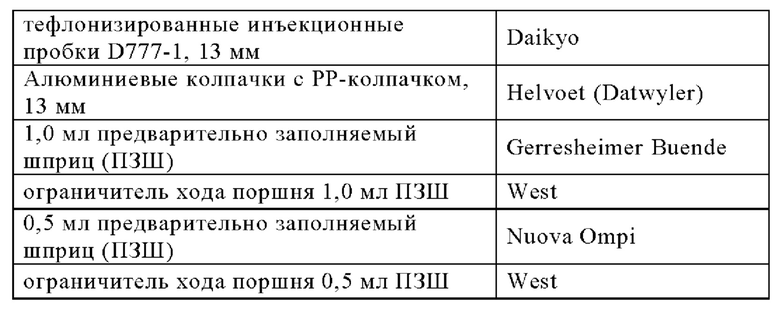
Укупорочная система контейнера
Бесцветный 2 мл или 6 мл стеклянный флакон (стекло 1 типа), закрытый посредством резиновой пробки (D 777-1, 13 мм) и алюминиевой дополнительной укупорки с предохранительным колпачком.
Бесцветный 1,0 мл предварительно заполняемый шприц (стекло 1 типа) с насадкой Люэра, закрытый посредством колпачка наконечника Gerresheimer Buende TELC и ограничителя хода поршня West 4023/50.
Бесцветный 0,5 мл предварительно заполняемый шприц (стекло 1 типа) с насадкой Люэра, закрытый посредством колпачка наконечника Vetter OVS и ограничителя хода поршня West 4023/50. Колпачок наконечника Vetter OVS состоит из эластомера West 4023/50.
Эксклюзионная хроматография (ЭХ-ВЭЖХ)
Эксклюзионную хроматографию (ЭХ) использовали для обнаружения растворимых высокомолекулярных соединений (агрегатов) и низкомолекулярных продуктов гидролиза (НМ) в составах. Метод проводили при помощи TSK-Gel G3000SWXL, 7,8 × 300 мм, 5 мкм (Tosoh Bioscience, №по каталогу 08541) или BioSuite 250, 7,8 × 300 мм или 5 мкм (Waters, №по каталогу 186002165). Интактный мономер, агрегаты и фрагменты разделяли по профилю изократического элюирования, используя 0,2 М фосфат калия, 0,25 М KCl, рН 7,0 в качестве подвижной фазы, и обнаруживали при длине волны 280 нм.
Ионообменная хроматография (ИО-ВЭЖХ)
Ионообменную хроматографию (ИОХ) проводили для обнаружения продуктов химического разложения, изменяющих полный заряд тестируемого антитела в составах. Метод проводили при помощи колонки YMC BioPro SP-F, 100 × 4,6 мм, 5 мкм (YMC, номер по каталогу SF00S05-1046WP). 20 мМ BES (N,N-бис[2-гидроксиэтил]-2-аминоэтансульфоновая кислота), рН 6,8, использовали в качестве элюента А, а 20 мМ BES, 488 мМ NaCl, рН 6,8 в качестве элюента В, соответственно, при скорости потока 0,8 мл/мин. Образцы разводили элюентом А до 3 мг/мл перед впрыском в колонку.
Программа градиента:
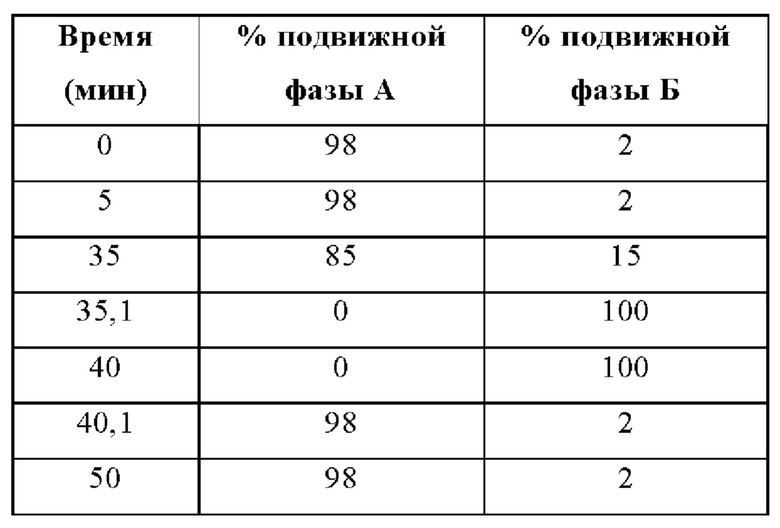
Мутность (в ЕМФ (=единица мутности по формазину))
Мутность образцов состава измеряли на турбидиметре Hach 2100 AN согласно Европейской фармакопее 2.2.1 (Прозрачность и степень опалесценции жидкостей). Объем образца приблизительно 2 мл раствора образца переносят в стеклянную кювету с внутренним диаметром 11 мм. Стеклянную кювету помещают в турбидиметр и мутность измеряют относительно калибровочной кривой эталонных суспензий 1 ЕМФ, 3 ЕМФ, 10 ЕМФ, 20 ЕМФ и 100 ЕМФ.
Вязкость (в мПа)
Вязкость образцов состава измеряли на ротационном реометре Anton Paar Physica MCR 301 с 25 мм - конусом 0,5° при скорости сдвига 1000 с-1 и температуре 20°С.
Видимые частицы
Образцы во флаконах визуально осматривали на контрольно-измерительной машине Seidenader V90-T с помощью 2 х увеличительной линзы. Источники освещения L1, L2 и L3 доводили до установки 5. Образцы флаконов изучали при вращательном движении на наличие частиц.
Концентрация белка (в мг/мл)
Концентрацию белка в образцах состава измеряли путем поглощения ультрафиолетового (УФ) излучения на фотометре для ультрафиолетовой и видимой части спектра Lambda 35 от Perkin Elmer. Образцы состава разбавляли при помощи 20 мМ раствора L-гистидин-ацетатного буфера рН 5,5 до концентрации белка приблизительно 0,5 мг/мл и набирали в кювету для измерения с толщиной 1 см. УФ-поглощение кюветы для измерения измеряли при длине волны 280 и 320 нм.
Концентрацию белка рассчитывали из измеренных поглощений УФ-излучения при 280 (А280) и 320 нм (А320), коэффициенте экстинкции (Е) 1,70 мл/(мг × см), толщине (d) 1 см и коэффициенте разведения (КР), соответствующем фактическому разбавлению, согласно следующему уравнению:
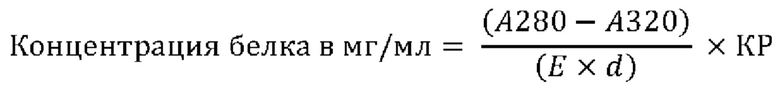
Осмоляльность
Осмоляльность образцов состава измеряли на осмометре Osmomat 030 3Р от Gonotec согласно принципу понижения температуры замерзания. рН
рН образцов составов определяли потенциометрией со стеклянным электродом.
Пример 2: Отбор I рН/буфера Установка
Целью отбора рН/буфера был выбор оптимального рН и буфера для коммерческого состава антитела к VEGF/ANG2 и выбор состава с низкой вязкостью, сниженной мутностью и хорошей стабильностью, что дает низкое образование растворимых агрегатов и заряженных изоформ.
Первая часть отбора рН/буфера включала три буферные системы L-гистидин/ L-гистидин-HCl (His/His-HCl), L-гистидин-ацетат (His/ацетат) и ацетат натрия (Na/ацетат), диапазон рН от 5,3 до 6,5, диапазоны буферной силы от 7 до 300 мМ и диапазон ионной силы от 5 до 86. Установка активных составов показана в таблице 3.
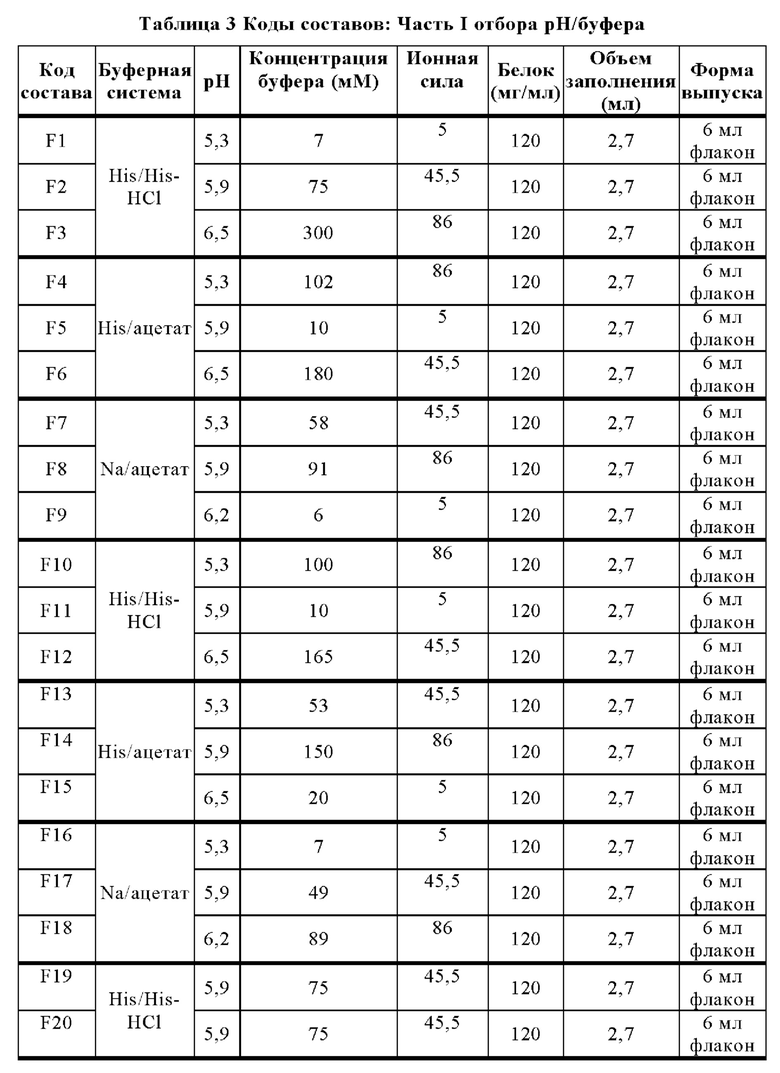
Материал и методы
Краткое описание материалов, используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
В лекарственном веществе заменяли буфер путем диализа, используя Slide-A-Lyzer G2 (Thermo Scientific) с отсечением по молекулярной массе 10 кДа, на буферные системы, перечисленные в таблице 3. Таким образом, 42 мл лекарственного вещества вводили в устройство для диализа и заменяли буфер трижды на 5 л буфера для диализа.
Необязательно, если концентрация белка была менее 120 мг/мл после диализа, лекарственное вещество концентрировали центрифугированием при помощи устройства Amicon Ultra 15, Ultracel 10К (Millipore) (20°C, 4000 об/мин).
Затем диализированное и необязательно концентрированное лекарственное вещество разводили соответствующим буфером для диализа до целевой концентрации белка 120 мг/мл, что давало конечный раствор лекарственного вещества.
Каждый раствор лекарственного вещества фильтровали через 0,22 мкм фильтр Sterivex GV (Millipore) и набирали в чистые и стерильные 6 мл флаконы с объемом заполнения 2,7 мл. Флаконы закрывали пробками и обжимали.
Аналитические методы
Аналитические методы тестирования мутности и вязкости описаны в примере 1.
Результаты
Фиг. 1 сравнивает результаты мутности и вязкости составов из отбора I рН/буфера.
В общем, составы с высокой ионной силой (например 4, 14, 10, 3, 8 и 18) показывают высокую мутность (свыше 30 ЕМФ) и низкую вязкость (приблизительно 10 мПа⋅с). Напротив, составы с низкой ионной силой имеют высокую вязкость (приблизительно 25-40 мПа⋅с) и низкую мутность (ниже 10 ЕМФ). Неожиданно, что составы с буферной системой гистидин-ацетата (13, 6, 4, 14) можно идентифицировать с низкими вязкостями приблизительно 10 мПа⋅с и мутностью менее 25 ЕМФ.
Вывод
Измеряли вязкость и мутность составов из отбора I рН/буфера. Неожиданно, что составы гистидин-ацетатной буферной системы и с ионной силой 45,5 или выше показали низкую вязкость и сниженные значения мутности.
Пример 3: Отбор II рН/буфера
Установка
Целью отбора рН/буфера был выбор оптимального рН и буфера для состава антитела к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаб) и выбор состава с низкой вязкостью, сниженной мутностью и хорошей стабильностью, что дает низкое образование растворимых агрегатов и заряженных изоформ.
Вторая часть отбора рН/буфера была разработана на основе результата отбора I рН/буфера и включала буферную систему L-гистидин-ацетат (His/ацетат), диапазон рН от 5,5 до 6,0 с диапазоном буферной силы от 14 до 59 мМ. Ионную силу составов изменяли или путем повышения буферной силы, или путем добавления хлорида натрия (NaCl) или хлорида кальция (Са С12), что давало диапазон ионной силы от 10 до 50. Установка активных составов показана в таблице 4.
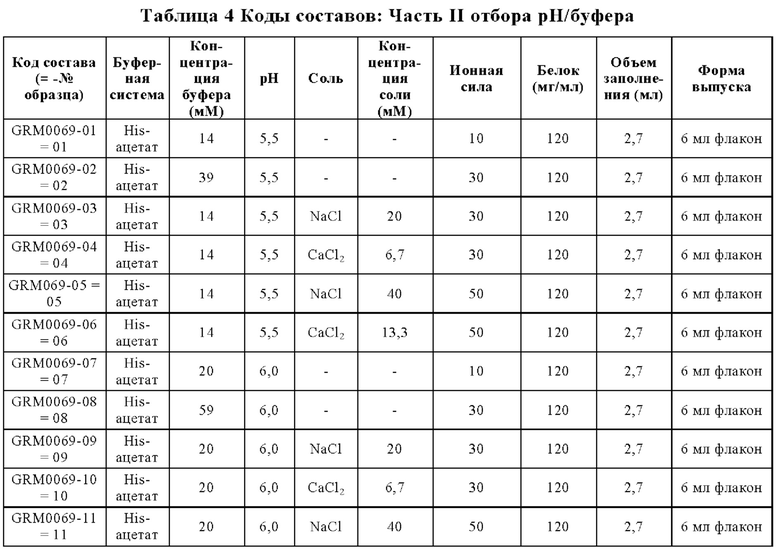
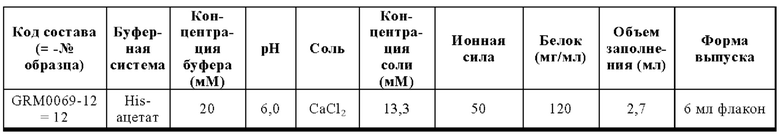
Материал и методы
Краткое описание материалов, используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
В лекарственном веществе заменяли буфер при помощи ультрафильтрации-диафильтрации, используя полупроницаемую мембрану Labscale TTF (Millipore) с отсечением по молекулярной массе 30 кДа, на буферные системы, как перечислено в таблице 4. Таким образом, 120 мл лекарственного вещества вводили в систему Labscale и заменяли буфер на 1050 мл буфера для диафильтрации.
После замены буфера лекарственное вещество концентрировали в системе Labscale до концентрации белка приблизительно 150 мг/мл.
Затем концентрированное лекарственное вещество разводили исходными растворами соответствующего буфера и солевыми растворами до целевой концентрации белка 120 мг/мл, что давало конечный раствор лекарственного вещества согласно таблице 4.
Каждый раствор лекарственного вещества фильтровали через 0,22 мкм фильтр Sterivex GV (Millipore) и набирали в чистые и стерильные 6 мл флаконы с объемом заполнения 2,7 мл. Флаконы закрывали пробками и обжимали.
Аналитические методы
Аналитические методы тестирования мутности, вязкости и ЭХ-ВЭЖХ описаны в примере I.
Программа для стабильности
Составы сохраняли стабильность при 2-8°С и 25 в течение 8 недель. Образцы отбирали и анализировали в начале испытания на стабильность и через 8 недель хранения.
Результаты
Фиг. 2 сравнивает результаты мутности и вязкости второй части отбора рН/буфера. В общем, мутность повышается при повышении ионной силы и при рН 6,0 по сравнению с рН 5,5. Кроме того, присутствие хлорида натрия также приводит к большей мутности. рН 5,5 также снижает вязкость по сравнению с рН 6. Кроме того, ионная сила по меньшей мере 30 способствует снижению вязкости до уровня приблизительно 15 мПа⋅с. При сравнении действия различных солей на вязкость хлорид кальция или большая буферная сила являются более эффективными для снижения вязкости, чем хлорид натрия.
Учитывая обе цели, снижение мутности и вязкости, состав с ионной силой по меньшей мере 30 и рН 5,5 показывает сниженный уровень мутности приблизительно 20 ЕМФ и вязкость приблизительно 15 мПа⋅с.
Фиг. 3 сравнивает уровни агрегатов (ВМС) составов отбора II рН/буфера в начале (=0) с уровнями через 8 недель при 5°С и 25°С. В общем, уровни ВМС повышаются с увеличением ионной силы. Если сравнивать влияние различных солей, высокая буферная сила или присутствие хлорида натрия приводит к более низкому увеличению агрегатов, чем присутствие хлорида натрия. Более низкий рН 5,5 имеет небольшое влияние на снижение образования агрегатов.
Вывод
Состав с рН 5,5 и ионной силой 30 обеспечивает оптимум со сниженной мутностью, низкой вязкостью и сниженным образованием агрегатов. Ионную силу можно регулировать при помощи большей буферной силы или добавления солей хлорида натрия и хлорида кальция. В общем, более высокая буферная сила или присутствие хлорида кальция демонстрируют предпочтительные свойства мутности и вязкости.
Пример 4: Отбор поверхностно-активного вещества
Установка
Целью отбора поверхностно-активного вещества является выбор оптимального типа поверхностно-активного вещества и концентрации поверхностно-активного вещества для состава антитела к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаба).
Матрица состава из 120 мг/мл антитела к VEGF/Ang-2, 20 мМ L-гистидин-ацетатного буфера при рН 5,5, 25 мМ хлорида натрия и 180 мМ сахарозы основана на результате отборов I и II рН/буфера и для обеспечения изотоничного состава с целевой осмоляльностью 300±50 мОсм/кг.
При отборе поверхностно-активного вещества исследовали стабилизирующий эффект поверхностно-активных веществ полисорбата 20 и полоксамера 188 при различных концентрациях поверхностно-активного вещества от 0,01 до 0,07% на антитело к Vegf-Ang2. Кроме того, исследовали состав без поверхностно-активного вещества.
В таблице 5 подытожены тестовые составы отбора поверхностно-активного вещества.
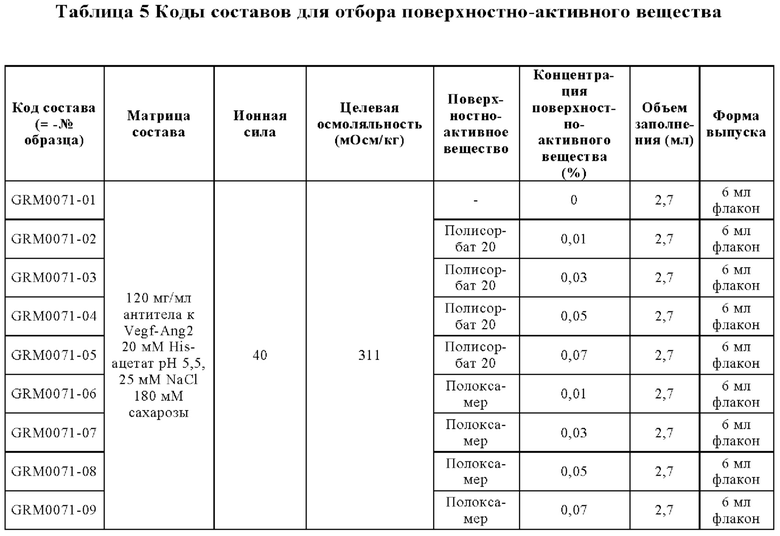
Материал и методы
Краткое описание материалов, используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
В лекарственном веществе заменяли буфер при помощи ультрафильтрации-диафильтрации, используя полупроницаемую мембрану Labscale TTF (Millipore) с отсечением по молекулярной массе 30 кДа, на 20 мМ гистидин-ацетатного буфера для диафильтрации с рН 5,3. Таким образом, 250 мл лекарственного вещества вводили в систему Labscale и заменяли буфер на 1700 мл буфера для диафильтрации.
После замены буфера лекарственное вещество концентрировали в системе Labscale до концентрации белка приблизительно 170 мг/мл и рН приблизительно 5,5.
Затем концентрированное лекарственное вещество разводили исходными растворами соответствующего буфера и солевыми растворами до целевой концентрации белка 120 мг/мл, что давало конечный раствор лекарственного вещества согласно таблице 5.
Каждый раствор лекарственного вещества фильтровали через 0,22 мкм фильтр Sterivex GV (Millipore) и набирали в чистые и стерильные 6 мл флаконы с объемом заполнения 2,7 мл. Флаконы закрывали пробками и обжимали.
Аналитические методы
Аналитические методы тестирования концентрации белка, рН, осмоляльности, мутности, вязкости, видимых частиц и ЭХ-ВЭЖХ описаны в примере I.
Программа для стабильности
При испытании поверхностно-активного вещества на механический стресс при отборе применяли условия горизонтального встряхивания в течение 1 недели при 2-8°С (200 об/мин), горизонтального встряхивания в течение 1 недели при 25°С (200 об/мин) и 5 циклов замораживания-размораживания (-40°С/5°С).
Результаты
В таблице 6 подытожены исходные результаты образцов отбора поверхностно-активного вещества. Все составы имели концентрацию белка приблизительно 120 мг/мл и рН 5,5±0,1. Измеренная осмоляльность составляла от 335 до 350 мОсм/кг и, таким образом, была несколько выше, чем целевая 311 мОсм/кг.Выбранная матрица состава из 120 мг/мл Vegf-Ang2 с 20 мМ гистидин-ацетатного буфера при рН 5,5 плюс 25 мМ хлорида натрия и 180 мМ сахарозы давала низкие вязкости приблизительно 15 мПа⋅с и сниженную мутность 20 ЕМФ.
Составы отбора поверхностно-активного вещества подвергали стрессу вследствие встряхивания при 5°С и 25°С и стрессу вследствие замораживания-размораживания (пять циклов замораживания-размораживания) и анализировали на видимые частицы и растворимые агрегаты (ВМЧ).
В таблице 7 подытожены результаты для видимых частиц в начале и после физического стресса. Все образцы составов вначале не содержали частицы. После воздействия различных физических стрессов состав GRM0071-01 без поверхностно-активного вещества всегда показывал множество частиц.
Добавление по меньшей мере 0,01% полисорбата 20 предотвращает образование видимых частиц при воздействии трех методов обеспечения физического стресса.
Неожиданно, что добавление полоксамера не может предотвратить образование видимых частиц после воздействия встряхивания в течение 1 недели при 5°С, тогда как он мог защищать белок от встряхивания при 25°С и стресса вследствие замораживания-размораживания.
Фиг. 4 показывает уровни растворимых агрегатов (ВМЧ) исходных образцов и подвергнутых стрессу образцов. Состав GRM0071-01 (1) без поверхностно-активного вещества был чувствительным к стрессу вследствие встряхивания и продемонстрировал повышенные уровни агрегатов до 10% через 1 неделю встряхивания при 5°С и 25°С. Присутствие 0,01% полисорбата 20 не было достаточным для полного предотвращения увеличения количества растворимых агрегатов через 1 неделю встряхивания при 25°С, поскольку уровень агрегатов повышался с 3 до 3,8%. Неожиданно, что уровень полисорбата 20 равный или выше чем 0,03% требовался для предотвращения увеличения количества растворимых агрегатов через 1 неделю встряхивания при 25°С.
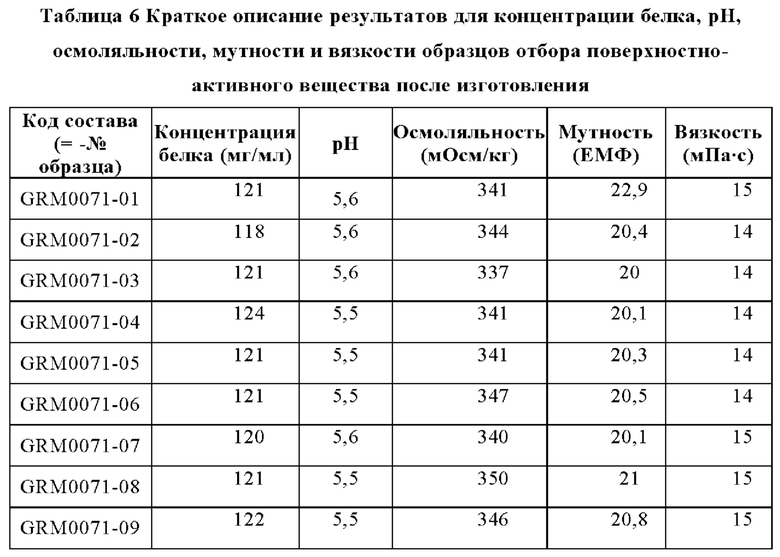
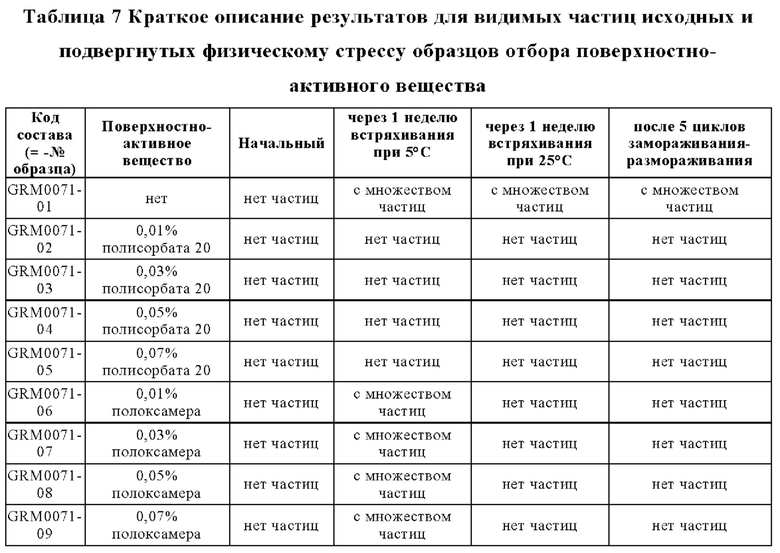
Вывод
Добавление по меньшей мере 0,03% полисорбата 20 требуется для полной стабилизации антитела к VEGF/ANG2 при концентрации 120 мг/мл от стресса вследствие встряхивания и замораживания-размораживания.
Поверхностно-активное вещество полоксамер не может защитить биспецифическое антитело к VEGF/ANG2 при концентрации 120 мг/мл от стресса вследствие встряхивания при 5°С.
Матрица состава с 20 мМ гистидин-ацетатного буфера при рН 5,5, 25 мМ хлорида натрия и 180 мМ сахарозы обеспечивает приемлемые результаты мутности (приблизительно 20 ЕМФ) и вязкости (приблизительно 15 мПа⋅с) для 120 мг/мл состава антитела к VEGF/ANG2.
Пример 5: Отбор I вспомогательных веществ
Установка
Целью отбора вспомогательных веществ является выбор конечной композиции для коммерческого состава антитела к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаба).
На основе результатов предыдущих отборов I и II рН/буфера и отбора поверхностно-активного вещества выбирали матрицу состава, которая состояла из 120 мг/мл антитела к Vegf-Ang2, 20 мМ гистидин-ацетатной буферной системы, 160 мМ сахарозы и 0,04% полисорбата 20. В матрице состава исследовали влияние рН (5,5 относительно 5,8), соли (25 мМ хлорида натрия относительно 8 мМ хлорида кальция) и метионина (0 относительно 7 мМ). Ионную силу доводили до 40 на основе вклада от концентрации буфера и соли.
В таблице 8 подытожены составы отбора I вспомогательных веществ.
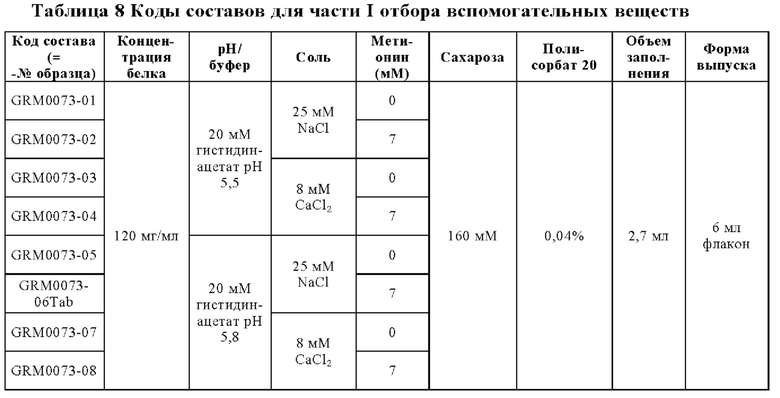
Материал и методы
Краткое описание материалов, используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
В лекарственном веществе заменяли буфер при помощи ультрафильтрации-диафильтрации, используя полупроницаемую мембрану Labscale TTF (Millipore) с отсечением по молекулярной массе 30 кДа, или на 20 мМ гистидин-ацетатного буфера для диафильтрации с рН 5,3, или 20 мМ гистидин-ацетата с рН 5,6. Таким образом, 410 мл лекарственного вещества вводили в систему Labscale и заменяли буфер на 3000 мл буфера для диафильтрации.
После замены буфера лекарственное вещество концентрировали в системе Labscale до концентрации белка приблизительно 165 мг/мл и рН или приблизительно 5,5, или рН 5,8.
Затем концентрированное лекарственное вещество разводили исходными растворами соответствующего буфера и солевыми растворами до целевой концентрации белка 120 мг/мл, что давало конечный раствор лекарственного вещества согласно таблице 8.
Каждый раствор лекарственного вещества фильтровали через 0,22 мкм фильтр Sterivex GV (Millipore) и набирали в чистые и стерильные 6 мл флаконы с объемом заполнения 2,7 мл. Флаконы закрывали пробками и обжимали.
Аналитические методы
Аналитические методы тестирования концентрации белка, рН, осмоляльности, мутности, вязкости, видимых частиц, ЭХ-ВЭЖХ и ИО-ВЭЖХ описаны в примере I.
Программа для стабильности
Составы сохраняли стабильность при 2-8°С до 20 недель и при 25°С до 13 недель. Кроме того, образцы подвергали горизонтальному встряхиванию в течение 1 недели при 2-8°С (200 об/мин), горизонтальному встряхиванию в течение 1 недели при 25°С (200 об/мин) и 5 циклам замораживания-размораживания (-40°С/5°С).
Результаты
В таблице 9 подытожены исходные результаты отбора I вспомогательных веществ. Все составы имели концентрацию белка от 125 до 130 мг/мл. Составы GRM0073-01 04 с целевым рН 5,5 имели измеренные значения рН приблизительно 5,6, тогда как составы GRM0073-05 - 08 с целевым рН 5,8 имели измеренные значения рН приблизительно 5,9. Осмоляльность составов, содержащих 25 мМ хлорида натрия (GRM0073-01, -02, -05 и -06), имела более высокие результаты осмоляльности (от 313 до 322 мОсм/кг) по сравнению с составами с 8 мМ хлорида кальция (GRM0073-03, -04, -07 и -08), где она была от 273 до 288 мОсм/кг).
В таблице 10 подытожены результаты для видимых частиц вначале, после физической нагрузки и через 13 недель хранения при 5°С и 25°С. После изготовления и после воздействия физического стресса (1 неделя встряхивания при 5°С или 25°С или пять циклов замораживания-размораживания) все составы не содержали частицы. Неожиданно, что все составы, которые содержали 8 мМ хлорида кальция, показали наличие видимых частиц через 13 недель хранения при 5°С и 25°С, тогда как все составы, которые содержали 25 мМ хлорида натрия, не содержали частицы.
Фиг. 5 сравнивает результаты мутности и вязкости составов, содержащих 25 мМ хлорида натрия. Таким образом, составы с рН 5,5 показали более низкую мутность (21 ЕМФ относительно 25 ЕМФ) и более низкую вязкость (17 мПа⋅с относительно 21 мПа⋅с).
Фиг. 6 и 7 показывают увеличение количества растворимых агрегатов (ВМЧ) при хранении 20 недель при 5°С, соответственно, хранении 13 недель при 25°С.Составы с рН 5,8 показали несколько более низкое увеличение количества растворимых агрегатов по сравнению с составами при рН 5,5. Неожиданно, что добавление метионина может снижать образование растворимых агрегатов и может компенсировать влияние более низкого рН на агрегацию.
Фиг. 8 и 9 сравнивают изменение заряженных изоформ, измеренное при помощи ИОХ, через 20 недель хранения при 5°С и 13 недель хранения при 25°С, соответственно. Все составы показали небольшое уменьшение приблизительно в 1% площади главного пика через 13 недель хранения при 5°С. Это сопровождается приблизительно 0,2% увеличением количества кислотных изоформ и приблизительно 1% увеличением площади основного пика. Нет явных различий, вызванных разным рН или присутствием метионина. Хотя уменьшение главного пика намного больше (приблизительно 18%) через 13 недель хранения при 25°С, нет явных различий на основе рН и метионина. Снижение главного пика при хранении при 25°С главным образом вызвано увеличением количества кислотных изоформ.

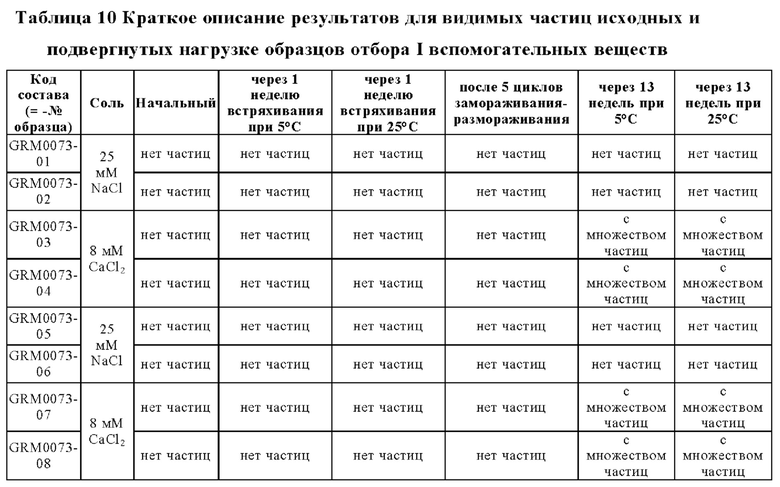
Вывод
Хотя присутствие хлорида кальция приводит к снижению уровней вязкости и мутности по сравнению с составами с хлоридом натрия (ссылка на примеры 2 и 3), оно также неожиданно вызывает образование видимых частиц. Образование видимых частиц неприемлемо для интравитреального введения согласно требованиям USP-NF <790>, которые по существу не содержат видимые частицы. Таким образом, добавление хлорида натрия в качестве модификатора ионной силы для снижения вязкости предпочтительно относительно использования хлорида кальция.
Кроме того, составы при рН 5,5 показывают более низкую мутность и более низкую вязкость по сравнению с составами при рН 5,8. Однако составы при рН 5,8 показали несколько меньшее образование растворимых агрегатов, чем составы при рН 5,5, но этот эффект может быть компенсирован добавлением 7 мМ метионина. Таким образом, добавление метионина обеспечивает снижение количества растворимых агрегатов при рН 5,5, в то же время все еще давая более низкие уровни вязкости и мутности.
Разница рН (рН 5,5 относительно 5,8) или присутствие или отсутствие метионина не имеет влияния на образование заряженных изоформ.
В общем, состав с 25 мМ хлорида натрия, а не 8 мМ хлорида кальция, и 20 мМ гистидин-ацетатного буфера при рН 5,5 с 7 мМ метионина и 160 мМ сахарозы и 0,04% полисорбата 20 обеспечивает состав без частиц с низкой мутностью и вязкостью и улучшенными свойствами стабильности.
Пример 6: Отбор II вспомогательных веществ
Установка
Во второй части отбора вспомогательных веществ свойство стабильности дополнительно определяют в предварительно заполненном шприце и при концентрации белка 30 мг/мл.
Отбор I вспомогательных веществ давал оптимизированный состав, состоящий из 120 мг/мл антитела к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаб), 20 мМ гистидин-ацетата при рН 5,5, 25 мМ хлорида натрия, 160 мМ сахарозы, 7 мМ метионина и 0,04% полисорбата 20, которым заполняли стеклянный флакон (соответствует составу GRM0073-02).
Этим составом также заполняли предварительно заполняемый шприц (GRM0076-02). Кроме того, свойство стабильности этой матрицы состава тестировали при концентрации белка 30 мг/мл, набранного в предварительно заполняемый шприц (GRM0077-02) или в стеклянный флакон (GRM0077-06).
Для сравнения стабильность эталонного состава, набранного в стеклянный флакон, тестировали при 30 мг/мл (GRM0077-09) и 120 мг/мл (GRM0076-05).
В таблице 11 подытожены составы отбора II вспомогательных веществ.

Материал и методы
Краткое описание материалов, используемых при получении составов, и их первичная упаковка даны в таблице 1 и таблице 2.
В лекарственном веществе заменяли буфер при помощи ультрафильтрации-диафильтрации, используя полупроницаемую мембрану Labscale TTF (Millipore) с отсечением по молекулярной массе 30 кДа.
Для получения антитела к VEGF/ AN G2 CrossMAb VEGFang2-0016 (фарицимаба) в 20 мМ гистидин-ацетатного буфера рН 5,5, приблизительно 340 мл лекарственного вещества вводили в систему Labscale и заменяли буфер на 2400 мл 20 мМ гистидин-ацетатный буфер для диафильтрации рН 5,2.
Антитело к VEGF/ANG2 CrossMAb VEGFang2-0016 (фарицимаб) в 20 мМ гистидин-HCl буфере рН 6,0 получали, используя приблизительно 200 мл лекарственного вещества. Его вводили в систему Labscale и заменяли буфер на 1400 мл 20 мМ гистидин-HCl буфера для диафильтрации рН 5,85.
После замены буфера соответствующее лекарственное вещество концентрировали в системе Labscale до концентрации белка приблизительно 165 мг/мл и рН или приблизительно 5,5, или рН 6,0.
Затем концентрированное лекарственное вещество разводили исходными растворами соответствующего буфера и солевыми растворами до целевой концентрации белка 30 или 120 мг/мл, что давало конечный раствор лекарственного вещества согласно таблице 8.
Каждый раствор лекарственного вещества фильтровали через 0,22 мкм фильтр Sterivex GV (Millipore) и набирали в чистые и стерильные 6 мл флаконы с объемом заполнения 2,7 мл или в чистые стерилизованные 1 мл предварительно заполненные шприцы с объемом заполнения 1 мл. Флаконы закрывали пробками и обжимали, тогда как шприцы закрывали ограничителем хода поршня.
Аналитические методы
Аналитические методы тестирования концентрации белка, рН, осмоляльности, мутности, вязкости, видимых частиц и ЭХ-ВЭЖХ описаны в примере I.
Программа для стабильности
Составы сохраняли стабильность при 2-8°С и 24°С до 13 недель. Кроме того, образцы подвергали горизонтальному встряхиванию в течение 1 недели при 2-8°С (200 об/мин), горизонтальному встряхиванию в течение 1 недели при 25°С (200 об/мин) и 5 циклам замораживания-размораживания (-40°С/5°С).
Результаты
В Таблице 12 подытожены исходные результаты отбора II вспомогательных веществ. GRM0076-02 (оптимизированный состав в ПЗШ) и GRM0076-05 (эталонный состав) оба соответствуют целевой концентрации белка 120 мг/мл с измеренными значениями 119 или 123 мг/мл, соответственно. GRM0077-02 (оптимизированный состав в ПЗШ), GRM0077-06 (оптимизированный состав в флаконе) и GRM0076-05 (эталонный состав) получали с целевой концентрацией белка 30 мг/мл. Фактическая концентрация белка находилась в диапазоне от 30 до 31 мг/мл.
рН всех составов был близок к целевому рН и с максимальным отклонением только 0,1 единицы рН.
Осмоляльность составов при 120 мг/мл была несколько выше и от 310 до 320 мОсм/кг, тогда как составы с 30 мг/мл имели от 278 до 394 мОсм/кг.
В Таблице 13 подытожены результаты для видимых частиц в начале, после физического стресса и через 13 недель хранения при 5°С и 25°С.После изготовления и после воздействия физического стресса (1 неделя встряхивания при 5°С или 25°С или пять циклов замораживания-размораживания) все составы не содержали частицы. Неожиданно, что эталонные составы показали много частиц через 13 недель хранения при 5 и 25°С. Все остальные составы не содержали частицы.
Фигура 10 сравнивает результаты мутности и вязкости оптимизированных и эталонных составов при концентрации белка 120 мг/мл. Оптимизированный состав показал явно более низкую мутность приблизительно 23 ЕМФ, тогда как состав для клинического исследования имел мутность более 45 ЕМФ. Интересно, что вязкость обоих составов была ниже 14 мПа⋅с.
Фигура 11 показывает мутность и вязкость составов с 30 мг/мл. Здесь различие в мутности меньше между составами GRM0072-02 и GRM0077-09, но все еще оптимизированные составы показывали более низкую мутность. Вязкости для обоих составов с 30 мг/мл были очень низкими по сравнению с составами с 120 мг/мл и составляли ниже 2 мПа⋅с.
Фигура 12 и Фигура 13 показывают увеличение соединений ВМС через 13 недели хранения при 5 и 25°С. Оптимизированный состав показывал как при 120 мг/мл, так и 30 мг/мл меньшее увеличение количества ВМ-соединений, чем эталонный состав. Стабилизирующий эффект наиболее явно выражен через 13 недель хранения при 25°С, где количество ВМ повышалось только до 2,4% в оптимизированном составе GRM0076-02, тогда как состав GRM0076-05 показывал увеличение до 2,9%. Такая же тенденция также наблюдалась для составов с 30 мг/мл, причем более низкое увеличение до 1,0% наблюдали для оптимизированного состава и увеличение до 1,3% для эталонной формы.
Фигура 14 сравнивает изменение заряженных изоформ, измеренное при помощи ИОХ через 13 недель хранения при 5°С и 25°С. Все составы показали небольшое уменьшение приблизительно на 1% площади главного пика через 13 недель хранения при 5°С.Это сопровождается соответствующим увеличением площади основного пика, тогда как площадь кислотного пика остается постоянной. Хотя уменьшение главного пика намного больше (приблизительно 10%) через 13 недель хранения при 25°С, нет явных различий между составами. Уменьшение главного пика при хранении при 25°С главным образом вызвано увеличением кислотных изоформ (около 8%) и небольшим увеличением основных изоформ (1-2%). Увеличение основных изоформ через 13 недель при 25°С несколько ниже (прибл. 1%) у эталонных составов (составленных при рН 6,0) по сравнению с оптимизированными составами (прибл. 2% увеличение). Более низкая концентрация белка и первичный контейнер не влияют на заряженные изоформы.
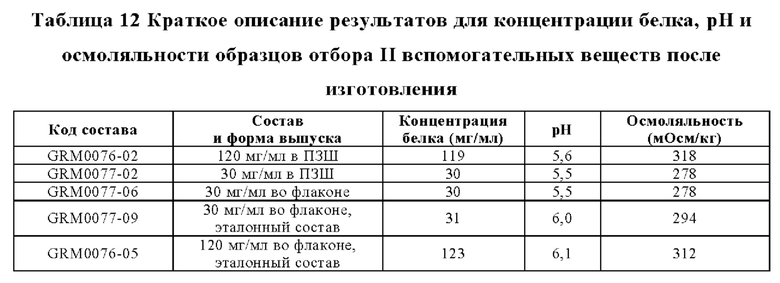
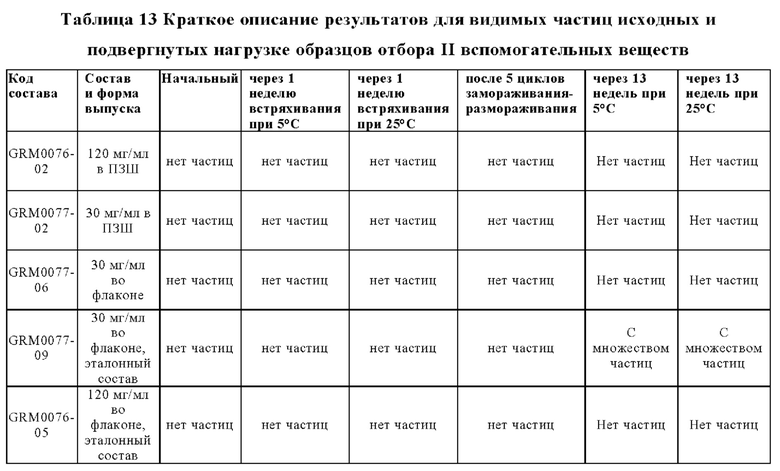
Вывод
Результат отбора II вспомогательных веществ подтвердил, что оптимизированные составы лучше эталонного состава. Мутность оптимизированных составов при 120 мг/мл снижалась от более чем 45 ЕМФ до менее чем 25 ЕМФ, в то же время сохраняя вязкость менее 15 мПа⋅с.Низкая вязкость важна для обеспечения промышленного способа производства (повышение концентрации ультрафильтрацией) и для обеспечения простого и удобного интравитреального введения (силы впрыска менее 20 Н, в частности менее 15 Н). Было показано, что оптимизированный состав с вязкостью менее 15 мПа⋅с можно было инъецировать при помощи иглы для инъекции 30G с временем впрыска 5 с при силе впрыска менее 5 Н.
Кроме того, оптимизированные составы с 30 мг/мл все еще не содержали частицы, тогда как эталонные составы показали видимые частицы через 13 недель хранения при 5 и 25°С. Кроме того, увеличение количества ВМ-соединений было ниже в оптимизированных составах.
Улучшенное свойство стабильности оптимизированных составов наблюдали при концентрациях белка 30 и 120 мг/мл и во флаконе, а также в предварительно заполненном шприце.
В общем, оптимизированный состав с концентрацией белка 30 и 120 мг/мл, содержащий гистидин-ацетатный буфер рН 5,5, 25 мМ хлорида натрия, 7 мМ метионина, 160 мМ сахарозы и 0,04% полисорбата 20, обеспечивает состав без частиц с низкой мутностью и вязкостью и улучшенным свойством стабильности во флаконе и предварительно заполненном шприце.
Пример 7: Безопасность метионина для применения при показаниях для глаз (в составе для интравитреального введения) Обзор неклинических исследований токсичности с L-метионином
Проводили исследование токсичности у яванских макаков, в котором метионин (10 мМ) был компонентом носителя и составленного тестового материала CrossMAb VEGFang2-0016 (фарицимаб). В этом исследовании всего 12 животным (6 самцов/6 самок) вводили интравитреально 50 цл/глаз дважды через 14 дней. Левые глаза обрабатывали носителем (содержащим 10 мМ метионина), а правые глаза обрабатывали составленным тестовым материалом CrossMAb VEGFang2-0016 (фарицимабом), также содержащим 10 мМ метионина. В этом исследовании не наблюдали никаких воздействий метионина на глаза у яванских макаков.
Проводили три исследования (на яванских макаках и новозеландских белых кроликах), в которых метионин (5-25 мМ) был компонентом носителя, вводимого интравитреально (также 50 цл/глаз) до шести раз через 14 дней. В этих исследованиях не наблюдали никаких воздействий метионина на глаза у любых животных, обработанных содержащим метионин носителем.
Обзор неклинических исследований токсичности представлен в Таблице 14.
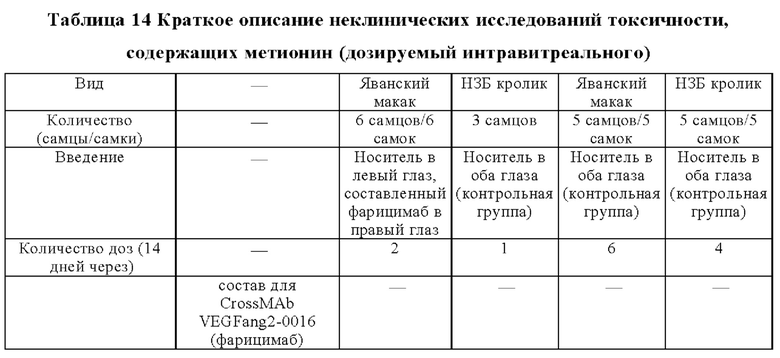
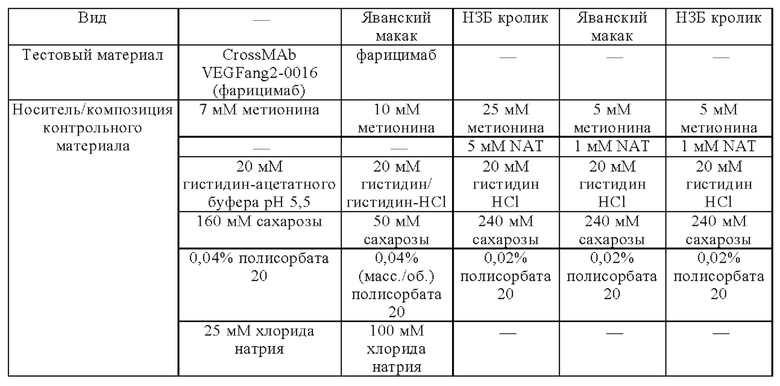
Сокращения: NAT=N-ацетилтриптофан; НЗБ=новозеландский белый.
Пример 8: Стабильность
Партию лекарственного продукта (120 мг/мл антитела к Vegf/Ang2 (фарицимаб) в 20 мМ L-гистидин-ацетата рН 5,5, 160 мМ сахарозы, 25 мМ хлорида натрия, 7 мМ L-метионина, 0,04% полисорбата 20) фильтровали через 0,22 мкм стерильный фильтр и набирали в чистые и стерильные 2 мл стеклянные флаконы с объемом заполнения 0,24 мл.
После изготовления рН составлял 5,6, осмоляльность 320 мОсм/кг и концентрация белка 120 мг/мл.
Таблица 15 представляет данные о стабильности партии лекарственного продукта GLI0219-01 при хранении при 5°С. Таблица 16 показывает стабильность при хранении при 25°С.
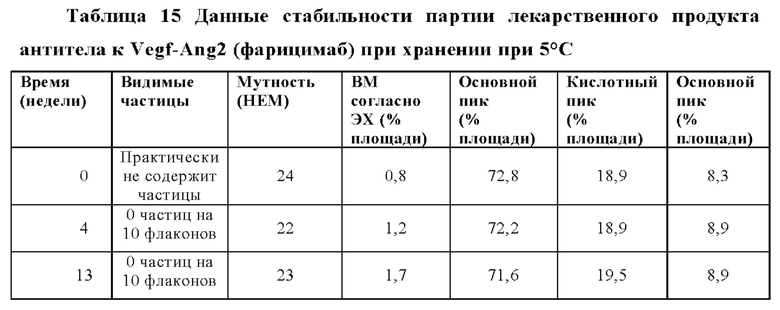
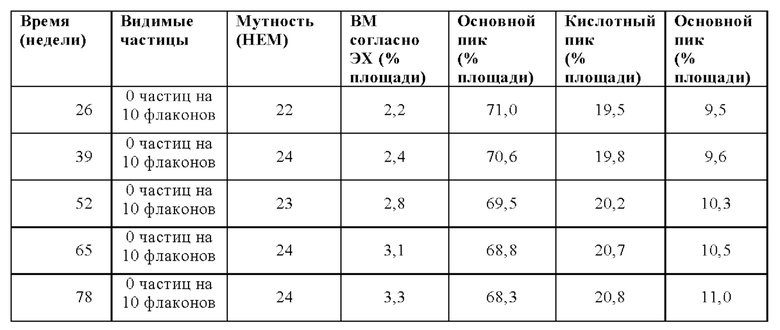
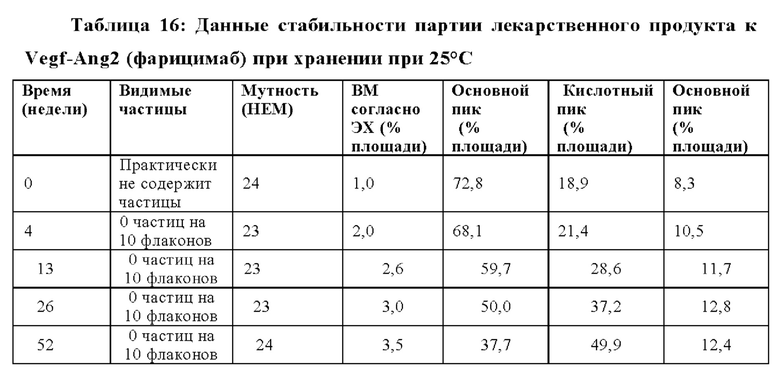

--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ф.ХОФФМАНН-ЛЯ РОШ АГ
<120> СОСТАВ, СОДЕРЖАЩИЙ АНТИТЕЛО
<130> P35108-WO
<150> EP18203104.7
<151> 2018-10-29
<160> 25
<170> PatentIn версия 3.5
<210> 1
<211> 14
<212> Белок
<213> Искусственный
<220>
<223> CDR3H тяжелой цепи, <VEGF>
<400> 1
Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
1 5 10
<210> 2
<211> 17
<212> Белок
<213> Искусственный
<220>
<223> CDR2H тяжелой цепи, <VEGF>
<400> 2
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe Lys
1 5 10 15
Arg
<210> 3
<211> 5
<212> Белок
<213> Искусственный
<220>
<223> CDR1H тяжелой цепи, <VEGF>
<400> 3
His Tyr Gly Met Asn
1 5
<210> 4
<211> 9
<212> Белок
<213> Искусственный
<220>
<223> CDR3L легкой цепи, <VEGF>
<400> 4
Gln Gln Tyr Ser Thr Val Pro Trp Thr
1 5
<210> 5
<211> 7
<212> Белок
<213> Искусственный
<220>
<223> CDR2L легкой цепи, <VEGF>
<400> 5
Phe Thr Ser Ser Leu His Ser
1 5
<210> 6
<211> 11
<212> Белок
<213> Искусственный
<220>
<223> CDR1L легкой цепи, <VEGF>
<400> 6
Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 7
<211> 123
<212> Белок
<213> Искусственный
<220>
<223> вариабельный домен тяжелой цепи VH, <VEGF>
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 107
<212> Белок
<213> Искусственный
<220>
<223> вариабельный домен легкой цепи VL, <VEGF>
<400> 8
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 20
<212> Белок
<213> Искусственный
<220>
<223> CDR3H тяжелой цепи, <ANG-2>
<400> 9
Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr Pro Gly
1 5 10 15
Ala Phe Asp Ile
20
<210> 10
<211> 17
<212> Белок
<213> Искусственный
<220>
<223> CDR2H тяжелой цепи, <ANG-2>
<400> 10
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 11
<211> 5
<212> Белок
<213> Искусственный
<220>
<223> CDR1H тяжелой цепи, <ANG-2>
<400> 11
Gly Tyr Tyr Met His
1 5
<210> 12
<211> 11
<212> Белок
<213> Искусственный
<220>
<223> CDR3L легкой цепи, <ANG-2>
<400> 12
Gln Val Trp Asp Ser Ser Ser Asp His Trp Val
1 5 10
<210> 13
<211> 7
<212> Белок
<213> Искусственный
<220>
<223> CDR2L легкой цепи, <ANG-2>
<400> 13
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 14
<211> 11
<212> Белок
<213> Искусственный
<220>
<223> CDR1L легкой цепи, <ANG-2>
<400> 14
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 15
<211> 129
<212> Белок
<213> Искусственный
<220>
<223> вариабельный домен тяжелой цепи VH, <ANG-2>
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser
<210> 16
<211> 110
<212> Белок
<213> Искусственный
<220>
<223> вариабельный домен легкой цепи VL, <ANG-2>
<400> 16
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser
100 105 110
<210> 17
<211> 453
<212> Белок
<213> Искусственный
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с мутациями AAA
и мутациями P329G LALA (VEGFang2-0016)
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala
225 230 235 240
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ala Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 18
<211> 463
<212> Белок
<213> Искусственный
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с мутациями AAA
и мутациями P329G LALA (VEGFang2-0016)
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 19
<211> 214
<212> Белок
<213> Искусственный
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с мутациями AAA
и мутациями P329G LALA (VEGFang2-0016)
<400> 19
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 20
<211> 213
<212> Белок
<213> Искусственный
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с мутациями AAA
и мутациями P329G LALA (VEGFang2-0016)
<400> 20
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
115 120 125
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
180 185 190
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
195 200 205
Glu Pro Lys Ser Cys
210
<210> 21
<211> 107
<212> Белок
<213> Homo sapiens
<400> 21
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 22
<211> 105
<212> Белок
<213> Homo sapiens
<400> 22
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 23
<211> 330
<212> Белок
<213> Homo sapiens
<400> 23
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 24
<211> 191
<212> Белок
<213> Homo sapiens
<400> 24
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Ala Pro Met Ala Glu Gly
20 25 30
Gly Gly Gln Asn His His Glu Val Val Lys Phe Met Asp Val Tyr Gln
35 40 45
Arg Ser Tyr Cys His Pro Ile Glu Thr Leu Val Asp Ile Phe Gln Glu
50 55 60
Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys Pro Ser Cys Val Pro Leu
65 70 75 80
Met Arg Cys Gly Gly Cys Cys Asn Asp Glu Gly Leu Glu Cys Val Pro
85 90 95
Thr Glu Glu Ser Asn Ile Thr Met Gln Ile Met Arg Ile Lys Pro His
100 105 110
Gln Gly Gln His Ile Gly Glu Met Ser Phe Leu Gln His Asn Lys Cys
115 120 125
Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg Gln Glu Asn Pro Cys Gly
130 135 140
Pro Cys Ser Glu Arg Arg Lys His Leu Phe Val Gln Asp Pro Gln Thr
145 150 155 160
Cys Lys Cys Ser Cys Lys Asn Thr Asp Ser Arg Cys Lys Ala Arg Gln
165 170 175
Leu Glu Leu Asn Glu Arg Thr Cys Arg Cys Asp Lys Pro Arg Arg
180 185 190
<210> 25
<211> 496
<212> Белок
<213> Homo sapiens
<400> 25
Met Trp Gln Ile Val Phe Phe Thr Leu Ser Cys Asp Leu Val Leu Ala
1 5 10 15
Ala Ala Tyr Asn Asn Phe Arg Lys Ser Met Asp Ser Ile Gly Lys Lys
20 25 30
Gln Tyr Gln Val Gln His Gly Ser Cys Ser Tyr Thr Phe Leu Leu Pro
35 40 45
Glu Met Asp Asn Cys Arg Ser Ser Ser Ser Pro Tyr Val Ser Asn Ala
50 55 60
Val Gln Arg Asp Ala Pro Leu Glu Tyr Asp Asp Ser Val Gln Arg Leu
65 70 75 80
Gln Val Leu Glu Asn Ile Met Glu Asn Asn Thr Gln Trp Leu Met Lys
85 90 95
Leu Glu Asn Tyr Ile Gln Asp Asn Met Lys Lys Glu Met Val Glu Ile
100 105 110
Gln Gln Asn Ala Val Gln Asn Gln Thr Ala Val Met Ile Glu Ile Gly
115 120 125
Thr Asn Leu Leu Asn Gln Thr Ala Glu Gln Thr Arg Lys Leu Thr Asp
130 135 140
Val Glu Ala Gln Val Leu Asn Gln Thr Thr Arg Leu Glu Leu Gln Leu
145 150 155 160
Leu Glu His Ser Leu Ser Thr Asn Lys Leu Glu Lys Gln Ile Leu Asp
165 170 175
Gln Thr Ser Glu Ile Asn Lys Leu Gln Asp Lys Asn Ser Phe Leu Glu
180 185 190
Lys Lys Val Leu Ala Met Glu Asp Lys His Ile Ile Gln Leu Gln Ser
195 200 205
Ile Lys Glu Glu Lys Asp Gln Leu Gln Val Leu Val Ser Lys Gln Asn
210 215 220
Ser Ile Ile Glu Glu Leu Glu Lys Lys Ile Val Thr Ala Thr Val Asn
225 230 235 240
Asn Ser Val Leu Gln Lys Gln Gln His Asp Leu Met Glu Thr Val Asn
245 250 255
Asn Leu Leu Thr Met Met Ser Thr Ser Asn Ser Ala Lys Asp Pro Thr
260 265 270
Val Ala Lys Glu Glu Gln Ile Ser Phe Arg Asp Cys Ala Glu Val Phe
275 280 285
Lys Ser Gly His Thr Thr Asn Gly Ile Tyr Thr Leu Thr Phe Pro Asn
290 295 300
Ser Thr Glu Glu Ile Lys Ala Tyr Cys Asp Met Glu Ala Gly Gly Gly
305 310 315 320
Gly Trp Thr Ile Ile Gln Arg Arg Glu Asp Gly Ser Val Asp Phe Gln
325 330 335
Arg Thr Trp Lys Glu Tyr Lys Val Gly Phe Gly Asn Pro Ser Gly Glu
340 345 350
Tyr Trp Leu Gly Asn Glu Phe Val Ser Gln Leu Thr Asn Gln Gln Arg
355 360 365
Tyr Val Leu Lys Ile His Leu Lys Asp Trp Glu Gly Asn Glu Ala Tyr
370 375 380
Ser Leu Tyr Glu His Phe Tyr Leu Ser Ser Glu Glu Leu Asn Tyr Arg
385 390 395 400
Ile His Leu Lys Gly Leu Thr Gly Thr Ala Gly Lys Ile Ser Ser Ile
405 410 415
Ser Gln Pro Gly Asn Asp Phe Ser Thr Lys Asp Gly Asp Asn Asp Lys
420 425 430
Cys Ile Cys Lys Cys Ser Gln Met Leu Thr Gly Gly Trp Trp Phe Asp
435 440 445
Ala Cys Gly Pro Ser Asn Leu Asn Gly Met Tyr Tyr Pro Gln Arg Gln
450 455 460
Asn Thr Asn Lys Phe Asn Gly Ile Lys Trp Tyr Tyr Trp Lys Gly Ser
465 470 475 480
Gly Tyr Ser Leu Lys Ala Thr Thr Met Met Ile Arg Pro Ala Asp Phe
485 490 495
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С FCRN И С СОХРАНЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2727639C2 |
| АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С VEGF-A И ANG2, И СПОСОБЫ ПРИМЕНЕНИЯ | 2021 |
|
RU2837708C1 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННЫМИ СПОСОБНОСТЯМИ СВЯЗЫВАТЬСЯ С FCRN | 2015 |
|
RU2730592C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| МОДИФИЦИРОВАННАЯ J-ЦЕПЬ | 2015 |
|
RU2761118C2 |
| АНТИТЕЛО ПРОТИВ ANG2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2788088C1 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2019 |
|
RU2747735C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2015 |
|
RU2723940C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
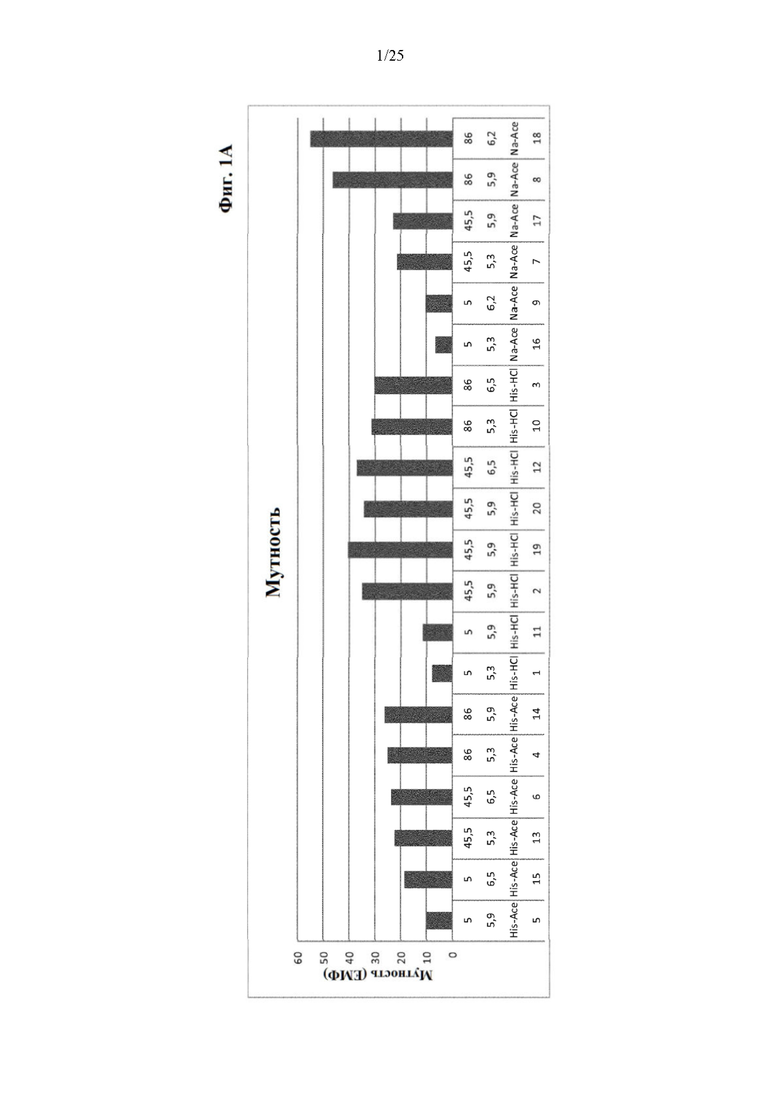
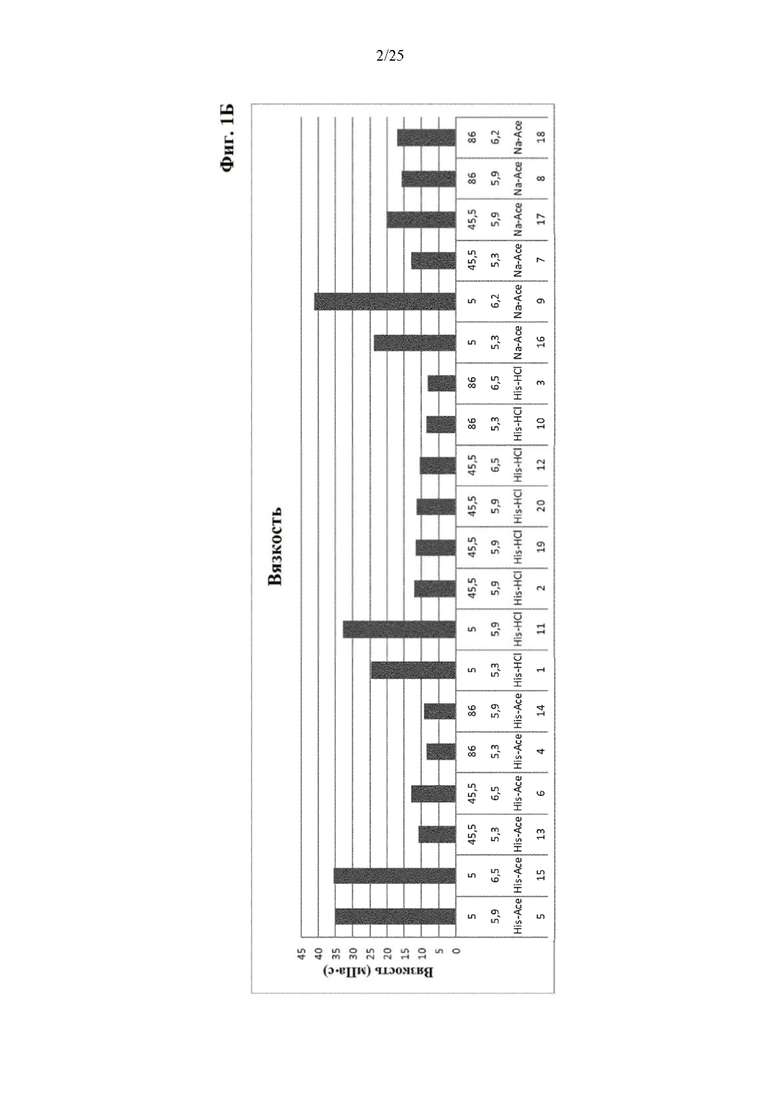
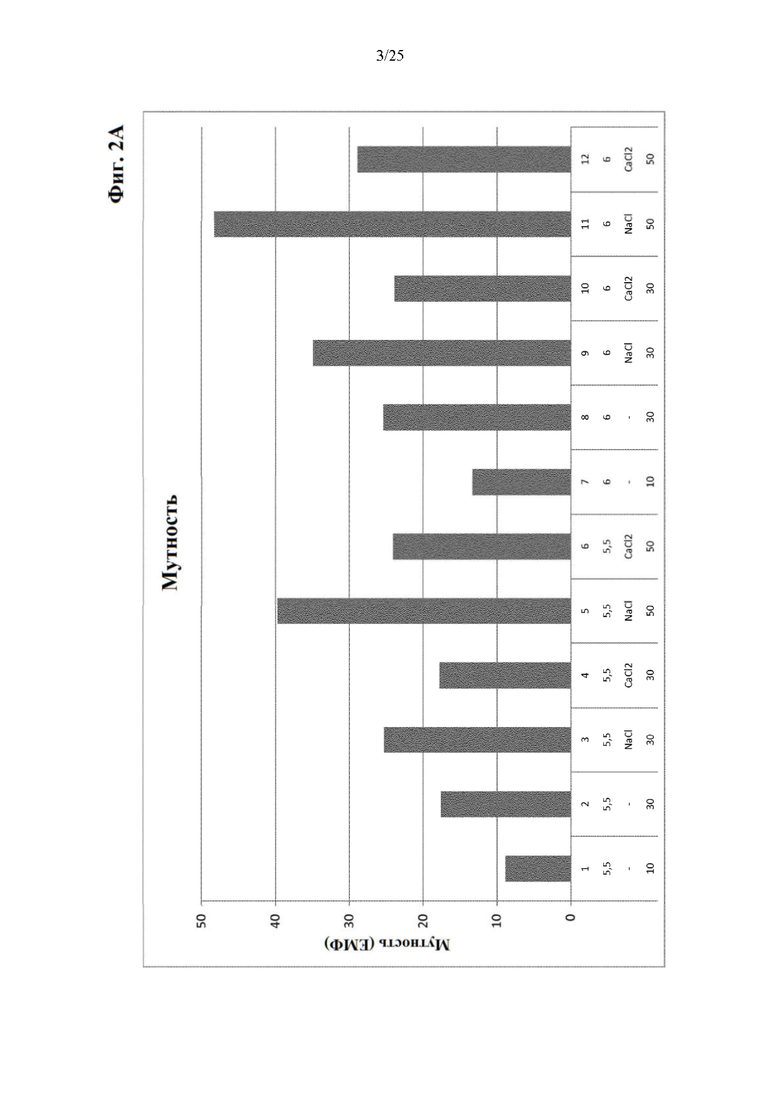
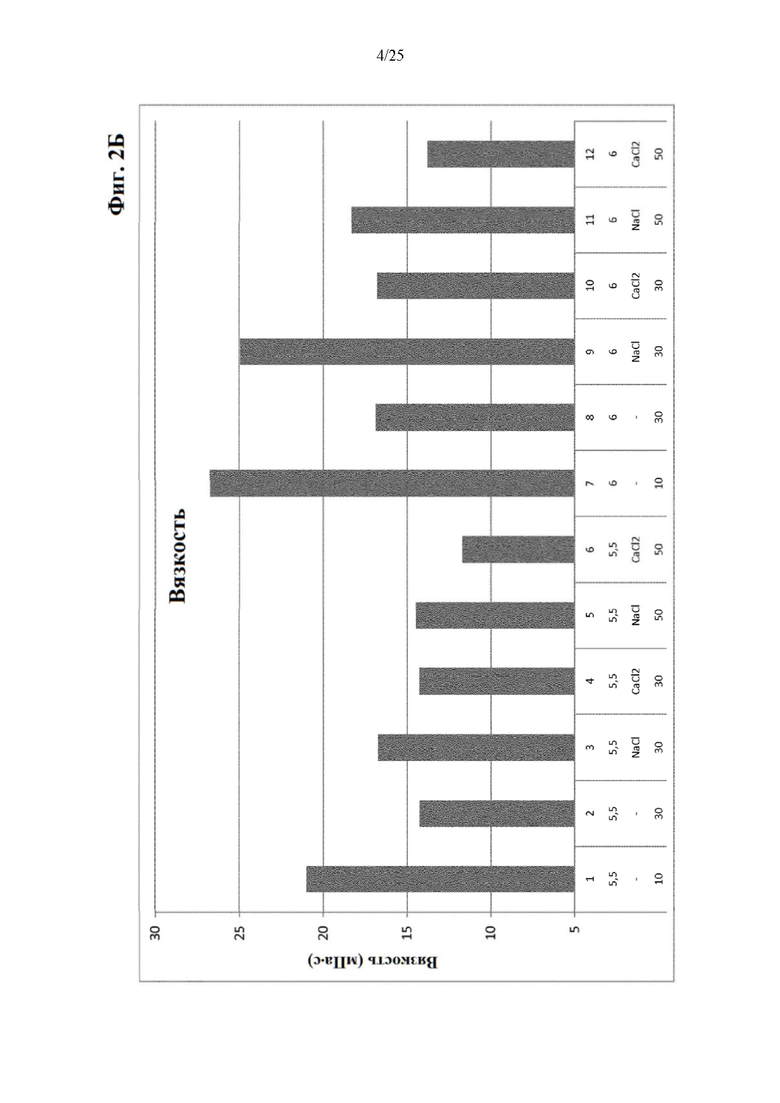
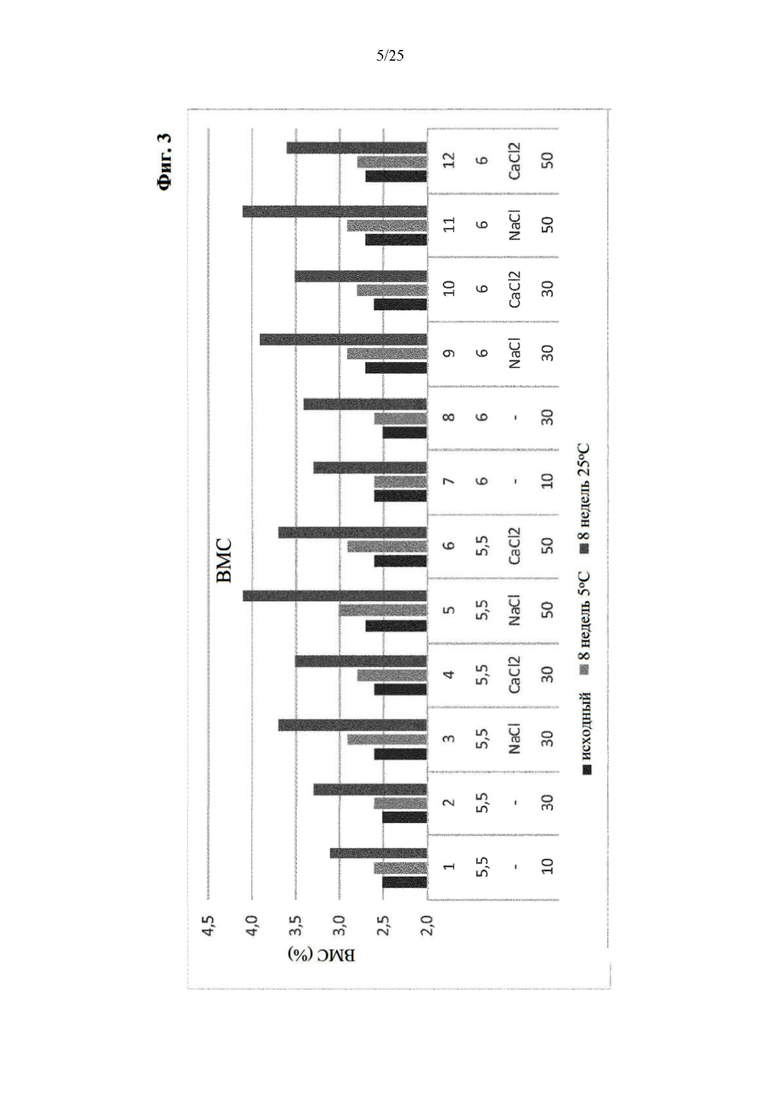
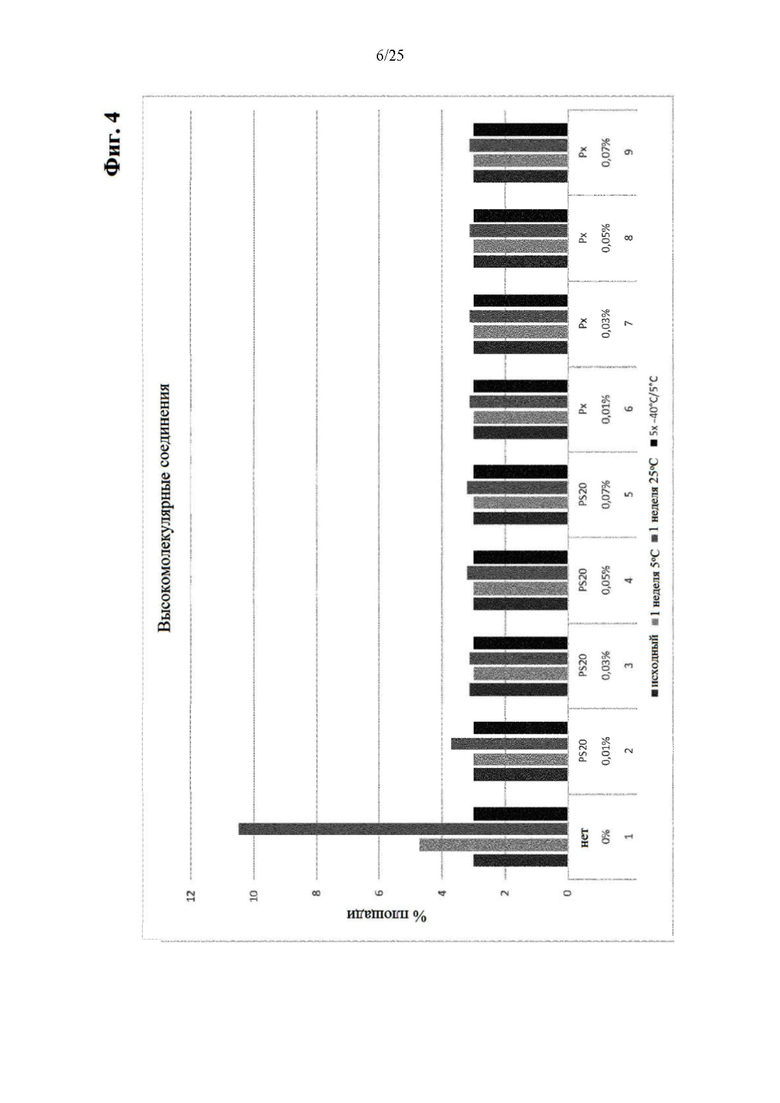
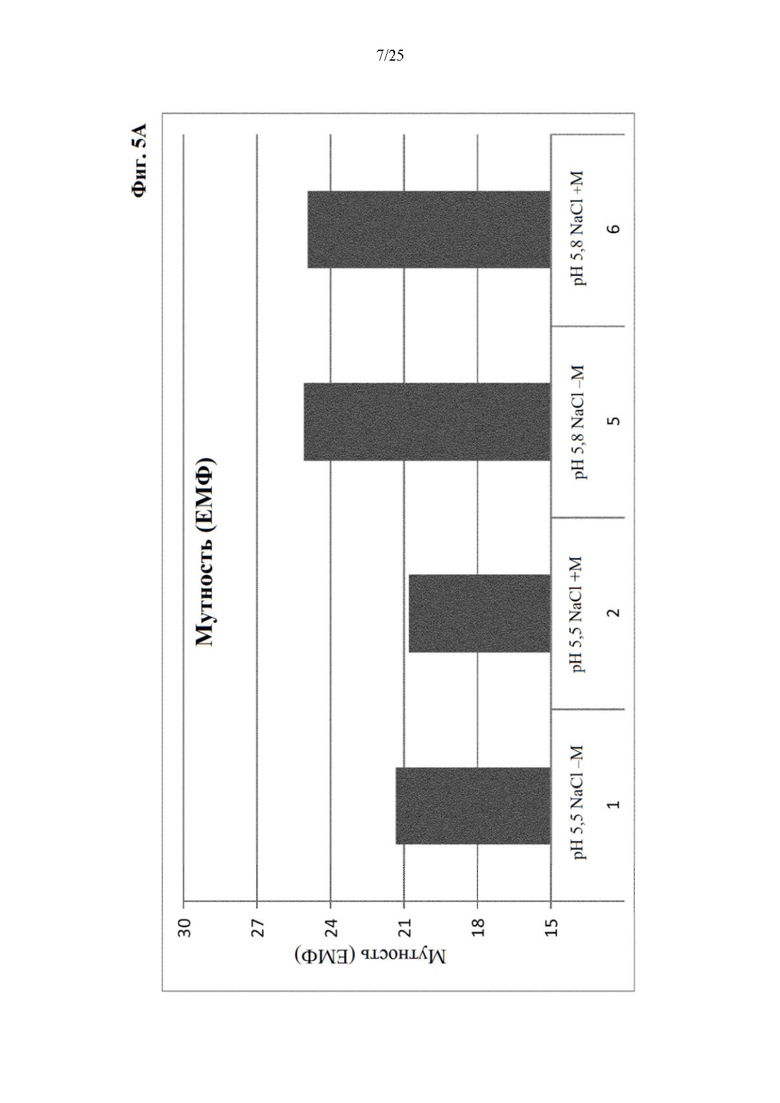
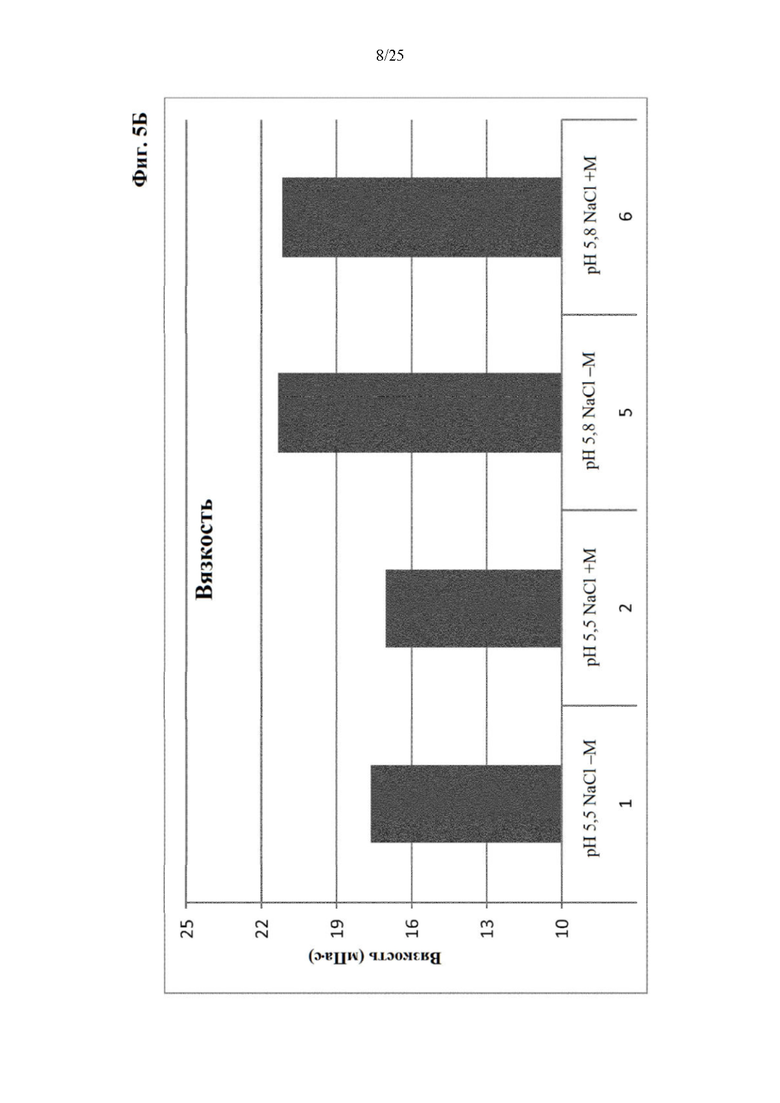
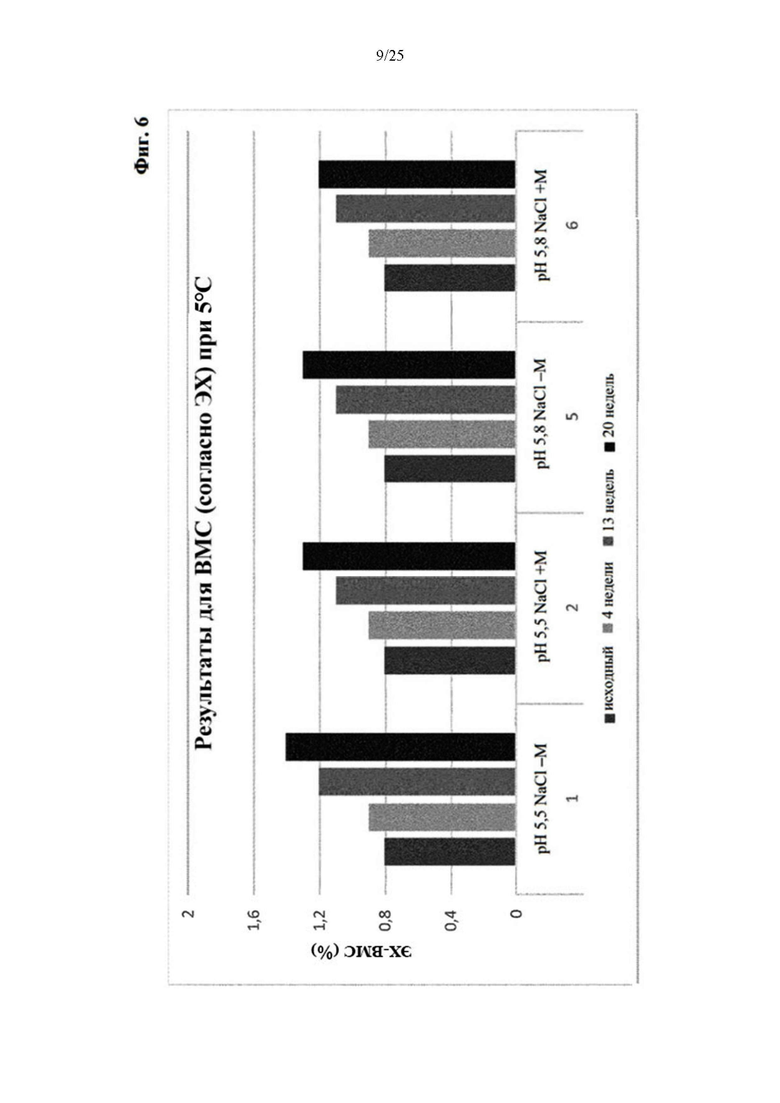

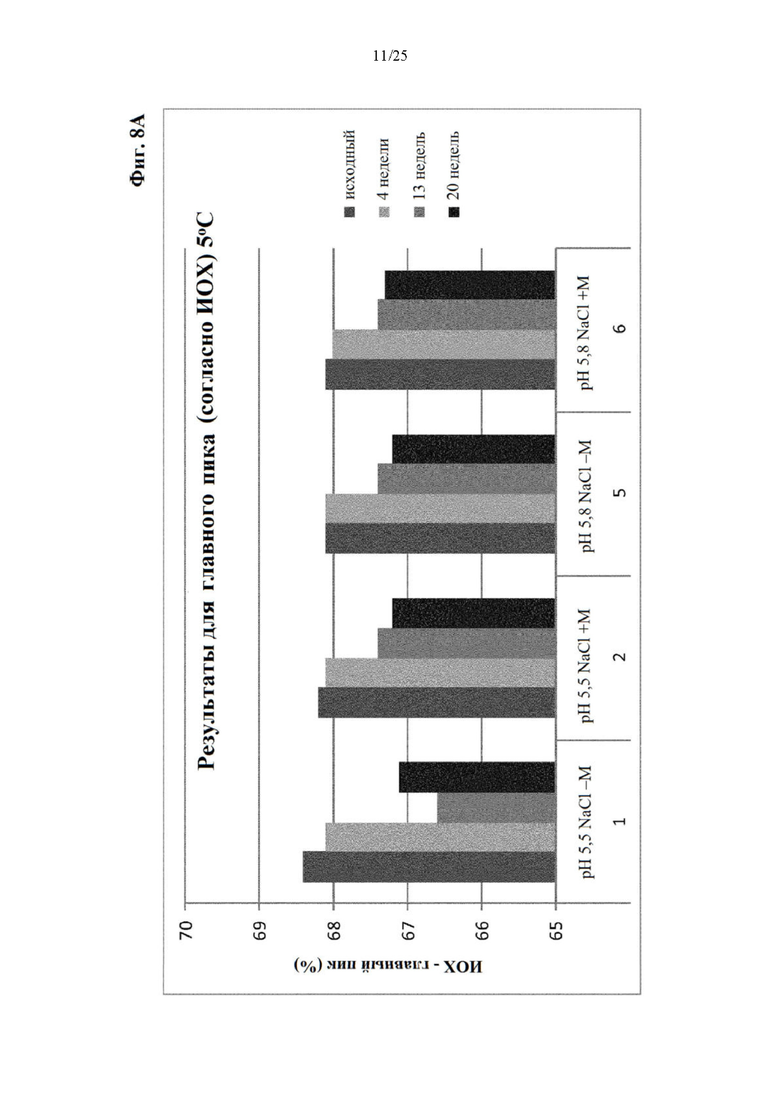
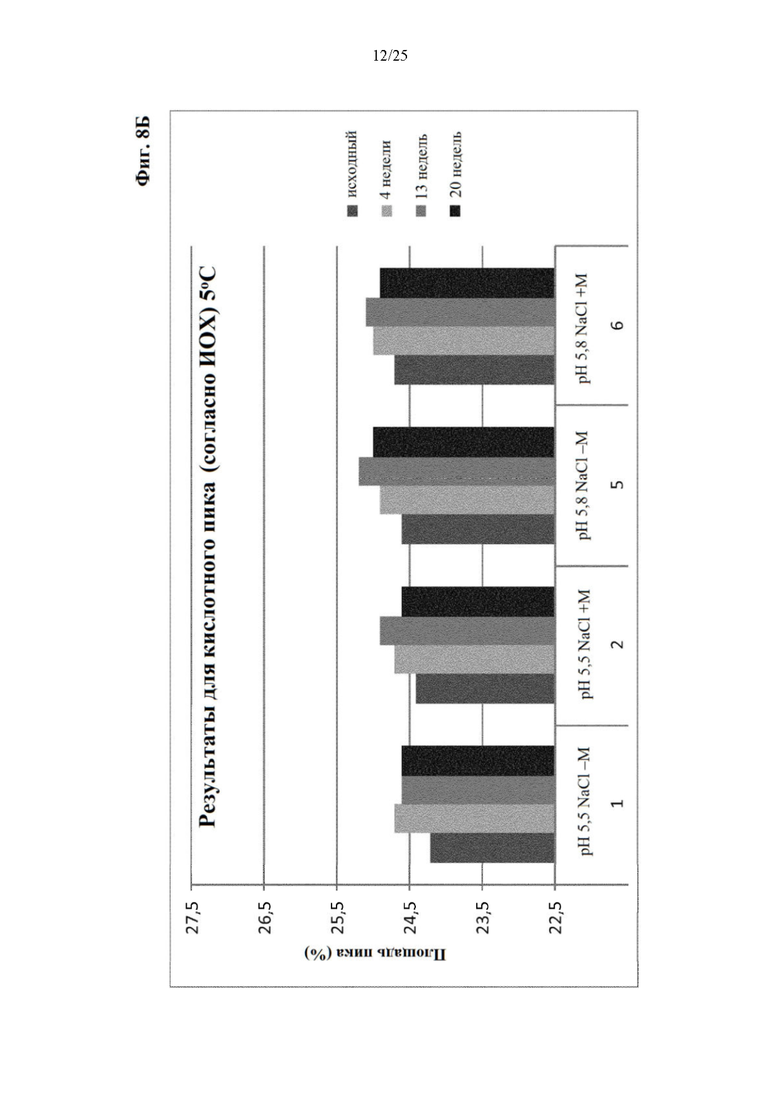
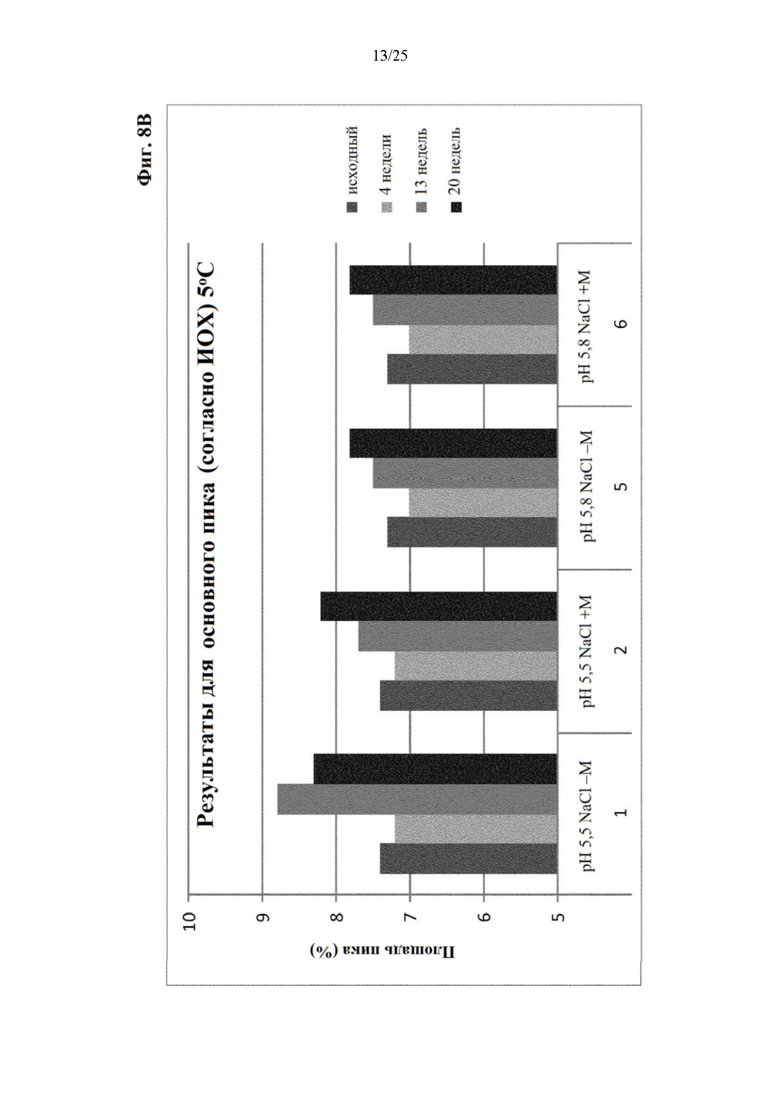


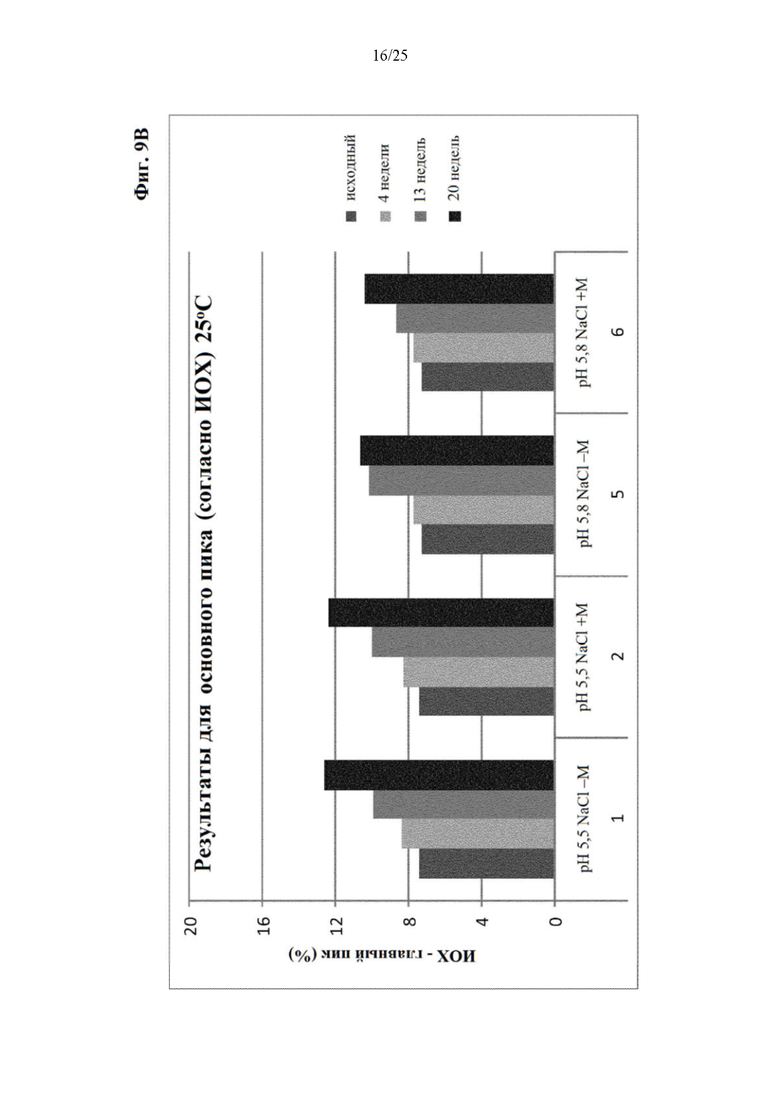
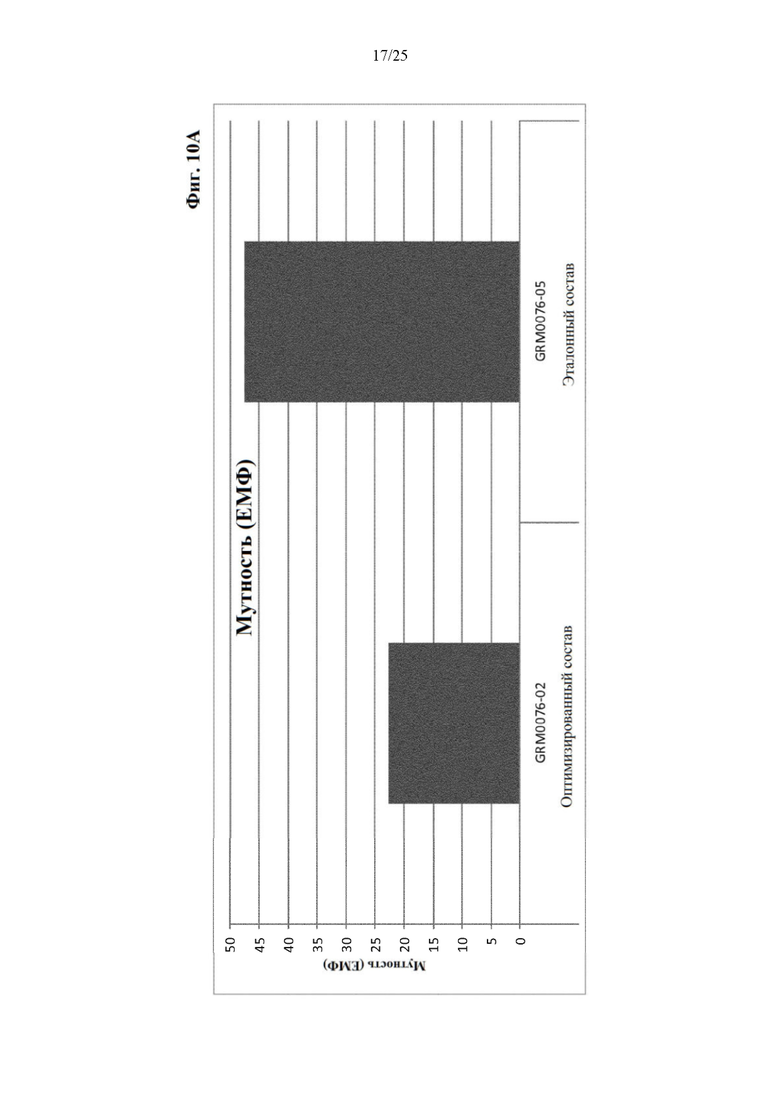
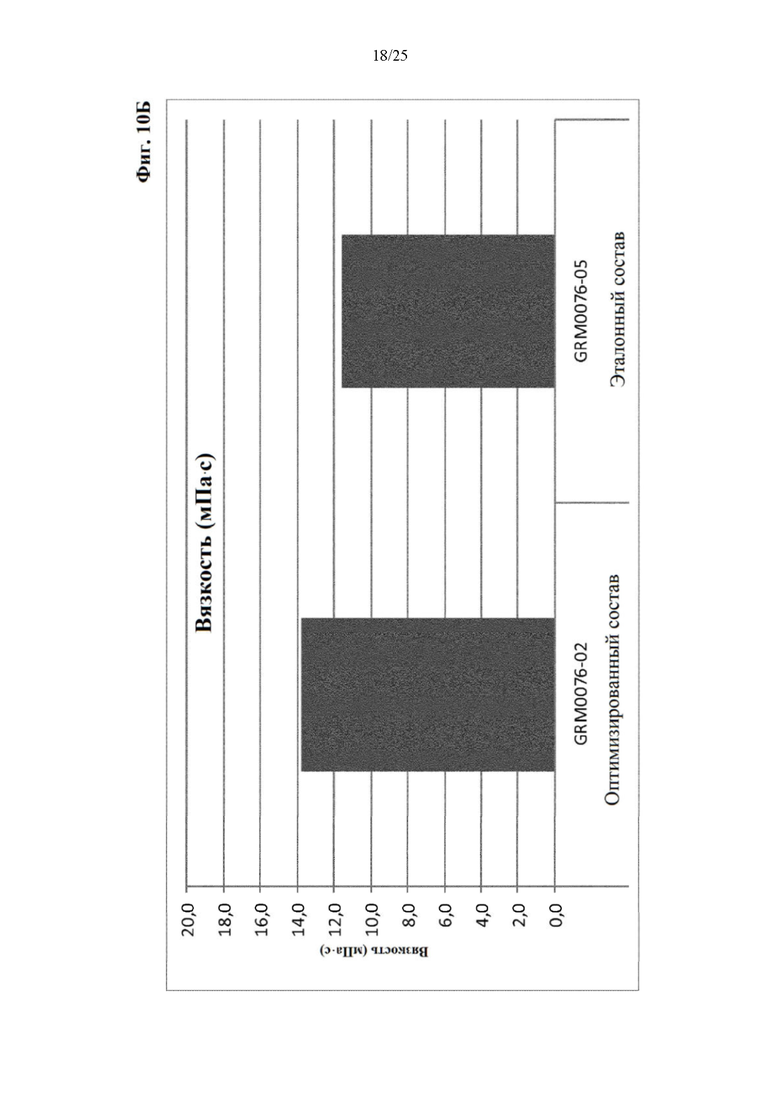
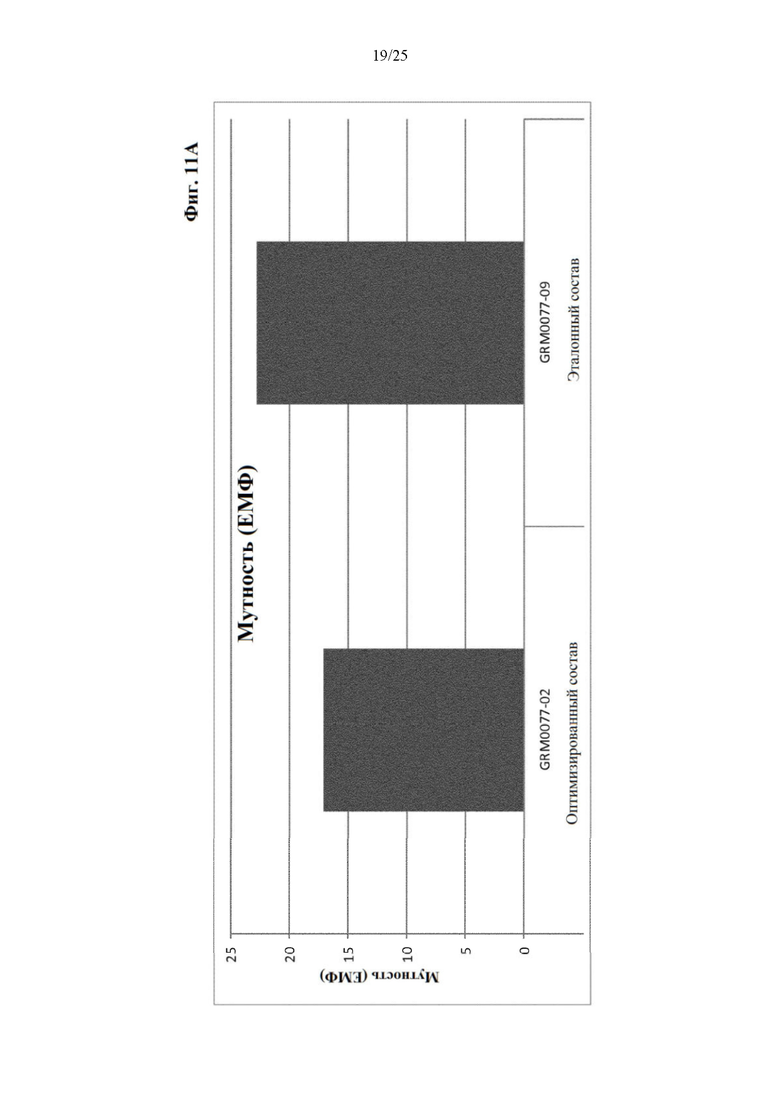
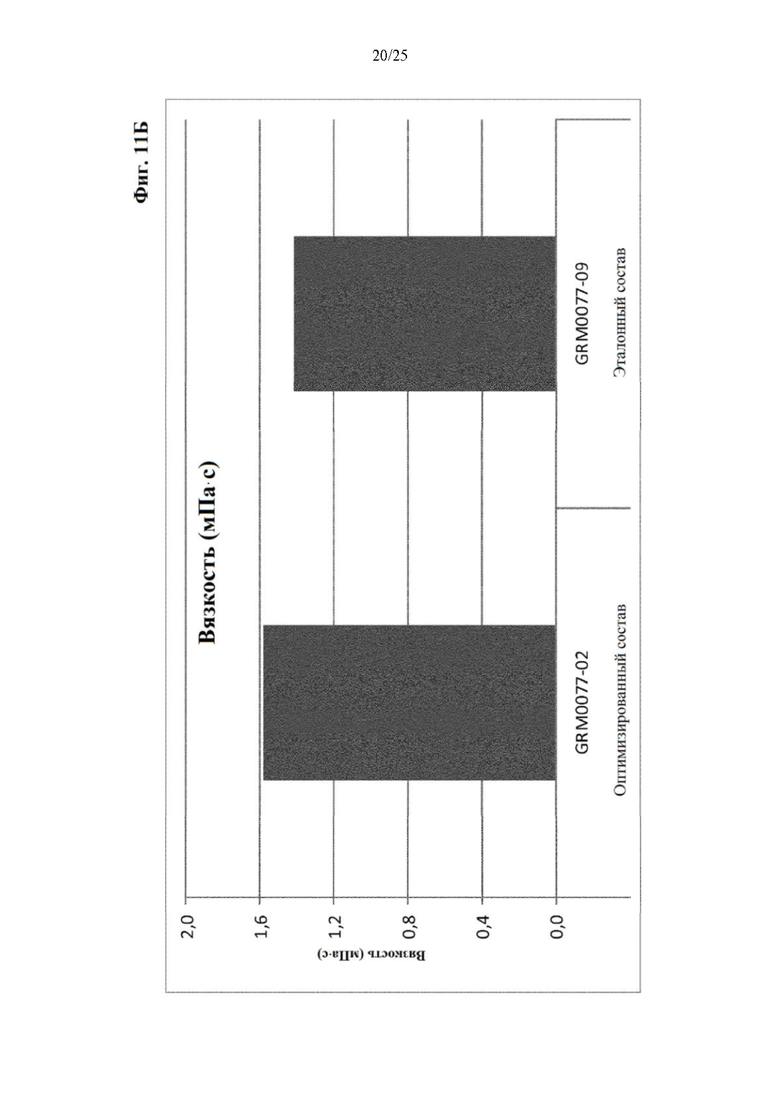
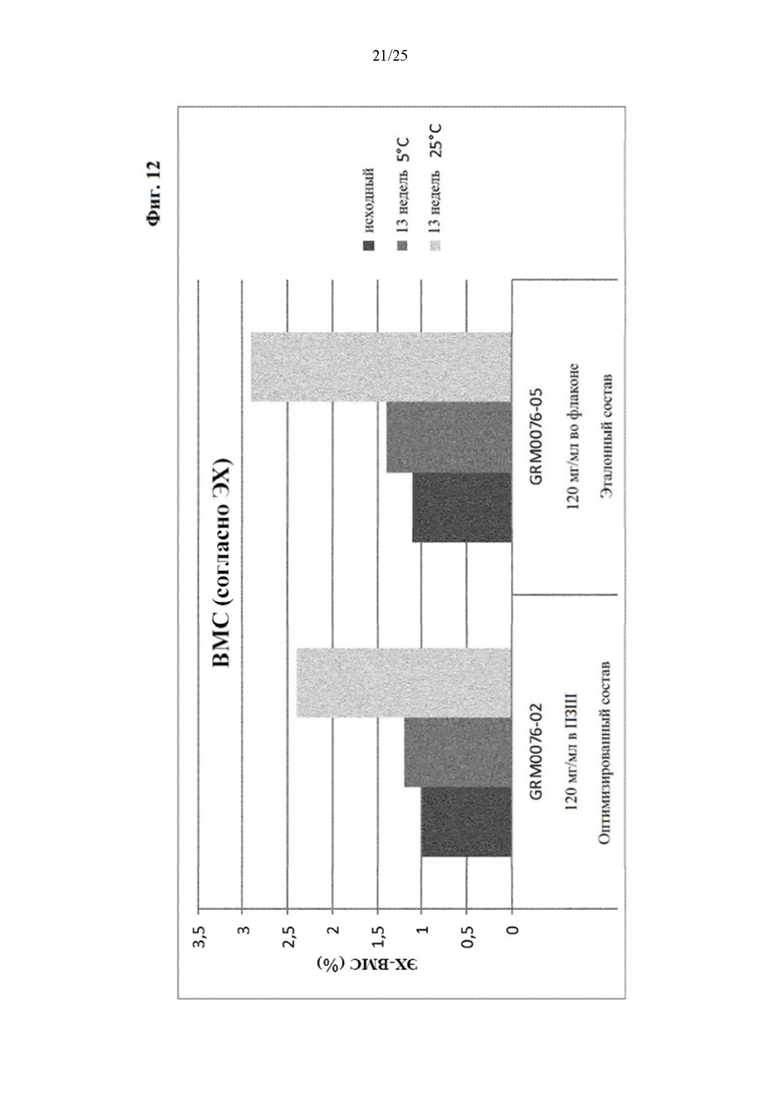
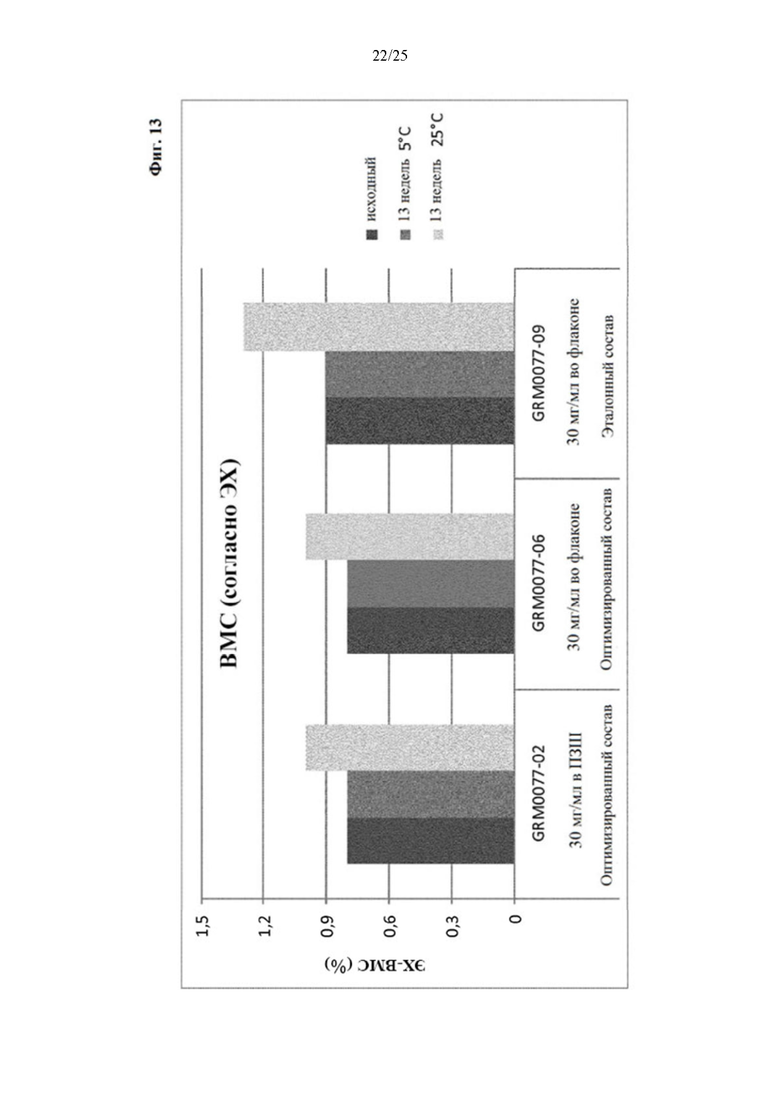
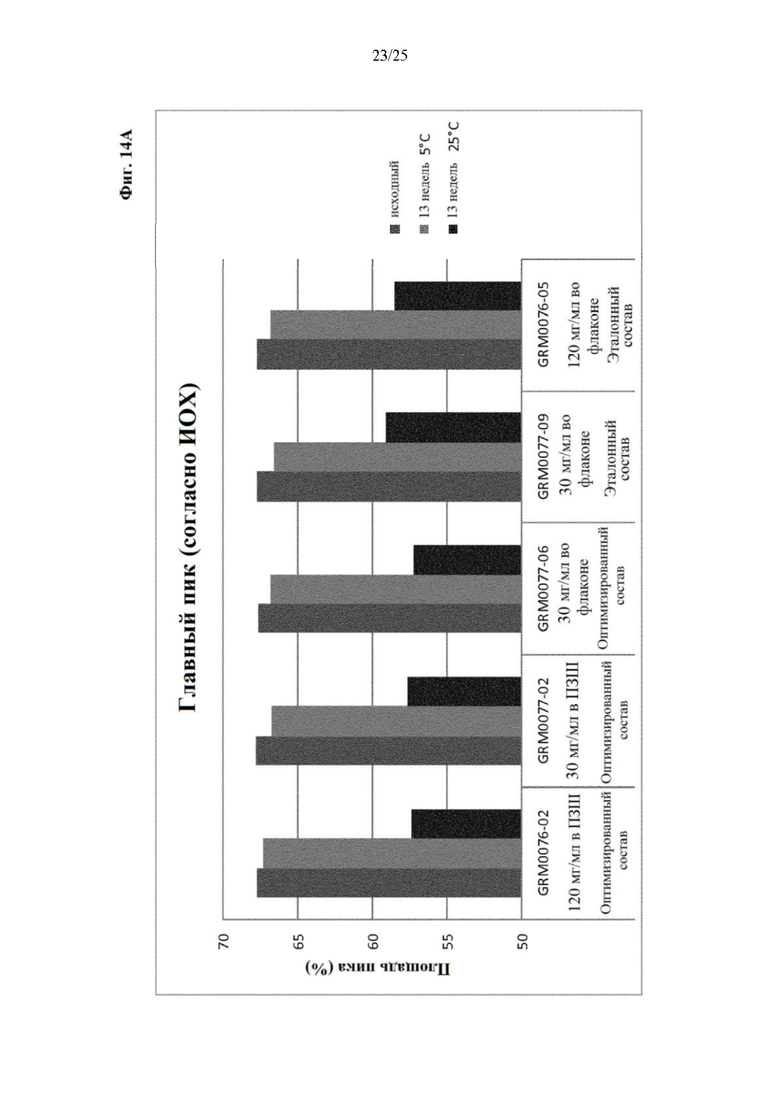
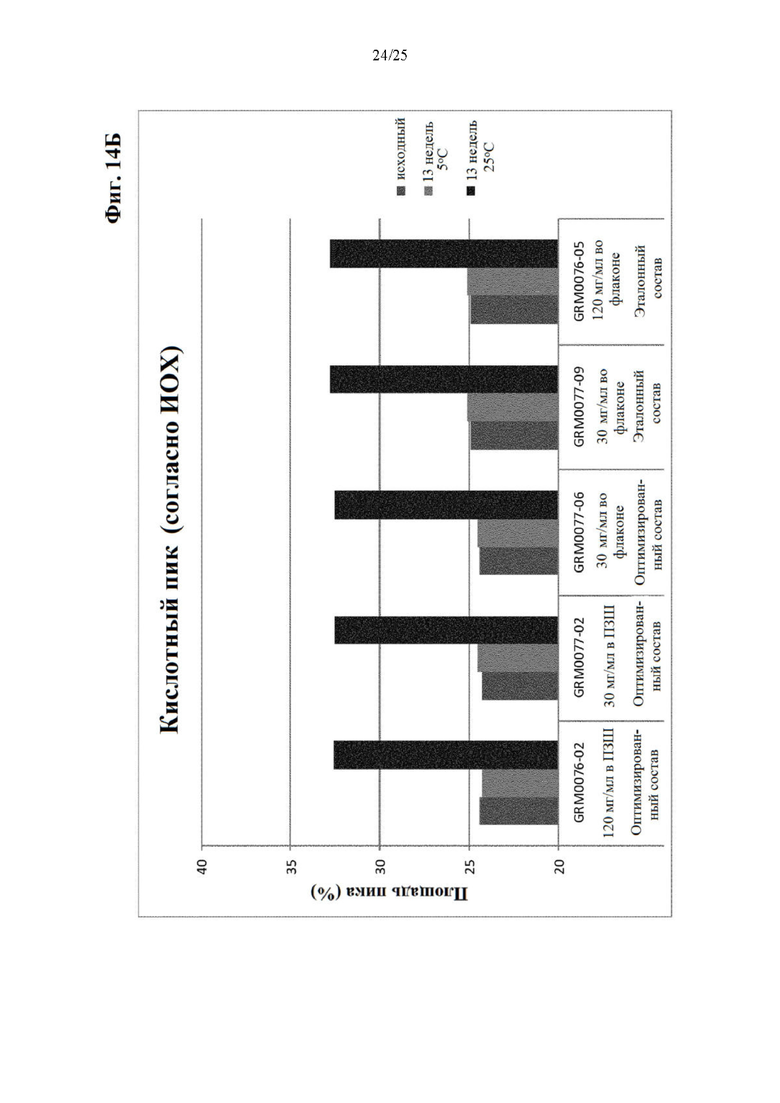
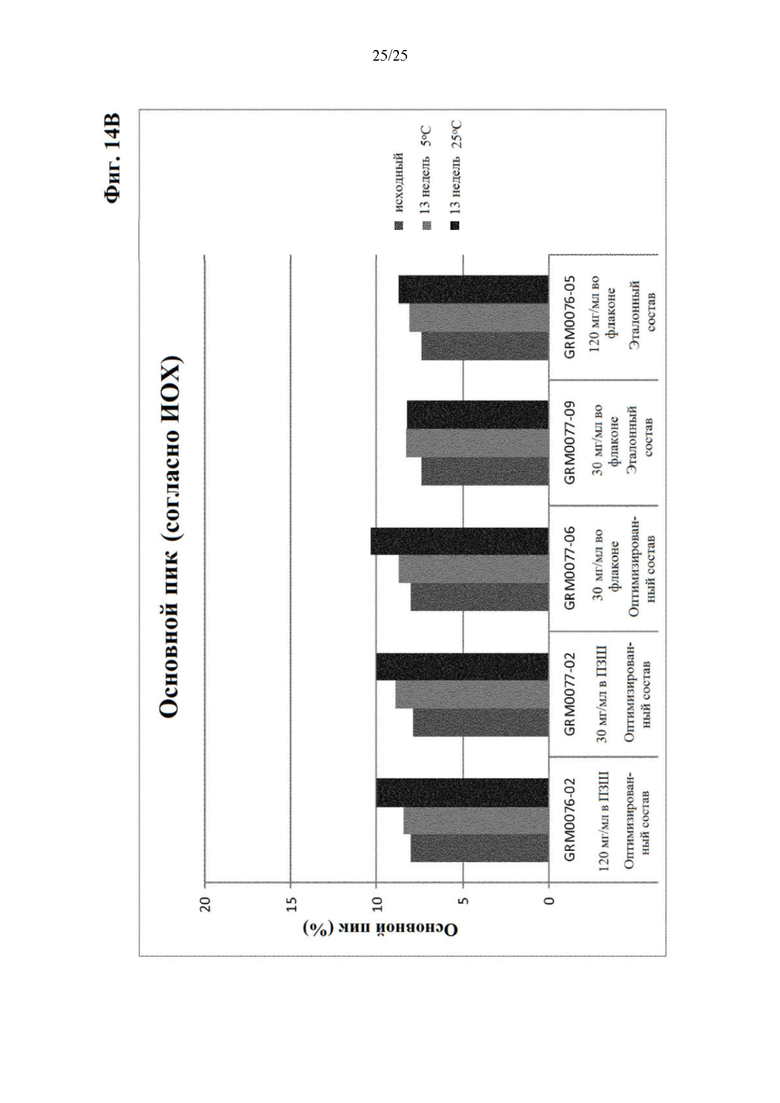
Группа изобретений относится к области фармацевтики и медицины. 1 и 2 объекты представляют собой жидкий фармацевтический состав, содержащий от 118 до 128 мг/мл биспецифического антитела к VEGF/ANG2, представляющего собой фарицимаб, от 15 до 35 мM хлорида натрия, от 15 до 25 мM гистидин-ацетатного буфера, при pH от 5,5 до 6,1, в том числе для применения в лечении сосудистого заболевания глаз. 3 объект – способ получения фармацевтического состава. 4 и 5 объекты – флакон и предварительно заполненный шприц, содержащие фармацевтический состав. 6 объект – лиофилизированная форма жидкого фармацевтического состава. Технический результат заключается в низкой вязкости и низкой мутности состава при высокой концентрации антитела. 6 н. и 11 з.п. ф-лы, 14 ил., 16 табл., 8 пр.
1. Жидкий фармацевтический состав, содержащий:
- от 118 до 128 мг/мл биспецифического антитела к VEGF/ANG2, содержащего константную область тяжелой цепи подкласса IgG1 человека,
- от 15 до 35 мM хлорида натрия,
- от 15 до 25 мM гистидин-ацетатного буфера,
при pH от 5,5 до 6,1;
где биспецифическое антитело к VEGF/ANG2 представляет собой фарицимаб.
2. Фармацевтический состав по п. 1 для интравитреального введения.
3. Фармацевтический состав по любому из пп. 1, 2, причем состав по существу не содержит видимых частиц.
4. Фармацевтический состав по любому из пп. 1-3, причем состав дополнительно содержит
- от 5,0 до 9,0 мM метионина.
5. Фармацевтический состав по любому из пп. 1-4, причем состав дополнительно содержит
- от 0,03 до 0,07% масс./об. полисорбата 20.
6. Фармацевтический состав по любому из пп. 1-5, причем состав дополнительно содержит
- от 136 до 184 мM сахарозы.
7. Фармацевтический состав по любому из пп. 1-6, причем состав имеет вязкость 20 мПа⋅с или менее.
8. Фармацевтический состав по любому из пп. 1-7, причем состав имеет мутность 30 ЕМФ или менее.
9. Фармацевтический состав по любому из пп. 1-8, причем состав имеет ионную силу от 20 до 50.
10. Фармацевтический состав по любому из пп. 1-9, в котором содержание высокомолекулярных соединений (ВМС) биспецифического антитела в фармацевтическом составе составляет менее 10% через 8 недель при 25°C или через 52 недели при 25°C.
11. Фармацевтический состав по любому из пп. 1-10, в котором осмоляльность состава составляет от 200 до 400 мОсм/кг.
12. Фармацевтический состав по любому из пп. 1-11 для применения в лечении сосудистого заболевания глаз.
13. Фармацевтический состав для применения по п. 12, где сосудистые заболевания глаз выбраны из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), макулярной дегенерации, влажной формы возрастной макулярной дегенерации (влажной ВМД), ретинопатии недоношенных (РН), неоваскулярной глаукомы, пигментного ретинита (ПР), ретинальной ангиоматозной пролиферации, макулярной телеангиэктазии, ишемической ретинопатии, неоваскуляризации радужной оболочки, внутриглазной неоваскуляризации, неоваскуляризации роговицы, неоваскуляризации сетчатки, хориоидальной неоваскуляризации и дегенерации сетчатки, в частности из группы, состоящей из диабетической ретинопатии (ДР), диабетического макулярного отека (ДМО), окклюзии вены сетчатки (ОВС), окклюзии центральной вены сетчатки (ОЦВС), влажной формы возрастной макулярной дегенерации (влажной ВМД).
14. Способ получения фармацевтического состава по любому из пп. 1-11,
при этом способ включает стадии:
- замены буфера основного объема раствора биспецифического антитела a) на буфер для диафильтрации путем ультрафильтрации и диафильтрации или б) путем диализа при помощи буфера для диализа, причем буферы содержат гистидин-ацетатный буфер, или гистидин-ацетатный буфер и хлорид натрия, или гистидин-ацетатный буфер, хлорид натрия и метионин, или гистидин- ацетатный буфер, хлорид натрия, метионин и сахарозу;
- концентрирования основного объема раствора с замененным буфером путем ультрафильтрации;
- регулирования готовой композиции фармацевтического состава путем добавления исходных растворов соответствующих вспомогательных веществ или при помощи соответствующего стабилизирующего буфера и гомогенизации жидкого фармацевтического состава путем перемешивания.
15. Флакон, содержащий фармацевтический состав по любому из пп. 1-4.
16. Предварительно заполненный шприц, содержащий фармацевтический состав по любому из пп. 1-11.
17. Лиофилизированная форма жидкого фармацевтического состава по любому из пп. 1-11.
| US 2017044246 A1, 16.02.2017 | |||
| WO 2016085750 A1, 02.06.2016 | |||
| WO 2016120413 A1, 04.08.2016 | |||
| БЕЛКОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2473360C2 |
| US 2011250130 A1, 13.10.2011 | |||
| WO 2018122053 A1, 05.07.2018 | |||
| WO 2017075259 A1, 04.05.2017. | |||
Авторы
Даты
2023-11-02—Публикация
2019-10-25—Подача